Το νάτριο είναι το χημικό στοιχείο με σύμβολο Na (από τη λατινική λέξη natrium, ενώ στα αγγλικά είναι sodium) και ατομικό αριθμό 11. Το χημικά καθαρό νάτριο, στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι μαλακό, αργυρόλευκο και πολύ δραστικό στερεό μέταλλο. Είναι μέλος των αλκαλιμετάλλων. Το μοναδικό σταθερό του ισότοπο είναι το 23Na. Στη φύση ποτέ δεν έχει βρεθεί ως ελεύθερο (στοιχειακό) μέταλλο, οπότε όταν χρειάζεται στη στοιχειακή του μορφή, πρέπει να παραχθεί από τις χημικές ενώσεις του. Για πρώτη φορά απομονώθηκε από τον Χάμφρυ Ντέιβυ (Sir Humphry Davy) το 1807, που το παρήγαγε με ηλεκτρόλυση τήγματος υδροξειδίου του νατρίου (NaOH). Το νάτριο είναι το 6ο πιο άφθονο χημικό στοιχείο στη λιθόσφαιρα της Γης, και μετέχει σε πολλά ορυκτά, όπως οι άστριοι, ο σοδαλίτης και ο αλίτης. Πολλά άλατα του νατρίου είναι εξαιρετικά διαλυτά στο νερό, και το νάτριό τους διαβρώνεται από τη δράση του νερού, ώστε μαζί με το χλώριο, δηλαδή ως χλωριούχο νάτριο (NaCl), να είναι τα πιο συνηθισμένα διαλυμένα στοιχεία (κατά βάρος) στους ωκεανούς της Γης.
| Νάτριο | ||||
|---|---|---|---|---|
|
||||
| Ιστορία | ||||
| Ταυτότητα του στοιχείου | ||||
| Νάτριο (Na) | ||||
| 11 | ||||
| μέταλλα | ||||
| 1 ,3, s | ||||
| 22,99 | ||||
| [ Ne] 3s1 | ||||
| 7440-23-5 | ||||
| Ατομικές ιδιότητες | ||||
| 186 pm | ||||
| 0,93 | ||||
| +1 | ||||
| 1η: 495,8 kJ·mol−1 2η: 4562 kJ·mol−1 3η: 6910,3 kJ·mol−1 |
||||
| Φυσικά χαρακτηριστικά | ||||
| 97,72°C (370,87 K) | ||||
| 883°C (1156 K) | ||||
| 0,968 g·cm−3 | ||||
| 2,60 kJ·mol−1 | ||||
| Παραμαγνητικό | ||||
| 0,5 | ||||
| 0,69 MPa | ||||
| 10 GPa | ||||
| (20 °C) 3200 m/s | ||||
| Η κατάσταση αναφοράς είναι η πρότυπη κατάσταση (25°C, 1 Atm) εκτός αν σημειώνεται διαφορετικά |
||||
Πολλές χημικές ενώσεις του νατρίου είναι χρήσιμες, όπως το υδροξείδιο του νατρίου για σαπωνοποίηση, το χλωριούχο νάτριο ως αποπαγωτικό μέσο και ως θρεπτικό υλικό.
Το νάτριο είναι ένα ζωτικής σημασίας στοιχείο για όλα τα ζώα και για κάποια φυτά της Γης. Πιο συγκεκριμένα, τα ιόντα νατρίου αποτελούν το κυριότερο είδος κατιόντων για το εξωκυτταρικό υγρό, καθώς και το κυριότερο είδος των κατιόντων που συνεισφέρουν στην (ισορροπία) της ωσμωτικής πίεσης, αλλά και σημαντικό ποσοστό του όγκου του εξωκυτταρικού υγρού. Στην περίπτωση σημαντικής απώλειας ύδατος από το εξωκυτταρικό υγρό συνεπάγεται σημαντική αύξηση της συγκέντρωσης των κατιόντων νατρίου σε αυτό (το εξωκυτταρικό υγρό), πάθηση που (από μια συγκέντρωση και πάνω) ονομάζεται υπερνατραιμία. Στην περίπτωση ισοτονικής ταυτόχρονης απώλειας ύδατος και νατρίου από το εξωκυτταρικό υγρό συνεπάγεται μείωση του όγκου του, πάθηση που (από ένα όριο και πάνω) ονομάζεται υπογκαιμία.
Στα ζώα, τα ιόντα νατρίου χρησιμοποιούνται ενάντια στα ιόντα καλίου για τις αντλίες νατρίου-καλίου στις κυτταρικές μεμβράνες, επιτρέποντας τη μεταβίβαση σε νευρικές ωθήσεις, όταν το φορτίο διαχέεται. Η επακόλουθη ανάγκη των ζώων για νάτριο το ταξινομεί ως ένα διαιτητικό ανόργανο μακρομέταλλο.
Φυσική παρουσία
Ο γήινος φλοιός περιέχει (περίπου) 2,27%, γεγονός που καθιστά το νάτριο το 7ο κατά σειρά αφθονίας χημικό στοιχείο στη Γη, και ειδικότερα το 5ο κατά σειρά αφθονίας μέταλλο στον πλανήτη μας, πίσω από το αργίλιο (Al), το σίδηρο (Fe), το ασβέστιο (Ca) και το μαγνήσιο (Mg). Mετά από το νάτριο βρίσκεται το κάλιο (Κ).[1] Η μέση συγκέντρωση νατρίου στους ωκεανούς του πλανήτη μας είναι περίπου 1,08·104 g/m³. [2] Εξαιτίας της μεγάλης δραστικότητάς του, ποτέ δε βρέθηκε στη μορφή του καθαρού στοιχείου. Βρέθηκε, όμως, σε πολλά διαφορετικά ορυκτά, κάποια από τα οποία είναι ευδιάλυτα, όπως ο αλίτης και το νάτρον, ενώ άλλα είναι λιγότερο διαλυτά, όπως ο αμφίβολος και ο ζεολίτης. Η δυσδιαλυτότητα ορισμένων νατριούχων ορυκτών, όπως ο κρυόλιθος και κάποιοι από τους άστριους, οφείλεται από την παρουσία σε αυτά πολυμερικών ανιόντων, που στην περίπτωση των αστρίων είναι πολυπυριτικά.
Αστροχημεία νατρίου
Το ατομικό νάτριο έχει μια πολύ ισχυρή φασματική κιτρινοπορτοκαλί γραμμή. Η ίδια γραμμή χρησιμοποιείται στους κίτρινους οδολαμπτήρες ατμών νατρίου. Αυτή η φασματική γραμμή εμφανίζεται σε πολλούς τύπους άστρων, που συμπεριλαμβάνουν τον Ήλιο μας. Αυτή η φασματική γραμμή πρωτομελετήθηκε το 1814 από τον Γιοζέφ φον Φραουχόφερ (Joseph von Fraunhofer) κατά τη διάρκεια έρευνάς του πάνω στις γραμμές του ηλιακού φάσματος. Γι' αυτό οι γραμμές αυτές είναι γνωστές και ως γραμμές Φραουχόφερ (Fraunhofer lines). Ο ίδιος ο Φραουχόφερ τις είχε ονοματίσει "D line" , στον ενικό, γιατί με τα τότε μέσα φαίνονταν ως μία μοναδική γραμμή, αν και πλέον είναι γνωστό ότι στην πραγματικότητα πρόκειται για ολόκληρων ομάδα κοντινών γραμμών.[3]
Η ισχυρή γραμμή D έχει ανιχνευθεί σε πολλά αστρονομικά περιβάλλοντα. Σε άστρα έχει βρεθεί σε εκείνες τις επιφάνειες που είναι αρκετά ψυχρές ώστε το νάτριο να μπορεί να υπάρχει σε ατομική μορφή και όχι στις θερμότερες στις οποίες όλο το νάτριο ιονίζεται. Αυτό αντιστοιχεί γενικότερα σε άστρα τύπου F και ψυχρότερα. Σε πολλά άστρα φαίνεται να έχουν τη φασματική γραμμή απορρόφησης του νατρίου, αλλά στην πραγματικότητα αυτό οφείλεται όχι στην παρουσία του σε αυτά, αλλά στην παρουσία του στο διαστρικό ενδιάμεσο μεταξύ αυτών και της Γης. Η διάκριση για αυτά τα δύο είδη φασματικών γραμμών είναι δυνατή με τη χρήση φασματοσκοπίας υψηλής ευκρίνειας, γιατί οι διαστρικές γραμμές είναι πολύ πιο λεπτές, επειδή οι αστρικές εμφανίζονται φαρδύτερες εξαιτίας της περιστροφής των άστρων.[4]
Το νάτριο έχει επίσης ανιχνευθεί σε πολλά περιβάλλοντα του ηλιακού μας συστήματος. Σε αυτά συμπεριλαμβάνεται η ατμόσφαιρα του του Ερμή, όπου το νάτριο ανιχνεύθηκε από το διαστημικό βολιστήρα Mariner 10[5]. Το νάτριο ανιχνεύθηκε επίσης στην εξώσφαιρα της Σελήνης[6] και πολλών άλλων σωμάτων. Κάποιοι κομήτες βρέθηκε ότι έχουν ουρά νατρίου.[7] Αυτό πρωτοανιχνεύθηκε στον κομήτη Χέιλ-Μποπ το 1997.[8] Το νάτριο ανιχνεύθηκε, ακόμη, στις ατμόσφαιρες κάποιων εξωπλανητών, μέσω φασματοσκοπίας μεταφοράς.[9]
Το 23Na παράγεται κατά τη διεργασία πυρηνικής σύντηξης δύο πυρήνων άνθρακα στα άστρα. Για την πραγματοποίηση τέτοιας αντίδρασης απαιτείται θερμοκρασία άνω των 600 MK και το άστρο πρέπει να έχει μάζα τουλάχιστον όσο τρεις ηλιακές[10].
Ετυμολογία και ιστορία
Το αλάτι ήταν ένα σημαντικό εμπόρευμα για τις ανθρώπινες δραστηριότητες, όπως (χαρακτηριστικά) δείχνει η αγγλική λέξη salary, που προήλθε από τη λατινική salarium, που αντιστοιχεί σε πλακίδια αλατιού που δίνονταν μερικές φορές στους Ρωμαίους στρατιώτες μαζί με τους μισθούς τους. Στη Μεσαιωνική Ευρώπη η λατινική λέξη sodanum χρησιμοποιούνταν για μια θεραπεία για τον πονοκέφαλο. Η ονομασία sodium, θεωρείται ότι προέρχεται από την αραβική λέξη suda, που σημαίνει «πονοκέφαλος», καθώς η ικανότητα του ανθρακικού νατρίου (Na2CO3), δηλαδή της σόδας, να ανακουφίζει από τον πονοκέφαλο ήταν καλά γνωστή από την αρχαιότητα[11]. Η χημική συντομογραφία για το νάτριο δημοσιεύθηκε για πρώτη φορά από τον Γιονς Γιάκομπ Μπερζέλιους (Jöns Jakob Berzelius) στο σύστημα των ατομικών συμβόλων του[12] και συνδέεται με τη λατινική λέξη natrium, που αναφέρεται στην αιγυπτιακή λέξη natron[11], ένα φυσικό ορυκτό άλας που αποτελείται κυρίως από ένυδρο ανθρακικό νάτριο. Το natron ήταν σημαντικό τόσο για βιομηχανικές όσο και για οικιακές χρήσεις, αν και μεταγενέστερα αντικαταστάθηκε από άλλες ενώσεις του νατρίου. Παρόλο που το νάτριο αναγνωρίζονταν για μεγάλο χρονικό διάστημα σε ενώσεις του, το ίδιο το μεταλλικό νάτριο απομονώθηκε για πρώτη φορά το 1807 από το Χάμφρυ Ντέιβυ (Sir Humphry Davy), μέσω ηλεκτρόλυσης υδροξειδίου του νατρίου[13][14].
Το νάτριο δίνει ένα έντονο κίτρινο χρώμα στις φλόγες. Από το 1860 οι Γκούσταβ Κίρχοφ (Gustav Robert Kirchhoff) και Ρόμπερτ Μπούνσεν (Robert Wilhelm Eberhard Bunsen) σημείωσαν την υψηλή ευαισθησία που έχει η φλογομετρική δοκιμή για το νάτριο, και το γεγονός αυτό το διετύπωσαν στο έργο τους Annalen der Physik und Chemie[15]:
...Σε μια γωνία του δωματίου μας (όγκου) 60 m3 (όσο το δυνατόν) μακρύτερα από τη συσκευή, προκαλέσαμε έκρηξη 3 mg χλωρικού νατρίου με λευκή ζάχαρη καθώς παρατηρούσαμε την ασθενική φλόγα πριν τη σχισμή. Ύστερα από λίγο, εμφάνησε μια λαμπρή κίτρινη φλόγα και έδειξε μια ισχυρή γραμμή νατρίου που εξαφανίστηκε μετά από 10 λεπτά. Από το βάρος του άλατος του νατρίου και τον όγκο του αέρα στο δωμάτιο εύκολα υπολογήσαμε ότι ένα μέρος κατά βάρος αέρα δεν περιείχε περισσότερο από 1/20 (του μέρους) κατά βάρος νάτριο...
Εμπορική παραγωγή
Εμπλεκόμενο σε μάλλον εξειδικευμένες εφαρμογές, μόνο περίπου 100.000 τόννοι μεταλλικού νατρίου παράγονται ετησίως[16]. Το μεταλλικό νάτριο άρχισε να παράγεται εμπορικά το 1855 με ανθρακοθερμική αναγωγή ανθρακικού νατρίου στους 1100°C, με τη γνωστή ως διεργασία Ντεβίλλ (Deville process)[17][18][19]:
{\displaystyle \mathrm {Na_{2}CO_{3}+2C{\xrightarrow {}}2Na+3CO\uparrow } }
Μια συγγενική διεργασία που βασίστηκε στην αναγωγή υδροξειδίου του νατρίου αναπτύχθηκε το 1886[17].
Στις μέρες μας το μεταλλικό νάτριο παράγεται εμπορικά με ηλεκτρόλυση τήγματος χλωριούχου νατρίου, βασισμένη σε μια διεργασία που πατενταρίστηκε το 1924[20][21]. Αυτό γίνεται σε ένα καθοδικό κύτταρο (Downs cell), στο οποίο το χλωριούχο νάτριο αναμιγνύεται με χλωριούχο ασβέστιο (CaCl2) για να χαμηλώσει η θερμοκρασία τήξης του κάτω από τους 700 °C. Επειδή το ασβέστιο είναι λιγότερο ηλεκτροθετικό από το νάτριο, δεν αποτίθεται ασβέστιο στην κάθοδο. Αυτή η μέθοδος είναι λιγότερο δαπανηρή από την προηγούμενη διεργασία Κάστνερ (Castner process) κατά την οποία ηλεκτρολύονταν υδροξείδιο του νατρίου.
Το χημικού βαθμού μεταλλικό νάτριο σε ποσότητες τόνου πωλούνταν περί τα 3,30 $ ΗΠΑ/kg το 2009. Χαμηλότερης ποιότητας μεταλλικό νάτριο είναι σημαντικά φθηνότερο. Η αγορά του μεταλλικού νατρίου είναι ρευστή εξαιτίας της δυσκολίας που το προϊόν αυτό εμφανίζει στην αποθήκευση και στη μεταφορά του. Πρέπει να αποθηκευθεί σε ατμόσφαιρα ξηρού αδρανούς αερίου ή σε άνυδρο πετρέλαιο για να αποφευχθεί ο επιφανειακός σχηματισμός στρώματος οξειδίου του νατρίου ή υπεροξειδίου του νατρίου. Αυτά τα οξείδια μπορεί να αντιδράσουν βίαια αν έλθουν σε επαφή με οργανικά υλικά. Μικρότερες ποσότητες μεταλλικού νατρίου κοστίζουν πολύ περισσότερο, ως και 165 $ ΗΠΑ/kg. Αυτό το υψηλότερο κόστος οφείλεται εν μέρει στα έξοδα αποστολής επικίνδυνου υλικού[22].
Χαρακτηριστικά
Φυσικά
Μια θετική φλογοανίχνευση για το νάτριο έχει ένα έντονο κίτρινο χρώμα.
Φάσμα εκπομπής για το νάτριο, δείχνοντας τη χαρακτηριστική D γραμμή.
Το χημικά καθαρό νάτριο, στις «κανονικές συνθήκες περιβάλλοντος», δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι μαλακό μέταλλο, μάλιστα τόσο μαλακό, ώστε μπορεί να κοπεί εύκολα με ένα μαχαίρι, και είναι ένας καλός αγωγός του ηλεκτρισμού. Αν το μεταλλικό νάτριο είναι πρόσφατα μόλις εκτεθειμένο, τότε είναι λαμπρό αργυρόλευκο μέταλλο, αλλά η γυαλάδα του θαμπώνει γρήγορα, επειδή σχηματίζει ένα λευκό προς το γκρίζο στρώμα από υδροξείδιο του νατρίου (NaOH) και ανθρακικό νάτριο (Na2CO3). Το επιφανειακό χρώμα που αποκτάται υπό την επίδραση της ατμόσφαιρας αλλάζει όταν υφίσταται υψηλότερες πιέσεις. Πιο συγκεκριμένα, υπό πίεση 1,5 Μbar το επιφανειακό χρώμα αλλάζει σε μαύρο, υπό πίεση 1,9 Μbar το επιφανειακό χρώμα αλλάζει σε κόκκινο διαφανές και τελικά, υπό πίεση 3 Μbar το επιφανειακό χρώμα αλλάζει σε καθαρό διαυγές. Όλες αυτές οι αλλοτροπικές μορφές είναι μονωτές και ηλεκτρίδια[23].
Όταν το (στοιχειακό) νάτριο ή οι ενώσεις του τεθούν μέσα σε μια φλόγα, τη χρωματίζουν κίτρινη[24], επειδή το διεγερμένο 3s ηλεκτρόνιο του νατρίου εκπέμπει φωτόνιο όταν «πέφτει» από το 3p τροχιακό πίσω στο 3s. Το μήκος κύματος για το φωτόνιο που αντιστοιχεί στη «γραμμή D» είναι 589,3 nm. Οι αλληλεπιδράσεις περιστροφής - τροχιάς περιφοράς διασπούν στην πραγματικότητα τη γραμμή D στα δύο (2). Υπέρλεπτες δομές διασπούν λεπτομερειακά τη γραμμή D σε ακόμη περισσότερες γραμμές[25].
Χημικά
Όταν το νάτριο είναι πρόσφατα κομμένο, το κόψιμο έχει αργυρόλευκο χρώμα, ως μεταλλικό (στοιχειακό) νάτριο. Αλλά με την έκθεσή του στον ατμοσφαιρικό αέρα η επιφάνεια κοπής σκουραίνει, αρχικά, και μετά σχηματίζει ένα λευκό επίστρωμα από υδροξείδιο του νατρίου και ανθρακικό νάτριο.
Το νάτριο είναι, γενικά, λιγότερο δραστικό από το κάλιο αλλά περισσότερο δραστικό από το λίθιο[26]. Όπως και όλα τα υπόλοιπα αλκαλιμέταλλα, το νάτριο αντιδρά εξώθερμα με το νερό, με αποτέλεσμα η θερμότητα που απελευθερώνεται να είναι συχνά αρκετή ώστε να λιώσουν σχετικά μεγάλα κομμάτια μεταλλικού νατρίου ή ακόμη και για να αναφλεγεί το παραγόμενο υδρογόνο. Παράλληλα συμπαράγεται υδροξείδιο του νατρίου:
{\displaystyle \mathrm {Na+H_{2}O{\xrightarrow {}}NaOH+H_{2}\uparrow } }
Όταν το νάτριο καίγεται σε ξηρή ατμόσφαιρα παράγει κυρίως υπεροξείδιο του νατρίου (Na2Ο2), καθώς και κάποια ποσότητα οξειδίου του νατρίου (Na2O):
{\displaystyle \mathrm {2Na+O_{2}{\xrightarrow {}}Na_{2}O_{2}} }
{\displaystyle \mathrm {4Na+O_{2}{\xrightarrow {}}2Na_{2}O} }
Σε αέρα που περιέχει υγρασία το προϊόν της οξείδωσης του νατρίου είναι υδροξείδιο του νατρίου[27]. Το μεταλλικό νάτριο είναι ένα ισχυρό αναγωγικό μέσο, αφού για την αναγωγή των κατιόντων νατρίου απαιτείται διαφορά δυναμικού -2,71 V[28]. Ωστόσο για την παραγωγή του μεταλλικού νατρίου από τις ενώσεις του χρησιμοποιείται μια σημαντική ποσότητα ενέργειας[27]. Επιπλέον, το κάλιο και το λίθιο έχουν ακόμη μεγαλύτερα (σε απόλυτη τιμή) δυναμικά αναγωγής[29].
Ισότοπα
Κύριο άρθρο: Ισότοπα του νατρίου
20 ισότοπα του νατρίου είναι γνωστά, αλλά μόνο το 23Na είναι σταθερό. Δύο ραδιενεργά, κοσμογονικά ισότοπα είναι υποπροϊόντα βομβαρδισμού από κοσμική ακτινοβολία: το 22Na με ημιζωή 2,6 χρόνων και το 24Na με ημιζωή 15 ωρών· τα υπόλοιπα ισότοπα έχουν διάρκεια ημιζωής λιγότερη από ένα λεπτό [30]. Δύο πυρηνικά ισομερή έχουν ανακαλυφθεί, το μακροβιότερο 24mNa έχει ημιζωή περί τα 20,2 μs. Τυχαία ακτινοβόλιση με νετρόνια, όπως για παράδειγμα σε περίπτωση κρίσιμου πυρηνικού ατυχήματος, μετατρέπει κάποια σταθερά άτομα 23Na, διαλυμένα στο ανθρώπινο αίμα, σε 24Na, οπότε με τη μέτρηση της συγκέντρωσης 24Na στο αίμα είναι δυνατός ο υπολογισμός της δόσης ακτινοβολίας νετρονίων που δέχτηκε ένα θύμα[31].
Χημικές ενώσεις
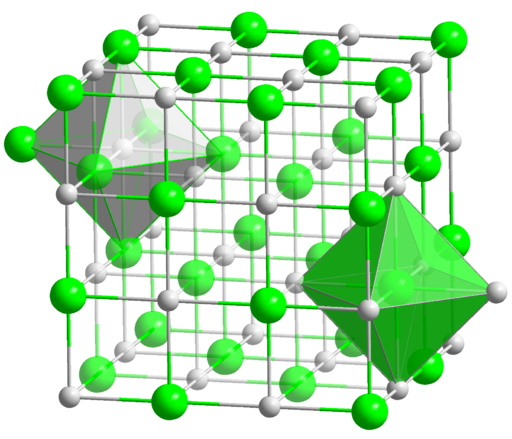
Δομή χλωριούχου νατρίου (NaCl), που δείχνει οκταεδρική χωροθέτηση γύρω από τα κέντρα Na+ και Cl-. Αυτό το δίκτυο καταστρέφεται με τη διάλυση του άλατος σε νερό και επανασχηματίζεται μετά από την εξάτμιση (του νερού).
Δυο ισοδύναμες απεικονίσεις της χημικής δομής του στεατικού νατρίου, ενός τυπικού σάπωνα.
Αρκετές χημικές ενώσεις του νατρίου έχουν σημαντική εμπορική σημασία, όντας ιδιαίτερα κεντρικής σημασίας για βιομηχανίες που παράγουν γυαλί, χαρτί, σαπούνια και υφάσματα[16]. Οι σημαντικότερες από τις χημικές ενώσεις του νατρίου συμπεριλαμβάνουν το μαγειρικό αλάτι (NaCl), η σόδα στάχτης (Na2CO3), η μαγειρική σόδα (NaHCO3), η καυστική σόδα (NaOH), το νιτρικό νάτριο (NaNO3), το όξινο φωσφορικό νάτριο (Na2HPO4), το φωσφορικό νάτριο (Na3PO4), το θειοθειικό νάτριο (Na2S2O3·5H2O) και ο βόρακας (Na2B4O7·10H2O)[32]. Στις ενώσεις του, το νάτριο, συνήθως βρίσκεται ιονικά συνδεδεμένο με ανιόντα ή με και με μόρια νερού (οι ένυδρες ενώσεις), και θεωρείται ως σκληρό οξύ κατά Λιούις (hard Lewis acid)[33]. Επίσης, οι περισσότεροι σάπωνες είναι άλατα λιπαρών οξέων με νάτριο. Οι σάπωνες νατρίου είναι σκληρότεροι (και με υψηλότερες θερμοκρασίες τήξης) σε σύγκριση με τους σάπωνες καλίου[32]. Το χλωριούχο νάτριο χρησιμοποιείται σε αντιπαγωτικά και αποπαγωτικά μέσα, αλλά και ως συντηρητικό τροφίμων. Το όξινο ανθρακικό νάτριο χρησιμοποιείται στη μαγειρική. Το νάτριο προστίθεται σε πολλά σημαντικά φάρμακα για να βελτιώσει τη βιοδιαθεσιμότητά τους, παρόλο που σε πολλές περιπτώσεις το κάλιο είναι καλύτερο ιόν, αλλά το νάτριο είναι οικονομικότερο και έχει χαμηλότερο ατομικό βάρος[34]. Το υδρίδιο του νατρίου (NaH) χρησιμοποιείται ως βάση σε διάφορες αντιδράσεις, όπως η αλδολική αντίδραση στην οργανική χημεία, και ως αναγωγικό μέσο στην ανόργανη χημεία[35].
Υδατοδιαλυτές ενώσεις
Το νάτριο τείνει να σχηματίζει υδατοδιαλυτές ενώσεις, όπως τα αλογονίδια, τα θειικά, τα νιτρικά, τα καρβοξυλικά και τα ανθρακικά άλατά του. Τα κύρια νατριούχα υδατικά χημικά είδη είναι τα υδροσύμπλοκα του νατρίου [Na(H2O)n]+, όπου n = 4-6[36]. Η υψηλή χημική συγγένεια του νατρίου για οξυγονούχους συναρμοτές είναι η βάση για τους αιθέρες - στέμματα, για τα μακρολιδικά αντιβιοτικά, όπου η αλληλεπίδραση με τα μεταφορικά Na+ του μολυσμένου οργανισμού είναι λειτουργικά συγγενική, αλλά πιο σύνθετη.
Η άμεση καθίζηση αλάτων νατρίου από υδατικά τους διαλύματα είναι σπάνια, επειδή τα άλατα νατρίου τυπικά έχουν υψηλή χημική συγγένεια με το νερό. Μια εξαίρεση στον παραπάνω κανόνα αποτελεί το βισμουθικό νάτριο (NaBiO3)[37]. Εξαιτίας της παραπάνω αναφερόμενης ευδιαλυτότητας των υδατικών διαλυμάτων αλάτων νατρίου, το στοιχείο απομονώνεται σε μορφή στερεού άλατος με εξάτμιση ή με καθίζηση από διαλύματα αλάτων του σε οργανικούς διαλύτες, όπως η αιθανόλη. Για παράδειγμα, η διαλυτότητα του χλωριούχου νατρίου στην αιθανόλη είναι μόλις 350 g/m³[38]. Οι αιθέρες - στέμματα, όπως ο 15-στέμμα-5, μπορεί να χρησιμοποιηθούν ως καταλύτες μεταφοράς φάσης[39]. Η συγκέντρωση των ιόντων νατρίου μπορεί να υπολογιστεί μετά από επίδραση μεγάλης περίσσειας οξεικού ουρανυλιοψευδαργύρου [ZnUO2(CH3COO)4], οπότε καθιζάνει ανοικτοκίτρινο [Na(UO2)3Zn(CH3COO)9·6H2O], το οποίο μπορεί να ζυγιστεί. Το καίσιο και το ρουβίδιο δεν αναμιγνύονται σε αυτήν την αντίδραση, αλλά το κάλιο και το λίθιο αναμιγνύονται[40]. Μικρότερες συγκεντρώσεις νατρίου μπορούν να προσδιοριστούν με φασματοσκοπία ατομικής απορρόφησης[41] ή και ποτενσιομετρικά, χρησιμοποιώντας ιονεκλεκτικά ηλεκτρόδια[42].
Ηλεκτρίδια και νατρίδια
Όπως και τα άλλα αλκαλιμέταλλα, το νάτριο διαλύεται στην αμμωνία και σε κάποιες αμίνες, δίνοντας έντονα χρωματισμένα διαλύματα. Η εξάτμιση τέτοιων διαλυμάτων αφήνει ένα λαμπερό στρώμα μεταλλικού νατρίου. Τα διαλύματα νατρίου σε αμμωνία περιέχουν σύμπλοκα μοριακού τύπου [Na(NH3)6]+, των οποίων το θετικό φορτίο αντισταθμίζεται από επιδιαλυτωμένα ηλεκτρόνια, ως ανιόντα. Κρυπτώματα επιτρέπουν την απομόνωση τέτοιων συμπλόκων ως κρυσταλλικών στερεών. Κρυπτώματα, όπως οι αιθέρες - στέμματα και άλλα ιονοφόρα, έχουν μια υψηλή χημική συγγένεια για τα ιόντα νατρίου. Επίσης, παράγωγα νατριδίου (Na-) έχουν επίσης παρατηρηθεί[43], με προσθήκη κρυπτωμάτων σε διαλύματα νατρίου σε αμμωνία, μέσω δυσαναλογοποίησης[44].
Οργανονατριακές ενώσεις
Η δομή του συμπλόκου του αντιβιοτικού μονενσίνη-Α με ιόντα νατρίου, που εικονίζονται κίτρινα.
Πολλές οργανονατριακές ενώσεις έχουν παρασκευαστεί. Εξαιτίας της υψηλής τους πόλωσης, οι δεσμοί C-Na, συμπεριφέρονται σαν πηγές καρβανιόντων, δηλαδή ως άλατα με οργανικά ανιόντα. Κάποια καλά μελετημένα τέτοια παράγωγα συμπεριλαμβάνουν το κυκλοπενταδιενίδιο του νατρίου (NaC5H5) και το τριτυλικό νάτριο (Ph3CNa)[45].
Παραπομπές και σημειώσεις
Greenwood and Earnshaw, p. 69
Lide, David R. (19 Ιουνίου 2003). CRC Handbook of Chemistry and Physics, 84th Edition. CRC Handbook (στα Αγγλικά). CRC Press. 14: Abundance of Elements in the Earth's Crust and in the Sea. ISBN 978-0-8493-0484-2.
«D-lines | spectroscopy». Encyclopedia Britannica (στα Αγγλικά). Ανακτήθηκε στις 6 Νοεμβρίου 2017.
Welty, Daniel E; Hobbs, L. M; Kulkarni, Varsha P (1994). «A high-resolution survey of interstellar NA I D1 lines». The Astrophysical Journal 436: 152. doi:10.1086/174889. Bibcode: 1994ApJ...436..152W.
Tjrhonsen, Dietrick E. (17 August 1985). "Sodium found in Mercury's atmosphere". BNET. Retrieved 2008-09-18.
Colaprete, A; Sarantos, M; Wooden, D. H; Stubbs, T. J; Cook, A. M; Shirley, M (2015). «How surface composition and meteoroid impacts mediate sodium and potassium in the lunar exosphere». Science 351 (6270): 249. doi:10.1126/science.aad2380. PMID 26678876. Bibcode: 2016Sci...351..249C.
«Cometary Neutral Tail | COSMOS». astronomy.swin.edu.au (στα Αγγλικά). Ανακτήθηκε στις 6 Νοεμβρίου 2017.
Cremonese, G; Boehnhardt, H; Crovisier, J; Rauer, H; Fitzsimmons, A; Fulle, M; Licandro, J; Pollacco, D και άλλοι. (1997). «Neutral Sodium from Comet Hale–Bopp: A Third Type of Tail». The Astrophysical Journal Letters 490 (2): L199–L202. doi:10.1086/311040. Bibcode: 1997ApJ...490L.199C.
Redfield, Seth; Endl, Michael; Cochran, William D; Koesterke, Lars (2008). «Sodium Absorption from the Exoplanetary Atmosphere of HD 189733b Detected in the Optical Transmission Spectrum». The Astrophysical Journal 673: L87. doi:10.1086/527475. Bibcode: 2008ApJ...673L..87R.
Denisenkov, P. A.; Ivanov, V. V. (1987). "Sodium Synthesis in Hydrogen Burning Stars". Soviet Astronomy Letters 13: 214. Bibcode:1987SvAL...13..214D.
Newton, David E. (1999). Baker, Lawrence W., ed. Chemical Elements. ISBN 978-0-7876-2847-5. OCLC 39778687.
van der Krogt, Peter. "Elementymology & Elements Multidict". Retrieved 2007-06-08.
Davy, Humphry (1808). "On some new phenomena of chemical changes produced by electricity, particularly the decomposition of the fixed alkalies, and the exhibition of the new substances which constitute their bases; and on the general nature of alkaline bodies". Philosophical Transactions of the Royal Society of London 98: 1–44. doi:10.1098/rstl.1808.0001.
Weeks, Mary Elvira (1932). "The discovery of the elements. IX. Three alkali metals: Potassium, sodium, and lithium". Journal of Chemical Education 9 (6): 1035. Bibcode:1932JChEd...9.1035W. doi:10.1021/ed009p1035.
Kirchhoff, G.; Bunsen, R. (1860). "Chemische Analyse durch Spectralbeobachtungen". Annalen der Physik und Chemie 186 (6): 161–189. Bibcode:1860AnP...186..161K. doi:10.1002/andp.18601860602.
Alfred Klemm, Gabriele Hartmann, Ludwig Lange, "Sodium and Sodium Alloys" in Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a24_277
Eggeman, Tim; Updated By Staff (2007). "Kirk-Othmer Encyclopedia of Chemical Technology". John Wiley & Sons. doi:10.1002/0471238961.1915040912051311.a01.pub3. ISBN 0-471-23896-1.
Oesper, R. E.; Lemay, P. (1950). "Henri Sainte-Claire Deville, 1818–1881". Chymia 3: 205–221. doi:10.2307/27757153. JSTOR 27757153.
Banks, Alton (1990). "Sodium". Journal of Chemical Education 67 (12): 1046. Bibcode:1990JChEd..67.1046B. doi:10.1021/ed067p1046.
Pauling, Linus, General Chemistry, 1970 ed., Dover Publications
"Los Alamos National Laboratory – Sodium". Retrieved 2007-06-08.
"007-Sodium Metal". Mcssl.com. Retrieved 2010-11-27.
Gatti, M.; Tokatly, I.; Rubio, A. (2010). "Sodium: A Charge-Transfer Insulator at High Pressures". Physical Review Letters 104 (21): 216–404. arXiv:1003.0540. Bibcode:2010PhRvL.104u6404G. doi:10.1103/PhysRevLett.104.216404.
Schumann, Walter (5 August 2008). Minerals of the World (2nd ed.). Sterling. p. 28. ISBN 978-1-4027-5339-8. OCLC 637302667.
Citron, M. L.; Gabel, C.; Stroud, C.; Stroud, C. (1977). "Experimental Study of Power Broadening in a Two-Level Atom". Physical Review A 16 (4): 1507. Bibcode:1977PhRvA..16.1507C. doi:10.1103/PhysRevA.16.1507.
De Leon, N. "Reactivity of Alkali Metals". Indiana University Northwest. Retrieved 2007-12-07.
Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 0080379419.
Atkins, Peter W.; de Paula, Julio (2002). Physical Chemistry (7th ed.). W. H. Freeman. ISBN 978-0-7167-3539-7. OCLC 3345182.
Davies, Julian A. (1996). Synthetic Coordination Chemistry: Principles and Practice. World Scientific. p. 293. ISBN 978-981-02-2084-6. OCLC 717012347.
Audi, Georges; Bersillon, O.; Blachot, J.; Wapstra, A.H. (2003). «The NUBASE Evaluation of Nuclear and Decay Properties». Πυρηνική φυσική Α 729: 3–128. doi:10.1016/j.nuclphysa.2003.11.001. Bibcode: 2003NuPhA.729....3A.
Sanders, F. W.; Auxier, J. A. (1962). "Neutron Activation of Sodium in Anthropomorphous Phantoms". HealthPhysics 8 (4): 371–379. doi:10.1097/00004032-196208000-00005. PMID 14496815.
Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Natrium". Lehrbuch der Anorganischen Chemie (in German) (91–100 ed.). Walter de Gruyter. pp. 931–943. ISBN 3-11-007511-3.
Cowan, James A. (1997). Inorganic Biochemistry: An Introduction. Wiley-VCH. p. 7. ISBN 978-0-471-18895-7. OCLC 34515430.
Remington, Joseph P. (2006). Beringer, Paul, ed. Remington: The Science and Practice of Pharmacy (21st ed.). Lippincott Williams & Wilkins. pp. 365–366. ISBN 978-0-7817-4673-1. OCLC 60679584.
Wiberg, Egon; Wiberg, Nils; Holleman, A. F. (2001). Inorganic Chemistry. Academic Press. pp. 1103–1104. ISBN 978-0-12-352651-9. OCLC 48056955.
"Comprehensive Coordination Chemistry II". 2004. p. 515. doi:10.1016/B0-08-043748-6/01055-0. ISBN 978-0-08-043748-4. |chapter= ignored (help)
Dean, John Aurie; Lange, Norbert Adolph (1998). Lange's Handbook of Chemistry. McGraw-Hill. ISBN 0-07-016384-7.
Burgess, J. (1978). Metal Ions in Solution. New York: Ellis Horwood. ISBN 0-85312-027-7.
Starks, Charles M.; Liotta, Charles L.; Halpern, Marc (1994). Phase-Transfer Catalysis: Fundamentals, Applications, and Industrial Perspectives. Chapman & Hall. p. 162. ISBN 978-0-412-04071-9. OCLC 28027599.
Barber, H. H.; Kolthoff, I. M. (1929). "Gravimetric Determination of Sodium by the Uranyl Zinc Acetate Method. Ii. Application in the Presence of Rubidium, Cesium, Potassium, Lithium, Phosphate or Arsenate". J. Am. Chem. Soc. 51 (11): 3233. doi:10.1021/ja01386a008.
Kingsley, G. R.; Schaffert, R. R. (1954). "Micro-flame Photometric Determination of Sodium, Potassium and Calcium in Serum with Solvents". J. Biol. Chem. 206 (2): 807–15. PMID 13143043.
Levy, G. B. (1981). "Determination of Sodium with Ion-Selective Electrodes". Clinical Chemistry 27 (8): 1435–1438. PMID 7273405.
Dye, J. L.; Ceraso, J. M.; Mei Lok Tak; Barnett, B. L.; Tehan, F. J. (1974). "Crystalline Salt of the Sodium Anion (Na−)". J. Am. Chem. Soc. 96 (2): 608–609. doi:10.1021/ja00809a060.
Holleman, A. F.; Wiberg, E.; Wiberg, N. (2001). Inorganic Chemistry. Academic Press. ISBN 978-0-12-352651-9. OCLC 48056955.
Renfrow, Jr., W. B.; Hauser, C. R. (1943). "Triphenylmethylsodium". Org. Synth.; Coll. Vol. 2, p. 607
Εξωτερικοί σύνδεσμοι
Υποστηρικτικό διδακτικό υλικό Χημείας: Το Νάτριο.
| Περιοδικός πίνακας | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|||||||||||||||||||||||||||||||||||||||||
Hellenica World - Scientific Library
Από τη ελληνική Βικιπαίδεια http://el.wikipedia.org . Όλα τα κείμενα είναι διαθέσιμα υπό την GNU Free Documentation License