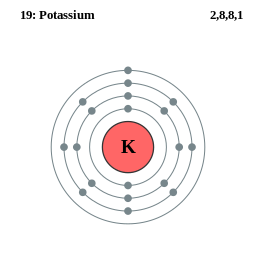
Το χημικό στοιχείο Κάλιο (νεολατινικά: Potassium, Kalium) είναι μέταλλο με ατομικό αριθμό (Ζ) 19 και ατομικό βάρος (AB) 39,0983 amu. Το μεταλλικό (στοιχειακό) κάλιο είναι ένα μαλακό αργυρόλευκο μέταλλο, που οξειδώνεται τάχιστα στον ατμοσφαιρικό αέρα και αντιδρά έντονα με το νερό, παράγοντας υδρογόνο και σημαντική θερμότητα, που συχνά είναι αρκετή ώστε να προκαλέσει την ανάφλεξη του παραγόμενου υδρογόνου. Έχει θερμοκρασία τήξης 63,65 °C και θερμοκρασία βρασμού 774 °C. Το σύμβολό του είναι K. Ανήκει στην 1η ομάδα του περιοδικού πίνακα (IA, με την παλαιότερη κατάταξη), κατατασσόμενο στα αλκαλιμέταλλα. Η κατανομή ηλεκτρονίων στις στιβάδες K, L, M, N είναι 2 8 8 1 και η ακριβής ηλεκτρονιακή του διαμόρφωση είναι 1s2 2s2 2p6 3s2 3p6 4s1.
| Κάλιο | ||
|---|---|---|
|
|
||
| Ιστορία | ||
| Ταυτότητα του στοιχείου | ||
| Κάλιο (K) | ||
| 19 | ||
| Μέταλλα | ||
| 1 ,4, s | ||
| 39.0983(1) | ||
| [ Ar ] 4s1 | ||
| 7440-09-7 | ||
| Ατομικές ιδιότητες | ||
| 227 pm | ||
| 0,82 | ||
| +1 | ||
| 1η: 418.8 kJ·mol−1 2η: 3052 kJ·mol−1 3η: 4420 kJ·mol−1 |
||
| Φυσικά χαρακτηριστικά | ||
| 336,53° K, 63,38 °C | ||
| 1032° K, 759 °C | ||
| 0,89 g·cm−3 | ||
| Παραμαγνητικό | ||
| 0,4 | ||
| 0,363 MPa | ||
| 3,53 GPa | ||
| Η κατάσταση αναφοράς είναι η πρότυπη κατάσταση (25°C, 1 Atm) εκτός αν σημειώνεται διαφορετικά |
||
Το κάλιο και το νάτριο είναι αλκαλιμέταλλα πολύ παρόμοια, από χημικής πλευράς. Για το λόγο αυτό, αρχικά (στην Ιστορία), τα άλατά τους δεν διαφοροποιούνταν. Τελικά συνειδητοποιήθηκε ότι πρόκειται για δυο διαφορετικά χημικά στοιχεία, στις αρχές του 19ου αιώνα, όταν έγινε εφικτή η απομόνωση των ίδιων των μετάλλων με ηλεκτρόλυση. Το κάλιο βρίσκεται στη φύση μόνο στη μορφή ιόνικών αλάτων του. Με τη μορφή αυτή βρίσκεται διαλυμένο στο θαλασσινό νερό (σε μέση περιεκτικότητα 0,04 %, κατά βάρος), αλλά και σε πολλά ορυκτά. Οι εφαρμογές του στη χημική βιομηχανία (συνήθως) αφορούν τη μεγάλη υδατοδιαλυτότητα των ιόντων του, που βοηθά έτσι, την έμμεση διαλυτοποίηση των λιγότερο (ή και καθόλου) υδατοδιαλυτών τμημάτων χημικών ενώσεων του, με χρήσιμη δραστηριότητα. Το ίδιο το μεταλλικό (στοιχειακό) κάλιο έχει λίγες ειδικές εφαρμογές και στις περισσότερες αντιδράσεις είναι δυνατό να αντικατασταθεί από το (οικονομικότερο) νάτριο.
Το ιόν του καλίου είναι απαραίτητο για τη λειτουργία όλων (των γνωστών) ζωντανών κυττάρων και γι' αυτό είναι παρόν σε όλους τους φυτικούς και ζωικούς ιστούς. Βρίσκεται σε εξαιρετικά μεγάλες συγκεντρώσεις στο εσωτερικό των φυτικών κυττάρων και ιδιαίτερα στα φρούτα.[1] Η σχετικά υψηλότερη συγκέντρωση καλίου σε σύγκριση με αυτήν του νατρίου στα φυτικά μέρη, είχε ως αποτέλεσμα, η πρώτη (ιστορικά) απομόνωση του στοιχείου να γίνει από τη στάχτη φυτικών υλών (απ' όπου προήλθε και η λέξη potash,[2] που ελληνοποιήθηκε σε «ποτάσσα» και αποτέλεσε το αρχικό όνομα του στοιχείου, που διατηρείται ακόμη σε αρκετές γλώσσες, που περιλαμβάνουν και την αγγλική). Η έντονη αγροτική καλλιέργεια απορροφά αρκετά σύντομα μεγάλο ποσοστό από το κάλιο που βρίσκεται φυσιολογικά στο καλλιεργούμενο έδαφος (απαιτώντας περιοδική αγρανάπαυση ή κατάλληλη λίπανση). Γι' αυτό, η βιομηχανία λιπασμάτων απορροφά το 93% της σύγχρονης παγκόσμιας παραγωγής καλίου.
Η φυσιολογική (βιοχημική) λειτουργία του καλίου είναι πολύ διαφορετική από αυτήν του νατρίου. Στα ζώα, ειδικότερα, τα ιόντα νατρίου και καλίου χρησιμοποιούνται διαφορετικά για την παραγωγή ηλεκτρικού δυναμικού στα κύτταρά τους και ιδιαίτερα στα νευρικά κύτταρα. Η έλλειψη καλίου στα ζώα (και στους ανθρώπους) έχει ως συνέπεια νευρολογικές δυσλειτουργίες.
Η σταθερή μορφή του καλίου δημιουργήθηκε σε υπερκαινοφανείς αστέρες, μέσω της διεργασίας r.[3]
Φυσική παρουσία
καλιούχος άστριος.
Το μεταλλικό (στοιχειακό) κάλιο δεν υπάρχει ελεύθερο στη φύση, γιατί αντιδρά βίαια με το νερό (και άλλες ουσίες που είναι διαδεδομένες σ' αυτήν). Σε διάφορες ενώσεις το κάλιο αποτελεί περίπου το 1,5% κατά μάζα και επομένως το έβδομο (7ο) πιο άφθονο στοιχείο στη λιθόσφαιρα του πλανήτη μας. Καθώς είναι πολύ ηλεκτροθετικό και γι' αυτό πολύ δραστικό στοιχείο, είναι δύσκολο να απομονωθεί από τα ορυκτά του.[4]
Τα κυριότερα ορυκτά του καλίου, από τα οποία μπορεί να ληφθεί καθαρό μέταλλο, είναι ο καρναλλίτης [KMgCl3·6(H2O)], ο συλβίνης (KCl) και ο πολυαλίτης [K2Ca2Mg(SO4)4·2(H2O)].[5]
Ιστορία
Το στοιχειακό κάλιο και τα άλατά του (ως ξεχωριστές ουσίες από τα άλλα άλατα) ήταν άγνωστα στην Ρωμαϊκή Εποχή. Γι' αυτό, το λατινικό όνομα kalium (από το οποίο προήλθε το ελληνικό «κάλιο») δεν είναι κλασσική λατινική λέξη, αλλά νεολατινική. Προήλθε από τη λέξη alkali, που με τη σειρά της από την αραβική القَلْيَه, που προφέρεται αλ-καλιαχ και σημαίνει «φυτική στάχτη». Από την ίδια λέξη προέρχεται και ομόηχος αγγλικός όρος alkali, που εξελληνίστηκε σε «αλκάλιο» ή «αλκαλικός» και χρησιμοποιείται στα αλκαλιμέταλλα, στις αλκαλικές γαίες και ως συνώνυμο του όρου «βάση», αν και στα Μοντέρνα Βασικά Αραβικά ο όρος «φυτική στάχτη» αποδίδεται από τη λέξη بوتاسيوم, που προφέρεται «μπουτάσυουμ». Το «ποτάσσιο», δηλαδή η σχετικά πλούσια σε κάλιο φυτική στάχτη, ήταν ένα μυστικό συστατικό που αναμειγνυόταν με την κοινή στάχτη, μια χρωστική indigo (δηλαδή λουλάκι) και καυτό νερό για να δώσει ένα βαθύ μπλε χρώμα βαφής υφασμάτων από τους εμπόρους της Χάουσας στην Κανώ.[6]
Η αγγλική λέξη για το κάλιο, potassium (εξελληνισμένα ποτάσσιο) προέρχεται από τη λέξη potash (εξελληνισμένα ποτάσσα),[7] αναφέρεται στη μέθοδο με την οποία η ποτάσσα, δηλαδή η φυτική στάχτη, λαμβάνονταν: Ξέπλεναν τη στάχτη (στα αγγλικά ash) από ξύλα ή φύλλα δέντρων και μετά αποξήραναν το διάλυμα σε μια κατσαρόλα (στα αγγλικά pot). Οπότε το συνολικό potash, κυριολεκτικά σήμαινε «στάχτη κατσαρόλας». Η ποτάσσα είναι κυρίως ένα άλας καλίου, γιατί τα φυτικά μέρη περιέχουν λίγο ή καθόλου νάτριο και τα άλλα κύρια μεταλλικά άλατα που περιέχουν, δηλαδή κυρίως το ασβέστιο, έχουν χαμηλή διαλυτότητα στο νερό, με το οποίο ξέπλεναν τη στάχτη. Η ποτάσσα, με την έννοια της ξεπλυμένης και αποξηραμένης φυτικής στάχτης, ήταν γνωστή από την Αρχαιότητα, αλλά δεν ήταν κατανοητό ότι ήταν ένα ριζικά διαφορετικό συστατικό από τα άλατα των άλλων μετάλλων και ιδιαίτερα του νατρίου. Ο διαχωρισμός των δύο στοιχείων, δηλαδή του νατρίου και του καλίου έγινε τελικά γνωστή μόνο μετά την εφαρμογή της ηλεκτρόλυσης τηγμάτων υδροξειδίου του νατρίου και υδροξειδίου του καλίου, από τον Σερ Χάμφρι Ντέιβι, στις αρχές του 19ου αιώνα.
Το μεταλλικό κάλιο πρωτοαπομονώθηκε το 1807 στην Αγγλία από τον Σερ Χάμφρι Ντέιβι, που το παρέλαβε με ηλεκτρόλυση τήγματος υδροξειδίου του καλίου (KOH), χρησιμοποιώντας ηλεκτρικό ρεύμα από μια, πρόσφατα τότε ανακαλυφθείσα, βολταϊκή στήλη. Μάλιστα, το κάλιο ήταν το πρώτο μέταλλο που απομονώθηκε με ηλεκτρόλυση.[8] Αργότερα, την ίδια χρονιά ο Σερ Χάμφρι Ντέιβι ανέφερε την απομόνωση του μεταλλικού νατρίου, με ηλεκτρόλυση τήγματος υδροξειδίου του νατρίου (NaOH), από ορυκτή προέλευση και όχι από φυτική στάχτη, αποδεικνύοντας έτσι οριστικά, ότι τα μέταλλα νάτριο και κάλιο και άρα και τα άλατά τους είναι διαφορετικές ουσίες.[9]
Παραγωγή
Κάλιο κάτω από THF.
Καθαρό μεταλλικό κάλιο μπορεί να απομονωθεί με ηλεκτρόλυση του τήγματος του υδροξειδίου του καλίου (KOH), με μια διεργασία που λίγο άλλαξε από την πρώτη απόπειρα του Σερ Ντέιβι[4]:
-
-
- Κάθοδος: K+(l) + e- → K(l)
- Άνοδος: 2ΟΗ-(l) - 2e- → H2O2 → H2O(g) + 1/2O2(g)
-
Χρησιμοποιείται επίσης θερμική μέθοδος απόκτησης μεταλλικού καλίου από τήγμα χλωριούχου καλίου: Σε θερμοκρασία 850 °C προστίθεται μεταλλικό νάτριο, οπότε έχουμε την ακόλουθη χημική ισορροπία:
{\displaystyle \mathrm {Na+KCl{\leftrightarrows }NaCl+K} }
Κανονικά, επειδή το κάλιο είναι ηλεκτροθετικότερο από το νάτριο, η παραπάνω χημική ισορροπία είναι μετατοπισμένη σχεδόν τελείως προς τα αριστερά. Στη θερμοκρασία των 850 °C, το παραγόμενο κάλιο εξαερώνεται και με την συνεχή απομάκρυνσή του μετατοπίζει τελικά τη χημική ισορροπία (σχεδόν) μονόδρομα προς τα δεξιά. Δηλαδή τελικά[1]:
{\displaystyle \mathrm {Na+KCl{\xrightarrow {850^{o}C}}NaCl+K\uparrow } }
Άλατα του καλίου, όπως ο καρναλλίτης, ο λανγκμπεϊνίτης, ο πολυχαλίτης και ο συλβίτης από εκτεταμένα αποθέματα σε (πρώην) αρχαίες λίμνες και θάλασσες, κάνοντας την εξόρυξη και εκμετάλλευση των αλάτων αυτών οικονομικά εφικτή. Η κύρια πηγή του καλίου, η ποτάσσα (Κ2CO3), εξορύσσεται στο Σασκάτσουαν, στην Καλιφόρνια, στη Γερμανία, στο Νέο Μεξικό, στην Γιούτα και σε άλλα μέρη σε ολόκληρο τον κόσμο.[10] Βρίσκεται ακόμη σε αφθονία στη Νεκρή Θάλασσα. Περίπου 900 μέτρα κάτω από την επιφάνεια του Σασκάτσουαν βρίσκονται μεγάλα κοιτάσματα ποτάσσας που είναι σημαντικές πηγές του μεταλλικού καλίου και των αλάτων του, με αρκετά μεγάλα ορυχεία που λειτουργούν από τη δεκαετία του 1960. Στο Σασκάτσουαν χρησιμοποιήθηκε πρωτοπόρα η μέθοδος του παγώματος της υγρής άμμου (σχηματισμός Μπλέρμορ) με σκοπό να δημιουργηθούν όροφοι ορυχείου από αυτήν. Οι ωκεανοί είναι μια άλλη πηγή καλίου, αλλά η ποσότητα του στοιχείου που παίρνεται από ένα δεδομένο όγκο θαλάσσιου νερού είναι πολύ μικρότερη από αυτήν του νατρίου.[11][12]
Το μεταλλικό κάλιο σε βαθμό καθαρότητας αντιδραστηρίου πωλούνταν για περίπου 22$/kg το 2010, όταν παραγγέλνονταν σε ποσότητες τόννων. Χαμηλότερης καθαρότητας μεταλλικό κάλιο πωλείται ακόμη οικονομικότερα. Η αγορά του μετάλλου αυτού είναι μεταβλητή, εξαιτίας της δυσκολίας (άρα και αυξημένου κόστους) της αποθήκευσης του στοιχειακού καλίου για μεγάλα χρονικά διαστήματα. Πρέπει να αποθηκεύεται κάτω από ατμόσφαιρα ξηρού ευγενές αέριο ή μέσα σε άνυδρο πετρέλαιο, για να αποφευχθεί ο επιφανειακός σχηματισμός στρώματος υπεροξειδίου του καλίου (K2O2). Το υπεροξείδιο του καλίου είναι εκρηκτικό ευαίσθητο στην πίεση και εκρύγνηται αν γρατσουνιστεί. Η φωτιά που ακολουθεί μια τέτοια έκρηξη είναι δύσκολο να σβηστεί.[13]
Ισότοπα
Κύριο λήμμα: Ισότοπα του καλίου
Υπάρχουν 24 γνωστά ισότοπα του καλίου. Από αυτά, μόνο τα τρία (3) ακόλουθα υπάρχουν στη φύση:
- 39K (93,3%), που είναι σταθερό.
- 40Κ (0,0117%), που, με πρόσληψη ηλεκτρονίου (σύλληψη Κ) ή εκπομπή ποζιτρονίου (β+ ακτινοβολία) διασπάται στο σταθερό 40Ar (σε ποσοστό 11,2%) και με εκπομπή ηλεκτρονίου (β- ακτινοβολία) μετατρέπεται στο επίσης σταθερό 40Ca (σε ποσοστό 88,8%), με ημιζωή 1,25·109 χρόνια. Αυτή η ραδιενεργή διάσπαση χρησιμοποιείται στη ραδιοχρονολόγηση πετρωμάτων. Η μέθοδος ραδιοχρονολόγησης K-Ar εξαρτάται από την ακρίβεια των ακολούθως δύο (2) υποθέσεων: α) Τα πετρώματα δεν περιείχαν αργό κατά το σχηματισμό τους. β) Είναι εγγυημένο όρι συλλέχθηκε όλο το ραδιογενές αργό από το πέτρωμα. Τα ορυκτά που είναι τα περισσότερο κατάλληλα για να ραδιοχρονολογηθούν με τη μέθοδο αυτή περιλαμβάνουν το βιοτίτη, το μοσχοβίτη, τα πυριγενή πετρώματα ή τα σε υψηλό βαθμό μεταμορφωσιγενή πυριτικά ορυκτά, οι άστριοι και τα αστριοειδή.
- 41Κ (6,7%), που είναι σταθερό.
Εκτός από τη χρησιμότητά τους στη ραδιοχρονολόγηση, τα ισότοπα του καλίου χρησιμεύουν ευρύτατα και ως ιχνηλάτες σε μελέτες της διάβρωσης. Χρησιμοποιούνται ακόμη, επίσης ως ιχνηλάτες, σε μελέτες διατροφικών κύκλων, γιατί το κάλιο είναι ένα μακροστοιχείο απαραίτητο για τη ζωή.
Το 40Κ υπάρχει στο φυσικό κάλιο και γι' αυτό αποτελεί συστατικό του εμπορικού αλατιού σε αξιόλογη ποσότητα, ώστε οι μεγάλες συσκευασίες του προϊόντος, να μπορούν να χρησιμοποιηθούν σε επιδείξεις ραδιενεργών πηγών σε σχολικές αίθουσες. Μάλιστα, το 40Κ αποτελεί για το ανθρώπινο σώμα τη μεγαλύτερη φυσική πηγή ραδιενέργειας, μεγαλύτερη κι από αυτήν του επίσης ραδιενεργού 14C. Ένα ανθρώπινο σώμα με μάζα 70 kg, διασπώνται περίπου 4.400 πυρήνες 40Κ ανά δευτερόλεπτο.[14] Η ραδιενέργεια του φυσικού καλίου είναι (συνολικά) 31 Bq/g.
Φυσικές ιδιότητες και χημική ανάλυση
Θετική δοκιμή πυρανίχνευσης καλίου. Το δείγμα που χρησιμοποιήθηκε μάλλον περιέχει και νάτριο και γι' αυτό η φλόγα πάνω από το δείγμα δεν είναι ακριβώς λιλά.
Το κάλιο είναι το μέταλλο με τη δεύτερη (2η) μικρότερη πυκνότητα. Μόνο το λίθιο είναι μέταλλο με μικρότερη πυκνότητα. Είναι ένα μαλακό χαμηλότηκτο στερεό. Έχει, μάλιστα, τόσο χαμηλή σκληρότητα, που μοιάζει με αυτή του κεριού και επιτρέπει την κοπή του μετάλλου ακόμη και με ένα κοινό μαχαίρι. Αν ένα κομμάτι κάλιο έχει κοπεί πρόσφατα είναι αργυρόλευκο στην όψη, αλλά στον ατμοσφαιρικό αέρα αρχίζει να οξειδώνεται και να γίνεται γκρι αμέσως μετά την επαφή του μετάλλου με αυτόν.[4]
Σε μια θετική δοκιμή πυρανίχνευσης, το στοιχειακό κάλιο και οι ενώσεις τους βάφουν τη φλόγο με ένα λιλά χρώμα, που όμως μπορεί να καλυφθεί από το (περισσότερο) έντονο κίτρινο χρώμα εκπομπής του νατρίου, αν είναι επίσης παρόν στο δείγμα. Σ' αυτήν την περίπτωση μπορεί να χρησιμοποιηθεί γυαλί κοβαλτίου, ως φίλτρο για το κίτρινο χρώμα εκπομπής του νατρίου.[15] Η συγκέντρωση του καλίου σε ένα διάλυμα συχνά προσδιορίζεται με τη χρήση φλογοφωτομετρίας, με φασματοσκοπία ατομικής απορρόφησης και τελικά με ζευγικό πλάσμα ή με εκλεκτικά ιονικά ηλεκτρόδια.
Χημικές ιδιότητες
Αρχείο:Potassium water 20.theora.ogvΑναπαραγωγή πολυμέσου
Η αντίδραση του καλίου στο νερό. Προσέξτε το χρώμα της φλόγας. Το δείγμα ήταν, φαίνεται, πιο καθαρό απ' ό,τι στην παραπάνω δοκιμής πυρανίχνευσης.
Το στοιχειακό κάλιο πρέπει να προστατεύεται από τον ατμοσφαιρικό αέρα και την υγρασία κατά την αποθύκευσή του, για να αποφευχθεί η διάβρωσή του που οδηγεί σε επιφανειακό (τουλάχιστον) σχηματισμό του οξειδίου του (K2O) ή του υδροξειδίου του (ΚΟΗ), αντίστοιχα. Γι' αυτό τα δείγματα του στοιχειακού καλίου πρέπει να προστατεύονται κάτω από ένα υλικό μέσο που δεν αντιδρά μ' αυτό (το κάλιο δηλαδή) και δεν επιτρέπει τη δίοδο του αέρα ή της υγρασίας ως το δείγμα του μετάλλου. Για το σκοπό αυτό χρησιμοποιείται συνήθως πετρέλαιο, κηροζίνη ή τετραϋδροφουράνιο (THF).
Αντίδραση με το νερό
Όπως και όλα τα άλλα αλκαλιμέταλλα, το κάλιο αντιδρά βίαια με το νερό, παράγοντας υδρογόνο. Η αντίδραση είναι αξιόλογα πιο βίαιη, σε σύγκριση με αυτές του λιθίου ή και του νατρίου και τόσο σημαντικά εξώθερμη, ώστε το παραγόμενο υδρογόνο αναφλέγεται:
{\displaystyle \mathrm {2K+2H_{2}O{\xrightarrow {}}2KOH+H_{2}\uparrow } }
Επειδή δε το κάλιο αντιδρά ακόμη και με ίχνη υγρασίας, και το παραγόμενο υδροξείδιο του καλίου είναι μη πτητικό, το στοιχειακό κάλιο μόνο του ή σε κράμα με νάτριο (δηλαδή NaK), χρησιμοποιείται για απομάκρυνση ιχνών υγρασίας από διαλύτες στους οποίους είναι ανεπιθύμητη, συνήθως πριν από απόσταξη. Σ' αυτές τις περιπτώσεις δρα ως ένα ισχυρό αφυδατικό μέσο.
Το κάλιο αντιδρά ακόμη, με όλα τα ηλεκτραρνητικά στοιχεία, αλλά και με αρκετά ηλεκτροθετικότερα, όπως τα μεταλλοειδή, δίνοντας τις αντίστοιχες ενώσεις:
Αντιδράσεις με το οξυγόνο και οξείδια του καλίου
Με οξυγόνο, το στερεό μεταλλικό κάλιο σχηματίζει υπεροξείδιο του καλίου (K2O2)[16]:
{\displaystyle \mathrm {2K+O_{2}{\xrightarrow {}}K_{2}O_{2}} }
Το απλό οξείδιο του καλίου (K2O), παράγεται με επίδραση υπεροξειδίου του καλίου σε μεταλλικό κάλιο:
2 K + K 2 O 2 → 2 K 2 O {\displaystyle \mathrm {2K+K_{2}O_{2}{\xrightarrow {}}2K_{2}O} } {\displaystyle \mathrm {2K+K_{2}O_{2}{\xrightarrow {}}2K_{2}O} }
Εναλλακτικά, μπορεί να παραχθεί και με επίδραση νιτρικού καλίου (KNO3) σε μεταλλικό κάλιο:
{\displaystyle \mathrm {10K+2KNO_{3}{\xrightarrow {}}6K_{2}O+N_{2}\uparrow } }
Τέλος, με επίδραση καθαρού οξυγόνου σε τήγμα μεταλλικού καλίου, παράγεται το σουπεροξείδιο του καλίου (KO2):
{\displaystyle \mathrm {K_{(l)}+O_{2}{\xrightarrow {}}KO_{2}} }
Αντίδραση με αλογόνα
Αντιδρά επίσης με τα αλογόνα (X2), όπου Χ = F, Cl, Br ή και I, σχηματίζοντας τα αντίστοιχα αλογονούχα άλατα:
{\displaystyle \mathrm {2K+X_{2}{\xrightarrow {}}2KX} }
Αντίδραση με θείο και σουλφίδια του καλίου
Το κάλιο αντιδρά με το θείο, σχηματίζοντας, ανάλογα με τις συνθήκες, τα ακόλουθα σουλφίδια:
- Σουλφίδιο του καλίου (K2S).
- Δισουλφίδιο του καλίου (K2S2).
- Τρισουλφίδιο του καλίου (K2S3).
- Τετρασουλφίδιο του καλίου (K2S4).
- Πεντασουλφίδιο του καλίου (K2S5). Και τέλος
- Εξασουλφίδιο του καλίου (K2S6).
Π.χ. η γενική στοιχειομετρική εξίσωση που δίνει κάθε σουλφίδιο του καλίου είναι η ακόλουθη (όπου x: 1-6):
{\displaystyle \mathrm {2K+xS{\xrightarrow {}}K_{2}S_{x}} }
Αντίδραση με το υδρογόνο
Το κάλιο αντιδρά με το υδρογόνο, παράγοντας υδρίδιο του καλίου:
{\displaystyle \mathrm {2K+H_{2}{\xrightarrow {}}2KH} }
Αντίδραση με το σελήνιο
Το κάλιο αντιδρά με το σελήνιο, παράγοντας σεληνιούχο κάλιο:
{\displaystyle \mathrm {2K+Se{\xrightarrow {}}K_{2}Se} }
Αντίδραση με το τελλούριο
Το κάλιο αντιδρά με το τελλούριο, παράγοντας τελλουριούχο κάλιο:
{\displaystyle \mathrm {2K+Te{\xrightarrow {}}K_{2}Te} }
Ως αναγωγικό μέσο
Το στοιχειακό κάλιο δρα ως αναγωγικό μέσο, αντικαθιστώντας τα περισσότερα άλλα μέταλλα (αφού ελάχιστα είναι πιο ηλεκτροθετικά) από τα άλατά τους. Βέβαια, σε βιομηχανικές εφαρμογές συνήθως προτιμάται το νάτριο σ' αυτόν το ρόλο, ως οικονομικότερο, αλλά το κάλιο είναι ισχυρότερο αναγωγικό. Π.χ. μπορεί να απελευθερώσει το τιτάνιο, από το τετραχλωριούχο τιτάνιο.[17]
{\displaystyle \mathrm {4K+TiCl_{4}{\xrightarrow {}}4KCl+Ti} }
Κάλιο και Οργανική Χημεία
Αντίδραση με τις αλκοόλες
Όπως και όλα τα άλλα αλκαλιμέταλλα, το κάλιο αντιδρά βίαια με τις αλκοόλες (ROH), σχηματίζοντας το αντίστοιχο αλκοολικό άλας.[18]:
{\displaystyle \mathrm {2K+2ROH{\xrightarrow {}}2ROK+H_{2}\uparrow } }
Η αντίδραση είναι επίσης έντονα εξώθερμη και συνήθως καταλήγει σε ανάφλεξη τόσο του παραγόμενου υδρογόνου, όσο και της αλκοόλης που δεν πρόλαβε να αντιδράσει.
Αντίδραση με τα καρβοξυλικά οξέα
Όπως και όλα τα άλλα αλκαλιμέταλλα, το κάλιο αντιδρά βίαια με τα καρβοξυλικά οξέα (RCOOH), σχηματίζοντας το αντίστοιχο καρβοξυλικό άλας.:
{\displaystyle \mathrm {2K+2RCOOH{\xrightarrow {}}2RCOOK+H_{2}\uparrow } }
Η αντίδραση είναι επίσης έντονα εξώθερμη και συνήθως καταλήγει σε ανάφλεξη τόσο του παραγόμενου υδρογόνου, όσο και του καρβοξυλιικού οξέος που δεν πρόλαβε να αντιδράσει.
Αντίδραση με «εξωτερικά» αλκίνια
Όπως και όλα τα άλλα αλκαλιμέταλλα, το κάλιο αντιδρά με τα «εξωτερικά» (όσα έχουν τον τριπλό δεσμό τους στο ακραίο (#1) άτομο άνθρακα) αλκίνια (RC ≡ CH), σχηματίζοντας το αντίστοιχο «αλκινιλίδιο»[19]:
{\displaystyle \mathrm {2K+2RC\equiv CH{\xrightarrow {}}2R\equiv CK+H_{2}\uparrow } }
Αντίδραση Würtz
Το κάλιο, με αλκυλαλογονίδια (RX) δίνει επίσης, όπως και το νάτριο, την αντίδραση Würtz[20]:
{\displaystyle \mathrm {2RX+2K{\xrightarrow {}}R_{2}+2KX} }
Αλκυλοκάλια
Το κάλιο, με αλκυλαλογονίδια (RX), σε άνυδρο και ψυχρό περιβάλλον δίνει τα αντίστοιχα αλκυλοκάλια (οργανομεταλλικές ενώσεις με κάλιο)[21]:
{\displaystyle \mathrm {RX+2K{\xrightarrow[{-10^{o}C}]{|Et_{2}O|}}RK+KX} }
Άλατα με μηλονικούς εστέρες
Στους εστέρες του μηλονικού οξέος (ROOCCH2COOR), τα δύο (2) άτομα υδρογόνου του κεντρικού μεθυλενίου είναι αρκετά όξινα ώστε να μπορούν να αντικατασταθούν από νάτριο, αλλά και από κάλιο[22]:
{\displaystyle \mathrm {2ROOCCH_{2}COOR+2K{\xrightarrow {}}K^{+}[ROOCCH^{-}COOR]+KX} }
Άλατα με ακετοξικούς εστέρες
Στους εστέρες του ακετοξικού οξέος (CH3COCH2COOR), τα δύο (2) άτομα υδρογόνου του κεντρικού μεθυλενίου είναι αρκετά όξινα ώστε να μπορούν να αντικατασταθούν από νάτριο, αλλά και από κάλιο[23]:
{\displaystyle \mathrm {2CH_{3}COCH_{2}COOR+2K{\xrightarrow {}}K^{+}[CH_{3}COCH^{-}COOR]+KX} }
Αντιδράσεις με κετόνες
Το κάλιο, όπως επίσης ομοίως το νάτριο και το μαγνήσιο, αντιδρά με κετόνες RCOR', παράγοντας τελικά (μετά από υδρόλυση) δευτεροταγείς διόλες[24]:
\( {\displaystyle \mathrm {2RCOR{\acute {}}+2K{\xrightarrow {}}RC(OK)(R{\acute {}})C(OK)(R{\acute {}})R{\xrightarrow {+2H_{2}O}}RC(OH)(R{\acute {}})C(OH)(R{\acute {}})R+2KOH} } ]_
Βιοχημικός ρόλος
Το κάλιο είναι το κύριο ενδοκυττάριο κατιόν. Το 90% του ολικού καλίου του σώματος είναι ενδοκυττάριο και μόνο το 2% είναι εξωκυττάριο. Τα φυσιολογικά άτομα διατηρούν το ισοζύγιο καλίου εκκρίνοντας ημερησίως ένα ποσό καλίου ίσο με το ποσό που προσλαμβάνεται με την τροφή εκτός από ένα μικρό ποσοστό που απομακρύνεται με τα κόπρανα και τον ιδρώτα. Η ρύθμιση της συγκέντρωσης καλίου στον ορό επιτυγχάνεται κυρίως μέσω των νεφρών. Η αλδοστερόνη και σε μικρότερο βαθμό τα γλυκοκορτικοειδή αυξάνουν την απέκκριση καλίου από τους νεφρούς.
Η επαναρρόφηση νατρίου από τους νεφρούς συνδυάζεται με αυξημένη απώλεια καλίου. Η αλκάλωση αυξάνει την είσοδο του καλίου στα κύτταρα και συνεπώς προκαλεί υποκαλιαιμία. Η οξέωση αντίθετα αυξάνει την έξοδο καλίου από τα κύτταρα και συνεπώς προκαλεί υπερκαλιαιμία.
Τα επίπεδα καλίου θα πρέπει να ελέγχονται προσεκτικά σε ασθενείς με ουραιμία, νόσο του Addison, εμετούς, διάρροια και σε ασθενείς που λαμβάνουν διουρητικά και στεροειδή ή διγοξίνη. Ψευδώς υψηλές τιμές καλίου στον ορό παρατηρούνται μετά από παρατεταμένη χρήση ελαστικής περιχειρίδας κατά την αιμοληψία καθώς και μετά από αιμόλυση.
Το κάλιο είναι το όγδοο (8ο) ή το ένατο (9ο) χημικό στοιχείο κατά μάζα (0,2%) του ανθρώπινου σώματος.[25] Για παράδειγμα, ένα σώμα 60 kg περιέχει 120 g καλίου. Το ασβέστιο και ο φωσφόρος είναι πιο άφθονα (πάντα κατά μάζα) στο ανθρώπινο σώμα, ενώ το νάτριο και το χλώριο έχουν περιεκτικότητα περίπου ίση με τα 2/3 της περιεκτικότητας του καλίου.
Τα κατιόντα του καλίου είναι σημαντικά για τη λειτουργία του νευρικού συστήματος, κεντρικού και περιφερειακού. Ακόμη, ρυθμίζουν την ωσμωτική ισορροπία μεταξύ των κυττάρων και του υγρού που τα περιβάλλει, καθώς η κυτταρική μεμβράνη έχει ένα ειδικό υποοργανίδιο, την Na+/K+ATPάση, που λειτουργεί ως αντλία εισαγωγής - εξαγωγής του αντίστοιχου ιονικού ζεύγους, σε όλα τα ζώα (αλλά όχι και σε όλα τα φυτά).[26] Αυτή η «ιονική αντλία» χρησιμοποιεί τη χημική ενέργεια που εκλύεται από την υδρόλυση ενός μορίου ATP σε ADP και φωσφορικό οξύ, για να εξάγει τρία (3) κατιόντα νατρίου έξω από το κύτταρο και να εισάγει παράλληλα δύο (2) κατιόντα καλίου μέσα στο κύτταρο. Η διαφορά του ενός κατιόντος δημιουργεί ένα ηλεκτροχημικό δυναμικό γύρω από την κυτταρική μεμβράνη. Επιπρόσθετα, υπάρχουν τα τετραμερή ιονικά κανάλια καλίου, που είναι κρίσιμης σημασίας για την αντιμετώπιση της υπερφόρτισης, ιδιαίτερα των νευρώνων όταν έχει ενεργοποιηθεί μια δυναμική πράξη. Το ιονικό κανάλι καλίου που έχει ανακαλυφθεί πιο πρόσφατα είναι το KirBac3.1, που δίνει συνολικά (μαζί με το τετραμερές που αναφέρθηκε παραπάνω) πέντε (5) ιονικά κανάλια καλίου (με αντίστοιχες ονομασίες KcsA, KirBac1.1, KirBac3.1, KvAP και MthK) σε μία καθορισμένη δομή.[27] Αυτά τα παραπάνω αναφερόμενα πέντε (6) ιονικά κανάλια καλίου είναι όλα από προκαρυωτικά είδη.
Το κάλιο μπορεί να ανιχνευθεί από την αίσθηση της γεύσης, ενεργοποιώντας τα τρία (3) από τα πέντε (5) είδη των γευστικών αισθητήρων, δίνοντας τελικά διαφορετική γευστική εντύπωση, ανάλογα με τη συγκέντρωση των κατιόντων του στο δείγμα τροφής που δοκιμάζεται. Συγκεκριμένα: Τα αραιά διαλύματα κατιόντων καλίου δίνουν γλυκιά αίσθηση (επιτρέποντας μέχρι μέτριες συγκεντρώσεις των κατιόντων καλίου στο γάλα και τους φυσικούς χυμούς, ώστε να είναι ευχάριστα δεκτά από τους καταναλωτές τους). Καθώς πυκνώνουν τα διαλύματα, η αίσθηση που δίνουν γίνεται ολοένα και πιο αλκαλική, δηλαδή πικρή, σαπωνοειδής, αλλά και αλμυρή. Η εύρεση της σωστής συγκέντρωσης κατιόντων καλίου, ώστε να δίνει ευχάριστο συνδυασμό πικράδας και αλμυρότητας σε προϊόντα που απαιτούν σχετικά μεγάλη συγκέντρωση του ιόντος είναι μια γευσιγνωστική πρόκληση.
Υποκαλιαιμία
Μια αφύσικα χαμηλή συγκέντρωση καλίου αναφέρεται ως υποκαλιαιμία. Αίτια:
- Ελλιπής πρόσληψη από του στόματος ή ενδοφλεβίως
- Εγκαύματα
- Διάρροια
- Διουρητικά
- Υπεραλδοστερονισμός
- Σύνδρομο Cushing
- Νεφρική σωληναριακή οξέωση
- Ασκίτης
- Κυστική ίνωση
- Στένωση νεφρικής αρτηρίας
- Τραύμα
- Σύνδρομο Fanconi
- Σύνδρομο Bartter
- Υπεργλυκαιμία
- Αλκάλωση
- Έμετοι
Τα συμπτώματα περιλαμβάνουν αφύσικη ξηρότητα δέρματος, ακμή, κρυολογήματα, δυσκοιλιότητα, κατάθλιψη, διάρροια, μειωμένη λειτουργία αντανακλαστικών, οίδημα, νευρικότητα, ανικανοποίητη δίψα, αυξομειώσεις στον ρυθμό της καρδιάς, ελαττωμένη ανοχή στη γλυκόζη, αϋπνία, μυϊκή κόπωση και αδυναμία, ναυτία και εμετό, περιοδικούς πονοκεφάλους, πρωτεϊνουρία και κατακράτηση νατρίου.
Θεραπεία υποκαλιαιμίας
Όταν η έλλειψη καλίου μπορεί να αποδοθεί σε συγκεκριμένη ασθένεια ή σε πυρετό και διάρροια, ο γιατρός μπορεί συνήθως να αντιμετωπίσει τις υποκείμενες συνθήκες και να διασφαλίσει ότι υπάρχει επαρκές κάλιο στη διατροφή. Αν η φαρμακευτική αγωγή είναι η αιτία, συνιστάται μια αλλαγή στη συνταγή ή σε ορισμένες περιπτώσεις μια δίαιτα υψηλή σε κάλιο. Μπορεί, επίσης, να χρειαστούν συμπληρώματα μετάλλων, αν ο ασθενής δεν μπορεί να πάρει αρκετό κάλιο, μέσω της διατροφής. Σε σοβαρές περιπτώσεις το κάλιο μπορεί να χορηγηθεί ενδοφλεβίως. Τροφές πλούσιες σε κάλιο είναι το βόειο κρέας, το κοτόπουλο και ψάρια όπως ο μπακαλιάρος, ο σολομός και οι σαρδέλες. Καλές πηγές καλίου αποτελούν επίσης τα μπιζέλια, οι ντομάτες, τα πράσινα φυλλώδη λαχανικά και οι φλούδες της πατάτας. Οι μπανάνες, τα φύκια, τα πεπόνια, τα βερίκοκα και τα εσπεριδοειδή είναι επίσης πλούσια σε κάλιο, όπως και τα αποξηραμένα φρούτα (μάνγκο, βερίκοκα), οι ξηροί καρποί και η σοκολάτα.
Υπερκαλιαιμία
Αφύσικα υψηλές συγκεντρώσεις καλίου αναφέρονται ως υπερκαλιαιμία.
Υπερβολική πρόσληψη
Οξεία και χρόνια νεφρική ανεπάρκεια
Υποαλδοστερονισμός
Αιμόλυση
Λοιμώξεις
Οξέωση
Αφυδάτωση
Νόσος του Addison
Ψευδοϋποαλδοστερονισμός
Η υπερκαλιαιμία συμβαίνει όταν η λήψη καλίου ξεπερνά την ικανότητα των νεφρών να το αποβάλλουν. Αυτό μπορεί να προκαλέσει βλάβη στα νεφρά. Σε χρόνια νεφρική νόσο παρουσιάζονται υψηλά επίπεδα καλίου στο αίμα, λόγω της μειωμένης αποβολής του από τον ελαττωμένο ή ανύπαρκτο όγκο ούρων.
Θεραπεία υπερκαλιαμίας
Υιοθετώντας διατροφή χαμηλή σε κάλιο μπορεί να μειωθεί ο κίνδυνος ανάπτυξης υπερκαλιαιμίας και των συνεπειών αυτής, όπως σοβαρή μυϊκή αδυναμία, παράλυση και καρδιακές αρρυθμίες που μπορεί να οδηγήσουν σε θάνατο. Προληπτικά μέτρα για την διατήρηση χαμηλών επιπέδων καλίου, αποτελούν η δίαιτα χαμηλή σε κάλιο και η αποφυγή της χρήσης φαρμάκων που αυξάνουν τα επίπεδα καλίου.
Διάγνωση
Για να συγκεντρωθούν αρκετές πληροφορίες για τη διάγνωση, η μέτρηση του καλίου είναι αναγκαίο να επαναληφθεί καθώς η αύξηση μπορεί να οφείλεται σε αιμόλυση στο πρώτο δείγμα. Στον ορό το φυσιολογικό επίπεδο του καλίου είναι 3,5 - 5 mEq / L. Γενικά, θα πρέπει να πραγματοποιηθούν εξετάσεις αίματος για τη νεφρική λειτουργία (κρεατινίνη, άζωτο ουρίας αίματος),τη γλυκόζη και περιστασιακά την κινάση της κρεατίνης και της κορτιζόλης. Ο υπολογισμός της σωληνοειδούς κλίσης του καλίου μπορεί μερικές φορές να βοηθήσει στη διάκριση της αιτίας της υπερκαλιαιμίας. Σε πολλές περιπτώσεις θα πραγματοποιηθεί νεφρικό υπερηχογράφημα, αφού η υπερκαλιαιμία είναι άκρως ενδεικτική της νεφρικής ανεπάρκειας. Επίσης, μπορεί να γίνει ηλεκτροκαρδιογράφημα για να διαπιστωθεί εάν υπάρχει σημαντικός κίνδυνος καρδιακών αρρυθμιών.
Κάλιο και διατροφή
Μια διατροφή πλούσια σε κάλιο φαίνεται ότι έχει ισχυρές ευεργετικές επιδράσεις στην υγεία. Συσχετίζεται με σημαντικά μειωμένο κίνδυνο για εγκεφαλικό επεισόδιο ή αποπληξία, καρδιοπάθεια και γενικά, για καρδιαγγειακή πάθηση. Το κάλιο είναι απαραίτητο στοιχείο στη διατροφή των ατόμων με υπέρταση, διότι βοηθάει στην απομάκρυνση του νατρίου. Πολλοί έχουν συνδέσει τη διατροφή που είναι υψηλή σε νάτριο (αλάτι) με την υπέρταση, αλλά αυτό που δε γνωρίζουν οι περισσότεροι είναι οτι η διατροφή χαμηλή σε κάλιο μπορεί να οδηγήσει σε υψηλή αρτηριακή πίεση. Ο λόγος για τον οποίο το κάλιο μειώνει τον κίνδυνο καρδιαγγειακών παθήσεων, φαίνεται να είναι η δράση του στην αρτηριακή πίεση. Το κάλιο βοηθά στη μείωση της υψηλής πίεσης και συμβάλλει στη θεραπεία κατά της υπέρτασης. Το κάλιο δεν αποθηκεύεται στο σώμα μας και έτσι πρέπει να το προσλαμβάνουμε μέσω της τροφής. Υπάρχουν τροφές αλλά και προϊόντα στο εμπόριο που είναι εμπλουτισμένα με κάλιο (π.χ. ρόφημα φρούτων με κάλιο) τα οποία βοηθούν στην αποβολή του νατρίου από το αίμα και συνεπώς στη μείωση της αρτηριακής πίεσης. Άλλες σημαντικές ιδιότητες του καλίου είναι η λειτουργία του εγκεφάλου, αφού τα κανάλια καλίου στον εγκέφαλο παίζουν κυρίαρχο ρόλο στη μνήμη και τη μάθηση. Μερικές έρευνες έχουν δείξει μειωμένες πιθανότητες εγκεφαλικού επεισοδίου στα άτομα που ακολουθούσαν με διατροφή πλούσια σε κάλιο. Σε άτομα με διαβήτη, μια διατροφή χαμηλή σε κάλιο μπορεί να ρίξει τα επίπεδα γλυκόζης στο αίμα, προκαλώντας υπογλυκαιμία. Μια άλλη, εξίσου σημαντική ιδιότητα του καλίου είναι, ότι βοηθά στα αντανακλαστικά των νεύρων που είναι υπεύθυνα για τη μεταφορά μηνυμάτων από το ένα μέρος του σώματος στο άλλο. Επίσης, το κάλιο ευθύνεται για τη σύσπαση των μυών του σώματος. Κάποιοι θεωρούν το κάλιο αγχολυτικό, αφού τονώνει τον οργανισμό από το άγχος και το στρες. Εξίσου σημαντικό ρόλο παίζει το κάλιο στον μεταβολισμό των λιπών, της πρωτεΐνης και των υδατανθράκων, αφού λαμβάνει μέρος στη διαδικασία διάσπασης αυτών των θρεπτικών συστατικών.
Κάλιο και οστεοπόρωση
Να σημειωθεί ότι εκτός από τη ρύθμιση της πίεσης του αίματος, το κάλιο παίζει ρόλο και στην πρόληψη της οστεοπόρωσης. Το κάλιο μειώνει την απέκκριση του ασβεστίου από το σώμα, ενώ το αλάτι (νάτριο) οδηγεί το ασβέστιο έξω από το σώμα. Μελέτες έχουν δείξει θετική σχέση μεταξύ μιας διατροφής πλούσιας σε κάλιο και της υγείας των οστών, ιδιαίτερα μεταξύ των ηλικιωμένων γυναικών. Αυτό υποδηλώνει ότι τροφές πλούσιες σε κάλιο μπορούν να διαδραματίσουν ρόλο στην πρόληψη της οστεοπόρωσης.
Κάλιο και αθλητές
Οι αθλητές είναι μια κατηγορία πληθυσμού που έχει αυξημένες ανάγκες σε κάλιο, ειδικότερα σε περιόδους εντατικής άσκησης, για να αντικαταστήσουν την απώλεια μυϊκής μάζας και καλίου που αποβάλλεται μέσω του ιδρώτα, κατά τη διάρκεια της άθλησης. Όταν υπάρχει μεγάλη απώλεια καλίου, έχουν αυξημένες πιθανότητες να εμφανίσουν μυϊκές κράμπες και αρρυθμίες στην καρδιά. Ένα ποτήρι χυμό πορτοκάλι ή 1 μπανάνα μετά από μια ώρα άσκησης, αρκούν για να επαναφέρουν το κάλιο στον οργανισμό.
Χ
ρήσεις
Το αυτούσιο μέταλλο έχει ελάχιστες βιομηχανικές χρήσεις, σε ορισμένα κράματα. Εκτός από τη χρονολόγηση, κάποια ισότοπα του καλίου χρησιμοποιούνταν ευρέως ως ανιχνευτές σε μελέτες του καιρού. Είχαν επίσης χρησιμοποιηθεί για μελέτες του κύκλου των θρεπτικών ουσιών, γιατί το κάλιο είναι ένα κύριο συστατικό της ανάπτυξης των φυτών, άρα και απαραίτητο για τη ζωή. Σήμερα χρησιμοποιούνται ευρέως ενώσεις του καλίου ως λιπάσματα και, σε μικρότερες ποσότητες, σε φαρμακευτικά σκευάσματα για τη θεραπεία της υποκαλιαιμίας.
Σημειώσεις, αναφορές και παραπομπές
Web Elements: Potassium
U.S Geological Survey, potash statistics and information
A.G.W. Cameron (June 1957). «Stellar Evolution, Nuclear Astrophysics, and Nucleogenesis». CRL-41. "http://www.fas.org/sgp/eprint/CRL-41.pdf"
Mark Winter. «Potassium: Key Information». Webelements.
Mineral data
http://edition.cnn.com/2010/WORLD/africa/11/26/nigeria.dye.tradition/index.html
Davy (1808), p. 32.
Enghag, P. (2004). «11. Sodium and Potassium». Encyclopedia of the elements. Wiley-VCH Weinheim. ISBN 3527306668.
Davy, Humphry (1808). «On some new phenomena of chemical changes produced by electricity, particularly the decomposition of the fixed alkalies, and the exhibition of the new substances which constitute their bases; and on the general nature of alkaline bodies». Philosophical Transactions of the Royal Society of London 98: 1–44. doi:10.1098/rstl.1808.0001.
http://books.google.de/books?id=EHx51n3T858C. Missing or empty |title= (βοήθεια)
Ober, Joyce A. «Mineral Commodity Summaries 2008:Potash» (PDF). United States Geological Survey. Ανακτήθηκε στις 20 Νοεμβρίου 2008.
Ober, Joyce A. «Mineral Yearbook 2006:Potash» (PDF). United States Geological Survey. Ανακτήθηκε στις 20 Νοεμβρίου 2008.
«Potassium Metal 98.50% Purity». Galliumsource.com. Αρχειοθετήθηκε από το πρωτότυπο στις 11 Ιουλίου 2011. Ανακτήθηκε στις 16 Οκτωβρίου 2010.
«background radiation – potassium-40 – γ radiation».
Anne Marie Helmenstine. «Qualitative Analysis – Flame Tests». About.com.
Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
«Titanium». Microsoft Encarta. 2005. Ανακτήθηκε στις 2006-12-29., με K αντί Mg
Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.199, §8.2.4α.
Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 159, §6.9.10α.
Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.2α, K αντί Νa.
«Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 268, §11.5Β
«Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 283, §12.2.4, K αντί Na
«Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 283, §12.2.5, K αντί Na
«Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 222, §9.7.4, K αντί Na ή Mg
Το θείο περιέχεται σε παρόμοια ποσότητα, κατά μάζα και επομένως το πιο περιέχεται λίγο παραπάνω, ώστε να πάρει την 8η θέση, είναι οριακά αμφισβητούμενο.
Campbell, Neil (1987). Biology. Menlo Park, Calif.: Benjamin/Cummings Pub. Co. σελ. 795. ISBN 0-8053-1840-2.
Mikko Hellgren, Lars Sandberg, Olle Edholm (2006). «A comparison between two prokaryotic potassium channels (KirBac1.1 and KcsA) in a molecular dynamics (MD) simulation study». Biophys. Chem. 120 (1): 1–9. doi:10.1016/j.bpc.2005.10.002. PMID 16253415.
Hellenica World - Scientific Library
Από τη ελληνική Βικιπαίδεια http://el.wikipedia.org . Όλα τα κείμενα είναι διαθέσιμα υπό την GNU Free Documentation License