
Το μαγνήσιο είναι το χημικό στοιχείο με ατομικό αριθμό 12 και χημικό σύμβολο Mg. Ο συνηθισμένος βαθμός οξείδωσης του είναι +2. Πρόκειται για το δεύτερο (2ο κατά σειρά ατομικής μάζας) μέταλλο αλκαλικών γαιών, το όγδοο (8ο) κατά σειρά αφθονίας στο φλοιό της Γης (2% κατά βάρος[1]) και το ένατο (9ο) γενικά στο σύμπαν[2][3]. Το τελευταίο οφείλεται στο γεγονός ότι σχετικά εύκολα παράγεται από τα υπερκαινοφανή άστρα, από την κύρια σειρά πυρηνικών συντήξεων: υδρογόνο → ήλιο → άνθρακας → μαγνήσιο. Η μεγάλη διαλυτότητα του ιόντος του (Mg2+) στο νερό, το κάνει ακόμη το τρίτο (3ο) πιο άφθονο διαλυμένο ιόν του θαλασσινού νερού, μετά από αυτά του νατρίου (Na+) και του χλωρίου (Cl-), φυσικά[4].
| Μαγνήσιο |
|---|
| Mg |
| 12 |
| μέταλλο αλκαλικών γαιών |
| 2+ |
| 2 (ΙΙΑ), 3, s |
| Αργυρόλευκο στερεό |
| [Ne] 3s2 |
| 2 8 2 |
| 231-104-6 |
| 7439-95-4 |
| Φυσικές ιδιότητες και σταθερές |
| στερεό |
| 24,3050(6)(amu) |
| 650 °C (1.202 °F) (923 K) |
| 1.091 °C (1.994 °F) (1.363 K) |
| 1.738 kg/m3 |
| 1,31 |
| 1η: 737,7 ΚJ/mol |
| 2η: 1.450,7 ΚJ/mol |
| 3η: 7.732,7 KJ/mol |
| 160 pm |
| 141±7 pm |
| 173 pm |
| παραμαγνητικό |
| 43,9 nΩ·m (20 °C) |
| 156 W·m−1·K−1 (300 K) |
| 2,5 |
| 4.940 m·s−1 |
| Η κατάσταση αναφοράς είναι η πρότυπη κατάσταση (25 °C, 1 Atm) εκτός αν σημειώνεται διαφορετικά |
Το μαγνήσιο είναι το ενδέκατο (11ο) πιο άφθονο στοιχείο της μάζας του ανθρώπινου σώματος, ενώ είναι απαραίτητο για όλα τα κύτταρα, καθώς και ειδικότερα για τη λειτουργία περί των 300 ενζύμων,[5] όπου διαδραματίζουν σημαντικό ρόλο στον έλεγχο σημαντικών βιοχημικών λειτουργιών. Τα ιόντα μαγνησίου (Mg2+) αλληλεπιδρούν με πολυφωσφορικές ενώσεις όπως το ATP, το DNA και RNA, καθώς επίσης και εκατοντάδες ένζυμα. Τα ιόντα μαγνησίου είναι επίσης η μεταλλική καρδιά στο κέντρο της χλωροφύλλης, και είναι γι' αυτό μια κοινή πρόσθετη ύλη για τα λιπάσματα[6]. Αρκετές ενώσεις του μαγνησίου χρησιμοποιούνται καθημερινά για, ιατρικούς λόγους, ως καθαρτικά, αντιόξινα (π.χ., το γάλα της μαγνησίας), και για σταθεροποίηση παθολογικής διέγερσης νεύρων, του αίματος και το σπασμό των αγγείων, σε τέτοιες συνθήκες όπως η εκλαμψία.[5] Τα ιόντα του μαγνησίου έχουν ξινή γεύση και σε χαμηλές συγκεντρώσεις βοηθούν να αντιμετωπιστεί εν μέρει η φυσική σκληρότητα των μεταλλικών νερών.
Σε μορφή ελεύθερου στοιχείου δεν βρίσκεται στη Γη, επειδή (το τελευταίο, δηλαδή το μεταλλικό μαγνήσιο) είναι (χημικά) πολύ δραστικό όταν παράγεται, αν και όταν εκτίθεται στην ατμόσφαιρα επικαλύπτεται με ένα λεπτό στρώμα οξειδίου του μαγνησίου (MgO), το οποίο προστατεύει το εσωτερικό του από την παρά πέρα οξείδωση και γενικά περιορίζει κάπως τη δραστικότητά του. Με την έκθεσή του, ωστόσο, σε (χημικά) καθαρό οξυγόνο (O2) αναφλέγεται εκπέμποντας χαρακτηριστικό έντονο φως, καθιστώντας το χρήσιμο συστατικό για φωτοβολίδες, πυροτεχνήματα. Το μέταλλο πλέον παράγεται κυρίως με ηλεκτρόλυση αλάτων του που παραλαμβάνονται από τη θαλάσσια άλμη, αλλά και από το δολομίτη. Η κύρια εμπορική χρήση του είναι να σχηματίζει κράματα με αλουμίνιο (Al), που συχνά γι' αυτόν το λόγο ονομάζονται «μαγνάλια» ή «μαγνήλια» (magnalium ή magnelium). Επειδή το μαγνήσιο έχει μικρότερη πυκνότητα από το αλουμίνιο (Al) τα κράματα αυτά είναι προικισμένα με σχετικά μεγάλη ελαφρότητα και αντοχή.
Στην όψη είναι ένα αργυρόλευκο μέταλλο. Αποτελεί ακόμη εξαιρετικά σημαντικό αντιδραστήριο για τη συνθετική Οργανική Χημεία, γιατί αποτελεί τη βάση των οργανομαγνησιακών ενώσεων που έχουν μια μεγάλη πληθώρα συνθετικών εφαρμογών (αν και τελευταία υπάρχει τάση οι τελευταίες να αντικαθίστανται από τις οργανολιθιακές ενώσεις).
Ιστορία
Το όνομα προέρχεται από τη Μαγνησία της Θεσσαλίας. Σχετίζεται με το μαγνητίτη (Fe3S4) και το μαγγάνιο (Mn), που προέρχονται από κοιτάσματα στην περιοχή και χρειάζονται διαφοροποίηση στην ονομασία τους ως διαφορετικές ουσίες.
Το μαγνήσιο είναι το έβδομο (7ο) κατά μάζα και το όγδοο (8ο) κατά μοριακή συγκέντρωση πιο άφθονο χημικό στοιχείο στο φλοιό της Γης[7]. Βρίσκεται σε μεγάλα αποθέματα μαγνησίτη, δολομίτη και άλλα ορυκτά και μεταλλικά νερά, καθώς το ιόν του μαγνησίου (Mg2+) είναι διαλυτό. Το 1618 ένας αγρότης από το Έπσομ της Αγγλίας προσπάθησε να ποτίσει τις αγελάδες του με νερό από ένα πηγάδι. Αυτές αρνήθηκαν να πιουν, γιατί το νερό είχε πικρή γεύση. Ωστόσο ο αγρότης παρατήρησε ότι το νερό έμοιαζε να θεραπεύει γδαρσίματα και ουλές. Η φήμη για τα άλατα από το Έπσομ εξαπλώθηκε. Τελικά αναγνωρίστηκε ότι περιείχαν ένυδρο θειικό μαγνήσιο (MgSO4).
Το ίδιο το μέταλλο πρωτοπαρασκευάστηκε επίσης στην Αγγλία από τον Σερ Χάμφρι Ντέιβι (Sir Humphry Davy) το 1808 με ηλεκτρόλυση ενός μίγματος οξείδιο του μαγνησίου (MgO) και οξείδιο του υδραργύρου (HgO). O Antoine Bussy το παρασκεύασε το 1831. Η πρώτη πρόταση του Ντέιβι για την ονομασία του ήταν «μάγνιο» (magnium), αλλά τελικά επικράτησε το όνομα «μαγνήσιο».
Ισότοπα
Κύριο λήμμα: Ισότοπα του μαγνησίου
Το μαγνήσιο έχει τρία σταθερά ισότοπα: 24Mg, 25Mg, 26Mg. Όλα υπάρχουν σε σημαντικά ποσοστά στη Γη: το 24Mg σε ποσοστό 78,99%, το 25Mg σε ποσοστό 10% και το 24Mg σε ποσοστό 11,01%. Το ισότοπο 28Mg είναι ραδιενεργό και εντός των χρόνων 1950 και 1970 χρησιμοποιούνταν σε μερικά πυρηνικά εργοστάσια για κάποια επιστημονικά πειράματα. Αυτό το ισότοπο έχει σχετικά μικρή διάρκεια ημιζωής (21 ώρες).
Το 26Mg χρησιμοποιείται επίσης στην ισοτοπική γεωλογία με παρόμοιο τρόπο με αυτό το αργιλίου (αλουμινίου). Το 26Mg παράγεται με ραδιενεργό διάσπαση από το 26Al, το οποίο έχει διάρκεια ημιζωής 717.000 χρόνια.
Παραγωγή
Ορυκτά
Παρόλο που το μαγνήσιο βρέθηκε σε πάνω από 60 ορυκτά, μόνο ο δολομίτης. ο μαγνησίτης, ο βρουσίτης, ο καρναλλίτης, ο τάλκης και ο ολιβίνης έχουν εμπορική σημασία.
Θαλασσινό νερό
Το κατιόν του μαγνησίου (Mg2+) είναι το δεύτερο (2ο) σε αφθονία κατιόν στο θαλασσινό νερό (περίπου το 12% της μάζας του νατρίου). Αυτό κάνει το θαλασσινό νερό μια ελκυστική εμπορικά πηγή παραγωγής μαγνησίου. Για την εξαγωγή του μαγνησίου από το θαλασσινό νερό ακολουθείται η ακόλουθη διαδικασία:
1. Προστίθεται στο θαλασσινό νερό υδροξείδιο του ασβεστίου [Ca(OH)2], για να καταβυθιστεί το δυσδιάλυτο υδροξείδιο του μαγνησίου [Mg(OH)2]:
{\displaystyle \mathrm {MgCl_{2}+Ca(OH)_{2}{\xrightarrow {}}CaCl_{2}+Mg(OH)_{2}\downarrow } }
2. Το ίζημα του Mg(OH)2 διηθείται και κατεργάζεται με υδροχλωρικό οξύ (HCl), οπότε λαμβάνεται πυκνό διάλυμα χλωριούχου μαγνησίου (MgCl2):
{\displaystyle \mathrm {Mg(OH)_{2}+2HCl{\xrightarrow {}}MgCl_{2}+2H_{2}O} }
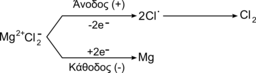
3. Το μεταλλικό μαγνήσιο (Mg) λαμβάνεται με ηλεκτρόλυση τήγματος MgCl2:
Στις ΗΠΑ
Οι ΗΠΑ ήταν παραδοσιακά ο μεγαλύτερος παραγωγός μαγνησίου παγκοσμίως, παρέχοντας το 45% της παγκόσμιας παραγωγής το 1995. Σήμερα πια το μερίδιό τους στην παγκόσμια αγορά μειώθηκε στο 7%, με μία μόνο εταιρεία παραγωγής που καλύπτει την εγχώρια ζήτηση του προϊόντος[8].
Στην Κίνα
Από το 2005 η Κίνα πήρε τη θέση του μεγαλύτερου παγκοσμίου προμηθευτή μαγνησίου, καλύπτοντας το 60% της παγκόσμιας παραγωγής, ενώ το 1995 κάλυπτε μόλις το 4%. Στην Κίνα προτιμάνε σχεδόν απόλυτα μια διαφορετική μέθοδο παραγωγής μετάλλου από τα ορυκτά της ηλεκτρόλυσης, την πυριτιοθερμική μέθοδο Pidgeon, δηλαδή την αναγωγή του οξειδίου του μαγνησίου (MgO) από πυρίτιο (Si) σε υψηλή θερμοκρασία:
{\displaystyle \mathrm {2MgO+Si{\xrightarrow {\triangle }}2Mg+SiO_{2}} }
Αξιοσημείωτα χαρακτηριστικά
Το στοιχειακό μαγνήσιο είναι ένα αρκετά ανθεκτικό και ελαφρύ αργυρόλευκο μέταλλο, με δύο τρίτα (2/3) της πυκνότητας του αλουμινίου. Όταν έρχεται σε επαφή με τον αέρα αντιδρά με αυτόν, παρόλο που, σε αντίθεση με τα μέταλλα των αλκαλίων, δεν είναι απαραίτητο να φυλάσσεται σε περιβάλλον χωρίς οξυγόνο, γιατί δημιουργεί ένα προστατευτικό στρώμα οξειδίου του μαγνησίου, το οποίο είναι αρκετά αδιάβροχο και δύσκολο να αφαιρεθεί. Το μαγνήσιο, όπως και το ασβέστιο που βρίσκεται από κάτω του, στην ίδια ομάδα στον περιοδικό πίνακα (2 ή ΙΙΑ), αντιδρά με το νερό σε θερμοκρασία δωματίου, αλλά αντιδρά πολύ πιο αργά από το ασβέστιο. Όταν βυθίζεται στο νερό, φυσαλίδες αέριου υδρογόνου (Η2) εμφανίζονται σχεδόν απαρατήρητα στην επιφάνεια του μαγνησίου. Η αντίδραση πραγματοποιείται ταχύτερα σε υψηλότερη θερμοκρασία. Το μαγνήσιο επίσης αντιδρά εξωθερμικά με τα περισσότερα οξέα, όπως το υδροχλωρικό οξύ (HCl). Όπως και με το αργίλιο, τον ψευδάργυρο και με τα άλλα μέταλλα που είναι ηλεκτροθετικότερα, η αντίδραση με υδροχλωρικό οξύ παράγει ένα άλας που στο θετικό μέρος του έχει το μέταλλο αυτό και στο αρνητικό του το χλώριο (Cl-) και απελευθερώνεται αέριο υδρογόνο:
{\displaystyle \mathrm {Mg+2HCl{\xrightarrow {}}MgCl_{2}+H_{2}\uparrow } }
Τα μέταλλα που μπορούν να πραγματοποιήσουν αυτή την αντίδραση πρέπει να είναι πιο δραστικά από το υδρογόνο (Η2) (βλ.: Σειρά δραστικότητας των μετάλλων). Το μαγνήσιο είναι ένα πολύ εύφλεκτο μέταλλο, όταν είναι σε σκόνη ή μικρά κομμάτια, αλλά αναφλέγεται δύσκολα όταν βρίσκεται σε μεγάλη ποσότητα. Αφού αναφλεχθεί είναι δύσκολο να σβήσει και είναι ικανό να αναφλεχθεί και σε περιβάλλον με άζωτο (N2) [για να σχηματίσει αζίδιο του μαγνησίου (Mg3N2)] και σε περιβάλλον με διοξείδιο του άνθρακα (CO2) [για να σχηματίσει οξείδιο του μαγνησίου (MgO) και άνθρακα (C)]. Αυτή του η ιδιότητα χρησιμοποιήθηκε για την κατασκευή φλογοβόλων και εμπρηστικών βομβών για πόλεις κατά το Δεύτερο Παγκόσμιο Πόλεμο, αφού το μόνο πρακτικό αντίμετρο είναι η κάλυψη της φλεγόμενης επιφάνειας με ξηρή άμμο, για να εμποδιστεί η παραπέρα επαφή με την ατμόσφαιρα. Κατά την καύση του σε επαφή με τον αέρα παράγει ένα εκτυφλωτικό λευκό φως και γι’ αυτό η σκόνη μαγνησίου χρησιμοποιούνταν στα φλας κατά τον πρώτο καιρό της ύπαρξης των φωτογραφιών. Σήμερα η σκόνη μαγνησίου χρησιμοποιείται στα πυροτεχνήματα και στις φωτοβολίδες των πλοίων, οι οποίες χρησιμοποιούνται σε περίπτωση ανάγκης και απαιτούν την ύπαρξη δυνατού λευκού φωτός. Η θερμοκρασία ανάφλεξης του μαγνησίου και των κραμάτων του δεν μπορεί να ξεπεράσει τους 1.371 oC και το ύψος της φλόγας πάνω από το μέταλλο δεν μπορεί να ξεπεράσει τα 300 mm[9]. Το μαγνήσιο μπορεί να χρησιμοποιηθεί σαν προσάναμμα (καύσιμη ύλη για ανάφλεξη) για το θερμίτη, δηλαδή ένα διαφορετικά δύσκολα αναφλέξιμο μείγμα σκόνης αλουμινίου (Al) και οξείδιο του σιδήρου (FeO).
Οι (ανόργανες) ενώσεις του μαγνησίου είναι τυπικά λευκοί κρύσταλλοι. Οι περισσότερες μπορούν να διαλυθούν στο νερό αποδίδοντας το κατιόν μαγνησίου (Mg2+) με την ξινή δυσάρεστη του γεύση. Μικρά ποσά διαλυμένων ιόντων μαγνησίου συνεισφέρουν στην οξύτητα και τη γεύση των φυσικών υδάτων. Ιόντα μαγνησίου σε μεγάλες ποσότητες χρησιμεύουν ως ήπια καθαρτικά και το θειώδες μαγνήσιο (MgSO3) χρησιμοποιείται συνήθως γι’ αυτό το σκοπό. Το γνωστό «γάλα της μαγνησίας» είναι μία από τις πιο δυσδιάλυτες ουσίες του μαγνησίου, το υδροξείδιο του μαγνησίου [Mg(OH)2]. Το «γάλα της μαγνησίας» είναι μια αραιά βάση και χρησιμοποιείται συνήθως ως αντιόξινο.
Εφαρμογές
Κράματα μαγνησίου
Κυριότερα κράματα του μαγνησίου είναι τα:
- Έλεκτρον ή Ήλεκτρον
- Υδρονάλιο
- Κασσιτερομαγνήσιο
- Κορκμέταλ
- Μαγνάλιο
- Νικελομαγνήσιο
- Σιδηρομαγνήσιο
- Χαλκομαγνήσιο
- Ψευδαργυρομαγνήσιο κ.ά.
Ενώσεις μαγνησίου
Σημαντικότερες ενώσεις του μαγνησίου είναι:
- Οξείδιο του μαγνησίου ή Μαγνησία
- Υπεροξείδιο του Μαγνησίου
- Ανθρακικό μαγνήσιο ως ουδέτερο και ως βασικό.
- Βρωμιούχο μαγνήσιο
- χλωριούχο μαγνήσιο
καθώς και διάφορες οργανομαγνησιακές ενώσεις
Κατασκευαστικές εφαρμογές ως ελεύθερο μέταλλο και σε κράματα
Κύλινδρος Μαγνησίου
(στο φόντο χάλκινο νόμισμα για σύγκριση)
Παράγωγα του Μαγνησίου
Το μαγνήσιο είναι το τρίτο (3ο) συχνότερα χρησιμοποιούμενο κατασκευαστικό μέταλλο, ακολουθώντας το χάλυβα και το αλουμίνιο. Η κύρια χρήση του είναι να σχηματίζει κράματα με το αλουμίνιο, μια ευρεία χρήση των οποίων είναι η κατασκευή μεταλλικών κουτιών για αναψυκτικά και μπύρες. Ωστόσο και το καθαρό μαγνήσιο μπορεί να συγκριθεί με το αλουμίνιο, γιατί είναι ισχυρό και ελαφρύ. Γι' αυτό χρησιμοποιείται σε μεγάλο βαθμό σε κατασκευαστικές εφαρμογές, όπως ανταλλακτικά αυτοκινήτων και φορτηγών. Ειδικά οι υψηλές ποιότητας ζάντες κράματος μαγνησίου που ονομάζονται «mag wheels». Το 1957 το μοντέλο «Corvette SS», που σχεδιάστηκε για αγώνες ταχύτητας, είχε αμάξωμα από καθαρό μαγνήσιο. Ένα άλλο σπορ μοντέλο, το «Mercedes-Benz 300 SLR» είχε αμάξωμα από το κράμα μαγνησίου «Elektron». Αυτά τα μοντέλα είχαν επιτυχίες στους αγώνες «Le Mans» και «Mille Miglia», καθώς και σε άλλους αγώνες αυτοκινήτων του 1955, αν και ένα από αυτά είχε ένα από τα χειρότερα δυστυχήματα με ανθρώπινες απώλειες στον αγώνα του «Le Mans». Η «Porsche», στη διαρκή προσπάθειά της για ελάττωση του βάρους των αυτοκινήτων της, οδηγήθηκε στη χρήση φτερών από μαγνήσιο στο διάσημο μοντέλο της «Porsche 917/053» που νίκησε τον αγώνα «Le Mans» του 1971, όπου ακόμη κρατά το απόλυτο ρεκόρ απόστασης. Το «917/30 Can-Am» επίσης είχε φτερά από μαγνήσιο, βοηθώντας έτσι την εκμετάλλευση του φιλόδοξου κινητήρα 1100-1500 ίππων της «Volkswagen Group», που επίσης χρησιμοποιούσε πολλά ανταλλακτικά από μαγνήσιο, για πολλά έτη. Για μακρά περίοδο η «Porsche» χρησιμοποίησε κράμα μαγνησίου για τους κινητήρες της, εξαιτίας φυσικά του μειωμένου βάρους του. Επίσης υπήρξε ανανεωμένο ενδιαφέρον για κινητήρες από μαγνήσιο ή και κράματά του από την «BMW», από το 2006 στα μοντέλα της «325i» και «325i» Οι κινητήρες της «BMW» χρησιμοποίησαν κράμα μαγνησίου (συγκεκριμένα το «AJ62A») στα εσωτερικά τοιχώματα των κυλίνδρων τους, καθώς και στα χιτώνια ψύξης τους. Ο κινητήρας της «Corvette Z06» το 2006 είχε περίβλημα από το κράμα μαγνησίου «AE44» θεωρήθηκε μια υψηλής τεχνολογίας σχεδίαση. Όλα αυτά τα κράματα είναι πρόσφατες εξελίξεις υψηλής θερμοκρασίας και χαμηλής τριβής κραμάτων μαγνησίου. Η «Mitsubishi Motors» επίσης χρησιμοποιεί μαγνήσιο, μεταλλικό και σε κράματα, για τα χειριστήρια αλλαγής ταχυτήτων της. Η γενική στρατηγική γι' αυτά τα κράματα είναι να σχηματίζουν διαμετταλλικές επαφές στα όρια κόκκων, π.χ. προσθέτοντας και μεταλλικό ασβέστιο[10]. Νέες εξελίξεις ανάπτυξης κραμάτων μαγνησίου και μειωμένα κόστη αρχίζουν να γίνονται ολοένα πιο ανταγωνιστικά για το καθαρό αλουμίνιο σε όλο και περισσότερες εφαρμογές της αυτοκίνησης.
Η δεύτερη περιοχή εφαρμογών του μαγνησίου είναι οι ηλεκτρονικές συσκευές. Εξαιτίας της μικρής του πυκνότητας και των καλών μηχανικών και ηλεκτρικών ιδιοτήτων του, το μαγνήσιο χρησιμοποιείται ευρύτατα στην κατασκευή κινητών τηλεφώνων, φορητών υπολογιστών, φωτογραφικών μηχανών, καμερών και άλλων ηλεκτρονικών συσκευών.
Ιστορικά το μαγνήσιο ήταν ένα από τα κύρια μέταλλα κατασκευής αεροδιαστημικών σκαφών και σχετικών συστημάτων. Χρησιμοποιήθηκε από τη Γερμανία για την κατασκευή πολεμικών αεροσκαφών της από τον Πρώτο Παγκόσμιο Πόλεμο, αλλά ιδιαίτερα κατά το Δεύτερο Παγκόσμιο Πόλεμο. Κατοχύρωσαν ακόμη την ονομασία «Elektron» για το σημαντικό αυτό κράμα μαγνησίου. Εξαιτίας των πιθανών ζημιών από την ανάφλεξη εξαρτημάτων μαγνησίων σε περίπτωση πυρκαγιάς η εφαρμογή του μαγνησίου στην αεροδιαστημική βιομηχανία γενικά είχε αποκλειστεί από τα εξαρτήματα των κινητήρων της. Ωστόσο πλέον η χρήση κραμάτων μαγνησίου και στον αεροδιαστημικό τομέα αυξάνεται, εξαιτίας της σημασίας της οικονομίας καυσίμων εκεί και επομένως της μείωσης του βάρους κατασκευής. Η ανάπτυξη και η έρευνα κραμάτων μαγνησίου (π.χ του «Elektron 21») συνεχίζεται επιτυχημένα στους κινητήρες, στα εσωτερικά και στα ατρακτικά εξαρτήματα. Η Ευρωπαϊκή Ένωση χρηματοδοτεί τρία (3) σχετικά ερευνητικά εγχειρήματα για την αεροδιαστημική τεχνολογία, με προτεραιότητα το «Six Framework Program».
Χημικές εφαρμογές ως ελεύθερο μέταλλο
Μια ασυνήθιστη εφαρμογή του μαγνησίου ως πηγή φωτισμού, κατά τη διάρκεια σκι με σανίδα (τη νύχτα) το 1931.
«Αναπτήρας μαγνησίου» (στο αριστερό του χέρι): Χρησιμοποιείται με ένα μαχαίρι και τσακμακόπετρα για να δημιουργήσει σπινθήρες που θα αναφλέξουν τα ρινίσματα του μετάλλου.
Κατ' αρχήν το μαγνήσιο είναι αναφλέξιμο. Όταν καίγεται παράγει θερμοκρασία έως 3.100 °C[11]. Η θερμοκρασία αυτανάφλεξης ρινισμάτων του στον αέρα είναι ακριβώς 630 °C[12]. Όταν καίγεται παράγει έντονο λευκό φως και θερμότητα. Η υψηλή θερμοκρασία που παράγει όταν καίγεται κάνει το μαγνήσιο θαυμάσιο εργαλείο για το επείγον άναμμα φωτιάς στο ύπαιθρο αλλά και για διασκέδαση. Άλλες σχετικές εφαρμογές της ιδιότητας αυτής είναι το φλας στη φωτογραφία, φωτοβολίδες, πυροτεχνήματα και πίδακες φωτιάς για εφέ.
Άλλες χημικές εφαρμογές του μαγνησίου είναι οι ακόλουθες:
Για την απομάκρυνση θείου (S) από σίδηρο (Fe) και χάλυβα.
Για τον καθαρισμό του τιτανίου (Ti) κατά διεργασία Kroll.
Για φωτογραφικές πλάκες στην εκτυπωτική βιομηχανία.
Για την παραγωγή οργανομαγνησιακών ενώσεων που είναι χρήσιμες για τις συνθέσεις οργανικών ενώσεων.
Ως προσθετικό παράγοντα σε συμβατικά προωθητικά πυραύλων
Για την παραγωγή συνθετικό γραφίτη από χυτοσίδηρο.
Σαν αναγωγικό αντιδραστήριο κατά την παραγωγή ουρανίου (U) και άλλων μετάλλων από τα άλατά τους.
Ως ξηραντικό, αφού αντιδρά εύκολα με το νερό (H2O).
Ως γαλβανική άνοδος για την προστασία υπόγειων δεξαμενών, σωλήνων, υπόγειων κατασκευών και λέβητες.
Βιολογική σημασία
Εξαιτίας της μεγάλης αλληλεπίδρασης μεταξύ των ιόντων του φωσφόρου και του μαγνησίου, τα ιόντα μαγνησίου είναι απαραίτητα για τη δημιουργία των νουκλεϊκών οξέων και συνεπώς απαραίτητα σε όλα τα κύτταρα όλων των γνωστών ζωντανών οργανισμών στη γη. Πάνω από 300 ένζυμα απαιτούν την παρουσία ιόντων μαγνησίου για την καταλυτική δράση τους.
Τα φυτά έχουν ακόμα ένα τρόπο με τον οποίο χρησιμοποιούν το μαγνήσιο. Υπάρχει στη χλωροφύλλη και η ανεπάρκειά του μπορεί να προκαλέσει καθυστερημένη πτώση των κίτρινων φύλλων.
Το μαγνήσιο είναι πολύ σημαντικό στοιχείο της ανθρώπινης διατροφής. Το σώμα ενός ενήλικα περιέχει περίπου 24 γραμμάρια μαγνησίου, με το 60% στο σκελετό, το 39% εντός των κυττάρων (20% στους σκελετικούς μύες) και το υπόλοιπο 1% εκτός των κυττάρων. Στο ανθρώπινο σώμα επίσης φαίνεται το μαγνήσιο να διευκολύνει την απορρόφηση του ασβεστίου. Υψηλή ή χαμηλή κατανάλωση πρωτεϊνών μπορούν να εμποδίσουν την απορρόφηση του μαγνησίου και άλλα διατροφικά στοιχεία, όπως ο φώσφορος και τα λίπη, την επηρεάζουν.
Πηγές μαγνησίου είναι οι ξηροί καρποί, τα δημητριακά, ο καφές, το κακάο, το τσάι, τα μπαχαρικά και τα λαχανικά (ειδικά αυτά που έχουν πράσινα φύλλα). Τα τελευταία χρόνια έχει παρατηρηθεί μείωση του μαγνησίου στους ανθρώπους με μοντέρνες διατροφικές συνήθειες, καθώς ο καθαρισμός της τροφής και τα λιπάσματα μειώνουν ή “εξαφανίζουν” το υπαρκτό μαγνήσιο.
Υπάρχουν πολλά συμπληρώματα μαγνησίου. Το οξείδιο του μαγνησίου (MgO), είναι ένα από τα πιο κατάλληλα, καθώς περιέχει μεγάλη ποσότητα μαγνησίου ανά μονάδα βάρους, αλλά είναι αυτό που υπάρχει στη μικρότερη ποσότητα στη φύση. Το όξινο κιτρικό μαγνήσιο (C6H6 O7Mg) έχει αναφερθεί ότι υπάρχει σε μεγαλύτερη ποσότητα στη φύση.
Δείτε επίσης
Αλκαλικές γαίες
Παραπομπές και σημειώσεις
Abundance and form of the most abundant elements in Earth’s continental crust. http://www.gly.uga.edu/railsback/Fundamentals/ElementalAbundanceTableP.pdf. Retrieved 2008-02-15.
Housecroft, Catherine E; Sharpe, Alan G. (2007). "Group 2 metals". Inorganic Chemistry (3 ed.). Harlow, England: Pearson. ISBN 978-0-13-175553-6.
Ash, Russell (2005). The Top 10 of Everything 2006: The Ultimate Book of Lists. Dk Pub. ISBN 0-7566-1321-3. http://plymouthlibrary.org/faqelements.htm Αρχειοθετήθηκε 2010-02-10 στο Wayback Machine...
http://www.seafriends.org.nz/oceano/seawater.htm#composition. Retrieved Jan. 20, 2009.
«Dietary Supplement Fact Sheet: Magnesium». Office of Dietary Supplements, US National Institutes of Health. 11 Φεβρουαρίου 2016. Ανακτήθηκε στις 13 Οκτωβρίου 2016.
"Magnesium in health". http://www.mg12.info Αρχειοθετήθηκε 2018-12-24 στο Wayback Machine..
(PDF) Abundance and form of the most abundant elements in Earth’s continental crust. http://www.gly.uga.edu/railsback/Fundamentals/ElementalAbundanceTableP.pdf. Retrieved 2008-02-15.
Vardi, Nathan (February 22, 2007). "Man With Many Enemies". Forbes.com. https://archive.is/20120730131736/http://www.forbes.com/forbes/2002/0722/044_print.html. Retrieved 2006-06-26.
DOE Handbook - Primer on Spontaneous Heating and Pyrophoricity. U.S. Department of Energy. December 1994. p. 20. DOE-HDBK-1081-94. http://www.hss.doe.gov/nuclearsafety/ns/techstds/standard/hdbk1081/hbk1081c.html Αρχειοθετήθηκε 2009-12-22 στο Wayback Machine..
Alan A. Luo and Bob R. Powell (2001) (PDF). Tensile and Compressive Creep of Magnesium-Aluminum-Calcium Based Alloys. Materials & Processes Laboratory, General Motors Research & Development Center. http://doc.tms.org/ezmerchant/prodtms.nsf/productlookupitemid/01-481x-137/%24FILE/01-481X-137F.pdf. Retrieved 2007-08-21.
Edward L. Dreizin, Charles H. Berman and Edward P. Vicenzi. "Condensed-phase modifications in magnesium particle combustion in air". Scripta Materialia 122. doi:10.1016/S0010-2180(00)00101-2.
N. V. Ravi Kumar, J. J. Blandin M. Suérya and E. Grosjean. Effect of alloying elements on the ignition resistance of magnesium alloys. doi:10.1016/S1359-6462(03)00263-X.
| Περιοδικός πίνακας | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|||||||||||||||||||||||||||||||||||||||||
Hellenica World - Scientific Library
Από τη ελληνική Βικιπαίδεια http://el.wikipedia.org . Όλα τα κείμενα είναι διαθέσιμα υπό την GNU Free Documentation License



