Αζιμουθιακός κβαντικός αριθμός
αγγλικά : Azimuthal quantum number
γαλλικά : Nombre quantique secondaire
γερμανικά : Nebenquantenzahl , Bahnquantenzahl , Drehimpulsquantenzahl
Ο Αζιμουθιακός κβαντικός αριθμός (ή κβαντικός αριθμός της τροχιακής στροφορμής) συμβολίζεται με l και είναι ένας κβαντικός αριθμός για μια ατομική τροχιά, ο οποίος προσδιορίζει την τροχιακή στροφορμή. Ο αζιμουθιακός κβαντικός αριθμός είναι ο δεύτερος από ένα σύνολο κβαντικών αριθμών που περιγράφουν την κβαντική κατάσταση ενός ηλεκτρονίου.
Περιγραφή
Υπάρχει ένα σύνολο κβαντικών αριθμών που σχετίζεται με τις ενεργειακές καταστάσεις των ατόμων. Οι τέσσερις κβαντικοί αριθμοί n, l, m, και s περιγράφουν την πλήρη και μοναδική κβαντική κατάσταση ενός ηλεκτρονίου σε ένα άτομο. Η κυματοσυνάρτηση της εξίσωσης Σρέντιγκερ μπορεί να χωριστεί σε τρεις εξισώσεις, οι οποίες όταν λυθούν οδηγούν στους τρεις πρώτους κβαντικούς αριθμούς. Κατά συνέπεια, οι εξισώσεις για τους τρεις πρώτους κβαντικούς αριθμούς συσχετίζονται μεταξύ τους. Ο αζιμουθιακός κβαντικός αριθμός προκύπτει ως λύση του πολικού μέρους της κυματοσυνάρτησης.
Η στροφορμή, L, ενός ηλεκτρονίου σε ένα άτομο που σχετίζεται με τον κβαντικό της αριθμό {\displaystyle \mathbf {} l} περιγράφεται μέσω της εξίσωσης:
{\displaystyle \mathbf {L^{2}{\boldsymbol {\psi }}} =\hbar ^{2}{l(l+1)}{\boldsymbol {\psi }}}
όπου {\displaystyle \hbar =h/2\pi } είναι η σταθερά του Πλανκ, {\displaystyle \mathbf {L^{2}} } είναι ο τελεστής της τροχιακής στροφορμής και {\displaystyle {\boldsymbol {\psi }}} είναι η κυματοσυνάρτηση του ατόμου.
Η ενέργεια ενός κύματος είναι η ταχύτητα πολλαπλασιασμένη με τη σταθερά του Πλανκ. Αυτό έχει ως συνέπεια την εμφάνιση πακέτων ενέργειας με μορφή σωματιδίων, που ονομάζονται κβάντα. Για να δείξουμε κάθε έναν από τους κβαντικούς αριθμούς σε μια κβαντική κατάσταση, η φόρμουλα για κάθε κβαντικό αριθμό περιλαμβάνει τη σταθερά του Πλανκ {\displaystyle \hbar =h/2\pi } , η οποία επιτρέπει μόνο συγκεκριμένα διακριτά ενεργειακά επίπεδα.
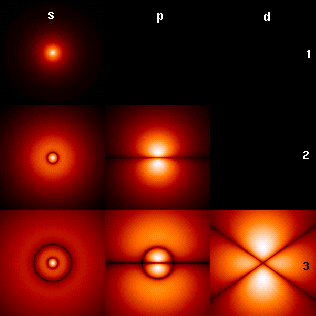
Οι κυματοσυναρτήσεις των πρώτων ατομικών τροχιακών ενός ατόμου του υδρογόνου. Ο κύριος κβαντικός αριθμός βρίσκεται στα δεξιά της κάθε σειράς (1, 2, 3) και ο αζιμουθιακός συμβολίζεται με γράμματα στην αρχή κάθε στήλης.
Οι ηλεκτρονικοί φλοιοί έχουν ιδιαίτερα σχήματα, που περιγράφονται με γράμματα. Στην εικόνα δεξιά, τα γράμματα s, p, και d περιγράφουν το σχήμα της ατομικής τροχιάς.
Οι κυματοσυναρτήσεις τους παίρνουν τη μορφή των σφαιρικών αρμονικών, και περιγράφονται από τα πολυώνμα Legendre. Τα διάφορα τροχιακά που αντιστοιχούν σε διαφορετικές τιμές του l συχνά καλούνται υποφλοιοί, και (κυρίως για ιστορικούς λόγους) αναφερόμαστε σε αυτά με γράμματα:
| l | Γράμμα | Μέγιστος αριθμός ηλεκτρονίων | Σχήμα | Όνομα |
|---|---|---|---|---|
| 0 | s | 2 | σφαίρα | sharp |
| 1 | p | 6 | δύο λοβοί | principal |
| 2 | d | 10 | τέσσερις λοβοί | diffuse |
| 3 | f | 14 | οκτώ λοβοί | fundamental |
| 4 | g | 18 | ||
| 5 | h | 22 | ||
| 6 | i | 26 |
Κάθε μία κατάσταση διαφορετικής στροφορμής μπορεί να πάρει μέχρι 2(2l+1) ηλεκτρόνια. Αυτό οφείλεται στο γεγονός ότι ο τρίτος κβαντικός αριθμός παίρνει ακέραιες τιμές από −l μέχρι l, οπότε υπάρχουν 2l+1 πιθανές καταστάσεις. Κάθε ξεχωριστό nlml τροχιακό μπορεί να καταληφθεί από δύο ηλεκτρόνια με αντίθετα σπιν (που δίνονται από τον κβαντικό αριθμό του σπιν ms), δίνοντας συνολικά 2(2l+1) ηλεκτρόνια. Αν και τροχιακά με υψηλότερο l από αυτό που δίνεται στον πίνακα είναι απόλυτα επιτρεπτές, οι παραπάνω τιμές καλύπτουν όλα τα άτομα που έχουν ανακαλυφθεί ως τώρα.
Για δοσμένη τιμή του κύριου κβαντικού αριθμού, n, οι πιθανές τιμές του l είναι από 0 μέχρι n−1. Κατά συνέπεια, ο φλοιός με n=1 περιέχει μονάχα έναν υποφλοιό και μπορεί να πάρει μόνο μέχρι 2 ηλεκτρόνια, ο φλοιός με n=2 περιέχει έναν s και έναν p υποφλοιό και μπορεί να πάρει μέχρι 8 ηλεκτρόνια συνολικά, ο n=3 φλοιός περιέχει s, p and d υποφλοιούς και μπορεί να πάρει μέχρι 18 ηλεκτρόνια, και ούτω καθ' εξής. Γενικά, ο μέγιστος αριθμός ηλεκτρονίων στο n-ιοστό ενεργειακό επίπεδο είναι 2n2).
Ανάλογα με την τιμή του n, του κύριου κβαντικού αριθμού, υπάρχει ένας κβαντικός αριθμός της στροφορμής l και οι ακόλουθες σειρές:
n = 1, l = 0, σειρές Λίμαν (υπεριώδες)
n = 2, l = ħ, σειρές Μπάλμερ (ορατό) Το μήκος κύματος παίρνει τιμές από 400 μέχρι 700 nm.
n = 3, l = 2ħ, σειρές Πάσεν (υπέρυθρο)
n = 4, l = 3ħ, σειρές Πφουντ (υπέρυθρο)
Σύνθεση στροφορμών
Δοσμένης της ολικής στροφορμής {\displaystyle {\overrightarrow {j}}} η οποία είναι το άθροισμα των επιμέρους στροφορμών {\displaystyle {\overrightarrow {l_{1}}}} και {\displaystyle {\overrightarrow {l_{2}}}} ,
{\displaystyle {\overrightarrow {j}}={\overrightarrow {l_{1}}}+{\overrightarrow {l_{2}}}}
ο κβαντικός αριθμός {\displaystyle j} σχετίζεται με το μέτρο της και μπορεί να πάρει τιμές από {\displaystyle |l_{1}-l_{2}|} μέχρι {\displaystyle l_{1}+l_{2}} σε ακέραια βήματα, όπου {\displaystyle l_{1}} και {\displaystyle l_{2}} είναι οι κβαντικοί αριθμοί που αντιστοιχούν στα μέτρα των επιμέρους στροφορμών.
Ολική στροφορμή ενός ηλεκτρονίου σε άτομο
Εξ' αιτίας των αλληλεπιδράσεων σπιν-τροχιάς στα άτομα, η τροχιακή στροφορμή δε μετατίθεται πλέον με τη Χαμιλτονιανή, και το ίδιο συμβαίνει και για το σπιν. Παρ' όλα αυτά, η ολική στροφορμή J μετατίθεται με τη Χαμιλτονιανή, οπότε είναι σταθερή. Η J ορίζεται μέσω της σχέσης
{\displaystyle {\overrightarrow {J}}={\overrightarrow {L}}+{\overrightarrow {S}}}
όπου L είναι η τροχιακή στροφορμή και S το σπιν. Η ολική στροφορμή ικανοποιεί τις ίδιες σχέσεις μετάθεσης, που ικανοποιεί η απλή στροφορμή, δηλαδή τις
{\displaystyle [J_{i},J_{j}]=i\hbar \epsilon _{ijk}J_{k}}
από την οποία συνεπάγεται ότι
{\displaystyle \left[J_{i},J^{2}\right]=0}
όπου {\displaystyle J_{i,j}} είναι για τα {\displaystyle J_{x}} , {\displaystyle J_{y}} και {\displaystyle J_{z}} .
Οι κβαντικοί αριθμοί που περιγράφουν το σύστημα, που διατηρούνται σταθεροί με την πάροδο του χρόνου, είναι τώρα οι j και {\displaystyle m_{j}} , που ορίζονυαι μέσω της δράσης της J πάνω στην κυματοσυνάρτηση \psi
{\displaystyle \mathbf {J^{2}{\boldsymbol {\psi }}} =\hbar ^{2}{j(j+1)}{\boldsymbol {\psi }}}
{\displaystyle \mathbf {J_{z}{\boldsymbol {\psi }}} =\hbar {m_{j}}{\boldsymbol {\psi }}}
Δηλαδή ο j σχετίζεται με το μέτρο της ολικής στροφορμής και ο {\displaystyle m_{j}} με την προβολή της σε συγκεκριμένο άξονα.
Σχέση μεταξύ παλιών και νέων κβαντικών αριθμών
Οι αριθμοί j και mj, μαζί με την αρτιότητα της κβαντικής κατάστασης, αντικαθιστούν τους τρεις κβαντικούς αριθμούς l, ml και ms, με τους οποίους και σχετίζονται. Πιο συγκεκριμένα, τα ιδιοδιανύσματα των j, mj και της αρτιότητας, τα οποία είναι επίσης ιδιοδιανύσματα της Χαμιλτονιανής, είναι γραμμικοί συνδυασμοί των ιδιοδιανυσμάτων των l, ml και ms.
Δείτε επίσης
Κβαντικός αριθμός
Κύριος κβαντικός αριθμός
Μαγνητικός κβαντικός αριθμός
Κβαντικός αριθμός του σπιν
Κβαντικός αριθμός της ολικής στροφορμής
Κβαντική μηχανική
Εξωτερικοί σύνδεσμοι
Ανάπτυξη του μοντέλου του Μπορ
NOTE ON "PENDULUM" ORBITS IN ATOMIC MODELS[νεκρός σύνδεσμος]
Εικόνες ατομικών τροχιακών
Εξήγηση της αζιμουθιακής εξίσωσης
Hellenica World - Scientific Library
Από τη ελληνική Βικιπαίδεια http://el.wikipedia.org και el.wiktionary.org/. Όλα τα κείμενα είναι διαθέσιμα υπό την GNU Free Documentation License