.
HANDBUCH DER
PHARMAKOGNOSIE
VON
A. TSCHIRCH
ZWEITER BAND
SPEZIELLE PHARMAKOGNOSIE

LEIPZIG 1912
VERLAG VON CHR. HERM. TAUCHNITZ
HANDBUCH DER
PHARMAKOGNOSIE
VON
A. TSCHIRCH
ERSTE ABTEILUNG
MIT 237 ABBILDUNGEN IM TEXT
UND AUF EINGEHEFTETEN TAFELN, SOWIE 3 KARTEN

LEIPZIG 1912
VERLAG VON CHR. HERM. TAUCHNITZ
Das Recht der Übersetzung in
fremde Sprachen ist vorbehalten
DIE VERLAGSHANDLUNG
[S. v]
Inhaltsübersicht
zur ersten Abteilung des zweiten Bandes.
|
Seite
|
|||||||||
|
Einleitung
|
|||||||||
|
I.
|
Kohlehydratdrogen (A bis D umfassen die Süßstoffdrogen)
|
||||||||
|
A.
|
|||||||||
|
a)
|
Drogen, die Hexosen als Monosaccharide enthalten
|
||||||||
|
Invertzuckerdrogen. Drogen, welche vorwiegend aus Invertzucker bestehen oder viel Invertzucker enthalten
|
|||||||||
|
α)
|
Mel
|
||||||||
|
β)
|
|||||||||
|
Flos Verbasci
|
|||||||||
|
Bassiablüten
|
|||||||||
|
γ)
|
|||||||||
|
Caricae
|
|||||||||
|
Dactyli
|
|||||||||
|
Passulae
|
|||||||||
|
δ)
|
Zu Roobs oder Pulpen verarbeitete Früchte
|
||||||||
|
Fruct. Juniperi
|
|||||||||
|
Fruct. Sambuci
|
|||||||||
|
Fruct. Pruni
|
|||||||||
|
Fruct. Jujubae
|
|||||||||
|
Sebesten
|
|||||||||
|
Fruct. Myrtilli
|
|||||||||
|
b)
|
Drogen, die Sorbit enthalten
|
||||||||
|
c)
|
Drogen, die Glukuronsäure enthalten
|
||||||||
|
Rad. Liquiritiae
|
|||||||||
|
Succus Liquiritiae
|
|||||||||
|
1)
|
Eschenmanna
|
||||||||
|
2)
|
Australisches Manna
|
||||||||
|
3)
|
Platanus-Manna
|
||||||||
|
4)
|
Manna von den Capverdischen Inseln
|
||||||||
|
5)
|
Harlálumanna
|
||||||||
|
6)
|
Olivenhonig
|
||||||||
|
Madagaskar-Manna
|
|||||||||
|
B.
|
Drogen, welche Disaccharide von Hexosen enthalten.
|
||||||||
|
I.
|
Rohrzucker aus Zuckerrohr
|
||||||||
|
II.
|
Rübenzucker
|
||||||||
|
III.
|
Ahornzucker
|
||||||||
|
IV.
|
Palmzucker
|
||||||||
| [S. vi] |
V.
|
Sorghumzucker
|
|||||||
|
VI.
|
Andere Rohrzucker liefernde Materialien
|
||||||||
|
a)
|
Alhagi-Manna oder Terendschabin
|
||||||||
|
b)
|
Tabaschir
|
||||||||
|
c)
|
Californisches Manna
|
||||||||
|
d)
|
Blue Grass Manna
|
||||||||
|
e)
|
Weidenmanna oder Bide Khecht
|
||||||||
|
f)
|
Eichenmanna oder Gueze-elefi
|
||||||||
|
g)
|
Schîr-Khist
|
||||||||
|
h)
|
Tamarixmanna
|
||||||||
|
Fructus Ceratoniae
|
|||||||||
|
Trehalamanna
|
|||||||||
|
Milchzucker
|
|||||||||
|
C.
|
Drogen, welche Trisaccharide enthalten.
|
||||||||
|
a)
|
Eucalyptus-Manna
|
||||||||
|
b)
|
Lärchen-Manna
|
||||||||
|
D.
|
Drogen, welche Tetrasaccharide enthalten.
|
||||||||
|
Polysacchariddrogen (keine Süßstoffdrogen, I-VII Inhaltsbestandteile, VIII Membranine).
|
|||||||||
|
α)
|
Zellinhaltsbestandteile.
|
||||||||
|
a)
|
Amylum solani
|
||||||||
|
b)
|
Arrowroots
|
||||||||
|
1.
|
Westindisches Arrowroot
|
||||||||
|
2.
|
Maniok
|
||||||||
|
3.
|
Ostindisches Arrowroot
|
||||||||
|
4.
|
Queensland Arrowroot
|
||||||||
|
5.
|
Tahiti Arrowroot
|
||||||||
|
6.
|
Guyana Arrowroot (und Bananenstärke)
|
||||||||
|
7.
|
Batatenstärke
|
||||||||
|
8.
|
Arumstärke
|
||||||||
|
9.
|
Costarica Arrowroot
|
||||||||
|
10.
|
Japanisches Arrowroot
|
||||||||
|
1.
|
Sago
|
||||||||
|
2.
|
Andere Palmen- (und Cycadeen-)Stärke
|
||||||||
|
1.
|
Amylum Tritici
|
||||||||
|
2.
|
Amylum Oryzae
|
||||||||
|
3.
|
Amylum Maidis
|
||||||||
|
4.
|
Fructus Hordei
|
||||||||
|
Leguminosenstärke
|
|||||||||
|
II.
|
Amylodextringruppe.
|
||||||||
|
Macis
|
|||||||||
|
Dextrin
|
|||||||||
|
IV.
|
Inulindrogen.
|
||||||||
|
Kompositenwurzeln
|
|||||||||
|
Rad. Cichorei (Cichorienkaffee)
|
|||||||||
| [S. vii] |
Rad. Taraxaci
|
||||||||
|
Rad. Bardanae
|
|||||||||
|
V.
|
Lävulindrogen.
|
||||||||
|
VI.
|
Triticindrogen.
|
||||||||
|
Rhiz. Graminis
|
|||||||||
|
VII.
|
Scillin-(Sinistrin-)Drogen.
|
||||||||
|
β)
|
Membraninbildende Substanzen.
|
||||||||
|
VIII.
|
Polysaccharide vom Charakter der Membranine. Membranin-Drogen.
|
||||||||
|
A.
|
Zellulosindrogen
|
||||||||
|
1.
|
Celluloso-Membranin-Drogen
|
||||||||
|
Gossypium
|
|||||||||
|
Pili haemostatici
|
|||||||||
|
Die Fasern
|
|||||||||
|
Von Haaren gebildet: Baumwolle, Pflanzendunen, Pflanzenseiden, Einheimische Wollhaare
|
|||||||||
|
Pflanzliche Bastfasern:
|
|||||||||
|
Lein, Hanf, Sunn, Nessel, Chinagras, Jute, Gambohanf, Neuseeländ. Flachs, Manilahanf, Pitafaser, Aloëhanf, Coir
|
|||||||||
|
Papier
|
|||||||||
|
2.
|
Reservezelluloso-Membranin-Drogen (Hemizellulosedrogen)
|
||||||||
|
Steinnuß
|
|||||||||
|
3.
|
Lichenino-Membranin-Drogen (inkl. Amyloidmembranine)
|
||||||||
|
Pergamentpapier
|
|||||||||
|
Lichen islandicus
|
|||||||||
|
Lerp-Manna
|
|||||||||
|
4.
|
Lignino-Membranin-Drogen
|
||||||||
|
Lignum Juniperi
|
|||||||||
|
Holzstoff, Holzwolle, Waldwolle
|
|||||||||
|
5.
|
Pectino-Membranin-Drogen
|
||||||||
|
Fruchtgelees
|
|||||||||
|
6.
|
Koryzo-Membranin-Drogen
|
||||||||
|
Cryptogame Schleimdrogen
|
|||||||||
|
Carrageen
|
|||||||||
|
Stipes Laminariae
|
|||||||||
|
Agar-Agar
|
|||||||||
|
I. Unbearbeitete Algen
|
|||||||||
|
Agar v. Ceylon, Makassar, Japan. Moos
|
|||||||||
|
II. Aus Algen dargestellte Gelatinen
|
|||||||||
|
Agar von Japan
|
|||||||||
|
2.
|
Schleim der sekundären Membran
|
||||||||
|
a)
|
Schleime in Samen
|
||||||||
|
1. Schleimepidermen
|
|||||||||
|
Sem. Lini
|
|||||||||
|
Sem. Cydoniae
|
|||||||||
|
Sem. Psyllii
|
|||||||||
|
2. Schleimendosperme
|
|||||||||
|
Sem. Fenugraeci
|
|||||||||
|
b)
|
Schleimzellen in der ganzen Pflanze verteilt
|
||||||||
|
Rad. Althaeae
|
|||||||||
|
Fol. Althaeae
|
|||||||||
|
Flos Althaeae
|
|||||||||
|
Folium et Flos Malvae
|
|||||||||
|
Flos Malvae arboreae
|
|||||||||
|
Flos Tiliae
|
|||||||||
| [S. viii] |
c)
|
Schleimzellen in Knollen
|
|||||||
|
Tuber Salep
|
|||||||||
|
d)
|
Schleimzellen in Rinden
|
||||||||
|
Cort. cinnamoni
|
|||||||||
|
Cort. ulmi
|
|||||||||
|
7.
|
Gummo-Membranin-Drogen
|
||||||||
|
Die Gummis
|
|||||||||
|
Traganth
|
|||||||||
|
Falsche Traganthe
|
|||||||||
|
Gummi arabicum
|
|||||||||
|
I. Acaciengummi
|
|||||||||
|
A. Afrikanisches Gummi
|
|||||||||
|
a) Nilgummi
|
|||||||||
|
Cordofan-, Sudangummi
|
|||||||||
|
Sennaargummi
|
|||||||||
|
Gedarefgummi
|
|||||||||
|
Ghezirehgummi
|
|||||||||
|
Talhgummi, Santa- oder Suntgummi, Kuk-Gummi, Kakamut, Kadab
|
|||||||||
|
Suakimgummi
|
|||||||||
|
Somaligummi
|
|||||||||
|
Massauagummi
|
|||||||||
|
Adengummi
|
|||||||||
|
Geddagummi, Berberisches Gummi
|
|||||||||
|
Litty, Sarki, Fachmi-Gummi
|
|||||||||
|
b) Senegalgummi
|
|||||||||
|
c) Maroccogummi
|
|||||||||
|
d) Tunis- und Tripolisgummi
|
|||||||||
|
e) Capgummi und Orange River-Gummi
|
|||||||||
|
Deutsch-Ostafrika, Deutsch-Südwestafrika, Angra Pequena, Deutsch Adamaua, Togo
|
|||||||||
|
g) Gummi von Angola
|
|||||||||
|
h) Gummi von Nord-Nigeria
|
|||||||||
|
i) Gummi von Réunion
|
|||||||||
|
B. Indisches Acaciengummi, Ghati
|
|||||||||
|
C. Australisches Acaciengummi
|
|||||||||
|
D. Amerikanisches Acaciengummi
|
|||||||||
|
A. Indische Gummis
|
|||||||||
|
B. Javanische Gummis
|
|||||||||
|
C. Australische Gummis
|
|||||||||
|
D. Amerikanische Gummis
|
|||||||||
|
Prunoideengummi
|
|||||||||
|
B.
|
Membranine, die keine Polysaccharide enthalten oder von denen es noch nicht sicher ist, ob sie solche enthalten.
|
||||||||
|
1.
|
Suberino-Membranin-Drogen
|
||||||||
|
Kork
|
|||||||||
|
2.
|
Pollenino-Membranin-Drogen
|
||||||||
|
Lycopodium
|
|||||||||
| [S. ix] |
3.
|
Mycino-Membranin-Drogen
|
|||||||
|
Fungus igniarius
|
|||||||||
|
4.
|
Silico-Membranin-Drogen
|
||||||||
|
Kieselgur
|
|||||||||
|
4.
|
Carbono-Membranin-Drogen
|
||||||||
|
Carbo ligni
|
|||||||||
|
Torfwatte, Torfmull
|
|||||||||
|
II.
|
Albuminoiddrogen
|
||||||||
|
1.
|
Gelatine
|
||||||||
|
2.
|
Os sepiae
|
||||||||
|
3.
|
Cornu cervi raspatum
|
||||||||
|
4.
|
Ichthyocolla
|
||||||||
|
5.
|
Catgut
|
||||||||
|
6.
|
Spongia
|
||||||||
|
Carbo Spongiae
|
|||||||||
|
Lapis Spongiarum
|
|||||||||
|
7.
|
Seide
|
||||||||
|
Seidensurrogate
|
|||||||||
|
8.
|
Schafwolle
|
||||||||
|
III.
|
Säuredrogen
|
||||||||
|
I.
|
Ameisensäuredrogen
|
||||||||
|
Formica
|
|||||||||
|
II.
|
Essigsäure-, Propionsäure-, Buttersäuredrogen
|
||||||||
|
III.
|
Baldriansäuredrogen
|
||||||||
|
Rhizoma Valerianae
|
|||||||||
|
IV.
|
Oxalsäure-, Bernsteinsäure-, Apfelsäure-Drogen
|
||||||||
|
Extract. ferri pomati
|
|||||||||
|
V.
|
Weinsäuredrogen
|
||||||||
|
Weinstein
|
|||||||||
|
Pulpa Tamarindi
|
|||||||||
|
VI.
|
Citronensäuredrogen
|
||||||||
|
Frische Citronen
|
|||||||||
|
Citronensaft
|
|||||||||
|
IV.
|
Fett- und Wachsdrogen
|
||||||||
|
1.
|
Trocknende Öle
|
||||||||
|
Semen Lini und Oleum Lini
|
|||||||||
|
Fructus Cannabis und Oleum Cannabis
|
|||||||||
|
Semen Papaveris und Oleum Papaveris
|
|||||||||
|
Andere trocknende Öle
|
|||||||||
|
2.
|
Halbtrocknende Öle
|
||||||||
|
Semen Gossypii und Oleum Gossypii
|
|||||||||
|
Semen Sesami und Oleum Sesami
|
|||||||||
|
Semen Tiglii und Oleum Crotonis
|
|||||||||
|
Andere Öle der Baumwollsamenölgruppe
|
|||||||||
|
Semen Rapae und Oleum Rapae
|
|||||||||
|
Andere Öle der Rübölgruppe
|
|||||||||
|
Fructus Arachidis und Oleum Arachidis
|
|||||||||
|
Semen Amygdalae dulcis und Oleum Amygdalae
|
|||||||||
|
Andere Pruneenöle
|
|||||||||
| [S. x] | |||||||||
|
Fructus Olivae und Oleum Olivae
|
|||||||||
|
Andere Öle der Olivenölgruppe
|
|||||||||
|
Semen Ricini und Oleum Ricini
|
|||||||||
|
Andere Öle der Ricinusölgruppe
|
|||||||||
|
1.
|
Öle von Seetieren
|
||||||||
|
a)
|
Fischöle
|
||||||||
|
b)
|
Leberöle
|
||||||||
|
Oleum Jecoris Morrhuae
|
|||||||||
|
c)
|
Trane
|
||||||||
|
2.
|
Öle von Landtieren
|
||||||||
|
1.
|
Myristinsäuregruppe
|
||||||||
|
Semen Myristicae, Macis und Oleum Myristicae
|
|||||||||
|
Andere nutzbare Myristicaarten
|
|||||||||
|
Andere fettliefernde Myristicaceen
|
|||||||||
|
2.
|
Laurinsäuregruppe
|
||||||||
|
Fructus Lauri und Oleum Lauri
|
|||||||||
|
Fructus Cocos und Oleum Cocos
|
|||||||||
|
Andere Vertreter der Gruppe
|
|||||||||
|
3.
|
Japansäure-Gruppe
|
||||||||
|
Cera Japonica
|
|||||||||
|
4.
|
Ölsäuregruppe
|
||||||||
|
Fructus Elaeïdis und Oleum Palmae
|
|||||||||
|
Oleum Cacao
|
|||||||||
|
Andere Vertreter der Gruppe
|
|||||||||
|
IV.
|
Animalische feste Fette
|
||||||||
|
1.
|
Körperfette
|
||||||||
|
Adeps suillus
|
|||||||||
|
Sevum ovile
|
|||||||||
|
Sevum bovinum
|
|||||||||
|
2.
|
Milchfette
|
||||||||
|
Butyrum
|
|||||||||
|
V.
|
Wachse
|
||||||||
|
1.
|
Pflanzenwachse
|
||||||||
|
Carnaubawachs
|
|||||||||
|
Andere Pflanzenwachse
|
|||||||||
|
3.
|
Animalische Wachse
|
||||||||
|
a)
|
Säugetierwachse
|
||||||||
|
α)
|
Walratgruppe
|
||||||||
|
Cetaceum
|
|||||||||
|
Ambra
|
|||||||||
|
β)
|
Cholesterinwachse. Wollfettgruppe
|
||||||||
|
Adeps Lanae
|
|||||||||
|
b)
|
Insektenwachse
|
||||||||
|
Cera flava (Bienenwachs)
|
|||||||||
|
Chinesisches Insektenwachs
|
|||||||||
|
Zusätze und Berichtigungen zu Band II. Erste Abteilung
|
|||||||||
[S. xi]
Verzeichnis der Tafeln und Karten
der ersten Abteilung des zweiten Bandes.
|
Seite
|
|||
|
Tafel
|
I.
|
Fabbrica liquirizia di Barone Senatore Compagna in Corigliano
|
|
|
„
|
II.
|
Interno di un solo frantoio (Fabbrica liquirizia di Barone Compagna. Dirett. Luigo Caruso)
|
|
|
„
|
III.
|
Lavorazione Biglie (Fabbrica liquirizia di Barone Compagna)
|
|
|
„
|
IV.
|
Zuckerrohr in Blüte (Java)
|
|
|
„
|
V.
|
Zuckerfabrik in Java (Zucker aus Zuckerrohr)
|
|
|
„
|
VI.
|
Ahornsaftgewinnung in America. Die Eimer am Baume befestigt während der Saison
|
|
|
„
|
VIa.
|
Agar-Agar (Kanten-) Fabrik in Suwa Gori (Japan)
|
|
|
„
|
VII.
|
Acacia Senegal Willd.
|
|
|
„
|
VIII.
|
Anschneiden des Baumes zur Gummigewinnung
|
|
|
„
|
IX.
|
Ausschwitzen des Gummis neben der angeschnittenen Stelle
|
|
|
„
|
X.
|
Zweimal geschälte Korkeiche aus dem Korkeichenwald Hafir bei Tlemcen (Algier)
|
|
|
„
|
XI.
|
Schwitzender Kohlenmeiler in Thüringen
|
|
|
„
|
XII.
|
Kultur von Englischem Baldrian in Long Melford Medicinal Herb Farms
|
|
|
„
|
XIII.
|
Tamarindus indica L. in Java
|
|
|
„
|
XIV.
|
Terrassierte Olivenpflanzung bei Albergo in Ligurien
|
|
|
„
|
XV.
|
Olivenernte, Racolta a mano, in Italien an einem ungewöhnlich grossen und reichtragenden Baume
|
|
|
„
|
XVI.
|
Ricinus communis L. in Italien mit reifen Früchten
|
|
|
„
|
XVII.
|
Die Flotille der Lofoten-Fischer begibt sich bei Morgengrauen auf den Dorschfang
|
|
|
„
|
XVIII.
|
Öffnen der Dorsche auf dem Schiff und Versorgen der Lebern in Fässern
|
|
|
„
|
XIX.
|
Myristica fragrans in Java. Frei stehender Baum in einem Zingiberaceengebüsch
|
|
|
„
|
XX.
|
Melanesische Arbeiter bei der Coprabereitung
|
|
|
„
|
XXI.
|
Copradarre der deutschen Handels- und Plantagen-Gesellschaft
|
|
|
„
|
XXII.
|
Elaeïs guineensis in Kultur auf Java
|
|
|
„
|
XXIII.
|
Palmölbereitung durch Eingeborene im Canoo
|
|
|
„
|
XXIV.
|
Männlicher Pottwal
|
|
|
Karten.
|
|||
|
Die Feigenkultur im Mittelmeerdrogenreich
|
|||
|
Die Verbreitung der Korkeichenwälder in der Westprovinz des Mittelmeerdrogenreiches
|
|||
|
Verbreitung der Olive im Mittelmeerdrogenreich
|
|||
Zweiter Teil.
Spezielle Pharmakognosie.
[S. 3]
Erste Abteilung.
Sic vos non vobis mellificatis apes.
Einleitung.
Bei der Besprechung der Aufgaben der Pharmakognosie habe ich (I. Teil, S. 6) als Ziel der Pharmakognosie als Wissenschaft neben der erschöpfenden allseitigen Behandlung der Einzeldroge die Zusammenfassung des Zusammengehörigen unter gemeinsamen Gesichtspunkten bezeichnet. Welches sind nun diese allgemeinen Gesichtspunkte? Sollen wir morphologische benutzen? Das hieße sich auf den Standpunkt der Signatura (I, S. 886) stellen. Alle Wurzeln, alle Blätter, alle Samen in Kapiteln zusammenfassen, würde bedeuten, daß wir die betreffenden Drogen benutzen, weil sie Wurzeln, Blätter, Samen sind. Aber die Zugehörigkeit zu einer morphologischen Gruppe ist für die arzneiliche Anwendung ganz gleichgültig. Und aus dem gleichen Grunde sind aus dem anatomischen Bau, der inneren oder feineren Morphologie Einteilungsprinzipien nicht abzuleiten. Eher könnten wir schon die Drogen nach Pflanzenfamilien zusammenfassen. Denn es hat sich ja herausgestellt, daß wir häufig die gleichen oder ähnliche Bestandteile in den Gliedern ein und derselben Pflanzenfamilie antreffen und daß CAESALPINI Recht hat, wenn er sagt: «Plantae quae generis societate junguntur, plerumque et similes possident facultates». Denn auf die Bestandteile kommt es an, die facultates, virtutes et vires. Aber auch hier treffen wir vielfach auf Unstimmigkeiten, vereinigen nicht zu Vereinigendes und trennen Zusammengehöriges. Zudem ist die pharmakognostische Ähnlichkeit der Arten einer Gattung und der Gattungen einer Familie nur selten so groß, daß die botanische Verwandtschaft mit der pharmakologischen und chemischen zusammenfällt.
So bleibt denn schließlich nur das chemische System übrig (vgl. I, S. 228). Wegen ihrer Bestandteile verwenden wir die Drogen. Ob eine Droge zu den Rubiaceen, den Zingiberaceen oder Lauraceen gehört, ist pharmakologisch ebenso gleichgültig, wie ob sie eine Wurzel, ein Blatt oder eine Blüte ist oder ob sie ein oder zwei Reihen Palisaden hat oder ob sie aus China bzw. Japan kommt. Für die Benutzung in der Medizin kommt nur in Betracht, was die Droge als wirksamen Bestandteil enthält. Läge nun der Fall so, daß jede Droge nur einen wirksamen[S. 4] Bestandteil oder nur eine Gruppe ähnlicher Bestandteile als wirksame enthielte, und wäre uns dieser Bestandteil für jede einzelne Droge bekannt, so läge die Sache sehr einfach. Dann wäre die Gruppierung der Drogen nach ihren Bestandteilen die einfachste Aufgabe der Welt. Aber, wie schon oben (I, S. 394) erwähnt, ist die Wirkung der Droge meist eine Mischwirkung und das Resultat mehrerer verschiedener Bestandteile. Wir werden also in einigen Fällen dieselbe Droge an verschiedenen Stellen des Systems unterbringen müssen. Dazu kommt, daß wir nur von einer kleinen Anzahl von Drogen die Bestandteile kennen oder angeben können, welches die wirksamen sind. Die Schwierigkeiten, welche sich der Gruppierung der Drogen nach chemischen Gesichtspunkten entgegenstellen, sind also beträchtliche. Aber sie müssen überwunden werden. Denn alle anderen Systeme sind nicht im Wesen der Sache begründet. Den Kern trifft nur das chemische System, kein anderes.
Ich werde also die Drogen nach chemischen Gesichtspunkten ordnen und gruppieren, also nur solche aufnehmen, die chemisch einigermaßen untersucht sind. Gar nicht oder nicht genügend chemisch untersuchte Drogen haben noch kein Anrecht auf Aufnahme in eine wissenschaftliche Drogenkunde. Sie gehören vorläufig nur in die Drogeninventare und Enzyklopädien.
Ich bin mir sehr wohl bewußt, daß bei der von mir gewählten Darstellung zunächst etwas nicht ganz Vollkommenes herauskommen wird, wie ja auch die ersten Systeme, deren sich die Chemiker in ihren Handbüchern bedienten, unvollkommen waren, aber dem ersten Versuche wird ein zweiter folgen, der schon besser ist, dem zweiten ein dritter — und je weiter unsere pharmakochemischen Kenntnisse fortschreiten werden, um so besser wird die Einteilung sich durchführen, eine um so grössere Zahl von Drogen wird sich im System an sicherer Stelle unterbringen lassen. Ganz unwesentlich erscheint es mir, daß einige wenige Drogen an verschiedenen Stellen unterzubringen sind. Nun, so erwähnt man sie eben an verschiedenen Stellen. Das ist doch kein so großes Unglück und zeigt uns nur die Mannigfaltigkeit der Beziehungen der betreffenden Droge. Man kann die Droge ja an der einen, der Hauptstelle, beschreiben und an der anderen nur erwähnen. (Über pharmakochemische Systeme vgl. im übrigen I, S. 216 u. flgd.)
Jedenfalls darf die Pharmakognosie nicht länger eine Sammlung von Drogen-Monographien bleiben, ohne geistiges Band. Und dies geistige Band — der die Artikel und Artikelgruppen verbindende Text — spielt daher in der nachfolgenden Darstellung eine wichtige Rolle.
Der Gang, den wir bei der Behandlung der pflanzlichen Drogen einzuhalten haben, ist vorgezeichnet durch den Weg, den die pflanzliche Zelle geht. Als Produkt der Assimilation der Kohlensäure entsteht meist zuerst ein Zucker. Man kann sich die Zuckerbildung aus Kohlensäure entweder über Formaldehyd (BAEYER) oder (LÖB) in drei Phasen verlaufend denken:
(In der Pflanze erfolgt die Zuckerbildung auch sekundär über Polysaccharide oder Pflanzensäuren, s. unten.) Aus dem Zucker entstehen einerseits die Polysaccharide, z. B. die Cellulosine: Gummi und Schleim, andererseits die Fette und andere aliphatische Substanzen. Denn «das in den Fetten enthaltene Glycerin kann aus dem Traubenzucker durch Anlagerung von 4 Wasserstoff und Aufspaltung der Kohlenstoffkette[S. 5] entstehen, wie es selbst umgekehrt in Glycerose und Zucker übergeht. Und um die Stearin- und Ölsäure, welche gebunden an Glycerin in den meisten Fetten enthalten sind, vom Zucker abzuleiten, braucht man nur anzunehmen, daß von letzterem drei Moleküle durch ihre Aldehydgruppen so verkuppelt werden, wie es dem Formaldehyd bei der Zuckersynthese ergeht. Dann würde ein Molekül von 18 Kohlenstoffatomen resultieren, in welchem nur noch eine Verschiebung und Wegnahme von Sauerstoff nötig ist, um jene Säure zu erzeugen» (EMIL FISCHER). Doch kann man sich auch die Fettsäuren indirekt als aus Zuckerteilstücken aufgebaut denken. Andererseits kann man von den Kohlehydraten zu olefinischen Campherarten, zyklischen Terpenen, Retenderivaten und Phytosterinen gelangen. Die Brücke zu den zyklischen Verbindungen bildet der, wie wir jetzt wissen, weitverbreitete hexazyklische gesättigte Inosit, bei dem der Ringschluss eines sechsgliederigen Systems erfolgt ist, eines der ersten Glieder der hydroaromatischen Reihe, die in den Terpenen und Resinosäureharzen eine weitverbreitete Klasse pharmakognostisch wichtiger Stoffe liefert und der auch zum Phloroglucin hinüberleitet:
Dann folgen die ungesättigten, ringgeschlossenen aromatischen Substanzen und ihre Paarungen mit Gliedern der Zuckergruppe, die Glykoside, und den Beschluß machen die Alkaloide.
So werden wir also vom Einfacheren zum Komplizierteren fortschreitend nacheinander die Zuckerdrogen, die Stärkedrogen, die Cellulosindrogen, die Drogen mit aliphatischen Säuren und sauren Salzen, die Fettdrogen, die Drogen mit ätherischen Ölen und anderen Riechstoffen, die Harzdrogen, die Drogen mit aromatischen Phenolen und die Tanniddrogen, die Glykosiddrogen und die Alkaloiddrogen behandeln und im einzelnen wieder die Einteilung nach der chemischen Struktur der wichtigsten Bestandteile, oder, wo dies angezeigt ist, nach Familienzusammengehörigkeit oder pharmakologischen Gesichtspunkten treffen.
Die benutzten Lehr- und Handbücher der Pharmakognosie sind in dem Kapitel «Pharmakognostische Systeme» (I, S. 216), die botanische Literatur in den Kapiteln Pharmakosystematik (I, S. 298, 305, 326), Pharmakomorphologie (I, S. 340) und Pharmakoanatomie (I, S. 349, 354–356) aufgeführt. Die chemische Literatur wird bei jedem Kapitel zitiert werden. Bei einigen Kapiteln hat mich Prof. VON LIPPMANN und Prof. WINTERSTEIN beraten. In etymologischen Fragen stütze ich mich besonders auf GRIMM, KLUGE und KANNGIESSER.
Die Produktions-, Export- und Importziffern sind vornehmlich den Handelsberichten und den Ausfuhr- und Einfuhrlisten von London, Hamburg, Amsterdam, New York, Buenos Aires, Rio de Janeiro, Japan, Singapore, Calcutta, Ceylon und Java entnommen. (Vgl. I, S. 181–184.) Einige Angaben verdanke ich auch den betreffenden Handelsministerien, z. B. dem Italiens, dem Department of commerce in Washington (U. S. A.), dem deutschen Handelsarchiv und anderen Quellen, wie dem Tropenpflanzer, dem Tableau général du commerce de France u. a.
Für die durch Herrn Prof. ED. FISCHER in Bern freundlichst übernommene Bearbeitung der pflanzlichen Schädlinge wurden hauptsächlich benutzt: P. SORAUER, Handbuch der Pflanzenkrankheiten, 3. Auflage, zweiter Band, bearbeitet von G. LINDAU, Berlin 1908. — A. B. FRANK, Die Krankheiten der Pflanzen, 2. Auflage, zweiter Band. Breslau 1896. — VON TUBEUF, Pflanzenkrankheiten.[S. 6] Berlin 1895. — P. A. SACCARDO, Sylloge Fungorum omnium hucusque cognitorum Vol. XIII, 1898. — M. HOLLRUNG, Jahresbericht über das Gebiet der Pflanzenkrankheiten. — P. SORAUER, Zeitschrift für Pflanzenkrankheiten. — Auf die drei erstgenannten Handbücher seien auch diejenigen verwiesen, welche eingehendere Angaben suchen. Weitere Literaturnachweise finden sich in den einzelnen Abschnitten. Die tierischen Schädlinge hat Herr Apotheker ISRAËL in Gera freundlichst zu bearbeiten übernommen.
Im jeder Droge beigefügten historischen Teil ist durchweg auf die Pharmakohistoria im I. Bande verwiesen. Dort sind die Quellen zu finden. Die Literatur wird entweder unter jedem Abschnitte oder am Schlusse des Artikels zitiert.
I. Kohlehydratdrogen.
Wir beginnen mit den Hexosen-Drogen; da sowohl Triosen wie Tetrosen nicht in den Heilpflanzen vorkommen, und Pentosen in freiem Zustande sehr selten sind. Die ersten faßbaren Assimilationsprodukte der Pflanze sind Hexosen. Der zu den Tetrosen in naher Beziehung stehende Erythrit:
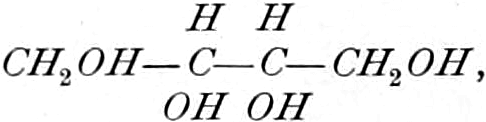
findet sich als Ester der Orsellinsäure in den Roccellaarten. (vgl. Lackmus).
1. Süssstoffdrogen.
A. Drogen, die einen Zucker oder einen verwandten Süßstoff mit sechs Kohlenstoffatomen enthalten.
a) Drogen, die Hexosen als Monosaccharide enthalten.
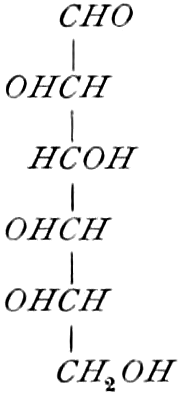
Die erste Gruppe der Zuckerarten ist die der Hexosen, die in Form von Monosacchariden auftreten. Sie entsprechen der Formel C6H12O6 und sind bald Aldosen (Mannose, Glukose [Traubenzucker, Dextrose, Stärkezucker, Harnzucker], Galaktose), bald Ketosen (Fruktose [Fruchtzucker, Lävulose, Schleimzucker], Sorbinose, Tagatose). Sie sind in einer rechtsdrehenden, einer linksdrehenden und einer inaktiven Form bekannt, was auch in der Formel zum Ausdrucke kommt, z. B.:
Aldosen (Aldohexosen).
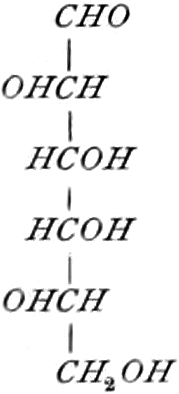
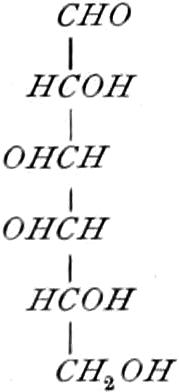
[α]D = +81°.
Sechsseitige Tafeln.
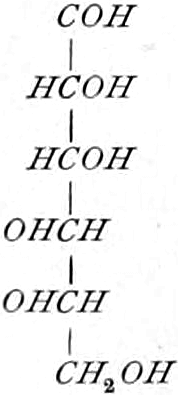
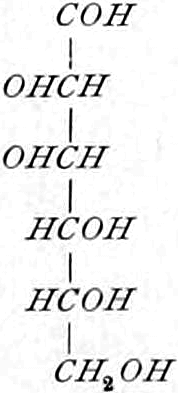
[α]D = +14,25°.
Rhombische Kristalle.
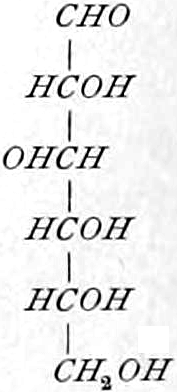
Rechts-Traubenzucker, Dextrose. Wasserfrei: [α]D = +52,5°, F = 146,5°. Nadeln. Monohydrat: Tafeln oder blumenkohlartige Massen.
Invertzucker = Dextrose + Lävulose.
[S. 7]
Ketosen (Ketohexosen).
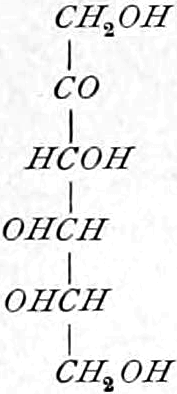
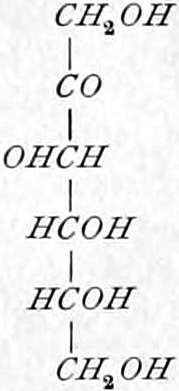
Fruchtzucker, Lävulose. [α]D = −91°, F = 95–105°. Krusten, Warzen, Nadeln (sehr süß).
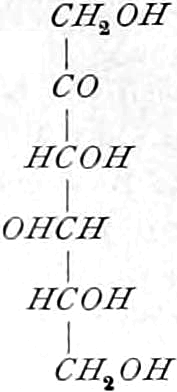
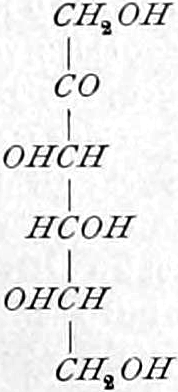
(Über den Nachweis von Ketozuckern vgl. Rosin, Zeitschr. phys. Chem. 1903, 555).
Monosaccharide vom Typus der Hexosen, besonders Dextrose und Lävulose (sehr selten freie Galaktose), finden sich in vielen Früchten reichlich, dürften aber kaum einer wachsenden Zelle fehlen. Ein Gemisch von Dextrose und Lävulose entsteht bei der Aufspaltung des Rohrzuckers (Saccharose s. d.), der ein Kondensationsprodukt dieser beiden Hexosen ist, z. B. durch das Enzym des Speichels der Biene (s. Honig).
Die Rolle, die der Zucker in der Pflanze spielt, ist eine mannigfaltige. Bei den Organen, die den Zucker in so reichlicher Menge enthalten, daß sie zur Darstellung desselben benutzt werden können (Wurzel der Zuckerrübe, Stengel des Zuckerrohrs, Stamm der Zuckerpalmen), ist er in stark entwickeltem Speicherparenchym aufgespeichert, spielt also die Rolle eines Reservestoffes. In kleinen Mengen findet er sich aber in fast allen Organen, da er die Form darstellt, in der die Kohlehydrate wandern. Die Rolle, die er bei den Früchten spielt, ist eine verschiedene. Einmal mag er dort wohl zur direkten Sicherung der Keimung der Samen durch Herstellung eines nährstoffreichen Keimbettes, dann aber wohl als Anlockung von Vögeln dienen, die Früchte zu verspeisen, da Samen, die den Magendarmkanal passiert haben, meist leichter keimen. Durch Kultur ist dann der Zuckergehalt stark vermehrt worden. Das Pektin der Früchte entstammt der Interzellularsubstanz der Fruchtfleischzellen, die ich daher Protopektin genannt habe. Es ist löslich in Zuckerlösung, nicht in Wasser (TSCHIRCH und ROSENBERG). Diese Lösung gesteht in der Kälte zu einer Gallerte. Vielleicht steht die Zuckerbildung in den Früchten zur Pektinbildung, die die Auflockerung des Fruchtfleisches bedingt, in Beziehung.
Die Umwandlung der Reservestärke in Zucker zur Zeit der Blütenstandsbildung läßt sich bei der Sagopalme schön verfolgen, deren Stammstärke zu jener Zeit gelöst und als Zucker zu den Blütenstandsanlagen geschafft wird. Die Stärkekörner zeigen daher mehr oder weniger Auflösungserscheinungen (Korrosionen, vgl. den Artikel Sago).
Quelle des Zuckers in den Früchten ist zum Teil die Stärke, zum Teil sind es vielleicht die in unreifen Früchten reichlich auftretenden Pflanzensäuren (Apfelsäure, Weinsäure, Zitronensäure) oder Tannide. Andererseits sind die Pflanzensäuren wohl auch Stufen des oxydativen Abbaues des Zuckers. Apfelsäure führende Früchte können in kalten Klimaten reifen, aber nicht weinsäurereiche, da die Apfelsäure bei viel niedrigeren Temperaturen in Zucker übergeführt wird.
Lit. EMIL FISCHER, Synthesen in der (Purin- und) Zuckergruppe. Vortrag, Braunschweig 1903 u. die Chemie der Kohlenhydrate und ihre Bedeutung für die Physiologie. Rede, Berlin 1894. Ferner Ber. d. d. chem. Ges. 1890 u. flgd. — VON LIPPMANN, Chemie d. Zuckerarten. 1904. — TOLLENS, Kurzes Handbuch der Kohlenhydrate. — CZAPEK, Biochemie d. Pflanzen.
In der lebenden Pflanze ist der Zucker immer im Zellsaft gelöst. In den Drogen findet sich Fruchtzucker und Rohrzucker oft auskristallisiert.
Der mikrohistochemische Nachweis der Hexosen in den Zellen der Drogen gelingt leicht durch die von SACHS zuerst 1862 auf mikrochemisches Gebiet übertragene FEHLINGsche Reaktion. Man legt den nicht zu dünnen Schnitt 2–10 Minuten in eine konz. Kupfersulfatlösung,[S. 8] spült schnell mit destilliertem Wasser ab und trägt in eine siedende Lösung von Kalihydroxyd in Wasser. In den reduzierenden Zucker enthaltenden Zellen entsteht ein rotgelber Niederschlag von Kupferoxydul. Man kann auch den Schnitt direkt in FEHLINGsche Lösung bringen, das Deckglas auflegen und bis eben zur Siedetemperatur erhitzen (MEYER-SCHIMPER).
Oder man benutzt die von EMIL FISCHER 1890 entdeckte, von SENFT auf das mikrohistochemische Gebiet übertragene Reaktion mit Phenylhydrazin. Man legt das Präparat in ein Gemisch einer Lösung von Phenylhydrazinchlorhydrat und Natriumacetat und erwärmt. Nach dem Abkühlen zeigen sich in den glukosehaltigen Zellen Sphärite von Phenylglucosazon. Die Reaktion tritt aber auch unter Umständen bei saccharosehaltigen Zellen auf.
Die direkte Methode von G. KRAUS, durch Einlegen der Schnitte in Glyzerin oder Alkohol den Zucker in Tröpfchenform zur Ausscheidung zu bringen, hat nur bei sehr zuckerreichen Geweben Erfolg.
Unsicher sind die Reaktionen mit Thymol und Schwefelsäure, sowie mit α-Naphthol und Schwefelsäure, die MOLISCH angab, da sie außer mit Monosen auch mit den Substanzen eintreten, die unter den angegebenen Bedingungen solche abspalten oder Furolderivate bilden.
Zur quantitativen makrochemischen Bestimmung des Zuckers bedient man sich jetzt allgemein der ALLIHNschen Methode oder der Polarimetrie.
Lit. SACHS, Mikrochem. Reaktionen. Sitzungsber. Münch. Akad. 1859. Flora 1862 u. Pringh. Jahrb. III. Abgeändert wurde die Kupfersulfatmethode dann von FLÜCKIGER (Pharmakognos.), SCHIMPER (Anleit. z. mikrosk. Unters. d. veget. Nahr.- und Genußm. 1900), A. FISCHER (Pringsh. Jahrb. 22), ARTHUR MEYER (Mikrochem. Reakt. z. Nachw. d. reduzierenden Zuckerart. Ber. d. d. bot. Ges. 1885), CZAPEK (Sitzungsb. Wien. Akad. 1897) und HOFFMEISTER (Pringsh. Jahrb. 31. 1897). — POULSEN, Botanische Mikrochemie. 1881. — SENFT, Sitzb. Wien. Akad. 1904 u. Über d. mikrochem. Zuckernachweis durch essigsaur. Phenylhydrazin. Pharmaz. Post 1902. — MOLISCH, Zwei neue Zuckerreakt. Sitzungsber. d. Wien. Akad. 97. 1886. Grundr. d. Histochemie d. pflanzl. Genußm. 1891 (vgl. auch Zeitschr. f. physiol. Chem. 1888). — G. KRAUS, Botan. Zeit. 1876. — ZIMMERMANN, Bot. Mikrotechn. 1892.
Invertzuckerdrogen.
Drogen, welche vorwiegend aus Invertzucker bestehen, oder viel Invertzucker enthalten.
α) Mel.
Syn. Honig — Miel (franz.) — Honey (engl.) — Miele (it.) — Miel (span.) — honig (holl.) — hunaja (finn.) — méz (ung.) — d.ᵉbasch (hebr.) — shahad, mahd (hind.) — madhu (= süß), mákshika (sansc.) — Aasl, aaslun-nahal (arab., bei IBN BAITHAR: Asal) — shahad, angabin, engebin (pers.) — μέλι (n.-griech).
Etym. Die Bezeichnungen in den romanischen Sprachen knüpfen an μέλι, mel an. Der Gote übersetzt das griech. μέλι mit milip. — Alle spät. germ. Dialekte haben das heutige Wort Honig, für das sich in den urverwandten Sprachen nichts findet. ahd. honag, honang, mhd. honec, altnord. hunang, schwed. honing, dän. honning, ags. hunig, engl. honey, altnfr. honog, alts. honeg, hanig, niederl. honigh, honing. Auch umgelautete Formen: hünic und hönic, hung (im Berndeutschen). KLUGE bemerkt: der Ursprung steht nicht fest, man hat an gr. κόνις = Staub gedacht; Honig «körniger» (?). Honig ist Neutrum noch bei LUTHER, auch noch bei LESSING. Das erstemal männlich bei KAISERSBERG. Manche Schriftsteller schwanken dann — so GOETHE; jetzt ist das Neutrum erloschen (GRIMM). Über Met bemerkt KLUGE: mhd. mēt, mëte, ahd. mëto, mitu, «Met» = angels. meodo, engl. mead «Met», anord. mjqõr (das germ. mëdur erscheint spätlatein. als medus, vorher afrz. mietz) ein gemeingerman. und weiterhin auch gemeinidg. Wort (idg. medhu): skr. mádhu. «Honig, süßer Trank» gr. μέθυ «Wein» aslov. medu «Honig, Wein», lit. midùs «Met» — medùs «Honig»; ir. mid. Dazu altind. mádhu «süß, lieblich», woraus sich der Wechsel der Bedeutung von idg. medhu «Met, Honig, Wein» erklärt, eigentl. «Süßer», vielleicht berauschende Flüssigkeit.
[S. 9]
Herkunft. Die Biene, Apis mellifica L. (Hymenoptera, Trib. Aculeata), die in zahlreichen Varietäten oder Rassen, von denen einige jetzt auch als gute Arten betrachtet werden, über ganz Europa, Afrika und einen großen Teil von Asien verbreitet ist — und zwar nur die Arbeitsbiene — entnimmt («leckt, schöpft») mit ihrer zu einem Rüssel stark verlängerten dreilappigen Unterlippe (Zunge, Fig. 1 S.R.) aus den Nektarien der Blüten zahlreicher Pflanzen (seltener auch aus extrafloralen Nektarien) den von der Pflanze als Anlockungsmittel der Insekten behufs Sicherung der Befruchtung der Blüte gebildeten, vorwiegend Saccharose (Rohrzucker) enthaltenden Saft (Nektar). Diesen Saft invertiert die Biene in dem 45–60 mgr. Flüssigkeit fassenden Vormagen (Honigmagen, Honigblase, Kropf, Fig. 1 H.M.) durch den Speichel der Speicheldrüsen, deren Sekret, da die Drüsen an der Basis des Saugrüssels münden (a in Fig. 1), sich beim Saugen mit dem Nektar mischt und mit diesem in den Honigmagen gelangt, und entleert ihn (zur Fütterung der jungen Brut) in die zuvor aus Wachs gebildeten Waben. Dort wird er weiter konzentriert. Beim Einsammeln des Nektar setzt sich der Pollen der Antheren an die sog. Bürstchen (Borstenreihen an der Innenfläche des Tarsus) und Körbchen (von Borsten umgebene grubenartige Vertiefungen an der Außenseite der Hinterschiene) der Hinterbeine ab und mischt sich beim Entleeren des Honigs in die Wabe zum Teil dem Honig bei. Für 1 kg Honig ist der Besuch von 5600000 Kleeblüten erforderlich (WILSON) im Durchschnitt sonst von 100000 bis 2 Mill. Blüten. Ein Bienenvolk erzeugt c. 10–13 kg Honig.
Honig ist also ein durch die Pflanze gebildetes, durch das Ptyalin des Speichels der Biene umgebildetes Produkt, dem häufig die Pollenkörner der Pflanzen, von denen die Biene den Nektar sammelte, beigemengt sind. Bisweilen läßt sich durch mikroskopische Analyse der Pollenkörner, die übrigens bei geseimtem Honig oft fehlen, feststellen, von welchen Blüten die Bienen den Honig sammelten und in besonders günstigen Fällen sogar, ob der Honig ein Frühlings-, Sommer- oder Herbsthonig ist. Denn die Blütezeit der Pflanzen ist ja innerhalb enger Grenzen festgelegt. Die in amerikanischen Honigen beobachteten Pollenkörner beschreibt YOUNG, die in deutschen gefundenen PFISTER (s. Lit.).
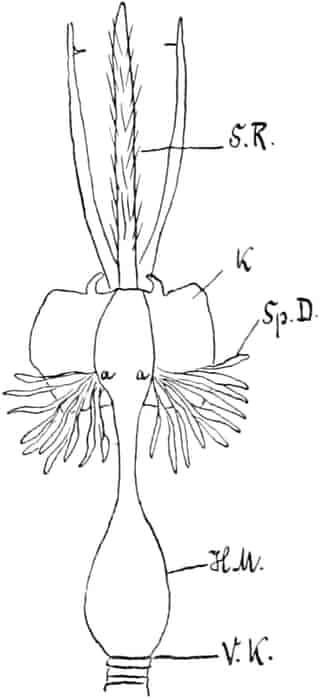
Schematische Darstellung der Saugvorrichtung der Biene.
SR. Saugrüssel. K. Kopf. SpD. Speicheldrüsen. HM. Honigmagen (Oesophagus). VK. Verschlußklappe. Das Saugen erfolgt durch rhythmische Kontraktionen und Ausdehnungen des Honigmagens. Bei a tritt der Speichel hinzu (Tschirch).
VILLIERS et COLLIN (Altérations et Falsific. p. 842) geben die Pollenkörner folgender Pflanzen als im Honig vorkommend an: Tilia, Origanum, Lavendula, Melissa, Rosmarinus, Linum, Vaccinium Myrtillus u. and. Ericaceen, Salvia officinalis, Verbascum Thapsus, Melilotus, Epilobium, Ledum und Kompositen-Synanthereen (Abbildung a. a. O. und auch in WINTON-MOELLER, Microscopy 1906). Im Honig von Chamonix: Erica, Vaccinium, Rhododendron.
In sog. giftigen Honigen (aus der Schweiz, Mingrelien, Pennsylvanien und Carolina) sollen sich Pollenkörner von Aconitum Napellus und Lycoctonum, Andromeda Mariana, Kalmia angustifolia, latifolia und hirsuta, Azalea pontica und Rhododendron ponticum finden.
[S. 10]
Bisweilen kommt es auch vor, daß die Bienen, besonders wenn sie nicht genug Blüten finden, das süße dextrinreiche Sekret der Blattläuse, das diese auf den Blättern absetzen, sammeln. Dieser meist minderwertige Honig heißt Honigtauhonig.
Beschreibung. Honig bildet eine klare, dicke, gelbliche oder gelbbräunliche Flüssigkeit oder eine durch auskristallisierten, im Mikroskope in Form von Tafeln und Blättchen erscheinenden Traubenzucker (Dextrose) mehr oder weniger trübe, weißliche Masse. Farbe und Geruch des Honigs wechselt nach der Provenienz, der Geruch z. B. nach der Art der vornehmlich besuchten Blüten. Honig soll bisweilen auch die anderen Eigenschaften der besuchten Pflanzen annehmen, also wenn diese giftig sind (Ranunculaceen, Aconitum; Ericaceen, Apocyneen, Nerium, Daphne, Azalea, Datura, Rhododendron) giftig werden können. Der in Abyssinien in der Nähe von Kussogärten gesammelte Honig besitzt die täniciden Eigenschaften des Kusso und wird wie Kusso benutzt. KEBLER fand (1896) in giftigem Honig einen Körper ähnlich dem Andromedotoxin. Giftiger (Rhododendron-) Honig ist auch neuerdings wieder in Indien beobachtet worden (AINSLIE), sowie in Pennsylvanien und im Kaukasus und (1905) in Neuseeland (KÜHN). Nach anderen hat die Giftigkeit einer Pflanze keinen oder nur bedingten Einfluß auf die Wirkung des Honig. Das erscheint wahrscheinlich, denn von den Nektarien wird ja wohl nur Zuckersaft aber keine giftige Substanz ausgeschieden. Die Sekrete der Drüsenhaare jedoch wird die Biene beim Besuche der Blüten leicht mit abstreifen und so mag sich wohl eine riechende Substanz oder ein anderer von den Drüsenhaaren gebildeter Körper bisweilen beimengen. PLINIUS bemerkt, daß Thymianhonig sehr gut riecht und schmeckt, überhaupt viel besser ist als z. B. Rosmarinhonig. Auch die Alphita (vgl. I, S. 652) erwähnt einen Mel thimenon. Der corsische Honig roch nach Taxus und stand im Altertum in schlechtem Ruf. In Vorderindien gilt der Honig als der beste, der durch die Bienen von Strobilanthes-Arten und Plectranthus rugosus gesammelt wird (WATT). ELBASRI weiß (bei IBN BAITHAR) zu berichten, daß die Honige, die von Satureja und die von Absynth stammen, eine verschiedene arzneiliche Wirkung besitzen. Letzterer sei auch bitter. Und neuerdings wurde berichtet, daß auch der Eucalyptushonig besondere arzneiliche Wirkung besitzen solle, was sich aber nicht bestätigt hat. Die Blütenhonige sind ebenso wie die Frühjahrshonige heller als die Tannenhonige, die Wald- und Honigtauhonige. Die überseeischen Honige besitzen meist einen wenig angenehmen Geruch und Geschmack und sind auch oft unrein. Aus ungedeckelten Waben ausgeschleuderter Honig ist wasserreicher, daher dünnflüssiger («unreifer Honig»).
Das spez. Gewicht des Honigs beträgt etwa 1,42 (1,406–1,478 MADER). Es wird (nach Pharm. helv.) nicht direkt bestimmt, sondern in Lösung 1 : 2. Diese Lösung soll wenigstens 1,12 spez. Gewicht besitzen.
Guter Honig ist haltbar (durch den Gehalt an Ameisensäure?). Wasserreicher geht leicht in Gärung über (Honigwein, Met, vgl. I, S. 1016) oder wird sauer.
Lit. ARNOLD, Der Honig, dessen Bedeutung, Wert und Verwendung. 1886. — PAULY, Der Honig. 1890. — VON BERLEPSCH und W. VOGEL, Die Bienenzucht auf ihrem jetzigen Standpunkte. Berlin 1899.
Einsammlung. Die Biene bildet entweder in hohlen Bäumen oder an geschützten Stellen (wilde Biene), oder in den Bienenkörben und Bienenstöcken aus sechseckigen, senkrecht gestellten Zellen (Waben, Wachszellen) einen Bau. Dieser wird durch Horizontalschnitte geöffnet, die Waben entdeckelt. Man läßt dann den Inhalt einfach auslaufen (Jungfernhonig, Senkhonig) oder beschleunigt das Ausfließen[S. 11] durch Zentrifugieren (Schleuderhonig), oder Zerkleinern der Waben (Laufhonig), oder Druck und Wärme (ausgelassener Honig, Preßhonig). Der letztere wird meist geklärt (geseimt). Auch die anderen Sorten läßt man oft durch ein Sieb laufen.
Handelssorten. Linden-, Heide-, Fenchel-, Klee-, Raps-, Buchweizenhonig sind ziemlich willkürliche Namen für gute Blütenhonige. Honigtau-, Wald-, Tannenhonig sind weniger gute. Der Handel unterscheidet: Wabenhonig (Scheibenhonig mit den Waben), Schleuderhonig, Leckhonig oder Senkhonig, Preßhonig, Laufhonig, Seimhonig, Landhonig, Stampfhonig. Ferner unterscheidet man noch: Frühjahrshonig (aus den Blüten von Raps, Obstbäumen, Weiden usw.), Frühsommerhonig (aus den Blüten von Klee, Hederich usw.), Hochsommerhonig (aus den Blüten von Linde, Kornblume, Wicke, Bohne usw.), Herbsthonig (aus den Blüten von Buchweizen, Erica usw. gesammelt). Schon DIOSKURIDES sagt: «Den Vorzug verdient der Frühjahrshonig, danach der Sommerhonig, der dickere Herbsthonig (Haidhonig) ist minderwertig». ARISTOTELES dagegen hält den Herbsthonig für den besten. PLINIUS meint, der beste Honig entstehe zur Zeit wo Thymus und Weinstock blühe.
Der Großhandel liefert jetzt viel überseeischen Honig und man unterscheidet jetzt solchen von Chile (Fässer à 70 kg), Havana, Kuba, Mexiko, Californien und Hawai, letzterer in Kanistern à 25 kg, die zu zwei in einer Kiste verpackt sind. Von chilenischen, dem wichtigsten, werden die Sorten weiß steif 00 und 0, blond, gelb und braun angeboten.
Produktion. Europa produziert jährlich c. 80000 t Honig. Deutschland, wo die Imkerei am rationellsten betrieben wird (z. B. in Holstein), allein 20000 t, Spanien 19000 t, Österreich-Ungarn 18000 t, Frankreich (bes. Narbonne) 10000 t. Geringere Mengen liefern Italien, Griechenland, Belgien, Holland, England und Rußland (Polen). Die überseeischen Länder lieferten 1907 c. 3¾ Mill. kg. Besonders viel kam aus Kuba, Chile, San Domingo, Mexiko, Peru, Kalifornien. Valparaiso (I, Fig. 250) ist ein großer Honighafen. 1908 lieferten Kuba 1320 t, Mexiko 370 t, Chile und Peru 700 t, Kalifornien und Nordamerika 56 t, die übrigen Länder 433 t (GEHE).
Die Einfuhr nach Deutschland betrug 1909:
|
c. 112000
|
kg
|
aus
|
Kalifornien und Nordamerika
|
|
c. 630000
|
„
|
„
|
Chile und Peru
|
|
c. 1505000
|
„
|
„
|
Kuba
|
|
c. 370000
|
„
|
„
|
Domingo und Haiti
|
|
c. 220000
|
„
|
„
|
Jamaika
|
|
c. 405000
|
„
|
„
|
Mexiko
|
|
c. 331000
|
„
|
„
|
Divers. Ländern
|
|
c. 3573000
|
kg
|
in Summa
|
|
Die Einfuhr von Honig nach Hamburg betrug seewärts 1906: 40618, 1907: 40699, 1908: 36746 Doppelzentner (dz). Die Vereinigten Staaten von Nordamerika führten 1909 145691 Gallons Honig ein, hauptsächlich aus Kuba (nämlich 103092 Gall.), Frankreich 1908: 12832 Quintalm. besonders aus Deutschland und Chile.
Chemie. Honig besteht hauptsächlich aus einer konzentrierten wässrigen Lösung von Invertzucker (Frucht- und Traubenzucker), die 65–80% (bei Blütenhonigen meist 65–73%, bei Honigtauhonigen weniger) Invertzucker (nach SIEBEN: 34,7 Dextrose und 39,2 Lävulose) und 15–20% (höchstens 20% nach Schweiz. Lebensmittelb.) Wasser enthält. Daneben finden sich geringe Mengen Rohrzucker (Saccharose, 2–5, höchstens 10%), Dextrine (unt. and. Achroodextrin, bis 4%, besonders[S. 12] viel, bis 10%, im Coniferenhonig), Proteïnsubstanzen (0,15–1,8%), etwas Farbstoff, Ameisensäure (A. VOGEL) und Apfelsäure, sowie 0,1–0,8% (nach RÖHRIG im Mittel 0,214%, aber auch bisweilen unter 0,1 (KREISS), nach UTZ 0,013–0,703%, nach Pharm. helv. IV. 0,3–0,8%) Mineralsubstanzen. Spuren von gummiartigen Substanzen und von Riechstoffen. Im ganzen 1,5% «Nichtzucker». Die saure Reaktion rührt zum Teil von der Ameisensäure her. Sie entspricht 0,04–0,15% dieser Säure. Nach FARNSTEINER beruht aber die saure Reaktion des Honigs in der Hauptsache auf einer nichtflüchtigen Säure (Apfelsäure?). In der Asche finden sich besonders Phosphate (4–10% der Asche, meist nicht über 7%). HEHNER gab (1885) an, daß natürlicher Honig 0,01–0,03% Phosphorsäure enthält, künstlicher nur Spuren.
Die hellen Blütenhonige sind stets linksdrehend, Honigtauhonige und Coniferenhonige, welche dunkle Farbe haben, rechtsdrehend. Rechtsdrehende Naturhonige werden nach Ausfällung des Dextrins inaktiv oder linksdrehend. Die Rechtsdrehung rührt also vom Dextrin her. Die Dextrine, die in Coniferenhonigen vorkommen, scheinen unter sich verschieden zu sein (HILGER) und zu den Stärkedextrinen in keiner Beziehung zu stehen. MONHEIM hält das Honigdextrin für ein Disaccharid.
Daß der Honig einen «besonderen» Zucker (also nicht Rohrzucker) enthält, fand bereits LOWITZ 1792. In Lindenhonig fand MAQUENNE übrigens bis zu 40% Melezitose.
Die FIEHEsche Reaktion zur Unterscheidung von Natur- und Kunsthonig (Rotfärbung des Rückstandes der Ätherausschüttelung mit einer Lösung von Resorcin in rauchender Salzsäure) beruht darauf, daß dem nicht erwärmten Naturhonig ganz oder nahezu ganz das β-Oxy-δ-methylfurfurol, ein Zersetzungsprodukt der Fruktose, fehlt, das sich sowohl im Kunsthonig, wie im Invertzucker und dem Stärkesirup findet (KEISER). Entscheidende Bedeutung kommt ihr nicht zu (LIPPMANN).
Honig enthält immer Enzyme (MARPMANN nimmt drei an: ein proteolytisches, ein invertierendes und ein alkoholbildendes). Dieselben entstammen offenbar den Speicheldrüsen der Bienen (Fig. 1 Sp D). Sie fehlen dem Kunsthonig.
Über die Zusammensetzung des Pollens und Nektars haben WILSON, VON PLANTA und KRESSLING Mitteilungen gemacht. Die Nektare enthalten bald nur Glukose, bald nur Saccharose, bald Glukose und Saccharose in wechselndem Verhältnis. Der Pollen dagegen, soweit untersucht, meist nur Saccharose (KRESSLING). Ameisensäure fehlt im Pollen und im Nektar. Sie wird von der Biene erzeugt. Der HONIGTAU (s. oben) enthält neben Saccharose und Glukose 8–39% Dextrin. Der «Futterbrei» (Futtersaft), welchen die fütternden Arbeiterbienen in die Zellen der Larven der Königinnen, Drohnen und Arbeiterinnen einlegen, enthält viel Stickstoffsubstanz (c. 43%) neben Fett und Glukose (c. 24%). Angaben über den Rohrzuckergehalt der Nektarienflüssigkeiten bei LIPPMANN S. 1047.
Lit. HASTERLIK, Der Bienenhonig und seine Ersatzmittel. 1909 (dort die Literatur). — V. LIPPMANN, Chemie der Zuckerarten. — Schweiz. Lebensmittelbuch 1908 und Deutsche Reichsvereinbarungen. — ELSNER in Realenzyklopädie (Prüfung). — KÖNIG, D. menschl. Nahrungs- u. Genußmittel. 4. Aufl. 1904 (dort die wichtigste chem. Lit.). — BROWNE, Chem. analys. and composition of american honeys, including a microscopical study of honey Pollen by YOUNG U. S. Dep. Agric. Bur. of chemistry 1908 (dort die Honigliteratur 1892–1907). — PFISTER, Forschungsber. 1895 (Pollen). — Ferner: KÜNNMANN und HILGER, Zur Chemie des Honigs. Forschungsber. 1896. — E. BECKMANN, Beitr. z. Prüf. d. Honigs. Zeitschr. Anal. Chemie 35. — V. PLANTA, Bienenzeit. 1878 u. 1879. — BISHOP, Journ. pharm. chim. (5) 10, 459. — Tabelle der Zusammensetz. bei VILLIERS-COLLIN, Altérat. et falsificat. — BENSEMANN, Pharm. Centralh. 1894. — HEFELMANN, Zeitschr. angew. Chem. 1888. — FARNSTEINER, Zeitschr. f. Unters. d. Nahr.- u. Genußm. 1908. — FIEHE, Zeitschr. f. Unters. d. Nahr.- u. Genußm. 1908. — KEISER, Beitr. z. Chem. d. Honigs. Arbeit. d. kais. Gesundheitsamtes. 1909. — KÜHN, Pharm. Zeit.[S. 13] 1905, S. 642 (giftiger Honig). — RÖHRIG, Jahresb. d. Pharm. 1908, S. 435 u. KREISS, Ebenda (Asche). — MARPMANN, Pharm. Zeit. 1903, S. 1010. — MONHEIM, Honigdextrin des Tannenhonigs. Jahresb. d. Pharm. 1903, S. 576. Ferner ist die Literatur d. Unters. der Nahrungs- u. Genußmittel zu vergleichen.
Pathologie. Über Schädlinge berichtet Israël:
Die als Schädlinge auf Arzneistoffen und arzneilichen Zubereitungen gelegentlich auftretenden Milben gehören hauptsächlich zur Familie der Tyroglyphinen. Es finden sich unter diesen scheinbar keine echten Schmarotzer. Sie leben auf sich langsam zersetzenden, faulenden, tierischen und pflanzlichen, namentlich auch zuckerhaltigen Stoffen, und sind deshalb auch oft da zu finden, wo Zuckerlösungen in Gärung begriffen sind. Auch auf fast allen getrockneten Früchten, wie Feigen, Datteln, Rosinen, Pflaumen usw. trifft man sie häufig genug an. Aber nicht allein auf diesen, sondern auch auf allen möglichen anderen trockenen vegetabilischen und tierischen Substanzen und Rohstoffen findet man oft irgend eine Milbenart in einer erstaunlichen Massenvermehrung. Auf diese Stoffe gelangen die Milben gewöhnlich im Zustande der Wanderlarve, durch die Fliegen, welche diese kleinen Tiere an ihren Beinen verschleppen und verbreiten. Auf gärendem Rohhonig findet man nicht selten Glycyphagus domesticus, Tyroglyphus longior und siro (vgl. das Kapitel Pharmakopathologie, S. 380).
Als Schmarotzer leben in den Bienenstöcken (nach ISRAËL):
1. Die Larvenzustände von Meloëarten, besonders die des bekannten, gemeinen Maiwurms Meloë proscarabaeus. Dieser Käfer legt seine Eier in den Sand, die ausgehenden Larven klettern an den Pflanzen empor und gehen in die Blüten. Von hier lassen sie sich von den Bienen selbst, an deren haarige Beinchen sie sich anklammern, in die Stöcke tragen, woselbst sie in eine Zelle kriechen, und zunächst das Bienenei fressen, und ihre weitere, ziemlich komplizierte Hypermetamorphose durchmachen. Die Larve macht nämlich, ehe sie sich endgültig verpuppt, mehrere erhebliche Verwandlungen durch.
2. Die schönen roten Larven der sog. Bienenwölfe, der Käfergattung Trichodes, besonders apiarius. Sie befallen mehr die wilden Bienenarten, besonders die Mauerbiene, seltener die Honigbiene.
3. Die Raupen von Galleria mellonella, der Wachsmotte, welche manchen Stock zum Eingehen bringen. Galleria gehört zur Familie der Pyralidae, einer Unterfamilie der Mikrolepidopteren. Sie fressen lange Gänge durch die Waben und stören den Haushalt der Bienen durch ihre Menge oft bedeutend; auch werden sie gelegentlich Veranlassung zur Entstehung von Faulbrut. Die Bienenmotte ist sehr resistent. Tuberkelbazillen beeinflussen sie z. B. gar nicht.
Beimengungen und Verfälschungen. Verdünnt man den Honig in einem Sedimentierzylinder stark mit Wasser, so setzen sich Pollenkörner und Wachsteilchen am Boden ab und können mikroskopisch diagnostiziert werden (s. oben S. 9). Sie sind regelmäßige Beimengungen. Unzulässig dagegen sind Bruchstücke von Organen der Biene und Bienenbrut, Stärke und Mineralsubstanzen, die sich event. ebenfalls im Sedimente finden. Als Verfälschungen sind zu nennen: Wasser, Stärkezucker, Rohrzucker, Kunsthonig, Dextrin; selten kommen vor: Stärke, Leim, Glycerin, Melasse, Saccharin, Farbstoffe. (Über Honigfälschungen vgl. auch Pharm. Zeit. 1903, 142).
Wer Fälschung des Honigs vornahm, wurde im Mittelalter mit dem Verluste einer Hand oder mit 65 Pfund Pfennigen (!) bestraft.
Prüfung. Außer der mikroskopischen Prüfung ist der Zucker, das Wasser, die Mineralstoffe, die Acidität zu bestimmen und auf Dextrin zu prüfen, sowie das optische Verhalten festzustellen, und zwar vor und nach der Inversion, vor und nach dem Ausfällen des Dextrins mit Alkohol. Eventuell ist Dextrin, Stickstoffsubstanz und Phosphorsäure zu bestimmen und[S. 14] auf Saccharin und Teerfarbstoffe zu prüfen. (Gute Prüfung in der Pharm. helvet. IV, dem Schweiz. Lebensmittelbuche und in SCHMIDT, Lehrb. d. pharmaz. Chemie.) Grenzzahlen s. oben. Honige mit Stärkezucker- oder Rohrzuckerzusatz bleiben auch, wenn das Dextrin mit Alkohol ausgefällt wurde, rechtsdrehend, echte werden inaktiv oder linksdrehend.
Kunsthonig ist meist invertierter Rohrzucker, der mit Naturhonig verschnitten oder mit Honigparfüm parfümiert ist. Er enthält meist keinen Stickstoff, keine Enzyme, keine oder wenig (s. oben) Phosphorsäure und keine Ameisensäure. Aber auch Stärkezucker, der zuerst 1811 von KIRCHHOFF dargestellt wurde, wird als Honig verkauft.
Lit. FIEHE, Über d. Nachweis von Stärkesirup im Honig und in Fruchtsäften. Arb. d. kais. Gesundheitsamtes 32 (1909), Heft 1.
Verwendung. Honig war im alten Ägypten das meistgebrauchte Heilmittel. Auch im Koran ist er die allgemeine «Arznei für die Menschen». Er bildete das Constituens des Theriak (I, S. 551) und war ein Bestandteil des Kyphi (I, S. 473). Honig ist jetzt vorwiegend Genuß- und Nahrungsmittel. Große Mengen, besonders überseeischer Honige, verbraucht die Lebkuchenfabrikation. Die Medizin benutzt ihn als gelindes Abführmittel und Geschmackskorrigens, auch wohl zu Mund- und Gurgelwässern. Oxymel Scillae, Hydromel, Mel boraxatum und besonders Mel rosatum sind noch viel benutzte, zum Teil uralte ägyptische Mel-Composita (I, S. 469 und 539). Die äußerliche Anwendung, die im Altertum eine Rolle spielte, ist jetzt nicht mehr beliebt. Reine Lävulose wird jetzt als Nährmittel für Zuckerkranke empfohlen.
Geschichte. Honig war eines der ersten Nahrungsmittel des Menschen. Milch und Honig war die Kost der Götter, die Ambrosia, die Zeus, der Zögling der Honignymphe Melissa, mischte. Mit Honig schläferte Zeus den Kronos ein. Von der heiligen Esche träufelte nach der nordischen Sage der Tau (Hunangsfall = Honigfall) und von ihm nährten sich die Bienen. Auch bei den semitischen Völkern stand Honig in hohem Ansehn. Er durfte zu Speisopfern nicht gebraucht werden. Die griechischen Dichter besangen ihn. Als ältestes Opfer der Griechen nennt PLATO mit Honig bestrichene Früchte.
Im Ägyptischen heißt Honig ʿft (koptisch êbiô und ěfeiô), im Babylonischen dišpu. Er war in Ägypten wohl das ursprüngliche süßende Geschmackskorrigens der Arzneien und der Dattelsirup ist erst durch babylonische Rezepte in die ägyptische Pharmazie gekommen (vgl. I, S. 469).
Schon die ältesten Kulturvölker betrieben die Zucht der Biene und die Gewinnung von Honig und Wachs. Lange bevor der Rohrzucker dargestellt wurde, diente der Honig als allgemeiner Süßstoff, der aber auch medizinisch innerlich und äußerlich benutzt wurde. Schon das Altertum unterschied mehrere Handelssorten. DIOSKURIDES kennt neben attischem Honig (vom Hymettos) solchen von den kykladischen Inseln und von Sicilien, sowie Honig von Sardinien und (giftigen) pontischen Honig, der auch bei XENOPHON erwähnt wird und der von Azalea pontica und Rhododendron ponticum oder von einer Datura (FLÜCKIGER) gesammelt wurde (SPRENGEL). Kap. 101–103 des II. Buches von DIOSKURIDES Heilmittellehre handelt περὶ μέλιτος melitos]. PLINIUS kennt auch Honig, von der Insel Calydna und pelignischen sowie von Creta, Cypern und Afrika, und endlich auch deutschen. Diätetische Honiggetränke der Alten waren: μελίκρατον (Honigmet), ὑδρόμελι (Wassermet, Aqua mulsa), οἰνόμελι (Mulsum), μελίκρατον γάλακτος, ὀξύγλυκον und ὀξύμελι (Oxymel). SUŚRUTA (I, S. 505) nennt hellen und kupferfarbigen Honig und erwähnt aus Honig dargestellte Zuckerarten. Hydromel und Oxymel war eines der beliebtesten Heilmittel des HIPPOKRATES. Gegorener Honig bildete den Met (I, S. 1016).
Daß Honig im Altertum als Konservierungsmittel der Leichen vornehmer Personen benutzt wurde, ist schon oben (I, S. 1013) erwähnt worden. Wie BASTIAN (Die Völker des östlichen Asiens II, 27) mitteilt, ist dies noch gegenwärtig in Birma üblich. «Hohe Herren werden ein Jahr lang für das Leichenbegängnis, das viele Vorbereitungen erfordert, präserviert und um sie frisch zu erhalten, steckt man sie in Honig, als die sicherste Methode, die außerdem die billigste ist, da der geschenkte Honig sich wieder verkaufen läßt».
Nach Nordamerika wurde die Biene 1675, nach Brasilien 1845, nach Australien 1862 gebracht.
[S. 15]
V. LIPPMANN, der viele historische Notizen über den Honig mitteilt, erbringt den Nachweis, daß der Honiggenuß sich besonders bei vegetarisch lebenden Völkern entwickelt hat.
Zur Merovinger Zeit bestand der Garten in Deutschland nur aus einigen Obstbäumen und Bienenstöcken (I, S. 619).
In der Frankfurter Lisie von 1450 (I, S. 812) steht propoleos uel on (d. h. das aromatische Vorwachs der Bienen, propolis).
Lit. VON LIPPMANN, Geschichte des Zuckers 1890 (darin eine Geschichte des Honigs als Vorgeschichte des Zuckers).
β) Blüten.
Flos Verbasci.
Syn. Königskerze, Wollblume, — Bouillon blanc, molène, bonhomme, herbe de Saint-Fiacre, Cierge de Notre dame (franz.) — High taper, torch-weed, mollein, mullein, wool-blade (engl.) — fiore di verbasco, tasso barbasso, barabasco, barbarastio mignattone, candela regia (ital.) — őkőrfarkkoró (ung.) — φλῶμος (n.-griech.).
Wollkraut, Himmelskerze, Fackelkraut. Fackelblumen, Unser Frauen Heil, Himmelbrand, Manwoll, Marienkerzen, Osterkerze, Wiln, Zöllich. — ahd.: Konigskrone, Konigskarcz, vullena, wullina; — mhd.: bullen, himelbrant, königsworcz, kunigskerz, wislma, wulkraut; — bei BRUNFELS: Bergenkraut — bei BOCK: waldwull — bei FUCHS auch Kerzenkraut.
DIOSKURIDES (I, S. 564) kennt mehrere Arten φλομός, der weiße ist wohl V. plicatum (oder Thapsus?, plicatum ist nach FRAAS in Griechenland häufiger), der schwarze V. sinuatum (= φλομός ἡ μέλαινα des THEOPHRAST). Er bemerkt, daß die Römer den Phlomos: Verbascum (gräzisiert Berbasclum) nennen. (Daraus ist dann Barbascum und Verbascum entstanden.) PLINIUS schöpft aus der gleichen Quelle. Auch der Name Thapsos war in Gebrauch. Ob die φλόμις λεύκη (und ἀῤῥέα) des GALEN V. phlomoides ist, wie DRAGENDORFF will, ist mir zweifelhaft. Es wird wohl eine der südlichen Arten sein (s. unter Paralleldrogen). Die φλόμις ἡ θύαλλις (und ἡ ἄγρια?) des GALEN soll Verbascum limnense? (fehlt im Kew Index) sein. Was der φλόμος des HERMES TRISMEGISTOS («Kraut des Merkur») ist, ist unbekannt. Das gleiche gilt von dem ägyptischen Phlomos heteros (Athal, kerykion, honnu rabdon). Man warf im Altertum Verbascum vielfach mit der Labiate Phlomis zusammen. Bei IBN BAITHAR steht für Verbascumarten: Busir, Sikrân el-haut (= fischbetäubendes Gift), Flumis, Miknasat el-andar, Berbaschka.
Etym. (φλομός vielleicht von φλέγομαι leuchten, φλόξ Flamme, weil Stengel und Blätter zu Lampendochten verwandt wurden (PLINIUS 25, 74), oder weil der Blütenstand (vgl. Fig. 2) wie ein Leuchter, eine Fackel oder eine Kerze aussieht. Darauf deuten auch die Namen Candella regia, Königskerze, Fackelblume, Marien- oder Osterkerze, während andere, wie Wollblumen, Wollkraut, wullina, barbascum (von barba?) auf die Behaarung Bezug haben; wie die arabische Bezeichnung Adân ed-dobb (= Bärenohren). Molène, mullein (von mollis = weich) hat vielleicht auch hierauf Bezug oder auf den Schleimgehalt (?) — Thapsus steht zur gelben Farbe der Blüten, d. h. zu θαψος, θαψία in Beziehung, mit welchem Worte die Griechen nach der Insel Thapsos (Isola degli Magnisi) bei Syrakus (FLÜCKIGER) eine zum Gelbfärben benutzte Umbellifere (Thapsia garganica?) bezeichneten. Aus thapsus und barbascum wurde dann tassus barbassus, ja sogar taxus barbatus (so bei CRESCENZI I, S. 678) gebildet, was ich übrigens für einen Fehler des Abschreibers halte.
Stammpflanze. Verbascum thapsiforme SCHRADER (V. Thapsus L. var. thapsiforme HOOK. fil., V. phlomoides MEY., V. Thapsus POLL., V. cuspidatum SCHRAD., V. Kicxianum DUMORT) und Verbascum phlomoides L.
Systemat. Stellung. Scrophulariaceae, Pseudosolaneae — Verbasceae. — Sectio Thapsus. Euthapsi.
[S. 16]
Beschreibung der Stammpflanze. Die meisten neueren Floristen (z. B. SCHINZ-KELLER, Flora der Schweiz, 3. Aufl., 1909) und auch ENGLER-PRANTL (Pflanzenfamilien) trennen V. phlomoides, die wildblumenähnliche Königskerze, von V. thapsiforme, der großblütigen, als Arten.
SCHUMANN bemerkt (in BERG-SCHMIDT, Atlas S. 74): «G. F. W. MEYER hat zuerst die Meinung ausgesprochen, daß V. thapsiforme SCHRADER von V. phlomoides L. nicht spezifisch zu trennen sei; wir können dieser Meinung, die auch FRANCHET und FLÜCKIGER geteilt haben, wohl beipflichten, da sich das aus den Blättern hergenommene Merkmal als kaum genügend erweist, um unserer Pflanze einen anderen Wert als vielleicht den einer Varietät zuzuerkennen».
Jedenfalls sind beide sehr ähnlich und die Blüten beider werden z. B. von Pharm. helvet. IV ausdrücklich zugelassen. Ich halte sie hier auseinander, ohne zu der Frage Stellung zu nehmen.
SCHINZ-KELLER beschreiben V. thapsiforme: 30–180 cm hoch. Laubblätter länglich, elliptisch, gekerbt, gelblich filzig. Jedes Laubblatt bis zum nächst unteren herablaufend. Blütenstiele kürzer als der Kelch. Krone radförmig, doppelt so groß und heller gelb als bei V. Thapsus, sonst aber wie diese.
V. phlomoides, 1–2 m hoch, Stengel aufrecht steif, einfach oder mit einzelnen aufrechten Ästen. Laubblätter länglich-eiförmig, gekerbt, die mittleren und oberen sehr verschieden stark herablaufend. Krone flach, etwa doppelt so groß und blasser als bei V. Thapsus, die zwei längeren Staubfäden 1½–2 mal so lang als ihre herablaufenden Staubbeutel, Narbe am Grunde herablaufend, spatelförmig.
V. Thapsus, das bei uns auch ziemlich verbreitet ist, kommt für uns nicht in Betracht. Es hat viel kleinere Blüten. Dagegen scheinen seine Blüten (common mullein) in Nordamerika benutzt zu werden, wo die Pflanze enorme Höhen (über 7 Fuß) erreicht. Auch V. phlomoides findet sich (wohl eingeschleppt) in den Vereinigten Staaten, z. B. in Massachusetts.

Verbascum phlomoides L.
Wie nötig es ist, bei den Pflanzennamen der Drogen die Autoren beizusetzen, zeigte HOLMES (Ph. journ. 1900, 418) an Verbascum. Es gibt fünf V. phlomoides[S. 17] (V. phlomoides L., V. glomeratum BOISS., V. Boerhavi L., V. montanum SCHRAD., V. lasianthum BOISS.) und zwei V. thapsiforme (V. thapsiforme SCHRADER und V. thapsiforme GUSS.).
Die Königskerze ist eine prächtige Pflanze von großer Schönheit. Ihr kerzengerader Stengel mit den großen grauen Blättern und der blütenübersäten langen Infloreszenz machen sie zu einer der charakteristischsten Pflanzen unserer Flora (Fig. 2).
Verbascum thapsiforme SCHRAD. sowohl wie V. phlomoides L. sind zweijährig. Im ersten Jahr entsteht nur eine große Blattrosette, im zweiten die Infloreszenz. Die spiralig gestellten Blätter sind oblong oder schmal umgekehrt eiförmig, meist sitzend, am Grunde mehr oder weniger bis zum nächsten Blatt herablaufend, gekerbt, zugespitzt, durch zahlreiche Büschelhaare dick filzig. (Die abgelösten Wollhaare werden als Zunder benutzt!)
Die Blüten von V. thapsiforme sind zu Dichasien vereinigt, die ihrerseits wieder, an einer langen Infloreszenzachse sitzend, einen sog. Blütenschwanz bilden.
Sie entstehen zuerst einzeln in den Achseln der spiralig angeordneten, zugespitzten, an der Infloreszenzachse herablaufenden Deckblätter (den Hochblättern der Infloreszenz, Fig. 3 D). Die erste Blüte (Fig. 3, 1) hat zwei lanzettliche Vorblätter (α). In den Achseln dieser letzteren entspringen bald 2, bald 4, gleichfalls mit Vorblättern (β) versehene Blüten (3–3, 5–5). Bevor jedoch diese 2, bzw. 4, mit der Blüte 1 ein 3- bzw. 5blütiges Dichasium bildenden Blüten sich entfalten, entsteht zwischen diesem Dichasium und dem Deckblatte D, also unter Blüte 1, eine Beiknospe als Bereicherungssproß. Der Bereicherungssproß ist im einfachsten Falle einblütig. Meist jedoch entsteht zwischen dieser einen Blüte, die zuerst aufblüht (2), und dem Deckblatte noch eine zweite Blüte (4). Jede derselben hat 2 Vorblätter (γ). Bisweilen finden sich aber auch noch in den Achseln der Deckblätter der oberen, älteren Blüte zwei weitere, aber deckblattlose Blüten (6). Diese sind die zuletzt aufblühenden. Infolge des sehr verschiedenen Alters der Blüten blühen von diesen Teilinfloreszenzen meist nur eine oder zwei zu gleicher Zeit. Da sie aber alle nacheinander (in der Reihenfolge der Zahlen) zum Blühen kommen, so steht ein Blütenschwanz von Verbascum thapsiforme von oben bis unten wochenlang in Blüte. Bald öffnet sich hier, bald dort eine Blüte (SCHUMANN und TSCHIRCH-OESTERLE, Anatom. Atlas).
Der gamosepale, krugförmige, fünfzählige Kelch ist außen dicht filzig behaart, 6–8 mm lang. Die fünf Zipfel sind eilanzettlich, länglich dreieckig und zeigen aufsteigend-dachziegelige Knospenlage. Er ist zygomorph. Die Haare sind entweder Drüsenhaare mit oft sehr zahlreichen sezernierenden Zellen oder Sternhaare mit 1–4 Etagen (Büschelhaare). Der Gipfelstern ist 3–6strahlig. Dergleichen Haare finden sich auch auf den Laubblättern. Der Fruchtknoten ist eiförmig.
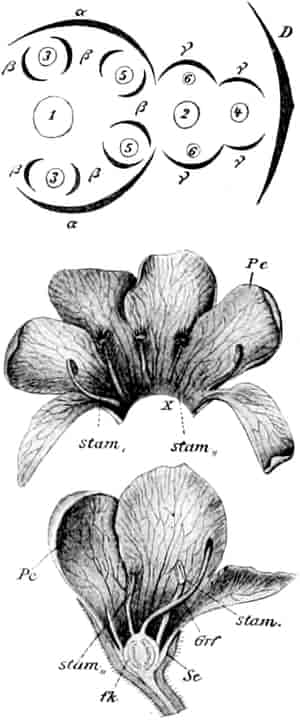
Oben: Diagramm einer Partialinfloreszenz in der Achsel des Deckblattes D. Die Kreise sind die Blüten. Die Nummern 1–6 bezeichnen die Aufblühfolge. In der Mitte: Eine aufgeschnittene Corolle. Unten: Vollständige Blüte im Längsschnitt.
[Nach Tschirch-Oesterle, Atlas.]
Die gleichfalls median-zygomorphe Corolle, die sich sehr leicht ablösen läßt, ist radförmig, 5zählig, sympetal, in der Mediane c. 3,5–4, bisweilen sogar 5 cm breit. An der Basis sind die 5 Blätter zu einer kurzen Röhre verwachsen. Die Zipfel sind fast kreisrund. Sie decken sich dachziegelig in absteigender Präfloration.[S. 18] Der unterste Kronenlappen ist oft erheblich größer als die beiden seitlichen. Die beiden obersten sind oft ⅓ kleiner als die unteren. Im Röhrenteile ist die Corolle dick-fleischig.
Die 5 Stamina sind der Corolle etwas oberhalb der Röhre eingefügt. Sie alternieren mit den Lappen. Sie setzen die Zygomorphie der Corolle in verstärkter Weise fort: die drei oberen sind anders ausgebildet als die zwei unteren. Die drei oberen sind c. 6 mm lang; sie besitzen eine nierenförmige, dem Filament quer aufgesetzte, mit Gipfelspalten aufspringende Anthere und sind von der Mitte an bis zur Spitze des Filamentes so dicht mit langen Haaren besetzt, daß man bei Betrachtung der frischen Blüte von oben den ganzen Schlund von einem Haarfilz erfüllt sieht. Sie dienen also gewissermaßen als Signal für das die Blüte besuchende Insekt, daß weiter unten in der Blüte nichts zu holen ist und weisen es auf die lebhaft roten Antheren hin. Die Haare sollen, nach HERM. MÜLLER, neben dem roten Pollen als Anlockungsmittel der Insekten dienen. «Vielleicht», bemerkt A. MEYER, «scheiden sie irgend einen genießbaren Stoff aus, oder sind selbst eine gute Nahrung». Beobachtungen TUNMANNS sprechen dagegen: es fanden sich niemals abgefressene Haare. So bleiben den Bienen, denn diese sind die hauptsächlichsten Besucher der Königskerze, da auch Nektarien fehlen, nur die roten Pollenkörner, und diese sind es denn auch, welche sie sammeln und als Futter für die Brut verwenden. Die Verbascumblüte gehört zu den «Pollenblüten». Die zwei unteren Stamina sind etwa 10 mm lang, meist ganz unbehaart und tragen die 3–4 mm lange Anthere an der inneren Seite der Spitze des Filamentes. Sie ist mit ihm ein Stück weit verwachsen. So verschieden aber auch ihr Bau von dem der behaarten Stamina ist: der Querschnitt durch die Anthere der langen sieht fast ganz gleich aus wie der Längsschnitt durch die Anthere der kurzen (vgl. den Anatom. Atlas).
Der Fruchtknoten ist eiförmig, etwa 2 mm lang, zweifächerig. Der Griffel ist nur an der Basis behaart, c. 12 mm lang. Die ungleich-großen Narbenschenkel sind nur undeutlich voneinander gesondert. Die Narbenpapillenschicht läuft ein Stück weit am Griffel herab. Die wandspaltig aufspringende Kapsel ist bis 1 cm lang und 8 mm breit. Die Samen sind zylindrisch. Der in Endosperm eingebettete Embryo ist gerade.
Die Droge besteht nur aus der Blumenkrone mit den ansitzenden Staubfäden.
V. phlomoides ist über ganz Mittel- und Südeuropa verbreitet. Sie wächst von Frankreich bis Dänemark und Rußland, von Spanien und Italien bis zur Krim, im Himalaya von Kaschmir bis West-Tibet. V. thapsiforme geht nicht so weit nach dem Süden und findet sich besonders in Mitteleuropa. V. phlomoides ist viel seltener als V. thapsiforme. Beide finden sich oft in derselben Gegend. Beide bilden zahlreiche Bastarde (vgl. PABST-KÖHLER, Medizinalpflanzen). Sie bevorzugen bei uns Wegränder, trockene Hügel und Haiden, sowie steinige, unbebaute Orte und lichte Waldplätze. Sie blühen von Anfang Juli bis Mitte Oktober.
Lit. SCHRADER, Monogr. generis Verbasci. Göttingen 1813/23. — FRANCHET, Étude sur les Verbascum de la France et de l’Europe centrale. Vendôme 1875. — Abbild. von V. thapsiforme in BERG-SCHMIDT Atlas. 2. Aufl. Taf. 26 (dort auch die florist. Lit.); von V. phlomoides in PABST-KÖHLER, Medizinalpfl. Taf. 45. — EICHLER, Blütendiagramme. — WYDLER, Flora 1851, 411. — A. MEYER, Drogenkunde. — HERM. MÜLLER, Befruchtung d. Blumen 1877, 272. — KERNER, Pflanzenleben. — TUNMANN (s. unten). — LAVADOUX (s. unten).
[S. 19]
Pathologie. Auf Verbascum kommen verschiedene Parasiten vor, wie Peronospora sordida BERK., Erysiphe Cichoracearum (DC.), Uromyces Scrophulariae (DC.) und andere, doch dürften dieselben für die Blüten keine Bedeutung besitzen (ED. FISCHER).
Über die tierischen Schädlinge berichtet ISRAEL:
1. Käfer. Bruchus marginellus FABR. Larve in den Blütenknospen von Verbascumarten. Cionus scrophulariae L., Cionus verbasci FB. Larven skelettierend auf Scrophularia- und Verbascumarten. Gymnetron teter. FB. Larve an den Blüten und Blättern von Antirrhinum- und Verbascumarten. Gymnetron thapsicola GERM. In Süd- und Mitteldeutschland auf Verbascumarten. Clytus verbasci FABR. Käfer, häufig an Verbascumblüten; ob die Larve in den Stengeln von Verbascumarten lebt, erscheint fraglich. Longitarsus verbasci PANZ. Larve meist in langgeschlängelten Blattminen in den Blättern von Verbascum Thapsus und phlomoides.
2. Schmetterlinge. Melitaea trivia W. V., Raupe, in Süddeutschland an Verbascum Thapsus und anderen Verbascumarten. Gortyna flavago HB. Die Raupe lebt in den markigen Stengeln vieler Pflanzen, auch in Verbascumarten. Cucullia verbasci L., Cucullia scrophulariae W. V. Die schönen Raupen dieser Falter leben von den Blättern, Blüten, Knospen und Samenkapseln der Verbascum- und Scrophulariaarten. Cucullia thapsiphaga TR. Die Raupe dieses seltenen Falters lebt ebenfalls an Verbascumarten. Polia xanthomista HÜBN., Raupe an Verbascum- und Silenearten. Acronycta euphorbiae W. V. Raupe an Plantago-, Euphorbia- und Verbascumarten. Außer diesen leben an Verbascumarten noch eine große Anzahl polyphager Eulenraupen.
Kultur und Einsammlung. Verbascumarten werden in den Bauerngärten Deutschlands, Österreichs und der Schweiz kultiviert, die sogar hier und da an Drogisten liefern, und sind auch meist ein Bestandteil der Apothekengärten (I, S. 50). Als besondere Kulturorte in Deutschland seien genannt: Horb (Württemberg), Neudorf (Bruchsal), Schweinfurt (Schwebheim, Räthlein), Aken (a. d. Elbe), Ballenstedt (a. Harz), Blaubeuren, Schwarzenfeld (Nabburg), Sonderburg (Alsen). Vgl. I, S. 63.
In Ungarn werden die Blüten von V. phlomoides von wildwachsenden Pflanzen in größerem Maßstabe gesammelt (B. PÁTER), stammen aber auch aus Kulturen. Auch Österreich exportiert Flos Verbasci. Oberösterreich kultiviert die Pflanzen in größerer Menge. In Rußland produziert das Gouvernement Poltawa Flos Verb. russic. Im Gouvernement Moskau werden die Blüten von wildwachsenden Pflanzen gesammelt.
Man sammelt nur die Blumenkrone samt den ihr inserierten Staubfäden im Juli und August an sonnigen Tagen bei trockenem Wetter und trocknet rasch an der Sonne, oder in dünner Schicht ausgebreitet bei künstlicher Wärme, die 30–35° nicht überschreiten sollte, unter Absaugung des Wasserdampfes, jedenfalls bei guter Lüftung. Sonst werden sie (durch Oxydasen) braun. Blüten, deren Enzyme abgetötet wurden, bewahren ihre Farbe (PERROT und GORIS). Da die Blüten leicht Wasser anziehen, bewahrt man sie über Kalk auf. Auch vor Licht sind sie zu schützen. Die Haare werden abgesiebt. 7–8 Teile frische Blüten geben 1 Teil trockene.
Anatomie der Blüte. Im Röhrenteile ist die Corolle außen und innen kahl und glänzend, unten fast farblos, oben gelb. Die Epidermiszellen der Ober- und Unterseite sind etwas palissadenartig gestreckt (Fig. 4). Die Cuticula der Ober- (Innen-) Seite ist wellig gefaltet. Die Epidermen beider Blattseiten (und nur diese) enthalten neben kleinen gelblichen Chromatophoren einen gelben Zellsaft. Der Farbstoff (α-Anthoxanthin) ist in Wasser und Alkohol löslich. Die Epidermiszellen beider Seiten führen, der Außenseite genähert, einen kleinen hellen, stark lichtbrechenden Tropfen (Fig. 4 tro), der sich nicht in Chloral, Essigsäure, Kali oder Alkohol, wohl aber in Salzsäure und Schwefelsäure löst und sich mit Osmiumsäure[S. 20] nicht färbt. Diese Tropfen bedingen den eigenartigen Glanz der Blätter, den KERNER fälschlich als durch (aus Spaltöffnungen hervortretenden) Nektar hervorgebracht ansah. Er verwechselte die glänzenden Epidermiszellen mit Honigtröpfchen. Nektarien finden sich nicht. Die Blattunter-(Außen-)Seite ist durch zahlreiche Etagen-Sternhaare (Büschelhaare) dickfilzig. Diese Sternhaare besitzen 2–3 Etagen. Der Spitzenstern ist 3–6-, die Etagensterne 3–5strahlig.
Das Mesophyll ist im Röhrenteile der Blüte ziemlich mächtig, wird aber in den Kronenlappen wenigschichtig. Es besteht aus einem zartwandigen, bisweilen ziemlich reich durchlüfteten, daher in der Droge weiß erscheinenden Parenchym, dessen Zellen oft noch mit dem Chromatophor verbundene Stärkekörner enthalten. In das Gewebe eingebettet findet man da und dort rundliche oder gestreckte Sekretzellen mit verkorkter Wand, die, in eine homoge oder von zarten Fäden durchzogene Masse eingebettet, sehr kleine Tröpfchen enthalten, die durch Osmiumsäure sich schwärzen und wohl ätherisches Öl sind. Die Kronenröhre ist von 30 Bündeln durchzogen, fünf davon treten in die Filamente der Stamina, je fünf in je einen der Kronenzipfel, sich hier reich verzweigend.
In der Epidermis der Filamente finden sich neben gelbem Zellsaft wulstige rote Chromatophoren (Fig. 5 chro), die durch Schwefelsäure gelb werden, während sich der Zellsaft bläulich färbt. Die Haare der drei oberen Stamina sind ziemlich lang, bleiben aber trotzdem einzellig. Sie sind an der Spitze keulenförmig und zeigen auf der Oberfläche zahlreiche derbe, oft in Reihen angeordnete Cuticularwärzchen (Fig. 5, 2). In der Droge sind sie oft bandartig zusammengefallen oder gedreht. Bisweilen schon in der Droge, besser bei Blüten, die frisch in Alkohol eingelegt wurden, findet man in diesen Haaren eigenartige Sphärokristalle. Dieselben wurden von den früheren Beobachtern ziemlich übereinstimmend für Zucker gehalten. Nach TUNMANNs Ansicht sind sie Hesperidin (s. weiter unten), resp. ein zur Hesperidingruppe gehöriger Körper.
Verbascum thapsiforme.
1. Querschnitt durch die Kronenröhre an der Basis der Corolle. 2. Querschnitt durch einen Kronenlappen am oberen Teil der Corolle. 3. Flächenansicht der Epidermis der Oberseite der Corolle. 4. Flächenansicht der Unterseite der Corolle.
[Nach Tschirch-Oesterle.]
Die Pollenkörner sind rundlich, besitzen eine stäbchenführende Exine, die diese feinpunktiert erscheinen lässt und drei Austrittsstellen für den Pollenschlauch.[S. 21] Sie sind meist mit Tropfen eines roten Öles so stark bedeckt, daß die aufgesprungenen Antheren orangerot erscheinen.
Ähnliche von einigen Autoren auch für Hesperidin gehaltene Sphaerokristalle, wie oben bei den Staubfadenhaaren erwähnt, finden sich außer bei den übrigen Verbascumarten mit weißen Filamenthaaren (LAVADOUX), in allen grünen Teilen von Scrophularia nodosa (VOGL 1896), bei allen Citrusarten, wenn man die frischen Organe einige Zeit in Alkohol legt (SACHS, PFEFFER, TSCHIRCH), ferner in der Epidermis der Blätter von Lythrum salicaria, von Pilocarpus trachylobus HOLMES, P. jaborandi HOLMES, bei Ptelea trifoliata, bei Umbelliferen, z. B. Conium (MODRAKOWSKI, ADOLPH MEYER, TUNMANN, TSCHIRCH), Aethusa (AD. MEYER), Labiaten (Mentha. TSCHIRCH, Hyssopus, TUNMANN, Teucrium, Satureja MITLACHER), Fol. Buccu (FLÜCKIGER, SHIMOYAMA), den Blättern von Vicia Faba und Calamintha acinosa, in den Blumenblatthaaren von Viola tricolor L., in den Blättern von Elaeagnus angustifolia L., in Aleppogallen (HARTWICH), bei Capsella Bursa Pastoris (MIKA), bei Cocculus laurifolius (KRAUS), Solanaceen (Nicotiana, TSCHIRCH), Tilia (TUNMANN) u. and. TUNMANN hält alle diese Kristallbildungen für Körper der Hesperidingruppe. Zucker sind sie nicht. Sie lösen sich nicht in Wasser, Alkohol, Glyzerin, Äther, Chloroform, Chloral, verd. Schwefelsäure, verd. u. konz. Salz- und Salpetersäure, sehr schwer und erst nach mehrtägiger Einwirkung in heißem Anilin, Ammoniak, heißer Essigsäure. Sie sind verschieden leicht löslich in Kalk- und Barytwasser, leicht und mit gelber Farbe löslich in verd. und konz. Kali- und Natronlauge. Für Citrus ist durch TIEMANN und WILL, für Conium durch MODRAKOWSKY makrochemisch der Beweis geliefert worden, daß es sich um Hesperidin handelt.
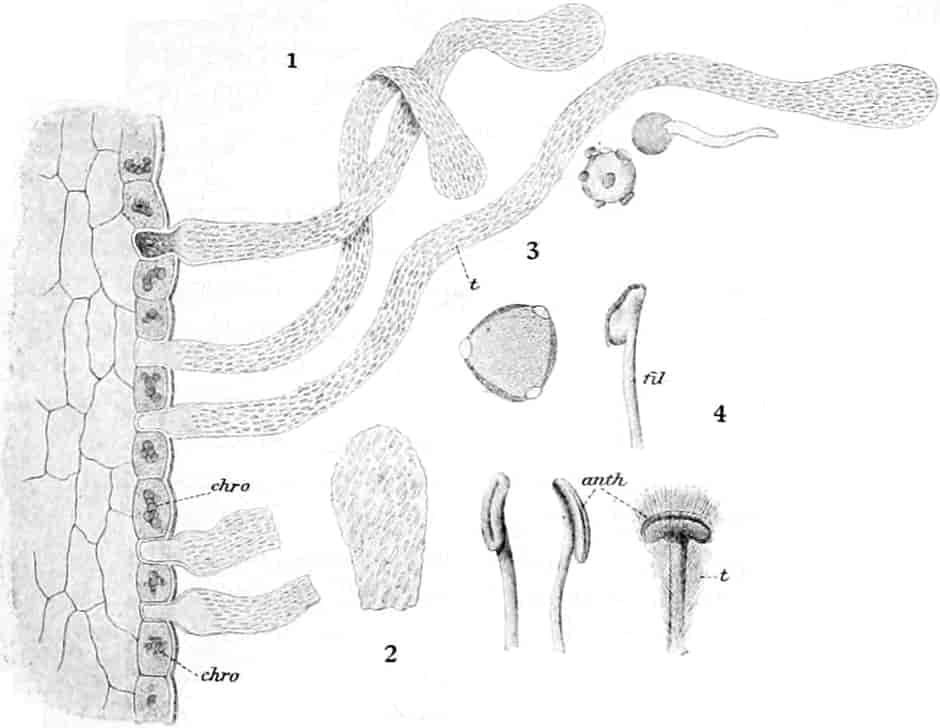
Verbascum thapsiforme.
1. Radialer Längsschnitt durch den Rand eines behaarten Filamentes mit den Staubfadenhaaren. 2. Spitze eines Staubfadenhaares. 3. Pollenkörner (oben mit ausgetriebenem Pollenschlauch). 4. Behaarte und unbehaarte Staubfäden.
[Nach Tschirch-Oesterle, Atlas.]
Lit. ARTHUR MEYER, Drogenkunde. — TSCHIRCH-OESTERLE, Anat. Atlas. — TSCHIRCH, Anatomie. — LAVADOUX, Rech. sur l’anatom. des Verbascées Thèse. Paris 1902 (dort d. Lit.). Lit. der (Hesperidin-)Kristalle: SACHS, Lehrbuch. — PFEFFER, Bot. Zeit. 1874. — MIKA, Bot. Jahresb. 1878, 20. — TSCHIRCH, Anatomie — TSCHIRCH-OESTERLE, Anatom. Atlas. — BORODIN, Sitzungsb. d. Ges. d. Naturf. Petersb. 1883. — MODRAKOWSKI, Poln. Arch. f. Biolog. u. mediz. Wissensch. 1905 (durch TUNMANN). — KRAUS, Bot. Jahresb. 1872. — TIEMANN u.[S. 22] WILL, Ber. d. chem. Ges. 1881, 946 (darin TSCHIRCH, Verbreit. d. Hesp. bei den Citrusarten). — AD. MEYER, Naturf. Ges. Halle 1882. — HARTWICH, Arch. d. Pharm. 1883. — SHIMOYAMA, Ebenda 1888. — VOGL, Pharm. Journ. 1896, 101. — MITLACHER, Zeitschr. d. österr. Apoth. Ver. 1908. - BRAEMER, Assoc. franc. avanc. d. sc. 1893. — TUNMANN, Pharm. Zeit. 1905, Zeitschr. d. österr. Apoth. Ver. 1906, Schweiz. Wochenschr. 1909. — Staubfadenhaare bei verschiedenen Verbascumarten: WESTLING, Om stådarhåren hos svenska Verbascumarter. Svensk. Farmac. tidskr. 1908.
Chemie. Die Flos verbasci enthält c. 10,5% Invertzucker (REBLING: 11%, SCHNEEGANS: 9,2–11,7%), daneben auch etwas Saccharose (SCHNEEGANS), dann Fett, Apfelsäure, Schleim und in Spuren ein flüchtiges Öl (MORIN); in der c. 4–6% (4,2–5,9 HAUKE, 4,8 FLÜCKIGER) betragenden Asche: Kalk- und Kalisalze der Phosphorsäure und Schwefelsäure, Eisen und Silicium. Ferner auch Kaliumacetat (?). In frischen Blüten fand A. MEYER nur wenig reduzierenden Zucker. JANSON fand in den Blüten von V. Thapsus: 2,49% Schleim, 11,76% Kohlehydrate auf Dextrin berechnet, 5,48% Glukose, 1,29% Saccharose, 16,76% Feuchtigkeit, 4,11% Asche und 32,75% Rohfaser.
Die Kapillaranalyse des Auszuges zeigt zu unterst eine hellgelbe Schicht, dann folgt nach oben: graugelblich — ockergelb — hellgelb — gelb — hellbraun — hellgrau. Das Spektrum des kapillaranalytisch abgetrennten gelben Hauptfarbstoffes der hellgelben Zone zeigt (mit dem Quarzspektrographen photographiert) zwei Bänder bei λ = 0,470–0,455 und λ = 0,445–0,425 µ. Die Endabsorption des Ultraviolett beginnt bei λ = 0,388 µ (TSCHIRCH, BUSS und OTTENBERG).
Der Verbascumfarbstoff gehört zur Gruppe der wasserlöslichen Anthoxanthine (α-Anthoxanthin TSCHIRCH, Anthochlor PRANTL, Xantheïn FREMY und CLOËZ). Zerfasert man ein Blumenblatt der Droge in Wasser und setzt viel Kali hinzu, so kristallisieren schöne gelbe, oft zu Rosetten vereinigte, wasserlösliche Nadeln aus (TSCHIRCH). Wäscht man dann das Präparat mit Wasser aus und läßt Schwefelsäure zufließen, so färbt sich das Gewebe erst violett, dann dauerhaft rot. Schwefelsäure allein färbt den gelben Zellsaft erst blau, dann violett, dann rot.
Hesperidin ist bis jetzt nur mikrochemisch nachgewiesen (s. oben). Es ist ein Glykosid, und zwar der Traubenzucker-Rhamnose-Äther des Hesperetins, des Phloroglucinesters der Isoferulasäure:
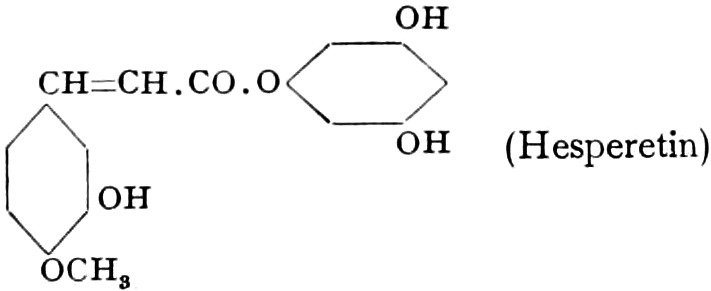
Die Verfärbung der Blüten wird durch Enzyme (bes. Oxydasen) bedingt.
In den Wurzeln von Verbascum Thapsus fand HARLAY neben reduzierendem Zucker (0,21–0,85%) Saccharose (0,21–0,73%).
Lit. REBLING, Zuckergeh. mehrer. Arzneikörper. Arch. Pharm. 1855, 11. — MORIN, Journ. chim. med. 1827, 231; Arch. Pharm. 1827, 91; Chem. Unters. d. Blumen v. V. Thapsus. — JANSON, The flowers of Verbascum Thapsus. Am. journ. pharm. 1890, 600. — SCHNEEGANS, Zuckergehalt d. Flor. verbasci, Journ. Pharm. f. Els. Lothr. 1898, 17. — PLANCHON-COLLIN, Drog. simpl. I 554. — TSCHIRCH, Vergleich. spektralanalyt. Unters. d. natürl. u. künstl. gelben Farbst. mit Hilfe d. Quarzspektrographen, Ber. d. d. Bot. Ges. 1904, 414. — BUSS, Beitr. z. Spektralanal. einig. etc. Farbstoffe, Forschungsber. 1896. — OTTENBERG, Spektralanalyt. mit d. Quarzspektrogr. vorgen. Unters. reiner u. kapillaranalyt. abgetr. Farbst. Diss. Bern 1904. — HARLAY, Journ. pharm. 1905, 49.
[S. 23]
Geruch und Geschmack. Die frischen Blüten riechen widerlich betäubend und schmecken bitterlich rettigartig. Die trockenen Blüten riechen ganz angenehm nach Honig und Veilchen und schmecken süßlich, etwas schleimig.
Verwechslungen. Die Blüten von V. Thapsus sind erheblich kleiner, mehr glockenförmig nicht flach ausgebreitet. Auch V. Lychnitis ist kleinblütig. V. nigrum hat violette Staubfadenhaare.
Geschichte. Seit undenklichen Zeiten betrachten die Irländer Flos verbasci und namentlich die frischen Blätter der Pflanze als unfehlbares Mittel gegen Phtise. Die Blätter werden übrigens auch bei Asthma geraucht.
Im Mittelalter wurden besonders Blätter und Samen benutzt. Bei SCHRÖDER (Pharm. med. chym. I, S. 890) werden die Blätter und Wurzeln, dann aber auch die Blüten erwähnt. MURRAY (I, S. 952) verwendete besonders die Blätter der Pflanze. Angebaut scheint sie damals nicht zu sein. Sie fehlt im St. Galler Klostergarten (I, S. 622) und bei MACER (I, S. 626).
HILDEGARD (I, S. 669) erwähnt sie als Wullena (Blandonia). Die mittelenglischen Medizinbücher (I, S. 683) nennen sie Moleyn. In der Alphita (I, S. 642) steht: barbastus flosmos. Hier wie bei BARTHOLOMAEUS, in Circa instans und den Tabulae (I, S. 660) auch tapsus barbatus, herba luminaria (daraus wurde dann Königskerze) flosmos, molena; bei SIMON JANUENSIS (I, S. 664) flommos vel flosmus, tapsus barbatus; im Nördlinger Register (1480): tassi barbasii; im Braunschweiger Inventar (1522) (I, S. 815): tapsus verbatus. In der Taxe von Worms 1582 steht: Flor. verbasci, Thapsi verbati, Wullkrautblum, Königkertzblumen. Vor dem XV. Jahrh. scheinen die Blüten in Deutschland nicht arzneilich benutzt worden zu sein.
Paralleldrogen. Im Süden von Europa werden die Blüten ähnlicher Verbascumarten benutzt; in Portugal: Verbascum crassifolium H. et L.; in Italien: V. densiflorum B.; in Spanien: V. macranthum H. et L. (FLÜCKIGER); in Amerika: V. Thapsus. Auch in Vorderindien wird diese Art, die im Himalaya von Kaschmir bis Bhután vorkommt und dort phúlla oder gidar tamákú (= Schakaltabak) heißt, benutzt, aber vorwiegend die Blätter und die Samen (Pharmacogr. ind.). Auch in Frankreich scheint V. Thapsus bevorzugt zu werden (PLANCHON-COLLIN).
Über die Verwendung von Verbascumarten als Fischgifte vgl. unter Saponindrogen. Die Blütenkrone kommt hierbei nicht in Betracht.
Bassiablüten.
Ein zu den Sapotaceen gehörender, im indischen Jungle häufiger Baum, Bassia latifolia (hind. Mahwá, mahulá, janglîmohvâ. sansc. madhuka, d. h. süß; oben S. 8) liefert in Indien (Wälder von Monghyr in Zentralindien und Satpurakette im Westen) pro Baum mehrere hundert (150–200) kg fleischige Blütenblätter, die bis 60 Liter Alkohol geben. Die Blütenblätter schwellen erst nach dem Verstäuben an (POISSON). Sie fallen dann von selbst ab und sind leicht zu sammeln. Sie tauchen von Zeit zu Zeit im Handel auf und gehen besonders nach Frankreich, England und Amerika. Sie schmecken sehr süß, rosinenartig. Sie enthalten nur Invertzucker (LIPPMANN), bis 50 (CASTLE and RICE) oder 63% (POISSON) und liefern (besonders in Guzerat und Radschputana) gegoren Alkohol. Obwohl die Religion den Hindus und Mohammedanern den Alkoholgenuß verbietet, wurden doch allein in Vorderindien im Jahre 1907/08 9 Mill. Gallonen Schnaps für die einheimische Bevölkerung fabriziert, vorwiegend aus Bassiablüten (Mowrah [Mahua] flowers). Es geschieht dies z. B. in Dadar und auf der Halbinsel Urann bei Bombay, wo allein 19 Destillerien liegen.
Lit. V. LIPPMANN, Ber. d. chem. Ges. 1902 (dort die Lit.). — WATTS Dictionary. — LOCKWOOD, Notes on the mahwa tree Journ. Linn. Soc. XVII, 1879. — CASTLE AND RICE, The Mahwatree New. Rem. 1879 (Bot. Jahresber. 1879, 336). — SOUBEIRAN, Journ. pharm. 1881. — POISSON, Bull. soc. bot. de France 1881. — Tropenpflanzer. 1909.
[S. 24]
γ) Früchte und Fruchtstände.
Caricae.
Syn. Feigen — fîga (althd.) — vîge, veyg (mhd.) — figues (franz.) — figs (engl.) — fichi (ital.) — vijg (holl.) — fiige (ung.) — viikuna (finn.) — die Frucht: σῦκον, der Baum: συκῆ (n.-griech.).
Die hieroglyphischen Zeichen für Feige sind auf S. 468 wiedergegeben. Die Frucht hieß tab, der Baum meist nouhi nel tab, d. h. Sykomore mit Feigen, der Feigenbaum wird auch geschrieben db (deb, deba, dab, dabei), die Feige: neh ent bet, die kleine Feige: kund — Griech. σῦκον (bei DIOSKUR.) auch συκῆ z. B. bei THEOPHRAST (τὰ ἐρινᾶ σῦκα = wilde Feigen), die unreife Feige: Olynthos (bei GALEN) — Lat. Ficus (z. B. bei PLINIUS, CELSUS) und Caprificus — tînâ, tênâ (aram.) — tîn (arab.) — teʾēnē (hebr.) — anjér (hind, bengal. pers.) — wu-hua-kuo (chines.) = Frucht ohne Blüte, wörtlich: Nicht-Blüte-Frucht.
Stammpflanze. Ficus Carica L. (Kulturfeige) bildet unzählige Kulturvarietäten (bei Neapel: leucocarpa, dottata, colombra, polymorpha, pachycarpa, deliciosa, hypoleuca GASPARINI).
SEMLER nennt folgende Spielarten: San Pedro (in Sizilien: Fico di San Pietro) in Italien und Dalmatien; braune türkische, klimahart; braune oder schwarze Ischia; weiße Ischia; Igo Breba in Spanien; Angelica; Nerii; Ottalo in Sizilien; weiße Genua; weiße Smyrna; weiße adriatische in Dalmatien, Italien und Kalifornien; Gentile in Kalifornien. Nicht alle diese Sorten eignen sich zum Dörren, einige liefern nur Tafelfeigen.
Etym. Carica (so z. B. in der Alphita, Caricae bei PLINIUS eine Sorte Feigen) nach der Landschaft Karien gegenüber Rhodos. Feige ist indirekt aus Ficus umgebildet, dies vielleicht aus συκῆ (?). Doch sind beide vielleicht semitischen Ursprungs, συκῆ von schiqmâ, Ficus von pagg abzuleiten. Feige, wie andere südeuropäische Baum- und Fruchtarten, aus dem roman.-lat. hier spez. aus dem nordital.-provenz. Figa, daraus auch frz. Figue.
Systemat. Stellung. Moraceae, Artocarpoideae-Ficeae Sect. Eusyce. Die Gattung Ficus (LINNÉ, Gen. Plant.) hat etwa 600 Arten. DRAGENDORFF führt 61 als benutzt auf. Vgl. auch MOELLER, Art. Ficus in d. Realenzykl. d. ges. Pharm. V.
Beschreibung der Stammpflanze. Die Kulturfeige ist ein großer Strauch oder ein viel verästelter Baum (Fig 6 u. 7), der 8–9 m hoch werden kann. Sie besitzt, da die Äste eigentümlich, erst nach Außen, dann nach Innen, gebogen sind, besonders wenn unbelaubt, ein sehr eigenartiges, rundlich bizarres, unheimliches Aussehn. Die unbelaubte Feige ist daher auf weite Strecken hin kenntlich. Die ziemlich großen rauhen, blaugrünen Blätter sind eigenartig gelappt, drei-fünflappig («Feigenblatt»), und wechselständig. In ihren Achseln entstehen eigenartige krugförmige Receptacula, deren Innenwand von den Blüten ausgekleidet ist und die oben ein Ostiolum (Auge) besitzen. Diese Blütenstände entwickeln sich zur «Feige», die also keine Frucht, sondern ein Fruchtstand ist. Da man die Blüten von außen nicht sieht, hat der Chinese die Feige «Frucht ohne Blüte» genannt (s. oben) und auch ALBERTUS MAGNUS sagt: «fructum autem profert sine flore». Die Cauliflorie der Feige, die schon PLINIUS erwähnt, ist auch hier wie bei vielen tropischen Ficusarten zu finden (Fig. 7). Oft sieht man am Stamm und den dickeren Ästen zahlreiche Fruchtstände dicht beieinander aus der Rinde hervortreten. Alle Teile sind von ungegliederten Milchröhren durchzogen.
Nachdem sich die Ansicht von SOLMS, daß der wilde Feigenbaum (Caprificus, ἐρίνεος, Caprifico, Profico) und die Kulturfeige (Ficus, σῦκον), die beide schon im Altertum gut voneinander unterschieden wurden, als zwei verschiedene Rassen zu betrachten seien, von denen die Kulturfeige aus der wilden Feige hervorgegangen sei, als irrig erwiesen hatte, nimmt man jetzt auf Grund der Beobachtungen[S. 25] von FRITZ MÜLLER an den Feigen Südamerikas allgemein an (und auch SOLMS stimmt dem jetzt bei), daß, wie schon LINNÉ wollte, der Caprificus die männliche, die Kulturfeige die weibliche Feige darstellt. Der Caprificus ist durch völlige Sterilität zweier Blütengenerationen und sehr dürftigen Samenertrag der dritten infolge von Bildung sog. Gallenblüten fast rein männlich, die Kulturfeige durch Fehlen der männlichen Blüten rein weiblich. Die Befruchtung wird durch die Feigeninsekten vermittelt, von denen namentlich Blastophaga grossorum GRAVENHORST (Cynips Psenes L.) eine Chalcidide, und zwar das weibliche Tier als Inquilin fungiert und den Pollen überträgt. Die Gallenblüten (SOLMS) entstehen dadurch, daß die weibliche Blastophaga durch den hier kurzen Griffel in den Fruchtknoten ein Ei legt (GASPARINI). Die Inquilinen kommen also nur in den kurzgriffligen Gallenblüten auf den männlichen Pflanzen zur Entwicklung, finden beim Verlassen der Feige reifen Pollen vor und tragen denselben in die weiblichen Feigen der weiblichen Pflanzen, in denen sie natürlich, da die Blüten hier langgrifflig sind, nur die Befruchtung vollziehen, ohne daselbst Eier ablegen zu können.

Ficus Carica belaubt.
[Nach Hamilton.]
Die überwinternden «Mamme» des Caprificus enthalten nur weibliche Gallenblüten,[S. 26] und demnach die überwinternde Generation der Blastophaga, die sich später entwickelnden Profichi dagegen in den unteren Zweidritteln Gallenblüten für die Inquilinengenerationen, im oberen Drittel in der Nähe der Mündung zahlreiche, monatelang Pollen erzeugende männliche Staubblüten. Innerhalb der Infloreszenz des Caprificus herrscht proterogynische Dichogamie (GASPARINI).
Da nun die Pollenreife der Staubblüten des Caprificus und die Konzeptionsfähigkeit der Narben der weiblichen Blüten der Kulturfeige zusammenfällt, ist eine Befruchtung der letzteren durch Vermittelung der Insekten gesichert.

Ein kleinasiatischer Feigenbaum kurz vor der Ernte.
[W. Tiedemann phot.]
Aber es kommt bei der Feige weniger auf die Befruchtung der Blüten als auf die Ausbildung der fleischigen Receptaculums an. Beides scheint bei der Kulturfeige nicht in direkter Beziehung zueinander zu stehen (CAVOLINI), wie ja auch bei vielen Obstsorten Samenbildung und Fruchtentwicklung unabhängig voneinander ist. Wir kennen ja kernloses Obst. Immerhin findet man in den Handelsfeigen so gut wie immer ausgebildete Samen; von dem Tiere allerdings nur sehr selten eine Spur. Es wird zwar angegeben, daß die Weibchen der Blastophaga, nachdem sie sich den Weg durch das Ostiolum mit vieler Mühe, oft unter Zurücklassung der Flügel, gebahnt, den Krug der Infloreszenz nicht wieder verlassen, da sie den Rückweg wegen der nach Innen gerichteten Schuppen des Ostiolumrandes nicht antreten können. Das kann aber nicht richtig sein. Sie müssen in der Mehrzahl der Fälle wieder ausschwärmen, denn in den Handelsfeigen findet man sie in der Regel nicht vor. Ich habe viele Feigen untersucht und nie ein Insekt oder Reste desselben darin gefunden.
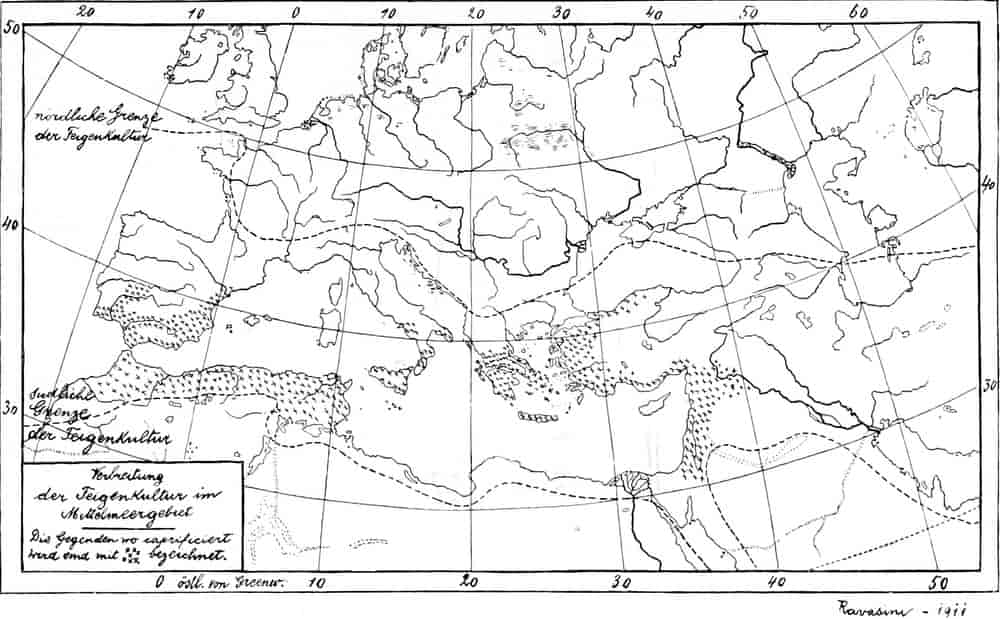
Erklärung der Zeichen: —— Wege der Insekten. ······· Pollenübertragung.
 eßbare Fruchtstände.
eßbare Fruchtstände.  männliche Blüten.
männliche Blüten.  weibliche Blüten.
weibliche Blüten.  Gallenblüten.
Gallenblüten.  sterile weibliche Blüten. (
sterile weibliche Blüten. ( ) vereinzelte weibliche Blüten. (
) vereinzelte weibliche Blüten. (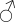 ) vereinzelte männliche Blüten.
) vereinzelte männliche Blüten.[Aus Ravasini, Die Feigenbäume Italiens, Bern 1911.]
Für das Gelingen der Befruchtung scheint die Kaprifikation (ἐρινίασμα),[S. 27] d. h. das Einhängen von blühenden Caprificuszweigen bzw. Kränzen in die Krone der Kulturfeige (oder Zwischenpflanzen von Caprificus) nicht erforderlich zu sein, obwohl dieselbe noch jetzt in Algerien, Tripolis, Syrien, Kleinasien, Griechenland und den griechischen Inseln, Malta, Sicilien, einem Teile von Unteritalien, besonders Neapel, Calabrien z. T. (Catanzaro), in Spanien (Andalusien, Valencia, Estremadura, Murcia) und Süd-Portugal geübt wird. Denn die Länder, die sie nicht oder nicht mehr üben — Ägypten, Mittel- und Norditalien, Sardinien, Corsica, Nordspanien, Südfrankreich, Tirol, die Canaren und Azoren — erzeugen nicht minder gute und nicht weniger Feigen, doch scheint sie bei einigen Kulturrassen nötig, wie Versuche in Kalifornien gelehrt haben.
Die Kaprifikation ist sehr alt und wohl eine Erfindung der Semiten Syriens und Arabiens. Die beiden üblichen Formen schildert schon PLINIUS. «Man setzt daher den Caprificus, den wilden Feigenbaum, dahin, wo der Wind nach den Feigengärten zieht, damit derselbe die ausfliegenden Insekten auf die Feigenbäume bringe. Noch ein anderes Mittel hat man ausfindig gemacht; man legt nämlich jene, wenn man sie anderswoher bringt, zusammengebunden auf den zahmen Baum». Auch THEOPHRAST (die wesentliche Quelle des PLINIUS) bespricht die Kaprifikation bereits. Beiden ist eine Beziehung zu den Insekten bereits klar; ebenso dem ARISTOTELES. Doch erkannte erst LINNÉ 1744 die Bedeutung der Insekten für die Fortpflanzung und die Bildung reifer Samen bei Ficus (hier lange vor SPRENGEL!).
SOLMS meint, daß die Kaprifikation «eine in längst vergangenen Zeiten notwendig gewesene, jetzt kaum mehr nützliche, durch die lebendige Überlieferung von Generation zu Generation bis zum heutigen Tage in gleicher Form konservierte gärtnerische Operation» sei.
Ob bei Ficus Carica nicht auch Parthenogenese stattfindet, bleibt zu untersuchen. Sie erscheint möglich, da z. B. bei Ficus Roxburghii weder ein Eiapparat noch Antipoden normal entwickelt werden und der Embryo aus dem Nucellargewebe entsteht (CUNNIGHAM). Die Sache ist nicht schwer zu entscheiden. Man braucht ja nur unreife Feigen in einen gut schließenden Gazebeutel einzuschließen, darin reifen zu lassen und zu untersuchen ob auch dann reife Früchte gebildet werden.
Eine andere Operation ist das Ölen, das ogliazione der Italiener, das Verschmieren des Ostiolums mit Öl — man bringt mit einem Strohhalm einen Tropfen Olivenöl auf das Ostiolum —. Es war bereits den alten Juden und auch dem THEOPHRAST bekannt. Es wird noch heute in Italien, Syrien, Spanien und der Provence geübt und bringt die Fruchtstände früher zur Reife.
Lit. MIQUEL, Prod. Monogr. ficuum. Hookers London Journ. of Bot. VII. — GASPARINI (Publikationen meist in der Acad. di Napoli) und CAVOLINI Opuscoli (beide zitiert bei SOLMS). — TOURNEFORT (I, S. 905). — Graf SOLMS-LAUBACH, Die Herkunft, Domestikation und Verbreitung des gewöhnlichen Feigenbaumes. Abhandl. d. Göttinger Ges. d. Wissenschaft. 28. 1881 (auch separat 1882). Dort die Literatur. Ferner: Die Geschlechterdifferenzierung bei den Feigenbäumen. Bot. Zeit. 1885 (Ref. in Bot. Jahresber.). — TREUB, D. weibl. Organ u. d. Embryogenese bei Fic. hirta. Ann. jard. bot. Buitenz. 1902. — FRITZ MÜLLER, Caprificus und Feigenbaum. Kosmos XI, 1882 (Ref. Bot. Jahresber.) — KING, Observ. on the genus Ficus Journ. Linn. Soc. 24 u. Ann. roy. bot. gard. Calcutta 1887. — SCHWEINFURTH, Bull. de l’Herbier Boissier 1896. — WESTWOOD, Descript. of the insects infest. the seeds of Ficus Carica Transact. Entomol. Soc. 1882. — G. MAYR, Feigeninsekten. Zool. Bot. Ges. Wien 1885 (Ref. in Bot. Jahresb.). — P. MAYER, Zur Naturgesch. d. Feigeninsekt. Mitt. Zool. Stat. Neapel III 1882. — MAYER u. FRITZ MÜLLER, Zur Naturgesch. d. Feigeninsekt. Kosmos XII. Ref. Bot. Jahresber. — TSCHIRCH und OESTERLE, Anatom. Atlas. — HEHN, Kulturpfl. u. Haust. — CUNNIGHAM, Rundschau 1900, XV. 51. — Abbildungen in BERG-SCHMIDT, Atlas. Erste Auflage, BENTLEY-TRIMEN, Medicinal plants und in ZIPPEL-BOLLMANN, Wandtafeln.
Pathologie. Über die pflanzlichen Schädlinge der Feige berichtet Prof. ED. FISCHER: Unter den Pilzen, welche die Fruchtstände der Feige befallen und zerstören, sind besonders folgende Arten zu nennen:
[S. 28]
Colletotrichum Carica STEVENS et HALL. (Zeitschrift für Pflanzenkrankheiten XIX 1909, p. 65); bringt die Fruchtstände zum Faulen und vorzeitigem Abfallen.
Cercospora Bolleana (THÜM.) tritt auf Blättern und Fruchtständen auf, letztere zu vorzeitigem Abfallen bringend.
Auch eine Botrytis ist beobachtet worden, welche die Fruchtstände durchwuchert, hier ihre Conidien bildet und sich von da auf die Zweige verbreitet.
Das Fruchtfleisch reifer Feigen des Handels ist zuweilen von einer schwarzen, etwas schmierigen Sporenmasse durchsetzt, die einem Pilze angehört, welchen REICHARDT (Verhandl. zoolog. botan. Gesellsch. Wien XVII 1867) für eine Ustilaginee angesehen und Ustilago Ficuum genannt hatte. HENNINGS (Hedwigia XXXIV 1895) zeigte jedoch, daß es sich um eine Aspergillacee handelt, die Sterigmatocystis Ficuum (REICH.) P. HENN. heißen muß.
Vorkommen und Kultur. SCHWEINFURTH hält die noch jetzt in Südarabien und Nordabyssinien vorkommende Ficus palmata FORSK. (F. pseudocarica HOCHST.) für die Stammform, aus der die Kulturfeige entstand. Die Urheimat der Feige sucht SOLMS in Südarabien. Von dort wird sie dann nach Idumaea, Coelesyrien und Syrien, sowie nach Babylonien und Ägypten gebracht und dort domestiziert worden sein. Ficus Carica existierte aber bereits in der Quartär- und Diluvial-Periode im westlichen Teile des Mediterrangebietes. Ein Ficus findet sich sogar in der Kreide Grönlands. «Sie hat sich schon in vorhistorischen Zeiten von Osten nach Westen verbreitet, als sie noch nicht Kulturpflanze geworden war» (HEHN). In frühgeschichtlicher Zeit war die Kultur der Feige wohl auf Syrien, Ägypten, Arabien und Babylonien beschränkt. Die Feigenkultur erstreckte sich dann später vom nordwestlichen Indien und den ostarabischen Steppen über die Länder am Caspimeer, das obere und mittlere Mesopotamien, Syrien, Palästina und Kleinasien. Durch Kultur ist die Feige dann (s. Geschichte) wohl durch die Semiten Syriens über das ganze Mittelmeergebiet verbreitet worden, hat dann später die Alpen überschritten und ist bis nach England vorgedrungen. Am Südrande der Schweizer Seen, in Südtirol und in der Provence hält sie an geschützten Stellen über Winter aus, ebenso in Südengland und den Inseln des Kanals. Auch in China, Nordwest-Indien, Dekkan, Beludschistan, Kalifornien, Canada, Mexiko und Chile wird sie jetzt kultiviert; in Kalifornien seit 1901 in steigender Menge. Ausgedehnteste Feigenkulturen finden sich in Kleinasien im Distrikt Aidin am Menderes Tehay (Mäander), große Feigengärten auch bei Ayazlúk (Ephesus). Sehr gute gedeihen bei Yenishehír (südöstlich von Isnik-Gölii), am Sabándja-See und am Golf von Ismid, sowie bei Anádoli-Kavák am Bosporus; ferner vom unteren Kyzyl Yrmák ab östlich, vorzüglich bei Trapezunt, endlich bei Malátia (SEMLER). Brasilien kultiviert von den Feigen besonders Fig blanc, albicone, napolitai und negretto. Vgl. auch Handelssorten.
Die Feige gehört in das Mediterrane Drogenreich (I, S. 441). Sie ist ein ausgesprochen subtropisches Gewächs. In den Tropen kultivierte Bäume liefern weniger gute Früchte.
Lit. RITTER, Erdkunde von Asien VII. Berlin 1844. — HEHN a. a. O. (dort weitere Literatur). — SOLMS a. a. O. — BUSCHAN, Vorgeschichtl. Botan. 1895. — SEMLER, Trop. Agrikultur.
Einsammlung. In der Achsel der Blätter entwickeln sich an vorjährigen Trieben schon zu Ende des Winters, meist vereinzelt, die im Juni reifenden Frühfeigen (Grossi, Profichi, Orni). Später kommen dann in den unteren Blattachseln die Sommerfeigen (Forniti, Mammoni). Sie entwickeln sich im August und reifen im November. Und schließlich kommen die über den Winter dauernden, in April-Mai[S. 29] des nächsten Jahres reifenden Spätfeigen (Cratiri, Mamme) zur Reife. Die Feigen werden meist an der Luft und Sonne auf Horden getrocknet.
Die Feige bleibt bis zur Vollreife am Baum. Das «Dörren» muß sehr sorgfältig, entweder an der Sonne oder in eigenen Dörrapparaten bei 40–50° erfolgen. SEMLER empfiehlt die Feigen vor dem «Dörren» kurze Zeit in eine Pottaschelösung (1 : 14) zu tauchen, um ihre Haut geschmeidiger zu machen. Das Pressen der Feigen geschieht in eigenen, sehr einfachen Pressen. Gepreßte Feigen haben einen höheren Preis. Sie sind weniger den tierischen Feinden ausgesetzt.
Lit. ROSSI, Sulla prod. d. fichi secchi in Italia. Ann. scol. sup. d’agricolt. Portici Napoli 1881. — SEMLER a. a. O.
Handelssorten und Verpackung. Schon im Altertum kannte man viele Sorten. Vorzügliche Feigen lieferte Caunus, nordöstlich von Rhodus, und Caria (Karien) im Südwesten Kleinasiens, woher noch heute Feigen und wie damals in Holzschachteln zu uns kommen. Dann waren auch die attischen berühmt. PLINIUS erwähnt lydische, afrikanische (Ruspina), alexandrinische, rhodische, tiburtinische, herkulanische, chalcidische Feigen, und auch solche, die nach LIVIUS und POMPEIUS benannt waren, sowie Feigen von der Insel Ebusus und den Marrucinen, im ganzen 29 Sorten. In der Tariffa des PASI (1540, I, S. 703) werden Fighi di Schiavonia, di Levante, di Italia und del Ponente erwähnt.

Ankunft eines kleinasiatischen Feigentransportes aus dem Innern des Landes auf der Station.
[W. Tiedemann phot.]
Die besten aber nicht sehr haltbaren Feigen des heutigen Handels sind die Smyrnafeigen (türkische Feigen), die aus Kleinasien, besonders aus der Ebene von Aidin, Innovasi, Nasli, Sultan Hissar stammen und aus Smyrna exportiert werden. Sie sind groß, plattgedrückt rund, sehr süß, von Honiggeschmack und haben eine[S. 30] dünne gelbliche Haut. Man unterscheidet drei Untersorten: Eleme [ellémé (türk.) = von Hand gepflückt] und Erbegli (Erbeili) — beide in runden Holztrommeln, Schachteln (Schachtelfeigen) oder Kistchen mit Lorbeerblättern bedeckt — und Roba mercantile in Fässern, locker, ungepreßt. Die Feige ist die vornehmste Quelle des Reichtums von Smyrna, das den Feigenhandel beherrscht. 1901 betrug der Export 20 Mill. kg.
Die im Innern Kleinasiens geernteten und am Produktionsorte getrockneten Feigen werden in Säcken verpackt, auf den Rücken der Kamele zur nächsten Bahnstation der kleinasiatischen Bahnen (Fig. 8) und von dort nach Smyrna gebracht, das Hauptstapelplatz und Ausfuhrhafen für die kleinasiatischen Feigen ist. Hier werden sie gewogen, gereinigt und sortiert, gewisse Sorten auch mit gepulvertem Fruchtzucker bestreut.
Die kleineren griechischen Feigen (Fraccazani, Corfu) sind weniger süß, derbhäutiger und haltbarer. Sie werden besonders von Kalamata, am Meerbusen von Messenien, von Andros und Syros exportiert und kommen entweder als Kranz- oder Moreafeigen, Caricae in coronis — gepreßt und auf Cyperushalme oder Bastschnüre gezogen — oder locker in Fässer gepackt in den Handel.
Die italienischen Feigen werden meist lose in Körbchen versandt (Korbfeigen). Man unterscheidet: Neapolitaner, Calabrische, aus Cosenza (in Calabria citeriore), Sicilianische, Puglieser und Genueser Feigen. Sie sind kleiner und weicher als die griechischen, aber weniger haltbar.
Die türkischen, griechischen und italienischen Feigen kommen meist über Triest und Fiume.
Die Tiroler Feigen stammen aus Südtirol (Trient, Rovereto). Nach dem Packmaterial — Lorbeer- oder Rosmarinblätter — heißen sie Lorbeer-, Laub- oder Rosmarin-Feigen. Die Dalmatiner, Istrianer oder Triester Feigen in Fässern sind sehr süß, aber nicht haltbar (Faßfeigen).
Die südfranzösischen, spanischen und portugiesischen Feigen sind den kalabrischen ähnlich und kommen meist über Hamburg. Marseille liefert viel Feigen, etwa von der Größe der Cosenzafeigen.
Die Türkei und Griechenland exportierten 1907: 30 Mill. kg Feigen im Werte von 90 Mill. Piaster (Griechenland allein: 14 Mill.), Italien im gleichen Zeitraum 14 Mill. kg, Spanien 1906: 4 Mill. kg.
Gehandelt werden die türkischen Feigen in Smyrna und Stambul, die italienischen in Catania, Bari und Genua, die griechischen in Patras.
Einfuhrhäfen sind besonders Marseille, London und Triest, ein Hauptpunkt des Feigenhandels.
Die in Vorderindien gezogenen Feigen werden nicht exportiert. Sie sind weniger gut als die Mittelmeerfeigen.
Die ägyptischen Feigen (Eselsfeigen, Pharaofeigen, Adamsfeigen) sind die walnußgroßen Fruchtstände der Sycomore (Ficus Sycomorus L.). Sie kommen aus Ägypten und Palästina.
Die indische Feige ist keine Feige, sondern die Frucht von Opuntia vulgaris MILLER (Opuntia Ficus indica). Die Paradiesfeigen sind Bananen.
Lit. J. MOELLER, in Realenzyklop. d. ges. Ph. III. — FLÜCKIGER, Pharmakogn. u. and.
Die Einfuhr an Feigen in Hamburg betrug in Doppelzentner (dz) 1906: 32226, 1907: 21770, 1908: 27966. Die meisten des Jahres 1908 stammten aus Kleinasien (15886 dz), dann[S. 31] folgt Griechenland und die Jonischen Inseln (5600) und Spanien (4689). Weniger kamen aus Triest, Algier und Italien, unbedeutende Mengen aus Frankreich, Arabien, den Verein. Staaten und der europäischen Türkei sowie den russischen Ostseehäfen. 1909 importierte Deutschland: 73594 dz. Feigen, vorwiegend aus Griechenland und der Asiat. Türkei, dann aus Italien, Algerien und Spanien. Die Vereinigten Staaten von Nordamerika führten 1909: 15235513 Pounds Feigen ein, vornehmlich (c. 13 Mill.) aus Kleinasien und (c. 1 Mill.) aus Griechenland. Italien exportierte Fichi 1907: 142511, 1908: 164417, 1909: 183953 Quint.
Ficus Carica.
Längsschnitt durch einen Fruchtstand und weibliche Blüte.
[Nach Tschirch-Oesterle, Anatom. Atlas.]
Morphologie und Entwicklung der Droge. Die Fruchtstände der Feige entstehen im typischen Falle zu zweit in der Achsel eines Laubblattes als seitliche Bildungen an der axillaren Laubknospe (Anatom. Atlas Taf. 28, Fig. 1 u. 17). Sie sind zunächst von der hinfälligen Stipulartute des Tragblattes umhüllt. Für gewöhnlich wird jedoch nur ein Fruchtstand entwickelt und der zweite verharrt im Stadium einer kurzen Knospe. Jeder Fruchtstand wird von einem Involukrum behüllt, das an der Basis der reifen Feige noch gut erhalten ist und aus drei schuppenartigen Blättern besteht: dem Vorblatt des Achselknöspchens und den Vorblättern des Blütenstandes. Der Blütenstand wird als eine flache Schale angelegt, an deren Rande schuppenartige Blättchen sitzen, Bildungen aus denen später die Schuppen werden, mit denen das Ostiolum verschlossen wird, und an deren Boden sich die Blütenanlagen finden. Mit fortschreitender Entwicklung wird die Schale immer tiefer und endlich zum Kruge (Receptaculum, Hypanthium, Frucht- oder Blütenboden). Dieser besitzt an seiner Spitze ein nicht ganz in der Mitte angeordnetes Ostiolum, das solange die Feige unreif ist von Schuppen geschlossen ist, deren äußerste schopfartig nach oben gerichtet sind, um die Insekten zunächst vom Besuche abzuhalten. In diesem Stadium ist die junge Feige noch ziemlich rundlich und grün. Sie milcht stark, wenn man sie verletzt, schmeckt widerlich und riecht unangenehm. Das derbe weiße Gewebe des Receptaculums enthält Stärke. Die die ganze Innenwand des Kruges auskleidenden Blüten sind bei der Kulturfeige für gewöhnlich rein weiblich, langgrifflig, kurzgestielt mit einem einseitig vorgewölbten Fruchtknoten, der einen Griffel mit zwei langen Narben trägt und meist drei Perigonblättern versehen (Fig. 9). Zwischen ihnen liegen auf dem Krugboden Haare (Anat. Atlas Taf. 28, 6, 8, 18). Die reife Feige hat eine mehr weniger schlanke, birnförmige, übrigens wechselnde Gestalt und Größe und eine grünlich-violette Farbe, die aber auch in bräunlich, rötlich, violett oder blauschwarz übergehen kann. Auch farbig gestreifte oder bereifte Sorten sind bekannt. Bisweilen platzt die Feige und läßt dicken Zuckersaft austreten (FLÜCKIGER). Das Ostiolum der reifen Feige ist durch nach unten gerichtete Schuppen geschlossen, die den Insekten den Weg nach Innen weisen. Das Gewebe des Receptaculums ist hyalin weich, zuckerreich und stärkefrei geworden. Der Geschmack ist nunmehr schleimig süß. Beim Verletzen tritt kein Milchsaft mehr aus. Der Inhalt der Milchröhren ist erstarrt, nicht mehr flüssig. Noch stärker sind die Veränderungen im Innern des Kruges. Aus den Blüten haben sich kleine gelbe, fast kugelrunde Früchtchen entwickelt, die ganz eingebettet sind in ein gelbliches, hyalines «Fruchtmuß», das durch eine tiefgreifende[S. 32] Pektin-Schleimmetamorphose der Krugwand, der Blütenstiele, Perigonblätter, Griffel und Narben, sowie der äußersten Schichten der Früchtchen gebildet wird und reichlich Zucker enthält. Immerhin findet man in der reifen Feige noch Reste, besonders der Narben, der oben erwähnten, jetzt dickwandiger gewordenen Haare, auch wohl einzelner Perigonblätter mit ihren Randhaaren und natürlich die etwa 2 mm großen Früchte. Die Frucht ist eine Drupa.
Die Feigen kommen entweder einfach getrocknet oder gepreßt in den Handel. Die gepreßten werden von oben her zu Scheiben zusammengedrückt, so daß auf der einen Seite etwas seitlich von der Mitte das Ostiolum, auf der anderen der Stielansatz sichtbar ist.
Lit. PAYER, Organographie p. 275, tab. 60. — EICHLER, Blütendiagramme. — TSCHIRCH und OESTERLE, Anatom. Atlas, Taf. 28.
Anatomie der Droge. Die Wand des Hypanthiums ist bedeckt von einer aus polyedrischen Zellen bestehenden Epidermis, in der sich da und dort Spaltöffnungen und ziemlich viele, meist aber nur kurze, derbe, kegelförmige Haare befinden (Fig. 10). Dann folgt eine Zone von Parenchym, dessen Zellen Oxalatdrusen enthalten und darauf die die Milchröhren führende Schicht. Weiter nach Innen liegen die Gefäßbündel. Die innerste Zone ist meist obliteriert. Die Milchröhren sind verhältnismäßig dünnwandig, 15–45, meist 20–30 mik. weit und sehr reich verzweigt. Sie gehören zum Typus der einfachen ungegliederten und enthalten ziemlich große (4–7 mik.) Guttakörnchen isoliert oder zu Ballen zusammengeflossen, die nur in Chloroform löslich sind. Die Gefäße sind meist Spiralgefäße, selten Netzleistengefäße. Sie besitzen eine Weite von 15–22 mik., sind also in der Regel enger als die Milchröhren (Unterschied gegenüber der Cichoriumwurzel s. d.).
Ficus Carica.
Succedane Flächenschnitte durch die einzelnen Schichten des Hypanthiums von der Epidermis (1) bis in die inneren Partien.
[Nach Tschirch-Oesterle, Anatom. Atlas.]
Von der Fruchtwand gehen die äußersten parenchymatischen Schichten mit in der Pektin-Schleimmetamorphose, dem das ganze Innere des Kruges anheimfällt, zugrunde. Erhalten bleibt meist nur die dritte Schicht in Form kleiner verdickter isodiametrischer Zellen und die innerste Schicht, die aus kurzen, stark verdickten Brachysklereïden besteht (Fig. 11). Die Samenschale besteht aus obliterierten Zellen und ist zusammengefallen. Der Embryo ist stark gekrümmt, Radicula und zwei Cotyledonen sind deutlich. Er ist eingebettet in Endosperm. In ihm und im Embryo finden sich reichlich, in Ölplasma eingebettet, Aleuronkörner, die Kristalloide und Globoide enthalten.
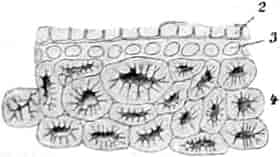
Ficus Carica.
Querschnitt durch die Randschicht eines herauspräparierten Früchtchens [Die äusseren Schichten (1–2) sind zu Grunde gegangen.
[Nach Tschirch-Oesterle, Atlas.]
[S. 33]
Lit. TSCHIRCH, Angew. Anatomie, Fig. 611. — TSCHIRCH-OESTERLE, Anatom. Atlas. — J. MOELLER, Mikroskopie d. Nahrungs- u. Genußmittel. 2. Aufl. 1905 (dort weitere Literatur). — Bei MALPIGHI (Opera 1687) findet sich ein guter Längsschnitt durch das Receptaculum. Er sah bereits die Milchröhren.
Pathologie der Droge. Häufig finden sich in trockenen Feigen Milben, besonders Carpoglyphus passularum, Glyciphagus prunorum u. and. (ISRAËL, s. I, S. 380).
Chemie. Getrocknete Feigen enthalten neben etwa 5,5% Pektin 27–62 (70?), meist etwa 51% Zucker, wie es scheint nur Invertzucker (Dextrose + Lävulose) und keinen Rohrzucker (Saccharose). Auch nach der Inversion bleibt der Zuckergehalt etwa gleich (DIETERICHS). Der Traubenzucker kristallisiert oft aus und bedeckt als Kruste die Oberfläche. Ein Liter frisch ausgepreßter Feigensaft enthält 128 g Zucker (BALLAND). Die unreife Feige enthält sehr wenig Zucker aber reichlich Stärke, die reife ist stärkefrei. Der Inhalt der Milchröhren, der beim Anschneiden unreifer Feigen ausfließt und diesen einen unangenehmen Geschmack verleiht, erhärtet beim Reifen und enthält dann zahlreiche ziemlich große Kautschukkörner, die aus Gutta bestehen (s. oben). Die Samen enthalten fettes Öl und Aleuron. Der Aschegehalt beträgt 1,3%. Die Asche enthält 0,06% Borsäure (HOTTER 1895). Frische Feigen enthalten oft 86% Wasser, trockene c. 30%. Da die Feige über 6% Eiweiß enthält, ist sie sehr nahrhaft.
Das peptonisierende Ferment Cravin, das sich im Milchsafte der ganzen Pflanze findet, ist nicht identisch mit Papayotin (MUSSI). Schon PLINIUS und DIOSKURIDES wußten, daß der Milchsaft unreifer Feigen, der im Altertum viel medizinisch angewendet wurde, Milch zum Gerinnen bringt.
Lit. Ältere Analyse von BLEY (in PEREIRA, Heilmittellehre). — FLÜCKIGER, Pharmakognosie (DIETERICHS). — KÖNIG, Chem. d. Nahrungs- u. Genußmittel. 4. Aufl. 1903/04. — ALBINI, Ber. d. d. chem. Ges. 1871. — BALLAND, Journ. pharm. 1876. — CARLUCCI u. ROSSI, Bot. Jahresb. 1881. — MUSSI, Orosi 1890. — Eine Analyse d. Milchsaftes: Magaz. f. Pharm. XX. — Über den Milchsaft vgl. auch BOUCHUT, Journ. d. pharm. 1880. — HANSEN, Bot. Jahresber. 1881 u. 1885. — Zusammensetzung des Feigenkaffees bei KÖNIG.
Geruch und Geschmack. Der Geruch ist schwach und nicht unangenehm. Der Geschmack stark süß, schleimig. Die frische Feige schmeckt weichlich, fade süßlich und wirkt abführend.
Aufbewahrung. Länger als ein Jahr bewahrt man Feigen nicht auf. Sie werden nach dieser Zeit trocken und unansehnlich und bedecken sich mit einer Schicht ausgewitterten Traubenzuckers (Kristalle abgebildet im Anatom. Atlas).
Es kommt vor, daß Feigen, um ihre Haltbarkeit zu erhöhen, mit Mehl (bes. Kastanienmehl) bestreut werden (E. HANAUSEK in ERDMANN-KÖNIG Waarenkunde).
Verwendung. Die Feige wird jetzt fast nur noch in der Volksmedizin als erweichendes Mittel benutzt. Feigenpflaster (?) kannten schon die Juden aus der Zeit des Jesaias und die Schola Salernitana lehrt:
Doch ist die Feige jetzt nur noch Bestandteil einer Spec. pectoral. cum fructibus. Bei den Arabern gilt sie als Aphrodisiacum (Signatura?). Die abführende Wirkung, die sie wie alle Zuckerdrogen besitzt, ist in drastischer Weise in BOCKS Kräuterbuch dargestellt (vgl. I, S. 323, Fig. 313). Die frischen Feigen sind im Süden ein beliebtes[S. 34] Nahrungsmittel und Obst. Aus gegorenen Feigen wird neuerdings, z. B. in Kleinasien, viel Alkohol destilliert. Auch Feigenwein wird im Orient bereitet.
Geröstet bildet die Feige den Feigenkaffee, der ein Kaffeesurrogat ist und auch bisweilen dem Kaffee zugesetzt wird, um den Geschmack zu verbessern (Karlsbader Kaffee). Er ist ziemlich teuer und es finden sich daher Fälschungen im Handel, besonders Cichorien mit eingebetteten Klee oder Cruciferensamen, die aber leicht mikroskopisch erkannt werden können. Auch Kornkaffee, geröstete Birnen und Carobben kommen als Fälschungen des Feigenkaffees vor. Der in Spanien und Portugal benutzte Feigenkäse ist ein gepreßtes Gemenge aus Feigen, Mandeln, Haselnüssen, Pistazien und Gewürzen.
Geschichte. Die Feige ist eine der ältesten Kulturpflanzen. In der westlichen Hälfte des Mittelmeergebietes schon am Ende der Pliocen vorhanden, ist sie dann ausgestorben und in vorhistorischer Zeit vom Osten her wohl durch die Phönikier wieder in das Gebiet eingeführt worden (LLOYD), zunächst aus Syrien nach Griechenland und Italien, von da nach Spanien und Gallien. In einem babylonischen Hymnus der Bibliothek von Nippur aus dem Jahre 2000 n. Chr. wird die Feige erwähnt: «süßer als Trauben und Feigen» (Cuneiform Texts of the Brit. Mus. XV. pl. 1). In dem Alfabet des BEN SIRA (XI. Jahrh. die Liste selbst älter) steht eine Liste von Pflanzen im Garten des NEBUKADNEZAR, die auch Feigen (tᵉēnīm) enthält. Sie haben übrigens auch einen assyrischen Namen: tittu. Auf assyrischen Denkmälern findet sich der Feigenbaum oft neben Dattel und Weinstock. (Ich halte wenigstens die in I, Fig. 371 mit Salix (?) bezeichnete Pflanze für eine Feige), so daß die Angabe HERODOTS (V. Jahrh. n. Chr.), Babylonien erzeuge keine Feigen, nicht richtig sein kann. HERODOT behauptete ja auch, Ägypten liefere keinen Wein, und doch kennen wir unzählige Darstellungen des Weinbaus und der Weinbereitung auf ägyptischen Denkmälern von der ältesten Zeit an. Ebenso häufig findet sie sich auf ägyptischen Denkmälern (WÖNIG). Feigen finden sich schon unter der Totenspeise eines Grabes aus der XII. Dynastie (2400–2600 n. Chr. SCHWEINFURTH). Kein Zweifel besteht, daß in Ägypten in ältester Zeit (2400–2200 n. Chr.) die Feigenkultur in Blüte stand (Fig. 12), ebenso in Syrien, hier vielleicht in noch älterer. In der Bibel ist sie neben dem Weinstock Symbol des Überflusses. Im jüdischen Altertum war Feige und Wein in Mischkultur. Die alten Inder kannten die Feige ebenfalls (I, S. 507). Der Anbau der Feige in Italien scheint in die Zeit der griechischen Kolonisation zurückzureichen (nach SOLMS ist er älter und gehört die Feige dem ältesten römischen Sagenkreise an). Der erste Anbau in Griechenland fällt in die späthomerische Zeit (HEHN), etwa IX. oder VIII. Jahrh. Nach Griechenland wurde mit der Feige die Kaprifikation gebracht. Die Römer übernahmen diese nicht, sondern pflanzten zunächst den Feigenbaum durch Stecklinge fort. DIOSKURIDES, der ebenso wie PLINIUS und IBN BAITHAR eine Menge von Krankheiten nennt, die durch Feigen geheilt werden — auch HIPPOKRATES bediente sich der Feige als Heilmittel — erwähnt auch den wilden Feigenbaum und die Aschenlauge des Feigenbaumes. Auf dem Forum romanum standen mehrere heilige Feigenbäume. Zur Zeit des PLINIUS wurden schon 29 Feigensorten gezüchtet.
Altägyptische Darstellung der Feigenernte.
Aus einem Gemälde der Westwand des Grabes Nr. 2 in Beni-Hassan, XII. Dynastie, 2400 bis 2200 n. Chr.
[Nach Wönig.]
In Ägypten war der Feigenbaum dem OSIRIS, in Griechenland dem DIONYSOS heilig[S. 35] sowie dem phallischen HERMES und dem PRIAPUS, bei den Römern der JUNO. Feigen spielten bei den Dionysien eine große Rolle. Bei den Römern war die Feige Symbol der vulva, bei den Hellenen des penis. Die sehr starke Erotik, die sich mit der Feige verknüpft, ist von südlichen, oft sehr alten Vorstellungen ausgegangen (AIGREMONT). Die Feige ist im Orient das Symbol der Fortpflanzung und wegen der zahlreichen Früchtchen auch Symbol der Fruchtbarkeit. Bei dem Feste der Thargelien waren die beiden φαρκμακοί, die als Sühnopfer zum Tode geführt wurden, der eine mit weißen, der andere mit schwarzen Feigen behangen (HEHN). Bei SCRIBONIUS LARGUS (I, S. 577) findet sich Caprificus und Ficus arida (getrocknete Feigen). Im Edikt des DIOCLETIAN (I, S. 570) finden sich frische und getrocknete, karische, pressae und duplices (gespaltene). Die Scriptores rei rusticae (I, S. 573) widmeten der Feige oft lange Kapitel und sie findet sich auch auf pompejanischen Wandgemälden und unter den Pflanzenresten Pompejis (I, S. 575). Sie wurde von den Römern als Heilmittel hoch geschätzt, ebenso von den Arabern. IBN BAITHAR (I, S. 608) widmet ihr ein großes Kapitel. KARL DER GROSSE wünschte ihre Anpflanzung (I, S. 620). Doch fehlt sie im St. Galler Klostergarten (I, S. 622); wohl aber kennt die HILDEGARD den Feikbaum oder Fickbaum. Im VIII. Jahrh. waren F. in Südfrankreich bekannt (I, S. 714). Im mittelniederdeutschen Gothaer Arzneibuch (I, S. 681) steht: vige, vyge. Die Alphita (I, S. 644) führt Caricae siccae auf. Über die Alpen muß sie ziemlich früh gekommen sein. GESNER (I, S. 846) beschreibt Feigenbäume in Straßburg. Nach England wurde sie unter HEINRICH VIII. von Kardinal POLE gebracht, doch scheint sie schon im XIII. Jahrh. dort kultiviert worden zu sein. Der mittelalterliche Drogenhandel umfaßte auch die Feige (s. Brügge). Schließlich sei bemerkt, daß die Feige auch im Pents’ao kang mu (I, S. 519) steht, also auch in der chinesischen Medizin verwendet wurde.
Die Krankheiten des Feigenbaums beschrieb schon der Rhizotom KLEIDEMUS (THEOPHRAST, Caus. plant. 3, 12).
Lit. HAMILTON, Botanique de la bible. 1871. — SOLMS a. a. O. — AIGREMONT, Volkserotik. — FLÜCKIGER-HANBURY, Pharmakographia (dort weitere histor. Literatur). — SCHWEINFURTH, Ber. d. d. bot. Ges. 1884 und Ägyptens Beziehungen. — SCHWENDENER, Kulturpflanzen. Vortrag. — UNGER, Botan. Streifzüge 1857. — MOLDENKE, Bäume Ägyptens. Diss. Straßburg 1887. — WÖNIG, Pflanzen d. alten Ägypten. 1886. — HEHN, Kulturpflanzen u. Haustiere. 7. Aufl. 1902. — BUSCHAN, Vorgeschichtl. Botanik. 1895.
Dactyli.
Dattel — datte (franz.) — date (engl.) — datil (span.) — dattero (ital.) — dadel (holl.) — datolya (ung.) — taateli (finn.) — φοῖνιξ (n.-gr.).
Syn. und Etym. Bei den Assyrern musuḳḳan (sumerisch-akkadisch = himmelhäuptig). bnr (ägypt. die hieroglyphischen Zeichen I, S. 468 u. 470), — Palma (PLINIUS), P. Carioti (SCRIB. LARG.), Dactyli (lat.), — φοῖνιξ (griech. DIOSKUR., ARRIAN, GALEN), φοινικοβάλανοι (HIPPOKR.), — Nachl, Tamr, Ruthab, Busr (arab.) — el oder tāmār (hebr.), davon wohl tamar indie! — Im Chinesischen heißt die Palme: Wu-tau-tsze (d. h. Fünf-Lasten) oder Fau-tsau (d. h. fremde Pflanze). — Die Frucht: tsau. — Dattel, bei HERESBACH (1570): Daktel, mhd. datel, tatel, tatele, aus it. dattilo, dies aus δάκτυλος. «Die Fiederblättchen der Dattel sind fingerförmig» (KLUGE) oder (was wahrscheinlicher) nach der Fingerform der Früchte oder von aramäisch daqual, diplâ = Palme. «Palma» war ursprünglich Chamaerops humilis, wurde aber später bis ins Mittelalter ganz allgemein der Name der Dattelpalme, später dann auf alle «Palmen» übertragen.
Stammpflanze und Systemat. Stellung. Phönix dactylifera L., mit 50 bis 80, nach anderen sogar 150 Kulturrassen. — Palmae, Coryphinae — Phoeniceae.
Beschreibung. Die dioecische Dattelpalme bildet große schlanke Bäume (ihr hebr. Name tâmar bedeutet «schlank und hochgewachsen»), die bis 20 m hoch werden können (I, Fig. 212, 217, Taf. 19) und die der Landschaft in Afrika das[S. 36] charakteristische Gepräge geben. Die wilde Urform ist nicht bekannt. Die Stammform, aus der die Kulturdattel entstand, ist vielleicht Phoenix spinosa (FISCHER). Danach wäre das tropische Afrika Urheimat der Dattelpalme. Die Dattel ist seit Urzeiten in Kultur und die Kultur hat erst die süßen Früchte erzeugt oder sie verbessert. Die babylonischen Nabatäer gelten für die Erfinder der Dattelveredelung (I, S. 479). Da die Dattelpalme zweigeschlechtlich ist, so wird die Befruchtung dadurch gefördert, daß man (es geschah dies schon zur Zeit der alten Babylonier) die männlichen Infloreszenzen, noch wenn sie geschlossen sind, in die Baumkronen der weiblichen Pflanzen hängt, «sobald sie beim Pressen ein dem Reiben von angefeuchtetem Mehl ähnliches Geräusch hören lassen». Der Pollen fällt dann bald aus und bewirkt die Befruchtung. Die Blüten stehen oft zu 200 in großen Infloreszenzen vereinigt zwischen dem terminalen Blattschopf. Die Zahl der in jedem Blütenstand zur Reife kommenden Früchte schwankt zwischen 80 und 200. Die Früchte reifen nach fünf Monaten, meist im Juli, August, September und Oktober. Für den Handel sammelt man sie etwas vor völliger Reife und läßt sie an der Sonne nachreifen. Die vollreife Dattel wird leicht breiig. Die Dattelpalme liefert Früchte vom 5. Jahre an, doch zahlreiche erst vom 15., das Maximum erreicht sie im 30. Jahr, das Ende im 95. Ein Baum kann 50–70 kg Datteln liefern. Die Früchte sind von gelblicher, gelbrötlicher oder gelbbräunlicher Farbe.
Vorkommen. Die Dattelpalme, «einer der wertvollsten Nutzbäume der Welt», «der König der Oasen», ist über Arabien, Ägypten, Nubien, die Oasen der Sahara, Algerien, Tunis und Marocco (Atlashochland) verbreitet. Sie geht westlich bis zu den Canaren und Capverdischen Inseln, östlich bis Iran, dem persischen Meerbusen bis zum Indus. Zentrum und Heimat der Kulturdattel ist wohl Arabien. Elche in Spanien liefert noch gute Datteln. In Nizza und San Remo reift die Dattel an geschützten Stellen — sie hält noch −5° C. aus —, nicht diesseits der Alpen. «Sie senkt ihre Wurzeln in das Wasser und ihre Krone in das Feuer», d. h. sie braucht Grundwasser und heißes Klima. Ihr assyrischer Name mussuḳḳan bedeutet «himmelhäuptig». Beled-el-Dscherid, d. h. Dattelland, hieß früher der Südabhang des Atlas-Systems, jetzt wird damit das südliche Tunis bezeichnet. Fezzan ist ganz auf Dattelkultur angewiesen. Das Niltal ist eine ungeheuere Datteloase. Die Zahl der Dattelpalmen in Algier übersteigt 4 Millionen. In Ägypten, Algier und Tunis ist die Dattelpalme ein wichtiges Steuerobjekt. In Arabien, das viele Datteloasen hat, ist Dschidda ein großer Dattelmarkt, ebenso die Bahreininseln, «Datteln nach Bahrein tragen» lautet ein arabisches Sprichwort, d. h. soviel wie «Eulen nach Athen tragen». Persien besitzt ausgedehnte Palmenhaine, besonders in Laristan. Sie bildet überall Dorfwäldchen. Sie braucht eine mittlere Jahrestemperatur von 24–25° C.
Pathologie. Über pflanzliche Schädlinge berichtet Prof. ED. FISCHER: Das Fruchtfleisch der reifen Datteln wird häufig von einem Parasiten zerstört, den CORDA als eine Ustilaginee angesehen hatte, der aber nach PATOUILLARD und DELACROIX (Bull. soc. mycol. France T. VII, p. 118) eine Aspergillacee ist und Sterigmatocystis Phoenicis (CORDA) PATOUILL. et DELACROIX genannt werden muß. Im Niltale trägt die Krankheit den Namen Mchattel. Man beobachtet sie zuweilen auch an Datteln, die in Kistchen nach Europa spediert werden.
Handelssorten. Die Dattel ist Charakterdroge der Südprovinz des mediterranen Drogenreiches (I, S. 441). Die meisten Datteln kommen jetzt aus Arabien, Persien und Ägypten. Algerien und Tunis liefern sehr gute Datteln. Die besten Datteln sind die afrikanischen. Sie sind fast walzenrund, fingerförmig, etwa 2–3 cm lang,[S. 37] weich und sehr süß. Man schätzt das Einkommen aus der in Afrika besteuerten Dattelpalme in Ägypten auf M. 10–20 pro Baum. Haupthandelsplatz für türkische Datteln ist Basra. Einfuhrhäfen sind besonders Marseille, dann Genua, Hamburg und London.
Man findet sie im Handel locker in Kistchen in Reihen gelegt oder zu Ballen (Blöcken) gepreßt.
Die unter türkischer Oberhoheit stehenden Länder produzierten 1907: 51 Mill. kg im Werte von 34 Mill. Piaster.
Die Einfuhr von Datteln nach Hamburg betrug seewärts in dz. 1906: 21813, 1907: 14156, 1908: 24717. Von der Einfuhr 1908 stammten die meisten (15177 dz.) aus Arabien, viel lieferte auch Persien (3921) und Großbritannien (2943, aus den britischen Kolonien und Ägypten). Geringer war die Einfuhr aus Frankreich, Marokko, Syrien und Kleinasien. Die Vereinigten Staaten führten 1909: 21869218 Pounds Datteln ein, die Mehrzahl (beinahe 19 Mill.) aus der asiatischen Türkei.
Anatomie. Das Pericarp ist von einer Epidermis bedeckt. Unter ihr liegt eine Schicht kleinzelligen Parenchyms. Dann folgt scharf abgesetzt in einer Zone stark tangential gestreckter, dünnwandiger Parenchymzellen die Sklereïdenschicht, die aus rundlichen oder stark radial gestreckten Zellen besteht, die oft zapfenartig nach Innen vorspringen. Dann folgt eine Zone größerer Parenchymzellen und dann die Region der Inklusen. Größere rundliche Parenchymzellen führen hier je einen hellen, stark lichtbrechenden, weichen, runden Körper, der sich Reagentien gegenüber ähnlich verhält, wie die Inklusen von Ceratonia und Diospyros (TICHOMIROW). Die Dattelinklusen färben sich mit Eisenchlorid blaugrün bis schwarz, mit Vanillin-Salzsäure rot. Sie enthalten ein in Wasser unlösliches Phloroglukotannid. Das Endocarp löst sich leicht als Silberhaut ab. An der Stelle, die der Samenrinne (s. unten) entspricht, ist es als Leiste vorgestülpt. Zwischen ihm und dem Fruchtfleisch findet man bisweilen Zuckerkristalle (VOGL, Nahrungsm. Fig. 136). Der Same ist gestreckt, beiderseits zugespitzt, an der einen Seite mit einer Rinne versehen. Die dünne Samenschale besteht aus einer mehrzelligen äußeren hellen und aus einer einreihigen braunen Schicht, die auch in die Rinne eindringt. Die Zellen sind schwach verdickt und getüpfelt. Das Endosperm ist hart, hornig, läßt sich aber mit dem Messer schneiden. Es besteht aus strahlig angeordneten, radial gestreckten, stark verdickten und reich getüpfelten Zellen, die reichlich Aleuronkörner enthalten. Der kleine Keimling liegt in der Mitte der konvexen Längsseite.
Chemie. Die Dattel enthält im vom Kern befreiten Fruchtfleisch 28–66, im Durchschnitt c. 47% Invertzucker (20,7–39,3% Dextrose und 22,1–22,4% Lävulose) und, wie es scheint, keinen Rohrzucker (BONASTRE gab 1832 welchen an). Der Dattelhonig enthält 39,3% Dextrose, 32,4% Lävulose, 3,3% Pektin. Der Dattelsirup 29,7% Dextrose und 22,1% Lävulose. Die aus Dattelhonig (s. unten) auskristallisierende Masse besteht aus 83,4% Dextrose und 11% Lävulose (GRIMBERT). Die Dattel enthält ferner in Prozenten: 20,8 Wasser, 6,6 Eiweißstoffe, 11,3 Pektose und Gummi, 0,2 fettes Öl, 5,5 Rohfaser, 1,6 Asche. Asche der Samen: 1,1%. Die Samen enthalten viel Reservezellulose, eine Hemizellulose, die beim Keimen gelöst wird und Cytase (NEWCOMBE). Sie liefern bei der Hydrolyse Galaktose und Mannose, enthalten also Galaktane und Mannane.
Verwendung. Die Dattel ist vornehmstes Nahrungsmittel der Stämme in ganz Nordafrika. Jede Karawane hat einen Dattelvorrat. Die Elemente des genügsamen[S. 38] Fellah sind: Sonne, Nil, Dattel und Prügel. Der geröstete Kern wird in Algerien und auch sonst als Kaffeefälschungsmittel benutzt. In Europa werden Dattelkerne zur Fälschung der Gewürze angewendet. Dattelkerne (Dactylorum ossa seu nuclei) finden sich in der Braunschweiger Taxe von 1574 (I, S. 816), wurden also jedenfalls damals als Arzneimittel benutzt. Die schlechteren Dattelsorten werden zur Alkoholfabrikation benutzt. Datteln aus Maskat werden z. B. in Vorderindien in großen Massen auf Schnaps verarbeitet. Die Fabriken in Urann gehören Parsi.
Medizinische Anwendung findet die Dattel in Europa kaum noch, doch ist sie Bestandteil der quatre fruits pectoraux. Dattelsirup wird in Afrika als Pectorale benutzt. (Im übrigen vgl. DRAGENDORFF, Heilpflanzen.)
Im Innern von Algerien wird aus einer sehr zuckerreichen Dattelart (Gharz) Dattelhonig (dibus) und Dattelsirup in der Weise bereitet, daß man die Früchte auf Palmzweighorden übereinander häuft und der Sonne aussetzt. Es fließt dann ein sirupdicker Saft aus, aus dem bisweilen Zucker reichlich auskristallisiert. Dattelhonig (mel phoenicinum) wird bereits im Edikt DIOCLETIANS (I, S. 570) erwähnt. Um Zucker aus der Dattelpalme zu gewinnen, macht man tiefe Einschnitte am oberen Stamm. In Jessore bei Calcutta wird noch jetzt viel Zucker aus dem Palmsaft bereitet. Dattelwein (duschab), den bereits die Bibel, HERODOT und PLINIUS erwähnen, wird noch heute dargestellt (vgl. I, S. 1017); ebenso Dattelbranntwein (in Ägypten und Indien). Datteln wurden und werden im Orient bisweilen als Geld benutzt (I, S. 186).
Geschichte. Schon in altsumerischer Zeit war die Dattel im Zweistromlande bekannt (I, S. 476). Sie ist ein Bestandteil zahlreicher Keilschriftrezepte, ebenso wie der Palmwein (Dattelwein I, S. 485). Die Dattelpalme findet sich auf den ältesten Darstellungen von Pflanzen, die auf uns gekommen sind, z. B. auf assyrischen Denkmälern (I, Fig. 371 u. 372), dort oft mit dem Weinstock zusammen. Berühmt war der königliche Dattelgarten von Babylon: Bagou; STRABO (I, S. 532) berichtet, daß die Dattel für die Babylonier Brot, Kuchen, Wein, Essig, Honig und Mehl gewesen, daß sie die Blätter zu Flechtwerk, die Kerne als Viehfutter und geglüht als Kohle für Schmiede benutzt hätten. Auf ägyptischen Denkmälern findet sich die Dattelpalme schon im III. Jahrtausend n. Chr. (I, Fig. 467). Sie scheint zur Zeit der X-XI. Dynastie (2560–2380 n. Chr.) dort in Kultur genommen worden zu sein (WÖNIG). Sie findet sich auch unter sehr alten Grabbeigaben (Verzeichnis bei BUSCHAN). Im Papyrus EBERS wird die Dattel, auch die unreife, Dattelhonig, -Wein und -Kuchen als Heilmittel erwähnt. Dattelwein und Dattelhonig waren schon zur Zeit des alten Reiches Heilmittel. Ein uraltes, noch heute gültiges, ungeschriebenes Kriegsrecht verbietet das Umhauen der Dattelpalme. Die Dattel (tamār) und ihr Honig (dibs) waren auch bei den Juden in Anwendung (I. Mose 43). Nach den griechischen Inseln kam sie um das Jahr 1000 n. Chr. (HEHN). Um das Jahr 700 n. Chr. kam sie nach Attica und Korinth (SCHWENDENER). Auf dem italienischen Festlande ist sie 291 n. Chr. nachzuweisen (BUSCHAN). Eingehend gedenkt ihrer THEOPHRAST (I, S. 547), der auch die künstliche Befruchtung beschreibt und über die Ertragsfähigkeit orientiert ist. Er rühmt die kölesyrischen. Berühmt waren auch die syrischen sowie die von Jericho, welche Stadt Palmyra (hebr. Tadmor) hieß, d. h. Dattelstadt. PLINIUS unterscheidet verschiedene Sorten (die königlichen, die Syagren, Margariden, Sandaliden, Karyoten, Nikolaen, Adelphiden, Paleten, Dactylen). Im Periplus wird φοῖνιξ aus Persien und Gedrosien erwähnt (I, S. 535), als Ausfuhrhafen Barygaza. Im Pen tsao kang mu (I, S. 519) finden sich persische D. Für die Chinesen war der Dattelbaum eine «fremde Pflanze» (s. oben S. 35). In der Liste des SERAPION (I, S. 606) finden sich dactili (Rorab). Die HILDEGARD erwähnt den Datilbaum (I, S. 671). Datteln (Dactyli ping., dattuli) finden sich auch bei CORDUS (I, S. 798).
Lit. BAILLON, Monographie des palmiers. Paris 1895. — DRUDE, Palmen in Engler-Prantl. — MARTIUS, Verbreit. d. Palm. in d. alt. Welt. Münch. gel. Anzeig. 1839. — SEEMANN, Die Palmen. Deutsch von BOLLE 1863. — WÖNIG, Pfl. d. alt. Ägypt. — BUSCHAN, Vorgeschichtl.[S. 39] Botanik. 1895. — SCHWENDENER, Kulturpflanzen, Vortrag. — SCHWEINFURTH, Pflanzengeogr. Skizze d. ges. Nilgebietes. Peterm. geogr. Mitth. 1868 und (Über d. Kultur d. D.) Gartenflora 1901. — CURTIS, Nil-Skizzen eines Howadji. Deutsch v. SPIELHAGEN 1857. — FISCHER, Die Dattelpalme, vgl. auch FISCHERS Karten in Peterm. Geogr. Mitt. Ergänzungsh. 64. 1881. — SEMLER, Trop. Agrikultur. 2. Aufl. I. — HASSACK, Schönheit u. Nutzen d. Palmen. Vortrag, Wien 1898. — Morph. Abbild. in HÉRAIL, Traité de pharmac. 1901, p. 64. — Die Keimung der D. in SACHS’ Lehrb. d. Bot. S. 444. — WILLKOMM, Südfrüchte. Samml. gemeinverständ. Vortr. 1877. — PLANCHON-COLLIN, Drogues simples. — HANAUSEK, Zeitschr. d. Österr. Apoth. Ver. 1892. — VOGL, Nahrungs- u. Genußm. (anatom. Abbild.). — TICHOMIROW, Die Johannisbrotartigen Intrazellular-Einschließ. im Fruchtparench. mancher süßen Früchte usw. Bull. Soc. des Naturalist. de Moscou 1905. — KÖNIG, Nahrungs- u. Genußm. 4. Aufl. 1903. — GRIMBERT, Journ. pharm. chim. 1889, p. 485. — VINSON, the Endo- and Ektoinvertase of the date. Journ. Am. Chem. Soc. 1908.
Passulae.
1. Passulae majores — Uvae passae — Große Rosinen, Zibeben — Raisins secs, R. passés ou de Malaga (franz.) — Raisin (engl.) — rozijn (holl.) — rusina (finn.) — mazsolaszöllö (ung.). Die Weinbeere heißt arab. ’Eneb, die Traube ägypt. elel, árer, aarer-t und die Rosinen zmtn.
Vitis vinifera L., Vitaceae, Vitoideae, in sehr zahlreichen Kulturformen. (Sowie die amerikanische Rebe: Vitis Labrusca L. u. and.) Ursprüngliche Heimat vielleicht im Südkaukasus.

Der größte Rosinenmarkt der Erde, Savannah in Georgien.
[Aus Les grandes cultures.]
Etym. Vitis ist sehr verschieden gedeutet worden. «Vitis a vino, idque a vi» (VARRO), «Vitis dicta quod vim habeat citius radicandi» (ISIDOR), auch von vincire (= binden) — Vinum, vin, wine, wijn etc. in allen Kultursprachen (s. auch unter Geschichte).
[S. 40]
Die reifen getrockneten Beeren, die sehr große Mannigfaltigkeit in Gestalt, Größe und Farbe besitzen, kommen aus Spanien, Frankreich, Griechenland, Kleinasien in den Handel. Die besten sind die Smyrnäer (Elemé [s. Caricae], Chesme), sowie die Valencia-Rosinen (Spanien). Die Sultaninen sind die größten, die Malagatraubenrosinen (Muscateller) sehr fleischig, meist noch an den Stielen. Die Zibeben sind hartfleischig, dunkel, oft zusammengeklebt. Rosinen werden in Kisten oder Fässern versandt. Besonders Malaga und Valencia sind Verschiffungshäfen für Rosinen. Beide Häfen verschiffen zusammen 3 Millionen Kisten (à 25 engl. Pfund). Dreiviertel der Rosinenausfuhr entfällt auf Malaga. Die Malagarosinen sind groß, fleischig und sorgfältig sortiert. Auch Kalifornien produziert jetzt steigende Mengen Rosinen. Savannah in Georgien ist einer der größten Rosinenhäfen der Welt (Fig. 13). Die Methoden der Trocknung sind verschieden. Entweder wird die Traube direkt in der Sonne getrocknet oder zuvor in heißes Wasser getaucht, oder künstliche Wärme benutzt. Die Valencia-Rosinen werden, um ihre Haut zarter zu machen, vor dem «Dörren» in ein aus Rebenasche hergestelltes Laugenbad getaucht.
Die aufgeweicht kugeligen Früchte sind von einer aus polygonalen Zellen bestehenden Epidermis bedeckt. Das Mesocarp besteht aus großen, zartwandigen Zellen, die bei der Droge tafelförmige Zuckerkristalle und derbe, meist zugespitzte Weinsteinkristalle enthalten. Legt man einen Schnitt durch eine Rosine in Öl, so sieht man die Schnittfläche mit zahlreichen großen Kristallen von Zucker und Weinstein, die in eine weiche hyaline Zuckermasse eingebettet sind, bedeckt. Daneben finden sich kleine Rosetten feiner Nadeln. Legt man einen Schnitt in Wasser, so lösen sich die Zuckerkristalle und man erkennt, daß der Weinstein besonders in der Peripherie liegt. Erwärmt man das Wasserpräparat, so lösen sich auch die Weinsteinkristalle. Die zarten Gefäßbündel sind bisweilen von Kristallkammerfasern begleitet. Die Fruchthöhle erscheint als Spalt. Die birnförmigen, meist zu zwei vorhandenen Samen besitzen eine Epidermis mit dicker Außenwand. Dann folgt ein zartwandiges Parenchym, von dem einige Zellen Oxalatnadeln führen und auf dieses eine breite Zone starkverdickter, radialgestreckter Sclereïden. Zu innerst liegt wieder ein zartes Gewebe (Gitterzellen) und eine innere Epidermis. (Abbild. bei MOELLER). Das Endosperm enthält Aleuronkörner, die entweder eine Oxalatdruse oder ein Globoid enthalten.

Die in Griechenland übliche Methode, die Korinthen zu trocknen.
[Aus Les grandes cultures.]
Sie enthalten 60,5–73,5%, im Mittel: 61–64% Invertzucker (KÖNIG) und zwar c. 27% Dextrose und c. 34% Lävulose, meist keinen Rohrzucker oder nur sehr wenig, ferner Weinstein. Im Mittel 1,22% freie Säure auf Weinsäure bezogen und 1,66% Asche. Ferner Apfelsäure und Pectin, die Samen 5–6% Gerbstoff. Das 15–18% der Samen betragende (gelegentlich extrahierte) fette Öl enthält vorwiegend Glyzeride der Erucasäure (C22H42O2), dann auch solche der Stearin- und Palmitinsäure (Fitz). Auf und in den getrockneten Weinbeeren kristallisiert bisweilen Zucker und Weinstein aus. Trauben enthalten auch pro kg 0,32 mgr Salizylsäure, wohl als Methylester (TRAPHOGEN) und etwas Borsäure (NORTON).
[S. 41]
Die Einfuhr von Rosinen in Hamburg betrug seewärts in dz 1906: 110688, 1907: 114342, 1908: 99537. Von der Einfuhr 1908 stammte das meiste (67055 dz) aus Kleinasien und Spanien (24382 dz). Beträchtlich war auch noch die Zufuhr aus der europäischen Türkei (3031) und Persien, geringer die aus den russischen Häfen am Schwarzen und Asowschen Meer, aus Griechenland und den Jonischen Inseln, Syrien, Italien, Frankreich, Chile, Australien. Deutschland importierte 1909: 184665 dz Rosinen.
2. Passulae minores, Uvae corinthiacae — Kleine Rosinen, Korinthen — Raisins de Corinthe — Currants — von Vitis vinifera var. apyrena L.
Die etwa erbsengroßen, kernlosen Korinthen kommen aus Griechenland, besonders von den Jonischen Inseln (z. B. Zante), dann auch von Morea. Patras im Peloponnes ist der größte Korinthenhafen. Sie bilden einen Hauptexportartikel Griechenlands und kommen meist in Kisten in den Handel (Fig. 15).
Die Korinthen enthalten im Fruchtfleisch reichlich Weinsteinkristalle. Der rote Farbstoff ist auf die peripherischen Zellschichten beschränkt.

Beginn der Verschiffung der Korinthenkisten (10.–15 August).
[Aus Les grandes cultures.]
Sie enthalten im Mittel c. 62% Invertzucker und zwar 31–36% Lävulose und 25–30% Dextrose; im Mittel 1,52% freie Säure (auf Weinsäure bezogen) und 0,4% Apfelsäure, sowie im Mittel 2,61% Weinstein, etwas Borsäure (NORTON) und 1,84% Asche.
Griechenland, das Hauptproduktionsland von Korinthen, wohin die Rosinentraube ungefähr um das Jahr 1600 kam, produzierte 1907: 288300000, 1908: 328500000 venezian. Liter Korinthen (σταφίς) und exportierte 1907: 247238809, 1908: 201333485 venez. Liter. Viel geringer war der Export von Rosinen (Sultaninen, s. oben). Er betrug 1907: 733433, 1908: 15207440 venez. Liter (EMMANUEL). Ein venez. Liter ist = 480 g.
Die Einfuhr von Korinthen in Hamburg betrug seewärts in dz 1906: 80728, 1907: 89682, 1908: 65839. Von der Einfuhr 1908 stammte das meiste (64291 dz) von Griechenland und den Jonischen Inseln. Geringere Mengen kamen von Kleinasien, Italien, Algier. Deutschland importierte 1909: 158604 dz Korinthen.
Pathologie. Prof. ED. FISCHER berichtet über die Schädlinge: Bei der großen Bedeutung, welche der Weinrebe als Kulturpflanze zukommt, ist naturgemäß auch ihren Schädlingen eine ganz spezielle Aufmerksamkeit geschenkt worden. Die Zahl der auf Vitis vinifera nachgewiesenen Parasiten ist daher auch eine besonders große. Wir greifen im folgenden, besonders[S. 42] nach SORAUERS Handbuch der Pflanzenkrankheiten, Editio 3., nur einige der allerwichtigsten heraus und beschränken uns auf solche, die auch auf die Beeren übergehen. Im übrigen verweisen wir auf die phytopathologische Literatur, speziell auch auf VIALA, Les maladies de la Vigne und SEMLER, Tropische Agrikultur.
Plasmopara viticola (BERK. et CURT.), BERL. et DE TONI., ruft auf der Weinrebe die unter dem Namen «falscher Mehltau» oder «Mildew» bekannte Krankheit hervor, die in einer Verfärbung und im Absterben der Blätter besteht, was auch ein Kleinbleiben der Beeren infolge von Nahrungsmangel nach sich ziehen kann. Der Pilz kann aber auch Blüten und jüngere Früchte befallen und bringt letztere zum Verschrumpfen und Abfallen. Bekämpft wird diese Krankheit besonders mit der Bordeauxbrühe (vgl. TSCHIRCH, Das Kupfer vom Standpunkt der Hygiene. Stuttgart 1893).
Uncinula necator (SCHWEIN.) BURR. (U. spiralis BERK. et CURT.), eine Erysiphacee, entwickelt ihr Mycelium auf den Blättern ganz epiphytisch, bloß Haustorien in die Oberhautzellen entsendend. Es sieht daher aus wie ein spinnwebeartiger Überzug, der dann infolge der Conidienbildung mehlig bestäubt erscheint. Diese Conidienform des Pilzes ist längst unter dem Namen Oidium Tuckeri bekannt und die Krankheit wird daher kurzweg Oidium oder echter Mehltau der Rebe genannt. Besonders verderblich wird sie dadurch, daß der Pilz auch auf die jungen Beeren übergeht, die klein bleiben, Risse bekommen und zugrunde gehen. Erfolgreich bekämpft wird diese Krankheit durch Aufstäuben von Schwefelblumen.
Guignardia Bidwellii (ELL.) VIALA et RAWAZ, besonders in der Pyknidenform (Phoma uvicola BERK. et CURT.) bekannt, ruft die sog. Schwarzfäule (Black-rot) der Trauben hervor, bei der die Beeren mißfarbige, später braune Flecken erhalten, dann verschrumpfen und vertrocknen.
Charrinia Diplodiella (SPEG.) VIALA et RAWAZ, mit ihrer Pyknidenform Coniothyrium Diplodiella (SPEG.) SACC., wie die vorige ein Pyrenomycet, ist der Erreger der Weißfäule (White-rot). Die Beeren nehmen dabei erst eine grauweiße Farbe an und trocknen schließlich ebenfalls ein.
Botrytis cinerea PERS., ein grauer Schimmel, wird als Conidienform des Discomyceten Sclerotinia Fuckeliana angesehen. Auf reifen Beeren auftretend ruft er die sog. Edelfäule, auf unreifen die Sauerfäule hervor. Fäulniserscheinungen der Beeren können übrigens auch durch Penicillium hervorgerufen werden.
Gloeosporium ampelophagum (PASS.) SACC. (Sphaceloma ampelinum DE BY.), eine «Imperfecte», ist der Erreger des Schwarzen Brenners oder der Anthraknose, die auf allen Teilen des Weinstockes auftritt und auch die Beeren befällt. Letztere erhalten braune Flecken, schrumpfen und vertrocknen.
Melanconium fuligineum (SCRIB. et VIALA) CAV., ebenfalls eine Imperfekte, ruft ein Verschrumpfen der Beeren hervor, das unter dem Namen «Bitterrot» bekannt ist.
Schädlinge. Häufig finden sich in älteren Rosinen und Korinthen Milben, besonders Carpoglyphus passularum (ISRAEL).
Anwendung. Passulae gehören zu den Früchten der Spec. pectoral. cum fructibus. Abführkorinthen (passulae laxativae) werden durch Einquellen von Korinthen in Wiener Trank und Trocknen bereitet. Früher wurden auch die Weinranken (Pampini vitis) und der Saft (Omphacium) vor der Reife gesammelter Weinbeeren (Agresta) benutzt. Die Pharmazie benutzt meist Valenciarosinen (HANBURY). Gemahlene Traubenkerne sind als Kaffeefälschung beobachtet worden.
Der eingedickte Traubensaft heißt bei IBN BAITHAR thilâ (so auch bei GALEN). Frischer Traubenmost wurde schon von den Alten als Versüßungsmittel benutzt und Traubenzucker stellten schon die Araber aus eingedicktem Traubensaft dar (IBN AL AWAM, IBN BATUTA). Sie wußten bereits, daß er sich von Rohrzucker unterscheide. Er findet sich auch bei PEGOLOTTI, OLIVIER DE SERRES (1600), GLAUBER und JUNCKER (Conspectus chemiae 1730). GLAUBER stellte 1660 aus Most, Rosinen, Kirschen und Birnen körnig-kristallinischen Traubenzucker dar (I, S. 883). Rein erhielt ihn MARGGRAF (I, S. 964). Zur Zeit der Kontinentalsperre bestanden in Frankreich Traubenzuckerfabriken, die aber eingingen, als KIRCHHOFF 1811 die Darstellung des Stärkezuckersirups (Sirop impondérable, Capillairsyrup) entdeckte (VON LIPPMANN).
Geschichte. Die Heimat der Kultur des Weinstockes ist wohl in der Nähe des Caspimeeres, am Oxus und Jaxartes und südlich vom Kaukasus zu suchen. Von dort haben sie vielleicht[S. 43] die Ursemiten nach Westen gebracht, zunächst wohl nach Palästina, Syrien, Phönikien, Babylonien und Ägypten. SCHRADER hält aber nicht die Semiten für die Erfinder der Weinkultur, sondern indogermanische Stämme des westlichen Kleinasiens. Er leitet οἶνος (Wein) von dem indogermanischen voino, vino (= Ranke) ab. Das Wort Wein ist auch indogermanisch und stammt, wie vitis, von dem urindogermanischen uei = sich winden, bezeichnete also zunächst die Rebe (HOOPS). Die Phönikier brachten die Weinkultur dann nach Massilia (Marseille), von dort kam sie nach Spanien. Die Römer brachten sie nach dem Norden. In Afrika baut Tunis und Algerien sowie das Capland Wein. Auch Australien ist jetzt Weinland geworden, ebenso China. In Amerika baut Chili, Argentinien, Peru, Bolivien, Brasilien, Uruguay, Mexiko, ferner Florida, Virginien und Kalifornien Wein. In prähistorischen Tuffsteinablagerungen von Montpellier finden sich Weinblätter (PLANCHON), in Pfahlbauresten Weinbeerensamen (Heer). Wild findet sich Vitis vinifera noch jetzt da und dort in Spanien, so daß anzunehmen ist, daß sie über ganz Europa verbreitet war. In Pfahlbauten der neolithischen und Bronze-Periode sind Traubenkerne oft gefunden worden (Verzeichnis bei BUSCHAN). Schon auf ägyptischen Denkmälern aus der Zeit der V. Dynastie (um 3500 n. Chr.) finden wir Darstellungen von Anbau und Pflege des Weinstockes und Bereitung des Weines. Er hieß dort arp. Die alten Ägypter kannten acht Weinsorten. Der Weinstock muß in prähistorischer Zeit nach Ägypten gebracht worden sein. Ebenso findet er sich auf vielen babylonischen Denkmälern (I, S. 481, 483). Auch in uralten griechischen Gräbern finden sich Darstellungen der Weinernte. Auf dem Schilde des ACHILL wird die Traubenlese geschildert. Kreta, das Eldorado der antiken Heilpflanzenkultur, war in früher Zeit auch ein wichtiges Weinland, da das damalige Klima Italiens der Weinkultur nicht eben hold war (BUSCHAN). Die Weinberge von Burgund und Bordeaux bestanden schon zu STRABOS Zeit, die an der Mosel und am rechten Rheinufer im II. bzw. III. Jahrh. (HOOPS).
Bereits die alten Ägypter trockneten die Weinbeeren und bereiteten Rosinen. Man fand solche — es war besonders Vitis vinifera var. monopyrena — unter den ägyptischen Grabbeigaben (BRAUN, SCHWEINFURTH). Rosinen (inekuun — Körner) sind ein Bestandteil des Kyphi (I, S. 473). Die Rosinen werden auch in der Bibel erwähnt (in Jesaias und Jeremias), sogar bereits kernlose Beeren (sorek). Im Edikt DIOCLETIANS (I, S. 570) stehen «ubae passae fabriles et maximae». Im Mittelalter waren Rosinen nördlich der Alpen ein Luxusartikel. In den mittelalterlichen Heilmittellisten, der Alphita (I, S. 655), bei PLATEARIUS, SERAPION und in den Synonoma BARTHOLOMEI stehen passulae, uva passa, haineb, uva çibib. Rosinen (pansa) finden sich auch im Zollbuch von Barcelona c. 1430 (I, S. 705), die Danziger Liste von 1410 (I, S. 811) führt sie als Einfuhrartikel von Lissabon auf. Passulae enucleatae stehen im Nördlinger Register (I, S. 813). Bei CORDUS (I, S. 801) finden sich passulae enucleatae und mucilago sowie p. laxativae (s. oben). Traubenbeeren finden sich auch im Pen ts’ao kang mu als Heilmittel.
Lit. DELITZSCH, Die Bibel und der Wein. 1885. — WÖNIG, Pfl. d. alt. Ägypt. — HEHN, Kulturpfl. — BUSCHAN, Vorgeschichtl. Botanik. — ROSENMÜLLER, Biblische Naturgeschichte. — HOOPS, Waldbäume u. Kulturpflanzen. 1905. — VOGL, Nahr.- u. Genußm. 1899. — JOS. MOELLER, Mikrosk. d. Nahrungs- u. Genußm. (dort weitere Literatur). — T. F. HANAUSEK, Nahrungs- u. Genußm. 1884. — VILLIERS ET COLLIN, Traité d. altérat. et falsif. 1900. — HOWARD, Microsc. exam. of fruits. U. S. Agric. Dep. Bull. 66. — LAMPE, Bau u. Entw. saftiger Früchte. Zeitschr. f. Naturw. 1886. — SCHULER, Stud. über d. Bau u. d. Zusammens. d. Traubenbeere. Weinlaube 1880. — KÖNIG, Nahrungsm. (dort die chem. Lit.). — FITZ, Ber. d. chem. Ges. 1871. — Man vergleiche auch die Literatur der Unters. d. Nahrungs- u. Genußm. — Über die Rosinenbereitung vgl. auch SEMLER, Trop. Agrikultur.
δ) Zu Roobs oder Pulpen verarbeitete Früchte.
Hierher gehören die Wacholderbeeren, die Fliederbeeren, die Pflaumen, Jujuben, Sebesten und die Blaubeeren, von denen seit der Zeit der Araber Roobs (Robs, Rubbs, I, S. 1062) bereitet wurden, aber nicht immer in arzneilicher Benutzung waren. Bei CORDUS (I, S. 796) stehen auch noch folgende Roobs: R. de Ribes, de Berberis, Nucum, Diamorum, Cerasorum, Diamarenatum; in der Prager Taxe 1659: Roob Myrobalanorum; bei CORDUS unter den Lenitiva et solutiva auch: Medulla sive Pulpa prunorum.
[S. 44]
Fructus Juniperi.
Syn. Baccae Juniperi, Galbuli juniperi, Wacholderbeeren, Jachandel-, Johandel-, Kuddig-, Kattick-, Kranewitt-, Enebeer-, Reckholder-, Knirk-Beeren, — Baies de genièvre (franz.) — Juniper berries (engl.) — Bacca di ginepro (ital.) — Jenever bes (holl.) — Katajan marja (finn.) — boróka bogyó (ung.) — ἀρκευθίς (griech.).
In der Alphita und den Sinonoma (I, S. 650): geneure, gost, quikentre, grana juniperi, uva et semen. Bei der HILDEGARD: cedrus und Wacholder, bei ALBERTUS MAGNUS (I, S. 674): Juniperus, in den mittelenglischen Medizinbüchern (I, S. 683): tribulus. Weitere siehe unten unter Etym. und bei KANNGIESSER.
Etym. Wacholder (KLUGE schreibt Wachholder, beide Schreibweisen sind zulässig) von wach = lebendig (hier = immergrün) und ahd. trâ (engl. tree) ter, tar = Baum; das ol ist eine Ableitungsendung. ahd. Wecholter oder Wachholtern (zugrunde liegt das Wort wëhhalturia oder wëhhaltar), mhd. auch Queckholter (Norddeutschland), von queck = lebendig (hier = immergrün), angels. quicbeam; Wachholder auch vielfach entstellt in weckholter (BRUNSCHWIG, BOCK), wecheltürre, weckelder, wachhilter. Bei HILDEGARD auch: wachelterboum, bei MEGGENBERG: wechalter, im Ortus sanitatis und bei CORDUS: weckholder. Im mnd. wachandel. Im Gothaischen Arzneibuch (I, S. 681): wachandelenbere. Daraus im Niederdeutschen: machandel (Ostfriesland) — Jachandel (oberschles.) aus jach = munter (hier = immergrün) — Rechholder (CORDUS), Reckholder (in der Schweiz) aus reck = regsam (= queck und jach, s. oben) — kattick, kaddie, katachu vom altslav. kaditi = räuchern — kranwit (bei MEGGENBERG) kranawit, kranetwit kraewet, kranawet (Österreich), sogar kranat aus ahd. chrana (= Beere, unwahrscheinlicher aus kran = Kranich oder grôni = grün) und witu (= Holz) — knirk aus knick (= Hecke, niedriges Gesträuch, KANNGIESSER). Im Würzburger Rezept (I, S. 624) steht: aitiolidus = chraneuuito. Der Wacholder besitzt zahllose Volksnamen.
Lit. PRITZEL und JESSEN, Volksnamen. — KANNGIESSER, Etymologie. — PERGER, Studien über die deutschen Namen der in Deutschland heimischen Pflanzen. Denkschr. d. Wiener Akademie. 1860.
Stammpflanze. Juniperus communis L. (LINNÉ, Spec. plant. ed. I, 1040).
Etym. Die Ableitung von Juniperus ist zweifelhaft. ISIDOR. HISPAL. (I, S. 592) glaubt, daß in Juniperus der Begriff πῦρ = Feuer enthalten sei (nach der Form des Strauches oder weil das Holz das Feuer lange unterhält). Andere leiten es von iunix (= Kuh) und parere (= gebären) ab oder bringen es gar mit juvenis und parere (um die Benutzung von Juniperusarten als Abortiva anzudeuten) in Verbindung, noch andere mit dem keltischen Worte jeneprus = rauh. KANNGIESSER bezeichnet die Ableitung BOERHAAVES von junior und pario («da die jüngeren grünen Früchte gezeitigt werden, während die alten schwarzen noch am Strauche hängen») als die wahrscheinlichste. Aus Juniperus entstand dann genévrier (franz.), enebro (span.), genepro (ital.), zimbro (port.), ferner jenever.
Systemat. Stellung. Coniferae, Pinoideae, Cupressineae, Cupressinae (Sectio Oxycedrus). Über die sonst benutzten Arten der Gattung Juniperus vgl. TSCHIRCH, Art. Juniperus in Realenzykl. d. Ges. Pharm. VII, 178.
Die Arten der Gattung Juniperus bilden Bäume oder Sträucher mit in alternierenden, zwei- oder dreigliedrigen Wirteln angeordneten Nadeln oder Schuppen und diöcischen oder monöcischen Blüten (Fig. 16). Die männlichen Blüten werden von an der Basis von Staubblättern inserierten Pollensäcken gebildet, die weiblichen bilden einen kleinen armgliedrigen Zapfen. Die Zapfenschuppen des weiblichen Blütenstandes entstehen durch vollständige Verwachsung der Deck- und Fruchtblätter und erzeugen so einen beerenartigen Zapfen (Beerenzapfen, Galbulus, Scheinbeere), der die 1–3 (selten 4–8) Samen einschließt. Pollen ohne Exineblasen. Ovula frei, nicht in einen Fruchtknoten eingeschlossen (gymnosperm, nacktsamig), aufrecht, Integument krugförmig,[S. 45] an der Spitze offen. Zwei Cotyledonen. Bei der Sectio Oxycedrus sind die Nadelquirle dreizählig. Der Harzbehälter der Nadel (der nicht fehlt wie die Systematiker vielfach behaupten) wölbt sich nach außen nicht vor (wie bei Sabina). Fruchtschuppen mit nur einer seitlichen Blüte. Zapfenschuppen in 1–3gliedrigen Wirteln, von denen nur der obere fruchtbar ist.
Vorkommen und Verbreitung. Juniperus communis L. ist ein durch ganz Europa bis zum äußersten Norden (Nordkap, Länder um die Hudsonsbai), sowie durch Mittel- und Nord-Asien auf offenen Heiden und in Wäldern als Unterholz verbreiteter, an den Seeküsten Bestand bildender, bis in die subalpine Region der Gebirge (im West-Himalaya bis über 4000 m) vordringender, in den Tropen und Subtropen fehlender, aber z. B. in Nord-Italien häufiger, selten geselliger (Lüneburger Heide, Ostpreußen, Ungarn) und dann einen bestimmten Vegetationscharakter (s. unten) bedingender Strauch von niedrigem Wuchs, der aber auch höher (bis 3 m) wird und dann pyramidale Umrisse zeigt, oder gar baumartig (bis 12 m), und dann cypressenähnlich wird (z. B. jenseits der Alpen, in Norwegen). In Ungarn bilden Wacholdersträuche oft undurchdringliche Dickichte. Im Gebirge wird er, besonders auf Torfgrund, bisweilen humifus und die Nadeln breiter und wenig stechend (Sierra Nevada bei 2600 m, auf der Balkanhalbinsel, in Südsibirien). Solche niederliegende, in den Hochalpen, in Schottland, Skandinavien, Nowaja Semlja und Grönland vorkommende Formen werden wohl als Juniperus nana WILLD. (J. alpina GAUD., J. prostrata HORT.) oder Juniperus sibirica BURGSDORF unterschieden, aber auch als gute Arten betrachtet. Aus der Ferne erscheinen diese meist isolierten niedrigen Büsche, die übrigens oft reiche Fruchtbildung zeigen, fast wie eine Herde Schafe (ähnlich den vegetable sheeps Neuseelands). Besonders der Kalk scheint den Wuchs zu hemmen (vgl. KÖRNICKE und ROTH in KARSTEN und SCHENCK, Vegetationsbilder, 5. Reihe, Heft 1 und 2).
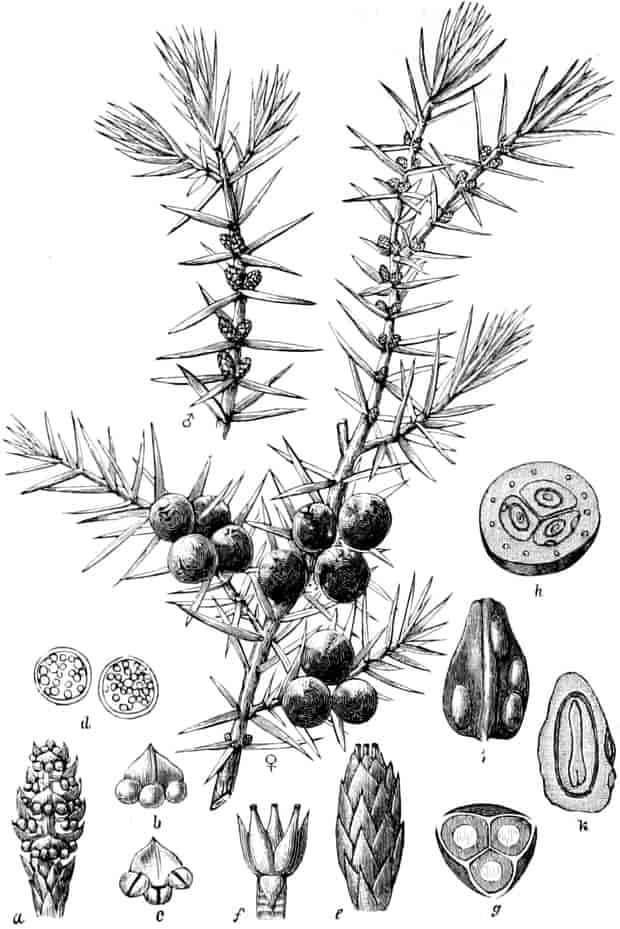
Juniperus communis L.
a, b, c, ♂ männliche, e, f, ♀ weibliche Infloreszenz, d Pollen, g Querschnitt durch f, i, k Samen.
[Nach BERG-SCHMIDT.]
[S. 46]
Wacholder, jetzt neben der Kiefer das weitverbreitetste Nadelholz Europas, muß schon in altgermanischer Zeit in ganz Deutschland gewachsen sein (HOOPS).
Beschreibung der Stammpflanze. Die anfangs glatte Rinde wird schon beim zweijährigen Sproß braun und von ihr lösen sich dann oft Schuppen und Bänder ab. Die jüngeren Internodien sind mehr oder weniger deutlich dreikantig. Die linear-pfriemlichen, abstehenden, linealen, starren, mit einer scharfen Stachelspitze versehenen, oberseits flachrinnigen Nadeln stehen in alternierenden, dreigliedrigen, genäherten Quirlen. Die Blüten stehen in den Achseln vorjähriger Blätter an kurzen Seitensprossen. Die männlichen sind fast sitzend, klein (3–4 mm), eikugelig bis oblong eiförmig. Bei den weiblichen ragen die drei aufrechten Ovula aus der ziegeldachartigen Hülle frei hervor, behüllt mit drei mit ihnen scheinbar alternierenden Fruchtblättern (Fig. 16).
Juniperus communis. Entwicklung des Galbulus.
1. Längsschnitt durch ein Zweiglein und die an seiner Spitze sitzenden Ovula vor der Befruchtung. 2. Dasselbe nach der Befruchtung. Die Fruchtblätter (hbl I) haben sich verdickt und beginnen um die Samenanlagen herum zu wachsen. 3. Die Fruchtblätter sind schon fast um die Samenanlagen herumgewachsen, doch hat sich die terminale Öffnung noch nicht geschlossen. 4. Die Öffnung ist geschlossen. Die kongenitale Verwachsung des Integumentes mit dem Fruchtblatte ist deutlich (links). 5. Reifer frischer Beerenzapfen längs durchschnitten. 6. Derselbe, quer durchschnitten.
[Nach Tschirch-Oesterle, Atlas.]
Die Entwicklungsgeschichte des Galbulus ist folgende (ausführlichere Angaben bei A. MEYER und in TSCHIRCH-OESTERLE, Anatom. Atlas). Fruchtbildende Zweiglein findet man bald in der Achsel aller drei Nadeln, bald nur in der zweier oder einer Nadel des Wirtels. Sie sind mit bis neun dreizähligen Wirteln kleiner Schuppenblätter besetzt. An der Spitze des Zweigleins sitzen die drei Ovula, von denen jedes nur ein Integument besitzt. Der Embryosack (Makrospore) entwickelt sich erst nach erfolgter Befruchtung (Mai, Juni). Im ersten Jahre entstehen nur die Embryoanlagen. Erst im Frühjahr des folgenden Jahres wird der Embryo ausgebildet. Der Beerenzapfen entsteht dadurch, daß die drei Blätter des obersten Hochblattwirtels, die man als Fruchtblätter bezeichnen kann, die zu Samen heranwachsenden Ovula umwachsen und schließlich der dadurch entstehende Becher oben fast ganz zusammenschließt — nur einen dreistrahligen Spalt zurücklassend. So entsteht ein Gebilde, das ganz den Charakter einer Beere besitzt. Der einzige Unterschied ist der, daß, während bei der echten Beere die Ovula von vornherein in einem von den Fruchtblättern gebildeten Fruchtknoten eingeschlossen sind, hier die «Fruchtknotenwand» erst nachträglich gebildet wird. Die Bezeichnung Baccae juniperi kann also,[S. 47] wenn man den Begriff Beere im erweiterten Sinne braucht, aufrecht erhalten werden. Ein Fruchtstand ist der Galbulus keinesfalls, höchstens ein «Samenstand». Am besten ist wohl die Bezeichnung «Beerenzapfen». Die Spitzen der auch seitlich ganz miteinander verschmelzenden Fruchtblätter sind selbst an der reifen Frucht noch als kleine Höcker sichtbar. Die Blätter des zweiten Hochblattwirtels, die man als Deck- oder Vorblätter betrachten kann, verwachsen bisweilen mit der Basis der Fruchtblätter. Die Samenanlagen verwachsen nicht vollständig mit den Fruchtblättern. Die Spitze der Samen bleibt frei und ragt in die terminale Höhle des dreistrahligen Spaltes hinein. An der Basis ist jedoch die Verwachsung so vollständig, daß das Gewebe der Samenschale ganz allmählich in das der Fruchtblätter übergeht (Fig. 17).
Lit. EICHLER in ENGLER-PRANTL, Pflanzenfamilien. — BRANDIS, Forest Flora of northwestern and Central India 1874. — KERNER, Pflanzenleben der Donauländer. 1863. — SCHÜBELER, Pflanzenwelt Norwegens 1875 und Viridarium norvegicum. 1888. — TSCHIRCH, In Real-Enzykl. d. Pharm. VII. — PFITZER, Entwickl. d. Embryos der Coniferen Bot. Zeit. 1871. — STRASBURGER, Die Coniferen u. Gnetaceen. 1872. — A. MEYER, Wissenschaftl. Drogenk. — TSCHIRCH u. OESTERLE, Anatom. Atlas. (Dort und bei MEYER die Entwicklungsgeschichte.) — FLÜCKIGER, Pharmakognosie. — Abbild.: BERG-SCHMIDT Atlas, II. Aufl., Taf. 155 (dort die florist. Liter.). — PABST-KÖHLERS Medizinalpfl., Taf. 53 — und in fast allen anderen Abbildungswerken von Medizinalpflanzen. Die ältesten Abbild. bei den Patres.
Pathologie. Parasitische Pilze scheinen als direkte Zerstörer der Beerenzapfen von Juniperus communis keine große Bedeutung zu besitzen, während auf Blättern und Zweigen sehr zahlreiche Parasiten bekannt sind. Wir erwähnen nur die Gymnosporangiumarten, deren Teleutosporenmycel in den Zweigen perenniert, die Herpotrichia nigra, die mit ihrem Mycel die beblätterten Zweige umspinnt, Exosporium juniperinum, das nach JACZEWSKI (Zeitschr. für Pflanzenkrankheiten XI, 1901) die Nadeln und oft auch den ganzen Strauch zum Absterben bringt, u. andere (ED. FISCHER).
Über die tierischen Schädlinge berichtet ISRAEL:
Falter: Sesia cephiformis OCHS, die Raupe dieses seltenen Glasflüglers lebt in Stengelanschwellungen von Juniperus communis. Bupalus piniarius L., die Raupe dieses häufigen und in Nadelholzrevieren oft schädlich auftretenden Spanners lebt auch an Juniperus communis. Cidaria juniperata L., Raupe an jungen Trieben. Ypsolophus juniperellus L., die kleine Raupe verspinnt die Nadeln zu kleinen Säckchen und höhlt Nadeln und junge Triebe aus.
Außer diesen leben an Juniperus noch eine große Anzahl von Mikrolepidopteren, die aber weniger in Frage kommen.
Einsammlung. Es werden nur die vollreifen Beeren des zweiten Jahres gesammelt und ohne Anwendung von künstlicher Wärme getrocknet.
Wacholderbeeren ziehen leicht Feuchtigkeit an, sie werden daher am besten über Kalk aufbewahrt. Bisweilen kristallisiert Fruchtzucker auf der Oberfläche aus. Das Pulver wird aus über Kalk getrockneten Beeren hergestellt.
Man kann die dem Insektenfraß ausgesetzten Früchte dadurch schützen, daß man sie mit Äther besprengt und in mit Äther ausgespülten, gut schließenden Gefäßen aufbewahrt (IDELSON).
Handelssorten. Wachholderbeeren kommen besonders aus Nord-Italien (Parma), Ungarn, besonders den Karpathen, Frankreich, besonders Südfrankreich und den Departements Jura, Doubs, Savoien, und Deutschland (Ostpreußen, Lüneburger Heide), weniger aus Rußland und Mähren. Der Handel spricht von italienischen, ungarischen und deutschen Wacholderbeeren. Italienische sind in Säcken à 50 oder 60 kg im Handel.
[S. 48]
Morphologie der Droge. Die Baccae juniperi sind fast kugelig, kaum schwach dreikantig und besitzen einen Durchmesser von 5–9 (meist etwa 6–8) mm — die indischen und die von Neufundland sind größer —. Außen sind sie tief braunschwarz und meist noch mit einem bläulichen Reif (Wachsüberzug) bedeckt. Nach Abwischen dieses sich leicht abscheuernden Reifes erscheinen sie glänzend. An der Basis sitzt oft noch als kleines Spitzchen der Sproßrest mit den kleinen Hochblattwirtelchen. Etwas seitlich von der Spitze erblickt man die breiten Spitzen der drei Fruchtblätter (s. oben), zwischen diesen mit der Lupe den dreistrahligen Spalt. Bei den Früchten von Juniperus nana, seltener bei Jun. comm., kommt es vor, daß der Galbulus durch Verwachsung von zwei dreizähligen Blattvierteln entsteht, also an der Spitze sechs Nähte sich zeigen. Diese Form hat GÖPPERT als Juniperus commun. var. duplicata beschrieben. Bei Juniperus Oxycedrus ist diese Erscheinung häufig (FLÜCKIGER). Das Innere ist markig-mürbe, grünbräunlich, durch zahlreiche Ölbehälter oft glänzend punktiert. Die drei sehr hartschaligen Samen lassen sich leicht herauspräparieren. Sie sind oval-oblong, stumpf-dreikantig, meist mit einem starken, bisweilen fast flügelartigen Kiele versehen, an der Mikropylarseite zugespitzt, die Spitze nach oben gerichtet. Sie sind bis zu halber Höhe mit der Fruchtschale (Zapfenschuppe) verwachsen, oben frei. Succedane Querschnitte lehren, daß die Samen an der Basis der Frucht vollkommen ringsum, in der Mitte nur außen und oben gar nicht untereinander und mit dem Fruchtblatte verwachsen sind und die Fruchtblätter unten vollkommen, in der Mitte nur an den Rändern, ganz oben gar nicht miteinander verwachsen sind. Sie tragen, in die Testa eingesenkt, an der Basis der Bauchseite 1–2, an der Rückenseite 2–8, meist ungleich große, blasige, rundlich-elliptische, beim Herauslösen meist an dem Samen haften bleibende Ölbehälter. Der gerade Embryo ist in Endosperm eingebettet.
Juniperus communis. Querschnitt durch den reifen Samen und das angrenzende Gewebe des Fruchtblattes. Die Nährschicht (4 und 5) ist bis auf die innere Epidermis (5) obliteriert, ebenso der Nucellarrest (6, 7). Die Nährschicht dringt an den Ecken (x) in die Sclereidenschicht der Samenschale (3) ein. End Endosperm, rad Radicula, scb Sekretbehälter.
[Nach Tschirch-Oesterle, Atlas.]
Anatomie der Droge. Die Epidermis der Fruchtschale ist außen stark verdickt, an den Seitenwänden getüpfelt. Sie enthalten außer dem großen Zellkern eine braune, körnige, durch Jod gelbbraun, durch Eisenchlorid grünschwarz, durch Kali goldgelb sich färbende Masse, die die tief braunschwarze Farbe der Außenseite bedingt. Die Auffassung (von NESTLER), daß die in und auf der Frucht sich sehr häufig aber nicht immer findenden Fadenpilze [Aspergillus (?), LENDNER fand mindestens drei verschiedene] die Umfärbung der grünen Beeren in Braunschwarz bedingen, ist nicht richtig. Die die Reifung begleitende, sehr rasch eintretende, schon THEOPHRAST bekannte Farbenänderung wird vielmehr bedingt durch den Sauerstoff der Luft und die Wirkung von Peroxyden und Peroxydasen auf den Gerbstoff und die harzartigen Substanzen der Epidermis (LENDNER). Der Außenwand der Epidermiszellen ist ein feinkörniger Wachsüberzug aufgelagert, den man besonders auf den frischen Früchten regelmäßig findet. Spaltöffnungen finden sich meist nur an der Spitze der Frucht. Gegen den Spalt hin werden die Epidermiszellen der Innenseite der Fruchtwand papillös und am Spalt schieben sich die Pupillen zahnartig ineinander. Auf die Epidermis folgt ein schwach kollenchymatisches Hypoderm von einigen Zellschichten. Dann wird das Gewebe rasch sehr lückig und reich durchlüftet. Die großen rundlichen Zellen enthalten einen großen Zellkern und oft noch Chlorophyllkörner (bei der unreifen Frucht auch Stärke). Bei Glycerinpräparaten kristallisiert in diesen Zellen oft Zucker in schönen Tafeln aus. In dieses mürbe Gewebe sind reichlich große, schizogene Ölbehälter eingebettet, die von elliptischer Form in der äußeren[S. 49] Fruchtwand 100–150 mik. weit, im inneren Teile der Fruchtwand eine Weite von 1–2 mm erreichen, also mit bloßem Auge sichtbar sind. Sie gehören alle zur Fruchtwand, sind aber zum Teil der Samenschale so fest eingefügt, daß sie beim Herauslösen der Samen an diesen haften bleiben (Fig. 16). Sie enthalten in der Droge meist einen hellen, zähen Balsam, bei unreifen Früchten ein farbloses Öl, bei alten[S. 50] Früchten eine bisweilen kristallinische Harzmasse. Das Öl verharzt rasch. Bei jüngeren Früchten ist das Sezernierungsepithel und die resinogene Schicht gut sichtbar. Außerdem findet man in dem Gewebe einzeln oder zu Gruppen vereinigt zahlreiche leere, bisweilen verbogene oder verkrümmte Idioblasten (Tonnenzellen MOELLERS) mit verholzter, bisweilen etwas verdickter Wand, behöften Tüpfeln oder (seltener) netzleistenartigen Verdickungen. Man kann dieselben als versprengte, metamorphosierte Tracheiden eines nicht normal ausgebildeten Tracheidensaumes oder Transfusionsgewebes betrachten. Sie sind auch im Pulver durch Anwendung von Phloroglucin-Salzsäure leicht sichtbar zu machen und finden sich auch an den Gefäßbündeln. Die zarten Gefäßbündel sind zahlreich. Drei größere, den Mittelrippen der Fruchtblätter entsprechende sind der Außenwand genähert. Innerhalb derselben finden sich je sechs in einem nach außen offenen Bogen angeordnete kleinere. Sie zeigen strahlige Anordnung ihrer Elemente und führen neben einer Gruppe derber Bastfasern mit meist linksschiefen Tüpfeln zarte Spiralfasertracheïden von meist nur 7–8 mik. Weite.
Die Samenschale zeigt folgenden Bau (Fig. 18). An den inneren Seiten, wo die Samen freiliegen, ist die aus der Epidermis des Integumentes hervorgehende Samenschalepidermis zu sehen. Sie besitzt gegen den Hohlraum hin verdickte Außenwände. Diese Epidermis löst sich frühzeitig von der darunter liegenden Schicht ab und ist beim reifen Samen als zarte Haut oft auf weite Strecken abgetrennt. Unter der Epidermis folgt eine Reihe parenchymatischer Zellen. Dort, wo der Same mit dem Fruchtblatte verwachsen ist, geht sein Gewebe ganz allmählich in das des Fruchtblattes über. Die dritte Schicht der Samenschale ist die Sklereïdenschicht. Sie besteht aus verschieden stark, besonders in den inneren Partien der Schale sehr erheblich verdickten und dort radial gestreckten Sklereïden von verschiedener Gestalt, deren Wand verholzt und geschichtet ist und die reichliche Tüpfel besitzen. Im Lumen führen sie oft einen oder mehrere Oxalatkristalle. An die Sklereïdenschicht schließt sich die Nährschicht an, die beim reifen Samen meist sehr stark obliteriert ist. Dort, wo der Same scharf dreikantig ist, dringt die Nährschicht in Form flügelartiger Zapfen in die Kanten ein. Die innere Epidermis der Nährschicht (innere Epidermis des Integumentes) obliteriert nicht. Das Perisperm ist bis auf eine zarte bräunliche, das Endosperm bedeckende Haut resorbiert, die aus fast ganz obliterierten Zellen besteht. Die Außenwand der Epidermis besteht aus drei Schichten, einer Stäbchenschicht, einer zapfenartig in die Zwischenwände vordringenden derben, gelblichen Zwischenschicht und einer hellen, inneren quellbaren Zelluloseschicht. Die ersten beiden sind cuticularisiert. Das zartwandige Endosperm enthält Öl und Aleuronkörner mit Kristalloid und Globoiden. Der innere Rand des Endosperms besteht aus Quellgewebe. Die gegen die Spitze des Samens gerichtete gerade Radicula und die beiden plankonvexen Cotyledonen enthalten ebenfalls Öl und Aleuron.
Lit. A. MEYER, Wissensch. Drogenkunde (mit Abb.). — TSCHIRCH-OESTERLE, Anatom. Atlas. — MOELLER, Pharmakognosie, 2. Aufl. u. Nahrungs- u. Genußmittel. — NESTLER, Über d. Vorkommen von Pilzen in Wachholderbeeren. Ber. d. d. Bot. Ges. 1899. — LENDNER, Bull. scienc. pharmacol. 1903. — Vgl. auch H. MONGIN, Et. anat. de la feuille des Junipérinées Thèse. Paris 1902.
Pulver. Im Pulver walten die Parenchymreste und Sklereïdengruppen vor, sowie Reste der äußeren Epidermis. Auch einzelne Sklereïden sind zu finden, ferner die Zellen des Transfusionsgewebes (s. oben) und abgebrochene Papillen der Innenepidermis der Fruchtschale. Im Ölpräparat findet man die Aleuronkörner.
Lit. KOCH, Mikrosk. Analys. d. Drogenpulv. IV. Taf. XIII.
[S. 51]
Chemie. Frische Wachholderbeeren enthalten 7,07% Invertzucker (in der Trockensubstanz 32,88%), keine Saccharose, 6,67% sonstige stickstofffreie Stoffe, 2,79% freie Säure, 0,9% Stickstoffsubstanz und 78,5% Wasser (KÖNIG).
DONATH (und FRANZ) fanden in mährischen Wacholderbeeren: Zucker 29,65% (12,62), wachsähnliches Fett 0,64% (0,094), Harz im Alkoholauszug 1,29% (1,33), ätherisches Öl 0,91% (0,89), Rohfaser 15,83% (29,43), Bitterstoff (Juniperin) 1,37% (0,24), Pektin 0,73 (1,64), Ameisensäure 1,86% (1,5), Essigsäure 0,94% (0,57), Apfelsäure 0,21% (0,43). Alte Früchte enthalten auch Buttersäure. BEHREND fand in italienischen Wacholderbeeren: 25,8% Zucker. In ganz reifen fand FRANZ 26,49%, in halbreifen aber nur 8,46% Zucker. Der amorphe Bitterstoff, das Juniperin von STEER, das sich aus einer Auflösung des Roob und aus dem Dekokte absetzt, ist schwarz, in viel Wasser und in Äther löslich. Es soll (nach VOGT) ein Glukotannid (?) sein oder enthalten. Wahrscheinlich ist auch noch Chlorophyllan darin (TSCHIRCH) und noch anderes. NICCOLET fand ein krist. Harz, welches HENRY D. J. analysierte (C = 75, H = 5%).
Im Durchschnitt liefern italienische Beeren 1–1,5, bayrische 1–1,2, ungarische 0,8–1% ätherisches Öl; ostpreußische, polnische, thüringische und fränkische Beeren geben 0,6–0,9%, schwedische 0,5% (GILDEMEISTER und HOFFMANN). Je wärmer das Klima, umso höher also der Ölgehalt (MAYER). Die ölärmsten sind die von Trondjem und Tjelwestat Orebro (Schweden).
Das meist linksdrehende Öl enthält in dem zwischen 155–162° siedenden Anteile Pinen C10H16 (TILDEN, WALLACH), in der Fraktion 260–275° Cadinen (SCHIMMEL). In dem Anteile 162–260° sind die charakteristisch riechenden Bestandteile enthalten. Ester (KREMEL) sind es hier nicht (SCHIMMEL). Die Verseifungszahl liegt meist bei 3,3–3,7 und steigt selten auf 7,4 und 16,4 (KREMEL). Im Nachlauf fand SCHIMMEL (1895) einen in Nadeln kristallisierenden Körper vom Schmelzpunkt 165–166°. Es ist dies wahrscheinlich der schon früher von BUCHNER, BLANCHET, WANDESLEBEN, ZAUBZER beobachtete Wacholdercampher (Wacholderstearopten), dem WANDESLEBEN die Formel C6H14O6 gibt.
Der Pentosangehalt beträgt 5,96–6,07%. Auch Inosit ist nachgewiesen. Das Wachs, das den Reif der Früchte bildet, besteht aus Cerotinsäure- und Palmitinsäure-Myricylalkohol neben geringen Mengen eines einwertigen Alkohols mit niedrigem Molekulargewicht und Glycerinestern (VOGT).
Der wässerige Extrakt soll nicht weniger als 20% betragen (Ph. austr.). Die Handelsware liefert bisweilen 30–32%.
Der Wacholderbranntwein (Steinhäger, Gin, Genièvre) enthält 42,5–55 Vol.% Alkohol (MANSFELD und FRANZ bei KÖNIG). Über die Herstellung des Wacholderbranntweins vgl. BEHREND, Zeitschr. Spir. Industr. 1890.
Der Aschegehalt der Früchte beträgt meist 3–4,5% und soll 5% nicht überschreiten (Ph. helv. IV). Die Asche ist grünlich.
Wenn die zerquetschten Beeren, behufs Gewinnung des ätherischen Öles, mit Dampf destilliert werden, so bleibt in der Blase eine süße Masse. Sie wird mit heißem Wasser ausgelaugt und im Vakuum eingedickt. Dies ist der Succus oder Roob juniperi (Wacholdermuß, Wacholdersalse, Kaddigmus, Johandelbeersaft, Rob de genièvre). Er riecht kaum nach Wacholderbeeröl, enthält aber bisweilen so viel Zucker, daß dieser reichlich auskristallisiert. Die Pharmakopoeen (z. B. die Helvet. IV) verstehen jedoch unter «Succus juniperi inspissatus» ein aus nicht destillierten Beeren[S. 52] unter nachherigem Zuckerzusatz hergestelltes Extrakt. Will man ein pektinreiches Extrakt, so muß die Extraktion unter gleichzeitigem Zuckerzusatz erfolgen (TSCHIRCH).
Unreife Wacholderbeeren sind nicht süß und enthalten Stärke, die später verschwindet (ASCHOFF), sowie reichlich Peroxydasen (LENDNER). Auch das ätherische Öl unreifer Früchte ist anders zusammengesetzt wie das reifer (BLANCHET und SELL). Die Pharm. brit. läßt das Ol. junip. aus unreifen Beeren destillieren.
Lit. STEER, Analys. d. Früchte v. Jun. com. Sitzungsber. Wien. Akad. XXI und BUCHN. REPERT. VI (1857). — KÖNIG, Nahrungs- u. Genußm. IV. Aufl. — DONATH, Jahresber. d. Ph. 1873. Polytechn. Journ. 1877, Vierteljahrsschr. f. Nahr. u. Genußm. 1892. — FRANZ, Ebenda. — RITTHAUSEN, Landw. Versuchsstat. 1877. — BEHREND, Chem. Zeit. 1890. — VOGT, Dissert. Erlangen 1889. — NICCOLET, Journ. d. pharm. 17 (1831). — Asche bei HAUKE, Zeitschr. d. österr. Apoth. Ver. 1902.
GILDEMEISTER und HOFFMANN, Äther. Öle. — WANDESLEBEN, Jahresb. d. Chem. 1861. — ZAUBZER, Rep. Pharm. 22. — TILDEN, Jahresb. d. Ph. 1877. — WALLACH, Lieb. Ann. 227 (1885). — KREMEL, Pharm. Post 1888. — SCHIMMEL, Berichte 1887, 1890, 1895. — MAYER, Prager Rundschau 1884. — Ältere Lit. in SCHWARTZES Tabellen und GMELINS Handb. d. Organ. Chem. V (1858). Die Ausbeute an Öl ermittelten bereits CARTHEUSER (I, S. 962) und SPIELMANN (I, S. 965). Das Öl untersuchten auch BUCHNER (Repert. 1825), BLANCHET (Lieb. Ann. 1833), DUMAS (ebenda 1835), SOUBEIRAN ET CAPITAINE (ebenda 1840).
Geschmack. Die Wacholderbeere schmeckt eigenartig gewürzhaft, süß mit etwas bitterlichem Beigeschmack.
Verwechslungen. Juniperus Oxycedrus L. (im Mittelmeergebiete bis Kaukasien) hat größere (bis 12 mm), glänzend braunrote Beeren. J. macrocarpa SIBTH. (auch im Mittelmeergebiete) hat noch größere Früchte (12–15 mm). J. phoenicea L., zur Sectio Sabina gehörig (in Südeuropa und dem Orient), hat rote glänzende Beeren von 8–14 mm Durchmesser (das Herb. Sabinae der französischen Apotheken stammt oft von dieser Pflanze. COLLIN). J. Sabina L. hat schwarze, blau bereifte Beeren von 6–8 mm Durchmesser. J. virginiana L. hat dunkelpurpurne Beeren.
Die Früchte von Juniperus macrocarpa SIBTHORP, die die Größe einer Kirsche erreichen, sind sehr süß. Noch besser schmecken die Früchte von Junip. californica, die von den südkalifornischen Indianern in großen Mengen gegessen werden (Am. journ. ph. 1878). Nur die Beeren von Juniperus Sabina sind als Beimischung in Wacholderbeeren wirklich beobachtet worden (TSCHIRCH). Die roten Beeren der Phoenicea sind leicht kenntlich.
Anwendung. Seit alter Zeit gilt Wacholder beim Volke als ein souveränes Universalmittel gegen Wassersucht (wie der Holunder). Wie hoch er geschätzt wurde, zeigt der folgende alte Vers:
Auch beim Übertragen der Krankheiten der Pflanzen spielte ehedem der «Herr Wacholder» oder «Frau Kranewitt» eine Rolle (I, S. 1008).
Um Hexen abzuwehren, werden kleine Kinder noch jetzt über Feuer gehalten, in denen man Wacholderbeeren verbrennt. Wacholderräucherungen galten auch als ein wirksames Mittel gegen die Pest:
[S. 53]
Jetzt ist die medizinische Anwendung der Beeren gering. Sie werden benutzt zu Teemischungen und Räucherungen, zu Bädern und Kräuterkissen, zum Genever (s. oben), in der Tierheilkunde zu Kropfpulvern und als Diureticum (GMEINER).
Extrahiertes Wacholderbeerenpulver, wohl aus der Öldestillation stammend, ist als Verfälschungsmittel des Pfeffer beobachtet worden (SPAETH). Es wurde in Posten zu 300 Ztr. im Handel angeboten (WAAGE).
Der serbische Schnaps Wodnijika wird durch Vergärenlassen von Wacholderbeeren mit Senf und Meerrettich gewonnen (I, S. 1018).
Lit. GMEINER, Pharm. Zeit. 1906. — SPAETH, Forschungsber. I 1893. — WAAGE, Verunrein. von Drogen. Ber. d. pharm. Ges. 1893.
Geschichte. Der Wacholder wurde im Altertum zu Räucherungen benutzt (wie auch heute noch), aber es handelte sich dabei wohl mehr um Juniperus Oxycedrus und phoenicea, die auch im südlichen Mittelmeergebiet vorkommen. Diese sind wohl auch in der Bibel (Hiob 35, 4; Könige 19, 4) gemeint. Samen und Beeren von Juniperus phoenicea (hierogl. prt šn, pershou — der Baum hieß in Ägypten ouôn, aoun, annou, arou, arlou —) sind mehrfach in Ägypten gefunden worden (SCHWEINFURTH, vgl. auch I, S. 462). In zahlreichen Rezepten des Papyrus EBERS werden Beeren von Juniperus phoenic. aufgeführt. Juniperus hieß in Ägypten «syrisches Holz», da es aus Syrien eingeführt wurde. Die Vorschrift zu dem berühmten Räuchermittel Kyphi (I, S. 473) enthielt die Früchte dieser Pflanze, die bei THEOPHRAST (I, S. 547) θυία ἄγριον ἀείφυλλον heißt. DIOSKURIDES erwähnt zwei Arten Juniperus: ἄρκευθος μεγάλη (= Junip. phoenicea oder macrocarpa?) und ἄ. μικρά (= Junip. communis [nach DAUBENY I, S. 559] ἄρκευθις nach KANNGIESSER soviel wie «verfluchter Strauch» — wegen der stachligen Blätter). Als Synonyme sind bei DIOSKURIDES in [] (vgl. I, S. 471) Mnesitheon, Akatalis, Zuorinsipet (so bei den Afrikanern = Karthagern), Libium (bei den Ägyptern), Juniperus (bei den Römern, z. B. bei PLINIUS), Joupikelluson (bei den Galliern) genannt. Auch HIPPOCRATES (I, S. 541) verwendete ἄρκευθος (wohl Junip. comm.) neben κέδρος (Junip. oxycedrus). Bei den späteren Griechen finden sich für Jun. commun. die Bezeichnungen κατζαραία, κατζούρον, κατζαρία; für J. phoenic.: κέντρος, κένδρος. Bei IBN BAITHAR heißt der Wacholder ar’ar. Bei SCRIBONIUS findet sich Juniperus (I, S. 577), ebenso bei MARCELLUS (I, S. 590) (hier Juniperum hispanum). Wacholderbeeren stehen auch in MEDDYGON MYDDFAI (I, S. 683), in der Alphita (s. oben), in Circa instans (I, S. 635), im Medicus hortus pauperum des MIZALDUS (I, S. 859), und bei CORDUS (I, S. 799). ACTUARIUS (I, S. 857) unterscheidet Baccae minoris Juniperi (J. comm.) und B. majoris Juniperi (J. phoenic.?).
Den Rob führten die Araber des Mittelalters in die Medizin ein. Das destillierte Wacholderbeerenöl wird erwähnt in SALADINS Compendium aromatariorum 1488, bei RYFF (I, S. 875), CORDUS (I, S. 801), in SCHNELLENBERGS Arzneybuch. Königsberg 1556, in FLACCUS, Estimatio materiae medicae. Berol. 1574, in dem Frankfurter Catalogus von 1582 (I. S. 817), bei VAN HELMONT (Ortus medicinae 1648) u. and. In dem Braunschweiger Register 1521 (I, S. 814) steht Ol. de granis juniperi neben Ol. junypery. Bei OTHO CREMONENSIS findet sich Classa (Resina juniperi).
Lit. BUSCHAN, Vorgeschichtliche Botanik. 1895. — SCHWEINFURTH, Die letzt. botan. Entdeck. — UNGER, Streifzüge etc. — GILDEMEISTER-HOFFMANN, Ätherische Öle.
Fructus Sambuci.
Syn. Baccae Sambuci, Holunder-, Holler-, Holder-, Aalhorn-, Elder-, Elhorn-, Schipken-, Fliederbeeren, Hutscheln, — Grana aktes im Mittelalter, — im Gothaer Arzneibuch: vleder, — in den mittelengl. Medizinbüchern (I, S. 683): hyldre. — Baies de Sureau (franz.) — Black elder fruit (engl.) — Sambuco (ital.) — Vliervrucht (holl.). — Selja puun marja (finn.) — Bodza bogyó (russ.) — καρπός ἀκτῆς (n.-griech.).
[S. 54]
Bei DIOSKURIDES, HIPPOKRATES, THEOPHRAST, GALEN: ἀκτή, auch wohl ἄκεα, ἄκτεος. Nach DIOSK. bei den Galliern: skobien, den Dakiern: seba. Bei den Arabern des Mittelalters (RHAZES, IBN BAITHAR): aktha (chamân, sabukat), in Japan: set-kotz-mo-kah.
Etym. Sambucus wohl vom äol. σάμβυξ oder σάνδυξ (= roter Farbstoff oder zum Rotfärben dienende Pflanze; nach dem Saft der Beeren). Die Ableitung vom persischen sambuca (einem dreieckigen Saiteninstrument), scheint mir zweifelhaft (zufälliger Gleichklang?). Im Mittelalter auch Riscus, Ruscus. — Holunder (besser wie Hollunder) wohl von hohl (wegen des hohlen Markes) und tar, ter = Baum (PERGER: holantar, engl. the hollowtree, der hohle Baum, hohl-ter) oder nach der Göttin HOLLA (FREYA), der der Baum geweiht war, oder von halt (= brechen, holder also Brechholz, wegen der Zerbrechlichkeit des Holzes), ahd. holuntar, holenter, mhd. holar, ellaer, holunder, holder, mnd. holdern. Er hat uralte Kultbeziehungen (vgl. das Kap. Pharmakoethnologie I, S. 1008 u. 1009) — Elder von ags. eller, ellarn = anzünden, weil durch die ausgehöhlten Zweige das Feuer angeblasen wurde (KANNGIESSER). Nach GRASSMANN hat Eller und Hollunder die gleiche Wurzel al, gotisch alan (= wachsen, sich erheben). Weitere Volksnamen bei PRITZEL-JESSEN. Die befremdende Bezeichnung Ahornbeeren ist aus Aalhornbeeren korrumpiert, dies aus ellarn (s. oben). Wie es kam, daß der Name Flieder auch auf die Syringe übertragen wurde, ist unbekannt. Flieder ist der niederdeutsche Name von Sambucus nigra. Er stammt wohl von fleder (= flattern).
Stammpflanze. Sambucus nigra L., (LINNÉ, Spec. plant. ed. I, 269). Caprifoliaceae, Sambuceae, Sect. Eusambucus.
Der schwarze Holunder ist ein Strauch oder Baum von bis 6 m Höhe mit borkiger Rinde, dekussierten Ästen, die im Jugendstadium rund, grün und von Lentizellen bedeckt sind. Ältere Äste enthalten ein großes Mark, das sich leicht in toto herauslösen läßt und dann das bei Herstellung mikroskopischer Schnitte vielbenutzte Holundermark bildet. In den Gärten finden sich viele Spielarten, die durch die Teilung der Blätter, ganze oder teilweise Panachirung oder Chlorose sich unterscheiden (laciniata, argentea, aurea, virescens, monstrosa) oder weiße Früchte besitzen (leucocarpa).
Die Pflanze ist fast durch ganz Europa bis Taurien und Kaukasien verbreitet — auch vielfach kultiviert — und geht in den Alpen weit hinauf, bleibt aber meist den Hütten benachbart. Selten sieht man dort und auch im Tal Hollunder frei. Er lehnt sich gern an die Hauswand oder sucht doch deren Nähe.
Sambucus nigra ist ein Bestandteil der Bauerngärten Deutschlands, Österreichs, Frankreich und der Schweiz, alles Länder, die unter KARLS DES GROSSEN Szepter vereinigt waren.
Lit. Abbild. BERG-SCHMIDT Atlas (dort auch die Florenliteratur). — PABST-KÖHLERS Medizinalpfl. und HAYNE, Arzneigew. IV t. 16. — Beschreib. in LUERSSEN, Med. pharm. Bot. S. 1112.
Beschreibung der Droge. Der halbunterständige Fruchtknoten der Holunderblüte (s. d.) ist meist drei- (seltener zwei-)fächerig. Er enthält drei (zwei) hängende, anatrop-epitrope Ovula. Er entwickelt sich zu einer Drupa (Steinbeere) mit drei (zwei) Samen. Die Frucht ist rundlich-oval, bis 6 mm lang, violettschwarz, oben genabelt. Das Fruchtfleisch ist purpurrot. Die einsamigen Steinkerne sind bräunlich, runzlig, außen gewölbt. Der gerade Embryo ist in Endosperm eingebettet.
Die Früchte haben einen eigentümlichen Geruch und bitterlich säuerlich-süßen Geschmack. Sie reifen im August und September. Beim Trocknen verlieren sie ⅔ des Gewichtes und schrumpfen stark.
Pathologie. Parasitische Pilze als Zerstörer der Früchte von Sambucus nigra sind uns nicht bekannt (ED. FISCHER).
Anatomie. Das Epicarp besteht aus großen, einen violettbraunen Inhalt führenden isodiametrischen oder etwas gestreckten Zellen, die infolge einer groben Faltung[S. 55] der Cuticula gestreift erscheinen (Fig. 19). Die Falten laufen in sehr regelmäßigen Abständen. Spaltöffnungen finden sich nur vereinzelt. Das Mesocarp besteht aus mehr oder weniger dickwandigen Zellen, deren Interzellularsubstanz oft verschleimt ist. Es scheint sich hier um einen besonderen Fall von Pektinmetamorphose zu handeln. Die Zellen führen einen braunen Inhalt. Das Gewebe ist von zarten Bündeln durchzogen. Das Endocarp (die Steinschale der «Steinkerne») ist sehr hart, zeigt buckelige Erhebungen, die Steinkerne erscheinen daher grobrunzelig. Zu äußerst liegt eine Reihe von kurzen, verbogenen und ineinander eingeschobenen, radial gestreckten, ungleich hohen Sklereïden mit verzweigtem, spaltförmigem Lumen (Fig. 20). Die stark verdickten Sklereïden besitzen unregelmäßigen Umriß und sind miteinander verzahnt. Dann folgt eine Schicht von ein bis zwei Reihen in der Längsrichtung des Samens gestreckter Bastfasern, dann eine ebenfalls ein- bis zweireihige Bastzellreihe, die rechtwinklig zu vorgenannten gestreckt ist. Die Anordnung der mechanischen Elemente in sich kreuzenden Schichten und Verzahnung der Zellen ist bei Frucht- und Samenschalen häufig und erhöht die Festigkeit bedeutend. Auch die Fasern der inneren Schichten sind unter sich und mit den Sklereïden verzahnt. Die Samenschale der (aus hängenden, anatrop-epitropen, mit nur einem Integumente versehenen (BOCHMANN) Ovulis hervorgehenden) Samen besteht nur aus einer obliterierten Nährschicht (Fig. 20, 1, 5). Embryo und Endosperm enthalten reichlich in Ölplasma eingebettete Aleuronkörner, bei denen man sowohl Kristalloide wie Globoide findet (Fig. 20, 4).
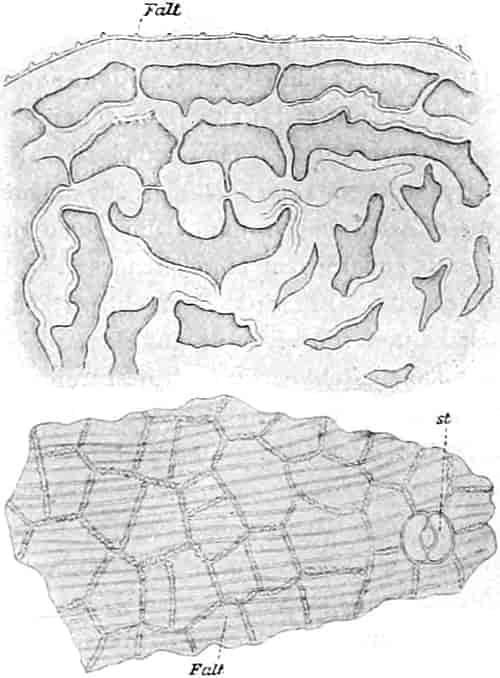
Sambucus nigra.
Oben: Querschnitt durch die Randpartie der Frucht. Das Mesokarp in Pektin-Schleimmetamorphose. Unten: Flächenansicht der Epidermis der Frucht.
[Nach Tschirch-Oesterle, Atlas.]
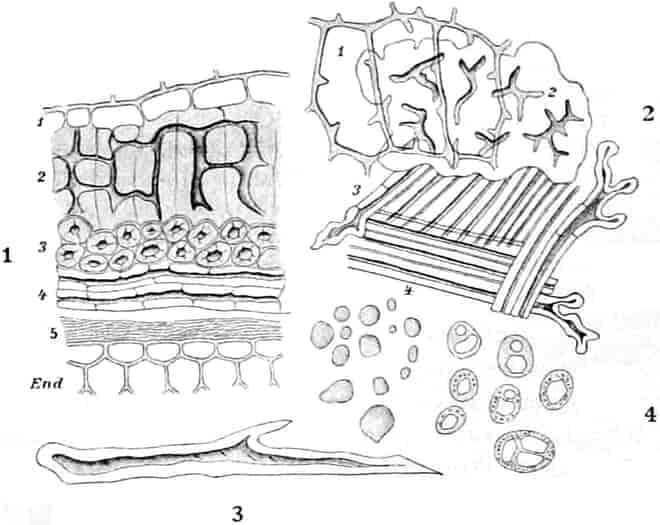
Sambucus nigra.
1. Querschnitt durch das Endokarp und den Rand des Samens. 2. Flächenschnitte durch das Endokarp. (Die Zahlen korrespondieren mit 1.) 3. Bastzelle aus Schicht 3 isoliert. 4. Aleuronkörner links in Alkohol, rechts nach Zusatz von Wasser.
[Nach Tschirch- Oesterle, Atlas.]
Lit. TSCHIRCH-OESTERLE, Anatom. Atlas (dort das Detail). — TSCHIRCH, Pectin und Protopectin. Ber. pharm. Ges. 1907. — ROSENBERG,[S. 56] Über die Pectinmetamorphose. Diss. Bern 1908. — BOCHMANN, Bau u. Entw. offiz. Sam. u. Früchte. Dissert. Bern 1901. — ARTHUR MEYER, Drogenkunde.
Chemie. SCHEELE fand Apfelsäure, aber keine Zitronensäure, ENZ (1859): gärungsfähigen Zucker, ätherisches Öl, Bitterstoff, roten Farbstoff, Baldriansäure, Propionsäure (?), Essigsäure, Weinsäure, Apfelsäure, Gerbsäure, Wachs, Gummi, Harz. KUNZ und ADAM fanden (1901) Zitronensäure, aber keine Apfelsäure. «Hinsichtlich des Fliederfarbstoffes sei bemerkt, daß verschiedene Arten Sambucus sich spektralanalytisch verschieden zu verhalten scheinen. Gewisse Arten geben mit Alaun einen deutlichen Streif gleich dem Malvenfarbstoff, während andere ein abweichendes Verhalten zeigen» (VOGEL). Der Farbstoff ist eisengrünend. Er wird durch Bleizucker lackmusblau gefällt, durch Alkalien blau, durch Säuren rot. Er tritt aus den trockenen Beeren, die an Alkohol, neben etwas (spektralanalytisch leicht nachweisbarem) Chlorophyll, nur einen gelben Farbstoff abgeben, in Wasser leicht mit violettroter Farbe über. Der mit Wasser aus der Droge hergestellte rote Auszug gibt nach dem Ausfällen der Schleimsubstanzen mittels Alkohol im Spektrum ein dunkles Band bei D etwa von λ = 0,560–0,620 und Trübung des Blau. Unabsorbiert wird nur Rot durchgelassen. Setzt man zur Lösung etwas Ammoniak, so treten zwei Bänder auf, ein dunkleres zwischen λ = 0,610 und 0,660 und ein helleres zwischen λ = 0,570 und 0,590 (TSCHIRCH). Der unbekannte schweißtreibende Bestandteil der Blüten findet sich auch in den Früchten. SACK und TOLLENS fanden in den Beeren Tyrosin. Der Pentosangehalt beträgt 1,20–1,22. Das Öl der Samen hat einen widerlichen Holundergeruch und Geschmack. Neuere Untersuchungen über die Kohlehydrate der Beeren fehlen.
Die Beeren von Sambucus Ebulus haben ähnliche Zusammensetzung (ENZ).
In der Rinde (das Fluidextrakt derselben nennt LÉMOINE Sambucin) und den Blättern findet sich neben Gerbstoff, abführend wirkendem Harz und einem Riechstoff ein krist. Alkaloid (MALMÉJAC), in den Blättern Sambunigrin (ROSENTHALER). Die Rinde, die Blätter und Wurzeln wurden im XVI. Jahrh. mehr verwendet als die Beeren und die Blüten (s. d.).
Lit. SCHEELE, Schriften 2, 378. — JOHN, Tabellen. — ENZ. WITTSTEINS, Vierteljahrschr. VIII (Jahresb. d. Pharm. 1859, S. 36). — VOGEL, Spektralanalyse. — MALMÉJAC, Journ. pharm. chim. 1901. — GOVAERTS (Blätter, Rinde) Trav. Soc. Ph. d’Anvers 1880. — SACK und TOLLENS, Ber. d. d. chem. Ges. 1904. — SACK, Dissert. Göttingen 1901. — KUNZ u. ADAM, Zeitschr. Österr. Apoth. Ver. 1901, 244. — VAN DEN DRIESSEN, Ned. Tijdkr. 1900. — ALFRED BLANC, l’Hièble (Monographie), Montpellier 1905. — Über die Blätter von Sambucus nigra vgl. MITLACHER, Aus dem Arzneischatze des Volkes. Pharm. Post. 1908 (dort die Literatur). — Historisch interessant: MARTIN BLOCHWICH, Anatomia (d. h. hier «Chemia») Sambuci or the Anatomie of the Elder. 1670.
Anwendung. Die Fliederbeeren geben gepreßt einen Saft, aus welchem man das Holunder- oder Fliedermus, die Fliederkreide, Holundersalse, Rob, Roob oder Rubb sambuci bereitet. Dieses Fliedermus findet sich schon bei den arabischen Ärzten, getrocknete Holunderbeeren dann in den Taxen des XVI. Jahrh. und später. Die niederl. Pharmakopoee hat Fruct. samb. recentes (versche vliervruchten). Den ausgepreßten Saft der Blätter von S. nigra benutzte HIPPOKRATES als diätetisches Abführmittel.
Geschichte. In steinzeitlichen Niederlassungen (z. B. Moosseedorf bei Bern) sowie in den bronzezeitlichen Terramaren Parmas sind Samen von Sambucus nigra gefunden worden (HEER). Bereits der Mensch der Steinzeit scheint die Holunderbeeren zum Färben und zur Musbereitung benutzt zu haben. Die Benutzung von Sambucus acinos zum Färben (der Haare)[S. 57] erwähnt auch PLINIUS. Von den alten Deutschen wird berichtet, sie hätten nicht nur ihr Antlitz, sondern auch die Götterbilder mit Holdersaft gefärbt (LOHENSTEIN). Bei den alten Preußen war der Holunder heilig und durfte nicht verletzt werden (GRIMM). Vgl. auch den Vers bei Juniperus (S. 52). Sambucus findet sich als Bestandteil der geweihten Kräuterkränze (I, S. 1009). Auch beim Übertragen der Krankheiten auf Pflanzen spielt der «Herr Flieder», die «Frau Holler», «Frau Ellhorn» beim Volke eine Rolle (vgl. I, S. 1008). Akte (ἀκτῆ) findet sich bei HIPPOKRATES, THEOPHRAST und GALEN. Bei SCRIBONIUS LARGUS (I, S. 578) steht sabucum und sambucum. In der Alphita, den Sinonoma, Circa instans, den Tabulae magistri Salerni steht: Sambucus (actis) hellarne, Ebulus, Kameactis Sambucus — man warf also vielfach (auch im Altertum schon) Sambucus Ebulus und nigra zusammen. Der Name Akte ging dann auf den Attich, d. h. Sambucus Ebulus über. Attich ist aus Akte umgebildet. Bei der HILDEGARD (I, S. 671) steht nur der Holderbaum; bei HARPESTRENG (I, S. 684) Sambuca; im gothaischen Arzneibuch (I, S. 679): elhorn, alhorn und holunder. Bei CORDUS steht Sambucus (flos et cimacum) neben sampsuchus, das als Maiorana gedeutet wird. (Vgl. auch KÜHN, Der Holunder in der alten Arzneikunde. Mediz. Klinik 1907, Nr. 33.)
Paralleldrogen. In Nordamerika wird der sog. amerikanische Holunder, Sambucus canadensis L., in der gleichen Weise benutzt (JACKSON, MOOSBRUGGER). Die mehr rötlichen Früchte sind süßer; in Brasilien: Sambucus australis CHAM. et SCHL.; in Sibirien: Sambucus racemosa L. (weitere in DRAGENDORFF, Heilpflanzen).
Die Beeren von Sambucus Ebulus L., des Zwergholunder (χαμαιάκτη der Griechen, Ebulum der Römer, nabsakat der Araber, hatich bei HILDEGARD), purgieren (Bestandteil des Kneipp-Tee). Sie sind kleiner, viersamig, mit deutlicher hervortretendem Kelchrest. Sambucus Ebulus ist in allen Teilen mehr oder weniger giftig. Die Beeren des Zwergholunder werden in Rumänien zum Färben des Weines benutzt (Analyse und Spektrum des Farbstoffes bei RADULESCU).
Lit. JACKSON, Pharm. Journ. 1906. — MOOSBRUGGER, Amer. Journ. ph. 1895. — RADULESCU, Bul. Soc. sc. Bucaresc. 1899. (Ber. d. pharm. Ges. Jahrber. 1899). — HOLM. Sambucus canadensis. Merck Rep. XVIII, 259 (1909).
Fructus Pruni.
Syn. Pflaumen, Zwetschen, Zwetschgen, Quätschen, Brunellen. Prunibaum (bei der HILDEGARD), — pruneau noir, prune de Damas (franz.), — prunes (engl.) — pruim (holl.) — luumu (finn.) — δαμάσκηνον (n.-griech.) — bei IBN BAITHAR: idschás.
Etym. Prunus aus dem Griechischen übernommen, sicher aber wohl aus Kleinasien stammend, wo es für Prunus domestica benutzt wurde. Nach SCHMIDT ist das ahd. phrûma (so noch im XI. Jahrb.) pflûmo, mhd. phlûme, durch thrakische oder illyrische Vermittlung direkt aus dem griechischen προῦμνον und nicht aus dem lateinischen prûnus, prunum entstanden. Im Griechischen auch: προῖνος (ein wilder Obstbaum) oder πρῶμος (= frühzeitig, da seine Früchte im Hochsommer reifen). Nach KLUGE ist dagegen Pflaume schon vor der ahd. Zeit aus dem latein. prûnum, prûna entlehnt. Das r des latein. Wortes ist ein l geworden, wie bei morus in Maulbeerbaum; ndl. pruim hat noch das r, ebenso frz. prune, ital. prugna, span. pruna; nicht mehr angls. plúme, engl. plum.
Zwetsche hat wohl ursprünglich Quetsche geheißen (Quetschen, Quetsch noch heute in Thüringen, am Rhein, in Hessen) wegen des daraus bereiteten Muses (— auch in Paris hörte ich für Pflaumenmus: quètche —), oder weil sich der Kern leicht herausquetschen läßt, oder von slav. sweska (?).
Viel mehr deutsche Volksnamen besitzt Prunus insititia, die heimische Pflaume, die im Mittelalter auch cinus, cinum, prinus, pruna, spinellum genannt wurde. Solche Namen sind: Bilse oder palse (von balgan = aufgeschwollen, bauchig?), kriech, kriecher, krigen (von chrieh, franz. crêque = stechend, ahd. chrezzan = kritzen), spilling (spinellum = Dörnlein), braume, haber, kickerling, marunken, pelzkirsche, prume, schlucken, spelje, zibarten, zipperli u. v. a. (vgl. PRITZEL-JESSEN).
[S. 58]
Stammpflanze. Prunus domestica L. (LINNÉ, Spec. plant. ed. I, 475), mit zahlreichen Varietäten, — DON kennt 270 — bes. wohl P. d. var. Juliana DC.
Rosaceae, Prunoideae, Untergatt. Prunophora.
Einige (LINNÉ, LINK, DE CANDOLLE) halten alle Pflaumen für Varietäten von Prunus domestica, andere (DIERBACH) leiten die runden Pflaumen von Prunus sativa FUCHS, die länglichen von Prunus damascena CAMER. ab, noch andere (KOCH) halten Prunus insititia L. für die Stammart der runden, Prunus domestica für die der länglichen. Zu den runden Pflaumen, mit kurzem dicken Steinkern, gehört die Mirabelle und die Reineclaude, zu den länglichen Zwetschen mit langem platten Steinkern die Damaszener und Brignoler. Nur diese blauen länglichen Pflaumen werden medizinisch verwendet. In Japan wird Prunus triflora ROXB. kultiviert. ASCHERSON und GRÄBNER halten (mit FOCKE, BOISSIER, RADDE) P. domestica L. (P. damascena DIERB., P. domestica subsp. oeconomica C. K. SCHNEIDER) für eine eigene Art, die zwar P. insititia verwandt, aber doch gut von ihr geschieden ist.
Nach ENGLER sind die heutigen Pflaumenarten von verschiedenen Stammarten abzuleiten. Prunus insititia L. (Kriecherpflaume) ist im Kaukasus und Kleinasien heimisch, geht aber bis Nordafrika und nach Süd- und Mitteleuropa. Prunus cerasifera EHRH. (Kirschpflaume) stammt nach ihm von der in Turkestan und überhaupt in Vorderasien heimischen, in Persien angebauten P. divaricata LEDEB. Die Zwetsche im engeren Sinne (P. oeconomica BORKH.) gehört zu P. domestica L., die im Kaukasus, auf dem Talysch und Elbrus sehr verbreitet ist. Ob die Reineclaude (P. italica BORKH.) eine selbständige Art ist oder nicht, will ENGLER nicht entscheiden.
Kultur und Handel. Die umfangreichsten Pflaumenkulturen finden sich in Bosnien und Serbien, wie überhaupt in den österreichisch-türkischen Grenzländern. Dort — in dem Dorado des Slibowitz — findet man ganze Zwetschenwälder, und von dort werden gedörrte Pflaumen in alle Länder exportiert. Neuerdings kultiviert Nordamerika viel Pflaumen.
Deutschland importierte 1907: 392469 dz getrocknete Zwetschen vorwiegend aus Serbien (135115) und Nordamerika, dann aus Frankreich und Österreich.
Pathologie. Neben Sclerotinia cinerea (s. unter Prunus Cerasus), die auch hier vorkommt, ist Exoascus Pruni FUCK. der wichtigste Krankheitserreger des Zwetschenbaumes. Sein Mycel entwickelt sich in den Früchten, welche dadurch eine ganz abnorme Entwicklung erfahren: sie sind verkrümmt, abgeplattet oder stark verlängert, weißlich oder rötlich gefärbt und ungenießbar, es unterbleibt auch die Differenzierung von Steinkern und fleischigem Exocarp. Diese deformierten Früchte werden als «Narren», «Taschen» oder «Hungerzwetschen» bezeichnet. An ihrer Oberfläche entstehen die Asci des Pilzes. (ED. FISCHER.)
Die tierischen Schädlinge s. unter CERASUS.
Beschreibung. Die frisch blaue, eirunde, mit einer seitlichen Rinne versehene Pflaume besitzt eine wechselnde Größe. Sie schrumpft beim Trocknen stark zusammen und wird außen fast schwarz, das Fruchtfleisch braunrot. Sie ist eine Drupa und schließt einen plattgedrückten Steinkern ein, dieser den Samen. Die den Farbstoff führenden Epidermiszellen der Fruchtschale zeigen oft noch die Teilungen der Mutterzellen. Die Epidermis besitzt einen Wachsüberzug, aber keine Haare. Oft finden sich auf der Oberfläche der Droge Zuckereffloreszenzen. Das Fruchtfleisch besteht aus Parenchymzellen. Die Gefäßbündel führen Spiral- und Netzleistengefäße. Das Endocarp besteht aus Sklereïden. Die Tonnenzellen der Samenschale (Abbild. bei WINTON) sind ziemlich klein, etwa von der Größe der Tonnenzellen bei der Aprikose. Das Endosperm ist schmal. Die Hauptmasse des Samens bilden die Cotyledonen.
[S. 59]
Chemie. Frische Pflaumen enthalten im Durchschnitt (Zusammenstellung bei KÖNIG) 78,6% Wasser, 14,71% (8,43–25,62) Invertzucker (in der Trockensubstanz der Frucht 68,74%), 0,77% freie Säure (auf Apfelsäure berechnet). Der Pentosangehalt beträgt 0,54% (WITTMANN). Das Fleisch der getrockneten Zwetschen enthält 23,28–59,20%, im Durchschnitt 43,15% Invertzucker (in der Trockensubstanz im Mittel 60,3%), im Mittel 2,44% freie Säure (auf Apfelsäure berechnet), Im Fruchtsaft der Pflaume wurde auch Saccharose (0,51–2,81%) gefunden (s. bei KÖNIG), in trockenen Zwetschen 9,33–13,2%. Die Samen enthalten c. 44,5% Fett. Die Asche der ganzen Frucht beträgt 3,17, die der Kerne 2,5, die des Fruchtfleisches 4,2% (auf Trockensubstanz berechnet). Analysen der Asche bei KÖNIG B. I, S. 862.
Die Samen enthalten ein Blausäure abspaltendes Glykosid und ein hydrolytisches Ferment. Aus den gegorenen zerstampften Früchten wird in Elsaß-Lothringen und anderwärts ein Zwetschgenbranntwein (Slibowitz, Slivovica) dargestellt, der c. 43,5–52 Vol.% Alkohol und 0,2–3,3 mg Blausäure in 100 ccm enthält. (Über seine Zusammensetzung vgl. WINDISCH, Arb. d. kais. Gesundheitsamt. 1898). Wie der Zuckergehalt der Pflaumen einem großen Wechsel unterworfen ist, so zeigt auch der Alkoholgehalt der Zwetschgenbranntweine große Schwankungen.
Durch Einkochen des mit Wasser zerquetschten, durch ein Sieb getriebenen Fruchtfleisches zu einem dicken Brei wird das Pflaumenmus (Zwetschenmus, Pulpe de pruneau, Pulpa prunorum, Rob pruni) dargestellt, das seit Jahrhunderten als mildes Abführmittel benutzt wird. Es enthält c. 24,5% Invertzucker, c. 8,8% Saccharose und c. 1,7% Pectin. Ein sirupus de prunis steht im Kalender des HARIB aus dem Jahre 961 (I, S. 612).
Schädlinge der Droge. Auf getrockneten Pflaumen finden sich oft Milben, z. B. Glyciphagus prunorum (ISRAËL).
Geschichte. Der königliche Garten des NEBUKADNEZAR enthielt nach dem Alfabet des BEN SIRA auch Pflaumen, achwānijjôt (J. LÖW). — Prunus insiticia, die Kriecherpflaume (vom germ. krik, SCHRADER), ist die europäische Pflaume, die schon für die vorgeschichtliche Flora Mitteleuropas nachgewiesen ist, nämlich in Pfahlbauten der neolithischen, Bronze- und Eisen-Periode (BUSCHAN). Unter κοκκόμηλον (von κοκκό-μηλον = Kernobst, vielleicht steckt aber in κόκκος ein orientalisches Wort) — die Schlehenpflaume hieß βράβυλον — verstand DIOSKURIDES sowohl diese heimische Pflaume, die heute noch in Griechenland coromelea heißt, wie auch die Syriens, besonders die von Damaskus, d. h. die nach der Zeit des CATO von dorther nach dem Westen gebrachte und von den Römern schon zur Zeit des PLINIUS in vielen Spielarten kultivierte Damascenerpflaume (Prunus domestica), deren Kultur sich zunächst im Orient entwickelt hatte (ENGLER). Die Römer warfen beide durcheinander. Auch noch bei der HILDEGARD (I, S. 670) scheint der Name Prunibaum beide zu umfassen, wie übrigens ja auch unser Wort «Pflaume» alle Arten umfaßt, die runden und die langen. Das Wort prunus bei ALBERTUS MAGNUS (I, S. 675) scheint sowohl für Prunus domestica wie P. armeniaca benutzt worden zu sein. Die Ausgrabungen bei der Saalburg zeigten, daß bereits in den ersten christlichen Jahrhunderten dort Pflaumen, Zwetschen und Kirschen von den Römern gebaut wurden. Das östliche Deutschland erhielt die Damascener Pflaume vielleicht aus den österreichisch-türkischen Grenzländern über Ungarn, Siebenbürgen und Mähren, wo sie jedenfalls schon vor 400 Jahren viel kultiviert wurde (RELING und BOHNHORST). Wie alt die Kultur in Serbien und Bosnien ist, ist unbekannt. Vielleicht bestand sie schon vor der slavischen Einwanderung (?). «Aus Beeren, an denen der Nordosten reich ist, ein Getränke zu machen, ist ein altslavischer oder osteuropäischer Nationalzug, der schon von HERODOT in seiner Beschreibung des hinterskytischen Landes angedeutet wird» (HEHN). Ein Prunarius steht sowohl im Kapitulare KARLS wie im St. Galler Klosterplan (I, S. 622). Das[S. 60] war aber nicht die Damascener Pflaume. In der Alphita (I, S. 656) steht pruna alba et nigra, in den Tabulae: pruna immatura et damascena, bei SERAPION: anas.
Die Pflaume spielt nicht in der Volksmedizin, wohl aber in der Volkserotik eine große Rolle, wie schon viele ihrer Volksnamen (Bockshoden, Geishoden, Hengsthoden, Tittlespflaumen, Spönling) zeigen. (Weiteres siehe bei AIGREMONT, Volkserotik.)
Lit. ENGLER, in HEHN Kulturpflanzen, VII. Aufl. 1902. — BUSCHAN, Vorgeschichtl. Botanik. — WINTON-MOELLER, Microscop. of vegetable foods 1906 (dort die weitere Lit.) — BORDZILOWSKI, Entwickl. d. beerenart. u. fleischig. Früchte. Kiew. Naturf. Ges. 1888. — KÖNIG, Nahrungs- u. Genußm. (dort die chem. Literatur). — Abbild.: HAYNE, Arzneigew. IV. t. 43 und NEES VON ESENBECK, Pl. med. t. 319.
Fruct. jujubae.
Syn. Baccae Jujubae seu Zizyphi, Rote Brustbeeren, Zieserleinsbaumbeeren, Judendornbeeren, — jujube (franz.) — jujube (engl.). — Ein Lotus der Alten (s. Geschichte). — Griech.: ζίζυφα, ζίνζυφα, ζίτζυφα (davon der Gattungsname der Pflanze). — Bei den späteren Griechen: hanab — n.-griech.: καρπός ζιζύφων — bei AVICENNA: Hunen und Zufaizef. — Schon bei SERAPION: iuiubes — Indian jujube: bér, beri (hind.) — badara, kola (sansc.), — sidr, aunnábehindi (arab.), sider wa nabk (IBN BAITHAR) — kunár (pers.) — tao n’hon (in Annam). (Die Früchte des Sidr bei IBN BAITHAR: dhâl) — Common jujube: pitni bér (hind.) — unnah (arab.) — bei IBN BAITHAR: unnāb — sinjid-i-jiláni (pers.). — Zizyphus (und Rhamnusfrüchte) heißen im Chines. Swan-tsau, Nan-tsau, tsau-pʿi.
Stammpflanzen und Paralleldrogen. Die in Deutschland und Frankreich benutzten spanischen oder französischen Brustbeeren (Common jujube, Große J., Welsche Hahnbutten, jujubier commun) stammen von Zizyphus vulgaris LAM. (Z. sativa GÄRTN., Z. flexuosa WALL., Rhamnus Zizyphus L.), kultiviert in Spanien und Südfrankreich. Die weniger süßen kleinen italienischen und nordafrikanischen von Zizyphus Lotus LAM. (Z. nummularia W. et A., Rhamnus nummularia BURM.), kultiviert in Ägypten, Italien und Südspanien. Die ostindischen Jujuben (Indian Jujube, Chinese date) von: Zizyphus Jujuba LAM. (Z. mauritiana HAM., Z. Sororia SCHULT., Rhamnus Jujuba L.), heimisch im indomalaiischen Gebiet bis nach China, kultiviert in Vorderindien, Persien, China und nach VOLKENS auch in Togo (Notizbl. d. Berl. Bot. Gart. 1909). Weitere Paralleldrogen sind: Zizyphus Oenoplia MILL. (Indien), Z. Spina Christi WILLD. (Ägypten, Palästina). Weitere in DRAGENDORFFs Heilpflanzen.
Systemat. Stellung und Beschreibung. Rhamnaceae, Zizypheae. Zizyphus vulgaris ist ein ursprünglich in China heimischer, jetzt im ganzen südlichen Europa und Nordafrika kultivierter und oft verwilderter Strauch oder Baum von 5–7 m mit dornigen Nebenblättern. Die glänzend zinnober- bis braunrote ovale, in Juli-August reifende Frucht von der Größe und der Form einer großen Olive (2–3 cm), ist eine Drupa. Sie schrumpft beim Trocknen stark und enthält einen oblongen Steinkern mit einem oft geschrumpften oder geschwundenen Samen. Innerhalb des derben lederigen Epicarp liegt ein außerordentlich weiches, markiges, reichdurchlüftetes Fruchtfleisch (Mesocarp, «Sarcocarp»), dessen Zellen da und dort Kristalldrusen führen. Das Endocarp ist steinhart. Es besteht zu äußerst aus einer breiten Schicht Sklereïden und einer schmalen inneren Faserschicht. Von den zwei Fächern ist meist nur eins ausgebildet. Die Früchte des z. B. in Tunis weit verbreiteten Z. Lotus, die kleinen Jujuben, sind kleiner, oft nur halb so groß. Die meisten großen Jujuben kommen jetzt aus der Provence sowie von den Iles d’Hyères, die kleinen aus Italien. Jujuben sind, besonders wenn ausgetrocknet, sehr dem Insektenfraß (Anobium paniceum) ausgesetzt.
Chemie. Jujuben enthalten so reichlich Zucker, und zwar sowohl Hexosen wie Saccharose (TSCHIRCH u. ERIKSSON), daß sie im Innern oft einen zähen Sirup führen und ein Schnitt durch das Fruchtfleisch (unter Öl betrachtet) übersät ist mit Zuckerkristallen. Ferner sind darin Schleim, Malate und Tartrate nachgewiesen. Schon GEOFFROY teilt eine pyrochemische Analyse mit. Im Holz von Z. Lotus fand LATOUR die krist. Ziziphussäure und Ziziphogerbsäure.
Anwendung. Jujuben «thun bei Husten etc. nicht mehr als inländische süßschleimige Dinge» (GREN 1799). Sie fanden sich in älteren Brustsirupen und Loochs oft in Gesellschaft[S. 61] von Datteln, Rosinen und Sebesten (s. d.) In der Pharm. gall. war früher ein Rob jujubae (Pulpa de jujubis) aufgeführt und die Jujuben sind ein Bestandteil der Quatre fruits pectoraux, einiger älterer Brusttees und and. (fruits béchiques, pâtes pectorales). Die säuerlich süß, frisch fast apfelartig schmeckenden Früchte von Ziziphus Jujuba werden in Indien, die von Z. vulgaris in Südeuropa gegessen. Auf Z. Jujuba bildet die Lackschildlaus einen «Stocklack» (s. d.).
Geschichte. Lotus war ein antiker Sammelbegriff. Der indische Lotus ist Nelumbium speciosum, der ägyptische Lotus: Nymphaea Lotus, der kyrenäische Lotus: Zizyphus Lotus (THEOPHRAST). THEOPHRASTS großer Lotus von Kyrene (λωτός λιβυκός d. PLINIUS): Celtis australis, die Lotusbirne: Diospyros Lotus; der Lotusklee: Trifolium fragiferum und Melilotus messanensis (WÖNIG). WÖNIG hält also nur den kyrenäischen Lotus für Zizyphus Lotus. «THEOPHRAST kennt vom kyrenäischen Lotus zwei verschiedene Spezies: die eine in Form eines Baumes, birnenartig, die zweite unter dem Namen Paliurus strauchartig (Hist. plant. IV, 3). Die letztgenannte Art hat POLYBIUS (Athenaeus XIV, 65) genau beschrieben und aus seiner Beschreibung ist ersichtlich, daß unter derselben keine andere Pflanzenart als Zizyphus Lotus W. gemeint sein kann, wie auch DESFONTAINES in einer besonderen Abhandlung erwiesen hat. (Mem. de l’acad. Paris 1788.) Dieser Zizyphus wird allgemein für den in HOMERS Dichtungen erwähnten Lotusbaum der Alten (λωτός des THEOPHRAST) angesehen. Er ist zugleich der Melilotus des STRABON (XVII, 3), aus dessen Früchten man nach HERODOTS Mitteilungen den lybischen Wein bereitete, der ein Lieblingsgetränk der ärmeren Bevölkerung Alexandriens bildete». Der zweite afrikanische Lotus ist Celtis australis. Die συρικά, Serika des GALEN war wohl auch ein Zizyphus. Unsicher bleibt, ob der Paliurus des STRABON Zizyphus Spina christi (aus dem wohl die Dornenkrone Christi hergestellt wurde, I, S. 491) ist; der ägyptische Pflaumenbaum des PLINIUS ist vielleicht Diospyrus Lotus. Nach welchem Lotus die Lotophagen benannt wurden, wissen wir nicht. Im Papyrus EBERS findet sich (nach LÜRING und JOACHIM I, S. 475) von Zizyphus Lotus außer der Frucht (für ein Pflaster) das Harz, das Holz, die Späne, ein Brod und ein Pulver. (Eine in einem ägyptischen Grabe gefundene Frucht, ehedem für Diospyros Lotus gehalten, wurde als Mimusops Kummel HOCHST. erkannt). Den Römern wurde der Brustbeerenbaum (Z. Lotus) erst gegen Ende der Regierung des AUGUSTUS bekannt. Zu dieser Zeit brachte ihn der Konsul SEXTUS PAPIRIUS aus dem Orient, der ursprünglichen Heimat, nach Italien. Der Brustbeerenbaum muß aber schon zu des PLINIUS Zeit in Italien gut bekannt gewesen sein, denn PLINIUS vergleicht die Blätter des Baumes Cypros mit denen des Ziziphus, also mit etwas Bekanntem. Jujuben stehen auch bei COLUMELLA, bei GARGILIUS MARTIALIS (I, S. 573) u. and. Die Araber bedienten sich der Früchte viel (vgl. IBN BAITHAR und das botan. Lexikon Kitâb aš-šaģar, um 980) und ebenso das Abendland. In der Alphita findet sich Jujube (hunen, zufaizef); bei BARTHOLOMAEUS (I, S. 650) poma Sancti Johannis, Jugibe in der Frankfurter Liste (1450), jujubae und jujibe bei CORDUS (I, S. 799). Jetzt sind sie ziemlich in Vergessenheit geraten. Jujuben gehören zu den Drogen erster Klasse («Fürsten») des ältesten chinesischen Pen tsʿ ao, des Shen nung Pen tsʿ ao king (I, S. 515). Sie sind dort seit Jahrtausenden bis auf den heutigen Tag hochgeschätzt.
Lit. JUSSIEU, Gen. plant I, 3798. — LAMARCK (Encyclop. und Diction.) t. 185, F. 1. — Flor. Brit. Ind. I, 632. — WATT, Diction. econ. prod. VI, 4. — Pharmacographia indica. — Abbild. bei WEBERBAUER in ENGLER-PRANTL, Pflanzenfamilien. — POMET (I, S. 941) gibt eine phantastische Abbildung der Pflanze, eine etwas bessere in VALENTINIS Museum I und in HÉRAIL, Traité de pharmacol., Fig. 66. — Abbild. von Z. vulgaris: HAYNE 10 t. 43 und Düsseldorfer Atlas 16 t. 22. — Abbild. von Z. Jujuba: RHEEDE 4 t. 41 und RUMPHIUS 2 t. 36. — GEOFFROY, Materia medica, p. 346. — SEMLER, Trop. Agrikultur. — WÖNIG, Die Pflanzen im alten Ägypten. 2. Aufl. 1886. — LATOUR, Journ. pharm. 1858, 420.
Sebesten.
Die früher sehr viel, oft (vgl. GEOFFROY) in Verbindung mit den Jujuben benutzten schwarzen Brustbeeren oder Sebesten (bei THEOPHRAST: μύξα, bei PAUL. AEGINETA: μυξάρια, bei ACTUARIUS: Sebesten) stammten von Cordia Myxa L. Sie finden sich schon im Papyrus EBERS (I, S. 463).
[S. 62]
Fructus myrtilli.
Syn. Baccae Myrtillorum, Heidelbeeren, Blaubeeren — Baies d’Airelles-myrtille (franz.) — Bilberries, Blueberries (engl.) — Bacca di mirtillo (ital.) — blauwe boschbessen (holl.) — mustikka (finn.) — καρπός μυρτίλλων (n.-griech.).
Schwarze Besinge, Bäsinge, — Bickbeere, Gandelbeere, Haselbeer, Heiti (in Bern), Kranbeere, Paudel- oder Roßbeere, Puckelbeere, Setbeer, Wolpere (in Siebenbürgen), Köhteken (= Kuhzitzen); — bei d. HILDEGARD: waltbeere und heydelbeere, — bei BOCK: Staudelbeeren, bei CORDUS: Heidel; — im athd.: Heitbere, Heitperi, im mhd.: boschbesie, brounber, heudelbeeren, kräckelbäsin, heverbesin.
Etym. Die gewöhnlichen Ableitungen von Vaccinium durch Korruption aus ὑακίνθιον oder von vacca (= Kuh) verwirft KANNGIESSER und leitet, wie mir scheint, mit Recht das Wort von bacca, baccinium (= Beerenstrauch) ab, da Umlautungen von b in v häufig sind (vetonica in betonica, valeriana in Baldrian, barbascum in Verbascum) — Myrtillus ist Diminutiv von Myrtus, weil das Sträuchlein einer kleinen Myrthe ähnlich. — Heidelbeere = Heidebeere; — Blaubeere wegen der Farbe. — Auf die dunkle, fast schwarze Farbe deuten auch die Bezeichnungen Bickbeere (holl. pik = pechschwarz), bleuets, maurets (Dunkelbeeren), brambelles, brimbelles, blaeberry, mustikka u. and. Auch die russische Bezeichnung tscherinka bedeutet Schwarzbeere. — Besie, Besing, Bei von bhan, bhâs (= glänzend).
Stammpflanze. Vaccinium Myrtillus L. (LINNÉ, Spec. plant. 349).
Systemat. Stellung und Beschreibung der Stammpflanze. Ericaceae, Vaccinioideae — Vaccinieae (Sectio Myrtillus).
Vaccinium Myrtillus.
Gipfel der Frucht. K. Kelch, verwachsen mit der (FW) Fruchtknotenwand. CSt. Ansatzstelle der Korolle. D. Diskus. Gr. Griffelansatz. S. Same.
[Tschirch.]
Die Heidelbeere ist circumpolar in Mittel- und Nordeuropa, in Asien (mit Ausschluß Innerasiens), in Kanada und dem mittleren Nordamerika bis Colorado südwärts verbreitet. Die Heidelbeere ist ein höchstens 30–50 cm hoher kahler Strauch mit eiförmig-rundlichen Blättern und einzeln achselständigen Blüten. Die Blüten besitzen einen unterständigen Fruchtknoten, der an den Seiten mit dem fleischigen Kelche vollständig verwächst und nur an der Spitze frei bleibt (Abbild. in ENGLER-PRANTL, Pflanzenfam. IV. 1, S. 24). Hier liegt ein kleiner Diskus und diesem sind Corolle und Staubfäden inseriert (Fig. 21). Die Frucht ist also, da sich[S. 63] an der Bildung der Fruchtschale auch der Kelch beteiligt, keine echte Beere, besitzt aber, da die «Verwachsung» von Kelch- und Fruchtblättern eine vollständige ist, ganz Beerencharakter (Steinbeere MÜLLER). Die durch Albinismus zustande kommende weißfrüchtige Form, Vaccinium Myrtillus L. var. leucocarpum HAUSM., kommt für uns nicht in Betracht.
Die Früchte reifen im Juli und August, werden mit hölzernen Kämmen oder Rechen «abgebürstet» und in der Sonne getrocknet. 6½ Teile frische geben 1 Teil trockene.
Handelssorten. Heidelbeeren kommen aus verschiedenen Gegenden Deutschlands, z. B. dem Fichtelgebirge, Bayern, Böhmen, Schlesien, aus Rußland. In Rußland liefern die Gouvernemente Wladimir und Moskau, sowie Polen Myrtilli.
Die Blätter von Vaccin. Myrtillus und besonders V. Arctostaphyllos bilden den sog. «kaukasischen Tee», ein Surrogat des chinesischen Tees (s. I, S. 1023).
Beschreibung. Die Heidelbeeren sind vier- oder fünffächerig, kugelig, etwa erbsengroß oder kleiner, blauschwarz, bereift. Sie schmecken säuerlich-süß, etwas herb und enthalten einen dunkel-violettroten Saft. An der Spitze liegt eine durch den unregelmäßigen Kelchsaum gerandete wulstige Scheibe, der Diskus, in dessen Mitte man die Ansatzstelle des Griffels bemerkt (Fig. 21). Durch Trocknen schrumpfen die Beeren stark. In Wasser gelegt, geben sie sofort Farbstoff ab und schwellen auf. Jedes Fach enthält zahlreiche kleine glänzende, gelbe bis gelbbraune, kurz geschnäbelte Samen mit netzadriger Oberfläche. Ihre Größe beträgt meist 1 mm.
Die Epidermis der Fruchtschale (d. h. des mit ihr verwachsenen Kelches, s. oben) besteht aus polygonalen Zellen, die blauen Zellsaft enthalten. Spaltöffnungen mit vier Nebenzellen, zwei großen und zwei schmalen, der Spalte parallelen finden sich nur an dem Kelchsaum an der Spitze der Frucht. In das Parenchym der Fruchtschale sind oft zu Nestern vereinigte Sklereïden eingebettet und auch die innere Epidermis der Fruchtschale und der Scheidewände ist teilweise sklerotisiert. Die Parenchymzellen enthalten den Farbstoff im Zellsaft gelöst und da und dort Oxalatkristalle. Die kleinen Bündel sind kollateral. Die «Verwachsung» von Kelch und Fruchtschale ist so vollständig, daß in der reifen Frucht keine Grenze zwischen beiden zu sehen ist. Die Epidermis der Samenschale besteht aus innen und an den unteren Teilen der Seiten verdickten und dort getüpfelten Zellen ohne Schleimmembranauflagerungen (Unterschied von der Preißelbeere). Die übrige Samenschale besteht aus der obliterierten Nährschicht, deren Seitenwände schief gestellt sind. Der Embryo ist in Aleuron führendes Endosperm eingebettet.
Pathologie. Über die pflanzlichen Schädlinge berichtet Prof. ED. FISCHER: In den Früchten von Vaccinium Myrtillus bildet Sclerotinia baccarum (SCHROET.) REBENT. ihr Sklerotium aus. Es stellt dieses ein hohlkugeliges Gebilde dar, welches sich an Stelle der Gewebe des Pericarpes ausgebildet hat und äußerlich wie eine schmutzig-weiße Heidelbeere aussieht. Für das Nähere vgl. WORONIN, Über die Sclerotienkrankheit der Vaccinien-Beeren. Mém. Acad. des sciences de St. Pétersbourg, Ser. VII, T. 36, 1888). Vgl. auch SENFT, Pharm. Post 1903.
Über die tierischen Schädlinge berichtet ISRAEL: An Vaccinium Myrtillus lebt eine sehr große Zahl von mehr oder minder polyphagen Falterraupen (Spinner, und besonders Eulen) aus den Gattungen Acronycta, Hadena, Mamestra, Agrotis, Anarta usw. Von Spannern ist es besonders eine Anzahl von Cidaria- und Acidaliaarten, die sich von den Blättern der Vacciniumarten nähren. Auch die Zahl der Mikrolepidopteren, die an Heidelbeeren leben, ist sehr groß.
Chemie. Heidelbeeren enthalten (nach FRESENIUS, MARTINI, MARGOLD, KULISCH und OMEIS) 4,78–6,28% Invertzucker — in der Trockensubstanz 21,29 bis 30,67% Zucker (nach KAYSER 20,13, nach BLAU 20,89%) — und keinen Rohrzucker (OMEIS fand solchen nur in unreifen Früchten), 1–1,92% freie Säure auf[S. 64] Apfelsäure berechnet und als solche wohl auch vorhanden (in trockenen Beeren gibt KAYSER 7,02% auf Weinsäure berechnet an). SCHEELE fand Apfelsäure und Zitronensäure in fast gleicher Menge und c. 0,5% Pektin. Der Pentosangehalt beträgt 0,76 bis 1,28%. Die Asche beträgt im Durchschnitt 0,71%. OMEIS und HORNBERGER fanden darin neben Eisen c. 2% Manganoxyduloxyd. Die Kerne und Schalen betragen c. 11,5 bis 13%. NYGÅRD gibt 4,5% Wasser und 2,88% Asche (der bei 105° getrockneten Droge) an.
Der Zuckergehalt der Beeren steigt während des Reifungsprozesses von 0,42 auf 1,90 und schließlich 5,06% (OMEIS). Bei reifen Beeren stellt sich das Verhältnis der Säure zum Zucker durchschnittlich wie 1 : 3.
SCHLEGEL fand im frischgepreßten Heidelbeersaft 3,92–5,57% Invertzucker, 0,15–0,74% Alkohol, 6,92–9,29 Extrakt, 0,20–0,22% Asche, Gesamtsäure (auf Weinsäure berechnet) 1,11–1,13%, flüchtige Säuren (auf Essigsäure berechnet) 0,023–0,032%. Auch Inosit ist im Safte der Heidelbeere gefunden worden (NACKEN). Benzoësäure, die NESTLER in Vaccinium Oxycoccus auffand, findet sich in V. Myrtillus nicht.
Der Farbstoff der Heidelbeeren ist im Zellsaft gelöst. Er ist löslich in Wasser und Alkohol, unlöslich in Äther, Benzol, Chloroform, Schwefelkohlenstoff. Aus neutraler und saurer Lösung geht er in Amylalkohol (SPÄTH). Er gehört zu den Anthocyanen und zwar zur Gruppe des Weinrots (WEIGERTS). Er wird durch Eisensalze dunkelbraunrot, durch Alkalien grün, durch Säuren rot, reduziert FEHLINGsche Lösung beim Sieden und soll die Zusammensetzung C10H12O8 (?) besitzen (NACKEN). Er wird durch Kalkmilch grüngrau gefällt. Er ist spektralanalytisch nicht mit dem Weinfarbstoff identisch, wie ANDRÉE meinte, sondern davon verschieden (VOGEL), welche Verschiedenheit besonders nach Zusatz von Ammoniak und Alaun hervortritt. Der Farbstoff verändert sich aber beim Trocknen der Beeren (vgl. VOGEL). Der Auszug frischer Heidelbeeren, der Blau und Rot durchläßt, zeigt ein Band bei bE, das durch Ammoniakzusatz nach D rückt, nach Alaun- und Ammoniakzusatz findet man ein breites Band d½ D bis b. Nach HEISE soll der Farbstoff aus zwei Körpern bestehen, von denen der eine, rotbraune, in saurem Wasser löslich ist, der andere, rotviolette, der die Hauptmenge bildet, nicht. Der letztere spaltet sich bei der Hydrolyse mit verdünnten Säuren in Glukose und den zuerst genannten Farbstoff. Der Farbstoff passiert den Magendarmkanal fast ohne resorbiert zu werden. Er färbt daher die Faeces und geht auch in den Urin über.
Die wirksame Substanz ist unbekannt. WINTERNITZ hält den Farbstoff dafür, andere (MÜLLER und BLAU) den Gerbstoff (Chinagerbsäure?), von dem BLAU angibt, daß er zu 7,28% der Trockensubstanz darin vorkomme. Nach NACKEN soll der Gerbstoff ein Glykosid sein. Seine wässrige Lösung wird durch Eisenchlorid grün.
Ob der von ROCHLEDER und SCHWARZ in den Blättern verschiedener Ericaceen (bes. Ledum) aufgefundene, von THAL in den Blättern und Zweigspitzen von 29 Arten der Gattungen Erica, Rhododendron, Pyrola, Vaccinium (auch V. Myrtillus), Azalea, Gaultheria, Clethra, Eriodyction, Ledum und Epigaea nachgewiesene glykosidische Bitterstoff Ericolin (C34H56O21?) wirklich auch in den Früchten vorkommt, wie ich angegeben finde, erscheint mir noch zweifelhaft. Die Blätter enthalten auch Chinasäure (SIEBERT und ZWENGER). Vgl. auch SENFT, Über d. Zersetz. d. Arbutins in Fol. Myrtilli Pharm. Post 1903.
Verfälschungen kommen kaum vor. Die Beeren von Vaccinium uliginosum L.[S. 65] (Rauschbeere) sind größer, außen heller, weniger sauer. Sie dürften wohl die gleiche Wirkung haben. Die Beeren von Vaccinium Vitis idaea. L. sind rot, wenig saftig, herbe, durch Zitronensäure und Apfelsäure sauer. Bei ihnen nimmt der Gehalt an Zitronensäure während des Reifungsprozesses zu. Er erreicht 2,5%.
Anwendung. Medizinische Anwendung fanden die Heidelbeeren vielfach. Sie finden sich z. B. in SCHROEDERS Pharmakopoeia (I, S. 890), in MURRAYS Apparatus medicaminum (I, S. 952). Als Antidiarrhoicum und bei Eczemen (äußerlich) und zu Mundspülungen empfahl sie neuerdings WINTERNITZ (in den Blättern f. klinische Hydrotherapie 1891 u. 1895). Vielfach wird das sog. Myrtillin, d. h. das Extractum myrtillorum WINTERNITZ und der Heidelbeerwein benutzt. Die Blätter wurden neuerdings (1892) gegen Diabetes empfohlen.
Heidelbeeren sind auch ein beliebtes Weinfärbemittel. Deutschland liefert davon nach Frankreich wohl besonders zu diesem Zwecke. Dann werden aber auch baies de myrtille zur Alkoholdestillation nach Frankreich eingeführt.
Geschichte. Heidelbeersamen und Fragmente der Früchte sind in steinzeitlichen Niederlassungen nur selten (Robenhausen) gefunden worden (HEER). Die Pfahlbauer benutzten die Früchte also jedenfalls nicht viel. Des PLINIUS (XVI, 31) Vaccinia scheint V. Myrtillus gewesen zu sein. Er setzt sie in Gegensatz zu einer gallischen Art (Vacc. Vitis idaea?), die zum Färben der Kleider der Sklaven benutzt wurde. In der Alphita (I, S. 653) steht Mirtus und Mirta; cujus semen: mirtillus, bei BARTHOLOMAEUS auch bloberi. Auch LONICERUS hat Mirtillus; bei CORDUS (I, S. 800): Myrtillorum succus et bacca; in der Frankfurter Liste (1450): mirti; im Nördlinger Register (I, S. 813): mirtus.
Lit. MÜLLER und BLAU, Fruct. myrtilli. Pharm. Post. 1902. S. 461. — (dort anatom. Abbild. u. auch die medizin. Literatur). — LAMPE a. a. O. — GARCIN, Rech. histogen. d. pericapes charnus. Ann. scienc. nat. 1890. — KÖNIG, Nahr.- u. Genußm. — FRESENIUS und MARTINI, Ann. Chem. u. Pharm. 101. — MARGOLD, Jahresber. f. Agrik. Chem. 1861/62. — KULISCH, Zeitschr. angew. Chem. 1894. — OMEIS, Chem. Centralbl. 1889. — SCHLEGEL, Jahresb. d. Pharm. 1908. — NACKEN, Zur chem. Charakt. d. Heidelbeersaftes. Forschungsber. 2 (1895). — ANDRÉE, Arch. d. Pharm. 1880. — HEISE, Pharm. Centrh. 35. — H. W. VOGEL, Chem. Zeit. 1888 und Spektralanalyse 1889 (dort die Spektren). — SPÄTH, Zeitschr. Unters. d. Nahrungs- u. Genußm. 1899. — GAUTIER, Bull. soc. chim. 25 (Arch. d. Pharm. 9, S. 486). — MÜNZBERGER, Zeitschr. d. Öster. Apoth. Ver. 1893, 370. — R. KAYSER, Repert. d. analyt. Chem. III, 182. — OMEIS, Studien über die Entwickl. d. Frucht d. Heidelbeere. Mitt. pharm. Inst. Erlangen, II. Heft (Pharm. Centrh. 1889). — ROCHLEDER u. SCHWARZ, Sitzungsb. d. Wien. Akad. 9 u. 11. — THAL, Pharm. Zeitschr. f. Rußl. 1883. — NEVINNY, Rauschbeeren und Heidelbeeren. Zeitschr. f. Hyg. u. Infektionskr. 1908, 95. — Analysen der Heidelbeeraschen bei KÖNIG, I, S. 862.
ε) Frische zu Sirupen verarbeitete Früchte.
Nicht als Drogen, sondern nur im frischen Zustande werden verwendet: Kirschen, Maulbeeren, Himbeeren, Brombeeren, Moltebeeren. Dieselben können auch zu den Säuredrogen gestellt werden, da sie, wie bereits SCHEELE fand, aliphatische Säuren enthalten (s. d. chem. Zusammensetzung), stehen aber richtiger hier an dieser Stelle.
Fructus Rubi idaei.
Syn. Himbeere, Himpbeer (bei BRUNSCHWIG), Hindbeere (bei GESNER), Hindelbeere, Hinkbeere, Entabeer, Höntabeer, Hünkbeer, Ampe, Maline. Im althd. findet sich hintperi, hint-bẹri; im mitthd. hintbẹr auch haiper; heorotberge, herutbeg,[S. 66] hindberige (angels. hier Erdbeere und Himbeere bedeutend) — hind-berry (engl.) — hind baer (norw.), bei CORDUS: himpen (die Frucht: himper) — frambroise (franz.) — raspberry (engl.) — framboos (holl.) — lampone (ital.) — vattu (finn.) — erdei málna (ung.) — καρπός ἰδαίας βάτου (n.-griech.) — fuh-pwʿan-tsze (chin.).
Etym. DIOSKURIDES sagt: «βάτος ἰδαία ἐκλήθη μὲν διὰ τὸ πολλὴν ἐν τῇ Ἴδη γεννᾶσθαι». Ebenso äußert sich PLINIUS. Himbeere (so z. B. schon bei BOCK), angeblich = Hindbeere, d. h. Hindin- oder Hirschkuhbeere, soviel als Waldbeere, vielleicht aber von hünk = Honig oder von Hain (?). — Ampe von Ampornola. — Maline von slav. malina. — Raspberry von rasp = raspeln, schaben, kratzen, wegen der stachligen Zweige (KANNGIESSER). Auch der spanische Name zarza idea erinnert an die Stachlichkeit. — Framboscia (1537) bei RUELLIUS [daraus framboise (franz.) und framboos (holl.)] aus dem deutschen Brombeere umgebildet. Über Rubus vgl. unter Rubus fruticosus.
Stammpflanze. Rubus idaeus L. (LINNÉ, Spec. plant. edit. I. 492), Mit zwei Varietäten var. viridis AL. BR. und var. anomala ARRH. (auch wohl noch: var. denudatus SPENNER, β. spinulosus MÜLL. und γ. trifoliatus BELL SALTER).
Systemat. Stellung. Rosaceae — Rosoideae — Potentilleae — Rubinae, Sectio Idaeobatus.
Rubus idaeus ist eine Circumpolarpflanze. In lichten Wäldern, an Hecken, steinigen Berghängen durch ganz Europa (mit Ausnahme der südlichsten Teile) vorkommend, geht die Pflanze in Norwegen bis zum 70. Breitengrade, in Asien bis Nordsibirien hinauf und steigt auch in Skandinavien noch bis 1200 m an den Bergen empor. Sie findet sich auch in Grönland und auf Sacchalin. Sie wird auch vielfach in Gärten kultiviert (neuerdings auch amerikanische Mischlinge mit Rubus occidentalis L.), aber niemals durch Samen fortgepflanzt. Die in Amerika kultivierte Himbeere ist nach BAILEY ein Sprößling des dort einheimischen Rubus strigosus MICHX., der mit der europäischen Himbeere (R. Idaeus L.) verwandt ist (WINTON).
Pathologie. Über die Feinde der Himbeere und der Brombeerarten, die sich nicht ohne Zwang trennen lassen, berichtet ISRAEL:
1. Käfer: Byturus fumatus FB., Himbeermade. Die Larven dieses Käferchens leben in den reifenden Himbeeren, welche sie ausfressen. Haltica rubi FABR. Soll auf Rubus idaeus leben. Anthonomus rubi HERBST. Dieser Blütenkäfer lebt vorzüglich auf Rubus- u. Prunusarten.
2. Falter: Argynnis daphne W. V., A. paphia L. Raupen an Rubus- und Violaarten. Syrichthus malvae L. Raupe an Fragaria und Rubusarten. Thecla rubi L. Raupe an Rubusarten, Sarothamnus und Genistaarten. Bembecia hylaeiformis LASP., Himbeer-Glasflügler. Die Raupe dieser Sesie lebt in den Wurzeln und unteren Stengelteilen der Himbeerbüsche, dieselben ausfressend. Man findet die Raupe häufig im Frühling in den vorjährigen Stengeln, die sich leicht ausreißen lassen. Callimorpha dominula L., C. hera L. Raupen an Rubusarten, Nesseln und Salweiden usw. Arctia caja L., Raupe ziemlich polyphag, auch an Rubusarten. Gonophora derasa L., Thyatira batis L., Raupen an Rubusarten, nicht überall häufig; derasa mehr in den Mittelgebirgen. Acronicta leporina L., A. rumicis L., Raupen an Rubusarten, Waldweiden und vielen niederen Pflanzen. Xanthia fulvago L., Raupe an Rubus- und Salixarten usw. Gnophos obscuraria HÜBN., Raupe an Rubusarten.
Auch sonst leben gelegentlich an Rubusarten sehr viele polyphage oder fast polyphage Raupen von Spinnern, Eulen, Spannern und Mikrolepidopteren, die hier nicht alle mit den Namen angeführt werden können. Überhaupt sind die Blätter von Rubusarten ein sehr beliebtes Futter, welches von sehr vielen Raupen angenommen und gerne gefressen wird. Im Frühlinge gesammelte, überwinterte Raupen, von denen man oft die Futterpflanze nicht kennt, die aber meist nicht sehr wählerisch im Futter sind, nehmen sehr oft Rubusarten als Futter an, und lassen sich damit zum Imago erziehen.
3. Fliegen: Lasioptera rubi HEEG. Diese kleine Fliege legt ihre Eier in die noch krautartigen Schößlinge der Himbeerbüsche. Durch den Fraß der jungen Maden entstehen[S. 67] längliche Anschwellungen (Stengelgallen), die man sehr häufig an Himbeerstengeln wahrnimmt. Im Frühling fliegen die fertigen Insekten aus den mittlerweile verholzten Gallen aus.
4. Schnabelkerfe: Aphis rubi KALT. an Rubusarten, besonders an den Blättern, seltener auch an den krautartigen Stengeln.
Beschreibung. Die Himbeere ist keine Beere, sondern eine Sammelfrucht, die aus einer Gruppe von Fruchtknoten hervorgeht, die in einer Blüte vereinigt sind. Jedes einzelne Früchtchen ist eine Drupa mit saftigem Mesocarp und sklerotischem, beim Herauslösen des Samens an diesem als grubige Hülle haften bleibendem Endocarp. Die 20–50 Einzelfrüchtchen liegen auf dem Fruchtboden so dicht nebeneinander, daß sie sich gegenseitig abplatten. Sie sind behaart und tragen noch den c. 4 mm langen, etwas unter dem Fruchtscheitel inserierten Griffel. Die schön rote (seltener gelbliche) Sammelfrucht löst sich als hohles, halbes Ellipsoid von dem an dem Stiel bleibenden Fruchtboden ab, der an seiner Basis die Reste des Kelches und der Stamina trägt. Die abgelöste Himbeere sieht aus wie ein umgestülpter Topf und die chinesische Bezeichnung fu-pau-tsze heißt denn auch «umgeworfene Schüssel».
Die Himbeere reift im Juli oder August. Nur die roten werden verwendet, die weißen und gelben sind Albinoformen. Die aromatischeren, duftreicheren Waldhimbeeren werden bevorzugt.
Rubus strigosus.
I. Sammelfrucht in nat. Gr. II. Querschnitt durch ein Früchtchen. Epi Epidermis. Hy Hypoderm. Mes Fruchtfleisch. F Steinschale (Endocarp). S Samenschale. R Raphe. E Endosperm. Em Embryo. III. Steinkern in natürlicher Größe. IV. Derselbe 8fach vergr.
[Nach A. L. Winton.]
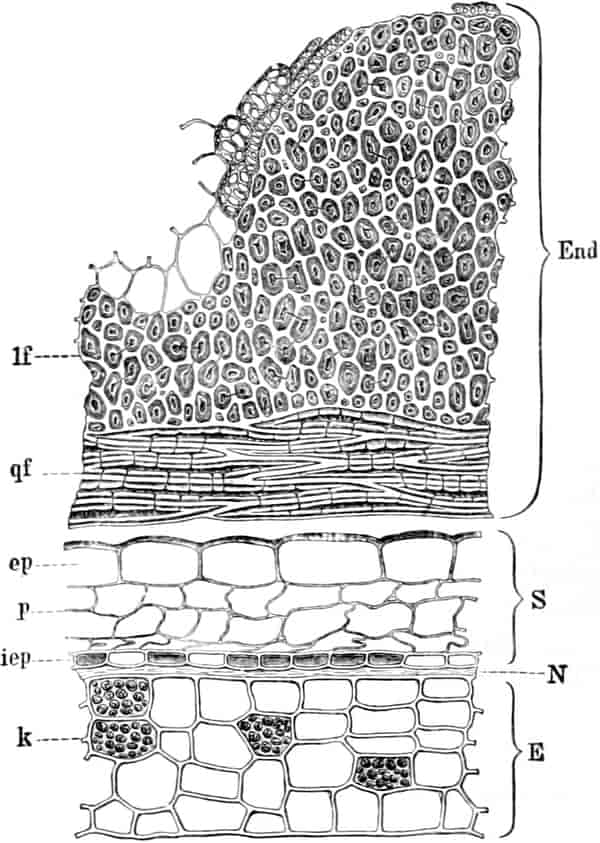
Rubus strigosus.
Steinschale und Randschicht des Samens im Querschnitt. End Endocarp. S Samenschale. E Endosperm.
[Nach A. L. Winton.]
Lit. BAILEY, the evolution of our native fruits. London 1898. — FLÜCKIGER, Pharmakognosie. — ARECHOUG (Über d. Abstam. u. d. Verwandtsch. d. Rub. idaeus). Journ. of bot. 1873 (Bot. Jahresber. 1874). — Abbild. in BERG-SCHMIDT, Atlas d. offiz. Pfl. 2. Aufl. Taf. 64 (dort die florist. Lit.). — PABST-KÖHLER, Medizinalpfl. Taf. 43. — HAYNE, Arzneipfl. III t. 8 u. and. — Über die schwierige Gattung Rubus vgl. auch FOCKE in Engler-Prantl, Pflanzenfam.
Anatomie. Das Pericarp ist von einer aus polygonalen Zellen bestehenden Epidermis bedeckt, die Spaltöffnungen und an den freien Flächen der Frucht lange[S. 68] einzellige Haare in großer Zahl trägt, die so stark verfilzt sind, daß sie der Oberfläche ein sammetartiges Aussehn verleihen. Unter der Epidermis liegt eine Schicht kollenchymatischer Zellen. Das Mesocarp (Fruchtfleisch) besteht zu äußerst aus kristallführenden, vorwiegend aber aus radial gestreckten dünnwandigen Parenchymzellen, das sklerotische Endocarp aus zwei Schichten, einer die höckerige Beschaffenheit der herausgelösten «Steinkerne» bedingenden, ungleich breiten, äußeren Schicht, die aus längsgestreckten und einer schmalen inneren Schicht, die aus vorwiegend quergestreckten Zellen besteht. Die Richtungen der Zellen der beiden Schichten kreuzen sich also.
Die zarte Samenschale ist stark zusammengefallen, besonders in der Nährschicht. Nur die Epidermen pflegen gut erhalten zu sein. Das Perisperm, der Nucellarrest, bildet eine schmale helle Zone. Das Endosperm dagegen ist mehrere Zellreihen dick. Die kleine Radicula liegt an der Spitze des Samens. Die großen oblongen, plankonvexen, fleischigen Cotyledonen bilden die Hauptmasse des Samens.
Der erhalten bleibende lange Griffel ist am Grunde verbreitert und dort behaart. Die Epidermis ist kleinzellig, das Gewebe enthält Oxalatdrusen.
Lit. TSCHIERCKE, Beitr. z. vgl. Anat. u. Entwicklungsg. einiger Dryadeenfr. Zeitschr. f. Naturw. 1886. — WINTON, Beitr. z. Anat. d. Beerenobstes. Zeitschr. Unters. Nahr.- u. Genußm. 1902 (auch Rep. Connect. Agr. Exp. Stat. 1902) (mit zahlr. Abbild.). — MOELLER-WINTON, Nahrungs- u. Genußm. 2. Aufl. (mit Abbild.). — VILLIERS ET COLLIN, Altérat. et Falsific. d. subst. aliment. 1900. — MARPMANN, Beitr. z. mikrosk. Unters. d. Fruchtmarmelad. Zeitschr. angew. Mikrosk. 1896.
Chemie. Die frischen Früchte liefern c. 70 (67–78)% Saft, der sich durch Gärung klärt. Frische Himbeeren enthalten im Mittel 4,38–4,7% Invertzucker (das Verhältnis von Lävulose zu Dextrose ist wie 4,6:2,5), keinen oder wenig (0,72 bis 2%, BUIGNET: 0,95%) Rohrzucker, Apfel- und Zitronensäure: 1,48% freie Säure (auf Apfelsäure berechnet). Auch Ameisensäure ist nachgewiesen und sehr kleine Mengen Salicylsäure (wohl als Methyläther, TRAPHOGEN), 1,45% Pektinsubstanzen, 2,08% Pentosane, 0,32% Asche (enthält viel Kali und Phosphorsäure, GOESSMANN). In der Trockensubstanz finden sich im Mittel 35,82% Zucker. Waldhimbeeren sind ärmer an Zucker als Gartenhimbeeren. Sie enthalten davon nur c. 2,8–3,5% (GALLENCAMP, ZERVAS, SEIFFERT). Im Himbeersaft werden neuerdings Zitronensäure (0,65–0,75%) und Weinsäure (0,18–0,22) angegeben (KAYSER 1906). PABST erklärte Apfelsäure und Zitronensäure als vorherrschend. SCHEELE fand Zitronensäure und Äpfelsäure etwa in gleichen Mengen, BLEY im Verhältnis 8 : 13. Das Aroma (der Riechstoff) scheint ein Fettsäureester zu sein.
Aus dem destillierten Aqua Rubi idaei scheiden sich Flocken ab, die ausgeäthert in kleinen Blättchen erhalten werden können, die in Alkohol und Äther und auch in Wasser und Kalilauge sich lösen (BLEY).
Die fast regelmäßig im Himbeersaft auftretende Nachtrübung ist auf mikrokristallinische Abscheidung von Ellagsäure zurückzuführen (KUNZ-KRAUSE und SCHWEISSINGER).
HEFELMANN fand in frischen Preßsäften sächsischer und werderscher Himbeeren im Mittel 0,437% Asche, die Alkalinität der Asche war = 5,64 ccm Normallauge. Das Verhältnis von Asche zur Alkalinität sinkt nicht unter 1 : 10 herab (BEYTHIEN und WATERS). Die freie Gesamtsäure betrug 1,561% (auf Apfelsäure berechnet). Der Alkoholgehalt 2,99%. PABST fand im Liter Saft 46 g Lävulose und 25 g Dextrose.
[S. 69]
Die freie Säure beträgt in vergorenem Himbeersaft im Mittel 1,836% (auf Apfelsäure berechnet), die flüchtige Säure, auf Essigsäure berechnet, im Mittel 0,359% (SPÄTH), die Asche 0,515%.
Der Farbstoff ist nicht näher untersucht. Er ist in der Pflanze im Zellsaft gelöst, gehört also zur Gruppe der Anthocyane MARQUARTS und zwar zur Gruppe des Weinrots. Er ist mit dem Weinrot selbst verwandt (PABST). Der Himbeerfarbstoff gibt im Spektrum zwei nicht scharf getrennte Bänder, eins bei E und ein zweites zwischen b und F, die aber bald zu einem breiten Bande zwischen D½ E und F zusammenfließen (V. LEPEL). Ausgepreßter Himbeersaft entfärbt sich mit der gleichen Menge Salpetersäure (spez. Gew. 1,2) gemischt erst nach 2–3 Tagen. Äther, Essigäther, Amylalkohol, Chloroform nehmen den Farbstoff nicht auf. Bleiessig gibt mit Himbeerpreßsaft einen starken grünen Niederschlag, das Filtrat ist schwach gelblich. Vergleiche zwischen den Reaktionen der Farbstoffe der Himbeeren, Kirschen und Heidelbeeren stellten VAN DEN DRIESSEN-MAREEUW, SPÄTH u. and. an (vgl. Jahresber. d. Pharm. 1900, S. 588). Über Nachweis von fremden Farbstoffen im Himbeersaft vgl. RIEGEL (Pharm. Zeit. 1897, S. 247).
Der mit Wasser verdünnte Himbeersirup gibt, der Kapillaranalyse unterworfen, eine untere, schwach schmutzigviolette, c. 2,8 cm breite und eine darüber liegende, fast farblose, steif anzufühlende Zone. Nach Zusatz von etwas Fuchsinlösung erhält man eine 3 cm breite, schmutzigviolette Zone, darüber 0,15 cm lebhaft fuchsinrot mit violettem Stich, 1,1 cm hell fuchsinrot und zu oberst 5,5 cm rötlicher Schein (GOPPELSRÖDER).
In den Himbeerkernen sind 14,6% eines fetten, stark trocknenden Öles enthalten, welches Linolsäure, Linolensäure, Ölsäure und Isolinolensäure enthält (KRIŻIŻAN).
Lit. KÖNIG, Nahr.- u. Genußm. — BLEY, Arch. Pharm. (2), 13 (LII). — REICHARDT (SEYFFERT), Arch. Pharm. (3) 12 (1879). — Analysen von GALLENKAMP (1854) und ZERVAS (1855) in Jahresber. d. Chem. 1857, S. 636. — GOESSMANN, Amer. Chem. Journ. 1. — BUIGNET, Ann. chim. et pharm. (3) 61 (1861). — TRAPHOGEN und BURKE, Journ. Amer. chem. soc. 1903 (Pharm. Zeit. 1903, S. 323). — HEFELMANN, Zeitschr. f. öffentl. Chem. 1905. — BEYTHIEN u. WATERS, Zeitschr. f. Unters. d. Nahr. u. Genußm. 1905. — V. LEPEL, Über d. Verhalt. v. Fruchtsäften verschied. Alters gegen Reagent. Zeitschr. Anal. Chem. 1880 (dort auch die Spektren der Reaktionen). — H. W. VOGEL, Spektralanalyse. — (Farbstoff) PABST, Bull. soc. chim. 1885 und VAN DEN DRIESSEN, Ned. Tijdschr. 1900. — KUNZ-KRAUSE u. SCHWEISSINGER, Apoth. Zeit. 1907, S. 825.
Über Himbeersaft vgl. die zahlreichen Arbeiten in den Zeitschriften für Untersuchung der Nahrungs- und Genußmittel.
Geschichte. Aus den Pfahlbauten sowohl der neolithischen wie der Bronze-Periode kennen wir Steinkerne der Himbeeren (BUSCHAN). Die Himbeeren und Brombeeren der Pfahlbauer stammten jedenfalls von wildwachsenden Pflanzen (HOOPS). — βάτος war bei den Griechen die Himbeere und die Brombeere, βάτος ἰδαία (bei DIOSKURIDES) vielleicht die Himbeere (FRAAS), benannt nach dem Berge Ida (entweder der Psiloriti auf Candia, wo aber jetzt keine Himbeeren mehr wachsen, oder der Kaz dagh in Nordwest-Kleinasien, FLÜCKIGER). βάτος ἀκανθώδης des THEOPHRAST war möglicherweise auch Rubus idaeus, jedenfalls βάτος ὀρθοφυής. Rubus idaeus steht schon bei PLINIUS, ob aber damit unsere Himbeere gemeint ist, wie FRAAS will, ist fraglich. Bei den arabischen Schriftstellern fehlt sie, ebenso bei der HILDEGARD (I, S. 667) und bei ALBERTUS MAGNUS (I, S. 672). Der Rubus der Alphita ist wohl die Brombeere (s. d.). Ob die Griechen und Römer unsere Himbeeren benutzten, ist nicht ganz sicher. Das Mittelalter beachtete sie nicht. CORDUS (Dispensatorium I, S. 800) benutzte die Früchte (Mora Rubi idaei) neben Maulbeeren und Erdbeeren zum Rob Diamoron. Der Syr. rubi idaei scheint zuerst von GESNER (Epistolar. medicin. libr. III, vgl. I, S. 847) dargestellt worden zu[S. 70] sein, den seine herrliche Farbe, sein höchst angenehmer Geschmack und Geruch entzückten (vgl. FLÜCKIGER, 3. Aufl. S. 862). Die Pflanze beschrieben BOCK, FUCHS, CORDUS. BOCK gab eine Abbildung. In BAUHINS Pinax heißt sie Rubus idaeus spinosus.
Fructus Rubi fruticosi.
Syn. Brombeere — baie de ronce (franz.) — blackberry (engl.) — braambes (holl.) — heggi málna (ung.).
Brämel, Bramel, Brambla, Brombesing, Haiper, Swartjebeere; angels.: brēmbelaeppel, braemelberian, blace berian, — arab.: ullaik, ʿullaiq, ollaik (bei IBN BAITHAR). Dieser Name umfaßt aber wohl, ebenso wie bâthus, thut elwahschi, auch die Himbeere; — brema, brama (HILDEGARD), kratzen, bramenbeer (CORDUS), prumen, brambernstruch (Ort. san.), prauper (MEGENBERG) — chin.: hiuen-tiau-tsze.
Stammpflanze und systemat. Stellung. Rubus fruticosus L. mit vielen Spielarten, oder in verschiedene Arten aufgelöst. Rosaceae, Rosoideae — Potentilleae — Rubinae.
Etym. Rubus im Latein. Kollektivum für verschiedene (dornige) Sträucher; vielleicht von ῥάπτειν stechen, unwahrscheinlicher von reber = rot, denn nur die unreife Frucht der Brombeere ist rot; aber auch das franz. ronce ist wohl verwandt mit rouge = rot; mures ist wohl von μαυρός schwarz, wegen der schwarzen Farbe der reifen Frucht, abzuleiten. Das Gleiche sagt das englische blakeberien, blackberry (KANNGIESSER). Der Name Brombeere von mhd. brame = Dorn deutet auf die dornige Beschaffenheit, ebenso das englische bramble und das niederländische brambezi. — mhd. brâmber, ahd. brâmberi, eigentlich die Beere «einer Dornart», ahd. brâmo, mhd. brâme (auch «Dornstrauch» überhaupt, KLUGE). Im Mittelalter finden sich auch die Namen morus rubi, citromora, batus (in der Alphita = Rubus ferens mora, bedegar) mora bati, mora silvatica, dumus, genesta, Morabati, Vepres.
Rubus fruticosus, die europäische wilde Brombeere, die über Europa und Asien verbreitet ist, findet sich in Nordamerika weder wild noch in Kultur. Dort wird sie vertreten durch Rubus villosus AIT. (kriechende Brombeere, Taubeere), Rubus canadensis L. (dornenlose Brombeere) und Rubus nigrobaccus BAIL. (große oder Buschbrombeere, gemeine amerikanische Buschbrombeere). Rubus nigrobaccus var. sativus BAIL. ist der Stammvater der meisten Gartenvarietäten.
Beschreibung. Die Brombeere ist der Himbeere (s. d.) ähnlich gebaut, doch sind die Früchtchen kahl und dem Fruchtboden angewachsen. Die Brombeer-Sammelfrucht löst sich also nicht so leicht von diesem ab wie die Himbeere. Die Epidermiszellen der Fruchtwand sind gestreckt. Die Griffel sind kürzer (c. 2 mm lang) und kahl. Sie verbreitern sich an der Basis nicht. Die «Steinkerne» sind meist (doch schwankt dies nach den Spielarten) etwas kürzer und dicker als bei der Himbeere, was schon HEER zur Unterscheidung der Pfahlbaufunde benutzte. WINTON gibt umgekehrt an, daß sie größer seien.
Die Sammelfrüchte von Rubus caesius L. bestehen meist nur aus wenigen Früchten. Sie sind blauschwarz und hellblau bereift. Die geruchlosen, säuerlichen Sammelfrüchte von Rubus saxatilis bestehen aus 3–7 ziemlich großen, scharlachroten Früchten.
Pathologie s. bei Rubus idaeus.
Chemie. Frische Brombeeren enthalten im Mittel 5,3% Invertzucker, wenig (0,48%) oder keinen Rohrzucker, 0,77% freie Säure (auf Apfelsäure berechnet), 1,44% Pektinstoffe. In der Trockensubstanz finden sich im Mittel 40,17% Zucker.
[S. 71]
Der Blackberry-Farbstoff ist in seinen Reaktionen von KRAEMER studiert worden (vgl. The origin and nature of color in plants. Proc. amer. philos. soc. XLIII.).
Die Brombeeren enthalten auch sehr kleine Mengen Salicylsäure, wohl als Methylester (TRAPHOGEN und BURKE).
Geschichte. Einige nehmen an, daß der brennende Busch (seneh) des Moses ein Brombeerstrauch gewesen sei (ROSENMÜLLER). Da der Strauch in Griechenland häufig ist, war er HOMER, THEOPHRAST und DIOSKURIDES bekannt. βάτος; (= Dornstrauch) umfaßte auch die Brombeere. βάτα heißt sie noch im heutigen Griechenland. Batus seu Rubus findet sich auch in den Spuria MACRI (I, S. 626). PLINIUS erwähnt die Brombeere. PALLADIUS gibt (De re rustica XIV) eine Vorschrift für Brombeergelée. Aus den Pfahlbauten der neolithischen Periode kennen wir Brombeersteinkerne. Bei SCRIBONIUS LARGUS (I, S. 578) und CELSUS (I, S. 588) steht Rubus. Morus fructus, Mora rubi, blakeberien, Rubus ferens mora in der Alphita (I, S. 657) waren wohl Rubus fruticosus, ebenso batus der Sinonoma. In SERAPIONS Tabula steht Rubus neben Rubus canis, bei ALBERTUS MAGNUS heißt die Brombeere Ramnus (!), bei HILDEGARD steht brema. Der Succus mororum Rubi des CORDUS ist Brombeersaft. Das im ganzen Mittelalter sehr geschätzte, auch in KARLS Capitulare erwähnte Getränk moratum wurde aus Brombeeren, Honig und Wein bereitet mit einem Zusatz von Gewürzen (FISCHER-BENZON, Gesch. uns. Beerenobstes. Bot. Centralbl. 1895).
Lit. GODFRIN, Etude histol. sur les Tégum. semin. d. Angiosp. Soc. d. scienc. Nancy 1880. — WINTON, Beitr. z. Anatom. d. Beerenobstes. Zeitschr. Unters. d. Nahr.- u. Genußmittel 1902 u. Connect. Agric. Exp. Stat. 1902. — LAMPE a. a. O. — TRAPHOGEN u. BURKE, Pharm. Zeit. 1903, S. 323. — MOELLER-WINTON a. a. O. — KÖNIG a. a. O. — Die ältere chem. Literatur in JOHN, Tabellen.
Fructus Cerasi acidi.
Syn. Sauerkirsche, Weichselkirsche, Morelle. — cerise (franz.) — cherry (engl.) — ciliegia (ital.) — zure kers (holl.) — kirsikka (finn.) — καρπός ὀξίνων κερασίων (n.griech.).
Etym. Kirsche mhd. Kirse, alam. chriesi (s in sch umgebildet), ahd. Kirsa «stammt sicher nicht aus lat. cerasum, sondern, wie die verwandten roman. Worte, aus einem ceresia», mlat. cerésea. Die Entlehnung des hd. fällt wohl vor das VII. Jahrh. (KLUGE). Im Gothaer Arzneibuch (I, S. 680) steht noch Kersebere. Weichsel ist (nach HOOPS) der alte vorrömische deutsche Name der einheimischen Vogelkirsche, der auch nach Einführung der römischen Kulturkirsche an der wilden Kirsche haften blieb.
Stammpflanze und systemat. Stellung. Prunus Cerasus L. (LINNÉ, Spec. plant. edit. I, 474). Rosaceae, Prunoideae. Untergattung Cerasus (Mischling von Süß- und Sauerkirsche?).
Man unterscheidet von der sauren Kirsche zwei Varietäten (von EHRHART 1792 als Arten betrachtet und wohl auch als Cerasus acida GÄRTNER und Cerasus austera LEIGHT unterschieden): α. acida EHRH. (Glaskirsche) mit farblosem Safte (Unterarten und Varietäten in ASCHERSON-GRÄBNER Synopsis) und β. austera EHRH. (schwarze, saure Kirsche). Die saure Kirsche (Pr. Cerasus) wächst sicher wild in Transkaukasien, wird aber auch in Macedonien, am Bithynischen Olymp und am Kaukasus angegeben. In Mitteleuropa ist sie verwildert. Ihre Kultur erstreckt sich über Europa und die Vereinigten Staaten. Die wilde süße Kirsche (Pr. avium) war schon in vorgeschichtlicher Zeit in Europa heimisch (ENGLER).
Beschreibung. Die Kirsche ist ein relativ kleiner Baum mit gerundeter Krone. Die Langtriebe der sauren Kirsche sind unfruchtbar, die gestielten Früchte werden an der Spitze von in den Blattachseln stehenden gestauchten Kurztrieben erzeugt.[S. 72] Die Blüte besitzt nur einen Fruchtknoten. Aus ihm entsteht eine niedergedrückt kugelige Steinfrucht von meist braunschwarzer Farbe und purpurrotem Mesocarp. Das sklerotische Endocarp umschließt den Samen und bildet mit ihm den kugeligen harten «Steinkern» der Früchte. Der Same besteht aus den zwei plankonvexen Cotyledonen und einem kurzen Würzelchen.
Pathologie. Prof. ED. FISCHER berichtet über die pflanzlichen Schädlinge: Auf Prunus Cerasus ruft Sclerotinia cinerea (BON.) SCHROETER ein Absterben der Laubtriebe und Blütenstiele hervor, kann aber auch Fäulniserscheinungen der Früchte bewirken. Es entwickelt sich dabei eine Nebenfruchtform des Pilzes in Gestalt von grauen Schimmelpolstern (Monilia cinerea BON.) (siehe WORONIN, Über Sclerotinia cinerea und Sclerotinia fructigena, Mém. Acad. St. Petersbourg Ser. VIII, T. 10, 1900).
Gnomonia erythrostoma (PERS.) AUERSW. befällt zwar fast nur die Süßkirsche, seltener die Sauerkirsche. Es entwickelt sich dieselbe auf den Blättern und Früchten, letztere in ihrer Entwicklung hemmend und zum Absterben bringend, und überwintert in den am Baume hängen bleibenden dürren Blättern, wo im Frühjahr seine Ascosporen reifen, und aufs neue Blätter und Früchte befallen. Besonders intensiv trat diese Krankheit in den achtziger Jahren des letzten Jahrhunderts im Altenlande bei Hamburg auf (B. FRANK, Die jetzt herrschende Krankheit der Süßkirschen im Altenlande. Landwirtschaftliche Jahrbücher XVI, 1887).
Fusicladium Cerasi RABENH. bringt auf den noch grünen Kirschen mißfarbige Flecke hervor und kann zur Folge haben, daß sie im Wachstum zurückbleiben und abdorren. — Fäulniserscheinungen an Kirschen werden auch durch ein Gloeosporium hervorgerufen.
Über die tierischen Schädlinge von Prunus-Arten (Prunus armeniaca L., spinosa L., cerasifera EHRH., domestica L., insititia L., avium L., cerasus L., chamaecerasus JACQ., mahaleb. L., padus L., Persica vulgaris MILL,) berichtet ISRAËL:
Die Zahl der auf Prunusarten lebenden Insekten ist sehr groß. Als die wichtigsten Insekten seien folgende angeführt.
1. Käfer: Phytoëcia cylindrica L. Larve in dürren Zweigen von Obstbäumen, auch in alten Ballonkörben. Saperda scalaris L. Larven in frischen Trieben von Kirschbäumen und anderen Laubhölzern. Liopsus nebulosus L. Die Larve dieses Bockkäfers lebt im Splinte von Kirschbäumen, auch in anderen Obstbäumen. Anthonomus druparum L. Die Larven dieses Rüsselkäfers leben in den Blüten und Früchten von Prunus cerasus u. Pr. padus. Magdalinus cerasi L., M. pruni L. und andere Magdalinusarten leben als Larven unter der Rinde abständiger Schlehen, Kirschen, Quitten, Pflaumen, Äpfel und anderer Obstbäume, auch oft in trocknen Ästen. Phyllobius pyri L., P. argentatus L., P. oblongus L. und andere Phyllobiusarten schaden als fertige Rüsselkäfer den Kirschen- und Pflaumenbäumen oft sehr durch das Benagen und Ausfressen der Knospen. Rhynchites cupreus L., R. bacchus L., R. alliariae L. und andere Rhynchitesarten leben als Larven in den unreifen Früchten von Kirschen, Pflaumen, Äpfeln, Traubenkirschen, Aprikosen, Mispeln, Ebereschen usw. usw. Rhinosimus planirostris FABR., Larven in dürren Zweigen von Kirschen, Pflaumen, Aprikosen, Schwarz- und Weißdorn. Eccoptagaster pruni RATZB., E. rugulosus RATZB., Larven dieser Splintkäfer gerne in Apfel-, Pflaumen-, Quitten-, Pfirsich- und anderen Obstbäumen, auch Kirschbäumen. Polygraphus pubescens FABR. Larve im Splinte von Kirschbäumen, auch oft in verschiedenen Koniferen. Bostrychus chalcographus L., B. dispar. FABR. und andere Borkenkäfer leben nicht nur in Nadelhölzern, sondern auch in rückgängigen Laubhölzern des Waldes und der Gärten. Valgus hemipterus L., Larve in Prunusarten und Weiden; auch in Johannisbeerstöcken.
2. Falter: Auch die Zahl der an Prunusarten lebenden Lepidopterenraupen ist ganz enorm. Es seien nur die hauptsächlichsten angeführt.
Aporia crataegi L., Raupe, besonders häufig an allen Prunusarten und an Crataegus, auch an Äpfeln, Quitten usw. Früher fast überall sehr häufig, ist der Falter heute in sehr vielen Gegenden Deutschlands zur Seltenheit geworden. Die Raupen leben in der Jugend in Nestern; wo sie auftreten, sind sie gewöhnlich massenhaft. Thecla betulae L., T. pruni L., T. spini W. V., Raupen vornehmlich an Prunusarten, auch an Mandelbäumen und Rhamnusarten. Aglaope infausta L., Ino pruni W. V. Die asselförmigen Raupen an Prunusarten. Kommen nicht überall vor. An allen Prunusarten leben gelegentlich auch eine ganze Anzahl polyphager Bärenraupen (Arctiidae). Aus der großen Zahl der Spinnerraupen seien ferner noch die hauptsächlichsten[S. 73] angeführt; unter diesen finden sich die schädlichsten aller Lepidopteren. Cossus ligniperda F. (Cossus cossus L.), Raupe sehr oft auch in Prunusarten (s. Morus). Zeuzera pyrina L. Raupe nicht nur in Waldbäumen, sondern auch in Gärten in fast allen Obstbäumen, auch in Syringen und Staphyllaea. Dasychira pudibunda L., Raupe an allerhand Laubholz, meist Buchen, doch oft auch in Gärten an Obstbäumen. Porthesia chrysorrhoëa L., P. similis, FÜSSLY, Raupen in Nestern an Waldbäumen. In Gärten an Obstbäumen oft sehr schädlich. Auch an Weißdorn gemein. Psilura monacha L., die Nonne. Diese sehr gefährliche Raupe tritt oft an Laubhölzern, namentlich aber an Nadelhölzern sehr schädlich auf, oft den Nadelwald auf weite Strecken vernichtend. In Gärten und an Alleen scheint sie Kernobst (Kirschen) zu bevorzugen. Sie ist polyphag. Ocneria dispar. L. Die sehr schädliche und gefräßige Raupe an Laubholz; Pflaumen-, Kirschen- und Apfelbaum oft ganz entblätternd. Bombyx crataegi L., B. populi L., B. neustria L., B. lanestris L., Raupen an fast allen Obst- und Waldbäumen; namentlich die Raupe des Ringelspinners oft überaus schädlich in Gärten und an Alleen. Phalera bucephala L. Die sehr schädliche Raupe oft in großer Anzahl an Linden, Ahorn, Rosen, Pappeln, Weiden, Birken, Erlen, Buchen, Hainbuchen, Eichen, Kirschen, Aprikosen, Pflaumen, Schlehen, Apfel- u. Birnbäumen. Nimmt in Parkanlagen gelegentlich auch exotische Laubhölzer an. Lasiocampa pruni L. Raupe des seltenen Falters an Prunusarten. L. quercifolia L. Raupe der Kupferglucke in Baumschulen oft sehr schädlich. Gern an Prunusarten. Saturnia pavonia L. Raupe auch an Prunusarten usw. Aglia tau L. Raupe an Eichen, Buchen, Linden usw., auch an Prunus. Die Zahl der Eulen- und Spannerraupen, die an Prunusarten und anderen Obstbäumen leben, ist ebenfalls ganz außerordentlich groß, doch sind alle diese keine eigentlichen Schädlinge, die nur selten einen Kahlfraß usw. an Obstbäumen herbeizuführen imstande sind. Letzteres kommt dagegen dem sehr schädlichen Cheimatobia brumata L. und Hibernia defoliaria L. und einigen anderen in bedeutendem Maße zu. Auch die Zahl der Mikrolepidopterenraupen, die an Prunusarten leben, ist sehr groß. Auch unter ihnen finden sich Schädlinge wie Sciaphila nubilana HB., die einen Kahlfraß ganzer Gegenden herbeiführen können. Sie können hier nicht alle angeführt werden, da sie gegenüber den schädlichen Spinnern weniger wichtig erscheinen.
3. Fliegen: Trypeta signata MG. Die Made dieser Fliege lebt vornehmlich in den süßen Kulturkirschen, oft in solcher Anzahl, daß man fast keine Kirsche aufbricht, in der nicht eine solche Made vorhanden wäre. Verschiedene Cecidomyia-Arten leben an den Blättern von Prunusarten.
4. Schnabelkerfe: Aphis pruni FB. lebt in sehr großer Anzahl auf der Rückseite der Blätter von Prunusarten, dieselben deformierend. Die Blätter kräuseln sich zusammen und machen einen krankhaften, weißbestäubten Eindruck. Die Fruchternte wird dadurch oft für Jahre vereitelt. Aphis cerasina WEK. lebt besonders auf Kirschen (auch an Schlehen), die Blätter deformierend und die Fruchternte verhindernd.
Chemie. Saure Kirschen enthalten 6,3–10,2% Invertzucker, in der Trockensubstanz 44–62%; 1,2–2% freie Säure (auf Apfelsäure berechnet).
Süße Kirschen enthalten meist 10,70–13,11 (bis 16,5)% Invertzucker, in der Trockensubstanz 42–58 (bis 72)%; 0,3–1% freie Säure (auf Apfelsäure berechnet). Unreife Kirschen enthalten viel Apfelsäure, Zitronensäure und Bernsteinsäure, sowie etwas Inosit (KEIM).
Der Pentosangehalt der Kirsche beträgt 0,61–1,07% (WITTMANN). Die Reinasche in der Trockensubstanz beträgt in der ganzen Frucht 2,35, im Fruchtfleisch 2,25% (KÖNIG). Die Samen enthalten 37,61% der Trockensubstanz Fett. SCHMID fand in getrockneten Kirschen Glycerin.
Kirschen enthalten im Kilogramm meist 0,1–0,2 mg (DESMOULIÈRE) bis 0,4 mg (TRAPHOGEN) Salicylsäure, wohl als Methylester, sowie kleine Mengen Borsäure (NORTON).
Die Samen enthalten ein Blausäure abspaltendes Glykosid nebst einem glykosidspaltenden Fermente. Die Abspaltung der Blausäure war schon ITTNER bekannt (1809). Durch Destillation der gegorenen zerstampften Früchte wird in der[S. 74] Schweiz, dem Schwarzwald und anderwärts der «Kirsch», ein Schnaps, bereitet, der c. 43–58 Vol.% Alkohol und c. 14–48 mg Blausäure im Liter enthält (Zusammensetzung bei WINDISCH, Arb. d. k. Gesundheitsamtes 1895).
Der Farbstoff des Kirschsaftes zeigt die gleichen Absorptionsbänder, wie der des Himbeersaftes. Unterschiede in den Spektralreaktionen treten bei Einwirkung von Reagentien hervor (vgl. bei LEPEL). Mit der Zeit verändert sich der Farbstoff.
Geschichte. Ob die in der Liste der Pflanzen des königlichen Gartens des NEBUKADNEZAR von BEN SIRA aufgeführten Kirschen (wie J. LÖW übersetzt) wirklich welche waren, scheint mir unsicher. Es ist nicht mehr festzustellen, ob das Wort κεράσια (κέρασος), das neben κράνεια von den Griechen benutzt wird (THEOPHRAST), die süße Vogelkirsche oder die saure Kirsche oder beide bedeutete. Es ist nicht griechisches Indigenat, sondern stammt vom Pontus, von dem Worte Kirahs, hat also mit κέρας nichts zu tun. Die Stadt Cerasus ist nach der Kirsche, nicht (wie ISIDOR meint) diese nach der Stadt benannt (BUSCHAN). Die Veredelung der Süßkirsche (Prunus avium) scheint frühzeitig am Pontus erfolgt zu sein und von dort hat wohl LUCULLUS die süße Edelkirsche nach Italien gebracht (KOCH). Die Kirschkerne aus der Stein- und Bronzezeit sind alles Süßkirschen-Steinkerne (HEER, BUSCHAN). DE CANDOLLE nimmt an, daß die Sauerkirsche (Prunus Cerasus) schon in vorgeschichtlicher Zeit aus Prunus avium hervorgegangen sei. Die Sauerkirsche ist durch Funde aus paläolithischer Zeit in Südfrankreich beglaubigt. 120 Jahre nach Einführung der Kirsche in Italien wurde sie bereits am Rhein, in Belgien und Britannien von den erobernden Römern gebaut (PLINIUS). Auf den pompejanischen Wandgemälden (I, S. 575) findet sich Prunus Cerasus, die wohl nicht lange nach der süßen Edelkirsche nach Italien kam. Cerasarios diversi generis stehen im Capitulare (I, S. 620) und im Breviarium (I, S. 621), aber nicht im St. Galler Klosterplan (I, S. 622). Bei ALBERTUS MAGNUS heißt die Sauerkirsche amarella, amarena. Cerasorum nuclei stehen im Compend. des Magister Salerni (I, S. 639). GLAUBER stellte bereits 1660 (s. S. 883) aus Kirschen Traubenzucker dar.
Lit. Abbild. in BERG-SCHMIDT, Atlas, Taf. 61 (dort auch die florist. Literatur). — HEHN, Kulturpflanzen usw. — BUSCHAN, Vorgeschichtl. Botanik 1895. — KEIM, Stud. über d. chem. Vorgänge bei d. Entwickl. u. Reife der Kirschfrucht. Wiesbad. 1891. — VON LEPEL, Über d. Verhalt. v. Fruchtsäft. verschied. Alters gegen Reagent. Zeitschr. anal. Chem. 1880. — SCHMID, Zeitschr. f. Unters. d. Nahr.- u. Genußm. 1901. — DESMOULIÈRE, De la presence norm. d’acide salicylique dans div. subst. aliment. d’orig. végét. Thèse. Paris 1902 und Journ. pharm. chim. 19 (1904). — NORTON, Amer. Chem. Soc. 1909. — KÖNIG a. a. O. — MOELLER-WINTON a. a. O. — Entwicklungsgesch. von Frucht u. Same bei Prunus cerasifera in COPPER, Beitr. z. Entwicklungsgesch. offiz. Samen u. Fr. Dissertation Bern 1909.
Fructus Mori.
Syn. Maulbeeren — mûre, mûres noires (franz.) — mulberry (engl.) — more (ital.) — moerbezie (holl.) — μῶρον oder συκάμινον (n.griech.).
Bei MEGENBERG Maulper, im mhd. auch: Mulbaum, Muleberban und Mulbeire, sowie dubere, dusbere, suazbere.
Etym. Daß μόρος, μῶρον von μέρος = Teil (d. h. aus vielen Teilen zusammengesetzte Sammelfrucht) oder von μῶρος = unschmackhaft, fade abzuleiten wäre, erscheint mir unwahrscheinlich. Einleuchtender ist mir die Ableitung von μαυρός dunkelfarbig (kelt. mor = schwarz), ein Ausdruck, der auch auf die Brombeere weist, die vielfach mit der schwarzen Maulbeere zusammengeworfen wurde. Das griechische μῶρον und lateinische môrum Maulbeere geht allmählich in mor, mori, moreni, Brombeere über. Der Stamm mor kehrt dann wieder in ahd.: Môrperi, murperi, murpoum, mhd.: morber. — Maulbeere aus dem Lateinischen umgebildet.
Stammpflanze und systemat. Stellung. Morus nigra L. — Moraceae — Moroideae — Moreae.
Beschreibung. Der Baum wächst wild angeblich im nördlichen Kleinasien, Armenien, Südkaukasus bis Persien. Der schwarze Maulbeerbaum ist unzweifelhaft wild in Süd-Transkaukasien und wohl auch in einigen persischen Provinzen zu treffen. Nach[S. 75] Europa kam er ungefähr zur Zeit der attischen Tragiker (HEHN). In Italien wurde er bis zur Einführung des weißen Maulbeerbaumes (c. 1434) zur Seidenraupenzucht benutzt. Jetzt dort verwildert. Er wird jetzt auch nördlich der Alpen kultiviert. Die Früchte reifen noch in Gotland, Schweden und England. Die Alten warfen ihn vielfach mit der Sykomore zusammen. Die Maulbeere ist eine Scheinfrucht. Sie ist entstanden aus dem scheinährenförmigen weiblichen Blütenstande durch Auswachsen und Fleischigwerden der vierblätterigen Blütenhüllen (Perigone), die als saftige Fruchthülle die Früchte (Nüßchen) umhüllen und Scheinfrüchtchen bilden. Diese Scheinfrüchtchen treten zu einer eirunden, etwa 2 cm langen, fast schwarzen, mit purpurfarbigen, säuerlich-süßen Safte erfüllten Scheinfrucht zusammen, die also ein Fruchtstand ist.
Die Maulbeere ist etwa 2½ cm lang. Die einzelnen Früchtchen, bei denen man noch deutlich an der Spitze den vierstrahligen Spalt und die vier Perigonblätter bemerkt, messen 2–3 mm.
Die der Himbeere äußerlich ähnlichen Früchte schmecken nur, wenn sie ganz reif sind, halten sich dann aber nur kurze Zeit.
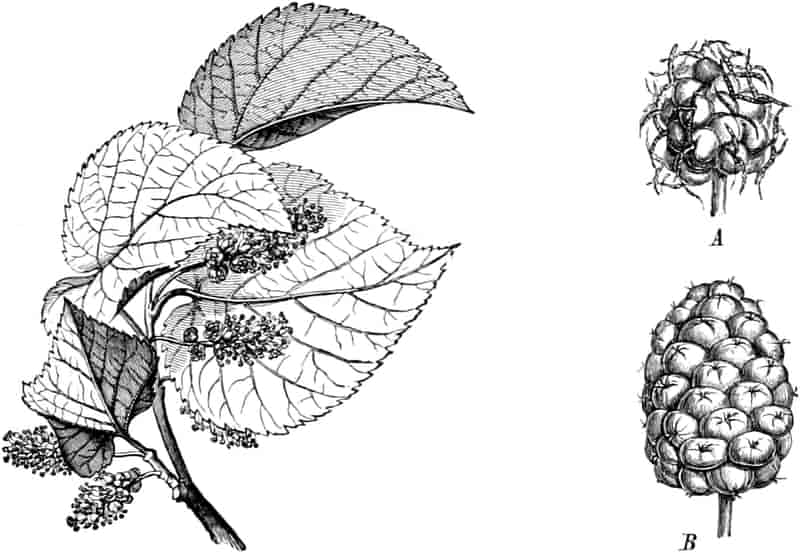
Morus alba. A ♀ Blütenstand. B. Fruchtstand.
[Nach Baillon.]
Pathologie. Über die Schädlinge berichtet ISRAËL: Falter: Die in Deutschland noch in der Umgebung vieler Städte (in Gärten, Parks auch als Alleebäume) anzutreffenden Maulbeerbäume stammen aus einer Zeit, als man die Zucht der Seidenraupe auch nach Deutschland zu verpflanzen trachtete. Die Blätter dieser Bäume sind die Hauptnahrung für die Seidenraupe, die Larve des Spinners Bombyx mori. In der Gefangenschaft läßt sie sich auch mit den Blättern von Scorzonera hispanica erziehen. Sonst leben gelegentlich auf Morusarten die Raupen von Acronycta aceris L. Smerinthus tiliae L.: Die Zucht der letzteren ergab oft die braune Varietät. Cossus ligniperda F. (Cossus cossus L.): Diese große Holzraupe fand ich bei Hanau am Main in dem Holze von Wurzeln und Stämmen gefällter Maulbeerbäume. (Sonst lebt diese sehr schädliche Raupe meist in den Stämmen von Weiden, Pappeln, Eichen, Birnen, Äpfeln, Kirschen und anderen Laubhölzern.)
Chemie. Frische Maulbeeren enthalten 84,71% Wasser, 9,19% Invertzucker, 1,86% freie Säure (auf Apfelsäure berechnet), c. 2% Pektinstoffe, 0,57% Asche (VAN HEES 1857). In der Trockensubstanz finden sich 60,10% Zucker.[S. 76] Die Maulbeere ist also eine der zuckerreichsten Früchte. Maulbeeren enthalten auch eine sehr kleine Menge Salicylsäuremethylester (DESMOULIÈRE).
Auch aus den Maulbeeren wurde, wie den Holunderbeeren (s. d.), den Wacholderbeeren (s. d.) und den Möhrenwurzeln ein Roob (Rob, Rubb) bereitet, der unter dem Namen Rob mororum baccarum bekannt war.
Der Sir. Mori ist hauptsächlich Geschmackskorrigens. In Griechenland wird aus Maulbeeren ein berauschendes Getränk dargestellt.
Geschichte. Der Maulbeerbaum wird von den alten Schriftstellern erwähnt und war z. B. den alten Juden bekannt. Maulbeeren (tut) werden von BEN SIRA auch unter den Pflanzen des königlichen Gartens des NEBUKADNEZAR aufgeführt (J. LÖW). μορέα bei DIOSKURIDES (I. Kap. 180) ist Morus nigra und alba (συκμόμορον war die Sycomore). Bei THEOPHRAST hat Maulbeerbaum und Sycomore den gleichen Namen. Die schwarzen Maulbeeren finden sich bei HIPPOKRATES (de victus ratione lib. II). Maulbeere heißt bei AESCHYLOS μόρον. DIODOR unterscheidet den maulbeeren- von dem feigentragenden συκάμινος. Im Mittelalter wird der Maulbeerbaum zum Unterschiede von dem Brombeerbusch wohl mora celsa oder sycomorus celsa (Baumbrombeere) oder einfach celsa (celsus) genannt, die Früchte mora celsi. Bei IBN BAITHAR heißt er tuth. Er findet sich auch in KARLS Capitulare (I, S. 620) sowie im St. Galler Klosterplan (I, S. 622) als murarius, und dem Kalender des HARIB aus dem Jahre 961 (I, S. 612) — Sir. de moris wurde im Juni bereitet —. Dann im Brevis de Melle des Klosters Corbie u. and. Bei der HILDEGARD (I, S. 670) heißt er mulbaum, mulberbaum. In der Alphita steht: CELSUS, sicaminum, bei SERAPION: mora celsi, tut (I, S. 644). Der Succus mororum de arbore ist Maulbeersaft.
Lit. FLÜCKIGER-HANBURY, Pharmacographia. — VOGL, Nahrungs- und Genußm. — FRESENIUS, Ann. Chem. pharm. 101. — KÖNIG a. a. O. — MOELLER-WINTON a. a. O. — Abbild. in BENTLEY and TRIMEN. — Über Morus alba tartarica (Russian Mulberry) vgl. U. St. Dep. Agr. Forest. Divis. 1907 Circ. 83.
b) Drogen, die Sorbit enthalten.
Das Reduktionsprodukt der d-Glukose ist der d-Sorbit:
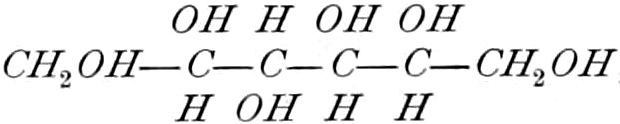
der sich in den Beeren von Sorbus aucuparia findet — neben der verwandten
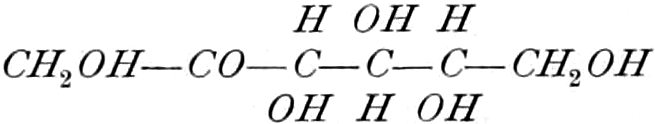
Sorbit ist bisher nur in Pomoideen, Prunoideen und Spiraeoideen gefunden worden (z. B. Pirus commun., P. Malus, Mespilus germanic., Prunus Cerasus, P. domestica, P. persica, P. armeniaca, P. Laurocerasus). Nur Pflanzen dieser Familien besitzen die Fähigkeit, aus Sorbit Stärke zu bilden (TREBOUX).
Der Chirkhestit (s. Schir-kist-Manna) der Pomacee Cotoneaster nummularia ist wohl auch Sorbit.
c) Drogen, die Glukuronsäure enthalten.
An die Glukose schließt sich die zugehörige Säure, die Glukuronsäure, deren Beziehungen zur Glukose durch Vergleich der folgenden Formeln ersichtlich ist:
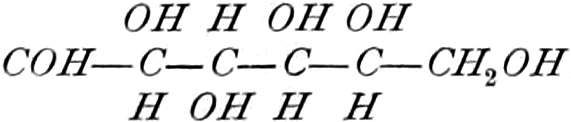
[S. 77]
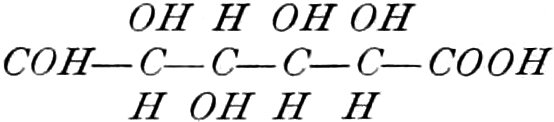
(An diese schließt sich dann die beim Behandeln der d-Glukose mit Salpetersäure entstehende d-Zuckersäure:
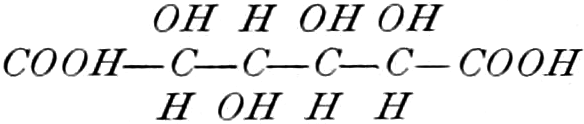
Freie Glukuronsäure, die der Tierkörper oftmals bildet, ist in Drogen oder Heilpflanzen bisher nicht gefunden worden. Auch gebundene war bis vor Kurzem in Pflanzen nicht bekannt. Denn die Euxanthinsäure, die sich im Jaune indien (Indian Yellow, Piuri, Purree, Indischgelb), einem in Indien viel benutzten Farbstoffe, findet, ist kein rein pflanzliches Produkt. Er wird aus dem Harn von Kühen dargestellt, die mit Mangoblättern gefüttert wurden. Er besteht aus dem Glukuronsäure-Euxanthonäther resp. dem Calcium-Magnesiumsalze desselben. Das Euxanthon entstammt der Pflanze, die Glukuronsäure dem tierischen Organismus, der die Fähigkeit besitzt, eingeführte Phenole durch Paarung mit Glukuronsäure zu verestern und durch den Harn fortzuschaffen.
Die Glukuronsäure ist im Pflanzenreich zuerst im Süßholz aufgefunden worden (1907 TSCHIRCH mit CEDERBERG und GAUCHMANN), sie scheint aber auch in Algen, z. B. Laminaria, vorzukommen (TOLLENS). Neuerdings (1910) zeigte GOLDSCHMIEDT, daß auch das Scutellarin, das MOLISCH in Scutellaria und anderen Labiaten fand, ein Glukuronsäureester ist. Eine gute Reaktion auf Glukuronsäure ist die von TOLLENS mit Naphtoresorcin (Ber. d. chem. Ges. 1908, 1788): es entsteht ein ätherlöslicher, rotvioletter Farbstoff, dessen Spektrum ein Band bei D zeigt. Diese Reaktion unterscheidet die Glukuronsäure von den Pentosen, mit denen sie sonst manche Reaktionen teilt (z. B. die mit Orcin- und Phoroglucinsalzsäure). Mit α-Naphthol und konz. Schwefelsäure gibt Glukuronsäure und ihre Verbindungen eine smaragdgrüne Färbung, die durch allmählichen Zusatz von Wasser in Blau und Violett übergeht. (GUIDO GOLDSCHMIEDT, Eine neue Reaktion auf Glukuronsäure. Zeitschr. phys. Chem. 65 [1910] 389). Glukuronsäure liefert bei der Destillation mit HCl Furfurol. Die Glukuronsäure ist flüssig und schmeckt sauer, aber ihr kristallisierendes Anhydrid (Lakton):
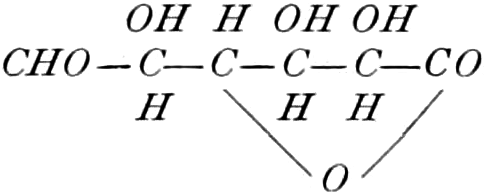
schmeckt süß.
Rad. liquiritiae.
Syn. Rad. glycyrrhizae, Süßholz, Süßholzwurzel, Lakrizwurzel — bois ou racine de réglisse (franz.) — liquorice root (engl.) — legno dolce, liquirizia, regolizia (ital.) — zoethout (holl.) — lakritsi juuri (finn.) — edesgyökév (ung.) — γλυκύρριζα (n.-gr.).
Bei THEOPHRAST: γλυκεῖα ἡ σκυθική (russisches Süßholz), bei DIOSKURIDES: γλυκυῤῥίζη (D. führt noch folgende Namen an: Glyceraton, Symphyton, Leontica, Glycophyton, Scythion, Adipson, Sylithra, Lybiestason, Omoeomoeon, Penthaomoeon), bei PLINIUS, CELSUS u. and.: Radix dulcis. GALENS Glykyrrhiza war wohl Gl. glandulifera, des SCRIBONIUS LARGUS (I, S. 577):[S. 78] Glycyrrhiza war wohl G. glabra; im Liber medicinalis von St. Gallen (IX. Jahrh.): gliquiritia. Die spätlateinische Form liquiritia tritt wohl zuerst im IV. Jahrh. bei THEODORUS PRISCIANUS (in De diaeta cap. 9), dann auch bei VEGETIUS RENATUS (I, S. 591) auf. Sie findet sich z. B. bei Otho Cremonensis. In ISIDORS Etymologicon (I, S. 592): ligusicium, liguricium, bei HILDEGARD (I, S. 668) liquiricium (Hunigwurz); im Gothaer Arzneibuch (I, S. 679): lacrisse, lacrissen, lacrissyen, lakerissien, lecritzen; im Tegernseer Arzneibuch (I, S. 678): liquiricii; bei HARPESTRENG (I, S. 684): lyquericia, lykrissa, lykriz, lakriz. In mittelengl. Medizinbüchern des XIV. Jahrh.: licoris, in Meddygon Myddfai 683: licraz (lacris ist die vallonische Form). Altfranzösisch: requelice, recolice, recalisse. In der Taxe von Ferrara von 1424 (I, S. 811) findet sich Requelizia, in SALADINS Compendium: Rad. lyquyrrhizae. In dem Inventar von LEFORT 1439 (I, S. 805) steht rigalice. In der Frankfurter Liste 1450: liqworicic. Auch die volksetymologischen Umbildungen Lackaricie, Lackeritze, Lackritze, Leckerici, Leckwariz, Licritz, Lickweritzie, Lukretia (!), Luquatze, Lichtkritz finden sich. In der Alphita (I, S. 652), Circa instans und den Tabulae, sowie bei SIMON JANUENSIS (I, S. 664): liquiritia, gliceria, glacoria, bei SERAPION, NAJM AD-DYN MAHMUD und IBN BAITHAR (I, S. 611) auch sūs (sous), in den Sinonoma (I, S. 639): glicoricia, glicida (hier mit Paeonia offic. [Glycysida bei SCRIBONIUS] zusammengeworfen). Die Synonymie der Patres bei SCHRÖDER (I, S. 891), wo sich auch der Name Galissienhout findet. — hind.: mulhatti, jethimahd — sanscr.: madhuka (= Süßholz), yashti madhu (= Süßstengel) — arab.: aslussús, aslus-sûs (= Süßwurzel) — pers.: bikhe-mahak. shîrin bagân, urâk dâr haram (auch glikiriza LECLERC); — chin.: kau-tsʿau (kao tsao, kom tso), kao = Leim, Pflanzenharz, tsao = Kraut.
Etym. Das Stammwort für alle Namen ist γληκυρῥίζη (von γλυκύς = süß und ῥίζα = Wurzel). Aus diesem Worte ist das latino-barbarische liquiritia, in all’ seinen zahlreichen Umformungen (vgl. auch I, S. 1060) lakriz, reglisse etc. entstanden. Das sanskritische madhu bedeutet ebenfalls Süßigkeit, süß. Es kehrt beim Honig (S. 8) und Met (I, S. 1016) und den Bassiablüten (S. 23) wieder.
Stammpflanze. Glycyrrhiza glabra L. (G. laevis PALL., Liquiritia officinalis MOENCH).
Systematische Stellung. Leguminosae, Papilionatae — Galegeae — Astragalinae, Sect. Euglycyrrhiza.
Beschreibung der Stammpflanze. Die Pflanze bildet einfache Stengel, eine oft gewaltige Wurzel und zahlreiche Ausläufer. Die Blätter sind unpaarig gefiedert, vielpaarig, mit eioblongen, stumpflichen, an der Spitze meist etwas ausgerandeten, kurz stachelspitzigen, oberseits kahlen, unterseits schwach drüsigen und sonst kahlen oder behaarten kurzgestielten Blättchen. Die gestielten Trauben sind kürzer als die Blätter, sie sind später locker. Der Kelch ist röhrenförmig fast bis zur Hälfte in pfriemliche Zipfel geteilt. Die Fahne ist lineal-oblong, nur wenig aufwärts gekrümmt. Von den zehn geraden Staubfäden sind neun beinahe bis zur Hälfte in eine oben geschlitzte Röhre verwachsen, aber auch das zehnte hängt am Grunde mit dieser zusammen. Der Fruchtknoten enthält 6–8 campylotrope Ovula. Die gerade Hülse ist in eine Stachelspitze ausgezogen.
Glycyrrhiza glabra ist durch Südeuropa bis Mittelasien verbreitet. Sie variiert sehr nach dem Standort und bildet zahlreiche Varietäten und Wuchsformen.
Es werden von ihr jetzt (nach BOISSIER) folgende Varietäten unterschieden, die zum Teil früher als Arten gingen:
α) typica Reg. et Herd. (G. glabra Aut.), ziemlich kahl, Kelchzähne linealisch-pfriemlich, so lang wie die Röhre, Fahne bläulich, Hülse kahl, drei-sechssamig; in Südeuropa, Mittelmeerländer, Kleinasien, Krim, kaukasisch-kaspisches Gebiet, Syrien, Nordpersien, Turkestan, Afghanistan.
β) violacea Boiss., ziemlich kahl; Blättchen kleiner, elliptisch, Kelchzähne breiter, pfriemlich, etwas kürzer als die Röhre, Fahne violett, Hülse kahl, etwas schmäler, vier-siebensamig; im Euphrat- und Tigrisgebiet, Babylonien, Assyrien.
γ) glandulifera Reg. et Herd. (G. glandulifera W. K.; G. hirsuta Pall.; G. brachycarpa[S. 79] Boiss.), niedriger. Stengel behaart oder etwas rauh; Fahne violett, Hülsen zerstreut oder dichter stachelig, drüsig, bald mehr-, bald wenigsamig. In Südost-Europa (Ungarn, Galizien), Westasien (mittlere und südliche russische Gouvernemente), bis Turkestan und Afghanistan, Süd-Sibirien, Tschugarei, China bis zur großen Mauer.
δ) pallida Boiss., Stengel angepreßt und kraus kurzhaarig; Kelchzähne schmal pfriemlich bis doppelt so lang wie die Röhre; Fahne rötlich weiß. In Assyrien.
Auch die als G. asperrima (Linn. f. suppl. 330) bezeichnete Art, die «in arenosis et collibus inter Wolgam et Jaicum, in deserto Tatarico ad fl. Karaman, in mont. Uralens. et ad lacum Inderiensem» angegeben wird (DE CANDOLLE, Prodrom. II, 248), ist wohl ebenso wie die mit ungenügender Diagnose in DE CANDOLLES Prodromos veröffentlichte G. uralensis (FISCH. in litt.) vom Ural nur eine Varietät von glabra. Früher wurde ja auch glandulifera als besondere Art betrachtet (G. glandulifera Waldst. et Kit. Pl. Rar. Hung. I. 20 t. 21). REGEL und HERDER sind nicht dieser Ansicht, wollen aber doch wenigstens asperrima und uralensis vereinigen. Sie beschreiben von Gl. glabra folgende Varietäten: α typica, β asperula, γ hispidula, δ glandulifera (= Gl. glandulifera Waldst. et Kit., G. glandulifera. Boiss. et Buhse), ε echinata, ζ tuberculata, — von G. asperrima: α uralensis, β desertorum, γ sutinermis, δ intermedia, ε glabra, ζ typica. Jedenfalls steht G. uralensis der glabra, besonders der Varietät glandulifera sehr nahe, denn LEDEBOUR nennt sie in seiner Flora rossica: G. glandulifera β grandiflora und auch G. glandulifera Kar. et Kir. ist synonym damit. Sie findet sich «in Sibirica uralensi, in Sibiria altaica, in Dahuria, in Mongolia chinensi, in desertis soongoro-kirghisicis», geht also, da Gl. glabra β glandulifera als «in Hungaria, in provinciis caucasicis et transcaucasicis, in desertis soorgoro-kirghisicis volgensibusque» angegeben wird, weiter nach Norden und Osten. ASCHERSON und GRAEBNER stellen in ihrer Synopsis G. glandulifera wieder als Art der G. glabra gegenüber.
Dagegen ist die in Apulien und der Tartarei heimische Glycyrrhiza echinata (Linn. spec. 1046, Abbild. in BERG-SCHMIDT, Atlas, I. Aufl.) sicher als eine gute Art anzusprechen. Sie bildet keine Ausläufer und ihre Wurzel ist nicht gelb und nicht süß. Sie kann daher kein Süßholz liefern. Trotzdem zum Überfluß 1887 BECKER (in den Bull. Soc. imp. d. natural. Moscou) nachwies, daß sie in der Tat kein Süßholz gibt (vgl. auch FLÜCKIGER, Pharmakognosie III), wird sie auch noch in neueren Werken (z. B. ENGLER-PRANTL, Pflanzenfam., ASCHERSON-GRÄBNER, Synopsis) immer wieder als Stammpflanze des russischen Süßholz aufgeführt. Sie ist wohl die Glycyrrhiza des DIOSKURIDES, der die Wurzel als ὑπόστρυφνος (etwas herb) bezeichnet, die oberirdischen Teile aber eher wie bei glandulifera und glabra beschreibt. Die Konfusion beginnt also bereits hier.
Glycyrrhiza glabra ist eine etwa mannshohe (1–2 m) Staude mit einem riesigen, viele Quadratmeter bedeckenden Systeme von Wurzeln und Ausläufern (vgl. die Abbild. in I, S. 324), die auch oberirdisch, wenn sie ungehindert wachsen kann, zu einem wahren Dickicht werden kann. Wie schwer es ist, eine ganze Pflanze mit allen ihren nicht selten 8 m langen Ausläufern aus dem Boden zu graben, zeigt die von WEIGAND mitgeteilte Sitte, daß die Gärtnerzunft von Bamberg ehedem als Meisterstück von den Gesellen verlangte, daß sie eine Süßholzpflanze mit allen Wurzeln und Ausläufern unversehrt aus dem Boden graben mußten (FLÜCKIGER). Wenn man sie sich selbst überläßt, okkupiert sie bald weite Strecken. Auf Kreta, in Kleinasien und nördlich vom Kaukasus ist sie z. B. ein lästiges Unkraut, auch in Sicilien, wo Süßholz wild im Simetotal (bei Catania) wächst und in Calabrien, wo man sie in der pianura di Sibari im Flußtal des Crati nördlich von Corigliano und Rossano findet (RAVASINI).
An den feinen Nebenwurzeln finden sich Wurzelknöllchen (TSCHIRCH) wie bei so vielen Papilionaceen.
G. glabra wächst noch auf Sandboden, verlangt aber reichliche Bewässerung, gedeiht also am besten an Flußufern, in trockenen Flußbetten oder im Überschwemmungsgebiet. Und so treffen wir denn sowohl das wildwachsende Süßholz, wie auch die Kulturen fast ausschließlich in Flußtälern: am Guadalquivir, am Ebro, am Mäander, am Ural und an der Wolga, am Amu Darja und im Euphrat-Tigristale.
[S. 80]
Wir dürfen jetzt wohl annehmen, daß das spanische und italienische Süßholz (wie überhaupt das europäische) von Glycyrrhiza glabra L. α. typica REG. et HERD., das russische von Glycyrrhiza glabra L. γ. glandulifera REG. et HERD., das mesopotamische von Glycyrrhiza glabra L. β. violacea BOISS. und das chinesische von Glycyrrhiza asperrima L. fil. α. uralensis BOISS. (G. uralensis FISCH.) abstammt. Ob letztere auch das Uralsüßholz liefert, ist sehr zweifelhaft (s. unten). Ich glaube es nicht. Auch HOLMES hält (1910) die Stammpflanze für die gleiche wie die des russischen Süßholz.
Lit. LINNÉ, Spec. pl. ed. I 742. — Abbild. in BERG-SCHMIDT, Atlas, Taf. 55 (dort auch die florist.-Lit.). — PABST-KÖHLER, Medizinalpfl. Taf. 135. — BENTLEY-TRIMEN, Medicin. plants. und zahlreichen anderen Abbildungswerken. — BOISSIER, Flora orientalis II, 202. — REGEL und HERDER, Enumer. plant. in regionibus cis- et transiliensibus etc. Bull. soc. imp. d. naturalistes de Moscou 1866. II 527. — SESTINI, Gazetta chimic. italian. 1878. — WHITMANN, Zeitschr. d. Öster. Apoth. Ver. 1886. — BUNGE, Enumerat. plant. quae in China boreali colleg. Petrop. 1831. — BRETSCHEIDER, Bull. Roy. Kew Gardens 1896. — AITCHISON, Some plants of Afghanistan. Pharm. Journ. 1886, 465. — KOWALEW, Diss. Petersb. (Chem. Z. 1907. Rep. 589). — TSCHIRCH, Artikel Glycyrrhiza in Realenzyklop. d. Pharm. V, 706.
Pathologie. Prof. ED. FISCHER berichtet über die Schädlinge: Glycyrrhiza glabra wird von einer Uredinee Uromyces Glycyrrhizae (RABH.) MAGNUS befallen, deren Mycel ganze Sprosse durchzieht und an der Unterseite der Blätter Uredolager produziert. Aus dieser Form des Auftretens ist zu schließen, daß das Mycel im Rhizom perenniert (s. P. MAGNUS, Über das Auftreten eines Uromyces auf Glycyrrhiza in der alten und in der neuen Welt. Berichte der deutschen botan. Gesellschaft 1890).
Im Süßholz des Handels findet sich bisweilen die Mehlmotte Pyralis farinalis.
Kultur und Ernte. Glycyrrhiza glabra α. typica wird vornehmlich in Spanien und in Italien kultiviert. Spanien exportiert Süßholz, Italien verarbeitet das meiste auf Succus. Die spanischen Kulturen liegen besonders im Tal des Ebro und Guadalquivir bei Alicante, Tortosa, Barcelona, Cordóba, Elche (s. auch Handelssorten). In Spanien ist Süßholz auch vielfach verwildert zu finden. Die italienischen Kulturen finden sich besonders in Calabrien, dann in Atri bei Teramo, in Abruzzo ulteriore primo und auf Sicilien, besonders im Süden (Caltanisetta). Bei Catania wird auch wildwachsendes Süßholz auf Succus verarbeitet. Südfrankreich baut auch etwas Süßholz. Dann England: Surrey (Mitcham), Yorkshire (Pontefract, Nottingley), bei London: Kew, Isleworth, aber lange nicht genug für den eigenen Bedarf. In Österreich bestehen Kulturen bei Auspitz in Mähren und in einigen ungarischen Distrikten, z. B. bei Sassin (Komitat Neutra). Unbedeutend ist die Kultur bei Bamberg, einem Orte, bei dem seit alter Zeit (vgl. I, S. 32) Süßholz gebaut wurde, das ehedem einen vortrefflichen Ruf genoß, dann bei Schweinfurt (Schwebheim). Apotheker KRAFT in Bamberg berichtet mir darüber (1910): «Der Süßholzbau im Bamberger Flurbezirk ist auf einige wenige kleine Parzellen zurückgegangen, deren Erträgnis ungeschnitten in kleine Bündel verflochten am Gemüsemarkt zum Verkauf kommt. Kommerzielle Bedeutung hat der Anbau in der Gegenwart, welche ich aber auf beinahe 25 Jahre ausgedehnt wissen will, denn so lange beobachte ich das selbst, nicht.» Im XVI. Jahrh. lieferte Bamberg den ganzen Bedarf Deutschlands. Kleinasien kultiviert bei Smyrna und Sokia etwas Süßholz. Das meiste wird aber von wildwachsenden Pflanzen gesammelt, da sich die Pflanze im Innern von Kleinasien in großer Masse findet, wild z. B. im Mäander- und Hermustal. Man sieht oft weite Strecken des Bodens östlich von Smyrna ganz durchwühlt (KANNENBERG). In Syrien bestehen Kulturen nur in der Umgegend von Antiochia (seit 1865). Hier, wie in Kleinasien,[S. 81] scheint es sich ebenfalls um G. glabra zu handeln, da die Droge der spanischen ähnelt. Man sammelt in Kleinasien vom Oktober an. Am Abend liefern die Bauern das gesammelte Süßholz in die Depots. Dort bleibt die Wurzel bis zum Mai oder Juni und nimmt hierbei um 50% ab. Es wird dann entweder unsortiert in hydraulisch gepreßten Vals à 220 pounds (besonders nach Nordamerika) versandt, oder in debris und bagettet sortiert und in Säcken à 300–330 pounds (besonders nach Frankreich) exportiert (HARRIS 1909). Über die Kulturen in Rußland vgl. unter Handelssorten.
In Nordamerika sind neuerdings erfolgreiche Anbauversuche mit Gl. glabra gemacht worden (I, S. 72), wesentlich auf Empfehlung von RITTENHOUSE (Amer. journ. ph. 1895 und 1897), der 1895 selbst mit der Kultur in New Jersey, Pennsylvania, Louisiana und Florida begann. Auch Kalifornien kultiviert etwas.
In den Kulturen blüht Glyc. glabra selten, und wenn sie blüht, bildet sie nur wenige oder keine Samen. Man vermehrt das Süßholz nicht durch Samen, sondern durch Knospen (buds) und Ausläufer (runner), die in England z. B. Anfang April gesetzt werden. Zwischen den Pflanzreihen werden dort Gräben gezogen, die ein leichtes Ausheben des ganzen Ausläufersystems ermöglichen. In den ersten Jahren werden in England Kartoffeln und Kohl dazwischen gepflanzt. In Mischkultur (mit Weizen, Erbsen, Mais) befindet sich das Süßholz auch bisweilen in Calabrien. Die besten Wurzeln und Ausläufer werden nach 3–4 Jahren erhalten. In England erntet man im September, in Spanien vom September bis März, in Syrien beginnt die Ernte im November. Ernte pro Hektar: c. 1000 kg.
Das Süßholz leidet nicht von Parasiten und verträgt Frost gut. Bei der Ernte bedient man sich des Pfluges. Sie ist nicht leicht, denn nach 5–6 Jahren können die Wurzeln eine Dicke von 2 dm, die Ausläufer eine Länge von 8 m erreichen. Die Pflanze läßt sich leicht durch die Ausläufer, die auch zum Teil im Boden bleiben, vermehren. Sie ist sehr dankbar und anspruchslos. In England steckt man die Ausläufer senkrecht in den Boden.
Die Wurzeln werden in den Produktionsländern nach dem Graben und vor dem Trocknen zunächst auf Haufen geschichtet und machen, wie es scheint, hierbei eine Gärung durch, die ihnen eine schöne Farbe verleiht.
Die geernteten Ausläufer und Wurzeln werden gewaschen, geputzt und meist auch durch oberflächliches Abschaben von den Nebenwurzeln befreit. Das Schälen (s. russisches Süßholz) geschieht am Produktionsorte und in den Handelszentren (z. B. in Hamburg).
Lit. Kultur in Italien: SESTINI, Gazz. chim. ital. 1878. — England: Pharmakographia, Jahresber. d. Pharm. 1894, 156 und WHITMANN, Zeitschr. Öster. Apoth. Ver. 1886, 277. — Kleinasien: Jahresb. d. Ph. 1884, 268, KANNENBERG, Kleinasiens Naturschätze und NICKUM, Am. J. pharm. 1895, 306. — Syrien: Pharm. Zeit. 1886, 129. — Rußland: Pharm. Journ. 1889, 613 u. and. (vgl. unter Handelssorten). — Österreich: GAWALOWSKI, Pharm. Post 1901. — Amerika: Am. journ. pharm. 95 und 1896, 636 u. Proc. am. ph. ass. 1895, 865. — New South Wales: Am. journ. ph. 1897. — Neuseeland: Arch. Pharm. 1883, 854. — Deutschland: HARTWICH, Historisches über die Kultur von Arzneipflanzen. Schweiz. Wochenschr. 1893, 441. — TSCHIRCH, Anbau der Arzneigew. in Deutschl. Arch. Ph. 1890.
Handelssorten. 1. Russisches S. Bis 1870 genügte die Produktion Spaniens, dann erschien zuerst Südrußland (speziell die nördlich vom Kaukasus gelegenen Länder), dessen Süßholz seit Anfang des XIX. Jahrh. in Deutschland bekannt war, dann Kleinasien (besonders Anatolien) auf dem Platz. Jetzt beherrscht seit 1908 das Uralsüßholz vom Ural und den benachbarten Steppen den deutschen Handel, das schon 1889 von dem kaukasischen unterschieden und diesem gegenübergestellt[S. 82] wurde. Der Geschmack des Uralsüßholz ist intensiv und rein süß, während das Kaukasussüßholz schwach und unangenehm süßlich schmeckt (CAESAR u. LORETZ). Die Ernte bewegte sich zwischen 10- und 15000 Pud (1907). An den Ufern des Ural, an denen Glycyrrhiza in großen Mengen wächst, wird übrigens schon seit langem Süßholz gesammelt, vor 25 Jahren so viel, daß damals die Regierung das Graben einschränken, bzw. ganz verbieten mußte. Das russische Uralsüßholz ist zurzeit das beste, und doppelt so teuer als Alicante. Es kommt in gut mundierter (einfach und doppelt geschälter), schön gelber Ware in Ballen, à 70, 90, 110 und 120 kg in den Handel, wird auf der großen Messe in Nischni-Nowgorod gehandelt und gelangt über Moskau und Petersburg nach Hamburg. Auch die beim Schälen und Nachschälen abfallenden, sehr billigen «Schnitzel» sind Handelsartikel (Ballen à 140 kg) und werden viel auf Succus verarbeitet. Der Großhandel unterscheidet einfach und doppelt mundiertes S.

Rad. liquiritiae ross. «peeled». [Wright Layman and Umney phot.]
[Vgl. auch Greenish, Textbook.]
Angeblich sollte das Uralsüßholz von Glycyrrhiza uralensis FISCH. (Gl. asperrima L., fil. α uralensis REG. et HERD., G. glandulifera β grandiflora LEDEB., G. glandulifera KAR. et KIR.) stammen, dessen einheimischer Name Chuntschir ist. Das von dieser Pflanze gesammelte Süßholz soll (nach KOWALEW) pharmakognostisch von dem spanischen und russischen abweichen und im Glycyrrhizingehalt zwischen beiden stehen. Das im Herbst gesammelte ist glycyrrhizinreicher als das im Sommer geerntete. Es ist mir jedoch fraglich, ob das Uralsüßholz von dieser Pflanze stammt und nicht vielmehr ebenfalls von der naheverwandten Glycyrrhiza glabra γ glandulifera REG. et HERD., der bis vor kurzem allein als Stammpflanze des russischen Süßholz in Betracht kommenden Pflanze. Diese letztere wurde in ziemlich umfangreichem Maße auf den Inseln des Wolgadeltas und bei Sarepta kultiviert und die Droge über Astrachan nach Moskau gebracht.[S. 83] Dann wurden in den achtziger Jahren des XIX. Jahrh. Kulturen auch bei Batum am Schwarzen Meer angelegt und Liakha (Distrikt Elisabethpol) wurde Hauptstapelplatz für kaukasisches Süßholz. Aber die Pflanze findet sich auch wildwachsend sowohl in Ciskaukasien im Gebiete des Kuma und Terek und im Dagesthangebiet wie auch in Transkaukasien, besonders im Gouvernement Elisabethpol (früher. tartarisches Khanat Gandscha) zwischen Tiflis und Batum. Die Ernte im Kaukasus beträgt oft 11000 t und mehr.
ROSENBERG berichtete mir 1907, daß in Transkaukasien das Einsammeln der Wurzeln von den wildwachsenden Pflanzen ausschließlich durch zum Teil noch nomadisierende Tartaren betrieben werde und daß der Süßholzhandel dort durch feste Verträge mit den Aoulältesten von den Engländern monopolisiert sei, die viel Süßholz (zur Porter- und Alefabrikation) über die Häfen am Schwarzen Meer (Batum, Poti, Noworossiisk) nach England exportieren und auch in Elisabethpol eine Succusfabrik angelegt haben. Die Wurzel wird mittelst hydraulischer Pressen zu großen rechteckigen Ballen gepreßt, die mit 8–10 eisernen Reifen umgeben werden (Fig. 26). Die extrahierte Wurzel wird als Feuerungsmaterial benutzt, die Asche auf Pottasche verarbeitet. Die erste russische Succusfabrik im Kaukasus legte Anfang der neunziger Jahre ein Deutscher (PETERS) in Tiflis an. Die von ihm eingeführte Marke «Sanitas» ist noch jetzt im Handel.

Rad. liquiritiae ross. «unpeeled». [Wright Layman and Umney phot.]
[Vgl. auch Greenish, Textbook.]
Auch in Ciskaukasien kommt Süßholz massenhaft wild vor, namentlich im Überschwemmungsgebiete des Terek und Sulak. Dieses Land, das aus abwechselnden Vegetations- und Überschwemmungsschichten besteht, wird, wie mir ROSENBERG berichtete, seit einigen Jahren von deutschen Kolonisten, meist Menonitengemeinden in Kultur genommen. Hier bildet die Pflanze mit ihren Ausläufern wahre Labyrinthe[S. 84] und es ist außerordentlich schwer sie ganz herauszubringen, um den Boden in Kultur zu nehmen. Man sieht dort auf den Feldern ganze Berge Süßholz, die, wenn die Handelskonjunktur ungünstig ist, einfach zu Feuerungszwecken benutzt werden.
Der große Bedarf an Süßholz, den besonders die Succusfabriken neuerdings im Kaukasus haben, wird jetzt vornehmlich durch die Bucharei gedeckt, wo die Süßholzpflanze an beiden Seiten des Amu-Darja in großen Mengen wächst. Zentrum der Gewinnung ist die Stadt Tschardshui. Die Wurzel wird hier, nachdem sie nach dem Graben vorgetrocknet wurde, in großen Trockenanstalten fertig getrocknet und mittelst hydraulischer Pressen zu Ballen von 9–10 Pud gepreßt. Ein großer Teil der Wurzeln wird über Krassnowodsh und Batum nach England und Amerika ausgeführt. Die Ausfuhr betrug im Jahre 1909 über 600000 Pud.
Rußland verbraucht übrigens viel Süßholz zum Einmachen der Früchte. Das russische Süßholz, das man in Bastmattenballen im Handel findet, ist meist geschält (Fig. 25), doch kommt auch ungeschältes vor (Fig. 26).
2. Spanisches Süßholz. Das spanische Süßholz ist stets ungeschält und besteht nur aus den Ausläufern. Die beste Sorte ist Tortosa (Catalonien) in Packleinewandballen à 24 Bunde à 5 kg (2 bouts 29/30 cm). Es bildet schön gewachsene, fast gleichdicke, im Querschnitt runde Stücke. Es ist zurzeit 1½ mal teurer als die zweite Sorte: Alicante, die in Säcken à 60 kg im Handel ist, bisweilen aber (z. B. 1909) fehlte. Die Händler machen einen Unterschied zwischen gelbem, rotem und braunem Süßholz. Das beste spanische Süßholz (Tortosa) kommt aus Aragonien und Catalonien, aus der Nähe des Ebro; das zweitbeste aus Córdoba (Andalusien), aus dem Tale des Guadalquivir, sowie aus Navarra und Alt-Castilien; geringere Sorten aus Alicante (Valencia). Hauptorte für den Export sind Sevilla, Alicante, Barcelona, Bilbao und Malaga.
Zum Typus des spanischen Süßholzes gehören und auch von G. glabra α. typica stammen die übrigen europäischen Sorten. Italien verarbeitet das Süßholz auf Succus und exportiert wenig (vom Typus des spanischen). Sicilianisches Süßholz war 1909 geschält, an der Sonne und im Ofen getrocknet, im englischen Handel. Griechisches Süßholz war 1906 im deutschen Handel in Pack. à 60 und 150 kg zu finden. Englisches Süßholz wird wenig exportiert. Es wird meist auf Succus (Pontefract cakes) verarbeitet. Das gleiche gilt von dem österreichischen (GAWALOWSKI 1906) und dem südfranzösischen Süßholz. Die übrigen Sorten sind ohne Bedeutung für den deutschen Handel.
3. Kleinasiatisches Süßholz geht über Smyrna besonders nach Nord-Amerika, das 1909 mehr als die Hälfte seines Bedarfes, nämlich 53½ Mill. Pounds aus der asiatischen Türkei, einführte. Anatolische Wurzel steht betreffs der Süße zwischen spanischer und russischer. Sie kommt über Smyrna und ähnelt der spanischen.
4. Syrisches Süßholz. Ausfuhrhafen für syrisches Süßholz sind Suedieh und Alexandrette. Dorthin wird die Wurzel auf Kamelen gebracht. Es ähnelt dem spanischen.
5. Mesopotamisches und persisches Süßholz. Im Zweistromlande wächst viel Süßholz (var. violacea und pallida), das meist an Ort und Stelle auf Succus verarbeitet, aber auch exportiert wird (über die Häfen im persischen Golf). Persien exportiert viel besonders nach Indien, der Türkei, aber auch nach Europa.
6. Australisches Süßholz. In Neuseeland besteht seit Anfang der achtziger Jahre des XIX. Jahrh. eine Süßholzkultur und Succusfabrikation. In Australien (Neu Süd-Wales) gedeiht Glycyrrhiza vorzüglich und das geerntete Süßholz ist gut (FINZELBACH), aber noch nicht im Handel.
[S. 85]
7. Kalifornisches Süßholz. In geringer Menge seit 1896 im amerikanischen Handel (soll 14% Glycyrrhizin im Extrakt enthalten).
8. Chinesisches Süßholz. China verbraucht große Mengen Süßholz. Ich traf es zierlich geschnitten in allen chinesischen Apotheken. Es ist dort nächst dem Ginseng das meist benutzte Arzneimittel (SIMMONDS). Es gilt als ein Mittel sich jung und schön zu erhalten. In den europäischen Handel gelangt chinesisches Süßholz, das ungeschält ist und spanischem gleicht, nicht. Dieses chinesische Süßholz wird (mit mehr Recht wie das Uralsüßholz) von G. uralensis FISCH. (s. oben S. 79, 80, 82) abgeleitet, da die Pflanze in Südsibirien, Ural, Turkestan und der Mongolei, sowie Tibet, also in chinesischen oder China benachbarten Ländern vorkommt. Aber auch die nordöstlichen Provinzen Chinas, z. B. die Mandschurei, liefern große Mengen Süßholz. Stapelplätze sind Chefoo, Hankow, Shanghai, Tientsin. Nach BRETSCHNEIDER (1896) produzieren Shantung, Shensi, Kansu, Netschwang Süßholz. (Über Mandschurisches Süßholz vgl. auch Pharm. Journ. 1904, April.) Glycyrrhiza uralensis wird auch von PRZEVALSKI als Stammpflanze des Süßholz genannt, das die Mongolen an die Chinesen verkaufen, welche die Droge auf dem Hoangho hinunter an die chinesischen Märkte bringen. Das Süßholz von G. uralensis (Chuntschir) enthält nach KOWALEJEW mehr Glycyrrhizin als das spanische und weniger als das russische. Die Herbstpflanze enthielt mehr als die Sommerpflanze.
Lit. KOWALEJEW, Pharm. Journ. Rußl. 1908, 1063 (Pharm. Zeit. 1909, Nr. 8).
Die Einfuhr von Süßholz nach Hamburg betrug seewärts 1906: 5484, 1907: 5088, 1908: 2503 dz. (= 100 kg). Davon kamen 1907 (1908) in dz aus Arabien 442 (446), Kleinasien 16 (588), Syrien 235 (0), Persien 1346 (0), Russischen Ostseehäfen 2010 (787), Frankreich 442 (146), Spanien 204 (151), russischen Häfen am Schwarz. u. As. Meer 0 (268), Großbritannien 388 (0). Übrige Einfuhr seewärts 5 (117), per Eisenbahn und Oberelbe 660 (819). Deutschland verbraucht vornehmlich russisches Süßholz. Italien exportierte nur wenig Radiche di Liquirizia, 1907: 1014, 1908: 822, 1909: 1061 Quint. Frankreich importierte 1908 28840 Quintalm. Süßholz, bes. aus der Türkei und Spanien, wenig (1366) aus Rußland, nur 443 Qˡm aus Italien, etwas auch aus Algier. Japan importierte Süßholz 1908: 558336, 1909: 614496 kin. Die Vereinigten Staaten von Nordamerika brauchen sehr große Mengen Licorice root. Die Einfuhr betrug 1906: 102151969, 1907: 66115863, 1908: 109355720, 1909: 97742776 Pounds, vornehmlich aus Rußland und der asiatischen Türkei (c. 2 Mill. auch aus Spanien). Amerika kauft bisweilen die ganze kleinasiatisch-syrische Ernte auf.
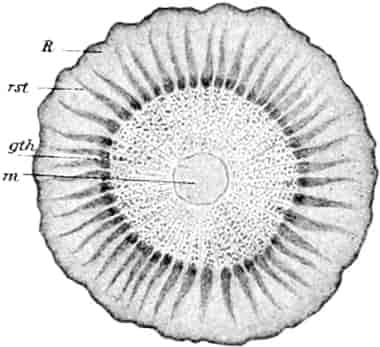
Glycyrrhiza glabra. Lupenbild eines Ausläufers.
[Aus Tschirch-Oesterle, Atlas.]
Beschreibung der Droge. Das spanische Süßholz besteht nur aus den zu Bündeln vereinigten, meist geraden und einfachen ungeschälten Ausläufern von ziemlicher Länge, die meist in Wasser leicht untersinken. Wurzeln sind selten. Die Ausläufer sind oft auf weite Strecken von gleicher Dicke und fast genau rundem Querschnitt. Sie sind bis 2 cm dick, schwer, dicht, zäh, im Bruche grob- und langfaserig. Die Oberfläche ist längsrunzelig und querrissig, in der Farbe etwas wechselnd, graubräunlich bis rotbraun. Da und dort finden sich Rindenhöckerchen und vereinzelte Knospen oder deren Ansatzstellen. Das Innere ist gelb. Im Lupenbild tritt ein grobstrahliger Bau in Holz und Rinde hervor. Letztere ist deutlich geflammt. Im Holzkörper sind Gefäßöffnungen, das Cambium als graue Linie sichtbar. Die Ausläufer haben immer ein Mark, die größeren Wurzeln bisweilen (Fig. 27).
[S. 86]
Glycyrrhiza glabra. Querschnitt durch einen Ausläufer am Cambium.
[Nach Tschirch, Anatomie.]
Das russische Süßholz ist meist mehr oder weniger tief geschält und daher auch außen hell zitronengelb. Es finden sich in ihm sowohl die dünnen Ausläufer,[S. 87] wie die nach unten sich verjüngenden Wurzeln, die bisweilen riesige Dimensionen annehmen und dann einen gewaltigen rundlichen, bisweilen mehrteiligen Wurzelkopf tragen. Die Ausläufer sind auch hier auf weite Strecken gleich dick. Der Bruch ist meist faseriger als beim spanischen, welches überhaupt zäher, fast hornartig zu sein pflegt. Öfter finden sich hier auch Zerklüftungen im Holzkörper. Es ist meist leichter und lockerer als das spanische und man findet oft Stücke, die in Wasser nicht untersinken. An der Außenseite findet man zahlreiche Fäserchen: beim Schälen bloßgelegte Bastfasergruppen der Rinde.
Anatomie. Die Ausläufer sind von Sekundärkork bedeckt, der in der Stärkescheide entstanden ist (die primäre Rinde, die «Wurzelhaare» trägt, wird frühzeitig abgeworfen, TSCHIRCH, Angew. Anatomie Fig. 316). Die Korkschicht ist oft 10–25 Zellenreihen dick und schuppt infolge von «Trennungsschichten» zwischen den Korkplatten ab. In der unter dem Kork liegenden Rindenpartie finden sich Oxalat führende Zellen, vereinzelte Bastfasern und (sehr zerstreut) Protophloëmbündel. Die sekundäre Rinde ist von 3–8 Zellen breiten, sich nach außen verbreitenden Markstrahlen (Rindenstrahlen) durchzogen, die Stärke und Öltröpfchen führen. Zwischen ihnen liegt der sekundäre Siebteil. Er besteht aus Siebröhren, Cambiform, Bastfasern und Phloëmparenchym. Die Siebröhren sind nur in der Nähe des Cambiums unverändert erhalten. Etwas weiter nach außen sind sie samt dem Cambiform obliteriert und bilden nicht mehr leitende, breite, gestreckte, von Spalten durchzogene Keratenchymbänder (Fig. 28). Das Phloëmparenchym obliteriert nicht. Es führt Stärke, Öl und da und dort monosymmetrische Oxalatkristalle (Einzelkristalle und Zwillinge), letztere besonders in der unmittelbaren Umgebung der zahlreichen Bastfasergruppen in sog. Kristallkammerfasern. Die kristallführenden Zellen sind mit einer unregelmäßigen bis fast an den Kristall heranreichenden Verdickungsschicht versehen, die mit Jodschwefelsäure blauviolett wird und früher entsteht als der Kristall. Dadurch erscheint der Kristall wie in einer Tasche steckend. Die Bastfasern sind sehr lang und stark, oft fast bis zum Verschwinden des Lumens, verdickt. Ihre primäre Membran ist stark verholzt, die sekundäre wenig, die tertiäre nicht oder fast gar nicht. Das Cambium ist wenig deutlich. Der Holzkörper besteht aus Gefäßen, Tracheïden, Holzparenchym und Bastfasern (Libriform). Namentlich an der Peripherie finden sich sehr zahlreiche und sehr weite Gefäße. Im allgemeinen differiert die Weite der Gefäße erheblich: die engsten haben eine lichte Weite von 25 mik., die weitesten bis 170 mik., die meisten 100–130 mik. Die engsten besitzen kurze Tüpfel mit spaltenförmigem Ausführungsgang, die mittleren Leiter- und Netzleistenverdickungen, die weitesten schief reihenförmig angeordnete rhombische Tüpfel mit spaltenförmigem Ausführungsgang. Die Perforationsstellen der ursprünglichen Querwände sind gut zu sehen, die Gefäßwand daher deutlich gegliedert (Fig. 29). Die Gefäße werden begleitet von Tüpfel- oder Netzfaser-Tracheïden. Das Holzparenchym führt den gleichen Inhalt wie das Phloëmparenchym und die Markstrahlen. Die Bastfasergruppen, die in nichts von denen der Rinde abweichen, werden von Kristallkammerfasern begleitet, die ähnliche, im Typus der Form  folgende Kristalle einschließen. Es finden sich sowohl Einzelkristalle wie Zwillinge. Im Zentrum pflegt ein mehr oder weniger großes parenchymatisches Mark zu liegen.
folgende Kristalle einschließen. Es finden sich sowohl Einzelkristalle wie Zwillinge. Im Zentrum pflegt ein mehr oder weniger großes parenchymatisches Mark zu liegen.
In allen parenchymatischen Zellen findet sich neben meist einzelnen kleinen, rundlichen, spindelförmigen, ei- oder stäbchenförmigen, meist 1,5–7 (selten bis 20[S. 88] und 30) mik. großen Stärkekörnern, Glycyrrhizin. Setzt man konzentrierte Schwefelsäure hinzu, so färbt sich das ganze Gewebe strohgelb und der Farbstoff wird von den Membranen der Gefäße und der primären Membran der Bastfasern gespeichert (TSCHIRCH-OESTERLE, Atlas).
Glycyrrhiza glabra. Längsschnitt durch den Gefäßteil eines Ausläufers.
[Aus Tschirch-Oesterle, Atlas.]
Die Wurzeln weichen nur wenig von den Ausläufern ab. Der sekundäre Bau ist fast ganz derselbe. Sogar Mark wird oft gebildet, so daß es schwer hält, an kleinen Stücken Wurzeln von Ausläufern zu unterscheiden. Das primäre (meist tri- oder tetrarche) Bündel geht bald in den kollateralen Bau über und die primäre Rinde wird frühzeitig abgestoßen und ist nur an 8–10 mm dicken Wurzeln noch in Form von Fetzen zu sehen (TSCHIRCH, Angew. Anatomie, Fig. 315).
Bisweilen sind beim Süßholz einzelne Partien der Rinde, des Holzkörpers oder des Markes durch Binnenkorkbildung eingekreist und so aus dem Saftverkehr ausgeschaltet. An der Außenseite dieser Korkbänder finden sich reichlich Oxalatkristallzellen (VOGL) — oft ganze Nester bildend.
Das meist aus geschälter Wurzel hergestellte, daher korkfreie Pulver (bei schlecht mundierter Ware treten einige Korkzellen auf) wird durch konzentrierte Schwefelsäure dunkelrot- bis orangegelb. Es läßt die Stärkekörner, die Kalkoxalatkristalle und deren Splitter, die Fragmente der getüpfelten und Netzleistengefäße sowie die Bastfasern und deren Gruppen erkennen, die oft von Kristallkammerfasern begleitet sind.
Lit. G. W. WEDEL, De glycyrrhiza 1717 (hier die erste, allerdings sehr primitive mikroskopische Untersuchung). — WIGAND, Flora 1877 und Lehrbuch 1879. — TSCHIRCH, Angew. Anatomie und Artikel Liquiritia in Realenzykl. d. Pharm. VIII, 234. — TSCHIRCH-OESTERLE, Anatom. Atlas. — TSCHIRCH-HOLFERT, Arch. d. Pharm. 1888, S. 473. — VOGL in WIESNER, Rohstoffe. 2. Aufl. — A. MEYER, Drogenkunde. — Der primäre Bau bei HOLFERT, Arch. Pharm. 1889. — Das Pulver sehr ausführlich in KOCH, Mikrosk. Anal. d. Drogenpulver II, Taf. 17 und auch bei KRAEMER, Am. journ. ph. 1897, Proc. Am. ph. ass. 1898, 310. — ICLIFFE, Drug. Circ. 1900 u. and. — Entwicklungsgesch. von Frucht und Samen v. Gl. gl. in STSCHERBATSCHEFF, Beitr. z. Entw. einig. Sam. u. Fr. Arch. Pharm. 1907, 48.
Chemie. Der wichtigste Bestandteil des Süßholzes ist das Glycyrrhizin. Das Glycyrrhizin (Glycyrrhizinsäure, Süßholzzucker, Wurzelzucker) wurde von PFAFF aufgefunden und Glycion genannt, ROBIQUET gab ihm 1809 den Namen Glycyrrhizin. Es wurde dann von DÖBEREINER, BERZELIUS, BUCHNER, MARTIN, HIRSCH, RUMP, FLÜCKIGER und MÖLLER, SESTINI u. and. studiert. A. VOGEL jun. gab ihm die Formel C16H26O6, ROESCH: C16H24O6, T. LADE: C36H48O14, GORUP-BESANEZ:[S. 89] C48H72O18, HABERMANN: C22H33NO9 oder C44H66N2O18. Auch ROUSSIN gibt Stickstoff als Bestandteil an, ebenso TSCHIRCH und RELANDER (1898). GORUP-BESANEZ rechnet das Glycyrrhizin zu den Glykosiden. HABERMANN erhielt bei der Hydrolyse eine harzige Substanz, die er Glycyrrhetin nannte neben Parazuckersäure, GORUP-BESANEZ einen gärungsfähigen Zucker. Die zuerst von FLÜCKIGER (1867) ausgesprochene, von vornherein unwahrscheinliche Ansicht, daß das Glycyrrhizin in der Pflanze als Ammonsalz vorhanden sei, wurde von ROUSSIN (1875) wiederholt und ging in alle Lehrbücher über. Sie ist von TSCHIRCH und CEDERBERG (1907) widerlegt worden. In Pflanzen sind übrigens organische Ammonsalze bisher niemals gefunden worden. Die Glycyrrhizinsäure ist in der Pflanze an Kalium und Calcium gebunden (nach SESTINI nur an Ca, was aber unwahrscheinlich ist). TSCHIRCH und CEDERBERG erhielten auch zuerst die Glycyrrhizinsäure über das tertiäre Kaliumsalz in reiner Form und zeigten, daß sie bei der Hydrolyse in Glycyrrhetinsäure und Glukuronsäure zerfällt. Sie formulierten daher:
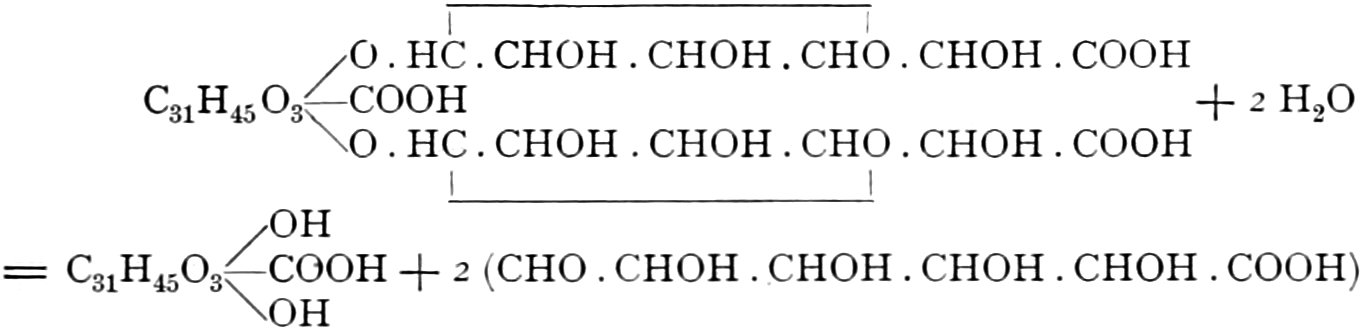
Die Glukuronsäure wurde dann durch TSCHIRCH und GAUCHMANN (1908) weiter identifiziert und wahrscheinlich gemacht, daß in der Glycyrrhetinsäure nur eine doppelte Bindung und der Kern:
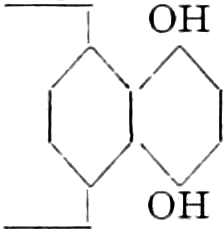
enthalten ist, sowie daß wahrscheinlich die Bindung der Glukuronsäure an den α-Hydroxylen erfolgt.
Weder die Glycyrrhetinsäure (F = 210°), die in Nadeln kristallisiert, noch die Glukuronsäure (s. oben S. 77) sind süß. Wohl aber schmeckt sowohl die in farblosen Schuppen oder Prismen kristallisierende dreibasische, optisch inaktive Glycyrrhizinsäure C41H55O7(OH)6(COOH)3 (F = 205°) als ihre wasserlöslichen Kalium- und Ammoniumsalze intensiv und rein süß, nicht kratzend — noch in Lösungen 1:20000. Sie reduzieren weder Fehlingsche Lösung noch ammoniakalische Silberlösung. Die Glycyrrhizinsäure ist in heißem Wasser löslich. Die Lösung gesteht beim Erkalten zu einer Gallerte (beim Rohglycyrrhizin beobachtete dies schon PFAFF). Das Glycyrrhizin, das einen besonderen Typ der Süßstoffe darstellt, ist zu etwa 5,3 bis 7% in der Droge enthalten (TSCHIRCH, CEDERBERG und ERIKSSON). Die früheren Autoren (FLÜCKIGER, SESTINI, J. H. MÖLLER u. and.) sprechen von 6,27, 7,5, 8% und noch höheren Zahlen (9% GAWALOWSKI). Sie hatten aber nur unreines G. in Händen. Russisches Süßholz ist glycyrrhizinreicher als spanisches. Das fand schon NEESE (1863).
Das Roh-Glycyrrhizin fällt beim Versetzen der Perkolate der Wurzel mit Schwefelsäure[S. 90] als pflasterartige Masse aus. Aus der alkoholischen Lösung der letzteren (1=3) fällt bei weiterem Alkoholzusatz eine stickstoffhaltige gummiartige Masse. Dampft man das Filtrat zur Trockne, löst in Alkohol und setzt Äther hinzu, so fällt eine außerordentlich bitter und dabei kratzend schmeckende Masse aus. Das so gereinigte Glycyrrhizin gibt an Äther etwas Glycyrrhetinsäure (s. oben) ab, die also das Glycyrrhizin in der Pflanze begleitet. In dem Filtrate von der Schwefelsäurefällung (s. oben) findet sich d-Glukose und Mannit (TSCHIRCH und RELANDER). Doch ist fraglich, ob Mannit primär gebildet in der Droge vorkommt. ARNST und HART geben den Zuckergehalt bei span. Süßholz zu 9,57, bei russischem zu 10,39% an, KÖNIG auf 7,44 bzw. 6,01% (in der Trockensubstanz 8,16 bzw. 6,58%) Glukose (direkt Fehling reduzierend). Nach RASENACK kommt auch reichlich Saccharose im Süßholz vor. (KÖNIG gibt davon für spanisches 2,13, für russisches 10,38% an.) Das Süßholz ist also ein wahres Arsenal von Süßstoffen. Es enthält deren nicht weniger wie vier.
Die von mir vorgeschlagene Methode der Bestimmung der drei Süßstoffe (Glukose, Rohrzucker, Glycyrrhizin) nacheinander in derselben Lösung ist von ELLA ERIKSSON in meinem Institut durchgeprüft worden. Sie beruht darauf, daß Glukose in der Kälte, Saccharose bei kurzem, Glycyrrhizin erst bei lange anhaltendem Kochen FEHLINGsche Lösung reduzieren und nach ALLIHN bestimmt werden können. In dem mit Alkohol von den Schleimstoffen befreiten Auszuge wird zuerst durch zwölfstündiges Stehenlassen mit FEHLINGscher Lösung in der Kälte die Glukose oxydiert und nach ALLIHN bestimmt, im Filtrate vom Kupferoxydul wird durch 3 Minuten langes Kochen mit FEHLINGscher Lösung die Saccharose bestimmt und dann aus dem Filtrate das Glycyrrhizin mit Schwefelsäure ausgefällt, aufgelöst und 15 Stunden mit FEHLINGscher Lösung gekocht und dann ebenfalls nach ALLIHN bestimmt. Wir fanden in lufttrockenem Süßholzpulver: Glukose 1,39–1,45%, Saccharose 2,40 bis 2,57%, Glycyrrhizin 6,42–7,13%. Nach der CEDERBERGschen gravimetrischen Methode erhielten wir etwas weniger, nämlich 5,5–5,6% Glycyrrhizin bei dem gleichen Material.
Ferner findet sich im Süßholz l-Asparagin = NH2CO.CH2.CH(NH2).COOH, 2–4% (SESTINI), das CAVENTOU darin auffand und Agedoil nannte (auch PFAFF hatte es in Händen). HENRY und PLISSON identifizierten es 1828 mit dem von VAUQUELIN und ROBIQUET (1809) im Spargel aufgefundenen Asparagin. ROBIQUET erwähnt in seiner Analyse eine kristallinische Substanz, ähnlich dem Vauqueline. MOULIN weist das Asparagin dadurch nach, daß er Schwefelsäure und etwas Resorcin zusetzt, erhitzt und verdünntes Ammoniak hinzufügt. Es entsteht eine fluoreszierende Lösung. Ferner enthält das Süßholz bis 3,5% Fett (wir fanden nur 0,2–0,8%), etwas Harz (Glycyrrhizinharz?), gelben Farbstoff in den Gefäßwandungen, durch Kali tiefgelb, wenig Gerbstoff, viel Stärke (in span. Süßholz 31,33, in russischem 20,73%, ARNST und HART), Gummi 1,5–4% (MADSEN) und ein ätherisches Öl (0,03% in spanischer, 0,035% in russischer Droge, HAENSEL). Süßholz enthält auch kleine Mengen Salicylmethylat (DESMOULIÈRE). Die bisweilen angegebene Apfelsäure dürfte Glukuronsäure gewesen sein. Der Extraktgehalt beträgt bei russischem Süßholz meist 35–38%, bei spanischem 20–25% (LA WALL erhielt 1896 55%; Pharm. helv. IV verlangt wenigstens 28% bei 100° getrocknetes Extrakt, die Ph. austr. 30%). Asche 3–6% (selten mehr als 5%, HAUKE, nach DIETERICH 3,2 bis 6,15 (im Pulver etwas mehr; DIETERICH: russisches 4,8–11,7, span. 5,1–9,9);[S. 91] nach Pharm. helvet. IV höchstens 6%. Der Wassergehalt beträgt 6,5–10% (im Mittel 8,75 ARNST und HART).
Durch Liegenlassen in Ammoniakgas soll Süßholz etwas süßer werden (LANDERERS Rad. liquirit. ammoniata). Die Prozedur ist aber unzulässig; in ihrer Wirkung zudem zweifelhaft.
Lit. (Glycyrrhizin.) Ältere Lit. in SCHWARTZE, Tabellen 1819. — PFAFF, System d. Mat. med. I, 187. VI, 113. — DÖBEREINER, Elemente d. pharm. Chem. 149. — ROBIQUET, Ann. de chim. 72 (1809), 143, TROMMSD. Journ. 19. — BERZELIDS, Poggend. Ann. 10 (1827). — MARTIN, Jahresb. d. Chem. 1860. — RUMPF, N. Repert. d. Pharm. 4, 153. — HIRSCH, Jahresb. d. Chem. 1860, 551; 1871, 308. — FLÜCKIGER, Pharmakognosie I. Aufl. — A. VOGEL, Journ. f. prakt. Chem. 28, 1. — LADE, Ann. Chem. Pharm. 59, 224. — GORUP-BESANEZ, Ann. Chem. Pharm. 118, 236. — ROESCH, Beitr. z. Kenntn. d. Glyc. Dissert. Erlangen 1877. (Jahresb. d. Pharm. 1878, 426.) — WESELSKY u. BENEDICT, Ber. d. chem. Ges. 1876, 1158. — ROUSSIN, Journ. pharm. chim. 1875. (Arch. d. Pharm. 1876, 157.) — SESTINI, Gaz. chim. ital. 1878, 131 (Ber. 1878) u. Arch. d. Pharm. 1880, 233. — HABERMANN, Sitzungsb. d. Wien. Akad. 74 (1878) u. Ann. d. Chem. 197 (1879), 105. — TSCHIRCH u. RELANDER, Schw. Wochenschr. f. Ch. u. Ph. 1898, S. 243. — TSCHIRCH u. CEDERBERG, Arch. Pharm. 1907, 97. — TSCHIRCH u. GAUCHMANN, Arch. Pharm. 1908, 545 u. 558. — RASENACK, Arbeit. d. K. Gesundheitsamt. 1908.
HAENSELS Berichte 1899. — ARNST u. HART, Zeitschr. ang. Chem. 1893, 136. — KÖNIG, Nahr. u. Genußm. II, 1065. — KREMEL, Pharm. Post. 22, 194. — MOULIN, Journ. pharm. 1896. 543. — LA WALL, Am. journ. pharm. 1896. — NEESE, Jahresb. d. Ph. 1863. — (Asche.) HAUKE, Zeitschr. Österr. Apoth. Ver. 1902, 418; MOOR and PRIEST, Ph. journ. 1900 und DIETERICH, Helfenb. Ann. 1890.
Glycyrrhizin in anderen Pflanzen. Mit Sicherheit nachgewiesen und durch Analysen belegt ist das Glyzyrrhizin bisher nur in der Wurzel der zu den Phaseoleen gehörenden Periandra dulcis MART. (P. mediterranea VELL. TAB.), der brasilianischen Süßholzwurzel (Alcassuz), in der PECKOLT es bereits vermutete, durch TSCHIRCH und GAUCHMANN, sowie in der Monesiarinde von Pradosia lactescens (VELL.) Radlk. (Chrysophyllum glycyphloeum CASAR.), einer brasilianischen Sapotacee, aus der zuerst PAYEN den Süßstoff in unreiner Form erhielt, ebenfalls durch TSCHIRCH und GAUCHMANN.
Die Wurzel von Abrus precatorius soll nach HOOPER 1,5% Rohglyzyrrhizin enthalten, die Blätter sogar 9–10%. (Die Zahlen sind wohl zu hoch.) Die Jequiritywurzel ist als Süßholzersatz (indisches Süßholz) empfohlen worden. Doch sind die Auszüge etwas bitterer (RUDOLFE). Ferner wird Glyzyrrhizin angegeben in Glycyrrhiza lepidota (MAC CULLOUGH), Sarcocolla, Trifolium alpinum L. (die unterirdischen Teile als Réglisse des montagnes bekannt), Astragalus glycyphyllos, Rhizom von Polypodium vulgare (Engelsüß) und pinnatifidum var. indivisa (GUIGNET), Myrrhis odorata L. (SCHRÖDER), Guilielma speciosa MART., Ononis spinosa (das Ononid soll glyzyrrhinähnlich sein), Lepidota Pursh. (angeblich 8,5%), Tabermirca nummularia, Alyssicarpus longifolius, Macrua arenaria (die Wurzel der letzteren Pflanze findet sich in indischen Bazaren. SIMMONDS). Doch ist bei keiner dieser Pflanzen bisher der Beweis erbracht, daß wirklich Glyzyrrhizin vorliegt. Daß der von RASENACK untersuchte und als Glykosid erkannte Süßstoff von Eupatorium Rebaudianum, auf welche Pflanze BERTONI (Pharm. Zeit 1902, 108) aufmerksam machte, nicht Glyzyrrhizin ist, zeigten TSCHIRCH und GAUCHMANN (1908).
Lit. PECKOLT, Zeitschr. d. Österr. Apoth. Ver. 1867; Pharm. Rundsch. 1888. — PAYEN, Exam. chim. et méd. du Monesia. Paris 1841. — GUIGNET, Rep. d. pharm. 13, 72. — HOOPER, Pharm. Journ. 1894, 937 (Abrus auch: NORMAN, Bull. of ph. 1897). — SIMMONDS Bull. of pharm. 1894, 205. — RUDOLFE, ebenda 1897. — FLÜCKIGER, Pharmakogn. und Pharmakographia. — GUIGNET, Jahresb. 1885, 16. — SCHRÖDER, ebenda (Arch. Pharm. 1885, 621). — TSCHIRCH und GAUCHMANN, Arch. Pharm. 1908. — MAC CULLOUGH, Am. journ. ph. 1890, 388.
Der Geschmack des Süßholz ist eigenartig kräftig süß, schwach kratzend, ein wenig schleimig und sehr schwach bitterlich.
Verfälschung. Im Pulver wurde als Verfälschung Olivenkernmehl und Maisstärke gefunden (EVANS), auch Kartoffelstärke (1908). WIGAND gibt (1887) als Verfälschung des Pulvers an: Mehl, Arrowroot, Curcuma, Farinzucker, Guajac, Schüttgelb, Sem. Trigonellae. Ich habe 1909 nichts dergleichen beobachtet. Auch MITLACHER fand[S. 92] Süßholz wenig verfälscht. BASTIN beschreibt die Unterschiede (?) der Stolonen und Wurzeln. HANSON macht auf Verfälschung des Pulvers mit ausgezogenem Pulver aufmerksam.
Lit. EVANS, Pharm. Journ. 1905. — WIGAND, Pharmakognosie. — MITLACHER, Ergebnisse d. Apotheken-Visitationen usw. Zeitschr. d. Öster. Ap. Ver. 1904. — BASTIN, Detection of stem admixtures in Root drugs. Pharm. Journ. 1902, 652. — HANSON, Amer. Drugg. 1886 (Jahresb. d. Ph. 1896).
Schädlinge. Ein Schädling der Süßholzdroge ist Pyralis farinalis, die Mehlmotte (JACKSON). Dann besonders Niptus hololeucus FALDERMANN, eine sehr schädliche Ptinide, die durch russisches Süßholz in Deutschland eingeschleppt, in den letzten Dezennien sich stark ausgebreitet hat (ISRAEL).
Geschichte. Das Süßholz gehört zu den ältesten Drogen. Es findet sich im Magical Papyrus (I, S. 465) und ist einer der Bestandteile des Theriak (I, S. 551). Bei den Indern diente Süßholz (madhuka) beim Liebeszauber (JORET). Eine Abkochung der Süßholzwurzel und des Süßtee (Gymnostemma cissoides) wird auch zum Bade Buddhas bei dessen Geburtsfeier am 8. Tage des 8. Monats benutzt. Am Morgen dieses Festes wird die Statue des Gottes in eine Kufe gesetzt und mittels einer Kelle von den Betenden dreimal mit diesem Tee begossen. Die abtropfende Flüssigkeit wird gesammelt und bildet ein geschätztes Heilmittel (JUNKER VON LANGEGG). Liquiritia gehört auch zu den Drogen der ersten Klasse («Fürsten») der Shen nung Pen tsʿao king, des ältesten chinesischen Kräuterbuches (I, S. 515). Es wurde seit alter Zeit, wie noch heute bei Katarrhen der Luftwege benutzt. Bei THEOPHRAST steht (IX, 13): γλυκεῖα δὲ καὶ ἡ σκυθική. καὶ ἔνιοι δὲ καλοῦσιν εὐθὺς γλυκεῖαν αὐτήν. γίνεται δὲ περὶ τὴν Μαιῶτιν. χρησίμη δὲ πρός τε τὰ ἄσθματα καὶ πρὸς τὴν βῆχα ζηρὰν καὶ ὄλως τοὺς περὶ τόν θώρακα πόνους. ἔτι δὲ πρὸς τὰ hέλκη ἐν μέλιτι. δύναται δὲ καὶ τὴν δίψαν παύειν ἐάν τις ἐν τῶ στόματι ἔχῃ usw. Und ποιεῖ δὲ τὸ χύλισμα πρὸς τραχύτητας ἀρτηρίας (der Saft wirkt gegen Rauheit der Luftröhre) sagt schon Dioskurides (III, 5). Scribonius kennt Lakritz-Pastillen. Wir finden es also bei THEOPHRAST (I, S. 548) und DIOSKURIDES (I, S. 561). Ferner bei GALEN (I, S. 581), ORIBASIUS (I, S. 588), MARCELLUS EMPIRICUS (I, S. 590), PAULUS AEGINETA (I, S. 592) und ALEXANDER TRALLIANUS, die auch bereits das Süßholzextrakt kennen. Ebenso findet es sich bei SUSRUTAS (I, S. 505). Die Inder werden es wohl von den Persern und Arabern übernommen haben. Es war bei ihnen sehr geschätzt, kommt aber in Indien, das die Droge noch heute vom persischen Golf, Karachi und Afghanistan bezieht, nicht vor. Auch die Kultur des Süßholz ist alt, besonders die in Spanien. Doch reicht sie hier nicht bis ins X. Jahrh. zurück. Der Kalender des HARIB erwähnt Süßholz nicht. Die Kultur des Süßholz «auf dem Acker» bei Bamberg wird von den einen (REUSS, Walafridi Strabi Hortulus 1834) auf die Gemahlin HEINRICHS II., KUNIGUNDE († 1033), von anderen (wohl richtiger) auf die Benediktiner der Abtei Michaëlsberg zurückgeführt, die im XV. Jahrh. das Süßholz aus Italien (und Spanien?) nach Deutschland brachten. Im Vocabular AFRICS, Erzbischof von Canterbury (X. Jahrh.), in KARLS Capitulare, im St. Galler Klosterplan, im Hortulus und bei MACER FLORIDUS fehlt das Süßholz. Es wurde also in Deutschland kaum vor dem XIII. Jahrh., wahrscheinlich erst vom XV. Jahrh. an kultiviert. PLATEARIUS (I, S. 635) und CRESCENZI (I, S. 678) erwähnen Kulturen in Italien und beschreiben die Darstellung des Succus. TABERNAEMONTANUS (I, S. 848) erwähnt Succus liquiritiae von Creta. «Liquiritia» (Radix? oder Succus?), figuriert auch im XIV. Jahrb. in englischen Dokumenten (Testamentsexekution des Bischofs von Exeter 1310), unter Regolitia figuriert Liquiritia in verschiedenen Vorschriften des «Ricettario fiorentino» 1498. In der Frankfurter Liste 1450 (I, S. 812) steht Lequeritia und Succus liqworicic, bereits in dem Frankfurter Catalogus von 1582 (I, S. 817) findet sich Rad. dulcos scythica (russisches) und hispanica, sowie cretischer (candiacus seu creticus) und venedischer Süßholzsaft. Die Eßlinger Taxe 1571 (I, S. 816) hat liquiriciae liquor cond(ensatus). Eine Abbildung der Pflanze, der Handelsform der Droge und einer Succustablette mit dem Reichsadler gab schon BOCK (Fig. 30). Nach TABERNAEMONTANUS wurde schon Anfang des XVI. Jahrh. viel Süßholz in Deutschland gebaut und Succus (im Gegensatz zum venedischen vulgaris genannt) dargestellt (vgl. auch Taxe von Worms 1609). Des bambergischen Süßholz gedenken CORDUS, BOCK und GESNER (Horti german.). SCHRÖDER erwähnt in seiner Pharmac. med. chym. sogar nur das bambergische. In[S. 93] der Reformation von Frankfurt 1656 steht ausdrücklich: Liquiritiae succus impissatus Bambergensis. Das englische Süßholz steht in der BERLU-Liste (1724, I, S. 949). Die Süßholzkultur in Italien scheint nicht viel über das XIII. Jahrh. zurückzureichen. Sie wird zuerst bei CRESCENZI erwähnt. Und auch später kann sie nicht bedeutend gewesen sein, denn ANGUILLARA, MATTHIOLI und PORTA (Villae Libri XII) erwähnen sie nicht. Benutzt wurde das Süßholz aber das ganze Mittelalter viel, kaum weniger als in späterer Zeit, denn es fehlt in keinem medizinischen Werke. Italienisches und spanisches Süßholz gelangte 1264 nach England und zahlte 1305 dort Zoll (I, S. 713). In Sizilien wurde 1770 Succus noch ebenso bereitet wie zur Zeit des PLATEARIUS (RIEDESEL, Reise durch Sizilien 1770). Der Succus liquiritiae ist als Heilmittel kaum jünger als die Wurzel. Schon ANDROMACHUS (I, S. 551) nennt «Cyanea Glycyrrhizae» (nach CORDUS: Succus liquir.) unter den Bestandteilen des Theriak. DIOSKURIDES empfiehlt ihn. In MEGENBERGS Buch der Natur (Mitte des XIV. Jahrh. I, S. 692) steht lakritzenzahersaf, daz man süezholz haizt. Es ist dies die erste Erwähnung des Succus in Deutschland. SALADINUS führt ihn in seiner Series medicaminum im Compendium Aromatariorum 1488 auf. THEODERICH Dorsten beschrieb im Botanicon, Francf. 1540, die Darstellung in Italien und WALTER RYFF gab in seinem Confectbüchlein, Frankf. 1544, eine verbesserte Vorschrift (FLÜCKIGER). Schon im XV. Jahrh. finden wir ihn in Taxen (s. d.). In den rates of marchandizes (I, S. 921) findet sich der Succus. In der BERLU-Liste (I, S. 951) steht Succus liquiritiae angl. und hispan. In den Taxen Frankfurt 1718 und Goßlar 1731 steht Succ. liquir. hispanic. In GEOFFROYS Materia medica (1742) wird besonders spanischer, französischer und holländischer Succus erwähnt (dann cretensischer, italienischer und deutscher) und als bester der catalonische (circa Dertusam et Ilerdam paratus) bezeichnet. Auch GREN erwähnt 1799 vorwiegend den letzteren (neben sizilianischen). In dem Antidotario romano vom Jahre 1675 wird gesagt, daß der Succus aus den in der Gegend von Ascoli im Herbste gesammelten Wurzeln dargestellt werde. Im XVIII. Jahrh. wird der Suc de reglisse de Bayon erwähnt.
Paralleldrogen. Die in Nordamerika heimische Glycyrrhiza lepidota NUD. enthält Glycyrrhizin (CULLONGH), nach HOOPER sogar 6,39%. Sie wird aber, wie es scheint, nicht in größerem Stile benutzt. Vgl. auch indisches Süßholz (S. 91) und brasilianisches Süßholz (S. 91).
Lit. CULLONGH, Amer. journ. pharm. 1890. — HOOPER, Pharm. Journ. 1894.
Aus Hieronymi Tragi (Bock), Historia stirpium 1552. Links die Handelsform des Süßholz, rechts Succustablette mit Stempel.
[Phot. verkleinert.]
Succus liquiritiae.
Syn. Extract. glycyrrhizae oder liquiritiae crud., Lakritzen (in vielen Sprachen [vgl. I, S. 1060], auch finn. lakritsi), Süßholzsaft, Bärendreck, Bärenzucker, — Suc[S. 94] oder jus de réglisse (franz.) — Extract or juice of liquorice (engl.) — Sugo oder succo di liquirizia oder di regolizia (ital.) — drop (holl.) — ὀπός γλυκυρρίζης (n.-gr.) — bei ACTUARIUS (I. S. 792): Succus dulcis radix — hind.: jathímadh-ká-ras, mulatthi-ká-ras — pers.: asus, rob-a-sus. — arab.: rubbussús. — (Etym. s. Süßholz).
Gewinnung. In allen Süßholz bauenden und sammelnden Ländern wird auch Succus dargestellt, am meisten wohl jetzt in Rußland, das England und Amerika damit versorgt. Der in Deutschland verwendete stammt meist aus Italien oder Kleinasien, der spanische, französische, englische wird zumeist im Lande selbst verbraucht. In Italien, dessen Succus für uns in erster Linie in Betracht kommt, wird sowohl in Calabrien (der Succus heißt in Frankreich geradezu «Réglisse de Calabre») wie in Sicilien Succus fabriziert, meist in von Großunternehmern abhängigen Kleinbetrieben auf dem Lande, die ziemlich konservativ an den Gebräuchen festhalten und seit 100 Jahren wenig geändert haben.

Waschen und Schneiden der Süßholzwurzel in der Fabbrica liquirizia des Barone Compagna in Corigliano. Die gewaschenen Wurzeln werden von zwei Arbeitern mit Stangen in die ganz vorn sichtbare Schneidemaschine geschoben.
[Ravasini phot.]
Der Succus kann in der Form fester Stangen nur aus frischer Wurzel dargestellt werden. Nur diese Stangen werden hart und wetterfest und lassen sich brechen. Wird Succus aus getrockneter Wurzel dargestellt, so erhält man Stangen, die beim Liegen sich abplatten, nicht hart und wetterfest sind und sich beim Versuche, sie zu brechen, biegen (KÄMMERER). Der Grund ist nicht bekannt.

In 1 werden die Wurzeln gereinigt, gewaschen, geschnitten und gekocht und der Saft eingedampft, in 2 wird der Succus ausgerollt, in 3 getrocknet, in 4 magaziniert.

Zerquetschen der Süßholzwurzel mit den Lavawalzen.

In der Mitte: Ausrollen der Stengel. Rechts: Stempeln. Links: Ausbreiten zum Trocknen und Beurteilung.
FLÜCKIGER berichtet über die Darstellung in Catania: Anfangs April 1889 besuchte ich in Catania zwei Fabriken, welche die Wurzel der in der Gegend wildwachsenden Pflanze vom Oktober bis April verarbeiten. Die gewaschene, geschnittene und auf dem Reibsteine zerquetschte Wurzel wird in eisernen Pfannen (Caldaja), welche 2½ hl fassen, zweimal mit Wasser ausgekocht, dann zweimal gepreßt, was für eine Beschickung jeweilen einen Tag in Anspruch nimmt. Zum Zwecke des Pressens füllt man die gekochte Wurzel aus den Pfannen entweder in korbartiges Geflecht, Frantojo, aus Spänen von Kastanienholz (Sporta di pezzuola) oder schichtet sie mit 18 durchlöcherten Eisenplatten (lastre di ferro), welche, durch ein hölzernes Gestell (Gabbia) zusammengehalten, der Wirkung der Presse unterworfen werden. Nach der Klärung, welche durch ruhiges Stehen des Saftes herbeigeführt wird (die zuletzt abfließenden Anteile werden auf neue Portionen der Wurzel gegossen), kocht man den Saft in der Caldaja mit Hilfe von Steinkohlenfeuer ein und bringt ihn schließlich mittelst Holzkohlen zu der geeigneten Konsistenz. Eine Pfanne liefert so ungefähr 400 kg Pasta, welche sogleich durch Arbeiterinnen auf einem geölten Tische aus Nußbaumholz geteilt wird, wie oben erwähnt. Entweder formt man daraus Blöcke (Blocchi oder Pani) von 5 kg, welche in blaues Papier eingewickelt je zu 20 in eine Kiste (Cassa) verpackt werden. Oder man stellt aus der Pasta mit Hilfe von Rinnen aus Marmor oder Messing Stangen (Bilie) von gleicher Größe her, welche nach dem Stempeln rasch gewaschen werden, um sie von dem während des Ausrollens aufgenommenen Öle zu befreien. Schließlich erfolgt das Austrocknen auf Hürden (Tavole) im Magazin, wozu die Sommermonate erforderlich sind, weil wenigstens in jenen Fabriken in Catania kein Trockenraum mit Heizung eingerichtet war. Kupfer ist hier, wie man sieht, bei der Fabrikation ausgeschlossen.
Ähnlich lautete schon die Beschreibung der Bereitung, die wir in TH. MARTIUS, Über die Anfertigung des Succus liquiritiae crud. (Buchn. Rep. 89. 289, 1845) finden und die Angaben HANBURYS, die dieser 1872 auf Grund eigener Beobachtungen in Calabrien in der Pharmakographia machte.
HARTWICH teilt (nach Auskünften, die er 1896 erhalten) folgendes über die Bereitung mit (Kommentar zum Arzneibuch für das Deutsche Reich II, S. 622): Die Fabrikation zerfällt in die drei Operationen des Auskochens der Wurzeln, Klären des Saftes und Eindampfen desselben. In Italien werden in der vom November bis Juni reichenden Campagne die Nebenwurzeln (?) der mindestens vier Jahre alten Pflanzen durch Aushacken gewonnen, während man die Hauptwurzel und die tiefer als ½ m liegenden Nebenwurzeln (?) zur Erzeugung von Nachwuchs schont. Gewaschen, werden sie zerschnitten und durch Reiben in einen feinen Brei verwandelt. In den italienischen Betrieben scheint ein Schälen nicht stattzufinden. In Tiflis wird nur geschälte Wurzel verarbeitet. Das Reiben geschieht in allen größeren Fabriken durch Maschinen.
Die breiige Masse wird nun durch etwa 15 Stunden mit Wasser gekocht, nach dem Abkochen durch Beutel filtriert, meist auch ausgepreßt, und in ein Bassin zum Klären gebracht. Aus den Klärbassins gelangt der Auszug durch mit feinen Metallsieben versehene Pumpen in flache Abdampfschalen, Caldaja in Italien genannt, wo die dünne Succuslösung erst auf freiem Steinkohlen-, dann auf Holzkohlenfeuer, um gegen Ende zu starke Erhitzung zu vermeiden, unter Umrühren eingedampft wird. Eine solche Caldaja ergibt etwa 400 kg Succus. Das Trocknen geschieht auf Holzplatten an der Luft und erfordert lange Zeit und warme Witterung.
Vor dem Verpacken wäscht man sie nochmals, reibt sie mit Lakritzlösung ab und schichtet sie zwischen Lorbeerblättern, um das Aneinanderkleben zu verhüten.
Nach 1910 von RAVASINI erhaltener Auskunft wird der Succus meist in ziemlich primitiver Weise, neuerdings aber auch sorgfältiger, nur von Mitte Dezember bis Anfang Mai dargestellt. Man benutzt 4–5jährige Pflanzen, da sowohl jüngere wie ältere weniger Succus liefern. Die Ausläufer und Wurzeln werden gewöhnlich im Herbst, gleich nach Eintreten der ersten Regengüsse, wenn die Erde schon lockerer ist, ausgegraben. Sie werden gereinigt, dann in Fragmente von 3–6 pollici geschnitten (Fig. 31), mit Wasser sorgfältig gewaschen und in einer aus zwei Lavawalzen bestehenden Mühle zerquetscht (Taf. II). Nun bisweilen zunächst über Nacht mit Wasser mazeriert oder direkt mit Wasser einige Stunden bei schwachem Feuer ausgekocht und dann scharf in einer Presse (strettojo) abgepreßt. Die abgepreßte Wurzel wird dann meist noch zweimal auf stärkerem Feuer ausgekocht und der Saft, nachdem er durch ein Sieb filtriert worden war, in einem kupfernen Kessel soweit eingedampft[S. 96] (einige Fabriken benutzen hierbei Vacua), daß die Konzentration gerade ein Filtrieren noch erlaubt, nun ein zweites Mal filtriert und darauf unter fortwährendem Umrühren mit hölzernen Spateln bei gelinderem, allmählich erlöschendem Feuer soweit eingedampft, bis die Masse beim Erkalten hart wird. Nun formt man aus dieser Masse Brote (pani, blocchi) zu c. 5 kg, die in Kisten von 20 Broten (100 kg) verpackt werden, oder man formt mit den Händen, die man mit Stärke, Öl oder Asche einstreut, oder mittelst geölter hölzernen oder auch aus Messing gebildeter Formen die bekannten Stangen (bastoni oder biglie, Taf. III), die je nach den Fabrikmarken in verschiedenen Größen, und zwar zu 6, 8, 15, 25, 35, 45, 55, 75, 90 und 120 g geformt werden. Diese Stangen werden dann am einen Ende gestempelt (Taf. III, Fig. 32) und auf hölzernen Platten 2–3 Monate hindurch dem Trocknen überlassen. Die Stempel sind jetzt:
1. nach den Fabrikanten benannt: R. DE ROSA (in Atri bei Teramo), MARTUCCI, BARACCO, GUI GRASSO, CONTE D’ALIFE, ZAGARESE E CO., SINIB(ALDO) ODDO, DUCA DI ATRI oder D’ATRI (in der Provinz Abruzzo ulteriore), MUZZI (nicht mehr im Handel), GRIMALDI, PIGNATELLI (Fürst P. in Torre Cerchiara), DUCA DI CORIGLIANO (alte gute Marke), Barone COMPAGNA (in Corigliano, Taf. II u. III). SOLAZZI (in der Nähe von Corigliano), B. FICHERA, Barone AMARELLI, SALVAGO, SAVARINI, F. S. D. (nicht mehr im Handel), P. S. (= Principe de Salerno), BURGARELLA, S. FRANCO, DI SURDO, LA ROSA, CAFLISCH (Catania), G. BONGIORNO u. a.
Verschiedene Formen der Succusstangen.
[Ravasini.]
2. nach den Orten benannt: Corigliano und Atri (diese zwei Marken sind auch unter den nach den Fabrikanten genannten Marken angeführt, da sich die betreffenden Herren dieser Besitze nach dem Orte auch Duca di Corigliano und Duca d’Atri nannten), Cassano (mit und ohne Stern, vorzüglich, wegen des Papagei auf der Vignette auch als «Pappagalo» bekannt), Gerace, Messina, Rossano, Policoro, Sicilia, Catanzaro, Torcella, Puglia usw. (s. die Karte auf S. 98).
3. mit Phantasienamen: Theseus (von G. e. R. FRITZ), dann vom Barone[S. 97] Compagna fabriziert: Schiavonea, Cedonia, Cesarello, Venetta, Fratelli; vom Grafen D’ALIFE fabriziert: Favella; von DE ROSA: Regina; von CAFLISCH: Vittoria, endlich Imperial usw.
Über die außerdem erwähnten Marken: Pollici, Lavoro, Derosas (wahrscheinlich Imitation von DE ROSA), Convitato, Ferrajuolo, S. Rafft, Lagusso, Cagliano, Pastora, konnte ich nichts in Erfahrung bringen.
Bisweilen sieht man bei den Stangen außer dem Fabrikstempel auch Eindrücke, die von Stiften herrühren, die sich in den Formen finden (namentlich bei der Marke Ferrajuolo) oder einen Stern (CASSANO), oder ein Wappen (PIGNATELLI), oder die Bezeichnung «Sug pur» (CAFLISCH), «Italy» (DUCA DI CORIGLIANO, Barone COMPAGNA) usw.
Die Stangen werden, nachdem sie vom Staube befreit und glänzend gemacht wurden (lavoro di lustratura) mit Lorbeerblättern (in Rußland mit Eichenblättern) bedeckt und in Kisten zu 50, 60 oder 100 kg verpackt (lavoro d’incasso). — 3% Tara werden für die Blätter gerechnet. Auch bei den Broten werden Lorbeerblätter, die schon GEOFFROY 1742 erwähnt, als Packmaterial benutzt.
Wie aus Obigem hervorgeht, vermeidet man nicht immer kupferne Kessel (auch JANSSEN-Florenz erwähnt solche) und messingne Formen für den Succus in Massen. Immerhin gilt jetzt die Tendenz, sie möglichst auszuschließen, z. B. geschieht dies in vielen italienischen, dann in den englischen Fabriken und endlich in denen von Tiflis, wo man eiserne Kessel usw. vorzieht. Die Furcht vor dem Kupfer ist übrigens unbegründet (vgl. TSCHIRCH, Das Kupfer vom Standpunkt der Hygiene usw.).
Aus 5 Teilen frischer Wurzel erhält man c. 1 Teil fertige Ware (nach WOODCOCK 16%, nach RAVASINI aus Winterwurzel 18–22, aus Sommerwurzel 12–14%).
Die Stangen werden zwischen Lorbeerblättern in Kisten von 60, 110–120 kg verpackt. Das Gewicht der Lorbeerblätter darf nicht mehr als 3% des Gesamtgewichtes betragen. Außer in Stangen wird auch Succus in massa (blochi, pani) fabriziert (s. oben).
Die Gesamtausfuhr Italiens an Succus betrug 1908 (nach Mitteilung des italienischen Handelsministeriums): 11664 Quintal (1 Qu. = 100 kg) im Werte von 1749600 Lire (1909: 13744 Quint.). Der meiste italienische Succus ging nach England (3102 Qu.), dann folgt Belgien, Österreich, Holland und Deutschland. 1910 existierten allein in Catania sieben Häuser, die Succus fabrizieren ließen (RAVASINI).
Zu der von RAVASINI gezeichneten Karte der italienischen Succusfabrikation (Fig. 33, S. 98) gibt dieser folgende Erläuterungen.
Die Fabrik der Barone COMPAGNA liegt bei Corigliano. Sie fabriziert die Primamarken Duca di Corigliano (Stangen von 4, 3, 2 und 1 onze) und Cassano mit Stern und einige Sekundasorten (s. d. Karte), Jahresproduktion: 1500–2000 dz. Nicht weit davon — bei Isola Caporizzuto — liegt die Fabrik des Barone ALBERTO BARACCO, die die berühmte Marke «Baracco» herstellt und in Rossano befinden sich die Fabriken der Marchese G. MARTUCCI und des Barone AMARELLI, aus der die guten Marken MARTUCCI, Barone AMARELLI und G. AMARELLI hervorgehen. Beide sollen mit Vakuumapparaten arbeiten. In der Nähe von Rossano liegen die Lakritzfabriken der Grafen D’ALIFE und von ZAGARESE & Co. Die erstere Fabrik macht die Marken Conte d’Alife, Solazzi und Favella, die zweite die Marke Zagarese, sowie die Fabrik des FRANCESCO PIGNATELLI in Cerchiara di Calabria, in der die Marke V. Pignatelli hergestellt wird. Südlicher, bei Policoro, liegt dann die Fabrik von B. BERLINGIERI, die die Marken Gerace (nach dem Orte an der Ostküste) und P. S. fabriziert. Ein Rest der alten Lakritzfabrikation in Ascoli ist die Fabrik R. DE ROSA in Atri bei Teramo (in Abruzzo), die die Marken de Rosa und Regina herstellt. Die Marke Muzzi, ebenfalls aus Abruzzo, ist erloschen.
[S. 98]
In Sizilien ist Catania Hauptort der Fabrikation. Die größte Fabrik ist die der FRATELLI CAFLISCH, die die vorzügliche Sorte Caflisch mit der Bezeichnung Sug pur macht. Mittelsorte ist G. Bongiorno, schlechtere: Vittoria (in kleinen Stangen von 6–8 und 15–17 g).
Die Firma BERNARDO FICHERA fabriziert Marke Fichera, die Firma LA ROSA PASTORE die Marke La Rosa. Die Firma GUI GRASSO soll die Fabrikation aufgeben wollen.
Die wichtigsten Fabrikationsorte des Succus liquiritiae in Italien. Neben dem Orte ist der Fabrikant und neben diesem sind die von ihm fabrizierten Sorten angegeben.
[Ravasini.]
In Messina wurden die Fabriken der Firmen SANTO FRANCO (Marke S. Franco) und SALVAGO NUNZIO E CO. (Marke Salvago) durch das Erdbeben vom 28. Dezember 1908 zerstört. Die Neffen des umgekommenen SANTO FRANCO errichteten unter der Firma FRATELLI AINIS eine neue Fabrik (Marke S. Franco).
Die Fabriken von SINIBALDO ODDO in Termini Imerese (Marke Sinib. Oddo) und VITO BURGARELLA in Trapani (Marke Burgarella) sind eingegangen, da das Süßholz im Imeratal ausgerottet ist. Die Fabrik von VINCENZO GIUFFRIDA in Caltagirone macht nur Brote à 5 kg (in Kisten zu 100 kg).
Zwei österreichische Fabriken bestehen in Auspitz (Mähren). Englische Fabriken,[S. 99] die meist mit Vakuumapparaten arbeiten, bestehen in England (Yorkshire Lakrizen, Pontefract cakes, s. oben S. 84) und am Kaukasus, in Kasan und Astrachan, dann in Nazli, Sokia, Aidin und Alaschehr bei Smyrna. Auch Syrien fabriziert Succus (1901), dann Mesopotamien. Eine russische Fabrik, von einem Deutschen begründet und jetzt von der pharmazeutischen Handelsgesellschaft betrieben, besteht in Tiflis.
Amerika erzeugt in Philadelphia und New York Succus aus eingeführtem, russischen, griechischen und kleinasiatischen Süßholz, ebenso Deutschland.
Französische Fabriken bestehen in Nîmes (die Sorte «Bayonne» scheint jetzt verschwunden zu sein), spanische in Gerona und Vittonia. Die Fabriken in Sevilla und Saragossa gehören französischen Konsortien. In Griechenland wurde Succus in Patras dargestellt (1910 nicht mehr, EMMANUEL) und Morea (Gastuni) figurierte früher auch unter den Sorten (seit 1910 nicht mehr). Südrussische Marken sind z. B. Sanitas Tiflis, die als vortrefflich gilt, da die Fabrik mit modernen Einrichtungen (Vakuum usw.) arbeitet. In Deutschland sind Baracco, Marke J. G. STERN, J. D. RIEDEL u. a. beliebt, in Österreich Martucci und Theseus (von FRITZ). Einige nicht italienische Firmen lassen sich in Italien Marken mit ihrer Firma herstellen, z. B. G. e R. FRITZ-PEZOLDT E SÜSS, J. D. RIEDEL, J. G. STERN. Baracco ist am teuersten und wird oft nachgemacht, auch der Stempel (wegen des Markenschutzes) in Baraco, Barraco abgeändert. Die in Italien verbreitetste Marke ist jetzt de Rosa. Spanische Marken sind Alicante, Careño, Zaragossana, Spaniola, Imit. Baracco. Spanischer Succus heißt in Italien allgemein d’Alicante. Er gilt als schlechte Qualität. In Italien gelten als die besten Marken: Corigliano, Cassano, Baracco und Martucci. HAFNER bezeichnete (Zeitschr. d. Österr. Apoth. Ver. 1900) Cassano als minderwertig, Salvago als die beste.
Die Einfuhr von Lakritzen nach Hamburg betrug seewärts 1906: 3032, 1907: 3615, 1908: 3524 dz. Von der Einfuhr 1908 stammten aus Kleinasien 402, Italien 1232, Rheinprovinz 1313, Frankreich 227, Großbritannien 196, Russische Häfen am Schwarzen und Asowschen Meer 73, Bremen 35, Griechenland und ionische Inseln 12, übrige Einfuhr seewärts 34. Mit der Eisenbahn und von der Oberelbe 354 dz. Deutschland importierte 1909: 5817 dz Succus, davon 2902 dz aus Italien und 1548 aus der asiat. Türkei. Frankreich importierte 1908: Succus (jus de réglisse) 908705 kg, besonders aus Spanien und der Türkei, nur 66435 kg aus Italien. Nordamerika importierte Licorice paste 1908: 644457, 1909: 551084 pounds.
Fast überall wird der Succus nach der gleichen Methode dargestellt. Nur in Neuseeland wird (oder wurde wenigstens 1883) dem durch Auskochen mit Wasser erhaltenen, unter Zusatz von Schwefelsäure eingedampften, dann mit Alkohol gefällten und mit Pottasche neutralisierten Safte Stärke, Erbsmehl und Gummi zugesetzt. In Italien wird nahezu die ganze Süßholzernte auf Succus verarbeitet.
Die extrahierten Rückstände dienen als Feuerungsmaterial, früher wurden sie zur Papierbereitung benutzt (MÉRAT E LENS). Dazu müssen sie sich, da die Bastfasern sehr lang und sehr zahlreich sind, gut eignen.
Lit. FLÜCKIGER-HANBURY, Pharmacographia. — FLÜCKIGER, Pharmakognosie, III. Aufl. und Arch. Pharm. 1889. — SESTINI, Gazz. chim. ital. 1878 (Jahresb. d. Ph. 1878). — WOODCOCK, Journ. d. pharm. chim. 13 (1886), 275 (Chem. Drugg.). — MÉRAT-LENS, Diction. univers. III; auch FONTENELLE ET POISSON, Man. compl. du marchand papet. Paris 1828. — Bereitung in Sizilien: Apoth. Zeit. 86.
Beschreibung der Droge. Die Stangen besitzen je nach der Sorte einen verschiedenen Durchmesser und verschiedene Länge (11–20 cm lang und 1–2,5 cm dick). Sie sind schwarz, außen glatt, in der Wärme biegsam, trocken in der Kälte brechend[S. 100] mit muscheligem Bruch. Der Strich ist braun. Sie verlieren beim Trocknen bei 100° bis 20% Wasser, schwimmen auf Chloroform und sinken in Schwefelkohlenstoff unter. Bei 100° getrocknet beträgt das spez. Gewicht ungefähr 1,427 (FLÜCKIGER).
Chemie. Kaltes Wasser entzieht dem Succus c. 60–75, bisweilen sogar bis 90% lösliche Bestandteile (inkl. der Feuchtigkeit), Pontefract Cakes (Dunhills) z. B. geben 71% an kaltes Wasser. Die Stangen behalten hierbei, wenn man sie zwischen Holzwolle packt, ihre Form. Der Rückstand, der noch Spuren Glycyrrhizin enthält, besteht zum Teil aus Stärkekleisterballen, pektinösen und gummösen Substanzen, und enthält etwa so viel Asche als der Succus selbst (3,29% FLÜCKIGER). Unverkleisterte Stärke enthält er nicht. In Lösung geht Glycyrrhizin, Glukose, Saccharose, Mannit und deren Umwandlungsprodukte, welch letztere auch in Alkohol sich lösen. Ferner die oben (S. 90) genannten Begleitstoffe. Der wässerige Auszug gibt mit Weingeist eine Fällung. Das Rohglycyrrhizin wird aus ihm durch Schwefelsäure ausgefällt (Lakritzlösungen dürfen daher keine Mineralsäuren, aber auch keine Alkaloide zugesetzt werden!). Die gewaschene Fällung in Ammoniak gelöst und eingedampft gibt das im Handel als Glycyrrhizinum ammoniacale (MERCK, PÉGURIER) bekannte, in schwarze Lamellen gebrachte Präparat, das auch aus Süßholz dargestellt wird (in Frankreich als Glyzine bekannt).
Im Durchschnitt findet sich im Succus: 7–20, meist 10–14% Wasser, in kaltem Wasser unlösliche Substanz 10–40, meist 17–33%, darin: c. 15% gummöse Substanz und Stärkekleister (1,33–35,5 [?] Stärke, PILTZ), dann 11 bis 16% Zucker (PILTZ), bisweilen aber nur 6–7%. Der Extraktgehalt schwankt zwischen 33 und 79%. Meist beträgt er 55–72%. Über den Glycyrrhizingehalt können wir noch kein ganz sicheres Urteil abgeben, da eine ganz genaue Bestimmung desselben noch nicht gefunden wurde. Es kommt also sehr auf die Methode an. Bisher wurde immer nur Rohglycyrrhizin bestimmt (siehe Wertbest.). Es werden angegeben Prozente Ammoniumglycyrrhizat im Mittel: 5,8-(11,9) 20,8 (KREMEL), 4,02–13,34 (PY.), 1,33–18,14 (PILTZ), 3–30, meist 10–18 (PROLLIUS), 15,8 (RENNARD), 1,8–8,6 (SCHRÖDER), 6,4–27,78 (KINZEY), in einer Tifliser Marke Sanitas 30 (UTESCHER). In der Tabelle bei E. SCHMIDT (Ap. Zeit. 1900, 216): 6,6–14,7% (Salvago meist 10–13%).
PARRY gab (1910) folgende Zahlen:
|
Wasser
|
Asche
|
Unlöslich
in Wasser |
Glycyrrhizin
|
Zucker
|
||
|
vor der
Inversion |
nach der
Inversion |
|||||
|
Calabrischer Succus
(Stengel u. Block) |
10,95–13,60
|
5,95–7,55
|
17,95–25,15
|
9,95–12,50
|
11,90–13,50
|
14,50–15,50
|
|
Anatolischer Succ.
(Block) |
16,95–20,50
|
6,80–7,22
|
6,90–8,50
|
18,85–23,50
|
10,88–12,0
|
12,90–13,90
|
|
Spanischer Succus
(Block) |
8,55–10,50
|
5,95–7,12
|
22,05–26,55
|
5,95–6,65
|
12,50–14,50
|
14,45–15,25
|
ELLA ERIKSSON fand mit Benutzung meiner Methode (siehe oben S. 90) in meinem Laboratorium (1910) in Cassano: 15,9–16,8% Glycyrrhizin (nach CEDERBERG bestimmt 12,8 bis 15,6%), 5,8–6,3% Fehlingsche Lösung in der Kälte reduzierende Substanz und 11,1–11,8% Fehlingsche Lösung bei kurzem Kochen reduzierende Substanz.
Der Succus läßt sich nur schwer veraschen. Der Aschengehalt wechselt sehr. Gute Sorten (z. B. Baracco) geben nicht mehr als 5% der lufttrockenen Substanz alkalische Asche. Die Asche des in Wasser unlöslichen Rückstandes beträgt etwas über 3% (FLÜCKIGER, s. oben), doch steigt die Gesamtasche oft auf 6, 8, 10, nach[S. 101] MADSEN sogar auf 14%. Guter Succus gibt nicht mehr als 8%. Gefälschter Lakritzen hat oft weniger als 2% Asche, so daß auch eine untere Grenze verlangt werden sollte. In der Asche der echten Lakritzen finden sich 34–43% Kali (in der von gefälschtem 18–30%, DYER 1888).
Von Einfluß für die Zusammensetzung des Succus ist, ob derselbe durch kalte Extraktion der Wurzel, oder kaltes Auspressen des Saftes, oder Auskochen der Wurzel erhalten und ob das Auskochen lange oder kurze Zeit bei mäßigem oder starkem Feuer fortgesetzt wurde, endlich ob und wie der Saft geklärt, ob Teile des Saftes durch Ausfällen oder Koagulation abgeschieden und durch Filtrieren abgetrennt wurden und ob bei dem Eindampfen das Vakuum benutzt wurde oder nicht, bezw. bei starkem oder mäßigem Feuer eingedampft wurde. Daraus, daß ein einheitliches Verfahren nicht existiert, erklärt sich die außerordentliche Verschiedenheit der Handelsprodukte und der schon vor 60 Jahren gemachte, ganz berechtigte Vorschlag, den Succus selbst darzustellen event. nach einer Vorschrift der Pharmakopoee. Zugegeben mag werden, daß für die Festigkeit der Stangen ein gewisser Prozentsatz unlöslicher Substanz (wohl hauptsächlich Stärke und Pektinkörper) notwendig ist.
Die Veränderungen, die die Bestandteile der Wurzel bei der Darstellung des Succus erleiden, sind noch nicht studiert. Ich habe Gründe anzunehmen, daß ein Teil des Glycyrrhizins gespalten wird.
Verfälschungen. Dem Succus wird bisweilen, aber selten, Gummi, Dextrin, Stärkezucker, Gelatine zugesetzt (s. unten). Stärke erwähnt bereits GUIBOURT, WOODCOCK Reis- und Weizenmehl, sowie Johannisbrotpulver, VOGL Mehl und Dextrin. Doch muß man hier vorsichtig sein mit dem Vorwurf der Verfälschung, da sich in Italien bisweilen die Arbeiter, welche das Ausrollen besorgen, die Hände mit Stärke einreiben (s. oben), um das Ankleben des Succus zu verhindern. Bisweilen (neuerdings selten) enthält der Succus Kupfer (Pharm. Zeit. 1894). Eine neuerdings von den Fabrikanten zur Erzielung größerer Festigkeit der Stangen beliebter Zusatz von 0,03% Gelatine dürfte kaum zu beanstanden sein. Früher wurden als Verfälschung angegeben: die Extrakte von Quecken, Löwenzahn und Cichorien, Schwefeleisen, Tonerde (WOLLWEBER 1862).
Schädlinge. Oft wird alter Succus von Sitodrepa panicea (I, S. 379), Nicobium castaneum var. hirtum (I, S. 381) und einer anderen weißen Käferlarve (ebenda) befallen und zerstört.
Prüfung. Im allgemeinen verlangt man jetzt von einem guten Succus, daß er höchstens 25% nicht in Wasser löslicher Substanzen enthalten soll (MADSEN fand 26–45%, FROMME dagegen nur 14,2–25,26%). Eine Wertbestimmung kann auf folgende Weise ausgeführt werden.
1 g lufttrockener, in möglichst kleine Stücke zerbrochener Süßholzsaft wird mit 150 g lauwarmem Wasser und 10 Tropfen Ammoniak übergossen, die Mischung öfters umgeschüttelt und nach 24 Stunden durch ein tariertes Filter von 10 cm Durchmesser filtriert; der Rückstand wird auf das Filter gespült und mit soviel Wasser nachgewaschen, daß das Filtrat 200 g wiegt. Das Gewicht des bei 100° getrockneten Rückstandes soll nicht mehr als 25 cg betragen. Werden 40 g des Filtrats auf dem Dampfbade zur Trockne eingedampft, so soll der Rückstand wenigstens 12 cg wiegen, 160 g des Filtrats, auf 10 g eingedampft, geben mit 30 g Weingeist vermischt, einen bräunlichen Niederschlag, welcher, mit Weingeist vollkommen ausgewaschen und bei 100° getrocknet, nicht mehr als 24 cg wiegen darf (Dextrin, Gummi) (Pharm. helvet. IV). Die Asche darf 6–8%, der Wassergehalt 17% nicht übersteigen.
Für die Bestimmung des Glycyrrhizins besitzen wir keine ganz zuverlässige[S. 102] Methode. Am besten hat sich bisher die gravimetrische Methode von HAFNER bewährt, die für die Praxis leidlich zuverlässige Resultate ergibt. Ich habe sie etwas abändern lassen (vgl. die Dissertation von CEDERBERG, Bern 1907). Meine oben (S. 90) erwähnte Methode muß noch an größerem Material durchgeprüft werden. Sie lieferte ELLA ERIKSSON bei Cassano gut übereinstimmende Resultate.
Da das trockene Süßholz c. 5,5–7% Glycyrrhizin enthält und ungefähr 25 bis 30% Extrakt gibt (in den Fabriken, wo anders gearbeitet wird, 16–20% der frischen Wurzel), so müssten in gutem Succus etwa 16–21% Glycyrrhizin enthalten sein, vorausgesetzt daß das Glyzyrrhizin bei der Fabrikation intakt bleibt, was aber nicht der Fall ist.
Tabellen über Analysen von Succus liquiritiae finden sich im Kommentar zum deutschen Arzneibuch von HAGER-FISCHER-HARTWICH 1896, II, S. 624, WITTSTEINS Handwörterbuch d. Pharmakognosie S. 821 und bei E. SCHMIDT, Apoth. Zeit. 1900, 216. Die Angaben von PARRY s. oben (S. 100).
Lit. Mit der Prüfung des Succus beschäftigten sich: MADSEN, Investigationes of Succus liqu. Kopenhagen 1881. — DIEHL, Jahresb. d. Pharm. 1883, 269 (Seine Methode auch in HAGER-FISCHER-HARTWICH, Kommentar). — SCHRÖDER, Ebenda. S. 271. — PY, Journ. pharm. chim. 1897, 280. — PILTZ (1876, vgl. WITTSTEINs Handwörterb. S. 821). — PROLLIUS in Fischer-Hartwich, Handb. d. pharm. Prax. — HAGER-FISCHER-HARTWICH, Kommentar z. d. Arzneibuch 1896. — KREMEL, Notizen z. Prüf. d. Arzneim. u. Komment. z. Öster. Pharm. Ed. VII, Arch. d. Pharm. 1889. — DIEHL, Pharm. Rundsch. New York 1883. — KINZEY, Am. Journ. pharm. 1898. Journ. de pharm. 1898. 7. 304. — HAFNER, Zeitschr. d. Öster. Apoth. Ver. 1899 und 1900. Pharm. Centralh. 1899. — FROMME, Pharm. Centralh. 1901, 324. — TRUBECK, Journ. Am. Chem. Soc. 1900 (Pharm. Zeit. 1900). — ZETZSCHE, Pharm. Centralh. 1901. 277. — E. J. PARRY, The Liquorice-juice of commerce. Chem. and Drugg. 1910, 21. — H. J. MÖLLER, HAGER, UTESCHER, FRESENIUS, GLÜCKSMANN, MORPURGO, LEDDEN HÜLSEBOSCH, STEIN, MOORE, TSCHIRCH, CEDERBERG, ERIKSSON u. and.
Anwendung. Amerika braucht viel für Kautabak, Frankreich etwas für ein Getränk, den Coco, England für Porter und Ale. Das meiste wandert in die Pharmazie für die Süßholztabletten. China und Japan brauchen Succus in der Tusche- und Tintenfabrikation.
Geschichte, s. Rad. liquiritiae.
d) Drogen, welche Mannit enthalten.
Auch die Mannose (s. oben S. 6) ist eine Hexose. Sie ist in der Natur selten frei zu finden (Amorphophallus), öfter in glykosidischer Bindung (Sem. strophanthi) oder als Polysaccharid (Mannane s. Membranine). Wohl aber spielt ihr Reduktionsprodukt, der d-Mannit, in der Drogenkunde eine Rolle, dessen Beziehungen zur Mannose der Vergleich der Formeln zeigt:
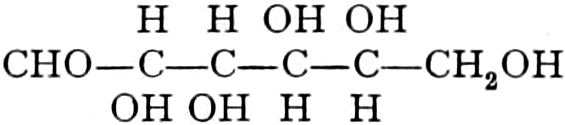
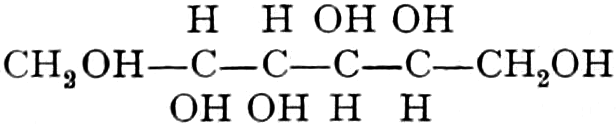
Der Mannit (Fraxinin, Syringin) ist also ein Zuckeralkohol. Er ist nicht sehr süß und bildet Nadeln oder rhombische Prismen, Schmelzp. 166°, die sich in 6,5 Teilen Wasser und 1500 Teilen absolutem Alkohol lösen. Er reduziert FEHLINGsche Lösung auch in der Wärme nicht, wohl aber nach Oxydation mit Permanganat.
[S. 103]
1. Eschenmanna.
Manna (in zahlreich. Sprachen) — Himmelsbrot, Himmelstau — Manne — Mana (span.).
Etym. Das (nicht die) Manna von hebr. man, arab. mann = Geschenk des Himmels oder von hebr. man hu = «was ist das?» nach dem Ausrufe der Juden, als sie den ersten Mannaregen sahen (vgl. II. Mose, 16, IV. Mose, 11), so schon von GEOFFROY gedeutet. Manna bei DIOSKURIDES, PLINIUS, GALEN bedeutet stets eine geringere Sorte der betr. Droge, z. B. Manna thuris (so auch bei PAULUS AEGINETA), d. h. kleinkörniger Weihrauch. Die Mannaesche hieß bei den Alten μέλεα (oder πολυμέλεα?).
Stammpflanze. Fraxinus Ornus L. (Fraxinus panniculata MILL., F. florifera SCOP., F. argentea LOSS., F. vulgatior SEG., Ornus europaea PERS.), Mannaesche, Frène à Manne, Manna ash.
Etym. Fraxinus leitet ISIDOR aber kaum richtig davon ab «quod magis inter aspera loca montanaque fraga nascitur»; wahrscheinlicher klingen die Ableitungen von φράγμα, Zaun, weil der Baum für Zäune benutzt wurde, oder ῥῆγμα, Bruch, wegen der Brüchigkeit des Holzes. Esche, wohl urindogermanisch, holl. esch, isl. askr, schwed. ask, ahd. ask, asch, mhd. eesch, eeisch, altnord. ask-r, engl. ash, ags. aesc. (auch = Speer), bei der HILDEGARD: asch, aska (vielleicht verwandt mit aesculus oder ὀξέα = Buche und Speer, KANNGIESSER). Die ursprünglichste Form scheint ås-is gewesen zu sein (HOOPS). «Möglich ist, daß Speer die ursprüngliche Bedeutung gewesen ist, dann würde die Wurzel in as (= werfen, schleudern) enthalten sein» (GRASSMANN). Auch das lat. Ornus (aus osinos) bedeutet sowohl Bergesche wie Speer (HOOPS), ob von ὄρεκνος (= auf Bergen wachsend)?
System. Stellung. Oleaceae, Oleoideae-Fraxineae. Sect. Ornus.
Die Mannaesche ist ein mäßig hoher Baum (5–7, selten über 10 m) mit grauer glatter Rinde und unpaarig-gefiederten drei- bis vier-jochigen Blättern. Die Blättchen sind eiförmig, zugespitzt, gesägt. Die reichblütige überhängende Blütenrispe ist nicht länger als das Blatt. Sie sieht wie ein zierlicher Federbusch aus, was daher kommt, daß die Blüten 4–10 mm lange freie, schmal lanzettliche, hellgelblichweiße Kronenblätter und zwei Stamina mit sehr langen Filamenten haben.
Der Baum ist in Südeuropa heimisch (waldbildend im Karst, in Kroatien, Slavonien, Dalmatien). Er findet sich auch im Tessin, Südtirol, Krain, Untersteiermark, Ungarn. Er wächst besonders an den nördlichen, westlichen und östlichen Gestaden des Mittelmeeres, von Valencia durch Südfrankreich bis nach Italien, von Istrien durch Dalmatien und die Donauländer bis Macedonien, Thessalien, Griechenland, Smyrna, Taurus, Libanon. Er hält nördlich der Alpen den Winter aus und ist ein beliebter Zierbaum. Aber er verträgt auch das afrikanische Klima und wird z. B. in Nordafrika kultiviert. Er blüht in Sizilien Ende März.
Fraxinus rotundifolia LAM. ist gewiß nicht spezifisch von F. Ornus L. zu trennen. Fr. americana PERS. ist gleichfalls, wie eine Reihe anderer von PERSOON beschriebener Arten, mit ihr identisch, indem jene Formen irrtümlich als aus Amerika stammend angegeben werden (SCHUMANN). Ob man die Varietät Fraxinus Ornus var. rotundifolia als vornehmsten Mannalieferanten aufrecht erhalten kann, scheint mir sehr zweifelhaft, denn wie HANBURY 1872 feststellte, verdient keine der in Sizilien kultivierten Mannaeschen diesen Namen. In den Pflanzungen um Palermo fand FLÜCKIGER gerundete Fiederblättchen seltener als spitz-lanzettliche. Die Blattform variiert jedenfalls sehr. In Sizilien wird von Fr. Ornus auch noch ein Fr. fraxinaster unterschieden. In Sizilien meint man, daß Fr. rotundifolia (der sog. amolleo) gute, Fr. Ornus wildwachsend (frassino, orniello, avorniello) minderwertige Castelbuono- oder Frassino-Manna liefere.
Lit. LINNÉ, Spec. plant. I, 1057. — Abbild. BERG-SCHMIDT, Atlas, II. Aufl. Taf. 40 (dort auch die übrige systemat. Lit.). — PABST-KÖHLER, Medizinalpflanzen, Taf. 115.
Pathologie. Unter den verschiedenen auf Zweigen und Stämmen von FRAXINUS ORNUS[S. 104] bekannten Pilzen scheint, unseres Wissens, keiner als Krankheitserreger eine wichtige Rolle zu spielen (ED. FISCHER).
Die Orte der Mannagewinnung in Nordwest-Sizilien.
[Ravasini.]

Mannaeschenpflanzungen (Frassinetti) aus der Umgebung von Cefalù in Sizilien. Die Arbeiter sind im Begriff Einschnitte zu machen (1910).
[Ravasini.]
Kultur. Die Manna liefernden Kulturen der Mannaesche (orniello, frassino della manna) liegen an der Nordküste von Sizilien und zwar im oberen Teile der Seezone oder dem unteren der Mittelzone. In der Seezone finden sich Sumach, Oliven, Orangen, Korkeiche, Maulbeerbaum; in der Mittelzone Pistazien, Walnuß, Mandel, Kastanie, Johannisbrotbaum. Die Mannaesche ist besonders mit Olive und Kastanie vergesellschaftet. Sie braucht keinen guten Boden und keine Düngung, wohl aber Sonne. Doch sind neuerdings Versuche mit Kalidüngung gemacht worden (Kali beeinflußt die Zuckerproduktion günstig). Die Sämlinge werden in Entfernungen von 1½–2 m oder noch weiter (3–4 m, MARIANI) gepflanzt. Die Mannaeschenpflanzungen (Frassineti) bilden[S. 105] lichte Haine (I, Fig. 17). Die unteren Äste werden bis zu einer Höhe von 2 m entfernt.
Die Kulturen finden sich jetzt (Fig. 34) vornehmlich im westlichen Teile der Nordküste Siziliens bei Palermo, S. Maria di Gesú, gegen Valdese, dann in den Bezirken Torretta, Capaci, Cinisi, Terrasini-Favarotta, westlich von Palermo, dann östlich davon, bei Belmonte Mezzagno und vornehmlich bei Cefalù. Hier gehen sie weit in die Berge (bis 1100 m) hinauf nach Castelbuono, San Mauro und Geraci Siculo. Hier und bei Cefalù wird das beste Manna gewonnen, bei Castelbuono (hier auch von wildwachsenden Bäumen) die geringeren Sorten (FLÜCKIGER). Im Distrikte Cefalù sind noch Castelverde, Pollina und Lascari zu nennen. Ganz im Westen wird Manna im Bezirk Trapani (Castelamare del Golfo bei Alcano, Monte Giuliano) gewonnen (RAVASINI). Da und dort scheint man auch mit Pfropfungen Versuche gemacht zu haben. Die Kulturen der Mannaesche, die zurzeit noch 4000 ha bedecken und in den genannten Gegenden die Haupteinnahmequelle der Bewohner bilden, weichen jetzt vielfach rentableren Kulturen, z. B. denen der Orange (über die untergegangenen vgl. Geschichte). Doch sind allein in der Gegend von Palermo 2070 ha in Mannaeschenkultur und an der Einsammlung, die dort 980 dz pro Jahr beträgt, beteiligen sich, die Kinder nicht mitgerechnet, 800–900 Personen. Die Mannagewinnung in Calabrien ist erloschen. Eine minimale Menge wird noch gewonnen südlich von Neapel, in Cetara bei Salerno, in San Martino Valle Caudino bei Avellino und in Accettura bei Potenza (RAVASINI).
Lit. FLÜCKIGER, Pharmakognosie. — ARCURI, Coltivazione del Frassino da Manna, Agricoltura meridionale 1879.

Mannastalaktiten am Baum (Sizilien).
[Aus der Zeitschrift «Die Ernährung der Pflanze».]
Gewinnung. Wenn die Bäumchen 7–12 Jahre alt und wenigstens 2 m hoch sind und man die Stämmchen mit Daumen und Mittelfinger gerade umspannen kann, beginnt die Gewinnung. Schon 4 cm dicke Stämmchen geben reichlich Manna und bleiben 12–20 Jahre ertragsfähig. Dann wird der Baum geschlagen. Aus dem Stuppen entwickeln sich neue Triebe, die nach 4–5 Jahren angeschnitten werden können. Das Anschneiden geschieht folgendermaßen: Mit einem gekrümmten scharfen und großen Messer (I, Fig. 150), das mit einer oder beiden Händen geführt wird, macht man im Juli, August und September frühmorgens zunächst an der Basis des Stämmchens einen Querschnitt durch die ganze Dicke der Rinde, bei den jüngeren Bäumen um ⅓, bei den älteren um ¼ des Umfanges und fährt nach oben aufsteigend fort, indem täglich vormittags ein neuer Horizontalschnitt gemacht wird (Fig. 35). Die Einschnitte sind etwa um Fingerbreite oder etwas weiter (1–4 cm) voneinander entfernt. Sie werden entweder genau horizontal oder etwas schief geführt. Wenn die eine Seite bis zur Ansatzstelle der Äste mit Einschnitten versehen ist, werden dieselben auf der nächst anstoßenden Seite in der gleichen Weise gemacht. Die Anzahl der Einschnitte beträgt pro Baum oft 90. Ein Arbeiter kann an einem Vormittag 4000 Bäume verwunden. Aus den Einschnitten fließt eine braune, bläulich fluoreszierende Flüssigkeit, die in wenigen Stunden fast weiß und kristallinisch wird und in einigen Stunden ihren anfangs bitterlichen Geschmack verliert. An geneigten Ästen treten hierbei natürlich stalaktitenartige Bildungen (Zapfen, Canoli, daher vielleicht canelata?) auf (Fig. 36), das meiste aber rinnt etwas an dem Stamme herab und erstarrt auf der Oberfläche in Form rinnenförmiger (daher cannellata, M. in cannoli) Stücke, die auf der einen Seite den Abdruck der Oberfläche des Baumes, auf der anderen wulstige Erhebungen zeigen (Manna cannellata, oder lat.: cannulata). Ob die[S. 106] früher sicher geübte Sitte, in die Wunde einen Grashalm (canna) einzuführen und an ihm das Manna erstarren zu lassen, wie es POMET 1694 abbildet, noch jetzt geübt wird, weiß ich nicht. Ich habe niemals Halme oder Höhlungen, die von herausgelösten Halmen herrühren könnten, in Handelsmanna gesehen. RAVASINI sagt mir, daß die Sitte nicht mehr besteht, auch MARIANI, der die Mannahaine 1909 besuchte, erwähnt sie nicht. Das vom Stamme oder den Ästen herabtropfende Manna wird von daruntergebreiteten Ziegeln oder den Stengeln (pali) des Feigenkaktus (Opuntia vulgaris) aufgefangen (Manna in sorta). Jüngere Bäume (des amolleo) liefern das beste Manna, ältere (des frassino) die geringeren, zum Teil schmierigen Sorten: Manna frassino, M. a sminuzzo (von sminuzzare = zerkleinern), M. in frasca (= Zweig), M. in grosso usw. Das Einsammeln (Fig. 37) geschieht bei heiterem Wetter in Zwischenräumen von mehreren Tagen oder wöchentlich bzw. alle 10 Tage von Mitte Juni bis Mitte September. Beim Biegen der Stämmchen lösen sich die Mannastücke von selbst ab (Cannelata). Das Haftenbleibende wird mit einem Spatel abgekratzt (Rotami), die kleineren Stücke davon sind M. in lagrime. Die Arbeiter tragen meist zwei aus Baumrinde gefertigte Röhren oder andere Behälter an einem Bande über die Schulter. In die eine legen sie die sorgfältig vom Baume gelösten weißen Stücke, in die andere die meist gefärbten, herabgeflossenen Massen. Diese bilden die beiden Handelssorten. Droht Regen, der ja das Manna auflösen und fortführen würde, so wird sofort jeder verfügbare Arbeiter aufgeboten und man rettet was zu retten ist. In den Eschenhainen ist daher auch in der Nacht eine Wache aufgestellt, die eine Glocke zieht. Sobald die Glocke ertönt, eilt alles herbei. Die Handelsberichte berichten oft von durch Regen gestörten Ernten. Der Preis steigt alsdann rasch, da die Produktion manchmal (z. B. 1901) auf ¼ sinkt. Zu einer Mittelernte gehören[S. 107] mindestens 4–5 ungestörte Einsammlungen. Auch anhaltende Trockenheit beeinflußt die Produktion ungünstig. Das aus den untersten Einschnitten des Stammes, sowie aus älteren Bäumen gewonnenes Manna ist unreiner, trocknet schwer aus, bleibt daher mehr oder weniger feucht und schmierig. Der aus den oberen Wunden ausgeflossene Saft, besonders jüngerer Bäume, gibt das beste, reinste, rasch austrocknende, durch und durch kristallinisch erstarrende Manna. Das besonders im August und September gesammelte Manna wird dann in der Sonne getrocknet. Ein Hektar enthält etwa 5000 Bäumchen (oder weniger), die 80–100 kg Manna liefern. Auf 4,5 kg Manna in canoli kommen 85,5 Manna in sorta. Die Mannaproduktion geht, da unrentabel, zurück. Der Export beträgt aber immer noch c. 1 Mill. Lire (MARIANI). Castelbuono produziert allein c. 2000 dz. Angeblich soll Manna auf Fraxinus Ornus auch durch den Stich der Cicada Orni entstehen. Ich glaube, daß jede Verwundung bei den Oleaceen die Mannitproduktion steigert.
Unsorgfältig wird Manna in Castelbuono gesammelt. Man kratzt die Ausscheidungen in toto von der Rinde und sortiert dann in bessere Stücke (M. Castelbuono scelte, d. h. auserlesene) und schmierige (M. frassino, bei Venedig: M. sporca [= schmutzige Manna] genannt).

Ablösen des Manna in Sizilien.
[Aus der Zeitschrift „Die Ernährung der Pflanze“.]
Ein neuerer Bericht von WARD lautet: Das Manna fließt aus Schnitten, die an zehnjährigen Bäumen quer durch die Rinde in der Ausdehnung von etwa ⅓ der Peripherie täglich gemacht werden, — während der Saison, die im September endigt, täglich etwa 45 —. Die am Baume erhärtende Masse bildet die Manna cannoli, die bei feuchtem Wetter herabfließende die Manna rottami (= Bruchstücke, «Bruchmanna»). Im folgenden Jahre werden frische Einschnitte neben denen des Vorjahres gemacht und im dritten Jahre wird der Prozeß an dem noch uneingeschnitten gebliebenen Reste der Rinde wiederholt, dann der Stamm nahe der Wurzel gefällt. Jede Wurzel treibt dann mehrere, meist vier neue Stämme.
Als Nebenprodukt erhält man nach RAVASINI bei der Mannaernte ein honigartiges,[S. 108] nicht erhärtendes Sekret von süßem Geschmack, das Mielocco genannt wird. Dieses wird in hohlen Stengeln von Opuntia Ficus indica (sog. pali) aufgefangen und hat den Vorteil, keine fremden Beimengungen mit sich zu führen. Es wird gewöhnlich der M. rottami beigemengt.
Lit. LANGENBACH, Pharm. Zeit. 17, 38, Jahresber. d. Pharm. 1872, 137. — CLEGHORN, Transact. Bot. Soc. Edinburgh. 1868/69, Jahresb. d. Pharm. 1870, 144. — STETTNER, Arch. Ph. 1848, 194. — FLÜCKIGER, Arch. Pharm. 1889, 1028 u. Pharmakognosie. — Über die Mannaproduktion in Calabrien: HANBURY, On calabrian Manna. Science papers, p. 362; in Sicilien: WARD, Pharm. Journ. 1893, 381 (Pharm. Zeit. 1894, 45). — MARIANI, Über d. Mannabaum u. s. Kultur in Die Ernähr. d. Pflanze 5 (1909) S. 25.
Handelssorten. Der italienische Handel unterscheidet Capaci cannolo, C. rottami, Geraci cannolo, G. rottami, G. lagrime, Castelbuono scelta. Der deutsche Handel unterscheidet jetzt Manna cannellata electa (in lacrimis, Tränenmanna) und in fragmentis (in granis, guttis, Tränenbruch), dann Gerace optima (feine rottami) und Gerace II (frassino). Die Gerace (richtiger Geraci) wird auch (fälschlich) als calabrina bezeichnet oder gar als Calabre Gerace (!). Die Cannellata ist oft doppelt so teuer als die Gerace. Die billigste ist die Castelbuono. Früher wurde cannellata, gerace, calabrina, communis, capace (diese weich wie Terpentin) unterschieden, später dann cannellata und pinguis (sordida). Die Händler unterscheiden die Handelssorten auch nach den Orten, wo sie gewonnen wurden. Das Manna kommt in Kisten zu 30, 50 und 90 kg in den Handel.
Allein aus Cefalù wurden in den letzten zehn Jahren 3000 dz Cannellata und 2000 dz Frassino exportiert. Italien exportierte Manna 1907: 2320, 1908: 1776, 1909: 2432 Quint. Deutschland führte 1909: 372 dz Manna aus Italien ein. Frankreich importierte 1908 41737 kg.
Eine künstliche M. cannellata wird in Italien in der Weise dargestellt, daß man M. calabrina im zehnfachen warmen Wassers löst, die Lösung koliert, mit Tierkohle digeriert, mit Eiweiß klärt, stark eindampft, mit der Masse Stäbchen begießt und das Übergießen nach dem Erhärten jeden Aufgusses solange fortsetzt, bis man die nötige Dicke erhalten (Nieuw Tijdschr. Pharm. 1885). Neuerdings kommt jetzt aus Italien auch eine «Manna pura» in den Handel, die in der Weise dargestellt wird, daß man das Manna löst, filtriert, eindampft und Brote zu 1 kg formt. Sie ist 15% teurer als Manna cannellata.
Schlecht schmeckendes Manna kann man durch Behandeln der wässerigen Lösung mit Tierkohle reinigen (HIRSCH-SCHNEIDER, Kommentar 1891).
Beschreibung der Droge. Gutes Eschenmanna bildet flache oder rinnenförmige oder stalaktitische, trockene, leicht zerreibliche, auf dem Querbruch bisweilen geschichtete Stücke von gelblich-weißer Farbe, honigartigem Geruche und süßem, schwach herbem Geschmacke. Die geringen Sorten bilden mehr oder wenig gelb-bräunliche, körnige, bisweilen ziemlich weiche oder gar schmierige Massen. Oft sind helle Körner durch eine bräunliche Masse verklebt. Die Arzneibücher verlangen meist nur die M. cannellata. Zerdrückt man ein Körnchen Manna in einem Tropfen Öl und betrachtet es unter dem Mikroskop, so sieht man zahlreiche, wohlausgebildete Kristalle und deren Fragmente, betrachtet man ein Körnchen Manna in Wasser, so findet man meist einige Gewebsfragmente, vorwiegend des Holzkörpers der Mannaesche und Pilzsporen (Pharm. helv. IV), bisweilen auch Calciumoxalatkristalle und Stärkekörner.
Man bewahrt Manna über Kalk auf (Ph. helv. IV). Gut getrocknetes Manna findet sich jetzt in Blechbüchsen im Handel (CAESAR und LORETZ).

Herstellung der Mannit-Coni bei F. Giglio e Co. in Cefalù (Sizilien).
Chemie. Der wichtigste Bestandteil des Eschenmanna ist der d-Mannit. Derselbe wurde von PROUST entdeckt (1806) und ist identisch mit dem Fraxinin,[S. 109] Granatin, Primulin, Syringin und Graswurzelzucker. Die Mengen, die davon in der Manna gefunden wurden, werden sehr verschieden angegeben. Ganz reines weißes Manna bester Qualität soll bis 90% enthalten (FLÜCKIGER), bei schlechter sinkt der Gehalt auf 30% und weniger. Alle diese Angaben bedürfen einer Revision, denn TANRET fand 1903 zwei neue krist. Zucker darin in beträchtlicher Menge: Manneotetrose (Mannatetrasaccharid C24H42O21, F. 167, wasserfrei αD = +150°, vgl. weiter unten) und Manninotriose (Mannatrisaccharid C18H32O16, αD = +167°, vgl. weiter unten). Das Manna in Tränen besteht zu c. ⅙, das Manna in Körnern zu ⅓ aus diesen Zuckern. Nach TANRET enthält gewöhnliches Manna 40, Manna in Tränen 55%, Mannit, 3 bzw. 2,2% Glukose, 3,4 bzw. 2,5% Lävulose, 16 bzw. 12% Manneotetrose, 16 bzw. 6% Manninotriose, 2 bzw. 1,5% Asche, 0,1 bzw. 0,05% Harz, 10% Feuchtigkeit und 10% noch zu untersuchender Körper. Früher (1890) wurde in Manna gefunden: 11,8–11,31% reduzierender Zucker (BUTLER); im allgemeinen schwankt der Gehalt daran zwischen 2 (bei gutem) und 20% (bei schlechtem Manna). BACKHAUSEN hält den Zucker für Traubenzucker, BUIGNET für Invertzucker. Dann in geringeren Sorten: Rohrzucker, viel Lävulose, Dextrin (BUIGNET 1868, FLÜCKIGER fand kein Dextrin), Schleim, der mit Salpetersäure Schleimsäure liefert (FLÜCKIGER), Spuren Zitronensäure und des aus der Rinde stammenden, fluoreszierende Lösungen gebenden Glykosids Fraxin, das bei der Hydrolyse in Fraxetin (ein Methyldioxycumarin) und Traubenzucker gespalten wird (fehlt in altem Manna, FLÜCKIGER). THÉNARD fand in schlechtem Manna einen ekelerregenden Körper bis 1%. Schon REBLING fand, daß, je besser das Manna ist, um so mehr Mannit und um so weniger Zucker in ihm enthalten ist. Er fand in Manna cannellata 82% Mannit und 2% Zucker; in M. Gerace 57 bzw. 8%, in M. commun. 50 bzw. 18%, in M. Capace 37,5 bzw. 30%. Vier italienische Fabriken (2 in Mailand, 1 in Genua, 1 in Cefalù) verarbeiten Manna auf Mannit, der in coni e pani und in tavoletti in den Handel kommt. Die Coni (= 200–400 g) sind in[S. 110] den Fig. 38 und 39 dargestellt. Die tavolleti sind Tafeln von 25, 50 und 100 g. Der Aschengehalt des Manna schwankt zwischen 0,07 und 5% (DIETERICH). Nur bei den schlechten Sorten steigt er über 3 (HAUKE). Den Feuchtigkeitsgehalt gibt Ph. helv. IV auf höchstens 10% an.
Lit. TANRET, Compt. rend. 134, 1586, Bull. soc. chim. (3) 27, 947. — REBLING, Jahresber. d. Ph. 1855, 44. — BUTLER in FLÜCKIGER, Pharmakognosie (III), 27. — BUIGNET, Journ. pharm. 7, 401 und 8, 5. — FLÜCKIGER, Arch. Pharm. 200 (1872) 159. — (Asche) HAUKE, Zeitschr. d. Öster. Apoth. Ver. 1902 und DIETERICH, Helfenb. Ann. 1905 u. 1906. — PROUST, Ann. chim. phys. 57, 143. — BOUILLON LA GRANGE, Journ. ph. 3 (1817), 10. (Erste Erwähnung kristallisierten Mannits «Manne pure»). — Ältere Analysen von FOURCROY und VAUQUELIN, BUCHOLZ, LEUCHTWEISS. — Mikroskop. Charakteristik auch bei KRAEMER, Proc. Am. Ph. Ass. 98, 334.

Trocknen der Mannit-Coni bei F. Giglio e Co. in Cefalù (Sizilien).
Bei der Mannaesche entsteht der d-Mannit in größerer Menge erst infolge der Verwundungen, ist also ein pathologisches Produkt. Doch scheint er in Organen, besonders der Rinde, der Oleaceen (Olea, Phyllirea, Fraxinus, Syringa) normal vorzukommen — das Fraxinin ist unreiner Mannit.
Mannit scheint weit verbreitet zu sein (CZAPEK). Er findet sich auch bei Evonymusarten, Platanus orientalis, im Kambialsafte der Fichte (KACHLER), der Cort. canellae (MEYER u. REICHE), der Rinde von Genipa brasiliensis (KWASNIK) und Basanacantha spinosa (GRÜTZNER), in den Früchten von Coffea arabica (2,2%, BOUSSINGAULT), von Prunus Laurocerasus (VINCENT und DELACHANAL), Hippophaë rhamnoides (ERDMANN), in Aconitumknollen (FLÜCKIGER), im Süßholz (TSCHIRCH), in Rhiz. graminis (VÖLCKER), Sellerie und Daucus Carota sowie in Laminaria- und Fucusarten (STENHOUSE). d-Mannit ist bei zahlreichen höheren Pilzen ein wichtiger Reservestoff, der bisweilen bis zu 20% der Trockensubstanz ausmacht. Das Bakterium der Mannitkrankheit des Weines bildet aus Fruktose Mannit. Über das Vorkommen von Mannit in verschiedenen Vegetationsperioden verdanken wir DE LUCA Untersuchungen. Daß bei den Oliven Mannit in Fett übergeht, zeigte GERBER durch genaues Studium des Respirationsquotienten.
Lit. CZAPEK, Biochemie. — W. MEYER u. VON REICHE, Lieb. Ann. 47 (1843), 234. — VÖLCKER, Über das Vorkommen von Mannit in den Wurzeln von Triticum repens. Ann. d. Chem. 59 (1846), S. 380. — STENHOUSE, Lieb. Ann. 51 (1844) und 91 (1854), 255. — PASCHKIS, Pharm. Centrh. 1884, 193. — KACHLER, Monatsh. d. Chem. 7 (1886), 410. — JANDRJER, Bot. Jahresb. 1893 II, 461. — KWASNIK, Chem. Zeit. 1892, 109. — GRÜTZNER, Arch. Pharm. 1895.[S. 111] — LUCA, Compt. rend. 55, 470 u. 506. — PECKOLT, Mannithaltige Pflanzen Brasiliens. Zeitschr. Österr. Apoth. Ver. 1896. — Zusammenstellung d. Vorkommens von Mannit in FEHLINGS Handwörterbuch IV, 265.
Prüfung. Die Bestimmung des in Alkohol unlöslichen Teiles («Rohmannit») kann nach DIETERICH erfolgen (Helfenb. Ann. 1893). Gutes Manna soll mindestens 70–75% Rohmannit enthalten. Werden 2 g Manna mit 2 g Wasser und 40 g Weingeist eine Stunde am Rückflußkühler gekocht, heiß durch gereinigte Baumwolle filtriert, Rückstand und Filter mit 10 g heißem Weingeist nachgewaschen, so soll nach dem Verdunsten der Flüssigkeit das Gewicht des bei 100° getrockneten Rückstandes mindestens 1,5 g betragen, was einem Minimalgehalt von 75% (Roh-) Mannit entspricht (Ph. helv. IV.).
Manna darf weder Stärke, noch Mehl, noch Honig enthalten. Der Ricettario fiorentino von 1498 (I, S. 794) erwähnt feingepulvertes Süßholz als Verfälschungsmittel des Manna, MEUNIEUR (1842) Stärkezucker, FRICKHINGER neuerdings Weizenbrotteig, JANDOUS Traubenzucker.
Anwendung. Manna ist ein gelindes Abführmittel, das oft mit Senna kombiniert wird.
Geschichte. Die Alten glaubten, daß Manna vom Himmel fällt: «Jupiter melle pluit» sagt GALENUS (Lib. 3 De alimentis). Über das Manna der Bibel vgl. weiter hinten. Was das mnn, das EBERS mannu liest, an den Wandungen des Laboratoriums im Tempel von Edfu war, wissen wir nicht. Es soll den Antakörnern (vom Nehabaume) gleichen, doch wissen wir nicht, was dies war (Weihrauch?), auch soll die Lesart anta (nach SPIEGELBERG) falsch sein und das Wort ᶜntjw (vokalisiert etwa: ᶜᵃntêjêw) lauten. Weihrauch wird meist sntr oder ʿntỉ geschrieben. BRUGSCH und LORET halten mnn für Erdpech, nicht für Manna. Es war wohl ein Harz. Die älteste sichere Erwähnung eines süßen Manna ist wohl in Suśrutas (I, S. 505) zu finden, wo süße Exsudate von Anethum Sowa, Cordia latifolia und «a foliis» erwähnt werden. (Solche Manna von den Blättern «di fronda» findet sich noch in einer Taxe von Rom 1558 I, S. 188.) Aber sowohl dieses Manna wie das bei den Arabern des Mittelalters, IBN BAITHAR (I, S. 608), AMRAN (I, S. 598) und SERAPION erwähnte, als auch die oftmals (Alphita, Frankfurter Liste, Braunschweiger Inventar, bei CORDUS, SCHRÖDER) genannten Mannas, besonders Manna granata, granulata oder mastichina sind sicher kein Eschenmanna, sondern persische oder syrische Produkte, vornehmlich das Alhagimanna (s. weiter hinten), dann Cedernmanna. Sie standen in hohem Ansehn als gelinde Abführmittel und wurden auch noch, als zuerst das calabrische, dann das sizilianische Eschenmanna in Aufnahme gekommen war, viel benutzt. Noch 1578 gibt ACOSTA an, daß das beste Manna aus dem Orient über Venedig komme. Aber weder er noch GARCIA DA ORTA, noch früher AVICENNA, unterschieden die Mannen gut. In dem Frankfurter Catalogus von 1582 ist die Calabrina als die schlechteste, die Brianzona als mittelmäßige, granulata, granata seu mastichina als die beste bezeichnet. Dagegen bezeichnet WECKER 1574 im Antidotarium (I, S. 807) die calabrische als die beste. SCHRÖDER führt in seiner Pharmakop. medic. phys. noch 1649 Tereniabin, Manna granata und mastichina neben der calabrischen auf. In der ersten brandenburgischen Taxe 1574 steht: Manna syriaca id est mastichina optima (M. de levant.) und M. calabrina non adulterata (gemein gut Manna). In der Reformatio von Worms 1609 steht M. granata sive granulata, M. mastichina (die best M., die sich den Mastixkörnlein vergleicht), M. calabrina (die allerschlechst und geringst M.). Der Ricettario fiorentino von 1567 (I, S. 794) erwähnt neben Manna di Soria solche von Cosenza di Calauria. Zuerst wurde also Eschenmanna in Calabrien gewonnen (HANBURY). WENRICH meint, daß die Mannaesche nebst dem Zuckerrohr durch die Araber nach Sizilien gebracht wurde (die Pflanze ist aber in Sizilien heimisch). Die früheste (aber zweifelhafte) Erwähnung des sizilianischen Manna stammt aus dem IX. Jahrh., wo es unter den Dingen genannt wird, die die Venetianer in Sizilien holten (MARIN). Nicht erwähnt wird sizilianisches Manna von PEGOLOTTI (c. 1340), ANTONIO DA UZZANO (c. 1442) u. and.
Auch bei SALADIN (Compendium aromatariorum 1488) und PONTANO wird nur calabrisches Eschenmanna erwähnt und bei ihnen wie bei MATTHIOLI (Comment. Venet. 1565 lib. I),[S. 112] wie es scheint, nur solche, die freiwillig an Blättern, Zweigen und am Stamme austrat. Ebensolches («di fronde» und «di corpo») findet sich auch in der römischen Taxe vom Jahre 1558. In SALADINS Compendium aromatariorum wird der Mai als Sammelmonat des Manna genannt: «Collige etiam in isto mense mannam tam in oriente quam in Calabria, quia tunc ros ille preciosus de celo cadit». Ein Zeitgenosse SALADINS, GIOVANNI GIOVIANO PONTANO, verherrlichte in dem Gedichte «de pruina et rore et manna» die Einsammlung des Manna durch die calabrischen Bauern. Der Brauch, die Rinde der Stämme durch Einschnitte zu verwunden, sog. «Manna forzata» zu erzeugen, kam Mitte des XVI. Jahrh. auf. 1691 betrug die bei Campana und Bocchiglioro in Calabrien gesammelte Menge 30000 Pfund (HANBURY). Im XVIII. Jahrh. mußte der gesamte Ertrag der Krone abgeliefert werden (FLÜCKIGER).
HANBURY resümiert: Eschenmanna wurde zuerst in der ersten Hälfte des XV. Jahrh. und zwar in Calabrien gesammelt («Manna nostra aetate coepit in Calabria provenire» sagt 1470 RAFFAELE MAFFEI VOLATERRANUS). Das Einkerben behufs Vergrößerung des Ertrages ist dort vor Mitte des XVI. Jahrh. nicht bekannt.
In Sicilien wurde Manna erst sehr viel später produziert. Es wird zuerst als Manna forzata bei BOCCONE 1697 erwähnt, der als Produktionsorte: Giachia, Jeraci, Castel Buono, S. Mauro, Mistretta, Carini und Capaci angibt, also ungefähr die gleichen Orte, wo noch heute Manna gesammelt wird (s. oben). ANNIBALE BRIGANTE zeigte, daß das freiwillig austretende mit dem durch Einschnitte erzeugten Manna identisch ist. POMET erwähnt 1694 Manna von Calabrien (Galliopoli au Mont Saint Ange) und Sizilien und bildet die Gewinnung mittelst der Canna ab (Hist. gen. d. Drog. p. 236). Auch GEOFFROY gedenkt des sicilianischen Manna. Ende des XVII. Jahrh. dominierte dieses Manna bereits. POMET erwähnt allerdings noch: Manne de la Tolfe (fälschlich = Manne de Briançon gesetzt), Manne liquide = Tereniabin (s. weiter unten). BOCCONE erwähnt 1697 von Calabrien: Manna di Corpo (das beste, aus kleinen Wunden freiwillig ausfließend), M. forzata («wie Eiszapfen», durch Einschnitte mit einem dreischneidigen Messer ≡ oder in Form von ̭̂), M. forzatella oder di foglio (freiwillig aus den Blättern der wilden Orni ausfließend).
Im XVIII. Jahrh. wurde in Calabria citra am Golfe von Taranto, besonders in dem Territorium von Rossano, dann bei Corigliano, Cariati und Cosenza (BOCCONE erwähnt noch Lucciro, Tarsia, Taverna, Castrovillari, Viesti, zwischen Bari und dem Monte S. Angelo) viel Manna gewonnen (RIEDESEL, CAPPEL CRAVEN). Die sicher bis in den Anfang des XIX. Jahrh. blühende Mannaindustrie Calabriens war, wie HANBURY 1872 an Ort und Stelle feststellte, damals schon so gut wie erloschen. Man sammelte von den «ornelli» nur noch ganz geringe Mengen für den eigenen Gebrauch im Gebiete von Rossano, ja die Regierung hatte sogar das Herstellen von Einschnitten verboten.
Auch die Mannaproduktion in den Maremmen von Toscana ist erloschen. Ebenso die im XVI. und XVII. Jahrh. blühende Mannagewinnung im Kirchenstaat (S. Lorenzo) und in Cività vecchia (Manna von Tolfa). Im XVIII. Jahrh. unterschied man Calabrina-, Tolfa- und Puglia-Manna. BOCCONE erwähnt 1697 als Produzenten von Manna noch: S. Felicita, Tolfa, Castro, Palombara, Vicovaro, Monte flavio, Cori, Albano, Montecelle, Montorio, Sassa und die Seeseite von Siena. BOCCONE beschreibt die Gewinnung des Manna von Tolfa, das mit dem Manna forzata Calabriens übereinstimmt, durch täglich zwei Einschnitte an der Ostseite des Stammes.
Daß Manna nicht vom Himmel fällt, sondern der Succus concretus fraxini ist, behaupteten schon ANGELUS PALEA und BARTHOLOMAEUS AB URBE VETERE, zwei Franziskaner, die 1543 einen Kommentar zu MESUË schrieben, und DONATUS ANTONIUS AB ALTOMARI, medicus et philosophus Neapolitanus, zeigte c. 1558 durch einen Versuch, indem er die Bäume mit Tüchern bedeckte und doch Manna darauf fand, daß dies richtig ist. Des ALTOMARI Beobachtungen bestätigten GOROPIUS, LOBELIUS, PENA, COSTAEUS u. and. Trotzdem wird noch 100 Jahre später im Antidotario romano das Manna immer noch als Tau bezeichnet, der vom Himmel fällt.
Der erste, der deutlich die abführende Wirkung des Manna erwähnt, ist ACTUARIUS (XIII. Jahrh., I, S. 792), doch bezieht sich die Angabe nicht auf Eschenmanna, ebensowenig wie die analogen Bemerkungen der Araber. Die purgierende Wirkung des Eschenmanna behandelt zuerst ausführlich ROLFINK (1667, De purgant. vegetabil.). Die Spagyriker destillierten das Manna (vgl. I, S. 869). GEOFFROY, der in seiner Materia med. das Manna sehr eingehend[S. 113] behandelt, teilt eine pyrochemische Analyse des Manna mit. Bei den Chemikern des XVI. Jahrh. galt die Bezeichnung «Manna» für eine besondere Form «Salz» oder «Gummi». PEDEMONTANUS nennt (I, S. 879) die Benzoësäure «mannaartig».
Lit. EBERS, Durch Gosen zum Sinai. Leipzig 1871. — BRUGSCH, Hieroglyph. Wörterbuch, — LORET, Rec. d. trav. relat. à la philolog. et archéol. égypt. 16. p. 158. — HANBURY (Pharm. Journ. 1869), Arch. Pharm. 1870, 80. — FLÜCKIGER, Pharmakognosie. — SYLVII BOCCONIS, Curiöse Anmerkungen über Ein unn ander natürliche Dinge 1697. I Anm. von der Italiänischen Manna. So in diesem Seculo zusammlen angefangen worden. — ST. F. GEOFFROY, Materia med. I, p. 498 (dort die Observationes des ALTOMARI).
2. Australisches Manna.
Dieses Manna (Outeman genannt) findet sich an einer Polygalacee, Myoporum platycarpum ROB. BROWN., dem sog. Sandelholzbaume Australiens und herabgeflossen am Fuße der Bäume am Boden. Es wird in der Nähe der südaustralischen Fowler Bay gesammelt. Frisch ist es weiß, im Handel aber rotbräunlich. Die Stücke sind handgroß und bilden bis ein Fuß lange, kerzengerade Zylinder. Unterm Mikroskop sieht man zahlreiche Mannitkristalle. Dieses australische Manna enthält 89,65% Mannit, 2,87% reduzierenden Zucker, 0,51% invertierbaren Zucker (Rohzucker?) und 2,37% Schleim (MAIDEN).
Lit. BENNETT, Wanderings in New South Wales. London 1834. — MAIDEN, Pharm. Journ. 1893, 608 (FLÜCKIGER, Apoth. Zeit. 1893, 39). — FLÜCKIGER, Arch. Pharm. 1894, 311.
3. Platanus-Manna.
Ein Manna mit 90% Mannit erwähnt JANDRIER. Es wird von Platanus orientalis gesammelt.
Lit. JANDRIER, Comp. rend. 117 (1892), 498.
4. Manna von den Capverdischen Inseln.
In diesem Manna fand BERTHELOT 1856 Mannit (Ann. chim. phys. 47, 86). Seine Provenienz ist unbekannt.
5. Harlálumanna.
In Indien durch Erhitzen der Wurzeln des Baumes Katrā erhalten. Es scheint Mannit zu enthalten (HOOPER).
6. Olivenhonig.
Olivenhonig (azzal zitoun) nennen die Eingeborenen von Bibans ein aus den Stämmen kranker Olivenbäume ausschwitzendes Ölbaummanna, das nach TRABUT und BATTANDIER (Journ. pharm. 1901 (13) 177, Zeitschr. Nahrungsm.-Unters. 1901, 991 u. Apoth. Zeit. 1901, 209) 52% Mannit, 7,8% reduzierenden Zucker, 9,3% durch Alkohol fällbare Substanzen enthält. Es soll infolge einer Bakterienerkrankung austreten.
Die mannitfreien Mannasorten s. unter Disaccharide und Trisaccharide.
e) Drogen, welche Dulcit enthalten.
Der Dulcit ist dem Mannit stereoisomer, wie aus dem Vergleich der Formeln hervorgeht:
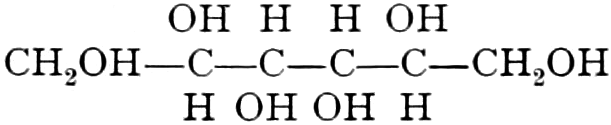
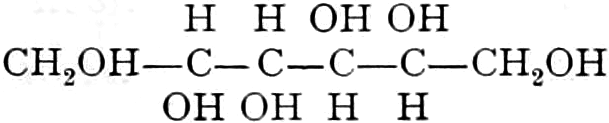
Er steht aber auch zur d-Galaktose (vgl. S. 6) in Beziehung, deren Reduktionsprodukt er ist. Dulcit bildet derbe, asparaginartige Kristalle, F. 186, optisch inaktiv, nicht gärungsfähig, nicht reduzierend.
[S. 114]
Dulcit ist in einem Manna von Madagascar, im Kraute von Melampyrum nemorosum (HÜNEFELD, EICHLER, ERLENMEYER) und im Cambialsafte von Evonymus europaeus, in der Rinde von Evonymus atropurpureus (VON HOEHNEL), überhaupt im japanischen und europäischen Pfaffenhütchen, auch im Honigtau von Evonymus japonicus (MARQUENNE), in Celastrus und Schaefferia, wie überhaupt in Celastraceen (KUBEL, V. GILMER, BORODIN) und Scrophularineen (EICHLER, MONTEVERDE, V. GILMER, BORODIN) gefunden worden. Vorkommen oder Fehlen von Mannit und Dulcit kann als Gattungs- und Gruppenmerkmal bei Scrophulariaceen verwertet werden (MONTEVERDE).
Madagascar-Manna.
Dieses Manna unbekannter Provenienz, das kristallinische helle Knollen bildet, besteht fast aus reinem Dulcit. Um Dulcit daraus darzustellen, braucht man es nur aus Alkohol oder heißem Wasser umzukristallisieren. GILMER zeigte, daß der Melampyrit von HÜNEFELD und EICHLER, sowie der Evonymit von KOBEL mit Dulcit identisch sind.
Lit. LAURENT, Compt. rend. 30, 41, 339 und 31, 694. Lieb. Ann. 76, 358; 80, 345. — JAQUELAIN, Ebenda. — GILMER, Lieb. Ann. 123, 375. — CZAPEK, Biochemie I, 212.
B. Drogen, welche Disaccharide von Hexosen enthalten.
Die Disaccharide oder Hexobiosen sind als durch Kondensation zweier Moleküle eines Monosaccharids, und zwar einer Hexose, unter Wasseraustritt entstanden zu denken, sind also ätherartige Anhydride der Hexosen. Hierher gehört die Saccharose (Rohrzucker, Rübenzucker), die ein d-Glukose—d-Fruktose-Äther ist, die Laktose (Milchzucker), die als d-Galaktose—d-Glukose-Äther und die damit wohl stereoisomere Maltose (Malzzucker oder Maltobiose), die als d-Glukose—d-Glukose-Äther zu betrachten ist. Zu der Gruppe der Disaccharide gehört auch die dem Rohrzucker ähnlich gebaute Trehalose oder Mykose (C12H22O11.2 H2O), die in dem Trehalamanna, im Mutterkorn und anderen Pilzen (Fung. sambuci, Agaricus Muscarius) vorkommt.
Untenstehende Formeln zeigen die Beziehungen der drei wichtigsten Disaccharide von Hexosen zueinander.
Durch Säuren oder Enzyme werden sie in ihre Komponenten aufgespalten. Invertase spaltet Rohrzucker in Glukose und Fruktose; Laktase spaltet Milchzucker in Glukose und Galaktose.
Bereits LAVOISIER machte von einem Disaccharid, dem Rohrzucker, eine Elementaranalyse.
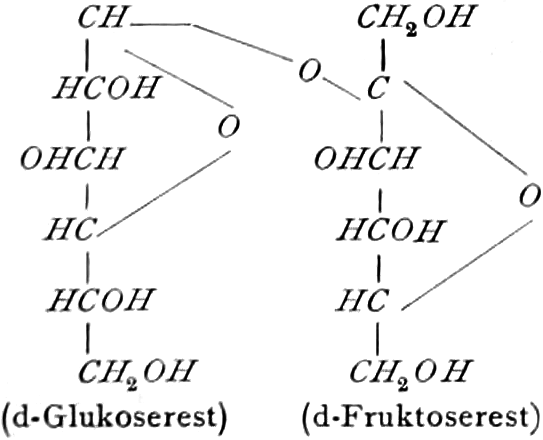
(Anhydridzucker)
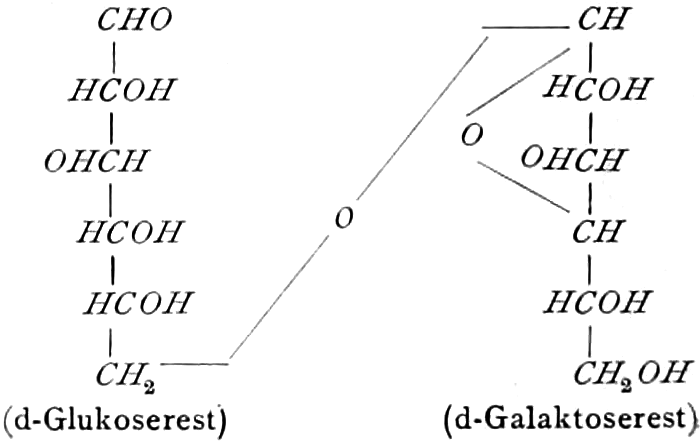
(Aldehydzucker)
[S. 115]
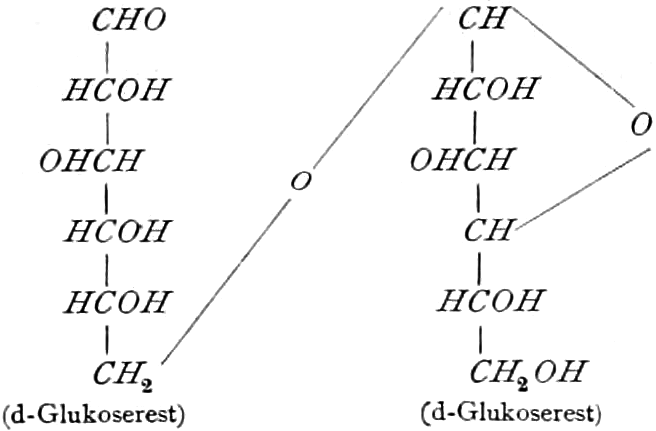
1. Rohrzuckergruppe.
Saccharose scheint bei den Tieren zu fehlen, ist aber bei den Pflanzen viel weiter verbreitet als man früher annahm. Das haben neuere Untersuchungen besonders von E. SCHULZE, ANDERSEN, HARLAY und BOURQUELOT dargetan, welch letzterer mit Hilfe seiner Invertinmethode, die eine Reindarstellung der Zucker nicht benötigt, gute eindeutige Resultate erhielt. Nachgewiesen ist sie z. B. in Zuckerrohr, Zuckerrüben, Zuckerahorn, Zuckerhirse, vielen Palmsäften, Krappwurzel, Kaffeebohnen, Gerste, Wallnüssen, Haselnüssen, Mandeln, Johannisbrot, in den Nektarien vieler Blüten (vgl. BEILSTEIN, Handbuch). Sehr viel Rohrzucker fanden wir in einer Rad. rhei monachorum. HARLAY fand (1905) viel auch in Umbelliferenwurzeln. BUIGNET gab ihn 1861 für viele Früchte an. Doch sind alle älteren Angaben mit Vorsicht aufzunehmen.
Physiologisch betrachtet ist Rohrzucker dort, wo er in so großen Mengen auftritt, daß seine Gewinnung lohnt, als Reservestoff aufzufassen. In den Stämmen der Palmen und dem Zuckerrohr, wo er im ganzen Grundgewebe sich findet, ersetzt er die Stärke und ist in erster Linie zur Ernährung des austreibenden Blütenstandes bestimmt oder war doch hierfür in erster Linie gebildet. Bei der Zuckerrübe ersetzt er ebenfalls andere Reservestoffe, die sonst in unterirdischen Reservebehältern vorkommen. Durch Kultur und Auslese läßt sich die Menge des Zuckers auch hier steigern, und die Kultur hat bereits eine starke Steigerung erzielt. Bei der Zuckerrübe z. B. von 3 auf 26%! Rohrzucker findet sich besonders in Pflanzenteilen, die kein Chlorophyll enthalten (JODIN).
Über die Verbreitung von Saccharose im Pflanzenreich vgl. CZAPEK, Biochemie, und von LIPPMANN, Chemie der Zuckerarten. Die Identität von Palmenzucker, Sorghumzucker, Ahornzucker und Johannisbrotzucker mit Rohrzucker stellte schon BERTHELOT fest (Jahresber. d. Chem. 1858, 486; dort die Lit.).
Daß Rohrzucker ein vortreffliches Nahrungsmittel ist, wußten schon die alten indischen, persischen und arabischen Ärzte (LIPPMANN), daß er dies sein muß, geht schon aus seiner hohen Verbrennungswärme hervor. Dieselbe beträgt (nach RUBNER) cal. für 1 g: 4001, cal. für 1 g-Mol: 1368,3. Bei großen Muskelanstrengungen eignet er sich daher außerordentlich zum Ersatze des Blutzuckers und des Glykogens und ist in bezug auf Eiweißersparnis dem Fette überlegen. 1 g Sauerstoff liefert bei der Oxydation von Rohrzucker 1511 Meter-Kilogramm Arbeit (ZUNTZ). Die Kreuzfahrer kauten nach den Berichten des Mönches ALBERTUS AQUENSIS bei Nahrungsmangel Zuckerrohr.
Über die aus Zucker hergestellten gegorenen Getränke vgl. I, S. 1016. Vergärbar[S. 116] sind nur die Zuckerarten mit drei, sechs oder neun Kohlenstoffatomen. Über Zuckervergärung ohne Enzyme vgl. die Zusammenstellung in Pharm. Praxis 1908, 266 (SCHADE).
CAMILL HOFFMEISTER beschreibt folgende mikro-histochemische Methode zum Nachweis von Rohrzucker neben Glukosen: die Schnitte aus dem zu untersuchenden Gewebe, 3–4 Zelllagen dick, werden direkt in Schälchen mit konzentrierter, siedendheißer Kupfersulfat-Seignettesalz-Natronlauge gebracht, so daß das Oxydationsmittel möglichst rasch und in großem Überschuß einwirken kann. Nach 1–2 Minuten ist die Glukose quantitativ oxydiert. Man nimmt die Schnitte heraus, spült dieselben durch Herumschwenken in einer Porzellanschale mit stark verdünnter Weinsäurelösung rasch ab und bringt sie auf dem Objektträger in einen Tropfen einer konzentrierten Lösung von Magnesiumchlorid. Das Magnesiumchlorid löst, besonders bei kurzem Erwärmen, den Niederschlag von Kupferoxydul in 1–2 Minuten glatt auf. Man spült nun das Magnesiumchlorid mit weinsäurehaltigem Wasser ab und bringt den Schnitt in einen Tropfen konzentrierter Invertinlösung auf den Objektträger. Man läßt mehrere Stunden die Zimmertemperatur einwirken. Ist der Tropfen nahe am Eintrocknen, so wird von neuem befeuchtet. Die genügende Zeit zur Inversion des Rohrzuckers war stets erreicht, sobald das Eintrocknen 2–3 mal vor sich gegangen war. Nun wird der Schnitt mit einem Tropfen Kupfersulfat-Seignettesalz-Natronlauge bedeckt, das Deckglas darüber gelegt und vorsichtig bis eben zur Siedetemperatur erhitzt. Ist Rohrzucker vorhanden, so scheidet sich rotgelbes Kupferoxydul ab. Beim mikrochemischen Zuckernachweis nach der Methode von SACHS (s. oben S. 7) werden die rohrzuckerhaltigen Zellen hellblau gefärbt.
Die regelmäßige Gestalt der Rohrzuckerkristalle erwähnt zuerst CÄSALPINI (daß OLIVIER DE SERRES gegen 1600 Rübenzucker gekannt und dessen Kristallgestalt beschrieben habe, ist ein in französischen Werken weitverbreiteter, aber völlig haltloser Irrtum, LIPPMANN). Der Tribolumineszenz gedenkt schon BACON VON VERULAM als etwas Wohlbekannten. Das Drehungsvermögen erkannte SEEBECK (1816) und BIOT gründete (1819) darauf die optische Saccharimetrie. Die Inversion des Rohrzuckers erkannte DUBRUNFAUT 1847. Alkalische Kupferoxydlösung zur Erkennung von Invertzucker und Traubenzucker empfahl 1841 TROMMER, der in MITSCHERLICHS Laboratorium arbeitete und 1848 veröffentlichte FEHLING die Vorschrift zu seiner alkalischen Kupfertartratlösung und beschrieb die Methode der quantitativen Zuckerbestimmung.
Lit. VON LIPPMANN, Chem. der Zuckerarten. — C. HOFFMEISTER, Über d. mikrochem. Nachweis von Rohrzucker in pflanzlichen Gew. Jahrb. f. wiss. Bot. 31 (1898). — E. SCHULZE, Nachweis d. Rohrzuckers in Pflanzensamen. Zeitschr. f. phys. Chem. 52 (1907), 404. — BUIGNET, Ann. chim. phys. 3 ser. 61, p. 233. — E. SCHULZE und FRANKFURT, Über die Verbreit. d. Rohrz. in den Pflanzen, Zeitschr. phys. Chem. 20 (1895) und 27 (1899). — NYGÅRD, Om rörsockrets förekomst och kvantitet i droger. Farm. Notisbl. Helsingfors 1909. — ANDERSEN, Zeitschr. phys. Chem. 29, S. 423. — BOURQUELOT, Le sucre de canne dans les véget. Bull. soc. d’hist. nat. des Ardennes 1901 (dort die Listen der Rohrzucker enthaltenden Pflanz.) und Journ. pharm. 1903. — HARLAY, Le Saccharose dans les organes végétaux souterrains. Thèse Paris 1905 (dort d. Lit.) und Journ. pharm. chim. 1905. — CH. LEFEBVRE, Application des procédés biochimiques à la recherche et au dosage des sucres et des glucosides dans les plantes etc. Thèse Paris 1907. — JODIN, Bull. soc. chim. 31. — Vgl. auch Bot. Jahresber. 1905, 815 (Kultur von Rohrzuckerpflanzen). — BRUNNO LINNÉ, Hydrolyse von Bi-, Tri- und Polysacchariden. Diss. Basel 1905. — FONCES-DIACON, Polysaccharides. Thèse Montpellier 1899.

(Kolonial-Museum, Haarlem.)
[S. 117]
Rohrzuckerdrogen.
I. Drogen, welche aus Rohrzucker bestehen.
Saccharum.
Syn. Zucker, Rohrzucker, Saccharose, Saccharobiose — sucre (franz.) — sugar (engl.) — zucchero (ital.) — açucar (span.) — suiker (holl.) — socker (schwed.) — sokuri (finn.) — cukor (ung.) — sachar (russ.).
Die Bezeichnungen für Zucker leiten sich alle von dem indischen Worte Çarkarâ (sansk. = Sand) oder Sakkarâ (prakr.) ab. σάκχαρον (DIOSKURIDES, war wohl Bambumanna, s. Tabaschir), σάκχαρι (Periplus), saccharum (PLINIUS), al sukkar (arab.), schakara (tibet.), schakar, scheker (pers.), scheker (türk.). Mit den Arabern kam das Wort nach dem Westen.
I. Rohrzucker aus Zuckerrohr.
Stammpflanze und systemat. Stellung. Saccharum officinarum L. (LINNÉ, Spec. pl. I, 54), Kasab elsukker bei IBN BAITHAR. Nach Einigen eine durch Kultur entstandene Form von S. spontaneum, das jetzt in Südasien, z. B. auf Java, ein sehr gefürchtetes Unkraut ist (Alang-Alang).
Gramineae — Andropogoneae. Sacchareae, Sect. Eusaccharum.
Beschreibung. Die Heimat des Zuckerrohrs, einer Pflanze des feuchtwarmen tropischen Klimas, ist Indien. Die wilde Stammform ist nicht mehr sicher bekannt. Es wurde durch Kultur zunächst nach dem übrigen Südasien, dann nach Vorderasien und Europa gebracht (s. weiter unten) und wird jetzt in den meisten warmen Ländern kultiviert (s. weiter unten), auch in ganz Zentralafrika (Congo, Njansa, Aequatoria). Kälte und Trockenheit sind die größten Feinde des Zuckerrohrs.
Im Habitus ist das Zuckerrohr dem Mais ähnlich, wird aber viel höher, bis 6 m und bis über 5 cm dick. Es wird fast ausschließlich durch Stecklinge vermehrt und kommt in den Kulturen selten zur Blüte (Taf. IV) und fast nie zur Fruchtbildung. Der Saft des ausgereiften Zuckerrohrs enthält im Mittel 12–15%, zuweilen 15–17%, vereinzelt 18–20% Rohrzucker neben nur 0,6% unkristallisierbaren Zucker.
Pathologie. Prof. ED. FISCHER berichtet über die pflanzlichen Schädlinge:
Das Zuckerrohr wird von zahlreichen Krankheiten befallen (siehe LINDAUS Bearbeitung in SORAUERS Handbuch der Pflanzenkrankheiten, 3. Aufl., WAKKER und WENT: De Ziekten van het Suikerriet op Java I, 1898, COBB, Fungus maladies of the sugar cane. Honolulu 1906). Eine Übersicht der in Java beobachteten Zuckerrohrkrankheiten gab ZEHNTNER, Oversicht van de Ziekten van het Suikerriet op Java. Mededeel. Proefstat. Oost Java. Soerabaia 1897. Vgl. dann auch den Katalog des Koloniaal-Museums. Haarlem 1900, vgl. auch I, S. 376. Wir greifen aus den Krankheiten nur die wichtigsten heraus:
Zunächst sind in neuerer Zeit mehrere Bakterienkrankheiten nachgewiesen worden, eine derselben ist die Spitzenfäule (Top-rot). — Blattfleckenkrankheiten werden von Leptosphaeria Sacchari BREDA DE HAAN, Coleroa Sacchari (Sacc.) BREDA DE HAAN und mehreren Cercospora-Arten hervorgerufen. — Eine gefährliche Erkrankung des Stengels (Rotfäule, red rot, red smut), bei der auch der Zuckergehalt sich vermindert (während die Glukose zunimmt), bewirkt Colletotrichum falcatum WENT. Ebenfalls an den Stengeln tritt die Ananasziekte auf, hervorgerufen durch Thielaviopsis Aethaceticus, die freilich kein obligater Parasit ist, sondern deren Eindringen Verwundungen voraussetzt. — Auch ein Brandpilz, Ustilago Sacchari RABENH., tritt auf den Zuckerrohrstengeln auf. Endlich kommen Hymenomyceten und Gastromyceten in[S. 118] Betracht, deren Mycel Krankheiten der Stecklinge oder Wurzelerkrankungen bedingen: Marasmius Sacchari WAKKER, ein Hymenomycet, der Erreger der sog. Dongkellankrankheit und die beiden Phalloideen Phallus celebicus und Ph. coralloides.
Die gefährlichste Krankheit ist die Seréh genannte, über die eine ganze Literatur existiert. WAKKER bezweifelt ihren parasitischen Charakter.
Gewinnung. Frisches Zuckerrohr enthält 12–18% Rohrzucker und bis 0,7% reduzierenden Zucker (VANDESMET). Der Zucker ist nicht gleichmäßig verteilt. Während z. B. die Spitze nur 1,914% enthält, steigt der Gehalt im oberem Stengelteil auf 7,79%, im mittleren auf 14% und beträgt im unteren 14,7%. Umgekehrt sinkt in den gleichen Organabschnitten der Glukosegehalt von 2,367 auf 0,945, 0,207 und 0,175. Doch sind diese Verhältnisse sehr variabel. Unter verschiedenen organischen Nichtzuckerstoffen ist auch Aconitsäure im Zuckerrohr gefunden worden (A. BEHR).

Ernte des Zuckerrohrs.
Die Gewinnung des Rohrzuckers aus dem Zuckerrohr geschieht in folgender Weise. Sobald das Rohr eine gewisse Höhe erreicht hat, wird es etwas über dem Boden geschnitten (Fig. 40). Dann werden die Blätter entfernt (I, Fig. 72 u. 73) und die knotig gegliederten dicken Stengel auf Kähnen (I, Fig. 219) oder Karren (I, Fig. 74 u. 215) oder Feldbahnen in die Mühle (I, Fig. 75) gebracht und dort zerquetscht (I, Fig. 144), worauf man den Rohsaft klärt, eindickt und kristallisieren läßt. Dies geschah früher in den Produktionsländern in sehr primitiver Weise und der Kolonialzucker mußte daher in Europa raffiniert werden.
Jetzt sind unter Benutzung der bei der Rübenzuckerindustrie (s. d.) gemachten Erfahrungen zahlreiche modern eingerichtete Rohrzuckerfabriken in den Produktionsländern entstanden, die nunmehr auch in den Tropen reinen Rohzucker und selbst Konsumzucker fabrizieren. Die javanischen Zuckerfabriken z. B. sind mit allen nur erdenklichen modernen maschinellen Einrichtungen versehen (Taf. V).

(Aus les grandes cultures.)
In Vorderindien ist (nach Pharmacogr. indic.) das durchschnittliche Erträgnis von 100 canes 18 guda (d. i. unraffinierter Zucker) oder 17,5 shakar (jaggery, d. i. trockener unraffinierter Zucker), oder 19,5 râb (d. i. Sirup).
Raffination. Die Zuckersiederei, d. h. die Kunst aus dem Rohrzucker, der unter dem Namen Moscovade (Mascovade, Muscuat) und Kassonade nach Europa gebracht wurde, reinen Zucker herzustellen, der Prozeß der Raffination (Reafinatio), war in den Ländern Europas im XVI. und XVII. Jahrh. schon weit verbreitet (vgl. z. B. ANGELUS SALA, Saccharologia 1650). Die erste Beschreibung lieferte aber erst DUHAMEL DU MONCEAU (L’art de raffiner le sucre 1764 mit 10 Taf., vgl. I, S. 975). Amsterdam, später Hamburg und Berlin, waren Hauptsitze der nordischen Zuckerraffinerie im XVIII. Jahrh. (vgl. darüber LIPPMANN). Die erste Zuckerraffinerie in Amsterdam entstand um 1600. Die erste deutsche Zuckerraffinerie wurde 1573 durch ROTH in Augsburg errichtet, eine zweite folgte 1597 in Dresden, dann folgten Hamburg, Orleans, Rouen. Der dreißigjährige Krieg vernichtete in Deutschland auch diese Industrie.
Handelssorten (s. auch Rübenzucker). In dem Frankfurter Catalogus von 1582 (I, S. 817) findet sich Saccharum canariense, candum (nicht von Candia, das Wort stammt vom persischen qand = Zucker), s. crystallinum, madeirense (von Madeira, wo seit 1420 Zucker gewonnen wurde), melitense, penidium (die indische Bezeichnung [fânîdh, fênîdh] schon bei arabischen und persischen [pânîdh] Schriftstellern des Mittelalters, dann in allen deutschen Taxen — vielleicht sog. Gerstenzucker), tabarzeth (pers. tabarzadh = axtgehauen, auch für Steinsalz — in vielen Taxen des XVI. bis XVIII. Jahrh.), Thomasinum (von St. Thomé im Busen von Guinea, wo Zuckerrohr seit 1485 gebaut wurde), s. rubrum und miscellaneum. In der Braunschweiger Liste 1521 (I, S. 814) figuriert: Hout sucker, Melzucker, Zucker penid und Zucker kand (s. auch unter Geschichte).
Eigenschaften. Der Rohrzucker (Formel vgl. S. 114) kristallisiert in großen monoklinen Kristallen (der Zuckerkand besteht aus solchen). Er zeigt Tribolumineszenz, leitet strömende Elektrizität sogut wie gar nicht, Wärme sehr schlecht. Er schmilzt bei 160° und erstarrt glasartig amorph (Gerstenzucker), die Masse wird aber allmählich wieder kristallinisch und trübe («Absterben»), bei stärkerem Erhitzen karamelisiert er. Sein spez. Gewicht ist bei 17,5° = 1,580. In absolutem Alkohol löst sich Rohrzucker schwer (1 : 80), in verdünntem leichter; leicht löst er sich in Invertzuckerlösungen und in ⅓ seines Gewichtes Wasser. Konzentrierte Schwefelsäure verkohlt ihn (Unterschied von d-Glukose). Sein spezifisches Rotationsvermögen ist: [α]20D = +66,5°, oder allgemein für jede Konzentration: [α]D = 66,386 + 0,015035. P − 0,0003986. P² (P = Prozentgehalt der Lösung an Rohrzucker). Er reduziert FEHLINGsche Lösung erst nach der z. B. beim Kochen eintretenden Inversion. Die gewöhnlichen Bier- und Weinhefen vergären Rohrzucker erst nach Inversion durch die Hefeenzyme (Invertase usw.). Über den Rum vgl. I, S. 1019.
Die Pharm. helvet. IV läßt den Zucker aus Zuckerrohr neben Rübenzucker zu.
Produktion. Zucker aus Rohrzucker produzieren jetzt: die Vereinigten Staaten (Louisiana), Porto Rico, Hawai, Cuba, Britisch Westindien (Trinidad, Jamaica, Antigua und St. Kitts, Barbados), Französ.-Westindien (Martinique, Guadeloupe), Dänisch-Westindien (St. Croix), Haiti und San Domingo, die kleinen Antillen, Mexiko, Zentralamerika (Guatemala, San Salvador, Nicaragua, Costa Rica), Brit. Guyana (Demerara), Holländ. Guyana (Surinam), Peru, Argentinien, Brasilien, Britisch Indien, Siam, Java,[S. 120] die Philippinen, Australien (Queensland, Neu-Süd-Wales), Fidschiinseln, Mauritius, Réunion, Ägypten, Spanien. Mauritius hieß früher die «Zuckerinsel».
In Java spielt die Fabrikation von Rohrzucker eine große Rolle.
Der Ertrag betrug 1907 in Java pro acre: Rohr 38 t 15 cwt, Zucker 4 t 3 cwt. Der Gesamtertrag an Rohr: 1210200 t. 1908 waren 115458 ha unter Zuckerrohrkultur. Java exportierte 1908: Hauptzucker 1075935516 kg, Sackzucker 80950282 kg, Stroopzucker 98278768 kg, Javan. Z. 5896000 kg.
Die Philippinen exportierten 1909 110604 t. Brasilien exportierte Zucker 1906: 84948346 kg, 1907: 12857899 kg.
Beträchtlich ist die Produktion in Cuba. Cuba produzierte 1907/08: 961958 t, 1908/09 1513582 t Rohrzucker.
Von rohem Zucker wurden 1908 in Hamburg seewärts eingeführt: 26982 dz, davon aus Ostafrika: 19516, geringere Mengen aus Peru, Brit. Ostindien, San Salvador, Nicaragua, Guatemala, Ägypten, Trinidad, St. Croix.
Frankreich importierte 1908 aus seinen Kolonien Réunion, Martinique, Guadeloupe und Mayotte 119561084 kg Rohrzucker (sucres en poudre), ziemlich viel (669357 kg) auch aus Engl. Afrika
Die Rohrzuckerproduktion der Erde betrug 1907/08: 5161900 t. Davon entfallen auf Java, das schon seit dem XVII. Jahrh. besonders im Osten Zucker produziert, 1156400 t, auf die Vereinigten Staaten (Louisiana, Texas, Portorico) 985000 t, auf Cuba 950000 t (1908/09: 1350000 t), auf Hawai 450000 t. Über 100000 t produzieren dann noch: die Antillen und Zentralamerika, Brasilien, Queensland, Mauritius, Peru, Philippinen, Argentinien, Demerara, der Rest fällt auf die Fidschiinseln, Ägypten, Réunion, Neu Südwales und Spanien. (Siehe auch unter Rübenzucker.)
Verbreitung über die Erde. Das Zuckerrohr ist in Indien heimisch und hat sich von dort aus über die Erde verbreitet. Schon 327 n. Chr. fand sich Zuckerrohr jenseits des Ganges (NEARCHOS), 250 n. Chr. in China, um Christi Geburt in Java, 400 n. Chr. finden wir es in Tibet und Kaschmir, um 600 in Ceylon, um 700 in Cambodja und auf Socotra. Auch nach Vorderasien gelangte es frühzeitig. Schon 643 finden wir es in Ägypten, 680 in Syrien, um 700 in Cypern, um 818 in Kreta. Nach Spanien kam die Zuckerrohrkultur 714. [Im arabischen Kalender des HARIB aus dem Jahre 961 (I, S. 612) wird der Anpflanzung des Zuckerrohrs gedacht.] Nach Sicilien 827 (nicht erst im XII. Jahrh. wie I, S. 33 steht), nach der Provence 750. In Marokko finden wir sie 709, in Tripolis um 900, in Madeira 1420, auf den Canaren und auf St. Thomé um 1480 (LIPPMANN) ISTACHRÎ (I, S. 616) berichtet c. 920 über Zuckerrohrkulturen in Tripolis, Chusistan, Meserkan, Asker Mokrem, wo auch Zuckerfabriken bestanden.
Während der Kreuzzüge war Syrien mit der größte Zuckerlieferant Europas. Im XII. Jahrh. blühte die Zuckerindustrie in Sicilien, aber schon im XI. Jahrh. finden wir sicilianischen Zucker auf dem Markte in Venedig. Die Rohrzuckerkultur hat sich noch in Ägypten und Spanien (Elche) erhalten, sonst ist sie im Westen erloschen. 1448 nahm die Zuckerrohrkultur die besten und ausgedehntesten Küstenstriche Siciliens in Anspruch (LIPPMANN). Bereits Ende des XIII. Jahrh. lieferte Cypern viel Zucker an den europäischen Markt, im XIV., XV. und XVI. Jahrh. blühte dort, wie auch in Ägypten, eine großartige Zuckerindustrie.
Nach Amerika kam das Zuckerrohr schon durch COLUMBUS (I, S. 745) 1493, der es auf seiner zweiten Reise nach Domingo brachte, wo es sich rasch akklimatisierte, OVIEDO (I, S. 755) folgte 1514. Nach Mexiko kam es um 1520, nach Brasilien 1532, nach Peru 1533, nach Paraguay 1580, nach Argentinien 1620, nach Guadeloupe und Martinique 1630, nach Barbados 1641, nach Louisiana 1673, nach[S. 121] Pennsylvanien 1785 (LIPPMANN). Das Zuckerrohr kam um 1797 auch nach Kalifornien. 1869 hatte Nieder-Kalifornien weite Zuckerfelder (ROSS BROWNE). Daß sich die Zuckerrohrkultur in Amerika so gut entwickelte, ist namentlich der Einführung der Sklaverei zu danken.
Mit der Zuckerfabrikation wurde in Mexiko schon bald nach der Eroberung begonnen. Schon 1553 hören wir von einem Zuckerexport aus Mexiko.

Zuckerfabrikation in Sizilien um 1570.
[Nach der Bildersammlung «Nova reperta» des Joann. Stradanus.]
Geschichte. Das Zuckerrohr wurde lange bevor man es lernte Zucker daraus darzustellen benutzt, wohl hauptsächlich gekaut. Die Darstellung festen Zuckers erfolgte zuerst in Indien, aber nicht vor dem III. oder gar VII. Jahrh. (VON LIPPMANN). Immerhin ist es also möglich, daß die Saccharum-Sorten in Suśrutas (I, S. 505) Zucker waren. PAULUS VON AEGINA und AVICENNA nannten daher den Zucker Sal indus — die Araber auch Tabarzeth. In der Alphita, bei BARTHOLOMAEUS und in Circa instans (I, S. 661) steht: zuccara, zaccara, zuccarum, zaccarum de canna mellis fit per decoctionem, auch zuchar, zucharum, zuccaria, zuccare. Die Perser und Araber nahmen die Zuckerfabrikation dann auf und brachten das Rohr und die Zuckerbereitung nach dem Westen. Bei den Hochzeitsfeierlichkeiten des Khalifen MESKADI-BENRITTALE (807 n. Chr.) in Bagdad wurden ungeheuere Zuckermengen verbraucht. Der Zuckerhut gilt als eine persische Erfindung, ebenso die Kunst zu raffinieren. Zuerst wurde der Zucker in Europa als Arzneimittel benutzt. Dann war er lange Luxusgegenstand. Noch Ende des XVII. Jahrh. war Zucker in Deutschland sehr teuer. In den Apotheken des Mittelalters findet sich Saccharum melitense (nicht von Malta, sondern wohl wegen der gelblichen Farbe — wie Melasse, LIPPMANN), S. madeirense und canariense, sowie S. thomasinum (von der Insel St. Thomé, s. oben S. 120). Der großkristallisierte hieß schon damals S. candum (Kandis). PEGOLOTTI (I, S. 702) teilt c. 1335 folgende Zuckersorten mit: 1. Hutzucker: Mucchera, Caffetino, Bambillonia, Musciatto, Donmaschino. 2. Kandiszucker. 3. Kristallzucker (polvere di zucchero), Farin von Cypern, Rhodus, Syrien, Cranco di Monreale u. Alexandria. 4. Sirup und Melasse (Mele di Canna-melei). Er fand sich in Hüten, Broten und in Pulver. Die Hüte wurden in Palmblätter eingehüllt, zu zwei aneinandergelegt ◁▷ und so in Leinwand gewickelt (una[S. 122] coppia di zucchero). In den Droits et Courtage etablis à Paris au XV siècle (herausg. von DORVEAUX) wird Sucre en bales et hors bales, Quassons (s. en morceaux) Pouldre de Cypre et d’Alexandrie und Sucre candy erwähnt. Im Nördlinger Register von 1480 (I, S. 813) steht: farina zuckari, zuccarum candie, zuccarum tabarset und zuckarum penidiarum. Das Braunschweiger Register von 1521 (I, S. 814) führt hout zucker, Melzucker, zucker penid und zucker kand. Penidiumzucker war wohl Gerstenzucker, der durch Schmelzen mit Weinstein infolge teilweiser Inversion dauernd in amorphen Zustand gebracht worden war (FLÜCKIGER). Tabarzed (s. oben S. 121) war ein reiner kristallisierter Stückzucker (bei CORDUS ist Sacch. Tabarzeth = album gesetzt, I, S. 802), wie das Sal indum (siehe oben), welcher Name auch noch 1604 und 1658 in den Braunschweiger Inventarien der Ratsapotheke zu finden ist (FLÜCKIGER). Die Fabrikation des Rohrzuckers bildet schon PISO (I, S. 893) 1658 und POMET (I, S. 942) 1694 ab, PISO eine brasilianische Zuckerrohrmühle und eine Zuckersiederei. Dann findet sich auch eine noch ältere Abbildung in der Bildersammlung der Nova reperta des J. STRADANUS (c. 1570 abgedr. vor LIPPMANNS Gesch. d. Zuckers, vgl. Fig. 41).
Lit. LIPPMANN, Geschichte des Zuckers und Chemie der Zuckerarten. — Abbild.: BENTLEY-TRIMEN, Medicinal plants t. 298, PABST-KÖHLER, Medizinalpfl. t. 169, NEES VON ESENBECK, Pl. med. t. 33–35, TUSSAC, Flore d. Antilles t. 23–25 und ENGLER-PRANTL, Pflanzenf. II, 2, 23. — SCHÄR, Das Zuckerrohr, seine Heimat, Kultur und Geschichte. Neujahrsbl. d. Zürich. Naturf.-Ges. 1890. Auch dort eine Abbild. des Zuckerrohres. Eine solche auch in den Afbeeldingen des Koloniaal Museums Haarlem. — PAASCHE, Zuckerindustrie und Zuckerhandel d. Welt 1891. — W. KRÜGER, Das Zuckerrohr und seine Kultur. Wien 1899. — TIEMANN, Zuckerrohr, Kultur, Fabrikation usw. 1899. — VAN GORKOM, Oostindische Cultures. — SEMLER, Trop. Agrikultur. 2. Aufl. 1903 (dort die Kultur beschrieben). — Lit. der Javanischen Zuckerfabrikation in Catalogus der Boekverzameling. Koloniaal Museum Haarlem. Ferner: Proefstation Midden Java, Mededeel. — Proefstat. West-Java Kagok-Pekalongan, Mededeel. — Proefstat. Oost Java, Mededeel. — Archief voor de Java-Suikerindustrie, Archief. — Jaarboek voor suikerfabrikanten op Java. — Karten in LANGHANS, Kleiner Handelsatlas 1895 und SCOBEL, Handelsatlas 1902.
II. Rübenzucker.
Stammpflanze. Beta vulgaris L. var. Rapa Dumort. (B. vulg. var. rapacea KOCH), var. maritima, var. altissima und andere Varietäten und Sorten. Besonders beliebt sind: Imperial-, Electoral-, Mangold-, weiße schlesische, Quedlinburger Rüben, sowie die sog. Klein-Wanzlebener Rübe. SCHINDLER (Bot. Zentrlbl. 46) leitet alle Kulturvarietäten von der an den Küsten Europas noch jetzt wild vorkommenden Beta vulgaris L. var. maritima KOCH ab. Beta vulgaris L. (wohl der τευτλός des THEOPHRAST) wird jetzt meist in die beiden Varietäten: Cicla L. (Gartenmangold) und Rapa Dum. zerlegt und letztere wieder in die zwei Untervarietäten: B. vulg. var. rapacea rubra (rote Rübe) und B. v. var. rapacea altissima (Zuckerrübe).
Systemat. Stellung. Chenopodiaceae, Cyclolobeae — Beteae.
Syn. Beißkohl, Chrut, Dickrübe, Mangold, Manichel, Rabetwörtel, Raude, Römische Kolle, Rungelrüben oder Runkelrübe, Speis, Zwickeln, Namen, die zum Teil sowohl für Beta vulgaris var. Cicla wie für B. v. var. Rapa benutzt werden.
Im ahd. finden sich die Namen: beizcol, bieza, bioza, stur, sturbete, manegolt, im mhd.: biese, bietekohl, mänglet, piesse, plateysske, romeskol, steyr, stir. — Im Ortus sanitat. Römisch Köl — bei BRUNSCHWIG: Mangolt — bei GESNER: bayrische Rübe.
Etym. Beta (so schon bei PLINIUS) vielleicht von kelt. bette = rot (wegen der Farbe der roten Rübe) oder, was wahrscheinlicher, von meta, «das jede spindelförmige Figur, in diesem Falle die Rübe bezeichnet» (KANNGIESSER) — beete heißt die Rübe auch noch jetzt in Norddeutschland; im Gothaer Arzneibuch (I, S. 679): bethe und betewort. Betas stehen im Capitulare KARLS (I, S. 620) und im St. Galler Klosterplan (I, S. 622). Runkelrübe = dicke Rübe. — Im Mittelalter: blitus (Tabula Mag. Salerni I, S. 638) und peta. — Bette (franz.) — beet (engl.) — biet (holl.). — Runkel von altnord. hruga = zusammenballen, wegen der dicken Wurzeln.
[S. 123]
Beta vulgaris ist eine krautige Pflanze mit großer basaler Blattrosette und einem meist nicht zur Ausbildung gelangenden oder unterdrückten ährenartigen Blütenstande. Die unscheinbaren fünfzähligen Blüten besitzen einen fast dreieckigen Fruchtknoten. Die Staubblätter sind am Grunde zu einem fleischigen, ringförmigen Polster (Discus) vereinigt. Der Embryo des Samens ist, ringförmig gekrümmt. (Abbild. bei VOLKENS in ENGLER-PRANTL, Pflanzenfam. III, 1a, 57.)
Die Wurzel ist eine mehr oder weniger hypertrophische Rübe, die oft ein sehr beträchtliches Gewicht erreicht und vorwiegend aus zuckerhaltigem Speicherparenchym besteht (s. oben).
Kultur. Die Zuckerrübe, Runkelrübe oder Mangold ist am Mittelmeer, am Kaspischen Meer, auf den Canarischen Inseln, in Mesopotamien und Ostindien heimisch und wird wohl seit den IV-VI vorchristlichen Jahrh. kultiviert (V. LIPPMANN). Sie findet sich auf alten ägyptischen Tempelgemälden (WÖNIG). Pen Tsʿao Kang Mu (I, S. 519) kennt Beta vulgaris. PLINIUS beschreibt ihren Anbau, ebenso die römischen Agronomen (I, S. 571). DIOSKURIDES empfiehlt sie als Heilmittel, ebenso die arabischen Ärzte (bei RASES: sicula, sicla, nach Sicilien). Sie steht im Capitulare KARLS (I, S. 619) und bei MEGENBERG (I, S. 693) als piezenkraut. Den Rohrzucker fand in ihr MARGGRAF (I, S. 964).
Die Rübenkultur kam schon bald nach 1700 von den Niederlanden nach Deutschland. Die heutige Zuckerrübe gelangte nämlich (nach RÖSSIG) als Burgunderrübe aus den burgundischen Niederlanden zuerst in die Pfalz und verbreitete sich von hier über Deutschland, besonders Franken, Sachsen und Schlesien. Das Problem, zuckerreiche Rüben zu züchten, löste ACHARD durch seine 1786 begonnenen Anbauversuche. Der erste Aufschwung der Rübenzuckerindustrie datiert von der Kontinentalsperre. Nach Frankreich brachte die Zuckerrübe u. a. der ältere VILMORIN. Sie wird jetzt in Deutschland, Österreich, Frankreich, Rußland, Belgien und Nordamerika gebaut.
Die Zuckerrübe ist auch ein Kaffeesurrogat (s. Cichorium).
Pathologie. Über die pflanzlichen Schädlinge berichtet Prof. ED. FISCHER:
Die Zuckerrübe wird von mehreren Bakterienkrankheiten heimgesucht. Eine auffällige ist die sog. Rübenschwanzfäule; sie besteht darin, daß die Rübe, beim Schwanzende beginnend, abstirbt, wobei eine Inversion des Rohrzuckers stattfindet.
In Algier beobachtete L. TRABUT eine Krankheit der Rübenwurzeln, die im Auftreten von fleischigen, traubigen Auswüchsen besteht, in welchen in stark vergrößerten Zellen ein Pilz auftritt, den TRABUT für eine Ustilaginee hielt, der aber nach Untersuchung von MAGNUS zu dem Chytridineengenus Urophlyctis gehört (U. leproides [TRAB.] MAGN.). — Peronospora Schachtii wird als Erreger der sog. Kräuselkrankheit der Herzblättchen der Rübe angesehen, welche mitunter einen nicht unbeträchtlichen Schaden stiftet. — Bei der sog. Wurzel- oder Herzfäule der Rüben tritt u. a. Phoma Betae B. FRANK auf, welche nach PRILLIEUX und DELACROIX die Pyknidenform des Pyrenomyceten Mycosphaerella tabifica ist; doch ist das ursächliche Verhältnis dieses Pilzes zu der Krankheit nicht in jeder Hinsicht klargestellt. Derselbe Pilz in Gemeinschaft mit Pythium de Baryanum und Aphanomyces laevis soll auch bei der gefährlichsten bei uns vorkommenden Rübenkrankheit, dem Wurzelbrand, beteiligt sein. — Das Mycel von Sclerotinia Libertiana und ein Mycel unbekannter Zugehörigkeit (Rhizoctonia) befallen die Rübenwurzeln, ersteres speziell auch die eingekellerten Rüben. Nicht völlig aufgeklärt ist in bezug auf ihren Urheber auch die sog. Schorfkrankheit der Rüben.
Über die Krankheiten der Zuckerrübe berichtet fortlaufend der Jahresber. über d. Untersuch. u. Fortschritte auf d. Gesamtgebiete der Zuckerfabrikation (herausg. v. JOH. BOCK) Braunschweig, VIEWEG.
Gewinnung. In der Zuckerrübe bezw. in dem Safte derselben sind (bes. durch[S. 124] V. LIPPMANN) sehr zahlreiche Substanzen nachgewiesen; neben Rohrzucker, der etwa 15–18% ausmacht, wenig Raffinose und Invertzucker, dann Zitronensäure, Oxalsäure, l-Apfelsäure, r-Weinsäure, Aconitsäure, Adipinsäure, Bernsteinsäure, Glutarsäure, Glykolsäure, Glyoxylsäure, Malonsäure, Oxyzitronensäure, Tricarballylsäure, ferner Glutamin, Asparagin, Leucin, Tyrosin, dann Lecithin, Cholin, Betain, Citrazinsäure, bisweilen auch Coniferin, Vanillin, Brenzcatechin, ferner Phytosterin und eine Rübenharzsäure, — Arabinsäure, Metapektinsäure, Metarabin, Pararabin, γ-Galaktan, endlich Xanthin, Guanin, Hypoxanthin, Adenin, Carnin, Arginin, Guanidin, Allantoin, Vernin und Vicin, von Enzymen Tyrosinase und ein Farbstoff.
Aufgabe der Rübenzuckerfabrikation ist es, den Rohrzucker von dem «Nichtzucker» zu trennen und zur Reinkristallisation zu bringen. Es geschieht dies jetzt meist in der Weise — im einzelnen werden Abweichungen beobachtet —, daß die gut gewaschenen Rüben in Schnitzel geschnitten und in den zu Batterien vereinigten Diffuseuren der Diffusion unterworfen werden. Der von den Diffuseuren kommende, etwa 12–15% Rohrzucker enthaltende Saft wird in der Hitze mit Kalkhydrat behandelt, nahezu mit Kohlensäure saturiert und zum Sieden erhitzt, durch Filterpressen geleitet, dann nochmals mit Kohlensäure oder schwefliger Säure saturiert und schließlich wieder durch die Filterpresse geleitet. Der so erhaltene Dünnsaft, der 10–12% Zucker enthält, wird in Vakuumapparaten eingedickt und dann auf verschiedene Weise zur Kristallisation gebracht. Durch Zentrifugieren der erkalteten Masse gewinnt man den «Rohzucker», was von diesem abgeschleudert wird ist der Sirup, der bei weiterem Verkochen noch ein oder zwei «Nachprodukte» liefert, und die letzte, nicht mehr kristallisierbare Mutterlauge ist die Melasse. Sie wird jetzt oft noch mittelst Strontian chemisch entzuckert, oder durch Vergärung auf Alkohol und die Melasseschlempe auf Kaliumcarbonat verarbeitet. Der Rohzucker wird meist in eigenen Raffinerien raffiniert (Konsumzucker) und gelangt dann als ganz reiner weißer Kristallzucker (und Raffinade) meist in den charakteristischen Hüten oder in Würfeln in den Handel.
Die Herstellung der bekannten Zuckerhüte (Zuckerstöcke) erfolgt in der Weise, daß man den Kristallbrei in konische, mit der Spitze nach unten aufgestellte Formen füllt, die Mutterlauge abfließen läßt und dann oben eine gesättigte reine Zuckerlösung aufgießt («deckt»). Diese verdrängt die Mutterlauge und wird schließlich abgesaugt, worauf man die Hüte in Trockenstuben trocknet.
Produktion. Die Rübenzuckerproduktion Europas betrug 1907/08: 6527800 t, davon entfallen auf Deutschland 2135000 t, auf Österreich-Ungarn und Rußland je etwa 1400000 t, der Rest auf Frankreich, Belgien, Holland u. and.
Es wird zurzeit (1910) wieder mehr Rohrzucker wie Rübenzucker produziert. (1907/08 mehr Rübenzucker.) Beide liegen in einem steten Kampfe.
Die Rübenanbaufläche betrug 1908/09 allein in Deutschland 432400 ha, in Rußland, das jetzt mit Deutschland in Konkurrenz tritt, sogar 561300 ha, in ganz Europa 1680700 ha. In Deutschland waren 1909 361 Rübenzuckerfabriken in Betrieb. Der meiste Zucker wird in Preußen gewonnen.
Deutschland exportierte 1909 von Rübenzucker in Doppelzentner: Kristallzucker 3303364; Platten-, Stangen-, Würfelzucker 440225; gemahlenen Melis 300992; Stücken- und Krümelzucker 141253 (bes. nach der Schweiz); gemahlene Raffinade 160694; Brotzucker 128994; Farin 69335; Kandis 30827; rohen Zucker (festen und flüssigen) 4037927 dz.
Die Rübenzuckerproduktion ist ein kompliziertes Problem, das auf das innigste ebenso mit einem rationellen Zuckerrübenbau (Erzielung hochprozentiger Rüben), mit[S. 125] den Bodenpreisen und Arbeitslöhnen, sowie den Besteuerungsverhältnissen, wie auch den maschinellen Einrichtungen der Fabriken, der chemischen Kontrolle des Betriebes und der Verwertung der Abfälle und Nebenprodukte zusammenhängt.
Ein gutes Bild über die Zuckerproduktion der Erde gibt uns die Ein- und Ausfuhr von Nordamerika. Es führte ein an versteuerbarem Zucker:
|
1906
|
1907
|
1908
|
1909
|
||
|
Melasse (vorwiegend aus Cuba)
|
16021076
|
24630935
|
18882756
|
22092696
|
Gallons
|
|
Rübenzucker not above Nr. 16 Dutch standard in color (vorwiegend aus Deutschland)
|
48548919
|
397745046
|
221036900
|
98625908
|
Pounds
|
|
Rohrzucker dito (vorwiegend aus Cuba und den westind. Inseln, aus holländ. Indien und den Philippinen)
|
3921605729
|
3986510021
|
3144022433
|
4084921078
|
„
|
|
Zucker , above Nr. 16 Dutch standard in color (vorwiegend aus Deutschland, Österreich und Canada)
|
9176782
|
7584908
|
6937789
|
5874032
|
„
|
Dem steht eine Ausfuhr gegenüber von:
|
1906
|
1907
|
1908
|
1909
|
||
|
Melasse (vorwiegend nach Großbritannien und Canada)
|
10205885
|
3193322
|
3320419
|
3973908
|
Gallons
|
|
Sirup (vorwiegend nach Großbritannien, Dänemark und Canada)
|
12335645
|
14115819
|
13181095
|
13865756
|
„
|
|
Brown Sugar (vorwiegend nach dänisch Westindien)
|
276556
|
58587
|
13285
|
60882
|
Pounds
|
|
Raffinierter Zucker (vorwiegend nach Großbritannien und Südafrika, dann nach Zentralamerika und Labrador)
|
21899290
|
21179016
|
25497358
|
79885415
|
„
|
Handelssorten. Der Handel unterscheidet: Raffinade (Abarten: Würfelzucker, und Pilé, Cubes, Granulated (Sandzucker), Kastorzucker, Kristallzucker), Melis, Farinzucker (Bastardzucker). (Vgl. auch unter Produktion.) Für die pharmazeutischen Präparate darf nur beste Raffinade oder Kristallzucker benutzt werden. Pharm. helv. IV verlangt z. B. Abwesenheit von Metallen und Traubenzucker, läßt nur Spuren von Kalk und Sulfaten zu und schreibt vor, daß 0,5 g ohne wägbaren Rückstand verbrennen sollen.
Prüfung. Ein für medizinische Zwecke brauchbares Saccharum muß weiß sein. 1 ccm der Lösung (2=3) mit 1 ccm Kobaltnitrat und 2 ccm Natronlauge versetzt muß eine beständige violette Färbung annehmen. 2 Teile Zucker geben mit 1 Teil Wasser einen farblosen, geruchlosen, neutralen Sirup von 1,330 spez. Gewicht, der beim Stehen nichts absetzen darf und sich mit Alkohol klar mischen muß. 10 ccm des Sirups dürfen nach Zusatz von 1 ccm Natronlauge und 1 ccm Kupfersulfat innerhalb 5 Minuten bei gewöhnlicher Temperatur höchstens eine grünliche Trübung, dagegen keine Abscheidung von rotem Kupferoxydul zeigen (Traubenzucker). Die verdünnte Lösung muß gegen Schwefelwasserstoff und Ammoniumoxalat indifferent sich[S. 126] verhalten und durch Barytnitrat und Silbernitrat höchstens opalisierende Trübung geben.
Medizinalzucker muß ultramarinfrei sein. Das blaue Ultramarin wird zugesetzt, um die gelbe Farbe unreinen Zuckers zu verdecken. Während nämlich unser Auge sehr empfindlich ist für Gelb und schon eine schwach gelbe Färbung deutlich wahrnimmt, ist es für Blau wenig empfindlich.
Geschichte. MARGGRAF ist der wissenschaftliche, ACHARD der technische Begründer der Rübenzuckerindustrie (I, S. 964). Der erste von ACHARD in etwas größerem Maßstabe dargestellte Rübenzucker wurde 1798 von der Berliner Zuckersiederei-Kompagnie auf Kandis, Farin und Syrup raffiniert (V. LIPPMANN). Auch NÖLDECHEN, HERMBSTÄDT und GÖTTLING fabrizierten bereits im XVIII. Jahrb. Rübenzucker. Die erste wirkliche Rübenzuckerfabrik setzte ACHARD 1802 in Betrieb.
Lit. V. LIPPMANN, Gesch. d. Zuckers (dort weitere Literatur). — Les grandes cultures. — ROESSIG, Vers. einer bot. Bestimm. d. Runkel- oder Zuckerrübe. Leipz. 1800. — SCHEIBLER, Aktenstücke zur Rübenzuckerfabrikation in Deutschland. Berlin 1875. — RÜMPLER, Ausführl. Handbuch der Zuckerfabrikation 1909 (vervollständ. Sonderabdruck des Artikels Zucker in MUSPRATTS Chemie). — RÜMPLER, Die Nichtzuckerstoffe der Rüben. — WILEY, Exper. with Sugar beets U. S. Dep. of Agric. 1894 und Progress of the Beet-Sugar Industry in the United States. House of representatives Doc. 699. 1900. — Jahresbericht über die Untersuchungen und Fortschritte auf dem Gesamtgebiete der Zuckerfabrikation. Begr. v. STAMMER, herausg. v. BOCK; der 48 Jahrg. (1908) erschien 1909. — Abbild. der Pflanze bei PABST-KÖHLER, Medizinalpflanzen t. 55 und in Les grandes cultures.
Auf einer anderen Chenopodiacee, Salsola foetida, beobachtete AITCHISON 1887 in Afghanistan ein aromatisch schmeckendes Manna.
III. Ahornzucker.
Syn. Maple sugar.
Stammpflanzen und Systemat. Stellung. Acer saccharum (Sugar maple) und dessen Varietät A. saccharum nigrum (black maple) in erster Linie, dann auch: Acer rubrum (red maple), Ac. saccharinum (silver maple), Ac. macrophyllum (Oregon maple), Ac. Negundo (box elder). Acer saccharinum WANGENH. ist abgebildet bei PAX in ENGLER-PRANTL, Pflanzenfam. III, S. 271.
Aceraceae.
Gewinnung. Der Saft des Zuckerahorn enthält im Liter 240–270 g Rohrzucker. (Auch der Saft unseres Ahorn enthält im Frühjahr c. 3% Zucker.) Reiner frischer Ahornsaft enthält keine Spur reduzierenden Zucker (WILEY). Der Ertrag hängt vom Standorte ab. Ahornbäume auf Höhenzügen und südlichen Abdachungen haben den zuckerreichsten Saft. Je frischer das Klima, um so feiner ist der Geschmack des Saftes. Die Indianer der nördlichen Staaten Nordamerikas benutzten seit undenklichen Zeiten den Ahornzucker. Sie schnitten in ganz geregeltem, aber ziemlich rohem Betriebe mit einer Axt den Baum horizontal an und leiteten den Saft mit einem Stück Rinde in Gefäße, wo er dann konzentriert wurde, im Winter durch Ausfrierenlassen. Sie kannten festen Zucker. Die ersten Ansiedler ahmten die Methoden der Indianer nach und verbesserten sie langsam. Das Einkochen und Kristallisierenlassen fand im Walde selbst statt (Fig. 42). Eine eigentliche Ahornzuckerindustrie entwickelte sich um die Mitte des XIX. Jahrh. Sie führte zu einer Verbesserung der Art des Anschneidens und besonders der Konzentrationsarbeit. Die Verwundung wurde nun[S. 127] nicht mehr mit einer Axt gemacht, sondern ein ⅜ Zoll großes Bohrloch angelegt, in dasselbe eine Metallröhre, meist verkupfertes Eisenrohr, eingesetzt und ein Eimer angehängt (Taf. VI). Das Eindicken erfolgt jetzt in langen flachen, schräggestellten Pfannen (Cooks Evaporator), über deren fragmentierten, mit Dampf oder durch direkte Heizung erwärmten Boden der Saft aus den Tanks in Zickzackbahn langsam von einem Ende zum anderen fließt (Fig. 43). In entlegenen Gegenden werden auch die alten Methoden noch geübt.

[Nach Fox und Hubbard.]

Eindampfen des Ahornsaftes im Walde in Nordamerika.
[Nach Fox und Hubbard.]

Moderne Verdampfungseinrichtung für den Ahornsaft in Nordamerika.
[Nach Fox und Hubbard.]
[S. 128]
Jeder Baum liefert jährlich 50–150 Liter Saft, woraus 12–35 kg Zucker gewonnen werden können. Der mir vorliegende Ahornzucker ist etwas gefärbt.
Die Ahornzuckerindustrie hat sich namentlich in den nördlichen Staaten der Union ausgebreitet. Von der fast 12 Mill. Pfund betragenden Menge Ahornzucker, die die Vereinigten Staaten 1900 produzierten, entfallen auf die New England States (Maine, New Hampshire, Vermont, Massachusetts, Connecticut) fast 5½ Mill., etwa ebenso viel lieferten die Middle Atlantic States (New York, New Jersey, Pennsylvania, Maryland, Virginia, West Virginia), etwa 1 Mill. die Centralstates und nur wenig North Carolina. Der meiste Ahornzucker kommt aus den Staaten Vermont, New York und Pennsylvania. Auch Ahornsyrup wird viel gewonnen, 1900 etwa 2 Mill. Gallonen, davon kam mehr als die Hälfte aus den Zentralstaaten, besonders Ohio. 1909 soll die Produktion an Ahornzucker auf 22½ Mill. Pfund gestiegen sein. 15 Mill. Eisenröhren mußten neu verkupfert werden. 1901 belief sich die Gewinnung an Ahornzucker und Sirup in Kanada auf 17804825 lbs im Werte von 1780482$. Hiervon fallen auf die Provinz Quebec 13,56 Mill. lbs, auf die Provinz Ontario 3,91 Mill. lbs. Die Produktion soll seither noch gestiegen sein. Auch sind eigens Ahornbäume in letzter Zeit angepflanzt worden (TUNMANN).
HERMBSTÄDT fand 1809 Rohrzucker in folgenden Acer-Arten: Acer saccharinum, A. pseudoplatanus, A. campestre, A. platanoides, A. dasycarpum, A. tataricum, A. Negundo, A. monspessulanum.
Eine lohnende Zuckerbereitung ist auch bei den japanischen Zuckerahornarten Acer argutum und A. japonicum möglich.
Lit. FOX AND HUBBARD, The maple Sugar industry U. S. Dep. of agricult. Bur. of forestr. 1905. — WILL. F. HUBBARD, Maple Sugar and Sirop. U. S. Dep. of agricult. Farmers Bull. Nr. 252, 1906.
IV. Palmzucker.
Die Gewinnung des Palmzucker (jaggery) ist in B. I, S. 1017 geschildert. Dort sind auch die Palmzucker liefernden Palmen genannt.
In ziemlich beträchtlicher Menge wird Palmzucker auf dem malaiischen Archipel, z. B. in Java, aus dem Safte der Zuckerpalme, Arenga saccharifera LABILL. (Gommutus saccharifera SPR., Saguerus Rumphii ROXB.), gewonnen. Diese in Malacca Gumúti, in Java Aren oder Anau, in Menado Akol (weitere Namen bei CLERQ) genannte, ziemlich struppige (Abbild. in TSCHIRCH, Ind. Heil. u. Nutzpfl.) Gomuti- oder Arenpalme, wächst im Innern der Malaiischen Inseln, fern von der Küste. Sie enthält im Stamm ziemlich viel Stärke, die ihr den Namen Sagopalme von Malacca verschafft hat und die z. B. auf Celebes gewonnen wird. Sobald die Palme sich aber anschickt ihren Blütenstand zu bilden wird diese Stärke in Zucker umgewandelt. Sobald die weiblichen Infloreszenzen sich entwickelt haben und die erste männliche erscheint, wird der Kolben geklopft bis bei Einschnitten reichlich Saft austritt, dann abgeschnitten und die durch Blätter gegen Bienen geschützte Schnittfläche mehrfach erneuert. «Nunmehr wird an der Schnittfläche ein aus mehreren Internodien bestehendes, unten geschlossenes, im Innern aber durch Durchlochen der trennenden Querwände in eine Röhre von oft 2 m Länge verwandeltes Stück Bambusrohr derartig befestigt, daß der aus der Schnittfläche ausfließende Saft in die durch Räuchern innen «sterilisierte» Röhre fließt. Diese Röhre hängt der Länge nach am Baum herab und ist mittelst[S. 129] Rotang- (oder Eju, d. h. Aren-) Schnüren am Stamm befestigt. Sobald ein zweiter Blütenstand erscheint, wird in der gleichen Weise verfahren. Ich sah oftmals an einem Baume 3–4 solcher Bambusröhren hängen. Täglich fließen etwa 2–3 Monate hindurch 2–4 Liter des Zuckersaftes aus. Derselbe wird, nachdem die Röhre alle paar Tage herabgenommen und entleert worden ist über freiem Feuer eingedampft, bis ein Tropfen, auf einen Stein gebracht, erhärtet. Aus der infolge der unsorgfältigen Bereitung braunen Zuckermasse werden alsdann runde Scheiben oder rechteckige Blöcke geformt, die in die Blätter des Aren oder der Zalacca edulis geschlagen als Gula-aren (d. h. Arenzucker) auf den Markt gebracht werden» (TSCHIRCH). Die Abgabe des Zuckersaftes dauert ziemlich lange, so daß ein Baum viel Zucker zu liefern im stande ist. Ein Hektar Arenpalmen könnte c. 8000 Pfund liefern, doch ist die Arenpalme nirgends in Plantagenkultur. Ich sah nur einzelne Exemplare. Zu JUNGHUHNS Zeit (Mitte des XIX. Jahrh.) gab es in der Residentschaft Bandong noch 159 Kochplätze für Arenzucker mit 334 eisernen Pfannen. Jetzt verdrängt der Rohrzucker allmählich den Arenzucker. Immerhin traf ich 1889 noch viel davon in den Warongs (Garküchen) und auf dem Pasar (Markt). Der Zucker der Arenga saccharifera besteht zu 87,97% aus Rohrzucker und enthält nur 1,53% Dextrose und 0,18% Fruktose (DÉON). Ursprünglich ist er wohl reine Saccharose.
Die chilenische Cocos- oder Coquito-Palme (I, S. 1018) liefert in Chile große Mengen Palmenhonig, eine Hacienda bei Valparaiso mit 150000 Bäumen z. B. jährlich 200000 Liter (SEMLER).
Der zum Export gelangende Palmenzucker der Dattelzuckerpalme, der sog. wilden indischen Dattelpalme (Phoenix silvestris), wird hauptsächlich in Bengalen gewonnen. Seine Bereitung, durch Anzapfen der Stämme, Einführen eines Bambusröhrchens und Eindicken des Saftes, schildert SEMLER (Tropische Agrikultur, 2. Aufl. 1897, 686; vgl. auch WATT, Dict. econom. prod. of India).
Die Gewinnung des Zuckers wird in Indien auf dem Lande noch ziemlich primitiv nach alten Methoden betrieben. Schon JOSEPH, ein Indianer von Calechut (I, S. 743), beschreibt die Palmzuckergewinnung.
Lohnend erwies sich auch die Zuckergewinnung aus der Dattelpalme und der Cocospalme. In Malabar setzt man dem abgezogenen Safte der Cocospalme (vgl. I, S. 1017) etwas Muschelkalk hinzu, um ihn am Gären zu hindern. Der zum dicken Sirup eingedickte Palmsaft wird auf Palmblätter aufgestrichen und erhärtet hier. Dieser Cocospalmzucker ist in Malabar ein namhaftes Handelsprodukt (SCHRÖTER). In Malacca wird übrigens Zucker auch aus der Arenpalme, die dort auch Kabong heißt und in Kultur sich befindet, bereitet. Die Blütenkolben heißen dort «mayams».
Über Palmweingewinnung vgl. I, S. 1017. Schon ODORICO DI PORTO MAGGIORE (I, S. 726) berichtet von «Bäumen, die Wein tragen». In Ceylon (Moratuwa) und Vorderindien (Tolligunj, Konnagar) wird sehr viel Cocospalmsaft, sowie Dattelzuckermelasse auf Arak (Toddy) verarbeitet, der in Deutschostafrika Tembo heißt.
Lit. TSCHIRCH, Ind. Heil- u. Nutzpfl. — BENTLEY-TRIMEN, Medicinal plants. — SIMMONDS, Tropical Agricult. — WATT, Diction. econ. prod. — SCHRÖTER, Die Palmen (I, S. 1020). — CLERCQ, Nieuw Plantkund. Woordenboek voor Nederl. Ind. 1909.
V. Sorghumzucker.
Stammpflanze. Sorghum saccharatum PERS. (Andropogon Sorghum var. saccharatus, Holcus saccharatus L.) und einige Sorten von Sorghum vulgare PERS.[S. 130] (Andropogon Sorghum var. vulgaris). — Gramineae — Andropogoneae, Andropogon. Untergattung: Sorghum.
Herkunft und Gewinnung. Die Zuckerhirse oder das chinesische Zuckerrohr (Sorgho) und das wohl kaum davon verschiedene, bisweilen aber als Sorghum kaffrarium davon unterschiedene afrikanische Zuckerrohr (Imphee), sind ursprünglich an der Ostküste von Afrika heimisch, aber jetzt über die Erde verbreitet. Die Zuckerhirse wurde zunächst nach China gebracht. Von dort aus kam sie über Europa nach Amerika.
Die Stengel enthalten in den Zellen des Grundgewebes Rohrzucker. Die Menge an Gesamtzucker beträgt oft bis 16% (WACHTEL), weil sie aber zum großen Teile aus Invertzucker besteht, ist die Ausbeute an kristallisiertem Zucker nur klein, meist nur wenige Prozente, während die Zuckerrüben schon bis 18%, das Zuckerrohr (z. B. in Cuba) schon 13% ihres Gewichtes krist. Zucker lieferten. Am meisten macht die Tatsache, daß der Saft der Zuckerhirse neben Rohrzucker und unkristallisierbarem Zucker (Glukose), viel Eiweiß und Aschenbestandteile enthält und sauer reagiert, die Darstellung von krist. Sorghumzucker schwierig und wenig lohnend. Dagegen kann mit Erfolg Sorghumsirup dargestellt werden. Es geschieht dies in Amerika, wo sich eine ziemlich große Sorghumzuckerindustrie — meist jedoch in Kleinbetrieben — entwickelt hat, in dem oben (S. 127) erwähnten Cooks Evaporator. Die großen Hoffnungen, die man in Nordamerika auf die Sorghumzuckerbereitung setzte, haben sich nicht oder doch nicht in dem Maße als man zur Zeit des «Sorghumfiebers» dachte, erfüllt. Immerhin wurden dort angeblich 1885 (vorübergehend) 600000 Pfund, aber ziemlich unreiner, Sorghumzucker gewonnen. Auch in Frankreich, in Indien und Australien sind mehrmals wenig erfolgreiche Versuche mit Sorghumzuckerbereitung gemacht worden. Der gereinigte Sorghumzucker enthält 92% Saccharose und 4,5% Glukose.
Einen Sirup bereiten die Mexikaner übrigens auch aus den Stengeln von Zea Mais L. (TAYLER), doch ist wohl, besonders aus der Süßmais genannten Varietät, deren frisch ausgepreßter Saft 15–16% Rohrzucker enthält, von jeher, schon in der präkolumbischen Zeit, auch fester Zucker dargestellt worden (Berichte des CORTEZ). In Europa wurde schon im XVIII. Jahrh. Maiszucker gewonnen. Daß der Maisstengel Rohrzucker enthält, zeigte 1836 PALLAS.
Aus Zuckermaissaft wird in Mexiko, aus Zuckerhirsesaft in China ein berauschendes Getränk bereitet. In Mexiko heißt dies Pulque de Mahiz.
Lit. SEMLER, Tropische Agrikultur III, 301. — H. W. WILEY, Rec. of experim. conduct. by the Commissioner of agriculture in the manufacture of Sugar from Sorghum at Rio Grande, New Jersey, Kenner, Louisiana, Conway springs, Douglass and Sterling, Kansas 1888, sowie Record of experiments with Sorghum 1890–1893 U. S. Dep. of Agriculture. Div. of Chem. Bulletin 20, 29, 34 u. 40. — Rep. of the secretary of agriculture 1892. — WACHTEL, Centralbl. f. Agrik. Chem. 1880.
VI. Andere Rohrzucker liefernde Materialien.
Es ist auch vorgeschlagen worden, die Ananas auf Rohrzucker zu verarbeiten, da deren Fruchtstand 11,5% kristallisierenden Zucker enthält. Er wird aber von 2% nicht kristallisierenden Zuckers begleitet. Der Saft eignet sich also nicht zur Rohrzuckergewinnung, ganz abgesehen davon, daß das Ausgangsmaterial zu teuer ist.
Das gleiche gilt von den Aprikosen, die neben 6% kristallisierendem Zucker, 2,75% unkristallisierbaren enthalten (SEMLER).
[S. 131]
Auch die Zuckerwurzel (Sium Sisarum), die man in Südeuropa und Nordafrika kultiviert, wird nicht auf Zucker ausgebeutet, obwohl MARGGRAF in ihr Rohrzucker fand.
Aus dem Safte der Agave (vgl. I, S. 1018) bereiteten die alten Mexikaner und Peruvianer Zucker. Jetzt geschieht dies nicht mehr. Im Safte der Agave americana finden sich 6% Saccharose und 2,6% Fruktose.
Der Saft der Birke wurde in Schottland und Irland, und wird noch jetzt da und dort in Nordamerika auf Zucker verarbeitet. (Näheres in W. LENZ, Über Birkensaft in Arb. d. pharm. Instit. Berlin VII [1910], 228.)
Früher diente auch Heracleum sphondylium und sibiricum in Nordasien zur Zuckerbereitung. Man trocknete die Stengel und klopfte die Zuckereffloreszenz ab.
Den Zucker aus Asclepias syriaca kannte bereits AVICENNA.
Die süß schmeckenden Früchte von Glyceria fluitans (Mannagras, Mannahirse), von denen man bis ins XVIII. Jahrh. glaubte, daß sie wie der Tau vom Himmel fielen, sind zur Zuckerbereitung, wie es scheint, nie benutzt worden.
Zucker aus Cocosmilch dargestellt enthielt 74,95% Saccharose. Zucker aus dem Safte von Borassus flabelliformis 79,12% Saccharose (BOURQUELOT).
In von Ahornblättern abgespültem Honigtau fand KREIS 19,7% der Trockensubstanz Invertzucker, 9,7% Rohrzucker und 40,1% Dextrin.
Weitere Angaben bei LIPPMANN, Gesch. d. Zuckers.
II. Rohrzucker enthaltende Mannaarten.
(Sämtlich frei von Mannit.)
a) Alhagi Manna oder Terendschabin.
Khorosani, Alhagi-Manna, persische Manna, Terendschabin, Taranjabin, Taryngiabin, — Terengebin (pers. = Fruchthonig, engebin = Honig, AITCHISON übersetzt: Honig vom Grünen, d. h. vom grünen Strauch), yavása-sarkara (ind.); — bei RHAZES und AVICENNA: Terengiabin, bei IBN BAITHAR: Tarandschubin, arab. Elbâdsch; bei SIMON JANUENSIS: Tereheniabin; bei SERAPION (I, S. 606) Tereniabin, bei GARCIA DA ORTA: Tirimiabin, Trungibim; bei ALPINI und CORDUS (I, S. 800): Tereniabin (oder Manna orientalis s. Drosomeli). Die Manna granata, z. B. in der Frankfurter Liste (I, S. 812) und bei CORDUS, war vielleicht auch Alhagi-Manna (FLÜCKIGER). Die im Mittelalter über Aleppo in den Handel gebrachte sog. syrische Manna war diese, die wohl auch MEGENBERG sah.
Die Stammpflanze, Alhagi Maurorum TOURNEF. (Dc.) (Hedysarum Alhagi L., Alhagi manniferum DESV., Alhagi camelorum FISCHER), eine Papilionacee, wird überall in Persien, besonders in Khorâsan, als Kamelfutter benutzt, daher Kamelsdorn. Das Manna schwitzt, wie es scheint, nur unter besonderen Bedingungen (nach größerer Hitze? auf besonderen Standorten?) als ein süßes Exsudat in Tröpfchen aus. Denn trotz der weiten Verbreitung der Pflanze, die auch in Afghanistan, Belutschistan und Hindostan gefunden wird, kommt dieses Manna nur aus Nord-Persien (Taebris) und vom persischen Golf (Bender-Buschir), übrigens meist stark mit Früchten und Stielen vermischt, in den Handel (SCHLIMMER). Die Gegend von Ruikhaut in Persien ist durch dieses Manna berühmt (AITCHISON). IBN BAITHAR zitiert nach Ishak Ben Amrân: «Tarandschubin ist ein Tau, der vom Himmel fällt, der dem festen körnichten Honig gleicht und Honigtau genannt wird. Der chorasanische ist der häufigste, welcher auf den Baum Elhâdsch, welcher der Aakul Hedysarum Albagi ist, fällt. Er wächst in Syrien und Chorasân und trägt grüne Blätter und rote Blumen, die keine Früchte tragen. Der beste Honigtau ist der weiße von Chorasân kommende.» L. RAUWOLFF (I, S. 771) beschreibt das Manna, das er 1573 auf dem Bazar in Aleppo sah und den Baum, der es erzeugt.
MIR MUHAMMED HUSAIN gibt an, daß es in Khorasan, Mawarunnahi, Kurjistan und Hamadan gesammelt werde. Es bildet braune, trockene Klümpchen von unregelmäßiger Gestalt,[S. 132] die mit Pflanzenresten untermischt sind. Einige sind durchscheinend körnig, spröde, kristallinisch, andere zäh, weich, amorph (EBERT). Sie riechen bisweilen schwach sennaartig.
Dies Manna bildete das hauptsächlichste süße Abführmittel der alten persischen Ärzte und wurde wohl schon in Suśrutas als Hedysarum und von THEOPHRAST (Hist. plant. IV, cap. 4) erwähnt. Es dient noch jetzt in Persien als Abführmittel und kommt dort in grünlich-gelben Broten in den Handel. DYMOCK fand es 1891 in indischen Bazaren. LUDWIG fand in ihm c. 35,5%, EBERT 42% Rohrzucker und c. 20% Schleim. Daneben fand sich etwas Chlorophyll. Der unlösliche Rückstand betrug c. 32%. Er bestand aus Pflanzenresten (Dornen, Blättern, Blüten), Sand und (zugesetzter) fremder Stärke (EBERT). Die kristallinischen Stücke sind nahezu reiner Rohrzucker. Der Feuchtigkeitsgehalt schwankt (1,5–5,5%). VILLIERS fand darin Melezitose (C18H32O16.2 H2O), deren Darstellung daraus ALECHIN beschrieb. EBERT fand den Körper nicht.
Lit. Die Pflanze (zuerst?) im Botan. Lexikon Kîtab as-šaǧar (um 980). — EBERT, Beitr. z. Kenntn. einig. selt. Mannasorten. Diss. Basel 1908 (dort die Literat.). Derselbe auch in Zeitschr. d. Österr. Apoth. Ver. 46 und Apoth. Zeit. 1909. — POLAK, Persien 1865. — SCHLIMMER, Terminol. medico pharmac. Franc.-Pers. Teheran 1874. — LUDWIG, Bestandt. einig. Mannasort. d. Orient. Arch. d. Pharm. 1870. — VILLIERS, Bull. soc. chim. 27, p. 98. — FLÜCKIGER, Pharmakognosie (dort S. 31 weitere Lit.) — HEYD, Levantehandel. — HAUSSKNECHT, Arch. d. Pharm. 1870. — ALECHIN, Zeitschr. d. russ. chem. Ges. 21, p. 420.
Nach COLLIN (Journ. pharm. chim. 1890) werden in Persien zwei purgierende und fünf pektorale Mannen unterschieden. Eine Übersicht über persische und indische Mannen auch bei HOOPER, Pharm. Journ. 1890.
BOCCONE erwähnt in seinen Curiösen Anmerckungen 1697: Terengiebin (Alhagi), Chirchest (Xirquest, Xircest, Scirquest, Siracest), Guczangkemin, Men essemà (Men essalüa) und ein Manna aus der Feige, sowie das Mannagras und die Manna caccia Ungarns (Hermata chassa). — Vgl. ferner: VIREY, Sur la manne des Hébreux et les mannes divers de l’Orient. Journ. ph. 4 (1818), 120 (dort ältere Lit.). — MAIDEN, Vegetable exudationes. Scient. res. of the Elder Exploring Expedit. 1892.
b) Tabaschir.
Tabâshîr, Tabaxir, aus Tvak-Kshira (sansc. = Rindenmilch) korrumpiert, bei Suśrutas: tugâkshîrî — Vaṁça rocana, Báns lochan (hind.), Bambusmanna, Vanśa śarkarā = Bambuszucker (Saccharum bambusae), Vanśa karpura = Bambuscampher (Manna bombacina bei ALPINI?).
I. Tabaschir (I) findet sich an der Oberfläche der Halme einiger indischer Bambusarten, bes. Bambusa stricta ROXB. (Dendrocalamus strictus NEES), die in Zentral- und Südindien heimisch ist, in Form von stalaktitenähnlichen, gegen den Halm hin abgeplatteten weißen oder hellbräunlichen Stücken, die sich leicht und vollständig im gleichen Gewichte Wasser lösen und fast vollständig aus Rohrzucker bestehen (HOOPER), jedenfalls nur wenig reduzierenden Zucker enthalten. Die Asche beträgt 0,96%. Nur 0,77% einer FEHLINGsche Lösung reduzierenden Substanz ließen sich nachweisen.
Dies Tabaschir ist wohl (auch nach LIPPMANN) das σάκχαρον des DIOSKURIDES, das er «Honig des Zuckerrohrs» nennt und als durch Ausscheidung entstanden und dem Salze ähnlich beschreibt. Es war ein Handelsartikel der Westküste Indiens, besonders von Thana, wo es EDRISI (1135) traf. Ebenso kennt es IBN SINA, die Zollliste von Aden (I, S. 699) und GARCIA DA ORTA (I, S. 736). Es wird noch jetzt in der orientalischen Medizin benutzt, ist aber selten geworden. Auch die Pharmac. persica von 1681 (I, S. 808) führt dies Tabaschir auf.
II. Ein anderes Tabaschir (II) kommt im Innern der Halme der Bambusen vor. Es wird schon von IBN BAITHAR bestimmt von dem oben beschriebenen unterschieden. Es besteht fast ganz oder zum größten Teil aus Kieselsäure und Silikaten. FOURCROY und VAUQUELIN fanden darin 70%, INCE 86,39–91,69%, ROST VAN TONNINGEN 86,38%, THOMSON 90,5%, GUIBOURT 97,39% Kieselsäure, daneben Kalk, Kali, Natrium. Es enthält aber auch 4,25% Rohrzucker neben 2,6% Schleim (EBERT).
Die Beziehungen der beiden Tabaschire können wir uns so denken, daß ursprünglich in das Innere der Halme ein Gemisch von Silikaten und Zucker abgeschieden wurde, die zunächst in wässriger Lösung sich befanden. (Ich habe beim Anschneiden von Bambushalmen in Java[S. 133] oft im Innern eine beträchtliche Menge einer wässrigen Flüssigkeit gefunden.) Dann dialysierte besonders an den Knoten der kristallinische Zucker durch die Halmwand nach außen, wo er nur in der Trockenzeit sich erhielt und auskristallisierte, in der Regenzeit aber abgewaschen wurde und in der Höhle der Internodien blieb eine zuckerarme Lösung zurück, die die amorphen, kolloidalen Substanzen (Schleim und Silikate) enthielt (EBERT). Diese gab dann beim Eintrocknen das Tabaschir II. Das würde erklären, daß Tabaschir I seltener ist. (KOBUS, der auf LIPPMANNS Ersuchen vor einigen Jahren den Sachverhalt untersuchte, fand obige Theorie in Java nicht bestätigt.) Auch das Tabaschir II wird noch jetzt arzneilich benutzt. Aus der Literatur, mit Ausnahme der analytischen, ist selten klar ersichtlich, welches der beiden gemeint ist.
So würden denn SALMASIUS und HUMBOLDT Recht haben, die (entgegen der Meinung PEREIRAS) meinten, daß das σάκχαρον der Griechen der «Saft des Bambusrohres» gewesen sei (vgl. auch PEREIRAS Handbuch II, S. 26).
Lit. FOURCROY u. VAUQUELIN, Ann. du Museum VI, 1806 (amerikan. Tabaschir). — GUIBOURT, Hist. des drog. simpl. — THOMSON, Rec. of Gen. Science 1836. — ROST VAN TONNINGEN, Jahresb. d. Chem. 1860. — Pharmacographia indica. — WATT, Dictionary of the economic prod. of India. — HOOPER, Pharm. Journ. 1891 und 1900, 640. — INCE, Ebenda. 1896 (dort Analysen). — POLECK, Bambusa arundinacea, Pharm. Centrh. 1886 u. Zeitschr. d. Österr. Ap. Ver. 1887. — HUTH, Der Tabaschir in sein. Bedeut. für d. Bot. Mineral. u. Phys. Berlin 1887. — KURZ, Indian Forester I. — BRANDIS, Ebenda XIII. — EBERT, Beitr. z. Kenntn. selten. Mannasort. Diss. Zürich. 1908. — FLÜCKIGER, Zur Geschichte d. Tabaschir. Zeitschr. d. Österr. Apoth. Ver. 1887 u. Schweiz. Zeitschr. f. Pharm. 1859.
c) Californisches Manna.
Auch an einem anderen Grase, Phragmites communis, ist ein wohl durch Aphiden (WATSON) erzeugtes süßes Exsudat beobachtet worden (Pater PICOLO und ROSS BROWNE bei LLOYD), das als Californisches Manna bekannt ist. Es wird noch jetzt von Indianern gesammelt (LLOYD, Californian Manna. Amer. journ. pharm. 1897 (deutsch in Ber. d. pharm. Ges. 1897).
d) Blue Grass Manna.
Ebenfalls von einem Grase, und zwar von dem in Neusüdwales heimischen Andropogon annulatus FORSK., stammt das Blue grass Manna (BAKER and SMITH, Pharm. Journ. 1897).
e) Weidenmanna oder Bide Khecht.
Das Weidenmanna (Bide khecht, Bid chischt) wird im Spätsommer von den Blättern von Salix fragilis L. in Persien ausgeschwitzt und nördlich von Teheran in den Dörfern am Fuße des Elbrus (POLAK) oder dem Distrikt Cheriar (SCHLIMMER) gesammelt. Ein ähnliches Manna scheint auf Apfelbäumen, auf Pirus glabra und Salsola foetida vorzukommen.
Es bildet unregelmäßige weiße oder rote Stücke. Den EBERT 1908 vorgelegenen Stücken waren Rosenblätter und eine Ferulaceenfrucht beigemengt. HAUSSKNECHT sagt, es werde mit Mehl vermischt.
Es enthält in den reinsten Stücken 50% Rohrzucker. Daneben findet sich darin 17,5% Dextrose, 13,26% andere wasserlösliche Bestandteile. Der unlösliche Rückstand (Gips, Weizenmehl, Pflanzenreste) betrug 19,2%.
Ein ähnliches Manna liefert Salix tetrasperma in Indien. Dies enthielt 10% eines reduzierenden Zuckers (Pharm. Zeit. 1893, 548). Aus einem Bidenguébine wurde neben 12% Glukose ein der Saccharose ähnlicher Zucker (Bidenguebinose) isoliert. Über das andere Weidenmanna siehe weiter unten.
Lit. EBERT a. a. O. — FLÜCKIGER, Pharmakognosie. — LUDWIG, Arch. Pharm. 1870 (dort die ältere Lit.). — HAUSSKNECHT a. a. O. — HOOPER, Pharm. Journ. 1890.
f) Eichenmanna oder Gueze-elefi.
Das Eichenmanna, Vallonenmanna, Manna quercina oder quercea, Gueze-elefi (gezza, bei den Türken küdret halwa = Himmelssüßigkeit, daraus vielleicht Trehala korrumpiert) erwähnt schon THEOPHRAST (hist. plant. lib. 3). Es entsteht in Persien auf den Blättern und Fruchtbechern[S. 134] von Quercus Vallonea KOTSCHY und Quercus persica JAUB. ET SPACH (IBN BAITHAR nennt Q. coccifera = dschidár), angeblich durch die Blattlaus Coccus manniparus (?). Im August werden die Eichenwälder von diesen Blattläusen befallen, die Blätter bedecken sich mit einem feinen Mehltau, der zu sehr süßen wasserhellen Tropfen zusammenfließt, die abtropfend oft den ganzen Boden ringsum bedecken (HAUSSKNECHT). Dies auf die Erde fallende Manna scheint nicht gesammelt zu werden. Die Bewohner der Bergdistrikte sammeln vielmehr die von der Manna befallenen Blätter, wiegen sie fein und stellen aus der klebrigen Masse graugrüne, zähe, gut haltbare Klumpen dar. Andererseits tauchen sie die klebrigen Blätter auch in heißes Wasser, dampfen zum Sirup ein und verwenden diesen direkt oder dicken weiter ein, vermischen das Extrakt mit Mehl, streichen auf Leinwandstreifen und trocknen an der Sonne. Dies Produkt heißt Pekmes (HAUSSKNECHT). Es scheint auch vorzukommen, daß man die Blätter trocknet und das eingetrocknete, pulverig gewordene Manna abklopft (BERTHELOT, SCHLIMMER).
Die mit der Blattmasse vermischten Klumpen, wie es scheint die einzige in den Handel gebrachte Sorte dieses Manna, enthält (nach EBERT) 52,2% Rohrzucker (BERTHELOT fand in der von der Blattmasse befreiten Masse 61%), 19% Traubenzucker, 10,3% Schleim, 7,45% Feuchtigkeit und 10% Rückstand. (Darunter nur wenige Tierreste.) LUDWIG und FLÜCKIGER geben 48 resp. 90% Traubenzucker und keinen Rohrzucker an, doch sagt FLÜCKIGER nur, daß er rechtsdrehenden Zucker gefunden habe, den er nicht zum Kristallisieren bringen konnte. Dextrin, das BERTHELOT angibt, konnte er nicht finden. LUDWIG hat nur die Drehung des Auszuges bestimmt.
Lit. POLAK, Persien, das Land und seine Bewohner. 1865. — SCHLIMMER a. a. O. — EBERT a. a. O. — FLÜCKIGER, Pharmakognosie u. Arch. Pharm. 1872. — LUDWIG, Bestandt. einiger Mannasort. des Orient. Arch. Pharm. 1870 (dort die ältere Literat.). — HAUSSKNECHT, Mannasorten d. Orient. Ebenda 1870. — BERTHELOT, Ann. chim. phys. 3 ser. t. 67.
g) Schîr-Khist.
Bei AVICENNA: Szirchosta. Die Bezeichnung Schîr-Khist, Schir-Khisht, Shîrkhisht (= erhärtete Milch) ist ein persisch-indischer Kollektivbegriff für Manna überhaupt (Dict. econom. prod. Ind.), wird aber auch für eine besondere Sorte, nämlich das schon von IBN BAITHAR unter dem Namen Schîrschaschak als Husten- und Abführmittel erwähnte Manna benutzt, das in Herat, dem Elbrus und in Khorasan gesammelt wird (SCHLIMMER) und von der Amygdalacee Cotoneaster nummularia FISCHER ET MEYER (und von der Polygonacee Atraphaxis spinosa L.) stammt (HAUSSKNECHT).
Das von EBERT 1908 untersuchte Manna, das bestimmt von Cotoneaster stammte (HARTWICH), bildete grauweiße, bröcklige, von Kristallen durchsetzte Stücke von Erbsengröße und süßem, schwach mehligem Geschmack. Die beigemengten Pflanzenreste (Stücke der Stengel, Rinde, Kelche und Blättchen) waren von einem mehligem Überzuge bedeckt. Dieses Manna enthielt 12,9% Rohrzucker, 37,5% Glukose, 24,2% Schleim, 15,9% Feuchtigkeit. Es wird noch heute in Persien benutzt (POLAK). In dem in Indien viel benutzten Manna von Cotoneaster nummularia FISCH. ET MEYER, einem bis 14 Fuß hohen Strauche der Paropamisuskette und Khorasans, das im Juni durch Abschütteln der Zweige gesammelt und massenweise nach Persien und Indien exportiert wird (AITCHISON), fand HOOPER 8,3% Glykose, 4,1% Rohrzucker, gegen 50% Chirkhestit (C6H14O6 «dem Mannit und Sorbit verwandt», wahrscheinlich Sorbit, RABY). Da Schîr-Khist ein Sammelname ist (siehe oben) — bei IBN BAITHAR lautet der Sammelname Mann — ist es begreiflich, daß auch andere Mannaarten unter diesem Namen gelegentlich in den Handel kamen und kommen. So ist das Schîr-Khist von RABY, in dem er einen neuen, angeblich dem Sorbit ähnlichen Zucker, den Chirkhestit, sowie das Bidenguebin-(Bid-engebin?-) Manna, in dem derselbe die Bidenguebinose auffand, sicher von der obigen verschieden und wohl den Weidenmannas (s. oben S. 133) anzugliedern. Und auch das Schîr-Khist von LUDWIG, in dem dieser 17,8% linksdrehenden Zucker und 22,5% Stärke fand, muß ein anderes Produkt gewesen sein (Atraphaxis-Manna?). Atraphaxis-Manna erwähnt GARCIA DA ORTA unter dem Namen Xirquest, Xircast. Die Manna mastichina des PROSPER ALPIN war vielleicht Schîr-Khist.
Lit. POLAK a. a. O. — SCHLIMMER a. a. O. — HAUSSKNECHT a. a. O. — EBERT, Dissert. Zürich 1908. — RABY, Chirkhest and Bidenguebin. Ph. Journ. Transact. 19 (1889) p. 993. — LUDWIG a. a. O. — HOOPER, Pharm. Journ. 1890, 421.
[S. 135]
Weitere Mannaarten siehe unter den Trisacchariden, unter Mannit und Dulcit. Eine Liste der indischen Mannaarten in WATTS Dictionary. Eine Zusammenstellung der Pflanzen, die ein Manna liefern, auch in Chem. Drugg. 1890, 863. Eine ältere Monographie der Mannen gab CLAUDIUS SALMASIUS (Plinian. exercitation. Ultraject. 1689).
h) Tamarixmanna.
Das Tamariskenmanna (arab. Gazánjabín, pers. gazangabín — Ges-engebin, Gesendschebin, Gäzändjebîn, — in der Pharmacop. persica 1681 (vgl. I, S. 808): Guezengebin, umfaßte hier wohl mehrere Mannaarten; — bei ALPINI: Terengebil) wird von Tamarix gallica var. mannifera EHRENBERG (arab. asl, tarfá [so auch bei SERAPION], athel [bei AMRAN, I, S. 598], — pers. gaz — gaz angabin [oder ges-engebin] also = Tamariskenhonig; Tamariscus steht in der Alphita «arbor genestae s. miricae», I, S. 660) gesammelt und soll angeblich durch die Schildlaus Coccus manniparus EHRENB. erzeugt werden. Diese bis 7 m hohe Tamariske findet sich fast in ganz Persien (besonders häufig im Süden), dann in Afghanistan, Arabien, in der sinaitischen Wüste, Ober-Ägypten und Nubien. «Die glänzend weißen, honigdicken Tropfen dieser eigentümlich angenehm riechenden, wohlschmeckenden Tamariskenmanna träufeln in der Sonnenwärme des Juni und Juli von den obersten Zweigen herunter, werden in der Umgebung des St. Katharinenklosters am Sinai in lederne Schläuche gesammelt und seit Jahrhunderten (bereits ANTONIUS MARTYR, c. 570 n. Chr., berichtet davon) teils genossen, teils den Pilgern teuer verkauft, da die ganze Ernte im günstigsten Jahr nur 700 Pfund beträgt» (WELLSTED, FLÜCKIGER). BURKHART traf den Baum im Tale Scheikh und nur in diesem einen Tale Arabiens, durch das die Juden seinerzeit zogen, kommt er in größerer Menge vor. Das Manna wird vor Sonnenaufgang gesammelt, wenn es erhärtet ist, in der Sonne schmilzt es. Die Araber kochen es und seihen es durch ein Stück Zeug. Es ist schmutzig gelb, schmeckt süß und etwas gewürzhaft, hart wird es nie. In Persien scheint, jetzt wenigstens, Tamarixmanna nicht gesammelt zu werden. Tamarixmanna enthält 55% Rohrzucker, 25% Lävulose und 20% Dextrin (BERTHELOT).
Nach der gewöhnlichen Annahme, die sich auf die Ausführungen von RITTER, TISCHENDORF und EBERS stützt, soll dies das Manna der Bibel sein. Auch FLÜCKIGER nimmt dies an. Ich lasse die Frage offen (I, S. 490) und führe (a. a. O.) als möglich an, daß es sich um eine Flechte (vielleicht um die Mannaflechte Sphaerothallia esculenta) gehandelt haben könne. Ich stütze mich auf HAUSSKNECHTS Ausführungen, der bemerkt:
«Was nun die biblische Manna anlangt (d. h. Chlorangium Jussuffii LINK [Lecanora esculenta EVERSMANN, Lecanora desertorum KREMPELHUBER]), so kann ich mir darunter nur eine solche oder eine ihr doch ähnliche Flechte vorstellen, die auch das scheinbar Wunderbare in der biblischen Darstellung sehr gut erklärt. Etwas Übertreibung muß man den Orientalen zugute halten, behaupten sie ja doch noch heute, daß diese Manna vom Himmel falle. Daß die Juden ihre Manna nur am Morgen, wenn der Nebel verschwunden war, sammelten, ist klar, weil dann die durch die Feuchtigkeit angeschwollenen Flechten leicht sichtbar waren; nach längerer Einwirkung der Sonnenstrahlen aber (2. Mos. 16, 21) schmolz sie, was wohl eine falsche Übersetzung ist, es hätte heißen müssen: «verschwand sie», indem die austrocknende Flechte sich zusammenkrümmt und sich mechanisch mit Erde umhüllt (resp. nun zwischen den Steinen nicht mehr sichtbar ist. TSCHIRCH). Aus 4. Mos. II, 7–9 ersieht man, daß die Manna eine trockene, feste Substanz sein mußte, da sie in Mühlen gestoßen wurde. Daß die Manna sich nur in stets unkultiviert gewesenen Wüsten fand, wo sich Flechten in großer Menge bilden konnten, geht aus Josua 5, 12 hervor, weil dieselbe bei Annäherung an kultivierte Gegenden aufhörte. Daß die Flechte unausgetrocknet in großen Massen aufgehäuft, sofort sich erhitzen und verderben mußte, ist selbstverständlich. Auch die Geschmacksangabe der Bibel paßt nur hierher «wie Semmel mit Honig», obgleich es richtiger gewesen wäre, wenn diese Stelle mit «wie süßes Mehl» oder «wie süßes Brot» übersetzt worden wäre, denn die Semmeln kannten sie ja damals ebensowenig als heute. Da EHRENBERG Manna-Ausschwitzungen auf Tamarix in den Schluchten des Sinai beobachtet hat, so hat man seitdem allgemein und mit ziemlicher Bestimmtheit angenommen, daß diese auch die Manna der Juden gewesen sei. Allein die Eigenschaften dieser Manna widersprechen den Angaben der Bibel vollständig. Auch ist es gar nicht denkbar, daß die verhältnismäßig so geringe Ausschwitzung einem ganzen[S. 136] Heere zur Nahrung hätte dienen können. Bezieht man aber die Angaben auf diese Flechte, so kann man nicht umhin, nur in ihr die wahre Manna der Juden zu erblicken.»
Auch HENRY CASTREY (La Nature 1898) teilt die Ansicht, daß es sich um eine Flechte handle. Er nennt das «Manna der Juden» Sphaerothallia esculenta N. ab Es. und berichtet, daß noch heute die Araber, welche die Sandwüsten Arabiens durchqueren, diese Flechte, welche sich dort sehr häufig findet und nach jedem Regen große Haufen auf dem Sande bildet, zur eigenen Ernährung wie zum Futter der Kamele benutzen. Die erbsengroßen, auf dem Bruche mehligen Körner von ziemlich angenehmem, schwach süßem Geschmacke enthalten 14% Stickstoffsubstanz, 32% Kohlehydrate, 4% Fett, sind also wohl imstande eine Zeitlang als Nahrung zu dienen. Über einen neuerlich erfolgten «Mannaregen» bei Diabakr, bei dem die Flechte zu Brot von guter Beschaffenheit verbacken werden konnte, erhalten wir Nachrichten durch La Nature 1891.
Das oben erwähnte Chlorangium wird von den Persern gemahlen und zu Brot verbacken und ist auf den Bazaren in Isphahan unter dem Namen schirsad bekannt.
Die Auffassung, daß das Manna mit dem Tau vom Himmel falle, finden wir auch bei MESUE.
Mit der Tamarixmanna vielfach verwechselt wurde ein den gleichen Namen: ges-engebin (d. h. Tamarixmanna) tragendes Manna, das in Persien von Astragalus florulentus BOISS. ET HAUSSK., Astr. adscendens BOISS. ET HAUSSK. besonders im Westen von Ispahan gesammelt und viel benutzt wird. Es bedeckt wie ein Mehltau die Zweige und läßt sich abklopfen. Die beste Sorte trägt den Namen Ges Alefi oder Ges Chonsari. Es wird mit Mandeln, Pistazien, Gewürzen und Mehl zu eigenartigen, sehr beliebten Gebäcken verarbeitet (HAUSSKNECHT).
Dies Manna enthält 30,95% Dextrin, 17,93% Invertzucker mit überschüssigem Fruchtzucker, 10,71% Gemenge von Dextrin und Invertzucker (LUDWIG).
Lit. II. Mose 16 und IV. Mose 11. — Tamarix mannifera im Botan. Lexicon Kitâb aš-šaǧar (um 980). — ANTONIUS MARTYR, De locis sanctis cap. 39. — RITTER, Erdkunde von Asien XIV, 1846, 665–695. — TISCHENDORF, Aus dem heiligen Lande 1862. — EBERS, Durch Gosen zum Sinai 1872, S. 223–243. — FLÜCKIGER, Pharmakogn. — WELLSTEDT, London and Edinb. Phil. Mag. X 1837, p. 226. — BERTHELOT, Arch. Ph. 115 (1861) u. Jahresber. d. Chem. 1861, S. 751. — SCHWEIGG, Journ. 29. — DIERBACH, Magazin d. Pharm. 1826. — HAUSSKNECHT, Mannasorten des Orient. Arch. Pharm. 1870. — LUDWIG, Über d. Bestandt. einig. Mannasort. d. Orient. Ebenda. — STOLZE und ANDREAS, Handelsverhältnisse Persiens, Petermanns Mitt. Ergänzungsh. 77 (1885).
Über andere persische Mannaarten vgl. HAUSSKNECHT a. a. O. — POLAK, Persien 1865. — VAMBERY, Reise in Mittelasien 1865. — Ausland 1867, — Jahresber. d. Pharm. 1869, — Pharmacographia p. 415.
Eine chem. Unters. der Mannaflechte bei CASTREY (Bull. gén. de Thérap. 138, 942, Pharm. Zeit. 1899, 238). — H. W. REICHARDT, Über die Mannaflechte Sphaerothallia esculenta NEES. Verh. Zool. Bot. Ges. 1864.
III. Rohrzuckerfrüchte.
Fructus Ceratoniae.
Syn. Johannisbrot, Sodbrot, Soodschote, Bockshörndl, — Siliqua dulcis — Caroube, Carrouge (franz.) — Locust been, Carob, St. Johns Bean or bread, Algaroba of Spain (engl.) — caroba, frutto del carubbio (ital.) — johannisbrood (holl.) — johanneksen leipä (finn.) — szentjánoskenyér (ung.) — κεράτιον (n.-griech.). — Kharnûb nûbti (ind.).
Der Name Carobe wird auch für andere Dinge benutzt, z. B. für die von Pemphigus cornicularius auf Pistacia Terebinthus erzeugten Gallen. Carobenblätter sind die Blätter einer Anzahl von Bignoniaceen (Jacaranda-, Bignonia-, Sparattosperma-, Kordelestris-Arten).
Etym. Die hieroglyphischen Inschriften nennen die Frucht der Ceratonia darouga, ouâh und djari. Die beiden ersten Worte bedeuten ursprünglich (nach LORET) einen gekrümmten Gegenstand mit spitz zulaufenden Enden (wie das Mondhorn = κρέας), besonders eine Schote (κεράτιον); der dritte bezeichnete die süße Pulpa der Frucht darouga hat die gleiche Wurzel wie die semitischen Worte quarouga und garouta (BUSCHAN).
[S. 137]
Johannisbrotbaum, weil sich nach der Legende Johannes der Täufer von den Früchten in der Wüste ernährte. (Man zeigt in Palästina sogar den Baum!) Der Ausdruck Johannisbrot findet sich (zuerst?) im Inventar der Ratsapotheke Braunschweig 1522.
Ceratonia (so bei GALEN) von κερωνία, ion., sonst auch κερατεία, die Frucht in der Bibel: κεράτιον; auch DIOSKURIDES schreibt: κεράτια, vielleicht von κέρας Horn, wegen der Form der Frucht, neugriech. ξυλοκερατέα, — pers.: charnûb, arab.: charrûb (bei IBN BAITHAR: chirnub), davon ital. carrobo, carruba, span. garrobo, algarobbo, port. alfarroba, franz. caroube, carouge. Im Albanes.: tšotšobanuze (= Ziegenhorn). Bei PLINIUS (XIII, 8): Siliqua, quam Jones cerauniam vocant; bei COLUMELLA: Siliqua graeca; bei SCRIBONIUS LARGUS: S. syriaca — Siliqua vielleicht aus λόβος (Wickenfrucht) umgebildet und übertragen (KOCH) —; Siliqua dulcis zuerst bei PROSPER ALPIN (De plant. aegypt. 1591); bei CORDUS findet sich: Fructus ceratoniae, Xyloceratia, Xylocaracta. Auch im Nördlinger Register steht Xilo caracta (Siliqua dulcis).
Ceratonia Siliqua.
A blühender Zweig, B männliche Blüte, C hermaphrodite Blüte, D Längsschnitt durch dieselbe mit dem hutförmigen Discus, E Hülse, F Längsschnitt durch die Basis derselben, G Längsschnitt und H Querschnitt durch den Samen.
[Nach Taubert in Engler-Prantl, Pflanzenfam.]
Stammpflanze. Ceratonia Siliqua L. (LINNÉ, Syst. veget. ed. XIV, 1167, 1), Johannisbrotbaum, Johannsbrodbaum und Judasboom (mhd.) — Caroubier.
Systemat. Stellung. Leguminosae, Caesalpinioideae — Cassieae.
Beschreibung. Der Johannisbrotbaum besitzt paarig-gefiederte Blätter mit lederartigen, wenigjochigen Blättchen und sehr kleinen Nebenblättern. Er ist polygam[S. 138] diöcisch. Die Blüten stehen in seitlichen kurzen, gebüschelten Trauben (PLINIUS sagt, die Ceratonia trägt ihre Früchte am Stamm). Sie besitzen keine Corolle, sondern nur 5 kurze unscheinbare Kelchblätter, die männlichen Blüten fünf große epipetale Stamina und einen rudimentären Fruchtknoten, die hermaphroditen 5 kleine Stamina (Staminodien?) und einen großen gestreckten, kurzgestielten, in der Mitte eines hutförmigen, drüsigen Diskus inserierten behaarten Fruchtknoten mit kurzem Griffel, schildförmiger Narbe und zahlreichen Ovulis (Fig. 44).
Die Frucht ist eine Hülse, ein Legumen. Daher ist die Bezeichnung Siliqua (d. h. Schote) dulcis falsch und irreführend. Sie stammt aber aus dem Altertum, wo man nicht zwischen Hülse und Schote unterschied, überhaupt nicht differenzierte. Übrigens spricht man auch heute noch fälschlich von Vanilleschoten, Hülsenfrüchten und unsere «Schote» (Pisum) ist bekanntlich auch eine Hülse.

Ceratonia Siliqua mit Früchten.
[Nach Hamilton.]
[S. 139]
Die Früchte hängen in großen Büscheln an den Zweigen. Ein alter Baum (Fig. 45) vermag Tausende von Kilogramm Caroben zu liefern.
Der Baum ist in Syrien und Palästina heimisch, nicht in Ägypten und Griechenland, auch nicht in Arabien (SCHWEINFURTH), kam aber frühzeitig nach Ionien, Knidos, dem südwestlichen Kleinasien und Rhodus (THEOPHRAST, PLINIUS). Seine nördliche Grenze fällt jetzt etwa mit der der Citronen und Orangen zusammen (HEHN). Er ist empfindlicher als die Olive. Das südlichste Vorkommen ist Yemen. Jetzt ist er vielfach verwildert (in der Kyrenaica, Algier, Sicilien usw.).
Lit. BONZOM, DELAMOTTE et RIVIÈRE, Du Caroubier et de la caroube. Paris 1878. — TAUBERT in ENGLER-PRANTL, Pflanzenfam. III (Abbild.). — G. BIANCA, Il carrubo, Monogr. storico-botan-agrar. L’Agricoltura italian. VII 1881. — HAMILTON, Botanique de la bible 1871. — Abbild. eines Caroubier auch in La Nature 1902, 316.
Pathologie. Auf den Blättern von Ceratonia Siliqua kommen mehrere Pilzarten aus den Gruppen der Pyrenomyceten und Imperfekten vor, es ist auch nicht ausgeschlossen, daß dieselben auch auf die jungen Früchte übergehen, doch sind Angaben hierüber nicht bekannt geworden (ED. FISCHER).
Kultur. Der Johannisbrotbaum, der in das Mittelmeerdrogenreich gehört, ist ein ziemlich hoher, weit ausgebreiteter, reichlich schattenspendender, immergrüner Baum (Fig. 45), der die Meeresnähe liebt. Er wird sehr oft Jahrhunderte alt, wächst langsam und trägt meist erst mit 20 Jahren Früchte. Behufs reichlicher Fruchtbildung muß er (wie Ölbaum und Weinstock) beschnitten und am besten auch künstlich befruchtet werden. Meist besorgt jetzt der Wind die Befruchtung und es ist bekannt, daß aus gewissen Gegenden (offenbar solchen, wo männliche Bäume reichlich wachsen) wehende Winde den Fruchtertrag steigern. Erst neuerdings erhält man die männlichen Bäume, die von den Bauern Siciliens früher vernichtet oder nur zum Pfropfen benutzt wurden. Sein Anbau reicht nicht sehr weit zurück. Erst PALLADIUS (I, S. 574) beschreibt Anbau und Fortpflanzung in Italien (späteres Einschiebsel? HEHN). Die Araber gaben der Kultur ihre heutige Verbreitung über Spanien, Süditalien, Apulien, Sicilien, Sardinien, Griechenland und die Inseln. Er wird jetzt auch in Indien (Panjab, Madras) kultiviert (O’CONOR 1876). Er wurde dort 1840 durch ROYLE eingeführt.
Die Kultur hat zahlreiche Varietäten ausgebildet, die sich durch ihre Süßigkeit, die Größe der Früchte, das Aroma, die Haltbarkeit unterscheiden. Durch Pfropfen wurde in Cypern, Chios und Candia eine große, fleischige, sehr süße Sorte erzielt (FLÜCKIGER).
Produktion und Handelssorten. Hauptsächlicher Lieferant der Caroben ist seit mindestens 6 Jahrhunderten Cypern, das jährlich viele Millionen kg verschifft, teils vom Cap Karrubieh, unweit Larnaka an der Südküste, teils von Limasol im Westen und Cerigna im Norden, dann auch aus Mazota und Lefkara.
Als beste gelten die ebenfalls in beträchtlicher Menge versandten italienischen, speziell die von Sicilien (Avola), von Bari (Puglia), Mola und die sog. Honig-Caroben. Auch die Levante, Kleinasien, Candia und Spanien liefern viel. Als die zuckerreichsten gelten die aus dem Küstengebirge von Algarve.
In Bari heißen die schlechten Sorten Caballo.
Die Gesamtproduktion wurde 1895 auf jährlich c. 10 Mill. kg geschätzt. 1910 war sie höher. Haupthandelsplatz für Caroben ist wohl Triest.
Handel. Deutschland importierte 1909: 37393 dz Johannisbrot, vorwiegend aus Cypern, Malta, Gibraltar, etwas auch aus Italien. Hamburg importierte 1908 24689 dz Johannisbrot;[S. 140] davon aus Cypern 18878, Italien 2130, Griechenland und den Jon. Inseln 1690, der europäischen Türkei 921. Italien exportierte 1907: 109269, 1908: 77645, 1909: 73331 Quint. Carrube. Von Bari, einem großen Carobenhandelsplatz, gehen ganze Schiffsladungen nach Rußland. Frankreich importierte 1908 232147 Quintal. Carrobe (carouge), besonders aus der Türkei, aber auch aus Algier und Tunis.
Ceratonia Siliqua.
Querschnitt durch die Frucht. MC. Mesokarp, EC. Endokarp, End. Endosperm, Cot. Cotyledonen, R. Radicula.
[Tschirch]
Ceratonia Siliqua.
Längsschnitt (parallel der Fläche der Frucht) durch die Lücken in den Randwülsten der Frucht.
[Tschirch.]
Beschreibung der Droge. Die zur Reifezeit tief braunvioletten Früchte sind besonders in jungen Stadien etwas hornartig gekrümmt (wohl darnach κεράτια s. oben auch in Bockshörndl und dem albanesischen Worte (s. oben) wird auf Horn angespielt). Sie reifen nicht immer. Sie sitzen einem kurzen Stiele auf und erreichen bisweilen eine Länge von 25 cm und eine Breite von 4 cm, variieren übrigens in der Größe sehr, je nach den Kulturvarietäten. Die Spitze, als kleines Zäpfchen erscheinend, ist etwas seitlich gegen die Bauchnaht herabgedrückt. Die Mitte ist beiderseits vertieft und zeigt zierliche, in gegen den Rand konvergierenden Fächerstrahlen (Fig. 44 E und 47) vom Stiele her aufsteigende Linien. Der Rand ist beiderseits wulstig verdickt und jeder der Wülste durch eine Mittelfurche geteilt, so daß der Querschnitt hantelförmig erscheint (Fig. 46). Der einen Furche entspricht die Bauchnaht, der andern die Rückennaht. In diesen Randwülsten liegen vier Reihen von Höhlungen. Schneidet man daher die Wülste parallel der Breitseite der Frucht an, so sieht man in jedem Wulst eine Reihe von ovalen, übereinander angeordneten Höhlungen mit ziemlich glatten Wänden (Fig. 47). Dort, wo die Samen liegen, ist die Mittelfläche etwas, aber meist nicht stark aufgetrieben. Dies tritt an jungen unentwickelten Früchten noch deutlicher hervor. Die Samen sind zahlreich, bis 15; sie liegen in ovalen, glatten, vom Endocarp ausgekleideten Höhlungen ziemlich dicht übereinander. Die Brücken zwischen ihnen sind nur schmal. Nicht immer sind alle gut entwickelt. Sie sind glatt, rotbraun, glänzend und mit einem ziemlich langen Funiculus an der Bauchnaht inseriert (Fig. 44 F). Sie enthalten, in ein helles Schleimendosperm eingebettet, den gelblichen Keimling, der zwei netzaderige Cotyledonen besitzt (Fig. 44 F, G, H u. 46).
Die Frucht bricht glatt, trotzdem sie sehr faserig ist. Der Querbruch erscheint infolge des Zuckerreichtums glänzend.
[S. 141]
Schädlinge. In den Früchten findet sich bisweilen die Larve von Myelois Ceratoniae.
Ceratonia Siliqua. Querschnitt durch die Randschicht der Fruchtwand.
[K. H. Hällström gez.]
Anatomie (Fig. 48 u. 49). Das Epicarp ist eine einreihige Epidermis, deren Zellen außen stark verdickt und cuticularisiert sind. Von der Fläche gesehen sind sie gradwandig polyedrisch, 12–30 mik. breit. Sie enthalten einen braunen Inhaltskörper. Einige Spaltöffnungen sind über die Epidermis regellos verteilt, ebenso einige wenige Haare oder, da diese oft abgebrochen sind, deren Fußteile (VOGL). Die Behaarung wechselt sehr. Bisweilen fand ich gar keine, dann wieder viele und lange. Dann folgt das Mesocarp. Unter der Epidermis liegen zunächst etwa 6–8 Reihen parenchymatischer, mit braunem, phlobaphenartigem Inhalte vollständig erfüllter Zellen (Fig. 48, 2). Dann folgt ein unvollständiger gemischter Ring. Derselbe besteht vorwiegend aus reichgliederigen Bastzellgruppen, denen da und dort Brachysklereïden angelagert sind. Die Bastzellen sind ziemlich lang (nach MÖLLER fast 1 mm, nach VOGL sogar bisweilen über 1,5 mm, und c. 18 [10–30] mik. breit), stark verdickt, mit meist stumpfen oder knorrigen Enden und nur wenig schiefgestellten Spaltentüpfeln versehen. Die Bastzellgruppen sind von Kristallkammerfasern begleitet. Die Kristalle stecken in einer Tasche. Dann folgt ein lockerer Kreis kleiner, im Längsverlauf bogig hin und her gekrümmter Bündel mit nicht sehr weiten, meist zu einer radialen Platte vereinigten Spiral-, Netzleisten- oder Tüpfelgefäßen.
Ceratonia Siliqua. Querschnitt durch den innersten Teil der Fruchtwand, dort wo ein Same liegt.
[K. H. Hällström gez.]
Soweit diese Bündel reichen, ist das Grundparenchym engzellig. Innerhalb des Gefäßbündelkreises wird es aber ziemlich unvermittelt weitzellig und die großen Zellen[S. 142] strecken sich sehr entschieden radial. In dieser Ausbildung reicht das Gewebe bis zum Endocarp. Die Zellen dieser Mittelschicht (Fruchtmus, Fig. 48, 5) enthalten (unter Alkohol betrachtet) entweder deutliche Kristalle oder unregelmäßig eckige Massen (von Zucker?). Diese Inhaltsbestandteile lösen sich daher meist in Wasser und es bleibt körniges Plasma zurück. Eingestreut in dies zuckerführende Gewebe finden sich sowohl in den äußeren kleinzelligeren als auch den inneren großzelligen Schichten zahlreiche Gerbstoffzellen, einzeln oder zu vielgliedrigen Gruppen vereinigt, in Form und Größe dem Zuckerparenchym gleichend. Sie enthalten neben anderen Substanzen vornehmlich Gerbstoff — man kann sie daher als Gerbstoffschläuche betrachten. In der frischen Frucht erfüllt die Masse die ganze Zelle. Beim Trocknen löst sich der solide Gerbstoffkörper als faltiger Sack von der Zellwand ab. Dadurch kommt dann ein sehr eigentümliches mikroskopisches Bild zustande. Die Inklusen fallen leicht aus den Zellen heraus und sind isotrop und nicht hohl, sondern solide (TICHOMIROW), aber nicht gleichartig in der Masse: in eine dunklere, gelatineartige Grundmasse ragen vom Rande her hellere, kugelige Gebilde (Fig. 50). Diese «Inhaltskörper», «Inklusen», sind von gelber, kupferroter oder violettroter Farbe, oft quergestreift. Sie werden durch Kali graublau bis violettblau, beim Erwärmen sofort tiefblau (die Färbung mit Kali ist abhängig von der Konzentration, Lauge von 25% und mehr färbt reinblau, schwache [bis 5%] rötlich-violett; dazwischen entstehen Mischfarben, HÄLLSTRÖM), durch Eisenchlorid violettblau bis tiefblau, fast schwarz, durch Jod und Jodschwefelsäure gelb, durch Vanillinsalzsäure rot (WINCKEL), durch Eau de Labaraque gelblich-rot (TICHOMIROW), durch Millons Reagens blaugrün, durch Orceïn rubinrot, durch Ammonmolybdat und Schwefelsäure tiefblau, mit Osmiumsäure blauschwarz (HARTWICH und WINCKEL). Sie sind unlöslich in Wasser, Alkohol, Glycerin, Äther, verdünnten Säuren, fetten und äther. Ölen. Ammoniak färbt sie nicht. Starke Lauge bewirkt ein Hervorquellen blauer Tropfen (FLÜCKIGER). Der blaue Farbstoff ist in Alkohol und Äther unlöslich. Woraus die Masse besteht ist unbekannt. Sie scheint ein Phloroglukotannid zu enthalten. Die Inklusen werden sehr frühzeitig angelegt, schon 1 cm lange Früchte enthalten einige fertig ausgebildet, viele in Bildung begriffen. Schon in ganz[S. 143] frühen Stadien färben sich die Zellen mit Eisenchlorid, Osmiumsäure und Vanillinsalzsäure. Die Entwicklung des Inhaltes scheint zentripetal vor sich zu gehen. In jungen Inklusenzellen findet sich ein feines, gegen Kali resistentes Gerüst. Doch gibt dieses nicht die Kali- und Eisenreaktion, auch Jod und Millons Reagens färben es nicht, wohl aber Methylenblau (HÄLLSTRÖM). In den äußeren Schichten sind die Gerbstoffsäcke klein, in den inneren groß, wie das Parenchym.
Ähnliche Inklusen finden sich bei der Dattel (s. d.) in den Kakifrüchten u. and. Diospyrosarten, bei Anona reticulata, Zizyphus vulg., Elaeagnus angustifol. (TICHOMIROW), in den Fruct. Rhamni cathartic. und den blauen Trauben, sowie in der Fruchtschale von Glycyrrhiza glabra (STSCHERBATSCHEFF). Sie wurden von FLÜCKIGER bei Ceratonia aufgefunden (Pharmakogn. I. Aufl.) und sind hier so charakteristisch, daß man an ihnen eine Beimengung von Caroben oder Carobenkaffee überall, besonders nach Zusatz von Vanillinsalzsäure, leicht erkennen kann.
Die innerste Zone des Mesocarps ist oft kollabiert (Fig. 49, 7). Die leeren Randwulstlücken (s. oben) scheinen durch Schwinden des Gewebes zu entstehen. Jungen Früchten fehlen sie.
Das Endocarp besteht vornehmlich aus stark in tangentialer Richtung gestreckten, stumpfendigen Bastzellen mit dicker Wand und longitudinalen oder sehr steil schiefgestellten Spaltentüpfeln. Diese Bastzellen verlaufen parallel der Kontur der Hohlräume, in denen die Samen liegen, nicht immer gerade, sondern oftmals gekrümmt und zu federnden Verbänden vereinigt, also anastomosierend. Sie werden begleitet von Schleimzellen, kristallführenden Zellen (Kristallkammerfasern) und einigen wenigen Sklereïden (Fig. 49, 8). Innerhalb dieser Hautschicht liegt noch eine mehrzellige Zone rundlichen Parenchyms (Fig. 49, 9). Diese Schicht verschleimt. An den Stellen, wo keine Samen liegen, berühren sich die Ränder der Fruchtwand für gewöhnlich und an den Seiten liegen hier eigenartige Haare (HÄLLSTRÖM).
Die Samenschale besteht aus einer c. 150 mik. hohen Palisadenschicht, deren 4 mik. breite Lichtlinie 55 mik. unter der derben Cuticula verläuft. Die Außenwand der Palisadenzellen ist auf eine Strecke von 45 mik. außerordentlich stark verdickt, das Lumen der Palisaden selbst als feiner Spalt nur wenig über die Lichtlinie hinaus zu sehen. Die T-Trägerzone ist schmal, die Nährschicht dagegen breit und von zahlreichen Schichten kollabierter Zellen gebildet.
Die Inklusen der Frucht von Ceratonia Siliqua.
x Querdurchschnitte, die übrigen in Aufsicht oder längsdurchschnitten.
[Tschirch.]
Das breite Schleimendosperm enthält stark verdickte Zellen mit gestrecktem oder sternförmigem Lumen. Die Interzellularsubstanz (Mittelplatte, primäre Membran) der Zellen ist erst auf Zusatz von Reagentien und auch dann noch nicht immer deutlich zu[S. 144] sehen. Sie wird wohl in die Schleimmetamorphose einbezogen. Die sekundären Membranverdickungsschichten sind Schleimmembranen, die tertiäre Membran besteht aus Zellulose; nur diese färbt sich mit Jodschwefelsäure blau. Der Schleim, der hier den Charakter eines Reservestoffes trägt, verdankt also auch hier den sekundären Verdickungsschichten der Membran seine Entstehung und gehört zu den echten mit Jod oder Jodschwefelsäure sich nicht bläuenden Schleimen und zur Klasse der Zellulosine. Im Inhalte der Schleimendospermzellen findet sich Eiweiß und fettes Öl.
Die Cotyledonen enthalten gegen Wasser sehr resistente Aleuronkörner. Die palisadentragenden Seiten liegen aufeinander. Procambiumstränge durchziehen den mittleren Teil der Keimblätter.
Lit. FLÜCKIGER, Pharmakognosie I. Aufl. (hier die Gerbstoffsäcke zuerst erwähnt). — VOGL, Nahrungs- u. Genußmittel 1899. — J. MOELLER, Mikroskopie. — FISCHER-HARTWICH, Handb. d. pharm. Praxis. — HARTWICH und WINCKEL, Arch. Ph. 1904, 471 und WINCKEL, Über d. angebl. Vorkomm. d. Phloroglucins in d. Pfl. Diss. Bern 1904. — TICHOMIROW, Die johannisbrotartigen Interzellular-Einschließungen im Fruchtparenchym mancher süßen Früchte usw. Bull. soc. imp. d. Natural. Moscou 1905. Derselbe: Bot. Jahresb. 1884. — K. H. HÄLLSTRÖM, Zur Entwicklungsgeschichte der Fruchtwand von Ceratonia Siliqua L. und Tamarindus indica L. Ber. d. pharm. Ges. 1910. — STSCHERBATSCHEFF, Arch. Pharm. 1907.
Chemie. Die Früchte enthalten bis 32% Saccharose und c. 18% Glukose (HECKEL und SCHLAGDENHAUFFEN). Den Rohrzucker, der bisweilen in den Samenfächern und den Randhöhlen auskristallisiert gefunden wird, erkannte schon BERTHELOT (1859) —. Der Zuckergehalt schwankt nach den Sorten (in den Analysen von FÜRSTENBERG, ANDERSON, VÖLCKER wird der Zucker auf 51,4–70,7% angegeben). BALLAND fand in Candia Caroben 21,74% Saccharose und 21,36% Glukose, in Zypern Caroben 28,57 S. bzw. 14,53% G., in Creta Caroben 8,20 bzw. 26,04%, in Griechischen Caroben 29,4 bzw. 10,28%, in Mersina Caroben 27,10 bzw. 12,75%, in Portugal Caroben 15,76 bzw. 21%. Ferner ist nachgewiesen: Wachs, 1,82% Gerbstoff, Pektin. Die Rohfaser beträgt 34%. REINSCH gibt an, daß die Fruchtschalen allein enthalten in Prozenten: 12 Wasser, 6,2 Faser, 41,2 Zucker, 20,8 Eiweiß und Pflanzenleim, 10,4 Gummi, 7,2 Pektin, 2 Gerbstoff. Die Samen allein: 44,8 Schleim, 33,7 Eiweiß, Gummi, Faser, 8 Stärke (?), Gerbstoff und Leim, 2,1 Zucker, 1,5 Öl. Neuere Untersuchungen haben den Zuckergehalt der Samen bestätigt (BOURQUELOT, SCHULZE und FRANKFURT). Man fand 0,11% reduz. Zucker und 1,58% Rohrzucker. Der Wassergehalt wird auf 14,96–23,8% angegeben, das Fett auf 0,55–1,28%, die Asche auf 2,3–2,53%. Der Pentosangehalt beträgt c. 4,45% (WITTMANN).
Der sehr charakteristische Geruch wird durch etwa 1,5% Fettsäuren, besonders Buttersäure, bedingt. Auch Ameisensäure ist darin nachgewiesen. GRÜNZWEIG zeigte, daß die von REDTENBACHER in den Caroben aufgefundene Säure, die MARSSON daraus darstellen lehrte, Isobuttersäure: (CH3)2=CH.COOH, ist. Der Gehalt daran variiert nach dem Alter und der Aufbewahrung. Feuchtgehaltenes Johannisbrot enthält mehr davon. Junge Früchte riechen nicht nach Buttersäure. Dieselbe entsteht also erst im Reifungs-, bes. im Nachreifungsprozeß, wohl durch Buttersäuregärung des Zuckers unter dem Einfluß eines spezifischen Fermentes oder eines dem Protoplasma zugehörigen Enzyms. Die Buttersäure wird von Capronsäure, Ameisensäure (und Benzoësäure? Grünzweig) begleitet. Bei der Gärung der Caroben erhielt BEISSENHIRZ Bernsteinsäure (1818).
[S. 145]
In unreifem Johannisbrot, das sehr herbe schmeckt, fand ROSENTHALER ein kristallinisches Phenol und einen Körper mit Alkaloidreaktionen.
In Carobenkaffee (s. hinten) wurde 44,2% Zucker, 2,4% Asche (in Wasser löslich 1,9%) gefunden. Die Extraktmenge schwankt: 46,9% (VOGL), 63,71% (KÖNIG). KÖNIG gibt an in Prozenten: Wasser 6,72, Stickstoffsubstanz 8,72, Ätherextrakt 3,51, stickstofffreie Extraktstoffe 70,81, Rohfaser 7,65, Asche 2,59, Wasserextrakt in der Trockensubstanz 58,13.
Das Pericarp macht 88–90, die Samen 10–12% der Frucht aus.
In den Samen fand EFFRONT 11,4% Wasser, 18,92% stickstoffhaltige Substanzen, 62% Kohlehydrate, 2,3% Fett. Sie enthalten das Kohlehydrat Carubin (C6H10O5), das RITTHAUSEN bereits 1867 im Roggenmehl und in der Kleie gefunden und Secalin (Secalan) genannt hatte. Carubin wird durch das ebenfalls in den Samen nachgewiesene hydrolysierende Enzym, die Carubinase, in Carubinose, einen mit Mannose identischen Zucker übergeführt. Das Carubin (EFFRONTS) ist ein Galaktomannan. Es liefert bei der Hydrolyse (neben wenig Galaktose) hauptsächlich d-Mannose (BOURQUELOT und HÉRISSEY). ⅘ des Samens bestehen aus diesem Galaktomannan, vorwiegend im Zustande von Hemizellulose, ein Teil des Mannans auch als Mannozellulose. Der Johannisbrotsame eignet sich zur Darstellung reiner krist. Mannose (EKENSTEIN). Es ist in ihm auch etwas Dextrozellulose vorhanden (BOURQUELOT).
Bei der Keimung entsteht in allen Teilen des Embryos ein diastaseartiges Ferment, welches aus der Hemizellulose Mannose und Galaktose bildet, daneben treten Pektasen auf.
Aus den von den Keimen befreiten Samen wird durch Ausziehen mit Wasser von 71–82° ein für Appreturen benutzter Klebstoff bereitet. Die Gewinnung dieses Tragasolgummi aus Johannisbrotkernen ist durch D. R. P. geschützt (Jahresb. d. Ph. 1907, 32), doch hatte schon GRIEUMARD 1834 für die Darstellung eines tragantähnlichen Gummis aus den Carobensamen ein Patent genommen.
In der Rinde von Ceratonia Siliqua fand MAFAT 50–55% Gerbstoff (sie dient als Gerbematerial).
Stamm und Blätter sollen bisweilen (in Sicilien) Zucker ausschwitzen (KLAPROTH).
Lit. KÖNIG, Nahrungs- u. Genußm. (dort die Analysen von FÜRSTENBERG, ANDERSON u. VÖLCKER). — Neuere Analysen in BALLAND, Analyses de caroubes de différentes provenances. Journ. pharm. chim. (6) 19, 1904, 569. — PROUST, Gehlens N. Journ. II (erste Analyse). — REINSCH, J. p. Ph. 1842, 401 und Chem. Centralb. 1857, 85. — VÖLCKER und KINSINGTON, Ebenda (u. Zeitschr. f. d. Landw. 1856). — BERTHELOT, Ann. d. chim. phys. 3 ser. 55, p. 269. Jahresb. d. Chem. 1858. — HECKEL und SCHLAGDENHAUFFEN, Rep. de pharm. 1892. — ROSSI, Estrazione dell’ alcool dalle carubbe Ann. scuol. sup. agric. Portici Napoli 1881. — REDTENBACHER, Lieb. Ann. 57, 177. — GRÜNZWEIG, Lieb. Ann. 158, 117 u. 162, 193, Bull. soc. chim. (2) 16, 177. — MARSSON, Arch. Pharm. 48, 295. Vierteljahrsschr. über Fortschr. d. Nahrungs- u. Genußm. 1887, 450 (Analyse d. Frucht). — MAFAT, Pharm. Journ. 1892. — KLAPROTH, Du sucre du caroubier. Mém. Acad. royale. Berlin 1804. — ROSENTHALER, Über einen Bestandteil des unreifen Johannisbrotes. Arch. Pharm. 1903, 616. — MARLIÈRE, Sur la graine et specialement l’endosperme de Ceratonia Siliqua. La cellule 13, 7 (1897) (Pharm. Zeit. 1898, 396). — EFFRONT, Compt. rend. 125, 38, 116 u. 309 (1897), Journ. pharm. chim. 1897. — EKENSTEIN, Compt. rend. 125, 38, 116, 309 u. 719. — BOURQUELOT et HÉRISSEY, Compt. rend. 129, 228 u. 391 (1899) und Sur la composit. de l’albumen de la graine de Caroubier. Journ. pharm. chim. 1899, 153 u. 249. Germinat. de la graine de Caroubier, production de mannose par un ferment soluble. Ebenda 1899, 438.
[S. 146]
Verfälschung. Im Jahre 1888 wurde in London eine falsche Ceratonia beobachtet. Es waren die Früchte von Calliandra (Pithecolobium) Saman (vgl. Jahresb. d. Ph. 1888, 40).
Anwendung. Die reifen Früchte dienen in Südeuropa und im Orient Tieren (Schweinen, Pferden, Eseln) und Menschen der ärmeren Klasse (Schweinehirten, Eseltreibern), als Nahrungsmittel, besonders wenn sie vorher geröstet oder gebacken wurden. Der verlorene Sohn begehrte sich περὶ τῶν κερατίων zu nähren (Lukas 15). Die Kreuzfahrer unter RICHARD I. griffen 1191 erst bei Hungersnot zu den Caroben (FLÜCKIGER). Die unreifen galten bei den Alten als schädlich, ebenso die unangenehm riechenden Blüten. GALEN hält sogar die reifen Früchte für schädlich (?). Die Früchte waren ein alter Handelsartikel des ganzen Orients. DIOSKURIDES hält die frischen Früchte für purgierend, die trockenen für ein Diureticum. Die Caroben dienen jetzt nur noch als Expectorans, als Zusatz zu Brusttees.
Die Samen dienen in Fezzan als Gewicht (= 4 Weizenkörner). Sie wiegen etwa 0,18 g. Von κεράτιον wird gewöhnlich das Wort Karat (Einheit für Gold- und Edelsteingewicht) abgeleitet. Es scheint aber hier eine Verwechslung vorzuliegen mit dem Abrussamen (Jequirity), deren Name rati, ratti, kirat auch dem Worte Karat zugrunde liegen könnte und die auch dem Karat (= c. 0,205) als Gewicht für Gold und Edelsteine näher kommen. Denn, wie es scheint, wurde Karat zuerst in Indien als Diamantengewichtseinheit, dann erst in Afrika als Goldgewichtseinheit benutzt. Andere beziehen Karat auf die Samen von Erythrina abyssinica (= kuara) oder Acacia nilotica. Die Sache sollte einmal historisch-kritisch studiert werden.
Die süßesten Varietäten der Caroben werden im Orient ausgepreßt und der so gewonnene «Honig» zum Einmachen benutzt. Als Leckerei der Kinder findet man die Früchte überall. Die gerösteten Früchte sind, meist mit Feigenkaffee gemischt, ein Kaffeesurrogat (s. oben). (Analysen des Carobenkaffee bei KÖNIG.)
Die Araber machten aus Ceratoniafrüchten einen Roob (auch ALEXANDER TRALLIANUS [I, S. 591] gab eine Vorschrift zu einem solchen). Noch jetzt bereiten sie eine Limonade daraus und einen Sirup. In Portugal, auf den Azoren, in Italien und Triest werden die schlechteren Sorten auf Alkohol verarbeitet. Nach ROSSI soll man nach dreitägiger Gärung 25% des Gewichtes der Früchte Alkohol erhalten. Da und dort werden sie auch zum Saucieren des Tabaks benutzt.
Seit VÖLCKER sie als Viehfutter von neuem empfohlen, werden sie oft, auch bei uns, als Mastfutter (Zusatz zu Viehmastpulvern) benutzt.
Lit. ROSSI, Estrazione dell’ alcool dalle carrube. Ann. Sc. sup. d’agric. Portici Napoli 1881.
Geschichte. Der Johannisbrotbaum ist die κερωνία des THEOPHRAST, der ceronische Feigenbaum des PLINIUS. THEOPHRAST erwähnt Johannisbrotpflanzungen auf Rhodos. Seine Früchte hießen im alten Griechenland auf den Märkten ägyptische Feigen. Schon PLINIUS erklärt dies für eine irrtümliche Bezeichnung «non enim in Aegypto nascitur sed in Syria Ioniaque et circa Gnidum atque in Rhodo». Im alten Ägypten finden wir aber kaum Spuren von ihm (vgl. WÖNIG). Jetzt fehlt er dort ganz (ASCHERSON). Die Frucht aber kam frühzeitig von Syrien nach Ägypten und scheint in einem Grabe von Beni Hassan abgebildet zu sein (vgl. WÖNIG). Ceratonia hieß im Ägyptischen w’n, doch wird die Deutung bestritten. JOACHIM führt C. entgegen LIEBLEIN im Papyrus Ebers nicht an. In Kleinasien und Syrien genießt der Baum noch heute religiöse Verehrung. Er ist dem heil. GEORG geweiht (HEHN). BIANCA hält Ceratonia für einen der Lotos der Alten (THEOPHRAST, hist. plant. IV, 3; vgl. auch I, S. 1070 und oben S. 61). In dem Alfabet des BEN SIRA (XI. Jahrh., die Pflanzenliste selbst älter) wird unter den Pflanzen des königlichen Gartens des NEBUKADNEZAR auch der Johannisbrotbaum (chārûbā) aufgeführt (IMMANUEL LÖW). — STRABON (I, S. 532) erwähnt Ceratonia. Bei den alten Juden, wie überhaupt[S. 147] in den Gegenden, wo der Baum gemein ist (Syrien) und die Früchte im April in Massen von den Bäumen fallen, waren sie von altersher Viehfutter. Im Gleichnis vom verlorenen Sohn (Lucas 15, 16) übersetzt LUTHER κεράτιον (in der Vulgata steht siliqua, bei ULFILAS haúrn, in der syrischen Übersetzung qĕratâ) mit Träbern. Diese falsche Übersetzung kam wohl daher, daß er für die harten, beim Auspressen der Früchte zurückbleibenden Teile der Frucht (Samen, Endocarp, Fasern) bei DIOSKURIDES den Ausdruck στέμφυλα fand (oder von gelehrten Freunden erfuhr), dieses aber auch die Trester der Weintrauben und Oliven bedeutet. LUTHER wußte offenbar nicht, daß nicht nur diese, sondern die ganze Frucht im Orient Schweinefutter ist und konnte dies auch nicht ahnen, da die Früchte im Norden eine Leckerei waren (MARTI meint, daß LUTHER vielleicht in Gedanken an den Relativsatz ὦν ἤσθιον οἱ χοῖροι den Ausdruck Träber gewählt haben könne).
Fruct. und Sem. Siliquastri finden sich in der Taxe von Nordhausen 1657 (weitere Nachweise oben unter Etym.).
Lit. FLÜCKIGER, Pharmakognosie III. — HEHN, Kulturpflanzen usw. — WÖNIG, Pflanzen Ägyptens. — DE CANDOLLE, L’origine des plantes cultiv. — IMMANUEL LÖW, Aramäische Pflanzennamen.
2. Trehalosegruppe.
Trehala-Manna.
Die Trehala oder Tricala (arab. scheker al aschaar, pers. scheker thigal oder tighal = Tierzucker, Nesterzucker) besteht aus den eigentümlichen Cocons, die die Larve eines Rüsselkäfers, Larinus maculatus FALDERMANN (nach FRAUENFELD, pers. Gūldigūl; — Larinus nidificans nach GUIBOURT), der zu den Curculioniden gehört, in den Stengeln und Blütenköpfen verschiedener Echinopsarten, bes. Echinops persicus FISCH. erzeugt. Diese Cocons, die vorwiegend an den Stielen der Blütenkörbchen zu sitzen scheinen, sind rundlich-oval, 18–20 mm lang, gelblich-weiß, außen höckerig, innen glatt. Sie schmecken fade süßlich und kommen aus den unbebauten Steppen von Teheran und Kuum, sowie dem westlichen Persien (HAUSSKNECHT).
Sie enthalten nach EBERT (1908) 17,5% Trehalose (nach APPING 23,84, nach GUIBOURT 28,8%), ferner 27,08% Schleim (nach APPING 18,58%) und 31,75% (nach APPING 24,9%) mit Jod sich rotviolett färbende Amylodextrin-Stärke (sog. rote Stärke), die wohl aus der Pflanze stammt. Die Asche beträgt 2,6–2,8%.
Die Trehala ist lange bekannt. Sie wird z. B. in der persischen Pharmakopoëe von 1681 (I, S. 808) beschrieben.
Trehalose (C12H22O11.2 H2O) ist identisch mit Mycose, dem Pilzzucker, der zuerst von WIGGERS und MITSCHERLICH, dann auch von Müntz in Pilzen, die davon bis zu 10% der Trockensubstanz enthalten, aufgefunden wurde und wohl auch mit dem Tihalin. Sie schmeckt süß, dreht rechts: αD=199° (wasserfrei) und bildet rhombische Kristalle. Sie reduziert FEHLINGsche Lösung nicht.
Lit. GUIBOURT, Notice sur le Tréhala. Journ. pharm. 1858, Gaz. med. de Paris 1858 (Buchn. Repert. 1858, S. 413, Jahresber. d. Chem. 1858). — BERTHELOT, Trehalose. Ann. de chim. (3) 55, Gaz. med. de Paris 1857 (Buchn. Repert. 1858, S. 28). — HAUSSKNECHT, Arch. Pharm. 1870. — HANBURY, Zwei tierische Produkte Persiens. Buchn. Rep. 1859; Science papers p. 158 u. 159 (Larinus abgebildet). — APPING, Unters. über d. Trehala-Manna. Diss. Dorpat 1885 (dort die Lit.). — BÖNING, Unters. d. Inversionsprodukte der aus Trehalamanna stammenden Trehalose. Diss. Dorp. 1888. — A. REDLIN, Unters. über d. Stärkemehl u. d. Pflanzenschleim der Trehalamanna. Diss. Dorp. 1890. — DRAGENDORFF, Über Trehalamanna. Sitz. Ber. d. Dorp. Naturf. Ges. 1890. — WINTERSTEIN, Z. Kenntnis d. Trehalose, Ber. d. d. chem. Ges. 1893, 3094 und Zeitschr. phys. Chem. 19, 1894, 70 (dort die Lit.). — TICHOMIROW, Das Glykogen der Ascomycetenpilze in seiner Bezieh. zu der Trehalose. Arch. Pharm. 1908.
[S. 148]
3. Milchzuckergruppe.
Milchzucker.
Syn. Saccharum lactis — sucre de lait, sel de lait (franz.) — sugar of milk, milk sugar (engl.) — zucchero di latte (ital.).
Vorkommen. Der Milchzucker (Formel oben S. 114) ist zu c. 4–5% in der Kuhmilch enthalten. Der Gehalt ist von Rasse und Individualität, von der Dauer der Laktationsperiode, dem sexuellen Zustande, von der Art, der Menge und der Zusammensetzung der Nahrung, der Arbeitsleistung der Kuh, ihrer Pflege u. and. Umständen abhängig. Ferner sind auch tägliche Schwankungen und solche nach der Tageszeit zu beobachten (LIPPMANN).
Milchzucker, und zwar immer derselbe, findet sich aber auch in der Milch anderer Säuger, in der der Hunde (1–4%), Kaninchen (2%), Renntiere (2,5–3%), Ziegen (3,2–6,6%), Schafe (3,4–6,6%), Stuten (4,7–7,3%), Kameele (5–5,8%), Eselinnen (5,2–7,6%) usw. Auch Frauenmilch enthält Milchzucker (4–7,5, selten bis 8%). Frauenmilch ist also am reichsten an Milchzucker.
Gewisse Pflanzen (z. B. Galega officinalis) erhöhen die Milch- und Milchzuckerproduktion.
Über den Ort der Bildung des Milchzuckers im Organismus ist wenig sicheres bekannt. Nach BERT entsteht der Milchzucker in der Leber und wird durch das Blut in die Brustdrüse gebracht, nach CREMER bilden ihn die Brustdrüsen aus d-Glukose und d-Galaktose, welch’ letztere den schleim- und gummihaltigen Bestandteilen der Nahrungspflanzen entstammen soll.
Die Angabe BOUCHARDATS (Compt. rend. 73), daß Milchzucker auch im Pflanzenreiche und zwar in Achras Sapota vorkomme, hat keine Bestätigung gefunden.
Darstellung. Der Milchzucker wurde bis vor kurzem, besonders in einigen viel Milch produzierenden Schweizer Kantonen (Bern, Luzern, bes. Emmenthal, Berner Oberland, Simmenthal), aus dem Molken der Kuhmilch dargestellt, der als Nebenprodukt der Käsefabrikation nach Abscheidung des Caseïns mittelst des Laabfermentes erhalten wird. Man dampfte den geklärten Molken zur Sirupkonsistenz oder weiter ein und ließ erkalten, und erhielt so zunächst feinkörnigen, etwas gefärbten Rohzucker (Zuckersand, Schottensand), der dann in einigen Fabriken durch Klären und Entfärben der Lösung — auch wohl durch Ausfällen mittelst Alkohol raffiniert wurde. Vor den Käsereien und den Sennhütten sah man oft die Säcke mit Schottensand stehen, deren körniger Inhalt keineswegs angenehm duftete. Der Zuckersand ist ein gelbliches Pulver. FLÜCKIGER schätzte die Produktion der Schweiz 1888 auf 30000 kg. Seit 1910 ist dieser Fabrikationszweig in der Schweiz eingegangen, nachdem LÜDY (Burgdorf) 1909 noch 8000 kg Schottensand aufgekauft und im Ausland weiter verkauft hatte. Wegen der hohen Holzpreise (früher erhielten die Sennen das Holz gratis) ist die Fabrikation zu teuer geworden und die Sennen ziehen vor, die Schotte (den Molken) zur Schweinemast zu benutzen (LÜDY).
Jetzt wird Milchzucker in ziemlich beträchtlicher Menge in Mecklenburg (Güstrow, Gielow), Lauenburg und Berlin (Meierei Bolle), ferner besonders in Holland und etwas auch in Italien (Lombardei bei Lodi) dargestellt — stets nur in intensiv Viehzucht treibenden Gegenden. In größtem Stil fabriziert und exportiert Nordamerika. Der deutsche Export an Milchzucker betrug über Hamburg 1907: 84900, 1908:[S. 149] 142600 kg. Der meiste in Deutschland fabrizierte Milchzucker wird im Lande verbraucht — besonders für medizinische Zwecke. Der Import nach Deutschland ist wegen der hohen Zollansätze gering (s. unten).
Eigenschaften. Milchzucker kristallisiert schwer und setzt sich in festen Krusten an eingehängten Stäben — was in der Praxis exekutiert wird — in derben Kristallmassen ab. Man kennt vom Milchzucker ein Monohydrat, mehrere wasserfreie kristallisierte und vermutlich eine wasserfreie amorphe Form.
Der Milchzucker des Handels ist das Monohydrat C12H22O11.H2O, das in großen monoklinen Kristallen kristallisiert, schwach süß schmeckt, Tribolumineszenz zeigt, pyroelektrisch ist und sein Kristallwasser auch bei 24stündigem Erhitzen auf dem Wasserbade nicht abgibt. Milchzucker löst sich in 5,87 Teilen Wasser von 10° und in 2,5 Teilen von 100°, in starkem Alkohol und Äther ist er ganz unlöslich, auch in verdünntem Weingeist löst er sich nicht in bemerkenswerter Menge (Unterschied von Rohrzucker und Dextrin). Milchzucker verhindert die Koagulation vieler Kolloide. In wässeriger Lösung zeigt er Rechtsdrehung: α²⁰D = +52,53°. Frisch bereitete Lösungen zeigen Multirotation. Die für die Beurteilung des Milchzuckers als Nahrungsmittel wichtige Verbrennungswärme beträgt bei wasserfreiem Milchzucker: 3951,5 Calorien für 1 g (und 1351,4 Cal. für 1 g Mol.), beim Monohydrat: 3736,8 Cal. FEHLINGsche Lösung wird schon in der Kälte reduziert (Unterschied von Rohrzucker). Es ist also eine Aldehydgruppe und zwar in dem Glukoserest erhalten geblieben (s. S. 114). Echte Alkoholhefe aus Reinkulturen, Zymase, Mycoderma, Aspergillus Oryzae, Saccharomyces apiculatus u. and. vergären Milchzucker nicht. Leicht und vollständig wird er von sog. «Milchzuckerhefen», sämtlich Torulaceen, dann den gemischten Kefir- und Kumysfermenten u. and. vergoren. Nicht alle Mikroorganismen, die den Trauben- und Rohrzucker in Milchsäuregärung versetzen, tun dies auch beim Milchzucker. Bei der Kumis- und Kefirdarstellung (vgl. I, S. 1018) entsteht sowohl Alkohol, wie Milchsäure. Verdünnte Schwefelsäure spaltet nach der Formel:
Handel. Deutschland importierte 1908: 137, 1909: 135 dz Milchzucker (aus den Niederlanden und der Schweiz) und exportierte 1908: 1432, 1909: 1650 dz (bes. nach Großbritannien und Japan). Frankreich importierte 1908 129419 kg Milchzucker, besonders aus Italien und den Niederlanden, wenig (8402 kg) auch aus Deutschland.
Verfälschung. Als Verfälschung ist neuerdings mehrfach Glukose (bis 28%, PATSCH) beobachtet worden (Proc. Am. ph. ass. 1906), dann auch Rohrzucker (OHLIGER, CASPARI).
Prüfung. Die schwach süße Lösung (1=1) ist neutral und schäume, erhitzt, beim Schütteln nicht. Mit Natronlauge erwärmt, nimmt sie rotbraune Färbung an und läßt bei nachherigem Zusatze von Kupfersulfat sogleich Kupferoxydul fallen. 1 ccm kalt bereitete Milchzuckerlösung (1=20) gebe mit 1 ccm Natronlauge und 10 Tropfen Kobaltnitrat eine rein blaue Flüssigkeit. Werden 1,2 g Milchzucker mit 12 ccm verdünntem Weingeist während einer halben Stunde häufig geschüttelt, so sollen 10 ccm des Filtrates beim Verdunsten auf dem Dampfbade nicht mehr als 4 cg Rückstand hinterlassen. Nach dem Verbrennen soll Milchzucker höchstens 0,2% Asche hinterlassen (Pharm. helv. IV). DIETERICH fand nur c. 0,08%.
Rohrzucker läßt sich im Milchzucker dadurch nachweisen, daß man eine Lösung[S. 150] mit Reinhefe stehen läßt. Da nur Rohrzucker nicht aber Milchzucker durch das Invertin der Hefe invertiert wird, tritt Gärung nur ein, wenn Rohrzucker zugegen ist.
Geschichte. Der Milchzucker wurde zuerst von FABRICIO BARTOLETTI in Bologna und Mantua (1581–1630 I, S. 883) unter dem Namen Manna seu Nitrum seri lactis in der Enzyclopaedia hermetico-dogmatica 1615 beschrieben — er erhielt ihn durch Eindampfen von Molken — und 1700 von dem Venezianern LUIGI TESTI sowie 1715 von VALLISNERI (in De praestantia lactis) als Arzneimittel empfohlen (FLÜCKIGER, VON LIPPMANN). LICHTENSTEIN und HERMBSTÄDT (I, S. 971) untersuchten ihn näher. Dargestellt wurde Milchzucker zuerst von MICHAEL ETTMÜLLER in Leipzig 1684. Im Kanton Bern wurde schon 1766 Milchzucker in größerer Menge fabriziert. Zu gleicher Zeit wohl auch im Kanton Luzern. KUNKEL wieß Ende des XVII. Jahrh. nach, daß man aus Molken Alkohol gewinnen kann und J. G. GMELIN besprach (1732) den Kumis. Der Gebrauch gegorener Stutenmilch seitens der Mongolen Ostasiens reicht sicher bis ins XIII. Jahrh., wahrscheinlich aber in weit frühere Zeit zurück (FLÜCKIGER).
Lit. FLÜCKIGER, Pharmac. Chem. — VON LIPPMANN, Chemie d. Zuckerarten. — NIELSON, Proc. Amer. pharm. ass. 1906 (Techn. Meth. z. Milchzuckerbereit.). — PATEIN, Bull. soc. chim. 1906, 1022 (Best. der Lactose in der Milch). — LEFFMANN, Jahresb. d. Pharm. 1906 u. 1907 und DEKKER, Pharm. Weekbl. 1905 (Nachweis von Saccharose im Milchzucker). — RIEDELS Ber. 1906 u. HELFENBERGER, Annalen 1906 (Analys. von Milchz.). — Ältere Lit. M. L. WILLAMOZ, de sale lactis essentiali 1756. — G. A. LICHTENSTEIN, Abhandl. v. Milchzucker 1772. — CRUIKSHANK, Scherers Allg. Journ. d. Chem. III, 293.
C. Drogen, welche Trisaccharide enthalten.
Die Trisaccharide oder Hexotriosen sind als durch Kondensation eines Disaccharides mit einem Monosaccharid entstanden zu denken, enthalten also drei Zuckerreste. Hierher gehört die Raffinose (Melitriose, Melitose, Gossypose), die als Äther der Melibiose (eines Disaccharides aus Galaktose und Glukose) und Fruktose zu betrachten ist. Sie zerfällt bei der Hydrolyse nach der Gleichung:
Raffinose kann man folgendermaßen schreiben:
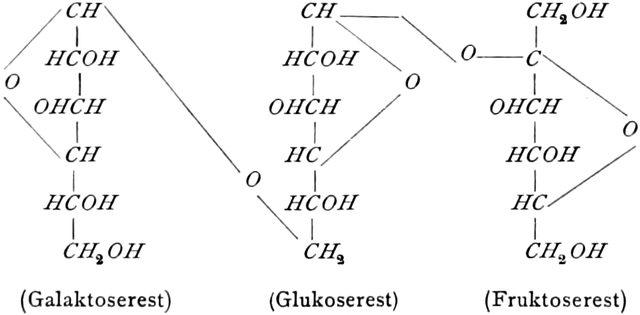
Raffinose ist nicht süß, unlöslich in Alkohol, leicht löslich in Wasser und ziemlich löslich in absolutem Methylalkohol. Letztere Eigenschaft dient zur Trennung vom Rohrzucker. Sie dreht rechts α²⁰D = 104,5° und reduziert FEHLINGsche Lösung nicht. Raffinose findet sich in den Eukalypten-Mannasorten, in der Rübe und in der Rübenzuckermelasse.
Hierher scheint auch die Melezitose, die ebenso süß ist wie Glukose, zu gehören. Sie hat die Formel C18H32O16.2 H2O, Drehung (wasserfrei): αD = 88,51°, reduziert FEHLINGsche Lösung nicht, zerfällt beim Kochen mit verdünnten Säuren in Glukose und Turanose (C12H22O11). Sie findet sich in der Lärchenmanna (daher Melezitose von mélèze = Larix decidua) und in dem Alhagi-Manna (s. d.).
Zu den Trisacchariden gehört auch das von TANRET aus dem Eschen-Manna[S. 151] (s. d.) isolierte, FEHLINGsche Lösung nicht reduzierende Manninotrisaccharid, das bei der Hydrolyse in 2 Mol. d-Galaktose und 1 Mol. d-Glukose zerfällt.
Lit. HANS MITTELMEIER, Über die Melitriose. Diss. Bern 1890 (dort die Literatur). — SCHEIBLER und MITTELMEIER, Ber. d. d. chem. Ges. 22 u. 26. — Melezitose 1859 von BERTHELOT in d. Manna von Briançon gefunden. (Nouv. rech. sur les corps analog. au sucre de canne Ann. Chim. Phys. [3] 55 [1859] 269). — VILLIERS fand sie in der Manne de l’Alhagi Maurorum (Rech. sur le mélézitose. Bull. Soc. chim. 27 [1877] 98), ALEKHINE in d. Pers. Manna (Bull. Soc. chim. [2] 46, 824). MAQUENNE im Miellée du tilleul (Bull. Soc. chim. [3] 9 [1893] 723). — BOURQUELOT ET HÉRISSEY, Sur l’hydrolyse du mélizitose par les ferments solubles. J. ph. 1896, 4, 385.
a) Eucalyptus-Manna.
Das Eucalyptus-Manna ist ein Exsudat mehrerer australischer Eucalyptus-Arten. Es soll angeblich hervorgerufen werden durch Cicada moerens, besonders auf Eucalyptus viminalis LABILL., Euc. mannifera MUDIE, Euc. resinifera SMITH und Euc. Gunnii HOOKER.
In dem von Eucalyptus viminalis (resp. Euc. mannifera) stammenden, zuerst 1832 von VIREY erwähnten Produkte entdeckten JOHNSTON und THOMSON einen kristallinischen Zucker, den BERTHELOT Melitose nannte, den RISCHBIETH und TOLLENS, SCHEIBLER und MITTELMEIER für identisch mit Raffinose, aus Rüben-Melasse und der von RITTHAUSEN aus Baumwollsamen isolierten Gossypose erkannten und dem sie die Formel C18H32O16.5 H2O gaben. Das Drehungsvermögen der Melibiose ist αD = 103,47°.
Ein anderes, von Eucalyptus Gunnii Hook. var. rubida stammendes Exsudat untersuchten PASSMORE und EBERT. Letzterer fand darin 68,49% Melitose (PASSMORE c. 60%), 20,86% unkristallisierbare Glukose, 2,14% Invertzucker, 3,22% Schleim, 0,11% Wachs. Die Asche betrug 6,78%, die Feuchtigkeit 9,74%, der Rückstand 4,27%.
Ein anderes Muster eines Eucalyptus-Manna, das von Eucalyptus pulverulenta SIMS. stammte und gelblich-weiße, bröckelige, süß schmeckende, nach Eucalyptusöl riechende Stücke bildete, enthielt nach EBERT: 21,35% Melitose, 16,15% Fructose und 60% Rohrzucker. Der Rückstand betrug 1%.
Lit. JOHNSTON, Manna von Eucal. mannifera. Chem. Gaz. 1843 (Jahresb. d. Pharm. 1849). — THOMSON, Ebenda. — BERTHELOT, Annal. d. chim. et phys. (3) 46. — RISCHBIETH und TOLLENS, Melitose aus Eucalyptus-Manna, Ber. d. d. chem. Ges. 18, S. 2615. — SCHEIBLER und MITTELMEIER, Ber. d. d. chem. Ges. 22, S. 1678. — PASSMORE, Manna von Euc. Gunnii Pharm. Journ. Transact 1891, p. 717. — MAIDEN, Chemistry of australian indigenous vegetation. Am. Journ. pharm. 1896. — EBERT, Beitr, z. Kenntn. seltener Mannasorten. Diss. Zürich 1908. Weitere Literatur s. oben.
b) Lärchen-Manna.
Das Lärchenmanna, Manna von Briançon, Manna brigantiaca, Manna brianzona (so in dem Frankfurter Catalogus von 1582 I, S. 817; in dem Pariser Zolltarif von 1542 steht: Manne de Dauphiné et de Provence I, S. 815; ebenso in den Edicts (I, S. 706), bei POMET heißt sie auch Manna laricaea) tritt auf jungen Trieben aller Bäume von Larix europaea L. im Sommer auf und wird wohl nur in dem Dauphiné bei Briançon (Depart. des Hautes-Alpes) in beschränktem Maße gesammelt. Es diente in Frankreich früher als gelindes Abführmittel. Zur Zeit GEOFFROYS (I, S. 947), der es als Manne de Melèze bezeichnet, war sie in Gebrauch. Jetzt scheint es auch in Frankreich ohne Bedeutung zu sein. Es bildet trockene weißliche Körnchen, die ihre kristallinische Beschaffenheit der Melezitose (BERTHELOT, ALECHIN) verdanken.
Ein, wie es scheint, ähnliches Manna findet sich auf Cedrus libanotica. POMET bezeichnet es als sehr selten und sehr geschätzt unter dem Namen «Manne masticine du Levant ou de Syrie». In der Brandenburgischen Taxe 1574 (I, S. 817) heißt es Manna Syriaca, i. e. mastichina optima, Manne de Levant. Es ähnelt dem calabrischen Manna und bildet Körner ähnlich dem Mastix. Es ist wohl dasselbe, welches GEOFFROY Cédrine nennt und von dem er meint, daß es schon dem HIPPOKRATES und GALEN bekannt gewesen sei.
[S. 152]
Auch Pinus excelsa WALLICH (und P. longifolia) liefert in Indien, besonders bei Simla im Himalaya (FLÜCKIGER) ein Manna. WATT bemerkt, daß dies in größerer Menge nur alle 20 Jahre auftretende Manna die Zweige und Nadeln inkrustiere und auch auf den Boden tropfe. Er hält es für identisch mit dem Libanonceder-Manna (siehe oben).
In Nordamerika liefert die Zuckerfichte Pinus Lambertiana ein zuckerreiches Manna (LLOYD). Vgl. auch THURBER, California Manna, Ph. J. 1877, 893 (Pinus Lambertiana liefert angebrannt «Pinit», ein Manna). Ähnliche Zuckeraussonderungen wurden beobachtet an Libocedrus decurrens und einer and. californ. Conifere.
Lit. POMET, Hist. gen. d. drog. p. 238. — GEOFFROY, Tract. d. mat. med. 1757, IV, p. 142. — WATT, Dictionary. — BERTHELOT, Ann. chim. phys. (3) 55. — ALECHIN, Journ. d. russ. chem. Ges. 21, S. 420. — LLOYD, Californische Manna. Ber. d. pharm. Ges. 1897.
Keine der oben (S. 131 bis 136, S. 147 und S. 151 bis 152) behandelten Mannaarten enthält Mannit.
D. Drogen, welche Tetrasaccharide enthalten.
Von den Tetrasacchariden ist nur die aus den Knollen von Stachysarten durch VON PLANTA und E. SCHULZE 1890 isolierte Stachyose bekannt, die mit der Manneotetrose (Mannatetrasaccharid), die TANRET 1903 aus dem Eschenmanna isolierte (vgl. S. 109), identisch ist. Sie reduziert, besitzt die Formel C24H42O21.4 H2O und zerfällt bei leichter Hydrolyse in Manninotrisaccharid (Manninotriose oben S. 109) und Fruktose, bei vollständiger Spaltung in 1 Mol. Glukose, 1 Mol. Fruktose und 2 Mol. Galaktose. [Lit. in LUCIEN PIAULT, Sur le Stachyose Thèse. Paris 1910.]
E. Polysacchariddrogen.
Zu den Polysacchariden gehören die Stärke, das Dextrin, das Inulin und die große Klasse der Membranine, zu der wir die Zellulose und ihre Modifikationen, z. B. die Hemizellulosen, Lichenin, die Membranschleime, das Pektin, das Gummi und verwandte Bildungen ziehen müssen, und denen wir dann auch Kork, Cutin, Pollenin, die Pilzzellulose und das Chitin angliedern können. Ihre Konstitution ist noch nicht bekannt. Wir gründen unsere Anschauungen auf die Tatsache, daß aus allen diesen Substanzen bei geeigneter Behandlung, besonders bei der hydrolytischen Spaltung, Körper der Zuckergruppen entstehen. [Eine ganz abweichende, sehr fragwürdige Anschauung vertritt neuerdings JENTYS (Bull. Acad. Cracovie. 1907), der alle oben genannte Substanzen für kolloidale Tannidglykoside hält.]
I. Stärkegruppe.
Stärkemehl, Stärke, Satzmehl — amidon, fécule (franz.) (im Code franc. steht amidon de blé und fécule de pomme de terre) — starch (engl.) — zetmeel (holl.) — amido (ital.) — almidon (span.) — amido (port.) — amydonu (rum.) — stärkelse (schwed.) — tärkkelys (finn.) — kemenyitő (ung.) — ἄμυλον (griech.).
Wenn wir auch nicht annehmen können, daß die Stärke das erste Assimilationsprodukt der Pflanze ist — das sind wohl andere Körper der Zuckergruppe —, so ist sie doch sicher das erste sichtbare, das in Form sehr kleiner Körnchen im Innern der Chlorophyllkörner auftritt (Assimilationsstärke). Ebenso wandern die Kohlehydrate wohl auch nicht in Form von Stärke, obwohl wir in den Leitungsbahnen oder deren Nähe oft kleine Stärkekörnchen antreffen (transitorische Stärke), sondern ebenfalls in Form von anderen Gliedern der Zuckergruppe. [Die Ausfällung der löslichen Stärke in den Pflanzen soll (nach WOLFF und FERNBACH) durch ein[S. 153] Ferment (Amylokoagulase) bewirkt werden.] Sicher aber ist die Stärke die Form, die die im Assimilationsprozeß gebildeten Kohlehydrate am häufigsten annehmen, wenn es sich darum handelt, das Material in Form von Reservestoffen zu deponieren (Reservestärke). Nicht nur in Vegetationsorganen, in den unterirdischen Reservebehältern (Knollen, Rhizomen, überwinternden Wurzeln), sowie im Stamm und immergrünen Blättern, sondern auch in den oberirdischen Reproduktionsorganen (Samen und Früchten) finden wir in unzähligen Fällen Reservestärke in großer Menge (60 bis 80, in einzelnen Teilen des Maiskorns bis 93%) abgelagert, und gerade diese Organe sind es daher, die eine technische Ausbeutung der Stärke erlauben und denn auch in der Tat dazu herangezogen werden, während Assimilations- und transitorische Stärke in zu geringen Mengen vorkommen, um eine Darstellung lohnend erscheinen lassen. Aus Knollen wird die Kartoffelstärke, aus Rhizomen das St. Vincent Arrowroot, aus dem Stamm der Sago, aus dem Endosperm der Samen die verschiedenen Cerealienstärkesorten, aus den Cotyledonen die Leguminosenstärke dargestellt. Die Franzosen unterscheiden die Stärke der Samen als Amidon von der Stärke der unterirdischen Organe, der Fécule, doch werden neuerdings (L. PLANCHON 1910) beide Worte auch als synonym promiscue benutzt. Der Gehalt der unterirdischen Reservebehälter an Stärke schwankt nach der Vegetationsperiode. Für die Fabrikation ist es wichtig festzustellen, wann das Organ die meiste Stärke enthält.
Die Stärke ist bei den Drogen ein sehr verbreiteter Zellinhaltsbestandteil, ohne daß man sagen kann, daß die Wirkung vieler derselben auf die Stärke zurückzuführen ist. Sie fehlt Rhiz. graminis, Rad. gentianae, Rad. Saponariae, Rad. Senegae und wird hier durch andere Reservestoffe vertreten. Bei den unterirdischen Organen der Compositen, Campanulaceen, Goodeniaceen und Stylidieen ist sie durch Inulin ersetzt. Beim Austreiben der Vegetationsorgane und beim Keimen der Samen wird die Stärke allmählich gelöst. Die Körner zeigen Korrosions- und Abschmelzungserscheinungen (Fig. 51). Man kann also anatomisch feststellen, ob z. B. gekeimtes Getreide vorliegt. Die Umwandlung der Stärke in Zucker erfolgt bei der Keimung durch Sekretionsdiastase, bei dem sog. Transport der (transitorischen) Stärke, wobei ebenfalls Lösung eintritt, durch eine besondere (?) Translokationsdiastase.
Stärke aus gekeimtem Weizen.
[Nach Tschirch-Oesterle, Atlas.]
Daß die Stärke ein Polysaccharid ist, gründen wir auf ihr Verhalten zu Enzymen und bei der Hydrolyse. Läßt man Diastase auf Stärkekleister einwirken, so geht allmählich die Blaufärbung durch Jod verloren. Jod färbt zunächst purpurrot, dann braunrot und schließlich gar nicht mehr. Es entstehen zunächst Amylodextrine.[S. 154] Die Endprodukte sind Dextrin, Maltose und Dextrose. Das Enzym Amylase, richtiger Amylomaltase, verwandelt Stärkekleister (nicht unverletzte Kartoffelstärke) zunächst in ein hochmolekulares Dextrin und Maltose (Weizen- und Gerstenstärke werden direkt angegriffen, DUBRUNFAUT). Unter Umständen werden beide durch Amyloglykase weiter in Dextrose übergeführt:
Dextrin
Dextrin
(vgl. S. 115)
(vgl. S. 6)
Auch beim trocknen Erhitzen auf 150–180° verwandelt sich Stärke in Dextrin. Auch hier entsteht daneben Zucker.
Es gelang MAQUENNE, die Stärke vollständig zu verzuckern und so den Beweis zu erbringen, daß sie ausschließlich aus Maltosanen besteht.
A. MEYER nimmt an, daß die Stärkekörner neben sehr wenig Amylodextrin und etwas mehr (0,6–2,5%) nicht mit Jod sich bläuender α-Amylose (Stärkezellulose, NÄGELI, BROWN, HÉROU) vornehmlich β-Amylose (Granulose, NÄGELI) enthalten. Andere (SYNIEWSKI) halten sie für einheitlich, FOUARD für ein Kolloid.
MAQUENNE zeigte im Gegensatz zu A. MEYER, daß der Hauptbestandteil der Körner α-Amylose (Amylose, MAQUENNE) ist, die er durch Retrogradation als «künstliche Stärke» in reichlicher Menge daraus darstellte, besonders bei Anwendung von Amylokoagulase (WOLFF und FERNBACH). Die Stärke besteht nach ihm aus 80 bis 85% Amylose (MAQUENNE) und 15–20% verschieden kondensierten Amylopektinen. WOLF und FERNBACH nehmen (1906) an, daß die Stärke besteht aus Amylosen, die polymerisiert und verzuckert werden können, aus Amylosen, die bloß verzuckert werden können und aus dem Amylopektin von MAQUENNE und ROUX. Alle diese Angaben sind aber noch sehr unsicher.
PFEIFFER und TOLLENS geben der Stärke die Formel C24H40O20, doch besitzt dieselbe nur vorläufigen Charakter, wie auch die Formel SYNIEWSKIS (C54H96O48)n–3n H2O,) der sie als ein hochmolekulares Anhydrid des Amylogens auffaßt. Das Amylogen (C54H96O48), das wasserlöslich ist und nicht reduziert, denkt sich SYNIEWSKI aus drei Maltoseresten und einem 18 Kohlenstoffe enthaltenden Dextrinrest aufgebaut, der aus drei Glukoseresten besteht, von denen zwei als Isomaltose darin enthalten sind.
Die aus mit Jod auf 330° erhitzter Stärke erhaltenen künstlichen Stärkekörner von Rodewald und KATTEIN hatten ein Molekulargewicht von 32700.
Reines Jod färbt reine trockene Stärke gelb. Die Stärke wird nur dann durch Jod blau gefärbt, wenn Wasser und Jodwasserstoff oder eine Verbindung desselben, oder eine Substanz die aus Jod HJ bildet, zugegen ist. Der Jodstärke kommt (nach F. MYLIUS) die Formel (C24H40O20J)4.HJ zu. KÜSTER und A. MEYER halten sie jedoch für eine Lösung des Jod-Jodwasserstoffs in der Stärkesubstanz. Das Verhältnis zwischen dem in die Stärke eingehenden und dem in wässriger Lösung verbleibenden Jod folgt dem NERNSTschen Verteilungsgesetze. Noch 1⁄52800 Jod bewirkt in Stärkekleister Violettfärbung. Die Jodreaktion der Stärkekörner läßt sich dadurch fixieren, daß man die blaugefärbten Körner mit Silbernitrat behandelt, das Präparat der Sonne aussetzt und dann mit Hydrochinon «entwickelt», die Körner bleiben dann (durch[S. 155] Ag) dauernd braun (LAGERHEIM). Durch Jod wird von in der Natur vorkommenden Substanzen nur noch das Saponarin BARGERS blau gefärbt (Ber. d. chem. Ges. 1902. Zuerst DUFOUR fand in den Epidermiszellen der Blätter von Saponaria officinalis und Bryonia dioica einen wasserlöslichen Körper, der mit Jod sich bläut.); wohl aber färben sich auch einige Membranine (s. Lichenin) und Spaltungsprodukte von Membraninen durch Jodpräparate blau bzw. violett, wie die Phellonsäure und das Glukosamin (vgl. auch unter Zellulose).
Legt man verschiedene Stärkeproben auf eine Glasplatte, stellt ein Uhrglas mit einigen Kristallen Jod daneben, so färben sich nach 24 Stunden die einzelnen Stärkesorten verschieden: Maisstärke wird schwarzviolett, Getreidestärke taubengrau, Kartoffelstärke gelbgrau, Sago milchkaffeefarben (DUBASC).
Bei einigen Stärkesorten gibt, da Oxydasen darin vorkommen, Guajaktinktur eine Blaufärbung (CORSINI), doch tritt dieselbe niemals an den Stärkekörnern selbst ein.
Das Stärkekorn ist farblos und durchsichtig. Die weiße Farbe der Mehle rührt von der Luft her, die zwischen den Körnern liegt.
Stärke nimmt reichlich Wasser auf (sog. grüne Stärke enthält c. 55%), lufttrocken enthält Stärke 13–19% Wasser.
Die Verkleisterungstemperatur ist bei den einzelnen Stärkesorten verschieden. Sie schwankt zwischen 50 und 77,5°. Die Bestimmung der Verkleisterungstemperatur wird zur Differentialdiagnose benutzt, ebenso das Verhalten zu Kalihydratlösungen verschiedener Konzentration (BELLIER). LENZ benutzt die verschieden große Quellungsfähigkeit der Stärke durch Natriumsalycilatlösung zur Unterscheidung der einzelnen Stärkesorten.
Die Stärke entsteht, wie es scheint, stets in (oder auch an?) Stärkebildnern (Amyloplasten, Chromatophoren). Reste derselben finden sich bisweilen noch (Rhiz. iridis, Kronenröhre von Verbascum, Anatom. Atlas Taf. 22). Sie findet sich stets in Form von Körnern, deren Größe in den Reservebehältern zwischen 4 (Reis) und 170 mik. (Canna) und deren Kubikinhalt zwischen 20 und 320000 Kubikmik. schwankt. Wenn ihre Größe 150 mik. erreicht, so sind sie mit bloßem Auge sichtbar. Die Größe schwankt für jedes Stärkemehl nur in bestimmten Grenzen. Man bestimmt die Grenzwerte der Längsdurchmesser und gibt außerdem die am häufigsten vorkommenden Werte an. Auch die Form ist für jedes Stärkemehl charakteristisch, wenigstens findet sich stets ein «Typus», der als «Leiter» dienen kann (TSCHIRCH). Sehr oft ist auch die Schichtung und die Lage des Kerns diagnostisch wichtig, wie die Feststellung ob einfache, komplexe, solitäre, adelphische, monotone oder polytone Körner (A. MEYER) vorliegen. A. MEYER betrachtet die stets doppelbrechende Stärke als ein Organoid und zwar als einen aus zahllosen kurzen Amylosetrichiten aufgebauten Sphärokristall.
DELBRÜCK teilte (Chem. Zeit. 1901, 195) eine Methode zur Prüfung der Stärke auf Gesundheit mit.
Lösliche Stärke kann man durch Erwärmen mit 2% Natriumperboratlösung darstellen, oder nach der LINTNERschen Methode: Erhitzen mit 7,5% Salzsäure während 3 Tagen auf 40°, Auswaschen der Säure und Trocknen.
Kleine Mengen von Stärke erkennt man am besten mit Jod-Chloralhydrat.
Die fabrikmäßige Darstellung der Stärke beruht im wesentlichen auf einer Zerkleinerung der stärkeführenden Gewebe, Auswaschen (Ausschlämmen) der Stärkekörner und Trennen derselben von den Zellresten und dem Wasser. Bei Knollen (z. B. Kartoffeln) verfährt man entweder in der Weise, daß man die Organe auf Reibezylindern in einen Brei verwandelt und diesen auf Sieben mit Wasser auswäscht (ausbürstet)[S. 156] — auf dem Siebe bleibt die Pülpe — oder die in Scheiben geschnittenen Knollen zunächst durch Gärenlassen in Haufen aufschließt (VÖLCKER). Intakte Stärke widersteht der Gärung und Fäulnis. Bei Samen (z. B. Weizen) verfährt man entweder in der Weise, daß man die 10–15 Tage eingequollenen Samen zwischen Walzen zerquetscht und aus dem Brei die Stärke austritt (in Tretfässern) bezw. ausschlämmt, oder indem man den Brei zuerst gären läßt, oder aber — und hierbei erhält man den Kleber als Nebenprodukt — indem man vom Mehle ausgehend dieses mit Wasser ausknetet (MARTIN) bezw. zentrifugiert. Festere Samen werden auch zuvor mit Alkalien (Natron, Kalk, Ammoniak) aufgeschlossen. Das sich zunächst absetzende Satzmehl ist sehr wasserreich (grüne Stärke). Es wird gewöhnlich in Trockenkammern ausgetrocknet und dann in der Sonne oder künstlich gebleicht.
Fabrikmäßig dargestellt werden nur verhältnismäßig wenige Sorten, da trotz der weiten Verbreitung der Stärke nur selten alle Bedingungen für lohnende technische Ausbeute — Reichtum des Materials an Stärke, leichte Zerkleinerung, Abwesenheit störender Beimengungen, billige Gewinnung, gleichmäßige Beschaffenheit des Materials — vorhanden sind. 9⁄10 aller Samen sind stärkefrei! In großem Maßstabe werden Kartoffel-, Weizen-, Mais- und Reisstärke fabrikatorisch dargestellt.
Da Stärke aus der Luft reichlich Wasser und Gerüche anzieht, muß sie an einem trockenen und geruchfreien Orte aufbewahrt werden.
Geschichte. DIOSKURIDES sagt vom Amylum, daß es diesen Namen trage, weil es ohne Mühle hergestellt werde (α privativum und μύλη Mühle). Er beschreibt die Darstellung aus Sommerweizen (ἐκ πυροῦ σητανίου καθαροῦ). Derselbe wird 5 Tage in Wasser eingequollen, dann mit den Füßen zerquetscht und unter Wasserzusatz getreten. Die oben aufschwimmenden Hülsen werden entfernt, der Brei koliert und schnell auf Steinen in der Sonne getrocknet. Ein für arzneiliche Zwecke nicht verwendbares könne man aus Dinkel (ἐκ ζέας βραχείσης) bereiten. Er hält das ägyptische und kretische Amylum für das beste. Ähnlich äußert sich über die Darstellung des Amylums (appellatum quod sine mola fiat) PLINIUS, der die Bewohner von Chios für die Erfinder des Verfahrens hält, das chiotische für das beste erklärt und es auch ex siligine herstellen läßt. Er kennt ferner das Hafermehl und die Verwendung der Amylacea bei Diarrhöen, die auch RHAZES erwähnt. PLINIUS bezieht sich auf CATO. In der Tat findet man bei diesem (vgl. I, S. 572) die erste kurze Angabe über Darstellung des Amylums. Es heißt in CATO, De re rustica im LXXXVII Capitel: «Amyllum sic facito. Siliginem purgato bene, postea in alveum indat, eo addat aquam bis in die. Die decimo aquam exsiccato, exurgeto bene, in alveo puro misceto bene, facito tanquam faex fiat. Id in linteum novum indito exprimito cremorem in patinam novam, aut in mortarium. It omne ita facito, et refricato denuo. Eam patinam in sole ponito, arescat. Ubi arebit, in aulam novam indito, inde facito cum lacte coquat.» Auch die Bezeichnung Satzmehl, Absatz, κατάστατον findet sich schon bei den Alten. Reismehl war ein beliebtes Heilmittel bei den alten Indern (I, S. 504) und wurde auch zu Liebestränken benutzt. Des Gersten-, Linsen- und Ervenmehles bediente sich HIPPOKRATES (I, S. 541) als Hautmittel. Das waren aber wohl Mehle. In SCRIBONIUS LARGUS Compositiones (I, S. 576) steht amulum. IBN BAITHAR (I, S. 608) führt es unter dem Namen Naschâ (pers. Naschâstadsch) auf (das garâ, garirâ wird von ELGAFÂKI als ein Stärkemehl (?) aus einem wohlriechenden Samen — Sison des DIOSKURIDES — bezeichnet). In der Tabula des SERAPION (I, S. 605) steht amilum, in der Alphita (I, S. 641) und Circa instans: amidum (amitum) de tritico (Sinonoma BARTHOLOMAEI). Die Alphita hat bekanntlich ihren Namen nach der damaligen Bezeichnung für farina hordei (vgl. I, S. 639). Bei MATTHAEUS SYLVATICUS resp. SIMON JANUENSIS (I, S. 663) steht amilum vel apoyois. CORDUS (I, S. 797) verwendete ein Amylum und ein Amylum assatum. In der ersten brandenburgischen Taxe 1574 (I, S. 817) steht Amylum vulgo amidum (Krafft melh). Der Ausdruck Kraftmehl kehrt dann später bis ins XIX. Jahrh. oft wieder. Die Satzmehle oder faecula früherer Jahrhunderte waren besonders: Faecula Ari, Bryoniae, Colchici autumnalis, Elaterii, Orchidis, Pseudacori, Paeoniae. Man schrieb ihnen spezifische Wirkungen zu. Wie FLÜCKIGER (Dokumente, s. d. Taxen) mitteilt, wurden im XVII. Jahrh. besonders vier[S. 157] Faecula in den Apotheken gehalten von den Wurzeln oder Knollen von Arum maculatum L., Bryonia alba L., Iris florentina L. (und I. Pseudacorus) und Paeonia officinalis L. Dazu kam dann noch das Mehl von Rad. Serpentariae (Polygonum Bistorta L.) und das Amylum Mechoacannae (Jalapae). Bei GREN (System d. Pharmac. 1799) findet sich nur noch Weizenstärke. Auch POMET und LÉMERY erwähnen nur das Amidon der Getreidefrüchte (nicht ein Arrowroot oder Kartoffelstärke). DIERBACH (1841) Weizen- und Kartoffelstärke. Neuerdings werden für gewöhnlich nur fünf Stärkemehle in den Apotheken gehalten und zum Teil in den Pharmakopoëen aufgeführt: Reis-, Weizen-, Kartoffel-, Mais- und Maranta-Stärke, nur die japanische und die portugiesische Pharmakopoëe haben andere Stärkemehle (s. weiter unten). Die germanischen Völker bevorzugen die Weizenstärke. Die einzelnen Sorten vertreten sich jetzt vielfach. In Amerika spielt die Maisstärke die gleiche wichtige Rolle in Industrie und Pharmazie, wie in England die Reisstärke, auf dem Kontinent die Weizen- (und Kartoffel-)Stärke und in Japan die Stärke von Erythronium Dens canis L. und Pueraria Thunbergiana BENTH. Dies kommt auch in den Pharmakopoëen zum Ausdruck. Unter Amylum schlechthin verstehen die Pharmakopoëen der romanischen Länder (und Deutschlands) Weizenstärke, die Pharmakopoëe von Nordamerika Maisstärke, die Britannika Weizen, Mais und Reis, die portugiesische Mandioca oder Manihot, die Japonica die oben genannten Sorten. In der portugiesischen Pharmakopoëe steht auch noch Amylum ari. Die erste Stärke, die fabrikmäßig zunächst in Hausindustrie dargestellt wurde, ist die Kartoffelstärke, deren Fabrikation schon FRIEDRICH DER GROSSE anregte (1765). N. C. BLOCH begründete (1811) die Kartoffelstärkefabrikation im Elsaß. Auch Weizenstärke wurde zuerst von der Hausindustrie dargestellt.
Schon LEEUWENHOEK betrachtete 1716 Cerealien- und Bohnenstärke mit dem Mikroskop (Philos. Transact.). Da er sich selbst stärkere Linsen schliff wie sie MALPIGHI und GREW zur Verfügung standen, konnte er seine Beobachtungen auch auf kleinere Objekte ausdehnen. LUKE HOWARD erkannte 1800 die Veränderungen der Stärkekörner durch Wasseraufnahme beim Erhitzen. Noch vor SCHLEIDEN zeigte 1838 PAYEN und 1842 PEREIRA (I, S. 340), daß sich die Stärkemehlsorten durch das Mikroskop unterscheiden lassen. Die umfangreichsten morphologisch-anatomischen Untersuchungen über die Stärkekörner finden sich aber in dem mit vielen Tafeln geschmückten Werke von C. NÄGELI, Die Stärkekörner. Zürich 1858. In ihm wurde auch die Theorie des Wachstums der Stärkekörner durch Intussuszeption verfochten, die jetzt als überwunden gelten kann (A. F. W. SCHIMPER, ARTHUR MEYER). KIRCHHOFF fand 1811 die Verzuckerung von Stärkekleister durch Malzauszug (Diastase). COLLIN und GAULTHIER DE CLAUBRY beobachteten 1814 die Blaufärbung durch das wenige Monate zuvor entdeckte Jod. Die ältesten Hadernpapiere (VIII. Jahrh. n. Chr.) waren mit Weizenstärkekleister geleimt (WIESNER).
Lit. C. VON NÄGELI, Die Stärkekörner. 1858. — WIESNER-HÜBL, Mikroskop. Untersuch. — A. MEYER, Unters. über die Stärkekörner. Jena 1895 (dort d. Lit.) und Grundlagen u. Method. f. d. mikrosk. Unters. v. Pflanzenpulv. Jena 1901, 24. — LUTZ, L’amidon, Bull. sc. pharm. 1906. — SYNIEWSKI, Lieb. Ann. 199. Ber. d. d. chem. Ges. 30, 2415. — VOGL, Nahrungs- und Genußm. 1899. — JOS. MOELLER, Mikroskopie d. Nahr. u. Genußmittel, 2. Aufl. — VILLIERS et COLLIN, Traité des altérations et falsifications des subst. aliment. Paris 1900. — KÖNIG, Nahrungs- und Genußm. IV. Aufl. — TSCHIRCH, Stärkemehlanalysen. Arch. Pharm. 1884 u. 1885 und Angew. Anatomie. — TSCHIRCH-OESTERLE, Anatom. Atlas. — FRANK und TSCHIRCH, Pflanzenphys. Wandtafeln. — T. F. HANAUSEK, Nahrungs- und Genußm. 1884. — SCHIMPER, Anleitung. 2. Aufl. 1900. — ROSEN, Anatom. Wandtafeln d. vegetab. Nahrungs- u. Genußm. — EUG. HESS, Unters. einig. trop. Stärkem. Zeitschr. öster. Apoth. Vereins 1906. — DECROCK, Contrib. à l’étude des farines de l’Indo-Chine. Ann. Mus. col. Marseille 1908 u. 1909. — LOUIS PLANCHON et ARMAND JUILLET, Etude de quelques fécules coloniales. Ann. mus. colon. Mars. 1910. — VON WEINZIERL, Qualitat. u. quant. mechan. mikrosk. Analyse, eine neue Unters.-Methode d. Mehlprodukte. Wien 1887. — KRAEMER, Amer. journ. pharm. 1899, Proc. amer. pharm. assoc. 1899, Journ. am. chem. soc. 1899, Science 1900 u. and. — SACHSSE, Chemie u. Physiolog. d. Farbstoffe, Kohlehydr. u. Proteinsubst. Leipz. 1877. — Über die Asche der Stärken: LA WALL, Am. journ. pharm. 1897.
DUHAMEL DE MONCEAU l’art de faire l’amidon. Paris 1775. — V. WAGNER, Die Stärkefabrikation. Braunschweig 1876. — SEEL, Gewinn. u. Darst. d. wichtigst. Nahr. u. Genußm. Stuttgart 1902. — Über die Bestimmung von Stärke in Getreidesamen nach LINDET, vgl. Zeitschr. Angew. Chemie 1898, 166. — Über die Untersuchung der Rohmaterialien und der Stärke: ECKENBRECHER in LUNGE, Chem. techn. Untersuchungsmethoden III, 494.
[S. 158]
Vgl. ferner meinen Artikel Amylum in der Realenzyklopädie der ges. Pharmazie I, S. 583, EULER, Pflanzenchemie und CZAPEK, Biochemie (dort die bot. Lit.). — PAYEN, Mém. sur l’amidon, considéré sous les points de vue anatomique, chimique et physiolog. Ann. sc. nat. 1838, II, 27 (erster Versuch einer mikroskop. Diagnose). — Eine ziemlich vollständige Liste der Stärke liefernden Pflanzen findet sich in WIESNER, Rohstoffe I, S. 564. Einen Bestimmungsschlüssel gab MOELLER (Mikroskopie). Die DUFOURsche Tabelle zur Bestimmung der Stärkesorten ist abgedruckt in Pharm. Praxis 1904, S. 54. — VON HOEHNEL, Die Stärke und d. Mahlprodukte. Allgem. Waarenk. Kassel 1882. — HARZ, Landwirtsch. Samenkunde. Berlin 1885. — BERG, Anatom. Atlas. — FLÜCKIGER-TSCHIRCH, Grundlagen. — MOELLER, Mikroskopie d. Cerealien. Pharm. Centralh. 1884 und Pharmakogn. Atlas 1892, Taf. 1–27. — W. LENZ, Eine neue mikrochem. Unterscheid. d. Roggen- und Weizenstärke. Apoth. Zeit. 1909 und Arb. aus d. pharm. Inst. d. Univers. Berlin VII, 1910. — BLOEMENDAL, Bijdragen tot de Kennis van zetmeel. Pharm. Weekbl. 1906. — BAUR und POLENSKE, Trennung von Stärke u. Glykogen. Arb. d. Kais. Gesundheitsamt. 1906. — FOUARD, Sur les propriétés colloïdales de l’amidon et sur l’unité de sa constitution. Bull. soc. chim. 1908. — LINTNER, Journ. pr. Chem. 34 (1886). — SCHLICHT, Verzuckerung d. Stärke. Jahresb. d. Schles. Ges. f. vaterl. Kultur. 1909. — DUBASC, Chem. Zeit. 1904, 1149. — LAGERHEIM, Zeitschr. f. Mikrosk. 14. — MAQUENNE, Bull. soc. chim. 1906. — WOLFF u. FERNBACH, Compt. rend. 137 u. 138. — CORSINI, La guaiaco reazione nella diagnosa della farine. Riv. d’igiene e sanit. pubbl. 1905. — BELLIER, Ann. de chim. analyt. 1907, 224 (Verwendung des KOH, auch in Rev. intern. des falsific. et d’analyse d. mat. aliment. 1907).
I. Stärke aus unterirdischen Organen.
a) Amylum solani.
Syn. Kartoffelstärke, — fécule de pomme de terre (franz.) — potato starch (engl.) — aardappelzetmeel (holl.) — amido di patate (it.) — potaatti tärkkelys (fin.) — ἄμυλον γεωμήλων (n.-griech.).
Stammpflanze und systemat. Stellung. Solanum tuberosum L. (LINNÉ, Spec. plant. 183), Erdapfel, Erdbirne, Grundbirne, Potacke mit zahlreichen (c. 900) Varietäten, Sorten und Kulturrassen.
Solanaceae, Solaneae — Solaninae, Sect. Pachystemonum.
Etym. Die Italiener nannten die Kartoffel wegen ihrer Ähnlichkeit mit der Trüffel tartufo, daraus entstand (zwischen 1650 und 1760) durch Dissimilierung das deutsche, noch jetzt im Elsaß gebräuchliche tartuffel (tuften, tüften in Mecklenburg). Unwahrscheinlich erscheint die Umbildung aus Erdapfel (mhd. ërtapfel = Trüffel?), Herdapfel (Erdtuffel, Artoffel) = pomme de terre. Auch der Name Grumbirn (= Grundbirne, Erdbirne) deutet auf das subterrane Vorkommen der Knollen. Das engl. potato ist angeblich haitischen Ursprungs (Pataken, ostfränk.) — Nachtschatten = schwarzer Schaden —. Solanum von solari trösten, stärken oder von solo den Sonnenstich verursachen = verrückt machen (KANNGIESSER). — Der Strychnos der Alten war wohl ein Solanum. — Der Knollen besser wie die Knolle.
Beschreibung. Solanum tuberosum ist ein vieljähriges, angedrückt behaartes, ästiges Kraut von 50–120 cm Höhe, mit unterbrochen fiederschnittigen Blättern — Endlappen größer als die schiefherzförmigen Seitenlappen — Blüten weiß oder violettrötlich mit flach radförmiger Krone in doldenartigen Wickeln. Früchte gelbgrüne, etwa kirschengroße Beeren. Die Pflanze wird nur durch die Knollen, nicht durch die Samen fortgepflanzt. In den Achseln der unteren Blätter der Pflanze, sogar der schrumpfenden Cotyledonen (ct in Fig. 52), entspringen unterirdische Ausläufer (Wandersprosse), welche mit Niederblättern (éc) besetzt sind und Nebenwurzeln (r’) treiben, jedoch, wenn sie ans Licht kommen, auch zu Laubsprossen werden können. Die Enden dieser unterirdischen Ausläufer werden durch Anschwellen zu knollenartigen Speichersprossen (tb). Diese bilden die Kartoffeln. In ihnen ist das[S. 159] stärkeführende Speicherparenchym des Markes stark vermehrt (Hypertrophie des Markes). Die einen randständigen Kreis bildenden Gefäßbündel sind nur klein. Außen ist der Knollen von einem mehrreihigen Kork umgeben, der das wasserreiche Knollengewebe vor dem Austrocknen schützt (Fig. 53). Da und dort finden sich am Knollen kleine schuppenförmige Niederblätter, in deren Achseln Knospen, die sog. «Augen» (br. Fig. 52) liegen, die austreiben können, bei der Vermehrung der Kartoffel dies auch tun und eine neue Pflanze erzeugen. Die Parenchymzellen der Randschichten sind kleiner als die der inneren Partien. Die roten Sorten enthalten in allen Zellen neben Stärke einen roten Zellsaft, die rotschaligen nur in den Randschichten. Die Kartoffel enthält 15–20% Stärke (zahlreiche Analysen bei KÖNIG). Doch steigt in einigen Sorten der Stärkegehalt bis 22 oder gar 24%. In Deutschland allein sind c. 3 Mill. Hektar unter Kartoffelbau.
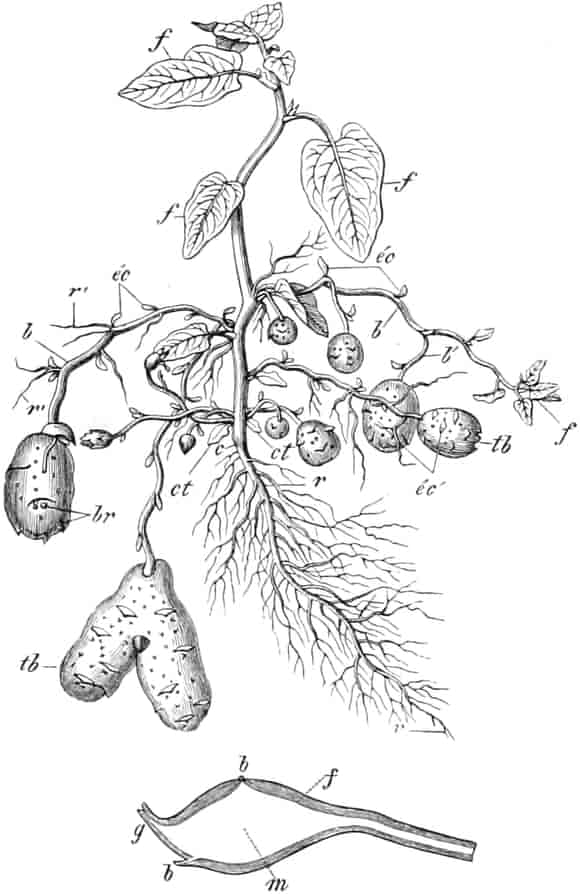
Solanum tuberosum.
Bildung der Knollen (Speichersprosse) an unterirdischen Wandersprossen. Unten Längsschnitt durch die Spitze eines jungen Knollen.
[Aus Sachs, Lehrbuch.]
Pathologie. Prof. E. FISCHER berichtet über die pflanzlichen Schädlinge: Die wichtigste Krankheit der Kartoffel wird hervorgerufen durch Phytophthora infestans (MONT) DE BARY. Dieser Parasit bewirkt ein Absterben des Krautes, das natürlich auch ein Zurückbleiben der Knollenentwicklung zur Folge haben kann. Aber es geht der Pilz selber auch auf die Knollen über, Bräunung und Absterben ihres Gewebes bedingend. Sekundär hinzutretende Bakterien und Schimmel vollenden dann den Zersetzungsvorgang. Indes scheinen gewisse Schimmelpilze, namentlich Fusarium Solani (MART.) SACC., auch selbständig Erkrankung (Trockenfäule), wenigstens bei verwundeten Knollen, hervorrufen zu können. Eine Chytridiacee Chrysophlyctis endobiotica SCHILBERSKY wird als Erreger einer Schorfkrankheit der Kartoffel angesehen. Endlich sind in neuerer Zeit auch eine Reihe von primären Bakterienkrankheiten der Kartoffelknollen beschrieben worden.
Lit. APPEL und KREITZ, Der derzeitige Stand unserer Kenntnisse von den Kartoffelkrankheiten und ihre Bekämpfung. Mitt. Kais. Biol. Anstalt f. Land- und Forstwirtschaft 1907, Heft 5. — Über die Bekämpfung der Kartoffelkrankheit mit Bordeauxbrühe vgl. auch TSCHIRCH, Das Kupfer vom Standpunkt der Hygiene usw. Stuttgart 1893.
Über tierische Schädlinge berichtet ISRAËL:
1. Käfer. Agriotes lineatus L.: Larve die Kartoffelknollen durchlöchernd, sonst an Getreide- und Graswurzeln. Melolontha vulgaris L., der Maikäfer: Der Engerling lebt an den Wurzeln aller möglichen Pflanzen und Waldbäume, auch oft in großen Mengen an den Kartoffelknollen.
[S. 160]
2. Schmetterlinge. Acherontia atropos L., der Totenkopf: Die in Mittel- und Norddeutschland vorkommenden Raupen stammen von Faltern, die im Mai aus südlicheren Ländern (Ungarn) zugeflogen sind. Sie leben meist auf Kartoffelkraut, doch auch, wenn sie häufiger auftreten, auf Datura, Lycium, Hyoscyamus, Daucus, Syringa, Philadelphus usw. Schädlich wird die Raupe wohl niemals, da sie meist einzeln vorkommt. Calocampa exoleta L.: Die polyphage, sehr schöne Raupe, lebt unter andern auch an Kartoffelkraut.
3. Fliegen. Sciaria vitripennis. KLUG.: Die Made dieser Fliege lebt gern an faulenden Kartoffeln in Kellern.
In Kartoffelstärke findet sich bisweilen die Milbe Aleurobius farinae.
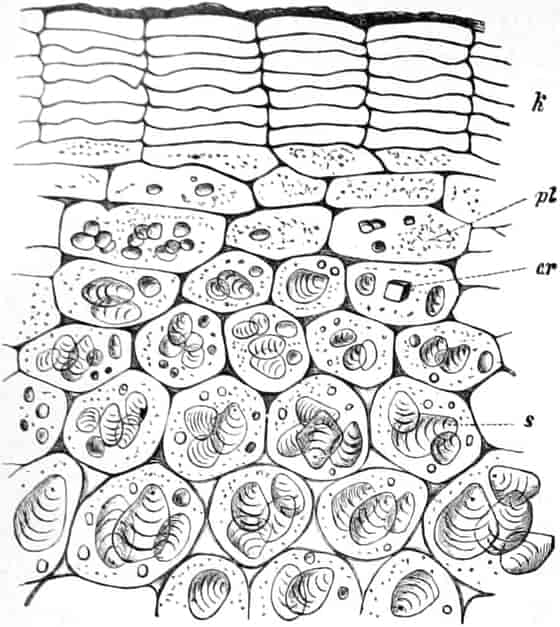
Querschnitt durch die Randschicht des Kartoffelknollen.
[Tschirch.]
Darstellung von Kartoffelstärke. Kartoffelstärke wird in größerem Stil seit 1846 fabrikmäßig dargestellt. Die in Trommeln gewaschenen Kartoffeln werden in Zerkleinerungsapparaten zerrieben und samt dem Kartoffelsaft (Fruchtwasser) durch Siebapparate geleitet (Fig. 54). Die zurückbleibende Pulpa wird entweder verfüttert oder auf Mühlsteinen vermahlen und durch die Siebapparate geschickt. Die Gemische von Fruchtwasser und Stärke werden vereinigt (Rohstärkemilch), durch mehrere Siebe (Fein- oder Raffiniersiebe) von den Fasern und Schalenteilchen befreit und in gemauerten Absatzkästen (Sedimenteurs) 6–10 Stunden sedimentiert (bisweilen unter Zusatz von Schwefelsäure) oder zunächst durch 20 m lange Rinnen (Flutensystem) geschickt, in denen sich die gröberen Stärkekörner absetzen und dann zum Absetzen der feinsten Körner in Bottiche geleitet. Nach dem Absetzen wird das Fruchtwasser abgelassen, die oft noch stark gefärbte Rohstärke herausgestochen und in Waschbottichen (Laveurs) mit Rührwerken gewaschen (Fig. 55). Es setzt sich dann am Boden reine Stärke (Schlemm-, Schabe-, Hinter-Stärke) und darüber gefärbte Schlammstärke ab, die nach dem Abziehen des Waschwassers vorsichtig von der reinen Stärke getrennt wird, die man entweder als grüne Stärke in den Handel bringt bzw. auf Dextrin oder Traubenzucker verarbeitet oder durch Waschen noch weiter reinigt und nach dem Abcentrifugieren des Wassers (in Raffiniercentrifugen) auf Horden oder in mechanischen Apparaten trocknet.
Die grüne Stärke enthält bis 50%, die centrifugierte c. 35%, die fließende oder kaufechte, bei gewöhnlicher Temperatur getrocknete 14–20%, die getrocknete 8–15, meist 12% Wasser. Letztere kommt in Stücken oder gemahlen als Pulver in den Handel. Das Trocknen erfolgt meist auf Gipsböden in großen Trockenkammern (Fig. 56) bei höchstens 40° in lebhaftem Luftzuge. Die Schlammstärke geht entweder in die Branntweinbrennerei oder wird, mit Wasser gemischt, in großen Behältern mit Rührwerk am Absetzen verhindert, dann auf Schüttelsiebe gebracht und nach dem Flutensystem durch Schlemmrinnen oder Schlemmtafeln geschickt. Aus dem Fruchtwasser wird meist noch Sekundastärke abgeschieden. Der Schlamm, die Pülpe (Kartoffelfaser,[S. 161] petit sous) und die Abwässer werden entweder zu Futtermitteln (Pülpekleie) verarbeitet oder zu Düngezwecken benutzt. (Vgl. auch die Darstellung in TSCHIRCH-OESTERLE, Anatom. Atlas.)
Stärkefabrik, Grundriß (unten) und Durchschnitt (oben) (für Kartoffel- und Cassavestärkefabrikation).
1. Kocher (Boiler), 2. Maschine, 3. Wäscher, 4. Reiber, 5. Reiber Tank, 6. Pumpe vom Reiber Tank zum Sieb, 7. Zylindersieb, 8. Schüttelsieb, 9. Stärkeablagerungs-Tank, 10. Rühr-Tanks, 11. Milch-Tanks, 12. Milchpumpe, 13. Zentrifugal-Tank, 14. Zentrifuge, 15. Stärke-Elevator, 16. Trockenzimmer, 17. Pulp-Tank, 18. äußere Ablagerungs-Tanks, 19. Wasser aus dem Wascher, 20. Ausfluß zur Bewässerung (w. Frisch-Wasser-Pumpe).
[Nach Wiley.]
Bei der VÖLCKERschen Methode werden die in Scheiben geschnittenen Kartoffeln in Haufen gären gelassen und der Brei ausgewaschen. Bisweilen werden beim Reinigungsprozeß außer Schwefelsäure auch Ammoniak, Soda, Pottasche, Natronlauge herangezogen und zum Bleichen Chlor benutzt.
[S. 162]
Man erhält jetzt etwa 15–18% Stärke aus den Kartoffeln. Mehr als 80% der in der Kartoffel enthaltenen Stärke läßt sich nicht gewinnen; selbst ein rationeller Betrieb erzielt meist nur 66–75%, da selbst die vollkommensten Reiber nicht alle Zellen öffnen. In den Kartoffelknollen finden sich auch Histidin, Lysin und Arginin (E. SCHULZE). Die Zusammensetzung ist der ähnlich, die wir bei etiolierten Keimpflanzen finden.
Die Kartoffelstärkefabrikation wurde von N. J. BLOCH 1811 im Elsaß (Düttlenheim) begründet. Vorher, im XVIII. Jahrh., bestand sie nur als Hausindustrie. Sie blüht jetzt besonders in Frankreich (Depart. Vosges, Oise, Loire, Sarthe, Seine) und Deutschland. Hier seit den dreißiger Jahren des XIX. Jahrh. In Deutschland bestehen 663 Kartoffelstärkefabriken, besonders in Preußen (630), Mecklenburg, Anhalt, Braunschweig, Hessen. Auch Nordamerika produziert jetzt viel Kartoffelstärke.
Stärkewäscher (für Kartoffel- und Cassavestärkefabrikation) innere Ansicht.
[Nach Wiley.]
Stärketrockenraum (für Kartoffel- und Cassavestärke).
[Nach Wiley.]
[S. 163]
Die Jahresproduktion betrug 1897 c. 1 Mill. dz grüne und c. 3 Mill. dz trockene Stärke (SAARE).
Nordamerika produzierte bereits 1899: 15500 tons Kartoffelstärke. Davon entfielen auf Maine und New Hampshire 9000, auf New York 400, auf Wisconsin und andere Weststaaten 6100 t.
Hamburg importierte 1908 seewärts 89613 dz Kartoffelstärke und Kartoffelmehl, (davon 82388 dz aus den Niederlanden) und exportierte 123948 dz.
Deutschland exportierte 1909: 303032 dz Kartoffelstärke, etwa die Hälfte nach Großbritannien.
Handel. Im Handel findet sich die Kartoffelstärke entweder in Pulverform oder in unregelmäßigen Stücken, Brocken (Brockenstärke, Schäfchen) oder in Form runder, gepreßter Stengelchen (Stengel- oder Kristallstärke). Die grüne Stärke heißt im Handel auch Naßstärke. Das Kartoffelmehl des Handels ist meist auch nichts anderes als Kartoffelstärke. Der Großhandel unterscheidet aber zwischen Kartoffelmehl und Kartoffelstärke (JULIUS GROSSMANN) — letztere ist etwas teurer. Bei beiden, die in Säcken à 100 kg gehandelt werden, werden die Qualitäten superior und prima unterschieden.
Anatomie. Die Stärkekörner variieren in der Größe außerordentlich. Von ganz kleinen, wenige mik großen findet man alle Übergänge bis zu Körnern von 90, 100 mik und darüber (selten 110–145) Längsdurchmesser. Die größten erscheinen daher schon mit bloßem Auge als feine helle Pünktchen. In der Kartoffelstärke des Handels fehlen jedoch die ganz kleinen und oft auch die ganz großen, denn sie ist ja ein Schlämmprodukt. Die Fabrikation erzeugt jetzt oft durch sorgfältiges Schlemmen Kartoffel-Stärkesorten, die bald kleine, bald mittlere, bald große Stärkekörner enthalten. Die besten Sorten enthalten die größten Körner. So fand SAARE den mittleren Durchmesser bei Superior 32,8–35,5, bei Prima 21, bei Sekunda 16,9, bei Tertia 12,5 mik. Alle Körner sind exzentrisch (⅓–⅙), was leicht durch das Polarisationsmikroskop festgestellt werden kann. Der Kern liegt am schmäleren Ende der entweder rein ovalen oder unregelmäßig rhombischen, keil- oder beilförmigen, oder ellipsoidischen Körner. Meist ist auch die Schichtung sehr deutlich: einige grobe und zahlreiche sehr feine Schichten. Als Nebenform findet man kleine rundliche und mittelgroße, halb- oder ganz- (zu 2–3) zusammengesetzte Körner mit oft tiaraförmigen Teilkörnern.

Kartoffelstärke. y zusammengesetzte, x halbzusammengesetzte Körner.
[Nach Tschirch-Oesterle, Atlas.]
Chemie. Trockene Kartoffelstärke enthält durchschnittlich: 79,64% Stärke, 19,22% Wasser, 0,69% Stickstoffsubstanz, 0,33% Asche, 0,08% Rohfaser und 0,04%[S. 164] Fett. Grüne (feuchte) Kartoffelstärke enthält nach SAARE im Durchschnitt: 48,5% Wasser, 50,5% Stärke, 0,12% Fruchtwasserreste, 0,22% Sand, 0,15% Faser. Kartoffelstärke reagiert schwach sauer (Schwefelsäure aus dem Sedimenteur oder Milchsäure vom VÖLCKERprozeß). Langes Auswaschen mit verdünntem Ammoniak entfernt die Säure (FESCA). SOXHLET fand (vor längerer Zeit) in der Kartoffelstärke 0,108 bis 0,765 (im Mittel 0,331)% freie Säure auf Milchsäure berechnet. Sehr selten reagiert Kartoffelstärke alkalisch. Der aus Kartoffelstärke bereitete Kleister ist klar (Unterschied von Weizenstärkekleister) und riecht unangenehm durch aus der Fabrikation herrührende Zersetzungsprodukte, die von den Körnern absorbiert wurden. Dieser sog. Krautgeruch tritt besonders beim Behandeln mit Schwefelsäure oder Salzsäure hervor. PAYEN isolierte den riechenden Körper, der nur höchstens zu 0,01% vorhanden ist. Er läßt sich durch Soda entfernen (MARTIN). Kartoffelkleister schäumt nicht, wie die kleberhaltigen Kleister der Cerealien.
Verfälschung. Kartoffelstärke wird öfter zur Verfälschung anderer Stärke- oder Mehlsorten benutzt, doch ist beste Kartoffelstärke teurer als feinstes Weizenmehl. Daher findet man auch bisweilen umgekehrt Kartoffelstärke mit anderen Mehlen vermischt. Hier entscheidet das Mikroskop. Kartoffelstärke verkleistert mit Alkalien (z. B. 2–4% Ätzkali) leichter als Weizenstärke. Darauf wurde ein Nachweis der Kartoffelstärke im Weizenmehl gegründet (KRÜGER 1885). Die mikroskopische Prüfung ist aber sicherer und rascher.
Prüfung. Für die Prüfung kommt in erster Linie das Mikroskop in Betracht. Der Wassergehalt soll 16% nicht viel überschreiten (max. 18%), was entweder mit dem (übrigens nur unsichere Resultate gebenden) BLOCHschen Fekulometer oder durch direkte Trockengewichtsbestimmung (SAARE) ermittelt wird. Die Asche darf 0,5% nicht übersteigen, der Rohfasergehalt nicht 0,2–0,3%.
Anwendung. Kartoffelstärke ist ein wichtiges Appreturmittel und wird zum Stärken und Leimen des Papiers viel benutzt, neuerdings auch zur Herstellung von sog. deutschen Sago (Kartoffelsago, Kartoffeltapioka, imitierter Sago), minderwertigen Macaronis, Vermicelli usw. herangezogen. Sie wird in der Papierfabrikation, zum Stärken der Wäsche, zum Appretieren feiner Gewebe, zur Weberschlichte, beim Zeugdruck, zur Kleisterdarstellung, zur Fabrikation von Stärkezucker, Stärkesirup und Dextrin (Leiogomma), zur Herstellung von Puder (Poudre de riz, P. de serail, Blanc végétal) und Celluloid (C. A. WOLFF) und zum Auspudern der Formen der Metallgießereien benutzt. Sie dient auch für sich selbst und in Gemisch mit anderen Stärkesorten als Nährmittel (Kraftmehl, Amidon, Solanta, Semoule d’Igname) — ist aber nur von wenigen Pharmakopoëen (franz., holl.) aufgenommen. Die Waschblaukugeln bestehen aus Gips, Kartoffel- und Weizenstärke mit einem Zusatz von Ultramarin, Smalte oder einem anderen blauen Farbstoffe, die Glanzstärke enthält Stearinsäure, Walrat, Gummi, Borax u. a. mehr.
Geschichte. Die Heimat der Kartoffel ist Chile und Peru (DE CANDOLLE). Es ist aber nicht sicher, ob wirklich das Mehl der in der Sonne getrockneten Kartoffeln bei den Eingeborenen von Peru und Chile seit Urzeiten in Gebrauch war. Die Chuña ist etwas anderes. Nämlich eine seit Jahrhunderten benutzte, noch heute dargestellte, aus gefrorenen Kartoffeln (vielleicht von Solanum Maglia SCHLCHTDL. oder Sol. immite DUNAL?) in den Anden Südamerikas bereitete Konserve (HARTWICH). Jedenfalls fand PIZARRO 1526 in Peru und DIEGO D’ALMAGRO 1535 in Chile Kartoffeln in reichlicher Benutzung, als sie das Land betraten und die Kultur der Pflanze bestand zu jener Zeit in Südamerika von Chile bis nach Neu-Granada. Möglicherweise, ACOSTA bestätigt dies für Peru, CIECA für Quito (I, S. 762), bestand diese Kultur dort schon seit langer Zeit, wie in Brasilien die Kultur des verwandten Solanum Commersonii, während sie in Mexiko unbekannt war. Die Europäer schenkten aber ebenso wie die Eingeborenen Chiles der Pflanze keine besondere Beachtung. Die Spanier brachten Mitte des XVI. Jahrh. die Pflanze nach Europa und sie scheint zuerst in Sevilla als Zierpflanze angebaut worden zu sein. WALTER RALEIGH und THOMAS HERRIOTT, sowie HAWKINS brachten 1585 (1586) Kartoffelknollen[S. 165] von Virginien (Carolina), wohin Solanum tuberosum wohl aus Südamerika gekommen war, nach Europa (Island). GERARD (Herbal, vgl. I, S. 909) hatte die Pflanze 1597 in seinem Garten, vielleicht auch 1587 der Breslauer Arzt SCHOLZ. CLUSIUS, der sie 1588 von PHILIPPE DE SIVRY erhielt und in Wien kultivierte, beschrieb sie und bildete sie unter dem Namen Papas Peruanorum ab (Rarior. plant. historia). Ende des XVI. oder Anfang des XVII. Jahrh. war die Kultur der Kartoffel in Toscana verbreitet (PATER MAGAZZINI) und als RALEIGH 1623 nochmals und mit besserem Erfolge als das erste Mal Anbauversuche machte, waren die Tartufoli schon in Spanien und Italien gut bekannt. 1588 kam die Kartoffel nach Wien, 1591 nach Dresden. Anfang des XVII. Jahrh. waren die Blüten bei der Pariser Hofgesellschaft sehr beliebt und 1616 kam der Knollen als besonderer Leckerbissen auf die königliche Tafel. Die Knollen, von denen diese Kultur ausging, stammten nicht von RALEIGH, sondern waren wohl direkt oder indirekt (über Spanien) von Südamerika importiert. In Europa wurde die Kartoffel besonders durch FRANCIS DRACE (I, S. 751), einem Verwandten von HAWKINS gegen Ende des XVI. Jahrh. bekannt, doch ist es zweifelhaft, ob die von DRACE ursprünglich eingeführte Knollenfrucht nicht die Batate war. Von Italien kam die Kartoffel und ihr Name (s. oben) nach Deutschland und wurde dort Mitte des XVIII. Jahrh. heimisch. Ihre Kultur verbreitete sich aber nur langsam. 1678 fand sich die Pflanze in den Gärten des GROSSEN KURFÜRSTEN, 1680 baute sie der Bauer HANS ROGLER in Selb (Nordost-Bayern) auf dem Felde. Und nun breitete sich in Bayern und im Vogtlande der Anbau aus, der von den Kanzeln herab empfohlen wurde. Noch FRIEDRICH DER GROSSE mußte im Teuerungsjahr 1745 energisch für sie eintreten und festen Fuß hat sie bei uns eigentlich erst im Anfang des XIX. Jahrh. gefaßt. Die russische Regierung zahlte noch Mitte des XIX. Jahrh. Prämien für den Anbau. In größerem Maßstabe wird sie seit 1684 in Lancashire (England), seit 1717 in Sachsen, seit 1728 in Schottland, seit 1738 in Preußen (im größeren Maßstabe seit den Jahren 1770–1772), seit 1783 in Frankreich angebaut. Dort wirkte der Apotheker PARMENTIER für sie und noch heute heißt die Kartoffelsuppe in Frankreich Soupe Parmentier. Jetzt hat sich die Kartoffel sogar die Tropen (Gebirge in Java) und das arktische Gebiet (Hammerfest) erobert.
Die Stammform von Solanum tuberosum nennt ALPH. DE CANDOLLE: S. tuberosum α Chiloense (gefunden 1862 von PHILIPPI auf der lnsel Chiloe). Er unterscheidet von ihr die Varietäten β cultum, γ Sabini und δ Maglia. Doch faßt BAKER den Begriff S. tuberosum weiter. Nach ihm erstreckt sich das Verbreitungsgebiet nicht nur über Chile und Peru, sondern auch über Ecuador, Columbia, Costarica, Mexiko und die südwestlichen Staaten von Nordamerika.
Lit. Abbild. der Pflanze bei WETTSTEIN in ENGLER-PRANTL, Pflanzenfamilien. — SAARE, Fabrikation der Kartoffelstärke. 1897. — HARVEY W. WILEY, The manufacture of Starch from potatoes and Cassava. U. St. Dep. Agr. Div. chem. Bull. 58 (1900). — TSCHIRCH, Realenzyklop. d. Ges. Pharm. und TSCHIRCH-OESTERLE, Anatom. Atlas. — DE CANDOLLE, Geogr. bot. raison. und L’origine des plant. cult. 4 edit. 1896 (dort die Literatur). — WIESNER, Rohstoffe. — Zahlreiche Analysen bei KÖNIG. — Zur Geschichte der Kartoffel. Prometheus 1910, S. 384. — HARTWICH u. JAMA, Chuña. Schweiz. Wochenschr. 1909, 313. — H. JUMELLE, Les plantes à tubercules alimentaires (avec 15 Fig.). Paris 1910.
Vgl. auch E. SCHULZE, Vorkommen von Hexonbasen in d. Knollen d. Kartoffel. Landw. Vers. Stat. 1903. — Über das Solanin der Kartoffeln vgl.: FIRBAS, Monatsh. d. Chem. 1889, 541. — SCHNELL, Apoth. Zeit. 1898, 775. — BAUER, Zeitschr. Angew. Chem. 1899, 99. — WEIL, Pharm. Zeit. 1900. — WINTGEN, Arch. d. Pharm. 1906, 360. — Über das Vanillin der Kartoffelschalen vgl. BRÄUTIGAM, Pharm. Zeit. 1900, 165. — Die Blüten der Kartoffelpflanze enthalten ein mydriatisches Alkaloid neben Betain (SCHÜTTE).
b) Arrowroots.
Unter diesem Namen, der aus arrow (= Pfeil) und root (= Wurzel) gebildet ist, begreift man alle aus tropischen Pflanzen, besonders den unterirdischen Organen derselben, hergestellte Stärkemehle. Das Arrowroot par excellence ist das Amylum marantae. Pfeilwurzel ist der Name der Maranta arundinacea und scheint das englische Wort dafür Arrow root, das bereits 1791 (OLAF SWARTZ, Observat.) und schon früher üblich war und dann auf das Stärkemehl übertragen wurde, in die südamerikanischen[S. 166] Sprachen (brasil.: araruta) übergegangen (SPRUCE) und nicht, wie MARTIUS will, aus dem indianischen aru aru (= Mehl, ursprünglich für Manihot benutzt) oder aru (= Mehl) und ruta (= Wurzel), oder aruac, dem Namen eines Volksstammes am Rio Negro, oder, wie ROSCOË meint, aus arri (dem Namen der Pflanze bei den Indianern Guianas) entstanden zu sein. Der Name Pfeilwurz soll vielmehr daher rühren, daß die Rhizome als Antidot gegen Pfeilgift von den südamerikanischen Indianern benutzt werden (SLOANE 1687). 1750 wurde ihr Saft, z. B. auf Barbados, als Gegengift getrunken (HUGHES). Auch BROWN erwähnt 1756 die Eigenschaften als Gegengift. «In der Tat wird der ausgedrückte Saft auch von manchen weißen Bewohnern des tropischen Amerika als Gegenmittel gegen Gift und als Heilmittel für schmerzhafte Bisse von Insekten und Reptilien noch heute empfohlen» (PECKOLT, SEMLER).
Lit. TSCHIRCH, Arrowroot in Real-Enzyklop. d. ges. Pharm. — Analysen seltener Arrowroots bei BALLAND, Journ. pharm. chim. (6) 17, 476 (Jahresber. Pharm. 1903, 555). Die dazu gehörigen mikroskop. Bestimmungen in HESS, Unters. trop. Stärken. Zeitschr. Öster. Apoth. Ver. 1906, 25 (mit Abbild.). — Die etymologischen Angaben I, S. 1063, Z. 18 sind zu berichtigen.
1. Westindisches Arrowroot.
Syn. Amylum marantae, Amylum Arrow, Ararutamehl — Pfeilwurzelmehl, Kraftmehl —, St. Vincent Arrowroot, Natal-, Jamaika-, Bermudas-Arrowroot — Arrowroot de la Jamaique. Auch: ostindisches, brasilianisches, afrikanisches Arrowroot.
Stammpflanze und Systemat. Stellung. Maranta arundinacea L. (LINNÉ, Spec. plant. 2.) nebst den Kulturformen: Maranta indica TUSSAC und M. ramosissima WALL. — Marantaceae, Maranteae.
Etym. Maranta wurde von PLUMIER nach BARTOLOMEO MARANTA (I, S. 851) benannt, dessen Werk Methodi cognoscendorum simplicium libri tres. Venet. 1559, schon den Versuch einer Organographie und einer Definierung des Artbegriffes enthält. Die Artbezeichnung arundinacea erinnert an den rohrartigen Habitus (arundo) — Bez. Arrowroot s. oben.
Beschreibung. Maranta arundinacea ist eine 1½–3 m hohe Staude mit länglich-ei-lanzettlichen, schwach behaarten Blättern, weißen Blüten und violetten Samen (Fig. 58). Die Kulturform M. indica, die sich zuerst auf Jamaica gebildet hat und die jetzt viel in Vorderindien kultiviert wird, hat breitere, kahle Blätter und weiße Samen. Die Pflanze ist ursprünglich in Dominica heimisch, aber (schon im XVIII. Jahrh.) zunächst nach Barbados und Jamaica, dann auch nach St. Vincent, Haiti und Mexiko gebracht worden.
Die Pflanze bildet ein ziemlich großes unterirdisches Sproßsystem mit zahlreichen, etwa daumenstarken Gliedern («Fingern»). Diese Speichersprosse, die wie die Kartoffeln aus den angeschwollenen Enden unterirdischer Achsen bestehen, sind keulenförmig, von gelblicher Farbe, in Abständen von 2–2,5 cm gegliedert und dort mit den faserigen Resten der Niederblätter besetzt (Fig. 59).
Zur Zeit wo die Stengel absterben ist das Rhizom am stärkereichsten. Es enthält alsdann 25–27% Stärke (und ziemlich viel Kali und Phosphorsäure). Zu dieser Zeit wird es geerntet.
Die Marantarhizome enthalten (nach MACDONALD, LEUSCHNER und WATTS) c. 27% Stärke, 63% Wasser, 1,5% Stickstoffsubstanz, 2–4% Dextrin, Zucker usw., 2,8–3,9% Rohfaser, 0,3% Fett, 1,2% Asche, die sehr reich an Kali ist (54,06% K2CO3).
Pathologie. Sphaerostilbe repens BERK. et BR. ist als Parasit in dem Rhizom von Maranta arundinacea aufgefunden worden, wo er in Form von Rhizomorphen auftritt (ED. FISCHER).
[S. 167]
Kultur. Die Kulturen auf den Bermuden (bes. Long Island) liefern das feinste Arrowroot, da die Bereitung dort am sorgfältigsten betrieben wird. Noch Anfang der siebziger Jahre des XIX. Jahrh. standen sie in erster Reihe, dann ging die Produktion zurück und in den achtziger Jahren betrug der Export kaum 1000 kg. Dann hat sich aber die Produktion wieder gehoben und noch heute erzielt das Arrowroot der Bermuden die höchsten Preise. Das zweitbeste ist das von Jamaica, aber auch dort sind die Kulturen stark zurückgegangen. Gering ist der Anbau in Grenada und auf der Insel Montserrat. Auf Barbados, Tortola und Antigua ist er aufgegeben. Dagegen sind die Kulturen auf der kleinen englischen Insel St. Vincent, besonders in den Distrikten Coomera und Pimpana, ständig in die Höhe gegangen, so daß diese Insel jetzt wichtigste Quelle für Marantastärke geworden ist. Nur diese ist jetzt im Großhandel. Die Produktion erreicht 1 Mill. kg. Auch in Natal, der zweitwichtigsten Bezugsquelle, ist die Produktion im Steigen (c. 3000 Kisten im Jahr), ebenso in Südbrasilien (Rio de Janeiro, Espirito Santo, Sa. Catharina und Para) — hier wird aber fast nur für den eigenen Bedarf fabriziert. Dies gilt auch für die Canarischen Inseln, Liberia, Lagos, Sierra Leone, Madagascar und das Capland.

Maranta arundinacea.
[Koloniaal Museum Haarlem.]
[S. 168]
Indien kultiviert in Madras, Bengalen, Bombay und Pondichery, sowie auf Ceylon und in Burma (wie es scheint ist das Rhizom hier stärkeärmer). Australien kultiviert in Queensland und Neu-Süd-Wales.
LOUIS PLANCHON hatte 1909 Muster von Martinique, Annam, Cochinchina, Guadeloupe, Guyana, Madagascar in Händen.
Die Kulturmethode hat mit der der Kartoffel viel Ähnlichkeit. Man setzt Abschnitte, besonders die knospentragenden Endstücke der Wurzelstöcke («Saatwurzeln») oder benutzt junge Schößlinge als Saatgut, die man in Abständen von 15 cm setzt. Nach 8–12 Monaten kann geerntet werden. Auf den Bermuden wird im Mai gepflanzt und im März und April geerntet. Man hebt die ganze Pflanze aus dem Boden, schneidet die Rhizome ab und benutzt das Kraut als Gründüngung. 1000 qm Land liefern etwa 6240 kg Knollen, die 1296–1370 kg Stärke geben. Die Kultur ist leicht zu erlernen, verlangt kein großes Kapital und gibt mit wenig Düngung bald Erträgnisse auf relativ schlechtem Boden. Nur ist ein frostfreies, tropisches oder subtropisches Klima erforderlich.
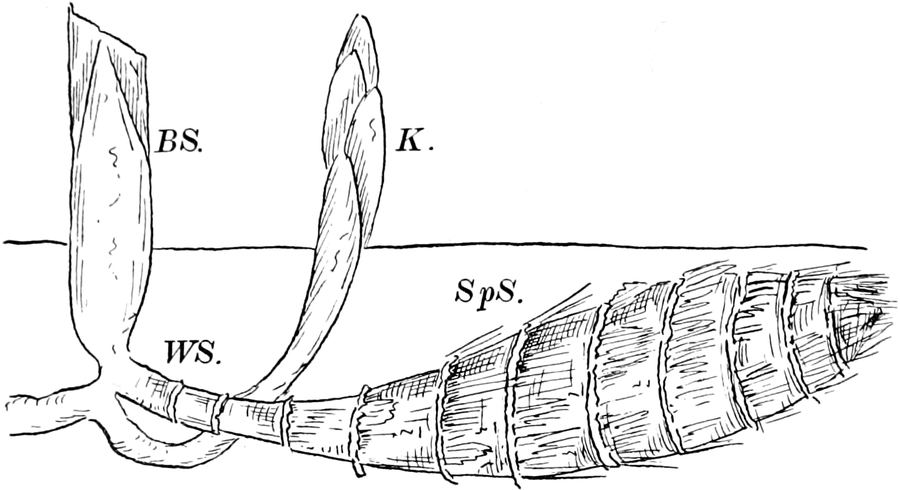
Die unterirdischen Organe von Maranta arundinacea.
Sps. Speichersproß, WS. Wandersproß, K. Knospe, BS. Blätter und Blüten bildender Sproß.
[Tschirch.]
Darstellung der Marantastärke. Die Ausbeute an Stärke aus den Knollen, die etwa 52–83 g wiegen (PECKOLT), ist 15–19% (EBERHARD erhielt 20,78%). Die Fabrikation ist auf den Bermuden teils Groß-, teils Hausindustrie. Sie wird mit großer Sorgfalt betrieben. Die gewaschenen Rhizome werden zunächst sehr sorgfältig geschält (die Schale enthält einen Bitterstoff), dann nochmals gewaschen und zu einem Brei zerquetscht. Der Brei fällt dann in einen feindurchlöcherten Zylinder, in dem sich eine mit hölzernen Schaufeln besetzte Walze dreht. Die durch die Löcher gehende Stärkemilch wird in Sedimenteurs absetzen gelassen, die Stärke vom Wasser getrennt und in flachen Kesseln mehrmals gewaschen. Die Stärke wird alsdann, nachdem die obere Schicht entfernt wurde, mit neusilbernen Schöpflöffeln in flache Kupferpfannen gebracht, diese mit Gaze überbunden und in die Sonne gestellt. Die trockene Stärke wird in mit Papier ausgekleidete Fässer gebracht.
In St. Vincent schält man die Rhizome nicht. Sie kommen nach dem Waschen[S. 169] in den Pulper. Die Pulpa wird handgesiebt und die Stärkemilch durch mehrere Siebkolonnen in mit weißglasierten Ziegeln ausgemauerte Senkbassins geschickt. Der Absatz wird dann wiederholt unter Schlagen mit hölzernen Stöcken mit Wasser gewaschen. Das Vortrocknen erfolgt auf Horden, dann legt man die halbtrockene Stärke in eigenen Trockenhäusern locker auf siebartig durchbrochene Drahtunterlagen. «Durch das Austrocknen brechen die zuerst auf die oberste Etage gelegten Stücke auf und fallen auf die nächste Etage, bis sie schließlich fein gekörnt auf die unterste Etage gelangen» (SEMLER). In drei Tagen muß die Trocknung beendet sein. Dann gelangt das Arrowroot in Zinnkästen oder in mit Papier ausgeklebte Fässer. Äußerste Sauberkeit wird beobachtet, alle Geräte sind von Kupfer, Messing, Neusilber usw., alle riechenden Substanzen werden ferngehalten.
In Hausindustrie stellten schon die westindischen Neger Arrowroot dar: durch Zerstampfen der Wurzelstücke in hölzernen Mörsern. Jetzt wird Arrowroot im Kleinbetrieb auch auf den Bermuden bereitet. Die gewaschenen und geschälten Rhizome werden in einfachen Reibmaschinen zerrieben, der Brei nacheinander auf drei Haarsieben von verschiedener Maschenweite mit Wasser ausgewaschen, die Stärkemilch absetzen gelassen und vom Satzmehl die obere Schicht mit einem neusilbernen Löffel abgekratzt, dann wird die Stärke nochmals gewaschen und schließlich in Horden auf Siebtuch mit Gaze bedeckt in der Sonne getrocknet.
Handel. St. Vincent-Arrowroot ist in Barrels à 100 kg im Handel (extra prima 00 und prima 0) — eine besonders gute Sorte auch wohl in Kisten mit vier Dosen à 20 kg.
Das Tonkin-(Maranta-)Arrowroot (Bot-Hoang-Tinh) ist bisweilen in Papier gewickelt in kleinen Paketen von 15 mm Durchmesser im Handel (Abbild. bei LOUIS PLANCHON).
Der Arrowroot-Export aus St. Vincent erreichte 1908 einen Wert von 27713 Pfund Sterling. Die Einfuhr von Arrowroot nach London betrug 1906: 14772, 1907: 11087, 1908: 12337, 1909: 13936 barrels, und 1906: 255, 1907: 36, 1908: 109 boxes and tins. Pfeilwurz(-mehl?) ist auch Ausfuhrartikel von Deutsch-Ostafrika (BRAUN).

Marantastärke.
[Tschirch-Oesterle, Atlas.]
Beschreibung. Marantastärke ist dadurch ausgezeichnet, daß sie zwischen den Fingern gerieben ein eigentümliches knirschendes Geräusch hervorruft.
Sie liefert mit siedendem Wasser einen farb-, geruch-, und geschmacklosen, durchsichtigen und schleimigen Kleister, der einen lichtbläulichen Schimmer besitzt.
Der Grund, warum von vielen das westindische Arrowroot vorgezogen wird, ist der, daß es infolge seiner Bereitung immer neutral ist[S. 170] (Kartoffelstärke ist das nie, sie reagiert wie Weizenstärke immer sauer, Reisstärke alkalisch) und infolge der großen, auf die Herstellung verwendeten Sorgfalt die reinste Stärke des Handels ist.
Marantastärke zeigt deutliches Aufquellen bei 66,2°, Beginn der Verkleisterung bei 66,2° und vollständige Verkleisterung bei 70° (LIPPMANN).
Anatomie. Die Stärkekörner (Fig. 60) sind sehr verschieden gestaltet. Rundliche, ovale, ei- oder birnförmige bilden die Hauptmasse, daneben finden sich dreieckige, spindelige, keulen- oder birnförmige, ja bisweilen sogar viereckige oder rhomboidische. Einige, die als «Leiter» dienen können, sind seitlich genabelt. Viele haben einen zentralen oder (häufiger) exzentrisch, meist am breiteren Ende, gelegenen Spalt. Die Exzentrizität des Kerns beträgt meist ½–⅓. Die Schichtung ist oft deutlich, aber zarter als bei der Kartoffelstärke. Die Körner sind dick-rundlich oder doch nur schwach abgeplattet.
Die Größe variiert sehr, meist beträgt sie 30–40 mik. Die kleinen sind oft nur 7,5–15 mik., die großen erreichen 45–55, selten 60 mik. (St. Vincent A.) oder gar 70–75 mik. (Bermudas A.). Die größten Körner sind also mit der Lupe zu erkennen. Zusammengesetzte Körner fehlen (MOELLER, TSCHIRCH).
Verfälschung. LOUIS PLANCHON beobachtete 1910 Maniok, MITLACHER 1904 Weizen-, Mais-, Bohnen- und Reisstärke, BROWN 1891 Kartoffelstärke, WAAGE 1893 Tahiti Arrowroot (von Tacca pinnatifida), ich selbst 1898 ostindisches Arrowroot (von Curcuma) als Verfälschung bzw. Ersatz des westindischen Arrowroot. Das Mikroskop läßt alle diese leicht erkennen. Curcumastärke und Manihot dürften der Marantastärke ziemlich gleichwertig sein.
Marantastärke darf nicht über 15% Wasser und 0,5% Asche enthalten (HAUKE).
Anwendung. Arrowroot wird ziemlich viel in der Schokoladefabrikation verbraucht. Dann als «Kraftmehl» in der Medizin (Kindernährmittel). Es ist das teuerste aller Stärkemehle.
Geschichte. Die Pflanze wird zuerst von SLOANE 1696 erwähnt, der sie Canna indica radice alba alexipharmaca nennt. Sie wurde in Dominica entdeckt und schon 1756 in vielen Gärten auf Jamaika kultiviert. HUGHES und BROWNE erwähnen bereits die Darstellung des Mehles und halten es für besser als Weizenstärke. Die Schrift JOS. SCHNEIDER, Über Systemsucht unter den Ärzten nebst einem Anhang über Arrow Root und Crotonöl, Fulda 1823, scheint die erste Beschreibung und Empfehlung des Marantaarrowroot für medizinische Zwecke zu enthalten. Wenigstens bemerkt PFAFF (System der Materia medica 1824), daß es Anfang der zwanziger Jahre des XIX. Jahrh. zuerst in den Handel gebracht worden sei. Er bemerkt auch bereits, daß es keine Vorzüge vor unserer heimischen Stärke besitze. Doch scheint es schon früher, Ende des XVIII. Jahrh. (1799), in beschränktem Maße von Jamaika exportiert worden zu sein (RENNIE Hist. of Jamaica). In England war es im Anfang des XIX. Jahrh. in Gebrauch. Die Rhizome und die Darstellung der Marantastärke beschrieben zuerst TUSSAC (Flore des Antilles 1808, 1, 183) und LUNAN (Hortus jamaicensis 1814). BROWNE beobachtete 1756, daß der Wurzelstock der Pflanze auf Jamaica gemahlen als Nahrungsmittel benutzt wurde. Die erste Einführung der Pflanze nach England 1732 wird HOUSTON zugeschrieben. Nach Indien (die Gattung Maranta fehlt der alten Welt) kam sie (wahrscheinlich zunächst die Form M. ramosissima) ungefähr 1830 über das Capland (WATT, Diction.). Sie wird seitdem dort kultiviert, in größerem Maße seit 1840. Im XIX. Jahrh. kam sie auch nach der Küste von Guinea (HOOKER, Nigerflora), nach Natal, Südafrika, Brasilien und den Bermuden, einer kleinen Inselgruppe nördlich von den Antillen, wo sie jetzt überall kultiviert wird. In St. Vincent befinden sich jetzt die umfangreichsten Kulturen. In Australien (Neu Süd Wales) wird die verwandte Art, M. nobilis MOORE, gebaut.
Lit. KÖRNICKE, Monograph. Marantear. Prodr. Bull. soc. imp. d. natur. Moscou 1862.[S. 171] — Abbild.: HAYNE 9 t. 25/26 (cop. nach REDOUTÉ, Liliac. t. 57 u. TUSSAC, Flore des Antilles t. 26). — Düsseldorfer Abbild. 13 t. 10/11. — ROSCOE, Monandrous plants of the order Scitamineae. Liverp. 1828 t. 25. — BENTLEY-TRIMEN, Medicinal plants t. 265. — PETERSEN, Marantaceen in ENGLER-PRANTL, Pflanzenfam. — Dann: SLOANE, Catal. plant., quae in insula Jamaica etc. London 1696, 122 und History of Jamaica 1707, 253. — BROWNE, Civil and nat. hist. of Jamaica 1756. — GRISEBACH, Flora of the Brit. West Ind. Islands 1864. — FLÜCKIGER-HANBURY, Pharmacographia.
Bereitung in Westindien: LEUSCHNER, Zeitschr. f. öffentl. Chemie 1902 (Pharm. Zeit. 1902, 200), Ber. d. pharm. Ges. 1904. SEMLER, Trop. Agrikultur. MACDONALD, Pharm. Journ. 1887, 1042, — in Queensland: Pharm. Journ. 1882, 224; — in Brasilien: EBERHARD (HIRSCHBERG), Arch. Pharm. 134 (1868), 257. WIMMEL, Hamb. Gewerbebl. 1868 (Jahresb. d. Ph. 1869). PECKOLT, Brasilian. Nutz- u. Heilpfl. (Marantaceen), Pharm. Rundschau. New York 1894, 87; — in Sansibar: Pharm. Journ. 1893, 789. — In Indien: WATT, Dictionary econ. prod. Ind. V, 182.
Ferner: WIESNER, Rohstoffe. — HANAUSEK, Pharm. Centralh. 1889. — TSCHIRCH-OESTERLE, Anatom. Atlas. — TSCHIRCH, Arrowroot in Realenzyklop. d. ges. Pharm. I. — JOS. MOELLER, Mikroskopie. — MACDONALD, Journ. soc. chem. ind. 6 (1887), 334. — WATTS Pharm. Journ. 1894, 624 (Kew Bulletin 84). — LOUIS PLANCHON et JUILLET, Ann. Mus. col. Mars. 1910. — Asche: HAUKE, Zeitschr. Österr. Apoth. Ver. 1902. Über andere stärkeliefernde Marantaarten s. WIESNER, Rohstoffe. II. Aufl.
2. Maniok.
Syn. Maniok und Mandioca (in Brasilien, Argentinien und Paraguay), Brasilianisches Arrowroot, Amylum brasiliense — Bahia-, Rio-, Para-Arrowroot — Cassava, Cassave oder Cassada (in Westindien und den Ver. Staaten) — Yuca oder Juca (in Zentralamerika, Columbien, Venezuela, Peru, Ecuador, Bolivien) — Pan de tierra caliente (in Chile), — Fécule de Yuca, amidon de Yuca. — Maravuli (in Indien) — Marachini (malaiisch). — Brasilian. Arrowroot ex parte. — Moussache. — Verarbeitet: Tapioca.
Stammpflanze und systemat. Stellung. Manihot utilissima POHL (Jatropha Manihot L., Janipha Manihot KUNTH — Mandioca brava [brasil.], Yuca amarga [Chile], bitterer Maniok) liefert vornehmlich den aus Südamerika exportierten Maniok. Dann auch Manihot Aipi POHL (M. palmata MÜLL. ARG., — Mandioca mansa oder aipim [brasil.], Yuca dulce (Chile), süßer Maniok), vielleicht nur eine Varietät von M. utiliss. oder M. palmata und endlich M. carthaginiensis MÜLL. ARG. (Jatropha Janipha L., Manihot Janipha POHL). — Euphorbiaceae Platylobeae-Crotonoideae-Manihoteae.
Beide Haupt-Manihotarten sind in den Tropen Südamerikas heimisch (M. utiliss. wohl im unteren Amazonastale), aber frühzeitig zunächst nach Westindien, dann nach Vorder- und Hinterindien (Malacca), dem malaiischen Archipel und endlich auch nach Polynesien und Afrika gebracht worden.
Kultur. Ihre Kultur hat sich in allen diesen Ländern rasch ausgebreitet und Maniok wurde ein wichtiges Nahrungsmittel der Tropen. In Südamerika ist Maniok, der übrigens auch in Neugranada, Peru und Ecuador gebaut wird, so wichtig wie bei uns die Kartoffel. In Ostafrika findet man ihn in jedem Negerdorf. Neuerdings wird Manihot utilissima auch im südlichen Florida in größerem Umfange kultiviert, sowie in Ceylon (hier in Mischkultur mit Eleusine caracana).
Manihot utiliss. ist ein Strauch, dessen Blätter einige Ähnlichkeit mit den Blättern des ja auch zu den Euphorbiaceen gehörigen Ricinusstrauches besitzen und dessen Früchte breit geflügelt sind (Unterschied von M. Aipi). Die Pflanze bildet zahlreiche (5–8) große, meist 25–45 cm lange Knollen, die bisweilen eine Länge von 60 cm[S. 172] und ein Gewicht von 4 kg erreichen können (SEMLER). Selten sind Knollen von 12–15 kg Gewicht. Im Durchschnitt liefert eine Pflanze nicht mehr als 4–6 kg Knollen. M. Aipi mit kleineren Knollen wird im allgemeinen weniger (besonders in Paraguay und Neu-Caledonien) angebaut. Den meisten Manihot baut Brasilien, wo besonders in den Küstenprovinzen gegen 30 Spielarten kultiviert werden. Das Maniokmehl ist ein ebenso wichtiges Nahrungsmittel wie Reis, Sago und Weizenmehl. Die Kultur der Pflanze ist sehr einfach. Sie gedeiht am besten in der Nähe des Meeres und an Flußufern. Sie braucht tropisches Klima, besonders Luftfeuchtigkeit. Die Vermehrung geschieht durch Stecklinge. Die westindischen Pflanzer erzielen durch Unterdrückung der Blüte größere Knollen. In den Straits Settlements erntet man nach 9–10 Monaten. Dann ist der Knollen am stärkereichsten.
Die Knollen enthalten 17–39% Stärke und 3,5% Eiweiß. Die Knollen des bitteren Maniok enthalten 0,0132–0,0442%, die des süßen 0,0102–0,0238% Blausäure. Ein Teil der Blausäure scheint sich in glykosidischer Bindung zu finden, denn die Giftigkeit auch der süßen Knollen steigt durch mehrtägiges Liegen oder durch Gärung (SEMLER).
Während in den Tropen die Knollen von Manihot utilissima sehr viel Blausäure enthalten, sind die im subtropischen Florida kultivierten Kulturformen so arm daran, daß man sie ohne weiteres genießen kann. Die Pflanze trägt dort den Namen «süße Cassava», da sie 17% Zucker enthält. In den Wurzeln, Blättern, Blüten und unreifen Früchten findet sich auch Aceton (ROMBURGH).
Bereitung des Mehls und der Tapioka. Brasilien produziert in den Nordprovinzen besonders Maniokmehl (Farinha), d. h. die ganze zerriebene und getrocknete Wurzel. Tapiokafabrikation wird (in Hausindustrie) besonders in Bahia, Minas und Rio de Janeiro betrieben. Gering ist die Produktion auf den Capverden und Mascarenen, sowie auf Réunion, wo auch Tapioka fabriziert wird, auf Martinique, Guadeloupe, Travancore, Guiana. Enorm ist der Anbau der Manihotpflanze durch das ganze tropische Afrika, z. B. im Kongogebiet, wo sie ein wichtiges Nahrungsmittel ist, aber keine Tapioka liefert. Neuerdings (1898) wird Manihot auch in Togo gebaut und Stärke daraus dargestellt. Merkwürdigerweise hat sich dagegen gerade in den Gegenden, wo Maniok von vornherein mit dem Sago in Wettbewerb treten mußte, d. h. in den Straits Settlements, bes. in Singapore (dann auf Malakka und in der Provinz Wellesley) nicht nur die Kultur der Pflanze, sondern auch die Bereitung der Sagoähnlichen Tapioka eingebürgert und ist die Fabrikation hier durch Einführung rationellen Maschinenbetriebes rasch zu großer Bedeutung gekommen. Sie liegt jetzt vorwiegend in europäischen Händen, doch fabrizieren auch Chinesen nach ihren alten Methoden.
Das Cassavemehl bereiten die Brasilianer, indem sie die gewässerten Knollen schälen, auf einem Reibeisen zerreiben, den Brei, nachdem er durch ein korbartiges Sieb gedrückt worden ist, in einem Sack, der unten ein Gewicht trägt, aufhängen und so von dem sehr giftigen Saft (der übrigens ein berauschendes Getränk, Tucupi, liefert) befreien. Die ausgedrückte Masse wird dann geröstet und gesiebt.
Die Maniokstärke wird in Brasilien wie Maranta-Arrowroot bereitet (s. d.). Sie ist bisweilen in Kügelchen (Carima) im Handel. Die Bereitung erfolgt in der Weise, daß die zermahlenen Knollen auf Gazesieben mit Wasser ausgewaschen werden, die Stärkemilch in Sedimenteurs geleitet und der Absatz wiederholt gewaschen wird.
Die Tapioka wird in der Weise dargestellt, daß man die gespitzten Knollen[S. 173] in großen Trommeln wäscht (I, Fig. 140), in Reibmaschinen zerreibt und den Brei auf Musselin- oder Messingdraht-Sieben mit Wasser auswäscht (die auf den Sieben bleibende Faser dient als Futtermittel). Die Stärkemilch wird aus dem Zylinder in eine Reihe von Bottichen gedrückt, in denen sie sich absetzt und wiederholt mit Wasser gewaschen wird (I, Fig. 141). Der Bodensatz wird herausgeschnitten und entweder auf durch künstliche Wärme geheizten flachen, viereckigen, zinnernen Behältern getrocknet (Tapiokamehl) oder noch feucht in tiefen Pfannen erwärmt, dann auf die Zinnplatten gebracht und mit hölzernen Rechen so lange gekrückt, bis durch Zusammenballen der Stückchen Schollen entstanden sind (I, Fig. 143), die man in Sortiermaschinen sortiert (Flake-[Flocken-]Tapioka) oder endlich (ähnlich wie beim Sago, s. d.) nach Hindurchpressen der feuchten Masse durch Siebe in dem bekannten, an zwei Schnüren aufgehängten Tuche durch zuckende Bewegungen gekörnt (geperlt) und dann auf erhitzten Schalen gerollt, d. h. oberflächlich verkleistert (I, Fig. 142, Pearl- [Perl-] Tapioka). Manche Fabriken perlen nur ohne zu rollen. Ich sah in Singapore drei Größen runder Tapiokakügelchen: Seed Tapioca (1–1,5 mm Durchmesser), med. Pearl (3 mm) und bulled Pearl (5 mm). Sorgfältig wird aller Staub abgehalten.
Primitiver ist die Bereitung in den chinesischen Tapiokafabriken Singapores, die ohne oder mit sehr primitiven Maschinen arbeiten (Beschreibung bei SEMLER). Auch Vorderindien und die französischen Kolonien (franz. Guayana, Martinique, Guadeloupe, Réunion, die Kolonien in Westafrika und Neucaledonien) produzieren etwas Maniokmehl. Frankreich fabriziert aus der Maniokstärke zahlreiche Produkte (Tapioka, T. Crécy, T. au cacao, T. julienne). Die Tapioka indigène ist jedoch Kartoffelstärkesago.
Man erhält c. 33% der Knollen Tapiokamehl.
Handel. Der Handel unterscheidet Perl, Graupen, Flocken, Mehl. Perl-Tapioka und Maniokmehl kommt aus Singapore in Säcken à 70 kg. Flake-Tapioka in solchen à 65 kg in den Handel. Die höchsten Preise erzielt Rio-Tapioka und beste Singapore.

Manihotstärke. x zusammengesetzte Körner.
[Nach Tschirch-Oesterle, Atlas.]
Die Ausfuhr von Tapioka aus Brasilien beträgt c. 7 Mill. Liter, die von Maniokmehl c. 8 Mill. kg. Die Einfuhr von Tapioka in Hamburg wird in den Listen jetzt nicht mehr von der des Sago getrennt (vgl. S. 182). (1898 importierte Hamburg 13500 Sack Tapioka und Maniokmehl und 22400 Sack Sago und Sagomehl.)
Deutsch-Ostafrika führte 1906: 59911, 1907: 42157 kg Maniok (Mhogo) aus.
Deutschland importierte 1909 Tapioka: 12935 dz aus Brit. Indien und 9999 dz aus Brit. Malacca.
[S. 174]
Anatomie. Die meisten Stärkekörner sind zusammengesetzt und zwar am häufigsten aus zwei Körnern, einem großen rundlichen und einem kleineren. Seltener sind die beiden Teilkörner gleich groß oder mehr wie zwei zu einem Korne vereinigt. Doch zerfallen die zusammengesetzten leicht in die Teilkörner (Fig. 61). Das Mehl besteht vorwiegend aus diesen, die oft die Form einer Kesselpauke besitzen. Einfache Körner sind selten. Die Körner haben fast alle einen zentralen, bisweilen sternförmigen Spalt.
Die Großkörner messen 15–23 mik, erreichen aber eine Größe von 25–36 mik. Die Kleinkörner messen meist 5–15 mik. Bei der geperlten und gerollten Tapioka finden sich Körner in allen Stadien der Verkleisterung: mit vergrößertem Spalt, trichterförmig erweiterter Bruchstelle und mannigfachen Verquellungen (Fig. 61 z).
Maniokstärke enthält im Mittel 84,36% Stärke, 14,47% Wasser, 0,74% Stickstoffsubstanz, 0,16% Fett, 0,06% Rohfaser und 0,21% Asche.
Geschichte. COLUMBUS traf bei den Eingeborenen der Antillen Cassave in Benutzung (I, S. 745) und auch CORTES berichtet über Yucas (I, S. 749), ebenso PETRUS MARTYR (I, S. 766) über Juca-Sorten und ihre Kultur, der auch schon ihre Schädlichkeit im frischen Zustande kannte und wußte, wie sie unschädlich zu machen sind (vgl. auch I, S. 1021). Die Pflanze hatte sich also schon in vorkolumbischer Zeit über Mittelamerika und die Inseln verbreitet. Aus Südamerika haben wir über Yuca (Caçavi) Nachrichten von JOS. DE ACOSTA (I, S. 762), aus Brasilien über Aypi und Maniot solche von JEAN DE LÉRY (Hist. d’un voyage faiet en la terre du Brésil etc. 1585). Nach Indien kam die Manihotpflanze schon Ende des XVI. Jahrh. durch die Portugiesen. Sie wurde dort besonders an der Westküste kultiviert. LINSCHOTEN (I, S. 743) erwähnt bereits 1596 ihre Kultur daselbst. Nach Calcutta kam sie 1794 von Südamerika, nach Ceylon 1786 von Mauritius. In Indien und auch in Assam dient sie als Heckenpflanze. Afrika erreichte sie ebenfalls sehr frühzeitig. Der Cassave gedenken FERNANDEZ (I, S. 755), WALTER RALEIGH (I, S. 714), PISO (I, S. 893) und MONARDES (I, S. 779). PISO bildet eine Tapiokafabrik ab. Die Blausäure fand schon HENRY 1834 in den Knollen. Über ein Bier der Indianer Guianas aus Cassave vgl. I, S. 1019.
Lit. POHL, Plant. Brasil. icones t. 23, 24. — PAX in ENGLER-PRANTL, Pflanzenfam. — BENTLEY-TRIMEN, Medicinal plants t. 235 (dort auch weitere Literatur). — BERG, Charakteristik t. 24. — Flora brasiliensis, Euphorbiac. t. 65 (1874). — Abbild. auch in TSCHIRCH, Ind. Heil- u. Nutzpfl. Taf. 111. — Die Kultur beschrieben in SEMLER, Tropische Agrikultur. — Die Bereitung auch in Flora 1869, 369 und HARVEY W. WILEY, Manufacture of starch from Potat. and Cassava. U. S. Dep. Agr. 1900. — Verbreitung in Indien in WATTS Dictionary. — Kultur in Malacca: Pharm. Post 1882. — PHILIPPI, Elem. de Botánica etc. en Chile 1869. — HENRY, Journ. de pharm. 1834. — HENRY et BOUTRON CHALARD, Journ. de pharm. 22, 118. — LACERDA, Sur l’action toxique du suc de Manioc. Compt. rend. 92, 1116. — GUIGNARD, Sur l’existence et la localisation de l’emulsine dans les plantes du genre Manihot. Bull. Soc. Bot. 41, 1894, 103. — ROMBURGH, Ann. jard. bot. Buitenz. 1899. — LEUSCHNER, Ber. d. pharm. Ges. 1904. — Anatomie in LOUIS PLANCHON et JUILLET, Ann. Mus. col. Marseille 1910.
3. Ostindisches Arrowroot.
Syn. Amylum Curcumae, A. indicum, Farina Tik, Curcumastärke, Tikhur (hind.), Tickar, Tavakhir (Bomb.), Tikor, Kooa (Tam.), Ararut-ke-gadde (Dec.), — Tikmehl, Travancorastärke. — Bombay-, Malabar-, Tellichery-Arrowroot. — Indian Arrowroot.
Etym. Tikhur und Tavakhir (ind.) abgeleitet von tavakshiri und tavakshiryeka-pattrika, den Sanskritnamen einiger Curcumaspezies.
Stammpflanze und Systemat. Stellung: Curcuma angustifolia Roxb. (Wild or East India Arrowroot, Narrow Leaved Turmeric); dann auch: Curcuma leucorhiza ROXB. (und in beschränktem Maße (nach Pharmacogr. indica): C. montana ROSC., C. longa L., C. aromatica SALISB., C. rubescens ROXB., Hitchenia caulina BAKER).
Zingiberaceae Hedychieae.
[S. 175]
Beschreibung. Curcuma angustifolia, die eigentliche Tikhur- oder ostindische Arrowrootpflanze, ist heimisch in Zentralindien, von Bengalen bis Bombay und Madras, besonders im tropischen Himalaya und Oudh, C. leucorhiza in Behar und Tikar (Tikari, Tikhar oder Tikor, südlich von Patna, unweit Gaya). C. angustifolia wird in Madras, Kanara, Cochin, Travancore, Malabar und anderen Gegenden Indiens, C. leucorhiza an der Malabarküste kultiviert. Beide besitzen ein großes, nicht gelb gefärbtes unterirdisches Speichersystem, einen Zentralknollen und viele Nebenknollen, die in Indien als Nahrungsmittel benutzt werden und aus denen man dort, besonders in Travancore, auch reichlich Stärke bereitet, die jedoch nicht so gut ist wie die Marantastärke — sie reagiert z. B. stets etwas sauer. Sie gelangt in beschränktem Maße von Malabar und Bombay zur Ausfuhr. Die Stärkekörner sind flach scheibenförmig und besitzen am schmäleren Ende gewöhnlich einen nabelartigen Ansatz, in dem der Kern liegt, dessen Exzentrizität meist beträchtlich ist: 1⁄5–1⁄17. Ihr Umriß ist also, wenn man sie von der Fläche betrachtet, sackartig. Von der Seite betrachtet sind sie lineal-länglich. Die Schichtung ist sehr dicht und zart. Die typischen Körner sind 35–60 mik lang, 25–35 mik breit und 7–8 mik dick, doch steigt der Längsdurchmesser bisweilen auf 70–80, bei C. leucorhiza sogar auf 105, ja 145 mik.
Mit Sappanholzauszug gefärbt liefert Curcumastärke ein Färbemittel, den gelâl der indischen Bazare.
Als ostindisches Arrowroot werden auch andere in Vorderindien gewonnene Stärkesorten (Maranta-, Cassave-, Canna-, Cycadeen-, Palmen-Stärke) bezeichnet.
Lit. Abbild.: ROSCOE, Monandrous plants of the order Scitamineae Liverpool 1828. — PETERSEN, in ENGLER-PRANTL, Pflanzenfamil. — ROXBURGH, Flora indica. — WATT, Dictionary. — DYMOCK, Veget. mat. med. of India. — Pharmakographia indica. — TSCHIRCH-OESTERLE, Anatom. Atlas. — L. PLANCHON et JUILLET a. a. O.
Curcuma angustifolia Roxb.
Zentralknollen mit Nebenknollen und angeschwollenen Wurzeln.
[Petersen in Engler-Prantl, Pflanzenfam.]
4. Queensland-Arrowroot.
Syn. Cannastärke, Tous les mois, Fécule de Tolomane oder Tulema (korrumpiert aus Tous les mois). Fécule de la Nouvelle Galle du Sud.
Stammpflanze und Systemat. Stellung. Canna edulis EDW. (C. edulis Ker. Bot. Reg. IX 775). Dann auch in beschränktem Maße: Canna indica L. (Heimat unbekannt, wahrscheinlich aber wie alle Cannaarten, Amerika, jetzt in Vorderindien allgemein verbreitet: Indian shot or bead, seit 1570 in Europa kultiviert), C. discolor (liefert in Trinidat ein sehr gutes Arrowroot: Canna root), C. coccinea ROSC. (Südamerika), C. gigantea (Brasilien), C. paniculata (Peru), C. Achiras GILL. (Trop. Südamerika), C. flaccida und glauca (Carolina).
Cannaceae (früher Zingiberaceae).
Im Großen für den Export wird nur Canna edulis (Achira in Peru, Meeru in Brasilien) wegen der Blüten die «rote Arrowrootpflanze» genannt, kultiviert, deren Heimat Peru ist, die dort auch Adeira heißt und deren Knollen (eine Pflanze liefert bisweilen 50 Pfund davon) wie Kartoffeln gegessen werden. Sie ist schon vor langer Zeit zunächst nach Westindien, dann auch nach Queensland gebracht worden, wo sie bald die Marantakultur verdrängte, da die Stärke aus ihren Knollen sehr leicht zu gewinnen ist. In Queensland waren 1909 etwa 200 acres mit Canna bestellt, die 15–20 cwt Arrowroot pro acre lieferten; Queensland produziert jetzt jährlich c. 600000 pounds dieses Arrowroot, das im Gegensatz zur Marantastärke (white A.) purple Arrowroot genannt wird. Die Rhizome sind in c. 6–8 Monaten reif, werden dann gewaschen. zu einem Brei zerrieben und dieser auf Metallsieben ausgewaschen. Die abgesetzte Stärke trocknet[S. 176] man auf Calicot. Der ganze Prozess wird in 24 Stunden zu Ende geführt. Von Queensland (Coomera, Pimpara) und aus St. Kitts (S. Christoph, einer der kleinen Antillen) kommt das Canna-Arrowroot jetzt in den Handel. Auf St. Kitts war die Produktion Mitte des XIX. Jahrh. ziemlich bedeutend, ist aber jetzt stark zurückgegangen.
Die Cannastärke ist die grobkörnigste aller Stärkearten. Einzelne Körner treten schon mit bloßem Auge als helle Pünktchen hervor.
Die Stärkekörner differieren in Form und Größe ziemlich, doch prävalieren die großen sackartigen, dicklinsenförmigen. Von der Fläche gesehen sind sie rundlich, eiförmig, breit-sackartig, das breitere Ende abgerundet, das schmälere breit genabelt. Der Kern liegt stark exzentrisch. Die Schichtung ist deutlich bei allen Körnern, oft grob. Halb zusammengesetzte Körner sind nicht selten. Der Längsdurchmesser beträgt 60–70–95 mik, doch steigt er nicht selten bis auf 110, ja 130 und sogar 145 mik.
Unter dem Namen Queensland-Arrowroot geht auch die Stärke von Zamia spiralis.
Lit. Abbild.: BENTLEY-TRIMEN, Medicin. plants. t. 266 (C. edulis) und RHEEDE, Hort. Malabar XI, t. 43 (C. indica). — Pharmacogr. indica. — THOMPSON, Jahresb. d. Pharm. 1892, 121. — SEMLER, Trop. Agrikultur. — TSCHIRCH-OESTERLE, Atlas (dort die Stärke abgebildet). — Pharm. Journ. 1909, 768, nach Agric. News 1909, 8, 119.
5. Tahiti-Arrowroot.
Taccastärke, Fécule de pia, Fécule de Kabija, Williams Arrowroot.
Tacca pinnatifida FORSK. (T. sitorea RUMPH., T. pinnatifolia GÄRTN.), Taccaceae, ist auf den Südseeinseln heimisch und wird auf Tahiti und den benachbarten Inseln Pia genannt. Sie wird dort und neuerdings auch in China, Indien (in Bombay: diva kanda), dem malaiischen Archipel, Queensland und Sansibar in beschränktem Maße angebaut. Die großen, sehr stärkereichen (26–29% Stärke enthaltenden) Rhizome, die in Tahiti auf Stärke verarbeitet werden, schmecken sehr scharf, doch läßt sich die Schärfe durch mehrmaliges Auswaschen der abgeschiedenen Stärke beseitigen. Tacca hat von allen den stärkemehlreichsten Knollen.
Lit. PAX in ENGLER-PRANTL, Pflanzenfam. — RUMPHIUS, Herb. amb. V, t. 114 (Kopie in ENGLER-PRANTL II, 5. 129.) — SEMLER, Tropische Agrikultur. — WOHLTMANN, Tacca pinnatifida, die stärkemehlreichste Knollenfrucht d. Erde. Tropenpflanzer 1905, 120. — TSCHIRCH-OESTERLE, Atlas (dort die Stärke abgebildet). — LOUIS PLANCHON et JUILLET a. a. O.
6. Guyana Arrowroot.
Dioscorea-Stärke, Yamswurzelstärke, fécule d’Igname, Farinha de Cará, Cara.
Die Yams- oder Ignamenwurzeln, die diese Stärke liefern, stammen von zu den Dioscoraceen gehörenden kletternden Dioscorea-Arten, von denen D. alata L. und bulbifera L. (inkl. sativa L.) in den Tropen, D. japonica (inkl. Batatas) in den Subtropen, besonders Chinas und Japans, viel als Nahrungspflanzen — yam bedeutet im Dialekt der Neger von Guinea «essen», igname bei den amerikanischen Indianern «Brotwurzel» — kultiviert werden. D. alata stammt aus Südasien, D. japonica aus Ostasien, D. bulbifera scheint in beiden (?) Hemisphären heimisch zu sein. Andere Arten kommen in Afrika und Australien vor und werden dort kultiviert. In Kamerun kultiviert man D. dumetorum. Die größten Knollen von 15–18, ja 40–50 kg werden auf den Fijiinseln und auf Neu Guinea erzielt. Yamsknollen enthalten 9–25% Stärke. Einige japanische Arten lassen sich sogar in Südeuropa anbauen, bieten aber kaum einen Ersatz für die Kartoffel.
Für die Stärkegewinnung kommt in erster Linie Dioscorea alata L. (Wing Stalked Yam, white Yam; in Indien: Kham alu, sund.: Huwi lilien, auf den Südseeinseln: ubi) in Betracht, die in den Tropen große, mehrere Kilogramm schwere Knollen — es sind solche von 10 kg und über ½ m Länge keine Seltenheit — bildet, die meist etwa 17% Stärke enthalten (MAISCH). Weniger wird dazu D. sativa (mit 22% Stärke) benutzt. D. bulbifera enthält nur 3,7% Stärke neben 16,9% Zucker.
D. alata wird in Brasilien, Guiana, Indien und den Südseeinseln kultiviert, aber, wie es[S. 177] scheint, nur in Guyana und Brasilien (Farinha de Cará) in etwas größerem Stil auf Stärke verarbeitet. Die Gewinnung scheint nicht sehr sorgfältig zu geschehen, denn das Handelsprodukt zeigt noch eine Menge Gewebsreste.
Die Stärke ist abgebildet in TSCHIRCH-OESTERLE, Anatom. Atlas.
COLUMBUS traf (I, S. 754), als er die Antillen betrat, dort Yams bereits in Kultur.
Lit. Abbild. in TSCHIRCH, Ind. Heil- und Nutzpfl. t. 110 und dies. Handb. I, Fig. 46. — WATT, Dictionary. — WIESNER, Rohstoffe (dort weitere Lit.). — CLERQ, Nieuw plantk. woordenb. — DE CANDOLLE, L’orig. des plant. cult. — LOUIS PLANCHON et JUILLET bilden a. a. O. die Stärke von D. alata L., D. eburnea Lour., D. trifida L. (Fécule de Cousse-couche) u. D. divaricata Blanco ab.
Unter dem Namen Guyana-Arrowroot geht aber auch das Stärkemehl der unreifen Früchte von Musa paradisiaca L. (M. sapientum BROWN.). Während die Banane (in Niederl. Indien: Pisang, in Engl. Indien: Plantain, franz.: Bananier) jetzt in den Tropen überall als Nahrungsmittel bez. Obst in zahlreichen Varietäten kultiviert wird, scheint nur in Britisch- und Französisch-Guyana, in Brasilien, Jamaika, Porto-Rico und den Bermuden, dann auch in Zentralafrika (am Ruwenzori, STANLEY) aus der Frucht Mehl bereitet zu werden. Deutsch-Ostafrika führte 1907: 1116 kg, 1908: 941 kg Bananenmehl aus. Man schält die unreifen Früchte, trocknet an der Sonne, vermahlt und siebt die zerkleinerte Masse. Das Mehl (conquintay, fou-fou), das also noch Gewebsreste enthält, bildet den Handelsartikel, doch scheint da und dort (Bermuden) auch die Stärke daraus abgeschieden zu werden. Das Mehl unreifer Bananen wird in England zur Brotfabrikation benutzt und zur Herstellung eines Bananenkakao. Bananenmehl (aus Jamaika) enthält: 78,32% stickstoffreie Subst. (bes. Stärke), 12,77% Wasser, 4,69% Eiweiß, 1,28% Rohfaser, 0,49% Fett, 2,45% Asche (VON SURY).
Die sehr eigenartigen Stärkekörner sind in TSCHIRCH-OESTERLE, Anatom. Atlas abgebildet, vgl. auch LOUIS PLANCHON et JUILLET, a. a. O. Reife Bananenfrüchte enthalten nur 1–2% Stärke, unreife bis 80%. Bei der Reife verwandelt sich die Stärke in Zucker.
Die Banane (sansk. kadalī, so in Suśrutas I, S. 505) ist seit Urzeiten in Indien in Kultur. Die Griechen trafen sie auf dem Alexanderzuge (I, S. 430). THEOPHRAST und PLINIUS beschreiben sie als pala, d. h. Blatt (hier pars pro toto), bei den Arabern hieß sie mouz oder mauwz (MESUË, IBN BAITHAR) und im Koran talk. Sie ist so frühzeitig nach der neuen Welt gekommen, daß HUMBOLDT sie als auch in Amerika heimisch betrachtete.
Lit. WIESNER, Rohstoffe. — Pharmacograph. indic. — DE CANDOLLE, L’origine d. pl. cult. — Über den Pisang vgl. auch TSCHIRCH, Ind. Heil- u. Nutzpflanzen (dort Abbild.). — SEMLER, Trop. Agrikultur. — Abbild. schon in RHEEDES, Hort. Malab. Vgl. auch I, Fig. 25. — VON SURY, Chem. Zeit. 1910, Nr. 52.
Als Fécule de la chataigne de la Guayane wird endlich auch die Stärke der Sterculiacee Pachira aquatica AUBL. bezeichnet (beschrieben bei WIESNER-HÜBL).
7. Batatenstärke.
Fécule de batate ou patate, Brasilianisch.es Arrowroot ex parte.
Die sog. weiße oder süße Kartoffel (sweet potato, ind.: míta-alú), Batatas edulis CHOIS. (Ipomoea batatas LAMK., Convolvulus Batatas L., C. edulis THUNB.), eine Convolvulacee, eine wichtige Nahrungspflanze der Tropen und Subtropen, besitzt spindelförmige Knollen, die oft 1–2 kg, selten bis 6 kg schwer werden. Sie hat sich von ihrer Heimat im tropischen Amerika, wo sie sich von Mexiko über die Antillen und Peru bis Paraguay hin seit Jahrhunderten in Kultur befindet — COLUMBUS traf sie (Ages) auf den Antillen (I, S. 745), ACOSTA (Comores) in Südamerika (I, S. 762), auch PETRUS MARTYR (I, S. 766) gedenkt ihrer — über die meisten tropischen und subtropischen Gebiete, bis nach Japan hin, verbreitet; nach Neuseeland vielleicht «auf einer der uralten polynesischen Wanderungen» (SEMLER). Denn ihr Name kumara findet sich sowohl auf Neuseeland wie bei den Quichua-Indianern Perus.
Sie verlangt nicht zu feuchtes Klima und leichten sandigen Boden. In den Tropen enthält der Knollen c. 10% Zucker und nur 9% Stärke, in den Subtropen c. 3% Zucker und 14–15% Stärke.
[S. 178]
Die Knollen werden in beschränktem Maße in Brasilien, auf Martinique, Guadeloupe und Réunion, in Cochinchina und Indien auf Stärke verarbeitet.
Die Stärke ist abgebildet in TSCHIRCH-OESTERLE, Anatom. Atlas.
Lit. ROXBURGH, Flor. ind. 162. — LOUIS PLANCHON et JUILLET, Ann. Mus. col. Mars. 1910. — Weitere Lit. in WIESNERS Rohstoffen und WATTS Dictionary.
8. Arumstärke.
Die Knollen von Arum maculatum L. werden in Südeuropa hier und da in beschränktem Maße auf Stärke verarbeitet (Portland-Arrowroot), ebenso die Knollen des seit Jahrhunderten kultivierten Arum esculentum L. (inkl. Arum Colocasia WILLD., Colocasia antiquorum SCHOTT., neuseel.: taro, sansk.: kuchoo, mal.: kelady, talus, japan.: imo — das Arum aegypticum des PLINIUS) auf Martinique, in Japan und den Südseeinseln. Letztere trägt den Namen Fécule de chou-choute, F. de chou caraïbe oder F. de chou-taró. Ob auch Arum macrorhizum L. (Apé) auf Tahiti auf Stärke verarbeitet wird, konnte ich nicht in Erfahrung bringen.
Die Bulbi Megarici von Arum italicum LAM. erwähnt schon CATO (I, S. 572). Auch ihre Stärke wurde viel in früheren Jahrhunderten (S. 156) und wird noch jetzt bisweilen abgeschieden (nach HÖHNEL in Italien und Algier). Arumstärke ist in Portugal offizinell.
Die Arum-Stärkekörner sind abgebildet in TSCHIRCH-OESTERLE, Anatom. Atlas. Auch bei LOUIS PLANCHON und JUILLET finden sich a. a. O. verschiedene Aroideenstärken abgebildet.
9. Costarica Arrowroot.
Dies Arrowroot stammt von den Knollen der zentralamerikanischen Yucca gloriosa L.
10. Japanisches Arrowroot.
Die japanische Pharmakopoëe hat (neben Kartoffelstärke) die Stärke der Zwiebel der japanischen Liliacee Erythronium Dens Canis L. (Katakuri) und der Wurzel der Papilionacee Pueraria Thunbergiana BENTH. (Dolichos hirsutus THUNB.), zweier in Japan und China vorkommender Pflanzen als Ersatz der in Europa üblichen Stärkesorten aufgenommen. (Abbild. der Erythroniumstärke in MOELLER, Mikroskopie S. 138.) In Japan wird auch aus Pteris aquilina (Warabi) und der Wurzel von Conophallus Konjak (Konyaku) Stärke hergestellt.
II. Stärke aus Stämmen.
1. Sago.
Etym. Sagu bedeutet im Malaiischen sowohl Mehl wie die mehlliefernden (Sago)-Palmen (Sagu baduri ist M. Rumphii, Sagu ihur M. silvestr., Sagu makanaru M. longispinum) — Metroxylon von μήτρα = Mark und ξύλον = Holz — Betr. RUMPHIUS vgl. I, S. 899.
Stammpflanze. Die Sagopalmen gehören zur Gattung Metroxylon, die auf die Tropen der alten Welt beschränkt ist und bilden wenige, schlecht charakterisierte, vielleicht gar nicht spezifisch verschiedene Arten (WARBURG).
Meist unterscheidet man: Metroxylon Rumphii MARTIUS (Sagus Rumphii WILLD., S. spinosus ROXB., S. genuina BLUME, die dornige Sagopalme, Bariam oder Bi (N.-Guin.), Karasula (Jav.), Kirai (Mal. Bat. Sund.), Lapia (Amb.), Rumijah (Atjeh), Sagu (Vulg. Mal.) Rambia). Dies ist der eigentliche Sagobaum der Molukken — und Metroxylon Sagu ROTTBOELL (M. Sago KÖNIG, M. inerme MART., Sagus laevis JACK, S. inermis ROXB., S. Rumphii BLUME), von den Eingeborenen vielfach mit[S. 179] den gleichen Namen wie der zuerst genannte Baum bezeichnet, da und dort aber auch davon unterschieden, über den ganzen Archipel verbreitet, aber mehr im Westen. Von ihm sowie von dem wohl dazugehörigen M. laeve (Sagus laevis) stammt wohl das meiste des nach Europa verschifften Sago.
Weniger in Betracht kommen: M. silvestre MART., der wilde Sagobaum der Molukken und M. longispinum MART., der wenig Ausbeute liefert, Sagus elata (Java) u. and. In den Tropen der neuen Welt (Brasilien, Guadeloupe) wird Sagus farinifera kultiviert.
Beschreibung. Die Sagopalmen gedeihen besonders auf feuchtem Boden, der periodischen Überschwemmungen ausgesetzt ist. Sie sind durch den malaiischen Archipel verbreitet, von Malakka und Sumatra bis zu den Fijiinseln gehend, mit Siam und Mindanao als Nordgrenze, den kleinen Sundainseln und Neu-Guinea als südlichste Punkte. (Vgl. die Karte im Kap. Reis, S. 189.) Sie fehlen in Australien. Es sind Palmen mit einem kriechenden Stamm, die in sumpfigen Niederungen wachsen und selten die ebenen Landstriche verlassen. Sie werden 25–30, selten bis 42 Fuß hoch, bleiben lange buschig und entwickeln erst spät, dann aber rasch den dicken Stamm. Sie sind monöcisch-polygam und blühen nur einmal, nach 10–15 Jahren, mit einem großen endständigen Blütenstand, der ungeheuere Massen von Blüten und Früchten bildet. Um diese ausbilden zu können, speichert die Pflanze große Mengen Stärke im Stamm. Meist stirbt die Palme bald nach der Fruchtbildung. Die Sagopalme ist eine der nützlichsten Pflanzen, die wir besitzen. Sie nimmt mit dem schlechtesten, sonst zu keiner Kultur brauchbaren Sumpfboden vorlieb; ein Stamm enthält, wenn er nach 15 Jahren reif zum Fällen ist, 400–900 (in der Regel 500–600) Pfund Sago, was für den jährlichen Unterhalt einer Person ausreicht; aus den im Boden bleibenden unterirdischen Organen erneuert sich die Pflanze leicht.
Kultur. Die Sagopalmen sind jetzt auch in Kultur in Ost-Sumatra (Bengkalis), auf dem Rioux-Lingga-Archipel und Billiton, in West-Borneo (Sambas, Pontianak), in den Sümpfen von Celebes, auf Bunguran, der Hauptinsel der Groß-Natunas, westlich von Borneo und auf der Halbinsel Malakka, z. B. bei Singapore; zur Atapgewinnung der Blätter für die Dachbedeckung auch an den Flußläufen Javas (bes. M. Sagu). Die Kultur bietet keinerlei Schwierigkeiten. Die Anpflanzung erneuert sich selbst durch Wurzelschößlinge. Doch wird die Hauptmasse des in Südostasien produzierten Sago von wildwachsenden Pflanzen gewonnen.
Die Darstellung der Sagostärke ist sehr primitiv (Fig. 63 u. 64, vgl. auch I, Fig. 139). Von den Eingeborenen wird, sobald eine Sagopalme gefunden wurde, zunächst festgestellt, ob dieselbe etwa bereits blüht oder gar Früchte trägt. In diesem Falle ist sie für die Sagogewinnung nicht mehr tauglich. Blüht sie nicht, so stellt man fest, ob sie «klopbaar», d. h. so mit Stärke gefüllt ist, daß die Ausbeutung lohnt (der Eingeborene unterscheidet hier fünf Grade der «Reife»). Ist der Baum als «klopbaar» befunden, was zwischen dem fünften und zehnten Jahre der Fall zu sein pflegt, so wird er gefällt und der Stamm, nachdem Blätter und Scheiden entfernt, in mehrere Stücke zerschnitten und diese in der Mitte aufgespalten. Nun setzt sich ein Mann rittlings auf den gespaltenen Stamm und klopft mit einem axtartigen Instrumente (stani paluk, pemaluk), das an der Spitze bisweilen einen Stein trägt, oder auch wohl mit den Füßen, das ganze innere Gewebe (sog. «Mark», Grundgewebe nebst Gefäßbündeln) in Flocken heraus (Fig. 63). Diese werden nun, wenn Wasser in der Nähe ist, was, da die Sagopalmen Sumpfpflanzen sind, meist der Fall ist, an Ort und Stelle weiter verarbeitet[S. 180] oder in aus Sagoblattscheiden gebildeten Körben (timbil) zu einem Wasser getragen. Hier erfolgt die Auswaschung nun in der Weise, daß man über einem ausgehöhlten Sagostamme oder einem Kahne oder einer aus Rinde oder Sagoblattscheiden hergestellten langen, auf Stützen ruhenden Rinne am einen Ende ein eigenartiges «Filter» anbringt. Das zerfaserte «Mark» wird auf eine durch einen gebogenen Rottan- oder Bambu-Stecken straff gespannte beutelartige Seihvorrichtung, die oft aus der zerfaserten Blattscheide der Cocospalme besteht, geschüttet und auf dieser durch Aufgießen von Wasser und Umrühren ausgewaschen (Fig. 64). Der eine hält die Seihvorrichtung, der andere gießt. Die Stärkemilch läuft für gewöhnlich nicht direkt in die lange Rinne, sondern erst in eine meist aus einer Blattscheide gebildete kurze und breite Rinne, die bisweilen unten eine Siebvorrichtung besitzt. Durch diese einfache oder doppelte Seihung werden die meisten Fasern zurückgehalten — sie werden verfüttert — und auf dem Boden der langen Rinne, die durch Fasern der Sagoblätter, der Cajuputrinde oder Arenpalme gedichtet wird, setzt sich das Stärkemehl ziemlich rein ab. Das Wasser fließt über den Rand der Rinne oder am Ende (durch ein weiteres Sieb) ab und wird schließlich ganz abgelassen. 800 kg Markmasse liefern 320–350 kg Sagomehl. Das Rohsagomehl wird dann in Massen von c. 30 Pfund in Blätter gewickelt und diese mit Rottan verschnürt oder in eigenartigen aus Sagopalmblättern gebildeten Körben (tuman, tamang) als Rohsago (sagumanta, lapia-manta) auf den Markt gebracht. Aus ihm werden die Hauptspeisen der Molukken dargestellt (WARBURG). In Sumatra bringt man den Rohsago in Zuckerhutform in den Handel. Ein Baum kann 150–300 kg marktfähige Ware produzieren.

Memukul Sagu, d. h. Herausklopfen des Sagomarkes.
[Nach der Zeichnung eines Malaien (Tupamahu) in Bull. Kol. Museum Haarlem Nr. 44.]
In Süd- und West-Neu-Guinea ist die Bereitung des Sago ähnlich wie auf den Molukken, auf Celebes, auf dem Lingga-Archipel und den Key-Inseln (siehe I, Fig. 139).[S. 181] Sonderliche Reinlichkeit scheint nirgends beobachtet zu werden, wie z. B. MARTIN von der Bereitung auf Ceram direkt betont. In Zentral-Borneo wird das «Mark» mit den Füßen getreten, während man Wasser darüberlaufen läßt.
In Brit. Nord-Borneo wird sowohl Metroxylon Sagu wie die dornige Sagopalme M. Rumphii benutzt, letztere ist kleiner, ist mit Dornen bewehrt, wird daher von wilden Schweinen weniger zerstört. Sie geht weiter ostwärts und ist namentlich in Neu Guinea und der Moluccen verbreitet.
In Singapore, wo besonders Sagus Rumphii und laevis kultiviert werden, werden die Stämme in 4–6 Fuß lange Stücke zerschnitten, dann geschält und mit einer primitiven Raspel geraspelt. Auch in Nordost-Sumatra wird das Stamminnere geraspelt. Die so erhaltenen Flocken werden durch Treten und Spülen mit fließendem Wasser von ihrer Stärke befreit; die Stärkemilch durch eine lange Rinne in ein längliches Becken geleitet. Die abgesetzte Rohstärke geht in die Sagofabriken. Hier wird sie zunächst durch wiederholtes Aufschlemmen und Durchseihen der Stärkemilch durch Tücher von den Fasern (Sagorefuse) befreit, dann die Stärkemilch wiederholt durch lange, am Ende durch Tücher geschlossene Rinnen geschickt, das Wasser abgelassen und die Stärke in Blöcken herausgenommen.

Meramasdan menapis sagu, d. h. Kneten und Auswaschen des Rohsagomehls.
[Nach der Zeichnung eines Malaien (Tupamahu) in Bull. Kol. Mus. Haarlem Nr. 44.]
Sagomehl kann das ganze Jahr hindurch gewonnen werden.
Der für den Außenhandel bestimmte Rohsago geht meist nach Singapore, dem eigentlichen Sagohafen der Welt, wohin er vom März bis Oktober gebracht wird. Hier (dann auch in Sarawak und Brunei, wo ebenfalls Fabriken bestehen) wird er, da er noch ziemlich viel Zellfragmente enthält, durch Schlämmen gereinigt (Sago flour, Sagomehl) oder gereinigt und granuliert, geperlt (Pearl Sago, Perlsago). Das Geschäft[S. 182] liegt fast ganz in den Händen von Chinesen. Das Perlen des Sago geschieht in der Weise, daß man die halbgetrocknete, durch Schlämmen eigener Art (Beschreibung bei SEMLER) gereinigte Stärke zerbricht, die Stücke siebt und in ein Tuch bringt, das an zwei von der Decke herabhängenden Seilen befestigt ist (I, Fig. 142). Die Arbeiter führen die Stärke durch geschicktes, viel Übung erforderndes Rütteln des nur halb gefüllten Tuches in Kügelchen (Perlen) verschiedener Größe über. Diese werden durch Sortiersiebe nach der Größe getrennt und dann auf flachen heißen Schalen von ¾ m Durchmesser, die bisweilen mit einem vegetabilischen Fett bestrichen werden, unter Rühren mit einem hölzernen Instrumente mit gebogener Kante gerollt (gedämpft), dann nochmals durch Siebe sortiert und getrocknet. Durch das Erhitzen werden die Körner oberflächlich verkleistert. Manche Fabriken perlen nur ohne zu rollen. Meist werden kleinere Kügelchen von 1–1,5 mm (Small Pearl Sago) und große von 2,5–3 mm hergestellt. Bisweilen wird der Sago ein zweites Mal «geröstet».
Der Perlsago aus Molukkensago ist immer rötlich. Auch durch Zuckerkouleur bräunlich gefärbter Sago ist im Handel, früher auch ziegelroter [durch Bolus (?) gefärbter].
Handel. Nach Singapore kam 1906 Rohsago besonders aus Sarawak (Nordwest-Borneo), dann aus Sumatra und Labuan und dem Niederl. Archipel, weniger aus Niederl. Borneo, Johore und Brit. Nord-Borneo, am wenigsten aus Pinang und Rioux. Die Molukken verbrauchen ihren Sago fast ganz als Nahrungsmittel.
1908 kamen nach Singapore: Gereinigter Sago in kg: aus Djambi (Sumatra) 2600 kg, Bengkalis (Sumatra) 503236, Rioux 648580, Indragiri (Sumatra) 11852, Westborneo 3629800, Celebes 7316. Ungereinigter, roher Sago: Aus Ostsumatra 20500, Rioux 3461876, Indragiri 7430238, Westborneo 694398, Süd- und Ostborneo 14508, Celebes 390352 kg.
Der Wert der Ausfuhr von Sagomehl aus Singapore betrug 1906: 2030082 Singaporedollars (= M 2,20), von Pearl Sago (und Rohsago): 365769 Doll. Es wurden 715836 Pikuls Sagomehl und 77381 Pikuls Pearl Sago exportiert. Der meiste ging nach London, viel auch nach Italien.
Hamburg importierte 1908 33703 dz Sago und Tapioka (s. oben S. 173). Davon kamen 16077 von Singapore, 13877 von Brit. Ostindien, 2322 von Nied. Ostindien, geringere Mengen aus China und Brasilien. Deutschland importierte 1909 «Pfeilwurzelmehl (Arrowroot), Sago und Sagomehl, Madioka und Sagoersatzstoffe»: 3654 dz aus Brit. Indien und 8616 dz aus Brit. Malacca. Frankreich importierte 1908 «Sagou, Salep et fécules exotiques» 117844 Qintal. besonders aus Englisch- und Niederländ.-Indien, dann auch (30265) von Réunion und Brasilien.
Sago und Sagomehl kommt in Kisten und Säcken à 85 kg in den Handel.
Anatomie. Die Stärkekörner des Sago flour, der ein weißes oder grauweißes bzw. rötlichweißes Pulver bildet, sind entweder einfach oder zusammengesetzt. Die zusammengesetzten zeigen ein großes Hauptkorn von 30–68 (selten bis 80) mik Länge, dem meist an kurzen Ausstülpungen 1–5 (meist 2–3) Nebenkörner von meist 10–20 mik Durchmesser angesetzt sind. In der Handelsstärke sind die Nebenkörner meist abgefallen und man sieht am Hauptkorn nur die meist ebenen Ansatzstellen (Fig. 65).
Das Hauptkorn ist sehr mannigfach gestaltet, länglich, trapezförmig oder dreieckig-rhombisch, stets mehr oder weniger rundlich, nicht abgeplattet. Der Kern liegt exzentrisch (meist ½–¼) und ist oft von einem ein- oder mehrstrahligen Stern durchzogen. Die Nebenkörner sind halbkugelig, mützen- oder tiaraförmig.
[S. 183]
Als Nebenform kommen einfache, meist sehr große, 50–65 mik. messende, eirunde oder gestreckt oval-längliche mit exzentrischem Kern oder zwei- bis mehrstrahliger Kernspalte vor.
Im geperlten und gerollten (s. oben) Sago findet man die gleichen Formen, daneben aber Körner in allen Stadien der Verkleisterung. Die Verkleisterung beginnt in den inneren, weicheren Schichten. In den ersten Stadien der Verkleisterung ist oft eine große, nach außen durch einen Kanal sich öffnende Zentralhöhle sichtbar, im letzten bilden die Körner einen unregelmäßig wulstigen Ballen mit zarter Kontur (Fig. 65, a-c). Der nur geperlte, nicht gerollte Sago zeigt diese verkleisterten Körner nicht. Er ist rein weiß, während der andere partiell hyalin erscheint.
Bisweilen findet man im Sagomehl auch Körner in allen Stadien der Korrosion. Es scheint dies Stärke zu sein, die von Stämmen gewonnen wurde, die schon zu sehr der Blütenbildung sich näherten, bei denen also bereits die Stärke in Auflösung begriffen war.
Unter dem Namen «Sago» kommen aber noch einige andere Produkte in den Handel: der deutsche oder französische (indigène) Sago aus Kartoffel- oder Weizenstärke, die Tapioca aus Maniok, der Portlandsago aus Arumstärke und der brasilianische Sago aus Batatenstärke. Diese alle sind leicht an dem Bau der Stärkekörner zu erkennen.
Eigenschaften. Sagostärke enthält im Durchschnitt 81,51% Stärke, 15,85% Wasser, 2,16% Stickstoffsubstanz und 0,48% Asche; Real Pearl Sago: 83,60% Stärke und 15,8% Wasser; Sago Ia Korrels sogar 84,9% Stärke.
Sagostärke beginnt bei 66,2° zu verkleistern und ist bei 70° vollständig verkleistert.
Geschichte. Als die Europäer Südostasien betraten, fanden sie bereits das Mehl der Sagopalme als wichtigstes Nahrungsmittel in Gebrauch. MARCO POLO (I, S. 726) beschreibt die sumatranische Sagopalme und die Gewinnung des Sago, ähnlich wie sie noch heute betrieben wird und auch ODORICO DI PORTO MAGGIORE (I, S. 726) gedenkt der «Bäume, die Mehl tragen». Auch WALLACE beschreibt die Sagobereitung. Sie wird in Singapore seit 1819 von Chinesen betrieben.

Sagostärke mit verschiedenen Verkleisterungsformen. c ganz verkleistert.
[Nach Tschirch-Oesterle, Atlas.]
Lit. ROTTBOELL in Nye Samling af K. Danske Vidensk. Selsk. Schr. 1783 p. 527. — GRIFFITH, Palms of East India. — Abbild.: BENTLEY-TRIMEN, Medicinal plants T. 278 und BLUME, Rumphia II, t. 126 u. 127. — VALENTINI, Museum muscorum (I, S. 914). — MOHNIKE,[S. 184] Blicke auf d. Pflanz.- u. Tierleb. in den Niederl. Malaienländ. 1883. — WARBURG in TSCHIRCH, Ind. Heil- und Nutzpflanzen (dort auch Abbild.). — WIESNER, Rohstoffe (dort die ältere Lit.). — Am ausführlichsten (mit zahlr. Abbild.) Sagoe en Sagoepalmen, Bulletin 44 des Koloniaal Museums Haarlem 1909 (mit Beitr. von VAN OLJEN, FORTGENS und [malaiisch] TUPAMAHU). — VETH, Bijdragen tot de kennis van de voornaamste voortbrengselen van Nederl. Indie. IV. De Sagoe 1866. — SEMLER, Tropische Agrikultur. — DE CLERCQ, Nieuw plantk. Woordenb. v. Ned. Ind. 1909. — TSCHIRCH-OESTERLE, Anatom. Atlas. — TSCHIRCH, Artikel Arrowroot in Realenzyklop. d. ges. Pharm.
2. Andere Palmen- (und Cycadeen-)Stärke.
Ebenfalls einen Sago bzw. ein sagoähnliches Mehl liefern (jedoch nur in beschränktem Maße) die Cycadeen: Cycas circinalis (paku adji) auf den Salomonsinseln, ferner: Cycas revoluta in Japan und China, Zamia integrifolia (Koonti) in Florida, Z. spiralis in Australien, Z. media in Ostindien, Z. pumila, angustifolia und tenuis in Westindien. Dann die Palmen: Arenga saccharifera LABILL. (Zuckerpalme, Aren, s. S. 128) auf den Sangirinseln, auf Celebes und Ceylon, Eugeissona tristis (bulang nanga), Caryota purpuracea (bulang talang), Caryota urens. L. in Mysore, C. Rumphiana MART. auf den Molukken, Borassus flabelliformis L. (Palmyrapalme, in Ostindien, Ceylon) und B. tunicata LOUR., Guilielma granatensis KARST. in Neugranada und Venezuela, sowie einige Cocos-, Oreodoxa-, Phoenix- und Chamaerops-Arten (Nordamerika); ferner Raphia vinifera und Medemia nobilis auf Madagaskar u. and. Die Stärke der Palmyrapalme ist der echten Sagostärke ähnlich, weicht aber doch in einigen Punkten ab. Namentlich sind hoch zusammengesetzte Körner hier häufiger (Näheres bei WIESNER). LOUIS PLANCHON und JUILLET bilden a. a. O. die Stärke von Borassus flabelliformis, Caryota urens, Phoenix und anderen Palmen und Cycadeen ab.
III. Stärke aus dem Endosperm von Samen.
1. Amylum tritici.
Weizenstärke, — amidon de blé ou froment (franz.) — wheat starch (engl.) — amido di frumento (ital.) — tarwe zetmeel (holl.) — hwetestärkelse (schwed.). — vehnä tärkkelys (fin.) — búza keményitő (ung.) — σιτάμυλον (n.-griech.).
Stammpflanze: Triticum vulgare VILL., Hist. pl. Dauph. II, 153 (T. sativum LAM. Encyc. meth. 1787) und Verwandte.
Etym. «Triticum quod tritum e spicis» (VARRO) — von tero, trivi, tritum = reiben (mahlen) oder terere = treten (austreten, ausdreschen), — πυρός (von πῦρ s. Geschichte) wegen der feuergelben Farbe der Früchte. Ein Weizenfeld erscheint im Herbst von Weitem gesehen rotorange. — blé (franz.), biada (ital.) von spätlatein. bladum = Korn, oder angels. blaed = Frucht, oder kelt. blawd = Mehl. — froment aus frumentum. — Weizen im got.: hwaiteis, germ.: hwaitja, ahd.: weizzi, mhd.: weitze, von hwîta = weiß, wegen der Farbe des Mehls. Davon auch engl. (common) wheat. Der Weizen heißt im Ägyptischen swt (die hieroglyphischen Zeichen, I, S. 470), koptisch suo; daraus entstand das griechische σῖτος als Lehnwort.
Systemat. Stellung. Gramineae, Hordeae.
KÖRNICKE teilt die Weizensorten in folgende drei Gruppen:
1. Triticum vulgare VILL. Dazu T. vulg. (im engeren Sinne), T. compactum HORST (Zwergweizen) T. turgidum L. (englischer Weizen), T. durum DESF. (Hartweizen).
2. Triticum polonicum.
3. Triticum monococcum.
Abbild. der Ähren in MULL-GUYOT, Encyclop. d’Agriculture (einige auch bei HACKEL in ENGLER-PRANTL, Pflanzenfam.).
[S. 185]
Beschreibung. Triticum vulgare besitzt einen langen, schlanken, oberwärts hohlen Stengel und eine lange dichte, deutlich vierkantige Ähre. Die parallel der Spindel zusammengedrückten Ährchen sind 4(–7)blütig, 3–4 Blüten sind fruchtbar. Sie werden an der Basis von 2 großen, bauchigen, kahnartigen, derben, gegenüberstehenden, in eine kurze gerade Stachelspitze (Granne) auslaufenden glumae (Hüllspelzen) bescheidet (Involukrum der Partialinfloreszenz). Jede der Blüten ist von 2 Paleis (Deckspelzen) behüllt. Die Palea inferior ist kahnartig bauchig, begrannt, die Palea superior ist zweikielig, auf der Rückenseite kahnartig vertieft, unbegrannt.
Die Weizenfrucht fällt aus der Paleis heraus. Sie zeigt auf der einen Seite eine tiefe Rinne und an der Spitze einen «Bart», aus ziemlich stark verdickten Haaren bestehend. An der Basis liegt seitlich der kleine Keimling und sein Scutellum. Der Bau der Fruchtschale ist in TSCHIRCH-OESTERLE Anatom. Atlas beschrieben. Die Aleuronschicht des Samens ist einreihig. Der Kleber findet sich in dem Stärkeendosperm neben den Stärkekörnern. Die Keime enthalten 15,5% Öl (DE NEGRI).
Triticum vulgare ändert ab: var. aestivum (Sommerweizen), Ähre etwas locker, Deckspelzen nicht begrannt, gleich den Hüllspelzen sammetartig behaart oder kahl und var. hibernum (Winterweizen), Ähre sehr dicht, Deckspelzen lang begrannt.
Außer Triticum vulgare wird oft auch T. Spelta (Spelz, Dinkel, Korn) gebaut. Ährchen mit 5 Blüten, von denen die drei unteren fruchtbar.
In Gebirgsgegenden baut man T. monococcum (Einkorn) mit dreiblütigen Ährchen, bei denen nur die unterste Blüte fruchtbar ist.
Selten kultiviert werden T. dicoccum (Emmer) mit vierblütigen Ährchen, bei denen die zwei unteren Blüten fruchtbar. T. polonicum (polnischer Weizen), mit nickender Ähre, T. durum mit knorpeligen Hüll- und Deckspelzen und T. turgidum.
Die Weizenernte der Erde wird pro Jahr auf 190 Milliarden engl. Pfund geschätzt.
Die Frucht des Weizen enthält Rohrzucker (E. SCHULZE). Die Weizenkleie liefert bei der Hydrolyse Arabinose und Xylose (SCHULZE, TOLLENS).
Pathologie. Prof. ED. FISCHER berichtet über die pflanzlichen Schädlinge: Zunächst gibt es eine Reihe von parasitischen Pilzen, welche Stengel, Blätter und auch Spelzen befallen und dadurch auch auf den Körnerertrag ungünstig wirken, so die Rostpilze Puccinia triticina, glumarum, graminis, der Mehltaupilz Erysiphe graminis, dann Melanospora damnosa (SACC.) LINDAU, OPHIOBOLUS GRAMINIS SACC., Septoria graminum DESM. u. andere. Die Körner selber werden namentlich von Brandpilzen zerstört, unter denen Tilletia Tritici (BJERK.) WINT. und Tilletia laevis KÜHN in erster Linie stehen. Es rufen dieselben den sog. Steinbrand, Stink- oder Schmierbrand des Weizens hervor. Äußerlich unterscheiden sich die erkrankten Ähren und die befallenen Körner wenig von den normalen, aber beim Öffnen der letzteren findet man sie vollständig von der schwarzen, nach Heringslake riechenden Sporenmasse des Parasiten erfüllt. Die ganze Blüte wird zerstört durch den Flugbrand Ustilago Tritici (PERS.) JENS. In einer von diesem Pilz befallenen Ähre tritt zwischen den Spelzen der schwarze Sporenstaub sehr auffällig zutage. In dem Fruchtknoten des Weizens entwickelt sich ferner das Mutterkorn Claviceps purpurea (s. den betreffenden Abschnitt), wiewohl es hier weniger häufig angetroffen wird als auf dem Roggen. — Eine Deformation der Ähren bringt die Peronosporee Sclerospora macrospora SACC. hervor.
Über tierische Schädlinge des Weizens berichtet ISRAEL:
1. Käfer: Anisoplia fruticola FABR., Anisoplia agricola FABR. Larven im Boden an Graswurzeln, Käfer an den Blüten, die Organe der Befruchtung zerstörend. Lema melanopa L., Lema cyanella L. Beide Käfer sind dem Volke als Getreidehähnchen bekannt. Die Larven dieser Käfer sind meist mit ihrem Kote bedeckt. Sie leben an den Blättern des Weizens, lange Streifen aus denselben herausfressend. Agriotes lineatus L. Larve an den Wurzeln von Getreide. Oft schädlich.
2. Falter: Hadena exclamationis L., Hadena tritici L. Die Raupen dieser gemeinen Eulen werden, wenn sie in Massen auftreten, den Getreidefeldern verderblich. Sie sind im übrigen polyphag.
[S. 186]
3. Fliegen: An Triticum leben auch mehrere Cecidomyiaarten, z. B. C. tritici, destructor, flava, aurantiaca und andere.
4. Gradflügler: Thrips frumentarius BELING. Dieser Blasenfuß lebt oft gesellig an diversen Cerealien und schädigt besonders die sich entfaltenden Ährchen, welche samt den Spelzen von der gemeinsamen Spindel abfallen.
5. Schnabelkerfe: Aphis cerealis KALT. Diese (grüne Kornlaus vom Volke genannte) Blattlaus lebt an den Ähren sehr vieler Gramineen, auch an Roggen, Weizen, Gerste und Rispengräsern (Hafer usw.).
Tylenchus tritici, das sehr gefährliche Weizenälchen, ist sehr resistent. Es kann in Glycerin leben und wird von Belladonna, Morphin, Atropin, Curare und Strychnin nicht getötet.
Über die Kornmotte (I, Fig. 333) vgl. I, S. 375 u. 383.
Darstellung der Weizenstärke. Weizenstärke wird in größtem Maßstabe in Europa (und Amerika) dargestellt, in Deutschland besonders in der Gegend von Halle a. S. — meist aus den Früchten von Triticum vulgare, aber auch T. durum und turgidum (in Langenau, Württemberg) und T. Spelta (Kernenstärke, s. w. u.) werden dazu benutzt. Entweder wird Weizenmehl auf Stärke und Kleber verarbeitet, oder man geht von dem ganzen Korn aus, zerquetscht dieses und verarbeitet den Brei auf Kleber und Stärke oder letztere allein.
Geht man vom Mehle aus (MARTINsche Methode), so wird dieses in einer Teigknetmaschine mit Wasser zu einer steifen Masse angemacht und diese in Sieben mit Wasser so lange ausgewaschen, bis dieses nicht mehr milchig abläuft. Das «Stärkewasser» läßt man in dem Absatzbottich schwach gären, um die letzten Reste des Klebers zu zerstören, läßt dann das Wasser ab und reinigt dann die Stärke durch wiederholtes Waschen und Absetzenlassen. Bei diesem Verfahren bleibt der größte Teil des sehr wertvollen Klebers auf den Sieben zurück und wird auf Futtermittel (Klebermehl, Kleberkörner) verarbeitet.
Geht man von der unvermahlenen Frucht aus, so wird diese zunächst (im Quellstein, Quellstock) in Wasser aufgeweicht, dann zwischen Walzen zerquetscht, der Brei (das «Gut») mit Wasser angerührt und im Gutbottich (14 Tage bei 20°) gären gelassen. Hierbei wird der Kleber durch saure (faulige) Gärung zerstört und die Stärke fast vollständig abgeschieden (reif). Die hierbei erhaltene Masse wird, nachdem man das «Sauerwasser» abgelassen, in Waschtrommeln oder Tretmühlen gebracht, die aus diesen abfließende Stärkemilch wird in Bottichen absetzen gelassen und dann abgezogen (Sauerverfahren von Halle). Um den Verlust des Klebers zu vermeiden, werden die eingequollenen Weizenkörner bisweilen (Elsässer Methode) geschrotet, zerquetscht und auf Sieben, die die Hülsen und den Kleber zurückhalten, ausgewaschen. Die Waschwässer (Rohstärkemilch) läßt man in Absatzbottichen unter Zusatz von Sauerwasser sauer werden, wodurch die Reste des Klebers gelöst werden, die Stärke wird dann durch Waschen gereinigt. Der auf den Sieben zurückbleibende Kleber, der noch viel Hülsen und Stärke enthält, wird entweder auf menschliche Nahrungs- oder Futtermittel verarbeitet, oder dient als Klebe-, Steifungs- oder Verdickungsmittel. Bisweilen werden bei der Reinigung Ätzkali, Ammoniak oder Schwefelsäure benutzt. Bei der Herstellung der besten Handelssorten werden vor dem Trocknen die oberen Schichten des Stärkesedimentes abgeschabt.
Das Verfahren aus Mehl liefert c. 45%, das Verfahren aus dem Korn mit Gärung c. 60%, ohne Gärung c. 52% der im Korn enthaltenen Stärkemenge.
In einigen Gegenden wird Weizenstärke auch noch im kleinen in Hausindustrie dargestellt, so z. B. wird in Tägerig, im Kanton Aargau, aus «Chorn» (Trit. Spelta)[S. 187] sog. Ammelemähl (Ammermehl, Kernenstärke) in ziemlich primitiver Weise noch jetzt bereitet. Die Industrie reicht dort jedenfalls bis 1678 zurück und ehedem wurde fast in jedem Hause «g’ammelemählet». Das interessante Verfahren ist (von Abbildungen begleitet) ausführlich beschrieben von MEIER, Tägliger Ammelemähl (in Die Schweiz 1908, 105).
Handel. Die Weizenstärke kommt im Handel in sehr verschiedener Form und Güte vor. Entweder findet sie sich in größeren oder kleineren unregelmäßigen Stücken (Bröckelstärke, Schäfchen) oder mannigfach, meist zu Stengeln, Stäbchen oder scharfkantigen Stücken geformt (Tafel-, Strahlen-, Kristall-, Stangen-, Stengel-, Zettelstärke) oder endlich als Pulver.
Die Feinheit wird durch Bezeichnungen, wie feinste Tulleanglais, Musselinstärke, feinste weiße Patentstärke, mittelfeine und ordinäre Stärke abgestuft.
Anatomie. Die Stärkekörner der Weizenstärke bilden zwei ziemlich scharf geschiedene, durch Mittelformen wenig miteinander verbundene Formen: Großkörner und Kleinkörner (Fig. 66).
Die Großkörner sind dick linsenförmig, von der Fläche betrachtet rund, aber sehr selten streng kreisförmig, bisweilen zum Oval übergehend oder mit geschweiften Umrißlinien, in der Seitenansicht länglich elliptisch mit einem Zentralspalt. Schichtung fehlt. Der zentral gelegene Kern ist undeutlich. Die Größe variiert. Die größten messen 30–38, ja sogar 45 mik. und mehr, die kleineren 15–25 mik. Die Großkörner der Speltastärke sind etwas kleiner, meist 20–25 mik.
Die Kleinkörner sind meist rundlich oder oval, seltener polyedrisch oder in ein Spitzchen auslaufend. Die Größe beträgt 2–9,5, meist 6–7 mik.
Weizenstärke. x Körner von der Seite. y zusammengesetzte Körner.
[Nach Tschirch-Oesterle, Atlas.]
Als Nebenform finden sich zusammengesetzte Körner mit 2–25 Teilkörnern, sowie einige Zwischenformen der Groß- und Kleinkörner, auch wohl zusammengesetzte Großkörner oder sackartige Formen.
Chemie. Weizenstärke enthält durchschnittlich 83 (82–85)% Stärke, 13 (12–16)% Wasser, 1,9% (die kleberarme nur 0,1–0,15%) Stickstoffsubstanz, 0,35 (0,1–0,5)% Asche, 0,31% (die schlechteren Sorten 1–1,5%) Rohfaser und 0,19% Fett.
Weizenstärke reagiert schwach sauer (Milchsäure). SOXHLET fand (vor längerer Zeit) in Weizenstärke im Durchschnitt 0,141% freie Säure auf Milchsäurehydrat berechnet. SAARE fand neuerdings den Säuregrad zumeist 1–1,4 (= ccm N⁄10 Natron). PATCH beobachtete (1900) auch alkalische Reaktion.
[S. 188]
Bei 62,5° sind die Körner der Weizenstärke noch wohl erhalten, die der Roggenstärke aber schon verkleistert (WITTMARCK). Der Weizenstärkekleister ist trübe, geruch- und geschmacklos.
Prüfung. Die Prüfung erfolgt durch das Mikroskop. Die Weizenstärke muß auf Chloroform schwimmen. Mit kaltem Wasser angerieben darf das Filtrat mit Jod keine Bläuung geben, sonst ist Stärkeabkochung (zur Stengelformung) zugesetzt. Die saure Reaktion darf nur sehr schwach sein. Der Aschengehalt darf 0,5% nicht übersteigen (HAUKE).
Anwendung. Die Weizenstärke ist jetzt die in der Pharmazie am meisten angewendete (s. S. 157). Viele sog. Kraftmehle, Kindermehle, Amidons enthalten Weizenstärke (oder Weizenmehl) oder bestehen daraus. Ebenso Semolina, Semoule d’Igname, Nevilles Patent flour of lentills, Bullocks Semula, Baby food u. and.
Geschichte. Während BUSCHAN die Cerealien nur bis zur neolithischen Periode zurückverfolgen konnte, haben die Ausgrabungen von PIETTE gezeigt, daß schon der paläolithische Mensch im südlichen Frankreich in der älteren glyptischen Periode des Renntierzeitalters Cerealien kannte und wohl auch in roher Weise kultivierte (HOOPS). Aus der Übergangszeit von der paläolithischen zur neolithischen Periode, also lange vor der Epoche der polierten Steinäxte, ist kultivierter Weizen und sind Getreidemühlen (von PIETTE) sicher nachgewiesen. Auch nach SOLMS-LAUBACH ist die Kultur der Getreidepflanzen unendlich viel älter als man gewöhnlich annimmt. Wir wissen jetzt, «daß in Zentralasien schon Getreide gebaut wurde, als Sibirien und die turanischen Steppen noch vom Meere bedeckt waren und die Gobi sich eben aus einem Binnenmeere in eine Wüste verwandelte, daß die Weizenarten von Mittelasien aus sich über Persien und Nordafrika schon zur Eiszeit bis in das Mittelmeergebiet verbreiteten und schon vor dem Ende der pleistocänen Epoche bis nach Spanien und Südfrankreich gelangten». Auch in Mittel- und Nordeuropa reicht der Getreidebau bis in die neolithische Periode zurück. Die ältesten Getreidearten waren hier Weizen, Gerste und Hirse. Triticum vulgare, T. dicoccum und monococcum, Hordeum hexastichum und distichum und Panicum miliaceum wurden, wie Funde in Pfahlbauten, Aschengruben, Feuerherdresten usw. zeigen, schon zur Steinzeit dort überall gebaut. Das älteste Getreide der Indogermanen war die Gerste (HOOPS). In Troja fand SCHLIEMANN Früchte von Tr. monococcum. Im alten Indien wurde hauptsächlich Reis (vrībíṣ), dann Weizen (godhūmas = Barbarenessen) und Gerste (yávas) gebaut (LASSEN). Auch in China ist Weizenbau uralt (vgl. I, S. 522). Die Urform des Weizen ist entweder Triticum Spelta oder T. dicoccum. Weizen (swt, beti, bet-t, bet) und zwar Triticum vulgare VILL. (begrannten und unbegrannten) und wohl auch T. dicoccum SCBR. und auch T. turgidum L. wurde bereits vor 4000 Jahren auch in Ägypten in großem Stile angebaut. Die Weizenernte in allen ihren Phasen ist ausführlich dargestellt in einem Grabe von Chum el Achmar, an der Ostwand des Ti-Grabes in Saqqarah (III. Jahrtaus. n. Chr.) u. and. Ein 3500–4000 Jahre alter Ziegel enthält Weizenkörner. Solche sind auch in zahlreichen Gräbern gefunden worden. Weizenähren tragen die Herrscher oft auf den bildlichen Darstellungen in der Hand. Auch auf unzähligen Bildwerken späterer Zeit finden wir Getreideähren (oft mit Mohnköpfen vergesellschaftet, vgl. das Mekonopeignion I, S. 926) in den Händen der Götter und Fürsten. Die ὄλυρα der Griechen (HERODOT) war wohl, wie der far der Römer, Triticum dicoccum, der Emmer (BUSCHAN, SCHWEINFURTH). Der πυρός des DIOSKURIDES, der von der arzneilichen Anwendung des Weizenmehles viel zu berichten weiß, war wohl T. vulgare. Die ζειά des DIOSKURIDES war wohl T. dicoccum (δικόκκος) und T. monococcum (ἅπλη). HIPPOKRATES bediente sich gern des Weizens. Weizenstärke tritt auch als Appretur schon auf frühmittelalterlichen Papieren sowohl als Kleister, wie in Substanz aufgewalzt auf (WIESNER, KOBERT).
Lit. KÖRNICKE, Getreidebau. — Abbild. in Les grandes cultures du monde. — HARZ, Landwirtsch. Samenkunde. — TSCHIRCH-OESTERLE, Anatom. Atlas. — MOELLER, Mikroskop. d. Nahr. u. Genußm. 2 Aufl. (dort weitere Lit.). — Analysen in KÖNIG, Nahr. u. Genußm. — DE NEGRI, Chem. Zeit. 1898. — WÖNIG, Pflanz. im alt. Ägypt. — HOOPS, Waldbäume u. Kulturpfl. im german. Altert. 1905. — SOLMS-LAUBACH, Weizen und Tulpe u. deren Geschichte. Leipzig 1899. — BUSCHAN, Vorgeschichtl. Botan. 1895. — PIETTE, L’anthropologie. 1896. — LASSEN, Ind. Altertumskunde. — KOBERT, Zeitschr. f. angew. Chem. 1910, 1250. — Abbild. d. Pflanze BENTLEY-TRIMEN, Medicinal plants t. 294.
[S. 189]
2. Amylum Oryzae.
Reisstärke, — amidon de Riz (fr.) — arroz (sp.) — rice starch (engl.) — amido di riso (ital.) — rijstzetmeel (holl.) — riisi tärkkelys (fin.) — rizskeményitő (ung.) ἄμυλον ορύζης (n.-gr.).
Stammpflanze: Oryza sativa L. (LINNÉ spec. pl. I, 333) mit den Kulturvarietäten: montana (Bergreis), glutinosa (Klebreis), praecox (frühreif. Reis), perennis (ausdauernd. Reis), mutica (unbegrannter Reis), minuta (kleiner Reis), coarctata (gedrungenblüt. Reis). Im Museum in Calcutta finden sich Proben von über 1100 Spielarten.
Etym. ὄρυζα (neben ὄρυζον) ist von sansc. vrīhíṣ, tam. arishi abzuleiten. Über das altpers. brîzi und das arabische arruz (arrozz) gelangte das Wort in die europäischen Sprachen, in das Spanische, wie so oft, durch Agglutination des arabischen Artikels, in das Deutsche über ital. riso. Im Sansc. heißt der Reis auch dhánya (d. h. Erhalter des Menschengeschlechts) (hind.: dhán, chával).
Systemat. Stellung. Gramineae Oryzeae.
Die punktierten Stellen bezeichnen die Länder, in denen Reiskultur getrieben wird.
· · · · · · · · · · Polargrenze der Maiskultur.
– – – – – – Verbreitungsgebiet der Sagopalme.
[Vgl. auch Langhans, Kleiner Handelsatlas.]
Vorkommen und Kultur. Der Reis ist im warmen Südostasien, besonders in China und Indien, ferner im tropischen Australien und in Westafrika heimisch. Er verlangt ein warmes Klima, gedeiht aber noch in der Lombardei und Spanien, am besten freilich in tropischem Klima. Er verlangt viel Wasser.
Die Kultur des Reis (vgl. Fig. 67) ist in China uralt und noch jetzt über die ganze südliche Hälfte des Reiches sowie Cochinchina und Birma verbreitet. Die Sage berichtet, daß der Kaiser SHEN NUNG, den man auf 2800 n. Chr. ansetzt (die Datierung ist aber sicher falsch), bei einer Zeremonie, bei welcher 5 Arten Getreide gepflanzt werden mußten, den Reis pflanzte, während die anderen 4 von den Prinzen gepflanzt wurden. Aber es ist wahrscheinlich, daß China die Pflanze vom Südwesten her erhielt, wo jetzt der beste Reis der Erde produziert wird (SEMLER). In Indien spielte die Reiskultur seit altersher eine große Rolle. Was der Sago für den Osten, das ist der Reis für den Westen Südasiens. Von Indien, das ¾ der Weltproduktion liefert, ist die Reiskultur nach dem Mittelmeergebiet (Italien: Poebene, Lombardei, Venezien, Piemont und Spanien: Andalusien, Valencia, Catalonien) und die Verein. Staaten gebracht[S. 190] worden. Obenan steht hier Süd-Carolina, dann folgen Louisiana und Georgia. «Wie nämlich mit dem Zucker und Kaffee und der Baumwolle geschah, so auch mit dem Reis: erst die Versetzung in die neue Welt hat ihn zu einem Weltprodukt gemacht. Europa war für diese Frucht nur die Haltestation, wohin sie die Araber, die alten Zwischenhändler des Ostens und Westens brachten und von wo andere sie weiter nach Neu-Indien jenseits des Ozeans schafften» (HEHN). Südamerika baut nur wenig. Im großen Stile wird Reis ferner in Japan, Hinterindien, Siam und auf Java gebaut, dann auch auf den anderen Inseln des malaiischen Archipels. In Afrika baut Ägypten Reis. Die Kultivateure unterscheiden Wasserreis (ind. aus) und Bergreis (ind. boro) und eine Zwischenform (ind. amum), sowie den hier nicht in Betracht kommenden Klebreis. In Java, dessen Reiskultur hoch entwickelt ist, sah ich die beiden typischen Kulturmethoden, die in den Bergen übliche trockene Methode der gaga (tegal), wo der Bergreis (O. montana = paddi tjereh) — seltener Klebreis (p. ketan) — auf trockene Felder ausgesät wird und die im ganzen Mittelland gebräuchliche der sawah (rawah, vgl. I, Fig. 24), bei der Oryza sativa und praecox in quadratischen, terrassenartig übereinander liegenden, periodisch bewässerten Feldern meist durch Einpflanzen von in Saatbeeten erzeugten Pflänzlingen (seltener durch Aussaat) gebaut wird. Die Reiskultur verursacht viel Arbeit. In Java heißt der Reis im Halme paddi, gedroschen gaba, geschält bras, gekocht nassi.
Pathologie. Über die pflanzlichen Schädlinge berichtet Prof. ED. FISCHER: Unter den Krankheiten, welche die ganze Reispflanze ergreifen, ist besonders die Brusone-Krankheit zu erwähnen, mit der die in Japan auftretende Imotsi-Krankheit identisch zu sein scheint. Es handelt sich um eine Fleckenkrankheit, die auch völlige oder teilweise Sterilität der Rispen nach sich zieht. Die meisten Autoren sehen eine Imperfekte, Piricularia Oryzae CAV. als Ursache an, doch halten andere das Auftreten dieses Pilzes für eine sekundäre Erscheinung. In den Blüten von Oryza ist Claviceps purpurea beobachtet worden; nahe verwandt mit derselben ist nach BREFELDS Untersuchungen sehr wahrscheinlich Ustilaginoidea Oryzae (PAT.) BREF., die in dem Fruchtknoten eine schwarze Conidienform bildet, welche man früher als einen Brandpilz (Tilletia Oryzae PAT.) ansah.
1. Einblütiges, kurz begranntes Ährchen, die Spelzenhülle geöffnet. 2. Querschnitt durch eine von Palea inferior (pi) und Palea superior (ps) eng umschlossene Frucht. 3. Längsschnitt durch die Frucht. 4. Längsschnitt durch den Keimling: scut. Scutellum, pl. Plumula, rad. Radicula.
[Nach Tschirch-Oesterle, Atlas.]
Beschreibung. Oryza sativa wird etwa 1 m hoch. Die einblütigen, etwas platten, von vier glumis behüllten Ährchen sind zu großen, meist ziemlich zusammengezogenen, seltener ganz lockeren Rispen vereinigt. Die Blüten besitzen sechs Stamina. Die meist etwa 6–7 mm lange Frucht ist von der Seite stark zusammengedrückt, zeigt zwei seitliche Furchen und wird von den miteinander verzahnten Spelzen (paleis) dicht und fest umschlossen (Fig. 68). Diese Spelzen sind knorpelig, lederig, reich an mechanischen Elementen, anliegend, rauhhaarig, die Palea inferior fünfrippig, begrannt, die Palea superior dreirippig. Bei dem wilden Reis fallen (wie bei den meisten wilden Getreidearten) die Früchte bei der Reife aus den Ähren heraus. Frucht- und Samenschale sind zart und obliteriert. Durch das Schälen und Polieren werden die Paleae und auch die Frucht- und Samenschale (Silberhaut) sowie die 1–2reihige Aleuronschicht und der stark exzentrisch gelegene, leicht sich ablösende Keimling entfernt, so daß das Korn dann nur aus dem Endosperm besteht. Der Bau der Spelzen und der Fruchtschale ist beschrieben in TSCHIRCH-OESTERLE, Anatomischer Atlas. Die Größe der Reiskörner schwankt zwischen der eines Senfkornes und der eines Melonenkernes, die Farbe von hellgelb bis schwarz. Ungeschälter Reis heißt[S. 191] in Indien paddy, in Nordamerika rough rice. Durch Schälen in der Reismühle (im peeler, polisher, huller) wird das Gewicht auf die Hälfte oder zwei Drittel reduziert. Das Produkt heißt Kochreis. Das beim Schälen abfallende ist die Reiskleie, die aber immer noch c. 25% Stärke, 6,5% Eiweiß und c. 5,5% Fett (daneben aber c. 46% Rohfaser) enthält. Das durch Polieren des Kochreis abfallende ist noch stärkereicher (30–50%) und bildet daher ein gutes Ausgangsmaterial für die Darstellung der Reisstärke. Die Eingeborenen der verschiedenen Länder Asiens besorgen das Schälen des Reis nur selten in Mühlen. Ich sah in Südostasien den Reis in Mörsern stampfen, durch hölzerne Klöpfel schlagen und durch mechanisch mit den Füßen in Bewegung gesetzte breite Hämmer klopfen (vgl. auch Fig. 69).
Geschälter Reis enthält 74,9–77% Stärke, 0,68% Rohfaser, c. 9,2% Eiweiß, ungeschälter c. 74% Stärke, 3,1% Rohfaser und 7,8% Eiweiß.

Japanische Reisschälmethode.
Stampfen des Reis in einem Mörser mit einem mit dem Fuß gehobenen, knieförmig gebogenen Holz.
[Aus Les grandes cultures.]
Produktion. Die Reisernte wird jetzt pro Jahr auf 175 Milliarden (engl.) Pfund (lb.) = c. 80 Mill. t. geschätzt. Britisch Indien produziert 60, China 50–60, Japan 15, Siam 6,75, Java 6,5, franz. Hinterindien 5, Korea 3, Formosa 2,75 Milliarden lb., Italien erzeugt 750 Millionen Pfund, je c. 500 Mill. lbs. erzeugen Spanien, Ceylon, die Philippinen, die Vereinigten Staaten (Louisiana, Texas, Süd-Carolina, Arkansas). In letzteren stieg 1908 die Produktion auf 608 Mill. lbs. (1907 erzeugte Nordamerika 18738000 Bushels Reis.) Es wird jetzt dort nicht nur Flußschlemmland, sondern auch Prairieland zum Reisbau herangezogen. Europa führt jährlich für 344 Mill. Mark Reis ein. Deutschland verbrauchte 1907 für 31743000 Mark. Der Jahresumsatz des Weltreismarktes beträgt 600–800 Mill. M. Vom indischen[S. 192] Reis unterscheidet man drei Sorten: Tafelreis, Ballam und Moonghy. Den meisten Reis exportiert Burmah, dann folgt Bengalen und Madras. In Code franc. steht geschälter (décortiqué) Reis.
Als Schädling der Früchte ist der Käfer: Rhizopertha pusilla FABR. zu nennen, dessen Larve vermutlich eingeschleppt wurde. Er ist namentlich in Hafenplätzen öfter schädlich aufgetreten (ISRAEL). Über Calandra Oryzae vgl. I, S. 383. Siehe auch unter Mais.
Darstellung der Reisstärke. Reisstärke wird besonders in England, dann in Belgien, Frankreich, Deutschland (Altona, Ulm), Österreich (Fiume, Tirol), Italien und Amerika aus schlechteren Reissorten, aus Bruchreis, havariertem Reis oder den beim Polieren des Reis erhaltenen Abfällen bereitet.
Da die Stärkekörner die Zellen dicht erfüllen, genügt Einweichen und Zerquetschen der Früchte nicht, um die Körner zu isolieren. Sämtliche zur Anwendung kommende Verfahren (JONES, RANSFORD, BERGER) laufen darauf hinaus, daß der die Körner verkittende Kleber durch Behandlung mit verdünnter Ätzlauge (z. B. 0,25% Natronlauge), Ammoniak oder Säuren oder durch ein «Gärverfahren» gelöst, das Reiskorn «aufgeschlossen», d. h. aufgelockert wird. Die weitere Behandlung ist wie bei der Weizenstärke (s. d.). Neuerdings wird in Frankreich auch der elektrische Strom herangezogen. Nach dem STOLTENHOFFschen Verfahren werden die Körner im Vacuum 6–8 Stunden mit fließender Natronlauge behandelt (die Lauge wird mit Säure gefällt, der gefällte Kleber ist als «Energin» im Handel). In Deutschland gibt es 12 Reisschälmühlen und Reisstärkefabriken. Über den Klebreis vgl. Amylodextrin.
Reisstärke.
[Nach TSCHIRCH-OESTERLE, Atlas.]
Anatomie. Das Endosperm des Reis ist bisweilen in ein Horn- und Mehlendosperm geschieden. Ein Teil und zwar die Hauptmasse erscheint alsdann glasig, ein Teil in der Nähe des Scutellums mehlig. Die Stärkekörner erfüllen die Zelle dicht. Zusammengesetzte Stärkekörner treten nur undeutlich hervor. Ihre Begrenzungslinie ist nie glatt (wie beim Hafer). Die Stärkekörner der Reisstärke (Fig. 70), die auch wohl (fälschlich) Reismehl genannt wird, sind kristallartig scharfkantig-eckig, besonders häufig fünfeckig. Rundliche Körner sind selten. Sie sind ziemlich gleichartig in Gestalt und Größe, meist 4,5–6 mik lang, die größeren bis 8,5, nie über 10 mik, die kleinsten 3 mik. Bisweilen hängen noch einige Körner zusammen. Einige zeigen eine Kernhöhle.
Chemie. Reisstärke enthält durchschnittlich 85,18% Stärke, 13,7% Wasser, 0,88% Stickstoffsubstanz, 0,3% Asche; Spuren Fett und Rohfaser. Reisstärke beginnt bei 53,7° aufzuquellen und bei 58,7° zu verkleistern, bei 61,2° (nach DAFERT bei 73°) ist die Verkleisterung vollkommen (LIPPMANN).
[S. 193]
Handel. Im Handel ist die Reisstärke entweder in kantig-prismatischen Stücken als Strahlen-, besonders Kristallstärke oder aber (die schlechteren Sorten) in Form unregelmäßiger Brocken (Schäfchen) oder als Pulver. «Royal Anglais» ist belgische (Remy-)Stärke, Corn flour besonders feine Reisstärke.
Die Gesamteinfuhr an Reisstärke betrug in Hamburg 1908: 24661 dz, die Einfuhr an Reis 2354543 dz, der meiste (1810385 dz) kam aus Brit. Ostindien.
Deutschland führte 1909 polierten Reis 851935 dz, enthülsten und Bruchreis 2178571 dz ein, letzteren vornehmlich aus Brit. Indien, dann auch aus Siam und französ. Indien (Reis in der Hülse nur 163958 dz) und exportierte Reisstärke 53497 dz besonders nach Großbritannien.
Prüfung. Reisstärke besteht fast nur aus Stärkekörnern (s. oben) mit sehr wenig Zellresten, bildet also ein sehr feines und gleichmäßiges Pulver. Die Beimengung von Spelzen ist leicht an der sehr charakteristischen Epidermis derselben zu erkennen, andere Stärke an den abweichenden Formen (am schwierigsten Haferstärke — kommt aber in praxi kaum vor).
Reisstärke reagiert stets alkalisch. Die medizinisch angewendete soll aber doch nur sehr schwach alkalisch sein, also mit Wasser geschüttelt ein nahezu neutrales Filtrat liefern (Ph. helv. IV). Die Asche übersteige 0,5% nicht (HAUKE).
Anwendung. Reisstärke ist in der Revalenta arabica (Revalescière du Barry), im Racahout des Arabes, in der Kaiffa, dem Palamoud des Turcs, der Palmycena und anderen Geheimmitteln enthalten. Reis wird gegen Diarrhoe angewendet. Die Reisstärke ist die wichtigste Poudre-Grundlage (poudre de riz). Reisstärke gibt, da sie vollständig, sehr gleichmäßig und gummiartig verkleistert, eine vorzügliche Appretur, wird aber wegen des hohen Preises nur zur Appretur feinerer Stoffe benutzt. Silberglanzstärke ist Reisstärke mit 10–15% Borax, Doppelstärke enthält neben Reis- und Kartoffelstärke 6–7% Borax und 2–2,5% Stearin. Crêmestärke ist mit Farbstoffen gefärbt.
Reis ist das wichtigste Nahrungsmittel Südasiens (China, Indo-China, Indien, Malaiisch. Archipel) und großer Teile Afrikas, denn er enthält neben viel Kohlehydraten (vornehmlich Stärke) auch ziemlich viel Stickstoffsubstanz (s. oben), so daß man sich von ihm allein ernähren kann. Reis kann aber nicht verbacken werden. «In dem Kranze wertvoller Nutzpflanzen, die die Tropen ihren Bewohnern liefern, ist der Reis eines der schönsten Blätter, ja er bildet mit dem Coco und dem Pisang die Grundsubstanz aller Speisen, die der Eingeborene in Ceylon und Java, ja im ganzen malaiischen Archipel genießt» (TSCHIRCH, Ind. Heil- u. Nutzpflanzen). Und auch der Holländer geht in Indien täglich um Mittag zur «Reistafel». In Asien werden aus Reis mehrere alkoholische Getränke hergestellt (vgl. I, S. 1019). Schon die alten Inder kannten ein Reisbier.
Geschichte. Reis findet sich noch nicht in Rig-Veda, in Atharva-Veda ist er mit másha (Phaseolus Roxburghii) und Sesam zusammen erwähnt. Die Alten des Abendlandes bauten Reis nicht, bezogen ihn aber aus Indien. Ein gebräuchliches Nahrungsmittel wurde er im Altertum des Abendlandes nicht. Selbst Reistisane war teuer (HEHN). Das Abendland wurde durch den Alexanderzug (I, S. 529) mit dem Reis bekannt. THEOPHRAST beschreibt ihn gut. Damals wurde Reis in Sawahs (s. vorn) nicht nur im Indusdelta, sondern auch im Zweistromlande und am Oxus gebaut (STRABO). Im Periplus (I, S. 536) wird Reis als Ausfuhrartikel von Limyrike und Reiskulturen in Ostindien bei Barygaza und Ariake erwähnt. Nach Ägypten und Spanien brachten die Araber die Reiskultur, ins Mailändische und Venezianische kam sie Anfang des XVI. Jahrh. (HEHN). ALBERTUS MAGNUS (I, S. 673) bespricht Rizum. Der Reis ist bei den Indern Symbol des Reichtums und der Fruchtbarkeit. Er spielt dort im Hochzeitsritus, bei den Ceremonien zur Erlangung von Kindern sowie als Liebesorakel und Aphrodisiacum, Allheilmittel, Schönheitsmittel eine Rolle. Auch in England wirft man der Braut Reiskörner nach. Reis ist die Pflanze der javanischen Ceres, Dewi Sri. Die Reiskultur hat aus den Malaien, orang malayu, d. h. herumschwärmenden Leuten, seßhafte gemacht. «Reis und Tee» heißt im[S. 194] Japanischen soviel wie bei uns «Essen und Trinken». Reismehl tritt als Appretur auf frühmittelalterlichen Papieren sowohl als Kleister wie in Substanz aufgewalzt auf (WIESNER, KOBERT). Die Reisstärke ist ziemlich spät erst in Aufnahme gekommen.
Lit. DE CANDOLLE, L’origine des plantes cultiv. — Pharmacographia indica (dort die Geschichte des Reis in Indien). — WATT, Dictionary of econom. prod. India. — K. BRAUN, Der Reis in Deutsch-Ostafrika. Ber. über Land- u. Forstw. in Deutsch-Ostafrika. 1908. — HEHN, Kulturpfl. u. Haust., VII. Aufl. 1902. — TSCHIRCH, Ind. Heil- und Nutzpflanzen (mit Abbild.: Sawah, Reismühlen usw.). — Les grandes cultures (zahlreiche Abbild. der Kultur und Ernte). — SEMLER, Trop. Agrikultur, 2. Aufl. — WIESNER, Rohstoffe (dort d. ältere Lit.). — TSCHIRCH, Stärkemehlanalysen. Arch. Pharm. 1885. — TSCHIRCH-OESTERLE, Anatom. Atlas, Taf. 45 (dort eine ausführl. Beschreib. d. Frucht). — MOELLER-WINTON, Mikrosk. d. Nahrungs- u. Genußm. 1905 (Abbild.). — VAN GORKOM, Rijst in Beschreijvende Catalog. Kolon. Mus. Haarlem 1907 und Oostindische Cultures. — HARZ, Landwirtschaftl. Samenkunde. — Abbild.: NEES VON ESENBECK, t. 36, BENTLEY-TRIMEN, Medicinal plants t. 291, BERG, Charakteristik t. 6 und HACKEL in ENGLER-PRANTL, Pflanzenfam. II. 2, 41. — KOBERT, Zeitschr. Angew. Chem. 1910, 1249. — Asche: HAUKE, Zeitschr. Österr. Apoth. Verein 1902.
3. Amylum Maidis.
Mais- oder Mays-Stärke — amidon de mays (franz.) — maize starch (engl.) — in Amerika: corn starch — maïszetmeel (holl.) — amido del mais (ital.) — maissi tärkkelys (finn.) — kukorica kemenyitő (ung.) — ἄμυλον ἀραβοσίτον (n.-gr.).
Stammpflanze: Zea Mays L. (LINNÉ, Spec. plant. I, 971) mit mehr als 300 Spielarten, die sechs Gruppen bilden: Balgmais (huskcorn), Zahnmais (dentcorn), Weichkorn (softcorn), Steinmais (flintcorn), Zuckermais (sweetcorn), Puffmais (popcorn). Der Coyotemais Mexikos wird von einigen als die wilde Urform (?) betrachtet. In Deutschland unterscheidet man: Gemeiner Mais, Perlmais, Pferdezahnmais, Zuckermais, Cuzcomais, Balgmais.
Syn. Indianisch Korn (CORDUS), Indian Corn (engl.), Corn (in Amerika), Türkischer Weizen, Türkenkorn, Türkisch Korn (BOCK, FUCHS), Blé turc (franz.), Kukuruz (Österreich-Ungarn, Donauländer), Welschkorn (BOCK), Türgga (Appenzell), Syrische Durrha (Ägypten), Ägypt. Korn (Türkei), Mekka Weizen (Persien), Arabisch Korn (Griechenland), Guineahirse (Portugal), Tureskorichljib (Rußland). Beim Mais sagt also die Länderbezeichnung nichts über die wahre Provenienz aus.
Etym. Zea von ζέα, ζειά griech. Name eines Triticum (s. S. 188), von ζῆν = leben — Mais von haitanisch (Tupi) Mahiz, mahis. COLUMBUS importierte auch das Wort. «Kukuruz» nach LIPPMANN vom spanischen Cucurucho.
Systemat. Stellung. Gramineae, Maideae.
Beschreibung. Der diclin monöcische Mais wird 60 cm bis 6 m hoch, je nach der Spielart. An der Spitze des Halmes finden sich die männlichen Blütenrispen. In den Blattwinkeln stehen 2–3 kolbenförmige, je nach der Spielart sehr verschieden große weibliche Ähren, von häutigen Hüllblättern umgeben. Die schwammige Achse trägt 8–10 Längsreihen zweiblütiger Ährchen, deren untere Blüte nur unvollständig entwickelt ist. Die Griffel sind sehr lang und hängen aus den Kolbenscheiden weit heraus. Sie werden neuerdings als Stigmata Maidis arzneilich benutzt. Beim Heranwachsen platten sich die Früchte, die in geraden oder etwas schrägen Längszeilen liegen, etwas gegeneinander ab. Sie bilden den bekannten Maiskolben.
Die Früchte sind von sehr verschiedener Größe, Form und Farbe. Letztere wechselt von weiß über gelb zu orange. Auf der einen Fläche der Frucht ist das große helle, ovale Scutellum deutlich und in seiner Mitte der gestreckt ovale Keimling. An das Scutellum grenzt das weiße Mehlendosperm, an dieses das glasige[S. 195] Hornendosperm (Fig. 71). In ersterem liegen die Stärkekörner locker gehäuft, in letzterem erfüllen sie die Zelle dicht und platten sich gegeneinander ab. Der Unterschied zwischen Horn- und Mehlendosperm wurde bereits von RASPAIL (1825) erkannt. Die Verschiedenheit der Stärke in den beiden Endospermen stellte dann PAYEN (1838) fest. Der Bau der Fruchtschale ist ausführlich beschrieben in TSCHIRCH-OESTERLE, Anatomischer Atlas.
Pathologie. Prof. ED. FISCHER berichtet über die pflanzlichen Schädlinge: Die wichtigsten Zerstörer der Früchte und Fruchtkolben der Maispflanze sind Ustilagineen:
Ustilago Maidis (DC.) TUL. bildet an Stengeln, Blättern, männlichen und weiblichen Blütenständen beulenförmige Pilzgallen, die an den Stengeln die Größe eines Kindskopfes erreichen können. In denselben entstehen die Brandsporen; schließlich zerfallen sie in eine schwarze, brandige Masse. Daß dadurch die Körnerbildung mehr oder weniger unterdrückt werden kann, versteht sich von selbst. Die Sporen der Ustilago Maidis werden neuerdings arzneilich benutzt.
Ustilago Reiliana KÜHN bildet ihre Brandsporen in den Fruchtknoten.
Ustilago Fischeri PASS. entwickelt die Brandlager in der Kolbenspindel.
Es gibt außerdem verschiedene Pilze, die die vegetativen Teile der Maispflanze befallen und dadurch indirekt die Körnerbildung beeinträchtigen können. Unter diesen ist eine der gefährlichsten die in Java auftretende Lijer-Krankheit, welche junge Pflanzen zum Absterben bringt. Sie ist auf eine Peronospora (P. Maidis) zurückzuführen. Auch sind neuerdings Bakterienkrankheiten der Maispflanze beschrieben worden.
Zea Mais.
1. Längsschnitt durch die Frucht, frs Fruchtschale, HEnd Hornendosperm, MEnd Mehlendosperm, pl Plumula, Rad Radicula, cal Calyptra, col Coleorhiza, 2 einzelne Zelle des Hornendosperms, 3 einzelne Zelle des Mehlendosperms, 4 das Klebernetz zwischen den Stärkekörnern.
[Nach Tschirch-Oesterle, Atlas.]
Kultur. Der Mais besitzt ein großes Anpassungsvermögen, obwohl seine ursprüngliche Heimat wohl im tropischen Klima lag. Er braucht aber eine gewisse Menge Feuchtigkeit und gedeiht in trockenen Klimaten nicht. Schon JOS. ACOSTA (I, S. 754) beschrieb seine Kultur. Die Früchte werden in Amerika durch eigene «Maisschäler» vom Kolben abgelöst. Die größte Menge Mais, c. 80% der Gesamtweltproduktion, erzeugt jetzt Nordamerika: etwa 50 Mill. t. im Jahre, den meisten die nördlichen Mittelstaaten (bes. Iowa, Illinois, Kansas, Nebraska, Missouri, Ohio, Indiana). Auch Kanada, Mexiko, Zentral- und Südamerika (Argentinien) bauen viel Mais; in Afrika: Ägypten, Algier. Geringer ist die Kultur in Asien, beträchtlich in Europa, besonders in Italien, Deutschland, Ungarn, Rumänien, Schottland und in Rußland (vgl. auch die Karte auf S. 189).
Die Maisfrucht enthält 62 bis 74,5% Stärke, 8–12% Eiweiß, 4,5–6,5% Öl, 1,6–2,7% Rohfaser, 8–14,5% Wasser. Maiskleie liefert bei der Hydrolyse mit verdünnten Säuren u. a. Xylose. (Über die Eiweißkörper des Maiskornes vgl. DONARD und LABBÉ, Compt. rend. 1903.)
Darstellung der Maisstärke. Die Maisstärke, welche das einzige Amylum der amerikanischen Pharmakopoëe ist, wird in großem Stile nur in Nordamerika dargestellt, in geringerer Menge in Brasilien, Neu Südwales, England, Frankreich, Deutschland,[S. 196] Niederösterreich und den Donaufürstentümern. Die eingequollenen Körner werden zerquetscht und der Brei in Cylindersieben ausgewaschen. Man verwendet hierbei, da das Korn ziemlich hart ist, das Natronverfahren (wie beim Reis, LECONTE) oder läßt den Brei gären (WATT) oder setzt ihm schweflige Säure zu. Die Lauge löst den die Körner miteinander verkittenden Kleber (Fig. 71). Die gemeine amerikanische Maisstärke in Brocken besteht aus Hornendospermkörnern, die Duryea Maizena, das feinste Maismehl, vorwiegend aus Mehlendospermkörnern. Beide werden aus dem großen Pferdezahnmais in großem Stil dargestellt; die St. Bernhardswerke in Cincinnati produzieren täglich 25000 kg. Die amerikanische Maisstärke heißt Corn flour oder Corn starch. Auch Mondamin ist Maisstärke. Ebenso Patent corn flour, Palamoud, Potage des Sultanes usw.

Maisstärke.
[Nach Tschirch-Oesterle, Atlas.]
Anatomie. Die Stärkekörner (Fig. 72) haben eine verschiedene Gestalt, je nachdem sie aus dem Hornendosperm oder dem Mehlendosperm (s. oben) stammen. Ihre Größe schwankt zwischen 8,5 und 31,5, meist beträgt sie 15 bis 20 mik.
Die Hornendospermkörner sind mehr oder weniger scharfkantig oder abgerundet kantig, isodiametrisch oft mit einem zentralen Spalt oder einer Zentralhöhle versehen, ungeschichtet, bisweilen noch zu mehreren zusammenhängend. Die Größe beträgt meist 10–18–23 mik, steigt aber auch bis 25 mik und darüber.
Die Mehlendospermkörner zeigen sehr unregelmäßige, aber stets abgerundete Formen, regelmäßige Kugeln sind selten, Schichten fehlen meist, der Zentralspalt bisweilen. Die Größe variiert sehr. Sie beträgt 9–23, meist 10–15 mik, steigt aber auch auf 25–30 mik. Daher erscheint das Mehlendosperm oft großkörniger als das Hornendosperm.
Nebenform: Zu zweien zusammengesetzte gestreckte Körner oder deren Teilkörner und ganz kleine rundliche Körner von 2–10 mik und Übergänge zwischen Mehl- und Hornendospermstärke.
Handel. Die Ausfuhr von «Starch» aus den Vereinigten Staaten betrug 1907: 51334580, 1908: 48125851, 1909: 33228278 Pounds. Es handelte sich hierbei wohl hauptsächlich um Maisstärke.
Deutschland führte 1909 c. 7 Mill. dz Mais ein, den meisten aus Argentinien, dann aus dem europäischen Rußland, Rumänien und den Ver. Staaten.
Deutschland führte 1909: 10850 dz Mais-, Weizen- und andere Stärke (aus Großbritannien und den Ver. Staaten) ein. Die Ausfuhr betrug c. 11000 dz.
Chemie. Maisstärke enthält durchschnittlich 84,14% Stärke, 13,95% Wasser, 1,53% Stickstoffsubstanz und 0,38% Asche. Sie enthält auch ein Gluko-Xylan (Storer). Maisstärke zeigt deutliches Aufquellen bei 50°, Beginn der Verkleisterung bei 55° und vollkommene Verkleisterung bei 62,5° (LIPPMANN). Maisstärke reagiert[S. 197] oft sauer. SAARE fand den Säuregrad der Maisstärke oft sehr beträchtlich, besonders bei geringeren Sorten (Zeitschr. f. Spiritusfabrikat. 1901).
Die Stigmata Maidis sind reich an Zucker und Gummi (19,5%) enthalten c. 5,5% Fett und sowohl im Äther- wie im Alkoholauszuge neben Harz kristallinische Substanzen (FISCHER, Am. Journ. Pharm. 1886).
Anwendung. Der Mais, die Maismehle und die Maisstärke spielen in Nordamerika die gleiche Rolle wie bei uns Weizen- und Kartoffelmehl und Weizen- und Kartoffelstärke und in England Reisstärke (s. oben S. 157) und haben die anderen fast verdrängt. Maismehl und Maisschrot sind Futtermittel. Maiskolbenmehl (Cob meal) wird aus dem ganzen Fruchtstand inkl. der Spindel dargestellt. In großen Mengen wird Mais zur Glukosefabrikation benutzt, wofür er sich am besten eignet (man behandelt mit Salzsäure bei 60–80°); dann zur Maltosefabrikation (Behandeln mit Malz), zur Darstellung von Sirup (Behandeln mit schwefliger Säure), Dextrin usw. Auch die Brennereien verschlingen große Mengen.
Geschichte. Der Mais, der schon in präkolumbischer Zeit fast durch ganz Amerika kultiviert wurde (Gräberfunde in Arizona, Ankona usw.) — die Mexikaner hatten eine Maisgöttin — ist das Gegengeschenk der neuen Welt für den Reis, den die alte ihr brachte. Er wurde von COLUMBUS wahrscheinlich schon von seiner ersten Reise (1493) nach Europa gebracht (I, S. 745); jedenfalls schon 1500 in Spanien gebaut. Bei HERNANDEZ (I, S. 761) ist dem Mais (Tlaoelli, span. Maizio) ein großes, mit Abbildungen geschmücktes Kapitel gewidmet. Er hat sich außerordentlich rasch über Europa, Afrika und Asien verbreitet und bildet jetzt ebenso für Südeuropa und die Levante, wie für China und Japan, ja selbst für einige Negerstämme Afrikas, «die nie einen Europäer gesehen haben», ein wichtiges Nahrungsmittel. Die Venetianer verbreiteten den Mais im XVI. Jahrh. im Orient, nach Deutschland kam er im gleichen Jahrhundert aus Italien, wo die Polenta bekanntlich eine beliebte Speise ist. Nach Afrika brachten ihn im XVI. Jahrh. die Portugiesen und die Spanier brachten ihn von Osten her nach Südasien. Er wurde schon 1496 auf Java ausgesät. Im XVI. Jahrh. kam er auch nach China. Da Reisende ihn schon zu so früher Zeit überall in Asien fanden, glaubte man anfangs, daß er auch dort seine Heimat habe.
Lit. Abbild.: BERG, Charakteristik t. 6, BENTLEY-TRIMEN, Medicinal plants t. 296, HACKEL in ENGLER-PRANTL, Pflanzenfam. II, 2, 19. — BONAFOUS, Hist. nat. agric. et econom. du Maïs. Paris 1836. — DE CANDOLLE, L’origine des plantes cultiv. 4. Aufl. 1896 (dort weitere histor. Lit.). — Abbild. der Kultur und Verarbeitung in Les grandes cultures du monde. — WITTMACK, Über antiken Mais aus Nord- und Südamerika. Zeitschr. f. Ethnologie XII. — MOELLER-WINTON, Mikroskopie (dort viele gute Abbild. und weitere Liter.). — Analysen in KÖNIG, Nahr.- u. Genußm. — HARZ, Landwirtsch. Samenkunde. — WIESNER, Rohstoffe (dort die ältere Lit.). — TSCHIRCH-OESTERLE, Anatom. Atlas und TSCHIRCH, Stärkemehlanalysen. Arch. Pharm. 1884/85. — A. MEYER, Arch. d. Pharm. 1884, 912.
4. Fruct. Hordei.
Gerste — orge — barley — gerst.
Im Code franc. steht oberflächlich geschälte Gerste (orge mondé) und ganz bis zum Endosperm geschälte (orge perlé), in der niederländischen Pharmakopoëe: Fruct. hordei decorticati (gepelde gerst).
Die Stammpflanze der Fruct. hordei ist Hordeum vulgare L. (LINNÉ, Spec. plant. 84). Gramineae — Hordeeae, von der auch die zwei Unterarten, die sechszeilige Gerste (H. hexastichum) und die vierzeilige Gerste (H. genuinum) kultiviert werden. Auch Hordeum distichum mit var. zeocrithum wird sehr viel gebaut.
In bezug auf die Krankheiten der Gerste gilt im wesentlichen dasselbe, was für Triticum vulgare gesagt wurde. Neben mehreren Pilzen, die indirekt den Körnerertrag beeinträchtigen (Erysiphe graminis, Puccinia graminis, glumarum, in Rassen, die zum Teil nicht auf Weizen übergehen; Puccinia simplex, Melanospora damnosa) finden wir als direkte Zerstörer[S. 198] der Früchte vor allem Ustilagineen, und zwar die beiden Flugbrandarten Ustilago Hordei (PERS.) KELL. et SW. und Ustilago nuda (JENS.) KELL. et SW. Auch Claviceps purpurea kommt auf der Gerste vor (ED. FISCHER).
Als tierische Schädlinge der Gerste nennt ISRAEL:
1. Käfer: Sitophilus granarius L. Dieser kleine Rüsselkäfer legt seine Eier an die Körner aufgespeicherter Getreidevorräte. Die Larve höhlt die Körner des Weizens, der Gerste und des Roggens aus und tritt oft in Massen auf. Sitophilus oryzae L., der Reiskäfer. Dieser Käfer ist mit Reis aus dem Oriente nach Europa verschleppt worden, nimmt aber bei uns auch die Körner von Mais, Weizen und Gerste an und tritt gelegentlich schädlich auf. Der sog. Springmais ist auf diesen Käfer zurückzuführen.
2. Falter: Gelechia cerealella OLIV. Räupchen in Gerste und Weizenkörnern. In einigen Gegenden Deutschlands ist dieser Kleinschmetterling schon schädlich aufgetreten. Orobena frumentalis L. Die Raupe lebt in den Halmen des Roggens, der Gerste und des Weizens.
3. Fliegen: Cecidomyia destructor SAY. Larve lebt wie die von Orbona in den Halmen der Cerealien.
Die Früchte der Gerste sind von den beiden Paleis dicht und fest umschlossen und fallen aus diesen nicht heraus (Anatom. Beschreibung in TSCHIRCH-OESTERLE, Anatom. Atlas). Für den Arzneigebrauch werden sie geschält. Der Same zeigt drei Reihen Aleuronzellen.
Die Stärke ähnelt sehr der Weizenstärke, doch sind die Großkörner etwas kleiner, meist 15–30 (am häufigsten um 25) mik.
Die Gerste enthält c. 64,5% Stärke, 13,5% Wasser, 11,15% Stickstoffsubstanz, 2,1% Fett, 1,5% Zucker, 5,3% Rohfaser, 2,7% Asche.
Die geschälte Gerste wird zu Tisanen und Gargarismen benutzt. Die gekeimte Gerste ist Grundlage der Bierbereitung (vgl. I, S. 1019) und Ausgangsmaterial für die Darstellung des Malzextraktes.
Das Gerstenmehl wird aus den mehr oder weniger entspelzten Körnern dargestellt und spielt auch als Bestandteil einiger Kindernährmittel (TIMPES Kraftgries, KOBENS Nährpulver, GEHRINGS Laktin) eine Rolle. Das präparierte Gerstenmehl, Farina hordei praeparata (30 Stunden im Dampfbade erhitztes Gerstenmehl), war, da leicht verdaulich, früher sehr beliebt und ist der Vorläufer der sog. Kindermehle. Früher war das sog. HUFELANDsche präparierte Gerstenmehl bei den Ärzten sehr beliebt, das in der Weise bereitet wurde, daß man eine größere Portion Gerstenmehl in einen Beutel eingeschlossen, in ein Wasserbad hing, 14 Stunden — unter öfterem Ersatz des Wassers — in dem siedenden Wasser beließ, dann herausnahm, die schlüpfrige Randschicht entfernte und den «Kern» pulverisierte.
Die Gerste heißt im Ägyptischen btt (die hieroglyphischen Zeichen I, S. 470). Bei antiken Räucherungen fand Gerstenmehl Anwendung (vgl. I, S. 1060). Alphita, das der berühmten Drogenliste (I, S. 639) den Namen gegeben hat, war Farina hordei.
Die Gerste war das Hauptgetreide der alten Indogermanen, die (nach HOOPS) vor ihrer Trennung in Asiaten und Europäer ihre Stammsitze in Mitteleuropa westlich von der Linie Königsberg-Odessa hatten.
Lit. MOELLER-WINTON a. a. O. — HOOPS a. a. O. — Große Monographie: LERMER und HOLZNER, Beitr. z. Kenntn. d. Gerste 1888 mit 52 Großfol. Taf.
IV. Stärke aus dem Cotyledonen von Samen.
Leguminosenstärke.
Die Leguminosenstärke findet sich in den Cotyledonen der Samen der Bohne und der Erbse. Sie wird arzneilich nicht angewendet. (Beschreibung der Samen und der Stärke in TSCHIRCH-OESTERLE, Anatom. Atlas, Taf. 48, 49 u. 53, bei VOGL, MOELLER-WINTON, HANAUSEK u. and. — TSCHIRCH, Stärkemehlanalysen. Arch. Pharm. 1884).
II. Amylodextringruppe.
Behandelt man Stärke mit verdünnten Säuren oder mit Diastase, so wird zunächst Amylodextrin gebildet. Diesen Körper hatte SCHULZE (1848) zuerst in Händen.[S. 199] Er nannte ihn Amidulin. Der eigentliche Entdecker ist aber MUSCULUS (1870), der ihn dextrine insoluble dans l’eau nannte. Den Namen Amylodextrin gab ihm WALTER NÄGELI (1873), der den Körper auch kristallisiert in Sphärokristallen erhielt. Das Erythrodextrin und das Achroodextrin sind unreines, vorwiegend mit Dextrin verunreinigtes Amylodextrin. LINTNERS Amylodextrin ist mit viel Amylose (MEYER) verunreinigtes Amylodextrin. Von der Amylose (reiner Stärkesubstanz, s. oben S. 154) unterscheidet sich Amylodextrin (nach A. MEYER) durch folgende Eigenschaften:
|
Amylose
|
Amylodextrin
|
|
|
Bleiessig
|
gibt Niederschlag in 0,05% Lösung
|
gibt selbst in 6% Lösung keinen Niederschlag
|
|
Tanninlösung
|
gibt einen Niederschlag noch in 0,005% Lösung
|
gibt keinen Niederschlag, selbst in 5% Lösung
|
|
Jodlösung
|
in verd. Lösung rein blau
|
in verd. Lösung rein rot
|
|
FEHLINGsche Lösung
|
wird nicht reduziert
|
100 g Amylodextrin reduziert so stark wie 5,6g Dextrose
|
|
(α)D in Lösung von Ca(NO3)2 = + 230°
|
+ 195°
|
|
Reines Amylodextrin kristallisiert in Nadeln, Tafeln und Sphärokristallen. Die Löslichkeit in kaltem Wasser ist gering, besser löst es sich in Wasser von 60°, noch besser bei 90°. Siedender Alkohol von 50% löst reichlich. Das Molekulargewicht ist sehr hoch.
Die «Stärke, welche sich mit Jod rot färbt», die man bisweilen in Pflanzen findet, ist eine an Amylodextrin reiche Stärke. Sie wurde zuerst von NÄGELI (1858) im Samenmantel von Chelidonium majus beobachtet, dann von GRIS (1860) im Klebreis (Oryza sativa var. glutinosa), von A. MEYER in Panicum miliaceum var. glutinosum und Sorghum vulgare var. glutinosum und von mir im Samenmantel von Myristica fragrans gefunden, dessen Hauptbestandteil sie bildet. Gepulverte Macis ist an ihr leicht zu erkennen. In Embryonen fand sie TREUB, in phanerogamischen Parasiten RUSSOW. Diese durch Jod rot werdenden Stärkekörner enthalten neben Amylodextrin noch (Dextrin und) Amylose. Ich habe sie «Amylodextrinstärkekörner» genannt, BÜTSCHLI betrachtet sie als ein besonderes stärkeähnliches Kohlehydrat: Amyloerythrin. Zu ihnen gehört auch die sog. Florideenstärke (vgl. Carrageen).
Lit. MUSCULUS, Zeitschr. f. Chem. 1869 u. 1870 u. Zeitschr. f. phys. Chem. 2. — WALTER NÄGELI, Beitr. z. näh. Kenntn. d. Stärkegruppe. Leipz. 1874. — SHIMOYAMA, Beitr. z. Kenntn. d. japan. Klebreis. Diss. Straßburg 1886. — DAFERT, Beitr. z. Kenntn. d. Stärkegruppe. Landw. Jahrb. 1886. — ARTH. MEYER, Stärkekörner 1895. — TSCHIRCH, Inhaltsbest. d. Arill. v. Myrist. fragr. Ber. d. Bot. Ges. 1888, 138. Artikel Amylodextrin in Realenzykl. d. ges. Pharm. u. Angew. Anatomie. — EULER, Grundlagen d. Pflanzenchemie 1908.
Die einzige Droge, die hierher gehört, die Macis, deren Grundparenchymzellen dicht mit Amylodextrinstärkekörnern erfüllt sind (vgl. TSCHIRCH, Angew. Anatomie), wird weiter hinten bei Myristica abgehandelt werden, da die Macis besser zu den Riechstoffdrogen gestellt wird. In gewissem Sinne kann aber auch das Trehalamanna (S. 147) hierhergezogen werden, da es 25–32% Amylodextrinstärke enthält, sowie die Rotalgen, in denen sich Florideenstärke findet.
Der Klebreis ist nur aus Ausgangsmaterial für ein gegorenes Getränk (I, S. 1019) für uns interessant.
III. Dextringruppe.
Über das Dextrin existiert keine Klarheit, wir wissen nur, daß es ein Polysaccharid ist. Aber ob es nur ein Dextrin gibt und die Formen Maltodextrin, Erythrodextrin,[S. 200] Achroodextrin, Amylozellulose usw. Gemische oder Individuen darstellen, wissen wir nicht. Die Dextrinliteratur bietet «ein trostlos verwickeltes, durch zahlreiche Widersprüche getrübtes, vorerst völlig unentwirrbares Bild» (V. LIPPMANN 1904). Die jetzt vielfach reproduzierte Formel (C12H20O10)3.H2O) trägt also nur vorläufigen Charakter. SKRAUP erteilte (1905) dem Erythrodextrin ein Molekulargewicht von 1700 bis 2000.
ARTHUR MEYER nimmt nur ein Dextrin an und betrachtet alle Achroodextrine als Gemenge von Dextrin mit Maltose oder Isomaltose. Das reine Dextrin MEYERS zeigte αD = +192° und ein kryoskopisches Verhalten, das auf ein etwas größeres Molekulargewicht als 1223 ± 25 hinweist. Es reduziert schwach FEHLINGsche Lösung.
Dextrin wurde zuerst von VAUQUELIN (1811) als ein besonderer Körper erkannt, dann zunächst von PERSOZ und PAYEN (1833) untersucht.
Lit. Die neuere Literatur bei LIPPMANN, Chemie der Zuckerarten. — A. MEYER, Stärkekörner. 1895.
Dextrin.
Das Dextrin (Dextrine, Dextrina) des Handels wird jetzt meist durch direktes Erhitzten von Stärke auf 150–200°, seltener durch Einwirkung von verdünnten Säuren oder Diastase auf Stärkekleister gewonnen.
Die Darstellung des Röstdextrins (Röstgummi, Leiokom), welches jetzt hauptsächlich im Handel ist und ein gelbliches Pulver bildet, erfolgt meist durch Erhitzen von luftrockener Kartoffelstärke in rotierenden, mittelst überhitzten Wasserdampf erwärmten Trommeln auf 180–200°, seltener durch Erhitzen von feuchter Stärke in flachen Kästen auf 160°.
Bei der Darstellung des Säuredextrins, welches ein weißes Pulver darstellt, wird die Stärke mit 2–9‰ chlorfreier Salpetersäure und etwas Wasser vermischt, in dünner Schicht auf 110° im Luftbade erhitzt. Seltener wird Salzsäure, Schwefelsäure oder Oxalsäure benutzt. (Letztere muß nach der Behandlung entfernt werden.)
Bei der praktisch nur selten ausgeführten Darstellung des Diastasedextrins wird die Stärke bei 60–75° mit Malzaufguß behandelt.
Endlich wird auch das auf eine der genannten Weisen erhaltene Rohdextrin dadurch gereinigt, daß man es mit Wasser auszieht, mit Alkohol ausfällt oder die Lösung eindampft und den Rückstand trocknet.
Dextrinierte (Kartoffel-)Stärke: a in Öl, die übrigen in Wasser.
[Nach Tschirch-Oesterle, Atlas.]
[S. 201]
Für medizinische Zwecke wird nur Röstdextrin verwendet. Die Pharm. helv. IV z. B. schließt ausdrücklich das mit Salpetersäure oder Oxalsäure bereitete und sog. chemisch reines Dextrin aus. Sie gibt z. B. an, daß die kalt bereitete Lösung durch Jod weinrot gefärbt werde, Kalkwasser und Diphenylamin keine Reaktion geben. Dies Röstdextrin, das wir als eine Droge betrachten dürfen, muß man aber richtiger dextrinierte Kartoffelstärke nennen. Es besteht aus Stärkekörnern, die alle Stadien der Dextrinierung zeigen. Neben noch fast unveränderten finden wir solche, die schon in Amylodextrinstärke und andere, die schon ganz oder zum Teil in Dextrin übergeführt sind (Fig. 73).
Äußerlich sind die Körner nur wenig verändert, denn wenn man sie in Öl betrachtet, zeigen sie noch die Umrißlinie der Kartoffelstärkekörner und im Polarisationsmikroskop das schwarze Kreuz. Nur eine kleine Luftblase an Stelle des Kerns (Fig. 73) verrät, daß nicht alles geblieben ist wie es war. Legt man die Körner aber in Wasser, so zeigt sich, daß tiefgreifende Veränderungen eingetreten sind. In den ersten Stadien der Dextrinierung hat sich der Spalt erweitert, die innersten Schichten sind gelöst, die Schichtung ist sehr deutlich geworden. In den späteren Stadien sind dann die äußeren Schichten und hier besonders die wasserreichen der Dextrinierung anheim gefallen. Sie lösen sich in Wasser auf und es bleiben zahlreiche übereinander geschichtete Häute übrig, die den dunkleren Schichten des unveränderten Kornes entsprechen. Am längsten widerstehen die mittleren Partien des Korns. Sie färben sich mit Jod blau, violett, rotviolett oder rot, sind also noch zum Teil unveränderte, zum Teil schon in Amylodextrin übergegangene Stärke (TSCHIRCH-OESTERLE, Anatom. Atlas, Taf. 52).
Deutschland fabriziert viel Dextrin. Hamburg exportierte 1908 22631 dz Dextrin (und geröstete Stärke) und importierte 21839 dz.
Frankreich importierte 1908 84187 kg Dextrin aus Deutschland und etwa ebensoviel aus Österreich, nur wenig aus Belgien und den Niederlanden.
IV. Inulindrogen.
Die Vorstellung, daß auch das Inulin, das VALENTIN ROSE 1804 zuerst als Absatz aus einem Dekokte von Inula Helenium beobachtete und dem THOMSON den Namen gab, zu den Polysacchariden gehört, gründen wir auf die Tatsache, daß es bei der Hydrolyse und der Einwirkung des Enzyms Inulase (BOURQUELOT) Fruktose liefert. Die Formel wird sehr verschieden geschrieben. Die Angaben schwanken zwischen C36H62O31 (= 6(C6H10O5).H2O, KILIANI, TANRET) und C108H180O90 (DÜLL). Nur BÉCHAMP erteilt ihm die einfache Formel C6H10O5. Jedenfalls wird Inulin sowohl durch Inulase (nicht durch Diastase, Ptyalin, Emulsin, Invertin) wie durch Hydrolyse mit verdünnten Säuren fast vollständig in d-Fruktose (Lävulose, Fruchtzucker, vgl. S. 7) übergeführt. Hefe vergärt Inulin nicht. Inulin reduziert Fehlingsche Lösung nicht, wohl aber ammoniakalisches Silbernitrat, dreht links (αD = −36,57°, LESCOEUR et MORELL) und färbt sich nicht mit Jodlösung.
Im Gegensatz zur Stärke ist Inulin nicht in Körnerform in den Zellen abgeschieden, sondern (obwohl schwer löslich in reinem kaltem Wasser) im Zellsafte gelöst, also direkt wanderungsfähig. Beim Trocknen der Drogen scheidet es sich in Form von Schollen aus, beim Einlegen der frischen Pflanzenteile in Alkohol in Form von Sphärokristallen (Fig. 74), die sich in konzentrierter Schwefelsäure und auch in heißem Wasser, aber ohne Kleisterbildung, lösen.
[S. 202]
Es vertritt vielfach die Stärke als Reservestoff, besonders bei den Kompositen und benachbarten Familien (Campanulaceen, Lobeliaceen, Goodeniaceen, Stylidieen). Es findet sich hier vornehmlich in den unterirdischen Organen, ist aber auch in oberirdischen, z. B. bei Cichorium, Taraxacum, gefunden worden (vgl. Rad. taraxaci). Sodann auch (nach CHEVASTELON) bei Monocotylen (Narcissus, Hyacinthus, Allium) und (nach KRAUS) in Violaceen (Ionidium Ipecacuanha).
Bei den unterirdischen Organen schwankt der Gehalt an Inulin natürlich je nach dem Entwicklungsstadium oft in sehr weiten Grenzen. RUNDQUIST machte neuerdings folgende Angaben über den Gehalt offizineller Wurzeln an Inulin: Rad. artemisiae 9,66%, R. bardanae 46,25, R. carlinae 17,87, R. cichorii 18,50, R. farfarae 17,40, R. helenii 35,10, R. pyrethri germ. 26,19, R. pyrethri roman. 35,66, R. scorzonerae 31,64, R. taraxaci 39,65, Rhiz. arnicae 5,55. Die höchsten bisher beobachteten Ausbeuten erhielt man aus einer Rad. helenii (44%) und einer Rad. pyrethri (über 50% DRAGENDORFF, nach KOENE: 57,7%), ferner aus Rad. cichorei (57,8%, MAYER, 79%(?) SAYRE).
Inulin-Sphaerokristalle.
[Nach Tschirch-Oesterle, Atlas.]
Das beste Material zur Darstellung des Inulins ist der Dahlienknollen, das billigste Cichorium- oder Taraxacumwurzel (s. d.). Der Inulingehalt der Cichorium- und Taraxacumwurzel bedingt in erster Linie deren Verwendung als Kaffeesurrogat.
Nach TANRET wird es im Alant von Pseudoinulin, Inulenin, Helianthemin und Synanthrin begleitet.
Lit. V. ROSE, Gehlens N. Journ. d. Chem. III, 217. — THOMSON, Syst. de chim. VIII, 82. — KOENE, Ann. chim. phys. 1835. — DRAGENDORFF, Material. z. einer Monogr. d. Inulins 1870. (Ausführl. Referat darüber in Arch. Pharm. 148 [1871] 82.) — PRANTL, Das Inulin. 1870. — RUNDQUIST, Farmac. Notisblad. Helsingfors 1904. — TANRET, Compt. rend. 116 und 117. — Weitere Lit. in TSCHIRCH, Angew. Anatomie, in LIPPMANN, Chemie d. Zuckerarten und TOLLENS, Handb. d. Kohlenhydr. — TSCHIRCH, Artikel Inulin in Realenzykl. d. ges. Pharm.
Die Kompositenwurzeln.
Von diesen, die alle hierher gehören, soll an dieser Stelle nur Rad. cichorei, Rad. taraxaci und Rad. bardanae abgehandelt werden, die anderen, Rad. helenii, Rad. pyrethri, Rhiz. arnicae werden an geeigneter Stelle behandelt. Die Verwendung der hier abgehandelten Drogen als Kaffeesurrogate gründet sich vornehmlich auf ihren Inulingehalt. Einige der Kompositenwurzeln gehören auch zu den Bitterstoffdrogen.
Rad. Cichorei.
Syn. Cichorienwurzel — chicorée, barbe de capucin (franz.) — wild succory, chicory (engl.) — radicchio, radice cicoria (ital.) — cichoreiwortel (holl.) — cigoria (ung.) — sikurin juuri (finn.) — ῥίζα κιχωρίον (griech.). — Wegwarte (so schon im Ortus Sanitatis I, S. 688), wilde Endivie, Sonnenwirbel (ahd. Sunniwirpela, mhd. Sonworbel, Sundwerbel, Sunwirbel), bei GALEN: Seris, bei PLINIUS VALER.: Cicinoria, bei KARL DEM GROSSEN: Solsequium. Bei MEGENBERG (I, S. 692): sunnenwerbel, bei HILDEGARD (I, S. 669): sunnenwirbel, bei ALBERTUS MAGNUS (I, S. 673): cicorea, sponsa solis. In der Alphita (I, S. 645): Cicoria, elitropia, mira solis, cicorea (B) solsequium, incuba. Ferner: Hindleufte, Hindlichte, Hundläufte, Wasserwart, Weigerein. Cichorie wird noch jetzt auch für Taraxacum offic. benutzt (Graubünden). Bei den[S. 203] Arabern: hindabâ (auch für Endivie benutzt). Die mittelalterlichen Namen solsequium, eliotropia (Heliotropium), mira (oder gira) solis, Sunniwerpila (Sonnenwirbel) umfassen auch die anderen Sonnenwendblumen (z. B. Calendula offic., Taraxacum, Valerianella usw.). Im Mittelalter auch: ambubeia (ambula bei PLINIUS), seris (die bittere, so schon bei DIOSKURIDES). — In Indien: kàsni (pers., ind. Baz. DYMOCK) — pers.: tarkashkun (so auch bei IBN SINA). In China: kʿu tʿu, kʿu tsʿai, kʿu ku, ku-mai-tsʿai (auch für Endivia).
Stammpflanze und Systemat. Stellung. Cichorium Intybus L. (richtiger Intubus). Compositae. Cichorieae — Cichorinae Sect. Eucichorium Dc.
Etym. Cichorium aus κιχωριον (so bei THEOPHRAST) umgebildet, dies aus κίω = gehe und χωρίον = Feld (nicht arabischen Ursprungs, aber vielleicht daraus das arabische chikouryeh gebildet, FORSKAL). Davon dann Cichorée, chicorée (franz.), chicory (engl.) und cichorei (holl.), und im Anklang an Zucker umgebildet: succory (engl.), suikerij (holl.), zuckerei (in Westfalen). Ferner: cichurien (in Mecklenburg), cikary (Eifel), — Intubus auch Intybus ja sogar incuba (ISIDOR, Etym.: Intubus Graecum nomen est, — Intubus auch bei APICIUS) wohl von ἔντομος = eingeschnitten, wegen der Blattform (KANNGIESSER). Daraus das arabische hendibeh. Endivia ist die ital. Form für intubus. Ambubeia (s. oben) ist syrisch und aus ambui (= Geruch) und baia (= voll) gebildet. Ambuleja und Ambugia findet sich bei römischen Schriftstellern (s. oben).
Beschreibung. Cichorium Intybus ist perennierend und über Europa und das gemäßigte Asien verbreitet. Es findet sich vorwiegend an Acker- und Wegrändern, Rainen und unbebauten Plätzen. Seine Blätter erinnern etwas an die von Taraxacum (s. d.), die unteren schrotsägeförmig, die oberen lanzettlich, sitzend. Die Infloreszenzachse trägt zahlreiche blaue Körbchen, der Hüllkelch ist zweireihig, die 5 inneren Blätter sind am Grunde verwachsen, Blüten zungenförmig, mehrreihig. Achaenen fast fünfkantig, kahl, mit 1–3reihigem Pappus.
Abbild. bei HOFFMANN in ENGLER-PRANTL, Natürl. Pflanzenfam. — PLANCHON-COLLIN a. a. O.
Pathologie. Es sind auf Cichorium Intybus eine ganze Anzahl von parasitären Krankheiten bekannt, unter denen wir Erysiphe Cichoracearum, Phoma albicans, Puccinia Cichorii (Dc.) Bell. erwähnen. Inwieweit aber durch dieselben auch die unterirdischen Teile mit betroffen werden, dürfte noch festzustellen bleiben. An Cichoriumwurzeln wurde Sclerotinia Libertiana beobachtet (ED. FISCHER).
Über die tierischen Schädlinge berichtet ISRAEL:
1. Käfer: Anaspis frontalis FABR. Larve in den Stengeln von Cichorium, Inula Conyza und Eupatorium. Jedenfalls in noch vielen anderen markigen Pflanzenstengeln. Käfer auf Blüten. Mordella aculeata L. Die afterstachelige Larve im Marke von Cichorium Intybus und Lychnisarten. Käfer auf Blüten. Cassida sanguinolenta FABR. Larve skelettierend an den Blättern von Cichorium Intybus und Sonchusarten. Wahrscheinlich auch noch auf anderen Pflanzen.
2. Falter: Cucullia umbratica L. Die schwarze, nächtliche Raupe dieses sehr häufigen Falters lebt auf vielen Pflanzen, u. a. auf Cichorium, Sonchus, Hypochaeris usw., vorzugsweise an den Blüten und Früchten. Cucullia lactucae W. V., Cucullia lucifuga W. V. Die Raupen dieser selteneren Falter leben an Lactuca- und Sonchusarten; auch an Daucus und Cichorium. An Cichorium leben ferner gelegentlich die behenden Raupen mehrerer Bärenspinner (Arctiidae) und eine ganze Anzahl polyphager Eulenraupen, besonders aus der Gattung Agrotis.
3. Schnabelkerfe: Aphis cichorii. DUTROCH. Diese schwarze Blattlaus lebt oft in enormer Menge an den weicheren Teilen der Cichorie, namentlich an den jüngsten Trieben saugend.
Beschreibung der Droge. Die Wegwartwurzel wird im Herbst von der wildwachsenden blühenden Pflanze gesammelt. Die einfache oder verästelte spindelförmige, etwa 1–1,5 cm dicke Wurzel wird, da Cichorium eine tiefwurzelige Pflanze ist, mehrere Dezimeter lang. Sie ist ein- oder mehrköpfig, frisch fleischig und milchend, trocken hornig, hellbraun, fast geruchlos, schwach bitter. Medizinisch angewendet wird meist[S. 204] nur die Wurzel der wildwachsenden Pflanze. Diese (Racine de chicorée sauvage) ist in Frankreich offizinell. Die Wurzel der kultivierten Pflanze wird beträchtlich dicker als die der wilden Pflanze und daher, um sie besser trocknen zu können, meist in 2 oder 4 Längsstreifen oder dicke Querscheiben zerschnitten.
Anatomie. Die Rinde macht etwa ⅙–⅓ des Gesamtdurchmessers aus. Sie ist radial gestreift (Unterschied von Taraxacum). Der Holzkörper ist gelb und deutlich strahlig. Der primäre Bau der Wurzel ist diarch. Die aus wenigen Zellreihen bestehende primäre Rinde bleibt erhalten (HOLFERT). Im oberen Teile ist der strahlige Bau des Holzkörpers auf dem Querschnitte sehr deutlich. Hier ist auch die Cambiumlinie ziemlich regelmäßig. Weiter unten ist der Holzkörper zwar auch noch deutlich strahlig, aber die Cambiumlinie verläuft hier oft unregelmäßig in einer Bogenlinie. Der Holzkörper ist markfrei. Er enthält sehr viel Holzparenchym und in dasselbe eingebettet im Innern unregelmäßig, weiter nach außen bis zum Cambium in unterbrochenen radialen Reihen angeordnet, zahlreiche getüpfelte Gefäße, die im Längsverlaufe meist gekrümmt, oft sogar geschlängelt und sehr deutlich gegliedert sind. Das Gewebe der breiten Markstrahlen unterscheidet sich im Querschnitt kaum von dem Holzparenchym. Bisweilen (nicht immer) finden sich im Holzkörper linksschief getüpfelte, relativ dünnwandige Ersatzfasern (MOELLER). In der sekundären Rinde liegen, zu radialen Strahlen angeordnet, Gruppen von gegliederten Milchröhren und Siebröhren. Die Milchröhren (Weite 6–10 mik) desselben Radialstrahles bilden infolge von Radialanastomosen ein reich verzweigtes Netz. Auch das Phloëmparenchym und das Parenchym der Rindenstrahlen ist mächtig entwickelt. Der äußere Teil der Rinde, der außerhalb der Sieb-Milchröhrenstrahlen liegt, ist sehr locker. Die Zellen sind hier tangential gestreckt und neigen zur Pektinisierung. Im obersten Teile der Wurzel ist diese ganze Schicht abgestorben und bedeckt als ein leicht abreibbarer Mantel die Wurzel. Zu äußerst liegt eine schmale, aus dünnwandigen Zellen bestehende Korkschicht. Alle parenchymatischen Zellen enthalten eine Inulinlösung, bei der Droge Inulinschollen. Die kräftige Hauptwurzel übernimmt die Befestigung. Die Nebenwurzeln sind ausschließlich Ernährungswurzeln (TSCHIRCH u. RADLAUER). Die Anatomie der Blätter bei PLANCHON-COLLIN.
Lit. MOELLER-WINTON, Mikroskopie der Nahrungs- u. Genußm. 1905 (Abbild.). — PLANCHON-COLLIN, Drogues simples 1896, Fig. 642 u. 643. — Vogl, Nahr.- u. Genußm. 1899, 334. — HOLFERT, Arch. Pharm. 1889. — ROSEN, Wandtafeln.
Chemie. Die Wurzel enthält Inulin, Zucker, Pektin und einen (nicht untersuchten) Bitterstoff, sowie angeblich Harz, Gerbstoff und ein flüchtiges Öl (VON BIBRA), keine Stärke. Der Inulingehalt beträgt in der Wurzel der wildwachsenden Pflanze bisweilen nur 11%, in der kultivierten 19% (VON BIBRA). RUNDQUIST (a. a. O.) gibt ihn auf 18,5% an. Durch die Kultur wird der Gehalt stark gesteigert. DRAGENDORFF fand (1870) in der Wurzel im Juni 4,82, Mitte Juli 36,53, Anfang August 44,01 und Anfang September 44,49% Inulin. Der Gehalt ist also ganz abhängig von der Vegetationsperiode. Der Inulingehalt der Wurzel kann 57,79% der Trockensubstanz erreichen (A. MAYER).
Die frische kultivierte Cichorienwurzel enthält 72,07–79,20% Wasser, 0,92–1,15% Stickstoffsubstanz, 0,11–0,60% Fett, 0,6–6,17% Zucker, im Mittel 15,30% stickstofffreie Extraktbestandteile, 0,65–1,11% Asche. In der Trockensubstanz im Mittel 84,37% stickstofffreie Extraktbestandteile (H. SCHULZE, VON BIBRA, HASALL, J. WOLFF). Getrocknete kultivierte Cichorienwurzel[S. 205] enthält 6,89–15% Wasser, 10,5–22,2% Zucker, 52,59% stickstofffreie Extraktbestandteile und 3–5% Asche (HASALL, KRAUCH).
BIBRA verglich die wilde mit der kultivierten Wurzel. Er fand in ersterer 37,81%, in letzterer 22,08% Zucker.
STORER fand bei der Hydrolyse auch Mannose, die Membranen enthalten also ein Mannan.
Die Asche beträgt 10,88% der bei 105° getrockneten Droge, bei 12,6% Wassergehalt (NYGÅRD).
In den Blüten (nicht in der Wurzel) fand NIETZKI ein schön krist. bitteres Glykosid, F. 215–220; C32H34O19.4½ H2O, auch das Aglukon desselben (C20H14O9) kristallisiert.
Lit. Ältere Analysen von JUCH und PLANCHE. — VON BIBRA (Analys. in WITTSTEIN, Handwörterb. d. Pharmakogn. 1882 mitgeteilt). — KÖNIG, Nahr.- u. Genußm. — A. MAYER, Jahresb. d. Agrik. Chem. 1883. — J. WOLFF, Bot. Centralbl. 1901, 85, 52. — Chem. Centrbl. 1899 und 1900. — DRAGENDORFF a. a. O. — NIETZKI, Über ein neues in den Blüten von Cichorium Intybus enthaltenes Glykosid. Arch. Pharm. (3) 8 (1876), 327. — STORER, Chem. Centralbl. 1902, 2, 1155.
Verwechslungen. Rad. taraxaci anatomisch gut zu unterscheiden. Rad. belladonnae und hyoscyami enthalten Stärke.
Anwendung. Im alten Ägypten (I, S. 464) kultivierte man Cichorium Intybus als Gemüse (PLINIUS). Sprosse und Blätter waren eine beliebte Magenspeise (PLINIUS). Sie dienen noch heute besonders in Frankreich zu diesem Zwecke. RHAZES hält die wilde Cichorie für heilkräftiger als die Garten-Cichorie. Die Araber benutzten den ausgepreßten Saft als allgemeines Antidot (IBN AMRÂN). In Indien, wo die Pflanze kultiviert wird, werden die Früchte arzneilich benutzt. Die Frucht war auch einer der «quatuor semina frigida minora». In einer österreich. Taxe 1776 findet sich Infusum «seu sanguis Cichorii simplex», gemeiner Cichoryaufguss oder Cichoryblut (PRUYS). Die Präparate der Wurzel sind besonders in Frankreich beliebt (s. HARTWICH-FISCHER, Pharm. Praxis). Die italienische Pharmakopoëe hat sowohl Wurzel, wie Blätter aufgenommen. Die frischen Blätter (folia cichorii, feuilles de chicorée, succory leaves) werden, wie die verwandte Endivie, als Salat (barbe de Capucins) und mit Kresse, Gartenlattich, Fumaria zu Kräutersäften (suc d’herbes) bei sog. Frühlingskuren benutzt. Die trockenen bilden einen Bestandteil des Sirop d’Erysimum comp., sowie des Sirop de rhubarb comp. (HARTWICH-FISCHER, Pharm. Praxis I, 828). Schon bei CORDUS steht ein Syr. è cichoreo und ein Syrupus de Cichoreo cum Rhabarbaro Nicolai Florentini.
Wegwart steht auch in der Liste der KNEIPP-Mittel als Diuretikum und Magenmittel — der Saft der Pflanze dient bei der «Blutreinigungskur». Äußerlich werden Kissen bei schmerzhaften Entzündungen empfohlen.
Geschichte. Der Wegwart oder die Wegwarte ist eine alte germanische Zauberpflanze. «Um die Wegwarte ranken sich noch heutzutage Vorstellungen, die jener uralten Lust, die Pflanze zu vermenschlichen, sie mit dem Menschen gleichzusetzen, entspringen» (AIGREMONT). So heißt es in VINTLERS Blumen der Tugend (1411): «Die begwart sey gewessenn aine frawe czart und wart jrs pullen noch mit schwerzen». Auch ihr Name «Verfluchte Jungfrau» deutet auf ähnliche Vorstellungen. Sie dient denn auch beim Liebeszauber. THEOPHRAST bespricht (Hist. plant. VII, 11) die Cichorien im allgemeinen (τὰ δὲ κιχοριώδη πάντα). HORAZ nennt sie als Nahrungsmittel: «me pascunt olivae me cicorea levesque malvae». PLINIUS bespricht beide Intubi, den wilden (Cichorium Intybus, in Ägypten, wo sie offenbar sehr geschätzt wurde (I, S. 464), Cichorium genannt) und den zahmen (C. Endivia, in Ägypten Seris[S. 206] genannt). Beide wurden kultiviert. PLINIUS erwähnt, wie DIOSKURIDES, bereits die Anwendung des Saftes bei Augenleiden, die wir auch noch in dem alten Verse: «Das edle Kraut Wegwarten macht guten Augenschein«(JACOB MEYLAND um 1600) und bei IBN BAITHAR, der die Pflanze hindabâ nennt und ihr ein großes Kapitel widmet, wiederfinden. DIOSKURIDES nennt die Pflanze seris (στενόφυλλος καὶ ἔμπικρος σέρις) und unterscheidet die wilde picris, auch Cichorie genannt, von der zahmen Gartencichorie, von der er zwei Arten kennt. Er weiß mancherlei über ihre Heilkraft zu berichten, besonders bei Magenleiden.
Lit. Pharmacographia indica. — PRUYS, Über d. therapeut. Wert von usw. Cichorium. Pharm. Zeit. 1896.
Cichorienkaffee. Cichorium Intybus wird in ziemlich beträchtlichem Umfange zur Herstellung des Cichorienkaffee kultiviert in Mitteldeutschland (Magdeburg, Braunschweig), dann bei Freiburg, Ludwigsburg und Heilbronn, in Belgien und Nordfrankreich sowie in Indien. C. 11000 Hektar werden jetzt jährlich mit Cichorie bebaut. 1909 bestanden c. 500 Cichorienfabriken. Davon c. 100 in Deutschland. Der jährliche Konsum Europas übersteigt 20 Mill. Pfund. Der Verbrauch an C. beträgt in Deutschland 1,85 kg pro Kopf und Jahr (Kaffee: 2,38 kg). Zur Bereitung des Cichorienkaffee werden die Wurzeln gewaschen und — oft unter Zusatz von Fett — in offenen oder geschlossenen Darren oder rotierenden Rösttrommeln gedörrt. Die ziemlich hygroskopische gebrannte Cichorie wird meist mit Wasser oder Sirup vermischt und in Formen gepreßt. Über die Bestandteile der ungerösteten Wurzel vgl. oben S. 204.
Der Gehalt an wasserlöslichen Bestandteilen schwankt bei der gerösteten Handelscichorie besonders infolge verschiedener Rösttemperatur (KORNAUTH) sehr, das Wasserextrakt von 60,2–85,5%, der Zuckergehalt von 8,2–23,3%. Als Mittel von zahlreichen Analysen gibt KÖNIG folgende Prozentzahlen für geröstete Cichorie an: Wasser 11,76, Stickstoffsubstanz 7,35, Ätherextrakt 2,48, Zucker 17,46, Karamel 12,74, Inulin 6,61, sonstige stickstoffreie Extraktstoffe 26,58, Rohfaser 10,03, Asche 4,99, Wasserextrakt 63,33.
Deutschland importierte 1909: 112788 dz Cichorienwurzeln, fast alles aus Belgien, etwas auch aus den Niederlanden, und exportierte 20605 dz, besonders nach Österreich-Ungarn. Gebrannte Cichorien importierte Deutschland 1909 22773 dz, besonders aus Frankreich. Deutschland produzierte 1907 für 5,75 Mill. M., Österreich 1906 für 3,73 Mill. Kr. (HUEPPE). Frankreich führte 1908 ungeröstete Cichorie 1453 Quintal. ein, besonders aus Belgien, wenig aus Italien und Algier; geröstete Cichorie 42721 Qintal., fast ganz aus Belgien.
Zur Unterscheidung von Cichorien- und Löwenzahnkaffee dienen die Gefäße, die bei Taraxacum bis 80 mik weit und mit schmalen, langgestreckten Tüpfeln versehen sind. Die Gefäße bei Cichorium sind bis 50 mik weit, die Tüpfel rundlicher (HARTWICH). Über weitere Cichoriensurrogate (besonders Rübenkaffee aus Rübenschnitzeln) vgl. MOELLER-WINTON, Mikroskopie, VOGL, Nahrungs- n. Genußmittel, FISCHER-HARTWICH, Pharm. Praxis.
Geröstete Cichorienwurzel wurde schon vor Bekanntwerden des Kaffees als Genußmittel benutzt (HARTWICH). ALPINI vergleicht den Kaffee direkt mit Cichoriendecoct. Doch scheint der Brauch keine weite Verbreitung gefunden zu haben. Im XIX. Jahrh. wurde geröstete Cichorie zuerst von TIMME in Arnstadt benutzt. Major VON HEINE und C. G. FÖRSTER führten 1763 den Cichorienkaffee ein und nahmen 1770 ein Privilegium für den Anbau und den Vertrieb der Wurzel in Preußen (MOELLER). Die ersten Kulturen befanden sich bei Berlin, Breslau und Magdeburg. 1790–1797 entstanden dort 14 Fabriken des «Preußischen Kaffee» (HARTWICH). Cichorie ist das älteste und noch jetzt verbreitetste Kaffeesurrogat. Als Kaffeesurrogat wurde die geröstete Wurzel seit 1690 in Holland benutzt, in Preußen bürgerte sie sich namentlich durch die Bemühungen FRIEDRICHS DES GROSSEN ein, der alle Kaffeesurrogate begünstigte (I, S. 1024), in Frankreich seit 1771 (DORVEAUX).
Lit. KÖNIG, Nahrungsm. — SCHULZE, Landw. Vers. Stat. 1866, 203. — VON BIBRA, Der Kaffee u. seine Surrogate. 1858. — HASALL, Foods, its adulteration and the methods for their detection. London 1876. — F. HUEPPE, Unters. über Zichorie 1908. — NICOLAI, Der Kaffee u. seine Ersatzmittel. 1901. — BOEHNKE-REICH, Der Kaffee u. seine Bezieh. z. Leben. 1885. — TRILLICH, Die Kaffeesurrogate. München 1889 u. 1892. — HARTWICH, Die menschl. Genußmittel. 1910. — WOLFF, Ann. chim. anal. 1899. — KRAUCH, Ber. d. d. chem. Ges. 1878, II, 277. — Zahlreiche Cichorienanalysen bei KÖNIG, 4. Aufl. I, 997. — VOGL a. a. O. — MOELLER a. a. O. usw.
[S. 207]
Rad. Taraxaci.
Syn. Löwenzahn-, Pfaffenröhrlein-Wurzel — racine de dent de lion, pissenlit (franz.) — dandelion root, blowball, cankerwort (engl.) — paárdebloemwortel (holl.) — gyermeklánczfű győker (ung.) — ῥίζα πικραφάκης (n.-griech.) — radice di tarassaco (ital.) — in Indien: dudhal, baran, kánphúl.
Einige der sehr zahlreichen deutschen Volksnamen s. unter Etymologie. — Mhd.: Pipawe, Säuschnabel, — mnd.: Pympanne, Soege- oder Sundistel. — Im Mittelalter: corona monachi, custos hortorum, dens leonis, rostrum porcinum, solsequium minus, aphaca.
Bei SIMON SETH: φάκη — bei MATTHIOLI auch: Dens caninus, ambugia, ambuleia (auch für Cichorium!), bei GESNER: Hieracium minus.
Stammpflanze und Systemat. Stellung. Taraxacum officinale WEBER (in WIGG. Prim. Fl. Hols. 56) [Taraxacum officinale (WITHERING) WIGGERS, Taraxacum Taraxacum (L.) KARSTENS, T. vulgare SCHRANK, T. Dens leonis DESF., Leontodon Taraxacum L., L. vulgare LAM., L. officinalis WITH., Hedypnois Taraxacum SCOP.].
Die Pflanze variiert: a) genuinum KOCH (Leontodon Taraxacum POLL.), b) Tarax. glaucescens M. B., c) T. corniculatum DC., d) T. alpinum HOPPE, e) T. taraxoides HOPPE, f) T. lividum W. K., (T. palustre SM.), g) T. leptocephalum RCHB.
Compositae, Cichorieae — Crepidinae.
Etym. Taraxacum ist wohl aus dem Arabischen: tarachakûn, tharachschakuk (so bei IBN BAITHAR) tarakshagan, tarascon (= eine Art wilder Cichorie), pers.: tarkhaskqun (so bei IBN SINA) umgebildet und dies aus dem Griechischen τάραξις (= eine Augenkrankheit) und ἀκέομαι (= heilen) entstanden, da alle sog. Cichorien, zu denen auch Taraxacum gerechnet wurde (in Graubünden und in Salzburg heißt noch heute Taraxacum: Cichorien, in Bern: wilde Wägluëge), Augenheilmittel waren (s. Cichorium). Bei BOCK heißt T. auch Augenwurzel. Andere leiten das Wort von ταράσσειν (= stören) ab und bringen es in Beziehung mit der abführenden Wirkung; noch andere von τράξυνον oder τρόξυνον (= Wilder Lattich). — Hedypnois von ἡδύς = süß und πνεῦμα = Atem. — Leontodon aus λέων (= Löwe) und ὀδούς (= Zahn) wegen der eigenartig gezähnten Blätter (daher auch der engl. Name hawkbit = Habichtsbiß). Wurde zunächst in dens leonis (so im Ortus sanitatis, in der Alphita und in den mittelenglischen Medizinbüchern, in der Alphita auch: doloroune) und dann in alle anderen Sprachen übersetzt: Lewenzahn, Löwenzehe (deutsch, so bei BOCK) — dent de lion, Liondent (franz.) — dandelion (engl., in MEDDYGON MYDDFAI [XIII. Jahrh. I, S. 683]: dent y llew). — Kettenblume (holl. Kettingbloem), weil die Kinder aus den ineinander gesteckten hohlen Stengeln Ketten bilden. — Pustblume, weil die Kinder sich durch Abblasen der reifen, mit Flugapparaten versehenen Früchte belustigen (KANNGIESSER). — Mönchshaupt, Pfaffen- oder Mönchsblatten (so bei FUCHS, im Gothaer Arzneibuch (I, S. 680): papenplatte; in den mittelenglischen Medizinbüchern: Capud monachi, franz.: Couronne de moine) wegen des Aussehens des kahlen, von den Fruchten befreiten Rezeptakulums. — Luchten, Lichter, Lampen wegen der Blütenstände. — Milchbluome, Milchdistel, Milchrödel wegen des Milchsaftes. — Wegen der diuretischen Wirkung: Seichblume, Pissblume (bei MATTHIOLI und ANGUILLARA: pisciainletto, franz.: pissenlit, holl.: pis in t’bed, pissebloem). Verächtlich wegen der großen Häufigkeit und Lästigkeit: Knotenblume, Säublume (in der Schweiz), Kuhblume, Schäfchenblume, Pferdeblume (paardenbloem), Hundeblume (holl. hondsbloem, franz. pissechien), Lusblom. — Butterblume, Ankeblume, Dotterblume (so bei BOCK) wegen der gelben Farbe. — An den hohlen Stengel erinnern Bezeichnungen wie: Röhrlinkraut (bei GESNER, Hort. germ.), Pfaffenröhrlein. — Erotische Beziehungen verraten: Pampelblume, Bumbaumel u. and.
Beschreibung der Pflanze. Die Pflanze ist über die ganze nördliche Halbkugel bis in die arktische Region verbreitet und in vielen Gegenden ein lästiges Unkraut der Äcker, Wiesen und Gärten. Sie findet sich ebenso in Europa wie in Nordafrika, in Vorderasien, Persien, Himalaya, Indien, China, wie auch, wohl dorthin[S. 208] verschleppt, in Nordamerika und geht nach Norden bis Grönland, Island und Novaja Semlja und weit hinauf auch ins Gebirge.
Taraxacum officinale.
bl basale Blattrosette, rh Rhizom, hw Hauptwurzel, w Nebenwurzeln.
[Aus Karsten-Oltmanns, Pharmakognosie.]
Der Habitus der perennierenden Pflanze wechselt etwas nach dem Standort. Die arktischen und Gebirgsformen (T. palustre DC. und T. nudum JORD.) sind z. B. kleiner. An trockenen Standorten bildet der Löwenzahn eine horizontal ausgebreitete Rosette tiefgesägter derber Blätter, an feuchten, zwischen hohem Gras, richten sich die dann nur schwach gezähnelten großen, zarten Blätter vertikal auf. Die lange, oft tief (5 dcm und mehr) in den Boden dringende, meist einfache Wurzel trägt ein kurzes, bisweilen mehrköpfiges Rhizom (Grundachse) (Fig. 75). Die lanzettlichen, kahlen oder wolligen Laubblätter bilden eine grundständige Rosette. Ihr Rand ist schrotsägeförmig («Löwenzahn»). Die Pflanze hat keine Winterruhe. Sie treibt auch über Winter Blätter. Daher fehlen die Knospenschuppen. Als Schutz der jungen Blätter mögen vielzellige Haare dienen, die in großen Mengen von deren Oberhaut gebildet werden (A. MEYER, KARSTEN-OLTMANNS). Die Vielköpfigkeit wird dadurch erzeugt, daß nach Absterben des Endsprosses in den Achseln der oberen Blätter seitliche Knospen sich entwickeln. Die Stengel sind kahl. Sie tragen keine Blätter, sondern an der Spitze nur ein Blütenkörbchen, dessen Hüllblätter lineal sind, die äußeren abwärts gebogen. Sämtliche Blüten des Körbchens sind hermaphrodite Zungenblüten, von goldgelber Farbe, mit einem Pappus (Kelch) am Grunde der Kronenröhre. Abends oder bei regnerischem Wetter schließen sich die Körbchen. Der zwischen Fruchtknoten und Pappus liegende Teil verlängert sich, wenn die Krone abgefallen ist, und so sitzt der sich horizontal ausbreitende Haarkranz schließlich mit langem Stiele, der dreimal so lang ist als die Frucht, dieser auf. Die Pappusteile der einzelnen Früchte orientieren sich zu einer Hohlkugel, so daß das reife[S. 209] Körbchen rund ist. Die lineal-keilförmigen, gerippten, hellbraunen Früchte lösen sich zur Reifezeit leicht vom kahlen, weißen Fruchtboden, der wie eine Glatze aussieht «Pfaffenplatte»), ab und werden, da der Pappus als Flugorgan dient, wie Luftschiffe, auf weite Strecken hin getragen, was wesentlich zur Verbreitung der Pflanze beiträgt. Bei Taraxacum findet sich Parthenogenesis.
Die frische Wurzel ist braungelb, fleischig und milcht stark beim Verletzen. Sie schrumpft beim Trocknen beträchtlich. Die trockene Wurzel milcht nicht. Die frische Wurzel bricht leicht, ist daher schwer auszugraben.
Der bald mehr süßliche, bald mehr bittere Geschmack tritt in sehr verschiedener Weise hervor je nach dem Entwicklungsstadium, der Einsammlungszeit und, wie FLÜCKIGER meint, auch der Bodenbeschaffenheit. Während die Wurzel (wie überhaupt die ganze Pflanze) im Frühjahr reich an Milchsaft ist, ist sie im Herbst reich an Inulin.
Das deutsche Arzneibuch schreibt die im Frühjahr vor der Blütezeit zu sammelnde Wurzel samt den Blättern vor (auch die Japanische Pharmakopoëe 1907 hat Rad. taraxaci cum herba), die österreichische Pharmakopoëe läßt die Blätter im Frühjahr, die Wurzel im Spätherbst sammeln, die schweizerische nur die Wurzeln, diese im Spätherbst.
Taraxacum wird in Indien in den Nordwest-Provinzen, besonders bei Saharanpur für die Government sanitary establishments angebaut. Wir benutzen nur die wildwachsende Pflanze, die in größeren Mengen z. B. in Thüringen gesammelt wird, aber auch in der Schweiz das gemeinste aller Unkräuter ist. Österreich exportiert Rad. taraxaci (MITLACHER).
Lit. Abbild.: BERG-SCHMIDT, Atlas t. 8 (dort die florist.-Literatur), PABST-KÖHLER, t. 5 und BENTLEY-TRIMEN, Medicinal plants t. 159. — GILG, Pharmakogn. 360. — KARSTEN-OLTMANNS, Pharmakognosie. — GIDEON WEIDEMANN, Beitr. z. Morphol. d. perennier. Gewächse. Diss. Marburg 1871. — SCHÜBELER, Pflanzenwelt Norwegens. 1875. — ALICE HENKEL, U. S. Dep. Agric. 1906, Nr. 89. — EBERLE, Proc. Am. ph. assoc. 1905. — HOLMES (Stammpflanze). Pharm. Journ. 1900, 65, 419. — Die Morphologie ausführlich in A. MEYER, Drogenkunde. — Einsammlung: ELBORNE AND WILSON, Pharm. Journ. (3) Nr. 773.
Pathologie. Auf den oberirdischen Teilen von Taraxacum officinale sind zahlreiche Parasiten bekannt, z. B. Olpidium simulans, Synchytrium Taraxaci, Sphaerotheca Humuli, Puccinia Taraxaci, P. variabilis, die Aecidienform von Puccinia sitvatica u. a., doch dürften dieselben kaum in wesentlicher Weise die unterirdischen Teile schädigen. Auf letzteren wird Torula rhizophila CORDA subsp. Taraxaci DESM. angegeben (ED. FISCHER).
Über die tierischen Schädlinge berichtet ISRAËL: Auf Löwenzahn lebt eine große Anzahl von Schmetterlingsraupen. Der Lepidopterologe benutzt daher Löwenzahn als eine Art Universalfutter. Fast alle polyphagen Raupen, namentlich eine große Anzahl von Eulenraupen, nehmen in der Gefangenschaft gerne Löwenzahn als Futter an. In der Natur findet man auf dieser Pflanze viele Raupen, die nur wohl gelegentlich die Blätter als Futter annehmen, aber auch gerade so gern alle möglichen anderen Pflanzen annehmen. Es seien nur einige erwähnt. Zygaena Filipendulae L. auch an Trifoliumarten usw. Bombyx trifolii W. V. Bombyx rubi L. Crateronyx dumi L. Crateronyx taraxaci W. V. Dasychira fascelina L., Spilosoma mendica Cl., Spilosoma luctifera W. V., Spilosoma fuliginosa L., auch an allen möglichen anderen Pflanzen. Mehrere Nemeophila- und Arctiaarten leben u. a. an Löwenzahn, Mania maura L. auch an Erlen, Weiden, Epheu, Berberitze usw. Hadena porphyrea ESP., Orthosia humilis W. V. Mamestra dentina W. V., M. albicolon HBN., M. leucophaea W. V., M. serena W. V. Mehrere Agrotis- und Poliaarten leben an Taraxacum, ferner einige Cucullia- und Orrhodia- und Hadenaarten usw. usw. Unter den Spannern sind es besonders Acidalia- und Cidariaarten, die die Blätter von Taraxacum fressen.
Die Droge unterliegt, wie die anderen Inulinwurzeln, sehr dem Wurmfraß (Anobium paniceum u. and.). In ihr findet sich bisweilen Tinea zeae, die indische Mehlmotte (JACKSON).
[S. 210]
Beschreibung der Droge. Taraxacum gehört zu den tiefwurzeligen Pflanzen (s. oben). Die Wurzel ist spindelförmig, graubraun, grob-längsrunzlig mit nur wenigen oder keinen Nebenwurzeln besetzt, einfach oder wenige Fasern bildend und oben einen rundlichen, querrunzlichen Wurzelkopf (Rhizom) tragend. Dieses Rhizom ist meist nur kurz (Fig. 76, rh). Doch findet man bisweilen, wenn die Pflanze z. B. beim Umackern des Bodens mit Erde bedeckt worden war, längere gestreckte. Ältere Achsenstücke sind bisweilen durch tiefgreifende Peridermbildung in mehr oder weniger zahlreiche netzförmig miteinander zusammenhänge Stränge gespalten (A. MEYER).
Nach dem Aufweichen quer durchschnitten zeigt die Wurzel eine breite Rinde, die mindestens den Durchmesser des Holzkörpers besitzt, in der man schon mit bloßem Auge, besser mit der Lupe, zahlreiche konzentrische Zonen bemerkt (Fig. 76,1), die durch Gruppen von Milchsaftschläuchen und Siebröhren gebildet werden. Der gelbe marklose, undeutlich strahlige Holzkörper ist entweder regelmäßig als solider Zentralzylinder entwickelt oder, und dies besonders gegen die Wurzelbasis hin und bei dickeren Wurzeln, unregelmäßig zerklüftet (Ph. helv. Ed. IV). Die beiden primären Markstrahlen sind bei dünnen Wurzeln deutlich. Das Lupenbild des Rhizomquerschnittes (Fig. 76,2) zeigt ein zentrales Mark, einen darumgelegten Kreis von Gefäßbündeln und in der breiten Rinde die gleichen konzentrischen Zonen wie die Wurzel. Da und dort sind Blattspurstränge sichtbar. Am Rhizom findet man die Ansätze der tiefst inserierten Blätter oder deren Narben. Da der Wurzel mechanische Elemente fehlen, bricht sie gerade-körnig.
Taraxacum officinale.
1. Lupenbild des Wurzel-Querschnittes. 2. Lupenbild des Rhizom-Querschnittes.
[Nach Tschirch-Oesterle, Atlas.]
Die Angabe SCHRENKS (Jahresb. Pharm. 1887, 67), daß die Taraxacumwurzel Mark enthalte, beruht auf einem Irrtum. Er hat wohl den Rhizomteil mit der Wurzel verwechselt.
Die oben noch die Blattrosette tragende Wurzel ist unter der Bezeichnung Rad. taraxaci cum herba im Handel.
Lit. BENTLEY, On the characters of Dandelion root and the means whereby it may be distinguished from other roots (einiger Kompositen). Pharm. Journ. XVI, 1856/57, 304 (mit Abbild.).
Verfälschungen. GILES fand (1851) in der Droge die Wurzeln von Apargia hispida. Als Verfälschungen werden auch genannt Rad. cichorei (RUSBY, s. oben S. 204) und die Wurzel von Rumex crispus. Die mikroskopische Untersuchung läßt diese Beimischungen leicht erkennen. Keine der genannten Wurzeln zeigt die konzentrische Zonung der Rinde. Die Rinde ist bei Cichorium radial gestreift.
[S. 211]
Lit. GILES, Root of rough hawkbit (Apargia hispida) substituted for Taraxacum. Pharm. Journ. XI, 1851/52, 107.
Taraxacum officinale.
Querschnitt durch die Wurzel am Cambium (c), sb Siebröhren, obl obliterierte Siebröhren, m Milchröhren, g Gefäße, hp Holzparenchym.
[Aus Tschirch, Angewandte Anatomie.]
Taraxacum officinale.
Milchröhrensystem der Wurzel.
[Nach Tschirch-Oesterle, Atlas.]
Anatomie. Der primäre Bau der Wurzel, der an zarten Nebenwurzeln der Droge vom Durchmesser 0,12–0,20 mm noch kenntlich ist, ist diarch (oder triarch). Die primäre Rinde ist nur 2–5 Zellreihen dick. Sie führt Milchröhren, ebenso wie die primären Siebteile. Frühzeitig geht der primäre Bau in den sekundären über. Schon 0,25 mm dicke Wurzeln zeigen sekundäre Gefäße, die weiter zu sein pflegen als die primären, und bei einer 0,5 mm dicken Wurzel ist der Cambiumring kreisförmig geschlossen. Die primäre Rinde bleibt oft lange erhalten. Meist wird sie erst, wenn die Wurzel mehrere Millimeter dick ist, abgeworfen. Die dicke Hauptwurzel, aus der die Droge vornehmlich besteht, ist außen von mehrreihigem Pericambialkork bedeckt. Die sekundäre Rinde besteht zur Hauptmasse aus vom Cambium her sehr regelmäßig in Radialreihen angeordnetem Phloëmparenchym, dessen dünnwandige Zellen in die Länge gestreckt, alle gleichlang und gleichhoch sind und daher auch auf dem Längsschnitt in regelmäßigen Radialreihen liegen. In der sekundären Rinde liegen, eingebettet in das Rindenparenchym, 10–30 konzentrische Kreise kleiner Gruppen, die aus Siebröhren und Milchröhren bestehen (Fig. 79). Die letzteren gehören zu den gegliederten Milchröhren, wie sie für die Cichoraceen charakteristisch sind. Sie bilden ein in tangentialer Richtung anastomosierendes Netz (Fig. 78), das, sobald eine Stelle desselben bei der frischen Wurzel durch das Messer verletzt wird, seinen ganzen Inhalt[S. 212] ausfließen läßt. Der dabei reichlich austretende weiße Milchsaft wird bald schwarzbraun. Bei der Droge ist der Inhalt, der sich mit Alkannin-Essigsäure färbt und neben Eiweiß auch den Bitterstoff (Taraxacin) und die Gutta (Taraxacerin) enthält, jedoch geronnen und selbst relativ resistent gegen Alkohol geworden. Die Milchröhren besitzen eine Weite von 12–22 mik. Nie anastomosieren die Milchröhren zweier Zonen, stets nur die derselben in tangentialer Richtung. Bei einer 4,5 mm dicken Wurzel zähle ich 9, bei einer 6 mm dicken 14 Kreise. Durch dieselben bekommt die Rinde ihr charakteristisch gezontes Aussehn. Die Siebröhren und die Milchröhren sind etwa gleich weit, beide etwas enger als das umgebende Phloëmparenchym. Die Milchröhren prävalieren bei weitem, so daß sie die eigentlich leitenden Organe der sekundären Rinde sind. Sie sind häufig mit Ausstülpungen versehen (Fig. 78), an denen sie oft durch Resorption der trennenden Wände miteinander verschmelzen. Ihren körnigen Inhalt kann man sich sehr schön sichtbar machen, indem man die frische Wurzel in Alkohol legt und die Längsschnitte mit Jod tingiert. Bei dieser Behandlungsweise erhält man auch das in der Wurzel in reichlicher Menge im Zellsaft gelöst enthaltene Inulin in prächtigen Sphaerokristallen (Fig. 74), Aggregaten zierlicher oft dentritisch verzweigter Nadeln und isolierten verzweigten Nadeln auskristallisiert, besonders schön in den großen Phloëmparenchymzellen. Rindenstrahlen sind in der Rinde nicht zu erkennen (Fig. 77).
In dem zentralen Holzkörper sind Markstrahlen nicht zu sehen. Die Bildung des sekundären Holzes erfolgt also regellos und nicht strahlig, oder doch wenigstens sehr undeutlich strahlig. Zwischen den dicht gedrängten leiterartig oder netzleistenförmig verdickten (Fig. 79), 10–45 mik. weiten, im Längsverlauf schwachgeschlängelten, im Querschnitt eckig konturierten Gefäßen liegen schmale Holzparenchymbänder. Im Zentrum des Ganzen sieht man bisweilen noch die englumigen primären Gefäße.
Taraxacum officinale.
Aus dem Längsschnitt durch die Wurzel. s Siebröhren, Mi Milchröhre, gf Gefäße, Er Ersatzfaser.
[Nach Tschirch-Oesterle, Atlas.]
Im äußeren Teile der sekundären Rinde sind die Milchröhren spärlicher, auch weniger regelmäßig angeordnet. Die Milchröhren werden von Siebröhren begleitet, deren Glieder etwa so lang sind wie Phloëmparenchym- und Cambiumzellen. Bei den Sieb-Milchröhren-Gruppen der Rinde bemerkt man Pektinisierung der Mittellamellen. Die Phloëmparenchymzellen zeigen bei Behandlung mit Chlorzinkjod oft eine feine Streifung, machen also den Eindruck von Ersatzfasern. Sie enthalten im Zellsaft gelöst das Inulin (s. oben S. 201), sehr selten Stärke.
Innerhalb des mehrreihigen Cambiums liegt der Holzkörper, der zu innerst noch wenige zarte primäre Gefäße erkennen läßt. Die sekundären liegen ziemlich unregelmäßig eingebettet in Holzparenchym und zarte Ersatzfasern (Fig. 79). Sekundäre Markstrahlen treten nicht deutlich hervor — nur bei jüngeren Wurzeln zwei breite primäre Fig. 76, 1). Die engsten Gefäße sind spiralig verdickt, die weiteren zeigen Leiter- und Netzleistenverdickungen.
[S. 213]
Die Nebenwurzeln zeigen deutliche Heterorhizie (TSCHIRCH): Ernährungswurzeln und Befestigungswurzeln. Letztere besitzen einen zentralen Libriformzylinder.
Das Rhizom besitzt die gleichen Elemente, jedoch ein mehr oder weniger großes Mark (Fig. 76, 2).
In der Stärkescheide der Blätter findet sich Stärke. Milchröhren treten auch in die Blattnerven höherer Ordnung ein. Die Blätter tragen 6–8zellige, dünnwandige, oft kollabierte Haare und an den Rippen der Blattunterseite mehrzellige Borstenhaare mit spornartig ausgebogenen Enden (ZÖRNIG).
Lit. HANSTEIN, Milchsaftgefäße 1864, Taf. IX. — DIPPEL, Entsteh. d. Milchsaftgefäße. Rotterdam 1865. Taf. V. — DE BARY, Anatomie S. 489, 519, 533 u. 540. — FLÜCKIGER-TSCHIRCH, Grundlagen. — ARTHUR MEYER, Wissensch. Drogenkunde (hier die Anatomie ausführlich). — VOGL, Interzellulars. u. Milchsaftgef. in der Wurzel d. gemeinen Löwenzahns. Sitzungsb. d. Wien. Akad. 48 (1863) u. Beitr. z. Kenntn. d. Milchsaftorg. d. Pfl. PRINGSHEIMS Jahrb. 5. und Nahrungs- und Genußm. — TSCHIRCH-OESTERLE, Atlas. — THOUVENIN, Contribut à l’étude anatom. des racines de la fam. des Composées. Thèse Nancy 1884 avec 6 tabl. — HOLFERT, Primäre Anlage d. Wurzeln. Arch. Ph. 1889, 481. — ZÖRNIG, Arzneidrogen 1909. — SCHRENK, Amer. Drugg. 1887. — DOHME, Drug. Circ. 1897, 178. — Pulver: KRAEMER, Proc. am. pharm. assoc. 1898, 305. — Anat. Abb.: PLANCHON-COLLIN, Les drogues simples II, Fig. 647, MOELLER-WINTON a. a. O. und TSCHIRCH, Angew. Anatomie, Fig. 601.
Chemie. Der Hauptbestandteil der Rad. taraxaci ist das Inulin, von dem RUNDQUIST (1904) bis 39,65% fand (die Angabe von SAYRE, der 79,02% (!) Inulin gefunden haben will, beruht wohl auf einem Fehler der Bestimmungsmethode). KOCH fand 15,6% in Handelsware, in selbst gegrabener 5,2%, neben c. 1% Saccharose, 0,46% Glukose, Harz und Schleim. Die Löwenzahnwurzel ist, wenn wir auf das Inulin abstellen, im Spätherbst zu sammeln, da sie zu dieser Zeit am reichsten an Inulin ist. Eine im Oktober gegrabene Rad. taraxaci enthielt 24,3%, eine im März gesammelte 1,7% Inulin (DRAGENDORFF).
An Stelle des Inulins tritt im Winter bisweilen Stärke (DIPPEL), im Frühjahr ein Zucker (bis 17%) und etwa ebensoviel Lävulin auf.
Junge Wurzeln des Löwenzahn enthalten bis zu 20% des nicht süßen, optisch inaktiven Lävulins (C6H10O5)n (Synanthrose oder Inulose, LEFRANC, POPP, DRAGENDORFF, vgl. S. 218).
Der Zucker scheint zur Zeit der kräftigsten Entwicklung der Pflanze in größter Menge gebildet zu werden und gegen den Herbst abzunehmen, im Winter aber wieder reichlicher aufzutreten, da die Wurzel nach den Winterfrösten wieder süßer schmeckt als im Herbst. Fetter Kulturboden begünstigt die Zuckerbildung (DRAGENDORFF).
Die Zellwand beträgt 23,1% des Gewichtes, davon sind Hemizellulosen 13,7% und Zellulose 9,4% (ALBERT KLEIBER). STORER fand bei der Hydrolyse Mannose. Die Membranen enthalten also ein Mannan.
Es unterliegt keinem Zweifel, daß die frische stark milchende Wurzel, besonders wenn sie noch die Blätter besitzt (s. oben), eine ganz andere Wirkung hat wie die getrocknete, die wir übrigens als Rad. taraxaconis erst in einer Taxe von Hamburg 1587 finden (I, S. 818) und die lange nicht so bitter ist, wie die frische. Der bittere Geschmack tritt vor und nach der Blütezeit am kräftigsten hervor, und besonders bei Pflanzen, die auf magerem Boden wachsen. Die Extrakte haben daher eine ganz verschiedene Zusammensetzung, je nachdem sie aus der frischen Wurzel (und dem Kraut) oder der trockenen Wurzel bereitet und ob sie im März, im Juli oder im Herbst dargestellt wurden (WIDNMANN, FRICKHINGER). Die Extraktausbeute wechselt[S. 214] ebenfalls sehr, je nach der Zeit der Einsammlung (Angaben bei PEREIRA). Der Extraktgehalt der Rad. taraxaci beträgt nach DIETERICH 19,9, nach LA WALL 35% (s. unten).
Der frische weiße Milchsaft, der zu einer braunen bröckeligen Masse (Leontodonium) gerinnt, ist eine Emulsion aus Eiweiß, Harz und einem guttaartigen (?) Körper, den man Taraxacerin (C8H10O? Kautschuk PFAFFS?) genannt hat (KROMAYER), und enthält auch den wasserlöslichen, kristallisierbaren (SQUIRE, STODDART) Bitterstoff, das Taraxacin (POLEX, KROMAYER), auf den wohl die Wirkung des Succus recens beruht. Taraxacin und Taraxacerin bedürfen jedoch erneuten Studiums. Stellen wir auf den Bitterstoff ab, so muß die Wurzel im Juli oder im März gesammelt werden. Das bittere Taraxacin, das SAYRE aus dem Chloroformauszuge in Kristallen erhielt (es kristallisiert aus Aceton), ist zu 0,05% in der Droge erhalten (die bei der Behandlung des amorphen Taraxacins mit H2O2 entstehende Taraxacinsäure ist Oxalsäure). Es wird von einem scharfen Stoffe begleitet. Auch das wachsartige Taraxacerin (C9H15O) erhielt SAYRE kristallinisch.
SAYRE glaubte (1898) auch 0,002% eines Alkaloides, Taraxin, gefunden zu haben. ZWALUWENBURG und GOMBERG konnten (wenigstens in im Oktober und November gesammelten Wurzeln) kein Alkaloid nachweisen, wohl aber einen nicht alkalisch reagierenden Körper mit Alkaloidreaktionen.
Ob das aus dem Extractum taraxaci bisweilen auskristallisierende Calciumlaktat in der Pflanze präformiert ist oder sich erst (aus Zucker, LUDWIG) nachträglich bildet, ist noch zu untersuchen. Der besonders in vergorenen, aber auch in frischen Auszügen der Wurzel auftretende Mannit [WIDNMANN (1832), FRICKHINGER (1840), T. u. H. SMITH (1849)] ist wohl ein erst bei der Verarbeitung auftretendes Produkt. HERMBSTÄDT glaubte Weinstein (?) gefunden zu haben.
Der in den Blättern, Blüten und Stengeln von MARMÉ gefundene Inosit fehlt der Wurzel (STILLÉ, MAISCH). Doch glaubte ihn MARMÉ auch dort gefunden zu haben.
Der Feuchtigkeitsgehalt beträgt 13,4% (NYGÅRD).
Die Asche der Wurzel beträgt 7,8% im Frühjahr, 5,5% im Herbst (FRICKHINGER). Die im April gegrabene Wurzel lieferte bei 100° getrocknet nach FLÜCKIGER 5,24%, NYGÅRD 4,85% Asche (Analyse der Asche bei SAYRE 1897). HAUKE fand 6,85–7,72%; obere Grenzzahl 8%. Die Pharm. austr. fordert für die Blätter höchstens 16%, für die Wurzel höchstens 8% Asche.
In den Blättern findet sich neben Inosit Schleim, Zucker, Harz (SPRENGEL).
Im Mai mit Blütenknospen gesammelte Blätter enthielten 2,81% Stickstoffsubstanz, 0,69% Fett, 7,45% stickstofffreie Extraktivstoffe (Zucker), 1,90% Asche (STORER und LEWIS).
SAYRE konnte (1894) keinen Unterschied im Gehalt der Droge an Taraxacin, Harz und reduzierendem Zucker finden, ob die Pflanze im Hochlande Amerikas oder in der Ebene gesammelt wurde. Die Septemberwurzel enthält das meiste Taraxacin, die Märzwurzel gibt das meiste Extrakt, die Augustwurzel enthält das meiste Inulin und die Oktoberwurzel das meiste Lävulin (SAYRE).
Der als Cichorienersatz verwendete Löwenzahnkaffee enthält 8,46% Wasser und in der Trockensubstanz: 65,74% wässriges Extrakt, 1,53% Zucker, 18,64% Rohfaser und in der Asche wasserlöslich 3,20%, unlöslich 4% (KORNAUTH).
Chemie. Ältere Analysen von DELIUS (De taraxaco. Erlangen 1754), JOHN (Chem. Unters. der Löwenzahnmilch. Chem. Schr. IV u. in GMELIN, Handb. d. Chem. II, 1827) und SQUIRE (BRANDE, Dict. of mat. med. 532). — PFAFF, Syst. d. Mat. med. VI. — PEREIRA, Elem. of mat. med. —[S. 215] POLEX, Arch. Pharm. 19, 1839, 50, Pharm. Journ. I, 425. — JÜRGENS, Diss. Dorpat. — DRAGENDORFF a. a. O. — WIDNMANN, Buchn. Repert. 43 (1832), 281. — FRICKHINGER, Vgl. Analys. der im Herbst u. Frühj. gesammelten Wurzeln. Rep. 23, 45. Pharm. Jahresb. 1840. — BUCHNER, ebenda 1841. — T. und H. SMITH (mit WILSON u. STENHOUSE), On the extraction of mannite from the root of Dandelion. Pharm. Journ. 8 (1848/49), 480. — SCHWEITZER, Chem. News II (Arch. Pharm. 1861, 380). — LUDWIG, Arch. d. Pharm. 107 (1861), 8. — MARMÉ, Lieb. Ann. 129 (1864). — SYMES, Pharm. Journ. (3) 10 (1869), 361. — ELBORNE, Succus Taraxaci. Pharm. Journ. 15 (1884/85) (dort die ältere Lit.). — KROMAYER, Arch. Pharm. 1861, 6 und die Bitterstoffe. 1862. — LA WALL (Extrakt), Amer. journ. pharm. 1896, 7. — SAYRE, Amer. Journ. pharm. 1894, 505, 1895, 465, 1896, 518, 1897, 494 und The important constituents of Taraxacum root. Amer. journ. ph. 1897, 543. — SAYRE, Alkaloid constituents of Taraxacum. Proc. Amer. pharm. Assoc. 1898, 341. — ZWALUWENBURG und GOMBERG, Amer. journ. pharm. 1899, 500 (Proc. am. ph. ass. 1899, 305). — STODDART, Pharm. Journ. 1870/71, 882.— STORER und LEWIS (1877) bei KÖNIG (dort auch weit. Lit). — NYGÅRD, Pharmac. Notisblad Helsingfors 1909. — RUNDQUIST, Farm. Notisbl. Helsingfors 1904. — KOCH, Amer. journ. ph. 1892, 65. — Pharm. Jahresb. 1892, 76. Bot. Jahresber. 1892 II, 408. — Asche: RÖDERS Handelsber. (Pharm. Post 1905). — KLEIBER, Vers. z. Best. d. Gehaltes einiger Pfl. u. Pflanzenth. an Zellwandbestandteilen, Hemicellulosen u. Cellulose. Diss. Zürich 1900. — STORER, Chem. Centralbl. 1902, 1155. — HAVENHILL, West. Drugg. 1905 (Literaturübersicht). — Vgl. auch FLÜCKIGER-HANBURY, Pharmacographia und FLÜCKIGER, Pharmakognosie.
Anwendung. Der harntreibenden Wirkung wegen (s. oben) nennt schon LOBELIUS das Kraut Herba urinaria, andere seris (s. oben S. 203) urinaria. Der Saft der frischen, im Frühjahr gegrabenen ganzen Pflanze ist noch jetzt bei den sog. «blutreinigenden» Frühlingskuren in Gebrauch, galt von jeher auch in Indien schon als ein Heilmittel bei Leberleiden, und wird auch neuerdings wieder dafür warm empfohlen (FYFE 1906). Die Wirkung beruht wohl auf dem Taraxacin.
Taraxacum steht auch in der Liste der KNEIPPschen Mittel als Mittel gegen Hämorrhoiden, Leberleiden usw. — Der Saft der frischen Pflanze auch gegen Gelbsucht.
In Formosa ist Taraxacum ein Antidot bei Schlangenbissen (JACKSON). Auf Island werden die frischen Wurzeln gebraten gegessen (SCHÜBELER). In England dienen die jungen Blätter als Gemüse. Die geröstete Wurzel ist ein Kaffeesurrogat. Hierbei kommt in erster Linie das Inulin in Betracht (s. oben). Dandelion Cocoa ist ein Gemisch von Extr. taraxaci und löslichem Cacao (STODDART).
Geschichte. Die Griechen und Römer beachteten die Pflanze wenig. Sie ist vielleicht das πέρδιον (Perdikion) des THEOPHRAST (PARKINSON, Theatr. Botan.). Die ἀφάκη des THEOPHRAST, DIOSKURIDES und PLINIUS kann nicht Taraxacum gewesen sein, obwohl ja der Name aphaka der Pflanze im Mittelalter anhaftete und die Pflanze jetzt in Griechenland πικραφάκη heißt (s. oben S. 207). Die Deutung von aphake als Vicia cracca oder Lathyrus aphaca erscheint mir wahrscheinlicher, denn es steht zwischen lens und pisum. Eher deutet die Beschreibung von Hedypnoïs als einer Art Cichorie, die sich bei PLINIUS findet, auf Taraxacum und dieser Name findet sich auch unter den Synonymen der Pflanze bei FUCHS (t. 680) und GESNER. Die Araber (RHAZES, AVICENNA) benutzten die Pflanze unter den oben (S. 207) angeführten Namen, aus denen dann Taraxacum wurde, welcher Name aber erst wieder bei LOBELIUS und LONICERUS auftaucht (FLÜCKIGER). HALLER benutzte ihn als Genus. Bei IBN BAITHAR heißt die Pflanze, die als wilde Cichorie bezeichnet wird, Tharachschakuk oder Marurijat. SIMON SETH (XI. Jahrh.) verbreitet sich eingehend über ihre Heilkraft. Im Pen tsʿao kang mu (I, S. 519) steht Taraxacum unter den sanften, schleimigen Pflanzen. FUCHS bildete die Pflanze ab, ebenso BOCK. LINNÉ wählte (1762) den Namen Leontodon Taraxacum. Der Löwenzahn war der Liebesgöttin FREYA geweiht. Sie wird noch heute (z. B. im Aargau) von den Mädchen zum Liebesorakel und Schönheitsmittel benutzt. In der Schweiz ist sie Kiltblume. In der Hamburger Apothekerordnung 1587 (I, S. 818) steht: Rad. taraxaconis.
Paralleldrogen. Als «Substitutes for Taraxacum» führt die Pharmacographia indica auf: Lannaea pinnatifida CASS., Lactuca Heyneana DC., Emilia sonchifolia DC.,[S. 216] Sonchus oleraceus LINN., Echinops echinatus DC., Dicoma tomentosa CASS., Notonia grandiflora DC., Tagetes erecta LINN., Anaphalis neelgerriana DC., Carduus nutans L. und Calendula officinalis L. Nach DYMOCK in Indien auch: Brachyramphus sonchifolius DC. und Microrhynchus sarmentosus DC. Nach DRAGENDORFF in China: Taraxacum sinense DC. und T. laevigatum DC.
Rad. Bardanae.
Klettenwurzel — glouteron, bardane (franz.) — bur, burdock (engl.) — klis (holl.) — gobo, kitakisu, uma fuki (jap.) — seta koroki (aino) — ta-li-tzu, nin fang (chin.).
Syn. Nach SPRENGEL (Hist. rei herb.) die ἀπαιρίνη des THEOPHRAST (Hist. plant. VII, 14) und das ἄρκτειον des DIOSKURIDES. Das ἄρκτιον im Cod. Constant. ist jedenfalls ein Arctium (kein Verbascum!) Althd.: bletacha, chledda, cliba, kletta, kliba, letiche lettecha, pletecha — mhd.: burres, chledden, clesse, crasse, klaten, klett, klobe, breit ledecha, sumerlatich — mnd.: klive, krotenbleder. Die vielen alten deutschen Namen zeigen, daß die Pflanze diesseits der Alpen viel beachtet wurde. Im Mittelalter auch: Lappa (z. B. bei ISIDOR), Lapathum, Personata. In der Alphita (I, S. 642) steht: Bardana, Lappa maior, Lappa inversa, clote, burr, gert. Es wird Lappa major (bardona) von Lappa incisa (agrimonia) und Lappa caprina unterschieden. Bei HILDEGARD heißt die Lappa auch cletta. Lappa findet sich bei ALBERTUS MAGNUS (I, S. 673). Bardana steht bei CORDUS (I, S. 797), Bardane und Klyve im Gothaer Arzneibuch (I, S. 679).
Stammpflanze und Systemat. Stellung. Arctium L. (Lappa JUSS.) Die Gattung Arctium hat vier Arten, die aber auch nur als Abarten einer Grundform (Arctium Lappa L.?) betrachtet werden (SCHINZ und KELLER halten die Arten aufrecht):
Arctium tomentosum (LAM.) SCHRANK (A. Bardana W., Lappa tomentosa LAM.), Köpfe doldentraubig, dicht spinnewebig, filzig, innere Hüllblätter mit gerader Stachelspitze, fast strahlend.
Arctium Lappa L. (ex parte. A. majus SCHRANK, Lappa officinalis ALL., L. major GÄRTN.). Sehr groß, bis 3 m, Köpfe doldentraubig, Hüllblätter grün, kahl, Körbe wallnußgroß.
Arctium minus SCHRANK (Lappa glabra Lam., L. minor DC.). Köpfe traubig, Hüllblätter an der Spitze rötlich, etwas spinnewebig.
Arctium nemorosum LEJEUNE (Lappa macrosperma WALLR., L. nemorosa KÖRN.) mit rutenförmig übergebogenen Zweigen.
Alle liefern Rad. bardanae. Die letztgenannte Art in Mitteleuropa, die drei anderen in Europa und Asien weit verbreitet, z. B. in Japan, namentlich auf Schutt und in Dorfstraßen, an Wegen und Hecken häufig, in Nordamerika eingeschleppt. (Abbild. bei HOFFMANN in ENGLER-PRANTL, Pflanzenfamilien IV, 5, 319.)
Compositae, Cynareae-Carduinae.
Etym. Lappa (Lapathum) von λαβεῖν (= ergreifen, vielleicht in Beziehung zum keltischen lapp, llap = Hand) wegen der an den Kleidern festhaftenden Früchte, welche Eigenschaft ihr bei den Griechen den Namen φιλάνθρωπος (quod vestibus hominum inhaeret ob asperitatem sagt ISIDOR) und im Deutschen die Bezeichnung Klette eintrug und wohl auch mit dem französischen Namen grateron (von gratter = kratzen) und mit der englischen Bezeichnung bur (ags. burr, dän. borre) zusammenhängt, das mit borre (ital.) und borste in Beziehung gebracht wird. Unwahrscheinlicher erscheinen mir die Ableitungen von λάπη (= Schleim), obwohl in dem französ. Namen glouteron (glutinosus = klebrig) ähnliches anklingt. — An die breiten Blätter erinnert: Oreille de géant (= Riesenohr), sowie viele Volksnamen (s. bei PRITZEL-JESSEN) und auch im engl. burdock — aus dem wohl das spätlatein. bardane entstand (?) — steckt etwas ähnliches: dock, angs. docce ist der Name vieler breitblättrigen Stauden (KANNGIESSER). Die Ableitung von Bardana von barda (ital. = Pferdedecke) oder gar von den Barden (WITTSTEIN) erscheint mir abenteuerlich. — Arctium, ἄρκτιον wohl von ἀρκτός (= Bär) wegen der wolligen Beschaffenheit. Die japan. Bezeichnungen seta (= Hund) und uma (= Pferd) bei Pflanzennamen, wie unser Hundszunge, Roßkastanie usw., halb verächtlich (wegen der großen Häufigkeit). — Vielleicht war das kekel (?) der alten Juden (I, S. 489) Klettenwurzel.
Kultur. Die Pflanze wird in Japan in umfangreichstem Maße kultiviert und die Wurzel als Gemüse von allen Bevölkerungskreisen gegessen. Japan erzeugte 1888: 72 Mill. pounds (NITOBE).
Beschreibung. Die Kletten sind zweijährige Kräuter mit langer spindelförmiger Wurzel[S. 217] und bis über meterhohen aufrechten ästigen, mehr oder weniger wollig-behaarten Stengeln. Die großen dicken, am Rande buchtig-gezähnten Blätter sind unterseits mehr oder weniger weißlich-filzig. Die kugeligen Blütenkörbe besitzen hakenartig gebogene Deckblätter. Die Einschließung der Blüten in den Hüllkelch war schon den Alten aufgefallen. Bei PLINIUS steht «Notabile et in Lappa quae adhaerescit, quoniam in ipsa flos nascitur, non evidens, sed intus occultus et intra seminat, velut animalia, quae in se pariunt» (!). Die Wurzel wird im Herbste des ersten oder im Frühjahr des zweiten Jahres gesammelt. Sie ist fingerdick, dunkelgraubraun, innen grauweißlich, oft mit schwammig-fädigem Kern und riecht frisch widerlich narkotisch wie Mohnköpfe (WITTSTEIN). Trocken ist sie fast geruchlos und schmeckt fade, schleimig-süßlich. Oben trägt sie oft einen weißlichen Schopf. Die deutlich strahlig gebaute Wurzel besitzt im Holzkörper schmale Gefäßstrahlen, Markstrahlen und viel Holzparenchym. In älteren Wurzeln findet sich Libriform (ZÖRNIG). Die Gefäßstrahlen setzen sich nach außen in keilförmige Sieb-Milchröhrenstrahlen fort. Die Endodermis bleibt erhalten. Im Zentrum findet sich ein weißes, schwammiges, aus abgestorbenem Zellgewebe entstandenes, sehr zerrissenes, markartiges Gewebe, sog. «falsches Mark» (BERG). Im zweiten Jahre wird das Gewebe der Markstrahlen mehr oder weniger zerstört, so daß zuletzt nur noch schwammige Rindenreste und die von den Holzparenchymresten bekleideten Xylemplatten übrig bleiben (LÜRSSEN). Sie enthält reichlich Inulin (bis 57% KELLNER, 70% WECKLER), 6,32% Zucker (NYGÅRD), 0,065% flüchtiges Öl. Eine allgemeine Analyse teilte WECKLER mit. Er fand 5% Glukose, 0,4% Fett, Schleim, einen Bitterstoff, Harz und Gerbstoff. Die frischen Wurzeln enthalten 73,8% Wasser, 5,6% Stickstoff, 10,5% Asche (NITOBE). In den Früchten fand TRIMBLE ein bitteres Glykosid, Lappine.
Pathologie. Über die tierischen Schädlinge der Pflanze berichtet ISRAËL: Agrotis stigmatica HÜBN.: Raupe an Lappa-, Lactuca-, Plantago-, Primula-, Geumarten und anderen niederen Pflanzen. Plusia gamma L.: Die Raupe dieser gemeinsten aller Eulen ist polyphag. Auf Lappaarten tritt sie häufig auf. Mitunter auf Kleefeldern und Rübenäckern verheerend. Plusia jota L.: Raupe auch an Anthemis, Lonicera, Vaccinium, Lamium usw. Plusia chrysitis L.: Außer an Lappaarten auch an den verschiedensten anderen Pflanzen, Dipsacus pilosus, Urtica, Stachys usw. Polia flavicincta W. V.: Raupe an Lappa, Artemisia, Rumexarten usw. Polia polymita L.: Raupe meist vereinzelt an Primula, Lappa und anderen niederen Pflanzen. Polia Chi. L.: Raupe an vielen Krautgewächsen, als Lappa, Aquilegia, Galium, Sonchus, Lactuca usw. Gortyna flavago W. V., Ochracea HB.: Die Raupe dieses schönen Falters lebt in den Stengeln (einzeln, selten zu mehreren in einer Pflanze) vieler markhaltiger Pflanzen. Sie bevorzugt in den verschiedenen Gegenden auch verschiedene Pflanzen. In Thüringen lebt sie hauptsächlich in Lappaarten, sonst auch in Sambucus, Verbascum, Valeriana, Scrophularia, Petasites, Cirsium, Carduus usw. Conchylis badiana L.: In Stengel und Wurzel von Lappaarten usw. Conchylis posterana HFFG.: Raupe in den Blütenköpfen von Lappa- und Cirsiumarten, auch in anderen Kompositen, die Samen ausfressend. Depressariaarten: Verschiedene Depressariaarten leben in den Blütenköpfen und Stengeln von Lappaarten und anderen Kompositen. Parasia Capella L.: Die Räupchen dieser Motte leben in dem Blütenboden von Lappaarten und anderen Kompositen, die Samen fressend.
In der trocknen Radix bardanae leben sehr gerne die Larven von Anobium paniceum und striatum, ferner diejenigen von Ptinus fur und Ptinus latro. Durch den Wurmfraß zerfällt die Wurzel alsbald zu Pulver. Es empfiehlt sich, die durch den Großhandel bezogene Ware, welche sehr häufig schon mit Käferbrut infiziert ist, erst in einem Holz- oder Blechkasten neben verdunstendem Chloroform einige Zeit liegen zu lassen, und sodann die absolut trockene Wurzel in gut schließenden Blech- oder Glasgefäßen aufzubewahren. Diese Vorsichtsmaßregel sei auch namentlich bei allen Umbelliferenwurzeln empfohlen und bei sonstigen Drogen, die ätherische oder riechende Stoffe enthalten (ISRAËL).
Anwendung. Die Klettenwurzel ist aus unbekannten Gründen ein altes Haarwuchsmittel. Das «Klettenwurzelöl» verlangt noch heute das Volk und im Bernischen heißt die Pflanze Haarballe oder Haarwachswürze. Sollte es sich hier nicht um eine Signatura handeln und die starke Behaarung der Pflanze sie zu einem Haarwuchsmittel gemacht haben? Medizinisch wird sie besonders in Nordamerika als Diureticum, Laxans und Sudorificum benutzt. Rad. Bardanae ist auch ein Bestandteil des Spec. lignorum, des sog. Blutreinigungstees. Die Samen waren als Diuretikum und (nach LINNÉ, Mat. med.) als Purgans ehedem geschätzt. Auch die Blätter wurden früher benutzt. Die Klette steht auch in der Liste der KNEIPPschen Mittel und spielen hier[S. 218] sowohl die Blätter wie die Wurzel eine Rolle. Die «haarwuchsfördernde Kraft» der Wurzelabkochung wird auch von KNEIPP behauptet.
Als Verwechslungen werden Rad. belladonnae (stärkehaltig) und die Wurzel von Symphytum officinale L. angegeben.
Lit. BERG, Pharmakognosie. — LUERSSEN, Med. pharm. Botan. — WITTSTEIN, Handwörterb. d. Pharmakognosie, S. 408. — INAZO NITOBE, Burdock as a vegetable. Am. journ. pharm. 1897, 416 (dort auch eine Aschenanalyse). — Abbild. in BERG-SCHMIDT, Atlas, 1. Aufl. t. XIX. und HAYNE, Arzneigew. II, t. 35 u. 36. — Anatom. Abbild. in OUDEMANS Atlas, BERG, Anatom. Atlas t. XIII., PLANCHON-COLLIN, Drog. simpl. II, Fig. 654 u. 655, VOGL, Anatom. Atlas, und HÉRAIL et BONNET, Manipulations pl. V. — TSCHIRCH, Anatomie, S. 117. — Anatomie in ZÖRNIG, Arzneidrogen. — WECKLER, Analysis of burdock root. Am. journ. pharm. 1887, 393. — KELLNER, Landw. Versuchsstat. 30 (1881), 42. — NYGÅRD, Farm. Notisbl. 1909. — TRIMBLE and MACFARLAND, Examinat. of burdock fruit. Am. journ. pharm. 1885, 127. — TRIMBLE, The bitter principle of burdock fruit. Am. journ. pharm. 1888, 79. — Anatomie der Frucht von Arctium Lappa bei GERDTS, Bau u. Entw. d. Kompositenfr. Diss. Bern 1905 u. F. EBERT, Beitr. z. Kenntn. d. chines. Arzneisch. Diss. Zürich 1907.
V. Lävulindrogen.
Die Lävuline oder Synanthrosen verhalten sich zum Inulin wie die Dextrine zur Stärke. Es sind wohl niedrigere Glieder von demselben Kondensationstypus.
Lävuline finden sich oft in beträchtlicher Menge in Rad. taraxaci (s. oben).
VI. Triticindrogen.
Das Triticin (H. MÜLLER) wird, da es bei der Hydrolyse mit verdünnten Säuren und der Einwirkung von Diastase (nicht von Invertin) Fruktose liefert, ebenfalls zu den Polysacchariden gerechnet. Es spaltet Fruktose schon beim Kochen mit Wasser ab. Man gibt ihm die Formel C36H60O30 = 6(C6H10O5). Es wurde außer in Triticum repens auch in der Wurzel von Dracaena australis gefunden. Es dreht links, ist nicht gärungsfähig und reduziert FEHLINGsche Lösung kaum. Es trägt gleichfalls den Charakter eines Reservekohlenhydrates. Es ist vielleicht mit dem Irisin (WALLACH), Phleïn und Graminin (EKSTRAND und JOHANSON) identisch (TOLLENS, KELLER). Doch formulieren EKSTRAND und MAUZELIUS: Triticin = C36H60O30, Graminin = C48H80O40, Phleïn = C90H150O75, Irisin = C96H166O80 Alle liefern bei der Hydrolyse Fruktose.
Rhiz. Graminis.
Syn. Stolones graminis, Rad. agropyri, Rad. Cynagrostis, Rad. graminis albi, s. arvensis, s. canini, s. officinarum, s. repentis, s. vulgaris, Queckenwurzel, Graswurzel, Ackergras-, Ackermauer-, Laufquecken-, Päden-, Saatgras-, Bayer-, Feg-, Hundsgras-Wurzel — petit chiendent (dent de chien), chiendent commun gramont, chiendent rampant ou officinal (chiendent wohl ursprünglich = Cynodon Dactylon) (franz.) — couch grass, quitch grass, qu. root, dog grass, kwich (engl.) — kweekgras, graswortel (holl.) — gramegna (ital.) — gramenha, grama (span.) — ῥιζωμα ἀγρώστεως (griech.).
Ahd. Quecca, mhd. graesch, graische, grasse, mittelalt.: herba graminis intuba. Volksnamen: Alescher- oder Apothekergras, Bättigras, Bochwurze, Fegwurz, Geech (Bern), Grammen (Wallis), Hundsgras, Knöpfligras, Knotengras, Kriechweizen, Laufquecken, Pärde (Niederlaus.), Quetsch, Rechgras, Sandklever, Suckerwuttel, Schnürligras, Spulwurz, Weißwurz, Wurmgras, Wullband, Zwecken. — Bei HILDEGARD: dorth (Lolium temulentum?); im Niederl. Herbar: gers; bei CORDUS: graß, quecken. — Bei TABERNAEMONTANUS steht: gramen caninum arvense seu gramen Dioscor. C. B. Gramen, Ruël. Dodo. gal. Cord. in Dios. Cast. canarium medicatum, Ad. Lob. caninum quod graecis ἄγρωστις, Dod. caninum vulgare, Lugdun. Graminis primi[S. 219] Dioscor. species major, Thalio. — Einige Autoren nehmen an, daß Agropyrum repens das ἄγρωστις der Griechen ἄγρωστις παρὰ τόν ἀγρὸν) und das gramen sowie die radix canaria der Römer sei (vgl. dazu unter Geschichte) und wohl auch des STEPH. MAGNETES radix agriae, des IBN BAITHAR: qutsami, des ABU MANSUR: tsîl, thîl. — Synonyme des Agrostis bei DIOSKURIDES (in [], also spätere Einschiebsel): Aigikon (= Ziegenpflanze), Hamaxitis, bei den Ägyptern: Anuphi, Asifolium, Sanguinalis, Viola, bei den Spaniern: Aparia, bei den Dakiern: Kotiata, bei den Afrikanern Jebal. — Bei IBN BAITHAR steht auch elnadschm oder elnadschir. — Im Chinesischen heißt die Graswurzel: Siau hwanchai oder meh-huh (DRAGENDORFF).
Etym. Triticum s. S. 184. — Repens wegen des langhinkriechenden Rhizoms — danach sind auch Namen wie Schnürligras, Sehnengras, Spulwurz gebildet, sowie Päde (von pede = hinkriechend, verwandt mit Pfad; petten = treten), Pädergras, Pedengras, Pehdenzel, Peyer. — Quecke von quecka, quick = lebendig, beweglich, deutet auf die Beweglichkeit im Wachstum des Rhizoms, wie die verwandten: Quäk, Quecken, Queke, Quetsch, Quitsch, Kweekgras. — An die knotige Gliederung des Stengels erinnern Namen wie Knöpfligras, Knopgras. — Chiendent = Hundszahn, weil die kranken Hunde es fressen sollen (LITTRÉ), vielleicht aber nur verächtlich, wie doggrass (KANNGIESSER). — Agropyrum von ἀγρός = Acker und πυρός = Weizen.
Stammpflanze. Agropyrum repens PALISOT DE BEAUVOIS (Argrst. 102) (Triticum repens L., Bromus glaber SCOP., Elymus dumetorum HOFFM.). Variiert: α vulgare DÖLL., β aristatum DÖLL. (davon auch als Arten: var. dumetorum SCHREB., var. vaillantianum WULFEN, var. sepium THUILL.), γ majus DÖLL., δ glaucum DÖLL., ε caesium PR. (auch als Art). Beschreibung in LUERSSEN, Mediz. pharm. Botan. II.
Systemat. Stellung. Gramineae, Hordeae.
Verbreitung. Die Quecke ist über Europa, Nordafrika, Asien (Sibirien, Afghanistan, am Demavend bis 3000 m) und Nordamerika bis Patagonien und Feuerland verbreitet. Sie ist ein auf Äckern und an Wegen, besonders auf Sandboden (Norddeutschland) und auf Kulturland weit verbreitetes, wegen der Verfilzung des Bodens durch die zahlreichen Wurzeln (Fig. 80) sehr lästiges Unkraut.
Agropyrum repens. Rhizom (Wandersproß), K Knoten, JN Internodien, Nb Niederblätter, W Wurzeln.
[Tschirch gez.]
Beschreibung der Stammpflanze. Die Quecke bildet auf weite Strecken oft mehrere Meter durch den Boden kriechende Grundachsen (Rhizome) von Charakter der Wandersprosse, die an der Spitze eine derbe, spitze Niederblattknospe (Fig. 80) bilden, mit der sich der Sproß selbst durch festere Bodenschichten, ja sogar durch Baumwurzeln bohren kann. Aus der Achsel der an den Knoten sitzenden Niederblätter der Wandersprosse entwickeln sich da und dort oberirdische Achsen. Der runde Halm ist entfernt knotig gegliedert und kahl. Er kann eine Höhe von über 1 m[S. 220] erreichen, bleibt jedoch meist weit dahinter zurück. Die linealen an den Knoten inserierten, oberseits rauhen Blätter besitzen eine bis 10 cm lange Scheide und sehr kleine Blatthäutchen. Die endständige Blütenähre ist 10–13 cm lang, die Spindel zusammengedrückt und abwechselnd rechts und links ausgehöhlt, zickzackförmig hin- und hergebogen. Die Ährchen sind meist fünfblütig, die zwei Hüllspelzen (glumae) sind kürzer als das Ährchen, kahnförmig, lanzettlich, zugespitzt, am Rande fein gewimpert, die Deckspelze (palea inferior) zugespitzt oder begrannt, fünfnervig, die Vorspelze (pal. superior) dünnhäutig, zweikielig, an den Kielen bewimpert, kurz zweizähnig, die Schwellkörper (lodiculae) kaum 2 mm lang, der eiförmige Fruchtknoten am Scheitel behaart, die Frucht 6–7 mm lang.
Lit. Abbild. BERG-SCHMIDT, Atlas II. Aufl., t. 139 (dort die florist. Lit.). — PABST-KÖHLER, Medizinalpflanzen, t. 86. — NEES VON ESENBECK, pl. med. t. 32. — HACKEL in ENGLER-PRANTL, Pflanzenfamilien. — IRMISCH, Bot. Zeit. 1859, 56.
Beschreibung der Droge. Das Rhizom wird gelegentlich der Frühjahrsbestellung davon befallener Felder ausgepflügt und herausgeeggt, von der Erde gereinigt, von den Wurzeln und Stengeln befreit und dann geschnitten. 100 Teile frisches Rhizom geben 40 Teile Droge.
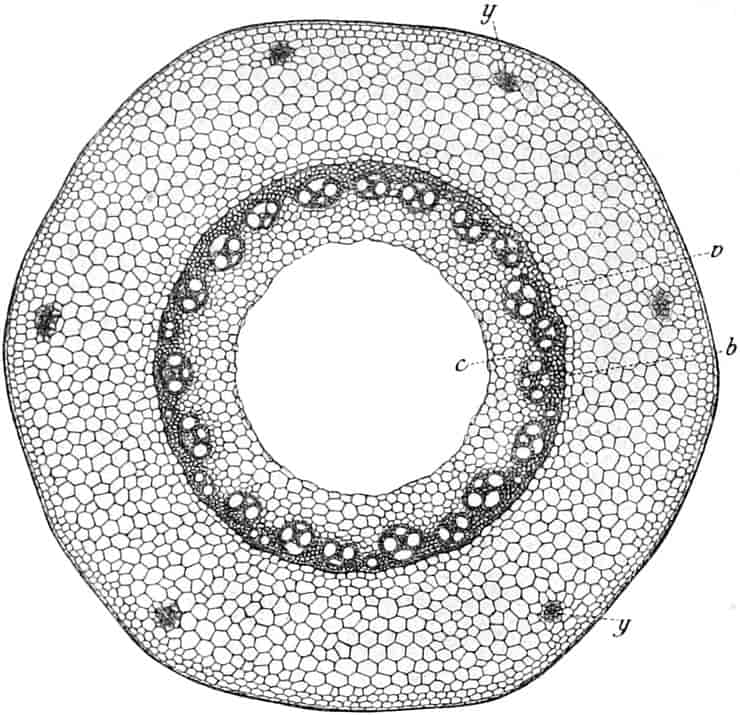
Agropyrum repens. Lupenbild des Rhizomquerschnittes.
[Nach Berg, Atlas.]
Das bisweilen wiederholt verzweigte Rhizom ist 2–3 mm dick, selten dicker (bis 4 mm), frisch von rundem Querschnitt, getrocknet stark geschrumpft und mit Längsleisten versehen, strohgelb, mit glänzender Oberfläche, innen hohl. (Fig. 81). Die Internodien sind etwa 5 cm lang. An den Knoten sitzen zweizeilig alternierende häutige, am Rande zerfaserte Niederblätter (Fig. 80 Nb.), in deren Achseln Knöspchen sich finden und auf der Unterseite einige Wurzeln. Die letzteren fehlen den Internodien.
[S. 221]
Graswurzel schmeckt fade, schwach süßlich.
Pathologie. Über Schädlinge von Agropyrum repens berichtet Prof. ED. FISCHER: Auf den oberirdischen Teilen von Agropyrum repens leben verschiedene parasitische Pilze, wie Erysiphe graminis DC., Ophiobolus herpotrichus SACC., Leptosphaeria culmiphaga (FR.), Laestadia canificans SACC., Phyllachora graminis FCKL., Puccinia graminis (PERS.) und andere, die vielleicht auch indirekt die Rhizome schädigen mögen. Auf dem Rhizom selber wird als Parasit angegeben Coniosporium rhizophilum (FR.) SACC., das möglicherweise als Nebenfruchtform zu Ophiobolus gehört.
Anatomie. Unter der derbwandigen Epidermis, die abwechselnd aus gestreckten Zellen mit dicker, wellig verbogener Wand (Langzellen) und zwei Kurzzellen mit dünner Teilungswand besteht, liegt ein mehrschichtiges, derbwandig-prosenchymatisches Hypoderm. In das dünnwandige Gewebe der Rindenschicht (Fig. 82 r) eingebettet finden sich einige (6) kleinere Bündel mit starken Bastzellbelegen (rb) und wenigen Bündelelementen. Die Endodermis [Zylinder- oder Kernscheide, (k)] besteht aus im Querschnitt fast quadratischen Zellen, die innen und an den Seiten verdickt sind. Der Gefäßbündelzylinder besteht aus ein oder zwei Reihen collateraler Bündel, die in Libriform (Bastzellen) eingebettet sind und von denen sich die kleineren an die Endodermis anlehnen, die größeren etwas nach innen gerückt sind. Sie zeigen den typischen Bau der Monocotylenbündel: zwei große getüpfelte Gefäße, dazwischen ein Spiralgefäß, außen eine Siebinsel. Der innere Teil des Markes ist geschwunden, der äußere in der Nähe der Bündel einige Zellreihen breit erhalten (m Fig. 82).
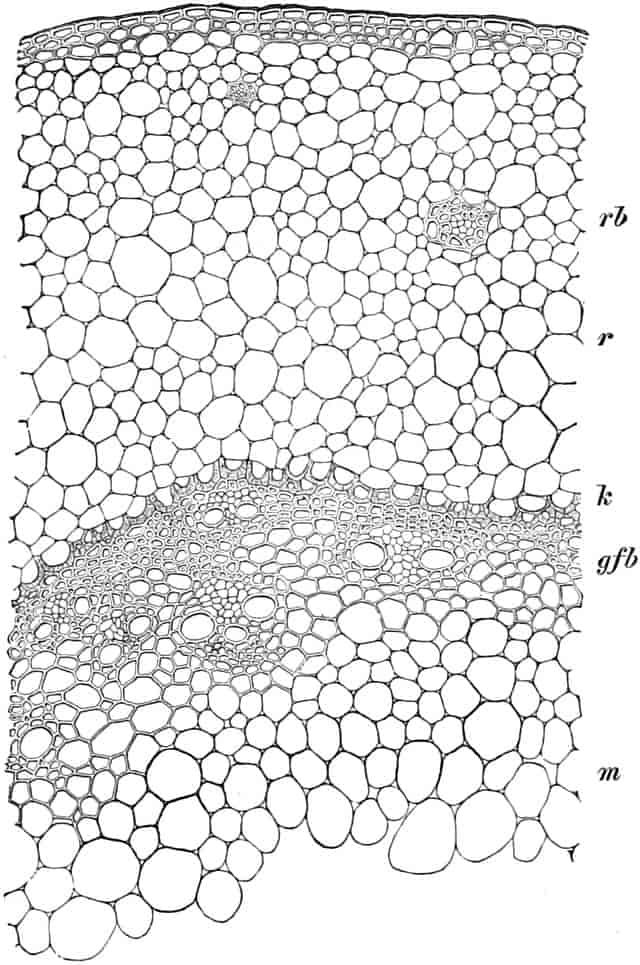
Agropyrum repens. Querschnitt durch das Rhizom. r Rindenschicht, rb Rindenbündel, k Endodermis, gfb Gefäßbündel, m Mark.
[Aus Tschirch, Angewandte Anatomie.]
In den Knoten ist der Bau verwickelter. Die Knoten «bestehen zunächst aus einer Querlage von Parenchym, in dieser aber treffen nicht nur die Gefäßbündel des unteren Stengelgliedes zusammen, sondern nehmen auch die der folgenden ihren Ursprung; beide bilden eine beiderseits das Parenchym einschließende, selbst aber wieder nach außen von dem Parenchym des Markes begleitete, aus kurz gegliederten, horizontal verlaufenden, getüpfelten Gefäßen bestehenden Querwand, von[S. 222] der sich nach beiden Richtungen, nämlich nach den beiden durch den Knoten getrennten Stengelgliedern, die Gefäßbündel aufrichten und vertikalen Verlauf nehmen. Diese Gefäßbündel bilden Schleifen, aus denen zuerst in horizontaler Richtung die zu den Scheiden und Wurzeln dringenden Gefäßbündel hervortreten» (BERG).
Triticum repens hat Befestigungs- und Ernährungswurzeln. Die Wurzeln sind, wenn 0,3 mm dick, nonarch. Die Endodermis verdickt sich bald stark und die Sklerose ergreift auch das benachbarte Gewebe der primären Rinde (HOLFERT).
Lit. BERG, Anatom. Atlas z. pharm. Waarenkunde. t. XVIII. — HÉRAIL et BONNET, Manipulations de botan. médic. 1891, Pl. VIII. — A. MEYER, Drogenkunde II, 43. — HOLFERT, Arch. Pharm. 1889, 505. — TSCHIRCH, Anatomie, Fig. 436. — MOBERGER und HÄLLSTRÖM (Über d. Bau v. Rhiz. graminis). Nord. farm. Tidskr. 1896.
Chemie. MARGGRAF erhielt keinen festen Zucker aus Queckenrhizom, wohl aber GRAFF (7 Lot aus 20 Pfund). PFAFF fand darin krist. «Graswurzelzucker», dessen Lösung gelatinierte und den BERZELIUS für Mannit hielt. Den Befund bestätigte VÖLCKER zum Teil, doch erscheint es ihm zweifelhaft ob Mannit vorgebildet ist oder erst sekundär entsteht. STENHOUSE fand weder Mannit, noch krist. Zucker, wohl aber Kaliumoxalat und einen gärungsfähigen amorphen Zucker. LUDWIG hält den Graswurzelzucker von PFAFF für ein Gemenge von Calciumlaktat und Mannit. Mannit kommt wahrscheinlich in frischem und gut getrocknetem Rhizom nicht vor (H. MÜLLER, A. MEYER). REBLING gibt den Zuckergehalt auf 22% (?) an. Andere fanden viel weniger, z. B. GEISSLER in Winterrhizom nur 0,6% Lävulose. LUDWIG und MÜLLER fanden 1872 einen stark linksdrehenden Zucker (Fruchtzucker), einen rechtsdrehenden Zucker (nicht Rohrzucker), ein eigentümliches, durch Spaltung Fruchtzucker lieferndes linksdrehendes Gummi, das durch Bleiessig nicht gefällt wird. Dieses durch Alkohol fällbare, nicht süße «Queckengummi» nennt H. MÜLLER (1873) Triticin (s. oben). H. MÜLLER, der das Triticin genau untersuchte und seine Darstellung beschreibt, erhielt davon 3,52 aus zuckerreicherer, 7–7,7% aus zuckerärmerer Rhiz. graminis. KELLER erhielt davon 5% aus im Oktober gesammeltem Rhizom. Der süße Geschmack der Droge rührt nicht vom Triticin, sondern von Zucker her, der besonders im Frühjahr reichlicher im Rhizom aufzutreten scheint. Spätere Untersuchungen zeigten dann H. MÜLLER, daß ausschließlich Fruchtzucker (keine Dextrose und kein Rohrzucker) in Rhiz. gram. vorkommt, und daß der Gehalt daran 2,45–3,33% beträgt. Auch Inosit ist nachgewiesen (FICK). Er ist ebenfalls süß.
Das Triticin, das schon durch Kochen mit Wasser in Fruchtzucker übergeht und den Reservestoff des Rhizoms darstellt, hält REIDEMEISTER nicht für identisch mit Lävulin (vgl. S. 218) und Sinistrin (S. 224). Es vergärt mit Hefe schwerer. Ob es mit dem Graminin (s. oben S. 218), das EKSTRAND und JOHANSON aus den Rhizomen von Phalaris arundinacea, Phleum pratense und den Knollen von Dracaena australis erhielten und dem Irisin (s. oben S. 218), das WALLACH in den Rhizomen von Iris Pseudacorus fand, übereinstimmt, bleibt noch zu untersuchen. Begleitet wird das Triticin von 10,5–11,5% eines stickstoffhaltigen Gummis (Schleim), das näherer Untersuchung bedarf.
PLAUCHUD gibt [neben 3% krist. und 4% unkristall. Zucker] 13,9% Stärke an und beschreibt die sich mit Jod blaufärbenden Körner eingehend (1877). Ich fand niemals Stärke in der Queckenwurzel. Auch A. MEYER fand weder Stärke noch Öl. Der Landwirt BARREL soll aber aus 100 kg Rhiz. gram. c. 65 kg «Mehl» dargestellt und als Viehfutter benutzt haben. Es wird hier wohl eine Verwechslung[S. 223] mit Cynodon Dactylon vorliegen, dessen Rhizom Stärke enthält. «Was RABOURDIN als eigentümliche stärkemehlartige Substanz beschreibt, dürfte wohl im wesentlichen Triticin sein» (WITTSTEIN).
HERMBSTÄDT glaubte Weinstein (?), H. MÜLLER Malate nachgewiesen zu haben. Pektin und Harz fehlen (FLÜCKIGER).
Rhiz. graminis enthält 12,8% Wasser und 3,44% Asche der bei 105° getrockneten Ware (NYGÅRD). H. MÜLLER erhielt 4,5%, HAUKE 2,72–2,95% Asche.
In dem Rhizom von Cynodon Dactylon PERS. fand SEMMOLA Cynodin (wohl Asparagin oder etwas dem ähnliches).
Lit. MARGGRAF, Chym. Schrift II. Th. 70 (1767). — GRAFF, TROMMSD. Journ. 1800, 7, 271. — PFAFF, Syst. d. Mat. med. 1808 I, 198; 1821, VI, 110. — STENHOUSE, Ann. Chem. Pharm. 41, 354 (Pharm. Jahresber. 1844, 26). — VÖLCKER, Ann. Chem. Pharm. 59, 1846, 380. — LUDWIG, Arch. Pharm. 1857. — Eingehende Analyse in H. LUDWIG und H. MÜLLER, Über d. Bestandt. d. Queckenwurz. Arch. Pharm. 1872, 51, 132. — PLAUCHUT, Et. sur le chiendent (Trit. repens). Journ. pharm. chim. 1877, 389 (dort auch eine Aschenanalyse). — REBLING, Arch. Pharm. 1855, 15. — H. MÜLLER, Über den Graswurzelzucker und über das Triticin, ein neues Kohlehydrat im Rhizom von Triticum repens. Arch. Pharm. 1873, 500. Journ. pr. Chem. 1873, 832. — A. MEYER, Drogenk. II, 46 (KELLER). — WITTSTEIN, Handwörterbuch. — A. W. V. REIDEMEISTER, Beitr. z. Kenntn. d. Levulins, Triticins und Sinistrins. Diss. Dorp. 1880 (Ph. Z. f. Rußl. 1880, 658. Referat in Botan. Jahresb. 1880, I, 438). — FICK, Pharm. Zeitschr. f. Rußl. 1887 und Ph. Jahresb. 1887, 324. — EKSTRAND u. JOHANSON, Ber. d. d. chem. Ges. 1887, 3310 u. 1888, 594. — WALLACH, Lieb. Ann. 234 (1886). 374. — Oper. min. di GIOV. SEMMOLA, Napoli 1841 (Chem. Jahresb. 1845, 535) Della Cinodina, nuovo prodotto organ. trov. nella gramigna offic. Cynod. Dactyl. — LIPPMANN, Chemie der Zuckerarten 1904.
Als Verfälschungen werden genannt die Rhizome von Carex arenaria L. (Rhiz. caricis), Carex disticha HUDS. (C. intermedia GOOD.), Carex hirta L. u. and. Carexarten. Alle Carexrhizome führen Mark. Die Rindenschicht besitzt bei dem graubraunen, mit langen zerrissenen, bräunlichen Niederblättern besetzten Rhizom von Carex arenaria große Luftlücken (abgebildet bei BERG, Anat. Atlas t. VIII). Das Parenchym des Markes führt Stärke. Die Luftlücken fehlen bei den rotbraunen Rhizomen von Carex hirta, die ebenfalls Stärke führen, auch in der Rinde. Sie fehlt hier bei C. disticha. MOBERGER und HÄLLSTRÖM halten Größe und Form der Endodermiszellen für das beste Unterscheidungsmerkmal. Sie messen bei Rhiz. graminis 24–30, bei Rhiz. caricis 8–14, bei Carex disticha 10–12 mik.
Die Ausläufer von Lolium perenne besitzen Wurzeln auch an den Internodien. Ich habe sie nie in der Droge gefunden. Ich fand dagegen (1909) der Droge oft beträchtliche Mengen der Halme beigemengt, die aber anatomisch leicht erkannt werden konnten.
BERG, Pharmakognosie 1879, 97. — MOBERGER und HÄLLSTRÖM (Bau von Rhiz. gram. u. deren Substituten). Nord. farmaceut. Tidskr. 1896, 114 (Pharm. Zeit. 1896, 437).
Anwendung. Beliebtes Blutreinigungsmittel und Diuretikum des Volkes. In der Medizin als Mellago (Fluidextrakt) und Ptisana besonders in Frankreich noch viel benutzt, in Deutschland auch als Extrakt.
Die Quecke steht auch in der Liste der KNEIPPschen Mittel (als harn- und schweißtreibend) — auch der Saft der frischen Wurzel zu Frühlingskuren als «Blutreinigungsmittel». In der Tierheilkunde dient Rhiz. graminis bisweilen als Substituens von Rad. althaeae.
HOFMANN bemerkt (1787), daß man aus Graswurzel eine Art Wein, Bier, Weingeist und Essig darstellen könne.
[S. 224]
Paralleldrogen. Das Rhizom von Cynodon Dactylon RICH. (Panicum Dactylon L., Digitaria stolonifera SCHRAD.), einer in Südeuropa, Nordafrika, Persien, Kaukasien heimischen, aber auch in Süddeutschland, Österreich und der Schweiz vorkommenden, nach Peru, Kalifornien und Australien verschleppten Graminee (vgl. auch S. 218), als Rhiz. graminis italici, Gros Chiendent, Chiendent pied de poule, Ch. du Midi bekannt, ersetzt in Südeuropa das Rhiz. graminis. Die Rhizome sind dicker und derber als bei Agropyrum repens, trocknen nicht so stark ein, besitzen längere Internodien und an den Knoten reichlich Knospen. Die Rindenschicht ist schmal. An die Endodermis lehnt sich ein Bastzellpanzer, in den vereinzelte Bündel eingebettet sind. Zahlreiche isolierte Bündel sind über das reichlich Stärke führende Mark verstreut, das im Zentrum geschwunden ist (Abbild. in BRAEMER-SUIS, Atlas de micrographie Pl. 4). Die Endodermiszellen messen 20–24 mik.
Die mehr maritimen Agropyrum acutum R. u. S., A. pungens R. u. S., und A. junceum P. DE BEAUV. dürften gleichwertig mit A. repens sein.
Geschichte. FRAAS, DAUBENY und FLÜCKIGER meinen, daß das gramen des PLINIUS (XXIV, 118) wie das ἄγρωστις des THEOPHRAST und DIOSKURIDES (IV, 30) wohl eher Cynodon Dactylon, die in Südeuropa häufige Paralleldroge unseres Rhiz. graminis gewesen sei, doch stellt PLINIUS dem gramen, das er als süß beschreibt und dessen diuretische Wirkung er kennt, ausdrücklich ein gramen aculeatum gegenüber, das er Dactylon nennt und von dem er drei Arten kennt. Auch THEOPHRAST bezeichnet die Graswurzel als süß (caus. plant. 6, 11, 10). Ich finde, daß das Rhizom von Cynodon Dactylon weniger süß schmeckt als das von Agropyrum repens. SPRENGEL hält gramen und ἄγρωστις für Triticum repens, das jedoch im Süden seltener ist. WIMMER führt in seiner THEOPHRAST-Ausgabe (1866) unter ἄγρωστις beide (Tritic. repens und Cynodon Dactylon) auf und das dürfte das richtige treffen. Die Sache läßt sich nicht entscheiden, da beide zu den gleichen Zwecken benutzt wurden. BONNET hält des DIOSKURIDES ἄγρωστις für Dactyloctenium aegypticum. In der Tabula des SIMON JANUENSIS steht Agrostis (I, S. 663).
PLINIUS nennt eine Menge Krankheiten, gegen die Gramen angewendet werden könne (XXIV, 118). Die diuretische und lithotriptische Wirkung war auch ORIBASIUS (I, S. 588), MARCELLUS EMPIRICUS (de medicamentis XXVI), AËTIUS (Tetrabibli sermo I) und ALEXANDER TRALLIANUS (I, 591) bekannt. Auch GALEN erwähnt die Eigenschaft «Blasensteine aufzulösen». Sie wird auch in den mittelalterlichen Kräuterbüchern (z. B. dem Herbarius Pataviae 1485) erwähnt, wie von DODONAEUS, TURNER (Herball 1568), GERARDE u. and. Nördlich der Alpen dürfte es sich hierbei immer um Agropyrum repens gehandelt haben; ebenso in den Sinonoma Bartholomei (I, 649: gramen radix), in dem Nördlinger Register (I, S. 813, graminis), in den Taxen von Frankfurt 1582 (I, S. 817), von Hamburg 1587 (I, S. 818) u. and. Graminis radix steht auch bei CORDUS (I, S. 799), der sie zu den Oxysacchara composita benutzte.
Lit. FLÜCKIGER, Pharmakognosie. — FLÜCKIGER-HANBURY, Pharmacographia.
VII. Scillin- (Sinistrin-) Drogen.
Das Sinistrin, ein linksdrehendes, nicht gärungsfähiges, beim Kochen FEHLINGsche Lösung reduzierendes, wohl mit dem Triticin verwandtes Polysaccharid, findet sich in den Bulbus Scillae, doch werden diese, da wegen anderer Bestandteile benutzt, an anderer Stelle abgehandelt werden.
Lit. REIDEMEISTER, Bot. Jahresb. 1880, I, 439. — SCHMIEDEBERG, Ebenda 1879, I, 385. — O. HAMMERSTEN, Pflüg. Arch. 36, 373.
VIII. Polysaccharide vom Charakter der Membranine.
Membranindrogen.
Früher hatte man den Inhaltsstoffen der Zellen fast allein Beachtung geschenkt. Mehr und mehr aber zeigte sich, daß auch die Membran zu chemischen Leistungen[S. 225] befähigt ist. Am deutlichsten trat dies bei der sog. resinogenen Schicht der Sekretbehälter hervor, die, zweifellos ein Teil der Membran, doch energische chemische Arbeit leisten kann. Schon früher war erkannt worden, daß die Schleime fast ausnahmslos Membranbildungen sind, und daß auch das Gummi und verwandte Substanzen zur Membran gehören, ebenso wie Lichenin, Amyloid und Pektin. Da war es denn keine besondere Überraschung mehr, daß Membranen auch den Charakter von Reservestoffen annehmen können.
Pharmakologisch spielen die Membranen und ihre Bestandteile eine sehr verschiedene Rolle. Rein mechanisch wirken z. B. die Baumwollhaare, das Penawar Djambi, der Feuerschwamm, der Torfmull, das Holzmehl, die Kieselschalen der Diatomeen: sie saugen kapillar und osmotisch Flüssigkeiten auf. Die Substanz ihrer Membran kommt hierbei wenig in Betracht, tritt jedenfalls pharmakologisch nicht in Reaktion. Physikalisch ist auch die Wirkung des Korkes zu deuten, aber in Abhängigkeit von der chemischen Natur der Korklamelle. Anders bei der Gruppe der Schleime und des Gummis. Hier ist es die Substanz selbst, die das pharmakologische Individuum bildet.
Chemisch umschließt der Begriff Membran sehr verschiedene Dinge. Wir wissen, daß er nicht identisch ist mit Zellulose, und daß der Begriff Zellulose seinerseits wieder vielerlei Verschiedenes umfaßt, wie auch, daß die nicht aus Zellulose bestehenden Membranen ihrerseits wieder recht verschieden aufgebaut sind.
Wenn nun die Verhältnisse aller dieser Klassen chemisch vollkommen und in allen Punkten aufgeklärt wären, so könnte man auch hier wohl an eine chemische Gruppierung denken. Da dies aber nicht der Fall ist, müssen wir uns nach einer anderen Einteilung, die auch das morphologische Moment mit berücksichtigt, umsehn. Das allen diesen Dingen gemeinsame ist, daß sie Membranbestandteile sind, und so mögen sie denn alle, welche chemische Beschaffenheit sie auch zeigen, unter dem gemeinsamen Namen Membranine zusammengefaßt werden.
CROSS und BEVAN bilden die Gruppen: Lignozellulosen, Pekto- und Mukozellulosen und Adipo- und Cutozellulosen. Ich teile die Membranine zunächst in zwei große Gruppen, in die der Zellulosine, die die Membranine umfassen, welche wir nach dem Stande unserer Kenntnisse als Polysaccharide auffassen können, die jedenfalls bei der Hydrolyse irgend einen oder mehrere Zucker liefern — und andererseits die Membranine, von denen wir dies vorläufig noch nicht annehmen können, bei denen jedenfalls andere Körper den chemischen Charakter der Membran bestimmen. So komme ich zu folgender Einteilung, die sich für unsere Zwecke besonders gut eignet, aber auch für den Phytochemiker vorläufig brauchbar sein dürfte.
- Zellulosine, welche Polysaccharide enthalten (umfaßt die Zellulosen von TOLLENS und die Lignozellulosen, sowie Pekto- und Mukozellulosen von CROSS und BEVAN).
- Zelluloso-Membranine (reine oder fast reine Zellulose, schwer hydrolysierbar),
- Reservezelluloso-Membranine (meist Hemizellulosen im Sinne von E. SCHULZE),
- Lichenino-Membranine inkl. Amyloido-Membranine,
- Lignino-Membranine (Lignozelluloso-Membranine, schwer durch Säuren hydrolysierbar, leichter durch schweflige Säure [TOLLENS]),
- Pektino-Membranine,
- Koryzo-Membranine (oder Myco-Membranine, Membranschleime),
- Gummo-Membranine.
- [S. 226] Membranine, von denen noch nicht sicher ist, ob sie Polysaccharide enthalten (umfaßt die Adipo- und Cutozellulosen von CROSS und BEVAN).
- Suberino-Membranine (Kork),
- Mycino-Membranine (Pilzzellulose),
- Silico-Membranine (Diatomeenschalen),
- Andere Kryptogamen-Membranine.
A. Zellulosindrogen.
TOLLENS nimmt vier Hauptgruppen der Zellulosen an: 1. die eigentlichen Zellulosen, 2. hydratisierte Zellulosen wie Hydrozellulosen und Hemizellulosen, die nicht reduzierend wirken, 3. Zellulosen mit Carboxylgruppen (dazu die sog. Pektinsäuren, die sog. Acidzellulosen), 4. Zellulosen, die Carboxyl- und zugleich auch Aldehyd- und Ketongruppen führen, daher reduzierend wirken (dazu die sog. Hydralzellulosen, das Oxybassorin und die Oxyzellulosen). BUMCKE und WOLFFENSTEIN ziehen die Gruppen 2–4 zusammen als hydratisierte oder Hydrozellulosen und unterscheiden: a) reduzierende (Hydralzellulosen), b) reduzierende mit Carboxylgruppen, c) nichtreduzierende mit Carboxylgruppen (Acidzellulosen), d) nichtreduzierende ohne Carboxylgruppen (Laktone?).
Jedenfalls stehen die Körper der Gruppe der Zellulosine, wie ich die ganze Gruppe nenne (s. oben), zu der Zuckergruppe in Beziehung und wir dürfen sie als hochmolekulare Polysaccharide betrachten, aber die Verhältnisse liegen bei ihnen viel komplizierter. Denn bei der Hydrolyse mit Säuren oder Enzymen (Cytasen) entstehen hier oft nicht nur Hexosen (Glukose, Galaktose, Mannose) [und bei der Oxydation (aus Galaktose) Schleimsäure:
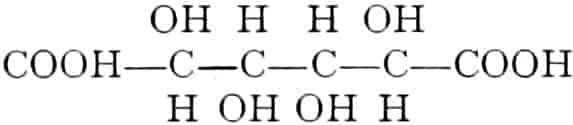
sondern auch sich durch Entstehung von Furol bei der Destillation mit HCl verratende Pentosen (Arabinose, Xylose), Methylpentosen (Fukose) und Furoide (Oxydationsprodukte von Hexosen- oder Pentosen-Monoformale), sowie (bei den Gummis) eigentümliche als Geddinsäuren bezeichnete Körper, so daß wir in den Zellulosinen nicht nur einfache Hexosane (z. B. Glukosan, Galaktan, Mannan) und einfache Pentosane (z. B. Araban, Xylan), sondern auch gemischte Hexosane (z. B. Gluko-Mannane, Frukto-Mannane, Galakto-Mannane und in vielen Hölzern: Manno-Gluko-Galaktane) und gemischte Pentosane, sowie gemischte Hexoso-Pentosane (z. B. Galakto-Araban), Furoido-Pentosane (wie z. B. in den Lignozellulosen) und Furoido-Hexoso-Pentosane, sondern bei einigen offenbar noch kompliziertere Kondensationsprodukte von Gliedern der Kohlehydratreihe und vielleicht auch anderen, nicht hierher gehörigen Körpern (?) vor uns haben.
So besitzt die sonst wohl für pharmakognostische Zwecke, besonders in der Gruppe der Gummis und Schleime, brauchbar befundene Unterscheidung zwischen Schleimsäure liefernden und Schleimsäure nicht liefernden Zellulosinen jetzt nur noch vorläufig orientierenden Wert. Sie sagt uns nur, ob Galaktose bildende Gruppen darin vorhanden sind. Und auch eine Einteilung, etwa nach Glukosozellulosen, Mannosozellulosen, Arabinosozellulosen, läßt sich für pharmakognostische Zwecke nicht machen, da bei der Hydrolyse eben meist mehrere Zucker entstehen. Ja selbst die Hemizellulosen[S. 227] (E. SCHULZE, Zellulosegummi (HOFFMEISTER) oder lösliche Zellulose) sind mit den echten Zellulosen durch viele Übergänge verbunden. Auch nach der Ansicht von SCHULZE, zu der dieser auf rein chemischem Wege kam, bilden Zellulose, Hemizellulosen, schleimgebende Zellbestandteile und Amyloid eine Reihe chemisch verwandter Substanzen, deren einzelne Glieder wohl durch noch unbekannte Zwischenformen miteinander verknüpft sind.
Immerhin können wir doch den zuerst von E. SCHULZE hervorgehobenen Unterschied machen, daß die echten Zellulosen nur schwer hydrolysierbar sind, die Hemizellulosen aber relativ leicht. Ferner sind die echten Zellulosen stets Gerüstsubstanzen, die Hemizellulosen aber oft Reservestoffe. Den Charakter von Gerüstsubstanzen tragen aber auch die Lignino-Membranine, und die Korizo-Membranine sind, bisweilen wenigstens (z. B. bei den Schleimendospermen), ebenfalls Reservestoffe. Die Gummo-Membranine endlich machen oft ganz den Eindruck von Sekreten und die Pektino-Membranine scheinen zu dem Zucker der Früchte biologisch in Beziehung zu stehen.
Nur eins ist, wie gesagt, allen Zellulosinen eigen: sie liefern bei der Hydrolyse einen oder mehrere Zucker.
1) Zelluloso-Membranindrogen.
Der Name Zellulose rührt von PAYEN her (1838), dem wir die ersten systematischen chemischen Untersuchungen über das Zellhautgerüst der Pflanzen verdanken. Er gab der Zellulose die Formel C6H10O5. SCHLEIDEN fand 1838 die Jodschwefelsäurereaktion, SCHULZE-Rostock die mit Chlorzinkjod. Die Löslichkeit der Zellulose in Kupferoxydammoniak entdeckte SCHWEIZER 1857 und GILSON zeigte 1893, daß man aus dieser Lösung krist. Zellulose erhalten kann, doch erhielt weder CRAMER noch WINTERSTEIN nach GILSONS Verfahren Kristalle mit Zellulosereaktion. Die Chemie der Zellulosen beginnt in den achtziger Jahren des XIX. Jahrh. mit dem Studium der bei der Hydrolyse der Zellwände auftretenden Zuckerarten.
Die Zellulosezellwände geben bei der Hydrolyse mit fast konz. Schwefelsäure (FLECHSIG) ganz vorwiegend Traubenzucker (Dextrose, vgl. S. 6), Galaktose entsteht hierbei nicht, Mannose, Arabinose und Xylose hin und wieder, meist jedoch in nicht großen Mengen. Es sind also Glukosezellulosen, gemischte Anhydride in denen der Glukose liefernde Bestandteil jedenfalls weitaus überwiegt. Glukosezellulose war es auch, die GILSON kristallisiert erhielt. Der Typus dieser Glukose(Dextrose-)zellulose ist die Baumwolle (s. d.).
Bei der Hydrolyse der Zellulose entsteht als Zwischenprodukt ein mit Maltose isomeres Disaccharid, die Zellose oder Zellobiose (SKRAUP und KÖNIG), das sich also zur Zellulose verhält wie Maltose zur Stärke. Durch Nitrieren der Zellulose gelangt man (bei Annahme der Formel C12H20O11) bis zu einem Hexanitrat (Kollodiumwolle, Schießbaumwolle). Salzsäure und Kaliumchlorat und andere Oxydationsmittel liefern Oxyzellulose (VIGNON), Schwefelsäure Hydrozellulose (GIRARD), Natronlauge Natronzellulose (C12H20O10.2 NaOH). Letzter Prozeß ist als Mercerisieren bekannt. Mit Laugen gequollene Zellulose gibt durch Behandeln mit CS2 die wasserlösliche «Viskose» (CROSS und BEVAN). Glycerin verändert Glukosezellulose selbst bei 300° nicht — Unterschied von anderen Zellulosen (WISSELINGH). Schmelzendes Kali bildet beim Erhitzen über 180° Protokatechusäure und Brenzkatechin (HOPPE-SEYLER), endlich Oxalsäure. Unter 180° soll Glukosezellulose unverändert bleiben (?). Darauf beruht das[S. 228] Verfahren LANGES zur Bestimmung der Zellulose. (Über Zellulosebestimmung vgl. auch meinen Artikel: Zellulose in der Realenzykl. d. Pharm.)
Die Möglichkeit der Überführung der Zellulose in Traubenzucker war bereits GAY LUSSAC und BRACONNOT bekannt. Aber trotz zahlreicher Arbeiten kennen wir die Struktur des Zellulosemoleküls noch nicht. CROSS und BEVAN, die seit langer Zeit sich dem Studium der Zellulosen widmen, betrachten nur das Eine als sicher, daß Zellulose weder eine einfache Polyaldose, noch ein Anhydrid von Polyaldosen sein könne, sondern neben Aldosekernen unter anderem jedenfalls eine ketonartige Gruppe enthalte.
Immerhin lassen sich aber schon jetzt zwei allerdings durch vielfache Übergänge miteinander verbundene Gruppen erkennen: die echten Zellulosen und die Hemizellulosen (SCHULZE und WINTERSTEIN), die sich durch ihr verschiedenes Verhalten zu 1–2% Mineralsäure unterscheiden. Die echten Zellulosen, zu denen z. B. die Zellulose der Baumwolle gehört, geben selbst bei andauerndem Kochen mit 1–2% Mineralsäuren nur geringe Mengen reduzierender Substanzen (Zucker).
E. SCHULZE schlug 1889 vor, nur den in verdünnten Säuren unlöslichen, in Kupferoxydammoniak löslichen Bestandteil der Zellhäute Zellulose zu nennen, die andern leichter zu verzuckernden aber in Kupferoxydammoniak unlöslichen Hemizellulose.
E. SCHULZE nennt die gewöhnliche Dextrose liefernde Zellulose: Dextrosozellulose. Ebenso nennt er den Mannose liefernden Zellwandbestandteil Mannosozellulose u. s. f. (die Mannosozellulose ist mit dem Paramannan GILSONS identisch).
CROSS und BEVAN (Chem. News 65, 77) geben der Baumwollzellulose die Formel: C12H20O10 und nehmen darin acht Hydroxyle an. GREEN hält die Zellulose für ein inneres Anhydrid des Traubenzuckers:
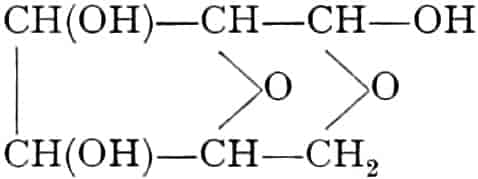 |
.
|
NASTJUKOFF erteilt ihr die Formel 40(C6H10O5), EDER: C12H20O10, VIEILLE, sowie LUNGE und BEBIE: (C7H10O5)4, MENDELEJEFF: (C6H10O5)8, doch sind das alles noch Hypothesen. Genaue Angaben über die Molekulargröße der Zellulose lassen sich derzeit noch nicht machen; vielleicht sind die Untersuchungen von E. BERL und seinen Mitarbeitern über Nitrozellulosen geeignet näheren Aufschluß über die Konstitution des Zellulosemoleküls zu bringen (WINTERSTEIN).
Lit. BRACONNOT, Ann. chim. phys. 1819. — PAYEN, Ann. sc. nat. 1839 u. 1840, Compt. rend. 1840, Mém. sur le develop. des végétaux. Paris 1842. — SCHLEIDEN, Pogg. Ann. 43 (1838) u. Lieb. Ann. 42 (1842). — SCHWEIZER, Journ. pr. Chem. 76 (1857). — NASTJUKOFF, Über d. Veränd. d. physikal. u. chem. Eigenschaften d. Baumwollzellulose bei ihr. Umwandl. in Oxyzellulose. Bull. soc. ind. de Mulhouse 1892. — C. SMITH, Über natürl. Oxyzellulosen. Chem. Zeit. 1894. — AUTENRIETH und BAYERHAMMER, Jahresb. d. Chem. I, 1822. — BRACONNOT, Ann. chim. phys. (2) 12, 1819 und GILBERTS Ann. 1819. — GILSON, La cristallisation de la cellulose et la composition chimique de la membrane cellulaire. La cellule 9, 397 und La composit. chim. de la membr. cellul. végét. Cellule 11, 19. — HOFFMEISTER, Die Zellulose und ihre Formen. Landw. Jahrb. 1889 und Landw. Versuchsstationen 39, 462. — SKRAUP und KÖNIG, Ber. d. d. chem. Ges. 34. — E. SCHULZE, Zur Kenntnis der in den pflanzl. Zellmembranen enthaltenen Kohlenhydrate. Landw. Jahrb. 1894 (Zusammenfassung). Derselbe, Zur Chem. d. pflanzl. Zellmembranen. Zeitschr. phys. Chem. 19 (1894). — RENKER, Über Bestimmungsmethoden der Zellulose. 2. Aufl. — CROSS and BEVAN, Cellulose an outline of the chemistry of the structural elements of plants with reference to their natural history and industrial uses. Sec. edit. 1903. Ferner Researches on Cellulose. London 1901. — CROSS, BEVAN and BEADLE, Proc. chem. soc. 1901. — WITT und LEHMANN, Chem. Technologie der Gespinnstfasern.[S. 229] — SCHWALBE, Die Chemie der Zellulose. 1909. — C. PIEST, Die Zellulose, ihre Verarbeitung und ihre chem. Eigenschaften. Stuttgart 1910. — LANGE, Zeitschr. angew. Chem. 1895. — T. F. HANAUSEK, Artikel Zellulose in Luegers Lexikon d. ges. Technik. — TSCHIRCH, Artikel Zellulose in Realenzyklop. d. Pharm. II. Aufl. — TOLLENS, Kurzes Handb. d. Kohlenhydrate. — CZAPEK, Biochemie (dort eine Liste des Rohfasergehaltes zahlreicher Objekte). — Vgl. ferner die chem. Lit. unter Baumwolle.
Die anatomischen Verhältnisse der Zellulosezellwände sind einfach. Bisweilen zeigen sie Schichten, die oft abweichende Struktur besitzen, bisweilen Plasmaeinschlüsse, die besonders bei wachsenden Membranen auftreten (KRABBE). Das Wachstum der Membran scheint sowohl durch Apposition (vorwiegend beim Dickenwachstum), wie durch Intussusception (beim Flächenwachstum) zu erfolgen. WIESNERS Dermatosomentheorie erscheint nicht haltbar.
Die Membran, besonders der Bastzellen, zeigt oft einen Aufbau aus mehreren Schichten, die sich deutlich, sowohl optisch wie durch abweichende Reaktion (z. B. gegen Jodschwefelsäure, die Verholzungsreagentien usw.) unterscheiden. Um diesen Unterschied zu markieren, habe ich die alte Bezeichnung, sekundäre und tertiäre Membran, wieder aufgenommen (Angew. Anatomie).
Lit. CORRENS, Dickenwachstum durch Intussuszeption bei einigen Algenmembranen. Diss. München 1889 und Z. Kenntnis d. inneren Struktur d. vegetabil. Zellmembranen. Pringsh. Jahrb. 23 (1891). — AMBRONN, Über Poren in den Außenwänden von Epidermiszellen. Pringsh. Jahrb. 14 (auch Habilitationsschrift Leipzig 1882). — Derselbe, Pleochroismus gefärbter Zellmembranen. Ann. d. Phys. 1888 und Ber. d. d. bot. Ges. 1888. — KRABBE, Beitr. z. Kenntn. d. Struktur u. d. Wachstums vegetabilischer Zellhäute. Pringsh. Jahrb. 18 (1887). — BUSCALIONI, Contribuz. allo studio della membr. cellulare. Malpighia 1892 u. 1893. — ZACHARIAS, Entstehung u. Wachstum d. Zellhaut. Pringsh. Jahrb. 20, 1889 u. Flora 1891. — WIESNER, Sitzungsb. d. Wien. Akad. 1886, I, 17, Ber. d. d. bot. Ges. 1888 und Botan. Zeit. 1892 (Dermatosomen). — MIKOSCH, Ber. d. d. bot. Ges. 1891, 306. — T. F. HANAUSEK, Zur Struktur d. Zellmembran. Ber. d. d. bot. Ges. 1892, 1. — KRASSER (Eiweiß in Zellmembranen). Sitzungsb. d. Wien. Akad. 94 (1886) u. Bot. Zeit. 1888, 209. — A. FISCHER, Zur Eiweißreaktion der Zellmembran. Ber. d. d. bot. Ges. 1887 u. 1888. — CORRENS, Jahrb. f. wissensch. Bot. 26 (1894). — SOLMS-LAUBACH, Über einige geformte Vorkommnisse oxals. Kalkes in lebenden Zellmembranen. Bot. Zeit. 29. — Über die Schleimmembran s. diese (weiter hinten).
Gossypium.
Pili gossypii, Lana gossypina, Baumwolle — coton (franz.) — cotton, cotton wool (engl.) — cotone (ital.) — algodon (span.) — algodâo (port.) — katoen (holl.) — bomull (schwed.) — puuvilla (finn.) — gyapot (ung.) — βάμβαξ (n.-griech.) — qutu (pers.) — kapas (mal.) — kapase (beng.). — Die Pflanze: Cotonnier, cotton-plant.
Etym. Zweifelhaft ist die Deutung von σίνδον, ξύλον, ὄθων, sowie von βίσσος, byssus, worunter wohl von den Alten ebenso Seide und Leinen, wie Baumwolle verstanden wurde (C. RITTER und REGNIER, PAULYS Realenzyklop. d. klass. Altert. 1897, V, S. 1108), und auch das semitische Wort keton (altsem. kettân, arab. alcuta, qutn, kutn), woraus dann coton, cotton, cottone, kattun wurde, bedeutete ursprünglich Leinen (D. H. MÜLLER). — Das ägyptische Wort schens (hebräisch šêš, schesch, buz), welches den Stoff bezeichnete, aus dem Kopfbinde und Leibrock des Hohenpriesters angefertigt wurde, kann Baumwolle aber auch Leinen bezeichnet haben. Der Baum pištim (Josua 2, 6) war nicht Baumwolle, sondern Flachs (D. H. MÜLLER). — Im Sansk. heißt die Baumwolle kârpâsa (die Baumwollpflanze kârpâsî). Doch wurden die Ausdrücke κάρπασος, carbasa, carpas im Munde der Griechen und Römer später mehrdeutig und schließlich auch für Leinen benutzt (WAGLER). — Bei PLINIUS steht gossipion oder Xylon. Gossypium entweder von gossum (= Wulst, Kropf?) oder, was wahrscheinlicher, von arab. goz (= seidenartig). PLINIUS sagt (XIX, 2): «Superior pars Aegypti in Arabiam vergens[S. 230] gignit fruticem, quem aliqui gossipion vocant, plures xylon et ideo lina inde facta xylina. Parvus est, similemque barbatae nucis defert fructum, cuius ex interiore bombyce lanugonetur. Nec ulla sunt eis candore mollitiave praeferenda.» (Vgl. auch WIESNER, Rohstoffe.)
Stammpflanze. Zahlreiche Kulturformen von mehreren Gossypiumarten besonders Gossypium barbadense L. [Spec. pl. ed. I (1753) p. 693] (G. vitifolium LAM., G. peruvianum DC., G. punctatum SCHUM. et THÖNN., G. acuminatum ROXB., G. religiosum PARL. non LINN.) mit der Varietät peruvianum CAV. (auch als Art, s. unten), und Gossypium herbaceum L. (Spez. pl. ed. I p. 693) (G. indicum LAM., G. album WIGHT et ARN., G. micranthum P. DC., G. hirsutum L., G. punctatum GUILL. et PERROTT, G. prostratum SCHUM. et THÖNN.) mit den Varietäten religiosum, hirsutum und Wightianum (diese auch als Arten). Die Systematik der Gattung Gossypium ist sehr unsicher.
Systemat. Stellung. Malvaceae, Hibisceae.
PARLATORE betrachtet Birma und den indischen Archipel als Heimat, MASTERS hält das in Sindh heimische G. Stocksii für die Stammform von G. herbaceum. SCHUMANN nimmt (in ENGLER-PRANTL, Pflanzenfam.) drei Arten kultivierter B. an: G. barbadense L. (heimisch auf den Antillen), G. arboreum L. (heimisch in Togo, Afrika) und G. herbaceum L. (seit Urzeiten in Indien kult.) mit den Varietäten religiosum (China [oder Amerika?]) und hirsutum (heimisch in Mexico und Westindien). In der Flora Brasiliensis stehen: G. hirsutum L., G. barbadense L., G. religiosum L., G. pubescens SPHITG. LINNÉ beschrieb 5 (6) Gossypium-Arten, DE CANDOLLE 16, ROHR (1807) 29 (34), TODARO (1877) 54, PARLATORE (1866) 7 (9), nämlich: Gossypium herbaceum L., G. arboreum L., G. sandvicense PARL. (= G. religiosum FORST.), G. taitense PARL., G. hirsutum L., G. barbadense L. und G. religiosum L. MASTERS 7, ROYLE 4, BENTHAM-HOOKER 3. Jetzt nimmt man meist 9–10 an.
In Kultur sind aber nur fünf Arten. Von diesen stammen die drei wertvollsten, die groß- und weiß- bzw. gelbblütig sind, aus Amerika, nämlich: Gossypium barbadense (Sea Island Baumwolle) aus Westindien (liefert unter andern Sea Island, Barbados und New Orleans Cotton), G. hirsutum (Upland Baumwolle) aus Mexiko und G. peruvianum (Nieren-Baumwolle) aus Südamerika (liefert die Peru-, Kidney- und Brasilbaumwolle). Die vierte in Indien bevorzugte Kulturart G. herbaceum (Indische Baumwolle) stammt aus Ostindien, und die fünfte, G. arboreum (Purpurblütige Baumwolle, das Gossipion des PLINIUS), wahrscheinlich aus Afrika. Letztere, die nur wenig in Ägypten, Arabien und Indien kultiviert wird, findet sich wild in Abyssinien und dem oberen Nilgebiet. Besonders von der Sea Island Baumwolle gibt es zahlreiche Spielarten. G. religiosum (s. oben) stammt aus China und liefert die gelbe Nankingbaumwolle. Vielfach sind durch Kreuzung von Arten, Unterarten und Rassen, Hybriden, erzeugt worden, so z. B. zwischen der in Florida heimischen Art mit der Common okza genannten Kulturrasse. Auch die Caravonica scheint eine Hybride zu sein.
G. herbaceum wird in den Tropen 2 m, in der gemäßigten Zone 60–90 cm hoch. Sie wird in Südeuropa und in Zentralasien, in großer Menge in der Bucharei, in Ostasien bis Nordchina, Korea und Japan, auf Cypern, in Syrien und Kleinasien gebaut. Die vorderindischen Produkte heißen Surats. Der Stapel ist mäßig lang und stark, meist weich seidenartig. Die Nordwestprovinzen und Assam sind für die Produktion weniger wichtig. Die indische Art wird auch in Zentralasien und China gebaut, sowie in Afrika, den Mascarenen und etwas auch in Zentralamerika und Chile. «Von wenigen Ausnahmen abgesehen sind alle Baumwollpflanzen, welche in Asien angebaut werden, nur als verschiedene Formen von G. herbaceum zu betrachten» (SEMLER). Die für Indien wichtigste Form ist G. Wightianum. Von den amerikanischen Arten liefert G. hirsutum, die in den Südstaaten gebaut und 2–2½ m hoch[S. 231] wird, die Upland-Baumwolle, die die größte Menge der Baumwolle des Welthandels liefert. Die Sorte Orleans wird mehr in Louisiana und Mississipi gebaut, die Sorte Georgian Upland (Boweds) in Georgia und Carolina. Die dritte ist die kurzstapelige Texasvarietät, die in geringer Menge auch im Mittelmeergebiet, Ägypten, Syrien, in Westafrika, den Mascarenen, in Süd- und Ostasien und in Queensland kultiviert wird, eine grünsamige Sorte in Westindien und Venezuela. Einige Sorten haben gelbe Wolle. In China und Hinterindien, aber auch in Ägypten und Italien wird G. religiosum, die Nangkingbaumwolle, gebaut.
Den längsten und feinsten Stapel haben die Sorten der Sea Island-Baumwolle von G. barbadense, die 2–2½ m hoch wird und in den feuchten Küstengebieten von Georgia, Süd-Carolina und Florida und den Inseln (Sea Islands) gebaut wird. Sie wird auch in Westindien, Zentral- und Südamerika, Peru und in bedeutender Menge in Ägypten kultiviert, wenig in anderen Teilen des Mittelmeergebietes, Westafrika, Zentralafrika, Bourbon, Indien, Süd-China und den polynesischen Inseln. Im Stapel gegen diese zurückstehend ist G. peruvianum (Nierenbaumwolle), die 2 bis 5½ m hoch wird. Sie wird besonders in Peru und Brasilien kultiviert, weniger im übrigen Südamerika und den Antillen, dem Mittelmeergebiet, Ägypten, Westafrika, Südasien. Maranham, Bahia, Maceio sind die beliebtesten Sorten.
G. arboreum L. ist baumartig. Sie wird in der Nähe der indischen Tempel angepflanzt. Sie ist bei den Hindus eine heilige Pflanze. Aus ihrer Baumwolle wird der heilige dreiteilige Faden der Brahmanen, «dieses Sinnbild ihrer göttlichen Dreiheit», gesponnen. Dieses G. arboreum L. ist aber nicht identisch mit dem Gossypium arboreum AUBLET (G. religiosum L., G. vitifol. LAM., G. peruvian. CAVAN., G. brasiliense MAC FADYEN), die aus Guayana stammt.

Baumwollernte in Georgia U. S. A.
[Nach Stromeyer & Wyman.]
Beschreibung der Stammpflanze. Die Arten der Gattung Gossypium sind Kräuter, Sträucher (I, Fig. 95–98) oder Bäume mit meist 3–9lappigen Blättern und großen ansehnlichen Blüten, die ein bleibendes Hochblattinvolukrum (Außenkelch) aus drei meist großen und gezähnten Blättern besitzen (Fig. 84). Die Staminalsäule unter dem Griffel meist nackt, der Griffel am Ende keulig, die Cotyledonen stark gefaltet (Fig. 87) mit der geöhrten Basis der Würzelchen umfassend. Die Früchte sind drei- (bis fünf-) fächerige, dunkelbraune, walnußgroße Kapseln, die fachspaltig aufspringen. Die 5–10 unregelmäßig nierenförmigen Samen sind mit langen weißen, einzelligen Haaren bedeckt. Nicht alle Epidermiszellen sind aber zu diesen langen Haaren ausgewachsen, ein Teil wächst nur zu kürzeren aus, die technisch auch nicht völlig wertlos sind.[S. 232] In der Union werden nämlich diese kurzen Haare der Grundwolle als Linters (im Gegensatz zur Lint-Baumwolle) bezeichnet und dienen nach SCHANZ zur Herstellung von Hut- und anderen Filzen, Vigognegarne, gewöhnliche und Verbandwatte, Politurmaterial usw. Bei G. barbadense und peruvianum ist der Same nur mit langen Haaren bedeckt, bei G. hirsutum, herbaceum und arboreum sitzt zwischen den langen Haaren noch ein kurzer Filz («Grundwolle»), bei einer besonders in China kultivierten Varietät von G. herbaceum sind die Haare gelb gefärbt (Nangkingbaumwolle), die Grundwolle sogar tiefgelb. Bei G. barbardense, wo die Grundwolle fehlt, erscheint daher der Same glatt und schwarz, bei G. herbaceum und arboreum weißfilzig, bei hirsutum grünfilzig. Die Kapsel ist bei der ägyptischen Art drei-, bei der nordamerikanischen vier- bis fünfteilig. Zur Zeit der Reife ist das ganze Innere mit den haarbedeckten Samen erfüllt und diese sprengen schließlich die Kapsel auf, so daß der Wollbausch hervorquillt. Ob hierbei auch die fortschreitende spiralige Drehung, die von der Spitze des Haares her, die zuerst austrocknet, erfolgt, mitwirkt, wie SEMLER meint, ist noch zu erweisen. Sicher ist, daß die Torsionen des Haares erst im letzten Stadium der Reife eintreten, also bei sog. «unreifen Fasern» weniger zu finden sind, die sich überhaupt durch geringere Wanddicke, das Fehlen der verdickten Ränder und stärkeres Zusammenfallen von den reifen unterscheiden. Am vollkommendsten ausgebildet, d. h. am reifsten, sind die Haare der ägyptischen und nordamerikanischen Baumwolle.
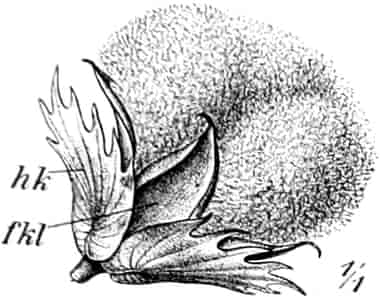
Gossypium spec. Frucht zur Reifezeit.
[Nach Gilg.]
Die Gattung Gossypium ist über die Tropen beider Welten verbreitet, nicht aber die einzelnen Arten. G. herbaceum L. (sansk. karpassi, hind. kapas) ist in Asien (Birma, Irawaddi, ind. Archipel, Sindh) heimisch. Über Europa gelangte es um 1770 nach Nordamerika. G. arboreum L. ist im subtropischen Afrika zuhause (Guinea, Abyssinien, Sennar, Ober-Ägypten) und G. barbadense L. in den Tropen Amerikas.
Lit. PARLATORE, Le specie dei cotoni. Firenze 1866, mit Taf. — TODARO, Relatione della cultura dei cotoni in Italia seguit de una Monografia del genere Gossypium. Roma 1877/78, mit Taf. — G. WATT, The wild and cultivated Cotton plants of the world. London 1907 and Dictionary of economic products. — MIDDLETON, Descript. of cert. indian botan. forms of cotton. Agricultur Ledger Nr. 8, 1895. — SADEBECK, Kulturgew. d. deutsch. Kolon. Jena 1898. — Übersicht der Arten in WIESNER, Rohstoffe, 2. Aufl. 1903. — Abbild. bei RUMPF, Herb. Amb., PARLATORE und TODARO (s. oben), sowie WIGHT, Illustr. Ind. Bot. t. 27 und 28. — Ferner von Gossypium herbac.: in BERG-SCHMIDT, Atlas t. 106 (dort auch d. system. Literatur). Abbild. von G. barbadens.: in PABST-KÖHLER, Medizinalpfl. t. 158 und BENTLEY-TRIMEN, Medicinal plants t. 37 (dort weitere Literatur). Alle drei Arten: in ENGLER-PRANTL, Pflanzenfam. III, 6, S. 51.
Pathologie. Auf der Baumwollpflanze sind zahlreiche parasitische Pilze beobachtet worden, von denen mehrere einen grösseren Schaden stiften. Zu diesen gehört Neocosmospora vasinfecta, eine Hypocreacee, welche die ganze Pflanze zum Absterben bringt; dasselbe wird auch von einem Fusarium angegeben. Mehrere Pilzarten bilden sich auf den Kapseln aus, so rufen Phyllosticta gossypina und Alternaria macrospora Schwärzungen der Fruchtknotenwand hervor, auch kennt man eine Bakterienkrankheit der Baumwollfrüchte. — Die einzige Angabe eines Pilzvorkommens speziell auf den Samen bezieht sich auf eine Torula incarcerata CKE. (ED. FISCHER)
Über die Schädlinge der Baumwollpflanze vgl. SEMLER, Tropische Agrikultur. Der gefährlichste tierische Schädling ist ein Verwandter der Seidenraupe, die sog. Baumwollraupe oder Baumwollmotte, eine Noctuidee, Aletia xylina (Abbild. bei SEMLER), dann die zur gleichen Familie gehörige Kapselraupe (Bollworm) Heliothis armigera (Abbild. bei SEMLER).
[S. 233]
Kultur und Erntebereitung. Die Sea-Islandstaude wird jetzt kultiviert auf den Inseln an der Küste von Georgia und Florida und in Florida, in Ägypten (Messifieh), auf den Südseeinseln, in Venezuela und Peru; die Uplandstaude in Georgia, Süd-Carolina, Alabama, Texas, Mississipi, Louisiana, Pernambuco, an der Nord- und Ostküste von Brasilien, Sao Paolo, San Salvador, den westindischen Inseln, Venezuela, Peru und in Ägypten (Siftah); die indische Staude in Vorderindien, Natal, Ägypten (Zagazig, Mansurah, Beharah) Vorderasien und Griechenland. Die australische Caravonica, deren botanische Zugehörigkeit unbekannt ist, in Nordaustralien (Queensland), auf den neuen Hebriden, in Ostafrika, Ägypten, Mexiko und Peru.

Walzengin der Sächsischen Maschinenfabrik Hartmann in Chemnitz.
Die Baumwollstaude ist eine ziemlich tiefwurzelige, tropische und subtropische Tieflandpflanze, die eine möglichst gleichmäßige Temperatur (18–26° C.), viel Feuchtigkeit bei anhaltendem Sonnenschein verlangt, also am besten in Küstenländern angepflanzt wird. G. barbadense wird besonders an den Küsten von Georgia und Florida, auf Sea Islands und in Westindien gebaut, gedeiht aber auch in Ägypten. Die nördlichen und südlichen Grenzen sind etwa der 36° n. und s. Br. (bzw. 30° s. Br. bis 41° n. Br.). Man pflanzt die in Samenbeeten erzogenen Pflänzlinge in Abständen etwa wie die Kartoffel (ein junges indisches Baumwollfeld sieht denn auch etwa wie ein Kartoffelfeld aus), oder legt Reihenpflanzungen (Kammkultur) oder sog. Hügelpflanzungen an, bei denen die Samen direkt an Ort gebracht werden. An jeder Pflanzstelle läßt man aber nur die kräftigste Pflanze sich entwickeln. Obwohl die Baumwollpflanze ein mehrjähriges Gewächs ist, zieht man es doch vor sie alljährlich neu auszusäen. 1 Hektar produziert 60–300 kg Baumwolle. Zwei Monate nach der Aussaat beginnt die Baumwollstaude zu blühen, nach weiteren 2½–3 Monaten ist die Kapsel reif. Die Carpelle rollen sich alsdann nach außen zurück und es tritt der große weiße lockere Ball der haarbedeckten Samen hervor (Fig. 84). Nicht alle Kapseln einer Staude öffnen sich gleichzeitig. Sobald so viel Kapseln aufgesprungen sind, daß[S. 234] ein Arbeiter 25 kg Baumwolle am Tage sammeln kann, wird mit der Ernte begonnen, die bei möglichst trockenem Wetter erfolgt (I, Fig. 96 u. 97). Ein Arbeiter kann im Maximum 75 bis 100, selten bis 150 kg sammeln. Eine Baumwollstaude liefert etwa 1¼ kg Baumwolle. Man hat auch mechanische Erntemaschinen eingeführt (vgl. I, S. 94), aber noch ist das Problem nicht gelöst. Der Arbeiter nimmt mit einem Griff den Bausch aus der geöffneten Kapsel (Fig. 83) und sorgt dafür, daß nicht Kapselteile, Blätter und anderes mit geerntet werden. Die die Baumwollbäusche enthaltenden Säcke werden dann auf Tennen entleert und der Inhalt getrocknet. Dann kommen sie in das Ginhaus, um dort zunächst eine Reinigungsmaschine (Seed Cotton Cleaner oder Exhaustorenreiniger) zu passieren und dann dem Gin (abgekürzt aus engine = Maschine) zugeführt zu werden. Das Ginen (Entkörnen, Egrenieren oder Egrainieren), d. h. das Trennen von Samen und Wolle, erfolgt ebenfalls durch Maschinen, deren älteste, jetzt meist durch neuere Systeme verdrängte, die churka (manganello) ist, die noch jetzt da und dort in Indien benutzt wird. Der Sägegin wurde 1792 von WHITNEY erfunden. Neueren Datums ist der Walzengin (Fig. 85). Die Maschinen enthalten entweder enggestellte Walzen (Walzengin, in Ägypten und Indien in Gebrauch), die die Haare fassen, während die Samen, die nicht folgen können, abgeworfen werden oder stumpfe, kreisförmige Sägeblätter (Sägegin, in Nordamerika in Gebrauch), deren Zähne durch ein enges Gitter greifen und die Haare von den auf dem Gitter hinabgleitenden Samen abreißen. Durch das Ginen wird die Samenbaumwolle zur Lintbaumwolle. Meist ist das Verhältnis von Samen zu Wolle wie 2 : 1, im besten Falle wie 6 : 4. Die egrenierte Baumwolle wird dann in Hanf- oder Jutesäcke oder Häute gefüllt und in hydraulischen oder Plattenpressen zu Ballen von 30 : 38 : 75 cm = c. 56 kg oder 135 : 70 : 80 cm = c. 180–220 kg gepreßt, die mit eisernen Bändern umschnürt werden (Fig. 86).

Mittelst hydraulischer Pressen hergestellte Baumwollenballen zum Verladen bereit (St. Louis).
Die Baumwolle wird noch jetzt, trotzdem auch noch der letztjährige Spinnerkongreß wieder Handel nach Gewicht verlangte, meist nach Ballen gehandelt. Diese aber besitzen ein sehr schwankendes Gewicht. Bei Sea Island finde ich z. B. Gewichte[S. 235] von 373, 375, 377, 384, 388 lbs angegeben; bei Upland 400, 450, 500, 503.69, 510.24, 519, 535 lbs (engl. Pfund), bei afrikanischer 400, 441, 500, 513. Der Standardballen wird zu 500 (engl.) lbs angenommen.
Der Wert der Baumwolle wird beurteilt nach der Länge des Fadens, dem Stapel, dem Grade der Seidigkeit (abhängig von der Glätte der Cuticula) und der Feinheit (abhängig vom Durchmesser), der Weichheit, der Reinheit und Homogenität (abhängig von der Anwesenheit toter Baumwolle und Frucht- bzw. Samenresten), von der Festigkeit und der Farbe.
Als langstapelig wird eine Baumwolle bezeichnet, die über 3,5 cm, als mittelstapelig eine solche, die c. 2,5–3,5 cm, als kurzstapelig endlich eine solche, die unter 2 cm Stapellänge besitzt. Die Standardmuster zeigen folgende mittlere Stapellängen in mm: Sea Island 42, ägyptische (Mako, Jumel) 38, Pernambuco (brasil) 32, amerikanische (exkl. Sea Island) 28, Port Natal 28, indische 23 und 17.
Der Stapel der indischen Baumwolle ist kurz aber fein, die Arboreumbaumwolle hat einen seidenartigen Stapel, doch ist die Wolle schwer vom Samen zu trennen.
In Europa wird die eingeführte Rohbaumwolle mit besonderen Maschinen gereinigt, von allen Verunreinigungen befreit, gekrempelt und gekardet (kardiert) — bisweilen unter Zusatz von Olivenöl —, dann aufgelockert und durch Benzol oder verdünnte Natronlauge bzw. Soda vom Fett befreit, mit verd. Schwefelsäure, Seifenwasser und Wasser gewaschen und dann gebleicht, und in den sog. Wattemaschinen aufgelockert (coton cardé ou ouate). Um Baumwolle mit «knirschenden Griff» herzustellen, wird ihr Stearinsäure zugesetzt.
Die für arzneiliche Verwendung bestimmte gereinigte Baumwolle muß stets entfettet werden. Nicht entfettete sinkt in Wasser nicht unter und saugt Wasser nur schwer auf, und in der guten Aufsaugefähigkeit beruht der Wert der Baumwolle. Auch der starke Luftgehalt hindert das Untersinken. Das Entfetten und Entlüften erfolgt durch Kochen mit verd. Sodalösung oder Seifenlauge (s. oben).
Die Darstellung der gereinigten Baumwolle (Coton dépuré, Purified cotton, Cotton wool, Wound dressing cotton) geschieht in der Weise, daß kardierte, möglichst langstapelige Rohbaumwolle in sehr verdünnte, siedende Pottasche oder Sodalösung getaucht und dann sofort ausgewaschen und ausgepreßt und darauf mittelst 5% Calcium- oder Natriumhypochloritlösung gebleicht wird. Dann wird mit Wasser gewaschen, bis Lackmuspapier nicht mehr verändert wird, getrocknet und gekrempelt.
Zu Verbandwatte werden meist die Abfälle der Baumwollspinnereien (die sog. Kämmlinge) verarbeitet. Sie werden auf dem Öffner von Unreinigkeiten befreit, auf der Krempelmaschine gekämmt und zu Vließen verarbeitet Die sog. Rohwatte wird nacheinander mit Harzseife, Natronlauge oder Soda, Chlorkalk (oder Eau de Javelle), salzsäurehaltigem und reinem Wasser behandelt, getrocknet und zu Vließen verarbeitet (A. MEYER).
Mit Benzin entfettete Baumwolle ist als Verbandstoff nicht verwendbar.
Lit. BECKMANN, Vorber. z. Waarenkunde I. Göttingen 1793. — BAINES, history of cotton manufacture in Great Britain. London 1835. — BENNO NIESS, Die Baumwollspinnerei in allen ihren Teilen. Weimar 1868. — A. OPPEL, Die Baumwolle nach Geschichte, Anbau, Verarbeitung und Handel. Leipzig 1902. — SEMLER, Tropische Agrikultur. — ECKARDT, Der Baumwollbau. 1906. Beiheft VII z. Tropfenpfl. — YVES HENRY, Le Coton. Publ. d. Gouverm. génér. de l’Afrique occid. franc. 1906. — KICK in KARMARSCH und HEEREN, Technisches Wörterbuch 1876. — VON KAPFF, Über Wolle, Baumwolle, Leinen, natürliche u. künstliche Seide. Leipzig, FOCK. 1909. — E. FRANK, Handb. d. Baumwollindustrie. — C. HEINE, Die Baumwolle (nach Cotton[S. 236] von BURKELT and HAMILTON). — KUHN, Die Baumwolle, ihre Kultur usw. 1892. — H. LECOMTE, Le Coton. Paris 1899. — TOBLER in Kolonialbotanik. — T. F. HANAUSEK, Artikel Baumwolle in Realenzykl. d. Pharm. II, 590. — WIESNER, Rohstoffe. — PASSON, D. Kultur der Baumwolle mit besonderer Berücksicht. derjen. von Brasilien. Nach dem gleichnamigen Werke von D’UTRA, Stuttgart 1910. — M. SCHANZ, Die Baumwolle in d. Verein. Staat. Beiheft z. Tropenpflanzer 1908. — YVES, Le coton aux États-Unis-Journ. Agr. pr. pays chauds 1903 (mit einer Übersicht der Varietäten). — M. SCHANZ, Baumwollbau in deutschen Kolonien. Berlin 1910. — BUSSE, Zeitfragen d. Landw. im trop. Afrika m. bes. Berücks. d. Baumwollbaus. Tropenpflanzer 1907. — Weit. Lit. unter Anatomie. — Der Baumwollbau und -handel im Mittelalter bei HEYD, Levantehandel II, 572.
Produktion. Das wichtigste Produktionsland der Baumwolle ist Nordamerika, wo in Texas, Georgien, Alabama, Mississippi, Süd-Karolina, Arkansas, Louisiana, Nord-Carolina und Tennessee Baumwolle gebaut wird. Der Jahresertrag betrug: 1906 über 13 Mill. Ballen (vgl. I, S. 184). Hauptausfuhrhäfen sind New Orleans (nach Liverpool wichtigster Baumwollmarkt der Erde), Galveston, Savannah, Charleston, Wilmington, Mobile, Pensacola, New York, Norfolk, Boston, Baltimore.
In Mittelamerika baut Haiti, Portorico, Jamaika, Martinique, Guadeloupe. Die Produktion geht, obwohl das Produkt vorzüglich ist, zurück.
In Südamerika baut Guyana, Columbien, Venezuela, Peru und besonders Brasilien Baumwolle. Hauptausfuhrhäfen sind: Barranquilla und Sabanilla, Puorto Cabello, Pernambuco, Maceió, Ceará.
In Ostindien, dem zweitwichtigsten Produktionslande besonders für ordinäre Sorten, baut Britisch Indien in Bombay, Sind, Berar, Madras, den Nordwestprovinzen, Haiderabad, den Zentralprovinzen, Pandschab und Radschputana Baumwolle (am meisten Berar). Die wichtigsten Produktionsgebiete der Baumwolle in Vorderindien liegen in den Ebenen von Guzerat und Katkiawar, dem Hochland von Dekkan, den tiefen Tälern von Berar und den Zentralprovinzen. Hier steht der Baumwollbau in Kleinbetrieb bei den eingeborenen Bauern und dies bedingt die Minderwertigkeit des Produktes gegenüber der amerikanischen und ägyptischen Baumwolle. Hauptausfuhrhäfen sind: Bombay, Calcutta, Karatschi, Tuticorin, Madras.
In China ist die Kultur umfangreich, reicht aber nicht zur Deckung des großen Bedarfes. Der Baumwollbau in China reicht bis ins XI. Jahrh. zurück. Er hat sich allmählich über große Teile des Reiches verbreitet, wird aber besonders in den Küstenländern betrieben.
Die Kultur in Japan ist ebenfalls beträchtlich, doch deckt sie nicht den Bedarf und muß Japan Baumwolle aus China importieren.
In Persien (Bezirk von Iphahan), Transkaukasien und Vorderasien ist die Kultur gering. In Australien und den Südseeinseln steigend. Australien (Queensland) baut die Caravonica. Von der vorzüglichen Caravonicabaumwolle ist jetzt (1910) sowohl wollige wie seidige im Handel.
In Afrika baut besonders Ägypten viel Baumwolle im Nildelta, überhaupt im Küstengebiet. Zuerst G. herbaceum aus Indien, dann Anfang des XIX. Jahrh. eine nubische Spielart (Jumel, Maho, Mako), jetzt die Sea-Island-Art und Caravonica. Die Baumwolle ist gegenwärtig die größte Finanzquelle Ägyptens. Der Ertrag beläuft sich auf über 200 Mill. Frs. Die ägyptische Baumwolle, die seidenartigen Glanz besitzt und japanischer Seide gleicht, macht der amerikanischen Baumwolle erfolgreich Konkurrenz. Die besten Baumwollsorten kommen jetzt aus Ägypten. Die Algerische Kultur hat aufgehört. In den deutschen Kolonien breitet sich die Kultur aus. Die Baumwollnot[S. 237] im Jahre 1909, die den Preis der amerikanischen Rohbaumwolle von 9,25 auf 16,15 Cents hinauftrieb, hat die Aufmerksamkeit der deutschen Konsumenten auf die Baumwollkulturen in den deutschen Kolonien gelenkt (vgl. SUPF, Deutsch-koloniale Baumwollunternehmungen. Beihefte z. Tropenpflanzer. 1910). Deutsch-Ostafrika lieferte 1908 erst 1081 Ballen = 540298 Pfund, Togo 1908/09: 2337 Ballen à 500 Pfund.
Die europäische Kultur in Griechenland, Italien, Spanien und der Türkei ist ohne Bedeutung. Immerhin produziert z. B. Griechenland (von G. herbaceum) jährlich 3840000 kg (EMMANUEL).
Das Ansteigen der Baumwollproduktion veranschaulichen folgende Zahlen. Die Weltproduktion betrug 1791: 213,4, 1834: 408,5, 1880/84: 2274,3, 1891/99: 3260,8 Mill. kg pro Jahr. Obenan in der Produktion steht jetzt Nordamerika, weit dahinter folgt erst Ostindien und dann mit etwa gleichen Mengen China und Ägypten. Die Baumwollernte der Erde erreichte 1906: 18,6 Mill. Ballen = 3682,8 Mill. kg. 1908/09 betrug die Baumwollernte in 1000 Ballen (à 400 engl. Pfund): Amerika: 13829, Indien: 4665, Ägypten: 910, Brasilien u. and. Länder: 3063. — Total: 22467. Sie steht damit von allen uns interessierenden Produkten obenan («KING COTTON»). Der Baumwollverbrauch der Erde betrug 1. Sept. 1907 bis 1. Sept. 1908 (exkl. ägyptischer B.): 15121281 Ballen (der Vorrat 1. Sept. 1908: 7574130 B.). Der Verbrauch ägyptischer B. im gleichen Zeitraum: 658256 B. 1909 liefen in der ganzen Welt 130795927 Baumwollspindeln, davon in Großbritannien c. 53½ Mill., in Nordamerika c. 27½ Mill., in Deutschland c. 10 Mill. 1909 entfielen von der Weltproduktion 66% auf die Vereinigten Staaten, 13% auf Ostindien, 10% auf Mittel- und Ostasien, 7–10% auf Ägypten und 4% auf alle anderen Länder. Nordamerika exportierte Sea Island B. 1908: 33042 bales (= 12699567 lbs), 1909: 25939 bales (= 9740806 lbs) und Upland and other 1908: 7401538 bales (= 3804299126 lbs), 1909: 8551789 bales (= 4438244396 lbs). Die Produktion Nordamerikas betrug 1908/09: 13829000 Ballen (1909/10 10–11 Mill.). Die indische Baumwollernte betrug 1908/09: 3643000 Ballen (zu 400 engl. Pfund). Die indische Baumwollernte 1909/10 wird auf 4289000 Ballen geschätzt. Ägypten produziert jetzt (1910) 5–6 Mill. Cantars pro Jahr. Rußlands Baumwollenbau macht Fortschritte. 1907 lieferte russ. Zentralasien bereits c. 5750000 Pud, Transkaukasien 800000 Pud. Java exportierte 1908 4221002 kg ungereinigte Baumwolle.
Deutschland importierte 1909: 4559207 dz Roh-Baumwolle besonders aus den Ver. Staaten (3½ Mill.), dann aus Brit. Indien und Ägypten, geringere Mengen aus Niederl. Indien, der asiat. Türkei, China, Deutsch-Ostafrika, Togo, Peru und Haiti. Hamburg importierte 1908 seewärts 1125919 dz Baumwolle, davon aus den Ver. Staaten: 491132, Brit. Ostindien: 486678, Ägypten: 80124, China: 17466, kleinere Mengen aus Ostafrika, Westafrika, Kleinasien, Haiti, Mexico, Peru, Brasilien, Venezuela, St. Croix, Niederl. Indien, den Gesellschaftsinseln, St. Thomas, Madagaskar, Nicaragua, Portorico, Jamaica, St. Domingo. Die Einfuhr an Baumwollsamen betrug 120492 dz.
Lit. Tropenpflanzer 1907–1910. — Jahrbuch u. Kalender für die Baumwollindustrie. Leipzig, DEGENER (1909, 30. Jahrg.).
Handelssorten. Nordamerikanische Sorten sind: Sea Island (Lange Georgia) — Louisiana — Alabama (Mobile) — Florida (Pensacola) — Kurze Georgia, Upland — New Orleans — Tennessee — Texas. Ernte im September.
Mittel- und südamerikanische Sorten sind: Molinos (Mexiko) — Pernambuco (Brasilien) — Ceara — Maceio — Bahia — Maranham — Surinam (Guyana) — Demerary — Berbice — Cayenne — Varinas (Columbia) — Barcelona — Cartagena — Lima und Payta (Peru) — Haiti — Barbados — Portorico — Guayanilla — Cuba.
Asiatische Sorten: Surate (Dollerah, Ostindien) — Madras — Bengal — Persische — Nangking.
Afrikanische Sorten: Maco (Jumel, Ägypten) — Bourbon.
Australische Sorten: Die beste australische Sorte ist Caravonica (woll- und seidenartig), die in Nordaustralien gewonnen wird. Von ihr werden Alpacca, Silk und[S. 238] Wool unterschieden. Caravonica gilt jetzt als die beste Baumwolle. Ihr gleichwertig ist die neue (1909) Mamara.
Levantinische Sorten: Smyrna — Makedonien.
Europäische Sorten: Griechische — Motril (Spanien) — Castellamare (Italien). Ohne Bedeutung: neapolitanische, römische, sizilianische.
Die Hauptmärkte für Baumwolle in Europa sind: Liverpool, Bremen, Hamburg, Havre, Marseille, Antwerpen, Rotterdam, Dünkirchen, Barcelona, Triest, Venedig, Neapel, Genua. Bremen ist erster deutscher Baumwollhafen.
Karte der Baumwollproduktion der Erde in LANGHANS, Kleiner Handelsatlas 1895, Nr. 10 u. 11.
Anatomie. Die Baumwollsamen sind rundlich, 7–9 mm lang, 3–5 mm dick. Die Epidermiszellen der Samenschale sind zum Teil zu den Baumwollhaaren ausgewachsen. Der Haarfilz bedeckt entweder die ganze Samenoberfläche (G. arboreum u. hirtum) oder liegt nur an der Basis und der Spitze (G. religios.). Von der Fläche betrachtet erscheinen die Epidermiszellen etwas unduliert. Oft sind die derbwandigen, einen braunen Inhalt führenden, nicht zum Haar ausgestülpten Zellen sternförmig um die Haarzelle gruppiert (HANAUSEK). Bei Samen mit Grundwolle sind nahezu alle Epidermiszellen zu Haaren ausgestülpt. Dann folgt die Pigmentschicht. Sie besteht aus 4–5 Schichten tangential gestreckter, farbstofführender Parenchymzellen. Auf diese folgt die Kristallzone, ein (oder zwei) Reihen verdickter, bisweilen gut ausgebildete Kristalle führender isodiametrischer Zellen. Die bis hierher beschriebenen Schichten gehen aus dem äußeren Integument hervor (SCHLOTTERBECK). Die nächste Schicht besteht aus stark verdickten Palissaden-Sklereïden, deren kleines Lumen ziemlich weit außen liegt. Die dann folgende, reich durchlüftete Nährschicht ist stark obliteriert; außen führen die ziemlich dickwandigen Zellen Farbstoff. Die innerste Schicht des inneren Integumentes (SCHLOTTERBECK) besitzt Zellen, die zierliche zentripetale Wandverdickungen zeigen (Fransenzellen HANAUSEKS, cellules plissées ou frangées PERROT). Dann folgt ein sehr schmaler Nucellusrest, ein meist nur einschichtiger Endospermrest und dann die außerordentlich stark gefalteten Cotyledonen, die im Querschnitt dunkel punktiert erscheinen, da sie zahlreiche, eine blau- oder grünlich-schwarze Masse enthaltende schizogene (PERROT oder lysigene HANAUSEK, VON HOEHNEL) Sekretbehälter führen. Sie enthalten Oxalatdrusen, Öl und Aleuron. Auf der Oberseite liegt eine Palissadenschicht. Das Sekret ist nicht näher studiert. Es löst sich in konzentrierter Schwefelsäure mit trüb-blutroter Farbe (T. F. HANAUSEK). Auf der Epidermis der Cotyledonen sitzen Haare ähnlich den MITSCHERLICHschen Körperchen (PERROT).
Lit. FLÜCKIGER, Über d. Baumwollsamen. N. Jahrb. f. Pharm. 1871. — HARZ, Landwirtsch. Samenkunde II, 741. — KOBUS, Kraftfutter und s. Fälsch. Landw. Jahrb. 13, 1884. — V. BRETFELD, Anatom. d. Baumwolle- u. Kapoksamen. Journ. f. Landw. 35, 1887, 29. — T. F. HANAUSEK, Zur mikrosk. Charakt. d. Baumwollsamenprodukt. Zeitschr. Öster. Apoth. Ver. 1888, 569 u. Samen in WIESNER, Rohstoffe. — GUIGNARD, Rech. sur le développem. de la graine etc. Journ. d. Botan. 1893. —ZWALUWENBURG and SCHLOTTERBECK, Anatomy of the cotton seed and the development of its seed coats. Proc. Amer. pharm. Assoc. 1899, 185 (mit 1 Taf.) (Entwicklungsgeschichte). — HANAUSEK-WINTON, Microscopy of technical products p. 59. — PERROT, Bull. sc. pharmacol. 1902, 336. — GREENISH, Struct. of cotton seed. Festschr. f. Vogl. — Die Preßkuchen auch in COLLIN-PERROT, Residus industriels 1904.
Gossypium spec.
1 Längsschnitt und 2 Querschnitt durch den Samen, C die gefalteten Cotyledonen, R Radicula.
[Nach J. Moeller, Mikroskopie.]
Mikroskopisch betrachtet erscheint das Baumwollhaar besonders bei den indischen Sorten als ein breites, bisweilen gekörneltes Band, das häufig um seine Achse korkzieherartig[S. 239] gedreht ist (Fig. 88) und drei- bis viermal breiter ist als dick. Bei den feineren, dünneren Sorten aus Nordamerika und Ägypten ist das Haar wenig oder gar nicht zusammengedrückt, nur schwach seilförmig gedreht, ja auf weite Strecken fast zylindrisch, sehr dickwandig mit schmalem Lumen und wulstigen Rändern. Nach WIESNER soll sich die Torsion bei G. herbaceum über die ganze Länge, bei G. arboreum und barbadense nur auf den mittleren Teil erstrecken, bei versponnener Baumwolle ist bisweilen gar keine Torsion mehr zu bemerken. Durch Salpetersäure wird die Drehung aufgehoben. Das Lumen ist immer klein. Es enthält Reste des Plasmas. Bedeckt ist das Haar mit einer sehr feinen Cuticula, die glatt ist oder Körnelung bzw. Streifung zeigt und bisweilen zart spiralig oder netzförmig gezeichnet ist (näheres bei WIESNER). Der wollige Charakter der Caravonicawolle wird durch eine sehr scharfe regelmäßige, feine spiralige Streifung, der seidige der Caravonicaseide durch dichte und feine wellige Streifung der Cuticula bedingt (T. F. HANAUSEK).
Das Baumwollhaar ist in der Mitte am breitesten (WIESNER), an der Basis schmäler. Die Spitze ist spitzkegelförmig, spatelförmig, abgerundet oder kolbenförmig, meist sehr dickwandig (VON HÖHNEL), bei der Caravonica oft schief abgeplattet (T. F. HANAUSEK). Die Dimensionen schwanken innerhalb bestimmter Grenzen, die Dicke von 10–42 mik (bei G. herbaceum 12–22, barbadense 19–28, arboreum 20–38, religiosum 20–40 mik, WIESNER). Die Länge (der Stapel) von 10–40 mm (nach BOLLEY: 25–60 mm, nach WIESNER bei barbadense: max. bis 51 mm, nach SADEBECK bei Sea Island: max. 41–52 mm). Genauere Angaben über Dicke und Stapellängen der Handelssorten bei HÖHNEL. Die Stapellängen betragen (nach HÖHNEL) bei G. barbadense (Sea Island) 40,5, G. b. (Brasilien) 40, G. b. (Ägypten) 38,9, G. arboreum (Indien) 25, G. herbaceum (Makedonien) 18,2, G. herbac. (Bengalen) 10,3 mm. Bei Caravonica (nach T. F. HANAUSEK) bis 45 mm. Bei der Breitenbestimmung gibt man das Breitenmaximum und die häufigste maximale Breite an (WIESNER).
Baumwollhaare, oben: Querschnitte.
[Nach von Hoehnel.]
An der Basis ist das Haar, da es vom Samen abgerissen wird (s. oben), meist offen. Eine Ausnahme macht die Caravonicabaumwolle, bei der (nach T. F. HANAUSEK) die verholzte Haarbasis erhalten ist, das Haar wird bei ihr also aus der Epidermis herausgezogen, nicht abgerissen. In der Mitte, wo das Haar auch am breitesten ist, ist das Lumen am größten und die Wand relativ dünn; nach beiden Enden wird das Lumen enger und die Wand dicker. Die Dicke der Wand ist bei der Baumwolle beträchtlich. Sie beträgt ⅓–⅔ des Durchmessers der Zelle. Die Baumwolle besitzt[S. 240] daher eine sehr bedeutende Festigkeit. Der Querschnitt der Baumwollhaare, die nie zu Gruppen zusammenhängen (wie einige Bastfasern), ist elliptisch, eiförmig, lineal, mitunter nierenförmig oder halbmondförmig, gekrümmt (Fig. 88) — niemals kreisrund oder polygonal; das Lumen der Umrißlinie entsprechend, linienförmig, schmal, länglich, niemals kreisrund. Schichtung fehlt oder ist nur schwach angedeutet. Nach Behandlung mit Jod-Schwefelsäure ist der Querschnitt meist breit-elliptisch oder unregelmäßig aufgequollen, das Lumen aber unverändert länglich; die Zellwand himmelblau, in den äußeren Partien dunkler; Cuticula und Inhalt undeutlich (T. F. HANAUSEK, VON HÖHNEL). Verschiebungen (im Sinne VON HÖHNELS), die bei den gebrochenen Fasern (Lein, Hanf) stets vorkommen, fehlen der Baumwolle.
Läßt man auf das Haar frisches konzentriertes, durch Auflösen frisch gefällten Kupferoxydhydrates in konz. Ammoniak bereitetes Kupferoxydammoniak einwirken (CRAMER, 1857), so quillt die Wand und läßt Schichtung hervortreten. Die Cuticula zerreißt oder bleibt in Form von Ringen da und dort erhalten, zwischen denen die Zellulosewand bauchig hervorquillt (Fig. 89). Der Inhalt zeigt, da sich das Haar bei dieser Behandlung verkürzt, Querfaltungen, doch treten die bauchigen Hervorquellungen bisweilen nicht hervor, z. B. nicht bei G. flavidum und religiosum (WIESNER), nicht bei gebleichten Baumwollwaren (Zwirn, Kattun), deren Fasern die Cuticula fast vollständig fehlt, nicht bei Anwendung von zu wenig konzentriertem Kupferoxydammoniak. Die Cuticula ist nicht immer gleich ausgebildet. Sie ist bald dünn und glatt (Sea Island, Lang. Georgia von G. barbadense), bald derb, gekörnelt und rauh (die matten, dickfaserigen Sorten von G. arboreum, herbaceum, religiosum). Die unreife (todte) Baumwolle ist schwerer in Kupferoxydammon löslich, färbt sich mit Jodjodkali nur hellgelb und ist nicht doppelbrechend (R. HALLER). Ihre Wand ist dünn, das Haar nicht gedreht, die Cuticula fein gestreift. Wird Baumwolle mit Kalilauge gekocht und dann ausgewaschen, so färbt sie sich mit Jodjodkalilösung rötlichbraun. Chlorzinkjod färbt die Wand, wenn sie dünn ist, so daß nur schwache Quellung eintritt, braunrot, bei starker Quellung violett bis blau (A. MEYER). Mit Jodjodkali behandelte Baumwolle wird durch konz. Schwefelsäure in eine blaue Gallerte übergeführt. Cuticula und Plasma werden hierbei gelbbräunlich. Phloroglucin-Salzsäure und Anilinsulfat-Schwefelsäure färben Baumwolle nicht. Nach Behandeln mit Ammoniak tritt auf der Cuticula feine Streifung hervor. Die seidenartig glänzende, besser färbbare mercerisierte Baumwolle, die dadurch erhalten wird, daß Baumwollgewebe oder Garne in stark gespanntem Zustande mit Ätzalkalien behandelt werden, besitzt keine Cuticula mehr, quillt daher mit Kupferoxydammon gleichmäßig, zeigt keine korkzieherartige Drehung und meist randlichen Querschnitt. Zur Herstellung der Schießbaumwolle eignet sich nur langstapelige Baumwolle (DAWSON).
Im polarisierten Lichte zeigt sich die Längsachse der Elastizitätsellipse in Baumwollfasern keineswegs parallel zu der Längsachse der Faser, sondern mehr oder minder stark in linksläufiger, seltener rechtsläufiger Windung gegen sie geneigt. Ausnahmsweise laufen streckenweise die Längsachse der Faser und der Elastizitätsellipse miteinander parallel (HERZOG).
Baumwollhaar in frischem Kupferoxydammoniak.
[Nach von Hoehnel.]
[S. 241]
Lit. REISSEK, Die Fasergewebe des Leins, Hanfs, der Nessel u. der Baumwolle. Wien 1852. — H. SCHACHT, Die Prüfung der im Handel vorkommenden Gewebe durch das Mikroskop u. durch chemische Reagentien. Berlin 1853. — CRAMER, Vierteljahrsschr. d. Naturf. Ges. Zürich 1857. — BOLLEY, Chem. Technologie der Spinnfasern. Braunschweig 1867. — VÉTILLARD, Etudes sur les fibres végétales. Paris 1876. — WIESNER, Mikroskop. Untersuch. Stuttg. 1872 und Rohstoffe, 2. Aufl. 1903. — A. MEYER, Drogenkunde. — SADEBECK, Kulturgewächse d. deutsch. Kolonien. Jena 1898. — VON HÖHNEL, Mikrosk. d. techn. verwend. Faserstoffe. 2. Aufl. 1905 und Über d. Baumwolle in Vortr. d. Vereins z. Verbreit. naturwiss. Kenntn. 1893. — T. F. HANAUSEK, Techn. Mikrosk. und Über die Caravonicawolle. Mitth. d. technolog. Gewerbemus. Wien 1910. — ED. HANAUSEK, Über Mercerisierung und Deformation d. Baumwolle, Mitth. aus d. Labor. f. Waarenk. d. Wien. Handelsakad. 1897, dann Dingl. polytechn. Journ. 1898, 310 u. Zeitschr. f. Nahrungsm., Hyg. u. Waarenk. 1898. — A. FRÄNKEL und P. FRIEDLÄNDER, Unters. über Seidenbaumw. Mitt. d. K. K. technol. Gewerbemus. Wien 1898. — BOWMAN, The structure of the Cotton fibre in its relation to technic. application. 2 edit. 1882. — H. KUHN, Die Baumwolle, ihre Kultur, Struktur u. Verarbeit. Wien 1892 (mit ausführt. Bibliographie). — O. N. WITT, Chem. Technologie d. Gespinnstfasern. Braunschweig 1888. — BERTHOLD, Zeitschr. f. Landw. Gew. Dobruschka 1883. — FOCKE, Mikrosk. Unters. d. bekannteren Gespinstfasern. Arch. Pharm. 1886, 224. — PERROT, Produits utiles des Cotonniers. Bull. sc. pharmac. 1902, p. 333 (m. anatom. Abbild.). — ZETZSCHE, Die wichtigst. Faserst. d. europäisch. Industr. 1904 (m. Mikrophotogr.). — BUSCALIONI, Sulle modificazioni provocate dai processi di mercerizzazione nei filati di cotone. Att. Ist. Univers. Pavia n. Ser. VII (dort die Literatur). — HERBIG, Beitr. z. Unters. d. Vorgänge, die beim Mercerisieren d. Baumw. stattfind. Zeitschr. d. ges. Textilindustr. III, 1899, 17. — HERZOG, Zur Kenntnis der Doppelbrechung d. Baumwollfaser. Zeitschr. Chem. u. Ind. d. Kolloide 1909, 245. — DAWSON, Polytechn. Zentralbl. 1866, 75. — R. HALLER, Chem. Zeit. 1908, 838. CROSS, BEVAN, KING und JOYNSON, Rep. on Indian Fibres and fibrous substances. London 1887.
Chemie. Die Baumwolle besteht aus fast reiner Zellulose. In den farbigen Sorten findet sich eine Spur eines gelben Farbstoffes. CHURCH und MÜLLER fanden in roher Baumwolle 91,15–91,35% Zellulose, 0,4–0,5% Fett und Wachs, 0,5 bis 0,67% stickstoffhaltige Substanz, 7–7,56% Wasser und 0,10–0,12% Asche. Cuticula 0,75%. Die Asche schwankt zwischen 0,1–0,5% (die Angabe von WIESNER: 1,85% ist zu hoch). Gute gereinigte Baumwolle soll nicht über 0,3% Asche enthalten (Ph. helv. IV). Baumwolle ist sehr hygroskopisch.
Das spez. Gewicht der lufttrocknen Baumwolle beträgt 1,47–1,50, die Festigkeit 2–5 g bei direkter Belastung.
Farbstoffe sind in der Baumwolle in sehr wechselnden Mengen enthalten, am wenigsten in den amerikanischen Sorten, am meisten in den chinesischen. Der Farbstoff scheint nicht in allen Baumwollsorten der gleiche zu sein. Sehr verdünnte Natronlauge löst beim Kochen 0,3–0,5% Fett. Das Fett ist wohl mit dem der Samen identisch. Es liefert beim Verseifen Ölsäure, Stearin- und Palmitinsäure (O. N. WITT). Das Wachs (0,3–0,5%) ist ein typisches Pflanzenwachs (SCHENCK).
Die Baumwolle wird erst durch konz. Schwefelsäure hydrolysiert (FLECHSIG). Dabei entsteht als Endprodukt reine krist. Glukose (neben sehr wenig Xylose, VOSWINKEL und LINK; die aus Baumwolle dargestellte krist. Zellulose gibt nur Glukose, GILSON). SCHWALBE und SCHULZ erhielten aus Baumwollzellulose bei der Hydrolyse im Autoklaven 44% Traubenzucker (Dextrose). Bei der Hydrolyse reiner Baumwollzellulose erhält man nicht genau die theoretisch berechenbare Zuckermenge, wenn man die Zuckerbestimmung nach ALLIHN ausführt und auf d-Glukose umrechnet. Vielleicht hängt dies mit einer «Reversion» zusammen (E. WINTERSTEIN). Daneben entsteht etwas Mannose, Xylose und Arabinose. Baumwolle enthält nur sehr wenig Xylan (SCHULZE, VOSWINKEL und LINK, SURINGAR und TOLLENS). Der Pentosangehalt der Baumwolle, bestimmt nach dem TOLLENSschen Verfahren, beträgt c. 1%[S. 242] (Holzschliff c. 12%!). Baumwolle ist also vorwiegend Glukosezellulose, sie besteht aus einem Glukosan.
Von den Abbauprodukten der Baumwollzellulose, soweit solche durch starke Schwefelsäure entstehen, sind verhältnismäßig eingehend studiert die Schwefelsäureester (HÖNIG, SCHUBERT und STERN), die Zellulosedextrine (HÖNIG und SCHUBERT) und die Bildung von Traubenzucker (FLECHSIG). Wenig bekannt sind Pergament (Amyloid), GUIGNETS Zellulose und EKSTRÖMS Acidzellulose. GUIGNETS Cellulose soluble färbt sich mit Jodschwefelsäure blau, ebenso FLECHSIGS «Amyloid», das also eigentlich kein pflanzliches Amyloid ist.
Kupferoxydammon, d. h. ammoniakalische Lösung von Kupferoxyd (POWER), löst Baumwolle so gut wie vollständig (s. oben), aus der Lösung fällen Säuren und Salze die Zellulose aus. Auch Chlorzink-Salzsäure (1 : 2) löst Baumwolle (CROSS und BEVAN). Konzentrierte 92%ige Schwefelsäure führt Baumwolle in Amyloid über. Kalte konz. Salpetersäure bildet Nitrozellulosen (Trinitrozellulosen liefern die Kollodiumwolle, vorwiegend Hexanitrozellulosen die Schießbaumwolle, Octonitrozellulosen die künstliche Seide CHARDONNETS). Die Baumwolle bleibt dabei in Form und Farbe erhalten (Wolle wird gelb). Ausführliches findet man in den Arbeiten E. BERLS. Konzentrierte Kalilauge löst Baumwolle nicht (Wolle löst sich), macht sie durchscheinend und für Farbstoffe aufnahmefähiger (Mercerisation, benannt nach JOHN MERCER 1844). Solche alkalisierte Baumwolle nimmt durch starke Spannung einen seidenartigen Glanz an (THOMAS und PREVOST).
Aus basischen Erd- und Schwermetallsalzlösungen schlägt Baumwolle ein stark basisches Salz auf der Faser nieder (Beizen). Direkt wird Baumwolle angefärbt von Safflor, Orlean, Curcumin-Glaubersalz-Schwefelsäure (Unterschied von Wolle, GANSWINDT) und den Azoxyfarbstoffen, sowie von Congo (BÖTTIGER) und von anderen Farbstoffen der Benzidinreihe. Auch Hämatoxylin färbt Baumwolle direkt (GILTAY). Jetzt kennt man schon über 500 substantive Baumwollfarbstoffe. Gegen nichtbasische Metallsalzlösungen ist die Baumwolle indifferent. Um Metallsalze binden zu können muß die Baumwolle zuvor mit Gerbsäuren und Fettsäuren (Türkischrotöl) «präpariert» werden. Basische Farbstoffe nimmt Baumwolle wenig auf, ebensowenig saure. Um letztere zu binden wird Baumwolle «animalisiert», d. h. mit Albumin, Kaseïn, Leim oder Gelatine imprägniert, oder durch Behandeln mit Ammoniak in sog. «Amidozellulose» (VIGNON) übergeführt. Mercerisierte Baumwolle (Natronzellulose, s. oben) ist fester und zeigt Farbstoffen gegenüber eine größere Affinität. Der Baumwollfaden wird durch Behandeln mit starken Alkalien verkürzt. Streckt man ihn dann auf die ursprüngliche Länge, so nimmt er Seidenglanz an. Zur Erkennung mercerisierter Baumwolle empfiehlt LANGE eine Lösung von 30 Teilen Chlorzink, 5 Teilen Jodkali, 1 Teil Jod und 24 Teilen Wasser, die nur mercerisierte, nicht reine Baumwolle nach dem Auswaschen blau färbt.
Lit. Vgl. auch die Lit. unter Zellulose (oben S. 228). — GANSWINDT, Artikel Baumwolle in Realenzyklop. d. Pharm. II, 594. — CHURCH und HUGO MÜLLER, Die Pflanzenfaser in HOFMANNS Ber. über d. Entwickl. d. chem. Industr. Braunschweig 1877. — OTTO N. WITT, Chem. Technol. d. Gespinnstfasern. — LEO VIGNON, Die Zellulosen der Baumwolle, des Flachses, Hanfs und des Ramié. Compt. rend. 131, 558. Derselbe, Zellulose, mercerisierte Z., gefällte Z. und Hydrozellulose. Ebenda p. 708. — C. PIEST, Die Zellulose usw. 1910. — HÖNIG und SCHUBERT, Monatsh. f. Ch. 6 u. 7. — STERN, Journ. Chem. Soc. 67 (1895). — SCHWALBE u. SCHULZ, Ber. d. d. chem. Ges. 1910, 913. — GUIGNET, Compt. rend. 108 (1889), 1258. — FLECHSIG, Zeitschr. phys. Chem. 7 (1882), 524. — LANGE, Chem. Zeit. 1903, 592 u. 735. — GILSON, Chem. Zentralbl. 93 b, 531. — WINTERSTEIN, Landw. Versuchsstat. 1894. CROSS und BEVAN, Journ. chem. soc., Ber. d. d. chem. Ges. und Cellulose an outline of the chemistry of the structural elements of plants 1895–1906.
[S. 243]
Anwendung. Baumwolle wird in der Medizin in erster Linie als Verbandwatte benutzt. Die Haare saugen die Flüssigkeiten kapillar und osmotisch auf. Vom Blutserum z. B. das 10–11 fache ihres Gewichtes. Sodann wird Baumwolle oft mit Medikamenten imprägniert (Verbandstoffe). Und endlich dient Baumwolle auch als Filtriermaterial, um Keime abzuhalten oder Luft zu filtrieren. Die durch Kochen mit Natriumhypochlorit erhaltene hygroskopische Watte wird als Ersatz für Charpie empfohlen. Ein entfetteter und gebleichter Baumwollstoff ist unter dem Namen Tela depurata, hydrophiler Verbandstoff, gereinigter Mull in Benutzung. (Prüfung in Pharm. helv. IV.) Baumwolle ist aber auch, hauptsächlich wegen der eingeschlossenen Luft, ein sehr schlechter Wärmeleiter und wird auch aus diesem Grunde benutzt.
Als Verbandwatte brauchbar ist im Notfall auch hydrophiler Baumwollendocht, Lint, Baumwollflanell, englischer Mull (Cambric), appretierte Gaze, Mull. Hauptsache ist, daß alle Verbandstoffe sterilisiert sind.
Lit. ZELIS, Die medizin. Verbandmaterialien. 1900. — BARTH a. a. O. (s. unten).
Prüfung. Der Stapel der gereinigten Baumwolle oder Verbandwatte betrage mindestens 3 cm. Die mikroskopische Untersuchung ergebe nur Haare. Die gereinigte Baumwolle sei rein weiß, geruchlos, frei von Fruchtschalresten und Samenteilen. Sie darf beim Drücken mit der Hand nicht knistern, knirschen (Stearinsäure) und mit Wasser durchfeuchtet Lackmuspapier nicht verändern (Alkali und Säure vom Reinigungsprozeß, s. oben). Der wässerige Auszug (1 : 10) darf nicht opalisierend oder seifig (von der Behandlung mit Seifenlauge, s. oben) oder gefärbt erscheinen. Der mit siedendem Wasser bereitete Auszug (1 : 10) darf weder durch Silbernitrat, noch durch Baryumnitrat oder Ammoniumoxalat mehr als opalisierend getrübt werden. (Chloride, Sulfate, Kalk vom Reinigungsprozeß mit Chlor etc.). Die in 10 ccm dieses Auszuges nach Zusatz von einigen Tropfen Schwefelsäure und 3 Tropfen Kaliumpermanganat entstehende Rotfärbung soll innerhalb einiger Minuten nicht verschwinden (reduzierende Substanzen, z. B. schweflige Säure und Sulfite vom Bleichprozeß). Wird gereinigte Baumwolle auf Wasser geworfen, so soll sie sich sofort mit Wasser vollsaugen und dann untersinken (Fett). Durch Trocknen bei 103° darf gereinigte Baumwolle nicht mehr als 7% an Gewicht verlieren (unzulässig hoher Wassergehalt). Wird der ätherische Auszug von 5 g Baumwolle verdunstet, so soll das Gewicht des getrockneten Rückstandes nicht mehr als 3 cg betragen (höchstens 0,6% Fett und Stearinsäure), doch vermindert selbst ein Gehalt von 1–5% Fett bzw. Fettsäure die Aufsaugefähigkeit der Verbandwatte nicht erheblich. Die Asche betrage nicht mehr als 0,3% (Ph. helv. IV) bzw. 0,5% (Ph. austr.).
Völlig von Fettsäuren freie Baumwolle ist nicht im Handel (BUDDE). Die käuflichen Verbandwatten enthalten 0,2–0,4%. Jedenfalls muß aber eine obere Grenze festgesetzt werden, da Baumwolle vor dem Kardieren nicht selten geölt wird (s. oben).
Ausgeschlossen vom medizinischen Gebrauch ist die in 2–4 cm dicken, beiderseits geleimten Platten vorkommende Handelswatte.
Lit. BARTH, Herst. und Beurteilung von Verbandwatte. Schweiz. Wochenschr. 1910, 321. — BUDDE, Unters. entfetteter Watte. Veröffentl. auf d. Geb. d. Militär-Sanitätswesens 1905.
Geschichte. HERODOT berichtet (III, 16), daß die Inder eine Pflanze haben, die statt der Frucht Wolle trage, ähnlich wie die der Schafe, doch feiner, und STRABO wußte bereits, daß man den harten Kern herausnehmen müsse, um die Fäden rein zu erhalten, kannte also das Egrenieren. Die Griechen trafen auf dem Alexanderzug in Indien Baumwolle (I, 530) und die Gangesstoffe (γαγγητικοὶ), die ALEXANDER mitbrachte, sollen Baumwollgewebe gewesen[S. 244] sein. STRABO erwähnt sie (I, S. 532), ebenso der Periplus (I, S. 534) als κάρπασος. Daß sich im allen Indien Baumwollkulturen, wohl von Gossypium herbaceum, befanden, ist zweifellos. Der Occident (Römer und Griechen) wie Araber, Perser und Ägypter bezogen während des Altertums den Baumwollrohstoff und Baumwollgewebe aus Indien. Sicher erwähnt wird Baumwolle (kârpâsa) nach VON SCHRÖDER zuerst in den jüngsten vedischen Schriften, den sûtras (500–600 n. Chr.). THEOPHRAST erwähnt Baumwollanpflanzungen auf den Bahreininseln im persischen Golf (Hist. pl. 1, 4, 9). Es handelt sich hier wohl um G. herbaceum (DE CANDOLLE). Noch in der Kaiserzeit baute fast nur Indien, besonders das Gangestal, Baumwolle. Nach PLINIUS sollen schon die Phönikier auf Tylos große Baumwollplantagen besessen haben(?). Der PHARAO schenkte JOSEPH als Zeichen seiner besonderen Zuneigung ein baumwollenes Gewand. Es scheint also Baumwolle damals noch selten gewesen zu sein. In altägyptischen Gräbern finden sich denn auch nur leinene Binden und Gewänder. Baumwolle wurde in Ägypten erst nach der Einwanderung der Perser (c. 525 n. Chr.) in größerem Maßstabe kultiviert (BRANDES). PLINIUS erwähnt die Anpflanzungen in Oberägypten (s. oben S. 230), ebenso POLLUX ein Jahrhundert nach PLINIUS (im Onomastikon). In den oberen Regionen des weißen und blauen Nil ist die Kultur der Baumwolle wohl noch älter (WOENIG). In Abyssinien reicht sie in undenkliche Zeiten zurück (SCHWEINFURTH). Merkwürdigerweise wird im Mittelalter nirgends Baumwolle aus Ägypten erwähnt (HEYD). Die Mumienbinden der Ägypter, die HERODOT βύσσος nennt, waren, wie mikroskopische Untersuchungen von BAUER-THOMSON (1849) und UNGER (1859) gezeigt haben, nicht aus Baumwolle, sondern aus Lein gefertigt. Ebenso bestand die charta bombycina der Alten wie das alte arabische Papier aus Leinen und Hanf, nicht aus Baumwolle (WIESNER, KARABAČEK). PROSPER ALPIN sah im XVI. Jahrh. Kulturen von G. arboreum in Ägypten. Von Indien kam die Kultur (im XIII. Jahrh. n. Chr., nach BRETSCHNEIDER im IX. oder X. Jahrh. n. Chr.) nach China. Größere Verbreitung fand die Baumwollkultur in China erst nach der Eroberung des Landes durch die Tataren (1368). Aus dem Jahre 1765 besitzen wir ein chinesisches Werk über Baumwollkultur (mien hua tʿu). Die Araber brachten Baumwollkultur und Industrie nach Spanien. Sie legten im IX. Jahrh. Pflanzungen bei Valencia in Spanien an. Die Mauren errichteten in Granada, Cordova, Sevilla, Barcelona und Fez (Marocco) Baumwollmanufakturen. IBN ALAWĀM (XII. Jahrh., I, S. 611) beschreibt die Kultur in Spanien, Sizilien und dem Orient, EDRISI (I, S. 617) die in Südostmarocco, ISTACHRI (X. Jahrh.) die Kultur in Mesopotamien (I, S. 616). Auf Kos und Malta scheinen schon im Altertum Baumwollmanufakturen bestanden zu haben. Bis zum Ende des XVIII. Jahrh. kam alle Baumwolle Europas aus der Levante. MARCO POLO (I, S. 724) traf Baumwollkulturen im XIII. Jahrh. bei Mosul, in Persien, bei Kaschgar und südlich vom Tarim und in Indien. Am Ende des XVI. Jahrh. brachten die Holländer rohe Baumwolle nach Europa, die in Gent und Brügge verwebt wurde; von 1772 an entwickelte sich auch in England eine Baumwollindustrie. Die Gewebe wurden aus indischer Baumwolle, später auch aus solcher der Levante, aus Macedonien, Cayenne, Surinam, Guadeloupe und Martinique hergestellt. In Frankreich beginnt die Baumwollindustrie gegen Ende des XVII. Jahrh. in Amiens. Die ersten italienischen Baumwollmanufakturen befanden sich in Venedig und Florenz (XIV. Jahrh.), von dort gelangten sie nach Zürich und Augsburg. Die ersten größeren deutschen Fabriken wurden in Plauen i. V. errichtet. Nach England kam die Baumwollindustrie vielleicht durch niederländische Protestanten; nach den Vereinigten Staaten kam sie 1643. Als die Spanier Amerika betraten, fanden sie die Baumwolle (G. barbadense) in Kultur und Benutzung sowohl auf den Antillen als in Mexico, Peru und Brasilien. In Peru ist die Baumwollkultur sehr alt. 1532 stand sie, als die Spanier das Land betraten, in hoher Blüte, und in alten peruanischen Gräbern findet man viele Baumwollgewebe und Gespinste. Die Expedition des HOJEDA, die Venezuela entdeckte, traf dort Baumwolle (I, S. 746). CORTEZ fand sie in Mexico (1519), VACCA in Louisiana (1536). Bei HERNANDEZ heißt die Baumwolle Xchcaxihuitl. Sie wird von ihm auch abgebildet. In Nordamerika reichen die Anbauversuche bis 1621 zurück, Gossypium herbaceum kam 1770 dorthin und in diesem Jahre begann man auch dort mit der Kultur. Virginia baute B. von Mitte des XVII. Jahrh. auf Betreiben von WYATT, in Carolina führte sie 1733 der Schweizer PETER PURRY ein, in Georgia 1784 der Schweizer ANSPURGER, 1784 begannen die amerikanischen Baumwollausfuhren. 1791 begann der Anbau in größerem Stil in Georgia, 1811 in Nord-Carolina, Louisiana und Tennessee, 1821 in Mississipi und Alabama, 1826 in Arkansas, 1826 in Texas und Florida. Heute bauen 14 Staaten der Union Baumwolle. 1800 produzierte Nordamerika schon 9 Mill. kg (SEMLER). Jetzt bevorzugt[S. 245] man dort G. barbadense. In Brasilien begann der Anbau in den Nordstaaten, besonders Bahia und Para, und verbreitete sich darauf nach Pernambuco, Maranhao usw. Jetzt wird dort die meiste Baumwolle im Munizipium Tatuhyan gebaut. Zur Zeit des amerikanischen Bürgerkrieges, der Periode des «Baumwollenhungers», warf sich alles auf die Baumwollkultur, z. B. in Süditalien, und auch in andern subtropischen und tropischen Ländern begann man mit dem Anbau, der aber nicht überall aufrecht erhalten werden konnte.
Lit. WIESNER, Rohstoffe. — WOENIG, Pflanz. d. alt. Ägypt. — THOMSON, Mumienbinden. Lieb. Ann. 69 (1849). — UNGER, Botan. Streifz. auf d. Geb. d. Kulturgesch. D. Pfl. d. alt. Ägypt. Sitzber. d. Wien. Akad. 1859. — WIESNER, D. mikrosk. Unters. d. Papiers usw. und KARABAČEK, Arab. Papier. Mitt. aus d. Samml. d. Papyr. Rainer. Wien 1887. — WAGLER, Artikel Baumwolle in PAULYS Realenzyklop. d. klass. Altert. — BRANDES, Über d. antik. Namen u. d. geogr. Verbreit. d. Baumwolle im Altertum. Leipzig 1866. — BLÜMNER, Technol. u. Terminologie d. Gewerbe u. Künste bei den Griechen u. Römern I (1875). — WITTMACK, Über d. Nutzpflanzen d. alten Peruaner. Compt. rend. du Congr. int. des American. Berlin 1888. — BRANDES, Über die antiken Namen u. d. geographische Verbreitung d. Baumwolle im Altertum. Jahresb. d. Freunde d. Erdkunde 1866. — DE CANDOLLE, L’origine des plant. cultiv. 4. Aufl. 1896, p. 323. — MASTERS in OLIVER, Flora of tropical Africa. — HOOKER, Flora of Brit. India. — BRETSCHNEIDER, Study and value of chinese botanical works. — C. RITTER, Die geograph. Verbreit. d. Baumwolle. — DE LASTEYRIE, Du Cotonnier. — SCHWEINFURTH und ASCHERSON, Aufzählung usw. — REYNIER, Economie des Arabes et des Juifs. — BRANDIS, Die Baumwolle im Altertum. 1866. — HEMSLEY, Biologia central.-american.
Die Samen (Sem. G. oder Sem. bombacis) wurden früher ähnlich wie Leinsamen in Abkochung als Schleim benutzt, jetzt meist auf Öl verarbeitet. In der Brandenburgischen Taxe 1574 (I, S. 816) steht Sem. Gossypii i. e. Coto vulgo v. Bombasum = Baumwollensat., und Sem. Bombacis in der Frankfurter Reformatio 1656 (I, S. 824) ist ebenfalls Sem. Gossypii.
Der früher als Ölsaat unbeachtet gebliebene oder (z. B. in China und Mittelasien) gemahlen nur als Viehfutter benutzte Same wurde zuerst 1783, aber erst seit 1852 in größerem Stil auf Öl verarbeitet. Jetzt bestehen zahlreiche große Baumwollsamenölfabriken bes. in Nordamerika (1894 dort bereits 252) und 1897 exportierte dies Land schon über 27 Mill. Gallonen Öl und verbrauchte noch mehr für den eigenen Bedarf als Ersatz des Olivenöls. Nächst Amerika exportiert Ägypten viel Baumwollsamen (1897 bereits 7½ Mill. hl).
Der amerikanische Baumwollsamen enthält 15–30, meist 20–25% Öl, der ägyptische im Mittel 25%. Beim Pressen erhält man 13–14%. Das Öl enthält neben Phytosterin Glyceride der Palmitin- und Ölsäure (besonders viel von letzterer, SLESSOR, Chem. Zentralbl. 1859, 140), der Linolsäure und Linolensäure; ferner geringe Mengen Oxyfettsäure, Cottonölsäure, einen aldehydartigen Körper und einen schwefelhaltigen, widerlich riechenden. Aus geschälten Samen bereitete Baumwollsamenpreßkuchen enthalten 43,3% Proteinstoffe, 14,3% Öl und 16,7% stickstoffreie Extraktivstoffe. Er ist also ein vorzügliches Futtermittel. (Mikroskopie bei PERROT, Bull. sc. pharm. 1902). Die Samen enthalten aber eine in Öl unlösliche (CORNEVIN), in kaltem Wasser lösliche giftige Substanz, die ein Alkaloid sein soll und die die Baumwollsamen-Preßkuchen zu einem nicht ganz ungefährlichen Futtermittel macht. Man hat denn auch Vergiftungen beobachtet (KOBERT, Intoxikationen). Der Same enthält neben Cholin und Betaïn Melitriose (RITTHAUSEN). In der Pharmazie wurde Baumwollsamenöl etwa seit 1880 als Ersatz des Olivenöls zuerst in Nordamerika benutzt. MARCHLEWSKI fand im Baumwollsamen krist. Gossypol (C13H12O2(OH)2?), das den Charakter einer Oxysäure besitzt (Chem. Zeit. 1898, 11). Die Cotyledonen der Samen von Goss. herbac. färben sich mit konz. HCl hellgrün, die Sekretbehälter an ihrem Innenrande dunkelgrün. Phloroglucin-Salzsäure färbt die Sekreträume violett. WINKEL führt die Reaktion auf Gossypol zurück (Apoth. Zeit. 1905, 211). Die Halphensche Reaktion ist eine Reaktion auf Baumwollsamenöl.
Lit. Cotton seed and its products U. S. Dep. of agric. Farmers Bull. No. 36 (1896). — Über das Baumwollsamenöl vgl. auch Pharm. Jahresber. 1908, 391 und WIEDEMANN, Dingl. polyt. Journ. 232, 190. — Weitere Lit. über die Baumwollsamen in BENTLEY-TRIMEN, Medicinal[S. 246] plants. — Bez. Analysen der Baumwollsamen vgl. Jahrb. d. Pharm. 1885, 95. — Gewinnung des Baumwollsamenöls: LEWIS, Diss. Philadelphia 1896 (Pharm. Zeit. 1896, 129). — MARCHLEWSKI (Gossypol). Journ. pr. Chem. 60 (2), 1899, 84. — HALPHEN, Journ. pharm. 1894 u. 1897. — SCHWEINITZ (Öl). Journ. Am. chem. soc. 1885. — CORNEVIN, Ann. agron. 22, 353 (Chem. Zentralbl. 1897, I, 515). — Das Anatomische oben S. 238.
Die Araber benutzten den Saft der Blätter medizinisch bei Koliken, die Samen bei Brustkrankheiten, das Öl bei Hauterkrankungen. Die Blätter von G. barbadense sollen die Milchsekretion befördern (ANDERSON, Jahrb. d. Pharm. 1881/82, 242).
In Amerika wird Cort. radicis gossypii auch vom Volke verwendet. Sie soll eine ähnliche Wirkung wie Secale cornutum besitzen. In Ostindien gilt sie als Diuretikum. STAEHLE fand in der Rinde c. 8% Harz, Kautschuk, Zucker, keinen Gerbstoff. DRUEDING fand in der Rinde ein rotes und ein gelbes Harz, Öl, Gummi, Zucker, Gerbstoff und Chlorophyll. HARTWICH und MORGAN erwähnen Sekretbehälter in ihr.
Lit. WILLIAM C. STAEHLE, Chem. and microscop. examinat. of Cotton Root Bark. Am. journ. pharm. 1875, 457. — CH. C. DRUEDING, Analysis of cotton root bark. Amer. Pharm. Journ. 1877, 49, p. 386. — HARTWICH, D. neuer. Arzneidrogen usw. S. 164. — MORGAN, Amer. Journ. 1898 (anatom. Beschr. d. Rinde). — Weitere Literatur über Rad. gossypii in BENTLEY and TRIMEN, Medicinal plants.
Über den Farbstoff der Blüten vgl. PERKIN, Journ. chem. Soc. 75 (1899) 825.
Ebenso wie Baumwolle und aus dem gleichen Grunde, d. h. wegen ihrer Aufsaugungsfähigkeit für das Blutserum, werden die Spreuhaare einiger tropischer Baumfarne benutzt, die also gewissermaßen als Paralleldrogen der Baumwolle betrachtet werden können.
Pili haemostatici.
Syn. Paleae cibotii s. stypticae, s. haemostaticae, Pili cibotii s. filicum, Farnhaare, blutstillende Spreuhaare, Farnkrautwolle, Teufelszwirn, Wundfarn, vegetabilische Schafwolle.
Im Handel finden sich von Farnhaaren folgende Sorten:
1. Penawar Djambi auch Penghawar Djambi (Pengawar Jambie, Pingh-war-har-Yamby, Pennober Jamby oder Pennawar dschambi; in China kau-tsib — Djambi liegt in Westsumatra) von Cibotium Barometz LINK (J. SM.) (Polypodium Baromez L., Aspidium Baromez WILLD.), und den nach SMITH wohl dazu zu ziehenden Cibotium glaucescens KZ., C. Cumingii KZ., C. assamicum HOOK. und C. Djambianum, sowie anderen Baumfarn Sumatras.
Cibotium Barometz heißt in Madur.: bar djambe oder bulu djambe, in Bali: djampi, javan.: penawar djambe, mal.: penawar djambi (DE CLERCQ). Man sollte also nicht Penghawar djambi, sondern Penawar djambi schreiben, wie dies übrigens die Pharm. austr. VIII tut (Penawar hitam ist Goniothalamus giganteus, P. merah: Ximenia americana, P. pahit: Eurycoma longifolia, P. putieh: Sonchus picta, P. radja: Sonchus insignis).
2. Paku kidang (Pakoe ist die holländ. Schreibweise) von Alsophila lurida BL., Balantium chrysotrichum HASSKARL (Dicksonia Blumei Mett., D. chrysotricha Moore, B. Magnificium Hook., Chnoophora tomentosa Bl.) u. and. Baumfarn Javas.
Die Alsophilaarten heißen im Sundanes. paku tihang, im Mal. paku tijang (DE CLERCQ). Man sollte also wohl den Namen so und nicht paku kidang schreiben. Kidang bedeutet Hirsch.
3. Pulu-Pulu von Cibotium glaucum HOOK. et ARN., C. Chamissoi KAULF., C. Menziesii HOOK. u. and. Baumfarn der Sandwichinseln und benachbarter Gebiete.
[S. 247]
Ferner die Haare der südamerikanischen Lophosoria (Alsophila) affinis PRESL. (Alsophila pruinata KLFS.), der brasilianischen Alsophila armata PRSL. (Polypodium aculeatum RADDI) und des südmexikanischen Cibotium Schiedei CHAM. et SCHLECHT.
Systemat. Stellung. Balantium, Dicksonia, Cibotium: Pteridophytae, Filicales, Eufilicineae, Cyatheaceae, Dicksonieae.
Alsophila, Cyathea: Pteridophytae, Filicales, Eufilicineae, Cyatheaceae, Cyatheeae.
Cybotium Barometz ist über das ostasiatische Monsungebiet verbreitet: Hinterindien, Hongkong, Formosa, Java, Sumatra, die Unterart C. Cumingii auf den Philippinen heimisch; C. Menziesii auf allen Inseln der Sandwichgruppe (bei den Eingeborenen Hapu Ji oder Heii), ebenso C. glaucum und Chamissoi.
Die Wedelbasen und besonders der Vegetationspunkt zahlreicher tropischer Baumfarn (Fig. 90) sind dicht besetzt mit Spreuschuppen oder Spreuhaaren (paleae), die diesen Organen ein gelb-bräunliches, wolliges Ansehn verleihen. Es sind ziemlich lange, bei Cibotium 2–3, manchmal sogar 7 oder gar 9 cm Länge erreichende einreihige, bisweilen gedrehte und zusammengefallene seidigglänzende Haare, die aus Reihen gestreckter, bräunlichgelber, dünnwandiger Zellen bestehen. Oft ist besonders bei Paku kidang in ziemlicher Regelmäßigkeit jede zweite Zelle obliteriert. Die Spitze ist stumpf kegelig, die Querwände wellig gebogen. In Paku kidang findet man bisweilen echte Paleae, die Zellflächen bilden und Randzähne haben.

Baumfarn (Alsophila?) am Rande des Urwaldes am Gedeh (Mitteljava).
[Tschirch phot.]
Läßt man Jodschwefelsäure darauf einwirken, so tritt die Cuticula als scharf begrenztes Häutchen, der Zellinhalt als ein faltiger Sack hervor. Nur selten sah ich hierbei Blaugrünfärbung der Wand eintreten. VOGL gibt an, daß die Wand aus Zellulose bestehe. (WINTERSTEIN erhielt bei der Hydrolyse von Zellulosepräparaten aus Aspidium Filix mas und Athyrium Filix femina Traubenzucker und Mannose.) VOGL gibt (1864) an, daß die braungelbe Zellwand durch kochende Kalilauge unter starker[S. 248] Quellung entfärbt und dann in den inneren Schichten durch Jodschwefelsäure blau gefärbt wird.
Die Farbe der Droge ist bei den einzelnen Sorten etwas verschieden. Penawar Djambi ist am hellsten, braunrötlichgelb, Pulu-Pulu gelb-bräunlich, Paku kidang fast kaffeebraun. Pharm. austr. VIII nennt sie «seidenartig oder fast metallisch bronzeartig schimmernd». Kali färbt sie dunkler, die gelben Haare von Penawar z. B. rotbraun.
Die Breite der Haare beträgt c. 20–45 mik. bei Penawar Djambi, bei Pulu etwa 40–60, bei Paku kidang bis 100 oder 150 (TSCHIRCH), oder gar 300 mik. (VOGL). Übrigens ist die Breite sehr wechselnd. VOGL gibt für Penawar Djambi z. B. die größte Breite auf 100–140 mik. an. Bei Penawar Djambi sind die Haare lang und auf weite Strecken gerade, bei Pulu durcheinander gewirrt und fast stets bandartig zusammengefallen, bei Paku kidang entweder walzenrund oder obliteriert. VOGL fand in den Pulu-Haaren und auch bei Paku kidang Stärkekörner. Auch OUDEMANS und HARTWICH geben kleine Stärkekörner an. Ich fand solche nur in Paku kidang. Außerdem enthalten sie bisweilen eine vakuolige Masse als Wandbeleg, oder sind leer und führen Luft.
DE VRIJ fand «eene groote hoeveelheid Sal Ammoniak en een eigenaardig zuur» (bei OUDEMANS).
Penawar Djambi und Pulu-Pulu enthalten 1,53%, Paku kidang 6,74% Asche. Der Wassergehalt beträgt c. 12%.
Die Farnhaare werden seit 1851 hauptsächlich als Stopfmaterial für Kissen benutzt. Zu diesem Zwecke wurden noch 1908 große Mengen Pulu von den Sandwichinseln nach Nordamerika exportiert. Während 1851 die Ausfuhr nur 2479 Pfund betrug, stieg sie 1858 bereits auf über 300000 Pfund. 1845 machte man in England den Versuch, die Farnhaare mit Seide vermengt zu verweben.
Die hämostatischen Eigenschaften der Alsophila- und Cibotiumhaare sollen schon im Mittelalter bekannt gewesen sein (BARILLÉ). In Java und Sumatra werden sie seit Jahrhunderten (nach VOGL seit den ältesten Zeiten?) als Hämostatika benutzt. 1843 führte HASSKARL zuerst die mit den Spreuhaaren besetzten Wedelbasen zu diesem Zweck aus Java (Wälder am Gedeh) in Holland ein. Die Holländer machten sie also im XIX. Jahrh. von neuem in Europa bekannt und sie standen schon in der Pharmac. néerlandica vom Jahre 1856 — noch heute übrigens in der Pharmac. austr. VIII.
Die Verwendung der Farnhaare an Stelle der Charpie (daher: charpie fougère) beruht wohl, wie schon VINKE annahm, nur auf der Aufsaugefähigkeit derselben und der geringe, von FRANCHIE behauptete, von VAN BEMMELEN bestrittene Gehalt an Gerbstoff kommt kaum hierbei wesentlich in Betracht. Da Penawar Djambi niemals steril ist, ist vor der Anwendung zu warnen. Sterilisierte Baumwolle ist sicherer. Man sollte Penawar jedenfalls sterilisieren. Immerhin ist die Aufsaugefähigkeit der Farnhaare beträchtlich, da sie ein großes Lumen und eine nur dünne Wand besitzen, und alle Beobachter stimmen darin überein, daß sie ein vorzügliches Blutstillungsmittel sind. Neuerdings (1902) empfahl sie LUBET-BARBON als Hämostatikum bei Nasenoperationen. Vielleicht kommt die Wirkung weniger durch kapillare Aufsaugung, die ja, da die Haare gegliedert sind, also nur kurze Röhrchen in Aktion treten können, nur gering sein kann — als vielmehr dadurch zustande, daß die Zellen osmotisch das Blutserum aufsaugen und die Blutkörperchen durch Filtration abtrennen.[S. 249] Läßt man nämlich Blut zu den Haaren treten, so sammelt sich im Lumen Flüssigkeit, die Wand quillt und die Blutkörperchen lagern sich an der Außenseite der Zellen ab und verkleben hier. VOGL dachte sich (1866) die Wirkung anders, aber auch nicht durch Kapillarität bedingt. Er nimmt an, daß der Inhalt der Haare dem Blute Alkali, die Wand ihm Wasser entziehe und dadurch die Koagulation des Blutes zustande komme.
Daß auch die kurzen Paleae von Polypodium aureum blutstillend wirken, fand SEUBERT schon 1844.
Als Verfälschung wird Kapok angegeben (PROLLIUS).
Als Surrogat des Penawar empfiehlt GAWALOWSKI einen eigenartig behandelten Torfmull (Näheres in Zeitschr. d. Österr. Apoth. Ver. 1898, 671).
Eine Zeitlang benutzte man das Dekokt bei Hämorrhagien (MOLKENBOER, GAUPP). Es enthält nach BARILLÉ neben Harz und einem santelartig riechenden Körper einen Gerbstoff. VAN BEMMELEN bestreitet, daß Gerbstoff darin vorhanden ist. Er konnte mit dem Dekokt nicht die mindeste Wirkung auf das Blut konstatieren. Er fand in den Haaren: Pflanzenwachs, indifferentes und elektronegatives Harz, eine eisengrünende Säure, Quellsäure, Quellsalzsäure (?), Humussäure. Es fehlten: Stärke, Zucker, Alkaloide, Gerbsäure, Bitterstoff, ätherisches Öl.
In früheren Jahrhunderten kamen nicht die Haare, sondern das Stammende oder ein großer Blattwedel oder ein Stammstück mit einer Blattwedelbase als Agnus scythicus (Frutex tartareus, plantanimal, Vegetable lamb, im chines.: keu tsie, im cochin.: cau tieh) in den Handel. Man gab wohl auch durch Einstecken von Holz- oder Bambusstücken, die die Beine vorstellen sollten, dem Ganzen ein noch tierähnlicheres Ansehn. Aber nur ein sehr blödes Auge konnte dadurch sich täuschen lassen. In den Beschreibungen der Wunder Indiens spielte der Agnus scythicus immer eine Rolle. So weiß ODORICO DI PORTO MAGGIORE (I, S. 726) im XIV. Jahrh. viel über dies merkwürdige Pflanzentier zu berichten und ERASMUS FRANCISCI widmet ihm im Ost- und West-Indianischen Lustgarten eine weitläufige Beschreibung. Jetzt findet man es nur noch in Sammlungen. Ich besitze in meiner Sammlung ein hübsches skythisches Lamm, das sogar ein rotes Bändchen um den «Hals» trägt und dessen «Beine» aus Bambusstäbchen bestehen (das Exemplar des British Museums ist abgebildet in RYMSDYKS Museum britannicum, London 1791 tab. XV, Fig. 2). Barometz soll ein altrussischer Name für Lamm sein. Das ist möglich, denn heute noch heißt das Lamm im Russischen baraschek (baramek) von baran = Schaf. Der Name Barometz (Baramets, Boramez) wurde dem Agnus scythicus, wie es scheint, von CARDANUS gegeben (VOGL), der die Heimat des Gebildes — fälschlich — in die Gegend zwischen Wolga und Jaik verlegt. Das «Pflanzentier» war ein bewurzeltes Tier, das sich solange im Kreise um die Anheftungsstelle drehte, bis es alles Erreichbare verschlungen hatte. Dann mußte es sterben. Diese Fabel finden wir auch bei JOH. VON MAUDEVILLE. Eine andere Version lautete, daß sich im Lande Chadissa eine Frucht fände, die aufgeschnitten ein Lamm zeige, das mit der Frucht genossen werde. HARSDÖRFFER spricht daher von einem «Fruchttier». DEURSINGIO nennt es Agnus vegetabilis. Bei SCALIGER, BACO VON VERULAM, JOH. BAUHIN u. and. findet sich die Fabel dahin modifiziert, daß aus einem Samen, ähnlich jenem der Melone, ein Kraut hervorwachse, das die Gestalt eines jungen Lammes besitze. Sein Stengel stelle gleichsam die Nabelschnur dar (Abbild. nach KIRCHER in VALENTINIS Museum museorum) und seine reife Frucht enthalte unter dem wollenen Fließ ein süßes Fleisch. KÄMPFFER (I, S. 907) ist der schon von WORMIUS (1694) geäußerten Ansicht, daß es sich um das Fell unreifer, aus dem Mutterleibe herausgeschnittener Lämmer handele und in der Tat scheinen derartige Felle in Sammlungen als Barometz bezeichnet und mit dem eigentlichen Agnus scythicus verwechselt worden zu sein. Auch VALENTINI, der KÄMPFFERS Ansicht teilt, handelt das Gebilde beim Schaf, also unter den tierischen Objekten ab. GUILLAUME SALUSTE (in der franz. Übers. des CLUSIUS durch ANTOINE COLIN 1619) besang den Agnus scythicus in Versen (abgedr. bei HANBURY). Bereits Anfang des XVII. Jahrh. scheint er in Europa als Blutstillungsmittel in Benutzung gewesen zu sein (VOGL). Penawar Djambi war aber seit 150 Jahren aus dem Handel verschwunden.[S. 250] POMET erwähnt es nicht, ebensowenig LINNÉ (in seiner Mater. medica), SPIELMANN u. and. LINNÉ gab einer ihm aus China unter der Bezeichnung Baromez zugekommenen «wolligen Wurzel» den Namen Polypodium Baromez. Die Pflanze selbst sah zuerst LOUREIRO (I, S. 903). Er bestätigte, daß es sich um ein stark behaartes Polypodium handele. Aber noch ARCHER hielt die Haare für den Pappus einer Distel, bis ein 1852 von den Freundschaftsinseln nach Liverpool gelangtes Wedelstück die Sache endgültig aufklärte. Damals scheinen diese oder ähnliche Spreuhaare auch nach Deutschland gekommen zu sein, wo sie für eine Alge gehalten und als Conserva aureofulva KÜTZING beschrieben wurden.
1856 fanden sich im Londoner Handel die behaarten Stammstöcke und Blattbasen. Später kamen dann nur die Haare in den Handel.
Die genaue botanische Provenienz stellte dann SMITH fest.
Lit. KÄMPFFER, Amoenitates. — VALENTINI, Museum museorum, I, p. 458. — DIELS in ENGLER-PRANTL, Pflanzenfam. I, 4 (dort die Abbild. einer Alsophila). — HANBURY, On Penghawar Djambi a new styptic. (1856), Science papers, p. 120. — SEUBERT, Buchn. Repert. 86. — FRANCHIE, Vierteljahrschr. f. prakt. Pharm. 1854, 577. — VAN BEMMELEN, Chem. Unters. d. Pengh. Dj. Vierteljahrschr. f. prakt. Pharm. 1856, 321. — VOGL, Ges. d. Ärzte 1864, Über blutstillend wirkende Spreuhaare d. Farne, Wien. Med. Jahrb. 1865 (Jahresb. d. Pharm. 1865) und Zeitschr. d. Öster. Apoth. Ver. 3 (1865), 539 (Jahresber. d. Ph. 1866, 28), dort auch die histor. Notizen, sowie VOGL, Kommentar 1908. — VINKE, Ausführl. Ref. in Pharm. Jahresb. 1860, 15 und WITTSTEINS Vierteljahrschr. 9, 235 (dort auch die früheren Arbeiten besprochen). — PROLLIUS, Über die sog. palea cibotii. Pharm. Zentralh. 1884, 170. — GRESHOFF, Bull. pharm. de Lyon 1891. — BARILLÉ, Etudes des fibres textiles. Thèse Straßb. 1868 und Note sur le Penghawar Djambi et le Paku kidang Rep. de pharm. 1892, 49. — LUBET-BARBON, Arch. intern. de laryngologie 1902, No. 6. — OUDEMANS, Aanteekeningen, Rotterdam 1854 und Handleiding 1880. — WIESNER, Rohstoffe II, 466. — GAWALOWSKI, Ersatz für Penghawar. Zeitschr. d. Öster. Apoth. Ver. 1898, 671. — BRÜCKNER, Russ. Revue 21 (1882), 131 (Histor. — Nicht gesehen). — SMITH, Genera filicum 1841. — KUNZE in Schkuhrs Supplement t. 31. — MIQUEL, Analecta botan. indic. II, 36 und Sumatra 1862. — DODGE, Descript. Catal. of useful fiber plants etc. Washington 1897. — Abbild. d. Haare im Atlas zu OUDEMANS Aanteekeningen, Pl. B, bei PLANCHON-COLLIN, I, S. 47, HAGER-FISCHER-HARTWICH, Handb. d. pharm. Praxis I, S. 827, VOGL, Atlas t. 60, bei BARILLÉ a. a. O. und PROLLIUS a. a. O. — Unters. über d. Zellmembr. d. Farne und Moose: WINTERSTEIN, Zeitschr. phys. Chem. 21 (1895), 152.
Die Fasern.
Die Fasern gehören nicht zu den Arzneidrogen im engeren Sinne, sondern eigentlich zu den technischen Rohstoffen. Da sie aber auch für den Pharmakognosten wichtig sind, vielfach in der Pharmazie verwendet werden, und auch sonst in pharmakognostischen Handbüchern Erwähnung finden, mögen sie wenigstens kurz an dieser Stelle aufgeführt werden.
Die Pflanzenfasern sind nur selten (Lein) reine Zellulose. Die Jute z. B. enthält, wenn reif, 20–30 % Nicht-Zellulose (CROSS und BEVAN).
Die technisch verwerteten pflanzlichen Fasern.
Unter dem Namen «Fasern» versteht man jetzt sehr verschiedenartige Dinge. In erster Linie gehören hierher die Textilfasern (Flachs, Hanf, Jute, Baumwolle, Pflanzenseide, Chinagras, Nesselfaser usw.) und die zur Papierfabrikation verwendeten Papierfasern (außer Flachs, Hanf, Baumwolle noch Esparto, Strohfaser, Holzzellen, Bambusfaser, Hopfenfaser u. and.), dann sind aber auch noch, wenn man den Begriff ganz weit faßt, den Fasern zuzuzählen: die als Stopf- oder Polstermaterial verwendeten Pflanzendunen, édredon végétal, das vegetabilische Roßhaar, Holzwolle; die Bürstenmaterialien: Coir, Pite, Piassave, Esparto, Reisbesen; die Seilermaterialien: Hanf, neuseeländ. Flachs, Manilahanf, Jute, Pitahanf, Coir, Piassave;[S. 251] die zu gärtnerischen und anderen Zwecken verwendeten Bindematerialien: Lindenbast, Raphiabast, Ulmenbast, Cubabast; die Flechtmaterialien: spanisches Rohr, Bambus, Esparto, Pitafaser. Ihren morphologisch-anatomischen Charakter nach stellen diese Fasern sehr verschiedenartige Dinge dar: Pflanzenhaare (Baumwolle, Pflanzenseide, Pappelwolle, Wollgrasfaser), einzelne Bastfasern (Lein, Hanf, Jute, Chinagras), Bastfasergruppen (Manilahanf, neuseeländ. Flachs), subepidermale Baststreifen des Blattes (Raphiafaser), Bastfasern mit anhängenden anderen Elementen (Lindenbast), Gefäßbündel mit Bastbelegen (Aloëhanf, Sisalhanf, Sanseveria und Coirfaser), Gefäßbündelgruppen (Piassave, Kitoolfaser, crin végétal), ferner zerkleinertes (geschliffenes) Holz (Holzstoff, Holzzellulose), ganze Wurzeln (Reiswurzelfaser), ganze Blätter (Espartostroh), ja sogar ganze Pflanzen (Seegras).
Die tierischen Fasern zerfallen in Tierwollen und Haare (Schafwolle, Ziegenhaare, Angora Ziegenhaar, Tibetwolle, Kalb- und Kuhhaare, Kamelhaar, Kamelziegenwolle, Rehhaare, Schweinsborsten, Roßhaare u. and.) und Fäden (Seide). Sie sind sowohl morphologisch als mikrochemisch leicht von den pflanzlichen Haaren zu unterscheiden. Sie geben z. B. niemals auch nach vorheriger Behandlung mit SCHULZEscher Macerationsflüssigkeit die sog. Zellulosereaktion. Zur Unterscheidung der Tier- und Pflanzenfaser benutzt MOLISCH α-Naphthol (Jahresb. d. Pharm. 1886, 16).
Wenn wir von den ganzen Pflanzen (Seegras, Zostera marina und Carex brizoides) absehen, so können wir die Fasern einteilen:
1. in solche, die pflanzliche Haarbildungen darstellen und
2. solche, die entweder ausschließlich oder doch vorwiegend aus Bastfasern bestehen.
Bei der Untersuchung pflanzlicher Fasern ist in Betracht zu ziehen: 1. Die Form der Faserzellen: Basis, Lumen, Dicke der Wand, Art der Verdickung, Spitze, Form des Querschnittes, 2. Länge und Breite der Faserzellen; 3. Mikrochemisches Verhalten. Außer einer genauen mikroskopischen Feststellung der morphologischen Verhältnisse spielt also bei derartigen Untersuchungen das Messen mit dem Mikrometer, sowie die Einwirkung von Reagentien eine große Rolle. Bei der Anwendung der letzteren ist zu berücksichtigen, ob man eine rohe Faser oder eine verarbeitete vor sich hat. Denn durch zahlreiche Verarbeitungsprozesse (besonders das Bleichen) wird die Faser chemisch verändert oder erleidet durch aufgetragene Farbstoffe Farbenveränderungen. So wird bei den meisten Bleichprozessen das Lignin, wo es vorhanden war, aus der Membran entfernt, dieselbe reagiert also, auch wenn sie einer verholzten Zelle angehörte, wie Zellulose. An stark gefärbten Fasern lassen sich mikrochemische Reaktionen überhaupt nicht anstellen.
Dimensionsverhältnisse
Länge, Dicke, Verhältnis der Dicke zur Länge der wichtigsten Fasern — nach den Angaben von WIESNER, VÉTILLARD und VON HÖHNEL.
|
Name der Faser
|
Länge mm
|
Breite in mik
(mmm) |
Verhältnis
der Dicke zur Länge |
||||
|
Min.
|
Max.
|
Mittel
|
Min.
|
Max.
|
Mittel
|
||
|
Lein von Linum usitatissimum
|
4
|
66
|
25–30
|
15
|
37
|
20–25
|
1200
|
|
Hanf von Cannabis sativa
|
5
|
55
|
15–25
|
16
|
50
|
22
|
1000
|
|
Hopfenfaser von Humulus Lupulins
|
4
|
19
|
10
|
12
|
26
|
16
|
620
|
|
Nesselfaser von Urtica dioica
|
4
|
55
|
25–30
|
20
|
70
|
50
|
550
|
|
Chinagras, Ramié von Boehmeria nivea
|
60
|
250
|
120
|
16
|
8
|
50
|
2400
|
|
Papiermaulbeerbaumfaser von Morus papyrifera
|
—
|
10–25
|
6–15
|
—
|
—
|
25–35
|
240–430
|
|
Sunnfaser von Crotalaria juncea
|
0,5
|
12
|
7–8
|
25(20)
|
50
|
30
|
260
|
|
Besenginster von Sarothamnus vulgaris
|
2
|
9
|
5–6
|
10
|
25
|
15
|
330
|
|
Pfriemenfaser von Spartium junceum
|
5
|
16
|
10
|
—
|
—
|
20
|
500
|
|
Steinkleefaser von Melilotus alba
|
5
|
18
|
10
|
20
|
36
|
30
|
330
|
|
Gambohanf von Hibiscus cannabinus
|
2
|
6(12)
|
5
|
14
|
33(41)
|
21
|
240
|
|
Lindenbast von Tilia europaea, platyphyllos
|
1,25
|
5
|
2
|
14
|
20
|
16
|
125
|
| [S. 252]
Jute v. Corchorus capsularis, olitorius etc.
|
0,8
|
(4,1)5
|
2
|
20(16)
|
25(32)
|
22,5
|
90
|
|
Faser von Lagetta linteria
|
3
|
6
|
5
|
10
|
20
|
—
|
500
|
|
Bast von Salix alba, capraea u. a.
|
—
|
3
|
2
|
17
|
30
|
22
|
90
|
|
Esparto oder Alfafaser von Stipa tenacissima
|
0,5
|
(1,9)3,5
|
1,5
|
7
|
18
|
12
|
125
|
|
Faser von Lygaeum Spartum
|
1,3
|
4,5
|
2,5
|
12
|
20
|
15
|
160
|
|
Ananasfaser von Ananassa sativa
|
3
|
9
|
5
|
4
|
8
|
6
|
830
|
|
Faser von Bromelia Karatas
|
2,5
|
10
|
5
|
20
|
32
|
24
|
210
|
|
Faser von Bromelia Pinguin
|
0,75
|
2,5
|
2
|
8
|
16
|
13
|
150
|
|
Neuseeländischer Flachs von Phormium tenax.
|
2,5
|
(5,6)15
|
8–10
|
8
|
20
|
16
|
550
|
|
Faser von Yucca sp.
|
0,5
|
6
|
3,5–4
|
10
|
20
|
—
|
170
|
|
Sanseveria-Faser v. Sanseveria zeylanica
|
1,5
|
6
|
3
|
15
|
26
|
20
|
150
|
|
Pite-Faser von Agave americana
|
1,5
|
4
|
2,5
|
20
|
32
|
24
|
100
|
|
Manilahanf von Musa textilis
|
3
|
12
|
6
|
16
|
32
|
24
|
250
|
|
Manilahanf von Musa paradisiaca, M. Sapientum
|
—
|
—
|
5
|
20
|
40
|
28
|
180
|
|
Faser von Phoenix dactylifera
|
2
|
6
|
3
|
16
|
24
|
20
|
150
|
|
Faser von Corypha umbraculifera
|
1,5
|
5
|
3
|
16
|
28
|
24
|
120
|
|
Faser von Elaëis guineensis
|
1,5
|
3,5
|
2,5
|
10
|
13
|
11
|
230
|
|
Faser von Raphia taetigera
|
1,5
|
3
|
2,5
|
12
|
20
|
16
|
160
|
|
Faser von Mauritia flexuosa
|
1
|
3
|
1,5
|
10
|
16
|
12
|
130
|
|
Coïr-Faser von Cocos nucifera
|
0,4
|
1
|
0,7
|
12
|
24
|
20
|
32
|
|
Tillandsia-Faser
|
0,2
|
0,5
|
—
|
6
|
15
|
—
|
—
|
|
Piassava
|
0,3
|
0,9
|
—
|
—
|
—
|
—
|
—
|
|
Abelmoschus tetraphyllos, Bast
|
1
|
1,6
|
—
|
8
|
20
|
—
|
—
|
|
Sida retusa, Bast
|
0,8
|
2,3
|
—
|
15
|
25
|
—
|
—
|
|
Urena sinuata, Bast
|
1,1
|
3,2
|
—
|
9
|
24
|
—
|
—
|
|
Baumwolle (Gossypium)
|
10
|
52
|
—
|
12
|
42
|
—
|
—
|
|
Wollbaumwolle (Bombax)
|
10
|
30
|
—
|
19
|
42
|
—
|
—
|
|
Wolle von Ochroma Lagopus
|
5
|
15
|
—
|
16
|
35
|
—
|
—
|
|
Vegetabil. Seide v. Asclepias curassavica
|
10
|
30
|
—
|
20
|
44
|
—
|
—
|
|
„ „ „ Calotropis gigantea
|
20
|
30
|
—
|
12
|
42
|
—
|
—
|
|
„ „ „ Marsdenia
|
10
|
25
|
—
|
19
|
33
|
—
|
—
|
|
„ „ „ Strophanthus
|
10
|
56
|
—
|
49
|
92
|
—
|
—
|
|
„ „ „ Beaumontia
|
30
|
45
|
—
|
33
|
50
|
—
|
—
|
|
Aloë perfoliata, Aloëhanf
|
1,3
|
3,7
|
—
|
15
|
24
|
—
|
—
|
|
Calotropis gigantea, Bastfaser
|
7
|
30
|
—
|
18
|
25
|
—
|
—
|
|
Bauhinia racemosa, Bast
|
1,5
|
4 u. mehr
|
—
|
8
|
20
|
—
|
—
|
|
Thespesia Lampas, Bast
|
0,92
|
4,7
|
—
|
12
|
21
|
—
|
—
|
|
Cordia latifolia, Bast
|
1
|
1,6
|
—
|
15
|
17
|
—
|
—
|
|
Sterculia villosa, Bast
|
1,5
|
3,5
|
—
|
17
|
25
|
—
|
—
|
|
Holoptelea integrifolia, Bast
|
0,9
|
2,1
|
—
|
9
|
14
|
—
|
—
|
|
Kydia calycina, Bast
|
1
|
2
|
—
|
16,8
|
24,2
|
—
|
—
|
|
Lasiosyphon speciosus, Bast
|
0,42
|
5,1
|
—
|
8
|
29
|
—
|
—
|
|
Sponia Wightii
|
—
|
4
|
—
|
—
|
—
|
—
|
—
|
|
Pandanus odoratissimus
|
1
|
4,2
|
—
|
—
|
—
|
—
|
—
|
Pflanzliche Fasern, die von Haaren gebildet werden.
Die die Epidermis überziehende Cuticula breitet sich auch über die Anhangsorgane der Epidermis, die Haare. Es werden daher alle pflanzlichen Fasern, die von Haaren gebildet[S. 253] werden, von einer Cuticula bedeckt sein. Doch ist zu bemerken, daß durch die eigentümliche Behandlungsweise, die gewisse weiche Fasern bei ihrer Verarbeitungsweise erfahren, bisweilen die charakteristische Reaktion der Cuticula verloren geht. So zeigt z. B. gut gebleichter Baumwollenzwirn an den Fäden keine Cuticula. Ferner pflegen die Haare keine gegabelte Spitze, wie sie viele Bastzellen zeigen, zu haben, sind dagegen oft verzweigt und an der Basis abgebrochen — also nicht beiderseits zugespitzt, wie die Bastzellen (Ausnahme s. oben S. 239). Da jedoch von letzteren meist nur Fragmente zur Untersuchung kommen, so fällt dies nicht sehr ins Gewicht. Tüpfel besitzen die Haare nur an ihrer Basis, wo sie an das Gewebe angrenzen. Meist führen sie Luft, doch ist bei ihnen ausnahmslos ein zartes Plasmahäutchen, der Innenwand anliegend, nachzuweisen. Einzellig sind die Haare der Baumwolle, der Pflanzenseiden und Dunen, von einer einfachen Zellreihe wird die Pulufaser, von mehreren Reihen das Wollgras, die Typhafaser u. and. gebildet.
1. Baumwolle.
wurde schon oben S. 229 behandelt.
2. Pflanzendunen.
Als Pflanzendunen bezeichnet man die Samen und Fruchthaare der Wollbäume (Bombaceen). Es gehören hierher: Ceibawolle, édredon végétal, Bombaxwolle, Kapok, patte de lièvre. Sie dienen vorwiegend als Stopfmaterial. Folgende Arten kommen in Betracht: Bombax Ceiba E., B. heptaphyllum L., B. malabaricum ROXB., Cochlospermum Gossypium DC., Ochroma Lagopus SW., Chorisia speciosa ST. HIL., Eriodendron anfractuosum Dc. (Bombax pentandrum L.)
Die Pflanzendunen sind einzellige konische Haare mit bisweilen angeschwollener oder zusammengeschnürter Basis und rundem Querschnitt. Die Länge beträgt 1–3 cm. Die Wandung ist verholzt; die Cuticula glatt und dünn. Die wichtigsten Pflanzendunen sind: Die Bombaxhaare von Bombaxarten und Eriodendron anfractuosum, schwach verholzt, bisweilen 3 cm lang und 19–43 mik dick, an der Basis netzförmig verdickt. Die sog. patte de lièvre von Ochroma Lagopus, 0,5–1,5 cm lang, sehr dickwandig (5–8 mik), braun.
3. Pflanzenseiden.
Als Pflanzenseide bezeichnet man wegen ihres seidenartigen Glanzes die Samenhaare zahlreicher Asclepiadaceen und Apocyneen: Asclepias curassavica E., Calotropis gigantea R. BR., Marsdenia, Beaumontia grandiflora, Strophanthus hispidus u. and. Die Fäden der Pflanzenseiden sind 1–3 cm lang, steif, bis 80 mik dick. Die meist dünne verholzte Wandung zeigt im Querschnitte deutliche, mehr oder weniger nach innen vorspringende Längsleisten. Der Querschnitt des Haares ist rund.
4. Einheimische Wollhaare.
Als Stopfmaterial werden bisweilen die bis 3,5 mm langen, einzelligen, zylindrischen Samenhaare von Populus (Pappelwolle), die einreihigen mehrzelligen Perigonhaare der Früchte von Typha angustifolia (Rohrkolbenwolle), die 2–4 cm langen, mehrzelligen, zweischichtigen Haare des Haarschopfes der Früchtchen von unseren Eriophorumarten u. and. mehr verwendet.
Pflanzliche Bastfasern.
Die pflanzlichen Bastfasern werden fast ausnahmslos von Bastzellen oder Bastzellgruppen gebildet, denen in einigen Fällen noch andere Gewebselemente anhängen. Sehr selten werden auch Libriformzellen technisch verwertet. Die Bastzellen sind ringsum geschlossen und laufen beiderseits mehr oder weniger spitz zu oder sind an den Spitzen mit kleinen Seitenspitzchen versehen. Sie sind niemals verzweigt, meist sehr stark verdickt, von rundlichem oder polyedrischem, übrigens sehr charakteristisch variierendem Querschnitte. Die Tüpfel sind stets einfach, meist spaltenförmig. Bei den Bastzellen der Dicotylen sind die Tüpfel meist sehr undeutlich oder fehlen, bei denen der Monocotylen sind sie zahlreich. Einige Handelsfasern sind auch noch durch die von HÖHNEL richtig gedeuteten eigentümlichen Wandverschiebungen (Knoten, Querbruchstellen, Sprunglinien, plis de flexion) ausgezeichnet, die aber erst bei der Bearbeitung der Faser entstehen (SCHWENDENER), mit Chlorzinkjod sich dunkler färben, und den Fasern, die sie besitzen (Flachs, Lein, Ramieh, Nessel) ein sehr charakteristisches Ansehn geben. Sie fehlen der Jute, die nicht «gebrochen» wird. Das wichtigste Hilfsmittel der[S. 254] Diagnose ist der Querschnitt der Faser (VÉTILLARD, VON HÖHNEL). Niemals besitzen natürlich Bastfasern eine Cuticula (Unterschied von den Haaren). Der Inhalt besteht meist aus Luft, ein Plasmahäutchen ist fast ausnahmslos vorhanden, anderer Inhalt selten. Sie sind stets sehr lang. Die die Bastfasern da und dort begleitenden Gewebselemente sind Parenchymzellen, Kristallzellen, Gefäße, Tracheïden, Sklereïden, Siebröhren. Parenchymzellen finden sich bei den Rohbastfasern (z. B. Hanf, Flachs) fast ausnahmslos, denn da der Prozeß der Gewinnung der Faser auf einer mechanischen Herauslösung derselben aus den übrigen Geweben beruht, so ist es erklärlich, daß der (auf diese Weise) isolierten Faser noch Reste der begleitenden Gewebe anhängen. Dort wo die Bastfasern überhaupt nicht eigentlich isoliert werden, sondern samt dem umgebenden Gewebe verwendet werden (Manilahanf, Coir), sind sie natürlich stets deutlich nachzuweisen.
1. Leinfaser.
Die Flachsfaser wird von den zu, einen konzentrischen Panzer bildenden, Gruppen vereinigten Bastfasern der Stengelrinde des Lein, Linum usitatissimum L., gebildet, die nach dem Ausreißen und Riffeln der Stengel durch Rösten (Faulen in Wasser), Brechen (Zertrümmern und Herauslösen des spröden Holzkörpers), Hecheln (Abstreifen des begleitenden Rindenparenchyms und der Epidermis) und Schwingen von den übrigen Elementen des Stengels losgelöst werden. Der Rohflachs enthält daher stets noch Parenchym- und Epidermiszellen, ja sogar Holzelemente, die gereinigten besten Sorten bestehen dagegen nur aus Bastfasern.
Die Bastzellen des Lein sind gänzlich unverholzt, bestehen also aus reiner Zellulose, sehr stark und gleichmäßig verdickt und mit engem, fadenförmigem, plasmaerfülltem Lumen versehen. Die Enden sind sehr spitz und lang ausgezogen, die Wandung zeigt deutliche Verschiebungen (Sprunglinien), Poren sind kaum oder garnicht zu bemerken. Die Bastzellen des Lein sind entweder isoliert oder zu weniggliederigen Gruppen vereinigt. Der Querschnitt ist meist eckig-polygonal, eine Mittellamelle tritt bei Behandlung mit Schwefelsäure nicht deutlich hervor. Die Schichtung der Wand ist undeutlich. Bez. der Länge und Breite vgl. die Tabelle (S. 251). Das Geschichtliche des Lein wird bei den Schleimdrogen unter Linum besprochen werden.
2. Hanffaser.
Die Bastzellen des Hanf liegen in großer Zahl zu vielen Gruppen vereinigt in der Rinde des Stengels der Hanfpflanze, Cannabis sativa L. Sie sind schwach verholzt, nicht so gleichmäßig verdickt wie die des Lein, und mit zahlreichen Verschiebungen versehen. Das Lumen ist meist weit, verengert sich jedoch gegen die sehr dickwandige, stumpfe, bisweilen mit seitlichen Auszweigungen versehene, gegabelte Spitze linienförmig. Die Bastzellen stehen hier stets in Gruppen. Der Querschnitt der einzelnen Bastzelle ist abgerundet, oft tangential gestreckt, nicht eckig, das Lumen erscheint spaltenförmig oder polygonal und inhaltsleer, die Membran geschichtet. Bei Behandlung mit Jodschwefelsäure tritt die Mittellamelle scharf hervor, sowohl bei den Gruppen als auch — als anhängende Fetzen — bei der einzelnen Faser (VON HÖHNEL).
Nach HÖHNEL genügt der anatomische Befund der Faser selbst zur Unterscheidung der Lein- und Hanffaser. CRAMER zieht zur Diagnose noch die begleitenden Gewebselemente — Epidermis, Haare, Spaltöffnungen, Kristallzellen, Gerbstoffzellen — herbei. Dieselben dienen ihm als «Leiter». Haare, Kristall- und Gerbstoffzellen hat nur der Hanf. T. F. HANAUSEK fand (1908), daß sich der Plasmaschlauch der Hanffaser bei Behandeln mit Chromsäuregemisch anders verhält wie bei der Leinfaser. Während er bei letzterer oft gewunden (ähnlich wie bei der Baumwolle, Fig. 89) erscheint, ist er beim Hanf niemals wellenförmig verbogen, sondern gerade und tritt sehr plastisch hervor. R. KORN hält die Unterscheidung mit Cuoxam für besser (1910). Der Hanf ist dem semitisch-ägyptischen Kulturkreise fremd. (Im übrigen vgl. Fruct. cannabis.)
Der Hanffaser sehr ähnlich ist die:
3. Sunnfaser.
Dieselbe entstammt den rindenständigen Bastbündeln von Crotalaria juncea. Die Unterschiede beruhen in einem breiten, nicht spaltenförmigen, inhaltführenden Lumen und breiten verholzten äußeren Membranpartien, die sich von den inneren nicht verholzten sekundären Verdickungsschichten leicht ablösen (VON HÖHNEL).
[S. 255]
4. Nesselfaser.
Die Bastfasern von Urtica dioica L. finden sich ebenfalls in der Stengelrinde. Sie sind unverholzt, unregelmäßig gebaut, die nicht sehr dicke Wandung ungleichmäßig gestreift. Das breite Lumen enthält oft Inhalt. Die Enden sind ausgezogen, abgerundet, meist löffelförmig erweitert, manchmal quer abgeschnitten oder gegabelt. Der Querschnitt der Bastzellen ist oval, abgeplattet, ja bandförmig, bisweilen mit einspringenden geschichteten Wandungen versehen (VON HÖHNEL).
5. Chinagras.
Das Chinagras oder die Ramié (Ramiehfaser) wird von den rindenständigen, einzelnen oder zu kleinen lockeren Bündeln vereinigten Bastzellen der Stengel von Boehmeria nivea (L.) HOOK. et ARN. gebildet. Die Bastzellen sind sehr ansehnlich (vgl. Tabelle S. 251), gänzlich unverholzt und zeigen häufig Verschiebungen. Das bisweilen Inhalt führende Lumen ist sehr breit, verschmälert sich aber gegen die Enden linienförmig; die Spitze ist dickwandig und abgerundet, der Querschnitt ist länglich oder flach zusammengedrückt, an den breiteren Stellen bandartig, die Wandung zeigt Schichtung. Sehr ähnlich ist die Roafaser von Pipturus argenteus.
6. Jute.
Die Jute wird von den rindenständigen, relativ kurzen, stets zu Gruppen vereinigten Bastzellen der Stengel von Corchorus capsularis L., C. olitorius L. u. and. Corchorusarten gebildet. Die Jutebastfasern sind stark verholzt, im Querschnitt isodiametrisch-polygonal, scharfkantig, mit schmaler Mittellamelle. Das Lumen ist, trotzdem die Wandung stark verdickt ist, relativ weit, rundlich oder oval, bei ein und derselben Zelle oft an bestimmten Stellen verengert, an den Enden dagegen weit. Letztere sind relativ dünnwandig, kegelförmig oder abgerundet, Verschiebungen fehlen, ebenso Streifung (VON HÖHNEL). Der Jute morphologisch sehr ähnlich ist der:
7. Gambohanf.
Derselbe stammt von den Stengeln von Hibiscus cannabinus u. and. Hibiscusarten. Von der Jute unterscheidet er sich durch eine breitere Mittellamelle, dickwandige, bisweilen schwach gegabelte Enden und eine bisweilen bis zum Verschwinden des Lumens vorschreitende partielle Verdickung der Wand. Der Jute ähnlich sind auch die Abelmoschusfaser (von Abelmoschus tetraphyllos) und die Urenafaser (von Urena sinuata).
Dicotylenfasern sind ferner: Die Hopfenfaser (v. Humulus Lupulus), die Papiermaulbeerbaumfaser (v. Broussonetia papyrifera), die Ginsterfaser (von Sarothamnus vulgaris), sowie die Daphnefaser (von Lagetta lintearia) — alle vier zur Papierfabrikation viel verwendet. Monocotylenfasern sind:
8. Neuseeländischer Flachs.
Derselbe wird vorwiegend gebildet von den Bastbelegen der Gefäßbündel der Blätter von Phormium tenax. Die vollständig verholzten Bastfasern sind gleichmäßig aber stark verdickt, das Lumen rund oder oval, leer, im Verlaufe der Fasern gleich breit. Die Enden sind scharf zugespitzt. Der Querschnitt ist rundlich oder polygonal mit abgerundeten Ecken. Mittellamelle undeutlich. Gefäße sind selten als Begleiter aufzufinden. Dem Aloëhanf und der Sanseveriafaser sehr ähnlich.
9. Manilahanf.
Unter dem Namen Manilahanf, Abaca, Plantainfibre, Siamhemp, white rope kommen die Bastfasern von Musa textilis NEES in den Handel. Dieselben sind stark verholzt, gleichmäßig aber nicht sehr erheblich verdickt, mit glatter Wand und großem, rundlichem, bisweilen inhaltführendem Lumen. Der Querschnitt der stets zu mehr oder weniger lockeren Gruppen vereinigten Bastfasern ist rundlich-polygonal. Mittellamelle undeutlich. Die Fasern werden von 30 mik langen verkieselten Zellen (Stegmata) begleitet.
10. Pitafaser.
Die Pitafaser, Pite, Sisal, Matamoros, Tampicohanf, besteht aus den Bastbelegen der Gefäßbündel der Blätter von Agave americana L. u. a. Agave-Arten. Die verholzten, stets zu Gruppen vereinigten Bastzellen (s. Tabelle) sind in der Mitte oft breiter, besitzen ein sehr weites (viel breiter als die Wand), polygonales Lumen und eine dünne Wand. Die breiten, stumpfen, selten gegabelten[S. 256] Enden sind stets verdickt. Die Mittellamelle ist undeutlich. Der Querschnitt der Bastzellen ist polygonal. Die Fasern werden begleitet von zahlreichen großen, spiraligen Gefäßen und Kristallzellen mit bis 0,5 mm langen Oxalatprismen oder deren Trümmern.
11. Aloëhanf.
Der Aloëhanf, Aloëfaser, Mauritiushanf sind gleichfalls Bastzellbündel von Blättern, und zwar von Aloëarten (bes. Aloë perfoliata). Die dünnen Bastzellen sind meist sehr stark verdickt, die Wandung (s. Tabelle) zeigt sehr steil linksschief gestellte Tüpfel, die Enden sind spitz oder kegelförmig, der Querschnitt ist polygonal, das Lumen rund, wenig breiter als die Wand. Die Faser wird von Gefäßen begleitet.
Sehr ähnlich gebaut ist die Sanseveriafaser von Sanseveria ceylanica.
12. Coirfaser.
Die braune Coirfaser entstammt der Fruchtschale der Cocosnuß (Cocos nucifera) und wird von den Gefäßbündeln derselben gebildet, die starke Sklerenchymbelege besitzen und von Stegmata begleitet sind.
Monokotylenfasern sind ferner: Ananasfaser, Silkgras, pine-apple fibre von Ananasa sativa. Yuccafaser von Yucca gloriosa. Alfafaser, Esparto von Stipa tenacissima und Ligaeum Spartum (das ganze Blatt). Pandanusfaser von Pandanus odoratissimus (Bastbündel der Blätter). Tillandsiafaser, vegetabilisches Roßhaar von Tillandsia usneoides (Bastbündel der Stengel). Palmenfasern und zwar: Piassave, Piassaba, Monkeygras von Attalea funifera MART. (Bahia-Piassave) und Leopoldinia Piacaba WALL. (nach T. F. HANAUSEK Paragras, Para-Piass.) (Bastbündel aus den Battscheiden). Palmettofaser, orin végetal, orin d’Afrique, von Chamaerops humilis (geschlitzte Blätter). Dattelpalmenfaser von Phoenix dactylifera (Blätter). Talipotfaser von Corypha umbraculifera. Raphiabast, Raphiastroh von Raphia taedigera (subepidermale Bastbelege der Blätter und Blattstiele). Kitool, Siamfaser von Caryota urens u. and. m.
Analytische Tabellen zur mikroskopischen Bestimmung der Fasern teilte HÖHNEL (a. a. O. und Beitr. zur techn. Rohstofflehre. Dingl. Polytechn. Journ. 1884, S. 251 u. 273) mit.
Ich verweise auf diese und bemerke nur, daß er folgende Gruppen bildet:
- Fasern, die durch Jodschwefelsäure blau, violett oder grünlich gefärbt werden.
- Dikotyle Bastfasern und Baumwolle — ohne Gefäße (Flachs, Hanf, Sunn, Chinagras, Roafaser von Pipturus argenteus).
- Monokotyle Fasern, mit Gefäßen, ohne Verschiebungen (Alfa [Esparto] und Ananasfaser).
- Fasern, die durch Jodschwefelsäure gelb gefärbt werden.
- Dikotyle Fasern, ohne Gefäße, Lumen mit Verengerungen (Jute, Abelmoschusfaser, Gambohanf, Urenafaser).
- Monokotyle Fasern, mit Gefäßen, Lumen keine Verengerungen (Neuseeländ. Flachs, Manilahanf [oft ohne Gefäße], Sanseveriafaser, Aloëhanf von Aloë perfoliata, Pitahanf, Yuccafaser von Yucca gloriosa).
Zur Papierfabrikation werden verwendet (bez. der Einzelheiten vgl. VON HÖHNEL, WIESNER, T. F. HANAUSEK): Lein, Hanf, Baumwolle, Weizen-, Roggen-, Hafer-, Reis-, Maisstroh, Esparto, Bambusrohr, Jute, Papiermaulbeerbaumfaser und Holzstoff (bes. das geschliffene Holz von Coniferen). Die Alten bedienten sich zum Beschreiben der Tempelwände (Ägypten), der Tontafeln (Assyrien), der Wachs- und Holztafeln (Rom), der Tierhäute (Pergament, verbessert in Pergamon II. Jahrh. n. Chr., verdrängte vom IV. Jahrh. an die Charta, dann wichtigster Schreibstoff des Mittelalters), des Leders, monokotyler Blätter (Bambus [China], Palmen [Indien, dort auch heute noch üblich]), einiger Rinden (z. B. des Birkenperiderm bes. in Asien, in Kaschmir bis ins XVI. Jahrh.), dann der Lindenbaststreifen (Rom) und des Papyrus (Charta: in dünne Blätter geschnittenes Mark der Papyrusstaude, die [zu dritt] übereinander gelegt und mit Stärkekleister miteinander verklebt wurden, bes. in Ägypten schon 2000 n. Chr. nachgewiesen, die ägyptische Papyrusfabrikation erlosch in der zweiten Hälfte des X. Jahrh., die sizilianische im XIII. Jahrh.), sowie später (in Asien) des Reispapier (Araliamark). Das gefilzte Papier ist eine Erfindung der Chinesen (c. 105 n. Chr., vgl. I, S. 523). Ein mittelalterliches Baumwollpapier gab es nicht (WIESNER, KARABACZEK, KOBERT). Die ältesten Papiere der Chinesen aus den ersten Jahrhunderten unserer Zeitrechnung[S. 257] bestanden aus den Fasern der Broussoneiia papyrifera L’HÉRIT (Papiermaulbeerbaum). Einige Jahrhunderte später traten dann auch noch das Chinagras (Ramie, Nesselfaser) von Boehmeria nivea HOOK. et ARN., die Hanffaser und die Faser von Edgeworthia papyrifera SALZM. dazu (WIESNER). Die in Turfan und Khotan kürzlich gefundenen Papiere aus dem VI-IX. Jahrh. bestanden vorwiegend aus Broussonetia- und Boehmeriafasern (KOBERT). Hadernpapier ist (nach KARABACZEK und WIESNER) eine Erfindung der Araber (VIII. oder IX. Jahrh.), wurde aber im X. Jahrh. von den Chinesen angenommen (oder selbständig erfunden?). Die Papiergewinnung kam c. 850 durch die Mauren nach Spanien. In Italien entstanden im XI., in Deutschland im XIV. Jahrh. Papiermühlen. Die ältesten europäischen Papiere sind gleich den arabischen stark mit Stärkekleister geleimt. Diese Leimungsart läßt sich bis zum Ende des XIII. bzw. Anfang des XIV. Jahrh. verfolgen. Dann folgt der Leim. Erst im XIX. Jahrh. begann die Harzleimung kombiniert mit Stärkeleimung. Bis zum XIV. Jahrh. sind die europäischen Papiere sehr langfaserig, nach und nach treten kurzfaserige an ihre Stelle, was auf eine tief eingreifende Umgestaltung des Papiererzeugungsverfahrens hinweist (WIESNER).
Lit. VON HOEHNEL, Die Mikroskopie d. technisch verwendeten Faserstoffe. 2. Aufl. 1905 (mit guten anatom. Abbild. und einem erschöpfenden Literaturverzeichnis). — WIESNER, Rohstoffe d. Pflanzenreiches. I. u. II. Aufl. 1873 und 1903. — VÉTILLARD, Etudes sur les fibres végétales textiles, employées dans l’industrie. Paris 1876. — T. F. HANAUSEK, Lehrb. d. techn. Mikroskopie. 1900. — HANAUSEK-WINTON, Microscopy of techn. prod. 1907. — SCHLESINGER, Mikrosk. Unters. d. Gespinstfas. Zürich 1873. — JOS. MOELLER, Pflanzen-Rohstoffe. Ber. über d. Weltausstell. in Paris. 1878, Wien. — FRANK-TSCHIRCH, Pflanzenphys. Wandtafeln. — HASSAK, Wandtafeln. — Abbild. auch in HAGER-FISCHER-HARTWICH, Handb. d. pharm. Praxis I, S. 1244 und den betr. Artikeln in Realenzyklop. d. Pharm. — FOCKE, Mikrosk. Unters. d. bekannt. Gespinstf. Arch. Pharm. 1886 (m. Abbild.). — BARILLÉ, Etudes des fibres textiles. Thèse Straßburg 1868. — CRAMER, Programm d. Zürich. Polytechnik. 1881; vgl. mein Refer. in Pharm. Zeit. 1881, Nr. 73. — VON HOEHNEL, Über den Einfluß des Rindendruckes. Pringsh. Jahrb. XV, S. 311. — SCHWENDENER, Über d. Verschiebung d. Bastfasern im Sinne VON HOEHNELS. Ber. d. d. Bot. Ges. 1894, 239. — T. F. HANAUSEK, Eine neue Methode zur Unterscheid. d. Flachs- und Hanffaser. Zeitschr. Farben-Industr. 1908. — GRESHOFF, De qualitatieve en quantitatieve bepaling van katoen naast kapok. Pharm. Weekbl. 1908. — J. AISSLINGER, Beiträge z. Kenntnis wenig bekannter Pflanzenfasern. Diss. Zürich 1907. — CROSS, BEVAN, KING and JOYNSON, Report on Indian fibres and fibrous substances. London 1887.
Über Papier vgl. VALENTA, Das Papier, seine Herstellung, Eigenschaften, Verwendung usw. Halle 1904, — CARL HOFMANN, Prakt. Handb. d. Papierfabrikat. I. B. 1891, II. B. 1897 Berlin. — HERZBERG, Papier-Prüfung. I. Aufl. 1888, II. Aufl. 1902 und D. heutige Stand d. Papierprüfung. Papier-Zeit. 1892. — MIERZINSKI, Handb. d. prakt. Papierfabrikation und Anleit. z. Unters. d. in d. Papierfabrik. vorhand. Rohprodukte in HARTLEBENS Chem. techn. Biblioth. B. 138–142. — HOYER, D. Papier, seine Beschaffenheit u. Prüf. 1882. — E. KIRCHNER, Das Papier I, Geschichte d. Papierindustrie 1897. — A. MEYER, Grundlagen 1901. — KOBERT, Über einige echte gefilzte Papiere des frühen Mittelalters. Zeitschr. Angew. Chem. 1910, 1249. — T. F. HANAUSEK in Real-Enzykl. d. ges. Pharm. VII und IX und Über einige besondere Papierbestandteile in Papierfabrikant 1910. — WIESNER, Die mikroskop. Unters. d. Papiers mit bes. Berücks. d. ältesten oriental. u. europäisch. Papiere. Mitt. aus d. Samml. d. Papyrus Erzherz. Rainer 1887. Die Geschichte des Papiers in WIESNER, Rohstoffe II, S. 429 — die bei der modernen Papierfabrikation benutzten Fasern sind ebenda aufgeführt und bei VON HOEHNEL a. a. O.
2) Reservezelluloso-Membranindrogen (Hemizellulosedrogen).
Die Membranen des Endosperms vieler Samen bestehen aus sog. Reservezellulose, die beim Keimen der Samen gelöst wird. Sie erweist sich verdünnten Säuren gegenüber als sehr verschieden resistent. Einige dieser Reservezellulosen lassen sich relativ leicht mit Säuren oder Enzymen hydrolysieren, wie die gemischten Mannane der Samenendosperme der Datteln, Palmkerne, Cocosnüsse, sowie von Ceratonia, Strychnos potatorum, Siliqua und Trigonella Foenum graecum, die sich als vornehmlich[S. 258] aus Galaktomannanen bestehend erwiesen, und die des Endosperms von Phytelephas macrocarpa, das viel Fruktomannan enthält — andere Mannosozellulosen, wie die der Kaffeebohnen, sind Säuren gegenüber sehr resistent. REISS fand bei der Hydrolyse Mannose (Seminose) liefernde Reservezellulose bei den Samen von Phytelephas, Phoenix dactylifera, Chamaerops humilis, Lodoicea Seychellarum, Elaëis guineensis, Allium Cepa, Asparagus, Strychnos nux vomica, Coffea arabica, Foeniculum officinale.
Während echte Zellulose nur Glukose liefert, liefert also die Reservezellulose, die sich leichter spalten läßt, andere Hexosen und oft Pentosen. Die bei der Hydrolyse mit verdünnten Mineralsäuren leicht in Lösung gehenden und dabei Galaktose, Mannose, Arabinose und Xylose liefernden Zellulosen nennt E. SCHULZE Hemizellulosen. Man nennt die Atomgruppen der Hemizellulosen, welche Galaktose oder Mannose, oder Arabinose oder Xylose liefern, Galaktane, Mannane, Arabane oder Xylane. Dementsprechend sind auch die Namen Pentosane und Hexosane gebildet (TOLLENS). Bei der Hydrolyse der Hemizellulosen entstehen die Monosen in so großen Mengen, daß sie zweifellos die Hauptprodukte der Umwandlung sind (E. SCHULZE). Hemizellulosen sind bei 300° in Glycerin löslich, aber nicht immer in Kupferoxydammoniak.
EULER teilt die Hemizellulosen in zwei Gruppen:
1. Reservezellulose in den Samen sowohl bei Monokotylen (Palmen, Liliaceen, Iridaceen), wie bei Dikotylen (Rubiaceen, Oleaceen, Convolvulaceen, Plantagineen, Primulaceen, Sapotaceen, Balsaminaceen, Tropaeolaceen, Ranunculaceen, Leguminosen, Myrtaceen). Die Lösung bei der Keimung bewirkt ein Enzym, die Cytase. Das Ferment führt die Hemizellulosen in verschiedene Zucker über, dadurch werden die aus Reservezellulose bestehenden Zellwände gelöst. Bis jetzt wurden bei der Aufspaltung der Reservezellulose erhalten: d-Mannose, dl-Galaktose, seltener d-Fruktose und d-Glukose. Sie enthalten also Galaktomannane. Die Membranen der Dattel z. B. liefern bei der Keimung durch den Einfluß der Enzyme Galaktose, d-Glukose und d-Mannose (GRÜSS). Die Endosperme der Palmensamen enthalten vorwiegend Mannane. Dattelsamen z. B. liefern fast ausschließlich d-Mannose, die Reiss Seminose nannte, wie viele Liliaceensamen, die Samen von Phytelephas macrocarpa Mannose und Fruktose. Die meisten Palmensamen geben auch Galaktose und enthalten daher Mannogalaktane, die sich auch bei Strychnos, Umbelliferen, Leguminosensamen (Ceratonia, s. d.) finden. Den Namen «Reservezellulose» habe ich 1888 (Angewandte Anatomie S. 171) eingeführt und dort auch ihre Rolle geschildert. Daß die Membranen einiger Samen beim Keimen gelöst werden, stellten zuerst SACHS (1862 bei der Dattel) und FRANK (1866 bei Tropaeolum) fest.
2. Hemizellulosen, die nicht den Charakter von Reservezellulose tragen, sondern Gerüstsubstanzen sind (Samenschalen usw.), enthalten vorwiegend Galaktane und Pentosane.
Über die Bildung und Auflösung der Reservezellulose äußert sich GRÜSS (1896) dahin, daß z. B. beim Dattelsamen zuerst Mannan gebildet wird und dann erst das Galaktan, und daß auch bei der Auflösung gelegentlich der Keimung der eine Bestandteil früher gelöst wird als der andere. GRÜSS meint, daß Galaktan und Araban durch die Enzyme nicht sofort in Galaktose und Arabinose, sondern zunächst in gummiartige Körper (Galaktin und Arabin) übergeführt werden (?) und auch als solche wandern können. Die Auflösung der Reservezellulosewände geschieht nach REISS (1889) entweder durch Abschmelzen von innen her (Phoenix, Chamaerops), durch intralamellare Lösung (Asparagus), durch intralamellare Verflüssigung (Foeniculum), durch intralamellare Lösung mit gleichzeitiger Korrosion (Allium, Cyclamen), durch Korrosion[S. 259] unter gleichzeitigem Abschmelzen (Iris) oder nur durch Korrosion (Tropaeolum, Impatiens). Auch in Rhizomen, Knollen und Zwiebeln finden sich Mannane als Reservezellulose.
Die zu 80% in den Sklerotien von Pachyma Cocos als Membranablagerung vorkommende Pachymose (WINTERSTEIN), die durch Jodschwefelsäure gelb wird und bei der Hydrolyse Glukose liefert, scheint ebenfalls ein Reservemembranin zu sein.
Lit. Zahlreiche Arbeiten von TOLLENS und seinen Mitarbeitern, sowie von E. SCHULZE und seinen Mitarbeitern (WINTERSTEIN, FRANKFURT, SCHELLENBERG, CASTORO, GODET u. and., Verzeichnis in Journ. f. Landwirtsch. 1904) und BOURQUELOT et HÉRISSEY und Mitarbeitern [Journ. ph. chim. 11 u. 12 (1900), Compt. rend. 130 (1900), usw.]. — E. SCHULZE, Über die zur Gruppe d. stickstofffreien Extraktstoffe gehörenden Pflanzenbestandt. Journ. f. Landwirtsch. 1904. — KLEIBER, Vers. z. Best. d. Geh. einiger Pflanz. u. Pflanzent. an Zellwandbestandt. Hemizellulosen u. Zellulose. Diss. Zürich. 1900. — SACHS, Sitzungsber. d. Wien. Akad. 1859. — TSCHIRCH, Angewandte Pflanzenanatomie. 1888. — GODFRIN, Ann. sc. nat. (6), 19, 1. — REISS, Über die Natur der Reservezellulose usw. Landw. Jahrb. 1889 u. Ber. d. d. chem. Ges. 22. 609. Ber. d. d. bot. Ges. 1889. — GREEN, Phil. Transact. London 178 (1887), 38. — BROWN u. MORRIS, Journ. chem. soc. 1890, 458. — ELFERT, Auflösungsvers. d. sekund. Zellm. d. Samen. Bibl. bot. 30, 1894. — GRÜSS, Lös. u. Bild. der aus Hemizellulose bestehenden Zellwände u. ihre Bezieh. z. Gummosis. Bibl. botan. 39, 1896 u. Bot. Zentralbl. 70. — M. GORET, Et. chim. et physiol. de quelqu. album. cornés de Graines de Légumineuses Thèse. Paris 1901. — E. SCHULZE, Ber. d. d. chem. Ges. 24, 2277. — SCHELLENBERG, Ber. d. d. bot. Ges. 1904, 9 und 1905. — CZAPEK, Biochemie (dort auch die Liste der Familien, bei deren Samen Reservezellulose vorkommt). — Zusammenfassung: E. SCHULZE u. CH. GODET, Unters. über d. in den Pflanzensamen enthalt. Kohlenhydrate. Zeitschr. phys. Chem. 61 (1909), 279.
Steinnuß.
Vegetabilisches Elfenbein (= Phyt-elephas) — corozo, morphil végétal, ivoire végétal (franz.) — yvory nut (engl.) — tagua, cabeza de negro (port.).
Die Stammpflanze der Steinnüsse ist Phytelephas marcocarpa RUIZ et PAVON (Syst. veg. 1798), dann wohl auch: Ph. microcarpa RUIZ et PAV. und einige andere Arten (Ph. Ruizii, Ph. Pavonii u. and.). Der Kew Index führt 15 Arten auf. DRUDE sagt: wenigstens drei.
Systemat. Stellung. Palmae-Phytelephantinae (Palmae anomalae). ROBERT BROWN stellt Phytelephas zu den Pandaneen, KUNTH zu den Typhinen, MARTIUS bildete aus ihnen eine besondere Familie: Phytelephantaceae (Phytelephasieae BRONGNIART).
Beschreibung. Die Phytelephasarten finden sich im tropischen Südamerika zwischen dem 9° n. B. und 8° s. B., sowie 70–79° w. L., an den Ufern der Ströme und Bäche, an der Küste und in der Bergregion. Ph. macrocarpa bildet einen bis 2 m hohen Stamm; Ph. microcarpa ist stammlos. Die Palme ist diklin-diöcisch. Der Fruchtkolben besteht aus sechs oder mehr aneinander gedrückten, beerenartigen Einzelfrüchten (Syncarpium), die außen hartholzige Protuberanzen zeigen. Jede Frucht hat 4–6 Fächer und ebensoviel Samen. Der Same ist von einer harten, bei den einzelnen Sorten verschiedenfarbigen, oft schwarzbraunen, aber häufig mit einer lehmfarbigen, abreibbaren Schicht (Mesocarprest) bedeckten Steinschale (Endocarp) umgeben, in der ein Keimdeckel sichtbar ist. Bricht man die sehr spröde Schale auf, so sieht man auf der braunen Samenschale ein grobes Netzwerk (Raphenetz). Sägt man den Samen der Länge nach durch, so findet man am einen Ende, etwas seitlich von dem Nabel, in einer konischen, durch einen Deckel geschlossenen Höhlung den kleinen Keimling. Die Hauptmasse des Samens besteht aus dem mehr oder[S. 260] weniger rein-weißen, steinharten Endosperm, das im Innern einen groben Längsspalt oder eine gestreckte Höhlung zeigt, die besonders bei den großen Colon- und Guajaquil-, weniger, bei den kleinen Savanilla- und Tumaco-Sorten hervortritt und die Verwertung der Steinnüsse zur Knopffabrikation sehr beeinträchtigt. Das Endocarp zeigt in der schwarzen Zone Palissadensklereïden, die Kieselkörper enthalten (MOLISCH). Dann folgt eine Zone kleiner Sklereïden und die innerste Schicht besteht aus braunen Inhalt führenden Faserzellen. Die bisweilen abgescheuerte, oben aufsitzende Deckschicht (Mesocarprest) besteht aus netzig verdicktem, luftführendem Parenchym (T. F. HANAUSEK). Die Samenschale besteht aus verschieden langen und verschieden orientierten gestreckten Sklereïden mit braunem Inhalt (Abbild. bei VOGL). Das Endosperm ist steinhart. Seine Zellen sind außerordentlich stark verdickt und zeigen große Porenkanäle, die sich an der Trennungsplatte keulig erweitern. Die Trennungsplatte ist von feinen Plasmafäden durchzogen, die eine offene Kommunikation der Zellen hervorrufen (aggregierte Verbindungen), aber auch die ungetüpfelte Membran ist von feinen Plasmafäden durchzogen (solitäre Verbindungen, Abbild. bei KOHL, Ber. d. d. bot. Ges. 1900, Taf. X). Die primäre Membran sowie die Schichtung der sekundären treten erst beim Behandeln mit Kali hervor. Die Wand wird durch Jod-Schwefelsäure blau. Im Lumen sieht man beim Präparieren in Öl große Aleuronkörner.
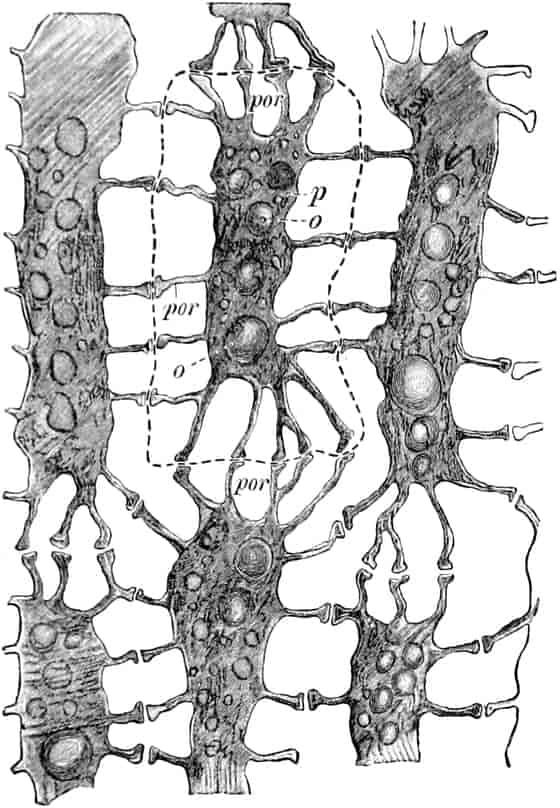
Zellen aus dem Endosperm der Samen von Phytelephas macrocarpa.
[Aus Tschirch, Angewandte Anatomie.]
Chemie. REISS fand in der Steinnuß 11,04 Wasser, 3,1–4,2 Proteïn, 1,51 Fett, durch heißes Wasser extrahierbar (exkl. Zucker) 7,5, Dextrose 0,49, Zellulose 74–75, Asche 1,3%. Bei der Hydrolyse erhielt er einen neuen Zucker, den er Seminose nannte und den EMIL FISCHER dann mit der d-Mannose (Rechts-Mannose, vgl. S. 6) identifizierte, die er bei der Oxydation des Mannits neben Fruktose erhalten hatte. Er ist auch identisch mit der Isomannitose, die TOLLENS und GANS bei der Hydrolyse des Salepschleims erhielten, und wohl auch mit der Carubinose. Der Pentosan- (nach IVANOW Araban-)gehalt beträgt 1,29% der Trockensubstanz. Die Seminase der Leguminosensamen vermag die Reservezellulose im Phytelephas- (u. and. Palmen-)Samen nicht direkt zu spalten — wohl aber, wenigstens teilweise, nach 24stündigem Digerieren 60% Schwefelsäure. Die Samen von Phytelephas enthalten ein Fruktomannan, das auf einen Teil d-Fruktose (Lävulose) 20 Teile Mannose liefert. IVANOW fand Hemizellulosen (Hexosane und Pentosane) und zwar 2,16%[S. 261] Pentosane und 1,55% Methylpentosane, viel Mannosezellulose und den dritten Teil davon Dextrosezellulose (?). Die Wände bestehen jedenfalls vorwiegend aus Mannanen.
Mannane finden sich in der Reservezellulose der Samen der Dattel, von Ceratonia und Phytelephas, im Salepschleim, in Cichorium, Taraxacum und Helianthuswurzeln, in Oliven, Äpfeln, Bananen, Mandeln (STORER) — Galakto-Mannane in den Samen von Ceratonia, Foenum graecum, Phoenix canariensis, Strychnos potatorum, — Gluko-Mannane im Samen von Ruscus aculeatus — Frukto-Mannane (Manno-Fruktosan) in vegetabilischen Elfenbein. STORER betrachtet das Mannan als einen weitverbreiteten Reservestoff.
Das Endosperm von Phytelephas macrocarpa enthält 8,8% Wasser und 5,48% der Trockensubstanz Rohfaser, d. h. durch Schwefelsäure während einer Stunde nicht verzuckerbare Substanz (LIEBSCHER). Der Gesamtstickstoffgehalt beträgt nur 0,619% (bei der Erdnuß: 8,132%, STUTZER), davon unverdaulich 0,082%, der Rohproteïngehalt 7,31% (FORMENTI, beim Dattelsamen 4,4%, GEORGES). Nach LIEBSCHER soll in den Phytelephassamen ein Alkaloid, Phytelephantin, vorkommen. MÉHU gibt Zucker (in den frischen Samen Rohrzucker) als Bestandteil an und den Eiweißgehalt auf 1,165–1,51%. Die Asche beträgt bei Phytelephas 1,40 (1,70 HOLDEFLEISS), bei der Tahitinuß (s. d.) 2,62% (HARZ). Die Asche enthält 33,58% SiO2. Die Steinschale gibt 14,6% Asche, vorwiegend aus Kieselsäure bestehend (MÉHU). Nach HARZ besitzen die Samen von Phytelephas eine Härte von 2,6, die Tahitinuß (s. weiter hinten) von 2,82 (tierisches Elfenbein 2,8, Areca Catechu 2,3).
Handel. Die Steinnüsse bilden einen bedeutenden Exportartikel des Magdalenenstromgebietes. Die Steinnüsse werden besonders aus Guajaquil und Manta (Ecuador) via Magellan oder Colon in Säcken von 100 kg exportiert. Columbien liefert die Corozos de Savanille.
Handelssorten (nach JOS. MOELLER): Marcellino, walnußgroß, c. 23 g schwer. Panama, größer, c. 53 g. Tumaco, von San Lorenzo, von Kugelausschnittform, Gew. 70 g. Palmyra, Kern graubläulich. Carthagena, 50–55 g schwer, Steinschale dunkelschwarzbraun. Guajaquil, Steinschale lehmfarbig, c. 45 g schwer. Esmeralda, kaffeebraun, Kern gelblich oder bläulich-weiß, Gew. 80 g. Colon, Gew. 80 g. Amazonas, taubeneigroß, Gew. 35 g, Kern elfenbeinweiß. Savanilla in vier Sorten (vgl. Wiesners Rohstoffe II, 691).
Der Großhandel unterscheidet besonders zwischen Guajaquil mit kleinem Spalt, 1000 geschälte Samen gehen auf 95–100 kg, und Savanilla mit großem Spalt, 1000 auf 5,5–7,5 kg (PLANCHON). Meist werden sie in der Steinschale (en coque) versandt. Die eine Hälfte des europäischen Bedarfes importiert Hamburg, die andere Le Havre und Genua.
Hamburg importierte 1908 aus Ecuador (Guajaquil-Manta, Esmeraldas, Tumacos in Columbien) 87950 dz, aus Columbien (Savanilla, Cathagena, Panama und Colon) 30300 dz.
Anwendung. Die Steinnuß wird in Deutschland, z. B. in Schlesien, dann in Böhmen, Wien, Frankreich und Nordamerika auf Knöpfe verarbeitet. Sie läßt sich färben. Die gemahlenen Abfälle werden zur Fälschung von Gewürzen und Kaffeesurrogaten benutzt. Gemahlene Steinnuß ist 1907 auch als Verfälschung von Mehl (VOY, BERTARELLI), sowie auch als Verfälschungsmittel des Knochenmehles und Palmkernmehles beobachtet worden (HARZ) und 1909 als Beimischung des Pulvers der Sem. strychni (LOUIS PLANCHON und JUILLET). Der Vorschlag von LIEBSCHER (1885), sie auf Albumin für Färbereizwecke zu verarbeiten, scheint nicht befolgt worden zu sein. Sie geben ein gutes Ausgangsmaterial zur Darstellung von Mannose.
[S. 262]
Lit. Abbild.: TSCHIRCH, Ind. Heil- und Nutzpfl. t. 102 und DRUDE in ENGLER-PRANTL, Pflanzenfam. II, 3, 89. — SEEMANN, Die Palmen (Deutsch von BOLLE). 2. Aufl. 1863. — T. F. HANAUSEK in WIESNER, Rohstoffe und Zeitschr. f. Nahrungsm. Hyg. u. Warenk. 1893, 197. — MORREN (cit. bei WIESNER, I. Aufl. S. 792. Erste anatom. Beschreibung). — JOS. MOELLER, Mitt. d. k. k. technol. Gewerbemus. Wien 1880. — KOHL, Ber. d. d. bot. Ges. 1900, 364. — LOUIS PLANCHON et A. JUILLET, Le Corozo, Bull. mens. de l’Acad. d. sc. et lettres. Montpellier 1909 und Encore le Corozo, Bull. de Pharm. de Sud-Est. 1910. — BERTARELLI, Zeitschr. Unters. Nahr. u. Genußm. 1907. — VOY, Journ. pharm. 1907. — MOLISCH, Die Kieselzellen in d. Steinschale der Steinnuß. Zentralorgan f. Warenk. und Technologie 1891, 103. — Anatom. Abbild. in PLANCHON-COLLIN, Drogues simples I, 141. — VOGL, Nahrungs- u. Genußm. S. 554. — HANAUSEK-WINTON, Microsc. of technical products p. 412. — Chem. Lit. s. oben S. 259. Ferner: IVANOW, Über die Kohlehydrate der Steinnußsamen, Journ. f. Landw. 1908, 217; Chem. Zeit. 1908, 32 Rep. 654. — Ältere Analysen: CONNELL, Journ. pr. Chem. 1844. — LOGES, Wochenbl. f. Schlesw.-Holst. 1886. — JOHNSON, Jahresber. f. Agrikulturchemie 1880, 413. — HOLDEFLEISS, Landwirt 1879, Nr. 39 und Zentr. Agr. Chem. 1880, 234. — Dann: REISS, Über d. Natur d. Reservezellulose u. über ihre Auflösungsweise bei d. Keimung d. Samen. Landw. Jahrb. 1889 und Über d. in d. Samen als Reservestoff abgelagerte Zellulose u. eine daraus erhaltene neue Zuckerart, die Seminose. Ber. d. chem. Ges. 22 (1889), 609. — EMIL FISCHER und HIRSCHBERGER, Ber. d. chem. Ges. 22 (1889), 365 u. 1155. — TOLLENS u. GANS, Ber. d. chem. Ges. 21, 2150. — STORER, Chem. Zentralbl. 1902, 2, 1155. — MEHU, Jahresb. d. Pharm. 1887, 114. — HARZ, Bot. Zentralbl. 18 (1884). — WOLFF, Aschenanalysen. — STUTZER, Zeitschr. phys. Chem. 11 (1887), 207. — FORMENTI, Chem. Zentralbl. 1902, II, 536. — LIEBSCHER, Journ. Landw. 33 (1885), 470. Bot. Jahresber. 1885, 84. — BAKER u. POPE, Proc. chem. soc. 16 (1900), 72. — LIÉNARD, Et. d. hydrates de carbone de réserv. d. quelqu. graines d. Palmiers. Thèse Paris 1903.
Unter dem Namen Tahiti- oder Fidschinüsse, Australische und Wassernüsse kommen, übrigens weder von Tahiti noch von anderen Freundschaftsinseln, sondern von den Karolinen und Salomonsinseln, seit 1876 zu dem gleichen Zwecke die ebenfalls steinharten Samen einer anderen Palme in den Handel, welche Palme WENDLAND, ohne sie zu kennen, Sagus amicarum, DINGLER Coelococcus carolinensis DINGL. nannte. WARBURG stellte dann fest, daß außer dieser Palme auch Coelococcus salomonensis WARB. Tahitinüsse liefert, und nach LOUIS PLANCHON kommen auch die Samen von C. vitiensis H. WENDL. in den Handel. Die Carolinennuß ist glatt und glänzend, die Salomonsnuß ist dunkelrotbraun und matt und zeigt zehn meridional verlaufende Wülste. Der Same von C. carolinensis ist 4–6 cm hoch und 5,5–8 cm breit, der Same von C. salomonensis 4,5–5 cm hoch und 5,5–7 cm breit, der Same von C. vitiensis 3 cm hoch und 4 cm breit (WARBURG).
Die Tahitinüsse sind die bisweilen über 200 g schweren kugeligen Samen der Pflanze, die namentlich dadurch ausgezeichnet sind, daß sie nach dem Durchsägen in der Längsrichtung becherartig erscheinen. Der Keimling liegt an der Außenseite mehr oder weniger exzentrisch. Die Keimhöhlung ist durch einen Deckel verschlossen. Der anatomische Bau des Endosperms der Tahiti-Steinnuß ist dem der Phytelephas-Steinnuß ähnlich, doch treten die Zellkonturen hier deutlich hervor und im Inhalt der Zellen finden sich prismatische Oxalatkristalle (HANAUSEK). Man kann aus den Tahitinüssen größere Objekte drechseln, als aus den amerikanischen Steinnüssen. Hamburg importierte 1907: 5000, 1908: 4150 dz australische Steinnüsse.
Lit. WENDLAND, Bonplandia 1862. — T. F. HANAUSEK in WIESNERS Rohstoffen. II. Aufl., Zeitschr. d. Öster. Apoth. Ver. 1880, 360 und Zur Anatomie d. Tahitinuß, Zeitschr. f. Nahrungsmittel-Unters. 1893, 197. — DINGLER, Bot. Zentralbl. 1887. — WARBURG, Verbreit., System. u. Verwert. d. polynes. Steinnußpalmen. Ber. d. d. bot. Ges. 1896, 133. — L. PLANCHON et JUILLET, Encore le Corozo, Bull. de Pharm. Sud-Est. 1910.
[S. 263]
3) Lichenino-Membranindrogen (inkl. Amyloid-Membranine).
Durch Jod sich direkt blau färbende Membranine.
Der Name Amyloid wurde 1844 von VOGEL und SCHLEIDEN für die mit Jod sich direkt blau färbenden Membranen einiger Endosperme angewendet. Amyloid findet sich in den Cotyledonen der Samen von Hymenaea Courbaril, Tamarindus indica u. a. und in den Endospermen der Samen von Primulaceen, Tropaeolaceen, Linaceen, z. B. in Primula, Impatiens, Tropaeolum, Cyclamen, Linum u. and., und Paeonia. Amyloid liefert bei der Hydrolyse keine Mannose (REISS). Es läßt sich mit kochendem Wasser extrahieren. Es liefert Glukosen (Galaktose) und Pentosen. Es enthält reichlich ein Galaktoaraban (WINTERSTEIN). Auch ein in den Essigbakterien gefundenes Kohlehydrat gibt Amyloidreaktion (BEIJERINCK), sowie das Amylomycin einiger Hyphenwände. Bei längerer Berührung mit konz. Schwefelsäure (oder HCl) oder dreistündigem Kochen mit Wasser bei 20 Atmosphären Druck, geht Zellulose in Hydrozellulose über, die identisch sein soll mit dem Amyloid genannten Körper, den man erhält, wenn man Zellulose in 30 Teilen Schwefelsäure (4 H2SO4.1 H2O) löst und mit Wasser fällt, aber nicht mit dem in den Membranen einiger Pflanzensamen (Paeonia, Linum) vorkommenden Amyloid, mit dem es nur die Eigenschaft teilt sich mit Jod direkt blau zu färben, von dem es sich aber dadurch unterscheidet, daß Hydrozellulose bei der Hydrolyse glatt d-Glukose liefert, währenddem die die genannten Membranen bildenden Substanzen dabei Galaktose, Glukose und Xylose (keine Mannose) liefern, also zu den Hemizellulosen gehören.
Das Pergamentpapier, das ja durch Einwirkung von Schwefelsäure auf Zellulosepapier dargestellt wird, färbt sich mit Jod direkt blau.
Einen Amyloid genannten Körper (diffus und in Körnern) fand VIRCHOW in degenerierter Leber, Milz, Niere, Lunge, Gehirn. Es wird mit Jod oder Jod-Schwefelsäure blau, enthält aber Stickstoff (W. KÜHNE, C. SCHMIDT). Es scheint den Eiweißstoffen näher zu stehen als der Stärke (FRIEDREICH) oder gar nicht zu den Polysacchariden zu gehören. Auch sonst scheint es bei Tieren vorzukommen, wie die Lerpmanna (s. d.) zeigt.
Lit. VOGEL und SCHLEIDEN, Beitr. z. Botanik 1844, I, Poggend. Ann. 1839, Flora 1840. — FRANK, Journ. pr. Chem. 95, 479. — KABSCH, Pringsh. Jahrb. III. — NÄGELI, Botan. Mitteil. I und Stärkekörner. — TSCHIRCH, Anatomie S. 173. — HEINRICHER, Flora 1888, 163. — WINTERSTEIN, Zeitschr. phys. Chem. 17 (1892), 353, Ber. d. chem. Ges. 25 (1892), 1237. — Derselbe, Über das pflanzliche Amyloid. Zeitschr. phys. Chem. 17, 353. — REISS, Ber. d. chem. Ges. 24, 1842, Landw. Jahrb. 18, 761. — SCHULZE, Zeitschr. phys. Chem. 19, 38. — VIRCHOW, Arch. path. Anat. 11, 188.
Auch in dem Lichenin steckt ein sich mit Jod direkt blau färbender Körper. Wie die mikroskopische Untersuchung lehrt, gehört das Lichenin zu den Membraninen. Es bildet die Substanz der Hyphenwände gewisser Schichten des Flechtenthallus, besonders des isländischen Moos. Man gibt ihm gewöhnlich die Formel (C6H10O5)n. Das durch Jod sich gelb färbende Lichenin wird im Lich. islandicus begleitet von Dextrolichenin (Isolichenin, ERRERA, HOENIG, SCHUBERT). Nur dies reagiert mit blauer Farbe auf Jod (daher Flechten- oder Licheninstärke). VOGEL nannte dies «Moos-Amylum» Amyloid. Lichenin ist optisch inaktiv. Dextrolichenin dreht rechts. Das Lichenin läßt sich aus dem Lichen islandicus dadurch darstellen, daß man die mit Alkohol, Äther, schwacher Sodalösung und Salzsäure extrahierte Flechte, nach dem Auswaschen mit kaltem Wasser, mit Wasser auskocht.[S. 264] Die Lösung gesteht zu einer Gallerte, aus der sich durch Alkohol oder Ausfrierenlassen das Lichenin abscheiden läßt. Aus der wässrigen Mutterlauge kann das Dextrolichenin (s. oben) abgeschieden werden. Lichenin löst sich in Kupferoxydammon, Dextrolichenin nicht.
Das Lichenin (Flechtenstärke, Moosstärke, Stärkemembran) und das Isolichenin liefern bei der Hydrolyse d-Glukose (nach ESCOMBE auch d-Galaktose?).
Lit. BAUER, Journ. pr. Chem. II, 34. — STENBERG und KLASON, Ber. d. chem. Ges. 19, 2541. — HÖNIG und SCHUBERT, Monatsh. d. Chem. 8, 452. — ERRERA, Compt. rend. 101, 253. — NILSON, Chem. Zentralbl. 93b, 942. — ESCOMBE, Zeitschr. phys. Chem. 22. — VOGEL, Linnaea 15, 63. — TSCHIRCH, Artikel Flechtenstärke in Realenzyklop. d. Pharm. V, 366.
Wohl mit dem Lichenin identisch, jedenfalls mit ihm verwandt, ist die durch Jod sich blau färbende Substanz der Apothecien der Flechten. Mit dem Lichenin verwandt, aber wohl nicht damit identisch, sind die ebenfalls in kochendem Wasser löslichen Everniin (in Evernia Prunastri STÜDE) und das Usneïn (in Usnea barbata), die bei der Hydrolyse Glukose liefern. Usneïn dreht rechts und wird durch Jodschwefelsäure rotviolett.
Nach ULANDER und TOLLENS enthält die Cetrariagruppe Lichenine, die Cladoniagruppe ist frei davon, liefert also keine wasserlöslichen Membranine. Sie gibt bei der (schwierigen) Hydrolyse d-Mannose und d-Galaktose neben etwas Glukose, sowie Pentosen und Methylpentosen.
Lit. ULANDER und TOLLENS, Ber. d. d. chem. Ges. 39, 401. — STÜDE, Lieb. Ann. 131.
Lichen islandicus.
Syn. Fucus islandicus, Muscus catharticus, Isländisch Moos, Lungenmoos, Haideflechte, Kramperltee, Tartschenflechte — lichene ou mousse d’Islande (franz.) — iceland moss (engl.) — lichene islandico (ital.) — ijslandsmos (holl.) — islannin jäkälä (fin.) — izlandizuzmo (ung.) — λειχὴν ὁ ἰσλανδικός (n.-griech.).
Etym. Isländisch Moos, obwohl weder ein Moos noch aus Island exportiert (kommt aber in Island vor). Mos, mossa (mosi, mus) ist der skandinavische Ausdruck für alle laubigen Kryptogamen, nicht nur für die Moose (JENSSEN-TUSCH, Nordiske Plantenavne. Kopenhagen 1867).
Stammpflanze. Cetraria islandica ACHARIUS Method. 293 (Lichen islandicus L. [Flor. suec. 1085, Spec. pl. 1611], Physcia islandica P. DC., Parmelia islandica SPRENGEL, Lobaria islandica HOFFM.). Bisweilen werden var. crispa ACH. mit schmalen, verbogen-krausen Thalluslappen, var. subtubulosa FR. durch zusammengeneigte Thallusränder röhrig und var. platyna ACH. mit breitem, flachem Thallus unterschieden. Auch andere Varietäten sind bekannt.
Systemat. Stellung. Lichenes. Ascolichenes — Parmeliaceae.
Etym. Cetraria ist aus cetra, dem kleinen, leichten, runden Lederschild des römischen Fußvolkes, gebildet und spielt auf die runden schildförmigen Apothecien an.
Beschreibung. Cetraria islandica gehört zu den heteromeren, gymnocarpen Strauchflechten (Thamnoblasti). Es handelt sich hier um eine eigenartige Symbiose vom Charakter eines parasitären Konsortiums zwischen einem Discomyceten und einer Palmellacee (s. unten). Der krause, aufrechte, strauchige Thallus (Thallom, Lager, Laub) ist mittelst kurzer, fadenförmiger Rhizoiden (Rhizinen) am Boden befestigt. Er ist blattartig, vielfach gelappt, aufrecht bis aufsteigend (Fig. 92), beiderseits berindet und kahl, bis 10 cm hoch. Bisweilen sind mehrere Individuen miteinander verwachsen oder verklebt. Am Grunde[S. 265] ist der Thallus verschmälert, rinnenförmig oder fast röhrenförmig und dort oft rötlich gefärbt. Nach oben verbreitert er sich und ist dort wiederholt gabelig oder unregelmäßig gelappt. Im frischen Zustande ist der Thallus häutig-lederig, auf der dem Lichte zugewendeten Seite olivengrün, auf der anderen blaß grün-weißlich oder grau-weißlich mit weißen, oft grubigen Flecken. Getrocknet ist der Thallus knorpelig, oberseits grünlich-braun, unterseits hell bis weiß. Am Rande zeigt der Thallus zahlreiche lange, bisweilen gegabelte, im Querschnitt rundliche Fransen, die an ihrer Spitze je ein Spermogonium tragen, in dem sich zahlreiche, stäbchenförmige Spermatien befinden, die bisweilen durch die terminale Öffnung ausgetreten sind und sich dort bisweilen als ein kleines Häufchen angesammelt haben (Fig. 93). Apothecien finden sich in der Droge selten. Ich habe ganze Zentner von Isländisch Moos durchsucht ohne eins zu finden. (Die im Handel vorkommende Form Cetraria island. var. crispa ACH. ist stets unfruchtbar, KRASSER). Sie sitzen einzeln oder zu zweit am Ende der Thalluslappen, der Oberseite schief angewachsen. Sie messen bis 1 cm in der Breite, sind rundlich oder oval und schildförmig (daher Cetraria, s. oben), frisch grünbraun, trocken bisweilen kastanienbraun. Sie besitzen einen niedrigen, bisweilen gekerbten Rand.

Cetraria islandica.
[Aus Luerssen, Med. pharm. Bot.]

Cetraria islandica. Spermogonien, die Spermatien entlassend.
[Aus Luerssen, Med. pharm. Bot.]
Lit. CRAMER, Diss. de Lichene Islandico Erlang. 1780. — OLAFSEN, Reise durch Island I, 85. — Abbild. bei NEES VON ESENBECK, Plant. med. t. 10, BERG-SCHMIDT, Atlas t. 159, BENTLEY-TRIMEN, Medic. plants t. 302 und LUERSSEN, Mediz. pharm. Bot. Ältere: PLENCK, Icon. t. 744, DILL, Hist. musc. t. 28, Fig. 111, Flor. Dan. t. 155 u. and.
Vorkommen. Die über die gemäßigte und kalte Zone beider Hemisphären verbreitete Flechte findet sich nur auf der Erde zwischen Moos, Gras und Heidekraut, im Norden in der Ebene, im gemäßigten Klima meist in lichten Gebirgswäldern. Häufig in Europa, Asien[S. 266] (Sibirien), im arktischen Amerika und weiter südlich bis Virginien und Nord-Carolina. In Skandinavien steigt sie bis zum Meeresstrande herab, in den Alpen bis 3260 m (Monte Rosa), ja über 3454 m (SCHRÖTER), also weit über die Baumgrenze empor.
Pathologie. Prof. ED. FISCHER berichtet über die Parasiten: Auf dem Thallus von Cetraria islandica können sich parasitische Ascomyceten ansiedeln, unter denen besonders der Discomycet Abrothallus Parmeliarum (SOMMERF.) NYL. zu nennen ist: Die Fruchtkörper desselben sind zuerst in die Marksubstanz der Flechte eingesenkt und bewirken blasige Wucherungen des Thallus, später brechen sie als rundliche schwarze Fruchtscheiben hervor (siehe H. REHM, Discomyceten in RABENHORSTS Kryptogamenflora. Pilze, Abt. III, p. 359). Außerdem wird (in SACCARDO Sylloge) auch der Discomycet Scutula oxyspora KARST. und der Pyrenomycet Sphaerulina cetraricola (NYL.) KARST. als auf Cetraria vorkommend angegeben.
Einsammlung und Handel. Die Flechte wird im Harz, Fichtelgebirge und Riesengebirge, in Niederösterreich, auf dem Schneeberg und der Rax, in den Voralpen (Kant. Bern und Luzern, I, S. 98), in Tirol, Frankreich, Skandinavien und Spanien, sowie in Nordamerika gesammelt. Island scheint nichts zu liefern, jedenfalls nicht regelmäßig zu verschiffen (WIGHT).
Lichen islandicus wird in gepreßten Ballen à 120 kg gehandelt.
Lit. WIGHT, Pharm. Journ. 17 (1887), 689. — Pharmacographia.
Anatomie. Der bis 0,5 mm dicke Thallus zeigt drei Schichten: die Randschicht, die Mittelschicht und die Markschicht. Die Randschicht besteht aus einem lückenlosen pseudoparenchymatischen Gewebe dicht miteinander verflochtener, dickwandiger, kurzer Hyphen (Paraplectenchym, LINDAU), deren Wände sich mit Jod nicht oder nur schwach blau färben. Die Mittelschicht besteht aus einer sehr verschieden dicken Schicht, vorwiegend parallel der Oberfläche gestreckter Hyphen mit dicker Wand und engem Lumen. Sie ist es in erster Linie, die sich mit Jod direkt blau färbt und beim Kochen mit Wasser sich löst bzw. in eine Gallerte übergeführt wird. Die Färbung mit Jod, die stets nur an den Wänden auftritt, bleibt auch bei alter Droge nur selten aus, wenn man den Schnitt in Jod-Jodkaliumlösung einlegt und dann mit Wasser auswäscht. Die Mittelschicht ist also die eigentümliche Licheninschicht. Die innerste oder Markschicht besteht aus locker verschlungenen Hyphen (Plectenchym, LINDAU), die reichlich Luft zwischen sich lassen, daher meist erst dann deutlich werden, wenn man zum Schnitte Alkohol zutreten läßt. Die Hyphenwände färben sich in dieser Schicht nicht mit Jod. Nur die äußersten Schichten zeigen bisweilen schwache Färbung. Zwischen den Hyphen dieser Markschicht liegen, meist der Mittelschicht genähert, die Gonidien, die Algenzellen des Flechtenthallus. Die c. 10–12 mik breiten, rundlichen, bisweilen in Teilung begriffenen Gonidienzellen sind bei der lebenden Flechte grün und enthalten ein fast hohlkugelförmiges Chromatophor, das ein Pyrenoid einschließt, bei der Droge sind sie bräunlichgrün. Sie sind der einzige chlorophyllhaltige Bestandteil der Flechte. Sie sind in größerer Zahl an der morphologischen Oberseite (Lichtseite) des Thallus zu finden, der demnach auch stärker gefärbt erscheint, doch finden sich auch der Unterseite (Schattenseite) genähert stets eine Anzahl Gonidien. Die Verteilung verleiht dem Cetrariathallus den Charakter eines heteromeren Flechtenthallus (bei den homöomeren sind die Gonidien über den ganzen Thallus verteilt). Die Gonidien gehören zu der Protococcaceen- (Palmellaceen-Gattung), Chlorococcum humicola (Cystococcus humicola NAEG.), die auch freilebend auf Baumstämmen und andere Flechten bildend bekannt ist. In den blasigen weißen Flecken, welche der Unterseite ein so charakteristisches[S. 267] Aussehn verleihen, finden sich luftreiche Wucherungen des Markes, die die Rindenschichten blasig hervorwölben und schließlich sogar aufsprengen, so daß das Mark da und dort zutage tritt. Da das hervortretende Hyphengewebe Gonidien mitnimmt, haben wir diese Bildungen als Soredien anzusehen. Die abgeschnürten Knäuel bilden die ungeschlechtliche Fortpflanzungsform der Flechte. (Es sind nicht Cetrarinablagerungen wie KNOP meinte.)
Die Spermogonien bilden ovale Höhlungen an der Spitze der Randfransen. Sie sind ausgekleidet mit einer dichten Schicht gegliederter schwach verästelter zarter Hyphen, die in Basidien auslaufen, welche die stäbchenförmigen, c. 6 mik langen Spermatien (s. oben) abschnüren. Früher hielt man die Spermatien für die männlichen Organe. Jetzt weiß man nur, daß ihnen diese Bedeutung nicht zukommt. Vielleicht sind die Spermogonien funktionslos gewordene (männliche?) Organe. Die Spermatien vermögen auszutreiben und ein neues Mycel zu erzeugen.
Die Apothecien zeigen ein stark entwickeltes Hymenium mit zahlreichen Ascis. Der flechtenbildende Pilz, der sich zu einer bestimmten Gattung nicht stellen läßt, ist ein Discomycet. Die keulenförmigen Asci mit 6–8 ovalen Ascosporen werden von den Paraphysen überragt. Die Wand der Asci, bisweilen auch die der Hyphen des Hypotheciums, färben sich mit Jod blau (enthalten also auch Lichenin), die Paraphysen gelb oder gelbbräunlich.
Lit. PAYEN, Compt. rend. 1837, 145. — PEREIRA, Heilmittellehre. — VOGEL a. a. O. — KNOP, Chem. Zentralbl. 1872, 173. — LUERSSEN, Med. pharm. Botan. I, 223. Abbild. auch in OUDEMANS Atlas 1854 (erste anatom. Abbild.), BERG, Anatom. Atlas t. II, 4 und HÉRAIL-BONNET, Manipulat. t. 36. — STAHL, Beitr. z. Entwicklungsgesch. d. Flechten. Leipzig 1877. — TSCHIRCH, Artikel Lichen islandicus in Realenzykl. d. Pharmac.
Chemie. Isländisch Moos enthält eine gallertebildende Substanz und einen Bitterstoff, der sich durch Extraktion mit schwachen Alkalicarbonatlösungen entfernen läßt (L. i. ab amaritate liberatus). «Man hat es daher in der Hand, aus der Droge ein Amarum purum, ein Amarum mucilaginosum oder (aus der entbitterten Droge) ein Nutriens mucilaginosum darzustellen» (JOS. MOELLER, 1906).
Den Gallerte bildenden Stoff isolierte bereits EBELING (1779), CRAMER (1780) und PROUST, sowie PFAFF (1808) in unreiner Form und PROUST erkannte schon seine Eigenart. PFAFF bemerkt, daß der Cetrariaschleim, von dem er 33% erhielt, am meisten mit der Stärke übereinkomme, obwohl er die Jodreaktion noch nicht kennen konnte, da das Jod noch gar nicht entdeckt war. JOHN scheint ihn 1821 für Inulin gehalten zu haben. BERZELIUS, der (neben 36,2% stärkeartigem Skelett) 44,6% Gummi und Moosstärke (laf stärkelse) erhielt, nannte den Stoff, der die Gallerte liefert, zunächst Moosstärke, dann Lichenin oder Flechtenstärke. PAYEN glaubte mit Jod sich bläuende Körnchen zu sehen, aber bereits PEREIRA fand keine stärkeähnliche Körner und so scheint bereits ihm klar gewesen zu sein, daß es hier die Membran ist, die sich mit Jod bläut. Lichenin ist nur in den Membranen enthalten (TSCHIRCH), nicht, wie KNOP und SCHNEDERMANN meinten, im Inhalt und zwischen den Hyphen. Die Wände der Hyphen von Cetraria islandica scheinen kein Chitin zu enthalten (ESCOMBE, WESTER). HOPPE SEYLER und TANRET hatten es als darin vorkommend angegeben. TH. BERG fand 1872, daß das Lichenin aus zwei Isomeren der Formel C6H10O5 besteht. Er nennt den in kalten Wasser löslichen, aber nicht durch kaltes Wasser aus der Flechte ausziehbaren jodbläuenden Stoff, der 10–11,5% der Flechte beträgt, «wahre Flechtenstärke» — jetzt (nach[S. 268] FLÜCKIGERS Vorschlag) als Dextrolichenin bezeichnet —, den in kaltem Wasser unlöslichen, durch Jod nicht gebläuten, der 20% ausmacht, Lichenin. Der letztere scheidet sich aus der Abkochung der Flechte beim Erkalten als Gallerte ab. BERG gab beiden die Formel (C6H10O5)n. Die Hydrolyse mit Mineralsäuren lieferte ihm aus beiden gärungsfähigen Zucker. Diastatische Fermente verzuckern nicht. Lichenin (s. oben, S. 263) bildet eine Gallerte, aber keinen bindenden Kleister. Es liefert mit Salpetersäure Oxalsäure (nicht Schleimsäure). Das durch Auskochen mit Wasser, Fällen mit Alkohol usw. gewonnene Lichenin ist optisch inaktiv und liefert bei der Hydrolyse mit verd. Schwefelsäure d-Glukose. Die Kohlehydrate der Cetraria islandica betragen im ganzen 80%. Sie bestehen etwa zur Hälfte aus dem in heißem Wasser löslichen Lichenin. Die in Wasser unlöslichen Kohlehydrate sind Hemizellulosen, die Dextrane, Mannane und Galaktane und etwa 3% Pentosane, sowie ein wenig echte Zellulose (?) enthalten. Werden nämlich die wasserlöslichen Kohlehydrate durch Auskochen entfernt, so bleibt ein Rückstand, der bei der Hydrolyse viel d-Glukose und daneben weniger d-Mannose und d-Galaktose und etwas Pentosen und Methylpentosen liefert (ULANDER und TOLLENS). Selbst durch anhaltendes Kochen ist man aber nicht imstande, dem unlöslichen Rückstande ganz die Eigenschaft zu nehmen, sich durch Jod blau zu färben (PEREIRA). Entbittertes, d. h. von der Cetrarsäure befreites Isländ. Moos, enthält: N-freie Extraktivstoffe, Lichenin usw. 79,2%, N-haltige Stoffe 2,81%, Rohfett 0,4%, Rohfaser 4,6%, Asche 6,99% (HANSTEEN). Zu Brot verbacken wurden 50% der Flechtenkohlehydrate vom Körper resorbiert und verbrannt. POULSON empfiehlt es als Nahrungsmittel für Diabetiker. Es gelingt, bis 70% gallertbildende Stoffe aus Cetraria islandica durch Auskochen darzustellen, die im Verhältnis 1 : 20 eine steife Gallerte bilden (FLÜCKIGER).
Bereits JOHN erkannte (1821) den Bitterstoff als einen eigentümlichen Bestandteil. BERZELIUS und besonders RIGATELLI stellten die Substanz dann dar und einige Zeit spielte «RIGATELLIS Salz» (unreines Cetrarin) als Fiebermittel in Italien eine Rolle. HERBERGER isolierte den Bitterstoff (1837) in reinerer Form und nannte ihn Cetrarin (Moosbitter). Diese Forscher benutzten Alkohol als Extraktionsmittel. Doch wußte bereits BERZELIUS, daß man Isländisch Moos mit Pottasche entbittern kann. SCHNEDERMANN und KNOP, die sich ebenso wie PAYEN der Alkalien zur Extraktion bedienten, erhielten (1845) das Cetrarin kristallinisch in Form intensiv bitter schmeckender Nadeln, erkannten seine Säurenatur und nannten es Cetrarsäure. Sie gaben ihm die Formel C34H34O15 (resp. C18H16O8); HILGER und BUCHNER formulierten C30H30O12. Cetrarsäure, nach SIMON: C20H18O9, ist zu etwa 2–3% (nach SIMON sicher) in der Flechte vorgebildet enthalten neben Fumarsäure (SIMON) und Protocetrarsäure (HESSE). Cetrarsäure reduziert Fehlingsche Lösung in der Wärme, löst sich sehr wenig in siedendem Wasser, leicht in Alkalien und Alkalikarbonaten. Auch die Salze schmecken sehr bitter. Wird die Lösung in alkoholischer Salzsäure einige Stunden gekocht, so färbt sie sich erst gelb, dann grünlich, rötlich fluoreszierend, violettrot und endlich blau (SIMON), eine sehr charakteristische Reaktion. Bei der Spaltung mit Natronlauge und Zinkstaub entsteht Orcin (Zopf) und 1,2-Dimethylphendiol-3,5 (SIMON):
[S. 269]
Cetrarsäure ist nach Simon methoxylhaltig und enthält wohl neben einem Carbonyl ein Carboxyl und ein Hydroxyl, jedenfalls zwei durch Metalle vertretbare Wasserstoffatome. Sie ist vielleicht der Methyläther von HESSES Protocetrarsäure. HESSE betrachtete sie früher fälschlich als Triäthylprotocetrarsäure (C54H31O24(OC2H5)3). ZOPF und HESSE sind entgegen der oben vertretenen Auffassung der Ansicht, daß Cetrarsäure in der Flechte nicht vorgebildet ist, sondern erst aus der Fumar-Protocetrarsäure bei der Extraktion entsteht. Diese Ansicht teilt SIMON nicht. Die blaugrüne bis blaue Färbung durch Salzsäure-Alkohol (s. oben) kommt außer der Cetrarsäure auch anderen Flechtensäuren, wie der Protocetrarsäure, Ramalinsäure (wohl identisch mit Protocetrarsäure), Kullensissäure, Caprarsäure und Physodalsäure zu, die alle ebenfalls bitter schmecken (vgl. ZOPF, Die Flechtenstoffe). Auch Protocetrarsäure (C18H14O9 oder C19H16O9) und Fumarprotocetrarsäure (Cetrarsäure ZOPF = 2(C4H4O4). C54H42O27) werden als vorgebildete Bestandteile der Cetraria islandica angegeben (ZOPF, HESSE, SIMON).
Bereits BERZELIUS gab an, eine Lichensäure in der Flechte gefunden zu haben (an Kalk und Kali gebunden). Später strich er diese wieder und erklärte sie, als Fumarsäure gefunden wurde, mit dieser identisch. (PFAFFS Flechtensäure ist von DEMARÇAY und SCHRÖDER als Fumarsäure erkannt worden). Vielleicht hatte er aber die Lichesterinsäure in Händen, die zuerst von SCHNEDERMANN und KNOP in Kristallen in einer Ausbeute von 1% isoliert worden war. Sie gaben ihr die Formel C29H25O5 (STRECKER: C14H24O3, HILGER und BUCHNER: C43H76O13, O. HESSE: C17H28O4, später C18H30O5, noch später C18H30O4), die dann SINNHOLD in C19H32O4 umwandelte, welche Formel R. BÖHME adoptierte und in:
auflöste. Diese Lichesterinsäure soll aber in Cetraria islandica nicht vorgebildet sein (ZOPF, HESSE). ZOPF und O. HESSE isolierten nämlich als angeblich wahre Bestandteile Proto-α-Lichesterinsäure C18H30O5, F. 106–107 und Proto-Lichesterinsäure (C19H32O4 ZOPF oder C18H30O4 HESSE). Wohl isomer mit letzterer ist die oben erwähnte Lichesterinsäure, die aber, wie gesagt, in der Flechte nicht vorgebildet sein, sondern erst beim Kochen mit Alkohol aus der Protolichesterinsäure entstehen soll. Auch α-Lichesterinsäure (C18H30O5) soll in der Flechte nicht vorgebildet sein, sondern aus der Proto—Lichesterinsäure beim Kochen mit Alkohol entstehen. R. BÖHME ist jedoch der Ansicht, daß es nur eine Lichesterinsäure (F = 124–125°) gibt. Seine Lichesterinsäure gab beim Kochen mit Alkali Lichesterylsäure (SINNHOLD):
und beim Behandeln mit Jodwasserstoff und Reduktion λ-Iso-Stearinsäure (C18H36O2) und einen gesättigten Kohlenwasserstoff. HILGER und BUCHNER erhielten bei der Oxydation Caprinsäure. Ferner ist in einer Varietät der Cetraria islandica eine Paralichesterinsäure (C20H34O5) in sehr kleiner Menge gefunden worden (HESSE). Was HESSE als β- und γ-Lichesterinsäure beschrieb, muß (nach HESSE) gestrichen werden; ebenso Hesses Dilichesterinsäure. Cetraria islandica aus Vorarlberg enthielt 0,62%[S. 270] Proto-α-Lichesterinsäure; die Flechte aus Tirol ein Gemisch dieser Säure mit Protolichesterinsäure. Regelmäßig war bei Exemplaren verschiedenster Provenienz Cetrarsäure vorhanden. Cetraria islandica erzeugt Fumarprotocetrarsäure wie Protolichesterinsäure sowohl in Mitteldeutschland wie in Süddeutschland und den Alpen, auf Kalk sowohl wie auf Urgestein (ZOPF).
Ferner werden Oxalsäure und Weinsäure (?) angegeben (Pharmacographia). Bereits BERZELIUS fand Blattgrün in der Flechte. Obwohl KNOP und SCHNEDERMANN angeben, daß ihr Thallochlor vom Chlorophyll abweiche, ist es doch wohl nichts anderes. Die Unterschiede rühren von Verunreinigungen her. Mit gespanntem Wasserdampf destilliert gibt Cetraria islandica 0,051% ätherisches Öl, das beim Stehen Kristalle abscheidet, bald rechtsdrehend, bald inaktiv ist und ein spezifisches Gewicht von 0,8765 besitzt (HAENSEL). Der Aschengehalt beträgt 1 bis 2% (nach HAUKE 1–1,4%). WITTSTEIN verglich die Asche der Cetraria mit der Zusammensetzung des Bodens, auf dem sie wuchs. Er fand in der Asche 43,2% Kieselsäure, 13,2% Kali und 13,7% Kalkerde. Sie enthält auch 4% Aluminium. In der lufttrockenen Flechte findet sich 0,0198% Eisen (in der frischen: 0,0176%). Sie enthält also mehr Eisen als z. B. Spinat (BALDONI).
Lit. Ältere Analysen von PROUST, EBELING, CRAMER, TROMMSDORFF, CRELL (vgl. MURRAY, Appar. medic. 1790, V, 499, und SCHWARTZE, Pharmakolog. Tabellen 1819). — PFAFF, Syst. d. Mat. med. 1808, II, 75. — JOHN, chem. Schriften 5 (1821), S. 41. — BERZELIUS, Schweig. Journ. 7 (1813), 342 (Analyse abgedruckt in Lehrb. d. Chemie 1838, VII, 446). — GUÉRIN-VARRY, Ann. Chem. Phys. 56. — MULDER, Journ. prakt. Chem. 15 und Lieb. Ann. 28, 279. — PAYEN, Ann. sc. nat. (bot.) 14. — PEREIRA, Heilmittellehre (d. von BUCHHEIM). — DAVIDSOHN, Journ. pr. Chem. 20. — SCHMIDT, Lieb. Ann. 51. — MASCHKE, Journ. pr. Chem. 61. — HERBERGER, Über d. Bitterstoff d. isländ. Flechte (Cetrarin, Moosbitter), Buchn. Rep. 36 (1830), 226 u. 56 (1836), 273. Über das Cetrarin, Lieb. Ann. 21 (1837), 137. — SCHNEDERMANN und KNOP, Lieb. Ann. 54, 143 und 55 (1845), 144 (Jahresber. d. Pharm. 1845, 13). — STENBERG, Oefvers. Akad. Forb. 1868. Pharm. Jahresb. 1868, 31. — TH. BERG, Zur Kenntnis des in Cetraria islandica vorkommenden Lichenins u. jodbläuenden Stoffes. Diss. Dorpat 1872 und Pharm. Zeitschr. f. Rußl. XII (1873), 129; Journ. pr. Chem. 1873, 848; Ref. in Pharm. Jahresb. 1873, 19. — WITTSTEIN, Schweiz. Zeitschr. f. Pharm. VII (1862), 237. — WEIGELT, Journ. pr. Chem. 1869, 106 u. 193. — BILLEY, Lieb. Ann. 86. — FLÜCKIGER, Arch. Pharm. 196 (1871), 14. — STENBERG und KLASON, Ber. d. d. chem. Ges. (19) 1886, 2541. — ERRERA, Dissert. Brüssel 1882. — BAUER, Arch. Pharm. 224 (1886), 803. — HÖNIG u. SCHUBERT, Monatsh. f. Chem. 8 (1887), 452. — HILGER u. BUCHNER, Chem. Charakt. d. Bestandt. d. isländ. Mooses. Ber. d. d. chem. Ges. 23 (1890), 461. — SINNHOLD, Lichesterinsäure. Arch. Pharm. 236 (1898), 504. — O. HESSE, Journ. pr. Chem. 57 u. 58 (1898), 62 (1900), 68 (1903), 70 (1904), 73 (1906), 113; 76 (1907) 1. — ZOPF, Lieb. Ann. 300, 323 u. 324 (1902). — GUESDON, Lichen d’Islande. Journ. pharm. 1901, 373. — TSCHIRCH, Artikel Lichen islandicus und Cetraria in Realenzykl. d. Ges. Pharm. VI, 286. — SIMON, Cetrarsäure. Arch. d. Pharm. 240 (1902), 521 und 244 (1906), 459. — R. BÖHME, Lichesterinsäure. Arch. Pharm. 241 (1903), 1. — HÄNSEL, Bericht 1903. — HANSTEEN, Chem. Zeit. 30 (1906), 638. — ULANDER und TOLLENS, Ber. d. d. chem. Ges. 39 (1906), 401. — POULSON (Nord. Tidskr. of terapi 1908). Pharm. Zentralh. 1908, 208. — ZOPF, Die Flechtenstoffe. Jena 1907. — HAUKE, Aschengehalte. Wien 1902. — BALDONI, Arch. exp. Path. 52 (1904).
Geruch und Geschmack. Getrocknetes Isländisch Moos riecht sehr eigenartig (Flechtengeruch!) und schmeckt fade, bitter-schleimig.
Prüfung. Cetraria islandica darf nicht fremde Pflanzenteile (Moose, Coniferennadeln, andere Flechten) enthalten. Diese sind, wenn vorhanden, durch Auslesen zu entfernen.
Anwendung. Isländisch Moos wird als Tonicum, Stromachicum, bei Lungenleiden[S. 271] und bei Chlorose empfohlen (s. S. 272). Offenbar ist die Cetrarsäure (Cetrarin) an der tonischen Wirkung des Lichen islandicus beteiligt (HUSEMANN, das Cetrarin prüfte auch KÖHLER und RAMM). Cetrarsäure ist auch ein mildes Laxans, das die Peristaltik reizt. Sie wurde neuerdings auch als Mittel gegen die Seekrankheit empfohlen. Die alkoholische, Cetrarsäure enthaltende Tinktur besitzt jedenfalls antiemetische Eigenschaften (DEGUY und BRISSEMORET, GUESDON, GIGON). Lichesterinsäure und Protolichesterinsäure besitzen hämolytische Wirkung (KOBERT). Am meisten hat sich aber die sog. Isländisch-Moos-Pasta (ENGELHARDT), eine aus entbittertem Isländisch Moos dargestellte Gelatine, als den Hustenreiz milderndes Mittel eingebürgert.
In Island, wie überhaupt in der arktischen Zone, soll Cetraria islandica noch jetzt als Nahrungsmittel, zu Brot verbacken, oder als Gemüse von der ärmeren Bevölkerung benutzt werden. Jedenfalls ist sie ein gutes Renntierfutter. Für Zeiten der Not empfahl es ZIMMERMANN 1817, BOUCHARDAT 1842 entbittertes Lichen islandicus als Nahrungsmittel. Auch neuerdings empfiehlt HANSTEEN mit Alkalicarbonaten entbitterte Cetraria islandica gemahlen als Volksnahrungsmittel. Sie enthält ja 79,2% Lichenin u. and. stickstofffreie Extraktivstoffe (Cetraria nivalis sogar 90,2% stickstofffreie Extraktstoffe). Längere Zeit im Kochen erhaltenes Dekokt von Lich. islandicus soll seine Bitterkeit verlieren (?). Durch Tierkohle verliert es nicht nur seine Bitterkeit, sondern auch seine Eigenschaft zu gelatinieren (PERETTI).
Cetraria islandica liefert bei der Säurehydrolyse bis 70, ja sogar 72% der lufttrockenen Substanz gärungsfähigen Zucker. Der Sirup besitzt aber einen unangenehmen Geschmack. Der daraus dargestellte Alkohol riecht angenehm (STENBERG). Auf die Tatsache, daß aus Cetraria Zucker gewonnen werden kann, haben STENBERG und MÜLLER den Vorschlag gegründet, diese Flechte (und die Renntierflechte), in Gegenden wo sie häufig sind, zur Alkoholgewinnung heranzuziehen. Cetraria islandica und andere Flechten (Cladonia rangiferina) werden denn auch zur Darstellung von Alkohol benutzt. Doch soll nicht viel dabei herauskommen (SCHÜBELER). Ähnliche Versuche sind in Finland, Petersburg und Archangel gemacht worden (FLÜCKIGER).
Lit. FORTUNATOFF, Arbeit. pharm. Instit. Dorpat 1890. — GUESDON, Le Lichen d’Islande. Thèse Paris 1901, Journ. de pharm. 1901 (14), 373. — DEGUY und BRISSEMORET, Journ. des practiciens 1897. Rep. Pharm. IX, 461. — Pharm. Journ. 1897, 378. — GIGON, Mercks Ber. 1905, 50. — TAPIE, Essai sur le Lichen d’Islande (Sep. Abdr.). — BOUCHARDAT, Bull. gen. de Therap. 1842, 42. — DRAGENDORFF, Heilpflanzen. — HUSEMANN-HILGER, Pflanzenstoffe. — KÖHLER, Prager Vierteljahrsschr. 120, 49, 1873. — RIGATELLI, Gazz. eclett. 1835 und Pharm. Zentralbl. 1835, 858. — RAMM, Bittermittel in KOBERT Studien II, 1890. — K. J. ZIMMERMANN, Über d. isländ. Flechte, als Nahrungsmittel zur Zeit des Mangels und der Not usw. Bamberg 1817. — Vgl. auch SCHWEIGGERS Journ. d. Chem. VII, 317. — HANSTEEN, Nord. Flecht. als Nahrungsm. Chem. Zeit. 1905, 1286 und 1906, 30, 638. — STENBERG, Jahresb. d. Pharm. 1868 u. 1869. — PERETTI, Jahresb. d. Pharm. 1843, 88. — SCHÜBELER, Pflanzenwelt Norwegens 1873. Arch. d. Pharm. 1872, 243. — Über die Renntierflechte und eßbare Flechten vgl. auch KRASSER in WIESNER, Rohstoffe, II. Aufl. — Über eßbare Flechten vgl. auch SENFT, Über einige in Japan verwendete vegetabil. Nahrungsm. usw. Pharm. Praxis 1906 u. 1907. Über giftige Flechten: KOBERT, Lehrb. d. Intoxikationen.
Geschichte. Den Alten war das isländische Moos unbekannt. Das, was DIOSKURIDES λειχὴν, das einige βρῦον nennen (IV. Kap. 53) nennt, ist nach SPRENGEL Peltigera canina oder P. aphthosa, nach FRAAS Lecanora Parella und des PLINIUS (XXVI, 10) Lichen ist wohl Marchantia polymorpha, die gleiche Pflanze, die auch FUCHS unter Lichen abbildet. Ob sich unter einem Muscus terrestris oder Lichen von BAUHINS Pinax (I, S. 855), worunter auch Lycopodium inbegriffen ist, Lichen islandicus verbirgt, ist schwer zu sagen. Ebensowenig vermag ich in einer der in der Pharmacia des CORBEIUS (1656) abgehandelten Muscusarten das isländische[S. 272] Moos mit Bestimmtheit zu erkennen. Das, was GEOFFROY (Tractatus 1742, vgl. I, S. 946) unter Lichen abhandelt und von dem er eine Analyse mitteilt, war es keinesfalls. KREMPEL-HUBER ist der Ansicht, daß sich die folgende Stelle in des VALERIUS CORDUS Sylva, in der CORDUS seine Reise nach Schwaben und Böhmen (1542) beschreibt, auf Cetraria bezieht: «Muscus quidam, Crispe lactuce similis, minor et per ambitus leniter aculeatus, cespite latiusculo diffusus, nascitur in Taedacea sylva inter Suetachiam et Lauffam.» Vielleicht ist auch das Lichen in der Pharmakopoëe von Bergamo (1580) isländisch Moos (FLÜCKIGER) sowie das Lichen der CORDUS-Liste (I, S. 800). Eine Abbildung des Muscus Eryngii folio findet sich in BREYNES Miscellanea usw. Nat. Curiosor. III (1672), Nr. 289. Die Namen Lichen terrestris foliis Eryngii (BUXB.), Lichenoides rigidum Eryngii folia referens (DILLEN.) finden sich auch anderwärts. In VALENTINIS Museum (I, S. 912) ist die Beschreibung des Lichen, den er ganz richtig zwischen die Lungenflechte und das Lycopodium einreiht, konfus, und die beigegebenen Abbildungen betreffen Mandragora, mit der er es verwechselt. Bei POMET fehlt Lich. islandicus. Muscus latifolius id est pulmonaria (Lungenkraut) in der Brandenburgischen Taxe 1574 ist wohl die Lungenflechte. Denn Lichen islandicus hieß Lichen pulmonarius minor angustifolius spinis tenuissimis ad margines ornatus (MICH. Gen. 83 t. 44 f. 4; auch BARTHOLINI sagt: «Costis hinc inde spinosis horridulus»). Der Lichen terrestris cinereus, den MEAD 1702 gegen Hundswut empfahl, ist wohl ebenfalls eine andere Flechte. Dagegen ist der Muscus carthaticus islandicus des Copenhagener Catalogus 1672 (I, S. 826) Isländisch Moos. Denn 1671 wurde L. i. von BORRICHIUS als Abführmittel empfohlen (in BARTHOLINI Act. med. Hafn. I, 1671, 126). Die medizinischen Eigenschaften waren zuerst den Isländern bekannt. «Ab Islandis primam virtutis medicae notitiam profectam esse probabile est, qui ipsi in phthisi aliisque quibusdam pectoris morbis lichenem magni faciunt» (OLAFSEN bei MURRAY). Auch HIÄRNE, SCOPOLI und SCHOENHEYDER empfehlen sie gegen Phthise (und Hämoptysis). LINNÉ, der die Pflanze Lichen islandicus taufte (BARTHOLINI nannte sie Muscus islandicus purgans), empfahl (1737) ihre Anwendung warm. Er bezeichnet sie in seiner Materia medica als farinacea, eccoprotica, nutriens, hectica, und auch BERGIUS, der der Droge ein Kapitel in seiner Materia medica 1782 widmet, nennt sie eccoprotica, obwohl OLAFSEN die purgierende Wirkung in Abrede stellte. Ende des XVIII. Jahrh. war L. i. als Medikament hochgeschätzt. MURRAY sagt im Apparatus medicaminum (I, S. 952): «inter praestantissima igitur hodie medicamina splendet» und bespricht eingehend die Anwendung (a. a. O. V, p. 499). Siehe auch das bekannte Gedicht FREILIGRATHS. Die ersten Analysen sind von HIÄRNE und FUCHS. Unreines Cetrarin wurde bereits 1835 von RIGATELLI unter dem Namen «Salino antifebbrile» und «Lichenino amarissimo» gegen Wechselfieber usw. empfohlen (vgl. oben S. 268).
Der beim Kochen entstehende Schleim von Flechten der Art der C. i. scheint auch zur Appretur frühmittelalterlicher Papiere benutzt worden zu sein (KOBERT).
Daß Lichen island. als Nahrungsmittel (s. oben) brauchbar ist, berichtete schon BORRICHIUS (vgl. auch TROILS, Resa til Island). Kapitän JOHN FRANKLIN und seine Begleiter benutzten es, als sie in Amerika aller übrigen Nahrungsmittel beraubt waren, als solches (Narrative of a journey to the shores of the polar sea 1823). In der Krain wurden Schweine, Pferde und Ochsen damit gefüttert (MURRAY).
Im XVIII. Jahrh. scheint Cetraria islandica auch als Färbeflechte benutzt worden zu sein (WESTRING 1805).
Lit. A. VON KREMPELHUBER, Geschichte u. Literat. d. Lichenologie I (1867), 13, 502. — FLÜCKIGER, Pharmakognosie III und Arch. d. Pharm. 226 (1888), 1020. — SCHÜBELER, Viridarium norvegicum 1885. — JOH. TH. PH. CH. EBELING, Diss. de Quassia et Lichene Islandico. Glasgow 1779. — TROMMSDORFF, Diss. de Lich. Island. — BORRICHIUS in BARTHOLINI, Act. med. et phil. Hafn. 1671 (1674) I, 126. — HIÄRNE, Vet. Acad. Handl. 1744, 176. — FUCHS, Crells chem. Ann. 1787. — MURRAY, Apparatus medicaminum 1790, V, 499. — R. KOBERT, Über einige echte gefilzte Papiere des frühen Mittelalters. Zeitschr. Angew. Chem. 1910, 1249.
Paralleldrogen. Ähnlich wie Cetraria islandica werden (nach DRAGENDORFF) benutzt: Cetraria nivalis ACH. (in den Alpen) und C. aculeata FR. Cetraria nivalis ist in der Schauberg-Rax-Ware des Wiener Handels stets enthalten (T. F. HANAUSEK). Cetraria nivalis enthält Usninsäure und 90,2% der Trockensubstanz stickstofffreie Substanzen (Zellulosine). Aus dem Mehl der von der Usninsäure befreiten Flechte kann ein Gebäck dargestellt werden.
[S. 273]
Lerp-Manna.
Die Lerp-Manna entsteht durch Psylla Eucalypti auf Eucalyptus dumosa CUNNINGHAM (Euc. incrassata?) in Australien, besonders auf Tasmania. Sie wird in der Weise erzeugt, daß die genannte Hemiptere mit Hilfe ihres gabeligen Schwanzes weiße Fäden absondert, welche nachher durch einen aus den Leibesringen des Insektes austretenden Sirup verklebt werden (DOBSON) und die das Gespinst darstellen, worin das genannte Insekt seinen Puppenzustand durchlebt (FLÜCKIGER). Durch kaltes Wasser geht der Zucker in Lösung und die Fäden bleiben zurück.
Der Gehalt an Fruchtzucker beträgt nach FLÜCKIGER 53,1% (nach ANDERSON 49%). Die Grundsubstanz der Fäden besteht aus einer von FLÜCKIGER Lerp-Amylum genannten Substanz, die sich durch Jodlösungen blau färbt, in kaltem Wasser kaum, in Wasser von 135–150° reichlich löslich ist und sich beim Erkalten dieser Lösung wieder abscheidet. Die Substanz, die ihrer Zusammensetzung nach (C = 43,4, H = 6,5%) zwischen Stärke und Zellulose steht, ist dem Lichenin ähnlich. Sie ist unlöslich in Kupferoxydammoniak.
Die von ANDERSON in der Lerpmanna angegebenen anderen Substanzen: Gummi, Stärke, Inulin und Zellulose sind nicht darin nachzuweisen (FLÜCKIGER). Der Feuchtigkeitsgehalt beträgt 14–15%.
Lit. ANDERSON, Journ. prakt. Chem. 47, 449 (Jahresb. Pharm. 1849, 68). — (DOBSON und) FLÜCKIGER, Wittsteins Vierteljahrsschr. 17 (1868), 161 und 18, 32. — FLÜCKIGER, Über Stärke und Zellulose. Arch. Pharm. 1871 (mit Abbild.).
4. Lignino-Membranindrogen.
Unter dem Namen Ligninomembranin mag die Holzsubstanz bezeichnet werden, d. h. der Körper, der die Membranen der Elemente des Holzkörpers bildet und der mit Jodreagentien nicht wie Zellulose reagiert. TOLLENS, dem ich meine Einteilung vorgelegt, schlägt vor, die Zelluloso-Membranine und die Lignozelluloso-Membranine als zwei Abteilungen einer Klasse zusammenzufassen und den übrigen voranzustellen, was viel für sich hat. Daß im Ligninomembranin ein Zellulosin steckt ist sicher, denn bei der Hydrolyse entstehen Zucker. Daß die Holzfaser durch Kochen mit Schwefelsäure Traubenzucker liefert, ist seit 1819 bekannt (AUTENRIETH und BAYERHAMMER, BRACONNOT). EKSTRÖM erhielt aus Holz 50–75% Glukose. Daneben treten aber auch (außer Galaktose und Mannose) Pentosen auf. Es sind also neben Manno-Gluko-Galaktanen auch Pentosane vorhanden. Diese Pentosane, die wohl niemals den Charakter von Reservestoffen tragen, spielen in den Gerüstsubstanzen der Pflanze eine große Rolle, besonders Xylane finden sich ganz allgemein in den Wänden der Zellen des Holzkörpers und verholzter Bastzellen, den harten Geweben von Früchten (Cocos) und Samen (Gossypium), wie überhaupt in den Zellen, die ich unter dem Namen «Sklereïden» zusammengefaßt habe. Während aber die Nadelhölzer nur wenig davon enthalten (2–9%), sind die Laubhölzer reich daran (20–33%). Jute enthält 15%. Methylpentosane sind in Samenschalen und Rinden nachgewiesen.
Xylan wird (nach THOMSON) in der Weise bestimmt, daß man die mit Ammoniak digerierten und ausgewaschenen Holzmehle mit 5% Natronlauge behandelt und das Filtrat mit Alkohol fällt. Xylan ist in Kupferoxydammon und Wasser löslich. Es dreht links. CROSS, BEVAN und CLAUD SMITH nehmen an, daß die Pentosane (z. B. im Stroh) an Ameisensäure zu einem Pentosemonoformal, 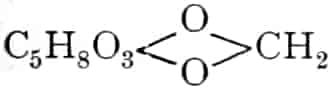 gebunden sind. Vielleicht sind die Xylane in der Membran mit Zellulose verestert. Bemerkenswert ist, daß d-Glukose und l-Xylose ähnliche Strukturformeln haben:
gebunden sind. Vielleicht sind die Xylane in der Membran mit Zellulose verestert. Bemerkenswert ist, daß d-Glukose und l-Xylose ähnliche Strukturformeln haben:
[S. 274]
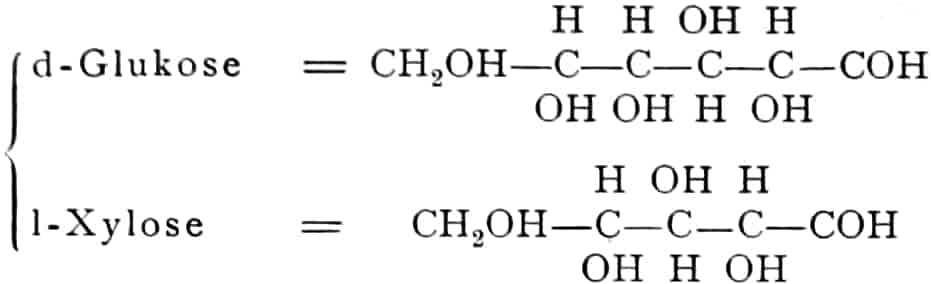
und denn auch häufig nebeneinander als Produkte der Hydrolyse von Zellmembranen erhalten werden, ebenso wie:
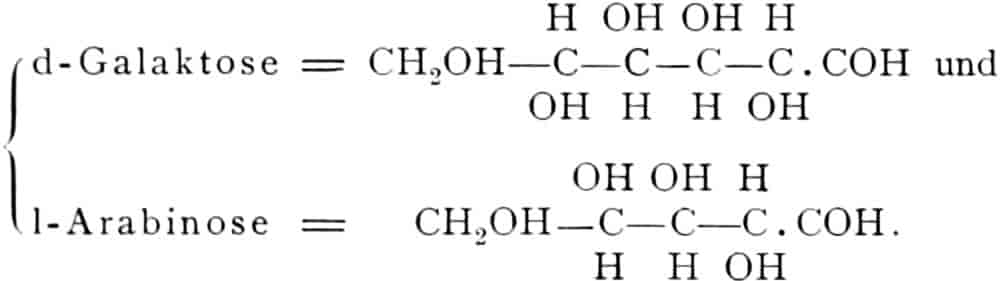
W. HOFFMEISTER nennt die aus den nicht zuvor von den inkrustierenden Stoffen befreiten Zellmembranen durch 5% Natronlauge extrahierbaren Stoffe Holzgummi. Dieses Holzgummi ist wohl mit Xylan identisch. Da der reinen Zellulose Pentosane fehlen — sie gibt bei der Hydrolyse niemals Pentosen —, so kann die Bestimmung des Holzstoffgehaltes eines Gewebes durch Bestimmung des Pentosangehaltes nach der Methode von TOLLENS erfolgen, die darauf beruht, daß Pentosane bei der Destillation mit Salzsäure α-Furfurol:
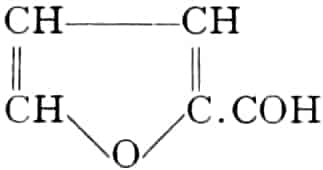
liefern, das als Phloroglucid gefällt und gewogen werden kann.
Den Holzstoff, das Lignin oder Lignon (CROSS, BEVAN, BEADLE) faßt man meist als ein methoxylreiches Oxyderivat der Zellulose (Oxyzellulose) auf, das sowohl freie wie veresterte Hydroxyl- und wahrscheinlich auch Acetyl- und Formyl-Gruppen (vielleicht stammt die Essigsäure im Acetum pyrolignosum daher!), nach KLASON 4 CH3 und ein OH enthält. Es ist kohlenstoffreicher (55% C) als Zellulose (44,4% C). Dem Jutelignin geben TOLLENS und LINDSEY die Formel: C17H16O7(OCH3)2. KLASON, der (C40H42O11)n formuliert, bringt es zum Coniferylalkohol, EULER zu den Gerbstoffen in Beziehung. Die unten erwähnten Farbstoffreaktionen beziehen sich nach der jetzigen Auffassung nicht auf das Lignin.
Daß in der Holzmembran eine zelluloseartige Substanz die Grundlage (meist 50 bis 64% der Substanz) bildet, ist also sicher (PAYEN, HOPPE SEYLER, LANGE). Die abweichenden Reaktionen der Holzmembran rühren von einer «Inkruste» her. Die Vorstellung, daß in der Holzzellmembran die Zellulose «inkrustierende» Substanzen (matières incrustantes, Xylogen, nach DE CANDOLLES Vorgang früher Lignin genannt) vorkommen, rührt von PAYEN her. Daß diese Substanzen zum Teil aromatische sind, kann keinem Zweifel unterliegen, denn es gelingt aus der Sulfitablauge der Holzfaserbearbeitung Vanillin, Brenzkatechin und Methylfurfurol abzuscheiden (GRAFE), Verbindungen, die in ihrer Gesamtheit wohl das Hadromal CZAPEKS bilden und auf die sich die zahlreichen Holzreaktionen (mit Phloroglucin, Anilinsulfat usw.) beziehen — auch Protokatechusäure wurde unter den Abbauprodukten gefunden (ERDMANN, BENTE). Aber es unterliegt ebenso keinem Zweifel, daß dieselben nicht als Beimengungen der Zellulose zu betrachten sind, sondern offenbar in Bindung mit[S. 275] den Polysacchariden der Zellulose sich finden. Übrigens faßte schon F. SCHULZE (1857) die Holzsubstanz als einheitliche Substanz auf, die er Lignin nannte und C38H24O20 formulierte und auch ERDMANN betrachtete die Holzsubstanz als eine einheitliche komplexe Verbindung, C30H16O21 (Glykolignose), mit zuckerbildenden, aromatischen und Zellulosegruppen. CROSS und BEVAN nehmen in der Holzsubstanz (Zellulochinon) Zelluloseester und einen Aldehyd oder ein Keton an. Nach Behandeln mit saurem Calciumsulfit (MITSCHERLICHS Sulfitverfahren) bleibt in Kupferoxydammon lösliche Zellulose zurück, die bei der Hydrolyse Traubenzucker, Galaktose und Mannose liefert. Die Zellulose wird von Xylan (die Hydrolyse liefert daher auch Xylose, TOLLENS) begleitet und außerdem scheinen darin (ob präformiert?) 12–14% Ligninsäuren, (C20H11O8? mit 61–62% C), enthalten zu sein (LANGE). Auf die wohl erst bei der Kalischmelze (s. oben) entstehenden Ligninsäuren bezieht sich wohl MÄULES Manganatreaktion des Holzes, eine mikrochemische Reaktion, die in der Weise ausgeführt wird, daß man Kaliumpermanganat zufließen läßt, mit Wasser auswäscht, dann Salzsäure zusetzt und nach abermaligem Auswaschen Ammoniak zufließen läßt: die Holzmembran färbt sich rot.
Auf die aromatischen Holzstoffbestandteile beziehen sich die mikrochemischen Reaktionen mit Phenol-Salzsäure: blaugrün (RUNGE), Phloroglucin- (oder Resorcin-) Salzsäure: kirschrot bzw. violett (WIESNER), Pyrogallol-Salzsäure blaugrün (IHL), Naphthol-Salzsäure: grün (IHL), Indol-Salzsäure: kirschrot (V. BAEYER NIGGL), Orcin-Salzsäure: rotviolett (LIPPMANN), Skatol-Salzsäure: kirschrot (MATTIROLO), Pyrrol-Salzsäure: rot (IHL), Thiophen: grün (IHL), Anilinsulfat: gelb (RUNGE, SCHAPRINGER); ebenfalls tritt Gelbfärbung ein durch p-Toluidin (SINGER), α- und β-Naphtylamin (NICKEL), α-Bromphenetidin (PIUTTI). Die empfindlichste Reaktion ist die mit Pyrrol, die am häufigsten angewendete die mit Phloroglucin. Nicht nur Amylschwefelsäure (KAISER) und Isobutylschwefelsäure (GRAFE), sondern alle Alkylschwefelsäuren und aromatischen Sulfosäuren färben Holzstoff (nicht Zellulose) rot oder blau (HERTKORN), ebenso auch Isobutylaldehydschwefelsäure (GRAFE). Nicht alle Membranen, welche auf Permanganat (s. oben) reagieren, geben auch mit Phloroglucin Reaktion und umgekehrt (V. FABER). In den meisten Fällen fallen aber die Reaktionen zusammen (AISSLINGER). CROSS und BEVAN halten die Jutefaser (s. oben S. 255) für «typische Lignozellulose». Sie unterscheiden darin drei Bestandteile, deren Anhydroaggregat die Faser bildet: eine der Baumwollzellulose nahe verwandte Substanz, eine Pentazellulose, die Furfurol und Essigsäure liefert und einen Chinon liefernden Bestandteil. Durch Behandeln mit Sulfitlaugen (s. weiter hinten) werden oft ⅔ der im Holzstoff enthaltenen Substanzen, jedenfalls alle aromatischen Gruppen, entfernt und es bleiben 39,5–63% «Zellulose» zurück. Die Verholzung erhöht die Festigkeit der Membran nicht (SONNTAG).
Wir sind berechtigt anzunehmen, daß alle die oben genannten Substanzen in der Membran nicht gemengt, sondern chemisch miteinander verbunden sind (TOLLENS).
Lit. AUTENRIETH und BAYERHAMMER (in Berzel. Jahresber. 1822). — BRACONNOT, Ann. chim. phys. (2) 12 (1819). — RUNGE, Poggend. Ann. 31 (1834). — PAYEN, Compt. rend. 1838 und 1839. — SCHAPRINGER, Einfaches Mittel, um Holzstoff in Druckpapier zu erkennen. Dingl. polyt. Journ. 176 (1865) (Anilinreaktion). — ERDMANN, Lieb. Ann. 138, 1 und Supplem. 5, 233. — BENTE, Ber. d. d. chem. Ges. 1875. — V. HÖHNEL, Histochem. Unters. über das Xylophilin und das Coniferin. Sitzungsber. d. Wien. Akad. 76 (1877). — LIPPMANN, Sitzungsber. d. Wien. Akad. 77. — WIESNER, Karstens bot. Unters. I, 120 (1866) und Sitzungsb. d. Wien. Akad. 1878 (Phloroglucinsalzsäurereaktion). — SINGER, Ebenda 1882. — LANGE, Zeitschr. phys. Chem.[S. 276] 1899. — SCHELLENBERG, Beitr. zur Kenntn. d. verholzten Zellmembran. Pringsh. Jahrb. 29, 1896. — CZAPEK, Zeitschr. f. phys. Chem. 27 (1899). — GRAFE, Unters. über d. Holzsubst. Sitzungsb. d. Wiener Akad. 113 (1904) und Neue Reihe von Holzreaktionen. Öst. bot. Zeitschr. 1905. — ZETSCHE, Beitr. z. Unters. d. verholzt. Membr. Zeitschr. f. angew. Mikrosk. II. — SELIWANOFF, Bot. Zentralbl. 1891. — V. FABER, Zur Verholzungsfrage. Ber. d. d. bot. Ges. 22, 177. — AISSLINGER, Beitr. z. Kenntn. wenig bekannt. Pflanzenfas. Diss. Zürich 1907. — THOMSEN, Chem. Unters. über d. Zusammensetz. d. Holzes. Journ. pr. Chem. 19, 146. — DE CHALMOT, Ber. d. chem. Ges. 27. — E. FISCHER, Ebenda 27, 3230. — TOLLENS und LINDSEY, Lieb. Ann. 267. — EULER, Pflanzenchemie. — KLASON, Ark. f. Kemi. 1908. — G. LANGE, Zeitschr. phys. Chem. 14. — CROSS, BEVAN and BEADLE, Cellulose, an outline of the chemistry of the structural elements of plants London 1895. — MÄULE, Verhalt. verholzt. Membr. gegen KMnO4. Habilitationsschr. Stuttgart 1901. — NIGGL, Flora 1881, 545. — CZAPEK, Biochemie. — IHL, Chem. Zeit. 1885, 266 und 1890, 1571. — NICKEL, Bot. Zentralbl. 38, 754 (1889) u. Farbenreaktionen der Kohlenstoffverbind. Berlin 1890. — MATTIROLO, Zeitschr. wiss. Mikrosk. II (1885), 354. — KAISER, Chem. Zeit. 1902. 335. — TOLLENS, Pentosen u. Pentosane u. ihre Bezieh. zur Papier-Industrie. Papier-Zeitung 1907. — STACKMANN, Stud. über d. Zusammensetz. d. Holzes. Diss. Dorpat 1878. — SCHUPPE, Beitr. z. Chem. d. Holzgewebes. Diss. Dorpat 1882. — WIELER, Landw. Versuchsstat. 1885. — HENZE, Unters. über d. spez. Gew. d. verholzten Zellwand u. d. Zellulose. Diss. Göttingen 1883. — SONNTAG, Beziehungen zwischen Verholzung, Festigkeit u. Elastizität vegetabil. Zellwände. Landw. Jahrb. 1892. — TSCHIRCH, Angew. Anatomie.
In die Gruppe der Ligninomembranindrogen gehören viele Pflanzenfasern, die aus äußeren Gründen schon oben (S. 253) abgehandelt wurden, ferner alle Hölzer, die nicht, sei es durch ihren Gehalt an einem Farbstoff (Campeche), einem Harz (Guajac) oder einem Bitterstoff (Quassia) oder einem anderen differenten Stoffe in eine andere Gruppe gebracht werden müssen. Diese sog. indifferenten Hölzer spielen aber in der Medizin so gut wie gar keine Rolle mehr. Das einzige, das noch da und dort verwendet wird, ist das Lignum juniperi (über Juniperus vgl. S. 44). Neuerdings haben Holzwolle und Holzmehl zu anderen Zwecken, nämlich als Verbandmaterialien einige Bedeutung erlangt. Zu Holzwollwatte wird Holzschliff verwendet, zu Zellstoffwatte sog. Holz- oder Strohzellulosen. Die Waldwolle wird als Nebenprodukt der Kiefernadelöl- und Kiefernadelextraktbereitung gewonnen. Sie besteht aus den «destillierten» Kiefernadeln. Über Torfwatte orientiert eingehend ROYER, L’ouate de tourbe et ses applications in Trav. d. labor. de mat. méd. Paris VI. 1910 (m. zahlr. anatom. Abbild.).
In der Technik spielt die Holzsubstanz eine große Rolle bei der Herstellung von Papier, zu dessen billigen Sorten (Zeitungspapier) ausschließlich oder als Hauptbestandteil Holzschliff verwendet wird, die daher stets auf Phloroglucin und Anilinsulfat reagieren. Neben diesem sog. Holzstoff wird aber auch «chemischer Holzstoff» sog. «Zellulose» benutzt, die aus dem Holzstoff (meist geraspeltem Coniferen- aber auch Laub-Holz) durch Behandeln mit Natronlauge unter Druck oder Calciumbisulfitlösung (MITSCHERLICH), oder Kalkmilch und schwefliger Säure unter Druck (ARCHBOLD), oder Magnesiumsulfit (ECKMAN), oder Schwefelnatrium erhalten wird.
Die Erfinder des Holzschliffs sind F. G. KELLER in Kühnheida (Erzgebirge) und H. VÖLTER in Heidenheim (1852), der Erfinder der Natronzellulose ist A. UNGERER in Semmering bei Wien (1869–1871), der Erfinder der Sulfitzellulose der Amerikaner TILGHMAN (1866). Das Verfahren wurde dann Anfang der siebziger Jahre praktisch durchgeführt von A. ECKMANN, C. KELLNER und A. MITSCHERLICH, die unabhängig voneinander arbeiteten (WIESNER).
In den heutigen Papieren findet man neben Lein, Hanf, Alfa (Halfa), Jute und Baumwolle, Nadelholz-Holzschliff, Laubholz-Holzschliff, Nadelholzzellulose und Laubholzzellulose. (Über Papier vgl. auch oben S. 256.)
[S. 277]
Dann ist auch nicht ohne Erfolg versucht worden aus Holz Alkohol darzustellen, was an sich keinen Schwierigkeiten begegnet, da ja die Zellulosine bei der Hydrolyse Zucker liefern. Das Verfahren ist aber zurzeit noch nicht billig genug. Auch die Verarbeitung auf Zucker ist versucht worden, jedoch ohne jeden Erfolg (LIPPMANN).
Lit. SCHUBERT, Zellulosefabrikation 1897 und Holzstoff- u. Holzschlifffabrikation 1898, sowie Praxis d. Papierfabrikation 1897. — WILHELM und ZEISEL in Wiesner, Rohstoffe. 2. Aufl. — A. MEYER, Grundlagen u. Methoden f. mikrosk. Unters. d. Pflanzenpulver 1901. — C. PIEST, Die Zellulose, ihre Verarbeitung u. ihre chem. Eigensch. 1910. — Der technisch verwendeten Hölzer: NÖRDLINGER, Technische Eigenschaften d. Hölzer. Stuttgart 1860. — SANIO, Vgl. Unters. über die Zusammensetz. d. Holzkörpers. Bot. Zeit. 1863. — DE BARY, Vgl. Anatomie. — KRAH, Über d. Verteil. d. parenchymat. Elemente im Xylem u. Phloëm d. dikotylen Laubbäume. Berlin 1883. — MOELLER, Die Rohstoffe d. Tischler- und Drechslergewerbes 1883, Nutzhölzer in DAMMERS Lexikon und Artikel Holz in Realenzyklopädie d. ges. Pharm. — R. HARTIG, Die anatom. Unterscheidungsmerkmale d. wichtigeren in Deutschl. wachsend. Hölzer. 1890. — WIESNER a. a. O. — MEYER a. a. O. — HANAUSEK a. a. O.
5. Pektino-Membranindrogen.
Der Name Pektin rührt von BRACONNOT her, der (1825) die Gallertsubstanz der Früchte erst Pektinsäure (von πηκτός = geronnen), dann (1831) Pektin nannte (GUIBOURT sprach von Grosselin). Ob das Pektin eine Membransubstanz ist oder nicht, war bis vor kurzem noch nicht ganz sicher. Einige suchten es im Zellinhalte, andere in verschiedenen Teilen der Membran. Die Untersuchungen, die ich 1907 mit ROSENBERG durchgeführt habe, haben die Zweifel beseitigt: es geht aus der Interzellularsubstanz hervor, weder die sekundäre Membran noch der Zellinhalt sind an seiner Bildung beteiligt. Außer PAYEN verlegen auch MANGIN, KABSCH, VOGL, WIESNER, HERZFELD die Pektinbildung in die Mittellamelle. Die Interzellularsubstanz muß nahe verwandt mit dem Pektin (der Pektinsäure der Autoren) sein. Aber nicht immer geht sie in Pektin über. Es scheint, daß dazu bestimmte Bedingungen erfüllt sein müssen, wie sie besonders in reifenden Früchten und einigen Wurzeln eintreten. Gewöhnlich bezeichnet man die in Pektin übergehende Substanz als Pektose (FRÉMY). Ich nenne sie Protopektin. Darnach würde also die Interzellularsubstanz vielleicht immer, wenigstens bei den pektinbildenden Pflanzenteilen, aus Protopektin bestehen. In reifenden Früchten kann man den Übergang des Protopektins, das in Wasser und auch in Kupferoxydammoniak unlöslich, in 2% Natronlauge (nach Vorbehandlung mit Salzsäure) und in Ammoniumzitrat aber löslich ist, in Pektin, das sich in konz. Zuckerlösungen löst, durch mikrochemische Reagentien verfolgen. Während sich nämlich Protopektin (Pektose FRÉMY, pektinsaurer Kalk MANGIN) leicht mit Jodgrün, HOFMANNS Violett, Naphthylenblau, Ammoniumrutheniumsesquichlorid (Rutheniumrot, Ru2Cl6·4 NH4Cl) färbt (MANGIN) — am besten reagiert Neutralviolett und Rutheniumrot in sehr verdünnter Lösung (ROSENBERG) —, verschwindet das Farbstoffspeicherungsvermögen mit fortschreitender Pektinbildung. Wenn die Pektinmetamorphose, wie ich diesen Vorgang genannt habe, abgeschlossen ist — was beim Reifen der Früchte eintritt —, so ist das Endprodukt in Zuckerlösung löslich bzw. gelatiniert nach dem Erhitzen mit Zuckerlösung (TSCHIRCH und ROSENBERG).
Über die chemische Beschaffenheit des Pektins, das wohl mit der Pektinsäure anderer Autoren bzw. dem sog. Calciumpektat identisch ist, sowie des Protopektins wissen wir wenig, doch verhalten sie sich jedenfalls wie Zellulosine. SCHEIBLER erhielt[S. 278] bei der Hydrolyse der Metapektinsäure der Rüben Arabinose (Pektinose), HERZFELD aus Rübenpektin, JAVILLIER aus Quittenpektin Arabinose und Galaktose. Ebenso fand MÜNTZ Galaktose. Auch das Pektin der Enzianwurzel und der Hagebutte lieferte diese beiden Zucker, das der Apfelsinen d-Glukose, Galaktose und l-Xylose; das der Kirschen, Äpfel, Johannisbeeren, Reineclauden, Rhabarberstengel und Mohrrüben noch andere Hexosen und Pentosen (TROMP DE HAAS und TOLLENS). Jedenfalls erhält man bei der Oxydation z. B. des Rübenmarks mit Salpetersäure viel Schleimsäure, das Oxydationsprodukt der Galaktose. Etwas Xylan enthält das Pektin der Äpfel (BAUER) und in vielen anderen Pektinen ist ein d-Galaktoxylan enthalten (BAUER, PRINSEN-GEERLIGS). Die Pektine liefern also bei der Hydrolyse Pentosen und Hexosen, enthalten also Pentosane und Hexosane, vorwiegend Galaktoaraban und Arabangruppen, sind also zu den Hemizellulosen zu rechnen. Sie reagieren schwach sauer und man trifft daher auch Säuren unter den Spaltungsprodukten. TOLLENS vermutet, daß die Pektine ursprünglich neutrale Laktone oder Ester den Glykosidosäuren nahestehender, kohlehydratartiger Substanzen sind, die in Berührung mit Alkalien leicht in die Salze der betreffenden Säuren übergeben. CROSS hält sie eher für lösliche, unbeständige Übergangsformen der Hemi-, Oxy- und Lignozellulosen.
Welche Rolle die Erdalkalien spielen, ist noch unaufgeklärt. Wahrscheinlich ist Kalk, der ja auch in vielen Schleimmembranen (Laminaria, Linum, Cydonia), in der resinogenen Schicht und den Gummis auftritt, ein regelmäßiger Bestandteil der Pektine. MANGIN ist der Ansicht, daß die Pektosen junger Zellwände mit der Zeit in Pektinsäuren übergehen, die Kalk aufnehmen und in Calciumpektate übergehen; DEVAUX meint jedoch, daß auch ältere Mittellamellen aus Pektosen bestehen. Durch andauerndes Kochen des Pektins (oder der Pektose) mit Wasser entsteht das sauer reagierende Parapektin, das mit Wasser aufquillt und 30% Schleimsäure, sowie 14,2% Furol liefert, also ebenfalls Galaktose und Arabinose liefernde Gruppen enthält (Araban, γ-Galaktan?). Der Pektinsäure gibt FRÉMY die Formel: C32H44O30, REGNAULT: C12H16O11, MULDER: C12H16O10, CHODNEW: C14H22O14.
Pektosen werden schon in der Kälte leicht hydrolysiert, wobei Pektinsäuren und Arabinose entsteht. Ebenso wirkt die Pektinase, die auch das Calciumpektat weiter spaltet (BOURQUELOT und HÉRISSEY). Der unlösliche Membranbestandteil, der aus Pektin, Parapektin und Metapektinsäure entsteht, wurde, wie erwähnt, Pektose genannt. Der Name ist irreführend, da er eine Zuckerart vermuten läßt, und sollte fallen gelassen und durch Protopektin ersetzt werden. Pektin wird durch Alkohol koaguliert, auch zahlreiche Pflanzenauszüge (wie solche der Kartoffeln, der Zuckerrüben usw.) koagulieren das Pektin, wobei ein Enzym (Pektase) in Aktion treten soll (?), das aber nur in Gegenwart von Ca-, Sr- oder Ba-Salzen und nicht in saurer Lösung wirkt. Die Pektinase soll das Gelatinieren hindern (BOURQUELOT). Doch bewirken schon die Calciumsalze allein die Fällung in Form von Pektinaten. FRÉMYS und HERZFELDS Pektin ist optisch-inaktiv, ANDRLIKS Pektin dreht 3–4 mal stärker rechts als Rohrzucker, und die Pektine von BOURQUELOT und HÉRISSEY zeigen Rechtsdrehungen von +82,3 bis +194,1. Alle halten Pektin für in Wasser löslich.
ROSENBERG und ich konnten weder durch kalte noch durch heiße Extraktion von Früchten ohne weiteren Zusatz eine in der Kälte gelatinierende Lösung erhalten — auch nicht wenn die Lösung eingedampft wurde. Wohl aber erhält man leicht eine Gelatine, wenn man die Früchte oder einen heißen Auszug derselben unter Zuckerzusatz[S. 279] kocht und die Flüssigkeit erkalten läßt. Diese Pektingelatine ist entweder eine feste Pektinzuckerlösung oder eine Pektinzuckerverbindung.
Immerhin scheint es besonders nach FRÉMYS Versuchen möglich, daß auch andere Substanzen, wie Zucker, Gelatinebildung bewirken; ob jedoch das Enzym Pektase ein solcher Körper ist, erscheint noch zweifelhaft. Für die Praxis der Fruchtgeleefabrikation kommt aber wohl nur Zucker in Betracht. Da Zuckerlösung das Pektin in der Pflanze zum Quellen und Gelatinieren bringt und dadurch die Zellen des Fruchtfleisches voneinander gelöst werden, so hat vielleicht die Zuckerbildung in den Früchten den Zweck, das Fruchtfleisch aufzulockern und so den Zerfall der Frucht und das Herauslösen der Samen zu beschleunigen. Die sog. «Auskleidungen der Interzellularen», die oft als Knöpfe oder Stäbchen in den Interzellularraum ragen (s. hinten Lit.), sind ebenfalls Pektin (pektinsaurer Kalk, MANGIN) und auch die resinogene Schicht der schizogenen Sekretbehälter (TSCHIRCH) muß Beziehungen zum Pektin haben. Da Pektin meist als Protopektin die Zellen miteinander verkittet, müssen alle Substanzen, welche Protopektin lösen, z. B. SCHULZEsche Macerationsflüssigkeit, die Zellen isolieren. Aber auch Bakterien vermögen dies zu tun. Bei der sog. Flachsröste (s. S. 254) werden die Leinstengel in faulendes Wasser gestellt und hier wirken nun die Bakterienprodukte lösend auf das Protopektin. Es entsteht eine Auflockerung des Gewebes und eine Isolierung der Fasern. WINOGRADSKY fand, daß der Bazillus der Flachsröste alle Pektinsubstanzen in Gegenwart stickstoffhaltiger Nährböden «vergärt». Beziehungen des Gummis zu den Pektinsubstanzen zeigt die Metapektinsäure, die SCHEIBLER durch Behandlung von «Rübenmark» (d. h. des Grundparenchyms der Rübe) mit Alkalien erhielt — sie entsteht auch beim Kochen von Rübenmark mit verdünnter Oxalsäure — und die er für identisch mit Arabinsäure hält. Zu den Pektinstoffen steht jedenfalls auch das Pararabin REICHARDTS (s. Agar), dem er die Formel C12H22O11 gibt, in Beziehung und THOMSENS Holzgummi ist wohl identisch mit dem Pektin (aus Holz) von POUMARÈDE und FIGUIER, die glauben, daß Pektin und Zellulose ursprünglich von gleicher Zusammensetzung waren.
Die Grenze zwischen Pektin- und Schleimmetamorphose der Interzellularsubstanz ist oft verwischt (vgl. Fruct. Sambuci, Fig. 19). Überhaupt finden sich mancherlei Übergänge in den Membranen, die offenbar nur selten ganz einheitlich sind. Ein solches Übergangsgebilde scheint die Callose MANGINS zu sein, die er zuerst im Callus der Siebplatten fand. Sie ist unlöslich in Kupferoxydammoniak, gibt keine Chlorzinkreaktion, ist leicht löslich in 1% Natronlauge, unlöslich in kalter Alkalikarbonatlösung; die Protopektinreagentien (s. oben) versagen, Korallinsoda und Anilinblau färben.
Lit. PAYEN, Ann. chim. phys. (2), 26 (1824), 329; Rec. sav. étrang. (2) IX (1846), 148, Compt. rend. 1856. — BRACONNOT, Ann. chim. phys. 28 u. 30 (1825); dann ebenda 47 (1831) und 50 (1832). — GUIBOURT, Schweigg. Journ. 1825. — FRÉMY, Journ. pharm. chim. 26 (1840), 568, Lieb. Ann. 67 und Compt. rend. 1847. Hauptarbeit: Ann. chim. phys. (3) 24 (1848) 5; Compt. rend. 48, 203; Journ. pharm. (3) 36 (1859) 5. — CHODNEW, Lieb. Ann. 51, 355. — MULDER, Journ. pr. Chem. 14, 285. — POUMARÈDE et FIGUER, Compt. rend. 1847 u. Journ. pr. Chem. 12, 31. — STÜDE, Lieb. Ann. 131, 250. — SCHEIBLER, Ber. d. chem. Ges. I (1868), 58 und 108; 6 (1873) 612. — MÜNTZ, Sur l’existence des éléments du sucre de lait dans les plantes. Ann. phys. chim. 10 (1887), 566. — HERZFELD, Chem. Zentralbl. 1891, 618. — BAUER, Landw. Versuchsst. 38 (1891) und 41 (1892), 477. — L. MANGIN, Compt. rend. 107 (1888), 109 (1889), 110 (1890), 111 (1891), 115 (1892), 116 (1893); Bull. soc. bot. 36 (1889), 274, 38 (1891), 39 (1892). Journ. de bot. 1891, 1892 und 1893 und Sur la callose, nouvelle substance fondamentale existant dans la membrane. Compt. rend. 110 (1890). — BOURQUELOT, Compt. rend.[S. 280] 128 (1899), 1241. — BOURQUELOT et HÉRISSEY, Compt. rend. 127 (1898), 191; Compt. rend. soc. biol. 1898, 777; Journ. chim. phys. 9; Journ. pharm. 7 (1898) und 9 (1899) 281. — BERTRAND u. MALLÈVRE, Compt. rend. 119, 120, 121. — BAUER, Chem. Zentralbl. 1901, 196. — DEVAUX, Soc. phys. et nat. de Bordeaux 3 (1903). — TSCHIRCH, Über Pektin und Protopektin. Ber. d. pharm. Ges. 1907, 237. — E. ROSENBERG, Über d. Pektinmetamorphose. Diss. Bern 1908 (mit 9 Taf.). — Pektinanalysen bei REICHARDT, Arch. d. Pharm. 209 (1876), 97 und 210 (1877) 116, MARTIN in SACHSSES Phytochem. Untersuch. 1880, BAUER, Journ. pr. Chem. 30, 369 und TROMP DE HAAS und TOLLENS, Lieb. Ann. 286 (1895), 278. — TOLLENS, Kurzes Handb. d. Kohlenhydrate. 2. Aufl. 1898. — LIPPMANN, Chemie der Zuckerarten 1904. — CZAPEK, Biochemie (dort die Lit.). — Auskleidungen der Interzellularen: DE BARY, Anatomie. — RUSSOW, Über d. Auskleid. d. Interzellularen. Sitzungsb. d. Dorpat. Naturf. Ges. 1884, 19. — GARDINER, Nature 1885, 390. — SCHAARSCHMIDT, Bot. Zentralbl. 18 und 19. — SCHENCK, Ber. d. d. bot. Ges. 3 (1885) (dort weitere Literatur). — VAN WISSELINGH, Sur les revêtements des espaces intercellulaires. Arch. Néerland. 21.
Die vornehmlich als Genußmittel benutzten Fruchtgelees, die sämtlich pektinreich sind (s. oben), werden in der Medizin nur als diätetische Heilmittel benutzt. Ihr Heilwert beruht nur zum Teil auf dem Pektin. Besonders kommt Quitten- und Himbeergelee in Betracht. (DIOSKURIDES nennt eine Menge Krankheiten, bei denen z. B. Quitten benutzt wurden.) Man kann durch richtiges Abstimmen des Zuckerzusatzes die Ausbeuten an Gelee vermehren und sich pektinreiche Geleegrundlagen durch Aufkochen der Preßrückstände der Früchte mit Zuckerlösung darstellen. Man kann die Fruchtgelees auf einen unzulässigen Zusatz von Gelatine dadurch prüfen, daß 5–10 g Gelee mit dem gleichen Gewicht Wasser gelöst, die Lösung mit 100 ccm Alkohol versetzt und im getrockneten und gewogenen Niederschlag der Stickstoff bestimmt wird. Während der getrocknete Niederschlag bei normalem Gelee nur 13 bis 28% Stickstoffsubstanz enthält, steigt der Gehalt bei Gelatinezusatz auf 45% (BÖMER, Chem. Zeit. 19). Ungereinigtes Agar ist durch Diatomeen nachweisbar (MARPMANN). Gereinigtes Agar dadurch, daß man 10–20 g Gelee mit dem gleichen Gewichte Wasser verdünnt, mit 100 ccm Alkohol versetzt, den Niederschlag mit Alkohol wäscht, trocknet und wiegt und dann mit soviel heißem Wasser löst, daß eine 1% Lösung entsteht. Entsteht beim Erkalten eine steife Gallerte, so soll dies Agar anzeigen.
6. Koryzo-Membranindrogen.
Etym. Korizo von κορίζα = Schleim — Schleim mhd. slîm. Die Wurzel slī = glatt, schlüpfrig steht in Beziehung zu lat. lîmare = glätten.
Daß die vegetabilischen Schleime, soweit sie entwicklungsgeschichtlich genau verfolgt werden konnten, alle ohne Ausnahme zur Membran, also zu den Membraninen gehören, ist namentlich durch die Untersuchungen von FRANK, mir und meinen Schülern NADELMANN und WALLICZEK nachgewiesen worden. Ich habe daher die Bezeichnungen Schleimmembran und Membranschleim eingeführt. Die ersten, die einige Schleime als Membranverdickungen erkannten, waren NÄGELI und CRAMER (1855). Doch finden sich zwei wesentlich verschiedene Typen der Schleimmembranbildung, je nachdem entweder die sekundären Membranschichten oder die Interzellularsubstanz als Schleimmembran auftreten. Die Schleimschichten der sekundären (und tertiären) Membran werden der Regel nach schon als solche angelegt (Fig. 94, 1–5). Es findet hier also nicht, wie man früher glaubte, eine Schleimmetamorphose ursprünglich als Zellulose angelegter Schichten statt. Wie dies bei den Interzellularsubstanzschleimen ist, bleibt bei den einzelnen Fällen noch zu untersuchen. Hier scheint eine Umbildung der primär gebildeten Interzellularsubstanz in Schleim zu erfolgen — ähnlich[S. 281] der Pektinbildung aus Protopektin. Und daß endlich auch an an Interzellularen grenzenden Zellen eine Schleimmembran sich bilden kann, habe ich bei den Cycadeen-Schleimkanälen nachgewiesen (Fig. 94, 11 u. 12) und geht auch daraus hervor, daß die resinogene Schicht der schizogenen Harzkanäle ebenfalls als Schleimmembran aufzufassen ist. Es liegen also hier ähnliche Verhältnisse vor wie bei der Pektin- und Gummibildung (s. d.).
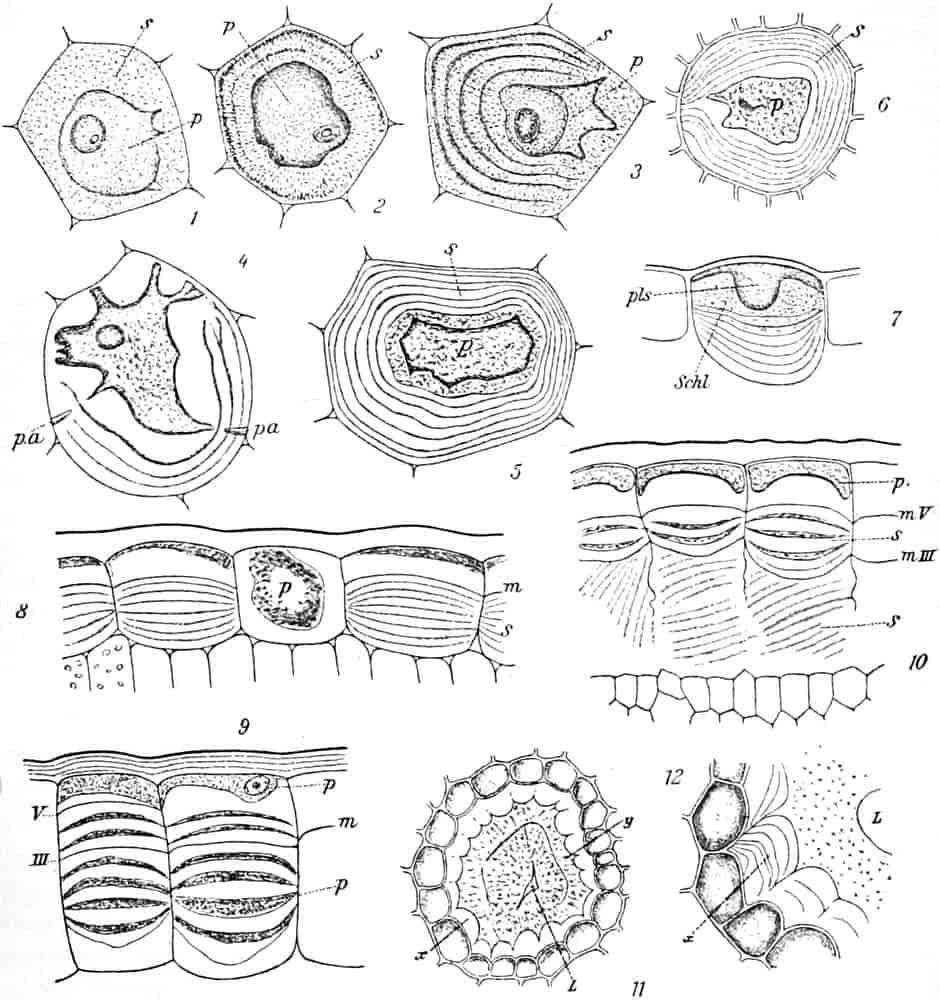
Schleimmembranen und ihre Entwickelung.
1–5 Entwicklung einer Schleimzelle aus dem Internodium von Tilia grandifolia. 6 Junge Schleimzelle aus der Stammrinde von Rhamnus Frangula. 7 Junge Epidermiszelle aus dem Blatte von Althaea officinalis. 8 Schleimzellen aus der Epidermis von Cassia angustifolia. 9 und 10 Schleimepidermis der Blätter von Barosma vulgaris, zwischen die Schleimschichten sind Zelluloselamellen (m) eingeschoben (1–10 nach Walliczek). 11 und 12 Schleimmembranen in schizogenen Kanälen von Cycas (Tschirch).
Fast alle untersuchten Schleime geben bei der Hydrolyse Arabinose und Galaktose (verhalten sich also wie Hemizellulosen und ähnlich wie Pektin, s. d.), einige (Linum, HILGER) auch Dextrose und Xylose. Arabinose und Xylose sind Pentosen:
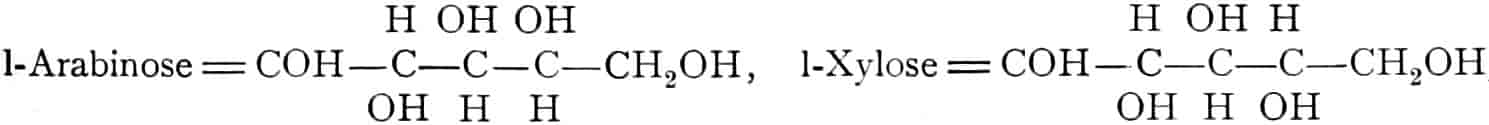
[S. 282]
Dextrose und Galaktose dagegen Hexosen (vgl. S. 6). Alle untersuchten echten Schleime geben bei der Oxydation mit Salpetersäure Schleimsäure (zuerst von VAUQUELIN 1811 beim Leinsamenschleim beobachtet), ein weiterer Beweis, daß Galaktosegruppen darin enthalten sind (s. oben S. 226).
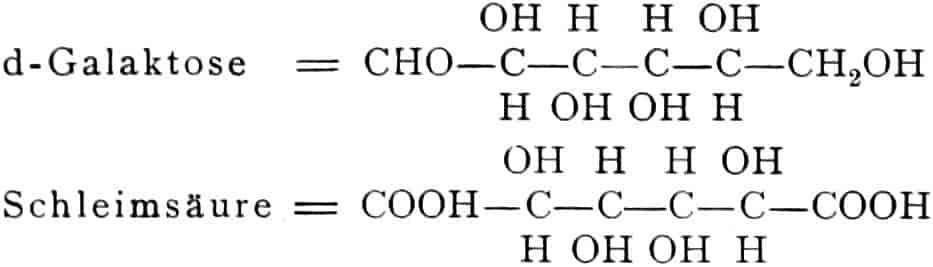
Man hat daher wohl auch zwischen Schleimsäure bildenden und keine Schleimsäure bildenden Schleimen unterschieden. Doch will ich diesen Unterschied hier nicht zur Einteilung verwerten. Ebensowenig die Reaktion mit Jodschwefelsäure oder Chlorzinkjod. Einige Schleimmembranen (Epidermis der Cydoniasamen, Salviafrüchte, Viscum) färben sich nämlich mit diesem Reagens blau (Zelluloseschleime, TSCHIRCH), andere (Echte Schleime, TSCHIRCH) gelb (Endosperm von Trigonella, Schleimzellen von Rad. althaeae). Im Zusammenhang mit dieser Erscheinung steht die Beobachtung von TOLLENS, daß einige Schleime (Agar, Linum, Cydonia, Salep, Psyllium) bei der Hydrolyse eine Abscheidung von Zellulose zeigen. Der «Zellulosegehalt» wird bei Meeresalgen auf 3,10% (Gracilaria confervoides), 4,40% (Fucus vesiculosus) und 8,89 (Vaucheria Pilus) angegeben (SESTINI, BOMBOLETTI und DELLA TORRE).
MANGIN unterscheidet, gestützt auf das verschiedene Tinktionsvermögen gegenüber den «Pektin färbenden» (vgl. oben S. 277) Lösungen (Methylenblau, Rutheniumrot): Zelluloseschleim, Pektinschleim, Kalloseschleim und gemischte Schleime. Wie schon die letzte Gruppe zeigt, gibt es hier mancherlei Übergänge. Eher läßt sich das morphologische Moment benutzen (s. unten). Ich habe schon in der Angewandten Anatomie die Schleimepidermen der Samen den endogenen Schleimzellen und den Schleimendospermen gegenübergestellt. Ihre Funktion ist sehr verschieden. Die Schleime der Schleimendosperme der Samen (Trigonella) sowie die Schleimzellen unterirdischer Reservestoffbehälter (Orchis) besitzen den Charakter von Reservestoffen. Die Schleimepidermen der Samen (z. B. Linum, Cydonia) dienen verschiedenen Zwecken: Festhalten von Wasser, Befestigung der Samen am Boden zur Sicherung der Keimung usw. (TSCHIRCH und LÜDTKE). Die Schleimepidermen der Blätter (Bukku) sind als Wasserspeicher aufzufassen. Welche Funktion die endogenen Schleimzellen der Vegetationsorgane, der Samenschalen (Cacao), der Kelch-, Blüten-, Staub- und Fruchtblätter der Sterculiaceen, Malvaceen und Tiliaceen besitzen, wissen wir nicht. Daß auch die resinogene Schicht der Sekretbehälter zu den Membraninen gehört, zeigt nicht nur der anatomische Befund, sondern auch die Untersuchung des Gummis der Gummiharze, welches ja der resinogenen Schicht entstammt (TSCHIRCH). Sie liefern bei der Hydrolyse Galaktose, Glukose und Arabinose, das Gummi der Myrrhe Galaktose und Arabinose, sowie etwas Xylose, es enthält also Galakto-Arabino-Xylane.
Nur wenig untersucht ist der sog. Inhaltsschleim. Dieser wird hier gar nicht berücksichtigt. Echte Schleime als Bestandteile des Zellinhaltes sind jedenfalls selten und immer wenn entwicklungsgeschichtliche Untersuchungen ihnen näher traten entpuppten auch sie sich als Membranschleime. So wurden die lange (LAUTERBACH) als Inhaltsschleime betrachteten Cacteenschleime ebenfalls als Membranschleime[S. 283] erkannt (WALLICZEK) und das gleiche gilt von dem Schleime von Viscum (CZAPEK). Nur bei Orchis ist mir die Sache auch heute noch zweifelhaft.
Mit Wasser bilden die Schleime kolloidale Lösungen. Einige (Althaea, Linum, Cydonia) lassen sich mit Ammonsulfat aussalzen (POHL).
Offenbar haben wir es aber bei den Koryzo-Membraninen nicht mit einer Substanz, sondern mit einer ganzen Klasse von Substanzen zu tun. Das zeigt schon das verschiedene Verhalten zu Wasser: einige quellen kaum, andere stark, noch andere lösen sich darin.
Lit. TSCHIRCH, Kapitel Schleimmembran in Angew. Anatomie 1888, S. 193. (Dort eine zusammenfassende Darstellung). Ferner Chemie u. Biologie d. pflanzl. Sekrete. Leipzig 1908. — KÜTZING, Grundzüge t. 4. — HOFMEISTER, Über die zu Gallerte aufquellenden Zellen der Samenepidermis. Ber. der Sächs. Ges. d. Wissensch. 1858. — NÄGELI u. CRAMER, Vorkommen u. Entstehen einiger Pflanzenschleime. Zürich 1855 (Arch. d. Pharm. 1857, 190) — WIGAND, Desorganisation der Pflanzenzellen. Pringsh. Jahrb. 3, 1863. — FRANK, Anatom. Bedeut. u. Entsteh. d. vegetabil. Schleime. Pringsh. Jahrb. 5 (1865). — TRÉCUL, Des mucilages chez les Malvacées, le tilleul, les Sterculiacées, les Cactées et les Orchidées indigènes. Compt. rend. 1862. — RADLKOFER, Monographie der Gattung Serjania. München 1875. — KLEBS, Organisat. d. Gallerte bei einigen Algen usw. Arb. d. bot. Inst. Tübingen II. — GUIGNARD, Observat. sur l’appareil mucifère des Laminariées Ann. sc. nat. (8) 15, 1892. — ULOTH, Pflanzenschleim und seine Entstehung. Flora 58, 809. — ABRAHAM, Bau u. Entwickl. der Wandverdick. in d. Samenoberhautzellen einiger Cruciferen. Pringsh. Jahrb. 16. — FLÜCKIGER (Buccu). Schweiz. Wochenschr. f. Pharm. 1873. — MARKTANNER-TURNERETSCHER, Z. Kenntn. d. anatom. Baues unserer Loranthaceen. Sitzungsb. d. Wien. Akad. 1885. — VAN TIEGHEM, Sur les canaux à gomme des Sterculiacées. Bull. soc. bot. de France 1885. — HARTWICH, Schleimzellen d. Althaea. Pharm. Zentralh. 1891, 586 und (Orchis). Arch. Pharm. 1890. — A. MEYER (Orchis). Arch. Pharm. 1886, 325. — LAUTERBACH, Bau u. Entwickl. d. Sekretbeh. bei d. Cacteen. Bot. Zentralbl. 1889. — DE BARY, Anatomie. — RADLKOFER, Monogr. v. Serjania 1875. — MANGIN, Bull. soc. bot. 1894. — TSCHIRCH, Harze und Harzbehälter. Botanischer Teil. — H. WALLICZEK, Studien über die Membranschleime vegetativer Organe. Pringsh. Jahrb. 25 (1893), 227 (auch Diss. Bern 1893). Dort weitere Literatur. — NADELMANN, Über Schleimendosperme der Leguminosen. Pringsh. Jahrb. 21, 1890 (auch Diss. 1890). — POPOVICI, Strukt. u. Entw. eigenart. Wandverd. Diss. Bonn 1893. — CZAPEK Biochemie und in GJOKIC, Sitzber. d. Wien. Akad. 105, I (1896), 451 (Viscum). — HOEHNEL, Ebenda 1881.
Chem. Untersuch.: VAUQUELIN, Ann. de chim. 80 (1811), 314. — TOLLENS, Handb. d. Kohlenhydrate. — CZAPEK, Biochemie. — CULLINAN, Bot. Jahresber. 1884, I. 71. — GANS und TOLLENS, Lieb. Ann. 249 (1889), 245. — POHL, Zeitschr. phys. Chemie 14 (1890), 151. — BAUER, Landw. Versuchsstat. 40 (1892) 480. — YOSHIMURA, Agric. Coll. Tokio 1895. — HILGER, Ber. d. d. chem. Ges. 36 (1903) 3198. — HARLAY, Journ. pharm. chim. 1902. — SESTINI, Zentralbl. Agric. Chem. 1878. — FRISCHMUTH, Chem. Zeit. 21, R. 289. — VALENTA, Klebe- und Verdickungsmittel. 1884. — Weitere Lit. bei den einzelnen Abschnitten.
HÉRAIL benutzt, MANGIN folgend, in Traité de pharmacologie 1901, die Färbbarkeit der Schleimsubstanzen durch organische Farbstoffe zur Einteilung und teilt sie in mucilages simples, m. mixtes und m. indéterminés und die m. simples wieder in mucilages cellulosiques (färbbar durch Orseilline BB und Naphtholschwarz in saurem Bade und Congorot und Benzopurpurin in alkalischem Bade — nie durch sog. basische Farben), mucilages pectosiques (färbbar durch basische Farben in neutralem Bade, z. B. Bismarckbraun, Methylenblau, Bleu de Nil und Rutheniumrot) und mucilages callosiques (färbbar durch Anilinblau in essigsaurem Bade und durch Corallin-Soda). Da alle uns interessierenden Schleime, mit Ausnahme des Salep, in die zweite Abteilung (m. pectosiques) gehören, hat diese Einteilung für uns keinen Wert. Ich führe die weitere Einteilung auf morphologischer Grundlage durch.
Die erste Gruppe der Koryzo-Membranindrogen bilden die, bei denen der Schleim von der Interzellularsubstanz gebildet wird. Hierzu gehören alle Kryptogamen-Schleimdrogen. Die zweite Gruppe umfaßt die, bei denen der Schleim von[S. 284] den sekundären Membranverdickungsschichten gebildet wird. Bei ihnen finden wir entweder Schleimepidermen oder Schleimendosperme oder Schleimzellen im Innern der Organe.
1. Schleime der Interzellularsubstanz.
Cryptogame Schleimdrogen
Carrageen.
Syn. Caragaheen, Carragheen, Karragaheen, Lichen Caragaheen, Fucus crispus s. hibernicus — Irländisches oder Perlmoos, Seeperlenmoos, Krauser Knorpeltang, Knorpelmoos, Krausmoos, Gallertmoos, Seemoos, Felsenmoos — mousse d’Irlande, goémon, mousse perlée (franz.) — irish Moss, pearl moss (engl.). — fuco carageo (ital.). — jersch mos (holl.) — karagén (ung.) — λειχὴν ὁ ἰρλανδικός (n. griech.).
Etym. Carrageen ist der in der irländischen Volkssprache aus Corigeen oder Carraigeen (= Felsenmoos) entstandene Name der Alge. Daß Corigeen aus κορίζα (= Schleim) und γίγνομαι (= entstehen) entstanden sei (wie WITTSTEIN meint), ist sehr fraglich. Carraigeen ist wohl ein keltisches Wort (Stamm: car = Fels). Nach Aussage eines Irländers ist die richtigste Schreibweise: Carraigeen (HANBURY), Carraig (irisch = Fels, daher Felsenmoos). Mos, mossa (mosi, mus) ist der skandinavische Ausdruck für alle laubigen Cryptogamen (nicht nur für die Moose).
Stammpflanze: Chondrus crispus (L.) STACKHOUSE (Chondrus crispus LYNGBYE, Chondrus polymorphus LAMOUROUX, Fucus crispus L., Sphaerococcus crispus AGARDH) und
Gigartina mamillosa (GOODENOUGH ET WOODWARD) J. G. AGARDH (Sphaerococcus mammillosus AGARDH, Mastocarpus mammillosus KÜTZING). Letztere Alge tritt in der Droge meist stark zurück.
Etym. χόνδρος = Knorpel, crispus = kraus, σφαῖρα = Kugel, κόκκος = Kern, γίγαρτον = Weinbeerenkern, ρόδον = Rose, φῦκος = Tang. — χονδρός bei DIOSCURIDES ist, wie ich durch Vergleich der Abbild. im Cod. constantinopol. ersehe, ein Hordeum.
Systemat. Stellung. Euphyceae — Rodophyceae — Gigartinaceae oder Klasse: Rhodophyceae — Unterklasse: Florideae — Reihe: Gigartinales — Familie: Gigartinaceae — Gigartineae.
Chondrus crispus. A. Starkgeteilter Thallus mit schmalen Lappen B. Anderes Extrem, breitblattartiger Thallus, der nur an der Spitze Teilungen zeigt.
[Tunmann gez.]
Beschreibung der Stammpflanzen. Chondrus (= Knorpeltang) und Gigartina (= Kerntang) sind etwa 7–15 cm hohe, rote Meeresalgen, deren Farbe von rein rosenrot über purpurrot, rotviolett zu blauviolett variiert, und deren laubiger, einer Haftscheibe aufsitzender Thallus (Lagerstämmchen) einen ganz außerordentlichen Polymorphismus zeigt (Fig. 95). Bald ist er nur wenig geteilt, bald in zahlreiche Lappen zerschlitzt, bald sind die Abschnitte breit, bald schmal, bald sehr schmal, bald reicht die Zerschlitzung bis zur Basis, bald findet sie sich nur an der Spitze breiter Lappen. Diese Variabilität war der Grund, weshalb man früher zahlreiche (über 40)[S. 285] Varietäten unterschied. [TURNER z. B. unterschied 9 Spielarten: virens, stellata, aequalis, filiformis, patens, lacera, samiensis, geniculata und plana.] Die Verzweigung, die stets rein dichotom ist, ist oft so groß, daß das Ganze ein krauses Durcheinander bildet. Der Thallus zeigt sehr deutliche Fadenstruktur.
Die Fortpflanzungskörper sind zweierlei Art: ungeschlechtlich entstehende Tetrasporen und durch einen Geschlechtsakt gebildete Cystocarpien. Die Tetrasporen sind paarweise geteilt und bilden Gruppen (Sori). Das weibliche Organ, das Procarp, besteht aus 4 Zellen. Die kleinste und innerste Zelle desselben, das Carpogon, bildet einen fadenförmigen, über die Lageroberfläche heraustretenden Fortsatz, die Trichogyne (Fig. 96 A tr). An diese legt sich zur Zeit der Fortpflanzung eines der in krugförmigen, an der Thallusoberfläche zu Krusten vereinigten Antheridien gebildeten, unbeweglichen Spermatien (Spermatozoiden) an. Es erfolgt Kopulation. Die befruchtete Carpogonzelle kopuliert durch einen sehr kurzen Ooblastemfortsatz mit einer zweiten Zelle des Procarps, der Auxilarzelle. Diese sendet nunmehr in das Thallusgewebe ein Büschel von gegliederten Fäden, den Gonimoblasten, dessen Endzellen und oberen Gliedzellen sich schließlich zu Sporen entwickeln. Diese Sporen, die den von der Thallusrinde umhüllten Fruchtkern bilden, werden entweder vom Cystocarpium durch Poren ausgestoßen und keimen alsdann im Wasser oder die Keimung erfolgt schon im Cystocarpium.
A. Endocladia vernicata. Dreizelliger Carpogonast einer Auxiliarzelle. c Carpogon. tr Trichogyne.
[Nach Hauptfleisch.]
B. Chondrus crispus mit Cystokarpien.
[Nach Kützing.]
Gigartina mamillosa mit Cystokarpien.
[Nach Kützing.]
Bei Gigartina STACKHOUSE (inkl. Mammillaria STACKHOUSE [Mastocarpus KÜTZING], inkl. Chondrodictyon KÜTZING, inkl. Chondroclonium KÜTZING [Chondracanthus KÜTZING], inkl. Sarcothalia KÜTZING) liegen die ebenfalls durch Poren sich öffnenden Cystocarpien in kleinen, zitzenartig über den Thallus hervortretenden Fruchtzweigchen (Fig. 99). Der Fruchtkern ist hier von einer Faserhülle umgeben.
[S. 286]
Bei Chondrus (STACKHOUSE) J. AGARDH sind die Cystocarpien oval, meist einseitig schwach vorspringend, über die Hauptsprosse des Thallus verteilt.
Lit. Chondrus crispus STACKHOUSE apud LEMOUROUX in Ann. Mus. XX, 126. — LYNGBYE Hydr. dan. p. 15, Tab. 5, A. B. — J. G. AGARDH Florid. 246 und Alg. med. p. 104. — SCHMITZ Sitzungsber. d. Berl. Akad. 1883, 223. — SCHMITZ und HAUPTFLEISCH in Engler-Prantl Nat. Pflanzenf. I (2), 356 u. 357 (dort die übrige botanische Literatur). — BERG-SCHMIDT, Atlas S. 75 t. 162 (dort die systematische Literatur).
Abbild. MORISON, Plant. hist. univers. Oxoniae (1699), III tab. 11 (Erste Abbild. von Chondr. crisp.) — BERG-SCHMIDT, Atlas, Taf. 162. — PABST-KÖHLERS Medizinalpflanzen 80. — PLANCHON-COLLIN, Drog. simpl. p. 15. — BENTLEY-TRIMEN, Medic. plants IV, Taf. 305. — RABENHORST, Cryptogamenflora. — LYNGBYE a. a. O.
Vorkommen. Die Carrageenpflanzen sind Meeresalgen, die an den Westküsten des Atlantischen Ozeans von Norwegen (Nordkap) bis Spanien, besonders reichlich bei Irland, aber auch bei den Azoren vorkommen und an der nordamerikanischen Küste sich überall dort finden, wo die Küstenkonfiguration Westküsten erzeugt (Kap Cod Bay). Chondrus crispus fehlt im Mittelmeer und der Ostsee.
Pathologie. Auf marinen Algen sind parasitische Pilze im allgemeinen selten, doch sind solche auch auf Chondrus crispus beobachtet worden. Unter denselben ist besonders der Pyrenomycet Leptosphaeria Chondri ROSENVINGE (L. marina ROSTR. non ELL. ET EV.) zu nennen, der seine Perithecien, vermischt mit Phoma-Conidien, auf den Tetrasporangiensori und Cystocarpien bildet (s. L. ROSENVINGE in Botanisk Tidsskrift Bd. XXVII 1906 p. 33 ff.) Außerdem wird von JONES eine Sphaerella Chondri beschrieben (Ed. Fischer). Über die Überzüge von Flustra vergl. unten unter Beimengungen.
Einsammlung. Gesammelt wird das europäische Carrageen im Norden und Nordwesten Irlands, gelangt nach Sligo und von dort nach Liverpool. Ferner in neuerer Zeit in der Bretagne zwischen Plougreseant und Perros-Guirec im Tréguier. Über Port Blanc gelangt das Produkt nach Hamburg. Die französische Regierung hat 1890 Maßregeln ergriffen, dem unsinnigen Ausreißen des Knorpeltangs Einhalt zu tun. Das amerikanische, meist vortreffliche Carrageen bildet die Hauptmenge des Handels. Es besteht fast nur aus Chondrus crispus. Es wird in Plymouth (Massachusetts) bei Scituate und Cohasset an der Cape Cod Bay gesammelt. Das Geschäft betreiben dorthin eingewanderte Irländer.
Man sammelt die Alge entweder mit der Hand bei der großen Ebbe vor den Springfluten (die besten Sorten) oder mit einem eisernen Rechen bei den kleinen Ebben (die schlechteren, technischen). Dabei wird der Thallus fast immer von der Haftscheibe abgerissen. Die abgelösten Pflanzen werden dann an der Sonne gebleicht, um den roten Farbstoff zu entfernen, in mit Süßwasser gefüllten Fässern gerollt und nochmals an die Sonne gebracht (MELZAR, BATES), wohl auch mit schwefliger Säure nachgebleicht (GUÉGUEN). Durch diese Behandlung wird die schön rote schlüpfrige Alge gelblich weiß und knorpelig hart. Die Haupternte, die den Preisgang bis zum Frühjahr reguliert, beginnt Mitte September.
KRÄMER berichtete (1899) über die Einsammlung in Amerika. Die Ufer der Bucht von Scituate, die etwa 10000 Pfd. Carrageen p. a. exportiert, fallen allmählich gegen die brakige Marsch ab. Dort wird das Carrageen von Ende Mai bis September gesammelt, am meisten im Juni und Juli. Die Sammler und Sammlerinnen arbeiten oft mit den an langen Stangen befestigten schweren eisernen Rechen von 4 Uhr morgens bis 8 Uhr abends. Die Segler gehen mit der Halb-Ebbe hinaus und kommen mit der Halb-Flut zurück. Ein Sammler kann 50 Pfd. pro Tag sammeln. Das frische[S. 287] Carrageen wird in zwei Fuß im Durchmesser haltende hölzerne Tröge (boxes) geschüttet, dann ausgebreitet und eine Woche der Luft und Sonne ausgesetzt. Dann ist es schon hellpurpurgelb. Nun wird es in halbe «hogsheads» (Fässer von 50–70 Gallonen) getan und mit Segeltuch zugedeckt. Diese Fässer werden an klaren Tagen zu den brakigen Marschen gerollt. Sie werden dann mit Wasser gefüllt, die Leinwand wieder darüber getan und das Ganze wieder hinaufgerollt. Dann wird das Carrageen wieder ausgebreitet und unter öfterem Umwenden weiter gebleicht. Schließlich wird es in Fässern oder Ballen verpackt.
Lit. MELZAR, Proc. am. pharm. assoc. 1860, p. 165. — BATES, Gathering and curing of carag. in Massachusetts, Amer. journ. ph. 1868, p. 417, Ph. Journ. XI (1869) 298 und VIII (1878) 304. — KRÄMER, Am. journ. pharm. 1899, p. 481, Pharm. journ. 1899 Nr. 1527. — GUÉGUEN, Le carag., ses emplois pharm. et industr. et sa recolte en Bretagne. Bull. sc. pharmac. X (1904) p. 225.
Handelssorten, Handelswege, Verpackung. Der Handel unterscheidet C. naturale — depuratum — electum albissimum. Nur das letztere ist für Heilzwecke brauchbar. Der Großhandel bezeichnet: elect (1⁄1 und 3⁄4) — fein A — fein B — fein C — 0000 — 000 — 00 — ff. naturell 0 — fein nat. 1 — gut. (Grossmann) Haupteinfuhrhafen und Handelsplatz für Carrageen ist Hamburg. Carrageen kommt meist in gepreßten Ballen zu 50 und 100 kg in den Handel. Es wird im Großhandel meist als Lichen (!) Carragheen bezeichnet, von allen Bezeichnungen die unrichtigste, denn es ist doch keine Flechte, ebensowenig wie ein Moos.
Chondrus crispus. A. Querschnitt durch ein Cystokarpium, schwach vergrößert. B. Ein Stück stärker vergrößert. r Rindenschicht, m Markschicht, s Sporen.
[Nach Luerssen.]
Morphologie der Droge. Chondrus crispus besitzt einen kurzen, fast zylindrischen Stiel und einen kleinen, höchstens handgroßen, 4–15 cm hohen, fleischigen, knorpeligen (daher Chondrus, s. oben Etym.), flachen, gallertartigen, laubartigen, am Rande etwas wellig krausen, wiederholt gabelig, in breitere und schmälere Lappen dichotom zerteilten, nach oben fein zerschlitzten, an der Spitze gestutzten, ausgerandeten, bei der Droge gelblichen, hornartig durchscheinenden Thallus. Die Gestalt und die Zahl der Lappen ist sehr variabel (s. oben). Dieselben sind entweder schmal, linealisch, gespreizt mit den äußersten Ästen durcheinander geschoben, am Ende abgerundet, gestutzt oder seicht ausgerandet (so der Typus) oder sie sind stark verbreitert, bedecken einander zum Teil, sind an den Rändern wellig gekräuselt oder unregelmäßig gelappt. Der Thallus ist am Grunde mit einer kleinen, am Gestein fest haftenden Scheibe (Haftscheibe) versehen, die jedoch, da die Droge beim Einsammeln von dem Boden abgerissen wird, derselben so gut wie immer fehlt. Eine Haftscheibe trägt oft mehrere Sprosse. Der laubartigen Form des Thallus verdankt die Pflanze die[S. 288] Bezeichnung Moos (s. oben Etym.). Bei weitem nicht alle Exemplare der Droge enthalten Fortpflanzungsorgane. Die Cystokarpien (Sporenfrüchte) sind in Form von oval-halbkugeligen, aus der Ebene des Thallus nur wenig buckelig hervorragenden, flach warzenförmigen Erhebungen an der Thallusoberseite sichtbar (Fig. 98). Unterseits entsprechen ihnen (besonders an der trockenen Droge) oft flache Vertiefungen. Sie enthalten zahlreiche Karposporen (Fig. 98). Die Tetrasporen finden sich im Thallus zerstreut in kleine, die Thallusfläche schwach vorwölbende Häufchen vereinigt. Sie sind an der Droge sehr viel seltener zu finden als die Cystokarpien.
Der gallertig-fleischige, verschieden verzweigte Thallus von Gigartina mamillosa ist nicht flach, sondern durch Aufwärtsbiegen der Ränder rinnenförmig (nur selten ist auch hier der Thallus flach riemenförmig). Die Abschnitte sind schmäler. Die meist in großer Anzahl vorhandenen Cystokarpien sitzen in kurzen, umgekehrt eiförmig-ellipsoidischen, papillösen (daher mamillosus = zitzenförmig) und kurz gestielten Exkreszenzen der Thallusoberfläche (Fig. 99). In der Droge erscheinen diese «Fruchtzweigchen» oft etwas umgebogen und gleichen Dornen (Fig. 97). Den häutigen Haftscheiben entspringen mehrere bis 20 cm hohe Sprosse. Im Habitus ist Gigartina dem Chondrus ähnlich und wie dieser in der Zerteilung des Laubes variierend.
Die Farbe dieser Florideen ist im frischen Zustande prächtig rot und wird erst durch den Bleichprozeß (s. oben) in die charakteristische gelbliche Farbe übergeführt, doch zeigen hier und da besonders die Spitzen des Laubes und die Tetrasporenhäufchen auch in der trockenen Droge noch eine schön rote Farbe. Die Farbe der trockenen Droge ist weiß oder gelblich oder gelblich weiß.
Gigartina mamillosa. Längsschnitt durch einen Thalluslappen mit einem Cystokarpium.
[Nach Luerssen.]
Die trockene Droge ist fast geruchlos. Mit kaltem Wasser angequollen (wobei Carrageen seine ursprüngliche Gestalt wieder annimmt), entwickelt es den charakteristischen sogenannten Seegeruch, der Geschmack ist schleimig fade, besonders bei den schlechteren Sorten etwas salzig. Kocht man es mit dem 30fachen Gewicht Wasser, so erhält man einen beim Erkalten erstarrenden, gallertigen Schleim.
Anatomie. Der Thallus des Carrageen besteht aus zwei Schichten, der zentralen Markschicht und der beiderseits dieser aufliegenden Rindenschicht. «Von einem mittleren Strange dünner, längsverlaufender, hier und da gegabelter Markfäden (Leitungsgewebe) zweigen auswärts zahlreiche, wiederholt gegabelte Rindenfäden ab, die einwärts etwas lockerer, aber doch ziemlich dicht geordnet, auswärts dicht seitlich zusammenschließen zur Bildung einer kleinzelligen, antiklinreihigen Außenrinde» (Assimilationsgewebe). Die Vegetationsspitze zeigt eine fächerförmig strahlende Faserstruktur.
Die sich leicht von der Markschicht ablösende Rindenschicht besteht aus 4–5 Reihen außen sehr englumiger, nach innen zu allmählich weiter werdender kleiner rundlicher Zellen (Rindenfäden). Die äußerste, sehr enge Zone ist von einem in Schwefelsäure unlöslichen Häutchen das in seinem Verhalten etwas von der Cuticula der höheren Pflanzen abweicht (TUNMANN), sowie bisweilen von ausgetretenen Schleimmassen bedeckt. Die Zellen der Rindenschicht stehen bisweilen, wie Behandeln des Schnittes mit Jodschwefelsäure lehrt, durch zarte Plasmafäden in offener Kommunikation miteinander, aber nur[S. 289] in radialer Richtung. Bisweilen sitzen auf einer weiten Zelle an der Grenze von Rinde und Markschicht zwei, auf jeder dieser wiederum zwei Zellen und so fort, so daß baumartige Bildungen entstehen, deren Elemente untereinander kommunizieren. Der Inhalt der Rindenzellen wird durch Jodwasser und Osmiumsäure nicht verändert, Jodjodkali färbt stark gelb, Millons Reagens rötlich. Er enthält hauptsächlich die Reste der Chromatophoren neben Amylodextrin. Die Lumina der Rindenzellen sind rundlich oder oval. Je weiter nach innen zu, um so weiter werden die Zellen, um so unregelmäßiger ihr Lumen und um so reichlicher das Amylodextrin im Inhalt. In der breiten Markschicht ist das Lumen selten rundlich, meist oval, schlauchartig gestreckt. Durch schmale geschlossene Tüpfel, neben denen die Membran derber ist, stehen die Lumina benachbarter Zellen miteinander in Verbindung (Siebhyphen WILLE). Bisweilen schien es mir, als ob die dünne Tüpfelmembran mittelst sehr feiner Kanälchen durchbrochen sei, so daß also auch hier eine offene Kommunikation hergestellt sein würde. (Also Makroporen mit Mikroporen, WILLE.) Die großen Markschichtzellen (Markfäden) besitzen wie die 5–10mal kleineren Rindenzellen eine das Lumen auskleidende, nicht sehr dicke sekundäre, aus mehreren z. T. amyloidischen (TUNMANN) Lamellen bestehende Membranverdickungsschicht und eine außerordentlich breite, durchweg verschleimte Interzellularsubstanz (Kollode). Die letztere löst sich schon in kaltem Wasser leicht. Sie liefert in allererster Linie den Carrageenschleim. Die das Lumen umgebende, bisweilen, besonders in der Nähe der Tüpfel, Schichtung zeigende Innenhaut löst sich wenig oder gar nicht, sie besteht aus einer eigenartigen Cellulose, wird durch Jodschwefelsäure blau, durch Chlorzinkjod zunächst hellblau, dann dunkelblau, durch Jodjodkali, nach längerem Liegen, blau — was alles bei der verschleimten Interzellularsubstanz nicht der Fall ist, die auch auf Chlorzinkjod nicht reagiert und auch Farbstoffe wenig aufnimmt, doch färbt sie sich mit den sog. Pectinfärbemitteln: Methylenblau, Naphtylenblau und Bismarckbraun (TUNMANN). Nach WISSELINGH wird die verschleimte Interzellularsubstanz durch Glyzerin bei 300° zerstört. Rutheniumrot färbt alle Membranteile rot. Der aus zahlreichen kleinen rundlichen oder ovalen Körnchen bestehende Inhalt der Markzellen färbt sich mit Chlorzinkjod rotviolett, mit Jod violett bis rotbraun. Erwärmt man einen mit Jod gefärbten Schnitt, so verkleistern die Körnchen und in der Zelle liegt ein rotvioletter Ballen. Der Inhalt der Zellen der Markschicht verhält sich also wie Amylodextrinstärke (vergl. oben S. 199). Ich habe sie denn auch bereits 1888 als solche bezeichnet. Gewöhnlich wird sie Florideenstärke genannt. Werden dünne Schnitte im geschlossenen Rohr einen Tag lang mit alkoholischer Kalilauge erwärmt und nach dem Abwaschen einige Stunden in Jodjodkali gelegt, so färbt sich der Inhalt der Zellen, nicht die Wand, blau (FLÜCKIGER). Die Markschicht macht die Hauptmasse der Droge aus. Ihre Zellen sind in Größe und Form sehr unregelmäßig. In der Nähe des Fruchtkerns der Cystokarpien, die man ziemlich häufig an der Droge antrifft, sind sie kurz. Der Fruchtkern (s. oben) des Cystokarpiums bildet bei der Droge meist ein unregelmäßiges Flechtwerk geschrumpfter Stränge, dessen Lücken zahlreiche, zusammengehäufte, an Amylodextrin reiche Sporen eingelagert sind. Dieser dem Thallus eingesenkte Fruchtkern ist bei Chondrus nicht von einer besonderen Faserhülle umgeben. Die Sporen der Cystokarpien sind rundlich, oval, birnförmig oder unregelmäßig und bilden Häufchen, die oft zu mehreren vereinigt in der Markschicht liegen und eine oft beiderseitige flache Hervorwölbung der Rindenschicht erzeugen, so daß die Cystokarpien durch runde Warzen auf der Thallusoberfläche sich bemerkbar machen. Die Sporen bilden die Endglieder[S. 290] kurzer, oft mehrmals gabelig verzweigter Zellreihen. Bei Gigartina liegen die Cystokarpien in dornartigen Ausstülpungen des Thallus (s. oben).
Um die anatomischen Verhältnisse zu studieren, präpariert man am besten in Alkohol und läßt allmählich verdünntes Glyzerin zufließen. Durch Wasser quillt der trockene Querschnitt auf die doppelte Breite.
Lit. VOGL, Komment. z. österr. Pharmak. VIII. 1908. — TSCHIRCH, Angew. Anat. S. 100. — BERG, Anat. Atl. t. II. — SCHMITZ-HAUPTFLEISCH in Engler-Prantl, Pflanzenfam. I, 2. — Für die Florideenstärke: NÄGELI, Stärkekörner, S. 533. — VAN TIEGHEM, Compt. rend. 61, p. 804. — SCHMITZ, Chromatophoren, S. 151. — SCHIMPER, Pringsh. Jahrb. XVI, S. 199. — N. WILLE, Bidrag til algernes physiologiske anatomi. Svensk. Vetensk. Akad. Handling. 1885. — HANSEN, Mitth. zool. Stat. Neapel XI. — BRUNS, Flora 1894, Ergänzb. S. 173. — KOLKWITZ, Ber. d. Bot. Ges. XVII, S. 247, Zeitschr. wiss. Mikrosk. XVII, S. 263. — TUNMANN: Anatomie und Inhaltsstoffe von Chondrus crisp. Apoth. Zeit. 1909, Nr. 17. — Erste Abbild.: OUDEMANS Atlas 1854.
Chemie. Carrageen enthält meist c. 1% Stickstoff (= 6,3% Proteïnsubstanzen), bisweilen auch mehr (bis 9,4% Proteïnsubstanzen, CHURCH). Andere Meeresalgen enthalten 1–1,8% N (MARCHAND). Mit zwanzig Teilen Wasser gekocht liefert Carrageen beim Erkalten eine Gallerte, die durch Jod nicht blau wird (Unterschied von Isländischmoosgallerte) und sich nicht in Cuoxam. löst. Carrageenschleim wird durch Ammoniumsulfat, Ammonphosphat und Kaliumacetat gefällt (POHL). Mit 50 Teilen Wasser gekocht erhält man eine Lösung, aus der Alkohol den Schleim (Carrageenin PEREIRA, Caragin BERZELIUS, Goëmin BLONDEAU — Goëmon ist der nordfranzösische Name der Alge — Gelin) in Fäden fällt, die hornartig eintrocknen, c. 0,8% Stickstoff und bis 16% Mineralsubstanzen enthalten, sich nicht in Kupferoxydammon lösen und durch metallisches Jod sich rötlich färben. Dieser Schleim liefert mit schwacher Salpetersäure Weinsäure, Oxalsäure und Zuckersäure, mit starker 14 bis 23% Schleimsäure (FLÜCKIGER, OBERMEIER, SEBOR). Er gleicht dem Pararabin REICHARDTS. Durch Kochen mit Schwefelsäure entsteht neben Ameisensäure Lävulinsäure (BENTE). SCHMIDT erhielt bereits 1844 hierbei auch Zucker. Bei der Hydrolyse lieferte Carrageen Mannit, Hydroxylmethylfurfurol und d-Galaktose, sowie auch Fruktose und Glukose. Carrageen enthält also außer Methylpentosen- und Glukosegruppen ein Galaktan, Fruktosan und wenig Pentosan (MUTHER und TOLLENS). SEBOR erhielt bei der Hydrolyse ebenfalls Galaktose, dann d-Glukose, Fruktose und Arabinose. Die gefundene Menge Schleimsäure (23,4%) entspricht 29,6% Galaktose (TOLLENS berechnet 20–28%), die mit Salzsäure erhaltene Menge Furfurol (1,2%) entspricht 2,5% Pentosen. SEBOR hält den Schleim für eine sehr komplizierte, wohl aus Galaktan, Glukosan und Fruktosan bestehende Kohlenhydratkombination von hohem Molekulargewicht, in dem auch ein d-Galakto-Xylan steckt. Der Stickstoff, den schon BLONDEAU im Schleime fand — er fand 2% (FLÜCKIGER und OBERMEIER 1%) neben 2,5% Schwefel — und der sehr schwer aus ihm zu entfernen ist, ist natürlich auf eine Verunreinigung mit Eiweißsubstanzen zurückzuführen. Der reine Schleim entspricht der Formel C6H10O5 (C. SCHMIDT). GIRAUD fand nur Spuren N darin. Auch die Mineralsubstanzen sind schwer aus dem Schleim zu entfernen. Selbst nach 20–30 maligem Fällen sind noch beträchtliche Mengen darin (MORIN). Die Menge des Schleimes beträgt c. 80% (nach CHURCH 55,5%, HERBERGER 79,1%). Er ist ausschließlich Membranschleim (Kollode). Zucker fehlt im Carrageen (GUIBOURT).
Durch Destillation des Carrageen mit Schwefelsäure und Wasser erhält man im Destillat Fukusol, ein Gemenge von Furfurol und Methylfurfurol (s. bei Laminaria).[S. 291] C. enthält etwas Fett, aber keine Stärke, wohl aber einen mit Jod rotbraun sich färbenden Inhaltskörper der Zellen, der mit dem Amylodextrin verwandt oder damit identisch ist (s. oben).
C. enthält etwas Jod (STEINBERG (1842), SARPATI, GROSSE, EBERS), das sich schon in der Asche von 10 g leicht nachweisen läßt (FLÜCKIGER, VAN ITALLIE, vergl. auch unter Laminaria), und Brom (DUPASQUIER 1843, GROSSE) in Form von Jodiden und Bromiden des Na, Ca und Mg, aber wohl auch (oder nur?) organisch gebunden. TUNMANN gelang es in 0,5–1,0 Carrageen Jod auf mikrochemischem Wege nachzuweisen. Die Asche beträgt 9,5–18% (14,15% CHURCH, 15,9% JOLLES). Sie ist reich an Sulfaten, z. B. Natrium- und Calciumsulfat und Chloriden. CZAPEK gibt 20,61% Reinasche an und darin 17,32% K, 18,73 Na, 7,16 Ca, 11,35 Mg, 2,21 Phosphorsäure, 41,24 SO3, 3,79 Cl. Nach meinen Erfahrungen, die mit denen von CAESAR und LORETZ und HAUKE übereinstimmen, kann man 18% Asche (als Maximum) verlangen. HAUKE fand 15,32 bis 17,7%. CHURCH fand, daß käufliches Carrageen mehr Schwefel enthält als dessen Asche.
Der Farbstoff ist in der Droge meist vollständig oder nahezu vollständig durch Bleichen zerstört. Er ist in Chromatophoren enthalten und ein Mischfarbstoff. Dieser Mischfarbstoff, den COHN (1867) Rhodophyll nannte, besteht aus einem roten Farbstoff, der von KÜTZING (1843) als Phycoërythrin bezeichnet wurde, und der schon beim Übertragen der Pflanze in Süßwasser in dieses diffundiert, einem gelben, dem Carotin ähnlichen Farbstoff (HANSEN) und Chlorophyll. Das Phycoërythrin hat im Spektrum 4 Bänder: 590–620, 550 bis 570, 520–540, 485 bis 585 (SCHÜTT). Das Phycoërythrin, das MOLISCH in hexagonalen Kristallen erhielt, scheint ein gefärbtes Protein oder eine Eiweißverbindung ähnlich dem Hämoglobin zu sein.
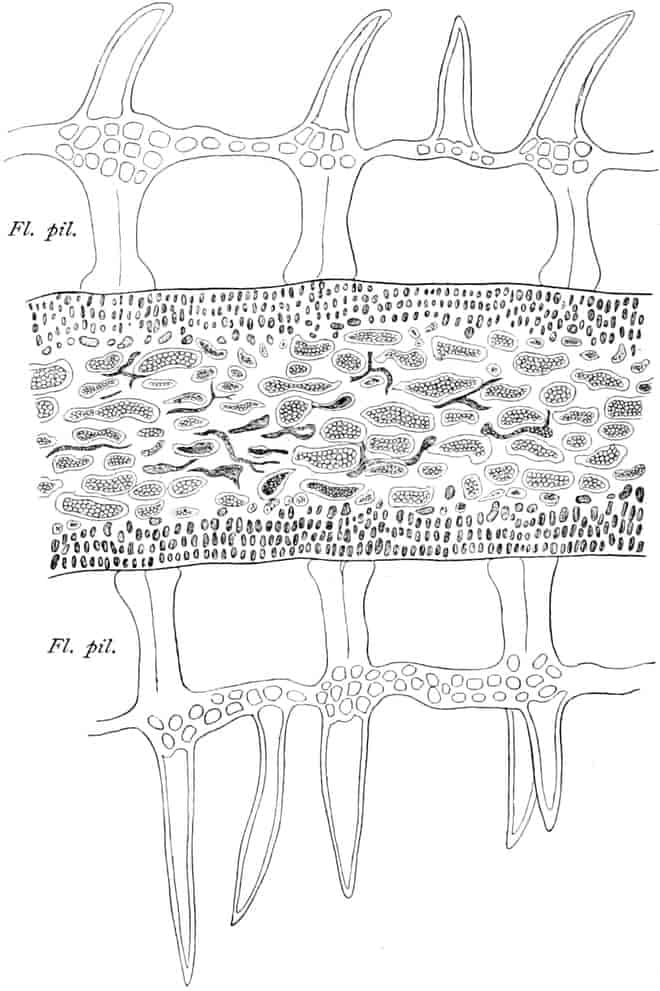
Thallus von Chondrus crispus mit Flustra pilosa (Fl. pil.) besetzt.
[Tunmann gez.]
Lit. Die ersten Analysen sind von HERBERGER (BUCHNER’S Rep. 49, 134 auch in WIGGERS[S. 292] Pharmakognosie 1840 und in PEREIRA Heilmittellehre) und FEUCHTWANGEN (Amer. journ. of sc. and arts XXVI). — DIERBACH, Die neust. Entdeck. 1837 und Mat. med. 1841. — BLONDEAU, Journ. ph. 1865, II, 159. — ROCHLEDER, Chem. u. Phys. d. Pflanz. — C. SCHMIDT, Ph. Jahresb. 1844. LIEB. Ann 51, S. 29. — STEINBERG, Journ. p. Chem. 25, 379. — DUPASQUIER, Journ. pharm. chim. méd. 1843, 113. — GROSSE, Pharm. Zentralbl. 1839, S. 125. — CHURCH, Journ. of Botany 1876 und Proc. Amer. pharm. assoc. 25, (1877), 177. — MARCHAND, Ann. chim. phys. VIII (1866), p. 320. — GIRAUD, Etude compar. des gommes et mucilag. Thèse Paris 1875. — GUIBOURT, Journ. chim. méd. VIII, 663. — TOLLENS, Kohlenhydrate. — BENTE, Ber. chem. Ges. 8, 417, 9, (1876), 1158. — PEREIRA, Heilmittellehre. — SEBOR, Österr. Chem. Zeit. 3 (1900), 441 und Zeitschr. f. Zuckerindustrie in Böhmen 25, 94. — HÄDECKE, Über die aus C. entstehenden Zuckerarten, Diss. Göttingen 1887. — HÄDECKE, BAUER und TOLLENS, LIEB. Ann. 238, (1887), 302. HÄDECKE, Diss. Göttingen. — MUTHER und TOLLENS, Ber. d. chem. Ges. 1904, 298. — HANSEN, Journ. pharm. 1896, 3, p. 462, Ann. agronom. 1896. — WHEELER and STANFORD, Pharm. Journ. XII, p. 642. — STANFORD, ibid. XII, p. 1019 u. XIV, p. 1009. — FLÜCKIGER, Pharmakogn. 3. Aufl. — FLÜCKIGER und OBERMAIER, Schweiz. Wochenschr. 1868, 85. — TSCHIRCH, Artikel Carrageen in Realenzyklopädie. — Rhodophyll siehe CZAPEK, Biochemie I, und MOLISCH, Bot. Zeit. 52 (1894) 177. — Mikrochem. Jodnachweis: TUNMANN Pharm. Centralh. 1907, 506. VAN ITALLIE, Arch. Ph. 1889, 1132. Ned. Tijdschr. 1889. Pharm. Zentralh. 1901.
Geruch und Geschmack. Der Geruch der Droge ist tangartig, der Geschmack fade-schleimig, schwach salzig.
Beimengungen. In gutem Carrageen findet man fremde Algen nur in sehr geringer Menge, da die Droge von diesen, sowie von Schnecken, Korallen, Muscheln und Steinchen durch Auslesen befreit wird. Einige Exemplare der Droge zeigen weiße oder grauweiße Überzüge von Flustra pilosa (Fig. 100), einer kleinen Bryozoë oder weißliche körnige Calciumkarbonatreste einer Blätterkoralle. «Reichlich mit Polypen besetztes C. ist zu verwerfen» (Pharm. helvet. IV.) In schlechter Droge finden sich bisweilen: Ceramium rubrum AG., Fucus canaliculatus, Furcellaria fastigiata LAM. (Fucus fastigiatus HUDS.), Laurencia pinnatifida LAM., Chondria obtusa, Polysiphoniaarten, Hypnea confervoides, Stilophora rhizodes, Sphorochnus rhyodes, Haleseris polypodioïdes, Porphyria laminata, sowie (was ich für zulässig halte): Chondrus canaliculatus GREV., Gigartina acicularis LAMOUR. (mit zylindrischem gabelteiligem Thallus, ist bis zu 40% im französischen Carrageen gefunden worden) und Gigartina pistillata LAMOUR., sowie andere Chondrus- und Gigartinaarten.
Prüfung. Die Prüfung erstreckt sich, da die Droge nur in toto verwendet wird, auf eine Durchmusterung. Bei zweifelhaften Stücken empfiehlt sich Aufweichen in Wasser. Die 1=30 bereitete Gallerte darf durch Jod nicht blau werden.
Mit schwefliger Säure gebleichtes Carrageen — solches ist im Handel — sollte nicht medizinisch verwendet werden. Man prüft darauf in folgender Weise: Wird C. mit 20 Teilen Wasser übergossen und eine Viertelstunde lang mazeriert, so darf die davon abfiltrierte Flüssigkeit blaues Lackmuspapier nicht röten. 20 ccm des Filtrates sollen durch einen Tropfen n/10 Jod gelb gefärbt werden.
Anwendung. Das C. gehört zu den Schleimdrogen, also neben Althaea, Linum, Traganth und Salep. Es rangiert zudem unter die schleimigen Vehikel. Die Ärzte brachten und bringen dem Carrageen wenig Interesse entgegen. Man verwendet es als Nährmittel bei Phthisikern (seit 1831), bei Katarrhen (STOLLWERKS Brustbonbons, Gelatina Carrageen, Pasta cacao carragenata, Saccharolatum carragenat.) und zur Herstellung haltbarer Leberthranemulsionen, dann zum Cataplasma artificiale von LELIÈVRE (Ersatz der unsauberen Leinsamenbreiumschläge). Nur in Irland scheint es seit langem als Heilmittel (bei Schwindsucht, Skrofeln, KOLB) und als geringwertiges[S. 293] Nahrungsmittel, z. B. zum Mästen von Kühen und Kälbern, benutzt worden zu sein. Die größte Menge, besonders des amerikanischen Carrageens, wird technisch verwendet und bildet ein wichtiges Ersatzmittel des Gummis in der Zeugdruckerei, der Appretur, der Papierfabrikation, der Textilindustrie (LABOULAYE) und wird auch bei Herstellung der Stroh- und Filzhüte, sowie zum Klären (Schönen) von Bier und Honig benutzt. In der Kosmetik bedient man sich seiner zum Befestigen der Haare (Bandoline). Neuerdings benutzt man es auch zur Herstellung von Nährböden für bakteriologische Zwecke (MIQUEL). Das Kesselsteinmittel Végétaline naturelle enthält auch Carrageen.
Lit. S. BROWN, On the mucilage of the fungi with remarks on its application to economical ends. New. Edinb. philos. journ. 26 (1839) p. 409. — MÉRAT, Dict. scienc. medic. 1816. Fucus und Suppl. 1846. — TSCHIRCH, in Realenzykl. 2. Aufl. — LABOULAYE, Dict. d. arts et manufact. 1907 Lichen. WOLFFSHEIM, Journ. prakt. Heilk. 1836. — MEYER, De fuco crispo, Dissert. Berlin 1835. — MOUCHON, Journ. de méd. de Lyon 1844. — HAGER, Manuale. — PEREIRA, Heilmittellehre.
Geschichte. Carrageen ist noch nicht lange in Anwendung, in England seit 1831 (durch TODHUNTER in Dublin empfohlen), etwas später in Deutschland (durch GRÄFE aus England gebracht und durch JOBST empfohlen 1837), in Frankreich seit 1846 (empfohlen durch GUIBOURT 1832, BÉRAL 1835). Die Anwendung zur Herstellung von Cataplasmen empfahl LELIÈVRE 1875 (GUÉGUEN). Die Anwendung in der Industrie ist noch jüngeren Datums. Sie kam eigentlich erst auf, als infolge der Sudanaufstände das Gummi knapp zu werden anfing. Nur in Irland dürfte es als Heilmittel schon seit langem im Gebrauch sein (FLÜCKIGER).
Lit. TODHUNTER, Monthl. gaz. of health, Jan. 1831. — PEREIRA, Elem. of mat. med. II (1845) part. I. 9. — DIERBACH, Die neuest. Entd. d. Mat. med. I (1837) 50, II S. 271. — FLÜCKIGER, Pharmak. 3. Aufl. und Pharmakographia. — GUIBOURT, Sur le Carragaheen, Journ. chim. méd. VIII, 1832. — BÉRAL, Ebenda, XI, 1835 u. Bull. gén. de thérap. VIII, 1835.
Paralleldrogen. Als solche können alle Florideen aus der Verwandtschaft von Chondrus und Gigartina betrachtet werden, besonders Gigartina acicularis (s. oben unter Beimengungen), denn alle diese liefern, wenn sie zuvor gebleicht werden, einen farblosen Schleim ähnlicher Eigenschaften. Als Carrageenersatz werden speziell genannt: Gelidium cartilagineum GAILL., Gracilaria compressa GREV., Cyclocladia articulata GREV. und Gloiopeltisarten. Dazu gehören auch die Agar-Agar liefernden Algen (s. d. und DRAGENDORFF, Heilpflanzen).
Stipites Laminariae.
Syn. Alga digitata, Riementang — Laminaire digitée (franz.).
Stammpflanze. Laminaria Clustoni (EDMONSTON) LE JOLIS als besondere Art oder als Varietät von L. digitata (L.) LAMX. (Fucus digitatus L., Hafgygia digitata Ktz.): Laminaria digitata (L.) LAMOUROUX β Clustoni EDMONSTON (— auch Cloustoni oder Cloustonii — geschrieben). Die älteste Bezeichnung (1772), die vielleicht die Priorität verlangt, ist: Laminaria hyperborea GUNNERUS.
COHN zeigte, daß unter Laminaria digitata zwei Arten gehen: L. flexicaulis LE JOLIS und L. Clustoni EDMONSTON, daß aber nur die zweite Stäbchen liefern kann, da der Stipes der erstgenannten zu dünn ist.
Systemat. Stellung. Phaeophyceae (Fucoideae) — Phaeosporeae — Laminariaceae.
Beschreibung der Stammpflanze. Die Laminarien sind große, braune Meeresalgen, deren Thallus in ein vielfach gegabeltes, an den Enden mit Haftscheiben versehenes[S. 294] wurzelartiges Haftorgan — das ursprüngliche Haustorium wird durch sog. Hapteren verdrängt —, einen langen Stil (Stipes) und einen blattartig (daher Laminaria von Lamina = Blatt) ausgebildeten oberen Teil (Laubteil) gegliedert ist. Sie wachsen interkalar, mit lokalisiertem, zwischen Stengel und Blatt liegendem, interkalarem Vegetationspunkt. Das Haftorgan und der Stipes perennieren, das Blatt wird alljährlich regelmäßig erneuert, das alte abgestoßen (Fig. 101). Bei der L. Clustoni tritt die eigentümliche Blattform sehr früh auf. Die einfächerigen Sporangien sind in großen Sporangienständen (Sori) vereinigt, die auf dem Blattkörper zerstreute Flecke bilden (Fig. 101).
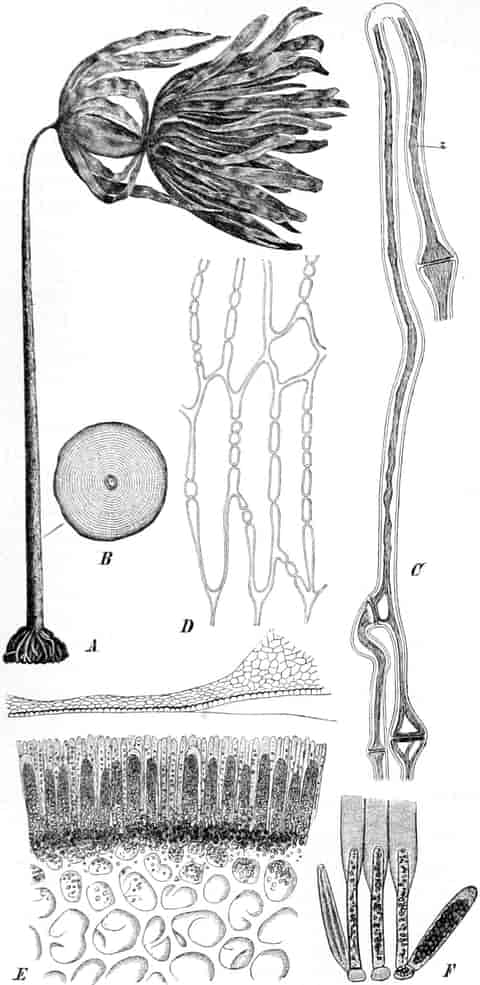
A-C Laminaria Clustoni.
A Habitusbild eines im Blattwechsel begriffenen Exemplars. B Querschnitt durch den Stipes 2 cm oberhalb des Haftorgans. C Siebhyphen des Stammes. D Längsansicht kürzerer Zellen: die Interzellularsubstanz verschleimt.
E-F Lamin. saccharina.
[E Querschnitt durch einen fertilen Blatteil. F Drei Sporangienstände mit einem entleerten und einem vollen Sporangium.
AB nach Foslie, C nach Wille, D nach Luerssen, EF nach Thuret.]
Laminaria Clustoni — FLÜCKIGER will sie als besondere Art, L. hyperborea GUNN., betrachtet wissen — geht weit in die See ins Tiefwasser hinaus. Sie hat oft recht beträchtlich lange, starre, aufrechte, runde, an der Basis sehr verdickte, gegen die Spitze allmählich verdünnte, hellbraune Stipites, die plötzlich in den recht ansehnlichen, bis 70 cm langen, hellbraunen, handförmig (daher digitata) in breite Lappen geteilten, lederigen, kastanienbraunen Laubteil übergehen. Der alte Laubteil wird alljährlich oben abgestoßen, nachdem von unten her ein neuer gebildet worden ist. Man findet die Laminarienstipites nach einer stürmischen Nacht oft in riesigen Massen am Strande. Da sie rasch faulen, verbreiten diese Haufen rasch einen sehr üblen Geruch. Die an den Küsten der Hebriden ausgeworfenen Laminariastipites waren oft 7–8 Fuß lang, an der norwegischen Küste wurden sogar 5 m lange Stipites beobachtet.
[S. 295]
Die nahe verwandte L. flexicaulis LE JOLIS (L. digitata (L.) var. α flexicaulis, L. stenophylla HARVEY, L. digitata var. stenophylla HARV., L. ensifolia KTZ.) hat einen schmalen, in wenig Lappen geteilten Laubteil und einer dünnen, biegsamen, nicht starren, dunkelbraunen, fast schwarzen Stipes. Nach FOSLIE fehlen dieser Art, die ruhigere Standorte und geringere Tiefe vorzieht, im Stipes die Hohlräume und die Schichten, die Blätter erneuern sich nicht so regelmäßig und das Blatt nimmt erst später seine endgültige Form an. Die Auswitterungen bestehen bei dieser Alge aus Mannit.
Lam. Clustoni findet sich in den nordischen Meeren, z. B. bei Nordost-Finmarken, längs der norwegischen Küste, bei Dänemark, in der Nordsee an den Küsten von Deutschland, Nordfrankreich, England, Irland und Schottland, bei Spitzbergen und Grönland. Sie geht weiter in die See hinaus als L. flexicaulis.
Lit. CLOUSTON in ANDERSON, Guide to the highlands and islands of Scotland. London 1834. Append. VI, 721. (CLOUSTON studierte zuerst die Entwicklung.) — FOSLIE s. unten. — LAMOUROUX, Dissert. sur plus. esp. de Fucus. Agen 1805. — HARVEY, Phycologia britannica. London 1846–51, t. 223. — DE TONI, Sylloge algarum omnium hucusque cognitarum. Vol. III Fucoideae. — LE JOLIS, Exam. d. espèc. confond. sous le nom de Laminaria digitata Mém. soc. sc. nat. Cherbourg 2 ed. 1855 u. Nov. act. Ac. Leop. Carol. 1856 (Flora 1855. Jahresb. d. Pharm. 1867, 23). — EDMONSTON, Flora of Shetland. Aberdeen 1845, 54. — AGARDH, Spec., genera et ordin. algarum. Lund 1848. — KÜTZING, Phycol. gener. Lips. 1843. — GRABENDÖRFER, Diss. Straßb. 1885. Bot. Zeit. 1885. — HAAXMANN, Tijdsch. v. wetensch. Pharm. III, 33. — ESPER, Icones Fucorum I, t. 48. — HARTWICH, Laminaria in Realenzyklopädie. — COHN, Arch. Pharm. 179 (1867), 113. — Weitere Lit. bei KJELLMANN in ENGLER-PRANTL, Pflanzenfam.
Abbild.: LUERSSEN, Medic. pharm. Botan. I, 98, Fig. 23. — KARSTEN, Deutsche Flora 275. — PABST-KÖHLER, Medizinalpfl. — KJELLMANN in ENGLER-PRANTL, Pflanzfam. Alle Formen in: FOSLIE, D. Laminar. Norwegens. Christiania. Vidensk. Selsk. Forhandl. 1884. 10 Taf. (Bot. Jahresb. 1884, 379.) — HARVEY a. a. O. — POSTELS u. RUPRECHT, Illustrat. algar. oceani pacifici. Taf. 12. — Anatom. Abb. PLANCHON-COLLIN, Dr. s. p. 13. — Erste Abbildung unter dem Namen Fuco giganteo in FERRANTE IMPERATO, Dell’ historia naturale 1599, Fol. 743.
Pathologie. ROSTRUP (Mykologiske Meddelelser (V). Botanisk Tidsskrift Vol. 19, 1895) beschreibt eine Dothidella Laminariae, welche den Stipes von Laminaria longicruris befällt. Ferner geben COOKE und MASSEE auf Laminaria flexicaulis ein Heterosporium Algarum und auf faulenden Laminarienspreiten ein Phoma Laminariae an; indes bleibt, namentlich im letztgenannten Falle, die Frage offen, ob es sich wirklich um einen Parasiten handelt (ED. FISCHER). Die Polypen und Florideen pflegen die Stipites der Laminaria flexicaulis zu meiden, während sie sich oft in großer Zahl auf denen der L. Clustoni finden. Über die Epiphyten der Laminarien vgl. auch F. TOBLER, Englers Botan. Jahrb. 44 (1909).
Morphologie. Die Droge bildet verschieden lange, von der Seite fast bandartig zusammengedrückte, hornartig harte, derbe Stücke, die glatt brechen und außen grob längsrunzelig sind. Sie sind außen schwarzbraun, innen grauweiß. Der Querschnitt ist länglich oval mit tiefbuchtigem Umriß — beim frischen Stipes kreisrund —, der Durchmesser c. 10 : 6 mm (frisch meist 25–30 mm, aber bis 40 mm). Die Stücke quellen in Wasser auf und sind außen meist mit kleinen roten Florideen (Ceramium, Polysiphonia, Dictyosyphon) und mit Kristallkrusten oder Effloreszenzen besetzt, die vorwiegend aus Natrium-Sulfat und Chlorid bestehen — bei Lam. flexicaulis enthalten die letzteren Mannit. Das Lupenbild läßt eine schmale Rindenschicht, eine breite Mittelschicht und eine dunkele, bisweilen geschwundene Markschicht unterscheiden.
Aus diesen eingetrockneten Stipites, und zwar besonders aus der mittleren Schicht derselben, werden Voll- und Hohlstifte (Laminariastifte, Laminariakegel, Quellmeißel) gedrechselt. Legt man dieselben in Wasser, so schwellen[S. 296] sie langsam auf das vier- bis fünffache ihres Durchmessers an. Die unbearbeiteten Stipites selbst sind nicht in Gebrauch.
Schleimkanal aus der Rindenschicht eines Laminaria-Stipes. C. Meristem.
[Tschirch.]
Anatomie. Ich beschränke mich auf die Anatomie der allein offizinellen Stipites. Der frische Stipes ist 3–4 cm dick. Die Randpartie des Stipes ist engzellig und enthält, da sie das Assimilationsgewebe repräsentiert, reichlich Chromatophoren, die auch in den folgenden Schichten, dort aber in geringerer Zahl auftreten. Der Zellinhalt dieser und der anderen Schichten kann, wie schon WILLE hervorhob, nur an ganz frischen lebenden Exemplaren studiert werden. Er ist äußerst empfindlich. An frischen Exemplaren — mir lagen solche aus Helgoland vor — findet man gut wahrnehmbare (bisweilen auch noch am trockenen Stipes deutliche) rundliche oder gelappte braungrüne Chromatophoren, deren brauner Farbstoff leicht in das Wasser diffundiert. Alsdann bleiben die Chromatophoren grün gefärbt zurück. In der nächstfolgenden Schicht liegt eine Reihe von Schleimhöhlen. Dieselben entstehen in der Weise, daß zunächst an einer zentralen Zellgruppe durch Aufquellen der Interzellularsubstanz (Mittellamelle) ein schmaler, schleimerfüllter, schizogener Gang entsteht. der Gang sich dann erweitert und schließlich die Randzellen thyllenartig in den Gang hineinwachsen (TUNMANN), vgl. Fig. 102. Lysigene Erweiterung, die ich auf Grund analoger Beobachtungen bei Phanerogamen annahm (Angew. Anatomie Fig. 600), scheint nicht vorzukommen oder doch selten zu sein. Ich fand gelegentlich losgelöste Zellen im Innern. Die Schleimhöhlen sind langgestreckte, verschieden breite Kanäle. Sie fehlen ganz jungen Stipites, in der Handelsware sind sie ausnahmslos zu finden, nie in den Stiften. In der Nähe dieser Schleimhöhlenschicht, sowohl außerhalb wie innerhalb derselben, fand ich in den Zellen frischer Stipites der Wandung ansitzende wulstig-traubige, cystolithenartige Körper, die bei näherer Betrachtung sich als Bläschenhaufen erwiesen, bei denen jedes Bläschen eine dünne, wahrscheinlich von Öl oder Plasma gebildete Haut und einen wässrigen Inhalt führt. Tritt gewöhnliches (nicht Meer-) Wasser hinzu, so fließen die zahlreichen Bläschen zu einer großen, mit einer stark lichtbrechenden Flüssigkeit erfüllten Blase zusammen. Schließlich platzt auch diese und man sieht an der Stelle dann nur einige Öltröpfchen liegen. Die Schleimhöhlenschicht besitzt eine braungrüne Farbe, das ganze Innere ist farblos und hebt sich erstere als sog. Rindenschicht auch noch dadurch relativ scharf von dem zentralen Gewebe stark ab, daß innerhalb der Schleimhöhlen ein Meristem zu liegen kommt, welches durch seine cambialen Teilungen das sekundäre Dickenwachstum der Stiele bewirkt. REINKE nennt die außerhalb[S. 297] des Meristems liegende Zone Außenrinde. In der Zone, wo die einen ringsumlaufenden Kranz bildenden Schleimhöhlen liegen, reißt das Gewebe leicht, so daß sich oft die ganze braune Rindenschicht als Röhre ablöst.
Die Zellen der mittleren, an das sog. Cambium nach Innen zu angrenzenden Partie sind rundlich eckig, in der Organsachse gestreckt und lassen sich von der Initialzelle aus oft auf weite Strecken in radialen Reihen verfolgen. Die Zellen der äußeren Reihen sind kurz, an den Enden stumpf oder spitz oder mit querverlaufender Wand. Nach innen zu werden sie immer länger und spitzer. An der radialen Längswand sind große Tüpfel häufig (Fig. 101, D). Die zwischen der Zuwachszone und dem «Mark» liegende Partie (REINKES Innenrinde), die oft die Hauptmasse des Stipites ausmacht, zeigt häufig konzentrische Zonen engerer Zellen, wodurch ein Querschnittsbild ähnlich den Jahresringen eines Coniferenstammes entsteht (Fig. 101 B). Nicht selten kann man 8–20 solcher «Jahresringe» zählen. Einige Autoren halten sie auch für echte Jahresringe. Es sind aber wohl nicht echte Jahreszuwachszonen, sondern nur abwechselnde Schichten mechanischen und Speicher-Gewebes. Wie N. WILLE 1885 gezeigt hat, besitzen auch die höheren Algen ein Assimilations-, ein Speicher-, ein Leitungs- und ein mechanisches Gewebe. Das Assimilationssystem befindet sich bei Laminaria vornehmlich in den blattartig ausgebreiteten Thalluslappen und in der Randschicht der Stipites, das Leitungssystem auch im Stipes und das mechanische und Speichersystem vorwiegend in diesem.
Querschnitt durch einen aufgequollenen Laminaria-Stipes. m Markschicht.
[Luerssen]
Gegen das Zentrum des Stipes hin geht das Gewebe ziemlich unvermittelt in ein krauses Durcheinander fädiger, hyphenartiger Zellen über. Diese Schicht ist die sog. Markschicht Fig. 103, m). In ihr liegen die leitenden Organe, die Siebhyphen (Fig. 101, C). Die von H. WILL zuerst bei Macrocystis beobachteten Siebhyphen (Siebröhren) fand N. WILLE auch bei Laminarien. Hier sind die Enden der relativ englumigen Röhrenglieder, ähnlich wie bei den Siebröhren der höheren Pflanzen, angeschwollen. Die Querwände sind fein perforiert, der Inhalt plasmareich. Die längsverlaufenden Siebröhren stehen durch zahlreiche Queranastomosen in Verbindung. Das Siebröhrensystem[S. 298] des Stammes setzt sich auch in die Gewebelamelle zwischen den beiden assimilierenden Schichten der Blätter fort.
Besonders in der Mittel- und Markschicht sind die Membranen stark verschleimt und zwar ist es fast ausschließlich die Mittellamelle (Interzellularsubstanz), welche den Schleim liefert. Dieselbe schwillt oft bis zu einer erheblichen Dicke an, während die sekundären Membranverdickungsschichten stets dünn bleiben oder nur schwach quellen. Doch sei bemerkt, daß die schleimige Interzellularsubstanz als solche von vornherein angelegt wird und nicht etwa nachträglich aus einer Zellulosemembran umgebildet wird. Durch Einlegen in Kupferacetat läßt sich der Schleim härten (TUNMANN). Die Schleimmembran ist eine besondere chemische und morphologische Form der Membran vom Charakter der (schleimartigen) Hemizellulosen. Die breite Interzellularsubstanz gibt mit Jodschwefelsäure keine oder nur sehr schwache Zellulosereaktion, mit HANSTEINS Anilinviolett färbt sie sich nur schwach. Die schmale sekundäre Membran zeigt starke Zellulosereaktion und färbt sich auch mit HANSTEINS Anilinviolett intensiv. Besonders tritt Bläuung mit Jodschwefelsäure dann auf, wenn die Schnitte vorher mit verd. Kali behandelt werden. Die Wandungen nehmen erst beim Trocknen braune Farbe an (WILLE).
Die starke Quellung der Lamarienstiele ist auf die Quellung der verschleimten Zwischenzellsubstanz zurückzuführen. Er ist also eine Schleimmembranquellung. Die Schleimhöhlen der Rindenschicht haben gar nichts damit zu tun, übrigens schon deshalb nicht, da diese sich niemals in den gedrechselten Stielen, die nur aus den inneren Schichten hergestellt werden, findet. In den Zellen von lebendem Material fand TUNMANN Zucker. Die kleinen mit Osmiumsäure sich bräunenden Bläschen reagierten auch mit Vanillinsalzsäure, Jod- und Eisensalzen (TUNMANN). Kristallbildungen fehlen, doch erhielt TUNMANN durch Einlegen frischer Stiele in Alkohol Calciumoxalatkristalle. Er nimmt an, daß die Zellen des Markes gelöstes oxalsaures Natrium enthalten, das sich mit dem Kalk zu Calciumoxalat umsetzt. Florideenstärke (Amylodextrin) ließ sich mikrochemisch nicht nachweisen. Die eigenartigen Körnchen, die man besonders in dem Speichergewebe antrifft, scheinen Eiweißcharakter zu besitzen, jedenfalls kein Kohlenhydrat zu sein und einen gerbstoffartigen Körper einzuschließen (TUNMANN). Diese Körnchen, die HANSTEEN Fucosan, SCHIMPER Phaeophyceenstärke, CRATO, der sie für amöboid bewegliche, plasmatische Bildungen erklärt, Physode nannte, zeigen nämlich auch Phenolreaktionen, besonders mit Vanillinsalzsäure (CRATO, BRUNS). Der Ausdruck Phaeophyceenstärke ist also jedenfalls verfehlt und irreführend.

Querschnitt durch einen eingetrockneten Laminaria-Stipes.
[Luerssen.]
An den Stipites der ähnlich gebauten Alaria esculenta (L.) GREV. kann man nach WILLE vier Zonen unterscheiden. Die äußerste Zone ist das Assimilationsgewebe, in dem sich die Chromatophoren finden und das zugleich als Bildungsgewebe fungiert, sich auch, wenn abgestoßen, leicht wieder regeneriert. Dann folgt die Hauptmasse, die zugleich mechanischen, Leitungs- und Speicher-Zwecken dient und die wenige Chromatophoren, aber viel Reservestoffe (Fucosankörner) enthält. Dann folgt die Schicht der Verbindungshyphen und das Zentrum ist wieder mechanisches Gewebe. Gestreckte (den Siebröhren der höheren Pflanzen entsprechende) Siebhyphen — bisweilen mit Callus auf der Siebplatte — sind (nach WILL und WILLE) besonders im Inneren reichlich vorhanden,[S. 299] ebenso wie die der gleichen Funktion dienenden Verbindungshyphen (true sieve tubes, trumpet hyphae, OLIVER). In den zugleich mechanischen und speichernden Zellen finden sich neben Chromatophoren Fucosankörner. Da die Stipites dieser Alge wegen des zentral gelegenen mechanischen Gewebes viel biegungsfester sind als die Laminariastipites, Alaria esculenta (L.) GREV. zudem in den norwegischen Meeren häufig ist, so dürfte es sich empfehlen, auch aus dieser Alge Stifte zu drehen. (Sie soll übrigens — nach KRÄMER — bereits hierzu benutzt werden.)
Lit. TSCHIRCH, Angew. Anat. und Über d. Entwicklungsgeschichte einiger Sekretbeh. Ber. d. bot. Ges. 1888, S. 5. — GRABENDÖRFER, Beitr. z. Kenntn. d. Tange. Dissert. Straßburg 1885 (auch Botan. Zeit. 1885). — KÜTZING, Phycol. gen. Taf. 31. — RUPRECHT, Bem. über d. Bau u. d. Wachsth. einiger großer Algenstämme u. d. Mittel d. Alter ders. zu bestimmen. Mém. de l’acad. Petersb. 1848. — LUERSSEN, Med. pharm. Bot. I, S. 100–102. — VOGL, Kommentar 1892. — GUIGNARD, Observ. sur l’appar. mucif. des Lamin., Ann. sc. nat. ser. 7, T. 15 (1892). — HANSTEEN, Stud. z. Anat. u. Phys. d. Fucoid. Pringsh. Jahrb. 24 (1892). — CRATO, Ber. d. bot. Ges. 11 (1893) u. bot. Zeit. 1893, 157. — BRUNS, Flora 1894, Ergb. S. 173. — J. REINKE, Atlas der Meeresalgen. 1889–92, Beitr. z. Kenntn. d. Tange. Pringsh. Jahrb. 10 (1875) und Unters. über d. Quellung einiger vegetabil. Subst. HANSTEINS bot. Abh. IV (1879). — WILLE, Siebhyphen bei d. Algen. Ber. d. d. bot. Ges. 1885. Bidrag til Algernes physiolog. Anat. Svensk. Vetensk. Akad. Handl. 1885 u. Beitr. z. phys. Anatom. d. Laminariaceen. Festschr. z. Kön. Oscars Reg. Jubil. 1897. — TUNMANN, Zur Kenntn. d. Laminaria. Pharm. Zentralh. 1907, 241 u. 505. Schweiz. Wochenschr. 1910, 537 (dort die Reaktionen des Fucosans). — KRAEMER, Textbook 1907. — Anatom. Abbild. auch in PLANCHON-COLLIN, Drog. simpl. I, 13.
Chemie. Die Interzellular- oder Bindesubstanz, die so gut wie ausschließlich die quellende Substanz der Stiele repräsentiert, enthält stets Calcium. WILLE und KREFTLING betrachteten sie als Calciumpektinat (FRÉMY) resp. als das Calciumsalz einer Tangsäure, die offenbar nahe Beziehungen zur Pektinsäure GIREAUDS besitzt. Extrahiert man den Kalk aus der Interzellularsubstanz durch Salzsäure, so quillt der Schleim mit verdünnten Alkalien gewaltig und löst sich dann rasch (WILLE), viel rascher als ohne diese Vorbehandlung. Er zeigt nun ausgesprochenen saueren Charakter. A. KREFTLING nimmt daher an, daß die Interzellularsubstanz aus der Kalkverbindung der Tangsäure besteht, die 39% C und 5% H enthält und in Wasser ohne sich zu lösen außerordentlich stark quillt. KREFTLINGS Tangsäure ist N-frei und soll der Formel C13H20O14 entsprechen. Sie bindet 97% Wasser und löst sich nur in Substanzen mit denen sie Verbindungen eingeht. Die Tangsäure lieferte KREFTLING einen reduzierenden Zucker. Auch MANGIN hält die Bindesubstanz der Zellen für einen Pektinkörper. In der Tat bestehen ziemlich viele Beziehungen zu den Pektinsubstanzen der Früchte (TSCHIRCH).
Die Zellwände enthalten Zellulose (WISSELINGH), nach WARRINGTON 9,33%, die Mittellamelle auch einen mit Jod und 1% H2SO4 sich blaufärbenden Körper (Fucin, WISSELINGH). Das beim Erhitzen von Fucus mit Schwefelsäure übergehende Fucusol (STENHOUSE) ist ein Gemisch von Furfurol und Methylfurfurol (MAQUENNE). Die Entstehung dieser Körper deutet auf das Vorhandensein von Pentosanen und Methylpentosanen. In der Tat erhält man bei der Hydrolyse von Fucus eine Methylpentose, die Fucose (die optische Antipode der Rhodeose, TOLLENS und GÜNTHER) von der Formel:
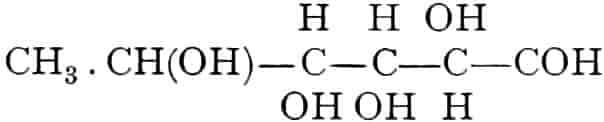
Die Membran enthält also ein Fucosan. BIELER und TOLLENS erhielten auch aus Laminarien Methylfurfurol:
[S. 300]
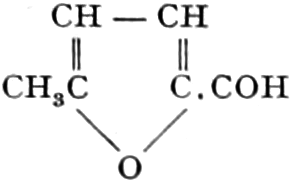
so daß wohl anzunehmen ist, daß die Fucus- und Laminaria-Membranen im wesentlichen übereinstimmen. Auch Glukuronsäure (vgl. S. 77) scheint in der Laminaria vorzukommen (TOLLENS). Laminariaschleim gibt bei der Hydrolyse Dextrose (BAUER). KÖNIG und BETTELS erhielten aus Laminaria japonica (und einer anderen Laminariaart): Glukose, Fruktose, Pentosen und Methylpentosen (aber keine Galaktose).
SCHMIEDEBERG erhielt aus Laminaria zwei den Kohlehydraten nahestehende Substanzen des Laminarin (C60H102O51) und die stark quellbare Laminarsäure (C12H18O11). In den beim Liegenlassen von Laminarien an der Luft bei Regenwetter austretenden Schleimblasen fand STANFORD Algin, das Ca-Na-Mg-Salz der Alginsäure. Das Natriumalginat kommt in den Handel. Es ist eine außerordentlich zähe Masse (37mal zäher als Gummi arabicum). Das Algin des Handels wird durch Ausziehen der Laminarien mit Sodalösung dargestellt. Schon eine 2%ige Lösung ist dick, eine 5%ige gelatinös. Auch hier treten also Beziehungen zum Pektin hervor. Die Tangsäure (KREFTLING), die Laminarsäure (SCHMIEDEBERG), die Alginsäure (Algin, STANFORD), die Alginicinsäure und die sog. Pektinsäure (?) sind wohl dieselbe Substanz in verschiedenen Reinheitsgraden. Die reine Substanz ist aber noch nicht erhalten worden.
Im lufttrockenen Stipes von Lam. digit. finden sich nach AXEL KREFTLING: in kaltem Wasser lösliche Schleimsubstanz 47,4%, Tangsäure 19%, Zellulose 10,9%, in Wasser lösliche Salze 8,6%, in Wasser unlösliche anorganische Salze 4,4%, Wasser 7,8%. Nach KÖNIG und BETTELS enthält luftrockene Laminaria in Prozenten: 6,16 Wasser, 8,19 Gesamtstickstoffsubstanz, 5,68 wasserlösliche Stickstoffsubstanz, 0,5 Ätherauszug, 36,04 stickstofffreie Extraktstoffe, 6,66 Pentosane, 1,12 Methylpentosane, 11,27 Rohfaser, 30,06 Asche, 16,47 Chlornatrium. Durch Dämpfen wird in Wasser löslich: 29,39% anorganische und 50,85% organische Substanz. Von den Meeresalgen sind die Porphyraarten sehr reich an Proteïn, Laminaria, Cystophyllum und Enteromorpha reich an Pentosanen.
Die Elastizitätsgrenze sinkt bei steigendem Wassergehalt. Das Elastizitätsmodul beträgt bei 40% Wassergehalt 24,5, bei 90%: 9, bei 140%: 3, bei 230%: 1,7, bei 350%: 1,5 (J. REINKE). Durch Einlegen in Wasser vergrößert sich der Durchmesser der Laminarienstäbchen um 72%, ein Kanal von 50 mm wird auf 147 mm erweitert (COHN). Auch Mannit (5–6%, STENHOUSE) und Dextrose sind aus Laminarienstipites (von L. flexicaulis, weniger von L. Clustoni) erhalten worden. Es scheint aber, daß diese Körper erst in den abgestorbenen Tangen auftreten [PHIPSON (1856), SOUBEIRAN (1857)], also wohl erst abgespalten werden (Laminaria saccharina LAMX. enthält bis 12% Mannit). Nach BRUNS kommt Fett und Phloroglucin (?) im Inhalte vor. Über das Fucosan vgl. oben S. 298.
Der Farbstoff der Chromatophoren trockener Laminarien (der sich aber vorwiegend in dem Blatteile, weniger im Stipes findet) ist ein Mischfarbstoff. Er wurde von COHN Phaeophyll genannt. Er besteht aus braunem, wasserlöslichem Phycophaein (MILLARDET), das keine Absorptionsbänder besitzt, sondern nur kontinuierliche Absorption des Rot bis 0,680 µ und des übrigen Spektrums bis 0,620 µ zeigt (SCHÜTT), gelbem, alkohollöslichem Phycoxanthin (MILLARDET), das wohl mit dem[S. 301] Carotin bzw. Xanthocarotin, d. h. dem Xanthophyll der Autoren ex parte, verwandt oder damit identisch ist (HANSEN, GAIDUKOW) — ich nannte den Körper η-Xanthophyll — und grünem Chlorophyll (MILLARDET, ARDISSONE, HANSEN). Chlorophyll und Phycophain sind vielleicht chemisch miteinander verbunden (ENGELMANN). Die lebenden Phaeophyceen enthalten kein wasserlösliches Pigment (Phycophaein). Ihre Chromatophoren sind nach TSWETT durch Chlorophyll, Karotin, Fucoxanthin und Fucoxanthophyll tingiert.
Die Asche beträgt 14,02% (FLÜCKIGER), 14–18% (STANFORD), 18,64% (GOEDICHEN). Darin sind 11,86% Kalk (sie ist also kalkreich), 22,4% Kali, 24,09% Na, 7,44% Magnesia, 0,62% Eisen, 2,56% Phosphor, 13,26% SO3, 1,56% SiO2, 17,23% Cl, 3,08% J; nach FLÜCKIGER kein Mangan. STANFORD fand in der Asche Jodide und viel Calciumcarbonat (20%), im ganzen 40% Salze. Nach WOLFF differiert Menge und Zusammensetzung der Asche je nachdem man die Stipites im Frühling oder Herbst untersucht ziemlich beträchtlich, nur Phosphorsäure und Jod bleiben etwa gleich. Er fand Jod: 1–1,2%, Chlor in Frühlingsmaterial 28,35%, in Herbstmaterial 38,67% der Asche.
Wichtig ist besonders der Jodgehalt, da die Laminarien der nördlichen Meere noch jetzt zur Jodgewinnung herangezogen werden. [Nur Laminarien nicht Fucusarten liefern den Kelp (Drift Kelp)]. Um Jod nachzuweisen, darf man nicht veraschen, sondern muß unter Zusatz von Zinkstaub, Bimstein oder Kieselgur verkohlen (FLÜCKIGER) oder man destilliert mit Braunstein und Schwefelsäure das Jod ab (JONES). Es enthalten Jod (nach STANFORD) in Prozenten der Trockensubstanz: Laminaria digitata (Stamm) 0,4535, (Laub) 0,2945; Lam. stenophylla (Stamm) 0,4028, (Laub) 0,4777; Lam. saccharina 0,2794, Lam. bulbosa 0,1966, Fucus serratus 0,0856, F. nodosus 0,0572, F. vesiculosus 0,0297. MARCHANDS Angabe, daß Laminaria 5% Jod enthalte, ist ein Irrtum. [Japan. eßbare Meeresalgen enthalten 0,3171 J, Chondrus crispus Spuren, Gelidium corneum dito, Gigartina spinosa nichts.] Nach GAUTIER enthält Laminaria 12 mg Jod auf 100 g frische und 60 mg auf 100 g trockene Substanz. Laminaria enthält das Jod fast ausschließlich in organischer Form, in ähnlicher wie es im Jodothyrin (oder Jodospongin HUNDESHAGENS aus Spongien) enthalten ist und zwar scheinen mehrere organische Jodverbindungen in Betracht zu kommen, solche, welche sich in Wasser, Alkohol, Aceton, Alkalien und Säuren lösen und solche, die in diesen Lösungsmitteln unlöslich sind. Letztere bilden die Hauptmenge (ESCHLE). Wahrscheinlich bedingen diese organischen Jodverbindungen die Benutzung der Fucoideenextrakte (Extr. fucus vesiculos., Extr. Laminariae) zu Entfettungskuren. Der Gehalt der Asche an Brom beträgt wohl selten mehr als 0,2%.
Entdeckt wurde in den Tangen das Jod 1813 durch COURTOIS (mitgeteilt von DESORMES und CLÉMENT, Schweigg. Journ. 9, 339), das Brom 1826 durch BALARD. Der Jodgehalt beträgt in % bei Ecklonia cava (Kajime), Stengel 0,14831; Ecklonia cava (Kajime), Laub 0,00177; Ecklonia bicyclis (Arame) 0,00028; Cystophyllum spec. (Nagahijiki) 0,00506; Arthrothamnus bifidus (Neckoashi Kombu) 0,223; Laminaria japonica (Ma-Kombu) 0,106; Laminaria religiosa (Hosome Kombu) 0,127; Laminaria longissima (Naga Kombu) 0,173; Laminaria angustata (Mitsuishi Kombu) 0,180, (Rijiri Kombu) 0,188; Laminaria diabolica (Oni Kombu) enthält auch Jod (DAVIDSOHN).
Der Jodgehalt beträgt bei Ecklonia cava in den einzelnen Monaten (nach DAVIDSOHN):
|
In den Stengeln:
|
|||||||||||
|
Jan.
|
Febr.
|
März
|
April
|
Mai
|
Juni
|
Juli
|
Aug.
|
Sept.
|
Okt.
|
Nov.
|
Dez.
|
|
0,092
|
0,167
|
0,061*
|
0,067*
|
0,147†
|
0,255
|
0,216
|
0,142
|
0,267†
|
0,144
|
0,145
|
0,099
|
| [S. 302]
Im Laub:
|
|||||||||||
|
0,81
|
0,167
|
0,063*
|
0,060*
|
0,076†
|
0,294
|
0,294
|
0,142
|
0,232†
|
0,081
|
0,112
|
0,097
|
TUNMANN fand im Stipes von Lamin. 0,059–0,108%, im Blatteil 0,071–0,154% Jod der Trockensubstanz. Der Blatteil ist also jodreicher. Das weiß auch bereits die Industrie. ALLAZY fand, daß Varech aus der ganzen Pflanze 0,06, aus dem alten Blatte 0,057, aus dem unteren Teile des altes Blattes 0,108, aus dem neuen Blatte 0,122% Jod enthielt. TUNMANN gelang es auch noch in 1–2 mgr Substanz Jod mikrochemisch nachzuweisen. Er legte neben die Schnitte Stärke und ließ starke Salpetersäure zufließen. Auf diese Weise gelingt noch der Nachweis von 2⁄1000 mgr Jod. TUNMANN fand Jod besonders in der Mark- und Rindenschicht und nur im Zellinhalte. Die Jodverbindung ist leicht in Wasser und Alkohol löslich.
Die Effloreszenzen auf den trockenen Stipites sind vorwiegend Natriumsulfat.
Lit. STENHOUSE, Lieb. Ann. 74 (1850), S. 278. — MAQUENNE, Compt. rend. 109 (1889). — STANFORD, Econom. applicat. of seaweed. Pharm. Journ. 1884, XIV, 1009 u. flgd. (Pharm. Zeit. 1884, 507) und Chem. news 1883; auch Pharm. Journ. XIII (1883), 1019, 1037. Journ. chem. soc. 1886, 218. — BAUER, Über eine aus Laminariaschleim entstehende Zuckerart. Ber. d. chem. Ges. 22 (1889), 618. — GÜNTHER u. TOLLENS, Über d. Fucose. Ebenda 23 (1890). — MANGIN, Sur la callose, Compt. rend. 110 (1890). Rech. sur l. compos. pectiques. Journ. de bot. 1893. — BIELER und TOLLENS, Ber. d. d. chem. Ges. 22, 3063. — MUTHER u. TOLLENS, Ber. chem. Ges. 1904, 298 u. 306. — TOLLENS (Glukuronsäure-Reaktion), Ber. d. d. chem. Ges. 1908, 1789. — — SCHMIEDEBERG, Tagebl. Naturf. Vers. 1885, 231 (Pharm. Jahresber. 1885, 23). — WILLE a. a. O. — JONES, Chem. News. 48, S. 296. — GAUTIER, Compt. rend. 129 (1899), 189 und ebenda 1900. — ESCHLE, Zeitschr. phys. Chem. 1897, 23, 30 (Ph. Zeit. 1897, 607). — KÖNIG und BETTELS, Die Kohlehydrate der Meeresalgen. Zeitschr. Unters. d. Nahrungs- u. Genußm. 10. — WARINGTON, Chem. News 40, 195. — MARCHAND, Ann. chim. phys. 8 (1866), 320. — Farbstoff: HANSEN, Bot. Jahresber. 1885, I, 404. — REINKE, Beitr. z. Kenntn. d. Phycoxanthins. Pringsh. Jahrb. 10, 399. — Analysen von Laminaria japonica von KELLNER, NAGAI und MURAI bei KÖNIG, Nahrungsm. — CZAPEK, Biochemie. — Nachweis des Jods in den Algen: FLÜCKIGER, Arch. d. Pharm. 225 1887), 519 und Pharmakogn. III (Zinkstaub). — JONES, Ber. d. chem. Ges. 17, Ref. S. 53 (1884). — WEIS, Chem. Centralbl. 1903, I, 1158. — RIEGLER, Ebenda 1903, II, 772. — TUNMANN, Über d. J. u. d. Nachweis desselb. in d. Laminaria. Pharm. Centralh. 1907, 505. — JUSTUS, Virchows Arch. 170 (1902), 501. — DAVIDSOHN, Imp. inst. Tokio in Pharm. Journ. 1906, 346.
Anwendung. In der Medizin finden die aus den Stipites gedrechselten Stifte (Laminariastifte, L.-Kegel, Quellmeißel) Verwendung — zur Erweiterung von Öffnungen, zum Offenhalten von Wunden und als Quellmeißel und Sonden — an Stelle des Preßschwammes. Sie quellen sehr langsam und erreichen in 24 Stunden ihr Quellungsmaximum. Da das Quellungsvermögen in der Markschicht am größten ist und nach außen hin abnimmt, müssen die Stifte, damit sie gleichmäßig quellen, möglichst genau in der Längsachse der Stiele gedrechselt werden. Die Stifte quellen in destilliertem oder kochsalzhaltigem Wasser besser als in kalkhaltigem. Die Laminariastäbchen sind entweder solide (Vollstifte) oder hohl (Hohlstifte). Es werden jetzt im Handel angeboten: Vollstifte von 1,5, 2, 3, 4, 5, 6, 7 und 8 mm Durchmesser und 8, 10, 20 und 30 cm Länge, Hohlstifte von 4, 5, 6, 7 und 8 mm Durchmesser und 8 bzw. 10 cm Länge, sowie conische 4,5 cm lang (CAESAR u. LORETZ, 1910). Neuerdings kommen sie auch sterilisiert (STICH) und imprägniert in den Handel. Auch ein Blutstillungscharpie wird aus den getrockneten Stipites hergestellt.
Sonst werden die Laminarien auch als Viehfutter und Düngemittel benutzt. Die mannithaltigen Teile der Lamin. flexicaulis, besonders die unteren Enden der Stiele,[S. 303] werden gegessen, ebenso Lam. saccharina (und Sargassum) im Mittelmeergebiet. Laminaria saccharina enthält 7,79% des Trockengewichtes N-haltige Substanzen (WARINGTON). Die japanische Algenkonserve, Naga-Kiri-Kombu (kombu = Seekraut), besteht aus der in Streifen geschnittenen Lamina von Laminaria japonica ARESCH. (SENFT). Die umfangreichste Verwendung ist die zur Jodbereitung (s. unten). Neuerdings dienen Fucusextrakte als Entfettungsmittel (s. oben). In Lahore und Kaschmir wird Lamin. saccharina als Galhár-Kapalta gegen Kropf, im Himalaya bei Syphilis benutzt. Hai-tao ist eine der Laminaria digitata nahestehende Meeresalge, wahrscheinlich L. bracteata, 1 m und darüber lange, etwa 6 cm breite Streifen mit von Salzauswitterungen weiß bestäubter, schmutzigbrauner Oberfläche. Die Alge verleiht mit Wasser gekocht diesem eine schlüpfrige Beschaffenheit, weshalb sie zur Appretur Verwendung findet. In Japan und China wird sie gegessen. Sie dürfte identisch sein mit der Laminaria, die in China als «Hai-tai» und «Kwanpu» oder «Kai-wan» bei Menstruationsbeschwerden zur Erhöhung der Uterustätigkeit verwendet wird (GEHE 1898).
Die Tang-Jodgewinnung wird in Japan besonders in Hokkaido betrieben. Man benutzt außer Laminaria auch Eclonia-, Sargassum-, Arthrothamnus- und Cystophyllum-Arten. Die Fischer ziehen mit ihren Booten zu den Kelp-grounds und reißen die Algen mittelst Gabeln von den Felsen (I, Fig. 100, S. 102). Die getrockneten Algen werden dann in Höhlungen oder Herden verbrannt — richtiger verkohlt — der Kelp mit Wasser ausgezogen, die Lösung eingedampft und mit Braunstein und Schwefelsäure erhitzt. Zur Jodfabrikation werden an den Küsten von Frankreich (Normandie) und Schottland besonders Laminaria-, Alaria- und Fucus-Arten benutzt. Der Jodgehalt sinkt beim Verbleiben der Algen im Wasser. Man bringt daher die von Booten aus mit an langen Stangen befestigten Sicheln geernteten samt den bei stürmischem Wetter vom Meere ausgeworfenen Laminarien sofort an Land und verkohlt bald. 22 t Tang liefern 1 t Varech oder Kelp (Tangasche). Die Verarbeitung der Tange geschieht jetzt nicht mehr überall in den früher üblichen Gräben der Varechbrenner, sondern zum Teil nach dem Verfahren von PELLIEUX und MAZE-LANNAY. «Es beruht auf der Verarbeitung von Schnittalgen. Zur Trocknung der Tange dienen drei terrassenartige Erhöhungen. Die beiden unteren sind mit Cement belegt. Auf der obersten Terrasse beläßt man die Algen 4–5 Tage zum Abtropfen und oberflächlichen Trocknen. Auf der zweiten Etage läßt man sie in Gärung kommen; dabei entlassen sie eine Menge Flüssigkeit von einem im Vergleich zu den getrockneten Tangen höheren Jodgehalt. Diese Flüssigkeit wird daher gesammelt und abgedampft. Der Abdampfrückstand gelangt schließlich mit den auf der untersten Terrasse vollständig getrockneten Tangen behufs Veraschung in den Calcinierofen.» In 1000 kg Varech sind enthalten bei Laminaria stenoloba 0,57–1,22, bei L. digitata var. stenophylla 0,99, bei L. saccharina 0,44, bei Araria esculenta 0,10 kg Jod (ALLAZY).
KREFTLING gewinnt für technische Zwecke STANFORDS Alginsäure jetzt im Großen aus Laminarien Norwegens. Er nennt sie Tangsäure. Ihre Alkalisalze sind stark klebrig (s. oben S. 300).
Lit. STANFORD a. a. O. — KREFTLING, Über wichtige organ. Produkte aus Tang. Chem. Industrie 1897, Nr. 20 (Bot. Centralbl. Beihefte 1898, 519). — SENFT, Über einige in Japan verwendete vegetabil. Nahrungsm. usw. Pharm. Praxis 1906 u. 1907 (dort ein Verzeichnis der Laminariakonserven). — KRASSER in WIESNER, Rohstoffe. — ALLAZY, Bull. soc. chim. 38, 11. — Jodgewinnung in Japan: Govern. Rep. on the investig. on Marine Res. of Hokkaido und KINGO MIYABE, On the Laminariaceae and Laminaria Industries of Hokkaido (Pharm. Journ. 1906 Sept.)
Geschichte. WILSON empfahl zuerst die Anwendung der Laminariastäbchen in der Chirurgie. Aber schon 1834 hatte HÄBERL die Laminariastäbchen mit den zu gleichem Zwecke empfohlenen aus Enzianwurzel verglichen (WINCKEL). Sie werden etwa seit 1863 in der chirurgischen Praxis benutzt. Man hat es für möglich erklärt (DRAGENDORFF), daß das Erythrodanon des MARCELLUS EMPIRICUS eine Laminaria war.
Lit. HÄBERL, Neue Zeitschr. f. Geburtskunde I, S. 50. — WINCKEL, Göschens deutsche Klinik XIX (1867), 270; — Pharm. Jahresber. 1864, 280. — Vgl. auch RUSSEL, Fucus vesiculosus. Dissert. Oxon. 1750.
[S. 304]
Paralleldrogen. Seit dreihundert Jahren ist die Eigenschaft der Wurzeln von Gentiana lutea in Wasser stark aufzuquellen bekannt. Dieselben wurden daher seit langem wie heute die Laminariastifte benutzt.
Neuerdings (seit 1879) wird das durch Pressen leicht auf ein geringes Volumen zu bringende Holz (Tupeloholz, Lign. Nyssae) der in den südlichen Vereinigten Staaten, besonders Südkarolina heimischen Cornacee, Nyssa aquatica L. (Nyssa multiflora WANGENH. und die verwandte N. biflora MICH.), einer Sumpfpflanze, in gleicher Weise zu Quellstiften benutzt. Nach MAISCH eignet sich Nyssa grandidentata noch besser dazu. Die daraus dargestellten sehr leichten, gelblich weißen sog. Tupelostifte quellen rasch auf ihr ursprüngliches Volumen, behalten dasselbe dann aber auch nach dem Trocknen bei. Der Vorgang beruht hier auf etwas ganz anderem wie bei den Laminariastiften, nämlich darauf, daß die Zellen des ungewöhnlich dünnwandigen Holzes (MOELLER) die Fähigkeit besitzen, durch Wasserentzug und Zusammendrücken stark zu kollabieren und durch Wasserzufuhr wieder auf das ursprüngliche Volumen zu gehen.
Lit. Nyssa: Pharm. Jahresber. 1879, S. 54 und 1884, S. 249, Arch. d. Pharm. 1879, S. 355 u. Pharm. Centralh. 1879, Nr. 6 (HAUBNER). — HAAXMANN, Ned. Tijds. 1879, S. 145. — J. MOELLER, Afrikan. Drogen, Lign. Nyssae. — Pharm. Centralh. 1883, S. 545 u. 581 (mit Abbild.). — Ph. Zeit. 1884. S. 59. — MAISCH, Am. journ. pharm. 1883, p. 631. — GEHE, Handber. 1880. — ENGLER-PRANTL, Pfl.-Fam.
Agar-Agar.
Unter dem Namen Agar-Agar werden sowohl einige kleine Meeresalgen der Abteilung der Florideen wie auch ein aus indisch-japanischen Florideen dargestellter eingetrockneter Schleim bezeichnet. Im Handel versteht man aber nur letzteren unter diesem Namen. Der Name Agar-Agar taucht in der europäischen Literatur zuerst bei CRAWFORD auf (History of the Indian Archipelago vol. III p. 46). Agar-Agar ist der malaiische Name für Gracilaria lichenoides. Gr. lichenoides var. tenuis heißt malaiisch: Agar-Agar Kuning, Javan.: Bulong, Makass.: Dongi-Dongi. Im Hind. Bomb. Bengal. bedeutet Agar etwas ganz anderes, nämlich Lignum Aloës! (DYMOCK). Im Japan. heißt Agar: kantén = kalter (klarer) Himmel, weil man es nur bereiten kann, wenn das Wetter kalt und trocken ist.
I. Unbearbeitete Algen.
1. Agar-Agar von Ceylon.
Syn. Ceylonmoos, Jafnamoos, Mousse de Jaffna, Alga ceylanica s. amylacea, Fucus amylaceus s. ceylanicus — shih-hwa-tsʾai (chin.) — chini-ghás (Ind. Bazars, bomb.) — kadal-pach-chi (tam.) — samudrapu-páchi (tel.) — kujáv-poen (burm.).
Stammpflanze. Gracilaria lichenoides GREVILLE (Sphaerococcus lichenoides AG., Fucus amylaceus O’SHAUGN., F. lichenoides L., F. gelatinosus KÖNIG, Plocaria candida NEES, Gigartina lichenoides LAMOUR.) in GREVILLE Alg. brit. 50, TURNER Fuci t. 118.
Systemat. Stellung. Florideae — Rhodymeliales — Sphaerococcaceae — Gracilarieae.
Die zierliche (gracilis, daher Gracilaria), in der Tat einer Flechte (daher[S. 305] lichenoides) äußerlich ähnliche Meeresalge, die im Indischen Ozean, an den Küsten von Ceylon, den Sundainseln und Burma vorkommt, bildet runde, nach dem Trocknen und Bleichen weiße oder grauweiße (lebend: blaß-purpurrote), wiederholt gabelig verästelte (daher Plocaria, von πλόκος, Geflecht) Fäden, deren Dicke zwischen der eines Zwirnfadens und der dünnerer Bindfäden schwankt. Der Thallus wird bis über 20 cm lang. In der Droge ist er meist stark zertrümmert. Jod färbt den Schnitt braunrot, beim Erhitzen rotviolett (daher: amylaceus). Die Randschicht besteht aus kleinen derben Zellen, die Markschicht aus großen weiten. In der kleinzelligen subepidermalen Zellschicht und vereinzelt auch in des großen Markschichtzellen finden sich kleine Stärkekörner und Körnchen, die mit Jod violett werden (Amylodextrinstärke?). Die Wände, besonders der Markzellen, färben sich mit Jod rot, beim Erhitzen geht die Farbe in violett über, ähnlich wie beim Amylodextrin. Auch der durch Auskochen der Droge erhaltene Schleim wird durch Jod violett. Die Fäden knirschen beim Drücken mit der Hand, quellen in Wasser nur wenig, entwickeln dabei aber den typischen Tanggeruch. Mit dem 50fachen Wasser gekocht liefern sie eine Gallerte.
Der Fucus amylaceus wurde 1834 von O’SHAUGHNESSY empfohlen und 1837 von PREVITÉ unter dem Namen Ceylonmoos in England eingeführt. Im deutschen Handel ist er seit 1841 (MARTIUS, Jahresber. d. Pharm. 1842, 241). Er wird in Indien als Nahrungsmittel benutzt, kann aber auch wie Carrageen (s. d.) benutzt werden (CRAWFORD). Im indischen Archipel und in China ist er längst in Gebrauch. Er ist wohl eine der von RUMPHIUS im Herbar. Amboinens. unter dem Namen Alga coralloides beschriebenen Pflanzen. In der Pharmakopoëa indica (1868) steht eine Decoction of Ceylon Moss [und (non officinal) Gillur ka putta von Laminaria saccharina].
Beigemengt ist der Droge bisweilen: Gracilaria confervoides GREV.
Als Paralleldroge gilt Gelidium cartilagineum GAILL. und Gigartina selacea LAMX. (Weitere Angaben in der Pharmakographia.)
2. Agar-Agar von Makassar.
Syn. Agar-Agar von Java, Alga spinosa, ostindisches Carrageen.
Stammpflanze. Eucheuma spinosum (L.) J. AGARDH (Fucus sp. L., Sphaerococcus sp. AG.).
Systemat. Stellung. Florideae — Gigartinales — Rhodophyllidaceae — Solicrieae.
Die im chinesischen Meere vorkommende Alge hat einen trockenen, etwa 2 mm dicken, stielrunden, rötlich-gelblichen, knorpeligen Thallus, der ziemlich reichlich mit dornigen Auswüchsen, den Cystocarpien, besetzt ist. In Wasser quillt sie auf die doppelte Dicke und wird hyalin. Sie zeigt oft weiße Salzinkrustrationen, dient auch zur Agar-Agar-Bereitung (s. unten) und in Japan zur Herstellung von Gelees (Abbild. nach KÜTZING bei KRASSER in WIESNER, Rohstoffe I, 645).
3. Japanisches Moos.
Stammpflanze. Gloiopeltis coliformis HARV., G. cervicornis SCHMITZ.
Systemat. Stellung. Florideae — Cryphonemiales — Gloiosiphoniaceae.
Diese in dem chinesisch-japanischen Meere vorkommenden Algen dienen den Japanern als billiges Nahrungsmittel und liefern einen zähen Schleim.
[S. 306]
Viele Algen dienen in Japan als Nahrungsmittel. SENFT gibt folgende japanische Namen eßbarer Algen an:
Laminaria japonica = Konbu, Kobu, Hirome; Porphyra vulgaris = Asakusa-nori, Ama-nori, Alaria pinnatifida = Wakame, Chondrus spec. = Hijiki, Gelidium corneum = Tokoro Tengusa, Gracillaria confervoides = Ogo nori, Enteromorpha compressa = Ao nori, Phycoceris smaragdina = Ao sa, Tisanori, Hallymenia dentata = Tasaka nori, Halochtoa macrantha = Hondawara, Kawaramo (vgl. auch Useful plants of Japan, Edible Algae). Über eßbare Algen vgl. auch oben S. 303, 307 und 313.
II. Aus Algen dargestellte Gelatinen.
Agar-Agar von Japan.
Syn. Vegetabilischer Fischleim, japanische oder chinesische Gelatine, japanische oder indische Hausenblase, Gelose — japanese isingglaß, vegetable gelatine, sea-weed — in Japan: kanten — dschin-dschen, tjen-tjan (das quadratische), dschindschom, tientjan, tjientjan, tientjow, thao, lothaho, haitao, haitsai, haitsau, yang-tsai. In den ind. Bazars: chinighás. In den Preislisten auch: Gelatina japonica Tjen-Tjan. — MARCHAND schlägt vor das Agar Phycocolla zu nennen (im Gegensatz zu Ichthyocolla).
Stammpflanze. Die beste Sorte japanisches Agar-Agar wird von Gelidium-Arten gesammelt, hauptsächlich wohl von Gelidium Amansii LAMX. (= G. Swansii?), G. polycladum KÜTZ., G. elegans KÜTZ. (G. rigidum) — weniger von Gelidium japonicum OKAM. und G. subcostatum SCHMITZ — [Florideae, Nemalionales, Gelidaceae], in neuerer Zeit auch von Acanthopeltis japonica OKAM., ebenfalls ein Gelidiacee.
Andere Arten, welche zur Herstellung von Agar-Agar dienen, sind: Gracilaria confervoïdes und G. lichenoïdes, Campyloeophora hypneoïdes, Ceramium rubrum.
Ferner werden als ein Agar liefernd angegeben: Gelidium corneum (HUDSON) LAMOUR. (G. capillaceum KTZ., Fucus corneus HUDS., Sphaerococcus corn. AG.); Gelidium cartilagineum GAILLON (Fucus cartilagineus L., Sphaerococc. cart. AG.); Gloeopeltis tenax (TURNER), J. AGARDH [Florideae — Cryptonemiales — Gloiosiphoniaceae]; Eucheuma spinosum (L.) J. AGARDH (Fucus spinosus L., Sphaerococcus spinos. AG.); Eucheuma gelatinae AG. (Sphaerococcus gelat. AG.). Eucheuma speciosum AG. (Gigartina speciosa SOND.).
Gelidium Amansii.
[Holmes, Pharmaceut. Journal 1906.]
PAYEN betrachtete Gelidium corneum LAM. und Gracillaria lichenoides GR. als Stammpflanze des Agar. Ersteres wird sicher von den Chinesen gebraucht. (HANBURY fand es 1860 in einer Sammlung chinesischer Algen.) Doch werden nach HANBURY auch Laurencia papillosa GR., Laminaria saccharina LAMX., Porphyra vulg. AG. und Gracillaria (crassa?) sowie Eucheuma spinos. benutzt. MARCHAND, der die Streifen und vierkantigen Stücke (Würfelagar) mikroskopisch untersuchte, fand hierbei besonders Gelidium polycladum KÜTZ., unter dem sich aber zwei Algen verbergen. HOLMES bildet das japanische Gelidium polycladum SONDERS ab, das die Hauptmasse der Tengusa bildet. MARCHAND hält Gloiopeltis für den Hauptbestandteil in dem Würfelagar und Gelidium corneum var. acanthocladum (nach HOLMES var. pinnatum) für den Hauptbestandteil der schmalen Streifen und erwähnt auch eine Endocladia. MATSUMURA nennt: Gelidium corneum var. pinnatum, G. cartilagineum, G. repens, G. rigidum; OKAMURA beschreibt andere Arten. DAVIDSOHN, der in Japan lebte, teilte dann (1906) mit, daß hauptsächlich Gelidium Swansii, soll wohl heißen: Amansii (= Tengusa) gutes Kantén liefere, dann ein unbekanntes Gelidium (= Higekusa), schlanker als Tengusa und G. japonicum (= Onigusa); geringeres Kantén aber von dem an der Küste wachsenden G. subcostatum und den besonders als Beisatz benutzten[S. 307] Campyloeophora hypneoides (= Ego) komme. Beinahe so gut wie Tengusa bezeichnet er Acanthopeltis japonica (= Toriaschi — in Shikoku). Als Substitute und Beisätze werden auch benutzt: Gracillaria confervoides (= Ogo) und Ceramium Boydeni (= Igisu). HOLMES fand in Tengusa (1879): Gelidium elegans und G. polycladum (nicht G. subcostatum und divaricatum). DAVIDSOHN führt noch als Kantén liefernd an: Campyloeophora hypneoides, Gracillaria confervoides (wohl compressa), Sarcodia spec. ign. TUNMANN fand 1909 in den feinsten Sorten Agar Gracillaria confervoides.
Nach MARCHAND u. a. werden außer den Hauptalgen (s. oben) noch folgende zur Agar-Agar-Bereitung benutzt: Sphaerococcus compressus AG., Gloiopeltis coliformis, Gelidium capillaceum, sowie Arten von Streblonema, Scytosiphon, Sporanthus, Ceramium, Centroceras, Endocladia Nitophyllum, Polysiphonia, Gracillaria.
EUG. COLLIN fand in Agar Reste von Gelidium, Gloeopeltis, Gracillaria, Laurencia und Ceramium. Er bemerkt: «Il est probable que les Japonais utilisent pour la préparation toutes les algues de leur littoral, qui peuvent se transformer en gélose.»
Etym. Gelidium von gelare gefrieren, gerinnen, gelu (für Gelée schon im Wiener Dispensatorium) bedeutet Frost, Kälte. — Eucheuma von εὐ = wohl, schön, χεῦμα = Guß, Gußarbeit — Gloeopeltis von γλοία = Leim, Gallerte, πέλτη = Schildchen.
Die Gelidiaceen sind Rhodophyceen mit meist zartem verzweigtem, stielrundem Thallus mit deutlicher Fadenstruktur. Die Cystocarpien in Gestalt kleiner Anschwellungen bald endständig, bald intercalar an den letzten Auszweigungen des Thallus verteilt. Die Gelidieen haben Sprosse mit Zentralachse und eine dicht geschlossene Rinde. Die Zentralachse mit quergegliederter Scheitelzelle, Rindenfäden wirtelig angeordnet. Die vielgestaltigen Arten der Gattung Gelidium LAMOUROUX (Cornea STACKHOUSE) finden sich in sämtlichen wärmeren Meeren, oft weit verbreitet, Gelidium corneum (HUDSON) LAMOURX. z. B. im atlantischen, indischen und stillen Ozean. Gelidium ist fiederig seitlich verzweigt, von sehr dichtem und zähfestem Gefüge. Die Außenrinde ist kleinzellig, die Innenrinde längsfaserig durch zahlreiche, dicht zusammenschließende, dünne, längslaufende Fäden, welche die dünne Zentralachse fast vollständig verdecken und deren Gliederzellen sich vielfach querüber vertüpfeln. Bei Gelidium corneum findet sich ein ausgesprochenes Assimilationssystem in der Peripherie, das durch Sammelzellen mit dem weiter innen gelegenen Leitungssystem in Verbindung steht (Abbild. nach AGARDH in HABERLANDTS Anatomie S. 265).
Andere aus Algen hergestellte Gelatinen sind: Satsuma Funori, ein statt Gummi oder Leim von den Japanern und Chinesen als Klebemittel und zum Wäschestärken benutzte Gallerte, wird besonders aus Gloeopeltis tenax AG. hergestellt (s. weiter unten). Nori, ein japanisches Nahrungsmittel, wird aus Porphyra laciniata und coccinea dargestellt (SENFT).
Assimilationssystem von Gelidium corneum (Zellumina schwarz); darunter Sammelzellen, die mit dem Leitungsgewebe in Verbindung stehen.
[Nach Agardh aus Willes Algernes physiologiske Anatomi.]
Unter dem Namen «Sea weed jelly from China», «chinesische Pflanzengallerte», befinden sich in meiner Sammlung braune Würfel, die einen Caramelgeruch besitzen, süßlich fad schmecken und stark in Wasser quellen. Weitere Angaben in DRAGENDORFF, Heilpflanzen. Über Hay-Thao und Ly-chô vgl. VALENTA, Klebe- und Verdickungsmittel.
Lit. RENNIE, Essays on the nat. hist. and orig. of Peat moss. Edingb. 1810. — MEYER, De Fuco crispo. Berolin. 1835. — HERZER, De fuco crispo. Turici 1836. — SIGMOND and FARRE,[S. 308] Essay of the Ceylon Moss. London 1840. — LOVÉN, Om Geléers. Lund 1841. — ARCHER, Pharm. Journ. XIII, 312, 1854. — SIMMONDS, Ebenda 355. — (WIGGERS bespricht ARCHERS u. SIMMONDS Arbeit, Pharm. Jahresb. 1854, 10). — PAYEN, Compt. rend. 1859 u. 1860. — HANBURY, Science papers 1860. — MARCHAND, Note sur le Phycocolla ou gelatine végétale produite par les algues. Bull. soc. bot. France 27 (1879), 287 und 1880, 207. — C. A. J. A. OUDEMANS, Bijdrage tot de kennis van het Agar-Agar vlugtige opmerkingen omtrent Fucus amylaceus en Tjentjau. Haaxm. Tijds. 1856 (gute morpholog. u. anatom. Abbild. von Eucheuma spinos. u. Gracillaria lichenoides), auch Arch. Pharm. (2) 87, 283 (mit einer Tafel). — J. AGARDH, Spec. gen. et ordines algarum. Lund 1848–76. — SURINGAR, Algae japonicae. — DE TONI, Sylloge algarum omnium hucusque cognitarum. — Useful plants of Japan. — BORNET et THURET, Rec. d’observ. sur les alg. Paris 1876–1880. — OKAMURA, Neue japan. Florideen. Hedwigia 1894. — YATABE, Iconographia flor. japon. I. — MATSUMARA, Catal. of the plants of Japan. — HOLMES, The japanese sea weed industry (Pharm. Journ. 1906, 319 (besonders nach DAVIDSOHN, Wakayama Sea weed industr. Bull. Imper. Inst. IV, 2, 125; mit Abbild.) — DYMOCK, Vegetable Mater. med. — FILET, Plantkundig woordenboek. — HARTWICH in Realenzykl. d. ges. Pharm. I, 322. — KRASSER, Algen in WIESNER, Rohstoffe. — Die Gelidiaceen-Literatur bei SCHMITZ-HAUPTFLEISCH in ENGLER-PRANTL, Pflanzenfam. I, 2,340. — Abb. von Gracillaria: BENTLEY-TRIMEN, pl. 306. — PLANCHON-COLLIN, Drog. simpl. I, Fig. 10 u. 11 (auch anatom.).
Darstellung und Handelssorten. Die Auskunft, die HOLMES (1906) von einem Japaner erhielt, lautete dahin, daß die gereinigten Algen zu einem steifen Gelee gekocht werden, welches in Formen ausgegossen wird. Die erkaltete Masse wird, in Streifen geschnitten und, der Sonne einen Tag ausgesetzt, langsam trocknen gelassen. Der Hauptsitz der Agarfabrikation sind (nach DAVIDSOHN) die Distrikte von Osaka, Kioto, Nagano und Hiogo (besonders Hokaido, Wakayama, Miye, Shozuoka, Chiba), woselbst die Gewinnung namentlich während der Wintermonate betrieben wird. Die Pflanzen werden bereits vom Mai bis August gesammelt, während welcher Zeit sie am ergiebigsten sind. Die Hauptalge ist Gelidium «Swansii» (= G. Amansii), in Japan «Tengusa» genannt. Sie ist 10–20 cm lang und wird mittelst Haken und Schaufeln bzw. Schleppnetzen, auch durch Taucher aus dem Meere gesammelt, da die am Ufer wachsenden Algen von geringerem Werte sind. Es werden aber auch andere Arten (s. oben) zur Agarbereitung herangezogen; man setzt diese gewöhnlich dem Tengusa-Agar in größerem oder geringerem Maße zu (vgl. oben S. 306), wodurch die Qualität natürlich entsprechend beeinflußt wird. Die frisch gesammelten Algen werden von den Fischern am Strande sorgfältig getrocknet und hierbei zum Teil schon gebleicht; dies geschieht häufig (z. B. in der Provinz Izu) auf über den Boden erhöhten Bambusmatten. Das Produkt wandert nun in die «Kanten»-Fabriken, wo es in einer Art von steinernen Mörsern unter fortwährendem Wasserzusatz von anhaftenden Verunreinigungen, wie kleinen Muscheln und dergleichen, befreit wird. Dann wird es in Bambuskörbe in fließendes Wasser gestellt, um die letzten Unreinlichkeiten zu entfernen. Dann wird gebleicht, unter fleißigem Begießen und Wenden (zumal bei trockenem Wetter), wozu in der Regel 24 Stunden, bei ungünstiger Witterung aber auch mehrere Tage erforderlich sind. Das erste Bleichen beginnt im August oder September. Die Algen werden in dünner Schicht auf Bambusmatten ausgebreitet. Schließlich hängen die Algen zu Bündeln zusammen und diese Bündel werden verspeichert. Zur eigentlichen Herstellung des Agars, die vom November bis März erfolgt, weicht man die bearbeiteten Algen in Wasser ein, kocht sie über freiem Feuer (in 790 gallons haltenden Kesseln) oder behandelt sie mit Wasserdampf. Hierbei werden von den Fabriken bestimmte Gewichtsmengen Wasser und Algen (es kommen z. B. 165 engl. Pfund Algen auf 950–1000 Gallonen Wasser) eingehalten. Verwendet man geringwertigere Algen als Zusatz, so läßt man diese länger kochen, d. h.[S. 309] man gibt sie früher in den Kessel als die gute Sorte. Die ganze Masse bringt man zum Kochen, rührt innerhalb fünf bis sechs Stunden häufig um, gibt dann ein bestimmtes Quantum Essig oder Schwefelsäure zu und läßt nun wieder frisches Wasser zufließen. Etwa eine halbe Stunde nach dem erneuten Aufkochen ist der Prozeß beendigt. Die gelatineartige Flüssigkeit (japan.: Tokoroten) wird durch ein Hanf- oder Baumwollgewebe gepreßt (in Pressen oder durch Beschweren mit Gewichten) und zum Erkalten beiseite gestellt; nach etwa 18 Stunden ist sie zu einer Gallerte erstarrt. Die Preßrückstände werden wiederholt mit Wasser behandelt und auf die gleiche Weise nochmals auf Agar verarbeitet. Die Gallerte wird schließlich (im November bis Februar) der Nachtkälte ausgesetzt, wodurch die Masse nach etwa 18 Stunden bis drei Tagen völlig erstarrt und fest wird. Man läßt hierbei den filtrierten Schleim in genau wagerecht gestellte hölzerne Tröge laufen, die 61 cm lang, 30,5 cm breit und 7,5 cm tief und bisweilen in Kolonnen geteilt sind von 46 cm Länge, 3,5 cm Breite und 3,8 cm Tiefe. Dann erst zerschneidet, bzw. trocknet man sie unter wiederholtem Wenden an der Sonne und bringt die Droge in die handelsübliche Form. Das Schneiden in Längsstreifen geschieht mittelst eiserner «frames», das Trocknen auf Bambusmatten oder auf Böcken in Holzverschlägen unter Abhaltung des Staubes, bei kaltem Wetter (35° F.). Der größte Teil des japanischen Agar-Agar geht nach China und Hongkong und nur eine verhältnismäßig kleine Menge gelangt direkt nach Europa (DAVIDSOHN 1906, HOLMES).

1. Die in dem hinten sichtbaren Bottich gekochte Masse wird auf die Filter geschöpft und die filtrierte Masse dann auf die rechts sichtbaren Rahmen gebracht. 2. Die gefüllten Rahmen werden ins Freie getragen. 3. Die starker Winterkälte ausgesetzten, in Reihen angeordneten Rahmen.
[Clichés Salle & Co. aus Perrot-Gatin, Les Algues marin. utiles 1911.]
Die Güte des Agar ist wohl nicht abhängig von den verwendeten Arten, sondern von der mehr oder weniger sorgfältigen Bereitungsweise. Es wird in folgenden Sorten hergestellt:
1. In c. 3–5 mm breiten, c. 35 cm langen, hyalinen oder grauweißlichen zerknitterten, meist zu Bündeln verschnürten Streifen. Selten erreichen diese, an die sog. Seele der Federkiele erinnernden, Streifen Fingerdicke und eine Länge von 50 cm.
2. In 2,5–4 cm dicken, c. 25–30 cm langen, gelblichweißen, leichten, vierkantigen, knitterig-blätterigen Stücken, die an den Kanten ebenfalls durchscheinend hyalin sind.
3. In c. 3 cm breiten und c. 30 cm dicken hyalinen Platten.
HANBURY hatte schon 1859 sowohl die vierkantigen Stücke, wie die dünnen Streifen in Händen (Science papers).
Der Großhandel unterscheidet Agar in Fäden — A.-Schnitzel — A.-Stangen und A. in Linealform. Fäden, Schnitzel, Stangen kommen in Packen von c. 90 kg in den Handel, Linealform in Kisten à 100 Stangen. Von Fäden, der besten und wichtigsten Sorte, unterscheidet GROSSMANN 1910 primaweiß 000, prima 00 und prima 0, eine minderwertige Sorte nennt er courant.
Der Export von Agar-Agar aus Japan betrug in den ersten 9 Monaten 1909: 1708353 Kin. 1904 exportierte Japan 10657 dz, 1906: 8377 dz. ⅓ der Ausfuhr geht nach China. Deutschland importierte 1906: 1064 dz, 1909: 919 dz.
Funori (sea weed glue s. oben S. 307) wird aus Gloiopeltis tenax (Yanayo-Funori) und G. coliformis und einigen anderen noch nicht bestimmten Algen dargestellt — das beste in Nagasaki und Kogoschima. Es wird auf dem Boden ausgebreitet, mit Händen und Füßen geknetet, in Körben gewaschen, dann zum Bleichen und Trocknen unter Bespritzen mit Wasser gleichmäßig ausgebreitet. Wenn ein zäher Saft auszutreten beginnt, wird kein Wasser mehr aufgespritzt. Man läßt dann eine Nacht liegen und trocknet. Das fertige Produkt ist also kein extrahierter Schleim, sondern wird von den verschleimten verschlungenen Thallusstücken gebildet. Es kommt in sheets (Blättern), die 4½ : 2½ Fuß lang sind, oder in Rollen in den[S. 310] Handel. Es löst sich fast ganz in kochendem Wasser (Pharm. Journ. 1906, Sept.). (Einige andere Algen, wie Chondrus spec. = tsuno-mata, Iridoea spec. = Ginantso, werden vorher in Wasser eingeweicht und erhitzt, dann mit Wasser bearbeitet und zum Trocknen ausgebreitet.)
Lit. Bereitung: DAVIDSOHN a. a. O. — HOLMES a. a. O., — Pharm. Zeit. 1907, 1078.
Beschreibung. In kaltem Wasser quillt Agar-Agar auf, in heißem löst es sich größtenteils zu einem klebrigen Schleim, der abgekühlt zu einer Gelatine erstarrt. Der Schleim wird durch Jod violett. Die Droge quillt in Kali stark, kaum in Kupferoxydammoniak.
Auf chinesischen Meeresalgen gefundene Diatomeen.
[Aus Villiers-Collin, Traité des alterations et falsifications. Doin et fils Paris.]
Im ungereinigten Agar-Agar finden sich neben plasmatischen und verkleisterte Florideenstärke enthaltenden Zellinhalten, die den einzelnen Algenzellen entsprechen, und intakten Zellen, besonders des Leitungsgewebes, stets zahlreiche Diatomeenschalen und Spongillennadeln (MARPMANN, SENFT, TUNMANN) (vgl. Fig. 107 u. 108). Man kann sich dieselben dadurch sichtbar machen, daß man einäschert, die Asche mit Salzsäure behandelt, sedimentieren läßt und das Sediment unter das Mikroskop bringt oder das Gelee mit Schwefelsäure und etwas Kaliumpermanganat dünnflüssig macht, sedimentieren läßt und das Sediment untersucht: Die besseren Sorten enthalten weniger Diatomeen und Spongillennadeln als die schlechten Sorten. Auf diese Weise kann man rohes, ungereinigtes Agar auch in Fruchtgelees nachweisen. Es finden sich namentlich Arten der Gattungen Cocconeis und Grammatophora, dann auch Arachnoidiscus und Campyloneis (SENFT), seltener die von MARPMANN angegebenen Amphiprora, Licmaphora, Stauroneis, Rhabdonema, Chaetoceras, Triceratium, Amphitetras und Biddulphia-Arten.[S. 311] Auf Gelidium fand MENIER Arachnoidiscus ornatus EHRB. Die Spongillennadeln sind einfache Nadeln oder Nadelsterne (TUNMANN). TUNMANN fand im Agar auch Kalkalgen Polypen und (von den Preßsäcken herrührend) Baumwolle und Hanffasern.
Lit. MENIER, Falsific. de l. gelée de groseille du comm. decouv. p. les Diatom. Nantes 1879. — MARPMANN, Über Agar-Agar und dessen Verwendung und Nachweis. Zeitschr. angew. Mikrosk. 2, 1897. — SENFT, Über Agar-Agar-Diatomeen. Zeitschr. Allg. öster. Apoth. Ver. 1902, 229 (mit Abbild.). — TUNMANN, Einige Bemerk. über Agar-Agar, Pharm. Centralh. 1909, 233. — Abbild. der Diatomeen auch in VILLIERS et COLLIN, Altérat. et falsificat. 1900, p. 833.
1. Grammatophora angulosa Ehrenb.: a Schalenseite. 2. G. oceanica Ehrenb. 3. G. oceanica f. macilenta. 4. G. serpentina Ralfs. 5. Arachnoidiscus ornatus Ehrenb. 6. Nicht punktierte Cocconeis. 7. Cocconeis Scutellum Ehrenb.: a obere, b untere Schalenseite. b f. minor. 8. Campyloneis Grewillei Grun. 9. Kieselnadeln.
[Senft.]
Chemie. Nach KÖNIG und BETTELS enthält lufttrockenes Gelidium cartilagineum in Prozenten: Wasser 13, Gesamt-N-Substanz 17, wasserlösliche N-Substanz 7,37, Ätherauszug 0,8, N-freie Extraktstoffe 40,16, Pentosane 3,35, Methylpentosane 0,91, Rohfaser 12,9, Asche 11,88, Chlornatrium 0,3. Durch Dämpfen wird in Wasser löslich: 9,37 anorganische und 54,22% organische Substanz. Nach GREENISH enthält Ceylonmoos 36,71% Gelose (s. unten). NAGAI und MURAI fanden in lufttrockenem Agar-Agar (Tungusa) in Prozenten 9,8 Stickstoffsubstanz, 52,2 stickstoffreie Extraktivsubstanz, 5 Rohfaser, 18,5 Wasser und 14,5 Asche. KELLNER fand nur 3,4% Asche. Auch bei den Agar-Analysen von GRESHOFF, SACK und VAN ECK finden wir große[S. 312] Schwankungen, in einem Falle 18,96%, im andern 2,89% Asche. DAVIDSOHN fand in bestem japan. Agar 21,79% Wasser, 5,95% N-haltige Subst., 64,59% Kohlehydrate, Gelose, 3,54% Zellulose, 4,13% Asche. GREENISH gibt in Agar 7 Kohlehydrate an: wasserlöslicher Schleim, Gallerte bildende Substanz, Stärke, Metarabin, Pararabin, Holzgummi, Zellulose. Die Zusammensetzung der «Strohhalmform» und der sog. «vierkantigen Form» des Agar unterscheiden sich nur wenig, sie enthalten (vgl. bei KÖNIG) 2,5 (6,1)% Protein, 0,85 (0,58)% Fett, 70,58 (63,96)% Kohlehydrate, 3,06 (3,18)% Pentosane, 0,44 (0,42)% Rohfaser, 3,46 (3,4)% Asche. KÖNIG und BETTELS fanden bei der Hydrolyse von Gelidium cartilagineum u. and. Gelidien: d-Galaktose, Fruktose und Pentosen. Die gleichen Zucker liefert Agar-Agar. Bei der Hydrolyse von Agar wird Zellulose abgeschieden und es scheint auch das dem Glukose-Dextrin entsprechende Anhydrid der Galaktose (Galaktan) aufzutreten (TOLLENS). Nach O’SHAUGHNESSY enthält Jafnamoos 54,5% Pflanzengallerte (Pektin), 15% Stärkemehl (?), 0,5% Wachs, 4% Gummi, 18% Faser und Salze. Ferner ist Jod darin gefunden worden (WONNEBERG und KREYSSIG). GREENISH fand 36,71% Gelose — daneben Metarabin (1,32%), Paramylan (6,52), Holzgummi (3,17), Zellulose (10,17).
Das Kohlehydrat des Agar-Agar wurde als Gelose (PAYEN 1859) bezeichnet und zur Pektingruppe gerechnet. Gelose ist nicht identisch mit Fucin, Lichenin, Pararabin. Bei der Hydrolyse liefert Gelose u. a. Arabinose (GREENISH). Reine Gelose gibt noch 1 : 500 eine steife Gallerte und unterscheidet sich von der tierischen Gelatine dadurch, daß sie von Tannin nicht gefällt wird, vom Carrageenschleim, daß sie gelatiniert, und vom Gummi, daß sie sich nicht in kaltem Wasser löst. Das Gelosin GUÉRINS (1886), das zu 20% aus Gelidium corneum erhalten werden kann und dem Fucin und der Pektose nahestehen soll, ist wohl identisch mit Gelose. Nach PAYEN stimmt die Gelose von Agar-Agar mit der des Jafnamoos überein. MORIN und PORUMBARU gaben ihr die Formel C6H10O5. Sie wird durch Jod rotviolett. Agar-Agar liefert bei der Behandlung mit HNO3 Schleimsäure und Oxalsäure. Es enthält also ein Galaktan (GREENISH, MORIN, BAUER). Bei der Oxydation lieferte Agar Strohhalmform 25,44–25,91%, Agar vierkantige Form 27,06% Schleimsäure — entsprechend 33,05–36,57% Galaktose. Ein wesentlicher Bestandteil sowohl des Agar-Agar wie des Ceylonmoos (REICHARDT, GREENISH) ist, wie es scheint, das Pararabin (C12H22O11)n. Pararabin quillt in Wasser und besitzt im Gegensatz zur Arabinsäure keine sauren Eigenschaften. Bei längerer Berührung mit Alkalien geht es in Arabinsäure über. Das Pararabin des Agar-Agar liefert bei der Hydrolyse Galaktose (BAUER), das des Ceylonmoos Galaktose und d-Glukose (GREENISH). Bei der Hydrolyse des Nori (s. oben) wurde l-Galaktose, d-Mannose, Glukose und etwas Fucose erhalten (OSHIMA und TOLLENS). Es enthält also Mannan. Nach TOLLENS enthält Agar 1,66% der Trockensubstanz Pentosan.
Die wichtigsten Gelatine gebenden Algen und aus Algen gewonnenen Substanzen zeigen folgendes Verhalten (STANFORD). Mit 1000 T. Wasser geben eine Gelatine:
|
Von
|
Teile
|
Also Proportion
|
Die erhaltene Gelatine
schmilzt bei |
|
Gelose aus China
|
4
|
1
|
31,0°
|
|
Gelidium corneum
|
8
|
2
|
31,0°
|
|
Chondrus crispus
|
8
|
7,5
|
26,5°
|
| [S. 313]
Hausenblase
|
32
|
2
|
21,0°
|
|
Gelatine
|
32
|
2
|
15,0°
|
|
Caragheenin
|
36
|
9
|
21,0°
|
|
Agar-Agar
|
60
|
15
|
31,0°
|
Lit. Ältere chem. Unters. des Fucus amylaceus und Agar in PEREIRA, Heilmittellehre, zitiert. — O’SHAUGHNESSY, Ind. Journ. of med. sc. Calcutta 1834 und London, Med. Gaz. 1837, 566, Royal. Med. Bot. Soc. 1837, 618. — SIGMOND and FARRE, On the Ceylonmos 1840. — BLEY, Jahrb. f. pr. Pharm. 1843. — RIEGEL, Ebenda. — KREYSSIG u. WONNEBERG, Artus allgem. pharm. Zeitschr. Heft 1. — GONNERMANN u. LUDWIG, Arch. d. Ph. 111, S. 204, — GUIBOURT (1842). — ARCHER u. SIMMONDS, Pharm. Jahresber. 1854, 10. — MARTIUS, Ebenda 1858 u. N. Jahrb. f. Pharm. 1858. — PAYEN, Ebenda 1860, 13. Sur la Gelose Compt. rend. 1859, 523. — HANBURY, Note on manufactur. prod. of sea-weed called japanese ising glass. Ph. Journ. (2), 1, 1859, 508 und Science papers 206. — REICHARDT, Arch. d. Pharm. 209 (1876), 107. Ber. d. chem. Ges. 8, 807. — H. G. GREENISH, Pharm. Zeitschr. f. Rußl. 20, 501. Ber. d. chem. Ges. 1881, 2253 und 1882, 2243. Chem. Centrbl. 81, 649. — Derselbe, Die Kohlehydrate von Fucus amylaceus. Arch. d. Pharm. 17, 241, 321. Dort die ältere Literatur. — MORIN, Compt. rend. 90 (1880), 924, Bull. soc. bot. france (2), 1. — PORUMBARU, ibid. p. 1081. — BAUER, Journ. pr. Ch. 30 (1885), 367. N. Zeitschr. f. Rübenzuckerind. 14, 154. — OSHIMA u. TOLLENS, Ber. d. chem. Ges. 34 (1901), 1422. — COOKE, Pharm. Journ. 1860. 504. — HOLMES, Pharm. Journ. IX (1878), 45. — TOLLENS, Kohlenhydrate und Journ. Landw. 1896. — FLÜCKIGER-HANBURY, Pharmacographia. — VOGL, Kommentar. — PEREIRA, Handbuch. — PORTER-SMITH, Contrib. t. Mat. med. etc. of China. Shanghai 1871. — OUDEMANS, Haaxm. Tijds. 1856 u. Arch. d. Pharm. (2) 87, 283 (mit Tafel). — STANFORD, Algin, Chem. Zeit. 1885. — KELLNER, Jap. chem. anal. of a collection of agric. specim. Intern. agr. exhib. New Orleans 1884. — NAGAI und MURAI, Jap. intern. health. exhib. London 1884, Catal. — KÖNIG und BETTELS, Die Kohlehydrate der Meeresalgen und daraus hergestellte Erzeugnisse. Zeitschr. Unters. d. Nahrungsm. 10. — KÖNIG, Nahrungsm.
Anwendung. Agar-Agar wird etwas in der inneren Medizin, viel zu Gelees, (Ersatz der Gelatine), dann (zum Teil mit Gelatine gemischt) zur Herstellung von Nährgelatine für bakteriologische Zwecke — sie bleibt auch bei c. 40° noch fest und und in der Industrie als Appretur und für Stempelkissenmasse benutzt; neuerdings in der chirurgischen Praxis als Prothese (KRAMER). Auch (das gepulverte) für Vaginalkugeln, Stuhlzäpfchen und Medizinalstäbchen. Zu arzneilichen Zwecken empfahl es zuerst PREVITÉ anfangs der vierziger Jahre des XIX. Jahrh. Die Mikroskopiker benutzen sie als Einbettungsmittel. In Japan und China werden die vierkantigen Stücke zu Gelees, Süßigkeiten usw., die schmalen Streifen im Haushalt wie Stärke, z. B. zum Stärken, Nori auch zum Leimen des Papiers und der Laternen benutzt. Die Gallerte aus Ceramium Loureirii AG. wird als Nahrungsmittel und bei Brustkrankheiten gebraucht (DRAGENDORFF). Agar dient auch zur Appretur feiner Gewebe, denen man einen geschmeidigen Griff geben will.
Lit. HEILMANN, Bull. soc. ind. Rouen 1875, 263. — DINGLERS Polyt. Journ. 218, 522. — DRAGENDORFF, Heilpflanzen. — SENFT, Über einige in Japan verwendete vegetabil. Nahrungsm. usw. Pharm. Praxis 1906 und 1907. — WATT, Diction. econ. prod. IV, 174. — MASON, Burma and its People. — BALFOUR, Ciclop. I — Pharmacogr. indica III, 635 u. 638 (dort die Verwend. in d. Technik). — DYMOCK, Veg. mat. med. West. ind. — Verwend. in d. Chirurgie: KRAMER, Mercks Bericht 1901.
An dieser Stelle mag auch der in Ostasien als Leckerbissen hochgeschätzten Salanganen-, Tunkin- oder indischen Vogelnester gedacht werden, da dieselben auch noch neuerdings (DRAGENDORFF 1898, LEUNIS, KARSTEN) mit den Meeresalgen in Beziehung gebracht werden. Sie haben aber mit denselben nichts zu tun, denn sie werden von Turmschwalben der[S. 314] Gattung Collocalia (bes. C. fuciphaga, esculenta und nidifica) aus einem von den Vögeln ausgewürgten Schleime aufgebaut, der von zwei Speicheldrüsen sezerniert wird, die sich während der Brutzeit zu einer bedeutenden Größe entwickeln (MARSHALL). Sie enthalten Neossin, eine dem Mucin verwandte Substanz (KÖNIG und BETTELS). Nach den Analysen von GRESHOFF, SACK und VAN ECK enthalten die Salanganennester im Mittel 55,57% «Protein» (neben 0,6% Fett, 7,16% Asche und 18,63% Wasser). Sie gehören also eigentlich zu den Mucindrogen (neben den tierischen Leim).
2. Schleime der sekundären Membran.
Schleime in Vegetationsorganen und Blüten von Phanerogamen.
a) Schleime in Samen.
1. Schleimepidermen.
Zu den Drogen, welche Schleimepidermen an der Samenschale besitzen, die also auch, ohne zertrümmert zu werden, mit Wasser einen Schleim liefern, gehören in erster Linie die Samen von Linum usitatissimum und Cydonia vulgaris, dann die Flohsamen von Plantago Psyllium; ferner die Samen zahlreicher Cruciferen (z. B. Sinapis, Brassica), endlich die von Collomia grandiflora, Citrullus Colocynthis und einiger Acanthaceen und Polemoniaceen (HOFMEISTER) (und die Pericarpien einiger Labiaten, z. B. Salvia Hormium, Ocymum Basilicum).
Hier werden nur Linum, Cydonia und Psyllium abgehandelt, die Cruciferensamen unter den Glykosiddrogen. Die Schleimepidermen der Samenschalen dienen dadurch, daß sie außerordentlich viel (s. Cydonia) Wasser zurückzuhalten vermögen und den keimenden Samen im Boden befestigen, zur Sicherung der Keimung, wie Versuche von LÜDTKE und mir bei Linum (1889) gezeigt haben, scheinen aber auch für die Ernährung des keimenden Samens von Bedeutung zu sein (RAVENNA und ZAMORANI 1910).
Semen Lini.
Syn. Leinsamen, Flachssamen (Glix im Oberengadin), liri, giglio rosso (im Tessin) — semence ou graine de lin (usuel) (franz.) — lin (commun), flax (linseed) (engl.) — lino (ital.) — lijn (holl.) — lenmag (ung.) — linfrö (schwed.) — pellavan (fin.) - λίνον, λινάρι (n.-griech.). — Im Ägyptischen hieß der Lein sꜢrἰ, Leinsamen dšr, psn. Bei DIOSKURIDES stehen in [] noch die Synonyma: linokalamis, annon, linon agrion, bei den Römern: linomyrum, linum agreste, bei den Afrikanern: zeraphoïs. — Bei IBN BAITHAR (arab.): kattān (bazr al kattān = sem. lini — «Elbazr heißt der Same jeder Pflanze», sagt ABU HANIFA) — kutan, zaghu (pers.) — atasí (sansc.), masina (beng.) — alsí, tisí (hind.) — alishi virai (tam.). — Wu-ma, Hu-ma-jin, Hsiao-hu-ma-ta-ku-ma (chin.).
Etym. «Der Name Lein gehört sicher zum uralten Sprachgut der europäischen Indogermanen und es kann demnach auch nicht zweifelhaft sein, daß der Flachsbau den germanischen Völkern schon in der Urzeit bekannt war» (HOOPS). kelt. lin (= Faden), goth. lein-jô — angels. lêne — ir. lín — cymr. llin — ad. lína — ahd. lîna — mhd. lyn (so im Gothaer Arzneibuch, neben vlas), lyne, leyne — lat. lînum — griech. λίνον. Bei der HILDEGARD: linsamo, linsame; bei MEGENBERG (I, S. 693): linsât. Der Stamm ist li. Schon in vorhistorischer Zeit finden sich in den Sprachen der europäischen Indogermanen Ableitungen von dieser Wurzel, welche Flachs und primitive Gewebe bezeichneten (SCHRADER). Vgl. auch I, S. 1059. Flachs (mehr für die Fasern wie für die Pflanze in Gebrauch), von der indogerm. Wurzel plek = flechten (gr. πλέκειν) — ahd. flahs — mhd. vlahs, vlaes — ag’s. fleax — nd. flaß — Flachs auch[S. 315] im Ort. sanitat. — Endlich auch (bes. für die Faser): ahd. haro, hara; mhd. har; nhd. haar; anord. horr = Haar. — Die im Altertum viel gebräuchliche Bezeichnung carbasos ist vielleicht (PLINIUS) iberischen Ursprungs und steht mit dem sansc. karpasam (pers. kirbas, korfas), das ursprünglich Baumwolle bedeutete (s. Gossypium, S. 229) in Verbindung.
Stammpflanze Linum usitatissimum L. (Spec. plant. ed. I 277).
Man unterscheidet die Kultur-Varietäten: Lin. usit. var. crepitans SCHÜBL. et MART. (L. usit. β humile MILL., L. crepitans BOENNINGH.), den sog. Klanglein, Klenglein oder Springlein (arab. kettân), mit niedrigerem, mehr verzweigtem Stengel, größeren, mit Geräusch aufspringenden Kapseln und hellbraunem Samen. — L. usit. var. (oder forma) vulgare SCHÜBL. et MART. (L. u. forma indehiscens NEILR., L. vulgare BOENNINGH.), der sog. Schließlein oder Dreschlein mit höheren, weniger ästigen Stengeln und geschlossen bleibenden kleineren Kapseln. — L. usit. var. (forma) β. hiemale A. DC. (L. bienne MILL.), zweijährig, mit zahlreichen gekrümmten Stengeln. — Zwischen den Hauptrassen steht als Übergangsform Lin. ambiguum JORDAN. — Nahe verwandt ist Lin. angustifolium HUDSON (s. weiter unten), das von den kanarischen Inseln über das Mittelmeergebiet bis zu den Alpen, zum Balkan, Kaukasus und Libanon und bis nach England verbreitet ist. Möglicherweise sind dies alles Rassen oder Formen einer Art (DE CANDOLLE). Wild ist Linum usitatissimum nicht mehr nachzuweisen (WETTSTEIN 1903).
Systemat. Stellung. Linaceae, Lineae — Eulinum.
Beschreibung der Stammpflanze. Der Lein ist ein ein- oder zweijähriges Kraut. Der stielrunde, einfache oder verästelte, bis 1 m hohe Stengel ist kahl und innen hohl. In der schmalen Rinde desselben liegen, die Rinde fast ausfüllend, zahlreiche Bündel langer Bastfasern. Sie liefern die Leinfaser (vgl. S. 254 und die Theorie der Flachsröste). Die spiralig angeordneten Blätter sind schmal lanzettlich, beiderseits verschmälert, sitzend. Der Blütenstand ist ein Wickel. Die aktinomorphen, pentazyclischen, pentameren, nur einen Vormittag blühenden, an naßkalten Tagen sich überhaupt nicht öffnenden Blüten besitzen einen fünfblättrigen, 5–6 mm langen, grünen, quincuncial deckenden Kelch, dessen Blätter oblong-eiförmig und an den Rändern zart gewimpert sind. Die fünf umgekehrt-eiförmigen, kurz genagelten, oben etwas gekerbten, bis 13 mm langen, schön blauen, etwas dunkler geaderten Blumenblätter besitzen eine gedrehte Knospenlage, die fünf episepalen, am Grunde ringförmig verbundenen Stamina besitzen blaue Antheren. Auch die Filamente sind im oberen Teil blau. Die Antheren sind in der Mitte des Rückens aufgehängt. Die Pollenkörner sind ellipsoidisch und besitzen drei meridionale Längsfalten. (Man findet sie bisweilen im Honig, vgl. VILLIERS et COLLIN, Altérat. et falsificat.) Zwischen den fertilen Staubfäden sitzen fünf epipetale Spitzchen, die als Staminodien aufzufassen sind. Auch die fünf schlanken, keulenförmigen, anfangs links zusammengedrehten Griffel sind blau — so dass die leider sehr vergängliche Blüte einen außerordentlich lieblichen Anblick gewährt.
Linum zeigt oft Selbstbestäubung. Der Fruchtknoten ist eiförmig und kahl. Er wird von fünf epipetalen Fruchtblättern gebildet. Da die Außenwand derselben aber nach innen zu eine Längsleiste, eine sog. falsche Scheidewand bildet, erscheint der Fruchtknoten zehnfächerig und enthält denn auch 10 Ovula, in jedem echten Fache zwei. Die bis zur Reife vom Kelche umhüllte FRUCHT (Flachsknoten) ist eine 7–8 mm lange, fast kugelige Kapsel, die je nach der Varietät entweder wand- oder fachspaltig aufspringt (Springlein s. oben) oder geschlossen bleibt (Schließlein s. oben).
Lit. REICHE in ENGLER-PRANTL, Pflanzenfamilien (dort die botan. Lit. d. Familie).
[S. 316]
Abbild. NEES V. ESENBECK, Pl. med. 389. — HAYNE, Arzneigew. VIII, t. 17. — BERG-SCHMIDT, Atlas, 2. Aufl. t. 102 (dort die systemat. Lit.). — PABST-KÖHLER, Medizinalpfl. — BENTLEY-TRIMEN, Medic. plants t. 39 u. in zahlr. and. Werken.
Pathologie. Über die pflanzlichen Schädlinge berichtet Prof. ED. FISCHER: Unter den Parasiten, welche den Flachs schädigen, ist vor allem Cuscuta Epilinum WEIHE, die Flachsseide, zu erwähnen, welche mit ihren fast fadenförmig dünnen Stengeln den Stengel ihres Wirtes umwächst und Haustorien in denselben entsendet. — Gefährliche Pilzkrankheiten sind besonders die sog. Flachsmüdigkeit oder Flachswelke, hervorgerufen durch Fusarium Lini BOLL. und der Flachsbrand, dessen Urheber eine Chytridiacee, Asterocystis radicis MARCHAL ist, die sich in den Wurzelzellen ansiedelt. Beide Parasiten können den Flachs zum Absterben bringen. (BOLLEY, H. L. in North Dacota Agric. Coll. Gov. Experim. Stat. Bulletin No. 50, 1902 und No. 55, 1903. MARCHAL, E., Recherches biologiques sur une Chytridinée parasite du Lin. Bull. de l’Agric. Belg. 1901). Neuerdings wird als arger Schädling auch der Flachsrost, Melampsora Lini (PERS.) DESM., genannt. Die Krankheiten des indischen Lein in WATT, Dictionary.
Über die tierischen Schädlinge berichtet ISRAËL:
1. Käfer: Den Leinfeldern fügen mehrere Halticaarten, besonders wenn die Pflanzen noch jung sind, erheblichen Schaden zu.
2. Falter: Plusia gamma L. Die Raupe dieser gemeinsten aller Eulen ist polyphag. Sie lebt unter anderen auf Leontodon, Urtica, Beta, Trifoliumarten usw. 1899 traf ich sie verheerend auf Leinfeldern im Odenwalde, woselbst sie hauptsächlich die unreifen Samenkapseln verzehrte. Auch auf Radiola linoides, Linum perenne und catharticum fand ich dieselbe fressend. Mamestra pisi L. Die polyphage Raupe lebt auch auf Linum usitatissimum. Calocampa exoleta L. Die fast polyphage, prachtvolle Raupe lebt auf den verschiedensten Pflanzen. Sie ist sehr häufig von Parasiten bewohnt. Ich traf sie außer auf Linum usitatissimum auf Phragmites, Typha, Euphorbia Esula und Cyparissias, Lamiumarten, Leontodon, Cytisus sagittalis, Sarothamnus, Gartenrhabarber, Lactuca sativa und vielen anderen Pflanzen. Conchylis epilinana ZELL. Die kleine Raupe lebt nach TASCHENBERG in den Samenkapseln von Linumarten. Ferner werden genannt: Engerlinge und die Made der Flachsfransenfliege (Thrips linaria UZEL).
Im gepulverten Leinsamen findet sich oft die Milbe Glyciphagus domesticus GEER. Einige Zeit aufbewahrtes Leinmehl enthält nach meinen Erfahrungen, wenn es nicht ganz trocken ist, immer Milben. Auch TUNMANN beobachtete sie (Pharm. Centralh. 1906). Er nennt besonders Glyciphagus spinipes C. L. KOCH und G. domesticus. Die Milben fressen in erster Linie den Schleim.
Kultur und Handel. Der Lein verlangt feuchte Wärme mit häufigem Wechsel zwischen Wärme und Feuchtigkeit. Er verträgt weder große Hitze noch Dürre, noch Fröste. Er gedeiht am besten an Seeküsten, in Niederungen und Gebirgen mit vielen Niederschlägen oder reichlichem Tau und Nebel auf flachgründigem, feuchtem Boden. Der Lein wird sowohl im subtropischen wie im gemäßigten Klima gebaut. Seine nördliche Grenze fällt im allgemeinen mit der der Gerste zusammen, ja geht in einigen Gegenden noch weit über den Polarkreis hinaus (SCHÜBELER), wo der Getreidebau bereits zurückbleibt. Als Gespinstpflanze wird der Lein sowohl als bäuerliche Hauspflanze im Kleinbetrieb, wie auch als Industriegewächs im Großen gebaut. Es bauen Lein: Mitteleuropa (bis 1500 m), Rußland, Ägypten, Algier, Abessynien (bis 3300 m), Ostindien (die kälteren Gegenden), Nordamerika, Argentinien, Uruguay, Brasilien, Australien. Besonders viel baut Belgien (Westflandern, Ostflandern und Namur), wo c. 600000 ha mit Lein bestellt sind, dann das nördliche europäische Rußland, Irland, Holland (I, S. 67), Preußen, Thüringen, Schlesien, Österreich (Böhmen, österr. Schlesien, Kärnthen, Tirol), Frankreich und Italien. In der Lombardei wird Lein wegen der Fasern, in Apulien der Samen wegen kultiviert (RAVASINI).
Der Anbau erfolgt hauptsächlich zum Zwecke der Gewinnung der Leinfaser und zu diesem Zwecke wird (besonders seit den siebziger Jahren des vorigen Jahrhunderts)[S. 317] fast ausschließlich der einjährige Schließlein (s. oben) gebaut. Die Länder, die Leinsaat (d. h. keimfähige Leinsamen zur Aussaat für Faserflachs liefern), wie in erster Linie Rußland (Riga, Pernau), dann neuerdings auch Tirol (Ötzthal) und Holland bauen daher jetzt nur diesen. Aus russischem Saatgut in erster Aussaat in Deutschland erhaltenen Leinsamen nennt man Rosenlein. Dort, wo der Lein der Samen wegen, d. h. zur Gewinnung von Ölsaat im Großen gebaut wird, kultiviert man dagegen den Springlein (s. oben). Leinsamen liefert jetzt vornehmlich Argentinien und Südrußland, dann Indien, die russischen Ostseeprovinzen, Belgien, Ägypten und Nordamerika, weniger Japan, Marocco, Österreich, Deutschland und Holland. Vom Schließlein unterscheidet man die keimfähigen, also als Saatgut benutzbaren Samen, die Leinsaat (s. oben) — nur diese ist für pharmazeutische Zwecke brauchbar — und die nicht keimfähigen, nur zur Ölgewinnung tauglichen Samen, die vor völliger Reife gesammelt wurden oder ihre Keimfähigkeit wegen langen Lagerns verloren haben, die Schlagsaat. Der Lein wird nämlich in vielen Gegenden, um eine gute Faser zu erzielen, vor der Reife der Früchte aus dem Boden gezogen. Schließlein muß natürlich gedroschen werden.
Zur Gewinnung des Öls wird meist Schlagsaat verwendet, für die feinsten Sorten aber eigens gebauter Springlein. Dieser ist auch, neben der Leinsaat, für pharmazeutische Zwecke allein anzuwenden, eventuell ausgereifte Samen, die ihre Keimkraft verloren haben. Unausgereifte Samen sind auszuschließen. Die Kultur von Lein zur Linseed- (Flaxseed-)Gewinnung ist in Indien, wo fast nur Samen und nur sehr wenig Fasern produziert werden, beträchtlich. Schon 1887 waren über 3½ Mill. Acres zu diesem Zwecke mit Lein bestellt. Besonders viel baut Bengalen und die Zentralprovinzen, weniger Berar, die Nordwestprovinzen und Oudh, Bombay und Sind, am wenigsten Panjáb, Madras und Burma (WATT). In Indien unterscheidet man whit-seeded und red-seeded, d. h. hellgelbe und rotbraune Samen.
Die Ausfuhr Indiens an Linseed nach England (und englischen Besitzungen) betrug 1907/08: 2290185, 1908/09: 1405467 cwts; nach anderen Ländern: 1907/08: 3907697, 1908/09: 1804080. Besonders Frankreich ist Abnehmer indischer Leinsaat. Es empfing 1908/09 c. 1 Mill. cwts.
Deutschland importierte 1909: 4368667 dz Leinsamen, vorwiegend aus Argentinien (3708478), dann aus dem europ. Rußland und brit. Indien, weniger aus Uruguay, den Ver. Staaten und Japan, Marocco, Österreich und den Niederlanden und exportierte 68280 dz, besonders nach den Niederlanden, Dänemark und Norwegen.
Frankreich führte 1908: 1876721 Quintal. Leinsamen ein, vorwiegend aus Argentinien (1138909 Quint.) und engl. Indien, dann auch aus Rußland, den Ver. Staaten, Uruguay, Tunis, Marocco und Algier. Von europäischen Staaten lieferte besonders Belgien viel, dann die Niederlande.
Die Einfuhr von Linseed in die Ver. Staaten von Nordamerika betrug 1909: 597671 bushels. Die Ausfuhr 1908: 4277313, 1909: 882899 bushels.
Die wichtigsten Handelssorten sind jetzt: Russischer Leinsamen und zwar baltischer (baltic linseed) und südrussischer oder asowscher (black sea linseed). Der reinste ist der baltische. Er liefert auch das am besten trocknende Öl. Der südrussische enthält 5% und mehr Hanf- und Ravisonsamen. Russischer L. enthält 32–38% Öl. Argentinischer L., sog. La Plata-Saat, neuerdings in großer Menge im Handel, aber ziemlich unrein (Unkrautsamen, Pflanzenfasern) mit 35–36% Öl. Indischer L. (s. oben), auch ziemlich unrein (s. hinten), mit 37–41% Öl. Marocco L., Canadischer L., Nordamerikanischer L. in geringer Menge.
Maroccoleinsamen (jetzt als Medizinalleinsamen viel im Handel) wird in Säcken à 100 kg gehandelt (JUL. GROSSMANN).
[S. 318]
Leinsamen wird leicht ranzig. Er sollte nicht über ein Jahr aufbewahrt werden.
Lit. LANGER, Flachsbau. Wien 1893. — KNIGHT, Flax and Linseed industry. Journ. Dep. Agr. Victoria 1906. — SCHINDLER, Flachsbau in Rußland 1898. — WIESNER, Rohstoffe. — T. F. HANAUSEK, Ebenda. — WATT, Diction. econ. pr. of India. — SCHÜBELER, Viridar. norwegic. II (1888), 439. — Über die Leinsamen-Sorten vgl. NOBBE, Handb. d. Samenkunde. HOLMES, The varieties of linseed in english commerce. Pharm. Journ. 12 (1881). — Über den Umfang, Zunahme und Rückgang des Leinbaus finden sich Zahlen in der Zeitschrift «Flachs und Leinen». Wien u. Trautenau. — Karte der Verbreitung der Flachskultur in SCOBEL, Handelsatlas.
Morphologie der Droge. Die Leinsamen sind flachgedrückt-eiförmig, 4–6,5 mm lang (europäische meist etwa 5 mm), 2,5–3 mm breit und 1–1,5 mm dick. Die größten finden sich bei indischen Sorten. Europäische Leinsamen wiegen meist 0,004 bis 0,0054 g. Doch schwankt das Gewicht (wie die Größe) nach den Sorten. Russische L. wiegen oft 0,01, türkische 0,009. Die Durchschnittssorte Mitteleuropas wiegt 0,0047, weiße indische von Malva 0,0088, gelbbräunliche von Indore (Zentralindien) 0,0093 (FLÜCKIGER), schwedische 0,004, dalmatinische 0,0053, persische 0,0054 (HARZ). HOLMES fand (1881), daß von russischem, holländischem, englischem und Calcutta-Lein 12–14 Stück auf 1 grain gehen, von großem Calcutta, Bombay, Sizilischem und Lein von den ionischen Inseln 6–7 Stück auf 1 grain (= 64,8 mg). Der Handel unterscheidet klein- und großkörnigen Lein. CAESAR und LORETZ führen jetzt auch (zum Kauen) eine Sorte von der doppelten Größe der kuranten deutschen Samen.
Sie sind an dem unteren Ende abgerundet, am oberen durch eine Caruncula (crista) genabelt Fig. 109, 3 X) und unterhalb der stumpfen, etwas schiefen Spitze, dort, wo das als feiner Punkt sichtbare Hilum liegt, leicht eingedrückt. Die glatte (infolge der eingetrockneten Schleimschicht), glänzende, dünne und spröde Schale ist meist gelbbraun bis dunkelrotbraun gefärbt, beim Springlein heller; bei den whit seeds Indiens gelb, bei den red seeds lichtbräunlich. Sie erscheint, mit der Lupe betrachtet, sehr feingrubig infolge der von der Sclereïdenschicht (s. unten) gebildeten kleinen flachen Mulden. Die Raphe läuft vom Hilum aus an der schmalen Kante entlang bis zu der äußerlich nicht sichtbaren, am abgerundeten Ende liegenden Chalaza.
Linum usitatissimum L.
1 Querschnitt und 2 Längsschnitt durch den Fruchtknoten, 3 Same von außen, 4 Same parallel der Fläche und 6 rechtwinklig dazu längsdurchschnitten, 5 Same in der Mitte querdurchschnitten, 5 a und 5 b Same oben querdurchschnitten, 7 Same an der Kante querdurchschnitten.
[Tschirch-Oesterle, Atlas.]
[S. 319]
In Wasser gelegt umgibt sich der Leinsamen rasch mit einer hyalinen Schleimhülle, da die Schleimepidermis (s. unten) stark quellbar ist. Spaltet man den Samen der Länge nach parallel der Fläche auf, so sieht man die herzförmigen Cotyledonen (Fig. 109, 4), die die Hauptmasse des Samenkernes ausmachen und in der Spitze des Samens die kurze kegelige Radicula (Fig. 109, 4); spaltet man ihn parallel den Schmalseiten, so erblickt man mit der Lupe zwischen Radicula und Cotyledonen die kleine Piumula. Durchschneidet man ihn in der Mitte quer, so sieht man, daß die plankonvexen Cotyledonen nur von einem schmalen Endosperm umgeben sind (Fig. 109, 7).
Linum usitatissimum L.
1–4 Entwicklung der Samenschale. Querschnitt, ia äußeres, ii inneres Integument. 5 Nährschicht (bei Nr. 4 zusammengefallen). 5 Längsschnitt durch Samenschale und Endosperm.
[Tschirch-Oesterle, Atlas.]
Anatomie. Die Samen gehen aus hängenden, anatropen Ovulis hervor, deren Mikropyle nach außen und oben gewendet ist und von einem papillösen Pollenzuführungsapparat überdeckt ist (Fig. 109, 2 X), der, aus dem Funiculargewebe hervorgehend, später zur Caruncula wird, die das Spitzchen des Samens (s. oben) bildet. Das äußere Integument liefert die Schichten 1 und 2 der Samenschale, das innere die Schichten 3–6 (Fig. 110). Das äußere bleibt zunächst zweischichtig und wird dann durch Teilung der inneren Zellreihe dreischichtig, das innere Integument vergrößert sich stark und die Zellen füllen sich mit Stärke. Es wird zur Nährschicht (TSCHIRCH). Bei der Weiterentwicklung entleeren sich die parenchymatischen Zellen aber wieder in dem Maße wie sie ihre Reservestoffe an die sich verdickenden Hartschichten[S. 320] zum Aufbau der Membranen abgeben und im reifen Samen besteht die Nährschicht fast nur aus der äußeren und inneren Epidermis. Das ganze mittlere Gewebe ist zu einer hyalinen Schicht zusammengefallen oder ganz resorbiert. Der Schleim ist auf die Epidermis beschränkt (Schleimepidermis TSCHIRCH). Er wird direkt als Membranschleim aber ziemlich spät, erst wenn der Embryo schon Grünfärbung zeigt, angelegt, vorwiegend an der Außenseite unter der Cuticula und den Seitenwänden, gar nicht auf der Innenwand. Stärkekörner, die in den Schichten 1 und 2 auftreten, liefern das Baumaterial. Die Schleimmembran besteht aus drei Schichten: einer hyalinen Stäbchenschicht, deren Struktur erst bei der Quellung sichtbar wird, einer körnigen Zone und der sehr breiten, beim Quellen deutliche Schichtung zeigenden Hauptschicht (Details in TSCHIRCH-OESTERLE, Atlas). Beim trockenen Samen ist die Schleimepidermis stark zusammengefallen (die primären, Zellulosereaktion gebenden, Trennungsmembranen wellig verbogen). Beim Einlegen in Wasser quillt sie stark, oft auf das fünffache, die primären Membranen strecken sich und die Zellen erscheinen nun prismatisch; schließlich platzt die Cuticula und der Schleim tritt aus. Am leichtesten löst sich die körnige Mittelschicht, dann folgt die breite geschichtete Partie, am längsten widersteht die Stäbchenschicht. Sie löst sich bisweilen mit der Cuticula zusammen spiralig ab (Details bei KORAN). Die Verhältnisse lassen sich am besten an Tuschepräparaten studieren. Von der Fläche gesehen erscheinen die Zellen der Schleimepidermis polyedrisch. Die Stäbchenschicht macht sich durch feine Körnelung bemerkbar (Fig. 110 u. 111, 4 a). Wenn man einen Samen mit Wasser schüttelt — am besten unter Hinzufügen von Glasperlen —, so löst sich die ganze Schleimepidermis los und der Schleim verteilt sich im Wasser. Die zweite, aus der zweiten Zellschicht des äußeren Integumentes hervorgehende, Schicht ist meist zweireihig, auf der Rapheseite fünfreihig. Ihre Zellen sind etwas verdickt, in der Flächenansicht erscheinen sie rundlich (Fig. 111, 2). Interzellularen sind reichlich vorhanden. In dieser Schicht verläuft das Raphebündel. Von den beiden Epidermen des inneren Integumentes wird die äußere zur Sklereïdenschicht. Im Querschnitt des reifen Samen erscheinen die reichgetüpfelten Sklereïden verschieden hoch, je nachdem sie an den Kanten oder Flächen des Samens liegen, auch verschieden stark verdickt (Fig. 110, 3). Stets sind sie in der Längsrichtung des Samens gestreckt Fig. 111, 3 u. 3 a), bis 250 mik lang und c. 10 mik breit. Die Außenlinie der Sklereïdenschicht zeigt Mulden (s. oben). Die innere Epidermis des inneren Integumentes wird zur Pigmentschicht, deren Zellen im reifen Samen tangential gestreckt, dickwandig und getüpfelt sind und einen mit Eisenchlorid blauschwarz werdenden Phlobaphenballen enthalten, dessen braunrote Farbe die Farbe der Samenschale bedingt. Bei den hellen indischen Leinsamen fehlt diese Pigmentschicht.
Das Endosperm ist schmal, nur wenige Zellreihen breit an den Flächen des Samens, an den Kanten und dort, wo die Radicula liegt, breiter. Die COTYLEDONEN bestehen aus zarten Zellen, deren Wände (ebenso wie die der Endospermzellen) durch Jod gebläut werden, also Amyloid enthalten. Die Palissadenseiten der beiden Blätter liegen auf der Innenseite, also einander gegenüber. Das Mesophyll ist von Procambiumsträngen durchzogen. Die Zellen der Cotyledonen enthalten meist 2–5 große, etwa 10–19 mik lange und zahlreiche sehr kleine Aleuronkörner. Nach LÜDTKE beträgt die Größe der großen elliptischen Aleuronkörner 10,5 mik in der Randpartie der Cotylen, 15 mik im übrigen Cotyledonargewebe und dem Endosperm. Meist sind bei den größeren Körnern ein Globoid und ein oder mehrere undeutlich eckige, durch Jod sich stark[S. 321] gelb färbende Kristalloide vorhanden, neben Grundmasse und deutlicher Hüllhaut. Eingebettet sind die Aleuronkörner in eine Grundmasse, die sich beim direkten Einlegen in Osmiumsäure gleichmäßig braun färbt und die ich als Ölplasma bezeichnet habe. Die Aleuronkörner des Endosperms weichen etwas von denen der Cotyledonen ab. Sie sind häufig lappig. Der Keimling enthält auch Zucker (RASPAILsche Reaktion).
Die Keimung, bei der zuerst das Endosperm entleert wird, erfolgt epigä. Die Schleimepidermis der Samenschale — und dies ist in erster Linie ihre Funktion — klebt hierbei den Samen am Boden fest und sichert das Eindringen der Wurzel in den Boden (TSCHIRCH und LÜDTKE, vgl. auch oben S. 314).
Das Pulver. Der Leinkuchen (farina lini, placenta seminis lini), entweder der gemahlene oder der gemahlene und ausgepreßte Leinsamen (Preßkuchen), der Preßrückstand der Leinölfabrikation, zeigt alle Elemente des Samens mehr oder weniger zerkleinert. Schon mit bloßem Auge lassen sich die braunen Samenschalfragmente von den hellgelblichen der Cotyledonen unterscheiden. Bei den Samenfragmenten (Fig. 111) fallen besonders die getüpfelten, quadratischen, mit rotbraunem Inhalt versehenen Zellen der Pigmentschicht (Fig. 111, 6) und die gestreckten Sklereïden (Fig. 111, 3 u. 3 a) auf, weniger Schicht 2 und die Schleimepidermis. Das Gesamtbild ist ein sehr charakteristisches und mit dem keiner anderen Samenschale zu verwechseln. Die hellen Fragmente bestehen aus dem dünnwandigen Gewebe der Cotyledonen, in dem man leicht (im Öl- oder Alkoholpräparat) die Aleuronkörner sichtbar machen kann. Stärke fehlt oder kommt doch nur in Spuren vor (s. auch unter Verunreinigungen).
Linum usitatissimum L.
Succedane Flächenschnitte durch die Samenschale. Die Zahlen bezeichnen die gleichen Gewebe wie in Fig. 110. Links: Aleuronkörner in Jodlösung.
[Tschirch-Oesterle, Atlas.]
Lit. ARTHUR MEYER, Drogenkunde. — HARZ, Landwirtsch. Samenkunde 1885. — SEMPOLOWSKI, Beiträge z. Kenntn. d. Baues d. Samenschale. Dissert. Leipzig 1874. — HERLANT, Caract. microscop. de quelqu. graines officinal. Ann. Univ. Libr. Brux. 1882, m. Taf. — GUIGNARD, Rech. sur l. dével. d. l. graine et en partic. du tégum. semin. Journ. d. botan. 1893 (m. Abbild.). — VOGL, Commentar 1908 (m. Abbild.). — TSCHIRCH-OESTERLE, Atlas t. 58 (SCHLOTTERBECK) (dort die Entwicklungsgeschichte). — MOELLER in Realenzyklop. und Pharmakognosie. — T. F. HANAUSEK in WIESNER, Rohstoffe. — NOBBE, Handb. d. Samenkunde. — CRAMER, Vorkommen u. Entsteh. einiger Pflanzenschleime in NÄGELI-CRAMER, Pflanzenphys. Unters. 1855. — HOFMEISTER, Ber. d. Sächs. Ges. d. Wissensch. 1858. — FRANK, Pringsh. Jahrb. 5 (1866), 161. — MANGIN, Observations sur l’assise à mucilage de la graine de Lin. Bulletin de la Soc. bot. de France 40 (1893), 119 (Bemerkungen dazu: GUIGNARD, l. c. 59). — KOŘAN, D. Austritt d. Schleimes aus d. Leinsamen. Pharm. Post. 1899, 221. — LÜDTKE, Beschaffenh. d. Aleuronk. einiger Samen. Ber. d. pharm. Ges. I, 53. — Abbild. der Aleuronkörner bei LÜDTKE, Beitr. z. Kenntn. d. Aleuronk. Pringsh. Jahrb. 21 (1889) (auch Dissertat.). — Über d. chem. Natur der Aleuronkörner vgl. KRITZLER, Mikrochem. Unters. über d. Aleuronk. Dissert. Bern 1900. — NELSON, Mercks Rep. 1906. — Nährschicht: TSCHIRCH, Anatomie 1889, 459 (die Angabe in SCHNEIDERS Illustriert. Handwörterb. d. Botan., daß der Name von FRANK herrühre, ist unrichtig. LOHDE (Entwicklungsgesch. u. Bau ein. Samensch. Dissert. 1874) drückt sich über[S. 322] die Nährschicht nicht klar aus, er ahnt aber ihre physiologische Bedeutung); vgl. besonders HOLFERT, Flora 1890 (und Dissert. 1890) m. Taf. — RAVENNA und ZAMORANI (Bedeut. d. Schleims f. d. Keimung). Att. R. Accad. d. Lincei (5) 19, II, 247. — Erste anatom. Abbild. im Atlas zu OUDEMANS Aanteekeningen t. JJ., dann auch in BERG, Anatom. Atlas t. 46. — Schleimepidermis abgebild. (nach MANGIN) in HÉRAIL, Traité de pharmacolog. 1901. — Leinkuchen (tourteau): COLLIN et PERROT, Les résidus industriels de la fabricat. des huiles etc. 1904. — Pulver: Mikroskop. Charak. bei KRAEMER, Proc. Am. pharm. ass. 1898, 331 und KOCH, Mikrosk. Anal. d. Drogenpulv. 1906, IV, t. 3.
Chemie. KÖNIG teilt zahlreiche Analysen des Leinsamen mit. Er gibt folgende Prozentzahlen (das Mittel aus allen Analysen in Klammern) in der lufttrockenen Substanz: Wasser 5,47–14,20 (8,96), Stickstoffsubstanz 16,83–30,77 (22,77), Öl (Fett) 22,45–40,48 (34,38), stickstofffreie Extraktstoffe 17,58–28,80 (22,86), Rohfaser 4,18–11,59 (6,78), Asche 2,54–8,04 (4,25); in der Trockensubstanz: Stickstoffsubstanz 18,49–33,8 (25,01), Fett 24,66–44,46 (37,76), Stickstoff 2,96–5,21 (4,0). Leinpreßkuchen enthalten (nach KÖNIG) noch im Mittel 9,88% Öl (3,78–16,34), der Gehalt an stickstoffhaltigen Substanzen beträgt im Mittel 29,48 (19–36,18)%, die Asche 9,69 (5,13–16,5)%.
Leinsamen liefert 3 (ULOTH) bzw. 5,1–5,9% (KIRCHNER und TOLLENS) Schleim. Der rohe Schleim enthält oft 7–10% und mehr Asche; unter 0,7% konnte auch TOLLENS die Asche nicht herabdrücken. Der Schleim wird nach Zusatz von etwas Salzsäure mit Alkohol gefällt und durch Auswaschen mit Ätheralkohol rein gewonnen. Die konz. wässrige Lösung des Schleims gibt mit Kupfersulfat, FEHLINGscher Lösung, Bleiacetat, Bleiessig und Quecksilbersalzen unlösliche Niederschläge. Er gibt mit Jodschwefelsäure keine Blaufärbung. Kupferoxydammon bildet eine feste Gallerte. Der Linumschleim läßt sich mit Ammonsulfat aussalzen (POHL). Er ist unlöslich in Alkalien. SCHMIDT fand im stickstofffreien Schleim unter Abrechnung der Asche 44,97% C, 6,26% H und 48,77% O. Er entspricht also in der Zusammensetzung anderen Pflanzenschleimen. SCHMIDT gab ihm die Formel C12H20O10, welche Formel KIRCHNER und TOLLENS (1874) bestätigten, TOLLENS schreibt die Formel jetzt C6H10O5. Die Hydrolyse des Schleims mit 1¼% Schwefelsäure liefert, neben einem «Gummi», 4% Zellulose (TOLLENS) und c. 60% d-Glukose. Mit Magensaft entsteht eine zum Teil kristallisierende Glukose, die keine Schleimsäure liefert (FUDAKOWSKI). Ein Teil des Leinsamenschleimes liefert bei der Oxydation mit Salpetersäure Schleimsäure (GUÉRIN, VAUQUELIN, CULLINAN). Bei der Hydrolyse liefert er denn auch Galaktose und neben Dextrose (d-Glukose, BAUER, HILGER) tritt dann auch Arabinose und Xylose auf (HILGER). Er enthält also wohl ein Galakto-Gluko-Arabino-Xylan. Der gereinigte Schleim hat (nach HILGER) die Zusammensetzung: 2(C6H10O5).2(C5H8O4), dreht rechts, ist schwach sauer und gibt bei der Destillation mit Salzsäure Furol.
Nachdem schon früher beobachtet worden war, daß bei längerem Aufbewahren von gepulvertem Leinsamen dieser sauer wird (PELOUZE fand 5–6% freie Säure) und sich Blausäure entwickelt (SENIOR, JORISSEN; SENIOR betrachtet die Blausäure als ein Gärungsprodukt), gelang es JORISSEN und HAIRS (1891) aus keimendem Leinsamen 1,5% eines krist. Glykosides (F. = 134°) zu isolieren, das sie Linamarin nannten und das sich (durch das im Leinsamen enthaltene Enzym, verd. Mineralsäuren usw.) in einen reduzierenden, gärungsfähigen Zucker, Blausäure und einen Körper mit Acetonreaktionen spaltet. Es löst sich in Schwefelsäure farblos (Unterschied vom Amygdalin). Dasselbe erwies sich als identisch mit dem Phaseolunatin von DUNSTAN und HENRY, das diese aus den Samen von Phaseolus lunatus isolierten,[S. 323] dem sie die Formel C10H17O6N geben (F. = 141°) und das sich nach der Gleichung C10H17O6N + H3O = C6H12O6 (Dextrose) + HCN (Blausäure) + (CH3)3CO (Aceton) spaltet. Wird Leinsamenmehl mit warmem Wasser angerührt bei 25° einige Zeit stehen gelassen und dann destilliert, so erhält man ein blausäurehaltiges Destillat. 100 g liefern 8 mg HCN (gekeimte Samen mehr als doppelt so viel. Es findet bei der Keimung auch eine Neubildung von HCN statt [RAVENNA und ZAMORANI]). Auch die Stengel liefern Blausäure (JORISSEN).
Das fette Öl (Leinöl) ist in seiner Zusammensetzung noch nicht genau bekannt. Die Elementarzusammensetzung gibt SACC wie folgt an: C = 76,8–78, H = 11–11,2, O = 11–12%. Es soll 10–15% Glyzeride fester Fettsäuren (Stearinsäure, Palmitinsäure und Myristicinsäure) und 85–90% flüssige Glyzeride enthalten. Die flüssigen Fettsäuren bestehen nach HAZURA und GRÜSSNER aus 5% Ölsäure, 15% Linolsäure (C18H32O2), 15% Linolensäure (C18H30O2) und 65% Isolinolensäure. Ob aber Ölsäure darin enthalten ist, ist noch fraglich. FAHRION gibt folgende prozentische Zusammensetzung an (1903): Unverseifbares 0,8, Palmitin- und Myristicinsäure 8, Ölsäure 17,5, Linolsäure 26, Linolensäure 10, Isolinolensäure 33,5, Glycerinrest 4,2. LEWKOWITSCH hält diese Zahlen aber nicht für richtig und meint, daß FOLKINS Angabe wohl zutreffend sei, daß Linolsäure vorherrsche und die Linolensäure nur 22–25% der Fettsäure ausmache. Er hält für wahrscheinlich, daß Linolen- und Isolinolensäure 14%, Linolsäure 78,5% betrage. Das Öl gibt von allen fetten Ölen die größte Menge flüchtiger Säuren (DIETERICH). Das Öl gehört zu den trocknenden Ölen. Es absorbiert an der Luft leicht Sauerstoff und trocknet schließlich zu einer in Äther unlöslichen Substanz ein (Linoxin, superoxydiertes Leinöl). ORLOW gibt dem Linoxin die Formel:
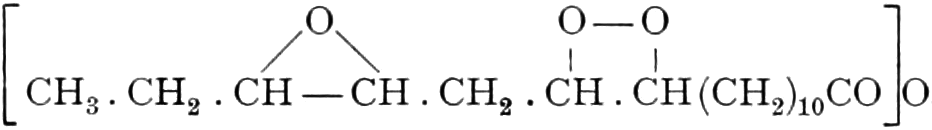 |
.
|
Diese Veränderung erleidet es auch im Leinmehl beim Erhitzen desselben auf 100–110° (KLOPSCH). Pressung lieferte in Indien bei whit seed 35,1, bold red 31,2, small 29,6% Öl; im Durchschnitt also ⅓ des Gewichtes des Samen. Durch Extraktion erhielt FLÜCKIGER 35,5%, aus weißen indischen Samen 39,2–40% Öl.
HAUKE fand in den Samen 3,2 bis 4% Asche. Er bezeichnet als obere Grenzzahl 5%. KÖNIG fand im Mittel 3,69% (Phosphorsäure: 41,5, Kali: 30,63, Magnesia: 19,29%), DEY und COWIE 1,93 (holl.) bis 4,0% (südamer.). Die Asche enthält Kupfer (MEIER).
In lufttrockener Placenta sem. lin. fand PETERS 7% Asche und 8,32 Wasser.
Lit. Die älteste eingehende Analyse der Samen von L. MEIER (in GMELINS Handb. d. Chem. II, 1251). — Viele Analysen in KÖNIG, Nahrungs- u. Genußm. 4. Aufl., bei HOOPER, Agricultur Ledger No. 12. Calcutta 1899 und bei W. LAWSON, Pharm. Journ. 16 (1885), 245. — Ältere Analysen des Schleimes von BOSTOCK (Nicholsons Journ. 18, 31), VAUQUELIN (Ann. de chim. 80, 314), GUÉRIN VARRY (Journ. de chim. méd. 7, 739), C. SCHMIDT (Lieb. Ann. 51, 29). — Schleim: GUÉRIN, Ann. chim. phys. (2), 49. — FUDAKOWSKI, Ber. d. chem. Ges. 11, 1073. — CULLINAN, Bot. Jahresb. 1884, I, 71. — HILGER, Ber. d. chem. Ges. 36 (1903), 3198. — BAUER, Journ. pr. Chem. II, 30, 367. — HILGER und ROTHENFUSSER, Ber. d. chem. Ges. 35, 1841. — KIRCHNER und TOLLENS, Unters. über Pflanzenschleim. Journ. f. Landw. 1874, 502; Lieb. Ann. 175 (1874), 205. — POHL, Zeitschr. phys. Chem. 14 (1890), 151.
PELOUZE et BOUDET, Ann. chim. phys. (2) 69, 43. — PELOUZE, Ebenda 45 (1855), 319. — JORISSEN et HAIRS, Sur la linamarine, glucoside cyanhydrique retiré du Lin. usitatiss. Bull. Ac. roy. belg. (3) 21, 1891 (Journ. pharm. chim. 24 [1891], 259) und 1907, 793. Auch Bull. ac. roy. belg. (3) 5 (1883), 750; (3) 6 (1884), 718; (3) 7 (1884), 736. — DUNSTAN und HENRY, Proc. Royal soc. 72, 285 und 78, 145. — SENIOR, Brit. Pharm. Conf. 1885 (Pharm. Zeit. u.[S. 324] Jahresber. d. Pharm. 1885). — JOUCK, Beitr. z. Kenntn. d. HCN abspalt. Glyk. Diss. Straßb. 1902. — TH. GREENISH, Further contrib. of the pharm. of linseed. Pharm. Journ. 15 (1884), 169 (Leinsamenmehl). — Gehalt an Öl: KÖNIG a. a. O. Dann: Chem. Drugg. 1899, 522. — LA WALL and PURSEL, Am. journ. pharm. 1899, 393. — PATCH, Proc. am. pharm. assoc. 1906, 339. — DEY und COWIE, Pharm. Journ. 25 (1895), 1037. — Über das Öl vgl. bes. LEWKOWITSCH, Chem. Technol. u. Analyse d. Öle, Fette usw. 1905 (dort die Literatur). — Dann auch DIETERICH, Helfenb. Ann. 1887, 89. — KLOPSCH, Zeitschr. anal. Chem. 1888, 452. — Asche: HAUKE a. a. O. — LAUDREAU, Ann. agronom. 6, 315. — MOOR and PRIEST, Pharm. Journ. 1900. — PETERS, Apoth. Zeit. 1909, 538. — Zahlreiche Aschenanalys. d. Samen, Früchte u. d. ganzen Pflanze in WOLFF, Aschenanalysen 1871, 106.
Verfälschungen und Prüfung. Leinsamen ist oft mit anderen Samen vermischt, doch dürfen nicht mehr als höchstens 4% darin sein (FLÜCKIGER), bei Ölsaat beträgt der Gehalt bisweilen 30–50% (z. B. in Telquel aus Calcutta). NOBBE fand in einem 2,84% fremde Samen enthaltenden Lein die Samen von 41 Phanerogamen. VÖLCKER fand in russischem Leinsamen 3%, in bestem indischen 1,75% fremde Samen. In dem hellen indischen Lein verraten sich dunkle Samen leichter, als in dem rotbraunen russischen.
Im Leinsamen wurden oft Cruciferensamen und die Samen des in Leinfeldern häufigen Lolium arvense SCHRAD. beobachtet, im Leinmehl oft Rapskuchen (bei Revisionen noch 1910 beobachtet, durch den abweichenden Bau der Samenschale leicht kenntlich) und Weizenmehl (BERINGER). TUNMANN beobachtete (1906) Kieselguhr als Verfälschungsmittel.
HOLMES fand in englischem Lein: Lolium, Polygonum Persicaria, Chenopodium glaucum; in holländischem L.: Chenopodium album; in russischem L.: Camelina sativa, Spergula arvens., Lolium, Polyg. Persicar.; in littauischem L.: Centaurea Cyanus; in Odessa-L.: Polygonum, Convolvulus, Agrostemma Githago, Sinapis, Panicum, Setaria; in indischem L.: Sesamum, Ervum, Sinapis, Medicago; in sizilian. und ionischem L.: Galium spur., Ervum. (Er bildet ab: Lolium spec., Polygon. lapathifol., Spergula arvens., Chenopod. alb., Silene inflata, Camelina sativa, Centaurea Cyanus, Panicum miliac., Setaria, Sinapis, Agrostemma Githago, Sesam. indic., Ervum, Medicago, Galium spur.) COLLIN et PERROT erwähnen und beschreiben (in Les Residus industriels 1904) eine große Anzahl von Verfälschungen der Leinpreßkuchen. Sie bilden ab die Elemente der Fruchtschalen des Lein und die besonders häufigen Samenschalen von Spergularia arvensis, Chenopodium polyspermum, Cerastium triviale und von Leguminosen (Luzerne u. and.), sowie Lychnis, Githago und Reisspelzen. Nicht unbedenklich ist eine Beimengung von Lolium temulentum. Daß davon bis 25% in einem Leinsamen vorkamen, ist aber wohl nur eine Fabel oder ein Zufall.
Aus der oben mitgeteilten Entwicklungsgeschichte der Samenschale geht hervor, daß beim unreifen Samen sowohl in der Schleimzellenschicht wie in der darunter liegenden, als auch in der Nährschicht Stärke vorkommt; die Körner sind relativ groß in den äußeren, klein in den inneren Samenschalschichten. Demnach wird man, da dem reifen Samen in der Regel Stärke gänzlich fehlt, die Beimengung unreifen Samens im Leinmehl an den Stärkekörnern erkennen können. Doch fand TUNMANN bei einer Sorte Springlein auch im reifen Samen Stärke, ebenso SCHÜRHOFF und EBERT (in der Schicht zwischen Schleimepidermis und Faserschicht). Die mikroskopische Prüfung gibt hierüber Aufschluß. Doch kann man auch, da kleine Stärkemengen, die ja auch von geringen zufälligen Beimengungen stärkehaltiger Samen stammen können, toleriert werden dürften, nach LLOYD in der Weise verfahren, daß man 1,0 Leinmehl mit 20 ccm Wasser kocht, erkalten läßt und zu 8 ccm des Schleims eine Mischung von 0,2 ccm Jodlösung (1 : 50) und 10 ccm 10%ige Schwefelsäure hinzufügt. Hierbei soll Blaufärbung nicht auftreten (weniger als 0,5% Stärke). Fragmente von Cruciferen- (Brassica-, Sinapis-) Samen färben sich mit Kalilauge dunkel (Lein nicht, J. LEHMANN). Auch der Nachweis von Schwefel im Destillat oder dem alkalischen Filtrat kann benutzt[S. 325] werden (CORENWINDER), da die Cruciferen schwefelhaltige ätherische Öle liefern. Neuerdings (Amer. Drugg. 1900) ist beobachtet worden, daß entöltes Leinmehl durch Zusatz von Mineralöl auf den alten «Ölgehalt» gebracht wurde. Da sich in der Ölsaat neben Leindotter- und Cerealien- besonders Cruciferen-Samen finden, enthält das Leinöl meistens etwas Cruciferenöl. Zur Erkennung fremder Beimengungen im Leinmehl wird neuerdings (Ann. d. falsif. 1910) Benzin empfohlen. Leinmehl sinkt unter, die meisten Beimengungen schwimmen oben.
Lit. HASELHOFF, Fabrik. u. Beschaffenh. d. Leinkuch. bzw. d. Leinmehls. Landw. Versuchsstat. 41 (1892) 55. — VON PESCH, Ebenda S. 73. — NOBBE, Handb. d. Samenkunde 1876, 439. — VÖLCKER, Journ. Roy. agr. soc. 9, 5. — HOLMES, Pharm. Journ. 12 (1881), 137. — FLÜCKIGER, Pharmakogn. — BERINGER, Amer. journ. pharm. 1889, 167. — ROGER, Ann. chim. anal. 1906, 136. — CORENWINDER, Journ. chem. soc. 1882/83. — LLOYD, Amer. journ. pharm. 1895, 463. — CULLIVAN, Pharm. Journ. 14 (1884), 983. — Stärke: SCHÜRHOFF, Pharm. Zeit. 1906, 658, RUSTUNG, Chem. Zeit. Rep. 1906, 449, TUNMANN, Pharm. Centralh. 1906, 725, EBERT, Chines. Arzneischatz. Diss. Zürich 1907.
Anwendung. Sem. lini ist ein Bestandteil der Spec. emollientes. Der Leinsame gehört zu den schleimigen Vehikeln und den einhüllenden, reizmildernden und resorptionshemmenden Mitteln. Die Placenta sem. lini dient zu meist heißen Breiumschlägen (Cataplasmen von καταπλάσσειν = Brei auflegen). Aus Laienkreisen (H. W. VOGEL) ist dem Leinsamen hervorragende Wirkung bei Diabetes nachgerühmt worden und er findet sich auch unter den Mitteln des Pfarrer KNEIPP. Er wird auch in der Zeugdruckerei benutzt. — «Statt Decoctum sem. lini ist die Kolatur einer halbstündigen Maceration zu dispensieren» (Pharm. helvet. IV).
Außer den Samen werden auch die aus den Ölmühlen stammenden gemahlenen (sehr harten) Preßkuchen (Placenta sem. lini, Leinkuchen, pain ou gâteau de lin, Linseedcake) benutzt. Da bei ihnen für die medizinische Anwendung der Schleim die Hauptsache ist (ihm verdanken sie auch die Fähigkeit viel Wasser zu binden), können sie wohl an Stelle der noch alles Öl enthaltenden Sem. lini pulveratum benutzt werden, doch erhält man bessere Cataplasmen mit gepulvertem (gemahlenem) Lein. Wegen des hohen Stickstoffgehaltes (s. oben) sind die Leinsamenpreßkuchen auch ein vorzügliches Futtermittel. In Westindien wird die unreife Frucht als Gemüse benutzt. Leinpreßkuchen ist neuerdings als Verfälschungsmittel von Gewürzpulvern beobachtet worden.
Die früher so viel verwendete Charpie (Linteum carptum, linamentum) wurde vorwiegend durch Zerzupfen von Leinwand dargestellt.
Lit. Wasserbindung: CARLES, Journ. ph. chim. 10, 244.
Geschichte. Der Flachs ist eine der ältesten Kulturpflanzen. Wie Gräberfunde zeigen, wurde im alten Ägypten sicher im III., vielleicht schon im IV. Jahrtausend n. Chr. Lein gebaut (I, S. 457). Auf Grabgemälden der XII. Dynastie (2400–2200 n. Chr.) ist der Flachsbau und die Verarbeitung des Lein in allen Details dargestellt (Abbild. bei WÖNIG). Wir treffen dort sowohl Linum usitatiss. var. vulgare (gewöhnlicher L., Schließlein) wie auch L. u. var. crepitans (Klenglein) (BRAUN, SCHWEINFURTH, BUSCHAN). Die gefundenen Fruchtproben der letzteren stimmten in allen Punkten mit dem noch jetzt in Ägypten gebauten Klenglein überein. KÖRNICKE meint, daß sich der gewöhnliche Lein (L. usit. var. vulgare) aus L. angustifolium HUDSON, einer nur wenig von ihm verschiedenen, durch Übergänge mit ihm verbundenen, über das ganze Mittelmeergebiet von den Kanarischen Inseln bis Palästina und den Kaukasus wildwachsend verbreiteten, sowohl einjährigen wie perennierenden Art mit zahlreichen, vom Grunde aus aufsteigenden, bei der Reife sich öffnenden Kapseln und kleinen Samen entwickelt habe. Auch WETTSTEIN bemerkt (1903), daß die Stammform unseres Lein perenn gewesen sein müsse, aufspringende Früchte und niedrigere Stengel gehabt habe und im Süden oder Osten Europas heimisch gewesen sei. Diese Umbildung muß sich schon vollzogen haben, bevor die Pflanze[S. 326] (durch die Prosemiten (?), DE CANDOLLE) nach Ägypten kam. Die Mumienbinden des Königs MENKARA (IV. Dynastie um 3600 n. Chr.) bestehen noch aus Wolle, leinene traten in der XII. Dynastie auf (2400–2200 n. Chr.). THOMSENS (1834) und UNGERS (1860) mikroskop. Untersuchungen zeigten, daß der Byssus der alten Ägypter Lein war (nicht Baumwolle). Auch in Mesopotamien bestand schon vor vier- bis fünftausend Jahren oder noch früher Flachsbau. Später nennt STRABO die Stadt Borsippa als Sitz der Leinwandindustrie Babyloniens. Flachs tritt aber bereits in altchaldäischen Gräbern der vorbabylonischen Zeit auf (MASPERO, DE CANDOLLE). Zur Zeit, als die Kinder Israels aus Ägypten zogen, waren die Gefilde des Landes am Nil reich mit Flachs bestellt (2. Mos. IX, 31). Als die Juden nach Palästina kamen, fanden sie dort bereits den Flachs (= pischta) in Kultur. Sie bedienten sich viel des Flachs. Die Priester trugen feine, das Volk grobe leinene Gewänder (BUSCHAN). Dies finden wir auch bei anderen Völkern und noch heute schreibt die katholische Kirche leinene Chorhemden den Priestern vor. Durch PAUSANIAS wissen wir, daß die Landschaft Elis Flachs baute und Linum findet sich auch in der mykenischen Periode (SCHLIEMANN). In Italien ist der Flachsbau sehr alt, geht aber nicht in die vorarische Zeit zurück. HERODOT bezeichnet leinene Kleider als Luxus. Auch für Panzerhemden wurde Lein verarbeitet. Die Pfahlbauer der Steinzeit in Oberösterreich, Oberitalien und der Schweiz bauten Lein und zwar Linum angustifolium (HEER; die Schweizer Pfahlbauer bauten die perennierende Varietät). Auf der iberischen Halbinsel ist er zur Bronzezeit nachgewiesen. Die Indogermanen brachten wohl diese Art und ihre Kultur aus ihren Kleinasien und Thrakien benachbarten Stammsitzen mit (SCHRADER). Wann das L. angustifol. in Europa durch unseren heutigen Lein verdrängt wurde, ist unbekannt. Vielleicht geschah dies zu Anfang unserer Zeitrechnung (NEUWEILER). Zu PLINIUS Zeiten wurde letzterer jedenfalls schon gebaut. Neuerdings hat NEUWEILER die Ansicht zu begründen gesucht, daß der Pfahlbaulein eine Form von L. austriacum sei. «Wir haben es mit einer Varietät oder Rasse einer perennierenden Leinart (L. usitatiss. ist einjährig), die L. austriacum am nächsten stand, zu tun, aus der sich die jetzigen auch in Kultur vorkommenden perennierenden Leinarten, L. austriacum und L. perenne, entwickelt haben können. Als Stammform wird auch für diese Reihe (wie für L. usitatiss.) L. angustifol. anzunehmen sein» (NEUWEILER). Bei den germanischen Völkern lag die Leinkultur und Verarbeitung in den Händen der Frauen. Sie verzierten die Leingewebe mit Vorliebe mit roter Farbe. Und noch heute wird die Wäsche rot gezeichnet. Der Flachs ist die heilige Pflanze der FRIGGA, der Gemahlin ODINS und Schutzgöttin der Ehe. Ihr Katzengespann war mit Strängen blühenden Leins angeschirrt. Sie war Schirmerin der Flachsbearbeitung und wurde (unter dem Namen Frau Holle) als spinnende Frau dargestellt (RELING u. BOHNHORST). TACITUS erwähnt in der Germania (Kap. XVII) deutsche Leinwand. UNGER betrachtet (gestützt auf HERODOT) die sumpfigen Niederungen im Südwest-Kaukasus als das Vaterland des Lein; HOOPS Kleinasien und die Kaukasusländer als Heimat des Flachsbaues. Nach SCHRADER scheint der Flachs schon in der Heimat der Indogermanen Kulturpflanze gewesen und als solche bei dem Zuge nach dem Westen gebracht worden zu sein, denn die gemeinsame Grundwurzel aller Idiome der europäischen Indogermanen ist die Silbe li (s. oben), die sowohl Flachs wie Gewebe bedeutet.
In Abessynien dienen die Samen eines niedrigen Berglein seit undenklichen Zeiten mit Salz und Pfeffer zerrieben als Fastenspeise (BRAUN, SCHWEINFURTH). JOACHIM übersetzt an mehreren Stellen des Papyrus EBERS (I, S. 463) ein Wort mit Leinsamen, setzt aber ein Fragezeichen dazu. Wir wissen, daß sie die Ägypter wie die Assyrer besonders mit Honig (I, S. 480) viel als Arzneimittel benutzten. Und auch bei den alten Juden spielten Leinsamen (kasno?) und Leinsamensuppe (ḳaṣchā?) eine Rolle unter den sog. diätetischen Mitteln (I, S. 489). In der chinesischen Medizin scheint Lein (huma) keine große Rolle gespielt zu haben. Ich finde ihn z. B. im Pentsʿao kang mu nicht. Das gleiche gilt von der indischen Medizin, wo bei SUŠRUTAS der Name akasa für Linum steht (I, S. 506). Dagegen bediente sich HIPPOKRATES (I, S. 542) der Leinsamen gern — unter den Schleimmitteln des Corpus Hippocraticum steht λίνον obenan. — Die Sitte Leinsamen (sowie Mohn- und Sesam-Samen) auf das Brot zu streuen, die auch für den Norden bezeugt ist, erwähnt der lydische Dichter ALKMAN (670–640 n. Chr.). Der erste, der Schleim und Fett der Samen und ihre Anwendung bei Husten erwähnt, ist THEOPHRAST (Hist. plant. III, 18, 3: γλισχρότητα καὶ λίπος). DIOSKURIDES (II. cap. 125) vergleicht den Samen mit dem ebenfalls schleimigen Samen des Foenum graecum. Er nennt eine Menge Krankheiten, gegen die er innerliche oder äußerliche Anwendung (als Clysma und Sitzbad) der Leinsamen empfiehlt. PLINIUS bespricht im XIX. Buch eingehend die Leinkultur, die Faserbereitung[S. 327] (das Asbestinum Linum, der «unverbrennliche Lein» war aber Asbest) und die medizinische Anwendung der schleimigen Samen, bei der, wie es scheint, meist der Honig (und zur Verdeckung des faden Geschmackes auch Pfeffer, s. oben) mit im Spiele war — so z. B. auch bei CRESCENZI (I, S. 677). Geröstete Leinsamen erwähnt GALEN und Lini semen wie Farina seminis lini steht bereits in den Compositiones des SCRIBONIUS Largus (I, S. 577), der Leinsamen bei trockenem Husten zur Beförderung der Expectoration empfahl. CELSUS brauchte ihn mit süßem Wein gemischt bei Geschwüren im Halse, ANDROMACHUS bei Harnbeschwerden, MOSCHION bei Menstruationsstörungen in Form von Leindekokt-Bädern. Auch zu Speisen und Backwerken fand er im Altertum Verwendung (DIERBACH). Im Edikt DIOCLETIANS (I, S. 569) steht λινόσπερμον und auch ALEXANDER TRALLIANUS (I, S. 592) benutzte die Leinsamen oft (sie heißen bei ihm ebenso). Die Leinkultur erwähnen die römischen Landwirtschaftsschriftsteller (z. B. COLUMELLA). Die Griechen bauten λίνον, die Römer Linum. Alle Operationen der Erntebereitung der Flachsfaser finden wir schon bei den Römern, das Raufen (vellere), Rösten (macerare), Brechen (frangere), Hecheln (digerere). Bei IBN BAITHAR (I, S. 610) sind zahlreiche Krankheiten angeführt, bei denen Leinsamen anzuwenden ist. ELGÂFAKI vergleicht die schmerzstillende Wirkung mit der der Kamille. Auch Fumigationen und Leinsamenumschläge waren beliebt und der geröstete Same diente als Adstringens. Doch scheint das Mittelalter im allgemeinen die Leinsamen wenig beachtet zu haben (im Regimen sanitatis und der Flos medicinae (I, S. 629) sowie im Hortulus fehlt Linum), doch finden wir in der Alphita (I, S. 651) Lineolum (oleum de semine lini) und das Breviarium KARLS (I, S. 621, nicht das Capitulare, wie FLÜCKIGER angibt), die HILDEGARD (I, S. 670), die den Samen zu Kataplasmen empfiehlt, MEGENBERG und das Gothaer Arzneibuch (I, S. 680) gedenken des Leinsamen. Flachs steht auch im Zolltarif von Accon (I, S. 699) und dem von Messina (SELLA) und die Abtei Saint Germain des-Prés erhob im VIII. Jahrh. Leinsamen als Abgabe (I, S. 715). Die Wirkung der Leinsamen als Aphrodisiacum, die MATTHIOLI betont und die auch dem Volke bekannt ist, erwähnt schon DIOSKURIDES. Der Leinsamen dient noch jetzt zum Liebes- und Eheorakel (Vogtland, Österreich) und spielt auch bei den Hochzeitsbräuchen der Südslaven eine Rolle (KRAUSS). Wie ausgedehnt der Flachsbau im XVI. Jahrh. in Deutschland war, zeigt der Umstand, daß es in Augsburg damals 3500 Weber gab. Die Fugger verdanken ihren Reichtum zum Teil der Weberei. Ehemals wurde Leinsamendekokt (zusammen mit Bockhornsamen- und Altheeschleim) zur Bereitung des Empl. diachylon benutzt, das seinen Namen (= Pflaster mit Saft) daher hatte (PETERS). Das Emplastrum Diachylon des MESUË z. B. enthält in allen seinen verschiedenen Vorschriften (vgl. CORDUS Dispensatorium. I, S. 795) Mucilago seminis Lini.
«Die von den Alten nicht geübte Ölmalerei, welche sich wesentlich auf die Verdickungsfähigkeit der sog. trocknenden Öle stützt, mag einen weiteren Aufschwung der Wahrnehmung verdankt haben, daß jene Eigenschaft des Öles durch Besonnung noch mehr erhöht wird. Dieser Behandlung unterwarf man das Leinöl (ebenso wie Mohnöl und Rizinusöl) schon im IV. Jahrh. Das erstere wurde zum gleichen Zwecke vom X. Jahrh. an, wenn nicht schon früher, auch mit Bleioxyd gekocht (ILG). Solcher Firniß scheint wohl lange Zeit vorzüglich in Danzig bereitet worden zu sein; manche Taxen des XVI. Jahrh. nennen Vernisium Dantiscanum und aus VALERIUS Cordus (Annot. ad. Dioscor.) ist ersichtlich, daß damit Leinölfirniß gemeint ist» (FLÜCKIGER). Die ältesten Papiere (s. oben S. 256) sind Hadernpapiere. In den alten arabischen, d. h. islamitisch-orientalischen und auch in den ältesten europäischen Papieren spielt die Leinfaser die Hauptrolle. Sie tritt in den Papieren viel häufiger auf als Hanffaser (WIESNER).
Lit. HEER, Pfl. d. Pfahlbaut. 1865 u. Flachs u. Flachskultur im Alterthum. Zürich 1872. — UNGER, Bot Streifzüge auf d. Geb. d. Culturgesch. Sitzungsb. d. Wiener Akad. IV-VII. — WÖNIG, D. Pflanz. d. alt. Ägypt. 1886. — SCHWEINFURTH, Ber. d. d. bot. Ges. 1883 u. 1884. — KÖRNICKE, Bemerk. über d. Flachs d. heut. u. alt. Ägypt. Ber. d. d. bot. Ges. VI, 388. — THÄR, Altägyptische Landwirtsch. 1881. — BUSCHAN, Vorgeschichtl. Botan. 1895. Prähistor. Gewebe u. Gespinste 1889 und die Weberei der Vorzeit. Verh. d. Berl. Anthropol. Ges. 1889. — NEUWEILER, Prähist. Pflanzenreste Mitteleuropas. Zürich 1905. — A. BRAUN, Pflanzenreste aus altägypt. Gräbern. Zeitschr. f. Ethnolog. 1877. — SCHRADER, Sprachvergleichung und in HEHN, Kulturpflanz. u. Haust. — DE CANDOLLE, L’Orig. des plant. cultiv. — MASPERO, Hist. anc. d. peupl. de l’Orient 1878. — BLÜMNER, Technol. u. Terminolog. d. Gewerbe u. Künste bei Griechen und Römern 1875. — H. VOGEL, Über d. Culturgesch. d. Flachses u. seinen Kampf mit d. Baumwolle. Darmstadt 1869. — SELLA, Pandetta delle gabelle e dei diritti della curia di Messina[S. 328] Torino 1870 (Miscellanea di storia italiana t. X). — EARLE, Bot. and mat. med. of linseed. Pharm. Journ. 14 (1884), 979. — Sagen und Volksgebräuche in RELING und BOHNHORST, Unsere Pflanzen. 4. Aufl. 1904. — A. BRAUN, Flora 1848, 94. — SCHWEINFURTH, Petermanns Mitth. 1868, 168. — HILDEBRANDT, Zeitschr. f. Ethnologie. Berlin 1874, 327. — DIERBACH, Synopsis mat. med. — FLÜCKIGER, Pharmakognosie. — ILG, Von den Farben u. Künsten d. Römer in EITELBERGERS Quellenschr. f. Kunstgesch. u. Kunsttechn. d. Mittelalt. IV (1873). — JUL. WIESNER, Rohstoffe und Die mikroskop. Unters. d. Papiers. Mitt. aus d. Samml. d. Pap. Rainer 1887.
Paralleldrogen. Schleimepidermen besitzen auch die Samen von Linum perenne L., L. Levisii PURSH., L. austriacum L., L. angustifolium HUDS., L. maritimum L. und können (nach DRAGENDORFF) wie Linum usitatissimum gebraucht werden. In Vorderindien darf Sem. lini durch die Samen von Plantago ovata ersetzt werden (I, S. 22).
Sem. Cydoniae.
Syn. Quittensamen, Quittenkerne — in Tirol: Kittenbaum, in der Schweiz: Schmeckbirn, in Osnabrück: quie — coing (franz.) — quince (engl.) — kwee, quee (holl.) — cotogno (ital.) — membrillo (span.) — marmeleiro (port.) — birsalma (ung.) — κυδώνια (plur. n.-griech.) — armud, aiva (russ.) — bihí-danah (hind., bomb.) — shimai-dalavirai (tam.) — safarjal (arab.).
Etym. Quitte (früher [XI. Jahrh.] Quidde); mhd. quiten, kitten und küten (bei BRUNSCHWYG, BOCK, bei MEGENBERG, I, S. 693: kütenbaum); ahd. chutina (chotin, chutinbaum, chutinboum) von gemeinroman. cotônea (cottanum, bei PLINIUS: mala cotonea). Dies aus κυδώνεα (bei DIOSKURIDES: κυδώνια). Aus cotônea dann auch coing (franz. so z. B. im Inventar LEFORT [I, S. 805] 1439) und kwee (holl.). Die spätgriech. Namen bei LANGKAVEL, Botan. d. spät. Griech. Im Mittelalter: cedonia, citonium, coctanus, cotoneum, quotanum, im ital.: cotegra. — Im IX. Jahrh. auch coronopus (= Krähenfuß). Bei SERAPION und in der Alphita (I, S. 645): cithonia, mala citonia; bei ersterem auch: tuffa, suffargel. In den Sinonoma (I, S. 639): cottana, citonia. — Bei MEGENBERG heißen die Früchte: pirn küten, gemain küten. Bei der HILDEGARD (I, S. 670): Quitdenboum, quotanus — bei ALBERTUS MAGNUS (I, S. 674): coctanus, citonius. — In den mittelengl. Medizinbüchern (I, S. 684): quyns — im Gothaer Arzneibuch (I, S. 681): quede. «Die lateinische Form cotonea wird auf einer Vermischung mit Namen der Feige beruhen, die auch in dem kleinrussischen (und poln.) Namen für Quitte pigva hervortritt» (SCHRADER) — cottana waren kleine Feigen. — Von dem portugiesischen Worte für Quitte: marmeleiro (ordinario) ist das Wort marmelade abgeleitet.
Stammpflanze. Cydonia vulgaris PERSOON (Enchirid. II, 40) [Pirus (nicht Pyrus) Cydonia L., Cydonia Cydonia KARST., C. europaea SROI, Sorbus Cydonea CRANTZ], Quittenbaum, Cognassier, coigenassier.
Mit den Varietäten: var. maliformis MILL., Apfelquitte, apfelförmig, beiderseits genabelt, — var. oblonga MILL., Birnquitte, Quittenbirne, birnförmig, nur auf dem Scheitel genabelt (das malum strutheum CATOS). — var. lusitanica MED., portugiesische Quitte, sehr groß und gerippt und noch einigen anderen Sorten (vgl. MATAICU, Nomenclator pomolog. 1889).
Schon PLINIUS erwähnt fünf Sorten. COLUMELLA nennt struthia, chrysomelina und mustea. THEOPHRAST (Hist. plant. 2, 2. 5) unterscheidet zwischen der wilden (verwilderten) Quitte, κυδώνιος und der zahmen, die er στρούθιον nennt, eine Bezeichnung, die sich (neben στρουτόμηλον) ebenso bei den späteren Griechen und auch bei den Römern findet. Der Autor von MAKHZAN beschreibt drei Arten Quitten (Safayal): die süße, die saure und die säuerliche (arab. muzz) (Pharmacogr. ind.).
Systemat. Stellung. Rosaceae, Pomoideae — Pomariae — Eucydonia (FOCKE).
Beschreibung. Die Quitte ist meist ein kleiner Baum, der selten 3 m Höhe überschreitet, mit abstehenden dornenlosen Ästen, oft ohne einen eigentlichen Hauptstamm (das steht schon bei PLINIUS) und kurzgestielten, eiförmigen oder eilänglichen, ganzrandigen, alternierenden Blättern, die unterseits, ebenso wie die jungen Zweige[S. 329] und der Fruchtknoten zottig-graufilzig sind. Nebenblätter laubig, länglich, drüsig gesägt. Die einzeln terminal stehenden Blüten, die größer sind als die des Apfels und bis 7 cm Durchmesser erreichen, besitzen fünf oblonge, drüsig-gesägte, filzige, unterseits zottig behaarte Kelchblätter, fünf damit alternierende, rötlichweiße oder weiße und rötlich geaderte Kronenblätter, die eine gedrehte Knospenlage besitzen und 15–20 Stamina, die in drei Kreisen angeordnet sind — bei 20 Staubfäden ist der äußere Kreis zehnzählig und die beiden inneren sind je fünfzählig. Das Gynaeceum ist unterständig, die fünf Griffel sind frei. Die aufsteigenden anatropen Ovula liegen in zwei collateralen Reihen. Die goldgelbe, stark und eigentümlich lieblich riechende, herb und sauer schmeckende Frucht ist apfel- bzw. birnförmig (s. oben), von dem vergrößerten laubigen Kelch bekrönt [vielleicht rührt der Name Coronopus (s. oben) von den auf der Frucht sitzenbleibenden Kelchzipfeln her, FISCHER-BENZON], gelb oder grünlich-gelb — «quittegelb» ist im Sprachgebrauch eine besondere Nuance des Gelb —, oft noch stellenweise von einem leicht abreibbaren Filze bedeckt, den Resten der Behaarung des Fruchtknotens, daher spinnwebig filzig (MARTIAL vergleicht den Flaum auf der Wange eines Kindes mit diesem Flaume). Das Fruchtfleisch ist derb, hartfleischig, wenig saftig, sehr herbe und sauer. Das Kerngehäuse pergamentartig knorpelig. Das Kerngehäuse entsteht aus den fünf Carpellen, die mit dem Receptaculum verwachsen. Das Fruchtfleisch (Mesocarp) und die Schale (Exocarp) sind also Bildungen des Receptaculums, wie dies bei der Gruppe der Pomoideen stets der Fall ist. Die Frucht ist also eine Scheinfrucht vom Typus der Apfelfrucht. In der Mittelschicht der Frucht finden sich viele Sklereïdengruppen (Reste der Drupa), die sich zumal gegen das Gehäuse zu sehr eng zusammendrängen. Jedes der fünf Fächer umschließt einen Ballen von 6–15 (selten mehr) Samen (Fig. 112). Die Frucht bleibt auch zur Zeit der Reife hart. Die Quitte blüht im Mai oder Juni.
Die Quitte wächst wild im Kaukasus, in Transkaukasien (bis 1300 m), den kaspischen Provinzen Persiens, Talysch und Asterabad, in Armenien, Syrien und Kleinasien (ENGLER). Verwildert findet sie sich im ganzen Mittelmeergebiet. Für uns kommen jedoch nur kultivierte Quitten in Betracht. Die Quitte ist von ihrer ursprünglichen Heimat, den transkaukasischen, südkaspischen, ostiranischen, turanischen und südostarabischen Ländern über Persien und Syrien zunächst nach dem Mittelmeergebiet gebracht worden. In Kultur ist die Quitte jetzt im ganzen warmen und gemäßigten Europa, sowie in Afrika, in Ägypten, Tripolis, auf Teneriffa und am Cap. In Italien z. B. findet sie sich im Valle Pantena bei Verona, bei Marsano, Bologna und in Sardinien spontan und kultiviert (RAVASINI), doch trägt sie reicher im Süden. Ihre Früchte reifen noch in England, nicht mehr in Schottland (HANBURY), wohl aber in einigen Gegenden im Süden Schwedens und Norwegens (SCHÜBELER). Im Süden ist sie ein Baum, im Norden wird sie oft strauchartig. Nach Amerika ist sie wohl frühzeitig gebracht worden. Sie wächst (halb wild?) in Chile (PHILIPPI), Guatemala (SMITH), Mexiko und Florida und wird auch dort kultiviert. Die Kultur hat, wie es scheint, die Frucht der Quitte wenig verändert.
Lit. BOISSIER, Flor. orient. II, 656. — BAILLON, Hist. des plantes. Monogr. d. Rosac. — DECAISNE, Mem. sur la fam. d. Pomacées. — LUERSSEN, Medic. pharm. Botan. — MORGENTHALER, Beitr. z. Entwicklgesch. der Quitte, Dissert. Zürich 1897 (dort die Lit. über die Verbreitung). — DE CANDOLLE, L’origine d. plant. cult. — SCHÜBELER, Pflanzenw. Norwegens. — TSCHIRCH in Real-Enzyklopädie. — Abbild.: HAYNE, Arzneigew. IV, t. 47. — NEES VON ESENBECK, Pl. med. t. 305. — DODEL, Anatom. physiolog. Atlas (Blüte). — BERG, Charakteristik t. 63, f. 479. — BERG-SCHMIDT, Atlas I. Aufl. — PABST-KÖHLER, Medizinalpfl. t. 34. — BENTLEY-TRIMEN, Medicin. plants t. 106.
[S. 330]
Pathologie. Über die Krankheiten der Quitte berichtet Prof. ED. FISCHER: In großer Zahl fallen in gewissen Jahren die jungen Quittenfrüchte der Sclerotinia Cydoniae SCHELLENB. zum Opfer. Das Mycel dieses Pilzes überwintert in den Zweigen, wächst dann im Frühjahr in die jungen Blätter, die gelbbraun bis schwarzbraun werden und absterben. Auf diesen erkrankten Blättern erscheint die sog. Moniliaform des Pilzes, welche durch mandelartigen Geruch wahrscheinlich Insekten anlockt, die diese Sporen auf die Narben der Quittenblüten übertragen. Hier findet die Keimung statt; die Keimschläuche wachsen durch den Griffelkanal in den Fruchtknoten. Dieser bleibt, statt zu einer normalen Frucht heranzuwachsen, klein, verwandelt sich in ein Sclerotium und fällt im Herbst ab. — Übrigens kann das Mycel auch direkt aus einem erkrankten Zweige in eine Blütenknospe hineinwachsen und diese zum Absterben bringen (s. H. C. SCHELLENBERG: Über die Sklerotienkrankheit der Quitte. Berichte der deutschen botan. Gesellschaft Band XVII, 1899). — Eine Fleckenkrankheit der Quittenfrüchte wird durch Trichoseptoria fructigena MAUBLANC hervorgerufen.
Über die tierischen Schädlinge berichtet ISRAËL: Die Feinde von Apfel-, Birn- und Quittenbaum lassen sich nicht trennen.
1. Käfer: Liopus nebulosus L.: Larven unter der Rinde von Obst- und Waldbäumen. Anobium striatum OL.: Die Larven dieses sehr gemeinen und in Möbeln und Gebälk sehr schädlichen Käfers lebt auch im Holze alter und kranker Obstbäume. Bostrychus dispar. FABR.: Larven im Splinte diverser Obstbäume. Die Larven der Bostrychiden veranlassen sowohl an Laub- als auch an Nadelhölzern die sog. Wurmtrocknis. Mehrere Eccoptagaster- und Magdalinusarten leben als Larven im Splinte von Pflaumen-, Apfel-, Birn- und Quittenbäumen. Auch in Kirschen und Schlehen usw. Otiorhymhusarten werden schädlich durch das Benagen junger Triebe. Häufig an Obstbäumen usw., auch an dem Weinstocke gelegentlich schädlich. Phyllobius calcaratus FABR., P. pyri L., P. argentatus L., P. oblongus L., Polydrususarten: Diese Grün- und Glanzrüsselkäfer werden gelegentlich lästig und schädlich durch das Benagen von Knospen, Blättern und krautartigen Stengelorganen der Obstbäume. Von den Rhynchitesarten (Rebenstecher) sind es ganz besonders Rh. cupreus L., bacchus L., alliariae L., aequatus L., aureus SCOP. und andere, die oft sehr lästig werden können. Die Larven leben entweder in den Früchten oder den jungen Trieben. Auch Anthonomusarten (Blütenstecher) treten gelegentlich schädlich auf. Die Larven fressen die Geschlechtsorgane der Blüten aus und verpuppen sich in den verdorrenden Blüten. Auch Apionarten (deren Larven meist in den reifenden Hülsen von Leguminosen leben) schaden als Käfer durch das Benagen der Knospen usw.
2. Falter. Papilio podalirius L.: Raupe an Apfel-, Birn-, Quitten-, Aprikosenbäumen, besonders an Schlehen und Pflaumen. Aporio crataegi L.: Raupe an Obstbäumen und Schlehen. Vanessa polychloros L.: Raupe an Ulmen, Apfel-, Birn- und Quittenbäumen, auch an Weichsel und Kirsche. Lycaena argiolus L.: Raupe an Rhamnus Frangula, Pirus communis, P. malus, Mespilus germanica. Smerinthus tiliae L.: Raupe an Linde, Eiche, Birke, Ulme, Maulbeere, seltener an Apfel, Quitte, Syringe. Smerinthus ocellata L.: Raupe an Weiden, Pappeln, Aspen, seltener an Apfel, Quitte, Birne. Zeuzera aesculi L., Cossus cossus L.: Raupen in Wald- und Obstbäumen. Cossus oft zahlreich in einem Stamme und denselben baldigst vernichtend. Die Raupen verraten sich oft durch den starken Geruch nach Holzessig. Zeuzera mehr im Holze der Zweige, gelegentlich auch in den Wurzeln, seltener im Stammholze. Saturnia pyri W. V., S. spini W. V.: Raupen hauptsächlich in Ungarn an diversen Obstbäumen, z. B. an Apfel, Birne, Quitte, Schlehe, Aprikose usw. Saturnia pavonia L.: Raupe ziemlich polyphag, auch an Obstbäumen. Ocneria dispar L., Aglia tau L.: Raupen an Wald- und Obstbäumen. Orgyia gonostigma F., Or. antiqua L., Dasychira pudibunda L., Porthesia chrysorrhoea L., P. similis FUSSLY, Psilura monacha L. und viele andere Spinner leben an diversen Laubhölzern, auch in Gärten oft mehr oder minder schädlich auftretend. Bombyxarten (namentlich crataegi, neustria, lanestris) und Lasiocampaarten (namentlich quercifolia) tun in Obstgärten oft enormen Schaden. Die in Nestern lebenden Raupen sind im ersten Frühjahre leicht zu finden. Man muß die Nester abschneiden und verbrennen. Wenn sich die Raupen erst über den ganzen Obstbaum verstreut haben, ist es meistens zu spät, um einen Kahlfraß zu verhüten.
Die Zahl der Eulen- und Spannerraupen, die unter andern auch an Obstbäumen leben, ist sehr groß, ohne daß man diese aber als Spezialfeinde ansehen könnte, da sie gegenüber den schädlichen Spinnern bedeutend weniger in Frage kommen.
Unter den Microlepidopteren überwiegen die Tortricineen und die Carpocapsen.[S. 331] Carpocapsa pomonana S. V. frißt die Kerngehäuse aus und ist in manchen Jahrgängen stellenweise so häufig, daß man kaum einen Apfel oder eine Birne oder Quittenfrucht findet, in der nicht eine Wicklerraupe gefressen hätte. Die Früchte fallen im Zustande einer Notreife oft vorzeitig ab.
3. Schnabelkerfe. Unter den Schnabelkerfen ist, von einigen lästigen Blatt- und Schildläusen (unter diesen befinden sich mehrere aus Amerika eingeschleppte Schädlinge) abgesehen, die Blutlaus, ein furchtbarer Zerstörer der Obstbäume. Die Stämme werden meist krebskrank. Das Kalken der Bäume ist wohl (obgleich es von den Behörden angeordnet wird) nicht so sehr zu empfehlen, da man an den weißen Stämmen neue Brutherde zu leicht übersieht. In neuerer Zeit hat sich das Anstreichen der Stämme mit Carbolineum (mit gleichen Teilen Wasser verdünnt) gut bewährt. Übrigens ist die Zahl der Blutlausvertilgungsmittel, die mehr oder minder gut sind, sehr groß. Auch Auflösungen von roher Schmierseife in Wasser sind zu empfehlen.
Als Schädlinge der getrockneten Früchte (Quittenschnitzel, Ringäpfel usw.) kommen neben verschiedenen Käfergattungen (Anobium, Ptinus usw.) von Microlepidopteren u. a. in Betracht:
Ephestia kuehniella Z. Diese jedenfalls aus Nordamerika eingeschleppte Phycitinaee lebt in Weizenmehl und vielen anderen amylumhaltigen Drogen, besonders lästig werdend durch die Gespinstfäden. Sie nimmt mit Vorliebe aber auch getrocknete Quittenschnitzel, Ringäpfel, Pflaumen und Eßkastanien an. Sie scheint sich in den letzten Jahrzehnten sehr ausgebreitet zu haben. Ephestia calidella GR., E. figulilella GREGS., E. afflatella MN., E. cautella WLK., E. elutella HB., Pyralis farinalis L.: Die spinnenden Räupchen leben gerne (oft in sehr großer Anzahl) in allen möglichen getrockneten Früchten und stärkehaltigen Samen, besonders gerne in Feigen, Datteln, Johannisbrot, Mehlvorräten usw., auch in Pflaumen, Quittenschnitzeln, Ringäpfeln.
In der Droge findet sich oft Sitodrepa panicea (I, S. 379).
Handel. Sem. Cydoniae kommen in den Handel aus Südrußland (Krim), Spanien, Portugal, Südfrankreich, Teneriffa, Capland. Die russischen Samen sind voller, fester zusammenhängend, von fast violettschwarzer Farbe und reich an Schleim (FLÜCKIGER). Sie erzielen jetzt die höchsten Preise. Indien, das viel verbraucht, bezieht Sem. Cydon. (vermutlich seit undenklichen Zeiten, FLÜCKIGER) vom persischen Golf sowie auch aus Afghanistan, Kabul, Bokhara, Kaschmir.
Als russische Quittenkerne kommt in den letzten Jahren in der Hauptsache persische Ware in den Handel, die sowohl von den russischen Stapelplätzen wie auch über London und Hamburg zugeführt wird. Als sog. spanische (rötliche) Quittenkerne rangieren die spanischen, französischen und Kap-Sorten, welch letztere meist über London kommen (CAESAR & LORETZ).
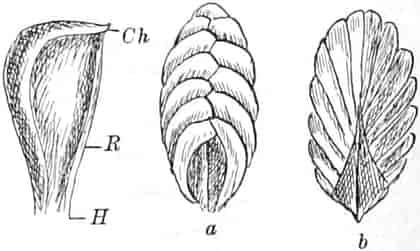
Cydonia vulgaris L.
Isolierter Same. a und b Samenballen eines Faches: a von außen, b von innen.
[Tschirch.]
Morphologie der Droge. Die Samen eines Faches sind für gewöhnlich um eine kurze Mittellinie in zwei Vertikalreihen orientiert und durch den Schleim zu einem ziemlich regelmäßigen Ballen verklebt (Fig. 112), so daß sie auch noch in der Droge oft zu mehreren zusammenhängen. Sie sind hart, rotbraun, mit einem Ton ins Violette, durch den eingetrockneten, bisweilen abschilfernden Schleim matt weißlich, spitz-eiförmig, halbherz- oder keilförmig, durch gegenseitigen Druck unregelmäßig-kantig, oft miteinander verzahnt. Der helle Nabel (Hilum) liegt am spitzen Ende, von ihm läuft die Raphe als ein scharfer, gerader Kiel zu der als erhöht-gerandeter Fleck seitlich hervortretenden Chalaza. Der der Raphe gegenüberliegende Rand beschreibt eine seichte Kurve (Fig. 112). Die Samen sind frisch etwa 8 mm lang, 4 mm breit und 2 mm dick und wiegen etwa 0,052 g; trocken messen sie etwa 7 mm (nicht über 10 mm) und wiegen im Durchschnitt 0,029 g (MORGENTHALER). Die Samen schmecken zuerst schleimig, ist die Schleimschicht entfernt herb-adstringierend, beim Zerkauen[S. 332] tritt schwacher Bittermandelgeschmack hervor. Legt man die Samen in Wasser, so umgeben sie sich mit einer Schleimhülle, schüttelt man sie mit Wasser — am besten unter Zusatz von einigen Glasperlen —, so löst sich die Schleimepidermis von der Schale ab und man erhält einen zähen Schleim. Der Embryo besteht aus zwei dicken plankonvexen, ölig-fleischigen, deutlich geaderten, wellenförmig zusammengelegten Cotyledonen und einer kleinen und kurzen, gegen das Hilum gerichteten geraden Radicula.
Cydonia vulgaris L.
Querschnitt durch die Randschicht des Samens an der Stelle, wo das Raphebündel liegt. Sep Schleimepidermis, in einigen Zellen kleine Stärkekörnchen. P Pigment- (Hart-)Schicht. NS Nährschicht. Psp Perispermrest. End Endosperm. Qu Quellschicht.
[Tschirch.]
Anatomie. Der trockene Same ist mit einer hellen derben, abschilfernden Schicht bedeckt, die unter Glycerin betrachtet keine Struktur erkennen läßt, aber im polarisierten Lichte glänzt. Läßt man zu dem in Glycerin liegenden Querschnitte langsam Wasser zufließen, so quillt diese Schicht mächtig (bis 0,170 mm) und nunmehr tritt die Struktur deutlich hervor. Es zeigt sich, daß sie aus einer Reihe prismatischer Zellen besteht, die deutlich geschichtete Schleimmembranen (Fig. 113, Sep) und auf der Innenseite ein kleines, etwas Plasma und oft noch kleine Stärkekörner enthaltendes Lumen besitzt. Die Schleimmembran, die sich mit Jodschwefelsäure blau färbt (KÜTZING, CRAMER), also zu den Zelluloseschleimen (TSCHIRCHS) gehört, ist aber so empfindlich gegen Wasser, daß sie rasch ihre Struktur verliert und sich in dem umgebenden Wasser verteilt. Der Schleim wird durch Hämatoxylin prächtig violett, durch Jod gelb bis rosa, bei viel Reagens rot bis braunrot. Diese große Schleimepidermis der Samen ist sehr charakteristisch für Cydonia, besonders zum Unterschiede von Pirus (doch haben die Samen von Pirus lomonii auch eine solche, DUTAILLY). Bisweilen unterbleibt in einzelnen Zellen die Schleimbildung, diese erscheinen dann seitlich zusammengedrückt. Die kappenförmige Ablagerung der Schleimschichten beginnt erst ziemlich spät (im August) an der Innenseite der Außenwand der Epidermiszellen und schreitet dann rasch bis zum Grunde fort (FRANK, LUERSSEN).[S. 333] Auf die Schleimepidermis folgt eine mehrreihige, an den Ecken dickere, an den Flächen schmälere, hier meist nur 3–4reihige, derbe Pigmentschicht (Fig. 113, P), die zugleich die Hartschicht bildet, deren verdickte, in der Längsrichtung des Samens gestreckte Zellen einen braunen Phlobaphenklumpen enthalten, der sich mit Eisensalzen färbt und deren Wand gegen Schwefelsäure resistent ist. Dann folgt die Nährschicht (Fig. 113, NS). Sie ist entweder ganz obliteriert (zum Teil sogar resorbiert), so an vielen Stellen an der Fläche des Samens oder es ist ihre äußere Zellreihe, oder — an den Kanten — mehrere Reihen erhalten. In ihr verläuft das Raphebündel (Fig. 113). Die Wände der Nährschicht sind gebräunt. Beim ganz jungen Samen besitzt die Nährschicht eine große Mächtigkeit und enthält, wie auch die junge Pigmentschicht und die Epidermis, reichlich transitorische Stärke. Bis hierher reicht die Samenschale. Dann folgt eine obliterierte Zone, die zu äußerst von einer Zellreihe begrenzt wird, deren dicke Außenwände gelbgefärbt sind. Wir dürfen die Zone wohl als einen Perispermrest betrachten (MORGENTHALER). An ihn schließt sich das mehrreihige Endosperm, das zu innerst von einer obliterierten Schicht begrenzt wird (Quellgewebe, TSCHIRCH und HIRSCH). Die Hauptmasse des Samens bilden die dickfleischigen Cotyledonen, deren Palissadenschicht deutlich ausgebildet ist und die so orientiert ist, daß die Palissadenseiten aufeinander liegen. Das Mesophyll ist von Procambiumsträngen durchzogen. Endosperm und Cotyledonen sind mit Aleuronkörnern erfüllt, die in Ölplasma (TSCHIRCH) eingebettet sind und von denen die größeren, wenigstens in Cotyledonen und Endosperm, neben Globoiden auch meist ein oder mehrere Kristalloide enthalten. Die größten Aleuronkörner (bis 28 mik) finden sich im Endosperm, die in den Cotyledonen sind etwas kleiner (bis 15 mik), die der Radicula sind am kleinsten (bis 7 mik, MORGENTHALER).
Lit. KÜTZING, Grundz. d. philos. Bot. t. 4. Fig. 4. — CRAMER a. a. O. (1855). t. 22. Fig. 3 u. 4. — HOFMEISTER, Ber. d. Sächs. Ges. d. Wiss. 1858. — FRANK a. a. O. — A. MICHELIS, Zur Anatom. schleimhalt. Samensch. Progr. d. städt. Realschule Königsberg 1877 (m. Abbild.). — TSCHIRCH, Artikel Cydonia in Realenzyklop. d. Pharm. — HIRSCH, Einricht. behufs Überführ. d. Reservestoffe in d. Embryo. Dissert. Erlangen 1890. — FLÜCKIGER, Pharmakognosie. — J. MORGENTHALER, Beitr. z. Entwicklungsgesch. d. Quitte. Diss. Zürich 1897 (dort auch die Keimungsgeschichte). — MARLOTH, Mechan. Schutzmitt. d. Samen. Engl. bot. Jahrb. IV, 236. — DUTAILLY, Un pirus à graines mucilagineuses. Bull. soc. Linn. 1898. — Nährschicht: HOLFERT, Flora 1890 (MORGENTHALER bringt Nährschicht und Nährgewebe durcheinander). — Anatom. Abbild. in OUDEMANS Atlas (1854). — BERG, Anatom. Atlas t. 46. — TSCHIRCH, Angew. Anatomie Fig. 36 u. 196. — HÉRAIL-BONNET, Manipulat. t. 35. — PLANCHON-COLLIN, Drog. simpl. 1896. — Anatom. Abbild., die Pektinbildung in der Fruchtschale der Quitte betr., in ROSENBERG, Über d. Pektinmetamorphose. Diss. Bern 1908 (mit 9 Taf.). Vgl. auch TSCHIRCH, Pektin u. Protopektin. Ber. d. pharm. Ges. 1907.
Chemie. Die Samen enthalten so viel Schleim (Cydonin, PEREIRA), daß sie das Vierzigfache ihres Gewichtes Wasser aufzunehmen imstande sind. Sie liefern denn auch c. 20% (lufttrockenen) Schleim (FLÜCKIGER). Der Rohschleim enthält viel Kalk und Eiweißsubstanzen — oft 10,4% Asche (SCHMIDT). Der Schleim bildet eine kolloidale Lösung. TOLLENS und KIRCHNER (1874) lösen zur Reinigung in Wasser, filtrieren, dampfen ein, versetzen mit Salzsäure und fällen mit Alkohol; getrocknet quillt er, wird aber erst auf Kalizusatz gallertig. Sie geben ihm die Formel C18H28O14 (= 3(C6H10O5) − H2O), SCHMIDT: C6H10O5, MULDER: C24H38O19.(= 4(C6H10O5) − H2O). Die geringere Menge H2O erklären KIRCHNER und TOLLENS durch Esterbindung im Molekül. Der Cydoniaschleim ist unlöslich in Alkalien und verd.[S. 334] Säuren, wird mit Jodschwefelsäure blau und gibt mit Salpetersäure Oxalsäure, nicht Schleimsäure (CRAMER, FRANK), enthält also kein Galaktan, ebenso liefert er hierbei keine bemerkenswerten Mengen Zuckersäure, enthält also auch kein Dextran (?). Er wird nicht durch Borax verdickt. Der lösliche Teil wird durch Alkohol und Metallsalze niedergeschlagen, ebenso durch Alkaloide. Gerbsäure verändert nicht, Kreosotwasser fällt nicht (Unterschied von Gummi- und Kirschgummischleim, REICHENBACH), Bleizucker fällt flockig (Unterschied von Acacien- und Carrageenschleim). Er läßt sich mit Natriumsulfat (FLÜCKIGER) und Ammonsulfat (POHL) aussalzen. Mit kaltem Wasser bilden Quittensamen eine sehr zähe Flüssigkeit, welche durch Filtrieren in dünnere und dickere Anteile sich trennen läßt (TOLLENS). Durch Erwärmen mit verdünnten Säuren wird Quittenschleim dünnflüssig und es scheiden sich c. 34% einer wie Zellulose reagierenden Substanz (auf der die Zellulosereaktion des Schleimes beruht) flockig ab. Das Filtrat enthält ein Gummi und einen rechtsdrehenden Zucker, der Arabinose oder Xylose zu sein scheint (TOLLENS). Vielleicht entsteht hierbei auch etwas Traubenzucker (BAUER und TOLLENS) bei der Destillation mit verd. Schwefelsäure entsteht Furfurol. Im Quittenschleim sind also (wie im Schleime von Plantago Psyllium) Pentosane enthalten (Araban und Xylan oder ein verwandter Stoff, GANS und TOLLENS). Der Cydoniaschleim hat viel Ähnlichkeit mit dem Traganthschleim. Vor der Reife enthält der Same in der Samenschale Stärke, Spuren finden sich auch bisweilen im reifen Samen (s. oben und Fig. 113 rechts).
Quittensamen liefern (ebenso wie die Rinde und die jungen, frischen Triebe) bei der Destillation mit Wasser ein blausäurehaltiges Destillat (STOCKMANN). Die Samen enthalten, neben Emulsin, nur wenig (0,4%) Amygdalin (JOUCK, LEHMANN gibt 1,2–1,5% an), das vollständig mit dem der Mandeln übereinstimmt. WICKE gab bereits 1851 an, daß das Amygdalin in vielen Pomaceen und Pruneen (Malus, Sorbus, Amelanchier, Cotoneaster, Crataegus, Cydonia, Eryobotrya, Prunus) vorkomme, hatte aber reines Quittenamygdalin nicht in Händen. Die Samen enthalten in der Samenschale eine gerbstoffartige Substanz und im Samenkern 15% Öl (BRAND). Das Öl der Samen enthält als Hauptbestandteil Myristicinsäure, C14H28O2, dann eine mit Isopentadecylsäure isomere und eine ungesättigte, flüssige Säure, C18H34O2 (= C17H32OH.COOH), sowie 4,1% Glycerin (R. HERRMANN). HAUKE gibt die Asche der Samen zu 4,45% an, WARNECKE zu 3,55%. Die Asche ist reich an Phosphorsäure (42%, SOUCHAY).
Lit. Schleim: PEREIRA, Heilmittellehre (dort Reaktionen des Schleims). — BOSTOCK, Nichols. Journ. VIII, 31. — C. SCHMIDT, Lieb. Ann. 51, 29. — KIRCHNER u. TOLLENS, Lieb. Ann. 175. — MULDER, Journ. pr. Chem. 37. — FRANK, Pringsh. Jahrb. 5 u. Journ. pr. Chem. 95. — FLÜCKIGER-HANBURY, Pharmacographia. — FLÜCKIGER, Pharmakognosie. — GANS und TOLLENS, Lieb. Ann. 249 (1889), 245. — SCHULZE u. TOLLENS, Ebenda 271 (1890). — TOLLENS, Kurz. Handb. d. Kohlenhydr. 2. Aufl. 1898. — POHL, Zeitschr. phys. Chem. 14 (1890), 151. — Blausäure: W. WICKE, Lieb. Ann. 79 (1851) und 81 (1852). — JOUCK, Beitr. z. Kenntn. d. Blaus. abspalt. Glycos. Diss. Straßb. 1902. — E. LEHMANN, Beitr. z. vergl. Unters. über Vork. u. Verbreit. d. Amygdalins usw. Pharm. Zeitschr. f. Rußland 1895, 352. — Öl: R. HERRMANN, Über d. fette Öl d. Quittens. Arch. Pharm. 237 (1899), 358. — Asche: HAUKE, Zeitschr. österr. Apoth. Ver. 1902. — SOUCHAY, Jahresb. d. Ph. 1845, 66.
Quittensaft enthält nach TROUCHON und CLAUDE g in 100 ccm: Invertzucker 7,59, Gesamtsäure auf Weinsäure berechnet 0,96, durch Alkohol fällbare Stoffe 0,46, Asche 0,42. Quitten enthalten keine Saccharose, wohl aber Weinsäure. Nach RIEKHER soll neben Zucker, Pektin und Gummi 3,5% Apfelsäure darin vorkommen. LANCASTER erhielt 1,6 g Bleimalat aus 453 g Frucht. Die Säuren der[S. 335] Quitte bedürfen einer erneuten Untersuchung. WÖHLER erhielt bei der Destillation reifer Quitten mit Wasser einen Oenanthäther, R. WAGNER hält jedoch das Arom für Pelargonsäureäthylester. Künstliche Quittenessenz besteht aus Äthylpelargonat. Das Pektin der Quittenfracht ist stark rechtsdrehend (αD = +188,2) und enthält ein Galaktoaraban. Es gibt bei der Hydrolyse Arabinose und mit Salpetersäure Schleimsäure. Der Pentosangehalt der wilden Quitte beträgt 3,23, der der Kulturquitte 1,78% der Trockensubstanz (WITTMANN).
Lit. WÖHLER, Lieb. Ann. 41, 239. — LANCASTER, Am. journ. pharm. 31, 198. — TRUCHON et CLAUDE, Journ. pharm. chim. 13 (1901), 171. — JAVILLIER, Ebenda 9 (1899), 513. — KÖNIG, Nahrungs- u. Genußm. — Über das Pektin der Frucht vgl. oben S. 280 unter Pektino-Membranine.
Anwendung. In der Volksmedizin (als Aphrodisiacum, zur Erzeugung kluger Kinder) und im Volksaberglauben (Liebeszauber) spielt die Quitte von jeher eine (allerdings beschränkte) Rolle. Die Nützlichkeit der Quitte schildert schon der alte Vers:
«Quittenkern in Rosenwasser geweicht geben ein glattes feines sälblein zu allerhand brand und breune der zungen, darmit bestrichen», steht in BOCKS Kräuterbuch. Unter den schleimigen Mitteln des HIPPOKRATES steht Cydonia (κυδωνέα). Er benutzte also wohl schon die Samen. Nach MATTHIOLI war Quittensamen in Spanien Antidot gegen Helleborus. Auch bei ATHENAEUS (Deipnosophist. III, 21) wird die Quitte als Gegengift genannt. Quittensamen sind seit langer Zeit ein Bestandteil der chinesischen Materia medica. Die Benutzung ihres Schleims scheint vornehmlich von den Arabern ausgegangen zu sein. Doch ist die Benutzung der schleimigen Samen wohl ein auf die hochasiatische Heimat des Baumes zurückzuführender Brauch (FLÜCKIGER). In Turkestan hat sie noch jetzt beträchtliche Ausdehnung. In dem Liber fundamentorum des ABU MANSUR MUWAFFAK (X. Jahrh.) wird die Benutzung des Samen der Safardschal bei Husten erwähnt. Im Altertum war ein fettes Quittenöl (durch Enfleurage oder Maceration der Früchte mit Öl bereitet) als Arzneimittel beliebt (DIOSKURIDES). Auch MESUË kennt ein zunächst durch Maceration, dann durch Auskochen mit Öl bereitetes Ol. Cydoniorum, das dann CORDUS, der ja vielfach noch auf MESUË fußt, in sein Dispensatorium aufgenommen hat. DIOSKURIDES nennt eine Menge Krankheiten, bei denen Quittenfrüchte innerlich und äußerlich anzuwenden sind. Man bereitete aus ihnen einen Wein und ein κυδωνόμελι sowie sog. Honigäpfel (melimela). In dem von CORDUS aufgenommenen Syrupus de Absinthio maior des MESUË findet sich Succus Cydoniorum. In der Pharmacia simplicium des CORBEIUS (1656) werden eine Menge Krankheiten genannt, die durch Quitten zu heilen sind. In Indien, wo der Same Handelsartikel ist, ist er außerordentlich beliebt in der Volksmedizin. Der Schleim wird bei Husten und Darmleiden benutzt, äußerlich bei Verbrennungen der Haut. Bei den Arabern sind auch Blätter, Blüten und Rinde des Baumes Hausmittel. Die persischen Karabádins (Grabadins [I, S. 599], d. h. Pharmakopoëen) kannten Konserven aus Frucht und Blüte (Pharmac. indica). GEIGER führte (Handb. d. Pharm. 1830) folgende Quittenpräparate an: Saft, Sirup, Mus (Roob, Pulpa), Marmelade, Quittenbrod (conditum s. panis c.), Extr. und Tinct. ferri cydon. und Mucilago sem., endlich Quittenliqueur und Quittenwein. Die Poma Cydoniorum (Cydonia exsiccata), das Extr. ferri cydoniati, der Syr. Cydoniorum (nach Art des Kirschsaftes dargestellt) und der frische Quittensaft sind noch jetzt, besonders in Frankreich und Österreich, beliebt. Der Schleim wird noch heute bei Hautleiden und oft auch als Zusatz von Augenwässern benutzt. Er findet auch in der Zeugdruckerei Anwendung. Eine Abkochung der Samen dient in Indien als Tonicum und Antidyssentericum (DYMOCK, Dict. econ. prod. u. and.).
Verfälschungen. Als solche werden besonders die Samen der Birne und des Apfels genannt. In der Form sind sie ähnlich, aber gerundet, niemals unregelmäßig abgeplattet, da sie in dem Fruchtfache isoliert oder zu zweit liegen und daher auch niemals miteinander verklebt sind. Sie umgeben sich auch in Wasser nicht mit einer[S. 336] breiten Schleimhülle, sind sehr wenig schleimig und glänzend dunkelbraun. Ihre Schleimepidermis ist sehr schmal, die Zellen sind kaum radial gestreckt.
Rosinenkerne besitzen eine ganz andere Form und sind leicht kenntlich. HAGER gibt als Verfälschung (bis 50%) «die Schale einer Frucht von brauner Farbe oder braun gefärbt und schwach weißlich bestäubt» an. Neuerdings sind in Amerika kleine Fragmente getrockneter Quittenfrüchte als Verfälschung beobachtet worden.
Geschichte. Die goldenen Äpfel (χρύσεα μῆλα, χρυσομήλα) der Hesperiden und der Atalante, «der der Aphrodite geweihte, in Mädchen- und Liebesspielen aller Art und zu bräutlichen Gaben dienende Apfel» (HEHN), der Apfel des Paris, der Erisapfel, das alles waren wohl «idealisierte» Quitten. Auf die Angabe in des BEN SIRA Alphabet (XI. Jahrh.), daß der Garten NEBUKADNEZARS auch Quittenbäume enthalten habe, ist nichts zu geben, obwohl die Pflanzenliste älter ist (LÖW). Dem semitisch-ägyptischen Kulturkreise scheint die Quitte in älterer Zeit fremd geblieben zu sein (SCHRADER). In der Bibel fehlt die Quitte (bei dem goldenen Apfel in den Sprüchen handelt es sich vielleicht nicht einmal um eine Frucht, sondern nur um ein Ornament) und das Althebräische hat keinen Namen für Quitte, erst im Aramäischen finden wir einen solchen, nämlich ỉspargᵉlîn (LÖW). Da die Griechen die Quitte μήλον κυδώνιον, d. h. Apfel von Κύδων (untergegangene Stadt, wahrscheinlich unweit des heutigen Canea auf Creta) nannten, erhielten sie sie wohl von Creta, wo sie entweder ursprünglich zu Hause oder frühzeitig aus Kleinasien eingeführt war. ISIDOR bemerkt im Etymologicon: «Malus Cydonia nomen sumpsit ab oppido, quod est in insula Creta, de qua dicere solent, urbium Cretensium matrem Cydoniam, ex cuius pomo Cydonitum conficitur» — auch der Talmud spricht von kretensischen Äpfeln. Jedenfalls wurde sie in Creta, dem Eldorado der Arzneipflanzenkultur des Altertums, besonders eben bei Κύδων (κυδώνεια — κυδώνιος = kretisch) in großem Umfange kultiviert. (Jetzt fehlt sie auf Creta). Die Griechen lernten sie schon in sehr früher Zeit kennen, denn sowohl der Dichter ALKMAN (650 n. Chr.), wie der Italiot IBYCUS (VI. Jahrh. n. Chr.), wie der Sikuler STESICHOROS (c. 550 n. Chr.) erwähnen die Quitte aus Lydien bzw. aus Rhegium und Sizilien (bei ALKMAN heißt sie κοδύμαλον). Die Kulturquitte muß also schon im VII. Jahrh. den griechischen Kolonisten in Kleinasien, Sizilien und Unteritalien bekannt gewesen sein (HOOPS). Die Quitte war wegen ihres Duftes und ihrer zahlreichen Samen bei den Griechen Symbol der Schönheit, Liebe und Fruchtbarkeit und der Aphrodite heilig. SOLONS Gesetz verordnete, daß die Braut, ehe sie sich ins Brautgemach begab, eine Quitte essen mußte, um sich unter den Schutz der Aphrodite zu stellen (PLUTARCH). Und auch bei den Deutschen wurde sie später Sinnbild der Fruchtbarkeit und einer glücklichen Ehe (AIGREMONT). Bei den Liebes- und Hochzeitssitten spielt sie in den Balkanstaaten, Dalmatien und Siebenbürgen noch jetzt eine Rolle. Auch zu den Römern kam die duftige Quitte, die sie malum cotoneum (m. aureum) nannten, frühzeitig und spielte bei ihnen im Kultus und Volksleben eine große Rolle. PLINIUS, der eine Menge Krankheiten nennt, die die Quitte heilt, sagt, man bewahre sie wegen ihres Duftes in den Besuchszimmern auf und das ist heute noch Sitte in Italien. Zur Zeit GALENS kam spanische Marmelade (= Quittengelee, s. oben) nach Rom. Das malum cydonium, findet sich im Edikt DIOCLETIANS (s. oben) und alle Scriptores rei rusticae von CATO bis PALLADIUS (I, S. 574) widmen ihr ihre Aufmerksamkeit. Wir finden sie denn auch auf den pompejanischen Wandgemälden (I, 575) und auf den Wandbildern der Villa Livia in Primaporta (MÖLLER, D. Bot. in d. Fresk. d. Villa d. Livia. Mitt. d. kais. Archäolog. Inst. Rom 1890). Cydonia mala stehen auch bei SCRIBONIUS LARGUS (I, S. 577) und werden bei ATHENAEOS NAUCRATITES (III. Jahrh. I, 574) erwähnt. Die Römer brachten sie dann mit den übrigen Obstbäumen nach den nördlichen Provinzen des Reiches. Doch fehlt es an alten Funden daselbst, obwohl die Samen nicht vergänglicher sind als die des Apfels. «Der althd. Name kutina, dem wahrscheinlich eine lateinische Form cudonia oder codonea = germ, kudinjō (?) zugrunde liegt, deutet wegen der Verschiebung von d zu t auf Entlehnung in den ersten Jahrhunderten» (HOOPS). Den Angelsachsen scheint die Quitte erst auf britannischem Boden bekannt geworden zu sein. Sie wird bereits im Corpus-Glossar erwähnt. Nördlich der Alpen wird sie sich dann wohl besonders durch die Benediktiner (I, S. 619) eingebürgert haben. Wir finden die cotonarios im Capitulare KARLS (I, S. 620) und dem Breviarium, im St. Galler Klosterplan (hier als: guduniarius I, S. 622), bei der HILDEGARD, ALBERTUS MAGNUS und in dem Opus ruralium des CRESCENZI (I, S. 678). Auch die spanische Landwirtschaft kennt sie. Im Kalender des HARIB (I, S. 612) steht beim September:[S. 337] apparent citonia. Die Zeit der Einführung der Quitte nach England läßt sich nicht mehr feststellen. Gebackene Quitten werden (nach HANBURY) 1466 gelegentlich der Installation des Erzbischofs von York, NEVILL, erwähnt (LELAND, De reb. brit. collectan. VI [1774] 5). Die Semina cytoniorum wurden von MESUË für viele Sirupe, wie den Syrupus de Prassio, den Syr. de Jujubis, den Syr. violarum und Syr. de Hyssopo benutzt, die alle CORDUS in sein Dispensatorium (I, S. 795) aufgenommen hat. In dem Empl. diachylon aber, das in seinen verschiedenen Vorschriften (bei MESUË und CORDUS) alle möglichen Schleime (von Linum, Psyllium, Althaea, Malvawurzel, Fenum graecum, Ficus, Passulae (!), Ulmusrinde) enthält, fehlt der Cydoniaschleim. BOCK empfiehlt die Samen mit Rosenwasser ausgezogen bei Bräune. Im Frankfurter Catalogus von 1582 steht: Cydonia mala de Bengala condita, eine frembde Art der eyngemachten Kütten aus India — was darauf deutet, daß auch eingemachte indische Quitten damals in Benutzung waren — in der Taxe von Eßlingen 1571 (I, S. 816): Sem. citoniorum. Auch in der BERLU-Liste (1724, vgl. I, S. 951) stehen Sem. cydon.
Lit. HANBURY, Pharmacogr. — FLÜCKIGER, Pharmakogn. — Pharmac. indic. — HEHN, Culturpfl. — KOCH, Bäume u. Sträucher d. alt. Griechenl. 1879. — STESICHOROS in Poetae lyrici graec. ed. Bergk. — LÖW, Aramäische Pflanzennamen. — DE CANDOLLE, L’origine des pl. cult.
Semen Psyllii.
von Plantago Psyllium L., die Flohsamen (bei den Griechen: Kynops, Psyllion, Buprestis, bei den Römern: Pulicaria) sind medizinisch kaum noch in Anwendung. Der auch hier als Schleimepidermis auf der Samenschale vorkommende Schleim (Xylin, BAUER) soll der Formel C36H58O29 entsprechen. Analyse auch bei SCHMIDT (Lieb. Ann. 51). Er liefert bei der Hydrolyse mit 1,5% Schwefelsäure neben Zellulose [KIRCHNER und TOLLENS, Lieb. Ann. 175 (1875), 205]. bis 108,3% Glukosen, mit Salpetersäure aber keine oder nur sehr wenig Schleimsäure (BRACONNOT). Flohsamenschleim wird wie Leinsamenschleim in der Zeugdruckerei, in der Buntpapierfabrikation, als Appreturmittel für verschiedenartige Stoffe verwendet (VALENTA).
Auch die in Indien in hohem Ansehn stehenden Ispaghúl-Samen oder Spogel seeds (arab. bazre qatúná) von Plantago decumbens FORK. (P. Ispaghula ROXB.), die sich sogar in der Pharmakopoea indica (1868) fanden, enthalten eine Schleimepidermis auf der Samenschale (vgl. FLÜCKIGER-HANBURY, Pharmacographia p. 490).
2. Schleimendosperme.
Samen mit Schleimendosperm, wie ich 1888 in der Angewandten Anatomie diese Gruppe von Nährgeweben genannt hatte, finden wir besonders bei den Leguminosen (Trigonella, Ceratonia, Gymnocladus, Cassia, Schizolobium, Gleditschia, Tetragonolobus, Indigofera, Medicago, Trifolium, Colutea, Genista). Es handelt sich hier nicht, wie HABERLANDT meinte, um «Quellschichten» oder «innere Quellapparate», sondern um Reservebehälter. Denn, wie Versuche, die ich mit NADELMANN 1889 angestellt habe, gezeigt haben, wird der Schleim, der hier ebenfalls in Form sekundärer Membranverdickungsschichten auftritt, und zwar für gewöhnlich schon als solcher angelegt wird, bei der Keimung gelöst. Dadurch treten diese Endosperme an die Seite der Endosperme bei denen Reservezellulose als Reservestoff auftritt (Palmensamen), mit denen sie durch mancherlei Übergänge (z. B. die Samen der Strychnaceen) verbunden sind, und wir werden auch chemisch mancherlei Beziehungen zwischen diesen beiden Gruppen finden. Ich habe denn auch oben im Kapitel Reservezelluloso-Membranine die Leguminosensamen mit erwähnt. BOURQUELOT und seine Mitarbeiter fanden in der ganzen Gruppe der «Albumens cornés» (vornehmlich der Leguminosen) Mannogalaktane (Galaktine, MÜNTZ), d. h. sie erhielten bei der Hydrolyse der Endosperme Mannose und Galaktose. So erhielten BOURQUELOT und HÉRISSEY z. B. bei der Hydrolyse des Schleimendosperms von Ceratonia Siliqua (S. 145) einen reduzierenden[S. 338] Zucker, aus dem sie 72,56% Mannose und 20,37% Galaktose in kristallinischer Form isolierten; in dem Hydrolysezucker des Luzernenendosperms war 51,38% Mannose und 49,49% Galaktose, in dem der Strychnossamen 11,02% Mannose und 35,45% Galaktose enthalten und die gleichen Zucker erhielt GORET bei Gleditschia, Medicago, Melilotus, Lotus und Indigofera. Jedenfalls besitzen also die Schleime der Schleimendosperme den Charakter von Polysacchariden. Der Biolog würde sie mit den Reservezelluloso-Membraninen zusammen abhandeln, pharmakologisch-pharmakognostisch gehören sie aber neben die Lein- und Quittensamen, aber in eine besondere Abteilung, da sie ihren Schleim erst nach dem Pulvern hergeben, die Samen mit Schleimepidermen dagegen schon durch Schütteln der unzerkleinerten Samen mit Wasser.
Lit. TSCHIRCH, Angew. Pflanzenanatomie S. 204. — NADELMANN, D. Schleimendosperme der Leguminosensamen. Ber. d. d. bot. Ges. 1889, 248 u. Pringsh. Jahrb. 21 (m. Taf.). — Schleimendosperm des Johannisbrot: EFFRONT, Compt. rend. 125 (1897), MARLIÈRE, La cellule 13 (1897), VAN EKENSTEIN, Compt. rend. 125 (1897), 719, BOURQUELOT et HÉRISSEY, Journ. pharm. chim. 10 (1899), 153 u. 249 und Compt. rend. 129 (1899). — Cassia fistula: BOURQUELOT, Vol. jubilaire de la soc. de Biologie 1900, 388. — Luzerne: MÜNTZ, Ann. chim. phys. (5) 26 (1882), 121 und (6) 10 (1887), 566, BOURQUELOT et HÉRISSEY, Journ. pharm. chim. 11 (1900). — Gleditschia, Medicago, Lotus, Melilotus, Indigofera: GORET, Et. chim. et. phys. de quelques albumens cornés d. graines léguminos. Thèse Paris 1901. — Strychnaceen: BOURQUELOT et HÉRISSEY, Journ. pharm. chim. 12 (1900). — Trigonella s. w. u.
Semen Fenugraeci.
Syn. Sem. Faenugraeci oder Foenugraeci, Sem. Faeni graeci, Sem. Foeni graeci, Sem. Trigonellae — Bockshorn (so schon bei BOCK und CORDUS), Bockshornklee, Kuhhornklee, Griechisches Heu, Fänne-Zwock — trigonelle, fenugrec (franz.) — trigonel, fenugreec (engl.) — hoornklaver (holl.) — trigonella (ital.) — τριγονέλλη (n.-griech.) — méthi (sansk., hind.) — hulbah (arab.) — shamlit (pers.) — lu-pa, hu-lu-pa (chines.).
Bei THEOPHRAST (Hist. u. caus. plant.): βούκερας, bei den späteren Griechen auch βουκέριν, bei DIOSKURIDES: τῆλις (bei d. spät. Griech. auch τίλις, τύλη; τῆλις auch noch bei ALEXANDER TRALLIANUS), im Edict Diocletians (I, S. 569): τῆλις βούκερας. Weitere Namen bei LANGKAVEL und DIOSKURIDES in []. Im Mittelalter auch aspaltea, brindelia.
Etym. Fenum (auch faenum oder foenum) = Heu, Fenugraecum also = griechisches Heu. — Trigonella von τρίγωνος = dreieckig, wegen der dreieckigen Blumenkrone (KANNGIESSER). Vielleicht hat LINNÉ, der den Namen zuerst in dem Hortus upsalensis benutzt, eher an die Blumenblättchen (?) oder, wie mir scheint, an die Blätter gedacht. — GRASSMANN bezieht auch Zwock auf die keilförmigen Fiederblättchen. Nach FLÜCKIGER bezieht sich der Name auf die dreieckigen Blumenblätter von Trigonella ruthenica L. Der Name Foenum Graecum wohl zuerst bei PORCIUS CATO (De re rustica XXVII, vgl. I, S. 572); bei COLUMELLA (I, S. 573) wird Siliqua (bei PLINIUS: Silicia) als synonym mit faenum graecum (vulgär lat.: fenum graecum) bezeichnet, was darauf deutet, daß die Pflanze viel kultiviert wurde (Katexochenbegriff!), denn es waren den Römern ja viele Hülsenfrüchte bekannt. Bei CAELIUS AURELIANUS (III. Jahrh. n. Chr.), sowie den Spätlateinern findet sich denn auch die zusammengezogene Form fenugraecum, im Deutschen volksetymologisch umgebildet: fine grethe (daraus dann wieder: schöne Margret, schöne Marie). Im Gothaer Arzneibuch (I, S. 680) findet sich fenum grotum neben fenum grecum, in Inventaire LEFORT (I, S. 804) fin ogre (DORVEAUX). Graecum nach der Herkunft, erhalten in griechisch Heu (gresches houw, gekeshew, krichishew, kriechshöwe, crischowe); römischer Klee deutet, da im Althd. als Römsklee(oder diolde) nachgewiesen, auf die Einführung aus dem Süden. — Bockshorn wegen des unangenehmen Geruches und der hornartigen Form der Frucht. Auch der[S. 339] Name Siebengezeit (Siebengezide Ort. san., im XV. Jahrh. Sybengetzeyt, Zeytkraut [XVI. Jahrh.], Stundenkraut) soll nach TABERNÄMONTANUS auf den (siebenmal im Tage verschwindenden und wiederauftretenden) Geruch anspielen. Der holländische Name bedeutet Hornklee. Und an Horn knüpfen an: bukeros (= Ochsenhorn), aigokeros (= Ziegenhorn), keraïtis (= hornähnlich), kallikrea, Kuhhorn (bei Bock) u. and.
Stammpflanze und systemat. Stellung. Trigonella Foenum-graecum L. [Sp. plant. ed. I (1753) p. 777] (Foenum graecum officinale).
Leguminosae, Papilionatae — Trifolieae, Eutrigonella, Gladiatae.
Beschreibung der Stammpflanze. Einjähriges Kraut mit einfachen oder vom Grunde verzweigten, 20–60 cm hohen, gegen oben hin behaarten, runden Stengeln und zweizeiligen, dreizähligen Fiederblättern, deren Endblättchen größer und länger gestielt ist als die Seitenblättchen. Blättchen kahl, umgekehrt eiförmig, im oberen Teile mit spitzen Zähnen besetzt. Nebenblätter zart, zweispitzig. Die hermaphroditen, zygomorphen Schmetterlingsblüten sitzen einzeln oder gepaart in den Achseln der oberen Laubblätter, der gamosepale, röhrenförmige Kelch ist in fünf gleiche lanzettliche Zipfel geteilt. Die gelblich weiße Corolle hat eine oblong-umgekehrt-eiförmige, tief ausgerandete Fahne, einseitig geöhrte Flügel und einen kurzen Kiel. Die Staubfadenröhre ist oben offen und wird durch das freie Stamen geschlossen. Die Narbe ist polsterförmig. Die aufrechte Frucht erreicht 13 cm Länge und ist 4–5 mm breit, lineal, sehr lang schnabelförmig zugespitzt, meist nach unten flach hornförmig gekrümmt und seitlich zusammengedrückt. An der Spitze der Frucht findet man bisweilen die Reste der Corolle. Die Pflanze wächst wild in Punjab, Kaschmir (BAKER), Mesopotamien und Persien (BOISSIER, Flor. oriental.), sowie Kleinasien (?). Verwildert findet sie sich in Griechenland, Italien und Spanien, wohl auch in Ägypten und Kleinasien auf Schuttplätzen, «überhaupt in der Nähe menschlicher Wohnungen oder Kulturstätten als Flüchtling». Blüht im Juni-Juli.
Lit. LUERSSEN, Mediz. pharm. Bot. — BATTANDIER, Bull. soc. bot. France 1884, 378. — Abbild.: BERG-SCHMIDT, Atlas. 2. Aufl. t. 52 (dort die florist. Literatur). — BENTLEY-TRIMEN, Medic. plants. t. 71. — PABST-KÖHLER, Medizinalpflanz. t. 155. Auch schon im Ortus sanitatis, Mainz (vgl. I, Fig. 303), bei POMET u. and.
Pathologie. Auf Trigonella foenum graecum sind unseres Wissens nur Parasiten bekannt, die Stengel und Blätter befallen: Uromyces Anthyllidis (GREV.), Uromyces Trigonellae PAT. und Erysiphe Polygoni DC. (ED. FISCHER).
Kultur und Handel. Trigonella wird jetzt in Marokko (Ausfuhrhafen besonders Mazagan, dann auch Mogador), dann in Ägypten (und Abessynien) und Indien (hier in ziemlicher Menge, Ausfuhrhafen: Bombay), sowie China kultiviert, weniger in Südfrankreich (Montpellier), der Schweiz, Deutschland (Elsaß, Thüringen: Erfurt, Großengottern, Mühlhausen, Cölleda, dann im Vogtland und in Söflingen b. Ulm, früher zwischen Nürnberg und Bamberg), Mähren (Znaim) und Italien (in Ligurien, Toscana, Sizilien und Sardinien kultiviert und verwildert, RAVASINI). Sie gedeiht noch bis 70° n. Br. in Norwegen (SCHÜBELER). Ich sah sie auch in Bauerngärten.
Allein in Bombay und Madras waren (1889) 1358 acres mit Fenugreec bestellt (WATT, Dict.) und 1890 kamen aus den höheren Inlandprovinzen c. 14000 cwts. nach Bombay. Die Ausfuhr Indiens von Fenugreec betrug 1906/07: 43941, 1907/08: 27285 und 1908/09: 9627 cwts., geht also zurück. Für indischen Samen ist Hamburg Haupteinfuhrshafen.
Morphologie. Die Früchte werden ausgedroschen. Sie enthalten eine wechselnde Menge an langen Funiculis befestigte Samen (5–20, meist 5–12). Eine Anzahl von Samenanlagen pflegt unentwickelt zu bleiben oder bald zu verkümmern. Die hellzimtbraunen[S. 340] oder gelbbräunlichen, mit der Lupe betrachtet feinhöckerig erscheinenden, Samen sind vierseitig-prismatisch oder rhombisch-rautenförmig, 3,5–5 mm lang und 2–3 mm breit (die chinesischen kleiner, die indischen größer), sehr hart und entweder glatt oder wenig runzlig. Bei längerem Verweilen in Wasser quellen die Samenkerne auf das Mehrfache und sprengen die Schale, die sich nun leicht ablösen läßt. Die Quellung erfolgt im Schleimendosperm. Durch eine tiefe Furche wird der Same in zwei Hälften geteilt, eine kleinere dreieckige, die Radicula enthaltende und eine größere mehr trapezförmige, in der die Cotyledonen und das Schleimendosperm liegen. An der Spitze der kleineren Hälfte liegt das Hilum. Das Lupenbild des aufgeweichten, in der Mitte durchschnittenen Samens (Fig. 114, 2) läßt in dem schmalen, runden Abschnitt die Radicula in dem breiteren ovalen die Cotyledonen, eingebettet in Schleimendosperm, erkennen. Während die Testa nur c. 170 mik dick ist, erreicht das gequollene Endosperm eine solche von 680–720 mik. Im trockenen Samen sind beide etwa gleich dick (Fig. 114, 1).
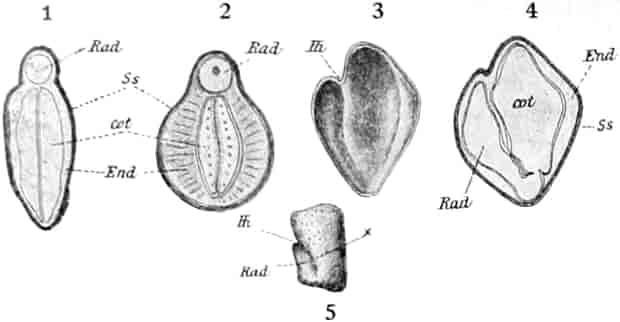
Trigonella Foenum-graecum.
1 Same trocken, querdurchschnitten. 2 Same aufgeweicht, querdurchschnitten. 3 Same längsdurchschnitten, Keimling herausgelöst. 4 Same längsdurchschnitten mit Keimling. 5 Same von außen.
[Tschirch-Oesterle, Atlas.]
Anatomie. Die Samenschale ist bedeckt von einer von der Cuticula bedeckten Schicht Palissadensklereïden, die etwa 65–80 mik hoch sind und an der inneren Seite ein weites Lumen besitzen, das sich nach außen stark verengert (Fig. 115). Das Lumen ist umgeben von einer derben, auf polarisiertes Licht stark reagierenden, im äußeren Teile getüpfelten Zellulosemembran, die nach außen hin zapfenartig in eine helle Schicht vorspringt, die indifferent gegen polarisiertes Licht ist, sich mit Jod graublau färbt, mit Jodschwefelsäure nur schwach auf Zellulose reagiert, sich in Kali löst und die wohl aus einer «gallertigen Zellulosemodifikation» besteht. Die Zapfenenden der inneren Membranschicht dringen ungleichweit nach außen vor und bilden da und dort bis zur Cuticula vordringende Gruppen, die die feinen Höcker der Samenschale (s. oben) bedingen. Die «Lichtlinie», die ich lieber «Lichtzone» nennen möchte und die sich bei der Sklereïdenschicht vieler Leguminosensamenschalen findet, verläuft hier ziemlich tief innen (Fig. 115, Ll) und ist relativ breit. Der Inhalt der Palissadenzellen ist körnig, färbt sich mit Jod gelb, gibt Gerbstoffreaktion mit Eisenchlorid und Osmiumsäure. Unter der Palissadenschicht liegt eine Schicht Säulenzellen (T-Zellen, Träger-, Sanduhr-, Spulenzellen), die eine, durch breite, besonders auf dem Flächenschnitt hervortretende, Längsstreifenverdickungen ausgezeichnete, Membran besitzen und große Interzellularen zwischen sich lassen. An den Flächen des Samens sind diese Zellen niedrig, am Radicularende hoch und dort, wie bei vielen Papilionaceensamen, knochenförmig. Dann folgt die, im unreifen Samen transitorische Stärke enthaltene, Nährschicht (vgl. oben S. 321). Sie ist sehr verschieden mächtig, auch verschieden stark obliteriert. Die äußeren Schichten pflegen keine Obliteration zu zeigen. Am Hilum und zwischen diesem und der Chalaza hat die Samenschale einen abweichenden Bau. Neben der Mikropyle, gegen die die Spitze der Radicula hin gerichtet ist,[S. 341] liegt in der Mulde eine doppelte Palissadenreihe und über der Raphe sind die Palissadensklereïden höher und die Säulenzellen fehlen. Unter der Ansatzstelle des Funiculus liegt, wie bei vielen Leguminosensamenschalen, die Nabelspalte und eine Gruppe von Tracheïden (Tracheïdeninsel, TSCHIRCH) und unter dieser ein braunes Parenchym, welches die auch äußerlich hervortretende braune Farbe der ganzen Partie um das Hilum bedingt. Von der Tracheïdeninsel läuft in einer wenig hervortretenden Schwiele die kurze Raphe zu der äußerlich am Samen wenig hervortretenden Chalaza. Innen liegt der Testa ein, besonders an der Spitze der Radicula hervortretendes, Häutchen an, das wohl der Rest des Perisperms ist.
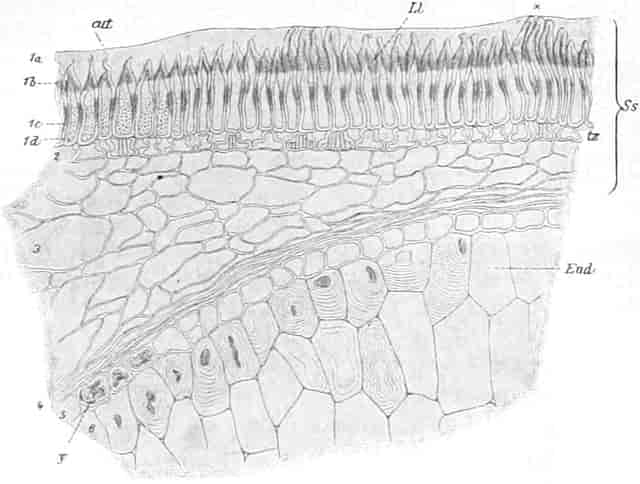
Trigonella Foenum-graecum. Querschnitt durch die Samenschale und den Rand des Schleimendosperms.
[Tschirch-Oesterle, Atlas.]
Das Endosperm ist bedeckt von einer einreihigen Aleuronschicht (Fig. 115, 5), deren Zellen einschlußfreie Aleuronkörner enthalten. Die Hauptmasse besteht aus Zellen, die eine zarte, aus Zellulose bestehende Mittellamelle erkennen lassen, im übrigen aber außerordentlich dicke, sekundäre Schleimmembranen besitzen, die sich mit Jodschwefelsäure nicht bläuen, also aus echtem Schleim bestehen. Sie zeigen bei geeigneter Behandlung Schichtung. Beim Keimen werden sie gelöst. Gegen die Cotyledonen ist das Endosperm durch ein Quellgewebe abgeschlossen.
Die Cotyledonen führen an der einander gegenüber liegenden Seite 2–4 Reihen Palissaden und sind an der Grenze dieser und des Merenchyms von zarten Procambiumsträngen durchzogen. In der Radicula liegt ein Kranz von Procambiumsträngen, in denen da und dort zarte Gefäße sichtbar sind. Die Zellen enthalten, eingebettet in Ölplasma, kleine Stärkekörnchen und zahlreiche Aleuronkörner, von denen die größeren, 10–20 mik messenden, ein Kristalloid enthalten. Die Globoide sind nicht in Körnerform, sondern als Balkengerüst ausgebildet (Details in TSCHIRCH-OESTERLE, Anatom. Atlas).
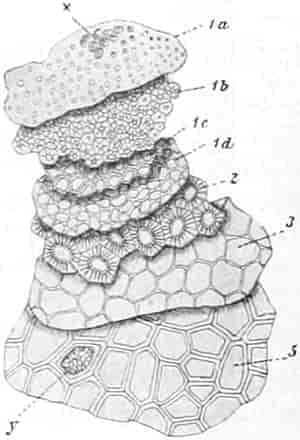
Trigonella Foenum-graecum. Succedane Flächenschnitte durch die Randschichten des Samens, besonders die Samenschale. Die Zahlen 1–5 bezeichnen die korrespondierenden Schichten in Fig. 115.
[Tschirch-Oesterle, Atlas.]
Das Pulver (nur durch Mahlen herzustellen) ist charakterisiert durch die Elemente der Samenschale (Fig. 116) — besonders charakteristisch sind die Säulenzellen —, die Schleimzellen und das Aleuron und Öl führende Gewebe des Keimlings. Haare fehlen. Stärke ist nur in geringer Menge vorhanden. Form, Bau und Größe der Aleuronkörner[S. 342] bieten gute diagnostische Hilfsmittel (Abbild. des Pulvers in KOCH, Atlas d. Drogenpulv. IV. t. 2).
Lit. SCHLEIDEN, Über d. Album. bes. d. Leguminosen 1838. — SEMPOLOWSKI, Beitr. z. Kenntn. d. Baues d. Samensch. Diss. Leipzig 1874. — DE LANESSAN, Struct. d. graines du Trig. F. gr. Bull. soc. Linn. Paris 1877. — GODFRIN, Etud. histolog. s. l. tégum. sém. d. Angiosp. Soc. sc. Nancy 1880. — SCROBISCHEWSKI, Embryogénie d. Papilionac. Congr. internat. de Bot. Petersb. 1884. — GODFRIN, Anat. comp. d. cotyl. et de l’album. Ann. sc. nat. (6) 19 (1884) 5. — TSCHIRCH, Angew. Anatomie Fig. 126, 193 und TSCHIRCH-OESTERLE, Anatom. Atlas t. 5. — NADELMANN, Schleimendosperme, Pringsh. Jahrb. 21 (dort die Keimungsgeschichte) u. Ber. d. d. Bot. Ges. 1889. — LÜDTKE, Beitr. z. Kenntn. d. Aleuronk. Pringsh. Jahrb. 21 (auch Dissert.). — HOLFERT, Nährschicht. Diss. 1890. — Über Nabelspalte und Tracheïdeninsel vgl. auch PFÄFFLIN, Bau u. Funkt. d. Nabelspalte u. Tracheïdeninsel. Diss. Bern 1897 (m. 2 Taf.). — HARTWICH, Foenumgraecum in Realenzyklopädie V, 407. — HASSALL, Food. London 1876. — Anat. Abbild. auch in Pharmacographia trad. p. LANESSAN 1878, 345 (ungenau), A. MEYER, Drogenkunde, S. 139 (dort auch eine Schleimzelle), HARZ, Landw. Samenkunde II, 631, MOELLER-WINTON, Microscopy of vegetable foods 1906, 216, MOELLER, Pharmakognosie 2. Aufl., Fig. 153 und Mikroskop. d. Nahrm., PLANCHON-COLLIN, Drog. simpl. II, Fig. 1063, GILG, Pharmakogn. Fig. 182.
Chemie. Aus dem wässrigen Auszuge der zertrümmerten Samen fällt Alkohol Schleim, der getrocknet 28% der Samen ausmacht (FLÜCKIGER). Die Schleimmembranen des Endosperms enthalten als Reservekohlenhydrat ein Mannogalaktan, liefern also bei der Hydrolyse Mannose und Galaktose (BOURQUELOT und HÉRISSEY). Sie verhalten sich ähnlich wie das Endosperm von Ceratonia (s. d.). In 2,5 g des bei der Hydrolyse erhaltenen Zuckers waren 1,249 Mannose und 0,978 Galaktose enthalten.
Die Samen enthalten ferner 0,13% Trigonellin, C7H7NO2, ein kristallisierendes, nicht alkalisch reagierendes, ungiftiges Alkaloid, das der Göttinger Apotheker JAHNS als das Methylbetain der Nikotinsäure erkannte:
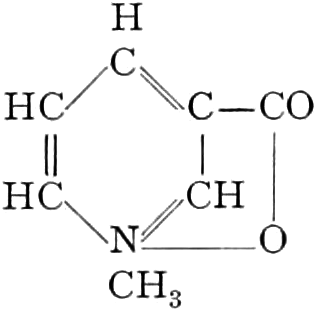
und das HANTZSCH (aus nikotinsaurem Kalium und Jodmethyl mit AgO) künstlich darstellte. Es löst sich nicht in Äther, Benzol, Chloroform, die Lösung in Wasser wird durch Eisenchlorid rötlich. Trigonellin findet sich auch in den Samen von Pisum sativum, Cannabis sativ., Avena sativ., Strophanthus hispidus und Kombe (SCHULZE und FRANKFURT, THOMS), von Coffea arabica (POLSTORFF) und liberica (GORTER). Daneben findet sich 0,05% Cholin (Amanitin, Sinkalín, Bilineurin):
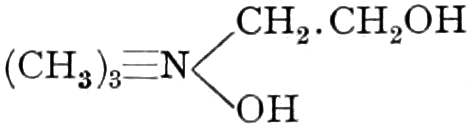 |
,
|
das also als Trimethyloxyäthylammoniumhydroxyd aufzufassen ist und das beim Zerfall der in den Pflanzen weitverbreiteten Lecithine (Ester der Glycerinphosphorsäure mit Fettsäuren und Cholin):
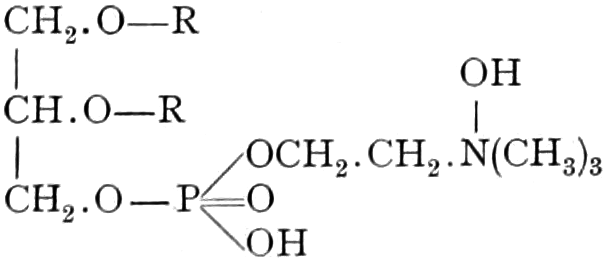
[S. 343]
entsteht. Es ist vielleicht auch hier ein sekundäres Produkt, denn Lecithin ist in den Samen nachgewiesen. Seminase scheint erst bei der Keimung aufzutreten.
Der Träger des sehr eigenartigen Geruches, der sich dem fetten Öle mitteilt, ist unbekannt. Den «sehr starken Geruch nach Cumarin», den HARZ erwähnt, kann ich nicht bemerken. FLÜCKIGER erhielt auch bei Wasserdestillation von 4 kg Samen keinen Riechstoff. Auch der Träger der Bitterkeit ist unbekannt (das Alkaloid?).
In der Samenschale findet sich ein Gerbstoff, in ihr und in den Cotyledonen ein gelber Farbstoff (s. auch unter Anwendung).
Der Gehalt an Öl beträgt (mit Äther extrahiert) 6% (FLÜCKIGER). Es enthält neben Lecithin (s. oben), wie viele Samenöle, ein Phytosterin (HECKEL und SCHLAGDENHAUFFEN). Amylalkohol extrahiert auch etwas Harz. Der Stickstoffgehalt beträgt 3,4% (= c. 22% Eiweiß), der Wassergehalt 10,4%, die Asche 3,7% (JAHNS, 2,67% HAUKE). Sie enthält c. 25% Phosphorsäure. — Asche des Pulvers: c. 5% (HAUKE).
Lit. BOURQUELOT et HÉRISSEY, Les hydrates de carbone de réserve des graines de Luzerne et de Fenugrec. Journ. pharm. chim. 11 (1900), 589, Compt. rend. 130 (1900), 731. — FLÜCKIGER, Pharmakognosie. — JAHNS, Ber. d. d. chem. Ges. 18 (1885), 2518, 20 (1887). 2840, Arch. Pharm. 225 (1887), 985. — HANTZSCH, Ber. d. d. chem. Ges. 19 (1886), 31. — HECKEL und SCHLAGDENHAUFFEN, Journ. pharm. chim. 16 (1886), 213, Jahresb. d. Pharm. 1886, 15. — Weitere Angaben über Trigonellin und Cholin in OESTERLE, Pharmakochemie.
Anwendung. Daß es schon den Alten bei der Verwendung der Bockshornsamen besonders auf den Schleim ankam, ersehen wir daraus, daß z. B. DIOSKURIDES nur das Bockshornmehl (ἄλευρον τήλεως) aufgenommen hat, das er seiner schleimigen Beschaffenheit wegen zu Umschlägen und als Erweichungsmittel empfiehlt. Es steht bei ihm neben Leinsamen, denen dieselbe Wirkung zugeschrieben wird. Auch die Verwendung des Bockshornsamen zum Empl. diachylon spl. und cps. (s. oben S. 337) beruht auf dem Schleim. Sie geht bis auf die Araber zurück (MESUË). «Es läßt sich denken, daß der Zusatz von Schleim die Pflasterbildung begünstigt, indem die Verflüchtigung des Wassers dadurch verzögert wird» (FLÜCKIGER). Auch jetzt noch sind sie Bestandteil des Empl. frigidum (Empl. foenugraeci cps.). Und auf dem Schleim beruht auch die Verwendung in der Tuchfabrikation. Im Mittelalter figuriert der Same unter den Speisewürzen (Rezept zu einer Fischspeise des Klosters St. Gallen, IX. Jahrh., DÜMMLER) und auch schon im Altertum wurde er in Rom in der Küche angewendet (APICIUS CAELIUS, De re coquinaria, III. Jahrh.). Jetzt benutzt man die ganze Pflanze (aber noch mehr Trigonella coerulea) als eine der Würzen des «Kräuterkäse» (Schabzieger). In Indien sind die gerösteten Samen noch jetzt ein beliebtes Volksmittel bei Dyssenterie (AINSLIE). Zahlreiche aromatische Faenugraec-Präparate in der alten indischen Literatur (methi modaka, svalpa methi modaca) deuten auf eine umfangreiche Anwendung (Pharmac. ind.) und auch die Araber benutzten Samen, Blätter und Öl zu den verschiedensten Zwecken. In Indien wird Bockshorn auch diätetisch als Aphrodisiacum und als Arzneimittel benutzt, die Blätter sind kühlend. Ganz junge Pflanzen werden dort (obwohl sie bitter schmecken) als Gemüse benutzt. Die Samen werden für eine Carmin-Contrefaçon benutzt und das gelbe Dekokt derselben gibt mit Kupfersulfat ein Permanentgrün (Pharmacogr. indic.). Das fette Öl wird in Madras gepreßt und in Indien viel benutzt.
In Europa werden die Samen besonders in der Tierheilkunde benutzt (Schweizer Viehmastpulver, Schweinefraßpulver, Holländisches Butterpulver. Vgl. auch SCHLAGDENHAUFFEN et REEB, Un. pharm. 43, (1902), 97). Sie sind auch ein Bestandteil des Curry powder und der Cattle Foods. Bockshornklee ist eines der Hauptmittel KNEIPPS. Der Samenbrei wird als «unübertreffliches Mittel» bei offenen Wunden, Geschwüren usw. gerühmt und auch die ganze Pflanze viel benutzt (vgl. DINAND, Heilpflanzen [KNEIPPS]. Eßlingen 1910). Sie gelten als Carminativum und werden bei Brust- und Milzleiden gebraucht. DIOSKURIDES läßt auch mittelst Olivenöl ein Öl aus Bockshorn bereiten, mit Kalmus- und Cyperngras-Zusatz (I, cap. 57: περὶ τηλίνον σκευασίας), das gleiche «telinum» erwähnt PLINIUS und noch bei den Arabern (I, S. 648) wird thilinum benutzt, ja sogar noch heute ist ein huile de fenugrec in Frankreich[S. 344] in Gebrauch und ist Bestandteil eines Ungt. althaeae. Bei ihm spielt der Schleim natürlich keine Rolle. Der Same wird gepulvert auch gegen Ungeziefer (Läuse) benutzt.
Verfälschung. Im Pulver ist früher oft Erbsenmehl gefunden worden. Auch jetzt noch (1910) findet sich oft ein Leguminosenmehl darin oder andere Stärkesorten.
Geschichte. Die ägyptische Medizin scheint sich des Faenugraecum bedient zu haben. Wir finden šbt (šebet) in einer Vorschrift des Papyrus EBERS (ed. JOACHIM) zur Heilung von Brandwunden und auch eine Kyphivorschrift (I, S. 473) enthält sie. Doch ist die Deutung zweifelhaft. Bei DIOSKURIDES steht (in []) der ägyptische Name itasin. Das biblische Wort hhatzir bezieht sich wohl kaum auf Bockshorn (TRISTAM). Daß die Römer die Droge vom Osten (aus Griechenland) erhielten, zeigen die Bezeichnungen F. graecum, die sich in griechisch Heu erhalten hat (s. oben). Die Pflanze ist noch jetzt in Griechenland sehr häufig. Sie stammt aber weiter von Osten, aus Arabien und Indien, denn die arabische Bezeichnung hulba (holba) ist nicht nur in ganz Nordafrika, sondern auch in China gebräuchlich, und der Sanskritname methi (erst in der späteren Sanskritliteratur auftretend, FLÜCKIGER) ist vielleicht das Stammwort von τῆλις (DE CANDOLLE). So wird man wohl Indien als ursprüngliche Heimat annehmen dürfen. Von dort hat sie sich aber frühzeitig als Kulturpflanze nach Westen verbreitet und wurde schon im Altertum in vielen Gegenden des Mittelmeergebietes kultiviert, wie wir von THEOPHRAST und den römischen Agronomen erfahren. Fenum graecum war vielleicht einer der Lotus der Alten (?) und zwar der Gruppe der Lotus, die wir die Kleegruppe nennen können (Lotos agrios wohl = Trigonella corniculata). Sie wurde in Griechenland und Italien als Futterpflanze gebaut (griechisches Heu!). Nach DIERBACH findet sich der Bockshornsame im Corpus Hippocraticum. Faenum graecum steht bei CELSUS (I, S. 587), SCRIBONIUS LARGUS (I, S. 577) und PLINIUS, der seine Kultur beschreibt und, ebenso wie GALEN, ARETAEUS u. a., viele Krankheiten nennt, die damit geheilt werden können. Sem. Faenugraec. benutzte MESUË für den Syr. de Marubio, den wir noch bei GEOFFROY finden. Bei IBN BAITHAR, der eine Menge arabische Schriftsteller nennt, die sich ihrer bedienen, heißt die Pflanze hulbat, bei QUTSAMÎ h’olbadt (die Pflanze h’ab al-holb, MEYER). In der Flos medicinae scholae Salerni (I, S. 629) findet sich foenugraecum und der Same steht auch in der Alphita (I, S. 648), den Tabulae, bei PLATEARIUS und SERAPION (mit Synon.: oiba). Die Salernitanische Schule übernahm also die Pflanze von den Arabern. Durch die Benediktiner kam sie nach dem Norden. Der Fena graeca ist im St. Galler Klosterplan (I, S. 622) ein Beet eingeräumt und in KARLS Capitulare (I, S. 620) wird der Anbau von Fenigrecum verlangt. Auch die HILDEGARD und ALBERTUS MAGNUS kannten die Pflanze. Von den Arzneibüchern des Mittelalters finden wir chriechschez heu in dem Tegernseer und Züricher (I, S. 678), sowie im Gothaer (I, S. 679). Ihr Anbau drang schon im Mittelalter über Hannover bis nach Mecklenburg. Im XVI. Jahrh. fand sich die Pflanze allenthalben in den Gärten Deutschlands und Italiens (GESNER) und auch in England. Im XVIII. Jahrh. war Sem. fenugr. sehr beliebt. GEOFFROY, der sie der pyrochemischen Analyse unterwarf, teilt im Tractatus de Mat. med. 1742 p. 259 eine Menge Vorschriften mit, in denen der Same oder der daraus bereitete Schleim vorkommt, meist zusammen mit anderen Mucilaginosis. POMET bildet fenugrec. («fälschlich senegré genannt») gut kenntlich ab.
Lit. FLÜCKIGER-HANBURY, Pharmacographia. — FLÜCKIGER, Pharmakognosie. — AINSLIE, Mat. med. ind. — TRISTAM, Nat. hist. of the bible.
Paralleldrogen. DIOSKURIDES verwendete auch in gleicher Weise die Samen von Trigonella elatior SIBTH., (T. corniculata L., λωτός ἄγριον?), des wilden oder Kuhhornklee, den auch die Araber beachteten (bei IBN BAITHAR: handakuâ elbarri).
b) Schleimzellen in der ganzen Pflanze verteilt.
Die Schleimmembranen der Schleimzellen von Vegetationsorganen (Wurzeln, Stengeln, Blättern) und Blüten tragen nicht den Charakter von Reservestoffen. Wir dürfen sie wohl, da sie sich wie einige Beobachtungen, besonders an Althaea, zeigen, auf trockenen Standorten vermehren, als Wasserspeicher auffassen. Darauf deutet auch das Vorkommen in der Epidermis der Blätter, welches bei den Fol. Buccu (s. d.) seine extremste Ausbildung erhält und hier zu einem ganzen Wasserspeichersystem wird (Fig. 94, 9 u. 10).
[S. 345]
Rad. Althaeae.
Syn. Rad. Bismalvae, R. Hibisci, R. Malvae visci, — Altheewurzel, Eibischwurzel, Fliestkrautwurzel, Gilfwurz, Hilfswurzel, Schleimtee, Weiße Süßholzwurzel, Heilwurz, Heilkraut, Samt- oder weiße Pappel, große wilde Pappel oder Malve, — guimauve officinale ou ordinaire (franz.) — (common) marshmallow (engl.) — weatweed, mortification root (in Amerika) — heemst (holl.) — malwischio, malvaccioni, bismalva, radice di altea (ital.) — malvavisca (span.) — ibis rot (schwed.) — altee juuri (fin.) zilizgyőkér (ung.) — ῥίζα ἀλθαίας, auch μολόχη, νερομολόχα (n.-griech.).
khairu, khitmi-ká-jhár, khaira-ka-jhor (pers., hind., duk., bomb.). Die Wurzel heißt in Indien und Persien: rishah-i-khitmi; die Frucht: tukm-i-khitmi; die Blüten: gul khairu. — Bei THEOPHRAST ἄλθαια. — athd. grozpapel, — mithd. ebich, ebiche, eibisch, ibsche (so noch jetzt in Bern) ipsch, ybeske, ybesch, ybischa, ybize, ywesche — mnd. homes, witte hümst, witte malve, wilt pippeln, rockwort. Bei ORTOLF: weiße Pappel. — Jetzt auch Arteawurzel und Theewurzel (Rendsburg), Eibich (Österreich), Hüffwurzel (Schlesien). — Im Mittelalter: bismalva, eviscus, ibiscus, flos siliaci s. syriaci; dann auch: althaea ibiscus, malva ibiscus, m. silvestris, m. palustris.
Etym. Althaea aus ἀλθαία umgebildet; dies wohl mit ἄλθος (= Heilmittel) und ἄλθομαι (= gesunden) zusammenhängend. Schon DIOSKURIDES leitet das Wort von πολυαλθὲς (= viel heilend) ab («ὠνόμασται δὲ ἀλθαία διὰ τὸ πολυαλθὲς καὶ πολύχρηστον αὐτῆς»). Heilwurz ist also die Übersetzung von ἀλθαία. — Eibisch (athd. ibisca, mhd. ipsch, bei der HILDEGARD: ybischa, ibiscum, bei BRUNSCHWYG und BOCK: ibisch, bei FUCHS: eibesch) aus dem Lat. ibiscum, hibiscum (hibiscus bei VIRGIL) und dem griech. ἴβισκος (ἔβισκος). «Ebich geht an Apium = Eppich und Hedera = Epich sehr nahe hinan» (PRITZEL-JESSEN). Im Corpus-Glossar steht: euiscus, ibiscus (FISCHER-BENZON). GRASSMANN bemerkt von ibiscus: «schwerlich ist es ein ursprünglich griechisches oder lateinisches Wort, da es in diesen Sprachen keine verwandten Wörter hat und auch die Lautform auf eine Entlehnung hindeutet.» Bei DIOSKURIDES ἀλθαία, Synonyma bei DIOSKURIDES: ἐβίσκον, μολόχη (μαλάχἠ) ἀγρία, ἀθίσκον (bei den Römern Hebiscum). Bei den späteren Griechen (vgl. LANGKAVEL) ἀλθαία, ἀσπρομολόχη, ἀλκέα, βύσκος, ἐβίσκη, ὀνομαλάχη. Bei PLINIUS: Althaea, d. h. Malva silvestris «cui grande folium et radices albae». — Malvaviscus aus malva viscida (wegen des Schleimes) umgebildet, aus viscida malva entstand dann auch bismalva und guimauve (gui = viscus). — mauve aus malva. Bez. Pappel vgl. I, S. 1064 und unter Malva.
Stammpflanze. Althaea officinalis L. (Spec. pl. ed. I, 686).
System. Stellung. Malvaceae, Malveae — Malvinae — Althaeastrum.
Beschreibung der Stammpflanze. Die Pflanze ist mehrjährig. Das oft vielköpfige bis 3 cm dicke Rhizom geht nach unten in eine einfache oder mehrweniger verzweigte Wurzel über und trägt oben 60–125 cm hohe einfache oder ästige, stielrunde, unten stark verholzte, innen markige, kaum hohle Stengel, die in der Rinde reichlich Bastfasergruppen besitzen und außen mit einem dichten Filz von Büschelhaaren bedeckt sind. Die spiralig gestellten Blätter besitzen einen kurzen, bis 4 cm langen Stiel; sie sind im oberen Teile des Stengels eiförmig, werden dann weiter nach unten größer und dreilappig, am Grunde gerundet bis herzförmig, und sind im untersten Teile, wo sie am größten sind, fünflappig mit meist vorgezogenen Endlappen, die Lappen spitz, am Rande ungleich kerbig-gezähnt bzw. kerbig-gesägt. Am Grunde ist die dicht graufilzig behaarte Spreite fünfnervig, beiderseits vom Mittelnerven gehen 3–5, besonders unterseits stark hervortretende Seitennerven ab. Die zweispaltigen Nebenblätter sind lineal oder lanzettlich-pfriemlich, lang zugespitzt, behaart, bis 8 mm lang, und, wie die Vorblätter der Blüten, hinfällig. Die wickeligen Blütenstände stehen in den Achseln der Laubblätter; sie erscheinen durch Zusammendrängung der Blüten büschelig, die Büschel bilden im oberen Teile der Stengel bei[S. 346] Verkürzung der Blätter wieder traubige Verbindungen, sind also oberwärts gehäuft. Die Blütenbüschel sind kürzer als die Blätter. Die aktinomorphe, fünfzählige Blüte besitzt einen Außenkelch (Hochblattinvolukrum), der bis fast zum Grunde in meist 9–10 (selten 6, 7 oder 11) pfriemliche zugespitzte, behaarte Zipfel geteilt ist, die etwas kürzer sind als der 8–9 mm lange eigentliche fünfzählige Kelch, dessen eiförmige, zugespitzte, beiderseits filzige Zipfel eine klappige Knospenlage zeigen. Die 5 spreizenden, in der Knospenlage gedrehten, asymmetrischen, hellrosenroten (fleischfarbenen), dunkel geaderten Blumenblätter sind fast 2 cm lang, schief umgekehrt eiförmig, oben etwas ausgerandet, am Grunde genagelt und hier beiderseits mit einem Haarbüschel versehen, mittelst der Staubgefäßröhre an der Basis unter sich verbunden. Die zahlreichen Stamina sind zu einer unten verbreiterten Röhre verwachsen, die Filamente sind schwach behaart, die monothecischen, mit einem Scheitelspalt aufspringenden, dunkelpurpurnen Antheren in der Mitte angeheftet, die Pollenkörner groß, mit grobstachliger Exine. Die 15–18 Fruchtblätter bilden eine niedrige, am Rande gekerbte, feinbehaarte Scheibe, aus deren Mitte sich der kräftige Griffel erhebt, dessen in der Zahl den Fruchtblättern entsprechende Narbenschenkel anfangs zusammenneigen, später aber auseinander spreizen. Jedes Fruchtknotenfach enthält ein aufsteigendes, anatropes Ovulum mit nach unten gewendeter Mikropyle. Die oben gewölbte, mit abgerundeten Rändern versehene Frucht bildet eine vom bleibenden Kelch und Außenkelch behüllte, niedergedrückte, am Rande gekerbte, behaarte, von der Mittelsäule überragte Scheibe, die einem Emmenthaler Käse ähnlich ist (daher: Käsepappel). Die Samen sind kahl, braun und enthalten, eingebettet in Endosperm, einen gekrümmten Keimling, dessen nach Innen geschlagene Keimblätter an der Spitze nochmals eingeknickt sind.
Blüht im Juli und August.
Verbreitung. Althaea officin. ist ursprünglich eine Pflanze der Steppen und Salzsümpfe. Sie ist über ganz Europa von Mittelrußland bis Frankreich (Südküste, Montpellier), Spanien (Salzmarschen von Saragossa), an der Nordsee, an der Ostsee bis zur Peenemündung, am Schwarzen Meer, am Mittelmeer, an den atlantischen Küsten bis Südengland und Irland, mit Ausnahme Skandinaviens und des höheren Nordens, auch in Griechenland und Macedonien, sowie über das gemäßigte Westasien (z. B. Syrien, Persien, Afghanistan), Zentralasien (Kaschmir), im Panjáb Himalaya, Sind und Nordasien (Alataugebirge in Südsibirien, südlich vom Balkasch-See) verbreitet. Aus Europa eingeschleppt findet sie sich jetzt auch in den Salzmarschen der Küste von Massachusetts, New York und Pennsylvania (HENKEL). Sie findet sich an den Rändern von feuchten Gebüschen, Gräben, Zäunen besonders auf salzigem Boden oder in der Nähe salzhaltiger Stellen. Auf trockenem Boden wird sie schleimreicher. In Norddeutschland ist die Pflanze zerstreut und ziemlich selten, in der Schweiz scheint sie zu fehlen. (Bei SCHINZ-KELLER finde ich nur die einjährige A. hirsuta.) Für Baden, Wetterau, Nassau, Franken, Westfalen, Oberhessen durch Thüringen und Sachsen, sowie Böhmen wird sie angegeben, in Ungarn scheint sie häufig zu sein. Im Alatau steigt sie bis 3000 Fuß (SEMENOFF).
Lit. FLÜCKIGER, Pharmakogn. — SIBTHORP, Prodr. flor. graec. II, 42. — LUERSSEN, Med. pharm. Bot. — ALICE HENKEL, U. S. Dep. Agr. Bulletin 89. 1906. — GARCKE, Flora v. Deutschland. — Abbild. in BERG-SCHMIDT, Atlas, 2. Aufl. t. 103 (dort die systemat. Lit.). — BERG, Charakteristik, t. 81. — PABST-KÖHLER, Medizinalpfl. t. 59. — HAYNE, Arzneigew. II. t. 25. — NEES VON ESENBECK, plant. med. t. 417. — BENTLEY-TRIMEN, Med. pl. t. 35 u. and.
[S. 347]
Pathologie. Über die pflanzlichen Schädlinge berichtet Prof. ED. FISCHER: Auf Althaea officinalis tritt, wie auf anderen Malvaceen, die Uredinee Puccinia Malvacearum MONT. auf, welche an allen grünen Teilen ihre kompakt polsterförmigen braunen Teleutosporenlager ausbildet. Es gehört dieselbe zu den sogenannten Leptopuccinien, d. h. sie besitzt nur Teleutosporen, welche sofort nach der Reife zu Basidien auskeimen. Die Basidiosporen infizieren sofort wieder junge Blätter. Nach meinen Beobachtungen erfolgt die Überwinterung auf den Malven einfach so, daß durch die ungünstigen Temperaturverhältnisse im Winter die Keimung der Teleutosporen zurückgehalten wird und erst eintritt, wenn wieder günstigere Temperaturverhältnisse vorliegen, in welchem Zeitpunkte dann meist auch Teile der Malvaarten sich in infizierbarem Zustande befinden. (Eine ähnliche Beobachtung hat auch schon J. SCHRÖTER gemacht.) Da der Pilz sowohl auf Althaea wie auch auf Malva und anderen Malvaceen lebt, so kann Althaea auch von befallenen Malven aus infiziert werden. Der Pilz ist ursprünglich in Chile einheimisch. In Europa wurde er 1869 zum ersten Male beobachtet und zwar in Spanien, dann 1872 in Frankreich. 1873 fand man ihn an verschiedenen Punkten von Frankreich, im Elsaß und Baden, sowie bei Erfurt. (Siehe E. IHNE, Studien zur Pflanzengeographie: Geschichte der Einwanderung von Puccinia Malvacearum und Elodea canadensis. Dissertation. Gießen 1880.) Puccinia Malvacearum ist bereits 1874 auf den Althaeakulturen bei Nürnberg und Erlangen beobachtet worden. (REES, Sitzungsb. d. phys. med. Soc. Erlangen 1874). Der Schaden ist weniger groß als man anfangs fürchtete (A. SCHWARZ 1910), immerhin werden die Blätter bei stärkerem Auftreten unverkäuflich. Zur Bekämpfung wurden Spritzmittel vorgeschlagen, doch können solche jedenfalls da nicht angewendet werden, wo die Blätter als Droge in Betracht kommen.
Auf den Blättern der Althaeen sind außer Puccinia Malvacearum noch mehrere Imperfekten beobachtet worden, welche Blattfleckenkrankheiten hervorrufen. Unter denselben tritt namentlich Colletotrichum Althaeae SOUTHWORTH (Stirochaete Malvarum A. BR. et CASP.) (s. SOUTHWORTH, Ad new hollyhock disease. Journal of Mycology 1890, p. 45 und 115) unter Umständen so verheerend auf, daß die Kultur der Malven und Althaeen in Frage gestellt wird (LINDAU).
Pilze als direkte Schädlinge der Wurzel sind uns nicht bekannt.
Über die tierischen Schädlinge von Malva alcea, moschata, silvestris, neglecta, rotundifolia und Althaea officinalis berichtet ISRAEL:
1. Käfer: Haltica rufipes. L., H. fuscipes. FABR. und H. malvae ILL. Larven und Käfer an den verschiedensten Malvaceen, letzterer mehr in den Donauländern. Lixus angustatus FABR. Larven meist in Kompositen, auch in Malvaarten. Apion aeneum FABR., A. malvae FABR. und andere Apionarten leben als Larven in den Früchten von Malva- und Althaeaarten. Trachys pygmaea FABR. Larven minierend auf Althaea- und Malvaarten.
2. Falter: Spilothyrus alceae ESP., S. althaeae HÜBN. Raupen auf diversen Malvaceen. Acontia lucida HUFN., A. luctuosa W. V. Die Raupen beider, nicht überall häufigen Falter leben auf diversen Malvaceen. Gelechia malvella HB. Räupchen in den Früchten vieler Malvaceen.
3. Schnabelkerfe: Aphis cardui L. soll außer an verschiedenen Kompositen auch an Malvaarten leben.
1894 trat eine Raupe auf den Stecklingen der bayrischen Kulturen auf, die dieselben stark schädigte (GEHE & Co.).
Die Droge ist sehr der Zerstörung durch Sitodrepa panicea (I, S. 379) ausgesetzt. Man tut gut, von Zeit zu Zeit ein offenes Gefäß mit etwas Chloroform in den Vorratskasten zu stellen.
Kultur und Einsammlung. Die deutsche Altheewurzel stammt nur aus den Kulturen. Wilde Althaea liefert überhaupt weniger gute Wurzeln. Hauptkulturort für deutsche Althaea ist Gochsheim, eine Stunde von Schweinfurt, dann die Umgegend von Nürnberg. Die Kulturen befinden sich nördlich von Nürnberg (Groß- und Klein-Reuth, Lohe, Schnepfenreuth, Almoshof, Poppenreuth, Höfles, Rohnhof, Bislohe, Kraftshof, Boxdorf, Stadeln, Gr. Gründlach, Neunhof usw.) und südlich von Nürnberg (Schweinau, Groß-Reuth, Sündersbühl). In der Umgebung von Schweinfurt sind Gochsheim,[S. 348] Schwebheim, Sennfeld zu nennen, bei Ulm Söflingen; kleinere liegen bei Jenalöbnitz, Rüdenhausen (Amt Kitzingen), Schlauraf. Bei Bamberg wird keine Althaea mehr gebaut (KRAFT 1910).
A. SCHWARZ in Nürnberg schreibt mir 1910: «Althaea ist die hauptsächlichste Arzneipflanze, welche bei Nürnberg gebaut wird. Der Anbau ist am stärksten zwischen Nürnberg und Erlangen. Die Länge des Anbaugebietes darf auf 7, die Breite auf 2 Stunden angegeben werden. Der Eibisch wird hier in mäßig großen Feldern neben Gemüsen, Spargel usw. gebaut.» Wie UNGER berichtet pflanzen die Bauern die Wurzeln in andere Felder unter Zwiebeln, Möhren, Kraut u. dergl. und im Oktober, November, eventuell auch im Dezember, wenn alles andere abgeerntet ist, wird die Eibischwurzel gegraben, geschält und getrocknet. Im Laufe des Winters wird dann von den Wurzelschneidern im Orte die Wurzel gespalten und geschnitten. Nicht alle Bauern haben Trockenschränke. Die Wurzelschneider feuchten oft die Wurzeln an und legen sie in den Keller, bis sie sich gut schneiden lassen, was aber unzulässig ist (UNGER).
Die Ernte in den Ämtern Nürnberg und Fürth beträgt pro Jahr etwa 3000 Zentner. Das meiste liefert: Neunhof, Kraftshof, Buch, Boxdorf, Klein- und Groß-Reuth hinter der Veste und Sündersbühl. Althaea verlangt besonders im August bis Oktober Feuchtigkeit. Anhaltende Trockenheit schädigt die Felder, ebenso anhaltende feuchte Witterung oder gar Überschwemmung, wie 1898 in Belgien. Nebeliges trübes Wetter liefert graue Wurzeln. Da die Asche der Althaea reich an Phosphaten ist, sollten die Kulturen mit Thomasmehl gedüngt werden. Die Erntebereitung erfordert ziemlich viel Arbeit und viele Bauern wendeten sich 1898–1900 anderen Kulturen zu, doch wurden, da wieder bessere Preise erzielt wurden, die Kulturen in Unterfranken 1907 wieder erweitert. Nur die größeren Wurzeln geben gute Ware, nicht die Zasern. Sorgfältige Trocknung eventuell Nachtrocknung bei nicht zu hoher Temperatur ist erforderlich, da die Wurzel sonst leicht einen widerlichen Geschmack annimmt und gelblich wird. 5 Teile frische Wurzel liefern 1 Teil geschälte und getrocknete.
Die Kultur von Althaea gelang 1887 LABLER in Böhmen nicht gut. In der von Prof. PÁTER geleiteten staatlichen Versuchsstation für die Kultur der Arzneipflanzen in Klausenburg (Kolozsvár) in Ungarn wird Althaea zu Wurzel-, Blätter- und Blütengewinnung kultiviert. Sie findet sich auch in vielen ungarischen Privatpflanzungen (z. B. der GEBR. NEUMANN, Dr. SKICZÁK u. a.), die zum Teil mit ganz modernen Trocknungseinrichtungen versehen sind (MITLACHER). Die Rentabilität scheint nicht sehr beträchtlich zu sein, immerhin lohnt die Kultur. Ungarn sammelt aber auch Althaea in größerem Maßstabe von wildwachsenden Pflanzen (PÁTER). Österreich-Ungarn exportiert größere Mengen Rad. Althaeae (MITLACHER, 1910).
Ich sah Althaea oft in Bauerngärten Deutschlands und der Schweiz. Auch in Frankreich, Belgien und Italien wird Rad. althaeae gesammelt und exportiert. Es befinden sich Kulturen in Nordfrankreich und im Hennegan (Belgien). Die Gärtnereien von Milly (Depart. Seine et Oise) kultivieren auch Althaea (PLANCHON, 1892). Die A. gallica war früher von vorzüglicher Qualität. Die belgischen Pflanzungen sind beträchtlich. Ganze belgische Wurzel ist beliebt. Frankreich bezog 1909 Althaeawurzel aus Italien und Belgien. In Italien wird die Droge nur von wildwachsenden Pflanzen gesammelt und zwar bei Mondoví in Piemont und Solesine in Venezien (RAVASINI). Kulturen finden sich auch in Madras (WATT), aber die meiste Althaea wird von Persien nach Indien importiert.
[S. 349]
Lit. UNGER, Apoth. Zeit. 1890, 14. — MITLACHER, Kultur von Arzneipfl. in Österr.-Ungarn. Pharm. Post 1909 (dort weitere Lit.) und Z. Produkt. v. Arzneipflanz. in Österreich-Ungarn. Zeitschr. d. Österr. Apoth. Ver. 1910, 459. — SCHERFEL, Medizinalpfl. Ungarns. Beih. z. Bot. Centralbl. 1897. — AUGUSTIN-LENGYEL Vezérfonal Pharmakobotanikai Gyàkorlatokhoz 1908. — A. SCHWARZ, Briefl. Mittheil. 1910. — LABLER, Prager Rundschau 1887 und Zeitschr. Österr. Apoth. Ver. 1889. — PLANCHON, Rep. d. Pharm. 1892, 375. — F. VON MÜLLER, Select. extratrop. plants readily eligible for Industrial Cultur 1885.
Handelssorten. Der Handel unterscheidet besonders deutsche und belgische Wurzel, zu denen dann noch die weniger wichtige französische tritt. Die ungarische Althaeawurzel ist bisweilen ungeschält (VOGL).
Morphologie der Droge. Die Droge wird nur von zweijährigen Pflanzen gesammelt, ältere sind zu holzig, jüngere zu dünn. Sie ist stets geschält im Handel. Die Wurzel des ersten Jahres bleibt entweder erhalten und entwickelt sich, zahlreiche Verzweigungen bildend, weiter oder geht zugrunde und an ihrer Stelle treten aus dem kurzen Rhizom zahlreiche, etwa gleichdicke Zasern. Das Rhizom entwickelt entweder nur einen Stengel oder wird mehrköpfig und treibt alsdann zahlreiche Stengel. Die hellgraubräunliche, nicht selten 0,5 m lange Hauptwurzel ist oft bis 3 cm dick, bisweilen um die Achse gedreht, die Zasern dagegen erreichen nur eine Dicke von 1 cm. Die Droge wird meist aus den Hauptwurzeln dargestellt. Man schneidet die Nebenwurzeln ab, schält sie durch Abschaben des Korkes und der äußersten Schichten der Rinde und trocknet dann. So erhält man verschieden (meist c. 2 dcm) lange, c. 1,5 cm dicke, weißliche Stücke, die auf der Oberfläche wenige aber grobe Längsrunzeln bzw. Furchen und zahlreiche dunklere Narben, von den Nebenwurzeln herrührend, erkennen lassen, sowie viele feine Fäserchen: freigelegte Bastfasergruppen der Rinde (s. unten). Der Bruch ist im Holzkörper uneben körnig, in der Rinde faserig. Der Durchmesser des Holzkörpers beträgt das fünf- bis sechsfache der Rinde, die nach dem Aufweichen etwa 3 mm dick zu sein pflegt.
Das Lupenbild des Querschnittes, der sich mit Jod stark bläut, zeigt deutlich hervortretend die ringsumlaufende bräunliche Cambiumlinie. Innerhalb derselben treten feine Radialstrahlen, im Zentrum unregelmäßige Punktierung hervor. Die Rinde läßt zarte konzentrische Zonen erkennen (Fig. 117). Die Gefäßgruppen erscheinen beim Betupfen des Querschnittes mit Phloroglucin-Salzsäure als rote Punkte.
Die Droge ist viel in Würfel geschnitten im Handel.
Rad. alth. riecht eigenartig und schmeckt süßlich, fade-schleimig.
Rad. althaeae, Lupenbild des Querschnittes.
[Tschirch-Oesterle, Atlas.]
Anatomie. Althaea besitzt Befestigungs- und Ernährungswurzeln (TSCHIRCH und RADLAUER, STSCHERBATSCHEFF). Die Befestigungswurzeln führen Libriform im Zentralzylinder, die Ernährungswurzeln nicht. Der primäre Bau der Wurzel ist radial-diarch, wird dann oft tri- und tetrarch, seltener pentarch. In der Rinde findet sich meist eine endotrophische Mycorhiza. Schon bei einer 1,3 mm dicken Wurzel ist die primäre Rinde abgeworfen. Der Bau des Wurzelbündels ist collateral geworden und es ist ringsum Perikambialkork entstanden und in der Rinde Bastzellgruppen und Schleimzellen.
Rad. althaeae. Querschnitt am Cambium.
[Tschirch-Oesterle, Atlas.]
Rad. althaeae. Längsschnitt am Cambium.
[Tschirch-Oesterle, Atlas.]
Der (der Droge fehlende) Kork besteht aus etwa 8 Reihen tafelförmiger Korkzellen. Darunter folgt ein großzelliges Parenchym. Die sekundäre Rinde wird in radialer[S. 350] Richtung von breiten, schon mit der Lupe sichtbaren Markstrahlen durchzogen. Die Tangentialstreifung (s. oben) der Rinde rührt von zahlreichen, kleinen, in tangentialen Zonen angeordneten kleinen Bastzellgruppen her (Fig. 118, B), deren äußerste bei der geschälten Droge als Fäserchen sichtbar werden. Mit letzteren alternieren Siebröhrengruppen (s. Fig. 117, 5). Die wenig oder gar nicht verholzten Bastzellen sind meist nicht sehr stark verdickt, ihre Enden kegelig oder gabelig oder knorrig. Sie sind 10–27 (meist 18 bis 20) mik breit und meist etwa 600 mik lang. Safranin färbt die Membran der Bastzellen und der Gefäße rot (VOGL), Chlorzinkjod die inneren Lamellen der Bastzellen blau (A. MEYER). Das Rindenparenchym (Phloëmparenchym) und die Markstrahlen führen viel Stärke, etwas Asparagin und kleine Öltröpfchen (letztere besonders in den Markstrahlen), einige Zellen auch etwa 25 mik (18–30) messende Calciumoxalatdrusen mit oft stacheligem Rande. Die Kristalle liegen in einer Tasche (WITTLIN). Eingestreut in das Rindenparenchym finden sich zahlreiche rundliche oder in der Organachse gestreckte Schleimzellen mit sehr dicken geschichteten Schleimmembranen (Schichtung wird deutlich beim Zufließen von Alkohol), die sich weder mit Jod, noch mit Chlorzinkjod und Jodschwefelsäure blau färben. Beim Chloralpräparate fand VOGL in den Schleimzellen 15–36 mik große prachtvolle Sphärite, oft traubig aggregiert, zerklüftet, rissig, geschichtet und radial gestreift, bald der Zellwand aufsitzend, bald frei in der Zelle liegend. Einige sind kugelig, andere[S. 351] eirund oder elliptisch, oder traubig gehäuft, nicht selten in langer Reihe der Zellwand aufsitzend. In dem innerhalb des Reihenkambiums liegenden Holzkörper ist das Speicherparenchym (Holzparenchym) sehr stark entwickelt. Es führt Stärke, Asparagin (in deutlichen Kristallen meist nur nach Einlegen frischer Wurzeln in Alkohol), fettes Öl und Rohrzucker. Konz. Schwefelsäure färbt rot, Kali zitronengelb. Die Stärkekörner, der hauptsächlichste Reservestoff der Wurzel, sind sehr mannigfaltig gestaltet: rundlich, oval, gestreckt, gekrümmt, verbogen oder gelappt (Fig. 120). Der Spalt ist nicht immer deutlich, zusammengesetzte Körner sind selten. Die Größe beträgt 3,5–27 mik. Eingestreut in das Speicherparenchym finden sich Schleimzellen und Zellen mit Calciumoxalatkristallen. Die 25–80 (meist 50–60) mik weiten Leiter- oder Netzleistengefäße, entweder einzeln oder zu Gruppen vereinigt, liegen ziemlich zerstreut. Sie zeigen manchmal Thyllenbildung (Fig. 119). Bisweilen sieht man innerhalb des Cambiums einzelne, meist Wundgummi führende Gefäß- und Tracheïdengruppen von einem Korkmantel ganz oder teilweise umgeben (LANESSAN 1877, HARTWICH 1906). Die Gefäße sind oft von einem Tracheïdensaume umgeben und von Bastfaser-(Libriform-)gruppen begleitet. Letztere finden sich aber auch isoliert im Gewebe verstreut. Die meist sehr hohen Markstrahlen des Holzes ähneln denen der Rinde, zeigen auch die gleichen Inhaltskörper. Im Zentrum des Holzkörpers findet man bisweilen noch die Protoxylemgruppe, deren Libriformzellen verholzt sind (VOGL).
Im Pulver prävalieren die Stärkekörner, deren charakteristische Form (Fig. 120) für die Diagnose brauchbar ist. Im Alkoholpräparate erscheinen die Inhalte der Schleimzellen als helle Schollen, die beim Zufließenlassen von Wasser zu hyalinen Blasen werden. Im Chloralpräparate treten neben Parenchymfetzen die sehr charakteristischen Bastzellen und Gefäße oder deren Fragmente deutlich hervor, sowie die Calciumoxalatdrusen oder deren Kristallsplitter. Da das Pulver nur aus geschälter Droge dargestellt wird, fehlen die Korkzellen oder sind doch nur in sehr geringer Menge vorhanden, herrührend von den Stellen, wo die Nebenwurzeln abgeschnitten wurden.

Rad. althaeae, Stärkekörner.
[Tschirch-Oesterle, Atlas.]
Lit. TSCHIRCH-OESTERLE, Anatom. Atlas t. 30 (dort das Detail). — TSCHIRCH, Angew. Anatom. — A. MEYER, Drogenkunde (Fig. 195). — BERG, Anatom. Atlas t. 11. — KARSTEN-OLTMANNS, Lehrbuch, Fig. 107–109. — MOELLER, Lehrbuch, Fig. 320. — GILG, Lehrbuch, Fig. 237. — PLANCHON-COLLIN, Drog. simpl. II, Fig. 1189. — VAN TIEGHEM, Ann. sc. nat. (7) 1 (1885), 76. — DUMONT, Anat. comp. d. Malvac., Ebenda (7) 6, 138. t. IV. — KUNTZE, Vergl. Anat. d. Malv. Bot. Centralbl. 1891. — SOLEREDER, System. Anat. d. Dicotylen S. 166 (dort weitere Lit). — FRANK, Pringsh. Jahrb. V, t. XV. — DE BARY, Anatomie 151. — WALLICZEK, Dissertat. Bern 1893. — GUIRAUD, Bot. Centralbl. 61 (1895) 376. — HOLFERT, Prim. Anlage d. Wurzeln. Arch. Pharm. 1889. — LANESSAN, Bull. Soc. Linn. Paris 1877 (u. Hist. d. drog. I, Fig. 59). — HARTWICH, Schleimzellen von Althaea, Verh. d. Naturforschervers. Halle 1891 (Pharm. Zeit. 1891, 609) und Eigenthüml. Bild. von Wundkork in d. Wurz. v. Althaea offic. Schw. Wochenschr. 1906, 137, sowie Althaea in Realenzyklop. d. Pharm. — FREIDENFELDT, Anatom. Bau d. Wurzel. Bibl. bot. Heft 61, 1904. — JOST, Zerklüftung einiger Rhizome u. Wurzeln. Bot. Zeit. 1890. — RADLAUER, Dissert. Bern 1911. — STSCHERBATSCHEFF, Arch. Pharm. 1907, 48. — WITTLIN, Bot. Centralbl. 67 (1896), Taf. 1 Fig. 35. — Das Pulver ausführlich in KOCH, Atlas d. Drogenpulver II, t. 12, GREENISH-COLLIN, Atlas veget. powders pl. 109 und KRAEMER, Powdered drugs. Amer. Pharm. Assoc. 1898, 312. — Stärke: BASTIN, The Apothecary 1893 (Pharm. Journ. 1893, 747). — Mikr. Nachweis des Asparagins: PFEFFER, Pringsh. Jahrb. 1872, 533. Vgl. auch Borodin, Bot. Zeit. 1878, 801.
Chemie. Der Apotheker Bacon fand 1826 in der Rad. alth. Gummi, Zucker,[S. 352] fettes Öl, Stärke, Eiweiß, Althaein und «malate acide d’althéine». Letzteres erklärte PLISSON für identisch mit dem von Robiquet 1805 in Asparagus entdeckten Asparagin, dem Monoamid der Amidobernsteinsäure:
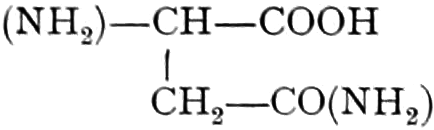 |
(F. wasserfrei = 234–235°).
|
Dieses Asparagin, das glänzende, rhombische, in heißem Wasser lösliche, in Alkohol und Äther unlösliche Prismen bildet, ist linkshemiëdrisches, optisch-linksdrehendes l-Asparagin [rechtshemiëdrisches, süßschmeckendes Asparagin erhielt PIUTTI aus Wickenkeimlingen, doch geht dies wohl aus l-Asparagin hervor (PRINGSHEIM)]. l-Asparagin ist im Pflanzenreich weit verbreitet. Rad. alth. enthält davon 0,8–2%. REBLING fand in Rad. althaeae 10–11% Zucker, den WITTSTOCK für Rohrzucker erklärte. Die von L. MEIER angegebene Apfelsäure hat keine Bestätigung gefunden.
BUCHNER fand 35,64% Schleim, 37,51% Stärke (nach FLÜCKIGER-HANBURY etwas mehr als 25%), 8,29% Zucker und Asparagin, 1,26% fettes Öl, 1,81% glutinöse Materie, 11,05% Pflanzenmark (Pektin). Der Althaeaschleim, von dem FLÜCKIGER 25% erhielt, ist in Wasser löslich. Er läßt sich durch Ammonsulfat aussalzen (POHL), ist in Kupferoxydammon unlöslich und färbt sich weder mit Jod noch mit Jodschwefelsäure (Echte Schleime, TSCHIRCH). Bleiacetat schlägt ihn nieder. Da der Schleim, dem die Formel C12H10O10 gegeben wurde (SCHMIDT, MULDER), bei der Oxydation Schleimsäure liefert, muß er Galaktose liefernde Gruppen enthalten. Vielfach wird kalte Extraktion der Wurzel an Stelle des Dekoktes gesetzt, doch treten auch neuerdings warme Verteidiger des Abkochens auf (UNGER 1890), da der heiße Auszug haltbarer ist. Der kalte Auszug enthält nur Schleim, keinen Stärkekleister, wird daher von Jod nicht gebläut, der heiße wird blau. Wenn es sich nur um den Schleim handelt, genügt kalte Extraktion. Pharmac. helvet. IV sagt: «Statt Decoctum rad. alth. ist die Kolatur einer halbstündigen Maceration zu dispensieren.»
ORLOW fand Betain (Trimethylglycin, Oxyneurin):
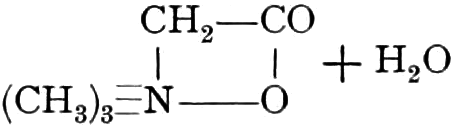
und einen dem Lecithin (vgl. S. 342) ähnlichen Körper. Die Wurzel enthält auch ein Enzym. Gerbstoff findet sich nur in den Randschichten der ungeschälten Wurzel. Die Asche beträgt 4,88% (FLÜCKIGER), 3,2–5,5% (HAUKE), im Pulver oft etwas mehr. Die obere Grenzzahl beträgt 6%. Die Asche ist rein weiß. NYGÅRD gibt den Wassergehalt auf 11% an. E. DIETERICH fand (1891) 9,95% H2O, 4,8% Asche und in letzterer 7,08% Kaliumcarbonat, — im Pulver 6,20–9,10% H2O, 5,8 bis 6,5% Asche, darin 17,0% K2CO3. Die Asche ist reich an Phosphaten.
Lit. Ältere Lit. LINK, Schweigg. Journ. XIII, 186, PFAFF, Mat. med. VI, 78, COLIN und GAULTIER, Schweigg. Journ. XIII, 453, GMELIN, Handb. d. Chem. II, 1251, PEREIRA, Heilmittellehre II. — WITTSTOCK, Poggend. Ann. 20 (1830) 346 (Pharm. Centralbl. 1831, 277). — BUCHNER, Rep. 41 (1832) 368 u. Pharm. Centralbl. 1832, 511. — LEO MEIER, Jahrb. f. d. Pharm. 12, 2 (1826) 75 (vollständ. Analyse). — GUÉRIN VARRY, Ann. de chim. II 49, 264. — SCHMIDT, Lieb. Ann. 51, 29. — HILGER und ROTHENFUSSER, Ber. d. chem. Ges. 35, 1841. — FLÜCKIGER, Pharmakogn. — FLÜCKIGER-HANBURY, Pharmacographia. — POHL, Zeitschr. phys. Chem. 14 (1890) 151. — Asparagin: ROBIQUET jun., Ann. chim. 55 (1805) 152. — VAUQUELIN et ROBIQUET, Ebenda 57 (1806) 88. (DELAVILLE, Ebenda 41 (1802) 298). — BACON, Althéine, nouvelle substance végétale. Ann. chim. phys. 34, 201 (1827), Journ. chim. med.[S. 353] II, 551. — PLISSON, Sur l’identité du malate acide d’althéine avec l’asparagine. Ann. chim. phys. 36 (1827) 175. — PIUTTI, Ber. d. chem. Ges. 22, Ref. 241 u. 243. — PRINGSHEIM, Zeitschr. physikal. Chem. 66 (1910).
N. ORLOW, Betain als Bestandt. d. Wurz. von Alth. offic. Pharm. Zeitschr. f. Rußl. 36 (1897) 631 (Journ. ph. 1898, 7. 108 u. 305) und Lecithin Farmac. Journ. 1900, Nr. 22 (Chem. Zeit. und Pharm. Zeit. 1900, 268). — REBLING (Zucker) Arch. Ph. 134 (1855). — NYGÅRD, Farmac. Notisbl. 1909.
Über den sich abweichend verhaltenden Schleim (Gombine) von Hibiscus esculentus (sog. Gombo) vgl. LANDRIN, Journ. ph. chim. 22 (1875) 278, POPP, Arch. Pharm. 1871, 140.
Verfälschungen und Prüfung. Eine solche mit der holzigen, zähen Wurzel der Althaea rosea, die früher (WITTSTEIN) angegeben wurde, scheint nicht mehr vorzukommen, ebenso wenig die Wurzel von A. narbonensis CAV. Eine sehr häufige, ja beinahe regelmäßige Verunreinigung des grob gepulverten Rad. alth. ist seit Jahren und bis auf den heutigen Tag die billigste Sorte Schwarzmehl. Auf den ersten Blick könnte man oft meinen es nur mit letzterem zu tun zu haben (DÖLL). Als Kuriosität sei erwähnt, daß von Getreidemehl freies Althaeapulver bisweilen als «stärkefrei» angeboten wird. Während früher die geschnittene Eibischwurzel häufig (mit Kalkmilch, Kreide, Gips) gekalkt wurde, wird sie jetzt vielfach mit Stärke, Getreidemehl oder Althaeapulver bestäubt. 1885 wurden mit Talcum geschminkte, geschnittene Althaea im Handel beobachtet, die über 1% davon enthielt (BERNBECK). Doch kommt Kalken auch jetzt noch vor. Die Prüfung auf gekalkte Wurzel durch Ausziehen mit Salzsäure (2 g Rad. auf 5 ccm 1% HCl, FROMME, CAESAR & LORETZ Handelsbericht 1898) und Prüfen des filtrierten Auszuges mit Ammoniumoxalat ist, da auch das in der Wurzel vorkommende Calciumoxalat sich in Salzsäure löst, von der Pharm. helvet. IV durch Prüfung eines mit Essigsäure dargestellten Auszuges ersetzt worden, die auch die auf Bleiweiß einschließt. «Schüttelt man geschnittene Eibischwurzel mit verdünnter Essigsäure, so darf Ammoniumoxalat im Filtrate nach dem Übersättigen mit Ammoniak nur höchstens eine Trübung und Schwefelwasserstoff keine Veränderung hervorrufen» (Pharm. helvet. IV). Gekalkte Wurzel enthält niemals weniger als 0,5% Kalk. Bisweilen ist so viel Kalk vorhanden, daß man ihn mit Wasser abschlämmen und den Bodensatz untersuchen kann. Auch Bleichung mit schwefliger Säure und Chlor scheint früher (1862) vorgekommen zu sein. Nicht ordentlich getrocknete, feucht aufbewahrte oder sonst feucht gewordene Wurzel riecht oft dumpfig oder schimmelt, sie enthält kein Asparagin mehr, bildet Ammoniak und gibt einen gelben Auszug (SELLE), der bisweilen nach Buttersäure riecht (FLÜCKIGER). Es empfiehlt sich, Blecheinsätze in die Vorratskästen zu machen. Wurzeln, welche nach längerem Lagern geschnitten werden, liefern oft trübe, wenig schleimige Auszüge (HAGER). Der Schleim (1=10) soll farblos und neutral sein und weder sauer, noch ammoniakalisch riechen. Durch Kalilauge oder Ammoniak soll er rein gelb, nicht braun oder rötlich werden.
Lit. Jahresber. d. Pharm. 1861, 65 (SELLE) und 1885, 94 (BERNBECK).
Anwendung. Rad. althaeae wird besonders als demulzierendes Mittel bei Katarrhen der Respirationsorgane und Reizzuständen der Verdauungswerkzeuge benutzt, dann als Vehikel für scharfe Arzneistoffe und als Konspergierungsmittel für Pillen. Beliebte Arzneiformen sind: Decoctum althaeae, Syr. althaeae, Spec. bechicae, Spec. pectorales, Spec. pro infantibus, Pastilli althaeae, Pasta althaeae, die aber oft keine Althaea enthält. (Weitere Formen und Spezialitäten in HAGER-FISCHER-HARTWICH, Pharmac. Praxis). Die Witterung und ein damit verbundenes größeres oder geringeres Auftreten von Katarrhen hat, wie die Handelsberichte lehren, auf den Verbrauch[S. 354] von Rad. althaeae großen Einfluß. Mit Altheepulver und Wasser allein angestoßene Pillen werden bald steinhart und passieren den Magendarmkanal ohne zu zerfallen. Althaeawurzel ist auch ein Hauptmittel des Pfarrer KNEIPP. Die Wurzel wird roh und geschält von den Kalmücken gegessen. Die Stengel enthalten Bastfasern in der Rinde und diese wurden als Faserstoff empfohlen (CAVANILLES). Ziemlich viel Fasern liefert Althaea narbonensis (span. cañamera) in der Nähe von Narbonne.
Geschichte. Dem indischen, babylonischen und ägyptischen Kulturkreise scheint die Verwendung der Althaea unbekannt gewesen zu sein. Alcea ficifolia L. (feigenblättrige Malve), noch heute Hauptschmuck der arabischen Gärten, war im alten Ägypten (1600 n. Chr.) eine der Blumen der Totenkränze. Die ἄλθαια des THEOPHRAST ist vielleicht Alth. offic. (FRAAS) oder A. acaulis (SPRENGEL), doch nennt er die Farbe der Blüten μήλινος (Pharm. ind. denkt daher eher an Abutilon Avicennae). Er beschreibt sie (Hist. plant. 9, 18) als der μαλάχη (Malva silvestr. und Lavatera arborea) ähnlich und erwähnt ihre Benutzung gegen Husten, sowie ad fracturas et ad ulcera. DIOSKURIDES, der viele Krankheiten nennt, gegen die Althaea innerlich und äußerlich angewendet wurde, nennt die Wurzel der ἀλθαία schleimig und innen weiß. PLINIUS, der viel besonders über die äußerliche Anwendung der wilden Malve mit großen Blättern und weißer Wurzel zu berichten weiß, aber auch die Abkochung der Wurzel mit Milch als Hustenmittel kennt, erwähnt, daß die A. auch Plistolochia (Plistolycia) heiße (von πλεῖστος = am meisten und λοχεῖα = Kindbettreinigung). Daß die Wurzel in dem I. Jahrh. n. Chr. arzneilich benutzt wurde, geht aus des SCRIBONIUS LARGUS Compositiones (I, S. 576) hervor, bei dem sich Ebisci, s. Hibisci radix findet. A. offic. steht dann auch im Kitâb aš šaǧar (X. Jahrh.). Im Capitulare KARLS steht (neben malvas) mismalvas [wohl ein Schreibfehler für uismalvas (FISCHER-BENZON)] ibicha id est alteas. Beide finden sich auch im Breviarium (I, S. 621). Die Benediktiner empfahlen und betrieben also ihre Kultur auch im deutschen Norden. Bei ALBERTUS MAGNUS steht Altea, im Gothaer Arzneibuch (I, S. 679): wylde poppele, auch bei MEGENBERG: papel. In den Sinonoma Bartholomei (I, S. 639) steht: Altea, holihocke; in der Alphita und den Tabulae: bismalva und bimalva (altea); die ebendaselbst erwähnte Malva silvestris (malva uiscus, merch[e] malue, caulis sancti Cutberti, alta malua Seynt Cutbertscole) ist wohl auch Althaea; wie das gleichfalls in der Alphita sich findende Alphaea (bismalva, enflos, eviscus, malvaviscus, hibiscus). Bis malue findet sich auch in der Frankfurter Liste (1450) und dem Nördlinger Register (1480). Bei CORDUS findet sich Althaeae flos, rad. (Rad. Hibisci) et mucilago; sowie die Namen Bismalva und Sammetpappeln. Der Althaeaschleim war Bestandteil des Empl. diachylon (s. S. 337). Auch Ungt. dialthaea simpl. und comp. D. NICOLAI (z. B. in CORDUS, Dispensator.) enthalten (neben Sem. lini und Sem. foenugraec.) Rad. althaeae.
Paralleldrogen. Die Wurzel des in allen Teilen sehr schleimreichen Hibiscus esculentus geben geschält ein schneeweißes, schleimreiches Pulver (Pharm. Rev. 1897). Die Wurzel wurde als Ersatz der Althaea empfohlen (DELLA SUDDA, Rép. d. pharm. 1860. Über die Früchte der Pflanze vgl. die Pharmakographia). DRAGENDORFF führt (Heilpflanzen, S. 422) als ebenso wie Althaea officin. benutzt an: Althaea taurinensis DC., A. narbonensis POURR., A. cannabina L., A. pallida W. et KIT., A. meonantha LK., A. chinensis CAV., A. ficifolia CAV.
Von den Portugiesen in Goa wird die Wurzel von Grewia scabrophylla ROXB. als Substituens für Althaea benutzt. Ebenso in Cochinchina und Indien die Wurzel von Hibiscus Rosa sinensis, die Ketmie von Cochinchina (Pharmacogr. indica).
Folium Althaeae.
Eibischblätter — feuilles de guimauve — marshmallow leaves — foglie di altea.
Die Beschreibung der Stammpflanze s. oben S. 345. Die Blätter werden an den gleichen Orten wie die Wurzel, aber in viel geringerem Maße, besonders im Juni[S. 355] und Juli vor (Pharm. helv. IV) oder während der Blütezeit, bisweilen auch von der wildwachsenden Pflanze gesammelt. 8 Teile frische liefern 1 Teil trockene. Sie gelangen vornehmlich aus Bayern und Österreich-Ungarn, dann auch aus Belgien, Frankreich und Thüringen in den Handel. Bei Nürnberg werden Eibischblätter besonders in Almoshof, Klein-Reuth, Neunhof und Buch gesammelt (FR. WAGNER).

Althaea officinalis, längliche Blattform.
[Aus Jos. Moeller, Lehrb. d. Pharmakogn.]
Die beiderseits graufilzigen, ungleich kerbig-gezähnten Blätter, deren Form oben (S. 345) beschrieben ist und von denen es längliche und runde Formen gibt (J. MOELLER), sind namentlich durch die fast dreieckigen, ungleich großen Blattzähne ausgezeichnet. Auf relativ kleine folgen weit hervortretende von fast länglich-herzförmigen Bau. Ein kräftiger Nerv tritt von unten her in den Zahn und verzweigt sich pinselartig. Von seiner Spitze gehen zwei Randnerven ab, die mit dem von den Hauptzahnnerven abgehenden Sekundärnerven je ein Dreieck bilden. Längs der Randnerven zeigt sich noch je ein zweiter, sehr schwach ausgebildeter Nerv (VIRCHOW). Die meist kleineren Blätter der wilden Pflanze haben im allgemeinen einen schärfer gezahnten Rand und spitzere Formen (ZÖRNIG). Die im allgemeinen starke Behaarung wechselt nach dem Standorte etwas. Sie ist auch bei der wilden Pflanze oft stärker als bei der kultivierten. Es finden sich vornehmlich Büschelhaare mit 2–6, seltener 8, spreizenden langen, dickwandigen Strahlen, die von der Fläche betrachtet einen 2–8strahligen Stern bilden («Sternhaare»). Die Haarwurzeln, die Basen der Büschelhaarstrahlen, sind reich getüpfelt. Auf Gewebspolster sind die Büschelhaare für gewöhnlich nicht erhoben. Daneben finden sich, besonders an den Nerven, Drüsenhaare mit einer Basalzelle, mehreren Stielzellen und einem 1–2zelligen Köpfchen, sowie am Blattrande einzellige, etwas gekrümmte Haare mit angeschwollener Basis. Die Epidermiszellen beider Blattseiten sind schwach wellig verbogen. Sie sind wegen der starken Haarbedeckung nicht gut zu sehen. Spaltöffnungen mit 3–4 Nebenzellen finden sich auf beiden Blattseiten. Zahlreiche Epidermiszellen sind als Schleimzellen ausgebildet. Die Schleimmembranverdickung ist besonders auf der Innenseite stark (Fig. 94, 7). Der Schleim färbt sich mit Safranin rot, mit Methylenblau blau (VOGL). Unterhalb der Büschelhaare finden sich oft Oxalatzellen (A. MEYER). Die Palissadenschicht der Blattoberseite[S. 356] ist einreihig, selten an einzelnen Stellen durch Teilung der Zellen zweireihig. Das Merenchym ist wenig-reihig und reich durchlüftet. Der stark nach unten ausladende Mittelnerv führt oben und unten Collenchymstreifen, ein großes strahliges Gefäßbündel und im Nervenparenchym Schleimzellen und Zellen mit Calciumoxalatdrusen, doch ist vornehmlich die Epidermis Sitz des Wasser zurückhaltenden Schleimes, die dadurch zu einem epidermalen «Wassergewebe» wird. An den Nerven höherer Ordnung ist die Spreite meist etwas eingezogen.
Blätter, auf denen sich Puccinia Malvacearun (vgl. oben S. 347) findet, sind zu verwerfen.
Das Pulver ist besonders an den sehr zahlreichen Haarbildungen zu erkennen, von denen selbst im feinsten Pulver wenigstens die Basen der Büschelhaare noch gut erhalten sind. Die Haarstrahlen sind oft zertrümmert. Stengel und Blütenteile, die sich nicht selten im Handelspulver finden, verraten sich durch reichliches Vorkommen von Pollenkörnern (einige finden sich auch im reinen Blattpulver), von Antherenfragmenten und Kelchhaaren und den großen Gefäßen des Stengels (KOCH). Eine Beimengung von Fol. malvae verrät sich durch zahlreiches Auftreten von einzelligen Borstenhaaren, die bei Althaea seltener sind.
Althaea officinalis, Querschnitt durch den Mittelnerven des Blattes.
[Tschirch-Oesterle, Atlas.]
Von den Bestandteilen kommt nur der Schleim in Betracht. Die Asche beträgt 13–15% (HAUKE). Die Fol. alth. germanicae von kultivierten Pflanzen sind schwächer behaart als die im südlichen Ungarn von wildwachsenden Pflanzen gesammelten Fol. alth. hungaricae (VOGL). Die Fol. althaeae werden meist in Form von Auszügen zu Gargarismen und Collutorien, Klystieren und, in Verbindung mit anderen erweichenden Kräutern, zu Cataplasmen benutzt (HUSEMANN). Sie sind ein Volksmittel gegen Husten und Bestandteil vieler Teemischungen (Spec. althaeae, Spec. emollient., Spec. ad gargarisma, Spec. pectoral.).
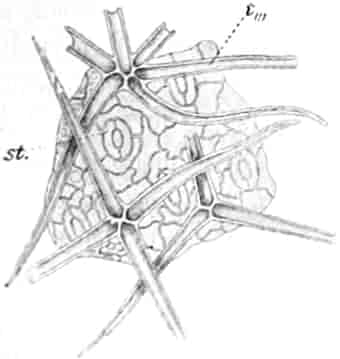
Althaea officinalis, Epidermis des Blattes. Flächenansicht.
[Tschirch-Oesterle, Atlas.]
Lit. TSCHIRCH-OESTERLE, Atlas t. 71. — A. MEYER, Drogenkunde II, Fig. 415–421. — PLANCHON-COLLIN, Drog. simpl., Fig. 1184 bis 1186. — VOGL, Commentar 1908 und[S. 357] Atlas t. 15. — MOELLER, Pharmakogn. Atlas t. 23 und Lehrbuch Fig. 62 u. 63. — HARTWICH in Realenzyklop. d. Pharm. — ZÖRNIG, Arzneidrogen S. 130. — VIRCHOW, Bau, u. Nervat. d. Blattzähne etc. Arch. Pharm. 1896. — HAUKE, Aschengehalt 1902. — SCHWARZ, Briefl. Mitth. — WALLICZEK, Membranschl. vegetativ. Org. Pringsh. Jahrb. 25 (1893) 227. — NESTLER, Die Schleimzellen d. Malvaceen. Öst. bot. Zeitschr. 1898. — DUMONT a. a. O. — KUNTZE a. a. O. — SOLEREDER a. a. O. (vgl. S. 351). — Das Pulver ausführlich in KOCH, Anal. d. Drogenpulv. III, 82 (dort auch die Pollenkörner).
Flos Althaeae.
Die Beschreibung der nur wenig noch angewendeten, fast geruchlosen, süßlich-schleimig schmeckenden Blüten s. oben S. 346. Sie werden in einigen Gegenden, wo Eibisch kultiviert wird, nebenher gesammelt, z. B. bei Nürnberg (Almoshof, Klein-Reuth, Großgrundlach, Schnepfenreut 1910). Sie enthalten in allen ihren Teilen Schleimzellen. Die großen (60 mik breiten) Pollenkörner besitzen eine grobstachlige Exine, die durch Jodchloral sich gelb färbt, während der Inhalt blau wird (VOGL).
Die Entwicklungsgeschichte des Samens und der Frucht bei STSCHERBATSCHEFF, Arch. Pharm. 1907, 60. — Die Nährschicht bei HOLFERT a. a. O.
Die Blüten liefern 0,024% ätherisches Öl (HÄNSEL), welches kristallinisch erstarrt. Der Farbstoff der Althaeablüten soll ein durch verdünnte Säure hydrolysierbares Glykosid sein, das in der Kalischmelze Protocatechusäure und Brenzcatechin liefert (WEIGERT, Jahresber. d. önolog. Lehranst. Klosterneuburg 1894/95).
Folium et Flos Malvae.
Syn. Herba malvae, Malvenblätter, Pappel- oder Papelkraut, Hanfpappel, St. Johannispappeln, Schwellkraut, Käsepappelkraut, Gäns-, Roß- oder Hasenpappelkraut, kattenkēs (= Katzenkäse), kerskes, in der Schweiz: chäslichrut, nüsserli, zigerli — feuille de mauve — mallow leaves — in Indien und Arabien: khubázi und khitmi.
Flores malvae silvestris, vulgar. s. coerulei, blaue Pappelblumen, wilde Malvenblüten, — fleur de mauve — mallow flowers.
Bei den alten Griechen und den Römern: malache. — Malva silvestris hieß bei den späteren Griechen: μολόχη, μαλάχη, ὑπερστρόγγυλος — Malva rotundifolia: ἀγριομάλαχων, τεμποράξ, γλυκάνησσος. — althd. papula, pappala, pappula, papilla, pampila, babilla, wengebapeln — mhd. pippole, pipelde, baippel — mnd. pippulencrut, poplencrut, popele, popel, pope, pöppol — bei der HILDEGARD (I, S. 669): babela — bei MEGENBERG (I, S. 693): malva haizt papel. — Im Gothaer Arzneibuch: wylde poppele (poppele, popplione, popplionie — den italienischen Ursprung verratend! — ist Populus). — Im Colmarer Glossar: popele, — bei BOCK: keespappeln. — Im Ortus sanitatis und bei BRUNSCHWYG: bappeln — bei BRUNFELS und FUCHS: Gansspappel, rosspappeln.
Etym. KLUGE bemerkt: «Pappel = Malve, mhd. papel, papele; ahd. (mlat.) papula, dunklen Ursprungs; wohl aus lat. pappus Samenkrone gebildet.» Das scheint mir sehr unwahrscheinlich. Ich leite es, ebenso wie GRASSMANN u. and., von pampe, pappe, mhd. pap = Kinderbrei, Kleister (aus ital. mlat. pappa und pappare = essen) ab, wegen der Schleimigkeit. (Im ald. bedeutete pappala schleimig.) Bei BOCK heißt es: «pappel ist im Westerich ein gemeiner Nam, dann es werden alle breite Kreutter sonderlich, die man nit vol kennet, mit dem namen pappel genannt, aber zu underscheid der andern nennen sie die klein malvam um des schnübelechten (scheibenförmigen) Samens willen käszpappeln und Hasen- oder Ganspapellen». In der Tat wird in Baiern auch die Betonien- und Pfingstrose, in Nassau der Sumpfhahnenfuß Pappel genannt (GRIMM). Das Wort Pappel als Bezeichnung für den aus Italien stammenden Baum (zuerst bei MEGENBERG und CORDUS) ist aus populus umgebildet (früher stets als Pappelbaum unterschieden). Es liegt also nur ein zufälliger Gleichklang vor (I, S. 1064). Popel als Baumname[S. 358] bedeutete ursprünglich die im Mittelalter über die Alpen gebrachte Schwarzpappel (P. nigra). Die Pyramidenpappel kam erst Ende des XVIII. Jahrh. aus der Lombardei nach Deutschland (HOOPS). — Malva aus μαλάχη und dies von μαλαχός = erweichend, weich, auch in bezug auf den Schleim, und wohl nicht, wie GRASSMANN will, von der weichen Beschaffenheit der Pflanze. — Malve erst nhd. aus lat. (ital.) malva. In England wurde der lat. Pflanzenname sehr früh heimisch, daher angls. mealwe, engl. mallow (KLUGE). — Der aramäische Name für Malve ist ru’ānā (LÖW). — Bei den Persern: nân-i-ku-lagh (= Krähenbrod) und khitmi-i-kuchak (= kleines khitmi) —MAULÁNA NAFIS (nach DYMOCK) unterscheidet bei den Malven: kultivierte (Malokhia) große wilde (khitmi), und kleine wilde (khu-bázi).
Stammpflanze. Malva silvestris L. (Spec. pl. ed. I, 689) (Althaea silvestr. ALEFELD). Roßpappel, wilde Malve oder Käsepappel, große Hasenpappel, Hanfpappel, Pferdepappel, Waldmalve — mauve sauvage, meule, grande mauve — wild mallow — mallowe — katost — μαλάχη — und Malva neglecta WALLROTH [Syllog. Ratisb. I, 140 (1824)] (M. rotundifolia C. BAUHIN et AUCT. nicht L., M. vulgaris FRIES, M. littoralis DETHARD, Althaea vulgaris ALEF.). Gemeine Malve, Käsepappel, Kässelpappel — mauve à feuilles rondes, petite mauve fromagère, fromageon — common mallow.
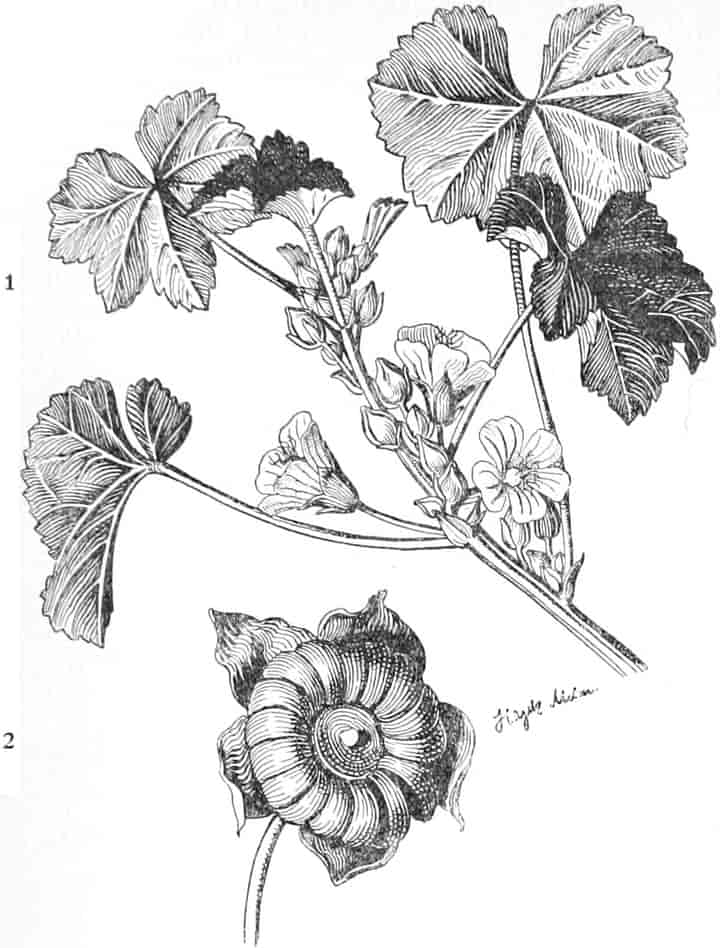
Malva silvestris L. 1. Infloreszenz und Laubblätter. 2. Frucht.
[Aus Schmeil, Lehrb. d. Botanik.]
Die LINNÉsche M. rotundifolia umfaßt zwei jetzt getrennte Arten: M. neglecta WALLR. (s. oben) und M. rotundifolia FR. (M. borealis WALLM., M. pusilla WITH., M. parviflora HUDS.).
Die Blätter werden von beiden Arten (M. silvestr. und neglecta) benutzt, die Blüten meist nur von Malva silvestris. Die Wurzel und Samen sind nicht mehr in Gebrauch.
Systemat. Stellung. Malvaceae, Malveae — Malvinae (neben Althaea).
Beschreibung der Stammpflanzen. Malva silvestris ist ein selten einjähriges, meist zweijähriges oder andauerndes Kraut. Aus der kräftigen, innen weißen Pfahlwurzel erheben sich mehrere aufsteigende, bis meterhohe, ziemlich kräftige, runde, behaarte, verästelte, unten holzige, innen Mark und eine Höhlung führende Stengel.[S. 359] FLÜCKIGER sah 1878 4 cm dicke Stämme aus den gallizischen Bergen in Nord-Spanien. Die jüngeren Teile sind rauhhaarig fast zottig. Die später vertrocknenden Nebenblätter sind 7 mm lang, halbeiförmig. Die Blätter besitzen einen 5–10 cm oder noch längeren, oben runden, unten abgeflachten, meist stark behaarten Stiel. Die nur spärlich behaarte, von 5–7 Hauptnerven durchzogene, 5–12 cm, ja bisweilen 18 cm breite Spreite der Laubblätter ist nierenförmig (Fig. 124), bisweilen an der öfter purpurn gefärbten Basis gestutzt, der kreisrunde Rand in 5–7 meist stumpfe, gesägte oder gekerbte Lappen geteilt. Die aktinomorphen, fünfzähligen, hermaphroditen Blüten bilden achselständige Wickel, sie sind 1,5–3 cm lang. Ihre zur Blüte- und Fruchtzeit aufrechten Stiele sind kürzer als die Blattstiele. Der Hüllkelch (das Hochblattinvolukrum) besteht aus drei freien, schmal spatelförmigen, spitzen, behaarten, c. 5 mm langen Blättern, die kürzer als die Kelchblätter sind. Der Kelch ist unten verwachsen, glockenförmig, oben in fünf fast gleichseitig dreieckige, innen kahle, außen behaarte Zipfel geteilt. Die hellpurpurroten, von dunklen Adern durchzogenen Blumenblätter sind drei bis viermal länger als der Kelch, c. 20–25 mm lang, keilförmig bis verkehrt eiförmig, an der Spitze sehr tief ausgerandet, am verschmälerten Grunde mit zwei dichten Haarbüscheln versehen (Fig. 125, 2), an der Basis allmählich in die Staubgefäßröhre übergehend. Das dunkelpurpurrote, behaarte Staubgefäßbündel ist 10–12 mm lang, die monothezischen Antheren sind quer aufgehängt und öffnen sich mit einem Querriß. Die Pollenkörner besitzen eine kurzstachelige Exine (Fig. 125, 3). Die 8 bis 11 (meist 10) Griffel sitzen dem niedergedrückt-scheibenförmigen Fruchtknoten auf. Sie sind unten verwachsen und teilen sich auf halber Höhe in die fädigen Narbenschenkel. Das Bündel der letzteren bleibt entweder in der Staminalröhre eingeschlossen (bei der sog. männlichen, kurzgriffligen Form der Blüte) oder tritt aus letzterer hervor (bei der sog. weiblichen, langgriffligen Form). Die Ovula sind anatrop-epitrop. Die vielfächerige, vom bleibenden Kelche behüllte Frucht bildet eine niedergedrückte, vom Stempelrest nicht überragte, mehr oder weniger stark behaarte, strahlig-gefurchte Scheibe von 6–7 mm Durchmesser (Fig. 124, 2). Die 8–11 (meist 10) Teilfrüchtchen sind durch tiefe Furchen geschieden und stark netzgrubig skulpturiert. Sie trennen sich zur Zeit der Fruchtreife. Die Samen sind nierenförmig, der Embryo gekrümmt. Die Behaarung der Pflanze wechselt sehr. Bald findet man reich, ja sogar sehr reich behaarte, bald fast kahle Blätter. Die stärker behaarten Formen finden sich im Süden und Osten (SCHUMANN).
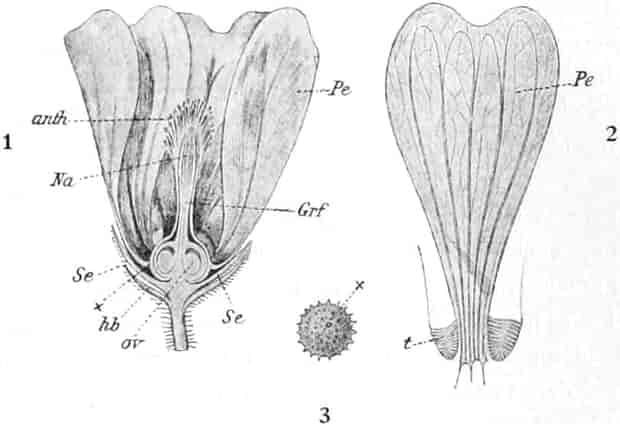
Malva silvestris L. 1. Längsschnitt durch die Blüte. 2. Corollenblatt mit den basalen Haarstreifen. 3. Pollenkorn.
[Tschirch-Oesterle, Atlas.]
Malva silvestris ist eine über ganz Europa, mit Ausnahme des äußersten Nordens, verbreitete und ziemlich häufige Ruderalpflanze. Sie findet sich auch am Cap, in Nordafrika, Kleinasien, Cypern, dem südlichen Kaukasus, Südsibirien, Persien, Afghanistan, Vorderindien und über den Ural bis zum Altai. Sie ist jetzt auch nach Nordamerika verschleppt, ebenso nach Brasilien, wo sie jetzt überall vorkommt (PECKOLT[S. 360] 1900). Sie wird in Indien (Bombay) kultiviert. Sie findet sich auf Schutt, an Zäunen, Acker- und Wegrändern, sowie auf Waldschlägen, und steigt bis in die mittleren Gebirge. Blüht vom Juni bis Herbst. Sie heißt daher auch Herbst-Rose (UHLAND besang «des Herbstes Rose, der gesunk’nen Sonne Kind»).
Malva neglecta ist ein einjähriges oder ausdauerndes Kraut. Die einjährige Pflanze bildet einen niederliegenden Stengel mit spärlichen Verzweigungen, die ausdauernde eine bleibende Grundachse, die nach allen Seiten Stengel treibt. Die ganze Pflanze hat einen schmächtigeren, dürftigeren Wuchs wie M. silvestris, auch Blätter und Blüten sind kleiner (daher neglecta). Die Nebenblätter sind bis 6 mm lang, schief oblong, spitz, hinfällig. Die Blätter pflegen sehr lang gestielt zu sein, man findet bis 27 cm lange behaarte Blattstiele. Die meist 3–7,5 cm breite Spreite ist nierenförmig bis kreisförmig, schwach 5–7lappig, von 5–7 Nerven durchzogen, mit gerundeten, gekerbten, mehr oder weniger behaarten Lappen. Am Grunde ist die Behaarung stärker. Die langgestielten Blüten stehen in achselständigen, gedrängten Wickeln. Ihr Stiel verlängert sich später noch (bis 3 cm). Der Hüllkelch besteht aus drei freien, c. 5 cm langen, lanzettlichen, besonders am Rande behaarten Blättern. Der Kelch ist kaum länger als 1 cm und etwa bis zur Hälfte in fünf fast gleichseitig-dreieckige, spitze, außen behaarte, innen kahle Zipfel gespalten. Die hellrosenroten, fast weißen, dunkel geaderten Blumenblätter sind klein, etwa 12–13 mm lang, 2–3mal länger als der Kelch (bei der var. decipiens ASCHS. ebenso lang), umgekehrt eiförmig, oben tief ausgerandet, unten mit dem Nagel der Staubfadenröhre angewachsen. Die Staubfadenröhre ist 6 mm lang, dunkelrot, spärlich behaart. Fruchtknoten fein behaart, aus 11–15 Carpellen gebildet. «Im weiblichen Stadium der Blüte ragen die spitzen, innen papillösen Narbenschenkel über die Röhre hinaus, krümmen sich nach unten und berühren die bläulichen Staubbeutel; dabei können sie den Pollen aus den geöffneten Beuteln entnehmen und somit bei ausgebliebener Fremdbestäubung eine Selbstbefruchtung bewirken» (BERG-SCHMIDT, Atlas). Die kreisrunde, scheibenförmige, 6–7 mm breite Frucht ist vom bleibenden Kelche und Hüllkelche behüllt und zeigt auf der eingesenkten Oberseite ein kleines Spitzchen. Griffelpolster fast so breit als die glatten, am Rande abgerundeten Früchtchen. Die Teilfrüchtchen sind schwach gerunzelt. Der Same zeigt feine Punktierung. Die Behaarung der Pflanze wechselt auch bei M. neglecta sehr. Bisweilen sind die Blätter nur sehr spärlich behaart, der Blattstiel dagegen stets stärker. M. neglecta bildet mit M. rotundifolia L. einen Bastard, dessen schwach runzelige Früchtchen einen wenig hervortretenden Rand besitzen.
M. neglecta ist eine durch ganz Europa, von Rußland und Schweden bis Spanien und Portugal verbreitete Ruderalpflanze. Sie findet sich auch in Nordafrika von Marokko bis zum Sinai, dann in Syrien, Armenien, dem Kaukasus, Altai, Persien, Tibet, Vorderindien. Nach Nordamerika und Chile, wo sie jetzt auch vorkommt, ist sie wohl eingeschleppt, ebenso nach Australien. Sie findet sich an Wegen, auf Schutt und an gedüngten Stellen in der Nähe menschlicher Wohnungen, z. B. auf Dorfstraßen. Blüht Mai bis Herbst.
Die Droge wird meist von der überall häufigen, weil durch Menschen und Tiere leicht verschleppten, wildwachsenden Pflanze gesammelt. Doch werden die Malven in beschränktem Maße auch für den Handel kultiviert, z. B. in Belgien und Ungarn, und man sieht sie bisweilen auch in Bauerngärten. Die Blätter beider Malven werden in Österreich-Ungarn gesammelt (MITLACHER 1910). Pharmac. helvetic. IV[S. 361] u. and. Pharmac. lassen die Blätter beider Malven zu. Aus Algier wird etwas (1891: 3000 pounds) Fol. et Flos Malvae (von M. silvestr., macrocarp. und nicaeensis) ausgeführt (SIMMONDS, Useful pl. of Algeria. Am. journ. ph. 1891, 9). Die Blätter und Blüten sind fast geruchlos, beide schleimig. Die Blüten verfärben sich beim Trocknen in blau, das sehr beständig ist.
Pathologie. Auf Malva neglecta und Malva silvestris tritt an allen grünen Teilen Puccinia Malvacearum MONT. auf. (Näheres über dieselbe siehe unter Althaea officinalis.) — Außerdem treten auf den Malven noch verschiedene Imperfekten, besonders Colletotrichum Althaeae SOUTHWORTH (s. unter Althaea officinalis) auf (ED. FISCHER).
«Blätter, welche die braunen Sporenhäufchen von Puccinia Malvacearum MONTAGNE zeigen, dürfen nicht verwendet werden» (Pharm. helvet. IV).
Malva silvestris L. Epidermis der Oberseite des Laubblattes.
[Tschirch-Oesterle, Atlas.]
Anatomie. Bzw. der Nervatur der Blattzähne vgl. TSCHIRCH-OESTERLE, Anatom. Atlas (nach VIRCHOW). Das Blatt von M. silvestris besitzt auf beiden Seiten Spaltöffnungen, die in der Flächenansicht eigenartige Zapfen zeigen und 3 (bis 4) Nebenzellen besitzen. Die Epidermiszellen sind wellig verbogen. Die Haare bevorzugen den Rand und die Nerven. Sie sind meist einzellige, derbe, etwas gekrümmte Borsten (Fig. 126), die oft auf Gewebepolstern sitzen, daneben finden sich Köpfchenhaare und 2–7strahlige Büschelhaare (Sternhaare), ähnlich wie bei Althaea, aber viel spärlicher und meist nur auf der Blattunterseite. Die Basis der Blätter ist am stärksten behaart. Im Mesophyll liegt eine Reihe Palissaden und ein relativ dichtes Merenchym. Da und dort finden sich Calciumoxalatdrusen, Schleimzellen sowohl im Mesophyll wie in der Epidermis. Im Hauptnerven liegt ein kollaterales, radial-strahliges Bündel. Das Blatt von M. neglecta hat fast nur einzellige Haare. Die Blätter des Hochblattinvolukrums der Blüte von M. silvestris sind besonders am Rande, dann auch auf der Außenseite stark behaart. Die derbwandigen, meist ein- selten zweistrahligen, oft bis 2 mm langen Haare sitzen meist auf mehrzelligen Polstern. Im Mesophyll liegen Calciumoxalatdrusen und Schleimzellen. Die Haare der Kelchblätter sind denen des Hochblattinvolukrums ähnlich, doch treten hier daneben zahlreichere, mehrstrahlige Büschelhaare auf mit 2–9 Haarstrahlen, die bald der Epidermis direkt eingefügt, bald auf mehr oder weniger hohen Zellpolstern emporgehoben sind. Dazwischen finden sich Köpfchenhaare. Diese sind auch auf der Innenseite der Kelchblätter anzutreffen, die im übrigen einzellige, stark gekrümmte Wollhaare besitzt. Spaltöffnungen liegen auf beiden Seiten. Im Mesophyll findet sich, neben Schleimzellen, unter der Epidermis der Oberseite eine Schicht Calciumoxalatzellen. Die nur wenige Zellschichten dicken Blumenblätter enthalten den Farbstoff im Zellsaft gelöst. Die Epidermiszellen der Unterseite haben wellig verbogene Wände, die der Oberseite sind ziemlich gerade. Auf beiden Seiten, besonders reichlich an der Basis der Corolle, sitzen ziemlich viel Köpfchenhaare. Dort finden sich auch, die Einbuchtung zwischen je zwei Corollenblättern ausfüllend, zwei Haarstreifen, deren Haare einzellig und gerade sind. Von den Schleimzellen des Mesophylls[S. 362] sind bisweilen mehrere durch Resorption der trennenden primären Wände zu Schleimhöhlen zusammengeflossen. Auch die in der unteren Hälfte zu einer Röhre verwachsenen Filamente führen Büschelhaare und im Innern Schleimzellen. In der Antherenwand findet sich eine Faserschicht. Die Pollenkörner besitzen zahlreiche Austrittstellen für den Pollenschlauch, die Exine Stacheln und eine Stäbchenschicht. Der Griffel führt so viel Bündel als Narbenschenkel vorhanden sind, das leitende Gewebe liegt in der Mitte. Die Narbenschenkel zeigen Papillen nur an ihrer Innenseite und im Innern einen Streifen mechanisches Gewebe, das dem Krümmungsmechanismus der Narben (s. oben) dient. In jedem Fruchtknoten liegt ein anatropes, epitropes aufsteigendes Ovulum.
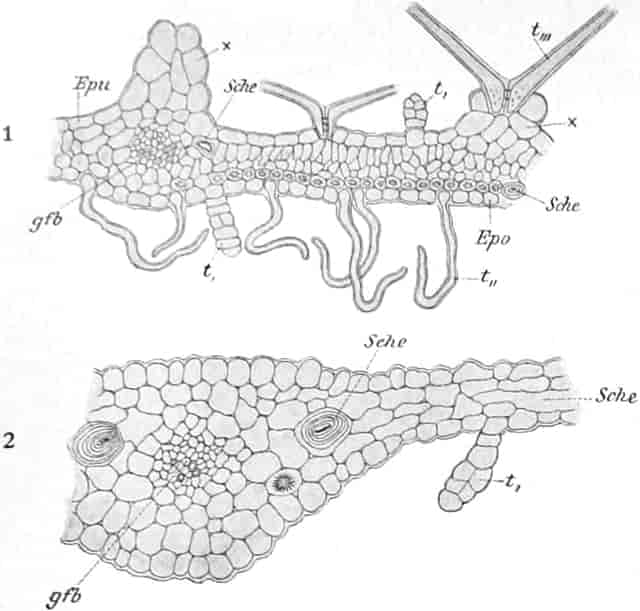
Malva silvestris L. 1. Querschnitt durch ein Kelchblatt. 2. Querschnitt durch ein Blumenblatt am Nerven.
[Tschirch-Oesterle, Atlas.]
Chemie. Die beiden Malven enthalten in allen Teilen Schleim. Der Farbstoff der Blüten wird durch Säuren rot, durch Alkalien grün. Die Asche des Fol. malvae beträgt c. 16% (HAUKE). Alle Laubblätter pflegen bekanntlich aschereich zu sein. Die Früchte enthalten einen Bitterstoff.
Verfälschungen. Folium Malvae fand MITLACHER 1910 mit den Blättern von Xanthium strumarium verfälscht. Auch Malva moschata wird angegeben, doch ist diese leicht schon am Geruch zu erkennen.
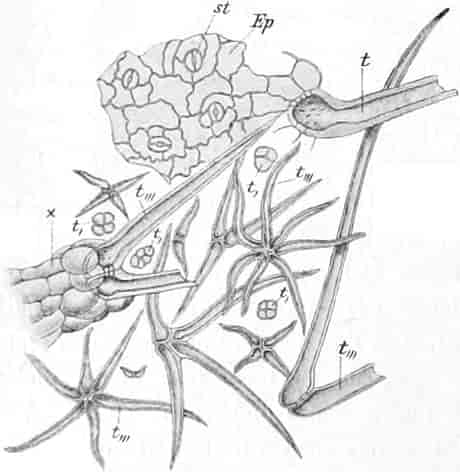
Malva silvestris L. Haarbildungen (t) an der Außenseite des Kelchblattes. × Haarpolster.
[Tschirch-Oesterle, Atlas.]
Anwendung. Man benutzt die beiden Malven ähnlich wie Althaea als Aufguß oder Beisatz zu Species (Spec. emollientes, Spec. pectoral., Spec. ad gargarisma, Spec. althaeae, Spec. puerperarum), auch als Ptisana de floribus malvae. Als Schleimmittel sind sie auch seit langem schon in Indien, Arabien und Persien in Benutzung (DYMOCK).
Malvaceenblattpulver ist als Verfälschung des Pulvers der Fol. digitalis beobachtet worden (1907).
HIPPOKRATES verwendete Malven neben anderen schleimhaltigen Mitteln. Die Früchte von M. silv., die noch jetzt viel in Indien benutzt und dahin aus Persien gebracht werden (DYMOCK), galten schon den Griechen als Aphrodisiacum, auch PLINIUS hält sie dafür, ebenso[S. 363] die Mohammedaner Indiens; MACER FLORIDUS verwendete sie bei Frauenkrankheiten. Der schleimige Brei dient noch heute beim Volke, um die verhärtete Gebärmutter zu erweichen. «Die Malve, die unter dem Zeichen der Venus steht, macht die brünstige Katze, die sich an ihr reibt, fruchtbar auch ohne Kater» — sagt der Volksmund.
Geschichte. Die μαλάχη ἀγρία des THEOPHRAST ist (nach SPRENGEL) Malva silvestris. Die μαλάχη des THEOPHRAST, die baumförmig wird und als Gemüse dient, ist vielleicht auch Malva silvestris oder die ebenso benutzte Lavatera arborea (FISCHER-BENZON). Ebenso erwähnt HESIOD das Malvengemüse, PALLADIUS gibt eine Anleitung zum Anbau und HORAZ singt: «me pascunt olivae, me cicorea levesque malvae» — und auch noch später dienten auch im Norden Malvenblätter als Gemüse. Bei HANS SACHS steht: «wir essen pappeln, kraut und grasz». M. silvestris wurde im Mittelalter von den Angelsachsen als Gemüse gebaut (HOOPS). PLINIUS, der Malva sativa (Gartenmalve) und M. silvestris (wilde Malve) unterscheidet, erwähnt, daß von den Gartenmalven zwei Arten unterschieden werden, die Malope (Lavatera arborea und Althaea rosea?) und die Malache (Malva silvestris und rotundifolia); die wilde Malve mit großen Blättern ist Althaea (s. d.). Im Edict DIOCLETIANS (I, S. 570) stehen Malvae maximae et sequentes. PROSPER ALPIN beschreibt und bildet unter dem Namen melochia Corchorus olitorius ab. Bei den Alten standen die Malven auch als diätetische Abführmittel in Gebrauch. SCRIBONIUS LARGUS benutzte die Samen, CAELIUS AURELIANUS Samen und Wurzeln, die HILDEGARD ein aus dem «slimechten» Kraute bereitetes Mus. ALBERTUS MAGNUS erwähnt beide: Malva neglecta (= malva) und M. silvestris (= arbor malvae, hier nicht die Stockrose, FISCHER-BENZON). Die Chubbâza des IBN BAITHAR ist jedenfalls eine Malve (wohl M. rotundifolia oder silvestris). Bei ARUCH und RASCHI steht: Eine Pflanze, deren Blätter sich nach der Sonne wenden und die malva heißt (LÖW). Malva silvestr. und nicaeensis steht auch in dem Botan. Lexikon Kitâb aš-šaǧar (NAGELBERG, Diss. Zürich 1909). In der Alphita (in der Tabulae und bei SERAPION) steht: Malva hortensis (melochia) et agrestis (minor), Succus et sem. malvae — chubeze. Malven stehen bei MACER FLORIDUS (I, S. 626) und in der Flos medicinae scholae Salerni (I, S. 629). Im Regimen sanitatis beginnt Malva den speziellen Teil. Die erste Abbildung von Malva silvestris finden wir bei BRUNFELS (I, S. 320, Fig. 310). FUCHS bildet Malva hortensis (Althaea rosea), M. silvestris pumila (M. neglecta) und M. sylvestris elatior (M. silvestr.) ab. Daß die Blüten der M. silvestris, die CORDUS als M. s. recta abbildete, größer sind als die der M. neglecta («vulgaris»), wußte schon BOCK. Flor. malv. commun. s. vulgaris finden sich in dem Catalogus von Straßburg 1685 (I, S. 827), der Taxe von Leipzig 1689 u. and.
Lit. BERG-SCHMIDT, Atlas 2. Aufl. t. 104 und 105 (dort die systemat. Liter.). — PABST-KOEHLER, Medizinalpflanzen t. 59. — NEES V. ESENBECK, Pl. med. t. 415. — LUERSSEN, Med. pharm. Bot. S. 664 (dort die botan. Lit. der Familie). — ARTHUR MEYER, Drogenkunde. — KARSTEN-OLTMANNS, Pharmakogn. Fig. 315–318. — ENGLER-PRANTL, Pflanzenfam. II, 1, Fig. 99 E und III, 6, Fig. 17. — RAUTER, Denkschr. Wien. Akad. 31 (1872) 23, t. 7 (Entwickl. d. Haare). — DUMONT, Ann. sc. nat. bot. VI (1887) 138. t. 4. — KUNTZE, Bot. Centralbl. 1891. — SOLEREDER, System. Anat. der Dikotylen (dort weit. Lit.). — ADOLF MEYER, Anat. Char. offiz. Blätter, Halle 1882. — LEMAIRE, Déterm. histol. d. feuilles médicin. Paris 1882. — TSCHIRCH, Anatomie und TSCHIRCH-OESTERLE, Anatom. Atlas (dort das anatom. Detail). — LOHDE, Entwicklungsgesch. u. Bau einiger Samensch. Diss. Leipzig 1874. — HARZ, Landwirtsch. Samenkunde 1885, II. 749. — HOLFERT (Nährschicht). Flora 1890. — Entwicklungsgesch. d. Samens in BOCHMANN, Beitr. z. Entwicklungsgesch. offizin. Samen u. Früchte. Dissert. Bern 1901. — GRASSMANN, Pflanzennamen. — KLUGE, Etymol. Wörterb. — FLÜCKIGER, Pharmak. — HAUKE, Aschengehalte 1902.
Flos Malvae arboreae.
Syn. Stockrose, Stockmalve, Winterrose, Pappelrose, Schwarze Malve — passe rose, rose trémière, rose d’outremer, bâton de Saint-Jacques (franz.) — garden mallow (engl.) — english hollyhock (in Indien) — stokroos (hol.) — vörösmályvarirag (ung.) — ἄνθη μαλάχης τῆς δενδροειδοῖς (n.-gr.) — fu-sang (chin.). — Bei MEGENBERG: Weizpappel — im Ortus sanitatis: felris — Soll das chatmi des QUTSÂMÎ und and. pers.-arab. Autoren sein, das auch Schahm-el-marah genannt wird (DRAGENDORFF).
Stammpflanze Althaea rosea (L.) CAVANILLES (Alcea rosea L.).
[S. 364]
Malvaceae — Malveae — Malvinae.
Etym. Alcea, αλκέα (von αλκέειν = heilen) in der Orphischen Argonautika und bei DIOSKURIDES, bei letzterem «eine Art wilder Malve», d. h. die in Griechenland häufige Malope malacoides.
Beschreibung und Kultur. Die zwei- oder mehrjährige, einen prächtigen Gartenschmuck bildende Pflanze besitzt eine innen weiße, schleimige Wurzel (vgl. S. 354) und treibt im zweiten Jahre einen geraden, bis 3 m hohen, runden, einfachen oder wenig verästelten, blütentragenden Stengel. Die gestielten, runzeligen, rundlich-herzförmigen, gekerbten, steifhaarig-filzigen Blätter sind unten 5–7lappig, oben 3lappig und kürzer gestielt. Auch die Blattstiele sind stark behaart. Die Nebenblätter sind ziemlich breit und in mehrere Zipfel gespalten. Die großen Blüten, die bisweilen einen Durchmesser von 7,5 cm erreichen, sitzen einzeln oder zu mehreren in den Achseln der Blätter. Das Hochblattinvolukrum (der Außenkelch) ist 6–9spaltig, halb so lang als der Kelch, stark behaart. Der Kelch ist unten verwachsen, oben in 5 Zipfel gespalten. Die Farbe der Korolle wechselt nach den Varietäten von weiß zu gelb, braun, blau, purpurn bis schwarz. Die 5 Kronenblätter sind geschweift oder ausgefressen gekerbt, breit-herzförmig oder rundlich-dreieckig, etwas wellig verbogen, an der Basis genagelt. Bei den gefüllten Varietäten ist ihre Zahl durch Umbildung der äußeren Stamina oft stark vermehrt. Die Staubfadenröhre geht oben in zahlreiche Filamente über, die monothecische Antheren tragen. Der vielfächerige Fruchtknoten ist zusammengedrückt, gefurcht und behaart. Die Griffel sind kürzer als die Staubfäden. Die Frucht ist von dem Kelche behüllt, in der Mitte genabelt. Sie besteht aus 20–40 rinnenförmigen, am Rücken tiefrinnenförmigen einsamigen, nicht aufspringenden Früchtchen.
Althaea rosea wächst wild im Orient. Sie findet sich (wohl verwildert?) auf den Bergen Italiens, Griechenlands, Syriens und der benachbarten Länder. Sie wird im größten Teile von Europa bis nach Norwegen (Throndhjem) hinauf als Gartenpflanze gezogen, in einigen Mengen bei Nürnberg (stark zurückgegangen, SCHWARZ 1910) und in Württemberg; dann auch in Ungarn, z. B. in der Versuchsstation in Klausenburg (PATER), im Komitat Neutra (AGNELLI), in Eger u. and. Orten (vgl. MITLACHER 1909). Mittelfranken soll jährlich 50000 kg ausführen, besonders nach Frankreich, England und der Türkei (GLAN 1892). In Griechenland sammelt man auch von der wildwachsenden Pflanze (HELDREICH). MORISON erwähnt Alth. rosea unter den Arzneipflanzen der südlichen Mandschurei. Die Stockrose wird in allen Farben — blau, purpurn, fast schwarz, gelb, braun, weiß — gezogen. Sie findet sich fast regelmäßig in den Bauerngärten Deutschlands und der Schweiz, wird aber auch anderwärts, z. B. in Vorderindien kultiviert. Arzneilich und als Farbstoff liefernd wird nur die blauschwarze Varietät und vorwiegend die mit gefüllten Blüten benutzt. Sie findet sich im Handel cum calyce und sine calyce.
Pathologie. Puccinia Malvacearum MONT. und die verschiedenen Imperfekten, welche die Blätter von Althaea rosea schädigen, können auch auf dem Außenkelch und auf dem Kelche der Blüten zur Entwicklung kommen (ED. FISCHER).
Anatomie. Der etwa 2,5 mm dicke Blütenstiel zeigt ein großes Mark, einen schmalen Gefäßbündelzylinder, einen ununterbrochenen peripherischen, etwa 10 Zellen breiten Collenchymring und an der Grenze desselben nach Innen einen Kreis von meist isolierten Schleimzellen. Die letzteren sind 13–35 mik breit, besitzen ein sehr enges Lumen und breite, treffliche Schichtung zeigende sekundäre Membranverdickungsschichten. Der Epidermis der Blütenstiele sitzen zahlreiche einfache oder Büschelhaare auf. Die Blätter des Außenkelches sind innen (oben) glatt und dort größtenteils unbehaart. Die Epidermiszellen sind hier sehr stark verdickt. Nur an den Blatträndern, sehr selten auch auf der Blattfläche, treten einzelne Haare auf. Dieselben sind stets einfach, entweder gerade oder vielfach gewunden, gekrümmt und durcheinandergeschlungen. Die Blatt-Außen-(Unter)-Seite ist dicht filzig behaart. Die Haare sind hier nur selten einfach, meist sind es Büschelhaare (Sternhaare). Dieselben sind mit ihrem breiten Fuße entweder der Epidermis direkt oder einem flachen Gewebshöcker eingefügt und besitzen meist 8 Strahlen. Ihre Größe variiert sehr, sie kommt in der Länge der Strahlen zum Ausdruck, die bis zu mehreren Millimetern steigen und bis auf 50 mik herabgehen kann. Diese Sternhaare sind für die Droge sehr charakteristisch. Eingestreut in das reich durchlüftete Mesophyll der Hochblätter finden sich zahlreiche Schleimzellen und Schleimzellgruppen und Gefäßbündel (Nerven). Die Blätter des Kelches sind ähnlich wie die Hochblätter des Außenkelches gebaut, d. h. sie sind außen sehr stark behaart — fast noch stärker als die Außenkelchblätter und innen kahl oder doch nur an den Rändern behaart. Ihr Mesophyll ist dichter, Schleimzellen[S. 365] sind seltener und meist isoliert. Kalkoxalatdrusen finden sich im Mesophyll häufig, besonders in den Schichten unter der Epidermis der Blattoberseite. Die Blätter der Korolle zeigen beiderseits eine Epidermis, die an den unteren Teilen des Blattes aus gestreckten, geradwandigen, an den oberen aus Zellen mit wellig verbogenen Seitenwandungen besteht. Die Zellen, beiderseits gleichgestaltet und nicht sehr hoch, enthalten ein Plasmanetz, deutlichen Zellkern und eine intensiv blaue Farbstofflösung. Das Mesophyll ist nur im basalen Teile des Blattes viele (10) Zellschichten dick, in dem überwiegenden Teile desselben besteht es nur aus wenigen Reihen und ist fast vollständig verschleimt. Die Verschleimung ist eine so starke, daß oft der gesamte Zwischenraum zwischen den Gefäßbündeln (Nerven) eine einzige große Schleimhöhle bildet. Diese Schleimhöhlen kommen dadurch zu stande, daß eine Gruppe benachbarter Zellen ihre Membranen verdickt, also jede Zelle auf der primären Membran sekundäre, aus Schleim bestehende Membranverdickungsschichten ablagert. Dies geschieht in so ausgiebigem Maße, daß das Lumen auf einen kleinen Raum reduziert wird. Läßt man zu einer solchen Gruppe Wasser hinzutreten, so tritt zunächst an jeder einzelnen Zelle die Schichtung deutlich hervor. Die Zellen dehnen sich dann stark aus, sprengen die primären Zellulosemembranen, die Schleimschichten der einzelnen Zellen fließen zusammen und es entsteht so eine große, oft 400–550 mik weite, oft von Bündel zu Bündel reichende mächtige Schleimhöhle. Auch in der lebenden Pflanze findet ein solches Aufquellen der Zellen und ein Zusammenfließen der Schleimzellen statt und tritt hier (wie bei den Tiliaceen) bisweilen noch eine nachträgliche Auflösung der primären Membranen ein. Die fertigen Höhlen lassen bisweilen (freilich selten) noch eine ganze Anzahl nebeneinanderliegender geschichteter Schleimklumpen erkennen, meistens ist jedoch das Ganze zu einer homogenen Schleimmasse zusammengeflossen. An der Basis sind besonders am Rande die Blumenblätter mit einem Haarbesatz bekleidet. Die Haare desselben sind sehr lang.
Chemie. Die Blüten enthalten viel Schleim, einen eisengrünenden Gerbstoff und Farbstoff. Der wässrige Auszug der Stockrosenblüten ist stark schleimig.
Die Blumenblätter geben mit verdünntem Alkohol (1=10) einen violettroten Auszug, der noch in 1 cm dicker Schicht undurchsichtig ist (FLÜCKIGER). Mit Ätzkalk liefert dieser Auszug einen grünen Bodensatz und ein (fast) farbloses Filtrat. Alaun färbt violett, schüttelt man darauf mit Calciumkarbonat, so wird die Farbe der Lösung bleibend blau. Brechweinstein färbt violett. Rotweinfarbstoff verhält sich ganz anders. Bei Gemischen beider werden aber die Reaktionen undeutlich. Die Lösung des Farbstoffes von Alth. ros. rubr. wird mit Ammoniak, Natronhydrat und Soda grün, durch Salzsäure und Salpetersäure rot, durch Essigsäure rotviolett, durch Eisenchlorid braunrot, durch Zinnchlorür violett, durch Alaun und Soda entsteht ein grüner Niederschlag, das Filtrat ist farblos; ebenso durch Bleiazetat und Bleiessig. Der Farbstoff der Flos alcaeae verhält sich ähnlich, doch ist bei den Bleifällungen das Filtrat grün (VAN DER DRIESSEN). Konzentrierte Kupfersulfatlösung färbt die Farbstofflösung violett (Rotwein wird dadurch entfärbt, BÖTTGER). Der Malvenfarbstoff gibt in Lösung in sehr verdünntem Alkohol ein breites Band zwischen F und D FRAUNHOFER, das nach Zusatz von Ammoniak nach dem roten Spektrumsende rückt und dann zwischen D und C liegt, nach Zusatz von Alaun liegt das Band auf D und ist gegen Rot scharf begrenzt, gegen Grün verwaschen (PHIPSON, H. W. VOGEL). Das Malvenband kommt nach Zutröpfeln von Alaun bei noch schwach saurer Reaktion, das Ammon-Rotweinband erst bei völliger Neutralisation zum Vorschein. Aus sauer reagierendem Wein nimmt Amylalkohol zuerst den Malvenfarbstoff auf, dann erst den Rotweinfarbstoff. Malvenwein färbt sich mit Kupfersulfat schön violett, Bleiessig fällt grün. Gärung verändert den Farbstoff nicht wesentlich. Ein Zusatz von Malvenfarbstoff beeinträchtigt die Haltbarkeit des Weines. Der Malvenfarbstoff ist unbeständig. Er bildet mit dem des Flieders eine Gruppe, die bestimmt von der der Kirsche und der Heidelbeere verschieden ist (H. W. VOGEL). Der Farbstoff läßt sich in einen wasserlöslichen und einen in Wasser unlöslichen, alkohollöslichen trennen, die sich durch Farbe und Reaktion unterscheiden. Der letztere, der bei der Kalischmelze Hydrochinon und Brenzkatechin liefert, hat die Formel C14H16O6 (mit 2 OH-Gruppen), der erstere ist ein Glykosid (GRAFE). Man hat den Malvenfarbstoff auch zur Herstellung von Reagenspapier empfohlen (Vorschrift in FISCHER-HARTWICH, Pharm. Praxis II, 346). Das Papier wird durch Säuren rot, durch Alkalien grün. Die Empfindlichkeit gegen HCl ist 1 : 13000, die zu NH3 1 : 20000. Der Farbstoff ist nicht nur ein spezielles Codeinreagens (BENEZECH), sondern reagiert auch mit einigen anderen Alkaloiden (z. B. Atropin,[S. 366] Brucin, Nikotin) mit grüner, mit Chininsulfat mit Purpurfarbe. Er ist aber indifferent gegenüber Morphin, Cocain, Kaffein und Cinchonin (WOOLSEY).
Anwendung. Man benutzt die Flor. malv. arbor. zur Herstellung schleimiger Dekokte und Gurgelwässer, z. B. bei Angina. Der Farbstoff wird jetzt nur noch wenig zum Auffärben von Rotweinen benutzt, da sich hierfür haltbarere Pflanzenfarben besser eignen (Kermesbeeren, Liguster, Orseille, Cochenille).
Geschichte. Die Stockrose scheint im Altertum und Mittelalter nicht bekannt gewesen zu sein, die Malven des THEOPHRAST, DIOSKURIDES und ALBERTUS MAGNUS sind andere Pflanzen (vgl. oben S. 363). GALENS Baummalve (δενδρομαλάκη nach FRAAS die μαλάκη δενδρώδης des THEOPHRAST) ist wohl Lavatera arborea L. Erst im XVI. Jahrh. begegnen wir ihr sicher, bei BOCK (sowie TABERNAEMONTANUS, MATTHIOLI) heißt sie Herbst- oder Ernrose, weil sie erst zur Erntezeit blüht, oder römische Pappeln, Malva romana, auch Rosa ultra marina. BOCK und GESNER beschreiben sie und bilden sie ab. Sie war schon damals in zahlreichen Farbenvarietäten bekannt (vgl. J. D. HOST, Malva arborescens lutea Gissae 1654). FISCHER-BENZON ist der Ansicht, daß sie durch die Türken nach Europa kam. Auch der sich bei BOCK und GESNER findende Beisatz romana deutet ihren fremden Ursprung an. Sie war wohl im XVI. Jahrh. diesseits der Alpen noch selten (FLÜCKIGER). Doch finden wir bei den patres botanices Abbildungen und Beschreibungen von ihr. Der Vergleich mit einer (geruchlosen) Rose findet sich bereits bei PORTA (Villae), BOCK («nobilem hunc rosam») und MATTHIOLI, der Ausdruck Malva rosea bei LOBELIUS (Adversaria 293); später finden sich dann auch noch die Bezeichnungen Malva rosacea hortensis, Rose di Francia (bei Neapel). Möglicherweise bezieht sich auch der Ausdruck Rosa syriaca auf die Stockrose (?) und ihre Herkunft aus der Türkei. Die Bezeichnung ros syriacus (Flos malvae vel orni id est querci) in der Alphita (I, S. 657), an anderer Stelle (I, S. 648): flos syriacus, flos malvae, ros syriacus = flos orni ist unklar, bezieht sich aber wohl nicht auf die Stockrose. In der Alphita oxoniensis (I, S. 652) steht Malua siriaca (molochia, malua domestica siue ortulana). In den mittelengl. Medizinbüchern (I, S. 683) flos siriacus, malew, malowys (HENSLOW deutet dies als M. silvestris). Nach dem Pinax BAUHINS, in dem sich auch eine Alcea arborescens Syriaca befindet, ist die syrische Malve eine von A. rosea verschiedene Art (?). In der Reformatio von Worms von 1582 (I, S. 817) finden sich: Flos malvae arb. = Finrosen, Halsrosen oder Brennrosen. A. ros. steht auch im Pen tsʿao kang mu (I, S. 518).
Lit. Abbild. in PABST-KÖHLER, Medizinalpfl. t. 19, NEES VON ESENBECK, Pl. med. t. 416 und BERG-SCHMIDT, Atlas (I. Aufl.) t. 21. — MORISON, Jahresber. d. Pharm. 1885, 12. — MITLACHER, Arzneipflanzenkultur. Pharm. Post 1909. — FLÜCKIGER, Pharmakogn. — Nährschicht: HOLFERT, a. a. O.
Farbstoff: H. W. VOGEL, Absorptionsspektra. Ber. d. d. chem. Ges. 1875, 1246 u. 1876, 1906 und Spektralanalyse. — PHIPSON, Chem. News 20, 229 (Zeitschr. anal. Chem. 9, 121). — BÖTTGER, Zeitschr. anal. Chem. 15, 102. — VAN DER DRIESSEN, Ned. Tijdskr. 1900. — GRAFE, Stud. über d. Anthokyan. Anz. d. Wien. Akad. 1909. — BENEZECH, Pharm. Zeit. 1892, 547. — WOOLSEY, Althaea rosea. Bulletin of pharm. 1897, 342. — GLAN, Über d. Farbstoff d. schw. Malve. Dissertat. Erlangen 1892 (Beih. z. Bot. Zentralbl. 1893, 292). — WEIGERT, Jahrb. d. önolog.-pomolog. Lehranst. Klosterneuburg 1894. — Empfindlichkeit des Malvenpapiers: Pharm. Post 1895, Nr. 1. — HASTERLIK, Mitt. aus d. pharm. Instit. Erlangen 1890. — Vgl. auch LINSBAUER in WIESNER, Rohstoffe II, 656. Spektralanalyt. Verhalten verschieden behandelter Lösungen des Farbstoffes in KÖNIG, Nahr.- u. Genußm. III. B. (1910), 584.
Flos Tiliae.
Syn. Lindenblüte — tilleul (franz.) — linden oder lime tree (engl.) — linde (holl.) — tiglio (ital.) — tilo (span.) — niinipuun kucka (fin.) — hársfa (ung.) — ἄνθος φιλύρας (n.-griech.).
ahd.: lin, lind, linda, linta — mhd.: linde, leynde, lindeboumen — anord.: lind — ags.: lind — serb., russisch, böhm. wend.: lipa (davon Leipzig!) — arab.: uglamur — jap.: badaisin.
Etym. Linde ist ein uralter Name und in vielen, sehr alten Ortsnamen enthalten. Linter[S. 367] (lin = Lein, ter, tera, tra = Baum, also Leinbaum, wegen der faserigen Rinde), «der uralte deutsche Bast- oder Gewandbaum», noch jetzt in St. Gallen: Bastholz. Das ahd. linta bedeutet sowohl Linde wie Bast, das altnord. lindi Gurt, das schweiz. linte Flachs und Hanf, das schwedische linda auch Binde — alle Bezeichnungen hängen also mit Binden und Bast zusammen. Im Isländischen bedeutet lind Baum schlechthin (Katexochebegriff, vgl. I, S. 1066). (Vielleicht (?) in Beziehung zu ἐλάτη, lentâ = Fichte, vgl. den Wandel in der Bedeutung von Baumnamen in KLUGE, Etymol. Wörterbuch). Mit «gelinde» hat es jedenfalls nichts zu tun, wie LONICERUS, ADELUNG u. and. meinen. Übrigens kommt auch der Name LINNÉ von Linde (und zwar von einem bestimmten Lindenbaum). Tilia (von θήλεια) wird meist mit πτίλον (= Flügel) zusammengebracht, wegen der flügelartigen Bractee. Andere bringen es mit τίλος (= Faser) zusammen und dies scheint mir das wahrscheinlichere. Auch zu φιλύρη (= Linde und Bast — verwandt mit φλόος = Bast) — was auch einiges für sich hat — ja sogar mit πτελέα (= Ulme) ist tilia in Beziehung gebracht worden (KANNGIESSER).
Stammpflanze. Tilia Europaea L. (Spec. pl. ed. I, 514) wird jetzt in folgende Arten gespalten:
Tilia ulmifolia SCOPOLI Fl. Carn. I, 374 (1772) [T. europaea L. ex parte (γ), T. parvifolia EHRHART, T. microphylla VENTENAT, T. silvestris DESF., T. cordata MILL.], Spät-, Winter-, August-, wilde, Wald- oder Steinlinde. Bei BOCK: wild Lindenbaum (T. silvestris), — blüht Ende Juni bis Mitte Juli (in Süddeutschland c. 10. bis 25. Juli) — mit der Form intermedia DC. [T. europaea L. ex parte (α), T. hybrida BECHST., T. vulgaris HAYNE] und die für uns weniger wichtige
Tilia platyphyllos (auch platyphylla ASCHERSON) SCOPOLI Fl. Carn. I (1772) [T. europaea L. ex parte (β), T. grandifolia EHRHART, T. pauciflora HAYNE, T. cordifolia BESS.], Früh-, Sommer-, Gras-, Hamburger oder holländische Linde. Bei BOCK: zam Lindenbaum (T. sativa), — blüht Anfang bis Ende Juni oder Anfang Juli, c. 14 Tage früher als T. ulmifol. (doch kehrt sich in Italien das Verhältnis um, FLÜCKIGER). — Nebst Hybriden zwischen beiden Arten.
Bei den Tiliaarten muß der Autor beigesetzt werden. Es gibt drei grandifolia und drei platyphyllos (HOLMES).
Systemat. Stellung. Tiliaceae, Tilieae.
Etym. Auf die kleinen Blätter bezieht sich: parvifol. (von parvus) und microphylla (von μικρός), auf die großen Blätter: grandifolia, auf die wenig zahlreichen Blüten pauciflora.
Beschreibung. Die Linde wird bis 50 m hoch und bis 600 und mehr Jahre alt. Sie trägt eine dichte, gerundete Krone mit weit ausladenden Ästen. «Die jüngsten Zweigchen sind deutlich zweizeilig wie eine Steigeleiter angeordnet» (SCHUMANN). Die leicht abziehbare Rinde ist reich an Bastfasern. Das helle Holz ist sehr gleichmäßig gebaut. In Mark und Rinde liegen Schleimzellen. Die deutlich zweizeilig, abwechselnd dorsiventral angeordneten Blätter sind gestielt, schief herzförmig, zugespitzt, ungleich gesägt bei T. ulmifolia, oberseits kahl und dunkelgrün, unterseits blaugrün, bei T. platyphyllos ist die Farbe der beiden Blattseiten fast gleich. In den Achseln der Nerven sitzen bei T. ulmifolia rotgelbe, bei T. platyphyllos weißliche Haarbüschel. Diese Haarbüschel sind Domatien für Milben. Die Milben halten als «Dank» für die Unterkunft, die ihnen das Blatt gewährt, bei ihren Exkursionen während der Nacht — am Tage bleiben sie im «Milbenhäuschen» — das Blatt von Pilzsporen u. and. Schädlingen frei (Symbiose). T. ulmifolia hat meist kleinere Blätter als T. platyphyllos, auch sind die Blätter kahl, während sie bei der anderen Art weichhaarig zu sein pflegen. Die Nebenblätter werden beim Austriebe abgeworfen, nachdem sie als Knospenschuppen gedient haben.
[S. 368]
Die bei T. ulmifolia vorgestreckte, bei T. platyphyllos hängende Infloreszenz zeigt folgenden Bau. Das Laubblatt der blühenden Zweige (l, Fig. 129) trägt in seiner Achsel auf der einen Seite eine gestielte Infloreszenz mit einem, dem Stiele halb angewachsenen flügelförmigen Blatte (a, Fig. 129), auf der anderen eine kleine Knospe (b). Die Infloreszenz ist als der Achselsproß des Laubblattes l aufzufassen, das Blatt a ist das eine, das Deckblatt der Knospe (b) das andere Vorblatt dieses Achselsprosses. Das Blatt a bleibt steril, in der Achsel von b entsteht eine (überwinternde) Knospe. Diese Knospe (b, Fig. 129) ist eine Laubblattknospe, nicht eine Blütenstandknospe wie bei FLÜCKIGER u. and. steht (vgl. den Querschnitt Fig. 129). Die Blütenstände entstehen erst an den Jahrestrieben, daher blüht die Linde so spät. Die Infloreszenz selbst schließt mit einer Gipfelblüte (t), der drei zarte Hochblättchen c, d und e vorangehen, die in einer Spirale angeordnet sind Fig. 129), c bleibt steril, die beiden anderen d und e entwickeln in ihren Achseln Blüten, deren Stielen sie eine Strecke weit angewachsen sind. Diese Blüten haben zwei sehr zarte, ungleich hoch inserierte, hinfällige Vorblättchen. Aus diesen kann sich die Verzweigung fortsetzen. Bei T. platyphyllos beträgt die Zahl der Blüten 3–7, bei T. ulmifolia bis 13 (oder gar 15). Die sekundäre Verzweigung der Infloreszenz ist dichasialwickelig. Die etwa 6–8 cm lange Infloreszenz ist besonders ausgezeichnet durch das der Infloreszenzachse ein Stück weit — meist etwa bis zur Mitte — angewachsene große, lineal-längliche, zungenförmige, stumpfe, ganzrandige, häutige, netzadrige, bleich-grüngelbliche Deckblatt (sog. Bractee — es ist aber ein Hochblatt). Die proterandrische Blüte ist fünfzählig. K 5, C 5, A 30–405 G. (5). Die zahlreichen Stamina sind als aus fünf epipetalen Primordien entstanden zu denken.
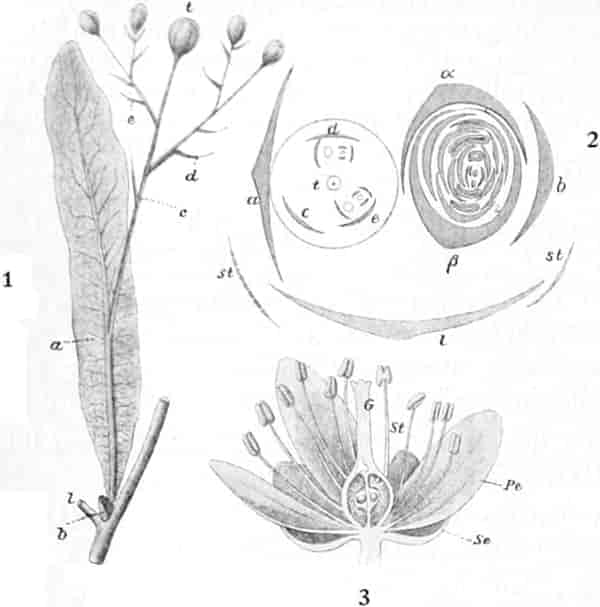
Tilia platyphyllos. 1. Infloreszenz in der Aufsicht. 2. Dasselbe im Grundriß. Die Buchstaben bezeichnen die korrespondierenden Teile. 3. Blüte im Längsschnitt.
[Tschirch-Oesterle, Atlas.]
Der Kelch, der besonders beim Aufblühen sehr angenehm riechenden (bei T. platyphyllos ansehnlicheren) Blüten besteht aus fünf in der Knospenlage klappigen, leicht abfallenden, oval-oblongen, kahnartigen, c. 5 mm langen, grau-grünen, behaarten Blättern. Die fünf mit den Sepalis alternierenden Kronenblätter sind länger als die Kelchblätter, grünlich-gelb (bei T. plat. gelb), oblong-spatelförmig, an der Spitze abgerundet oder zugespitzt, in der Knospenlage gedreht. Sie besitzen an ihrer Basis auf der Innenseite ein drüsiges Nectarium (SCHNITZLEIN), weshalb die Blüten viel von Bienen und Fliegen besucht werden, die vom Dufte angelockt, oft zu hunderten die blühende Linde umschwärmen. Die zahlreichen (30–40), freien Staubgefäße sind kaum länger als die Blumenblätter. Sie stehen in fünf epipetalen Phalangen und sind[S. 369] alle fruchtbar. An der Spitze ist das Filament gegabelt und trägt an den Gabelästen die beiden gesonderten Thekae (Antherenhälften), die am Rücken angeheftet sind und mit Längsspalten aufspringen. Der oberständige Fruchtknoten ist kugelig, dicht filzig. Er besteht aus 5 (selten 3 oder 4) Carpellen und ist meist fünffächerig. In jedem Fach liegen zwei anatrope, aufstrebende Ovula. Von allen zehn wächst aber nur eins (oder zwei) zu dem endospermhaltigen Samen heran, die anderen verkümmern und werden beiseite geschoben. Der einfache Griffel ist kürzer als die Staubgefäße und trägt an der Spitze eine fünflappige, papillenfreie Narbe, deren Lappen vielfach zerschlitzt sind. Die nußartige, einsamige Frucht ist 7–8 mm breit, fast kugelig, mit kurzer, schiefer Spitze versehen. Die Früchte sind bei T. ulmifolia dünnschalig, zerbrechlich, undeutlich-kantig, bei T. platyphyllos größer (oft 4 mm), fünfkantig, mit holziger Schale. Der Fruchtstand trägt noch die Bractee (s. oben). Dies «Flügelblatt» dient ihm als Flugapparat. Der Same enthält reichlich Endosperm und einen Keimling mit gefalteten, blattartigen, fünflappigen Keimblättern, sowie einer dicken Radicula.
Verbreitung. T. platyphyllos erreicht ihre Polargrenze schon in Mitteldeutschland (WILLKOMM), wo sie übrigens ursprünglich nicht heimisch war (GRISEBACH). T. ulmifolia dagegen, die nach den Moorfunden zu schließen, als alteinheimische Pflanze Nordwestdeutschlands anzuerkennen ist (HOOPS, vgl. auch BOCK oben S. 367) und die sich im größten Teile von Europa findet, geht wildwachsend in Norwegen und im Ural bis zum 62°, in Schweden bis zum 63° (in Anlagen bis zum 68°, SCHÜBELER). Im Süden findet sie sich mehr in den Bergen (bis 1200 m). Sie fehlt in Süd-Spanien, Süd-Italien und Griechenland, findet sich aber in den südlichen Kaukasusländern und geht über den Ural bis zum Altai. Im russischen Gouvernement Kostroma finden sich Linden noch auf dem 68°. T. platyphyllos ist wohl im Südosten (Donauländer, Griechenland, Unteritalien, Spanien) heimisch. Wälder bildend ist die Linde in Deutschland nie gewesen und ist sie auch heute nicht, im Osten dagegen, z. B. am Dnjepr, finden sich große Lindenwälder. Beide Linden finden wir oft als Alleebäume, in Anlagen, auf Friedhöfen, am Dorfteich, «am Brunnen vor dem Tore», — sowie als «Gedenklinden» angepflanzt. T. platyphyllos ist stärker und langlebiger als T. ulmifolia.
Lit. BERG-SCHMIDT, Atlas II. Aufl. t. 108 (dort die systemat. Liter.). — PABST-KÖHLER, Medizinalpfl. t. 15. — SZYSZYLOWICZ, Syst. d. T. Englers Jahrb. VI (1885). — J. MOELLER, Pharmakogn. Fig. 108 u. 109 und Artikel Tilia in Realenzykl. d. Pharm. — EICHLER, Blütendiagr. — SCHUMANN in ENGLER-PRANTL, Pflanzenfam. — TSCHIRCH-OESTERLE, Atlas. — SCHÜBELER, Pflanzenwelt Norwegens. — FLÜCKIGER, Pharmakogn. — GRISEBACH, Vegetat. d. Erde I, 142. — WILLKOMM, Forstl. Flora. — SCHNITZLEIN, Das Honigorgan d. Lindenblüte. Ber. Naturhist. Ver. Augsburg 1858. — HOLMES, Pharm. Journ. 1900, 418.
Einsammlung. Lindenblüten werden gesammelt in Deutschland (Franken, Elsaß) — der Elsaß liefert jährlich 2–3000 kg (ROSENTHALER) — der Schweiz, speziell in den Kantonen Bern, Solothurn, Luzern, Uri, Wallis, St. Gallen (SCHÜRMANN), Österreich (z. B. Mähren), Ungarn (PATER) und den Balkanländern. Montenegro führte 1907 für 20900 Kronen Flos tiliae aus (TUNMANN); auch Österreich exportiert (MITLACHER), ebenso Belgien (I, S. 100) und das Gouvernement Poltawa (Rußland). Durch, wegen der Beschädigungen der Bäume durch vandalisches Abreißen ganzer blütentragender Zweige, erlassene polizeiliche Verfügungen ist das Einsammeln von Lindenblüten in Deutschland sehr erschwert. Die Handelsware besteht (nach A. MEYER) meist aus den Blütenständen von T. platyphyllos, obwohl die von T. ulmifolia höher geschätzt werden. 4 Teile frische Blüten geben 1 Teil trockene. Will man oxydasehaltige[S. 370] Blüten, so muß man bei niedriger Temperatur im Schatten trocknen, da die Oxydase durch scharfes Trocknen und Sonnenlicht zerstört wird (CARLES). Der Vorrat ist jährlich zu erneuern, da die Blüten sich rasch verriechen. Der Geruch nimmt schon beim Trocknen stark ab. Es ist auch Fl. Til. sine bracteis im Handel.
Lit. MITLACHER, Pharm. Post 1909. — ROSENTHALER, Apoth. Zeit. 1909. — SCHÜRMANN, Schw. Wochenschr. 1908. — TUNMANN, Apoth. Zeit. 1910.
Pathologie. Auf den Blättern der Linde kommen verschiedene parasitische Pilze, namentlich Pyrenomyceten und Imperfekten vor. Dieselben können sicherlich auch mitunter das Deckblatt der Infloreszenzen oder letztere selber befallen. Es wird dies angegeben für Gloeosporium tiliaecolum ALLESCHER, welches nach LAUBERT (Zeitschrift f. Pflanzenkrankh. Bd. 14, 1904) auch auf diesen Teilen auftreten kann (ED. FISCHER).
Über die tierischen Schädlinge der Linde berichtet ISRAEL:
Käfer: Pogonocherus hispidus L. Die Larve dieses Bockkäfers lebt in dürren Zweigen von Tilia- und Acerarten. Bostrychus tiliae FB. Larve unter der Rinde von Lindenbäumen. Aegosoma scabricorne SCOP. Die Larve dieses selteneren Käfers lebt im Holze der Linde und anderer Laubbäume. Rhynchites betuleti FABR. Larve auf Linde, Birke, Haseln usw. Dorcus parallelepipedus L. Larve in kernfaulen Linden, Buchen, Hainbuchen, Nuß- und Obstbäumen usw. Osmoderma eremita SCOP. Die Larve dieses Käfers lebt meist zu mehreren in kernfaulen Linden, Erlen, Eichen usw. Anobium tessellatum FABR. Larve gesellig in Lindenstöcken usw.
Falter: Vanessa antiopa L., Smerinthus tiliae HB. an Lindenblättern. Zeuzera aesculi L. Im Holze der Äste. Cossus ligniperda O. Im Stammholze und den starken Wurzeln von Tilia, Salix, Populus, Prunus, Quercus usw. usw. Aglia tau. HB., Gastropacha lanestris HB., Notodonta camelina HB., Stauropus fagi HB., Phalera bucephala HB., Orgyia pudibunda HB., Ocneria dispar. L., Liparis monacha HB., Liparis auriflua HB., Laria V. nigrum F., Miselia aprilina L., Acronycta alni HB. und andere Acronycta-Arten. Orthosia und Xanthia-Arten, Amphipyra pyramidea HB., Crocalis elinguaria HB. und viele andere Spanner. Tortrix- und Penthina-Arten usw. usw.
Schnabelkerfe: An den Trieben der Linde und ihren Blättern leben auch eine Anzahl schwer zu bestimmender Aphiden.
Tilia platyphyllos. Epidermis der Ober- (Innen-)Seite des Kelchblattes.
[Tschirch-Oesterle, Atlas.]
Anatomie. Die ziemlich dicken (270–330 mik) Kelchblätter besitzen auf der Oberseite große polyëdrische Epidermiszellen und zahlreiche lange, dünne, einzellige, gerade oder hin- und hergebogene Haare (Fig. 130) und Büschelhaare mit 2–5, bisweilen ungleich langen Strahlen und oft gekrümmter Spitze. Am Blattrande liegen zweistrahlige Büschelhaare mit oft stark verbogenen und durcheinander geschlungenen Strahlen. Besonders die subepidermale Zellreihe führt Calciumoxalatdrusen. Im Mesophyll finden sich zahlreiche, oft zu Gruppen vereinigte Schleimzellen, deren trennende primäre Wand oft auch verschleimt, so daß große Schleimhöhlen entstehen. Die sekundäre Schleimmembran zeigt (besonders beim Präparieren in Alkohol) schöne Schichtung. Die Epidermis der Unterseite ist kleinzelliger und trägt keine oder doch nur wenige Haare. Die viel dünneren (105–140 mik) Korollenblätter sind oft nur 3–5 Zellreihen dick. Die gestreckten, nur wenig wellig verbogenen Epidermiszellen beider Seiten zeigen eine gefaltete Cuticula. Im Mesophyll liegen zahlreiche Schleimzellen und große Schleimhöhlen (s. oben), die am unzerkleinerten Blatte bei durchfallendem Lichte schon mit bloßen Augen sichtbar sind, sowie Zellen mit Oxalatdrusen. Die Lamina ist im allgemeinen haarfrei, doch finden sich an der Blattbasis Köpfchenhaare und am Blattrande (Fig. 131) Büschelhaare mit 2–5, oft gewundenen[S. 371] Strahlen. Auch in den Filamenten, dem Connectiv und der Antherenwand finden sich Schleimzellen. Die Antherenwand ist dreischichtig. Die fibröse Schicht bildet die Mittelschicht. Die Pollenkörner, die man bisweilen im Honig findet (s. d.), sind tetraëdrisch, 27–34 mik groß und besitzen drei Austrittsstellen für den Pollenschlauch. Sie besitzen eine Stäbchenschicht und zeigen daher eine feine Punktierung. Die Fruchtknotenwand ist von vielen 2-vielstrahligen Büschelhaaren mit oft bizarr verkrümmten Strahlen bedeckt, auf die parenchymatische Randschicht folgt eine obliterierte braune Zone, in der die Bündel verlaufen, und dann die Schleimzellenschicht. In der Fruchtknotenwand findet sich in besonderen Zellen ein eisenbläuender, im übrigen Gewebe ein eisengrünender Gerbstoff. Auch die Ovula werden durch Eisenchlorid blau (VOGL). Selbst der Griffel führt Schleimzellen und Oxalatdrusen und in der Mitte das leitende Gewebe. Ebenso finden sich in Mark und Rinde des Infloreszenzstieles Schleimzellen. Der im Querschnitt ovale Holzkörper ist hier umgeben von einem zarten Siebteil, in den hinein von dem breiten Bastzellpanzer aus Sklereïdenzapfen ragen. Das dem Infloreszenzstiel angewachsene, von zahlreichen bastzellreichen Bündeln durchzogene, derbe Flügelblatt (sog. Bractee) führt an den Nerven ebenfalls Schleimzellen. Die Bastbelege sind von Kristallkammerfasern begleitet, die rhomboëdrische Kristalle und Drusen führen (VOGL). Das außerordentlich reich durchlüftete Mesophyll zeigt an der morphologischen Oberseite palissadenartige Streckung. Auf der Unterseite finden sich Spaltöffnungen. Es ähnelt also im Bau einem Laubblatte. Im Glycerinpräparat frischer Brakteen finden sich Sphaerokristalle, die TUNMANN für Hesperidin hält. Die Oxalatdrusen sind bei Tilia von einer Haut umgeben, die nachträglich mit der Membran verwächst, liegen also in sogenannten Taschen (WITTLIN).
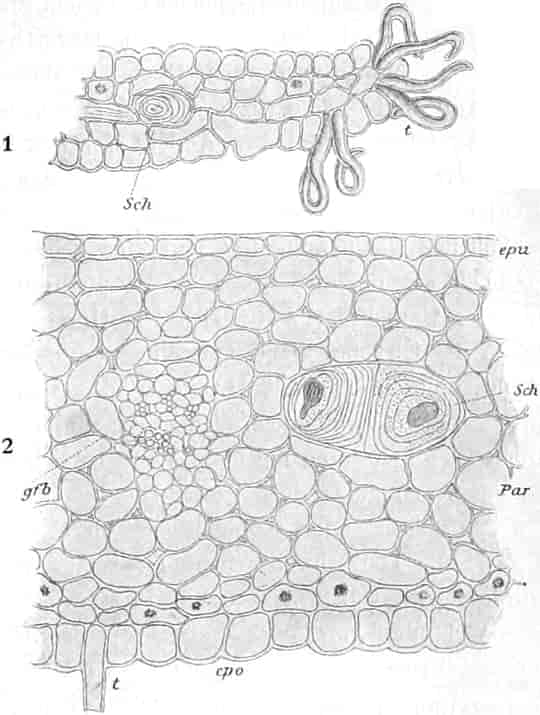
Tilia platyphyllos. 1. Querschnitt durch den Rand des Kronenblattes. 2. Querschnitt durch ein Kelchblatt.
[Tschirch-Oesterle, Atlas.]
Lit. Weitere Details in A. MEYER, Drogenkunde und TSCHIRCH-OESTERLE, Atlas t. 11. — KARSTEN-OLTMANNS, Pharmakogn., Fig. 308–314. — VOGL, Kommentar 1908, S. 149. — TRÉCUL, Mucilages. Adansonia VII (1866). — FRANK, Beitr. z. Pflanzenphys. Leipzig 1868. — DUMONT, Ann. sc. nat. bot. 5 (1887), 135. t. VI. — MATTIROLO, Sviluppo e natura dei tegumenti seminal. nel gen. Tilia Nuov. Giorn. bot. 1885. — HOLFERT, Nährschicht. Flora 1890. — SCHWARZ und WAHSARG, Pringsh. Jahrb. 1884, t. III. — WITTLIN, Kalkoxalattaschen. Bot. Centralbl. 1896. — SOLEREDER, System. Anat. d. Dikotylen. S. 176 (dort weit. Lit.). — Über Lindenbast und Lindenholz vgl. WIESNER, Rohstoffe 2. Aufl.
Chemie. Die Blüten der Linde enthalten viel Schleim, dann Zucker — die mit Wasser gegorenen Blüten geben Weingeist (Marggraf) —, Wachs, etwas eisengrünenden[S. 372] Gerbstoff und ätherisches Öl. Der Schleim bläut sich nicht mit Chlorzinkjod, wohl aber mit Kupfersulfat und Kalilauge (A. MEYER). Sie enthalten auch eine Oxydase (CARLES, die Brakteen nur wenig davon) und in der Asche Spuren Mangan. Der Brei frischer Blüten bläut Guajaktinktur. ROUX fand einen gelben und einen roten Farbstoff, HERBERGER Malate, Tartrate, einen Bitterstoff, SILLER «ein Balsamharz von gewürzhaftem Geschmack». In den Brakteen ist mehr Gerbstoff und — wie es scheint — kein Riechstoff vorhanden. Das ätherische Öl ist in den Lindenblüten nur in geringer Menge vorhanden. Doch gibt WINCKLER (1837) an, daß er aus 25 Pfund frischen Blüten 80 g (d. h. 0,64 %) farbloses, dünnflüssiges, in Wasser relativ leicht lösliches Öl erhalten habe. Andere sprechen von 0,1, 0,05, 0,042, 0,038 % (MARGGRAF erhielt gar nichts). HAENSEL hat das Öl neuerdings fabrikmäßig dargestellt. Es ist — offenbar durch ausgeschiedene, mit übergehende Fettsäuren — bei gewöhnlicher Temperatur fest und eine sehr teure Substanz. Sein Wert ist zehnmal so hoch wie der des Rosenöls. Er übertrifft alle übrigen ätherischen Öle an Feinheit des Geruches (LANDERER). Der Unterschied in den Eigenschaften und der Ausbeute des Öles bei WINCKLER einerseits und bei HAENSEL andererseits dürfte darauf zurückzuführen sein, daß HAENSEL mit gespanntem Dampf arbeitete, WINCKLER, der frische Blüten verarbeitete, nicht. Gespannter Dampf scheint das Öl zu verändern und treibt feste Fettsäuren mit über. Es findet sich im Handel (HAENSEL 1902). Nur frische Blüten geben gutes Aqua tiliae. Die Blüten enthalten auch einen in farblosen Blättchen kristallisierenden Kohlenwasserstoff C28H58; F. 54–56° (KLOPP, GARNIER und EHRWEIN). Die schweißtreibende Substanz ist unbekannt. Das fette Öl der Samen wurde zuerst von MASSI durch Pressen gewonnen, dann von MARGGRAF (1772) untersucht und von GEIGER als Ersatz des Mandelöls warm empfohlen. Es ist in den lufttrockenen Samen zu 59 % enthalten (C. MÜLLER) und gehört zu den nichttrocknenden, schwer ranzig werdenden Ölen. Die Asche der Blüten beträgt 5,5–7% (HAUKE, VOGL gibt 8% als Grenzzahl an). Sie ist meist etwas grünlich.
Die Blätter enthalten das Glykosid Tiliacin, das in Glukose und Tiliaretin zerfällt. Letzteres liefert Anissäure (LATSCHINOW). Die Blätter der Tilia parvifolia enthalten auch Inosit (FICK). In der Rinde der Linde fand BRÄUTIGAM (1898) einen phytosterinartigen Körper (Tiliadin, C21H32O2), der aber kein echtes Phytosterin ist, sowie Vanillin. Beim Anbohren des Stammes im Frühling erhält man einen süßen Saft, der dem Ahornsafte ähnlich ist (GEIGER). Das bisweilen auf den Laubblättern auftretende (LANGLOIS) Manna enthält (nach BOUSSINGAULT) 20 bis 30% Dextrin (?), 25–29% Invertzucker, 49–55% Rohrzucker, sowie freie Säuren (Apfelsäure?), ähnelt also dem Tamarix-Manna (S. 135). Der Algenbelag der Rinde (Pleurococcus vulg.) enthält nadelförmige Kristalle (BRÄUTIGAM).
Lit. Ältere Literatur in SCHWARTZES Tabellen (1819) I, 198, und JOHNS Chem. Tab. d. Pfl. S. 15. — Erste Analyse von MARGGRAF, Mém. de l’ac. sc. Berlin 1772, 3 (auch in PFAFF, Mat. med.). — GEIGER, Handb. d. Pharm. 1830, 1017. — HERBERGER und SILLER in DIERBACH, Mat. med. 1841. — FICK, Jahresb. d. Pharm. 1887, 11.— C. MÜLLER, Über Lindenöl. Ber. d. pharm. Ges. I, 60. — CARLES, Rep. de pharm. 1904, 1. — TUNMANN, Schweiz. Wochenschr. 1909. — BRÄUTIGAM, Arch. Pharm. 1900, 555 u. Pharm. Zeit. 1898 Nr. 105. — LATSCHINOW, Chem. Zeit. 1890, 14, 126. — Äth. Öl: Ältere Arbeiten (BROSSAT, LANDERER, BUCHNER, HERBERGER) in GMELINS Handb. d. Org. Chem. IV (1862) 343. — WINCKLER, D. äth. Öl d. Lindenblüte. Pharm. Centralbl. 1837, 781. — HAENSEL, Berichte 1902. — KLOPP, GARNIER und EHRWEIN, Bull. soc. chim. (4) 7, 940. — ZELLER, Ausbeute u. Darst. äther. Öle aus offizin. Pfl. N. Jahrb. d. Pharm. I-III und separat Stuttg. 1855. — Lindenmanna:[S. 373] LANGLOIS Journ. pr. Chem. 29, 444 (Arch. Pharm, 89 [1844], 320). — BOUSSINGAULT, Journ. pharm. 15 (1872), 214.
Verfälschungen. Beobachtet sind (PERROT) die Infloreszenzen von Tilia argentea DESF. (T. alba W. et K., T. tomentosa MÖNCH), einem aus Ungarn, Kleinasien und Südsibirien stammenden, vielfach in Anlagen angepflanzten Zierbaum, der wenigblütige Blütenstände hat und dessen Staubfäden halb so lang als die Blumenblätter und wenig länger als der Fruchtknoten sind. T. argentea gehört zu der Abteilung der Dekapetalae, d. h. bei ihr sind 5 der innersten Glieder des Staubfadenkreises zu petaloiden, noch mit Antherenspur versehenen Staminodien umgebildet. Zu dieser Gruppe gehört auch die nordamerikanische T. americana. 1896/98 waren, von Italien importiert, Lindenblüten von Tilia americana L. (T. canadensis MICHX., T. glabra VENT., T. nigra BROCKH., Schwarzlinde) im Handel. Sowohl das Dekokt wie das destillierte Aqua tiliae weichen von dem aus T. europ. bereiteten stark ab (CAESAR & LORETZ). Die Verwendung von Lindenblüten aus der Reihe der Decapetalae, die ganz anders riechen als unsere Lindenblüten, ist unzulässig, dagegen dürfen die Blüten der Hybriden und Formen der beiden deutschen Linden gesammelt werden.
Lit. PERROT, Bull. sc. pharm. 1907, 346.
Anwendung. Lindenblüten sind ein viel verwendetes Diaphoreticum, das meistangewendete Schweißtreibemittel des Volkes. Sie wurden schon von MURRAY (wie noch jetzt von KNEIPP) auch als schmerzstillendes und krampflinderndes Mittel empfohlen. Flos tiliae ist Bestandteil der Spec. laxant. St. Germain. Daneben bedient man sich (wie im Altertum) auch der schleimreichen Rinde, besonders äußerlich, z. B. bei Brandschäden, Schußwunden, Augenentzündungen u. dgl., was noch heute in Rußland beim Volke üblich ist (HENRICI). Das Lindenblütenwasser wird vom Volke gegen Sommersprossen und als Haarwuchsmittel benutzt. Die eigenartig aromatischen Blüten der T. argentea liefern ein Champagnerarom (LANDERER). MÉRAT und LENS sagen im Dictionnaire (I, S. 217) von der Lindenblüte: «C’est l’antispasmodique le plus universellement mis en usage par toutes les classes des malades.» Das übrigens ziemlich weiche Holz dient zur Herstellung der Carbo Tiliae. Die Bastfasern der Rinde dienten schon im Altertum als Fasermaterial zu Stricken, Sattelzeug usw. Die bekannten Bastschuhe (lapti) der Russen und Polen werden noch heute aus Lindenbast (liko) gemacht, ebenso Decken und Flechtwerk. Auch der nahe verwandte Corchorus (Jute, vgl. S. 255) ist eine Tiliacee. Lindenbaststreifen dienten in Rom als Papier (S. 256).
Lit. Ältere Lit. in MURRAY, App. medic. — HENRICI, Volksheilm. Rußlands in KOBERTS Studien IV. — LANDERER, Amer. journ. pharm. 1883.
Geschichte. Den alten Deutschen war die Linde ein heiliger Baum. Sie war der FRIGGA, der nordischen VENUS geweiht und fehlte in keinem heiligen Haine, keinem Dorf- und Marktplatze, keinem Friedhofe. (Sie ist auch der russischen Liebesgöttin KRASOGANI und der slavischen OSTARA heilig.) Sie schützte gegen Blitzgefahr und ihre Teile wurden gegen zahlreiche Leiden angewendet. Sie war der Frühlings-, Freuden- und Liebesbaum, aber auch der alte Rechts- und Dingbaum, unter dem sich die Gemeinde versammelte und Recht gesprochen wurde. Sie ist der deutsche Baum par excellence und noch heute der Lieblingsbaum des deutschen Volkes, den zahllose Dichter besangen, von WALTHER VON DER VOGELWEIDE bis auf HEINRICH HEINE, und der auch in den Volkssitten eine große Rolle spielte. Lindenblüten und Lindenblütenwasser gelten noch heute als Schönheitsmittel. In den Schweizer Pfahlbauten fanden sich Reste beider Linden. Des THEOPHRAST (hist. pl. III, 10; V, 4) φίλυρα ist wohl eine Tilia (SPRENGEL), denn die Linde heißt auch heute noch in Griechenland so (s. oben S. 366). Vielleicht[S. 374] war es T. ulmifolia, vielleicht auch (FRAAS) T. argentea. Des THEOPHRAST κλέθρη ist aber wohl eine Alnus- oder Acerart (DRAGENDORFF). PLINIUS, dessen Tilia wohl T. argentea DESF. ist (er unterscheidet merkwürdigerweise eine männliche und eine weibliche) erwähnt nur die Verwendung der Blätter und des Bastes. Auch VIRGIL gedenkt einer Tilia. Die Blüten scheinen aber erst seit dem Mittelalter in Gebrauch zu sein. Tilia steht bei der HILDEGARD (I, S. 671) und ALBERTUS MAGNUS (I, S. 675), die Lind bei MEGENBERG (I, S. 693), CORDUS (I, S. 803) verwendete Flos tiliae. Aqua Tiliae findet sich bei BRUNSCHWYG (1500) und FUCHS rühmte seine antiepileptische Wirkung. Flor. tiliae finden sich in der Taxe von Eßlingen 1571 (I, S. 816). In MURRAYS Apparatus medicaminum (I, S. 218) stehen außer den Flores noch Semen, Cortex und Folia. Die Angabe des französischen Arztes MASSI, daß man aus Blüten und Samen der Linde ein Getränk bereiten könne, «das der besten Schokolade nichts nachgebe» (!), veranlaßte FRIEDRICH DEN GROSSEN, der alle Surrogate der Purindrogen begünstigte, MARGGRAF aufzufordern, die Bedingungen für die Herstellung eines solchen Surrogates zu studieren, dieser Aufforderung resp. diesem Befehl verdankt die Untersuchung MARGGRAFS (s. oben) ihre Entstehung.
Lit. RELING und BOHNHORST, Unsere Pflanzen. 4. Aufl. — PERGER, Deutsche Pflanzensagen 1864.
c) Schleimzellen in Knollen.
Während bei den Dikotylen die typische Ausbildung der Schleimmembranen die Regel ist, zeigen die Monocotylen ein abweichendes Verhalten und es kommt hier in der Regel nicht zur Bildung einer deutlich geschichteten Schleimmembran. Der Grund, weshalb ich auch die monocotylischen Schleimdrogen, speziell Orchis, bei den Membraninen abhandle, ist der, daß nach meiner Auffassung hier ein Übergangsgebilde vorliegt, welches sich chemisch an die typischen Membranine anschließt, morphologisch allerdings noch nicht jene normale Ausbildung erlangt hat, die wir z. B. bei der Gruppe der Malvales (Tiliaceen, Malvaceen, Sterculiaceen) antreffen. Nur selten findet sich bei Orchis ein deutliches zentrales Lumen, das ringsum von Schleim umgeben ist (Fig. 133). Dagegen treffen wir bei der benachbarten Herminium monorchis (L.) R. BR. eine typische Schleimmembran (BIRGER). Es macht bisweilen den Eindruck, daß eine peripherische, parietal gelagerte Plasmaschicht die normale Auflagerung des Schleims in Form von normalen Schleimmembranschichten hindert.
Tuber Salep.
Syn. Rad. Salep, Salepknollen — Knabenkraut (weitere deutsche Namen unter Synom. und bei PRITZEL-JESSEN) — saleb (holl.) — saleprot (schwed.) — Salep (franz. und engl.) — saalāb, salap (arab. pers.). — Orchis militaris heißt auch in den Volkssprachen: Soldaten-O., O. guerrrier ou militaire, military-O., Soldaat-O. — wegen der helmförmigen Blüte; wie Orchis Morio (von μωρός = Narr): O. bouffon, harlekijns — wegen der bunten Blume. — Der handförmige: Rad. palmae Christi, Rad. palmata.
Bei THEOPHRAST ὄρχις und bei DIOSKURIDES ὄρχις und σατύριον, so auch bei PLINIUS (s. Geschichte). BONNET deutet des DIOSKURIDES ὄρχις als O. papilionacea und mascula, das σατύριον als Ophrys anthropophora (s. hinten). Bei ALHERVI (pers.): bûzeidan, bei IBN BAITHAR (arab.): būzīdān. — Satyrion bei CONSTANTINUS AFRICANUS (XI. Jahrh.) und in Circa instans (XII. Jahrh. I, S. 637). — In der Alphita oxoniens. steht: saturion (iarus, priapiscus, leporina — Kukkowspitte), Satirion (stondengousse); und in den Sinonoma Bartholomei: satyrion = herba leporina und ISIDOR bemerkt in seinem Etymologicon: Satyrion vulgus vocant stingum. Item et Orchis item et Leporina. — Bei ALBERTUS MAGNUS: satiria (Orch. mil.) testiculus vulpis, t. canis (O. mascula), so auch (— neben Rad. satyrionis —) bei CRESCENZI (I, S. 677), SERAPION (I, S. 605). — Im Liber Dynamidorum sind als Synonyma von Satyrion angegeben: priapiscum, tentaticon, mazinium, extingum, gartcolon. — Bei CORDUS (I, S. 802) steht: Satyrion (Rad. orchios, testiculi vulpis). Es waren dies vielleicht die Knollen von Platanthera[S. 375] bifolia. Doch bezogen sich wohl, darin stimme ich DRAGENDORFF bei, die arabischen und anderen allen und mittelalterlichen Namen nicht auf spezielle Arten (Orchis Morio und undulatifolia [LECLERC], O. anthropophora [FRAAS], O. papilionacea [SIBTHORP, SONTHEIMER]), sondern bezeichneten alle Arten der Gattung Orchis und verwandter Gattungen, deren Systematik ja noch heute eine sehr künstliche ist (ASCHERSON).
Etym. GRIMM (Deutsch. Wörterb. V [1873] 1465) sagt: Knolle (masc.) ungenau: Knollen. KLUGE (Etymolog. Wörterb.): Knollen (m) aus mhd., Knolle (m). Ich schließe mich der Schreibweise «der Knollen» an (FLÜCKIGER schreibt: der Knolle; die meisten Autoren: die Knolle).
An die Hoden erinnern die Ausdrücke: Bocks- oder Fuchshödlein, Hasen-, Narren-, Pfaffenhoden, Bällchenwurz (angels.), sowie ὄρχις (= Hoden, bei THEOPHRAST — ὀ. κυνός, bei DIOSKURIDES — von ὀρέχειν begehren), testiculus vulpis, leporis, canis, sacerdotis etc., — dog-, fox-, hare-, goat-stones. An die Verwendung als Aphrodisiacum erinnert: Bocksgeil, Erdgeile und Geilwurz (so z. B. bei CORDUS), Heiratsblume oder -wurzel, Kinder- oder Knabenkraut (so im Ort. sanit.), Raynwurz, Stendelwurz, Höswurz, Venusblume; Kuckucksblume (der Kuckuck ist der Vogel der Liebe), sowie die alten Bezeichnungen: priapismus (priaspiscus), satyrion. (Weitere erotische Beziehungen bei AIGREMONT, Volkserotik). An die handförmige Teilung der Knollen einiger Arten (s. weiter hinten) erinnern Ausdrücke wie Palmachristi, Pentadactilus, Marien-, Christi- oder Gotteshand (im Gothaer Arzneibuch [I, S. 680]: godeshant), Glücks- oder Teufelshand, Händechen. Im Arabischen heißt testiculi canis: ḫuṣa ʾl-kalb (das ḫ ist ein hartes ch) und testiculi vulpis: ḫuṣa ʾṯ-ṯaʿlab (das t in ta wie das englische th zu sprechen), der Singular testiculus vulpis lautet: ḫuṣjat at-ṯaʿlab (MARTI). Aus diesem ṯaʿlab wurde das noch jetzt im Osten gebräuchliche salap und unser salep. — Die Bezeichnung für Salep kâtil ahîhi bedeutet «Mörder seines Bruders» und bezieht sich wohl darauf, daß der alte Knollen zu Grunde geht, während der neue «Bruder»-Knollen heranwächst. Die Ausdrücke busidân, bûzeidan, būzīdan stammen aus dem Indischen.
Stammpflanzen. Salep wird vorwiegend von Orchidaceen der Ophrydeenabteilung, besonders von Orchisarten gesammelt. In Mitteleuropa kommen vor und liefern Salep:
Orchis militaris (L. ex parte) HUDS. (O. militaris JACQ., O. galeata POIR., O. Rivini GOUAN.), O. purpurea HUDS. (O. fusca JACQ.), O. ustulata L., O. Morio L., O. mascula L., O. latifolia L., O. incarnata L. (O. angustifolia WIMM. et GRAB.), O. maculata L., Anacamptis pyramidalis RICH. [Aceras pyramidalis (L.) RCHB. fil.], Gymnadenia conopéa [die Form conopsea ist grammatisch nicht zu erklären, ASCHERSON] (L.) R. BR. Auch Aceras anthropophora und Ophrys arachnites werden genannt.
In Thessalien, Macedonien und Epirus liefern (außer O. Morio und mascula) Orchis saccifera BRONGNIART, O. coriophora L. und O. longicruris LINK Salep. In Griechenland werden besonders die Knollen von O. Morio und O. papilionacea, dann auch O. undulatifolia, mascula, palustris gesammelt (LANDERER).
In Kleinasien ist die Gattung Orchis durch c. 30 Arten vertreten. Es ist nicht bekannt, welche speziell zur Salepgewinnung herangezogen werden.
Von den 32 Arten, die in BOISSIERS Flora orientalis aufgeführt sind (TCHIHATCHEFF nennt 36 kleinasiatische), sind für Gebiete des westlichen Kleinasiens angegeben: Orchis Morio β picta (Anatolien, Cilicien), O. comperiana (Lydien), O. coriophora β fragrans (Anatolien), O. sancta (Pamphylien, Smyrna), O. tridentata (Anatolien), O. palustris (ebenda.), O. pseudosambucina (ebenda), O. papilionacea (Pamphylien), O. provincialis β pauciflor. (Smyrna), O. anatolica (Carien, Lycien), O. Simia (Pamphylien) und weiter im Norden O. maculata und fusca (in Cappadocien).
In Algerien werden die sehr großen Knollen von Orchis Munbyana und O. Robertiana benutzt (LANDERER, Pharm. Jahresb. 1878, SIMMONDS, Am. journ. pharm. 1891).
In Nordpersien werden die Knollen besonders von Orchis latifolia L., dann auch von O. laxiflora LAMCK. gesammelt und unter dem Namen Salapmisri nach Indien gebracht (AITCHISON, STOLZE und ANDREAS).
[S. 376]
Orchis und Anacamptis, sowie Ophris und Aceras gehören zu der Abteilung Monandrae — Ophrydinae — Serapiadaceae; Gymnadenia zur Abteilung Monandrae — Ophrydinae — Gymnadenieae.
In Nordindien sind die großen Knollen (man-kand, amber-kand) von Eulophia campestris LINDL., Eul. herbacea LINDL., in Südindien die kleinen von Habenaria pectinata DON und etwa fünf anderen Arten Salep liefernd (WATT, Dict. of econ. prod. LINDLEY, ROYLE). Pharmac. ind. nennt auch Eulophia virens BR., Eu. campestris WALL., Eu. nuda LINDL.
Eulophia gehört zur Abteilung Monandrae — Cyrtopodiinae, Habenaria zur Abteilung Monandrae — Ophrydinae — Habenarieae.
Die Gattung Orchis mit ihren 70 vorwiegend in der alten Welt vorkommenden Arten wird jetzt eingeteilt in:
Sect. I. Herorchis LINDL.
a) Papilionaceae: O. papilionacea. b) Moriones: O. Morio. c) Militares: O. militaris, purpurea, tridentata (variegata), ustulata. d) Ibericae: O. iberica.
Sect. II. Anderorchis LINDL.
a) Globosae: O. globosa. b) Saccatae: O. saccata. c) Masculae: O. mascula, palustris, pallens. d) (Latifoliae): O. latifolia, incarnata, maculata.
Ausführlichere Angaben in LUERSSEN, Mediz. pharm. Botan.
Die LINNÉsche O. militaris umfaßt: O. purpurea, tridentata, Simia und Rivini.
O. militaris ist von England, Nord- und Mittelspanien, sowie Italien über Deutschland bis Mittelrußland und Sibirien, sowie Ost-Dahurien, O. Morio durch Europa und auch im westlichen Asien, O. maculata durch ganz Europa und Sibirien, O. mascula in Europa bis zum Ural, O. latifolia von Europa bis Kamtschatka heimisch. Diese sind bei uns die häufigsten, O. papilionacea und saccata sind im Mittelmeergebiet, O. purpurea in Mittel- und Südeuropa, O. ustulata in Europa bis zum Ural, O. iberica im Gebiet des Kaukasus, O. incarnata von Europa bis Kamtschatka heimisch.
Die Orchisarten sind Wiesenpflanzen und sog. «Magerkeitszeiger», die gedüngte Stellen fliehen und vom Weidevieh gemieden werden.
Folgende Standorte werden in GARCKES Flora von Deutschland angegeben: O. purpurea HUDS. schattige Gebirgswälder, gern auf Kalk, am häufigsten in Mittel- und Südwestdeutschland, namentlich in Thüringen, bei Hannover, auf Rügen. O. militaris (L.) HUDS., Wald- und Moorwiesen, sonnige Kalkberge, in Nordwestdeutschland fehlend. O. ustulala L., Bergabhänge, Wiesen niedriger und gebirgiger Gegenden, in den Alpen verbreitet. O. Morio L. (die kleinste unserer Arten), Wiesen, trockene Abhänge, häufig. O. mascula L., Wiesen, Wälder, häufig in Süd- und Mittel-, selten in Norddeutschland. O. maculata L., sumpfige Wiesen, Wälder häufig. O. latifolia L., feuchte Wiesen, häufig. O. incarnata, torfige, sumpfige Wiesen, zerstreut. Diese Standorte wären bei der Anlage einer Kultur zu beachten. Man hört oft aus den Handelsberichten, daß Trockenheit die Ernte beeinträchtigt.
Beschreibung der Stammpflanze. Die Orchisarten sind sämtlich ausdauernde Kräuter, die ihre unterirdischen Organe ziemlich tief im Boden bilden. Aus dem Samen bildet sich im ersten Jahre ein Knöllchen, das der Wurzel entspricht, an ihm sitzt ein aus Niederblättern und der Laubblattanlage gebildetes Knöspchen (Fig. 132, AB). Im nächsten Jahr entwickeln sich 2–3 Laubblätter und in der Achsel einer der Niederblätter ein Knöspchen, das eine Adventivwurzel bildet (Fig. 132, CD). «Diese verdickt sich knollenförmig und wird durch die vergrößerte röhrenförmige Scheide seines untersten Blattes wie durch ein Rohr tiefer in den Boden gesenkt» (Fig. 132, FG). Dieser kleine Knollen bildet den Grundstock für eine neue Pflanze, die sich dann im nächsten Jahre entwickelt (Entwicklung des Knollens ausführlich bei IRMISCH und ARTHUR MEYER).
[S. 377]
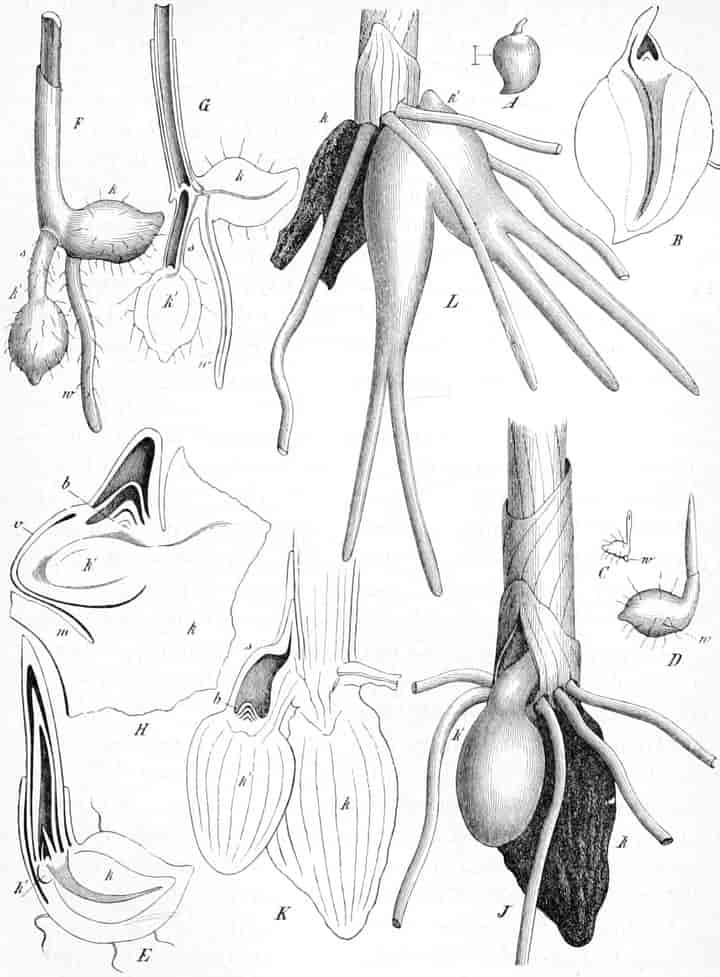
A-K Orchis militaris. a junge Keimpflanze nach der Blüte, B stärker vergrößerter Längsschnitt durch A, CD ältere Keimpflanze mit hervortretender Wurzel. E Längsschnitt durch eine solche Keimpflanze. FG Keimpflanze im nächsten Frühjahr, die Wurzel hat einen Knollen gebildet. H Anlage des aus einem Seitensproß und einer Adventivwurzel kombinierten Knollen an der erwachsenen Pflanze. Die Wurzel steckt noch in der Scheide (v). J Basis einer erwachsenen Pflanze im Sommer. K dasselbe im Längsschnitt. L Orchis latifolia. Basis einer erwachsenen Pflanze. (A–H nach Irmisch, J–L nach Luerssen.)
Die blühende Pflanze besitzt zwei Knollen (Fig. 132, JKL). Der ältere Knollen hat seine Reservestoffe an die oberirdische Pflanze abgegeben und erscheint daher mehr oder weniger geschrumpft und außen bräunlich, das Gewebe ist entleert. Der helle junge Knollen dagegen, der ähnlich wie der Knollen an der Keimpflanze aus der Adventivwurzel einer Knospe des vierten oder fünften Niederblattes entstanden ist, ist mit Reservestoffen prall gefüllt. Er ist ziemlich frühzeitig innerhalb der Achse entstanden, deren Gewebe ihn noch eine Zeitlang wie ein Sack umgibt (Fig. 132, H), sitzt, wenn ganz entwickelt, was schon im Juni erfolgt ist, einem kurzen Aste an[S. 378] und trägt oben ein Knöspchen (Fig. 132, K). Aus ihm entwickelt sich die neue Pflanze im nächsten Jahr. Der Knollen trägt ganz den Charakter einer Speicherwurzel. Daneben finden sich noch am Grunde der Achse Ernährungswurzeln. Orchis purpurea und militaris (Fig. 132, JK), sowie Platanthera bifolia haben ovale oder eiförmige, O. ustulata, Morio, mascula und coriophora und die Ophrys-Arten rundliche, O. tridentata, laxiflora und globosa längliche, O. sambucina zylindrische oder spindelförmige, Orchis maculata, latifolia (Fig. 132, L), incarnata und saccifera, sowie Gymnadenia conopea handförmig geteilte Knollen.
Der krautige Stengel ist einfach. Er wird bei den einzelnen Arten verschieden hoch. Die Niederblätter sind scheidenartig, und soweit sie im Boden stecken weiß. Die Blätter tragen bei O. militaris auf einer Scheide eine oblong-lanzettliche, stumpfliche, etwas fleischige, 4–5 cm breite, 8–16 cm lange Spreite, die getrocknet nach Vanillin riecht. Der Blütenstand ist eine Ähre, die bei O. militaris 7–10 cm lang wird. Die Deckblätter sind breit eiförmig, rot. Der sitzende einfächerige, unterständige Fruchtknoten ist gedreht und dadurch die zygomorphe Blüte resupiniert, d. h. die oberen Teile der Blüte nach unten gekehrt. Die drei äußeren Perigonblätter sind ziemlich gleich, eilanzettlich, bei O. militaris außen rötlich weiß, an den Nerven rot, zwei Perigonblätter des inneren Kreises etwas kleiner, schmaler, dunkler, alle fünf nach oben gerichtet, einen Helm bildend, das dritte (ursprünglich das hintere obere) Blatt des inneren Kreises aber als Labellum entwickelt und nun nach unten gerichtet, aus der Blüte heraushängend. Er trägt einen hohlen Sporn, der als Nektarium wirkt, obwohl er keine eigentlichen Nektarien bildet (der süße Saft muß «erbohrt» werden) und bildet eine breite, tief dreispaltige, als Anlockungsmittel für Insekten dienende Lippe, die länger ist als die übrigen Perigonblätter und deren Mittellappen wieder zweigespalten erscheint mit einem kleinen Zwischenläppchen (bei O. Morio ist die Lippe dreilappig, der Mittellappen abgestutzt-ausgerandet, bei O. papilionacea ganzrandig, bei O. mascula tief dreilappig mit breiten gezähnten Lappen, bei O. latifolia breit-keilförmig, dreilappig). Die Farbe der Lippe ist bei O. militaris weiß mit purpurnen Haarpinseln (bei O. ustulata weiß, rot punktiert, bei O. coriophora purpurn geadert, am Grunde weiß, purpurn punktiert, bei O. Morio purpurn mit grünen Adern). An die eigenartige Insektenform und den Geruch gewisser Orchisblüten erinnern die Bezeichnungen: conopea (von κώνωψ = Mücke), muscifera (= Fliegenträger), coriophora (von κόρις = Wanze) und Fliegenblumen. Das Androeceum ist mit dem Griffel verwachsen und bildet das Gynostemium, das aus der Columella, dem Clinandrium und dem Rostellum besteht. Die Griffelsäule ist sitzend, vorn flach, hinten gewölbt; die Narbe am Grunde der Säule quer gestellt, umgekehrt herzförmig. Über ihr liegt die kleine Bursecula und in dieser die beiden Klebscheiben (retinacula) der zwei gestielten, keulenförmigen Pollinien, die aus der verklebten Pollenmasse bestehen. Die Anthere ist also dithecisch. Senkt nun ein Insekt seinen Rüssel in die Blüte, so schiebt es, wie CHARLES DARWIN zuerst beobachtete, die Bursecula beiseite, der Rüssel kommt mit den Klebscheiben in Berührung, diese kleben sich am Rüssel fest und wenn nun der letztere aus der Blüte herausgezogen wird, so werden die Pollinien aus ihrem Behälter herausgerissen (vgl. auch I, S. 389). Sie stehen zunächst senkrecht auf dem Rüssel, senken sich aber dann herab und wenn nun das Insekt eine zweite Blüte besucht, so treffen die Pollinien direkt auf die Narbe: das klassische Beispiel einer an Insektenbefruchtung angepaßten zoidiophilen Blüte. Die Frucht ist eine sechskantige Kapsel, die mit drei Klappen aufspringt. Der Fruchtknoten stellt sich später wieder[S. 379] richtig, die Resupination der Blüte wird aufgehoben. Die sehr kleinen Samen haben einen ungegliederten Keimling. Sie werden zur Reifezeit durch den Wind verstreut.
Die Orchisarten blühen bei uns meist im Mai bis Juni. Die Knollen werden vor der oder zur Blütezeit der Pflanze gesammelt.
Lit. Abbild.: H. G. REICHENBACH, Orchideae in Flora germanica recensitae etc. 170 col. Taf. 1851 (B. 13 u. 14 der Icones flor. germ.). — Abbild. von O. militaris in BERG-SCHMIDT, Atlas taf. 134 (dort die system. Lit.), PABST-KÖHLER, Medizinalpfl. t. 61, LUERSSEN, Med. pharm. bot. (dort die systemat. Lit. der Familie). HAYNE, Arzneigew. t. 17. GIESENHAGEN, Botanik 1910, Fig. 367. — Von O. ustulata in HAYNE, Arzneigew. t. 16. — Von O. Morio in HAYNE, Arzneigew. t. 24 und NEES VON ESENBECK, Plant. med. t. 72. — Von O. mascula in NEES VON ESENBECK, Plant. med. t. 71. und GIESENHAGEN, Botanik 1910. Von O. latifolia im Bonner Lehrb. d. Bot. u. in GARCKES Flor. v. Deutschl. — PFITZER, Entwurf eines natürlich. Syst. d. Orchid. und Orchidaceae in ENGLER-PRANTL, Pflanzenfam. II, 6, S. 52 (dort die Literatur d. Familie). — IRMISCH, Morph. d. monokotyl. Knollen usw. Berlin 1850, Beitr. z. Biolog. u. Morph. d. Orchid. 1853 u. ein. Beobacht. an einheim. Orchid. Flora 1854. — A. MEYER, Knollen der einheim. Orchideen. Arch. Pharm. 1886 (m. zahlr. Abbild. u. Literaturnachweisen) und Wissensch. Drogenkunde.
Pathologie. Über die tierischen Schädlinge berichtet ISRAEL: Die Orchideen scheinen unter den Insekten sehr wenige Feinde zu haben, doch trifft man gelegentlich polyphage Eulenraupen auch an Orchideen, ohne daß sie jedoch Feinde derselben genannt werden könnten. Bei Jena fand ich eine Dipterenmade (vermutlich eine Cortdyluraspecies) auf Orchis mascula, die Blätter minierend.
Einsammlung und Handel. Im Handel dominiert der kleinasiatisch-türkische (anatolische) Salep. Der türkische, auch der aus Macedonien, wird meist Levantiner Salep genannt. In Kleinasien wird Salep im Süden bei Mersina (Rhodus gegenüber), Milas (Melassa) und Mugla (südöstlich von Smyrna) gewonnen (SCHERZER 1874), im Norden bei Kastamuni und Angora (Ber. über die Wiener Weltausstellung 1873), neuerdings (1895) werden auch Castambol, Tokat und Egin genannt. Der südliche geht nach Smyrna, der nördliche nach Konstantinopel. Dorthin, zum Teil über Saloniki, wird auch der in Macedonien und Thessalien gesammelte Salep gebracht. Seit den achtziger Jahren des XIX. Jahrh. ist Konstantinopel Hauptausfuhrort für Salep. 1892 betrug die Ausfuhr von dort 19000 kg, die Vorräte 10000 kg. Die Ausfuhr von Smyrna wurde 1879 auf 5000 Oka (zu 1283 g) geschätzt. Die Levantiner Ernte betrug 1893: 200–250 Sack à 80–90 kg. Smyrna exportierte 1905: 4690, 1906: 2926, 1907: 1806 und 1908: 1162 kg. Die Türkei braucht selbst viel Salep, nur ⅕ der Ernte gelangt zur Ausfuhr (GEHE). Die Zufuhren von der Levante treffen im Oktober bis November ein. In Deutschland wurde Salep früher namentlich in Bayern, Nassau (Taunus und Westerwald), Fulda (Rhön und Vogelsberg), sowie im Odenwald gesammelt (WIGGERS 1863), jetzt scheint nur noch bei Kaltennordheim in der Rhön, bei Meiningen und etwas auch im Taunus und Odenwald gesammelt zu werden (FLÜCKIGER 1891). Für den Großhandel kommt deutscher Salep nicht in Betracht. In den Preislisten finde ich S. german. höher im Preise notiert als S. levantin. Die deutschen Knollen pflegen kleiner zu sein. Auch in Frankreich scheint etwas Salep gesammelt zu werden. Der beste persische Salep wird auf dem Idjerûdplateau westlich von Zāndjân gesammelt. Nach der Blütezeit im Juli schicken die Teheraner Apotheker (attâr) Leute dorthin, um die Knollen zu graben und die Bewohner von Idjerûd verpachten den Salepsuchern ihre Wiesen (SCHINDLER). In Nordpersien wird sálāb bei Mesched (Meschhed) gegraben. Der bessere persische Salep heißt Panjeh-i-sálāb (= Handsalep), der schlechtere Abushaheri oder Lasaniya (Pharmakogr.). Der persische Salep geht über Buschir besonders nach Indien, kommt[S. 380] aber auch bisweilen nach Europa. Die großen indischen Salepknollen stammen aus Bengalen, den Nilagiris und Ceylon, sowie aus Afghanistan, Belutschistan, Kabul, Bokhara und dem Pandschab (Pharmakographia).
Die gegrabenen prallen Tochterknollen werden vom Stengel, dem Mutterknollen und den Wurzeln befreit, gewaschen, mit Tüchern abgerieben, dann — oft auf Fäden gereiht — in siedendes Wasser getaucht, um sie abzutöten und bei gewöhnlicher Temperatur oder bei künstlicher Wärme getrocknet. Bisweilen findet sich auch die Handelsware noch auf Fäden gereiht. Nur an der Luft getrocknete Knollen treiben, da der Schleim reichlich Wasser zurückhält, leicht an feuchter Luft aus. In Kultur werden die Knollen besonders in gutem Boden viel größer und schöner (VALTA, BEISSENHIRZ) und es sollte daher der Anbau (Anzucht aus Samen) versucht werden. Es dürfte sich lohnen, da die Handelsberichte fortgesetzt über schlechte Ernten und geringe Zufuhren aus der Levante berichten, auch fehlt es dort oft an Transportmitteln zu den Hafenplätzen. Die Bedingungen der Kultur müßten aber erst studiert werden. Immerhin bildet die Pflanze aus dem Samen erst im dritten Jahre brauchbare Knollen. Die Orchisarten lieben kalkhaltigen Boden. Eine spontane Aussaat ist bei wildwachsenden oft beobachtet worden, da sehr zahlreiche kleine, leicht verbreitbare Samen gebildet werden (s. oben).
Lit. HELDREICH, Nutzpflanz. Griechenlands. Athen 1862. — TCHIHATCHEFF, Asie mineure Bot. II, 1860. — C. V. SCHERZER, Smyrna, mit bes. Rücks. auf d. geograph., wirtschaftl. u. intellektuell. Verhältn. Wien 1873 (auch Arch. ph. 53 [1874] 53). — (Anonym), Pharm. Post 1890, 22. — SCHINDLER, Reis. im nordwestl. Persien 1880–82. Zeitschr. d. Ges. f. Erdk. 18. — STOLZE und ANDREAS, Handelsverhältn. Persiens. PETERMANNS Mitteil. Ergänzungsheft 77 (1885). — AITCHISON, Some plants of Afghanistan and their medic. prod. Pharm. Journ. 17 (1886) 467 und Notes on products of W. Afghanist. and N. E. Persia. — LINDLEY, Journ. Linn. Soc. 1859. — ROYLE, Illustrations of the Botany of the Himalayan mountains 1839. — POWELL, Economic products of the Punjab 1868. — STEWART, Punjab plants 1869. — HOLMES, Catalog. p. 135.
Beschreibung der Droge. Die Droge besteht aus den durch Abreiben oft von der äußeren Schicht, besonders dem Korke, befreiten, gebrühten und dadurch hornartig-hart gewordenen Tochterknollen, deren Form nach der Art wechselt (s. oben S. 377). Neuerdings sind auch viel handförmige im Handel. Der die Pflanze tragende Mutterknollen kommt nicht in Betracht. Er schrumpft beim Trocknen zusammen. Zugelassen sind (z. B. von Pharmac. helvet. IV) sowohl die europäischen wie die vorderasiatischen, sowohl die kugeligen wie die länglich-eiförmigen und handförmig geteilten Knollen (s. oben). Im allgemeinen gibt man den kleineren Knollen den Vorzug, doch läßt z. B. Pharm. helvet. IV noch solche von 4 cm Länge zu. Die Knollen tragen an der Spitze eine Knospe, sowie bisweilen die Reste des «Stieles», mit dem sie an der Mutterpflanze befestigt waren (Fig. 132, JK). Nicht selten wird jedoch bei dem Abreiben der Knollen das Knöspchen, das sich leicht ablöst, entfernt, so daß dann der Knollen in der Handelsware an der Spitze eine Narbe bzw. eine kleine Mulde zeigt. Das Knöspchen ist das Endknöspchen der Achse, in deren Gewebe die Nebenwurzel ursprünglich entstanden war (A. MEYER, Fig. 132, H). Der deutsche Salep ist durchscheinend-gummiartig. Frische Knollen schmecken etwas bitter und haben einen eigenen Spermageruch.
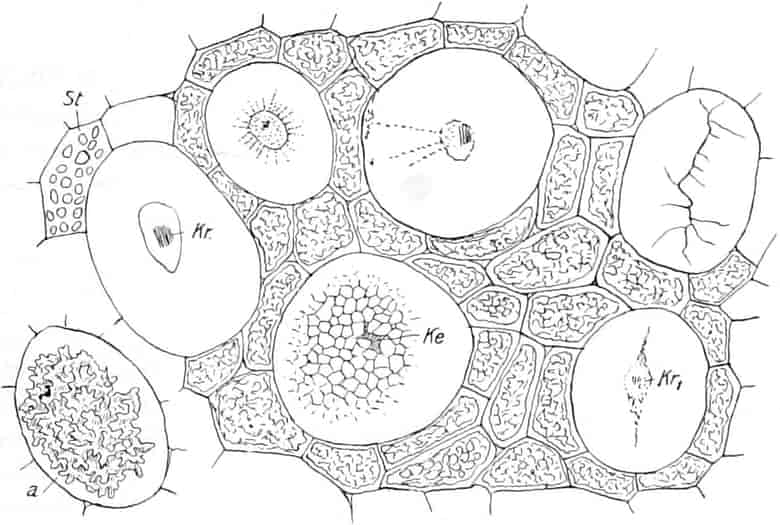
Querschnitt durch den gebrühten Salep.
Die großen Schleimzellen sind von Stärkekleister enthaltenden Zellen umgeben. Links oben (St) eine Stärkezelle aus dem ungebrühten Knollen, links unten eine Schleimzelle aus dem alten Knollen während der Entleerung.
[Tschirch.]
Anatomie. Der ausgewachsene Tochterknollen zeigt den typischen Bau unterirdischer Speicherorgane: kleine zerstreute Bündel und reichlich entwickeltes Speicherparenchym. Er ist bedeckt von einer Epidermis, die oft noch Wurzelhaare trägt.[S. 381] Dann folgt eine sehr schmale Rindenschicht und dann eine verkorkte Endodermis (A. MEYER). Diese Schichten pflegen bei der Droge zum Teil durch Abreiben entfernt zu sein. Innerhalb der Endodermis liegt ein lockerer Kreis von etwa 30 (MEYER) zarten, radialen, von einer Bündelscheide umgebenen, in der Droge oft stark zusammengefallenen Gefäßbündeln und auch im Innern des Knollen finden wir solche. Sie führen 2–4 zarte alternierende Gefäß- und Siebstränge (Abbild. bei MEYER). Die schmalen Gefäße sind Spiral- und Netzleistengefäße. Mechanische Zellen fehlen. Da jedes «Bündel» seine eigene Endodermis besitzt, die einen kleinen Kreis radialer Gefäßbündel umschließt, so nehmen einige an, daß hier nicht eine Wurzel, sondern ein Bündel miteinander verwachsener Wurzeln vorliegt. Das Speicherparenchym ist stark entwickelt. Es besteht aus dünnwandigen Zellen, die bei den frischen Knollen reichlich bis 35 mik große, eiförmige oder rundliche Stärkekörner enthalten (Fig. 133, St). Größe und Gestalt der Stärkekörner variiert etwas nach der Art. Sie sind nach VOGL bei O. militaris klein, unregelmäßig zusammengesetzt, bei O. Morio, variegata und pallens einfach kugelig oder eirund, meist mit einer Kernhöhle versehen, bei O. maculata verlängert und mit deutlichen Schichten versehen. VOGL gibt den Durchmesser auf durchschnittlich 8 mik an. Bei der Droge findet sich aber in den Zellen infolge des Brühens ein Kleisterballen (Fig. 133), der nur in den seltensten Fällen noch intakte Körner erkennen läßt. Durch Jod färbt sich der Kleisterballen violett bis rotbräunlich, die Stärke ist also zum Teil in Amylodextrin übergeführt. Eingebettet in dies Stärkeparenchym finden sich zahlreiche, bis 700 (im Mittel 250–350) mik große Schleimzellen (LINDLEYS «Knötchen»), meist einzeln, selten auch in übereinander stehenden Reihen, die ziemlich regellos im Gewebe verteilt sind oder doch wenigstens nur um die Bündel herum eine etwas regelmäßigere Anordnung zeigen. Meist trennt die Schleimzellen nur eine Reihe Stärkeparenchym (Fig. 133). Der Schleim wird durch Jod und Jodschwefelsäure gelb (echter Schleim). Eosin färbt den Schleim junger Zellen gelbrot, den alter Zellen rosa, welche Färbung stehen bleibt, wenn man kurze Zeit Alkohol auf den Schnitt wirken läßt (HARTWICH). Kongorot färbt orange (HEINRICHER). HANSTEINS[S. 382] Anilingemisch färbt nach schnellem Abspülen mit Alkohol rot. Rosolsäure in Sodalösung orangerot (HARTWICH). In der Handelsware enthalten die Schleimzellen der ausgewachsenen Knollen nur selten noch Raphidenbündel von Calciumoxalat [RASPAIL (Nouv. trait. syst. org. 1838) hielt die Kristalle für Calciumphosphat] — am meisten noch die der Randschicht. Der Schleim entsteht im Inhalt. Die Schleimbildung beginnt um (HARTWICH) oder in der Nähe (KOHL) eines kleinen Raphidenbündels. Dann erscheint er die Zwischenräume eines Plasmanetzes erfüllend und schließlich erfüllt er das ganze Innere der Zelle. Nur selten sieht man an der fertigen Schleimzelle einen zentralen Hohlraum, oft ein feines regelmäßiges Plasmanetz an der Peripherie der primären Wand anliegend, in dem sich dann auch wohl die bizarren Reste des Zellkerns (Fig. 133, Ke) bemerklich machen (A. MEYER, HARTWICH, BIRGER). KOHL beschreibt die Sache so, daß im Zentrum in einer Plasmascheide das Kristallbündel liegt und dieses Zentralplasma mit dem Randplasma durch den Schleim durchziehende Fäden verbunden ist. Beide sollen Netzstruktur zeigen (ähnlich A. MEYER). Die Kristallnadeln werden meist, aber nicht immer aufgelöst (Fig. 133, Kr1). In den jungen Schleimzellen liegen Stärkekörner, die aber mit fortschreitender Ausbildung des Schleimes zunächst in ihrer Substanz verändert (sie färben sich mit Jod erst blau, dann violett, dann rot, endlich gar nicht mehr), dann aufgelöst werden. Sie liefern das Material für die Schleimbildung. Schleim und Stärke sind Reservestoffe. Sie werden aufgelöst, wenn die Knospe im Frühjahr austreibt (s. oben) — zuerst die Stärke, dann der Schleim. Noch lange findet man in dem schon fast entleerten Knollen große korrodierte Schleimklumpen: die in Auflösung begriffenen Inhalte der Schleimzellen (Fig. 133, a). Wenn bei dem Knollen das Knöspchen an der Spitze erhalten ist, pflegen sich auch Reste des Stieles resp. der Tute vorzufinden, mit der der Knollen an der Pflanze befestigt war und in der das Knöspchen steckte (Fig. 132, K). Es kommt sogar vor, daß auch die Scheide, in der das junge Knöllchen ursprünglich sich entwickelte (s. oben S. 376), lange erhalten bleibt und auch den fertigen Knollen noch teilweise umgibt. Sowohl im Gewebe des Knöspchens als in dem der Tute finden sich sehr zahlreiche, oft dicht beieinander liegende Zellen mit Raphidenbündeln. Über den primären Bau der Wurzel vgl. HOLFERT, Arch. Pharm. 1889. Die Wurzeln enthalten eine endotrophe Mycorhiza.
Im Pulver der Salepknollen prävalieren die oft maschige Struktur zeigenden Kleisterballen und deren Fragmente, die sich mit Jod violett färben, sowie die Inhalte der großen Schleimzellen oder deren Fragmente, die Jod gar nicht oder gelb bis braunrot färbt und die oft noch das periphere Plasmanetz, seltener die zentrale Höhle mit dem kleinen Raphidenbündel zeigen und Parenchymfetzen. Gefäßfragmente treten auch im Chloralpräparat wenig hervor. Das Gleiche gilt von den Raphidenbündeln, die den peripheren Schichten der Knollen und der Knospe entstammen. Nur halb verkleisterte Stärke, wie sie KOCH abbildet, habe ich niemals gesehen, auch intakte Stärkekörner sind höchst selten. Jede Verfälschung des Pulvers mit anderen Stärkemehlen (s. unten) ist daher leicht zu erkennen. «Legt man das Pulver in Weingeist, so erscheinen die Schleimzellen als helle Schollen, läßt man dann Wasser zufließen, so verwandeln sie sich in helle, runde Blasen» (Pharm. helv. IV).
Lit. ARTHUR MEYER, Drogenkunde (dort das Detail). — BERG, Anat. Atlas t. 23. — VOGL, Kommentar (1908). — KARSTEN-OLTMANNS, Pharmakognosie, Fig. 128–133. — MOELLER, Pharmakogn., Fig. 291–293. — HARTWICH, Artikel Salep in Realenzyklop. d. Pharm. XI. — DE BARY, Anatomie 146, 151 u. 377. — JOHANN E. WEISS, Anat. u. Phys. fleischig verdickt.[S. 383] Wurz. Flora 1880. — PRILLIEUX, Ann. sc. nat. 4 (1865), 265. — LINDLEY (Bem. über die Anat. d. Ophryd. Wurz.), Transact. Linn. Soc. V, 18, 423 (Arch. Pharm. 39 (1844), 178, Okens Isis. 1843, 449, älteste mikroskop. Unters. d. Salep). — KOHL, Unters. über d. Raphidenz. Bot. Centralbl. 79 (1899), 273, Fig. 14–18.
Schleimzellen: SCHMIDT, Pflanzenschl. u. Bassorin. Lieb. Ann. 1844, 41. — LINDLEY a. a. O. — BEHRENS, Hilfsb. z. Ausf. mikr. Unters. S. 311. — CRAMER, Pflanzenphys. Unters. 1855. — WIGAND, Pringsh. Jahrb. III, 149. — KÜTZING, Grundz. d. philos. Bot. 1883, 194. — MEYEN, Sekretionsorg. — FRANK, Pringsh. Jahrb. V, 161. — ARTH. MEYER, Knoll. d. einheim. Orchideen. Arch. Pharm. 1886, 325 und Drogenkunde. — HARTWICH, D. Schleimz. d. Salepknollen. Arch. Pharm. 1890, 563 (m. Abbild.). — BIRGER, Om tuber Salep Arkiv för Bot. 6 (1907) u. Bot. Centralbl. 105, 31. — Das Pulver ausführlich in KOCHS Atlas II, t. 11. — Anatom. d. Eulophia in Pharmacogr. indic.
Chemie. DRAGENDORFF fand in Prozenten: Schleim (Arabin und Dextrin) 48,14, Stärke 27,30, Zellstoff 2,43, Zucker 1,21, Eiweiß und Albuminate 5, Fett 0,44, Weinsäure Spuren, Wasser 8,5, Asche 2,1. NYGÅRD gibt den Zuckergehalt auf 1% an. Im Knollen von Orchis purpurea fand HARLEY im Mai 0,41% Saccharose und 0,51% reduzierenden Zucker. Die Menge des Schleims variiert etwas. Er ist schwer zu reinigen und hält hartnäckig Stickstoff und Asche zurück. 1 : 100 erhält man mit Saleppulver einen dicken Schleim, 2 : 100 eine Gallerte. Der Schleim wird durch Jod rot und nach dem Eindampfen violett, da neben Schleim auch Amylodextrin aus den Stärkezellen in Lösung geht. Er wird durch Bleiessig und Alkohol gefällt, nicht durch Bleizucker. Magnesia und Borax verdicken ihn. Der Schleim färbt sich mit Chlorzinkjod nicht blau und quillt in Kupferoxydammon ohne sich zu lösen (A. MEYER). Er wird gefällt durch MgSO4, Na2SO4, (NH4)2SO4, (NH4)2HPO4 (POHL). GIRAUD betrachtete den Salepschleim als ein Umwandlungsprodukt der Stärke und zwar als «eine in Wasser schwellende Varietät des Dextrins». SCHMIDT nennt den Schleim Salepbassorin, gibt an, daß er mit verd. Schwefelsäure Gummi und Zucker liefere, bei gleichzeitiger Abscheidung von Zellulose und fand ihn zusammengesetzt = 47,20–47,28% C und 5,94–6,10% H. Er hielt ihn für ein Übergangsprodukt vom Gummi zur Zellulose, FRANK für eine Modifikation der Zellulose. Aus dem Salepschleim wird durch Zusatz von Salzlösung und nachher festem Salz zunächst ein schwerer löslicher, die Gallertebildung des Schleims bedingender Körper (α-Schleim) und dann erst ein gummiartiger β-Schleim gefällt (POHL). Im deutschen Salep ist α-Schleim nicht vorhanden. Mit Salpetersäure gibt Salepschleim Oxalsäure und keine Schleimsäure. Bei der Hydrolyse liefert er neben Dextrin Mannose und Glukose aber keine Galaktose oder Arabinose, Furfurol entsteht nicht (GANS und TOLLENS). Dabei wird Zellulose abgeschieden (TOLLENS). Daß Dextrose vorhanden schlossen GANS und TOLLENS daraus, daß sich bei der Oxydation Zuckersäure bildet, «so daß er zur Stärkereihe gerechnet werden könnte» (TOLLENS). (Sie erhielten aber auch ein Glukosazon.) Bei der vollständigen Hydrolyse liefert der Salepschleim ausschließlich Mannose (HILGER), die unvollständige liefert zunächst ein Mannotetrasaccharid und eine Mannobiose. Der Salepschleim enthält also ein Mannan. Bei der Oxydation mit H2O2 entsteht neben Formaldehyd, Ameisensäure und Kohlensäure d-Mannozuckersäure und d-Trioxyglutarsäure. HAUKE fand meist 1,5–2,5% Asche. Obere Grenzzahl 3% (Niederländ. Pharmakop.: 1,5 minim., 4% max.). Die Asche enthält viel Phosphate. Frische Knollen enthalten ein flüchtiges Öl, das von MATHIEU de Dombaste durch Destillation isoliert wurde. Beim Trocknen der frischen Knollen «entwickelt sich ein feiner an Cumarin erinnernder Wohlgeruch» (FLÜCKIGER).
[S. 384]
Lit. Ältere Untersuchungen von BERZELIUS, CAVENTOU, GUILLEMIN, GUIBOURT, RASPAIL, PAYEN, LINLEY. — GIRAUD, L’Union pharm. 16, 249. — SCHMIDT, Lieb. Ann. 51, 29. — DRAGENDORFF, Pharm. Z. f. Rußl. 1865, 145. — HARLEY, Thèse. Paris 1905. — FLÜCKIGER, Pharmakogn. — GANS u. TOLLENS, Ber. d. d. chem. Ges. 21 (1888), 1806 und 2150, Lieb. Ann. 249, 256. — TOLLENS, Kohlenhydrate. — E. FISCHER u. HIRSCHBERGER, Ber. d. d. chem. Ges. 21, 1805 u. 22, 365. — POHL, Zeitschr. phys. Chem. 14, 150. — HILGER, Ber. d. d. chem. Ges. 36 (1903), 3198. — THAMM, Salepschleim, Diss. München 1903.
Anwendung. Salep dient, da ein Mucilaginosum, als reizmilderndes und einhüllendes Mittel bei Diarrhöen und Darmkatarrhen besonders der Kinder. Als Mucilago, Dekokt, Gallerte, Mixtura Salep, auch äußerlich zu Klystieren oder deckendes Mittel (UNNAS Salepbassorinfirniß). Salep gilt auch als Nährmittel und wird auch z. B. in der Form der chocolat analeptique au salep mit Milch, Bouillon und Wein angewendet. Die, wie es scheint, durch nichts begründete Ansicht des Volkes, daß die Orchisknollen Aphrodisiaca seien, beruht auf der Signatura (Hodenform, Spermageruch).
Anrühren des Saleppulvers mit Alkohol erleichtert die Erzielung klümpchenfreien Schleims. Den besten Salepschleim erhält man (nach FROMME) weder mit feinem noch mit mittelfeinem Saleppulver, sondern mit der Griesform (Sieb 5). Ähnliches beobachteten schon FENNER und WINCKLER (1843). Zuckerzusatz konserviert den Schleim (VULPIUS). In Indien wird Salep viel für Süßigkeiten benutzt. Die Orientalen bereiten aus dem Salep ein Getränk, das an Stelle von Tee im Winter in großen Mengen genossen wird (GEHE, Handelsber. 1896). Salepdekokt mit Honig gemischt wird in der Türkei und Griechenland als erfrischender Frühtrunk genossen (HELDREICH). Aber auch zur Speiseeis-Bereitung dient dort der Salep. Mit Gewürz und Wein gibt das Dekokt ein angenehmes Krankengetränk. Salep dient auch als Klebemittel, zur Appretur statt Gummi arabicum. Nach AINSLIE soll Salep Salzwasser seines Salzgeschmackes berauben.
Verfälschungen. Als Verwechslung werden die Bulbotubera von Colchicum angegeben, die aber entweder in weißen Querscheiben oder mit dem braunen Niederblatt umgeben im Handel sind, auch eine seitliche Rinne haben, also ganz anders aussehen. Immerhin kommen Salepknollen bisweilen vor, die eine seitliche Rinne besitzen (HOCKAUF). Die anatomische Untersuchung läßt die Beimengung sofort erkennen. Die Stärke ist bei Colchicum niemals verkleistert. Als die Einsammlung des deutschen Salep in den fünfziger Jahren des XIX. Jahrh. in der Rhön und im Westerwald in Blüte stand und im Jahr bis 14000 Pfund der Droge nach Frankfurt kamen, beobachtete METTENHEIMER nicht nur Beimengung geschälter Colchicumknollen, sondern einmal bestand die ganze als «weißer Salep» angebotene Masse aus diesen Knollen. In Indien fanden sich vor einiger Zeit unter dem Namen banawati salap oder salam künstliche Salepknollen aus Gummi und Kartoffelstärke. HOCKAUF fand in einem Salepknollen ein Steinchen, das der wachsende Knollen eingeschlossen hatte. Das Saleppulver wird oft mit Stärke, z. B. Weizenstärke (HARTWICH), verfälscht angetroffen.
Lit. METTENHEIMER, N. Jahrb. f. prakt. Pharm. II, 165. — HOCKAUF, Ein interessant. Salepknollen. Pharm. Centralh. 1905, 83.
Geschichte. Der Unterschied zwischen den beiden Knollen war schon den Alten aufgefallen und sie schrieben ihnen eine verschiedene Wirkung zu. THEOPHRAST sagt, der größere vermehre die facultas coëundi, der kleinere vermindere sie. DIOSKURIDES sagt, daß der größere Knollen vom Manne verzehrt, die Geburt von Knaben bewirke, der kleinere, von der Frau genossen, die Geburt von Mädchen, und erwähnt, daß in Thessalien die Frauen den zarteren vollsaftigen (bei PLINIUS den größeren, härteren) Knollen als Aphrodisiacum, den festeren[S. 385] trockenen (bei PLINIUS den kleineren weicheren) als Antiaphrodisiacum benutzen. Die in dem von der Form hergenommenen Namen ὄρχις zum Ausdruck kommende Beziehung zu den Geschlechtsorganen und die entsprechende Verwendung zeigt, daß hier den Alten wie in so manchen Fällen eine Signatura (vgl. I, S. 886) vorschwebte. Auch der eigenartige Geruch frischer Knollen mag hier wegleitend gewesen sein. DIOSKURIDES unterscheidet ὄρχις (ὀ. κυνὸς), ὀ. ἔτερος (Serapias), σατύριον und σ. ἐρυθρόνιον. Von diesen wird das letztere nicht auf eine Orchidee bezogen, die übrigen sind Orchis- bzw. Ophrysarten. Ähnlich PLINIUS, der Orchis (Serapias), zwei Arten Satyrion (Männchen und Weibchen) und ein Satyrion erythraicon unterscheidet, und auch Krankheiten nennt, gegen die sie angewendet wurden. Blüten und Knollen der O. serapis (muscifera) spielten bei den üppigen Serapisfesten in Canopis eine Rolle. Im germanischen Altertum waren Orchisarten der Göttin der Liebe FREYA geweiht («Friggagras»), andere der Riesin BRANA («Brönnagras») und in zahlreichen, zum Teil sehr alten Namen (z. B. hiônarôt = Heiratswurzel, gradrôt = Gierwurzel), tritt auch hier die Beziehung zum Geschlechtsleben, die man besonders der Wurzel der Pflanze zuschrieb, hervor. Sie wurden denn auch damals viel zu Liebeszauber und als Aphrodisiacum benutzt (I, S. 1009), wie auch später noch im XV. und XVI. Jahrh. (vgl. d. Kräuterbücher). Eine alte Sage läßt sie aus dem verspritzten Samen von Vögeln hervorgehen (daher wohl Kuckuckspeichel, s. oben). Die Unterscheidung zwischen männlicher und weiblicher Orchis finden wir auch noch in späterer Zeit. In Sušrutas fehlt Salep. Die Araber des Mittelalters (z. B. AVICENNA) verwendeten die Orchisknollen wohl vorwiegend ungebrüht und brachten die Droge aus Persien nach dem Abendlande, wo sie bis dahin wenig beachtet worden war und nur die ungebrühten Knollen heimischer Orchideen ein wenig benutzt worden waren. Satyrion steht im Nördlinger Register (1480); Rad. satyrii sive testiculus vulpis, Staudelwurtz in der Hamburger Taxe von 1587 (I, S. 818), in Zucker eingekochter Salep im Braunschweiger Register (I, S. 814) und in SCHRÖDERS Pharmakop. vom Jahre 1649 (FLÜCKIGER). Abbildungen und Beschreibungen der Orchisarten lieferten die Patres botanices, z. B. FUCHS (Fig. 134), dann auch GERARDE (1636). CLAUDE JOSEPH GEOFFROY zeigte (1740), daß der bis zum XVIII. Jahrh. fast allein benutzte orientalische Salep ein Orchisknollen ist, wie schon vor ihm GERARDE (I, S. 909) und JOS. MILLER (Botanicon officinale, I, S. 948) erkannt hatten, und BUXBAUM (1733) auf seiner orientalischen Reise bestätigt fand, und daß man von den europäischen Arten der Gattung Orchis gleichwertigen Salep gewinnen kann.
Lit. BUXBAUM, Plantar. minus cognitar. Cent. III. Petropol. 1740. — CLAUDE JOS. GEOFFROY, Mém. de l’acad. d. sciences 1740. — FLÜCKIGER, Pharmakognosie.
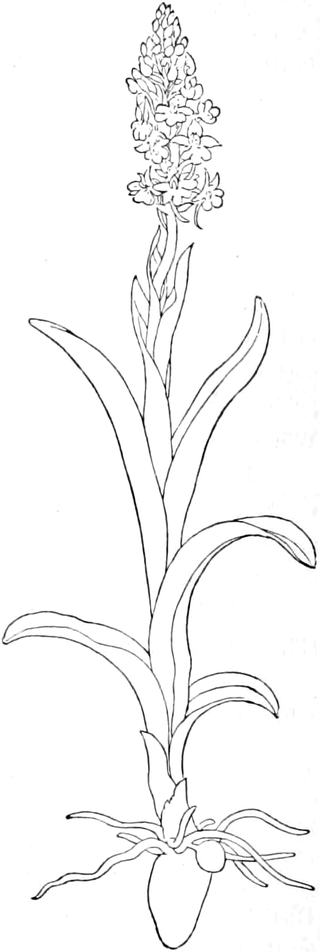
Aus Fuchs, New Kräuterbuch. Basel 1543.
[Phot. verkleinert.]
Paralleldrogen. In Mexico werden die Knollen der Orchideen Blettia campanulata und coccinea, Epidendron pastoris und Arpophyllum spicatum wie Salep benutzt (MAISCH).
1888 kam als Ersatz des Salep die Wurzel von Asparagus ascendens aus Ostindien nach England (DYMOCK).
Die zuerst 1865 im Handel erscheinende und als Ersatz für Salep empfohlene Rad. corniolae, die STRIELACK Nourtoak (von nourriture und toak = Wurzel) nannte, stammt von Asphodelus Kotschyi (? nicht im Kew Index). Sie weicht in der Zusammensetzung stark von dem Salep ab, denn sie enthält, neben 52% Schleim,[S. 386] 8–14% Zucker und keine Stärke, sowie 10% «unlöslichen Pflanzenschleim» (DRAGENDORFF).
Der Königs-Salep (Padischah-, Badschah-, Radja-Salep) der indischen Bazare (HANBURY) ist die amylumfreie Zwiebel von Allium Macleanii (AITCHISON, abgeb. in Bot. Mag. 1883, t. 6707), nicht die Zwiebel der Orchidee Pholidota imbricata HOOK. (DYMOCK) oder die der Amaryllidacee Ungernia trisphaera BUNGE (BAKER). Sie schmeckt bitterlich.
Lit. MAISCH, Jahresb. d. Pharm. 1885, 104. — (DYMOCK) Pharm. Journ. 1887/88. — DRAGENDORFF, Ph. Z. f. Rußl. 1865, 145. — Jahresb. d. Pharm. 1865, 87. — PASCHKIS, Pharm. Post 13. — HANBURY, Pharm. Journ. 17 (419) und Science papers, p. 155 (m. Abbild.), Journ. pharm. chim. 33 (1858). — AITCHISON, Ann. of botany 1889, Pharm. Zeit. 1888, 744.
d) Schleimzellen in Rinden.
Viele Rinden enthalten Schleimzellen mit typischen Schleimmembranen, wie z. B. die Zimtrinden, die um so weniger geschätzt werden, je schleimreicher sie sind, da die schleimreichen Rinden ölarm zu sein pflegen. Ich habe die Sache aufgeklärt. Es ließ sich zeigen, daß Schleim- und Ölzellen in ihrer primären Anlage sich nicht unterscheiden. Später werden dann die einen zu Ölzellen, indem die Schleimplasmaschicht resinogen wird (TSCHIRCH und RUD. BIERMANN), die anderen bleiben Schleimzellen und bilden die typische geschichtete Schleimmembran aus (Fig. 281). Wie viele zu Ölzellen werden, scheint vom Klima und Standort abzuhängen.
Zu den Rinden mit Schleimzellen gehört auch die jetzt nur wenig benutzte Cort. ulmi von Ulmus effusa WILLDENOW, unserer Rüster, die neben Schleim auch Gerbstoff enthält und die im Sommer bisweilen sogar reichlich Schleim ausschwitzt (FLÜCKIGER, Pharmakognosie S. 513).
Noch schleimreicher ist die Rinde der nordamerikanischen Ulmus fulva MICHAUX (Pharmacographia p. 557).
Die Chinesen bedienen sich außer der Lein- und Quittensamen gern auch der Ulmenrinde als Mucilaginosum (I, S. 521).
7. Gummo-Membranindrogen.
Die Gummis.
Das Gummi schließt sich an die Schleimdrogen (Koryzomembranindrogen) an. Das Traganth bildet den Übergang zwischen den typischen Schleimdrogen, wie sie z. B. bei den Malvales vorliegen, und dem Gummi arabicum, denn bei ihm findet Schleimmembranbildung statt, ähnlich wie bei den oben (S. 314 bis 374) behandelten Schleimdrogen. Doch liegen hier die Schleimzellen nicht isoliert, sondern bilden ein ganzes Schleimgewebe, das bei Verletzungen herausgequetscht wird. Die Bildung selbst ist nicht pathologisch. Bei den Gummis im engeren Sinne dagegen scheinen pathologische Produkte vorzuliegen. SORAUER und GRÜSS haben freilich neuerdings nachzuweisen versucht, daß die Gummosis aus einem normalen Stoffwechselprozesse hergeleitet wird und nicht ein dem gesunden Organismus ganz fremder Prozess sei, aber auch sie geben doch zu, daß Wundreiz, Störungen in der Ernährung, Bakterieninfektion u. a. dazu beitragen, daß dieser Prozeß irregulär verläuft und eine starke Steigerung erfährt. Jedenfalls ist eine irgendwie ergiebige Gummibildung ohne pathologische Eingriffe nicht beobachtet worden, eine Steigerung der Gummibildung[S. 387] durch den äußeren Reiz zweifellos. Damit tritt die Gummosis in Parallele zur Resinosis. Denn wir beobachten ja, daß eine Verwundung die bei vielen Pflanzen normale Harzproduktion durch Ausbildung neuer sekretbildender Organe stark steigert (Gesetz des Harzflusses, I, S. 363). Ebenso fand MIKOSCH, daß die das Gummi bildenden Gewebeinseln («Gummiparenchym») bei den Amygdalaceen erst infolge der Verwundung im Cambium angelegt werden, und zwar zunächst als schizogene Gänge, die sich dann lysigen erweitern — ganz ähnlich wie bei den Harzpflanzen. Diese Analogie wird noch dadurch größer, daß wir in beiden Fällen, der Gummi- wie der Harzbildung, eine Membranschicht beteiligt sehen und der Unterschied eigentlich nur darin besteht, daß in dem Falle der Gummibildung die betreffende Membranschicht gummogen, bei der Harzbildung aber resinogen ist, bei der Harzbildung in der resinogenen Schicht das Sekret entsteht, während bei der Gummibildung die ganze Membranpartie «vergummt» — womit übrigens nichts gesagt sein soll, daß hier eine als Zelluloseschicht angelegte Membranpartie nachträglich in Gummi übergeführt werden müsse, das Gummi kann auch sogleich als solches angelegt werden, wie wir dies ja auch bei den Schleimmembranen beobachten. Über die Gummosis wird im Zusammenhang unter Gummi arabicum berichtet.
Auch die chemische Untersuchung läßt keinen Zweifel darüber, daß die Gummis zu den Membranindrogen gehören. Sie besitzen durchaus den Charakter von Polysaccharid-Membraninen. Die Hydrolyse liefert für gewöhnlich Galaktose und Arabinose (über die nahen Beziehungen dieser beiden Zucker vgl. S. 274). Dies gilt auch für den Gummianteil der Gummiharze. Eine Einteilung der Gummis in Arabin-, Cerasin- und Bassorinhaltige (vgl. TSCHIRCH, Artikel Gummi in der Realenzyklopädie) hat wenig inneren Wert. Die Unterscheidung in ganz oder nur teilweise in Wasser lösliche besitzt jedoch praktische Bedeutung (vgl. Gummi arabicum).
Ein Verzeichnis der Gummi liefernden Pflanzen in WIESNER, Rohstoffe.
Lit. TSCHIRCH, Artikel Gummi in Realenzyklop. d. Pharm. und Angew. Anatomie. — WIESNER, Rohstoffe. Die weitere Lit. unter Gummi arabicum.
Traganth.
Syn. Gomme adragante (franz.) — tragacanth (engl.) — tragacánth (holl.) — gomma adragante, g. dragante (ital.) — goma tragacanto (span.) — dragant (schwed.) — τραγάκανθα (griech.) — pers. und arab. (auch in Indien und Afghanistan): kathîra, katâd, kettira, katira, kutera, katera, chitira, halusia — kurdisch: guini — bei den Türken: ketereh. — Der Traganthstrauch in Kleinasien: ketré oder τραγακάνθινος, in Persien (z. B. im Harirud-Tale, AITCHISON): kon (A. strobilif.) oder gabina (A. heratens.). — In Afghanistan heißt schlechtes Traganth: anserus. — Das nechóth, nᵉkhōth der Bibel (Genes. 37 u. 43) ist wohl = nakaʿat (arab.), nakamâti (assyr.), d. h. als Traganth anzusprechen; LUTHER übersetzt (jedenfalls fälschlich) Würze, KAUTZSCH Traganth.
Etym. Da Lehnwort aus dem griechischen τραγάκανθα Traganth und nicht Tragant. Ebenso auch Traganthon, nicht Traganton. Eigentlich muß man die Traganth sagen, denn THEOPHRAST schreibt ἡ τραγάκανθα, doch ist jetzt der oder das Traganth gebräuchlicher. Ich schreibe das Traganth (scil. gummi). — τραγάκανθα von τράγος (= Bock) und ἀκάνθα (= Horn oder Dorn) entweder in Beziehung zu der dornigen Beschaffenheit des Strauches oder der oft bockshornartigen Form des herausgedrückten Schleims — ἀστράγαλος = Würfel, Halswirbel. Beziehung zweifelhaft, von einigen auf Stengel und Wurzeln, von anderen auf die Samen bezogen.
[S. 388]
Stammpflanzen des kleinasiatischen Traganth (nach HAUSSKNECHT, 1879, und PLANCHON, 1892):
Astragalus gummifer (nicht gummifera wie der Autor schreibt) LABILLARDIÈRE (A. erianthus WILLD.), vom Libanon durch die zentralen Gebirge Kleinasiens, um Kaisarieh bis nach Armenien, ferner im Ala-dagh und in den nördlichen Gebieten des Euphrat und Tigris.
A. microcephalus WILLD. Ebenda und auch im südwestlichen Teile Kleinasiens (von Lycien bis Armenien und Iberien, Cappadocien, Paphlagonien).
A. stromatodes BUNGE, besonders in Höhen von 1500 m im Achyr dagh (Akker-dagh, Taurus) nördlich von Marasch in Nord-Syrien und zwischen Marasch und Aleppo. Liefert viel Traganth.
A. kurdicus BOISS. Gegend von Aintab zwischen Marasch und Aleppo, dann im südöstlichen und zentralen Kleinasien und Kurdistan (Nordsyrien, Cilicien, Cappadocien). Liefert viel Traganth.
A. verus OLIVIER in Kleinasien (und Nordwestpersien, Kermanchah).
Stammpflanzen des persischen Traganth (nach HAUSSKNECHT, BRANT und AITCHISON):
A. pycnocladus BOISS. et HAUSSKN. in den Avroman- und Schaho-Bergen in der Provinz Ardilan, überhaupt in den Gebirgen Westpersiens (Zagrosketten) weit verbreitet (Kurdistan). — Sehr reichlich Traganth gebend.
Astragalus adscendens (ascendens) BOISS. et HAUSSKN. (nicht im Kew Index), in den südwestlichen Gebirgsgegenden Persiens in Höhen bis 3000 m.
A. leiocladus BOISS., im mittleren und westlichen Persien, bei Isphahan und Hamadan.
A. brachycalyx FISCHER, in den gleichen Gegenden, besonders in persisch Kurdistan, in Luristan 1300–2600 m.
A. heratensis BUNGE und A. strobiliferus ROYLE (resp. eine diesem verwandte Art) im Harirud(Heri-Rud)-Tale und in den Bergen Chorasans im nordöstlichen Persien (AITCHISON).
A. eriostylus BOISS. et HAUSSKN., wird in Luristan (Südwestpersien) 2 m hoch und 1 cm dick (HAUSSKNECHT).
Stammpflanze des griechischen (Morea) Traganth (nach HELDREICH, 1862).
Astragalus Parnassi BOISS. var. cyllenaeus (A. cyllenaeus BOISS. et HELDR.) bei Vostizza und Pratras, im nördlichen Peloponnes, auf dem Boïdias, Taygetos und Phteri. Auf den höheren Bergen Griechenlands wächst auch A. creticus, A. aristatus und cephallonicus.
Die Sekretion bei A. creticus LAM. (Tragacantha cretica incana TOURNEF.) ist zu gering, um für den Handel in Betracht zu kommen (OLIVIER), ebensowenig liefert A. massiliensis LAM. (A. Tragacantha L.) Traganth.
Systemat. Stellung. Astragalus gehört zu den Leguminosae, Papilionatae — Galegeae — Astragalinae (in die Nähe von Glycyrrhiza); die Traganthsträucher zu der Sectio VII Tragacantha BGE. und zwar zu den Gruppen Brachycalyx, Platonychium, Stenonychium und Rhacophorus. (Näheres bei TAUBERT in ENGLER-PRANTL, Pflanzenfam.)
Die Gattung Astragalus ist eine der artenreichsten der Leguminosen (über 1200). Sie ist über die ganze Erde außer Australien und dem Cap verbreitet und auch bei uns mit einigen dornlosen Arten (A. excapus, — früher in Gebrauch: Rad. astrag. excapi — A. Cicer, A. glycyphyllos,[S. 389] A. danicus usw.) vertreten. Die Traganth liefernden Arten finden sich aber nur in Kleinasien, Syrien und Persien (sowie in Griechenland). «Ihre Heimat sind die ausgedehnten Gebirgszüge, welche östlich von der Linie aufsteigen, die man von der Insel Rhodus etwa durch Angora nach Sinope am schwarzen Meere zieht. Diese zahllosen Ketten umfassen den Südrand Kleinasiens, die syrische Küste, umfassen Mesopotamien bis zu den großen armenisch-persischen Seegebieten von Wan und Urmia, verzweigen sich bis in die Gegend von Kaschan und Isfahan und endigen unweit des persischen Golfes im Gebirge von Mohamed Senna, nordwestlich von Schiras» (FLÜCKIGER). Die Traganthsträucher bilden eine charakteristische Vegetationsform des östlichen Mittelmeergebietes und der angrenzenden persischen Gebiete, die eigenartigste Form des Dornbusches der Steppen. «Durch keine Pflanzenform», sagt GRISEBACH, «wird das persisch-anatolische Hochland bestimmter charakterisiert als durch die Traganthsträucher, deren gedrängte, zierliche Fiederblätter in Dornen auslaufen und deren Stämme, nachdem die Blättchen abgefallen, durch die stechenden Blattstiele, die sich dauernd erhalten, noch viel stärker bewaffnet sind.» Im Steppengebiet ist Astragalus mit c. 800 Arten vertreten (BUNGE). In der Gummibildung haben wir eine Anpassung an das Steppenklima, eine Ausnutzung auch geringer und vorübergehender Niederschläge durch Ausbildung eines Wasser speichernden Gewebes zu sehen. Die Bildung des Gummis im Mark erfolgt schon dicht unter der Vegetationsspitze (SOLMS). — Die geringe Größe der Sträucher «verschafft ihnen den Vorteil der winterlichen Schneedecke».
Beschreibung der Stammpflanze. Die Traganthsträucher (engl. Gum-bearing-milk-vetch) sind weiß behaarte Dornsträucher. Der Beschreibung mag Astragalus gummifer LABILL. zugrunde gelegt werden. Die Pflanze bildet einen sehr sparrigen, reich verästelten Strauch, der bis 80 cm hoch wird und dessen obere blühbare, stark verkürzte Zweige ein sehr hartes, gelblich-weißes Holz und eine borkenbildende Rinde besitzen. An den vorjährigen, dicht weiß behaarten Zweigen sitzen die paarig-gefiederten, 5–7jochigen Blätter, deren frühzeitig verholzende, gelbe, oben zugespitzte, stechende Spindel lange erhalten bleibt und dem Strauche das dornige Aussehn verleiht. Die oblong-lanzettlichen, 7–8 mm langen Blättchen fallen bald ab. Auch die spitzen, dem Blattstiele angehefteten Nebenblättchen sind sehr hinfällig. Die hermaphroditen, zygomorphen Schmetterlingsblüten stehen gepaart in den Blattachseln und werden von einem gekielten Deckblatte gestützt. Der 7 mm lange Kelch ist bis zur Hälfte fünfteilig, die dicht seidig-zottige Röhre kreiselförmig. Die gelblich-weißen Blüten besitzen eine oben ausgerandete, 14–16 mm lange Fahne, die 12–14 mm langen Flügel sind mit schmalem Nagel der Staubgefäßröhre angewachsen. Der Kiel ist schmal und stumpf, die weiße, geschlitzte Staubgefäßröhre ist nur wenig gekrümmt. Das obere Staubgefäß ist frei. Der schopfig behaarte Fruchtknoten enthält etwa 10 Ovula. Die Frucht ist eine Hülse.
A. adscendens wird 1,5 m, A. kurdicus 1,3 m, A. eriostylus 2 m, A. brachycalyx 1 m hoch (Beschreibung der Arten bei LUERSSEN, Mediz. pharm. Bot. und in PABST-KÖHLER, Medizinalpflanzen t. 119).
Lit. BUNGE, Gener. Astrag. Spec. Gerontog. Mém. acad. imp. Petersb. (7) 11 und 15. — BOISSIER, Flora orient. II. — LINDLEY, Flor. med. 247 und Botan. regist. 1840. — F. B. FISCHER, Synopsis Astragalorum Tragacantharum Mosquae 1853. — HAUSSKNECHT, Briefl. Mitth. (1879) in FLÜCKIGER, Pharmakogn. (auch: KIEPERT, Haussknechts Routen im Orient (1865 bis 1869). 4 Bl. Berlin 1882). — AITCHISON, Pharm. Journ. 17 (1886), 467. — GRISEBACH, Vegetation der Erde 1872. — HARTWICH in Realenzyklop. — Die sonst verwendeten Astragalusarten in DRAGENDORFF, Heilpflanzen. — Abbild. von Astrag. gummifer(a) in LABILLARDIÈRE, Observat. sur la Physique 36 t. 1, copiert in NEES VON ESENBECK, Suppl. t. 62. BERG-SCHMIDT Atlas, 2. Aufl. t. 54 (dort die systemat. Lit.). BENTLEY-TRIMEN, Medic. pl. t. 73. BAILLON, Bot. méd. I, Fig. 2200 u. 2201. PLANCHON-COLLIN, Drog. simpl. II, 491 und ENGLER-PRANTL, Pflanzenfam. III, 295. — Von A. adscendens in PABST-KÖHLER, Medizinalpfl. t. 119. — Von[S. 390] A. creticus LAM. in Flora Graeca t. 736 und in BERG-SCHMIDT, I. Aufl. t. 31. — Von A. Tragacantha in GIESENHAGEN, Botanik. — Von A. verus: OLIVIER in Oliviers Voyage Emp. Ott. t. 44. NEES VON ESENBECK, t. 329 und GILG, Botanik, Fig. 404.
Pathologie. Auf A. leiocladus BOISS. findet sich eine kleine parasitische Phanerogame, nämlich die Rafflesiacee Pilostyles Haussknechtii BOISS. (SOLMS LAUBACH, Bot. Zeit. 1874. Abgebildet auch in BERG-SCHMIDT, Atlas, 2. Aufl.).
Gewinnung. Gute Traganthe kommen nur aus Gebirgsgegenden (SCHLIMMER). Der Austritt erfolgt durch Wunden, die spontan, z. B. durch weidendes Vieh, entstehen oder künstlich angebracht werden.
Hauptproduktionsdistrikte für anatolisches Traganth sind (GEHE 1898) die Distrikte im mittleren Kleinasien: Kaisar (Kaisarie, das Caesarea der Alten) produziert am meisten, dünn, kleinblätterig, sehr ausgiebig, leicht zerbrechlich. — Everek größer wie Kaisar, sehr ausgiebig. — Nidé produziert viel, nach Kaisar das meiste, große kräftige, dicke Blätter von schönem Aussehn. — Angora, dünnes, glänzendes, etwas glasiges Blatt (ähnlich dem syrischen), Weißblatt blank, die blonden und gelben Sorten meist befleckt und sandig. — Joskat glasig, Blätter etwas kleiner als Angora und geringelt. — Sillé glänzend und glasig, sehr dickes Blatt, schwer löslich. Daneben finden sich noch sog. Mischlinge, d. h. zwischen den genannten Distrikten gesammelte Sorten. Auch MALTASS nennt bereits 1855 Kaisarie und Angora neben Yalavatz (Jalowadj, Jabolatsch), Isberta (Isparta), Burdur (Buldur) als Hauptplätze der kleinasiatischen Traganthgewinnung. Andere auch die Berge von Ala-dagh zwischen Kaisarie und Tarsos im Süden (vgl. die Karte I, S. 440/41) und das Hochland von Bingöl-Dhag zwischen Erserum und Musch ganz im Osten (in West-Kurdistan). Nach Smyrna gelangte das Traganth (1874) besonders aus Jalowadsch und Burdur (Prov. Hamid). Haupterzeugungsgebiete sind jetzt (1910) Kaisarieh und Everek, weniger wird in Nigde, Angora, Josgad, Erzinghian, Siwas, Caraman und Guran gewonnen.
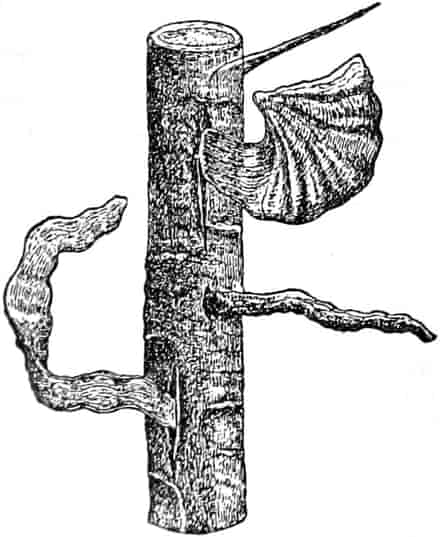
Der Austritt des Traganth.
[Nach Planchon-Collin, Drog. simpl.]
Schon HAMILTON, der die Traganthsträucher 1836 auf den Bergen bei Buldur beobachtete, berichtet, daß Einschnitte nahe an der Wurzel gemacht werden. Im Juli und August entfernen die Bauern in Kleinasien von dem unteren Stammteile die Erde und machen mit einem Messer Längseinschnitte in die Rinde. Aus diesen tritt das Blättertraganth aus, das in 3–4 Tagen erhärtet ist. Wird die Rinde nur mit der Spitze des Messers verwundet, so wird Faden- und Wurmtraganth erhalten. Aus natürlichen Wunden tritt Traganth in Form von gelblichen Tropfen oder wulstigen Massen, die meist stark gefärbt sind, aus. Bei trocknem Wetter ist das Traganth weiß, bei nebeligem wird es leicht gelb und bräunlich. So kann also ein und dieselbe Pflanze alle im Handel unterschiedenen Sorten von ganz weißem Blättertraganth bis zu bräunlichem Traganth in Knollen liefern. Beim Traganth spielt daher das Sortieren eine große Rolle. Es geschieht dies meist nicht in den Produktionsorten, sondern[S. 391] in Smyrna, wohin das anatolische Traganth in Säcken gebracht wird (hier früher [1874] besonders durch spanische Juden), Konstantinopel, Kermanchah und (beim persischen und syrischen) in London. In Smyrna rechnet man, daß in dem Rohtraganth im Durchschnitt 40–50% Weißblatt, 15–25% Gelbblatt, 10–15% Vermicelli und 10–25% Traganthon enthalten ist (VALENTA). Im westlichen Kleinasien werden die Sträucher im Frühjahr und Sommer angeschnitten, die Ernte ist im September im wesentlichen beendet. Anhaltender Regen schädigt die Ernte beträchtlich, da das Gummi abgewaschen wird. So lieferten die nassen Jahre 1907 bis 1909 nur wenig Traganth. Eine gute Getreideernte in Anatolien entzieht der Traganthsammlung oft viele Arbeitskräfte und der Ertrag bleibt dann gering.
Als Produktionsgebiete des westlichen persischen Traganth werden die Gebiete zwischen Hamadan und Isfahan und dem Nordende des persischen Golfes angegeben. Auf dem Markte von Kermanchah (Kermanshah) im westlichen Persien, gab es 1904 vier Qualitäten. Die erste Qualität (Katyra) erhält man aus Kermanchah, Nehawend und Burujird (Burudjird), sie wird in drei Preisklassen geteilt; die zweite Qualität kommt aus den gleichen Orten und Kurdistan, sie wird in fünf Klassen geteilt; die dritte Qualität (Zardeh) ist in Persien unter dem Namen Arrehbor (= mit einer Säge geschnitten) bekannt, sie kommt aus dem Delahu-(Dalaho-)Gebirge, Pusht-I-Kuh (Pisch-Kuh), Khorremabad (Chorremabad) und Burujird; die vierte Qualität (Steingummi) als Kurreh (Kora) bekannt, kommt von den gleichen Orten. Diese Sorten gehen nach Bagdad und auf dem Tigris zum Persischen Golf. Sie werden erst in London sortiert, das etwa ⅞ der Menge erhält (1904). Bei den persischen Nomaden heißen die Traganthsträucher Geesen, Gavan oder Gäwann schire (= milchgebende Sträucher, da sie zerkleinert verfüttert werden, SCHINDLER). Katyra wird von der Pflanze Gavansefid (= weißer Gavan) gesammelt, in die Einschnitte gemacht werden, die zweite Qualität von der Pflanze «Gelber Gavan». Sie ist größer. Die Spitze der Pflanze wird verbrannt; wenn die Blätter alle vernichtet sind, löscht man das Feuer und macht die Einschnitte. Am folgenden Morgen wird das ausgeschwitzte Gummi gesammelt. Diese Operation wird drei- oder viermal wiederholt. Die Qualität wird jedesmal besser. Das Arrehbor-Gummi kommt von einem kleinen Baume, die Spitze desselben wird verbrannt und die Zweige werden drei- oder viermal mit einer Säge abgeschnitten. (Die Pflanze, die Koragummi liefert, wird in derselben Weise behandelt.) Die Operation wird dreimal wiederholt und das Gummi wird jedesmal besser. Nach 7 Jahren vertrocknet die Pflanze. Ähnlich ist die Gewinnung in Fars, doch ist das Traganth von dort etwas weniger gut (das beste entspricht der zweiten Qualität von Kermanchah). Um Kermanchah gab es schon 1904 nur noch wenig Traganthsträucher, da die Pflanzen sehr geschädigt werden. Nach HAUSSKNECHT soll das persische Traganth eine spontane Exsudation sein, wenigstens wurden 1869 in Persien und Kurdistan keine Einschnitte gemacht.
STOLZE und ANDREAS nennen im Westen die Gebirge des persischen Kurdistan, Khārähan und Tâläkân (?), dann das Kehris-Kohrud-Gebirge zwischen Kaschan und Isfahan (in Irakadjmi) und die Höhen um Abadeh nördlich von Fars (Farsistan).
SCHINDLER gibt 1881 als Produktionsorte für südpersisches Traganth an: Feridûn zwischen den Chan-i-Surch-Paß und Deh-i-Dáwâi in Kirman (Südpersien). Auch STOLZE und ANDREAS erwähnen Gebiete von Kirman, besonders die Landschaft Sirdjan als reich an Traganth. Für den in diesen bis 8000′ hohen Gebirgen gesammelten Traganth ist Paris (Parîz c. 30° n. B.) Stapelplatz.
[S. 392]
Nach AITCHISON wird in Nord-Persien im Herirudtale und in Chorassan Traganth (Katira) gesammelt, besonders in der Nähe des Dorfes Kalla-roving bei Bezd in Chorassan. Dies Traganth geht an die Küste oder über Herat nach Indien.
1894 wurde von einem Aufschwung des Traganthhandels in Persien und Sulimania berichtet. Neuerdings störten aber die politischen Unruhen die Tragantheinsammlung in Persien beträchtlich. (Vgl. auch die Karte von TUNMANN im Kap. Pharmacogeographie I, S. 440/441).
Das griechische oder Morea-Traganth wurde in den Bergen in Nord-Morea gesammelt (HELDREICH 1862).
Lit. LA BILLARDIÈRE, Journ. d. phys. 36, 46 (1790) (Acad. sc. 1789). — OLIVIER, Voyag. dans l’emp. ottom. Paris an IX. — HAMILTON, Research. in Asia min. etc. I, 192 (Pharm. Journ. 1842, 540). — MALTASS, Pharm. journ. 15 (1855) 18. — SOUBEIRAN, Not. s. l. récolte d. gomme adragante en Asie Min. Journ. pharm. 1856 u. 1857. — HELDREICH, Nutzpfl. Griechenlands. Athen 1862. — BOISSIER, Flor. orient. — SCHERZER, Smyrna. Wien 1873 (Auszug in Arch. Pharm. 205 [1874], 48). — SCHLIMMER, Terminol. Teheran 1874. — SCHINDLER, Reisen im nördl. Persien. Zeitschr. Ges. f. Erdkunde 1881, 362. — STOLZE und ANDREAS, Handelsverhältnisse Persiens. Petermanns Mitth. Ergänzungsh. 77 (1885), 15. — HANBURY, Scienc. pap. 117. — SIMMONDS Bull. of pharm. Detroit 1891. — G. PLANCHON, Les Astragales Journ. pharm. chim. 1891, 24, 473 und 1892, 169. — FLÜCKIGER-HANBURY, Pharmacographia. — VALENTA, Klebe- u. Verdickungsmittel. — GEHE & Co., Handelsbericht 1898. — (British. Consularagent) Persian Tragacanth. Pharmac. Journ. 1904, 2, 40. — GUIBOURT, Hist. d. drogues.
Handelssorten. Die höchsten Preise erzielte 1910 das syrische Traganth, dann das anatolische (türkische, levantinische), geringere das persische, die geringsten das minderwertige Traganthon. Das syrische ist in Kisten à 75 und 80 kg und in Säcken à 100 kg, das anatolische in Säcken à 100 und 120 kg und Kisten à 130 und 160 kg, das persische in Ballen à 50, 70 und 100 kg und Kisten à 60 kg, Traganthon in Ballen à 120 und 130 kg im Handel (GROSSMANN 1910). Doch ist zu bemerken, daß die Bezeichnung syrisches Traganth irreführend ist, denn dieses Traganth stammt aus West-Persien und Ost-Kleinasien und kommt über Bagdad nach London. Syrien liefert überhaupt nur wenig Traganth und die syrischen Häfen exportieren nicht viel. Die frühere Einteilung in Blätter-, Stengel- und Körner-Traganth, französische und englische Qualität usw., ist jetzt nicht mehr üblich.
1. Das sog. syrische Traganth zeigt die schönsten weißen Blätter. Die ausgelesenen Stücke meiner Sammlung sind wahre Prachtstücke. Die als extraweiß bezeichnete Handelsware (1910 CAESAR & LORETZ) bildet relativ kleine, dünne, weiße, gestreifte Blätter oder gezonte Stücke. Bei Ia weiß sind die Stücke größer, bei Ia gelblich etwas gefärbt und dicker, die Bänder fehlen, gezonte Stücke bilden die Regel. Auch IIa weiß ist noch eine sehr gute Ware. Ia naturell bildet derbe gelbliche, gezonte Stücke oder fächerartige Blätter. IIa naturell ist gelblich gefärbt.
2. Die beste Sorte des anatolischen, türkischen oder Levantiner Traganth, die aber jetzt oft im Handel fehlt, erhält große Blätter. Die als weiß bezeichnete Handelsware (1910, CAESAR & LORETZ) bildet kleine, etwas gefärbte Blätter und gezonte Stücke von nicht sehr schönem Aussehn, noch mehr gefärbt ist die Sorte fein hellblond und blond I. Alle Sorten stehen den entsprechenden syrischen nach. Sie zeigen ein schmutziges Aussehn. Die Stücke sind zertrümmert, was auf unsorgfältigen Transport schließen läßt.
3. Im persischen Traganth des Handels (1910) fehlen die dünnen Blätter ganz. Es besteht selbst bei der Sorte Ia aus ziemlich großen, gelblich gefärbten,[S. 393] derben, dicken, gezonten oder fächerförmigen Stücken, die oft konzentrische Wülste zeigen, und bei der Sorte IIa an der Ansatzstelle Reste der Rinde erkennen lassen.
4. Das griechische oder Morea-Traganth ist jetzt fast gar nicht mehr zu finden. (Er fehlte 1910 in den deutschen Preislisten.) Es repräsentiert im allgemeinen den Typus des Wurm- oder Fadentraganth (Fig. 137). Das beste Moreatraganth meiner Sammlung bildet wurmförmige oder knollige oder traubige Stücke, oder kurze, derbe, fächerartige Blätter. Die schlechteren Sorten sind mehr oder weniger gelb-bräunlich gefärbt, die besseren hellgelb. Das mir kürzlich durch EMMANUEL aus Kreta zugesandte Traganth bildet relativ dicke gelbliche Blätter und knollige Stücke. Es ähnelt den schlechteren Sorten des persischen Traganth. Kreta und Griechenland lieferten 1910 kein Traganth mehr für den Handel (EMMANUEL).

Die Auslese des Traganth (Working traganth) in London.
[Heap in Greenish, Textbook.]
5. Unter Traganthon versteht der Handel die schlechtesten ausgelesenen Stücke, die eine gelbe, rötlichgelbe oder gelbbräunliche Farbe besitzen. In den Mustern meiner Sammlung prävalieren die kugeligen, knolligen, traubigen und wurmförmigen Stücke.
Zu dieser minderwertigen Sorte ist auch das Kuteragummi (auch kurzweg Kutera oder Kutira genannt) zu rechnen, ein aus Nordpersien von A. heratens. und strobiliferus stammendes T. (s. oben) mit deutlichen Membranresten, das früher bald von Acacia leucophloea (TH. MARTIUS), bald von einem Mesembryanthemum (VIREY), bald von einem Cactus (DESVAUX et DAMART) abgeleitet wurde. Kuteragummi löst sich in Wasser unter Druck bei 120° und zeigt dann die Eigenschaften des arabischen Gummi, ist also nach GIRAUD identisch mit dem unlöslichen arabischen Gummi von GÉLIS und dem Cerasin GUÉRINS. Auch das Mosul-Gummi (Moussoli) ist wohl nur ein schlechteres Traganth (HANBURY, nach anderen Pruneengummi).
Zu den echten Traganthen gehört auch, wie die mikroskopische Untersuchung lehrt, das Bombay-Traganth, das in Indien eine Rolle spielt. Die Muster meiner Sammlung bilden gelbliche oder gelbbräunliche, knollenförmige oder traubige oder wurmförmige, im Querschnitte oft rundliche Stücke, Blätter sind selten.
[S. 394]
Unter dem Namen gomme de Sassa (Lassa) und Pseudoadragante beschrieb GUIBOURT (Journ. chim. méd. 1832, 419 und Hist. d. drog. 7 ed. III, 450) zwei nach der mikroskopischen Untersuchung von Traganthsträuchern stammende T., von denen er das eine für identisch hält mit dem Gomme de Sassa von BRUCE (Voyage en Abysinie), von der Pflanze Inga Sassa WILLD., das andere zum Bassoragummi zieht, das er, sowie MÉRAT et LENS (Diction. III, 403, I, 80), als von A. gummifer abstammend ansieht. Beide enthalten viel Stärke. Das in meiner Sammlung als Inga Sassa (?) bezeichnete, aus im Querschnitt runden, langen Fäden oder Stäben bestehende T. ist durch eine feine helle netzleistenartige Zeichnung der Oberfläche ausgezeichnet, die aus Gefäßbündelresten besteht. Es scheint sich hier um den ganzen isolierten verschleimten Markzylinder nebst den umgebenden Resten des Holzkörpers zu handeln, der vielleicht nach Dekapitieren der Stengel herausgequetscht wurde. Auch HANBURY, der die Traganthsträucher am Libanon beobachtete, berichtet, daß, wenn man einen Traganthstrauch dekapitiert, aus dem Marke ein langer Gummifaden hervortrete.
Handel. Es wurden nach Deutschland eingeführt 1905 (1904) Traganth aus Persien 815 (471), aus Arabien 390 (46), Syrien 382 (507), Ägypten 345 (78), Kleinasien 700 (388), Brit. Ostindien 116 (24) dz. (GROSSMANN). Wir ersehen aus dieser Liste nur die Ausfuhr-, nicht die Produktions-Länder. 1909 importierte Deutschland 6148 dz., davon die Hälfte aus der asiat. Türkei, viel auch aus Persien, etwas aus Brit. Indien. Für den Import kommen in Betracht: New York, London, Marseille, Hamburg. Die Einfuhr nach Hamburg betrug 1904: 2618, 1905: 3340, 1906: 4616, 1907: 4747, 1908: 4613, 1909: 4346 dz. Nach Hamburg kommt viel Traganth via London, dann aus Persien, Arabien, Brit. Ostindien, Kleinasien, wenig aus Ägypten, Syrien und der europäischen Türkei. Die Einfuhr von Gum Traganth nach London betrug 1906: 13994, 1907: 13495, 1908: 13225, 1909: 13856 packages (Ballen). Amerika ist ein starker Abnehmer für anatolisches, Rußland für persisches T. Die Einfuhr von Traganth nach Nordamerika betrug 1908: 1309759, 1909: 1315091 pounds.
Traganthmarkt ist für den Export von anatolischem T. Konstantinopel, dann: Smyrna, Mersina, Samsoun. Jetzt geht ⅔ nach Konstantinopel, ⅓ nach Smyrna (1892: 80% nach Konstantinopel, 20% nach Smyrna). T. wird in Kleinasien nach Oka gehandelt (1 Oka = 1283 g). Die Ausfuhr Smyrnas betrug 1874: 4500 cwt (SCHERZER), 1905: 59794, 1906: 44142, 1907: 51310, 1908: 34566 kg. (Im Durchschnitt 4–5000 Sack.) Die anatolische Ernte betrug 1894: 480000 kg, 1908: 475000 kg, 1909 nur 400000 kg, d. h. nur ⅔ des früheren Durchschnitts (GEHE). 1904 und 1905 wurden in Anatolien 400000 Oka geerntet.
Das persische T. gelangt zum Teil via Bagdad über die Häfen des persischen Golfes, ein Teil auch über Ostindien nach Europa. Bagdad empfing 1903: 1496 Kharvar (1902: 1410) Traganth. Nach Rußland wurde via Tâbris (in Nordwestpersien) und Resht (am Caspimeer) etwa ein Drittel dieser Menge exportiert. Persisches Traganth wird meist nach Batman (I, S. 185) gehandelt. Man sortiert in Persien in 5 Qualitäten, davon gelangen die 3 besten zur Ausfuhr (1903). Für persisches (und syrisches) T. bildet jetzt London den Haupthandelsplatz.
Morphologie der Droge. Die Form des Traganth ist abhängig von den Öffnungen, aus denen es austritt: Aus Längseinschnitten tritt das Blättertraganth aus, dessen mehr oder weniger derbe, oft auf weite Strecken hin genau parallel verlaufende Streifung (Fig. 137, 1) von der Konfiguration der Wundränder, an denen es vorbei geschoben wird, bedingt wird, aus Löchern tritt das Traganth in Form von Tropfen, Fäden oder trauben- bzw. wurmförmigen Massen aus. Die Blätter zeigen oft eine eigenartige Zonenbildung. Dementsprechend zeigt das Traganth folgende typische Formen:
1. In ihrem Verlaufe nahezu gleich breite, bei größerer Länge spiralig gedrehte, «gelockte», relativ dünne, aber überall fast gleich dicke Bänder, die parallele Streifung und oft einen wellig verbogenen Rand zeigen (Fig. 137, 1).
2. An den Enden mehr oder weniger breit ausladende gezonte Blätter von verschiedener Dicke mit oft deutlicher, rechtwinklig zu den Zonen verlaufender Streifung (Fig. 137, 2). Die Zonen deuten wohl auf einen durch Wechsel in der Witterung, der Temperatur oder Belichtung hervorgerufenen stoßweisen Austritt.
[S. 395]
3. Fächerförmige Stücke mit deutlichen Zonen und Radialstreifen (Fig. 137, 3).
4. Dicke, wurmförmige, hin und her gebogene, knollige Stücke, mit glatter, unter der Lupe oft rissig erscheinender Oberfläche (Fig. 137, 4).
5. Gekrümmte, mehr oder weniger dicke, im Querschnitt oft rundliche Fäden (Fig. 137, 5).
6. Zu unförmlichen Massen zusammengeschlungene, gelockte oder gekräuselte Fäden und Würmer (Fig. 137, 6).
7. Tropfenartige, meist ovale Stücke von verschiedener Größe, bisweilen zu derben, knolligen Massen vereinigt (Fig. 137, 7).
Die ersten drei Formen bilden das Blättertraganth (adragante en plaques, leaf-gum, flaky-g.) und aus diesem bestehen die besten Sorten. Die Bänder sind oft c. 10–15 mm breit und c. 1 bis 1,5 mm dick. Ihre Länge variiert. Ich besitze in meiner Sammlung 21 cm lange Bänder! Sie sind bald hell und durchsichtig wie Glas, bald weiß, bald gelblich, bald gelb oder gar bräunlich gefärbt. Man unterscheidet daher im Handel: Weißblatt, Blondblatt und Gelbblatt. Weißblatt hat stets ein dünneres Blatt als die beiden anderen und bildet die besten Sorten des Handels.

Formen des Traganth (vgl. den Text). 1 Typus 1, 2 Typus 2, 3 Typus 3, 4 Typus 4, 5 Typus 5, 6 Typus 6, 7 Typus 7.
[Tschirch.]
Die drei weiteren Formen (4–6) bilden das Wurmtraganth (vermicelli, T. vermicularis), Stengeltraganth, Sesam seed und Fadentraganth (adragante en filets), die letzte das Knollentraganth. Diese Formen finden sich nur in minderwertigen Sorten, wie besonders im Traganthon und Skardo (common, sorts).
Bildung und Anatomie. Die Ausscheidung des Traganth wurde zuerst von TOURNEFORT an A. creticus auf dem Ida in Creta studiert (I, S. 907, Fig. 411). Er hält das Traganth für den durch die Hitze im Juni und den folgenden Monaten verdickten Nahrungssaft, der durch Zusammenziehung der Holzfasern herausgepreßt werde. Er, wie OLIVIER, der die Ausscheidung in Persien an A. verus beobachtete, glauben, daß die als Austrittsstellen dienenden Wunden durch Tritte von Tieren hervorgebracht werden. OLIVIER gibt die Zeit der größten Sommerhitze als Zeit des Austretens an. LABILLARDIÈRE beobachtete die Ausscheidung auf dem Libanon an Astragalus[S. 396] gummifer im August, LANDERER an A. aristatus im August und September. Schon in RITTERS Erdkunde findet sich die Angabe, daß bisweilen Einschnitte gemacht werden. LABILLARDIÈRE gibt an, daß auf dem Libanon wolkige Nächte und starker Tau zum Austreten des Gummis nötig sind, daß dasselbe nur während der Nacht und kurze Zeit nach Sonnenaufgang reichlich ausfließt und daß auf den tiefer gelegenen Stellen des Libanon wachsende Sträucher, die zwar starker Tageshitze, aber wenig nächtlicher Feuchtigkeit ausgesetzt sind, nur wenig Traganth liefern. Auch FRAAS hält das Ausfließen für abhängig von der Witterung und meint, daß die größte Ausscheidung erfolgt, wenn auf kalten Regen große Hitze folge. TREVIRANUS spricht von einer gesteigerten Sekretion. Die Ansicht von KÜTZING, daß das Traganth ein Pilz sei, hat dann MOHL, der die Bildung des Traganth durch Untersuchung der Zweige zahlreicher Astragalus-Arten im wesentlichen richtig ermittelte, widerlegt. Er zeigte, daß es einer Vergummung des Markes und den Markstrahlen seine Entstehung verdankt. Er fand die Reste der Wand und die Stärke im Blätter- und Wurmtraganth, weniger im syrischen, der mehr und größere Stärkekörner enthält. WIGAND, WIESNER und ich haben dann die Sache weiter verfolgt. Bereits UNGER setzte übrigens das Traganth in Parallele zu den sekundären Schleimmembranen bei Linum und Cydonia, und schon SCHMIDT sah 1844 Reste von Zellmembranen und Stärkekörner im Traganth. DE CANDOLLE meint, daß das Aufschwellen des T. in Wasser davon herrühre, daß das Gummi «in Zellen eingeschlossen» sei.
Querschnitt durch einen Sproß von Astragalus gummifer. Mark und einige primäre Markstrahlen in voller Gummose, an einer Stelle ist das Traganth ausgetreten. Schh Schleimhöhlen der Rinde.
[Tschirch.]
Querschnitt durch das Mark und den inneren Teil des Holzkörpers von Astragalus gummifer mit Hauptmarkstrahl im Mark. 0–4 die sukzessiven Stadien der Schleimbildung.
[Tschirch, Angew. Anatomie 1888.]
Blättertraganth. Querschnitt in Alkohol unmittelbar nach dem Zufließenlassen von Wasser.
[Tschirch.]
Das Traganth entsteht durch Bildung von Schleimmembranen in den Zellen des Markes und der Markstrahlen der Stammorgane der Traganth liefernden Pflanzen und Zusammenfließen der Zellen zu Schleimmassen, wobei die Mittellamelle entweder erhalten bleibt oder mit zugrunde geht, schließt sich also an die Bildung der Schleimhöhlen bei den Malvaceen, Tiliaceen und Sterculiaceen an. Durchschneidet man einen mehrjährigen Sproß von Astragalus gummifer, so erhält man folgendes Querschnittsbild. Die Rinde ist außerordentlich reich an großen Bastzellgruppen, innerhalb welcher eine nicht eben mächtige Innenrinde (Siebteil) liegt. Der Bastzellpanzer ist schon bei den einjährigen Zweigen so gewaltig, daß er bei weitem den größten Teil der Rinde einnimmt. Der Holzkörper besteht aus sehr zahlreichen Gefäßen, breiten Libriformgruppen und wenig Holzparenchym. Er wird durchzogen von nicht eben sehr zahlreichen, ein- oder zweireihigen Nebenmarkstrahlen und großen und bisweilen bis zehn Zellen breiten Hauptmarkstrahlen, deren Zellen die bekannte Radialstreckung der Markstrahlzellen zeigen. Durch die Markstrahlen wird der Holzkörper in im Querschnitte keilförmige Abschnitte geteilt (Fig. 138). Im Innern liegt das Mark. In diesem findet die Bildung der Schleimmembranen in erster Linie statt. Dieselbe beginnt im Zentrum des Markes und schreitet nach der Peripherie zu fort. So kommt es, daß man schon bei zweijährigen Zweigen alle Stadien der Vergummung nebeneinander zu sehen bekommt (Fig. 139). Die zu[S. 397] äußerst liegenden Markzellen sind noch gänzlich normal. Ihre unverdickten Membranen geben die Zellulosereaktion. Weiter nach innen zu werden die Membranen dicker. Bei den noch tiefer liegenden Schichten ist schon kaum noch das Lumen zu erkennen (vorausgesetzt, daß der Schnitt mit Wasser benetzt war und in Glycerin betrachtet wurde). Das oft verzerrte Lumen läßt häufig noch kleine Stärkekörner erkennen, die nur zum Teil zum Aufbau der Membranen aufgebraucht werden. Die Membran gibt nur noch eine geringe Zellulosereaktion, Schichten sind in ihr oft sehr deutlich zu erkennen. In der einzelnen Zelle schreitet die Vergummung der Wand von außen nach innen fort, so daß man also in den innersten Schichten eine deutliche Zellulosereaktion auch dann noch erhält, wenn die mittleren bzw. äußeren sie nur noch sehr schwach zeigen. Bei den noch tiefer liegenden Schichten ist nur noch die Mittellamelle als zartes Häutchen erkennbar, alles übrige ist vergummt, mit einziger Ausnahme einiger Stärkekörnchen. Ganz im Innern ist alles vergummt, doch sind selbst hier noch die Zellkonturen schwach zwar aber doch erkennbar erhalten. Bei den älteren Zweigen schreitet die Gummose immer weiter zur Peripherie des Markes vor und dringt nun auch in die breiten Hauptmarkstrahlen ein. Auch hier beginnt die Vergummung in den innersten Partien und schreitet gegen den Rand hin fort. Auch die Nebenmarkstrahlen scheinen der Vergummung bisweilen (aber jedenfalls selten) anheimzufallen. Ja selbst im Holzkörper sind bisweilen einige Gefäße nebst ihrer Nachbarschaft in Gummose begriffen und in dickeren Stengeln sah ich auch Gummidrusen in der Rinde (Fig. 138 Sch h). In erster Linie jedoch entsteht das Traganth, wie schon MOHL erkannte, durch eine zentrifugal fortschreitende Metamorphose der Zellmembranen des Markes und der primären Markstrahlen[S. 398] der Stengel. (In der Wurzel scheint das Traganth anders zu entstehen, LUTZ.) Tritt nun die Regenperiode ein, und nimmt die Pflanze reichlich Wasser aus dem Boden auf, so quellen die vergummten Partien stark auf und werden, wenn nun Trockenheit folgt, durch die schmalen, ebenfalls vergummten Hauptmarkstrahlspalten herausgepreßt, die Rinde durchbrechend: sie werden also als breite, senkrecht gestellte Bänder aus der Rinde hervortreten und diese Form besonders dann annehmen, wenn Längseinschnitte gemacht wurden. Ist der Übergang von Feuchtigkeit zur Trockenheit ein allmählicher, so werden die Bänder in langen gekrümmten Streifen hervortreten, ist der Übergang ein plötzlicher, so wird die Schleimmasse in Klumpen herausgedrückt. In beiden Traganthen kann man jedoch, wenn man dünne Querschnitte herstellt, noch deutlich die organische Struktur erkennen: nicht nur die Reste der Zellhäute, sondern ganze Zellen, sowie einzelne oder zu länglichen oder runden Gruppen vereinigte Stärkekörner sind noch, namentlich bei Anwendung von Jodlösung, im Lumen der Zellen gut nachzuweisen (Fig. 140). Die Stärkekörner gehören also den Schleimzellen an und sind nicht aus anderen Geweben beim Herausquellen des Schleims mitgerissen worden. Die wenigste Stärke enthält das kleinasiatische und syrische, schon mehr das persische, am meisten das Moreatraganth, bei dem auch die meisten, zum Teil ziemlich hoch zusammengesetzten, Körner vorkommen. Bei dem persischen Traganth steigt die Größe der Stärkekörner bis auf 20 mik und mehr.
Bei Herbarmaterial von Astragalus brachycalyx FISCH. fand WEYLAND in den Zellen der Markperipherie, der primären Rinde und der Markstrahlen einen festen, durchscheinenden, vom Plasmaschlauch umschlossenen Zellinhalt, der sich mit Jod blau färbte. (War das Material vielleicht erhitzt?)
Die Schichtung der herausgequetschten Schleimzellen ist beim syrischen, anatolischen und persischen Traganth vorzüglich zu sehen, wenn man zu dem in Alkohol liegenden Schnitte durch das Traganth Wasser vorsichtig zufließen läßt, wenig deutlich fand ich sie beim Moreatraganth. Bombaytraganth und Kuteragummi (abgeb. bei WIGAND) zeigen ebenso wie Traganthon auch geschichtete Membranen und Stärkekörner im Lumen. Sie entstehen also auch wie kleinasiatisches.
Eine ähnliche Schleimbildung scheint übrigens bei den Malvaceen Kydia calycina (Rinde) und Bombax malabaricum (Rinde) vorzukommen (Pharmac. indica). Bei Bombax scheint es sich um einen pathologischen Gummifluß zu handeln. Auch das Gummi der indischen Moringacee, Moringa pterygosperma GÄRTN. (gomme de benailé) zeigt typische Schleimzellen mit geschichteter Membran, aber keine Stärke (WIESNER).
In der Regel zeigen die Traganthschleimmassen keine Zellulosereaktion mehr. Doch beobachtete MOHL bei einigen Astragalusarten, die allerdings niemals Traganth liefern, eine vorübergehende Blaufärbung mit Chlorzinkjod. Da sich aber die jungen Schleimmembranen stets mit Chlorzinkjod färben, die alten nicht, so findet also beim Traganth eine Umbildung des Zelluloseschleims in echten Schleim statt, was wir bei den Malvaceenschleimzellen niemals beobachten, bei denen die Schleimmembran sofort als echter Schleim aufgelagert wird.
Lit. TOURNEFORT (vgl. I, S. 907). — OLIVIER, Reise durch d. türk. Reich III, 293. — LABILLARDIÈRE a. a. O. — FRAAS, Synops. plant. flor. class. p. 59. — DE CANDOLLE, Astragalogia 1802. — TREVIRANUS, Physiol. II, 21. — KÜTZING, Philosoph. Botan. I, 203 und Arch. Pharm. 8 (1851), — UNGER, Anatom. u. Phys. d. Pfl. — MOHL, Unters. über d. Entstehungsweise d. Traganthgummi. Botan. Zeit. 1857, 33. — WIGAND, Desorganisat. d. Pflanzenz. Pringsh. Jahrb. f. wiss. Bot. 3 (1861), 115. — WIESNER, Gummi u. Harze 1869 und Rohstoffe. — TSCHIRCH, Angew. Anatomie 213 u. Fig. 214. — SOLMS-LAUBACH, Bot. Zeit. 1874. — WEYLAND[S. 399] bei SOLEREDER, Systemat. Anatomie, S. 301. — FLÜCKIGER-HANBURY, Pharmacograph. — HARTWICH, Artikel Traganth in Realenzykl. d. Pharm. — LUTZ, Sur le mode de formation de la gomme adragante. Compt. rend. 1910, 1184 und Bull. soc. bot. France 57 (1910), 250.
Betrachtet man das Pulver in Alkohol, so sieht man zwischen einer körnigen Masse viele unregelmäßige helle Schollen. Läßt man alsdann Wasser zufließen, so quellen diese auf und lassen, bevor sie undeutlich werden, zunächst oft sehr deutliche Schichtung erkennen (Fig. 140). Tritt dann Jodlösung hinzu, so sieht man zahlreiche einzelne oder zu rundlichen bzw. gestreckten Gruppen vereinigte Stärkekörner zwischen unregelmäßigen Häuten. Die Körner sind meist rundlich, einfach oder zu zwei bis vielen zusammengesetzt, klein, 2–4 mik breit, doch kommen auch größere (bis 25 mik) vor (4–15, WIESNER). KOCH, der auch verquollene sah, fand sie 1–20, meist 6–10 mik breit mit oft auffallender Kernhöhle. Bisweilen fand ich im Traganthpulver auch einige Fragmente der Bastfasern und Gefäße der Traganthpflanze, seltener Rindenparenchymfetzen.
Lit. MOELLER, Pharmakogn. Atlas t. 43. — KOCH, Atlas IV, S. 193, Fig. 16. — KRAEMER, Proc. amer. pharm. assoc. 1898, 306.
Chemie. Über die Chemie des Traganth herrscht keine Klarheit, da es sehr verschiedene Sorten gibt und selten klar gesagt ist, welche untersucht wurde. Daß die einzelnen Sorten chemisch verschieden sind, ist zweifellos, denn die Menge der bei der Hydrolyse auftretenden Produkte ist verschieden (DREYFUS). J. OGLE fand z. B. in syrischem Traganth neben 18,92% Feuchtigkeit 35,94% lösliches «Gummi», das durch Alkohol, bas. und neutrales Bleiacetat fällbar war (nicht durch Borax), und nach dem Kochen mit Salzsäure Fehlingsche Lösung reduzierte, 42,39% «unlösliches Gummi», löslich in Kalilauge und 2,75% Asche. MASING fand in Smyrnaeer Traganth 3,34 (1.84)% Asche, 12,11 (10,91)% Feuchtigkeit und 23,08 (19,14)% lösliche Substanz. GERSTNER in Kutera 14% H2O, 44,6% Bassorin, 27,5–30% lösliches Gummi, 3,2–4% Asche.
Nach WILLIAMS beträgt die Gesamtkaliabsorption 11,05–11,98, das Verseifungsäquivalent 468–508, Kali zur Neutralisation der freien Säure 0,14, Jodabsorption keine bzw. 0,16, Verlust bei 100° 13,52–16,86, Asche 2,64–2,69. Traganthschleim läßt sich mit Ammonsulfat aussalzen (POHL).
Traganth gilt als der typische Vertreter der sog. Bassorin-Gummis, d. h. der mit Wasser nur quellenden, sich nicht darin lösenden. Bassorin gibt mit Salpetersäure 22,5% Schleimsäure (GUÉRIN-VARRY). Es wird mit Alkalien dünnflüssig (FRÉMY). Zuerst GUÉRIN nannte den Schleimstoff des Traganth Bassorin, GUIBOURT Adragantin, PEREIRA nennt den löslichen Teil Tragacanthin oder Adragantin, den unlöslichen Bassorin. Nach GIRAUD enthält Traganth 60% «composé pectique», (Adragantin, Pektose), 8–10% lösliches Gummi, 3% Zellulose, 2–3% Stärke, 3% Asche, c. 20% Wasser und Spuren von stickstoffhaltigen Substanzen. Das Adragantin enthielt 40,6% C, 5,35% H und 53,8% O. Nach GUIBOURT enthält das Traganth weder Arabin noch Bassorin, sondern ist eine organisierte gallertige Materie sui generis. Auch GIRAUD meint, daß Traganth nicht, wie GUÉRIN-VARRY angibt, aus Arabin und Bassorin, sondern hauptsächlich aus einer pektinartigen Substanz (Pektose FRÉMY) bestehe, der 7–10% lösliches Gummi beigemengt ist. Verdünnte Mineralsäuren bilden Glukose und Pektin, Alkalien und alkal. Erden Pektin, Pektinsäure und Metapektinsäure. Alkal. Erden bilden Niederschläge, die bei schwachem Erwärmen hart und eigelb werden (GIRAUDS Nachweis von Traganth). SCHMIDT fand[S. 400] in rohem Traganth 45,63% C und 6% H, in reinem Traganth 45,10–45,33% C und 6,16–6,27% H. Traganth soll der Formel C24H40O20 entsprechen. HILGER und DREYFUS formulieren jedoch: (C11H20O10)n. Sie fanden 42,4% C und 6,5% H. Das das Traganth vorwiegend bildende Polysaccharid nennen auch HILGER und DREYFUS Bassorin. Es reduziert weder SOLDAINIS Reagens noch FEHLINGsche Lösung, wohl aber ammoniakalische Silberlösung beim Kochen. Kalte 30–40% Alkalilauge führt das Bassorin in Oxybassorin: (C11H20O10)2O über, welches rechts dreht, SOLDAINIS Reagens und FEHLINGsche Lösung reduziert und mit den Metallen unlösliche Verbindungen bildet. Wird T. in Stücken mit kaltem Wasser maceriert, so erhält man bisweilen ein Filtrat, in dem Alkohol, in geringer Menge zugesetzt, weiße Flocken abscheidet (MAISCH). Auch Bleizucker scheidet zunächst eine Gallerte ab, erst später entsteht ein Niederschlag. Die Ansicht, daß der lösliche Teil des Traganths Arabin bzw. Arabinsäure sei (SANDERSLEBEN), ist nicht richtig (FRÉMY, POHL). T. enthält kein Arabin (DREYFUS). Es ist neutral und wird durch Borax, Eisenchlorid und Wasserglas nicht gefällt. Bleiessig und Bleiacetat geben eine Gallerte, die beim Erwärmen sich trübt und dann einen Niederschlag bildet. Mit Salpetersäure gibt Traganth Oxalsäure, Weinsäure, Zuckersäure und besonders Schleimsäure (GIRAUD). Die Menge der erhaltenen Schleimsäure wechselt. TOLLENS erhielt nur sehr kleine Mengen, DREYFUS 11,5–17%, GIRAUD 20%.
Die Hydrolyse lieferte GIRAUD (1876) einen reduzierenden Zucker. Auch SCHMIDT erhielt bei der Hydrolyse gärungsfähigen Zucker und ein Gummi, das mit dem aus Salep identisch war. Nach SANDERSLEBEN ensteht neben viel Sirup kristallisierbare Arabinose. Bei der Hydrolyse verschiedener Traganthsorten erhielten in neuerer Zeit WIDTSOË und TOLLENS Pentosen, aus einigen Sorten Arabinose, aus anderen Xylose, aus allen Fukose (Methylpentose, s. S. 299) und (in geringer Menge) Glukose und (wechselnde Mengen) Galaktose. Einige Traganthsorten enthalten 38,1–51,8% Xylan (TOLLENS und WIDTSOË). Möglicherweise bildet also entweder ein Galakto-Xylan oder ein Galakto-Araban den wichtigsten Bestandteil der Traganthe, denn das Traganth enthält (s. oben) auch oft beträchtliche Mengen eines bei der Oxydation Schleimsäure liefernden Bestandteils (GUÉRIN-VARRY, OGLE, POHL) — der Galaktosegehalt beträgt oft 15–21,5% (DREYFUS). Die Hydrolyse gewisser Traganthsorten soll ähnlich wie beim Gummi arabic. (s. d.) verlaufen. Als Hauptprodukt der Hydrolyse des wasserlöslichen Anteils entsteht zunächst eine linksdrehende Polyaraban-Trigalaktan-Geddinsäure (11 C10H16O8.3 C12H20O10.C23H36O20.H2O), die bei weiterer Hydrolyse 72% Arabinose und etwas Galaktose liefert (O’SULLIVAN). Das Bassorin einiger Tragantharten gibt mit überschüssigem Alkali die α- und β-Traganthan-Xylan-Bassorinsäure. Die α-Säure (C24H34O20.H2O) ist in kaltem Wasser löslich, dreht rechts (αD = +138,6°) und zerfällt bei der Hydrolyse mit verd. Schwefelsäure in Traganthose (eine linksdrehende Pentose, Fukose?) und Xylan-Bassorinsäure: C19H28O17, die fast unlöslich in kaltem Wasser ist, rechts dreht und bei weiterer Hydrolyse in Xylose und Bassorinsäure (C16H20O13) zerfällt, eine Substanz, die in kaltem Wasser unlöslich ist und in alkalischer Lösung stark rechts dreht (αD = +225°). Die in kaltem Wasser nicht lösliche β-Säure gibt ähnliche Hydrolysierungsprodukte (O’SULLIVAN).
Ich kann aus den Publikationen meist nicht klar ersehen, ob besonders die in allen Traganthen enthaltene Stärke, die primären Zellulosemembranen und die übrigen Beimengungen vor der Untersuchung des Schleims abgetrennt worden waren.[S. 401] Meist scheint dies nicht geschehen zu sein. Denn Traganth enthält ja auch Stärke (c. 3% DREYFUS, 2,3% GIRAUD, aber in einigen Sorten viel mehr, TSCHIRCH), Zellulose (die Reste der primären Membran, c. 4%), kleine Mengen stickstoffhaltiger Körper (TSCHIRCH), Dextrin und Invertzucker, sowie etwas Chlorkalium (DREYFUS). Die Stärkemenge im Traganth ist gering. Filtriert man daher einen kalt bereiteten Traganthschleim nach Verdünnung mit Wasser, so färbt sich der Filterrückstand mit Jod nicht schwarzblau, da die Stärkekörnchen in große Mengen unlöslichen Schleim eingebettet sind (doch sieht man bei Betrachtung mit dem Mikroskop die schwarzblau gefärbten Körnchen). Besser gelingt die Jodprobe, wenn man zu dem Traganthschleim direkt Jod zusetzt. Die suspendierten Teilchen färben sich alsdann blaugrau und nach dem Filtrieren erhält man einen blaugrauen Rückstand auf dem Filter und ein farbloses Filtrat. Die meisten Traganthsorten werden durch Natronlauge nicht in der Kälte, sondern erst bei gelindem Erwärmen gelb. Der diese Färbung bedingende Körper ist nicht derselbe, der die geringeren Sorten gelb färbt; denn auch, wenn man diesen mit 91% Alkohol entfernt, tritt trotzdem die Gelbfärbung mit NaOH ein (REUTER). Durch Alkohol wird den schlechtesten gelben Sorten ein Substanzgemenge entzogen, das ein Fett, einen Bitterstoff und einen Zucker enthält (REUTER). Wurmtraganth liefert nach LUDWIG 4,234% weingeistiges Extrakt (mit Spuren Zucker), Blättertraganth 1,557% (zuckerfrei). T. gibt beim Erhitzen mit KOH die Pyrrolreaktion (Rotfärbung des mit HCl befeuchteten Fichtenspans) und die Dämpfe färben Lackmus blau, gibt aber nicht die Oxydasereaktion (TSCHIRCH und STEVENS), enthält also im Gegensatz zu den Gummis und entsprechend seiner ganz anderen Bildungsweise keine Oxydase. Guajakharzlösung wird direkt auch nach 3 Stunden nicht gebläut (erst nach 10 Stunden tritt geringe Bläuung ein, RUNNE).
LUDWIG gibt den Wassergehalt auf 16,2% (Blättertraganth) bis 16,5% (Wurmtraganth), HILGER und DREYFUS auf 9,42–15,4%, PETERS (im feinem Pulver) zu 13,7–14,98%, WIESNER zu 11–17% an. Nach HILGER und DREYFUS soll die Farbe der verschiedenen Sorten wesentlich durch verschiedenen Wassergehalt bedingt sein (?) und die wasserreichsten besten Sorten auch die meiste Asche enthalten. Fadentraganth enthielt 3,1–3,57% Asche (LÖWENTHAL und HAUSMANN, HILGER und DREYFUS). In anderen Sorten wurde gefunden 3,16% (FLÜCKIGER), 2,89–2,95% (RÖDER), 2,68–2,85% (DREYFUS), 2,42–2,57% (PETERS), 1,75% (SCHMIDT) (s. auch oben), obere Grenze 3,5% (Pharm. helv. IV). In der Asche findet sich mehr Kalk als in der aller anderen Gummis: 76,3% CaCO3, aber relativ wenig Kali (11,9% K2CO3) und Magnesia (8,89% MgCO3), sowie 4,74% Calciumphosphat (RIDEAL und YOULE).
Lit. VAUQUELIN, Ann. de chim. 54, 312. Bull. d. pharm. 3, 56. — BUCHOLZ in GMELINS Handb. II, 779. — GUÉRIN-VARRY, Ann. chim. phys. (2) 49 (1832) 248 und 51, 522 und Journ. chim. méd. 7, 742. — FRÉMY, Journ. pharm. (3) 37, 81. Jahresb. d. Chem. 1860, 504. — H. LUDWIG, Pharmakogn. Beitr. (Gummi) Arch. Pharm. 132 (1855), 33. — FRANK, Chem. Centralbl. 1865, 902. — HERMANN in PEREIRAS Handbuch. — GIRAUD, Etud. comp. d. gommes et d. mucilages. Journ. pharm. chim. 1875, 485, 1876, 462. Compt. rend. 80, 477 u. l’Union pharm. 16, 249. — POHL, Zeitschr. phys. Chem. 14, 156. — V. SANDERSLEBEN in SACHSSES Phytochem. Unters. 1880. — SCHMIDT, Über Pflanzenschleim und Bassorin. Lieb. Ann. 51, 29. — GERSTNER in VALENTA, Klebe- u. Verdickungsm. 1884. — WILLIAMS, Chem. News 1888, 224. — OGLE, Pharm. Journ. 20, 1889, 3, Chem. Zeit. 13, R. 224, Arch. Ph. 1889, 905. — O’SULLIVAN, Proc. Chem. Soc. 17(1901), 156 (Chem. Zeit. 25, 569, Chem. Drugg. 1901). — MAISCH, Am. journ. pharm. 1889, 72. — TOLLENS und WIDTSOË, Ber. d. chem. Ges. 33,[S. 402] 132. — HILGER, Naturforschervers. München 1899. — HILGER und DREYFUS, Ber. d. d. chem. Ges. 33 (1900). — DREYFUS, Dissert. München 1900. — L. REUTER, Apoth. Zeit. 1890, 644. — TSCHIRCH, Gummasen. Pharm. Centralb. 1905, 504. — Aschenanalysen: RIDEAL und YOULE, Chem. Drugg. 1891, 788. — PHIL. RÖDER, Pharm. Post 1906, 298. — PETERS, Apoth. Zeit. 1909, S. 538. — LÖWENTHAL und HAUSMANN, Lieb. Ann. 89, 112. — LA WALL, Amer. journ. pharm. 1897, 141. — Asche, Löslichkeit, Wassergehalt: E. MASING, Vgl. Unters. d. wichtigst. Handelss. d. Traganth u. sein. Surrogate. Arch. Ph. 1880, 41.
Physikalische Eigenschaften. Traganth zeigt Doppelbrechung (WIESNER). Im Polarisationsmikroskop treten bei gekreuzten Nikols Polarisationsfarben hervor. Die Frage, ob diese Anisotropie auf Zusammensetzung der Substanz aus anisotropen Micellen beruht (SCHWENDENER), oder durch Zug und Druck zustande kommt (V. EBNER, WIESNER), wird von AMBRONN im erstgenannten Sinne beantwortet. «Die optischen Eigenschaften des Traganth im gequollenen Zustande sind auf das Vorhandensein optisch und räumlich anisotroper Micellen zurückzuführen», sagt AMBRONN, doch beobachtete EBNER, daß trockenes Traganth sich wie Glas verhält, d. h. durch Zug positiv, durch Druck negativ doppelbrechend wird; umgekehrt verhält sich gequollenes Traganth. Bei trockenen Traganthfäden ist das Elastizitätsellipsoid quergestellt (SCHWENDENER).
Das spez. Gew. des Traganth beträgt 1,384 (Watts Dict. und Enc. britt.). Es ist schwer genau zu bestimmen, da wenigstens die Blätter oft Luft einschließen.
Mit Wasser übergossen quillt Traganth stark auf; gepulvert liefert es mit dem 50fachen Wasser einen trüben schlüpfrigen, geschmack- und geruchlosen Schleim. Mit dem 200fachen Wasser häufig geschüttelt, zerfällt Traganth erst nach Wochen zu einem gleichmäßigen, trüben Schleim, der sich nur sehr langsam klärt (FLÜCKIGER). POHL hält den Traganth für löslich in Wasser, allerdings für sehr schwer löslich (1 : 1000). DREYFUS fand dagegen in Fadentraganth nur 0,06% wasserlösliche Bestandteile, FLÜCKIGER erhielt 0,47, MAIDEN 7,7, GIRAUD 8,10%; andere Sorten scheinen aber bis 50% und mehr (BUCHOLZ, GUÉRIN-VARRY) Lösliches zu enthalten. Traganth verhält sich im allgemeinen wie ein Kolloid. Traganthlösung gibt keinen osmotischen Druck, aber es konnte nur eine sehr verdünnte Lösung benutzt werden (MOOR und ROW). Eine «Lösung» des Traganth 1 : 1000 läßt sich filtrieren. Der wasserlösliche Anteil des Traganth zeigte FLÜCKIGER im Polarisationsapparat keine Drehung. Die unter Zusatz von Ammoniak, das die Löslichkeit erhöht, hergestellte Lösung (FLÜCKIGER) des Traganth drehte rechts. In Chloralhydrat löst sich Traganth, aber es bleibt eine wolkige Trübung in der Flüssigkeit, die wohl von den Zellulosehäuten herrührt (WIESNER). Die schön gelb gefärbte Lösung in verdünntem KOH bleibt auch nach Zusatz einer Säure klar, erst auf Zusatz von Alkohol entsteht eine Fällung. Diese besitzt keine sauren Eigenschaften. Traganth bleibt auf 100° erwärmt hell und zeigt auch dann keine Risse.
Traganth ist weicher als Akazien- und Kirschgummi, zähe und hornartig, schneidbar. Der Bruch ist eben. Die helle weiße Farbe der besten Sorten wird besonders durch reichlich eingeschlossene Luft bedingt. Die luftarmen Sorten erscheinen glänzend und gefärbt, die hellen matt. Traganth ist stets geruchlos.
Lit. WIESNER, Gummi u. Harze 1869 und Rohstoffe. — SCHWENDENER, Sitzungsb. d. Berl. Akad. 1889 u. 1890. — V. EBNER, Unters. über d. Urs. d. Anisotropie organ. Subst. 1882 u. Sitzungsber. d. Wien. Akad. 1888. — AMBRONN, Ber. d. d. Bot. Ges. 7 (1889), 103. — MOOR and ROW, Bioch. journ. 2, 34. — POHL a. a. O. — DREYFUS a. a. O.
Verfälschungen. Die guten Traganthsorten sind leicht kenntlich und mit nichts anderem zu verwechseln. Bei den schlechteren kommen Vermischungen oder Substitutionen[S. 403] mit falschen Traganthen und (s. d.) und anderen Gummis vor; die von KLENKE erwähnten, aus Mehl, Brot oder Kleister und Gummi geformten «künstlichen» Traganthe habe ich nicht gesehen. Der «Traganthersatz» von CARL BOSCHAN besteht aus: Stärke 20, Leim 6, Glyzerin 2, mit Wasser erhitzt. Neuerdings (1909) wurde T. mit indischem Gummi von Sterculia urens ROXB. und Cochlospermum Gossypium DC. verfälscht gefunden (SCOVILLE). Traganth muß geruch- und geschmacklos sein. (1905 [FRANCIS] und 1907 [STOEPEL] waren bittere in Handel). Das Bombaxgummi ist adstringierend. Mit Gummi arabic. vermischtes Traganth gibt dünnere Schleime als reines Traganth in entsprechender Konzentration (WHITE).
Die Unterschiede zwischen Sterculiagummi und echtem T. beschrieb MAIDEN: Mit kaltem Wasser bleibt Sterculiagummi farblos und bildet eine körnige Gallerte, wenig oder gar nicht klebrig, Traganth opaleszierend, weiche, zähe klebrige Masse. Beim Kochen in verdünntem Alkali ist Sterculiagummi unlöslich. Traganth löst sich fast ganz. Bei Behandlung mit Natronhydrat und Erwärmen zeigt Sterculiagummi keine Farbenänderung. Traganth bekommt eine kanariengelbe Farbe, die beim Abkühlen verblaßt. Beim Kochen mit verdünnter Säure ist Sterculiagummi löslich, bildet Arabin; Traganth löslich, bildet Pektin (GIRAUD). Fügt man obiger Flüssigkeit Alkohol hinzu, so bildet Sterculiagummi einen weißen Niederschlag, Traganth eine eiweißähnliche Masse. Das spez. Gew. beträgt bei dem Sterculiagummi über 1,4, der Aschengehalt ist ziemlich hoch: 5,83% (St. urens), 7,8% (St. Tragac.), 8,19% (St. diversifol.), 9% (St. rupestris). Stärke enthalten die Sterculiagummis nicht.
HANBURY beobachtete 1855 Bleiweiß als «Schönungsmittel» von Traganth. Auch KICK und GINTL berichten bei minderwertigen Sorten von «Bestreichen mit Bleiwasser», um die gefärbten Sorten den weißen ähnlicher zu machen (?).
Im Pulver ist fremde Stärke (Mais- und Weizenstärke, 1906 OHLIGER), getrockneter und gemahlener Stärkekleister (KICK und GINTL), Dextrin (1905 in Amerika) und Gummi arabicum beobachtet worden. Fremde Stärke und Stärkekleister sind durch das Mikroskop leicht nachzuweisen, ebenso Dextrin (vgl. S. 200, Fig. 73). Die Schollen von etwa beigemengtem Gummi arabicum lösen sich rasch in Wasser. CAESAR und LORETZ (Jahresber. 1910, 121) weisen beigemengtes Gummi arabicum durch die Oxydasereaktion des letzteren (mit Guajacol-Wasserstoffperoxyd) nach. Die Methode rührt von PAYET her. Es ist aber eine seit langem bekannte Erscheinung, dass Guajacharz und Guajactinktur wohl durch (mit kaltem Wasser bereiteten) Gummischleim, nicht aber durch Traganthschleim gebläut wird (BERG, Pharmakogn. 1869) und die Guajactinktur ist schon von PLANCHE zur Unterscheidung der beiden empfohlen worden. Auch RUNNE bezeichnet sie als das geeigneteste Reagens zum Nachweise von Gummi arab. im Traganth. Weniger eignen sich Benzidin-Wasserstoffperoxyd-Essigsäure und α-Naphthylamin. Auch der Umstand, daß Gummi arabicum mit Pyrogallol Purpurogallol liefert, Traganth nicht, ist zur Erkennung eines Gummizusatzes benutzt worden (FLÜCKIGER). Traganth bräunt sich nur mit Pyrogallol. Indisches Gummi (s. oben), das auch im Pulver beobachtet wurde (1909), läßt sich folgendermaßen nachweisen. Setzt man zu einem Schleime (2 auf 100) 2,0 Borax und läßt über Nacht stehen, so wird die Mischung nach 24 Stunden klebrig und fadenziehend, wenn mehr als 5% indisches Gummi beigemischt wurde (SCOVILLE). 2,0 Traganth geben, wenn rein, mit 5,0 Wasser einen Teig, der beim Drücken nur wenig an den Fingern klebt (HAGER) und der FEHLINGsche Lösung nicht merklich reduziert.
Lit. SCOVILLE, Pharm. Journ. 28 (1909), 493. — STOEPEL, Apoth. Zeit. 1907, 1064. — FRANCIS, Bull. Pharm. Detroit 1905. — WHITE, Pharm. Journ. 1905, 133. — PAYET, Rep. de Pharm. 1904, 301 (Ann. chim. anal. 1905). — RUNNE, Z. Prüfung des Traganths. Apoth. Zeit.[S. 404] 1909, 389. — OHLIGER, Proc. Michig. Pharm. Assoc. 1906, 48 und PEINT, Oil and Drug. Rep. 1905. — MAIDEN, Amer. journ. pharm. 1890. — KICK und GINTL, Techn. Wörterbuch IX (1888), 567. — FLÜCKIGER, Pharmakogn. — WIESNER, Rohstoffe. — HANBURY, Science papers, p. 117.
Anwendung. In der Pharmazie spielen jetzt (1910) die besten syrischen und persischen Sorten die Hauptrolle. Die schlechteren anatolischen Sorten werden besonders für technische Zwecke benutzt (CAESAR und LORETZ). Traganth dient als Bindemittel bei Herstellung von Pillen, Stäbchen, Pastillen, Dragées, Räucherkerzen, Sprengkohle. (Mit Traganth angestoßene Pillen werden rasch steinhart, wenn nicht Glycerin zugesetzt wurde.) Dann als Stypticum (als Klystier), zu Ungt. glycerini, zu Emulsionen als Ersatz des Gummis. (1 Teil Traganth besitzt die Bindekraft von 12 bis 15 Teilen Gummi arabicum.) BÖHM empfahl (1850) für den Schleim ein Gemisch von Traganth und Zucker. Man kann unlösliche Pulver mit Traganth in Suspension halten. Traganth wird auch zur Appretur von Kattunen, Seidenwaren und Spitzen, zur Herstellung von Dampffarben im Zeugdruck und in der Zuckerbäckerei verwendet. Es klebt nicht, bindet aber, wenn eingetrocknet, stark. Es läßt sich schwer pulvern, am besten, nachdem es zuvor bei 40–60° getrocknet ist. Man bewahrt Traganth am besten in mit weißem Papier ausgeklebten Holzkästen mit dicht schließenden Deckeln auf. Es zieht leicht Staub an und wird dann grau.
Manna liefert außer den S. 136 genannten Astragalusarten auch A. chartostegius B. et H. Ob Kunjudy-Gummi, Ansarut, Gujar und Sarcocolla von Astragalusarten kommen, ist noch unsicher (Sarcocolla wird auch von Panaea mucronata abgeleitet). Die Samen einiger Astragalusarten (A. baeticus L. — schwedischer Kontinentalkaffee, Stragel-K., A. excapus im Kanton Wallis, HARTWICH) dienen als Kaffeesurrogate. Die Blätter und Samen von A. glycyphyllos L. (Herb. et semen Glycyrrhizae silvestris) sind als Diureticum und Purgans in Anwendung (PLANCHON). Weitere in DRAGENDORFF, Heilpflanzen.
Geschichte. Die τραγάκανθα des THEOPHRAST [nach SPRENGEL, SIBTHORP und FRAAS = Astragalus aristatus L’HÉRIT und A. creticus LMK. (A. echinoides WILLD.)] wird als nicht nur auf Kreta, sondern auch in Achaia, dem Peloponnes und in Asien (Medien) vorkommend beschrieben — «truncis ramisque inhaerent lacrimae». Der Austritt des Gummis soll spontan erfolgen. Astragalus ist bei THEOPHRAST und and. eine andere, (nach KOCH) nicht bestimmbare Pflanze. Der Astragalus des GALEN soll A. excapus oder Orobus sessilifolius gewesen sein. Bei DIOSKURIDES (III, 20), der ja in Kleinasien lebte, bedeutet τραγάκανθα sowohl die Wurzel der dornigen Astragalussträucher wie das Gummi-Traganth. Er vergleicht die klebende Kraft des letzteren mit dem Gummi und nennt einige Krankheiten, bei denen es benutzt wird (z. B. Husten). Er beschreibt die Pflanze korrekt. Unklar drückt sich PLINIUS (XIII, 36) über Tragion und Tragacanthe aus. Die Pflanze nennt er Spina alta. Bei CELSUS (I, S. 588) steht Tragacantha, ebenso bei ORIBASIUS, AËTIUS und PAULUS AEGINETA. Bei VEGETIUS RENATUS (c. 400 n. Chr.) steht dragantum. Auch ISTACHRI (I, S. 606) und CONSTANTINUS AFRIKANUS (I, S. 633) kennen T. Ebenso hat GALEN: tragacantha (die Pflanze: δάκρυον), SCRIBONIUS LARGUS unterscheidet die Präparate tragacanthum album (mit Alaun abgeriebener T.) und candidum. Tracantha steht im Kitâb aš-šaǧar (X. Jahrh.), bei MASIH, IBN SINA u. and. HAJI ZEIN (1368) beschreibt den Gebrauch des Katira, das Gummi des katád genannten Baumes. Der Perser BURHÁN nennt den arabischen Namen für den Baum: miswák el abbas. Der Autor des Makhzan el Adwija erwähnt den persischen Namen kon. Die Gelehrten der Schule von Salerno bereiteten ein Diatrugacanthum frigidum und ein D. calidum. «An einer Stelle der sog. Bible des GUIOT VON PROVINS, wo dieser Dichter seine Satyre ausgießt über die teuren Arzneien, welche die Ärzte von Montpellier verschreiben, ist auch ein Trank des Namens diadragum erwähnt» (HEYD), Diadragagantum wurde als kühlendes Mittel verwendet. Im Mittelalter wurde T. auch bei der Auftragung des Azurblaus und der Vergoldung benutzt (HEYD). 1305 war T. zollpflichtiger Einfuhrartikel in Pisa (FLÜCKIGER). Zur Zeit des PEGOLOTTI (I, S. 702) kam Draganti (chitirra) von Romania (Griechenland) und Turchia (Kleinasien). Hauptmarkt war Satalia (in Pisidien, das heutige Adalia[S. 405] an der Südküste Kleinasiens), dann auch Cypern und Alexandrien (HEYD). BELON (I, S. 771) erwähnt die gleichen Gegenden und Brussa als Markt. Er wurde verwendet «pour donner lustre à la soye». OLIVIER fügt noch Armenien, Kurdistan und Nordpersien als Produktionsländer hinzu. AITCHISON erwähnt dann noch Chorassan und Afghanistan. Persisches T. ging schon Ende des XVIII. Jahrh. nach Bagdad und Bassora und nach Rußland über Baku. In Deutschland begegnen wir 1340 draganti als Bestandteil einer Augensalbe (FLÜCKIGER nach PFEIFFER). Im Inventaire LEFORT (1439) steht Pouldre de Diadragan und Diadragant (Electuar. Diatragacanthum). Dann findet sich T. auch in der Taxe von Ferrara (1424) und der Frankfurter Liste (1450). BELON (I, S. 772) traf 1550 auf Kreta zwei Arten Traganthsträucher, erfuhr aber, daß T. in Nordwest-Kleinasien gesammelt und zur Appretur der Seide benutzt werde (vgl. bei FLÜCKIGER). Die Form Dragagantum steht bei OTHO CREMONENSIS (dragantum i. e. vitriolum!) Traganthum neben Dragagantum bei CORDUS (I, S. 803). The rates of marchandizes (1635, I, S. 921) führt Gum Tragagant auf und gum Tragacanthum steht bei BERLU 1724 (I, S. 950). Die erste Beschreibung des Austrittes des T. gab TOURNEFORT (I, S. 907, Fig. 411). Die erste Beschreibung einer Traganthpflanze LABILLARDIÈRE 1790 (oben S. 389). Bei POMET (I, S. 942), der in der 2. Aufl. auch Stalie (Satalia) als Ausfuhrhafen angibt, findet sich eine recht gute Abbildung eines Traganthstrauches. POMET erwähnt Einschnitte in Stamm und Wurzel und bemerkt, daß die Pflanze in Syrien (um Aleppo) wachse. Er erwähnt vom gomme adragan die drei noch heute üblichen, besonders durch ihre Farbe unterschiedenen Handelssorten. St. F. GEOFFROY (I, S. 947), der eine pyrochemische Analyse mitteilt, bemerkt: «ex Creta, Asia et Graecia affertur».
Die von BRIQUET behauptete Traganth- und Harz- und kombinierte Traganth-Harz-Leimung des alten Papiers, welcher der Leimung mit Tierleim vorangegangen sein sollte, konnte von WIESNER in keinem Falle konstatiert werden. Doch fand KOBERT Traganth in der Appretur frühmittelalterlicher Papiere aus Turfan und Khotan.
Lit. FLÜCKIGER, Pharmakogn. — FLÜCKIGER-HANBURY, Pharmacographia. — HEYD, Levantehandel II, 654. — WIESNER, Papyr. Rainer 1887. — KOBERT, Zeitschr. Angew. Chem. 1910, 1249. — TRISTAM, Nat. hist. of the bible 1898.
Falsche Traganthe.
Das sog. Bassoragummi (Bassoratraganth) hat seinen Namen von der Handelsstadt Bassora (Basra) am Schat el arab, nördlich vom persischen Golf (vgl. die Karte S. 429) erhalten. Es kommt aber nicht viel von dort. (Basra exportierte 1905: 7679 cwts «Gummi».) Jetzt heißen alle minderwertigen, meist stark gefärbten Traganthe in Indien Bassoragummi, Hog-gum, Hog-Traganth oder Caramaniagummi. Die Herkunft des Bassoragummi ist unbekannt. Einige (NIEMANN, MARTIUS) leiten es von Acacia leucophloea WILLD. ab, andere (HANBURY) betrachten es als ein Mandel- oder Pflaumengummi, andere als von A. gummifer stammend (GUIBOURT). Ein Bassoragum, das 1903 aus Südpersien in den Handel kam, stammte vom wilden Mandelbaum. Von einem Traganthstrauch stammt es nicht; jedenfalls zeigen die Muster meiner Sammlung keinerlei geschichtete Membranen oder Stärkekörner — zwei sichere Merkmale echter Traganthe. Das Bassora-Traganth meiner Sammlung bildet knollige oder traubige Stücke von rötlich-gelber Farbe, unter denen sich oft große eiförmige Stücke finden, die als Tropfen aus runder Öffnung hervorgequetscht wurden. GUIBOURT betrachtet das Bassoragummi als identisch mit dem Kuteera (Hist. d. drog. 7 ed. III, 453, Pharm. Journ. 15, 57), rechnet es also zu den Astragalus-Traganthen (s. oben S. 393). Da er darin Stärke fand, muß er ein anderes Produkt in Händen gehabt haben wie ich. Es gehen eben unter dem Namen Bassoragummi sehr verschiedene Produkte. Über ein Bassoragummi aus Cycadeen vgl. BLACKETT, Pharm. Journ. (3) 13, 104. In Indien werden als Substituentien für Traganth die zum Teil ähnlichen Sekrete von Cochlospermum Gossypium DC. = kúmbi, gaddi (in Amerika Gum-Hogg) und Sterculia urens ROXB. = guhu, gular, kurí, sowie von Prunus Amygdalus (sog. Hog Tragacanth) benutzt. Ferner nennt Diction. of econom. prod. of India folgende andere Hog-gums (India Bassora gums): Der Gummi von Saccopetalum tomentosum, Moringa pterygosperma, Bombax malabaricum, Ailanthus excelsa, Stereospermum suaveolens und als amerikanisches Gum-hog das von Symphonia globulifera. Vgl. auch M. C. COOKE, the gums, resins, oleo-resins and resinous prod. in the India museum. London 1874. LEMELAND fand im G. von Cochlospermum Gossyp. 97,3% Unlösliches, 22,7% Wasser, 5,9% Asche, 45,2% Galaktane, 33,3% Pentosane. Es lieferte Galaktose und drehte −77°, 152.
[S. 406]
Besonders Sterculiagummis sind häufig mit dem Namen Traganth bezeichnet worden. Sie riechen oft sauer (Essigsäure?). Über diese von Sterculiaarten stammende traganthähnlichen Gummis aus Indien, Afrika und Australien und ihre Unterscheidung von echtem T. (s. S. 403) vgl. besonders MAIDEN, Sterculia gum its similarities and dissimilarities to Tragacanth (Pharm. Journ. 1889 Nov. p. 381 und Am. journ. pharm. 1890, 20). MAIDEN erwähnt von indischen Sterculiaarten, die Gummi liefern, St. urens ROXB., St. campanulata WALL., St. ornata WALL., St. foetida L., St. villosa ROXB., St. ramosa und piperifolia, von afrikanischen St. Barteri MAST., St. Tragacantha LINDL. — von australischen St. diversifolia G. DON., St. rupestris BENTH. Das Sierra-Leone Traganth von der in Westafrika (Senegambien bis zum Congo) heimischen Sterculia Tragacantha LINDL. (und wohl auch von St. Barteri MAST.) enthält keine Stärkekörner, und zeigt auch keine geschichteten Membranen, dagegen 20,5% Feuchtigkeit und 7,8% Asche (besonders Calciumkarbonat). Es gibt an Wasser keine durch Bleizucker oder Alkohol fällbare Substanz ab, liefert aber mit Salpetersäure reichlich Schleimsäure. Es löst sich nicht in Kupferoxydammon. (FLÜCKIGER, Über afrikan. Traganth. Pharm. Journ. 1869, 641 und Arch. Pharm. 1869, 81). Es entspricht der Formel C24H44O22.10 H2O (KRAUSHAAR). Das T. von Sterculia Tragacantha LINDL. meiner Sammlung (Leg. Barker, Nigerexpedition) bildet an Rindenstücken ansitzende spröde, glasige, hell-gelbliche oder weiße Massen, die sauer riechen. Ein anderes Muster (1872, auch aus Westafrika) schokoladenbraune feste Massen. MANGIN leitet auch das Kuteragummi (s. oben) von St. Tragac. ab (Compt. rend. 125 [1897], 725). Ein traganthähnliches Gummi aus Ostafrika beschreibt HARTWICH (Arch. Pharm. 1894, 43). Es war dem Kuteragummi ähnlich und stammte wohl von einer Sterculiacee, die ja große Schleimzellen mit Schleimmembran und durch Resorption der trennenden primären Membran Schleimkanäle und Schleimhöhlen besitzen. Ein traganthähnliches, im Senegal viel benutztes, dem Gummi von Cochlospermum ähnliches stärkefreies Gummi vom Spez. Gew. 1,416 kommt von Sterculia tomentosa HECKEL. Es heißt im Sudan und in Senegambien Gomme de M’beppe, kongosita, komikosita, M’boborg; in Port. Loanda chixé oder Ici io chixé (HECKEL, Rep. pharm. 1899). Gummis von Sterculia cinerea (tartar gum) und St. tomentosa (da or kandi gum) sind kürzlich im 3 Report of the Wellkome Research laboratories Khartoum (1908) beschrieben worden. Auch sie zeigten einen hohen Aschengehalt (5,48–7,05%) und eine hohe Säurezahl (13–14,59). Auch unter den Kuteeras (s. oben S. 393) scheinen sich bisweilen Sterculiagummis zu finden, denn BOULLAY (Bull. de pharm. 5, 166) und GUIBOURT (Hist. d. drog.) berichten von einem sauren Geruche. Ein traganthähnliches Gummi, Goma de oaxixa aus Brasilien, von Sterculia Chicha St. Hil. erwähnt PECKOLT (Ber. d. pharm. Ges. 1900). Bei den Sterculiaceen ist Gummibildung überhaupt häufig. Ich erinnere nur an die Schleimzellen in der Samenschale von Theobroma Cacao.
Eines Traganth von der im Trockenwald Ostafrikas vorkommenden Leguminose Berlinia Eminii TAUB. gedenkt BUSSE (Ber. d. pharm. Ges. 1904, 202).
Auch das Gummi von Acacia usambarensis ist traganthartig (MANNICH). Weitere unter Gummi arabic. Ein traganthähnliches Gummi aus Südamerika, «Goma de Tuna» von Opuntia Ficus indica MILL. beschrieb T. F. HANAUSEK (Zeitschr. d. Österr. Apoth. Ver. 1877, 113). Es enthält Kristalle und Stärkekörner.
Gummi arabicum.
Syn. Gummi acaciae — arabisches Gummi — gomme arabique (franz.) — gum arabic, acacia gum (engl.), in Amerika: acacia — gomma arabica, gomma acacia (ital.) — arabische gom (hol.) — arabiskt gummi (schwed.) — arabian kumi (fin.) — arabmézga (ung.) — ἀραβικόν κόμμι (griech.).
Arab.-Pers. und in Ägypten: samagh-i-arabi (bei IBN BAITHAR: samag). — Aar oder Czar von Arabien, Arabischer Zaher (bei MEGENBERG). — Gunde (gundi) heißt in Ostafrika jeder Klebstoff, also auch Gummi arab. DRAGENDORFF bemerkt bei Acacia vera (arabica): «Bei den pers. arabischen Autoren findet man für die Pflanze: Schankat-ul-misrija und Qaraz, für Gummi: Samgul (jetzt in Turkestan Samag arabi) und Agâqija, für Acacia überhaupt: Dschaschmîzadsch, für die Frucht von Ac. gummifera etc.: Omm Gilân, für die ganze Pflanze: Thalh, für die Frucht der[S. 407] Ac. nilotica: Chirnub kibthi und karats. In Indien wird das Gummi Mas-wai-gond und Maklai-gond genannt.»
Etym. Im alten Ägypten: qmyt (die hieroglyphischen Zeichen I, S. 470), komi (k[o]mi), q(o)mi, qmy (kmy) qema oder quemi — im Koptischen kome. Daraus dann κόμμι (zuerst bei HERODOT) und (lat.) commis, cummis, cummi und später gummis und gummi, im Deutschen zuerst: gumme — franz. gomme, engl. gum etc. Das ägyptische Wort soll nicht in Ägypten bodenständig, sondern der Sprache von Punt entlehnt sein (REINISCH). Die im Altertum gebräuchliche Bezeichnung Gummi acanthinum von ἄκανθα = Dorn, Dornbusch.
Stammpflanzen. Acacia Senegal WILLDENOW Spec. pl. IV, 1077 [A. VEREK Guill. et PERROT., A. rupestris STOCKS, Mimosa Senegal L., M. Senegalensis LAM. (AIT.)]. Trop. Afrika, in Cordofan, Sennaar, Khartoum, bei Kassala und Gedaref, im südlichen Nubien, am Atbara und Astaboran, in der Landschaft Gezireh; ferner im Westen in dem auf dem gleichen Breitengrade von Cordofan liegenden Senegambien und den Gebieten zwischen Cordofan und Senegambien (Bornu), sowie in Ostafrika, endlich auch in Arabien (Maskat, Aden, Dschidda) und Beludschistan, Indien (Sind, Ajmir). Die Flora von Sind hat große Ähnlichkeit mit der der afrikanischen Wüste. Der Baum heißt im Senegal: Verek, in Cordofan: Hashaba, plur. Hashab oder cheschâb, in Indien: Khor, Kúmta, in Bornu: Kol-Kol. Diese Pflanze liefert sowohl das beste Cordofangummi (SCHWEINFURTH, HEUGLIN, BEAM), das Hashab von Khartoum und Sennaar, wie das meiste gute Senegalgummi, besonders die Sorte bas du fleuve.
Weniger wichtig sind:
Acacia arabica WILLD. (Acacia vera WILLD., Mimosa nilotica L., M. arabica LAM.) in Indien: Kikar, Babúl und die von einigen dazugezogene, jedenfalls nahe verwandte Acacia nilotica DEL., der Sont- oder Ssantbaum. Trop. Asien und Afrika; im Sudan und oberen Senegal, Mosambique und Natal, Arabien und Indien (Sind). Liefert das Sunt-Gummi des Sudans, Marocco-, Mogador- und berberisches Gummi (MABEN) und einen Teil des Galam Senegambiens, sowie indisches Gummi. BENTHAM unterscheidet von A. arabica WILLD. die var. tomentosa (im Senegalgebiet), die var. nilotica (im Nilgebiet), die var. indica (in Indien) und die var. Kraussiana (in Port-Natal).
Acacia Seyal DEL., Sejal, Ssoffar, in Palästina: seijāl, ṭalḥ, mit der var. fistula (A. Fistula SCHWEINF.) im tropischen Afrika, in Nubien, Sennaar, in Kassala östlich von Khartoum und der italienischen Kolonie Erythraea, sowie in Deutsch-Ostafrika. Liefert Talh-Gummi (BEAM), Gedarefgummi (BUSSE) und Ssoffargummi (SCHWEINFURTH).
A. stenocarpa HOCHST., Talg, kitr, kakul oder suak, in den Nilländern, Abyssinien, Nubien und Deutsch-Ostafrika. Ebenfalls Talhgummi (talha) liefernd (SCHWEINFURTH), sowie Gedarefgummi (BUSSE) und Suakimgummi (MABEN).
A. Giraffae BURCH. (= A. erioloba WILLD.?), Camelthorn, in den Nilländern und in Deutsch-Südwestafrika, in den trockensten und heißesten Gegenden. Liefert Capgummi (weich) und deutsch-südwestafrikanisches Gummi.
A. horrida WILLD. (A. Karoo HAYNE, wohl auch = A. capensis BURCH). Extratrop. Südafrika, in Deutsch-Südwestafrika und am Cap (z. B. an den Ufern des Kariep). Liefert seit 100 Jahren viel Capgummi (hart) (BURCHELL) und deutsch-südwestafrikanisches Gummi.
A. abyssinica HOCHST. Tschéa und A. glaucophylla STEUD. (nahe mit A. Senegal verwandt), in Abyssinien und dem Somalilande, das Somali-Gummi (Karami) liefernd.
[S. 408]
A. Neboued GUILL., in Senegambien, und A. albida DEL., Anabaum, in Deutsch-Südwestafrika und im Senegalgebiet, hier Galamgummi liefernd.
A. gummifera WILLD. in Marocco.
A. pycnantha BENTH. (golden wattle) in Neusüdwales, Victoria und Südaustralien. Liefert australisches Gummi (Wattlegum).
Ohne größere Bedeutung sind: Acacia Ehrenbergiana HAYNE und A. tortilis HAYNE (A. Raddiana C. SAVI, A. fasciculata G. P.) Haraz, in Palästina: seijāl, ṭalḥ, im Nilgebiet, Nubien, Abyssinien und in Arabien — A. Adansonii GUILL. et PERROTT. in Senegambien — A. verugea SCHWEINF. liefert das Kukgummi (BEAM) — A. Suma KURZ (A. campylacantha HOCHST.) liefert das Kakamut oder Sinlingummi. A. Farnesiana WILLD. (in Indien: vilayati kikar, guya babúla, in Palästina: ghilān, ảnbar, ḳarz) in Vorderindien (heimisch in Westindien) — A. spirocarpa HOCHST. und Stuhlmanni TAUB. in den Nilländern und in Deutsch-Ostafrika — A. usumbarensis TAUB. in Deutsch-Ostafrika — A. Catechu WILLD. (in Indien: khair, khair-babúl, katha) im Nilgebiet, z. B. in Faschoda, in Indien und Burma, im Himalaya — A. decurrens WILLD. (A. mollissima WILLD., A. dealbata, LINK), A. homalophylla CUNN., A. vestita, A. pendula, A. Sentis, A. binervata, A. elata, A. glaucescens, A. penninervis und A. retinoïdes. SCHWEINFURTH nennt im Nilgebiet 24, TAUBERT in Ostafrika 22, WATT (Dict.) in Indien 18 Arten.
A. Angico MART. liefert brasilian. G. (SYMES), A. micrantha BENTH. venezuelanisches (ERNST). A. paniculata WILLD. liefert die Goma de tiamo von Venezuela (s. weiter hinten).
DRAGENDORFF führt (in Heilpflanzen) 65 Acaciaarten als benutzt auf. Alle, jedenfalls alle afrikanischen Acaciaarten, sind imstande Gummi zu liefern.
Systemat. Stellung. Leguminosae — Mimosoideae — Acacieae.
Die gegen 450 Arten der Gattung Acacia WILLD. sind besonders zahlreich in Afrika und Australien vertreten, etwa 300 entfallen auf Australien. Die afrikanischen Arten gehören zu den Sekt. Gummiferae und Vulgares (A. Senegal zu letzterer Gruppe).
Beschreibung der Stammpflanze. Acacia Senegal ist ein niedriger Baum mit einem nicht über 6 m hohen, mehr oder weniger geneigten, 12–25 cm dicken Stamm, knorrigen, gewundenen, spreizenden Ästen und einer dünnen Schirmkrone («Schirmakazie»). In Bornu ist A. Senegal strauchartig. Das Holz ist sehr hart und weiß, die sehr faserige, daher zum Binden benutzte Rinde außen grau, innen rostfarbig, Die 2 (bis 3) kurzen Stacheln sind hakenförmig nach unten gekrümmt. Es sind metamorphosierte Nebenblätter. Sie sitzen daher an der Basis der Blattspindel (Taf. VII). Die doppelt und paarig gefiederten, an der Spindel gemessen, 2–3 cm langen Blätter besitzen 3–5 Paare Fiedern, die Fiederchen sind 10–15 jochig, schmal lineal, graugrün, kahl, bis 5 mm lang, gegenständig, sehr kurz gestielt. Die oberseits rinnige Spindel zeigt einige gelbe, fleischige Drüsen. Die Blätter zeigen die Erscheinung des Transversalheliotropismus, sie stellen bei starker Belichtung und Verdunstung die Fiederblättchen senkrecht und geben vom Januar an keinen Schatten (DAVID). (Die australischen Acacien besitzen oft durch Drehung des Blattstiels senkrecht gestellte Phyllodien.) Die in den Blattachseln entspringenden Blütenstände werden bis 10 cm lang. Es sind walzenrunde, mäßig dichte Ähren (Taf. VII). Die Blüten sind weiß (nicht gelb wie bei vielen anderen Arten). Der fünfzählige Kelch ist becherförmig, die ebenfalls kleinen 5 Blumenblätter lanzettlich, die zahlreichen, doppelt so langen Stamina am Grunde einbrüderig verbunden, in den Thekae nur wenige Pollinien. Der lineale Fruchtknoten wird zu einem bis 10 cm langen, flachen Legumen mit 5–6 braunen, glänzenden Samen, die einen langen Funiculus besitzen. (Beschreibung der anderen Arten in LUERSSEN, Mediz. pharm. Botan.)
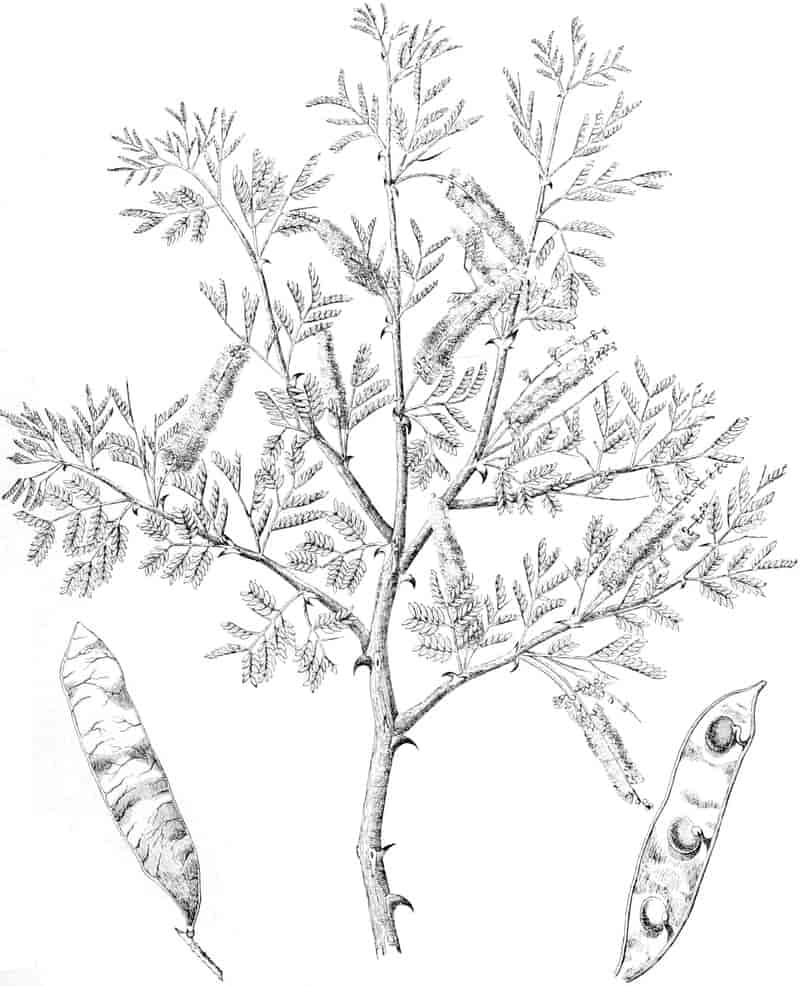
Nach Tafel 56 des Flor. Senegamb. Tentam. von Guillemin, Perrottet et Richard verkleinert.
Die Acacien verlangen ein heißes und trockenes Klima. Cordofan hat ein Jahresmittel von 28° C. (Maximum im Schatten 44° C. im Mai und September). «Dornen und immer wieder Dornen sind das Wahrzeichen von Cordofan. Ein dornenreicheres Geschäft als Gummisammeln läßt sich nicht wohl denken» (DAVID). Die Gummiacacien haben den Habitus von Erlen. In Cordofan bilden die Acacien lichte Haine, in Ostafrika eine besondere Vegetationsform, die ENGLER «Baumgrassteppe mit Vorherrschen der Acacien» nennt (Abbild. in ENGLER, Pflanzenwelt Ostafrikas, S. 59). Bei Bara fand DAVID neben A. Senegal auch A. stenocarpa, weiter nördlich bei Kagmar nicht A. Senegal, sondern nur A. Seyal, A. spirocarpa und stenocarpa. A. stenocarpa und fistula bilden ausgedehnte Wälder im Gebiete des Atbara und Bahr-el-Azrak.
Lit. G. SCHWEINFURTH, Aufzähl. u. Beschreib. d. Acacienarten des Nilgebiets. Linnaea 35. 1867/68 m. 19 Taf. und Im Herzen Afrikas 1874. — A. F. BROUN, Catal. of the flowering plants of the Sudan. — TAUBERT, Die Gummi liefernden Pflanzen Ostafrikas in ENGLER, Pflanzenwelt Ostafrikas 1895. — DELILE, Flore d’Egypte. — FORSCAL, Flor. aegypt. arab. — UNGER, D. Pfl. d. alt. Ägypt. — GERH. ROHLFS, Drei Monate in d. Libysch. Wüste. 1875. — HEUGLIN, Reise in d. Gebiet d. weißen Nil u. Reise nach Abyssinien. 1868. — HILDEBRANDT, Zeitschr. Ges. f. Erdkunde 1875, 279. — OLIVER, Flora of tropical Africa II, 338. — GUILLEMIN, PERROTTET ET RICHARD, Florae senegambensis tentamen. — BENTHAM, Transact. Linn. Soc. 30, 516. — C. MARTINS, Bull. Soc. Bot. France 1875, 20. — BURCHELL, Travels in the interior of south Africa 1822/24. — HAGGENMACHER, Reise im Somalilande. Peterm. geogr. Mitth. Ergänzungsh. 47 (1876). — SADEBECK, Kulturgewächse der deutschen Kolonien. 1899. — BRANDIS, Forest flora of North-West and Centr. India. — F. VON MÜLLER, Select plants for industrial culture in Victoria. 1876 und Iconographia of acacias. — LUERSSEN, Mediz. pharm. Bot.
Abbild. von A. Senegal WILLD.: GUILLEMIN et PERROTTET, Flor. Senegamb. tent. 1830, t. 56 (reproduziert in FLÜCKIGER, Gummi u. Bdellium, Schweiz. Wochenschr. 1869); BERG-SCHMIDT, Atlas II. Aufl.; BENTLEY and TRIMEN, Med. plants t. 94, SCHWEINFURTH a. a. O. t. 22, Reliquiae Kotschyan. t. 3; TAUBERT in ENGLER-PRANTL, Pflanzenfam.; von A. nilotica: bei ROHLFS t. 13; A. arabica: ROXB. Pl. Coromand. H t. 149, kopiert bei NEES VON ESENBECK t. 333; A. Seyal: NEES t. 336, SCHWEINFURTH t. 11–14, BERG-SCHMIDT, I. Aufl. t. 6 d.; BUSSE in ENGLER-DRUDE, Vegetat. d. Erde IX, I, S. 274; A. horrida: HAYNE X t. 33; A. horrida und erioloba: WARBURG, Zeitschr. f. trop. Landwirtsch. 1898; A. stenocarpa: in BUSSES Bericht VI.; A. spirocarpa: BUSSE a. a. O.
Pathologie. Schädlinge scheint die Gummiacacie nicht zu haben. Beeinträchtigt wird gelegentlich der Gummiertrag durch Antilopen und Paviane, die das Gummi fressen, Elefanten, die die Bäume umreißen (BAKER) und Kameele, die die Dornen abnagen (DAVID).
Lit. BAKER, Die Nilzuflüsse in Abessinien. Braunschw. 1868.
Bildung des Gummis in der Pflanze (Gummosis). Das Gummi arab. entstammt der Rinde der Acacien. Eine mir vorliegende Probe von mit Gummi reichlich besetzter Rinde von Acacia Senegal, ausgelesen aus der Handelsware, zeigt folgenden Bau. Eine dicke Schicht typischen farblosen Korkes bedeckt das Ganze. Die sekundäre Rinde besteht aus miteinander abwechselnden tangentialen Streifen von Keratenchym (WIGAND), d. h. obliterierten Siebbündeln (MOELLER) nebst begleitendem Phloëmparenchym und Bastzellbündeln, oft in sehr regelmäßiger Alternanz. In radialer Richtung wird die Rinde von ein- bis dreireihigen Markstrahlen durchzogen. In den Phloëmparenchymzellen findet sich bisweilen eine die Zellen meist ausfüllende, lichtgelbliche-dunkelbräunliche Masse. Die Gummosis, welche zur Entstehung großer gummierfüllter lysigener Höhlen führt, geht, nach MOELLER, von den[S. 410] jungen Keratenchymbändern und dem Phloëmparenchym, oder, wie ich vermute, von Stellen, die diesen entsprechen würden, aus. An dem mir vorliegenden Material ließ sich sicher nicht feststellen in welchem von beiden sie zuerst eintritt, jedenfalls werden die Membranen des Keratenchymbandes und die der Phloëmparenchymgruppen in Gummi übergeführt. So findet man in der Rinde von Zweigen, die Gummidrusen reichlich tragen, gummierfüllte Höhlen (cavernes de résorption, TRÉCUL) ringsum von in Auflösung begriffenen Zellen umgeben. In den äußeren Rindenschichten der Acacia fand MOELLER ein kirschgummiartiges, unlösliches Gummi.
Gummibildung in der Acacienrinde nach Moeller.
Entstehung des Pruneengummi. Zwei Gummidrusen, die im Jungholz entstanden und durch sekundäres Dickenwachstum des Holzkörpers ins Innere gerückt sind. Die Gefäße mit Wundgummi gefüllt.
[Tschirch.]
Nach dem Sitze der Gummimassen zu urteilen muß die ergiebigste Gummibildung in den inneren Teilen der sekundären Rinde stattfinden. Und es bleibt noch durch Versuche an der lebenden Pflanze festzustellen, ob nicht infolge der Verwundung zur Gummose vorgebildete Zellgruppen, sei es nun ein besonderes Gewebe oder zur Gummose neigende Phloëmpartien, direkt in der äußeren Partie des Cambiums im Jungleptom erzeugt werden. Es erscheint mir dies deshalb wahrscheinlich, weil JADIN und BOUCHER bei Moringa nach Verwundungen das Auftreten von Gummiräumen im Jungleptom beobachteten. Auch MOELLER beobachtete die Anfänge der Gummibildung bei Acacia pterygocarpa «in einer sehr tiefen Schicht der sekundären Rinde nahe dem Holzkörper» und CORRE und LOUVET verlegen sie sogar «zwischen Holz und Rinde», also in das Cambium. Das deutet darauf, daß auch hier (wie beim Harzfluß) der Anstoß zur Gummibildung im Cambium und seinen jüngsten Produkten erfolgt. — Andere Beobachtungen machen es wahrscheinlich, daß (wie beim Harzfluß) ein Verwundungsreiz das erregende Moment ist. Während aber bei der Gummose der Amygdalaceen, wie MIKOSCH gezeigt hat, infolge der Verwundung im Neuholz (Junghadrom) Gruppen abnormen Parenchyms («Gummizellen») entstehen, die der Gummose anheimfallen, müßte sich hier der Effekt des Reizes im Jungleptom äußern. Nach den Beobachtungen von LUTZ besteht zwischen der Gummose der Acacien und der Amygdalaceen eine ziemlich weitgehende Übereinstimmung. Er sah übrigens Gummose bei den Acacien auch im Jungholz auftreten. Da WIGAND einmal auch eine Gummidruse im Holzkörper fand, scheint in der Tat bei den Acacien auch dort unter gewissen Umständen Gummibildung möglich. Nach LOUVET entstehen auch Lücken im Zuge der Markstrahlen. Bisweilen erreicht der Gummifluß riesige Dimensionen. NAUDIN fand 1889 ein Exemplar der Ac. dealbata ganz eingehüllt von Gummimassen. LUTZ, der (nach MANGIN) mit Färbemitteln die Gummose bei den Acacien verfolgte — er benutzte Doppelfärbung mit Neutralrot CASSELLA und Vert acide JEEE POIRRIER — verlegt den Beginn der Gummose direkt ins Cambium, in dessen Wänden er eine Umwandlung in Gummi konstatieren konnte. Auch TRÉCUL und COTTON verlegen den Beginn der Gummibildung dorthin, führen sie aber auf Saftstauung und Überernährung zurück. Aus den Beobachtungen von[S. 411] LUTZ möchte man den Schluß ziehen, daß Gummibildung auch ohne Verwundung möglich ist, da die Membranen des Cambiums gewisser Pflanzen Neigung zur Umbildung in Gummomembranine zeigen, Gummifluß aber nur infolge von Verwundungen entsteht. Auch DAVID, der die cordofanischen Gummidistrikte besuchte, beobachtete, «daß der Gummosis immer Veränderungen, Risse oder Spalten in den geplatzten Borken» zugrunde lag, und bemerkt, «gewiß ist das Gummi ein vortrefflicher Wundverschluß um das Ausdörren zu verhindern». BEAM berichtet (s. weiter hinten) sogar von der Anbringung großer Wunden (vgl. Taf. VIII u. IX). BUSSE sagt (III. Bericht über die Reise in die ostafrik. Steppen 1900) über die Gummiausscheidung bei Acacia stenocarpa, «daß das Gummi in keinem Falle freiwillig, d. h. ohne äußere Eingriffe, der Rinde entfließt». Alle Erfahrungen deuten darauf, daß eine Verwundung, sei sie nun künstlich von Menschenhand angebracht oder spontan durch Tiere oder Astbruch oder Bersten entstanden, für das Zustandekommen des Gummiflusses auch bei den Acacien notwendig ist, die Gummose also eine Reaktion auf die Verwundung darstellt, wobei unentschieden bleiben mag, ob die Verwundung nur als Reiz wirkt, oder ob durch sie fremde Substanzen wie Bakterien oder Pilzsporen und ihre Produkte oder Gase (Sauerstoff) den inneren Geweben der Rinde zugeführt werden. Es würde also die Gummibildung in den Acacien mit der bei den Amygdalaceen und indirekt mit der Resinosis in Parallele gestellt werden können. Halten wir diese Analogie aufrecht,[S. 412] so wird klar, daß das Gummi nicht nur durch Metamorphose der loco vorhandenen Membranen entstehen wird, sondern daß diese einen Herd der Gummibildung erzeugen werden, in dem auch das weiter zugeführte gelöste Kohlenhydratmaterial, ohne den Umweg über eine typische Membran zu machen, eine Umbildung in Gummi erfährt, ähnlich wie dies auch FRANK und KARSTEN annehmen. Dies macht den Prozeß auch von anderen Faktoren als nur der Verwundung abhängig. Und in der Tat lehrt die Erfahrung, daß die Gummiacacien nur zu einer bestimmten Zeit Gummose zeigen, zur Zeit der Blattbildung z. B. nicht, und daß auch gewisse Standortsverhältnisse, z. B. trockener Boden, für das Zustandekommen der Gummose nötig sind. Dieselbe Art bildet in der einen Gegend Gummi, in einer andern keins (HILDEBRANDT, SCHWEINFURTH, BEAM), sie kann in einer Gebirgsgegend reichlich Gummi liefern, in größerer Höhe aber gar nichts geben. Auch die Temperatur spielt eine Rolle. An einem heißen Tage wurden in Cordofan (1908) von drei Bäumen 1,3, an einem kalten nur 0,63 rotls geerntet (BEAM, vgl. auch unter Gewinnung). In Cordofan tritt die Gummose nicht während der Regenzeit ein, sondern erst wenn die fürchterliche Trockenheit einsetzt.
JOS. MOELLER hält die Gummibildung der Acacien für einen normalen, in seiner physiologischen Rolle der Borkenbildung vergleichbaren Prozeß; ich habe die Gummose schon 1888, ebenso wie FRANK und MAIDEN, für einen pathologischen angesprochen, da es viele Bäume und andere Teile des gleichen Baumes gibt, die keine Gummosis zeigen und bisher nur an Wunden wirklicher Gummifluß beobachtet wurde. Auch PLANCHON-COLLIN nennen das Gummi «une production morbide». Nach SAVAITANA ist nicht nur bei den Amygdalaceen, sondern auch bei den Aurantieen die Ergiebigkeit des Gummiflusses proportional der Stärke der Verletzungen. Bisweilen wurde allerdings bei den Gummiacacien auch sog. freiwilliger Gummiaustritt beobachtet, sowohl im Sudan (CHEVALLIER) wie in Senegambien (GUILLEMIN und PERROTTET), ja dies Gummi trägt im Sudan sogar den besonderen Namen hashab wady. Aber auch hier werden Wunden entstehen, denn der Gummiaustritt erfolgt, wenn unter dem Einfluß der trockenen Westwinde nach einer Regenperiode sich die Rinde zusammenzieht, also spontane Risse entstehen.
Daß auch Parasiten den Wundreiz auszuüben bzw. zu unterstützen vermögen, wird allgemein zugegeben. Man hat aber auch die Gummosis direkt auf Parasiten zurückgeführt. So nahm MARTINS an, daß der phanerogamische Parasit Loranthus senegalensis MART. den Gummifluß der Acacien verursache (von LOUVET und CORRE widerlegt) und BEIJERINCK meinte, daß ein Pyrenomycet Pleospora gummipara OUDEMANS bei den Gummiacacien (Coryneum Beijerinckii bei Pfirsich, Aprikose, Pflaume und Kirsche) Gummifluß hervorrufe. Neuerdings hat GREIG SMITH zu zeigen versucht, daß Bakterien die Ursache der Gummosis sind. Die bakteriologischen Untersuchungen dieses Autors wurden an Acacia penninervis und binervata in Australien gemacht. Von den Zweigen isolierte er zwei Bakterien, Bacterium acaciae, die vorherrschende Art, produzierte auf künstlichen Nährböden einen Schleim der Arabino-Galaktanklasse (d. h. Arabin), der also qualitativ mit dem Gummi von A. binervata übereinstimmte, Bacterium metarabinicum dagegen, eine Varietät des anderen, einen Metarabin haltigen Schleim. Das Gummi von A. penninervis ist denn auch ein Metarabin haltiges. G. SMITH kommt daher zu der Hypothese, daß die Differenzen zwischen den einzelnen Gummiarten auf der Verschiedenheit der produzierenden Bakterien beruhen. Als Bildungsmaterial nimmt er Lävulose und Maltose an. Festgestellt ist, daß im Punjabgummi und dem australischen Wattlegummi andere Mikroorganismen vorkommen wie im Sudangummi (EDIE, PREBBLE, Pharmac. ind.). SMITH bleibt aber den Beweis dafür schuldig, daß die von ihm gezüchteten Bakterien am Baume die ihnen zugeschriebene Wirkung ausüben und beachtet nicht, daß sein Wattlegum nur +0,9°, sein Bakterienschleim aber +43° drehte, beide also Araban und Galaktan offenbar in ganz verschiedenen Verhältnissen[S. 413] enthalten. Zudem ist Schleim- oder Gummibildung bei Bakterien eine weit verbreitete Erscheinung. Doch wissen wir über die Natur der gebildeten Produkte wenig. Das von Streptococcus mesenterioides produzierte Gummi ist Dextran (SCHEIBLER), wie das eines Spaltpilzes einer Zuckerfabrik (ANDRLIK). Ein anderer Spaltpilz produzierte Lävulan (MAASSEN), ein dritter Galaktan. Auch BRZEZINSKI hat die Identität seines Gummis mit dem entsprechenden Bakterienschleim nicht nachgewiesen. RUHLAND bezweifelt den bakteriellen Ursprung der Gummis. Er erhält mit aus Kirschbäumen isoliertem Bacillus spongius auf Nährböden einen Arabinoseschleim. Der gleiche Bacillus erzeugt an Kirschbäumen eine von starkem Gummifluß begleitete Krankheit. Das austretende Gummi ist aber ein Araban-Galaktangemisch. EDIE wiederholte die Versuche von SMITH. Er sterilisierte außen die Zweige der Gummiacacie in Khartoum, zerschnitt sie, impfte Gelatine damit und übertrug die Kultur auf Kartoffelagar. Er erhielt ein Bakterium, das auf mit Gerbsäure versetzte Lävulose übertragen, nicht gut wuchs, aber auf Lävulose allein Schleim bildete. Allerdings noch nicht abschließende Impfungsversuche von EDIE ergaben aber, daß mit Bakterien «geimpfte» Bäume weniger Gummi lieferten als «ungeimpfte» (aber verwundete). (Das «Impfen» wurde in der Weise ausgeführt, daß der Schnitt, um die Mikroben besser hineinzubringen, vorher mit Wasser eingerieben wurde). GARROS brachte einen hefeartigen Pilz, der die Fähigkeit besitzt, den unlöslichen Teil des Kirschgummis in Lösung überzuführen, mit der Gummibildung in Beziehung. Daß sog. «Schleimflüsse» an Laubbäumen (Eiche, Ahorn, Pappel) infolge von Pilzinfektionen entstehen können, zeigte LUDWIG, daß jedoch z. B. die sog. «gommose bacillaire» von PRILLIEUX an der Rebe keine Bakterienerkrankung ist, RATHAY.
Der von einigen angenommene, zum mindesten bisweilen förderliche Einfluß der Bakterien auf die Gummibildung kann sehr verschiedene Gründe haben. Ich erinnnere daran, daß die Bakterien sehr oft Enzyme produzieren. Diese können direkt oder indirekt die Gummibildung beeinflussen oder Prozesse einleiten, die zur Gummibildung führen. Auch BEIJERINCK denkt daran, daß die von ihm beobachteten Pilze ein Ferment bilden, da Gummibildung auch entfernt von der Wunde eintrete. Dann erinnere ich daran, daß der Bacillus spongiosus von ADERHOLD und RUHLAND auf den Nährböden auch reichlich organische Säuren (Essigsäure, Ameisensäure, Milchsäure, Buttersäure) bildete und GRÜSS und SORAUER eine günstige Beeinflussung der Gummose durch Säuren (spez. Oxalsäure) beobachtet haben. Vielleicht wirken die Oxydasen besonders energisch in saurer Lösung.
Auch Tiere sind als Erreger des Gummiflusses betrachtet worden. ZIMMERMANN, der an Acacia decurrens arbeitete, brachte die Gummibildung mit Verletzungen durch Käfer in Beziehung. Nach BUSSE entstammt das G. der Ac. stenocarpa in Deutsch-Ostafrika ausschließlich Verwundungen, die durch Ameisen hervorgebracht wurden. Jeder Gummitropfen entspricht einem Bohrloch. Doch beteiligen sich bisweilen auch größere Tiere (bes. Insekten). Auch DAVID spricht bei den Gummiwäldern Cordofans von «massenhaft zuwandernden Ameisen», und davon, daß diese beständigen Begleiter der Gummiacacien an den Gummiklumpen naschen. Ebenso sah MURIEL bei A. Seyal Insekten. GENTZ fand bei der Acacia horrida (nicht bei A. Giraffae) in Südwestafrika Bohrgänge einer Raupe und eines Käfers. GUIBOURT glaubte, da er im Innern der Marrons de gomme (gomme lignirode) eine große eiförmige «Zelle» fand, dies G. sei durch ein Insekt erzeugt und die Morrons seien die Behälter der Larven, was aber unrichtig ist. Auch bei der Bildung des Sonoragummi (s. d.) scheinen Tiere beteiligt und eine Begünstigung der Gummibildung durch Verwundung durch ein Tier nimmt ja auch WIESNER bei der Bildung des Chagualgummis an (Rohstoffe, S. 124), dessen Stammpflanze aber auch normalerweise Gummigänge bildet.
Die meisten Autoren betrachten also die Gummosis als eine Krankheit. GRÜSS und SORAUER dagegen, welche den Wundreiz für eine häufig vorhandene, keineswegs aber für die einzige Veranlassung der Gummosis der Amydalaceen ansehen, halten den Gummifluß für eine physiologische Störung, die auf einem Übermaß der abbauenden gegenüber den aufbauenden Enzymen beruhe. Die im Plasma gebildeten abbauenden Enzyme rufen sowohl die Umwandlung des Reservematerials (Stärke, Hemizellulosen) als die Schmelzung der Membran hervor. «Ein solches Übermaß kann sowohl durch absolute Vermehrung der lösenden Enzyme zustande kommen, als auch durch Gleichgewichtsstörungen entstehen, indem die koagulierenden Enzyme nicht rechtzeitig in genügender Menge zur Wirksamkeit gelangen» oder lahmgelegt werden und die hydrolysierenden die Oberhand gewinnen. SORAUER, der Gummiherde auch im unverletzten Gewebe sah (waren nicht doch vielleicht Wunden in[S. 414] der Nähe?), verlegt die Gummosis in die Membran und sieht, gestützt auf Versuche, einen erhöhten Gehalt der Gewebe an Säure (bes. Oxalsäure) als begünstigenden Umstand an. Es gelang ihm künstlich, durch Oxalsäure Gummifluß zu erzeugen. Er sieht den Gummifluß als einen speziellen extremen Fall einer allgemein verbreiteten Neigung gesunder Gewebe an, bei bestimmten Wachstumsverhältnissen, die eine Hemmung der Wirksamkeit der koagulierenden Enzyme veranlassen, Wandquellungen- und Lösungen einzugehen. GRÜSS nimmt an, daß die Gummisubstanz aus dem Zerfall von Zellwänden herrührt, die Hemizellulosen enthalten und zwar speziell aus dem Galaktan derselben hervorgeht unter dem Einfluß von Enzymen (Cytasen, Diastasen). Bei mangelhafter Ableitung des verflüssigten Gummis kann eine Gummilücke entstehen, da schließlich die Grundsubstanz der sekundären und weiterhin die primäre Membran angegriffen wird. GRÜSS denkt sich die Gummibildung in der Weise verlaufend, daß die Gruppe COH in dem Zucker- oder Saccharo-Colloid-Molekül durch Sauerstoffüberträger in die COOH-Gruppe verwandelt wird und so Arabin- resp. Galaktinsäuren entstehen. Als Sauerstoffüberträger würden die Oxydasen fungieren. GRÜSS zeigte, daß die Cytase des Kirschgummi Hemizellulosemembranen zu verschleimen und zu lösen vermag. Bei der Gummibildung im Kirschholz, der normalen und der pathologisch gesteigerten, ist die Cytase beteiligt. «Jeder Gummibildungsprozeß setzt die Anwesenheit von Hemizellulosen im Holzkörper voraus.» Sitz der Cytocoagulase sind die MIKOSCHschen Gummiparenchymzellen.
Nach BEIJERINK und RANT beruht der Gummifluß bei den Amygdalaceen auf einer durch Wundreiz verursachten anormalen Entwicklung des embryonalen Holzgewebes, die schließlich zur «Verflüssigung» desselben führt und die verursacht wird durch einen cytolytischen Körper. Cytolytische Substanzen werden von nekrobiotischen Zellen, wie man sie in der Nähe von Wunden findet, deren Plasma tot, deren Enzyme aber erhalten sind, vielleicht in besonders großer Menge abgeschieden. Die Autoren sind der Ansicht, daß alle Ursachen, welche zur Nekrobiose führen, Gummifluß veranlassen und zwar um so heftiger, je umfangreicher die nekrobiotischen Prozesse sind. Quecksilberchlorid erzeugt auch dort noch Gummifluß, wo er sonst ausbleibt (Aber HgCl2 tötet doch alle Enzyme!) Coryneum u. and. Parasiten führen zur Gummibildung, weil sie ein Gift ausscheiden, Saprophyten (Dematium pullulans, Phyllosticta Persicae) verstärken die Gummibildung, weil sie einzelne Zellen abtöten. Die genannten Autoren betonen, daß der Gummifluß bei den Amygdalaceen wirklich bedeutungsvoll nur im sekundären Jungholze auftritt, wo auch normalerweise die Cytolyse am ausgiebigsten auftritt.
Demgegenüber hält RUHLAND die Gummose für eine allgemeine Eigenschaft embryonaler Zellen, die aber im normalen Leben nicht zur Auslösung kommt, sondern erst infolge eines äußeren Anstoßes. Er leugnet das regelmäßige Auftreten von nekrobiotischen Zellen und die Diffusion von zellstofflösenden Körpern aus nekrobiotischen Zellen in das embryonale Gewebe und führt durch zahlreiche Versuche den Nachweis, daß, sobald der Sauerstoff bei der Verwundung abgeschlossen wird, die Gummose unterbleibt. In den embryonalen Zellen wird, wenn Sauerstoff hinzutritt, statt Protopektin (S. 277) Gummi gebildet, das normale Wandbildungsmaterial in die sauerstoffreichere Gummisubstanz übergeführt. Danach würde also weder der Wundreiz allein, noch die durch die Wunde in die Pflanze gelangenden Parasiten und ihre Produkte Primärerreger der Gummosis sein, sondern der zutretende Sauerstoff chemische Prozesse in der Pflanze einleiten oder auslösen, die zur Gummibildung führen. Wie diese Prozesse verlaufen, ist noch unklar. Aber das vorstehend Mitgeteilte weist doch wieder auf Oxydasen und Peroxydasen, die wir bekanntlich ja noch in den Gummis selbst antreffen, hin.
Daß Gummi arabic. Enzyme enthält, ist lange bekannt. Doch sprach erst WIESNER 1885 von einem «Gummiferment» und schrieb ihm die Eigenschaft zu Zellulose in Gummi verwandeln zu können. Aber schon REINITZER zeigte 1890, daß das Gummiferment wenigstens außerhalb der Pflanze nicht hierzu imstande ist, sondern nur aus Stärke Zucker bildet, also ein diastatisches Enzym enthält. Als solches erkannte diesen Teil des Enzymgemisches auch BÉCHAMP (1893), der ihm den Namen Gummizymase gab, und GRAFE (1907). Daß aber neben dem diastatischen Ferment auch eine Oxydase im Gummi vorkommen muß, zeigt ja schon der Versuch mit Guajaktinktur, zeigen dann die Beobachtungen von BOURQUELOT über die oxydierenden Wirkungen verschiedener Gummiarten, sowie meine eigenen über die «Gummasen» und sprach endlich REINITZER aus, der den Nachweis führte, daß im Gummi arab. neben einer Amylase sowohl eine Oxydase wie eine Peroxydase vorkommt. Mir erscheint nun nach allem die Frage sehr diskutabel, ob wir in diesem Enzymgemisch, dem ich, da ich der DUCLAUXschen Nomenklaturregel[S. 415] nicht folgen konnte, den Namen Gummase gab, nicht wirklich die Gummibildner vor uns haben, die in der gummogenen Schicht der lebenden Pflanze unter dem Einfluß von durch die Wunde zugeführten Sauerstoff (die Oxydasen wirken als Sauerstoffüberträger) aus den z. Z. unbekannten Gummibildnern, die wir aber wohl unter den Sacchariden und Polysacchariden zu suchen haben, das Gummi erzeugen. Ein Beweis ist dafür aber noch nicht erbracht. Für die Bildung des Kirschgummis nimmt MIKOSCH die Beteiligung von Enzymen an. Daß Gummifluß durch Reize hervorgerufen werden kann, bei denen Mikroorganismen nicht beteiligt sind, unterliegt jetzt aber keinem Zweifel mehr (ADERHOLD, RUHLAND, BEIJERINCK, RANT).
Über die Gummibildung bei den Amygdalaceen bemerkt MIKOSCH: «Das Gummi entsteht in der lebenden Substanz der Gummiparenchymzellen, wird von dem Plasma als Lösung zwischen Hautschicht und primärer Membran ausgeschieden und hier unter dem Einflusse des Plasmas zum Teil in Wasser unlösliches, aber darin quellendes Gummi umgewandelt. Der Prozeß geht in der Zelle zentripetal vor sich. Die primären Membranen bleiben lange erhalten und werden erst später gelöst.» «Die kambialen Gummiräume werden bei fortschreitender Gummosis auch noch dadurch erweitert, daß die angrenzenden Markstrahlen in den Umwandlungsprozeß mit einbezogen werden.» «Die Gummibildung beginnt in der Membran stets in den Verdickungsschichten, zuletzt werden die primären Membranen gelöst.» Zur Membran brachten die Gummibildung zuerst KARSTEN, TRÉCUL, WIGAND, FRANK und PRILLIEUX in Beziehung. Auch die Bildung des G. a. ist an Membranen geknüpft. Sie beginnt vielleicht schon in den Membranen der Cambiumzellen (LUTZ) und wird deutlich in einer Vergummung der Membranen der Siebröhren und Cambiformzellen (Hornbastprosenchym, Keratenchym WIGANDS) der sekundären Rinde (WIGAND, J. MOELLER), einem Vorgange, den WIGAND «rückschreitende Metamorphose der Zellmembran» nannte. Immerhin müssen sich — das nahm schon TRÉCUL an — an der Gummibildung auch noch zugeführte Inhaltsstoffe beteiligen, denn wie von HÖHNEL an einem bestimmten Falle zeigte, hatte der an einem Zweige von A. Senegal ansitzende Gummiknollen einen Inhalt von 41 000 cbmm, während der Spalt, aus dem er hervorgequollen war, nur 84 cbmm maß. HÖHNEL schließt daraus, daß die Beteiligung der Membranen auf die ersten Anfangsstadien beschränkt sein müsse und 99,8% ohne ihre Beteiligung entstehe. (Ähnlich hatte sich bereits 1866 FRANK ausgesprochen.) Es verhielte sich dann mit der Bildung des Gummi arabicum ganz ähnlich wie mit der des Kirschgummi und der Gummis bei Combretaceen, z. B. Terminalia Bellerica und Catappa paniculata (V. HÖHNEL) und Bromeliaceen (BORESCH). Denn wie neuerdings MIKOSCH zeigte, beginnt in der Regel die Kirschgummibildung durch Bildung von Kappen an den einen schizogenen Raum umgebenden Zellen (solche Kappen sah ich auch bei schizolysigenen Harzbehältern). Diese Randzellen, sowie ihre Umgebung gehen alsdann zu grunde, es entsteht ein «schizolysigener (TSCHIRCH) oder auch rein lysigener Raum», und in diesem kann nun eine enorme Gummibildung dadurch Platz greifen, daß alles zugeführte Kohlehydrat-Baumaterial (durch die reichlich auftretenden Enzyme) direkt in Gummi übergeführt wird: die aus den Membranen hervorgegangene Masse wird «gummogen». Ähnlich muß es beim G. a. sein. Es scheint, daß beim G. a. zunächst die Membranen einiger obliterierter Siebröhren und Geleitzellen (oder die Zellen einer «Gummizellen»-Gruppe?) vergummen und daß von diesem Herde aus die Vergummung fortschreitet. «Die Einwände, welche HÖHNEL gegen die Entstehung des Gummis aus Zellmembranen erhebt (s. oben), können übrigens leicht beseitigt werden, wenn man überlegt, daß es sich bei der Gummosis um pathologische Hyperplasie handelt» (CZAPEK).
Die Ansicht von VOGL und G. KRAUS, daß das G. a. aus dem Siebröhreninhalte stamme, ist durch nichts bewiesen. (KRAUS sah bei Acac. melanoxylon aus den Siebröhren eine gummöse Flüssigkeit austreten.)
MANGIN setzt die Gummibildung zur Pektinbildung in Beziehung. Er betrachtet sie als eine pathologische Mehrproduktion pektinartiger Substanzen. Da das G. durch Erhitzen in Metarabinsäure übergeht und diese zum Bassorin und der Pektinsäure Beziehungen zeigt, so werden wohl auch Beziehungen des Gummis zum Protopektin (S. 278) bestehen. In der Tat scheint die Gummibildung bei den Gummiacacien in der Interzellularsubstanz (d. h. dem Protopektin) ihren Anfang zu nehmen (JOS. MOELLER) und die an den Interzellularraum angrenzende Membranpartie bei den Pruneen gehört ja ebenfalls zum Protopektin («Auskleidungen der Interzellularen», S. 280). Endlich sieht man oft noch in vergummenden Geweben die mit der sekundären bzw. tertiären Membran umgebenen Lumina der Zellen, durch Gummi voneinander getrennt (Fig. 141 u. 142).
[S. 416]
Eine ganz besondere Bildung ist das Gummi im Kernholz und das Gummi im Schutzholz (GAUNERSDORFER, FRANK, TEMME, PRAËL). Bei der Bildung des Kernholzgummi (Kerngummi) und Wundgummi beteiligt sich die Membran nicht (BÖHM, PRILLIEUX, GAUNERSDORFER, FRANK), es wird vielmehr eine bestimmte zarte Plasmaschicht «bassorinogen» (TSCHIRCH u. WILL). Diese Gummiverschlüsse der leitenden Organe des Holzkörpers scheiden die damit versehenen Gewebe aus dem Saftverkehr aus. Sie sind in Wasser unlöslich und verhalten sich wie Bassorin (TSCHIRCH u. WILL).

Stamm von Acacia Senegal mit Gummiausscheidungen, aus der Baumgrassteppe von Ugogo
[Busse phot.]
Holzgummi erhielt FR. KOCH (Pharm. Zeit. f. Rußl. 1886) vorwiegend aus dem Holze der Laubbäume. Die Coniferen sowie ligninfreie Gewebe ließen kein Holzgummi gewinnen. Es lieferte bei der Hydrolyse Xylose und enthielt 82 bis 86% Xylan, hat mit dem eigentlichen Gummi also nichts zu tun.
Lit. KARSTEN, Bot. Zeit. 1857, 313. — TRÉCUL, Maladie de la gomme, Compt. rend. 1860, 621 u. 1862, 248. — FRANK, Pringsh. Jahrb. 5, (1866) 25. — PRILLIEUX, Compt. rend. 78 (1874); Ann. sc. nat. (6) I (1875), 176. — JOS. MOELLER, Über d. Entsteh. d. Acacieng. Sitzungsb. d. Wien. Akad. 72 (1875), 219 u. Buchn. Rep. 1876, 323. — CORRE, Notes sur les gommes du Sénégal. Journ. pharm. 1876, 318. — WIGAND, Desorganisation d. Pflanzenzelle. Pringsh. Jahrb. 3, 136. — VON HOEHNEL, Über das Material, welch. z. Bild. d. arab. G. in d. Pfl. dient. Ber. d. d. bot. Ges. 1888 und (Combretaceen) Bot. Zeit. 1882. — CZAPEK, Biochemie. — LOUVET, Etud. sur la mode de production de la gomme arab. faites pend. plus. voyages dans les forêts de gommiers. Journ. pharm. 1876, 405. — GREIG Smith, The bacterial origin of the gums of the arabin group, Proceed. Linn. Soc. New South. Wales 1902–1904. Journ. soc. chem. ind. 23, 1904. (Centralbl. f. Bacteriol. 10 und 11, 1903. Zeitschr. Angew. Chemie 1905). — RUHLAND, Arabinbild. durch Bacter. u. der. Bez. z. Gummi d. Amygdalac. Ber. d. d. bot. Ges. 1906, 393 und zur Physiolog. d. Gummibild. bei d. Amygdalaceen. Ebenda 1907, 302. — EDIE, Bacterial origin of gum im III. Report Wellcome Research Laborat. Khartoum 1908. — MARTINS, Sur une mode particul. d’excrét. d. g. arab. Rev. sc. nat. Montpellier 1875, 553. — G. KRAUS, Entstehungsweise d. G. a. Sitzungsber. d. Naturf. Ges. Halle 1884, 19. (Ph. journ. 16 [1886] 840). — BEIJERINCK, Gomziekte in Natuurk. Verh. d. holl. Akadem. 23. Amsterdam 1883, 35 und Hedwigia 1883. — TSCHIRCH, Angew. Pflanzenanatomie. 1888. — NAUDIN, Journ. pharm. 20 (1889), 122. — SAVASTANO, I fatti traumatici nella gummosi degli Agrumi ed Amigdalae Ann. Sc. agric. Portici 1885, Experimenti sui rapporti tra i fatti traumatici e la gummosi. Giorn. bot. ital. 1887. Gummosi e carie degli agrumi Att. Comizio agrar. d. Circondar. di Napoli 1887. — CARRIÈRE, Rev. hortic. Paris 1886. — GARROS, Nouv. ferment organisé de la gomme de cérisier. Bull soc. chim. 7 (1892) 625. — MIKOSCH, Entsteh. d. Kirschgummis. Sitzungsb. d. Wien. Akad. 115 (1906) 911. — MAIDEN, Vegetable exudations.[S. 417] Scient. res. of Elder Explor. Expedit. 1892. — BÖHM, Bot. Zeit. 1877. — FRANK, Ber. d. d. Bot. Ges. 1884, 327. — GAUNERSDORFER, Sitzungsb. d. Wien. Akad. 1882, 38. — PRILLIEUX et DELACROIX, Gommose bacillaire des vignes. Compt. rend. 118 (1894) 1430. — LUDWIG, Lehrb. d. nied. Crypt. Stuttg. 1892. — RATHAY, Jahresber. d. Önolog. u. pomolog. Lehranst. Klosterneuburg 1896 (dort die Lit. d. Rebengummose). — MANGIN, Journ. de Botan. 1893. — LUTZ, Sur la marche de la gommose dans les acacias. Bull. soc. bot. France 1895, 467 (Zeitschr. f. wissensch. Mikrosk. 12, 522) und Thèse, Paris 1895. — GENTZ, Tropenpflanzer 1901, 601. — DAVID, Kordofang. Apoth. Zeit. 1901, Nr. 97. — ADERHOLD, Clasterospor. carpophil. u. Bezieh. zum Gummifluß. Arb. d. biolog. Abt. d. K. Gesundheitsamt. 1902. — SORAUER, Handb. d. Pflanzenkrankh. 1909, I. — BEIJERINCK und RANT, Wundreiz, Parasitism. u. Gummifl. bei d. Amygdalaceen. Centralbl. f. Bact. 1905. — RANT, De gummosis d. Amygdalaceae. Dissert. Amsterd. 1906. — BRZEZINSKI, Anzeig. d. Akad. Krakau 1903. — JADIN et BOUCHER, Orig. et prod. d. l. gomme chez les Moringa. Bull. sc. pharm. 1908, 247. — BUSSE, Naturw. Wochenschr. 1901, 100. Ber. d. pharm. Ges. 1904 und Reisebericht V. — ZIMMERMANN, Centralbl. d. Bact. (2) 20, 716. — GRÜSS, Lös. u. Bild. d. aus Hemizellulose besteh. Zellw. und ihre Bez. z. Gummosis. Bibl. Bot. 39 (1896). — GRÜSS und SORAUER, Stud. über d. Gummifl. d. Kirschen. Notizbl. d. K. botan. Garten 1910. — GRÜSS, Verh. d. Cytase u. Cytocoagulase bei d. Gummibild. Jahrb. wiss. Bot. 47 (1910), 393. — K. BORESCH, Über Gummifluß bei Bromeliaceen nebst Beiträgen zu ihrer Anatomie. Sitzungsb. d. Wiener Akadem. 1908.
Gewinnung des Nilgummi. Die Bedingungen der Einsammlung des Sudangummi beschrieben der Director of forests of the Sudan C. E. MURIEL (1901), sowie DAVID (1901) und neuerdings (1908) BEAM in Khartoum. Der Sudan exportiert hauptsächlich das sog. Hashab-Gummi, das Gummi von Acacia Senegal, die besonders in Cordofan, westlich vom weißen Nil (z. B. bei Djédid, Bara und el Obeïd) gefunden wird, weniger in Gezireh und Gedaref, sowie in Sennaar zwischen blauem und weißem Nil und bei Kassala (BEAM). (Vgl. die Karte auf S. 429.) In dem Bezirke Bara Tajara el Obeïd in Cordofan besteht etwa ⅓ des lichten Buschwaldes aus Gummiacacien. MURIEL unterschied zwei Sorten: Gummi aus «Gärten» (hashab geneina oder genaineh) und wildes Gummi (hashab wady oder ouadi) — ersteres von angeschnittenen Bäumen, die einen Besitzer haben, letzteres von unangeschnittenen Bäumen, die keinen Besitzer haben. Von einer eigentlichen Pflege, Anpflanzung oder geregelten Besitzverhältnissen ist aber meist nicht die Rede (DAVID), so daß also die Bezeichnung «Garten» und «Besitzer» nicht wörtlich zu nehmen ist: die Genainas sind lichte Haine. Immerhin kommen, seit die Engländer sich in Khartoum festgesetzt haben (1900), die Gegenden in geregeltere Verhältnisse. Schon jetzt gibt es kaum noch Wady-Gummi. Alles Gummi stammt von angeschnittenen Bäumen, selten von solchen, wo es aus natürlichen Wunden austritt. Jetzt ist Wady der Name für dunklere Gummitränen. Die Gummigewinnung ist abhängig vom Vorhandensein von Brunnen, da die Sammler in den sehr zerstreuten, lichten Gummigärten sich ihr Wasser, ihre Nahrung und endlich auch das Gummi tragen müssen. (Fig. 144) Da die Einsammlung in der heißesten Zeit stattfindet, so gehen die Sammler nur so weit wie nötig.

Fig. 144.
Gummisammler in Cordofan, ausgerüstet mit Wasserschlauch und Beutel für Gummi und Mundvorrat, sowie mit Speer zum Schutze gegen wilde Tiere.

(Genehmigter Abdruck aus dem dritten Bericht der Wellcome Untersuchungs-Laboratorien Khartum 1908.)

(Genehmigter Abdruck aus dem dritten Bericht der Wellcome Untersuchungs-Laboratorien Khartum 1908.)
Die Bäume werden nach dem Aufhören der Regenperiode, also vom Oktober an angeschnitten und das Anschneiden (tapping, barking) fortgesetzt bis zum Februar. Das Anschneiden erfolgt mit einer kleinen Axt. (Taf. VIII.) Es werden zunächst transversale Einschnitte gemacht, dann reißt man einen dünnen Streifen Rinde ab. Dieser Streifen sollte nicht länger als 2–3 engl. Fuß lang und 1–3 engl. Zoll breit sein (MURIEL vgl. Taf. IX), je nach der Dicke des Stammes. Größere Wunden schädigen den Baum, auch tritt weniger Gummi aus, ebenso bei kleineren Wunden oder Einschnitten. Es wird Sorge getragen, daß der Schnitt nicht bis in den Holzkörper geht. Wenn die Einschnitte an [S. 418] einem kühlen Tage gemacht werden und mehrere kühle Tage folgen, so tritt beinahe kein Gummi aus. Die Einschnitte müssen an heißen Tagen gemacht werden. Nach 60 Tagen kann, wenn das Wetter kühl ist, das erste Gummi gesammelt werden, bei warmem Wetter geht es schneller. Man läßt das Gummi zwei Wochen am Baum zum Erhärten. Vor dieser Zeit ist die Träne im Innern noch flüssig, läuft beim Sammeln aus und man erhält dann hohle Schalen, die leicht zerbrechen. Jeden vierten Tag kann das Gummi abgesammelt werden, bis die neuen Blätter erscheinen und der Regen einsetzt. Man sammelt (Fig. 144) in einer Saison meist 7–8 Mal (BEAM). Besonders sammeln Frauen das Gummi. Verwundet werden 3 Jahre alte und ältere Bäume.[S. 419] Schon Bäume von 8–10 Fuß Höhe und 6–8 Zoll Umfang können Gummi produzieren. Ältere Bäume, wie solche von 15 Jahren, liefern kein Gummi, das beste solche von 8–12 Jahren. Dann beginnt die Kernholzbildung und sobald diese eingetreten, wird kein Gummi mehr erzeugt. Belaubte Bäume liefern kein Gummi, ebenso durch Feuer beschädigte. Während der Ernte muß trockenes heißes Wetter sein. Starke Bodenfeuchtigkeit und Schatten beeinträchtigen die Gummiproduktion; so ist z. B. in Agari, wo der Khor Agari im Sande verläuft, keine Gummiproduktion zu finden, trotzdem überall Hashab geneinas sich finden.
Die Bildung des Gummis wird begünstigt durch einen leichten sandigen, eisenschüssigen Boden und gute Drainage. Während der trockenen Jahreszeit darf A. Senegal nicht befeuchtet werden (A. arabica dagegen verträgt Wasser gut). Die größte Gummiproduktion erfolgt, wenn auf eine gute Regenperiode eine ungewöhnlich heiße und trockene folgt. Bodenfeuer sistiert die Produktion in der Geneina für eine Saison. Man kann bei der jetzt üblichen Verwundungsart jeden Baum nur alle zwei Jahr verwunden. Ein großer Baum liefert ungefähr 1,9 rotl (2,166 rotl = 1 kg), ein mittlerer 1,33 und ein kleiner 0,75 (BEAM). Gummi von Bäumen, die angeschnitten wurden, ist heller als aus natürlichen Wunden austretendes. Das Gummi des ersten Gummiausflusses nach dem Anschnitt ist gewöhnlich weniger löslich, besonders bei älteren Bäumen, doch wird es beim längeren Liegen löslicher. Gegen das Ende der Sammelzeit wird das Gummi allmählich härter und glasiger, und die Lösung zeigt eine immer geringere Viskosität. Im allgemeinen fand BEAM, daß, entgegen der Meinung der Sammler, eine Lösung des Gummis älterer Bäume eine etwas größere Viskosität besitzt als das aus jüngeren. Das Gummisammeln wird sehr schlecht bezahlt. Es wird von den Bauern nur als Nebenbeschäftigung betrieben, und nur wenn sie Sesam und Dura geerntet haben. Sie kommen daher oft erst im Januar und Februar dazu die Bäume anzuschneiden. Die Gummiausscheidung ist dann im Mai beendigt.

Fig. 145.
Verlesen des Gummis in Omdurman.
Als der Khalif gefallen (1900), bereiste DAVID aus wissenschaftlichem Interesse und um Gummi aufzukaufen Cordofan von Dongola aus. Er besuchte Bara, Khursi, Tajara im Osten von el Obeïd, Khor Hable, Schekkan und Kattero im Süden und Nehoud im Westen, wo die Bewohner ihre freie Zeit mit Gummisammeln ausfüllen. Sein Bericht ergänzt das Obige. Das Anschneiden im Dezember und Januar geschieht meist in den oberen Regionen des Stammes, die mindestens 4–5jährig sind. «Die eingeborenen Jungen und Mädchen bringen durch Anritzen der Rinde mit Lanzenklingen und Messern das Gewebe zu stärkerem Ausscheiden», doch wird in den von DAVID (1900) besuchten Gegenden die Prozedur nur beiläufig vorgenommen. Die Bäume schwitzen vom Dezember bis Februar, also 2–5 Monate, nach der auf die Regenzeit folgenden Vegetationsaufflackerung bei Beginn der Trockenzeit Gummi aus. Niemals findet man an den Bäumen altes Gummi, nur diesjähriges. Je weiter ab der Baum vom Flusse liegt, um so besser ist das Gummi. Die Gummiausscheidungen sitzen meist an 10–20 cm dicken Ästen, spärlicher an dünnen Zweigen (DAVID). Das Gummi ist anfangs weich und schmeckt dann recht erfrischend. Es erhärtet am Baume und erhält dann die charakteristischen Risse. Das Gummi von A. Senegal bildet kleine runde oder wurmförmige Klümpchen von höchstens 3 cm Durchmesser. Als Instrument zum Ablösen des Gummis wurde in den von DAVID besuchten Gegenden das breite Blatt der Lanze benutzt. DAVID schlägt vor, Brunnen zu graben und Gummi als Abgabe für Benutzung derselben zu erheben, sowie Acacienhaine anzulegen. Die[S. 420] Geneinas müssen als lichte Haine gehalten werden (18–100 Bäume per acre). Nach BEAM lieferte eine 10 acre große Geneina bei Sher geila bei der ersten Sammlung 75–100 lbs, bei der zweiten und dritten 60, dann mehrmals 50 und am Ende der Saison 10 lbs. Die jährliche Produktion dieses Gartens betrug 12–15 Kantar (d. h. 1200–1500 lbs). Unzeitiger Regen, der aber in der heißen Zeit kaum vorkommt, schädigt die Ernte sehr. Ein niedriger Preisstand vertreibt die Lust zum Sammeln, alsdann geht die Produktion rasch zurück. Von März bis Mai kann Gummi gesammelt werden. In dieser Zeit, ja bis zum Juli, bringen die Sammler das Gummi in kleinen Portionen (5–7 lbs) den Händlern, die bei den Brunnen ihr Zelt aufgeschlagen haben. Die Chefs lassen ihre Sklaven und Weiber sammeln (DAVID). Dies rohe Sammelprodukt enthält stets das Gummi mehrerer Acacien, doch scheidet schon der Händler beim Ankauf die dunklen Knollen von Seyal- und Kitrsorten aus. [Kitr (A. stenocarpa) bildet bis 150 g schwere braune Knollen.] Einige Sammler bringen das Gummi nach Mandjura, el Duem oder Fakischowa am weißen Nil, andere nach Dabbe am Nil in Dongola. Dort erwarten sie die arabischen Händler (gellabas). Die Nubier transportieren das Gummi in Ziegenfellsäcken. Die Händler bringen es dann in oben verengte Bastkörbe (llahâwi), die c. 125 kg fassen und auf Kamelen transportiert werden. [Im Durchschnitt ladet man 3–4 Cantar (à 100 Rottoli) auf ein Kamel (PALLME).] In Khartoum werden sie dann bis zu 200 kg aufgefüllt. In den Nilstationen wird das Gummi von der anglo-ägyptischen Regierung mit der Regaltaxe von 20% ad valorem belegt. (Schlechte Sorten zahlen weniger.) Während früher das Rohgummi des Sudan zunächst auf dem Rücken der Kamele, dann auf dem Nil über Berber, Dongola, Mokrat und Wadi Halfa nach Kairo und Alexandrien oder von Berber über Land nach Suakim bzw. von Kassala nach Massaua an das Rote Meer[S. 421] gebracht wurde, strömt es jetzt fast ganz in Khartoum resp. dem gegenüber gelegenen Omdurman (am Zusammenfluß des weißen und blauen Nil) zusammen. (Fig. 146.) Auch die Ghezireh-, Gedaref- und Talhasorten werden jetzt dorthin gebracht und während früher das Gummi unsortiert nach Europa kam und sich z. B. in Triest die Gummiauslese zu einem besonderen Beschäftigungszweige entwickelt hatte, wird jetzt viel Gummi schon in Omdurman vorläufig ausgelesen (Fig. 146), sortiert und bisweilen auch, wenn nötig, in der Sonne gebleicht — in Omdurman befinden sich große Bleichanlagen. Immerhin ging noch 1908 die Hauptmenge des Gummi unsortiert nach dem Norden. In Hamburg hat sich seit Ende des XIX. Jahrh. die Triage entwickelt.

Fig. 146.
Gummihändler in Omdurman.
Als beste Sorten gelten: Picket turkey gum und white sennaar gum. Die Haupthandelssorten werden im Sudan und Ägypten nach der Größe der Tränen unterschieden:[S. 422] bold, large, medium und granular, dann nach der Qualität: hard gum (in Triest: Khartumgummi), hart, glasig von hoher Viskosität, meist im bold und large Gummi prävalierend, bleached gum, d. h. in der Sonne gebleichtes Gummi, brüchig und heller infolge der zahlreichen Risse, von geringerer Viskosität. Glasige Sorten werden nicht gebleicht. Das Bleichen verändert die Farbe übrigens nur wenig; sorts ist unsortiertes Gummi. — Die Viskosität hängt nicht von der Grösse der Körner ab (BEAM).
Das weniger wichtige Talh gum wird von zwei Varietäten von Acacia Seyal in Kassala am blauen Nil, bei Karkoj mamuria im südlichen Teile des Wad-el-abbas-mamuria und im Roserires Distrikt gesammelt, nämlich von der Talha hamra (= roter talh) und von der Talha beïda (= weißer talh) oder soffar, A. Seyal var. fistula. Bei diesen handelt es sich um natürlich austretendes geringeres Gummi. MURIEL berichtet von Insekten die diese Bäume bewohnen.
Das Gummi von A. vera WILLD. (Acacia arabica), im Sudan santa (plur. sant oder sunt) genannt, ist weniger benutzt. Das Verwunden wird hier durch Herausschneiden von 2–3 Zoll großen Stücken aus der Rinde bewirkt und die Wunde geschlagen.
Es vergehen für gewöhnlich 6 Monate bis die ganze Ernte des Sudangummi nach den ägyptischen Ausfuhrhäfen und dort zur Verschiffung gelangt (GEHE).
Auch im Somalilande werden die Acacien angeschnitten (VAUGHAN, MILES) und unterhalb der Schnittwunde eine Bastbinde angelegt. Dies erfolgt Anfang März, die Ernte beginnt einen Monat später und dauert bis zum September (PAULITSCHKE). In Abyssinien wurde auch noch 1905 Gummi ganz vernachlässigt, obwohl dort die gleichen Arten wie im Somalilande vorkommen.

Fig. 147.
Verladen des Nilgummis auf Leichter.
Lit. C. E. MURIEL, Rep. on the forests of the Sudan. 1901. — DAVID, Kordofang. Apoth. Zeit. 1901, Nr. 97. — BEAM, in III Rep. Wellcome Research Laborat. Khartoum 1908.[S. 423] — HARTMANN, Reise d. Freih. v. Barnim. Berlin 1863. — PALLME, Beschreib. von Cordofan (Jahresber. 1842, 339). — VAUGHAN, Jahresb. d. Pharm. 1852, 86. — MILES, Journ. R. geogr. Soc. 22 (1872) 64. — PAULITSCHKE, Ethnographie Nordostafrikas. 1893. — HAGGENMACHER, Reise im Somaliland. Peterm. geogr. Mitt. 1876.
Daß Cordofan- und Senegalgummi identisch sind und daher von derselben Acaciaart stammen müssen, bemerkte zuerst FLÜCKIGER (1869), nachdem CIENKOWSKY (1848) festgestellt hatte, daß A. Senegal, die GUILLEMIN und PERROTTET (1824 bis 1829) am Senegal gefunden, auch im Stromgebiete des Nil vorkommt und SCHWEINFURTH (1867) gezeigt hatte, daß das beste Cordofangummi in der Tat von A. Senegal stammt. Aber wie auch beim Sudangummi einige Sorten nicht von A. Senegal stammen, so stammt auch nicht alles Senegalgummi von dieser Pflanze. Nur das gomme du bas du fleuve wird hiervon abgeleitet, das Galamgummi dagegen von anderen Arten (A. vera, A. albida, A. Neboued).
Die Distrikte des Senegalgummi.
[TSCHIRCH gez.]
Über die Gewinnung des Senegalgummi sind wir durch zahlreiche französische Forscher orientiert worden. Acacia Senegal bildet im Senegalgebiete lichte Bestände. Sie geht bis an die Grenze der großen Wüste, in die Oasen derselben und nach Bornu (ROHLFS). Die bedeutendsten Gummiwälder (Krabbas) finden sich in Sahel im Gebiete des maurischen Stammes der Trarsa, (Fig. 148) der sich von der Küstenlandschaft am rechten Ufer des Senegal aufwärts bis Dagana und tief ins Innere erstreckt. Dann liegen Krabbas bei Alfatak zwischen dem See von Chomak (Kayak) und der Stadt Podor am Senegal und im Lande des Braknastammes. «Diese nördlich vom Strome liegenden Gehölze liefern das vorzüglichste Gummi in reichlichsten Mengen, doch sind eigentlich auch die den Franzosen unterworfenen linksuferigen Gebiete[S. 424] Walo (Ualo) und Cayor (15° n. B.), welche vom Negervolke der Dhioloffen (Djoloi) bewohnt sind, nur ein ungeheuerer Gummiwald» (FLÜCKIGER). Ferner sind zu nennen die Wälder von Dimar, Toro (am linken Ufer des Senegal), Chamana (am rechten), Diubuldu, Djeuleuss, Ndombo, Sanente, Bokol, Ndiaïen, Lérabé, Diambur (LOUVET). Das Einsammeln betreiben im Unterlande (bas du fleuve) besonders die maurischen Nomadenstämme der Trarsa, Brakna und Duaisch am rechten Senegalufer bis Bakel (15° n. B.), dann die Negerstämme im Galam- oder Gadingalande und oberhalb Galam (Kadschaga, en haut du fleuve) am Falemefluß die Bewohner der Landschaften Bondu und Bambuk, sowie die der Fulah- und Guidimakhadistrikte. Die Gegenden am Gambia (Rivières du Sud), am Cazamonce, Rio Grande, Rio Pongo und Mélacorée, welche Flüsse alle in den Ferlobergen entspringen, liefern kein Acaciengummi (COTTON).
Die Franzosen, die den ganzen senegalensischen Gummihandel in Händen haben, unterscheiden die gommes du bas du fleuve, vom Unterlauf des Senegal (Dagana, Podor, Wüste von Bunun, Gebiet der Brakna) und die gommes du haut du fleuve oder Galam, vom Oberlauf (Galam, Bakel, Medine). Der Unterlauf des Senegal, das Unterland, reicht ungefähr bis Mafu, bis wohin der Strom auch bei niederem Wasserstande schiffbar ist. Das weiter aufwärts liegende Gebiet ist das Oberland. Für reichliche Gummiproduktion scheint ein vorhergehender regelmäßiger Regenfall von mindestens 40–50 cm im Juli, August und September und dann im Dezember und Januar (nach GUILLEMIN und DUVEYRIER im Oktober und November) folgende anhaltende, starke und heiße Ostwinde (mbohio, harmattan) aus der Wüste unerläßlich («Wenn der Scirocco fehlt, kommt es auch nicht zu einer Gummibildung», COTTON). Die letzteren trocknen die Rinde aus und bringen sie zum bersten (LOUVET, PERGOLOTTE). Je stärker und anhaltender der Wind, um so stärker ist auch der Gummifluß (GUILLEMIN). Einschnitte scheinen nirgends gemacht zu werden. Das Gummi tritt aus den natürlichen Wunden aus. Nach dem im Sudan gemachten Erfahrungen (s. S. 417) würde das Senegalgummi wesentlich verbessert werden, wenn man die Eingeborenen veranlassen könnte, Einschnitte zu machen, denn das natürlich austretende Hashab wady ist ja auch in Cordofan minderwertig (s. oben).
Die Pflanze blüht im Unterland im Januar bis März, im Oberland im November bis Februar. Das Gummi tritt vornehmlich zur Blütezeit des Baumes oder unmittelbar nachher aus. Der Gummifluß erreicht seinen Höhepunkt zwischen Mitte März und Mitte April kurz vor Eintritt der Belaubung. Die Einsammlung (Traite) erfolgt vom Dezember oder Januar an. Die Bäume liefern Gummi vom 6. bis 7. Jahre. Wenn sie 3–4 Jahre Gummi lieferten, tritt eine Ruhepause ein. Im Januar und Februar treten bisweilen Seewinde, die reichliche Taubildung oder gar Regen bedingen, ein. Sie erzeugen eine zweite Saftfülle und (im März) unter Umständen eine zweite geringere Sekretion, können aber auch die ganze Ernte schädigen oder vernichten. Auch COTTON berichtet (1893) von einer zweimaligen Einsammlung: die beste Sorte im April bis Juni (grande traite), eine geringwertige im Dezember bis Februar (petite traite). Die leicht erreichbaren Gummitropfen werden mit der Hand, die schwer zu erreichenden an den oberen Teilen des Stammes mit an Stangen befestigten scheren- oder löffelartigen Werkzeugen abgebrochen (GUILLEMIN). Die Einsammlung soll besonders durch Sklaven oder durch Kriegsgefangene der nomadisierenden Stämme am rechten Ufer des Senegal erfolgen. Die Sammler ernähren sich, sobald ihnen die mitgenommenen Nahrungsmittel ausgehen, von dem Gummi. Der Ertrag wird oft durch Epidemien unter den Eingeborenen und durch Feuer vermindert. Das gesammelte, meist in[S. 425] ganze Ochsenhäute (zu 70–120 kg) verpackte Gummi wird auf Kamelen, Ochsen und Eseln nach den Stationen gebracht. Die Kamele tragen c. 300 kg, die Ochsen 120–150 kg, die Esel c. 80 kg. Das Gummi wird von den Franzosen an bestimmten, nach gegenseitigem Einverständnis gewählten Uferstellen (Escales) gegen Tauschartikel wie Getreide, Zucker, Reis, Quincaillerie, Waffen, Schmuck, Pulver, Gewebe und besonders einen blauen Baumwollstoff, genannt «la guinée», eingetauscht. Diese Escales oder Handelsstationen am Senegal, bei denen die Kamelkarawanen oft erst nach 50–60 tägigem Marsch eintreffen und auf denen man oft hunderte von Kamelen sieht, sind (Fig. 148) für Gomme du bas du fleuve: Dagana (167 km von der Küste), Podor (267 km), Salde (461 km) und Matam (601 km). Zwischen Matam und Bakel wird ein Gemisch von gutem Gummi mit Galam an den Fluß gebracht und bei Bakel (850 km) beginnt die Region des Galam. Sie reicht bis Medine (1150 km), wo der Fluß einen großen Wasserfall bildet, der der Schiffahrt eine Grenze setzt (COTTON 1893). Das Gummi geht dann auf dem Senegal nach der Hafenstadt St. Louis an der Mündung des Senegal, wo jetzt eine vorläufige Sortierung durch die Société des Importateurs-Trieurs erfolgt (weniger nach Rufisque und Freetown), und von dort (in Jutesäcken à 80–90 kg) nach Bordeaux. Dort erfolgt die eigentliche Triage, die Sortierung. Es wird das viele Rindenreste enthaltende Trümmergummi (baquaques ou marrons rôtis), sowie etwa beigemengtes Harz (z. B. Bdellium) entfernt und der Rest durch die Trieurs in die üblichen Handelsorten (s. unten S. 431) sortiert. Der Aufschwung des Senegalgummihandels datiert von der Einführung der Triage in Bordeaux. 1905 war die Produktion des Senegalgummi bedeutend zurückgegangen, da sie sich durch den niedrigen Preisstand des Sudangummi als nicht mehr lohnend erwieß. Auch hinderte die Besetzung der nördlichen Landstriche am rechten Ufer des Senegal, Podor und Kaëdi, durch französische Truppen die Eingeborenen von den Stämmen der Trarsa und Brakna an der Einsammlung und in manchen Gegenden wurde sie ganz aufgegeben. Das über Timbuctu ausgeführte deckte nicht einmal die Transportkosten (GEHE).
Lit. GUILLEMIN, PERROTTET et RICHARD, Flor. Seneg. tent. I, 246. — DUVEYRIER, Les Touareg du Nord I (Paris 1864) 164. — SOUBEIRAN, Des gommes du Sénégal. Journ. pharm. 1856, 53. — LOUVET, Voy. d. 1. forêts de gommiers. Journ. pharm. 24 (1876), 405. — CORRE, Journ. pharm. 24 (1876), 318. — FLÜCKIGER, Gummi u. Bdellium. Schweiz. Wochenschr. 1869. — BERENGER-FERAUD, Les peuplades de la Senegambie. 1879 (Einsammlung). — COTTON, La traite des gommes au Senegal. Journ. ph. 1893, 598. — (D. Gummihandel am Senegal). Bull. Soc. ph. Sud-Ouest (Pharm. Post 1896). — GEHE, Handelsberichte.
Handelssorten. Im Folgenden werden die Sorten in zwei getrennten Gruppen behandelt: Acaciengummi und Gummi von anderen Pflanzen. Das Rohgummi ist ein Gemisch sehr verschiedener Qualitäten, stammt auch bisweilen von verschiedenen Stammpflanzen. Schon EHRENBERG bemerkt, daß ein und derselbe Baum oft durchscheinendes, mattes, helles und gefärbtes Gummi liefert. Wie beim Traganth (s. d.) werden die verschiedenen Handelssorten durch Auslesen (triage, picking, scelta) des Rohgummi hergestellt. Diese Auslese geschah bei Sudangummi früher fast ausschließlich in Triest, jetzt zum Teil schon in Khartoum (Fig. 145), beim Senegalgummi besonders in Bordeaux (s. oben), bei den anderen Gummis in London, Hamburg u. and. Häfen. Prof. MORPURGO-Triest schreibt mir (1911): «Die alten, patriarchalischen Geschäftsverbindungen der Triestiner mit den ägyptischen Händlern haben aufgehört, so daß jetzt die Vermittlung des Triester Marktes im Gummihandel nur noch wenig Bedeutung hat. Das Geschäft entwickelt sich entweder[S. 426] direkt zwischen den ägyptischen Häusern und den Konsumenten, oder die Ware wird von deutschen, französischen und speziell englischen Spekulanten eingekauft, und infolgedessen konzentriert sich das Geschäft mit ägyptischen Gummi immer mehr in Hamburg, Bordeaux und London. Auch nach New York wird direkt viel Gummi arabicum exportiert. Was die Gummiauslese betrifft, so hat noch immer Triest dafür ein Renommee, es gibt nämlich noch eine Menge von Arbeiterinnen (Sessolote genannt), welche in der «Scelta della gomma» eine außerordentliche Praxis besitzen.»
Für pharmazeutische Zwecke eignen sich nur die besten Sorten Cordofan- und Senegalgummi.
I. Acaciengummi.
Acaciengummi kommt aus Afrika, Indien, Australien und Amerika. Doch liefern die einzelnen Arten ein sehr verschiedenwertiges Produkt. Unter den afrikanischen Sorten befinden sich die besten Gummis und das vorwiegend für pharmazeutische Zwecke brauchbare von Acacia Senegal.
A. Afrikanisches Gummi.
a) Nilgummi aus dem Stromgebiete des oberen Nil südlich vom 20° n. B.
1. Westliches Gummi, Cordofan- oder Sudangummi, das Hashab geneina G. (S. 417). Die beste Sorte: Picked Turkey oder Picked Cordofan, diese nur von Ac. Senegal [der Name turkey oder türkisches Gummi ist vielleicht aus torg-Gummi (gomme turique), einem alten Namen für Sudangummi korrumpiert, Torg soll ein Hafen bei Suez gewesen sein, ein Tor liegt auf der Sinaihalbinsel]. Cordofan liegt westlich vom weißen Nil zwischen dem 10. und 15.° n. B. (s. die Karte S. 429). Gewinnung oben (S. 417) beschrieben. Bestes Gummi des Handels, zum pharmazeutischen Gebrauch geeignet (Gummi arabicum officinale), klar löslich, linksdrehend (S. 427), Lösung farb-, geruch- und geschmacklos. Weiches helles Gummi, wird am höchsten geschätzt, hartes, besonders gefärbtes weniger. Die besten Sorten sind fast farblos. Die rundlichen oder wurmförmigen Stücke haben selten mehr wie 2,5 cm Durchmesser, sie sind innen mehr oder weniger glasig, außen stark rissig und trübe. Das Cordofangummi kam früher nach verschiedenen Stationen am Nil (vgl. S. 420), jetzt fast ganz nach Khartoum bzw. Omdurman am Zusammenfluß des weißen und blauen Nil und geht entweder auf dem Nil oder zum Teil auf Karawanenstraßen unter Umgehung der Nilkatarakte nach nördlicheren Nilstationen, wenig erst auf der Eisenbahn Khartoum–Kairo nach Alexandrien. Cordofangummi findet sich in Schilfmatten von pyramidenförmiger Gestalt, die außerdem mit Sackleinen umnäht sind und im Handel deshalb die Bezeichnung Ballen führen (WEIGEL 1905). Man unterscheidet beim Sortieren (nicht in Cordofan) hartes (hard) und weiches (soft) Gummi. Das harte wird in der Färberei und Seidenfabrikation, das weiche in der Confiserie und Pharmazie benutzt.
Die Commercial grades des Kordofan Gummi Hashab sind (nach BEAM in Khartoum): Grossgum as it is gathered (Natural Turkey sorts), — Sifted and cleaned sorts — sifted and cleaned sorts. Medium — partly cleaned and sifted sorts — bleached gum Selected Bold, — bleached gum. Selected Medium — Half bleached gum, — Selected sorts. Bold, — Selected sorts, Large, — Hard selected sorts, — Granular sorts cleaned, — Pickings, partly cleaned, — Pickings, uncleaned, — Siftings. Die ersten 8 geben helle Lösungen, die 3 folgenden gelbliche, die 3 letzten dunkle.
[S. 427]
In Triest wird sortiert in: Chartum und Cordofan, das erstere hell, hart wie Senegal und eine viskose Lösung gebend, das zweite, das höher bezahlt wird, (bianca scelta, bionda scelta, rossa scelta) ist weicher, zeigt Risse und verliert in der Sonne die Transparenz, eine blasse Lösung gebend von geringerer Viskosität. Weitere Sorten sind: granis crivellato, bianca friabile naturale, mezzo friabile nat., dura nat. und granello naturale. Der österreichische Drogenhandel unterscheidet daher: Natur. Cordofan weich; Natur. Khartoum hart; Natur. Granis grob; elect. albiss.; alb.; flav.; granello. Der deutsche Großhandel unterscheidet (1910) (nach dem Preise geordnet): Cordofan electum: mittelstückig, albissimum — blondweiß, weich, groß- und mittelstückig — weiß, mittel- und kleinstückig — blond, großstückig — granello, weiß-fein-grob — granis, hochfein-fein-grob — naturell. — Kolli à 100 kg. Die beste Sorte (albissimum) ist etwa viermal teuerer als granis und naturell.
FROMM fand bei Cordofangummi:
|
Lösung,
spezifisches Gewicht 1,035 |
Schäumt
|
ccm Schleim
aus 50 g |
Viskosität
bei 20° |
Säuregrad,
ccm Zehntel- Normal Natronlauge |
Drehungsver-
mögen αD |
Alkalische
Kupferlösung wird |
Dehnung %
|
Klebfähigkeit
|
|
|
hell u. klar
|
wenig
|
15
|
2,21
|
2,5
|
−2°28′
|
etwas
|
reduziert
|
2,29
|
14,1
|
|
hell
|
mäßig
|
20
|
2,0
|
2,4
|
−2°23′
|
kaum
|
reduziert
|
2,20
|
14,6
|
|
„
|
„
|
15
|
2,17
|
4,45
|
−2°29′
|
etwas
|
„
|
2,10
|
15,2
|
|
„
|
wenig
|
52
|
2,23
|
2,35
|
−2°47′
|
kaum
|
„
|
2,13
|
15,3
|
|
sehr hell
|
mäßig
|
11
|
1,59
|
2,3
|
−2°36′
|
deutlich
|
„
|
2,10
|
11,3
|
LEMELAND fand in Cordofang. 15% Wasser, 2,5% Asche, 35,7% Galaktane, 41,1% Pentosane. Es lieferte Arabinose. Die Analysen von BEAM s. unten (S. 444), die von MARTINA S. 437. Weitere in Bullet. Imper. Instit. London. 1908.
Das Sudangummi scheint im Altertum und Mittelalter unbekannt gewesen zu sein. Es ging früher meist auf der Karawanenstraße von Berber (am oberen Nil) nach Suakim am Roten Meer und nach Kairo (Berber und Suakim sind jetzt durch eine Eisenbahn verbunden). Auch damals schon war Khartoum ein wichtiger Gummiplatz. Dort strömten z. B. 1876 10000 cwts Gummi zusammen. Der blühende Sudangummihandel wurde aber zunächst gelähmt — die Zufuhren von Triest z. B. sanken von 20637 Kolli (1880) auf 10383 Kolli (1883) —, dann fast ganz zerstört, als 1882 die sudanischen Wirren begannen und der Sudan 16 Jahre in Aufruhr sich befand, der jeden regulären Verkehr, namentlich auf der Route Khartoum–Kairo, unmöglich machte. NEUFELD, der 1887 nach Cordofan reiste, um Gummi zu erwerben, büßte sein Unternehmen mit zwölfjähriger Gefangenschaft. Bis zum September 1898 befand sich Khartoum, bis November 1899 ganz Cordofan in den Händen der Mahdi (Kalif ABDULLAHI). Der Kalif hatte den Export von Gummi bei hohen Strafen verboten, da er es zur Verproviantierung seiner Truppen brauchte, auch der Abgang von Kamelen von Berber und Suakim nach Cordofan war untersagt. Gummi gelangte daher nur auf Schleichwegen aus dem Sudan nach Europa. 1888/89 war kein Cordofangummi im Handel. 1888–1890 erschien zunächst Ghezireh als Ersatz und nun machten die anderen Gummi produzierenden Länder (Indien, Australien, Kap, deutsche Kolonien) Anstrengungen, ihr Gummi einzuführen, was besonders dem Senegalgummi überraschend schnell gelang, so daß es bald den Platz[S. 428] des Cordofangummi einnahm. 1890 wurde der Sudanhandel zwar wieder freigegeben, aber es erschien auch 1891 noch kein Gummi und 1892 nur schlechtes sog. Chartumi. Die Verhältnisse blieben bis 1899 schwierig. Der 1896 einsetzende Feldzug der Engländer, der GORDON das Leben kostete, endete mit dem Falle des Mahdi (1899) und nun kamen allmählich die großen aufgespeicherten, zum Teil vergrabenen Gummivorräte in den Handel. Während Alexandrien, das nun Gummiexporthafen wurde, 1898 nur 257149 lbs Gummi (jeder Provenienz) ausführte, betrug der Export von Cordofangummi 1899 schon: 4160100, 1900: 6042050, 1901: 16937550, 1902: 21791000, 1903: 18939747, 1908: 17 Mill. lbs und erreichte 1909 die enorme Höhe von 26 Mill. lbs, trotzdem seit 1. September 1904 laut Verfügung des Generalgouverneurs des Sudan der Ausfuhrzoll 20% des Wertes beträgt. Aber die Handelsverhältnisse haben sich verschoben. Von der Ausfuhr von Cordofangummi 1902 gingen nunmehr nach Hamburg c. 1 Mill. kg, nach Frankreich c. 3 Mill. kg, nach England c. 1½ Mill. kg, nach New York 1¼ Mill. kg, nach Triest aber nur 787050 kg. Deutschland, das sich in der kritischen Zeit mit Senegalgummi beholfen, importierte 1902 Cordofangummi c. 2 Mill. kg, ostindisches Gummi c. 1⅓ Mill. und anderes Gummi c. 1¼ Mill. kg. Seit 1906 verdrängt nun wieder das Cordofangummi, das heute ein beliebtes Spekulationsobjekt geworden ist, das Senegalgummi. Ein Teil des arabischen Gummi geht auch nach Bombay und kommt von dort mit den indischen Gummis nach Europa (s. unten).
2. Östliches Gummi. Unter diesem Namen werden von mir hier G. verschiedener Gegenden östlich vom weißen Nil zusammengefaßt.
Sennaargummi. Die Landschaft Sennaar (Sennâr) liegt in dem Dreieck zwischen dem weißen Nil (Bahr el Abjad) und blauen Nil (Bahr el asrak), südlich vom Zusammenfluß beider (s. die Karte S. 429). Die Sennaarg. gelangen jetzt gleichfalls nach Khartoum, früher vielfach über Land via Berber und Kassala nach Suakim und Massaua, besonders von Ghezireh und Gedaref (östlich von Khartoum, südwestlich von Kassala, 14° n. B.) und von Distrikten zwischen Sennaar und dem roten Meer. Obwohl sie im Aussehn dem Cordofanischen G. gleichen, müssen sie von anderen Arten stammen, denn sie drehen meist rechts. Die linksdrehenden stammen wohl von A. Senegal. Gute Sorten heißen meist Gedaref (auch hashab geneina gedaref).
Jedenfalls ein Teil des gelblichen Gedarefgummi kommt von A. fistula, einem Baume, der z. B. im Lande Schilluk (10° n. Br.) ganz außerordentlich verbreitet ist und dort so kolossale Gummimengen produziert, daß ein Einzelner leicht 1 cwt täglich sammeln könnte. A. fistula und A. stenocarpa finden sich am linken Ufer des Atbara bei Gedaref und weiter südlich im Distrikt Kalabat und im oberen Stromgebiete des blauen Nil (SCHWEINFURTH 1874). In Faschoda wird das G. von A. verugera SCHWF. gesammelt. Gedaref gum Hashab (1908) sifted and cleaned sorts enthielt 8,52% Wasser und 1,12 Unlösliches. Die Acidität war = 2,95. Die Viskosität betrug 34° Retardation entsprechend einer 60% Rohrzuckerlösung. Die Lösung war braun (BEAM).
Auch das hierher gehörige Ghezirehgummi, das auch heute noch (1911) im Handel ist und gute Preise erzielt — es bildet relativ kleine, fast glashelle, hell-gelblich-weiße Körner — muß von einer anderen Acacia als A. Senegal abstammen. Sein ganz anderes Drehungsvermögen deutet darauf (FROMM fand es zu + 3°). In den Distrikten südlich von Djesirat fand DAVID A. Seyal, A. spirocarpa und stenocarpa. In Khartoum gilt «gezira» jetzt als Sekundasorte, da sein Schleim weniger konsistent ist als der des Cordofang. Gezirah (Ghezireh, Gezira, Jerise, Djesire, Djesirat, Dschesire) liegt gegenüber der Mündung des Atbara, 17–18° n. Br., also ziemlich weit nördlich. Etwas Ghezirehg. des Handels stammt aber auch von der Hochsteppe der Bischari zwischen Nil und rotem Meer. LEMELAND fand in vollständig löslichem Gezirehg., das αD +45° drehte, 9% Wasser, 4,1% Asche, 27,8% Galaktane, 47,6% Pentosane. Das G. lieferte Arabinose. Als während des Mahdiaufstandes die Ausfuhr von Cordofang.[S. 429] ganz sistiert war, gelangte Ghezirehg. auf dem Landwege zum roten Meer und bildete z. B. 1888/89 die Ersatzsorte für das Cordofang. Jetzt steht es im Preise den schlechteren Cordofansorten gleich. Das samagh savakumi ist eine schlechte Sorte des Ghesirehg. Das minderwertige G. aus der Landschaft zwischen Sennaar und dem roten Meer wird von A. fistula und stenocarpa abgeleitet (HEUGLIN). In Triest wurde 1911 von Gheziri unterschieden: in sorte, granello und granis.
Die Distrikte des Nilgummi.
[TSCHIRCH gez.]
Talhgummi (Talha, Talch, Talka) von A. Seyal (oder A. stenocarpa und fistula abgeleitet, vgl. S. 407), geht zum Teil nach Suakim, bildet kleine, zerbrechliche, verschieden von weiß bis rotbraun gefärbte Stücke oder ein Pulver und hat eine hohe Säurezahl, ja ist manchmal sogar relativ stark sauer. Die Lösung ist gefärbt und wird an Luft und Licht dunkler. Angeschnittene Bäume liefern ein besseres Gummi, dessen Lösung nicht nachdunkelt, wie Versuche in Khartoum zeigten. Talhg. gilt in Khartoum, wohin es jetzt ebenfalls gebracht wird, als Tertiasorte. Bei Talhg. von Kassala schwankte die Acidität zwischen 2,75 und 6,29, die Asche zwischen 2,42 und 4,42%, die Viskosität (im Torsionsviskosimeter) zwischen 29,2° und 43°[S. 430] Retardation entsprechend einer 61,3–63,8% Rohrzuckerlösung. Talh-Gum sorts enthielt 7,77% Wasser, 2,87% Unlösliches. Acidität = 4,50, Viskosität: 34° Retardation entsprechend einer 62,2% Rohrzuckerlösung (BEAM).
Das wenig benutzte Santa- oder Sunt-Gummi wird von A. arabica in Sennaar gesammelt. Es ist von guter Beschaffenheit und löst sich zu einem hellen geschmacklosen Schleim (BEAM). Ein Gummi von Acacia arabica von Sennaar enthielt 11,65% Wasser, 2,02% Asche, die Acidität betrug 2,09. Ferner fanden sich 1908 in Khartoum: Das Kuk-Gummi von Acacia verugea SCHWFTH., dunkler, löst sich nicht ganz. Es bleibt eine Gelatine zurück. Und das Gummi von Acacia Suma KURZ (A. campylacantha HOCHST.), das Kakamut oder Sinein der Eingeborenen, ist dunkler, aber vollständig löslich. Die Lösung schmeckt widerlich, etwas nach Terpentin. Kadab heißt in Khartoum ein schmutziges wertloses G. (MURIEL).
Auch das als Mittelsorte geltende, aber oft recht schlechte Suakimgummi (Savakim, Savakumi, Sauakim, Hafen am Roten Meer) zum Teil von der Hochebene von Taka und angeblich von A. stenocarpa und fistula, gesammelt, ist hierher zu ziehen. Es ist sehr brüchig, im Handel fast pulverig, hell oder gefärbt, oft rötlich, bisweilen rissig. Das Muster meiner Sammlung ist sehr unrein. Von allen Acacieng. fand WIESNER das von A. fistula am schlechtesten. Es bildet meist ziemlich stark gefärbte Körner und dreht rechts. In Ägypten heißt das schlechteste G. Samagh Savakumi (= G. von Suakim, FLÜCKIGER). Es ist nicht regelmäßig als Sorte im Handel und wird vielfach mit dem Talkag. (s. oben) zusammengeworfen.
Somaligummi. Im Somalilande wird ziemlich viel und gutes G. gesammelt, z. B. in der Gegend von Mieh im Innern (REVOIL), im Jahre 2–3000 t (PAULITSCHKE), besonders von A. abyssinica und glaucophylla. Es geht wohl hauptsächlich nach Berbera, das 1904 viel G. exportierte und Bender Felek, und von dort nach Aden oder Dschidda (Gedda) und hierher gehört also wohl ein Teil des Adengummi und des Geddag. (s. unten). Das Rohg. wird von den Somalis sortiert (safi = Auslese). Gute Sorten sind wordi (= feinkörnig) und adad (= grobkörnig), dunklere heißen djerjun, schlechte lerler (HAGGENMACHER). Ich habe in meiner Sammlung zwei Muster Somalig., das eine, Karamg. (Karam ist ein Hafen in der Nähe von Berbera), bildet große hellgelbe Knollen, die nicht ganz löslich sind, das andere, Jairieg., ist ein buntes Gemisch farbloser, gelber und dunkelbrauner, rundlicher Stücke. Das Somaligummi ist wohl das G., das die Ägypter vor 4000 Jahren aus dem Lande Punt holten. Das G. des in Ägypten heimischen Sontbaumes (s. oben S. 407) scheinen sie weniger benutzt zu haben.
Auch das erythräische Gummi, das unter diesem Namen kaum noch nach Europa kommt, von der erythräischen Kolonie stammt und südlich von Arkiko (bei Massaua) längs der Samharaküste gesammelt wird (die ganze Samharaküste ist voller Gummibäume, MUNZIGER), geht oft nach Dschidda und kommt dann als Geddag. (s. d.) zu uns. Es stammt von A. Senegal und A. Seyal (SCHWEINFURTH). In Triest wurde 1911 eine Sorte als Massauagummi unterschieden.
Adengummi. Nach Aden gelangt außer Somalig. auch Zeylag. Unter dem Namen Adeng. geht wohl vorwiegend ersteres. Ein Teil stammt aus Arabien. Das Adeng. meiner Sammlung besteht aus ungewöhnlich großen, bis 5,5 cm breiten, innen glasigen, außen grobrissigen Stücken, die oft im Innern eine Höhlung haben. Adeng. lieferte 3,7% Asche und enthielt nur 3,92% Unlösliches. Aden exportierte 1905/06: c. 10000 cwts G., das meiste nach Indien.
Das nach dem Hafen von Mekka Djidda (Djedda) oder Gedda (Jidda, Jedda) genannte Geddagummi, das bisweilen auch nach der Landschaft Hedschas (Hidschaz), in der Mekka und Djidda liegt, Hedschas-Gummi (samagh hidschazi oder hejazi) benannt wird, findet sich noch jetzt bisweilen im Handel. Es war wohl das Gummi des Mittelalters. Es ist sehr verschiedenen Ursprungs. Nach MUNZINGER stammt die Hauptmenge von der Samharaküste zwischen Bab el Mandeb und Massaua, und gelangt über Massaua (und Suakim) nach Djidda. Djidda ist also nur Durchgangshafen. Dann kommt auch aus Berbera (Somali) G. nach Djidda, so daß sich für Geddag. auch der Name berberisches findet. Neben dem Namen Geddag. finden sich auch andere Namen für arabisches G., wie Mekkag., El wisch-Gummi u. and. In Triest wurde 1911 Gedda eletta, bianca, rosa und rossa unterschieden. Alle sind großstückig. Im Geddag. fand O’SULLIVAN eine andere Gummisäure, wie im Cordofang., die Geddinsäure (s. unten S. 445). Es stammt also jedenfalls nicht von A. Senegal.
Die Herkunft des neuerdings aus dem Innern von Arabien, wo verschiedene Acacien wachsen, nach Makalla, Aden, Djidda oder über Land nach Damaskus gebrachten Gummis[S. 431] ist unbekannt, Südarabien sammelt wenig (HANBURY). Doch traf GLASER 1887 im Innern von Yemen vorzügliches G. Die in Triest 1911 gehandelten, früher über Gedda, jetzt über Aden exportierten Sorten Litty, Sarki (Schiarky), Fachmi und Mecca Fachmi stammen aus Arabien (MORPURGO). Auch im Altertum scheint Arabien Gummi erzeugt zu haben (DIODORUS SICULUS, zur Zeit des Kaisers AUGUSTUS), oder doch wenigstens Gummi über arabische Häfen ins Mittelmeergebiet gekommen zu sein. Der uralte Name Gummi arabicum deutet aber keineswegs mit Sicherheit darauf, daß Arabien das Produktionsland war.
b) Senegalgummi. Das Senegalgummi des Unterlandes (bas du fleuve), d. h. das nach dem Unterlauf des Senegal gebrachte Gummi, stammt von A. Senegal, das des Oberlandes auch von anderen Arten (A. Noboued, A. vera, A. albida, A. Adansonii, A. Seyal u. and.). Die Gewinnung des Senegalgummi ist oben (S. 423), die chemischen Eigenschaften S. 437 geschildert. Hauptausfuhrhafen ist St. Louis an der Senegalmündung. Das meiste Gummi geht nach Bordeaux, wo die zweite Sortierung (triage) durch die trieurs erfolgt (s. oben). Der Gummihandel am Senegal ist Monopol französischer Firmen. Auch die Royal-Niger-Compagnie exportiert Gummi. (1906: 6080 cwts) Die Verpackung geschieht in Säcken aus Ochsenhaut à 70–120 kg. Das Senegalgummi nimmt nach dem von Jahr zu Jahr steigenden Export an Erdnüssen (Arachis hypogaea) unter den Produkten Senegambiens meist den ersten Rang ein. Es geht frei nach Frankreich. Auch beim Senegalgummi unterscheidet man harte (dures) und weiche (molles, friables) Sorten. Rohes Senegalgummi wird in drei Hauptklassen eingeteilt:
1. Hartgummi. Gomme du bas du fleuve (Pudor). Besteht aus ziemlich großen, runden, wurmförmigen oder unregelmäßig geformten Tränen, variierend von fast farblos bis dunkelgelb.
2. Gomme du haut du fleuve (Galam). Kommt vom oberen Senegal. Die Tränen sind kleiner als die von «Bas du fleuve» und im ganzen dunkler.
Der Ausdruck Galam wird übrigens sehr verschieden benutzt, meist bezeichnet er schlechtere Qualitäten und nicht nur solche vom Oberland. Galam (oder Kadschaga) ist der Name der Landschaft bei Bakel (s. die Karte S. 423) am linken Ufer des Senegal.
Beide, besonders aber 2., werden oft mit glasigen Stücken von rötlicher Farbe und bitterem Geschmack vermischt gefunden, die wohl von dem Gummi von A. arabica und anderen Acacienarten herrühren.
3. Gomme friable (Salabreda). Dies ist besonders das Produkt von A. albida (weißer Baum = Cedra beida oder korrumpiert Sadra-beida, Sadra-brada und Sala-breda). Das Gummi ähnelt rohem Salz. Es ist sehr bröcklich und seine Lösung hat weniger Viskosität als die der oben erwähnten Gummis. Gewöhnlich besteht es aus kleinen Fragmenten oder wurmförmigen Tränen. Letztere sind oft fast farblos, aber die Fragmente sind gewöhnlich dunkel gefärbt. Die Varietät korrespondiert in der Qualität mit dem Talhgummi vom Sudan.
4. Ein Gummi vom mittleren Laufe des Senegal trägt bisweilen den Namen Gomme Mediné.
Nach der in Bordeaux vorgenommenen Sortierung unterscheidet man:
1. Gomme blanche. Bildet farblose bis schwach gefärbte, aber nie so schön weiße Stücke wie Cordofang., von sehr verschiedener Größe (1–4 cm). Die meisten derselben haben 1 cm im Durchmesser und sind kugelig bis ellipsoidisch geformt, innen glasig und oft hohl und weisen bisweilen eine netzförmig von Rißlinien durchzogene Oberfläche auf, welche, mit der Lupe betrachtet, eine feine Parallelstreifung erkennen läßt. Die einzelnen Stücke haben auch im Gegensatz zu den besten Sorten des arabischen Gummis geringen Glanz, was die Unterscheidung von[S. 432] letzterem leicht macht. Eine zweite, dem Gomme blanche fast in allen erwähnten Eigenschaften analoge Sorte bildet das:
2. Gomme petite blanche. Die einzelnen Stücke sind viel kleiner und haben nur einen Durchmesser von 0,5–1,5 cm, wurmförmige, sind häufig.
3. Gomme blonde. Weingelbe Stücke mit einem Stich ins Rötliche, in der Größe jenen der Sorte Gomme blanche ähnlich, die Oberfläche ist rauh; mit der Lupe betrachtet zeigen sich viele Runzeln und Streifen, hingegen wenige Sprunglinien. Innen glasig, bernsteinartig.
4. Gomme petite blonde. Diese Sorte hat kleinere Körner als die frühere, ist aber in bezug auf die Eigenschaften mit derselben identisch. Der Durchmesser der einzelnen Körner ist 0,5–1,5 cm.
5. Gomme vermicellée blanche. Weißlich bis blaßgelb gefärbte, stalaktiten- oder wurmförmige Stücke.
6. Gomme forte à fabrique ist eine mit dem Gomme blonde im allgemeinen übereinstimmende Sorte, welche jedoch dunkler gefärbt ist und aus ungleichen Stücken besteht, daher ebenso wie die folgenden Sorten den bereits erwähnten als minderwertig nachsteht.
7. Gomme boules wird aus Stücken bis zur Größe einer Orange gebildet, ist blaßgelb gefärbt und dürfte wohl künstlich geformt sein (für Reklameauslagen in Schaufenstern in Frankreich benutzt).
8. Galam en sorte besteht aus sehr ungleich, von hellgelblich bis rotbraun gefärbten Stücken von sehr verschiedener Größe; es finden sich neben runden auch wurmförmige Körner vor, sowie öfters Rindenstückchen, welche die Ware verunreinigen.
9. Gomme du bas du fleuve en sorte. Weingelb oder dunkler gefärbte, dicke, wurmförmige, gestreifte oder gerunzelte Stücke, meist 1–3 cm lang, 0,5–0,8 cm stark. Oft ist die Oberfläche mit dünnen Rindenstückchen bedeckt.
10. Salabréda en sorte (Sadrabeida). Dünne, ast- bis wurmförmige Körner, welche eine weiße bis gelbe Farbe zeigen und von kleinen, sehr verschieden gefärbten Bruchstücken und Rindenteilchen durchsetzt sind. Die Sorte ist sehr ungleich und stammt vielleicht von verschiedenen Stammpflanzen.
11. Baquaques et marons. Diese Sorte ist von sehr geringem Werte, stark verunreinigt; es finden sich Rindenstückchen und andere nicht gummöse Substanzen vor, so daß der Gehalt an Gummi gewöhnlich 73% nicht überschreitet. Die Lösungen zeigen geringe Klebkraft und die einzelnen Stücke sind ungemein verschieden gefärbt (licht weingelb bis rötlichbraun, graulich, sogar schwarz), oft vakuolig. Der Geschmack der Lösung ist ein rein süßlicher und erinnert an Karamel.
Die sogenannte Bruchware wird ebenfalls sortiert, und kommen im französischen Handel folgende Sorten vor:
12. Gomme gros grabeaux. Körner bis 8 mm Durchmesser, auch astförmige Stückchen, welche etwas länger sind.
13. Gomme moyen grabeaux. Körner bis 8 mm Durchmesser, kommt im österreichischen Handel unter dem Namen Granisgummi vor.
14. Gomme menus grabeaux. Körner 2–3 mm im Durchmesser; enthält keine wurmförmigen Stücke.
15. Gomme poussière grabeaux. Diese Sorte stellt ein ziemlich homogenes grau-gelbliches Pulver dar, dessen Körner weniger als 1 mm Durchmesser zeigen.
Oft findet man auch die Namen: Gomme grosse blanche — Grosse blonde, — Petite blanche — Petite blonde — Blonde larmeuse — Damienne blonde ou rouge — En sorte en bas du fleuve — Galam — Salabréda, Sadrabeida (unrein) — Baquaques ou marrons rôtis = Trümmergummi (mit Bastfasern und Rindenstücken verunreinigte verklebte Massen [G. lignirode]) — Außer Gros, Moyens und Menus grabeaux auch Fabrique grabeaux — Poussière de gomme. — Gomme pelliculée (GUIBOURT) ist ein Senegalg., dessen Stücke an einer Stelle von einem gelblichen undurchsichtigen Häutchen bedeckt sind.
Der deutsche Großhandel unterscheidet: Senegal elect., weiß, mittelgroß — naturblond, großstückig, hell — Granen und Granellen hell — naturell. Der österreichische Handel: Grosse blanche, Grosse rouge und Granello. Auch die besten Sorten erreichen nicht die Preise der besten Sorten Cordofan.
[S. 433]
FROMM fand bei Senegalgummi:
|
Lösung,
spezifisches Gewicht 1,035 |
Schäumt
|
ccm Schleim
aus 50 g |
Viskosität
bei 20° |
Säuregrad,
ccm Zehntel- Normal Natronlauge |
Drehungsver-
mögen αD |
Alkalische
Kupferlösung wird |
Dehnung %
|
Klebfähigkeit
|
|
|
hell
|
mäßig
|
3
|
1,94
|
2,1
|
−2°26′
|
etwas
|
reduziert
|
2,16
|
13,0
|
|
gelblich
|
„
|
9
|
2,0
|
2,1
|
−2°20′
|
„
|
„
|
2,06
|
14,1
|
|
gelblich
|
„
|
10
|
1,64
|
2,0
|
−1°25′
|
„
|
„
|
1,99
|
12,6
|
|
hell
|
stark
|
10
|
1,7
|
1,95
|
−1°19′
|
„
|
„
|
1,93
|
12,9
|
|
gelblich
|
mäßig
|
12
|
2,0
|
1,95
|
−2°16′
|
„
|
„
|
2,23
|
14,0
|
|
sehr hell
|
„
|
30
|
2,13
|
2,4
|
−2°28′
|
„
|
„
|
2,17
|
14,4
|
|
sehr hell
|
„
|
35
|
2,41
|
2,3
|
−2°47′
|
kaum
|
„
|
2,13
|
14,8
|
|
hell
|
stark
|
8
|
1,87
|
2,15
|
−2°51′
|
deutlich
|
„
|
2,19
|
13,0
|
|
hell
|
„
|
10
|
1,69
|
2,1
|
−1°44′
|
etwas
|
„
|
2,12
|
11,2
|
|
gelblich
|
mäßig
|
35
|
1,9
|
2,0
|
−2°27′
|
„
|
„
|
2,15
|
12,7
|
|
hellbraun
|
„
|
18
|
1,58
|
2,25
|
c. 1°
|
kaum
|
„
|
1,99
|
11,0
|
Möglicherweise brachten schon 1365 Kaufleute von Dieppe und Rouen, die «Pfeffer» holten, Gummi von der westafrikanischen Küste, St. Louis wurde schon zu dieser Zeit gegründet, aber erst 1449 tritt Gummi wirklich als Handelsartikel der portugiesischen Insel Arguim am Cap Blanco auf (KUNSTMANN), welche Insel von 1638 an Stützpunkt des Gummihandels der Holländer wurde, die die Insel eroberten, aber 1678 an die Franzosen, die schon vor 1664 sich am Senegal festgesetzt hatten, abtreten mußten, von welcher Zeit an die Franzosen mit geringen Unterbrechungen Herren des Gummihandels wurden. 1555 erwähnt SEBASTIAN MÜNSTER Senegalgummi in seiner Cosmographie. Der Gummihandel war Sache der Compagnie des Indes occidentales (I, S. 919), dann seit 1674 der Compagnie d’Afrique u. and. Gesellschaften. 1758 bis 1779 war England im Besitze der Kolonie, die aber 1785 wieder an die Franzosen überging. Damals wurde eine Compagnie de la Gomme gegründet, der 1786 die Comp. du Sénégal folgte (DURAND). Bereits 1760 erschienen 18000 cwt Senegalgummi am Markt. Der Aufschwung datiert von der Einführung der Triage in Bordeaux durch A. DORIS père 1832. 1865 erreichte die Ausfuhr von Senegalgummi den Wert von fast 4½ Mill. frs., der Export betrug 2,4 Mill. kg, 1880: 3013624 kg. 1884 wurde, als wegen der Erfolge des Mahdi im Sudan das Cordofangummi ausblieb, das Senegal-Konsortium gegründet. 1893 betrug die Produktion bereits c. 8 Mill. kg (COTTON). 1894 betrug die Ernte: 40000 Ballen, 1895: Bas du fleuve 35000 Ballen, Galam 10000 Ballen. Das Senegalgummi war das herrschende Gummi des Weltmarktes geworden. 1896 importierte Bordeaux 38600 Säcke. 1897 betrug die Ernte: 29000 Ballen Bas du fleuve und 21000 Ballen Galam, 1898: 20000 Ballen Bas du fleuve und 18 000 Ballen Galam. 1902 wurden 3 Mill. kg exportiert (20000 Ballen Bas du fleuve, 12000 Ballen Galam). Die Preise für Senegal gingen aber stark zurück, seit Cordofan in bester Qualität wieder erschien (1902) und die Einsammlung wurde, da weniger lohnend, eingeschränkt. 1903 erscheinen nur 6000 Ballen Galam im Handel und 1904 exportierte St. Louis nur 2370031 kg, davon 1842610 kg Hartgummi von den nördlichen Distrikten des Senegal, 484095 kg vom Sudan und Senegambien, 37396 kg Bruch und 5930 kg Staub; 1905: 49482 cwts. 1905 betrug der Export: 49482 cwts. Marseille empfing 1908 noch 6522 dz Senegalg., 1909 nur 4565, 1910 nur 2250 dz gegenüber 10094, 12204 und 10781 G. anderer Provenienz (bes. Nilgummi). Neben Bordeaux kommen auch Hâvre und Paris als Stapelplätze in Betracht.
Das Senegalgummi scheint allmählich seine Bedeutung zu verlieren. Die Produktion schwankt jetzt zwischen 2 und 4 Mill. kg. Es findet in der Hauptsache nur technische Verwendung (CAESAR-LORETZ).
c. Maroccogummi (Mogador, Barbarisches, braunes Barbary) aus Mogador, Saffi und Mazagan verschifft, wird von A. gummifera WILLD. (nach JACKSON = altalch) abgeleitet (HOOKER), spielt jetzt aber keine große Rolle mehr. Marocco verschiffte nach England 1905: 1731, 1906: 2073 cwts. Von dem Maroccogummi wurde (1891) die bessere Sorte als Mogador, die schlechtere als Amrad unterschieden (MABEN). Es kam früher besonders aus den Provinzen Sûs und Abda, weniger aus Shedma und Duguella, jetzt auch aus Fessan. Es ist nicht immer ganz in Wasser löslich[S. 434] (PEREIRA, GUIBOURT). Neben diesem fanden sich auch unter dem Namen weißer Mogador helle, vollkommen wasserlösliche Tränen, die wohl aus dem Sudan und von A. Senegal stammten. A. gummifera wächst in den Provinzen Blad Hamar, Rahamma und Sûs. 1888, zur Zeit der Gumminot, lieferte Mogador bessere Sorten. Bisweilen bilden Marocco, Mogador und Brown Barbary drei unterschiedene Sorten. Maroccogummi dreht rechts und soll von allen Gummis die geringste Menge Schleimsäure liefern (doch fand MARTINA 1894 c. 18%, vgl. S. 437). Vom Sudan wurde 1878 auch das Gummi von A. arabica nach Marocco gebracht (HOOKER). Es löst sich. gut zu einer hellen geschmacklosen Lösung.
d. Tunisgummi ist meist besser als das Maroccogummi. Es stammt von A. horrida (DOUMET-ADANSON). Die Ausfuhr ist gering. Die Ausfuhr von Tripolis erreichte 1890–1900 nur den Wert von £ 150–250 pro Jahr.
e. Capgummi und Orange River Gummi wird besonders von der im Hererolande weit verbreiteten Ac. horrida WILLD. (Dornbaum) gesammelt, dann auch von A. Karoo HAYNE (Karoobaum), die wohl mit A. capensis BURCHELL identisch oder nahe verwandt ist (dies Gummi stammt vorwiegend vom Orangefluß) und von A. Giraffae, die in Groß-Namaqua und Damaraland häufig ist. Capgummi kommt auch als hartes und weiches Gummi im Handel vor. Sein Aufschwung datiert von der Zeit der Gummimisere. Es ist gefärbt und viele Stücke lösen sich nicht klar in Wasser zu einem dicken Schleim (VÉE).
f. Gummi aus den deutsch-afrikanischen Kolonien. Neuerdings — besonders als die Gumminot Ende des XIX. Jahrh. am höchsten gestiegen war — hat man versucht, Gummi sowohl aus Deutsch-Ostafrika (Usambara), wie aus Deutsch-Südwestafrika (Angra Pequena, Namaqualand) in den Handel zu bringen. Deutsch-Ostafrika liefert noch wenig (kaum für M. 1000 jährlich), Deutsch-Südwestafrika aber (nach dem Cap und direkt) viel (für M. 10000 und mehr. 1897: 5000 kg, WORLÉE). Das Gummi der deutschen Kolonien ist von sehr ungleichem Werte. Zum Teil mag dies darauf zurück zu führen sein, daß man die guten Gummilieferanten noch nicht kennt oder doch von den schlechten nicht genügend unterscheidet, zum Teil darauf, daß die Auslese (Triage) noch in den Kinderschuhen steckt. — Man findet oft in dem gleichen Handelsmuster helle und dunkle, lösliche und unlösliche Stücke. Für pharmazeutische Zwecke ist es unverwendbar. A. horrida vermag jedenfalls ein gutes Gummi zu liefern, das von A. usambarensis und Giraffae scheint jedoch minderwertig zu sein.
In Deutsch-Ostafrika sind besonders A. stenocarpa, A. usambarensis und A. spirocarpa, vielleicht auch A. arabica, A. Seyal, A. verugera, A. Stuhlmanni, A. Kirkii gummiliefernd. Die gummiliefernden Acacien Ostafrikas hat TAUBERT zusammengestellt (in ENGLER, Pflanzenwelt Ostafrikas und Notizbl. d. Bot. Gart. Berlin Nr. 14, 1898).
Das Gummi aus Deutsch-Südwestafrika ist, da die gleiche Stammpflanze und zum Teil wohl auch die gleichen Provenienzen in Betracht kommen, mit einem Teile des Capgummi identisch. Jedenfalls stammt der größte Teil des südwestafrikanischen Gummi von A. horrida (WARBURG, MARLOTH) und nur ein kleiner Teil von A. erioloba, A. Giraffae, A. albida und A. dulcis. GESSERT empfahl daher die Anpflanzung der A. horrida, des Dornbaums. Die Vegetationsbedingungen in Deutsch-Südwestafrika, das sonst fast nichts hervorbringt, eignen sich in der Tat ganz außerordentlich für die Kultur von Gummiacacien und außer A. horrida möchte ich auch A. Senegal und A. arabica zur Kultur empfehlen.
Das Gummi von Angra Pequena, das HARTWICH (1898) untersuchte, stammte wohl von A. horrida WILLD. Es besitzt eine starke Viskosität, dreht rechts, hat eine geringe Aschenzahl (1,997–2,722%) und löst sich in Wasser. Gummi aus dem Hinterlande von Angra Pequena drehte bald rechts: G. Tlach (= braun), bald links: G. Amrad (DIETERICH). Eine dritte Sorte war als Auruar bezeichnet. HEFELMANN bestimmte in sog. Heiragummi von A. horrida den Pentosangehalt zu 20,65–51,21% (bestes Cordofan 29,4%), das Wasser zu 8,5–17%. Neuerdings untersuchtes Gummi von A. horrida WILLD. aus Südwestafrika (Angra Pequena) erwies sich als bestem G. arabicum gleichwertig (MEININGER 1908). Ein Gummi von A. detinens BURCH. vom nördlichen Hererolande (Watersberg) löste sich in Wasser und besaß starke Klebkraft, war aber gelbbraun gefärbt (MANNICH).
Das Gummi aus Deutsch-Adamaua, das 1909: 274110 kg exportierte, wird in 3 Sorten: Falli und Marrua von A. Senegal (und xanthophloea?) und Mumuye (von einem Combretum) gehandelt (DALZIEL, Bull. Kew Gard. 1910).
[S. 435]
Auch die deutsche Kolonie Togo liefert etwas Gummi. Das Gummi von der Station Sansanne Manga in Togo, von einer mit A. arabica verwandten Art, untersuchte FENDLER.
g. Das Gummi von Angola, der an Deutsch-Südwestafrika im Norden angrenzenden Kolonie, stammt nach MOLLER von A. horrida WILLD., A. etbaica SCHWF., A. erubescens WELW., A. albida DEL. (Cócótó, Capollo, Espinheira).
h. Das Gummi von Nord-Nigeria (aus den Provinzen Bornu und Yola) stammt besonders von Acacia Senegal (Kol-Kol), A. Seyal (Karumga), A. Suma (kara kaia) und A. Sieberiana (Katalabu u. Farin kaia). Die Ausfuhr betrug 1905: 4140, 1906: 6080 cwts. (Beschreibung und Analyse in Bullet. Imper. Instit. 1910).
i. Auf Réunion wird von A. dealbata und A. Lebbeck G. gesammelt (BOCQUILLON 1899).
B. Indisches Acaciengummi.
Die Pharmacographia indica bemerkt 1890, daß das aus Ostindien, besonders Bombay, exportierte G. arabicum ausschließlich «vom Roten Meer» stammt, also ostafrikanisches Gummi ist. «No part of it being the produce of India.» Von dem arabischen Gummi unterscheidet der indische Markt zwei Sorten: maklai (große runde oder wurmförmige Stücke, ähnlich dem Senegalgummi) — nach dem Hafen Makala genannt — und maswai (eckige oder wurmförmige Stücke) — nach dem Hafen Massaua genannt — (DYMOCK). Auch die Namen Bombay pink und Aden pink sind für Sudangummi in Indien in Gebrauch (PREBBLE).
Es wird aber seit 1893 auch Acaciengummi, das aus Indien selbst, und zwar den Wüsten im Nordwesten, stammt, exportiert. Das Gummi von Sind (Karachigummi) liefert besonders A. Senegal, dann auch A. arabica, die beide in der Wüste wachsen. Das Oomarkoteggummi stammt jedenfalls von A. Senegal (PREBBLE 1893). Die besten Qualitäten ostindisches oder Bombaygummi sind blaßbräunlich oder rötlich und vollkommen in Wasser löslich. Das Pondicherygummi ist weniger gut. Das Gummi von Acacia arabica aus Ostindien ist das Amrad-, Amraoti-, oder Oomrawatti-gummi (von hamra = rot). Es bildet ziemlich große, zum Teil stark gefärbte Tränen und gibt einen schwachen reduzierenden Schleim. Die dunkleren Stücke enthalten Gerbstoff. FROMM fand die Drehung −1° 12′.
Auch ein Teil des Ghatti, Ghátí oder Gatti gum aus Indien wird von A. arabica gewonnen (ATKINSON). Das Gummi der von Penjáb bis Behar vorkommenden A. arabica heißt in Indien Babul gum (babúl-kí-gónd, kikar, ki-gónd, babúl-gónd) und ist ein minderwertiger Ersatz für Cordofangummi. Man sammelt es im März und im April. Ein Baum liefert 2 lbs (WATT, Dict.). Das Gattigummi meiner Sammlung (1888) bildet relativ große, hellgelbliche, glasige Knollen. Der Namen Ghátí (das Adjektiv ghati bedeutet: aus dem Lande Desh stammend, DYMOCK) wird aber auch für das Gummi von Anogeissus latifolius benutzt (s. weiter hinten S. 437).
Weniger Bedeutung besitzen die Gummis von Acacia leucophloea (ist in Wasser reichlich löslich), von Ac. Catechu (auch fälschlich unter dem Namen babul gum gehend), hauptsächlich in rundlichen, gefärbten Tränen (reichlich in Wasser löslich), von A. modesta WALL., kommt aus Nordindien unter dem Namen Amritsargummi in kleinen Tränen oder wurmförmigen Stücken (sehr löslich in Wasser) und von Acacia Farnesiana aus Sind, rundliche Stücke, hellgelb-rötlichbraun, (in Wasser teilweise löslich); enthält oft einen Pilz (Ascomycet?) und Kristalle. Auch das Gummi von Ac. ferruginea DC., A. Jacquemontii BENTH., A. lenticularis HAM. und A. Suma KURZ wird in Indien gesammelt.
Das indische Gummigeschäft wird oft durch Pest und Hungersnot ungünstig beeinflußt. Gummi wird neuerdings auch sortiert in: glasig, blaß, ostindisch fein, ostindisch-rot Amrad.
Vorderindien exportierte Gummi arabic. 1905/06: 3967, 1906/07: 2684, 1907/08: 3010, 1908/09: 1119 cwts.
[S. 436]
C. Australisches Acaciengummi.
Aus Australien, das ja sehr reich an Acacien ist, wurde besonders seit der Gumminot Gummi exportiert (1899: 2186, 1905 aber nur 98 cwts). Obenan steht hier das Gummi des Golden oder Common Wattle Tree, A. pycnantha BENTH., das sog. Wattle gum aus Victoria. Es bildet große, gelbliche oder rötliche, wasserlösliche Tränen, ist aber bisweilen gerbstoffhaltig; dann das ebenfalls wasserlösliche Gummi (Sidneygummi) von A. decurrens WILLD. (A. mollissima WILLD.), des Black oder Green Wattle tree und die G. von A. homalophylla A. CUNN., A. pendula CUNN., A. sentis F. V. M.
Als gummiliefernd werden auch A. excelsa, A. Farnesiana, A. harpophylla, A. neriifolia criophylla und A. microbotrya angegeben. Die Gummis von A. binervata DC., A. dealbata LK., A. elata CUNN., A. glaucescens WILLD., A. penninervis SIEBER, A. vestita KER. Gawl. sind nicht ganz löslich und lassen 4–41% ungelöst. Exportiert wird zurzeit vornehmlich das Gummi von A. pycnantha. Die Eigenschaften der australischen Gummis gehen aus folgender Tabelle MAIDENS hervor.
|
I. Gruppe (Arabin-Gruppe)
|
Arabin
|
Metarabin
(Bassorin) |
Feuchtigkeit
|
Asche
|
||
|
Acacia
|
homalophylla
|
79,84
|
—
|
16,83
|
2,86
|
|
|
„
|
pendula var. glabrata
|
79,5
|
—
|
17,51
|
2,39
|
|
|
„
|
sentis
|
76,97
|
—
|
17,88
|
4,59
|
|
|
II. Gruppe (Übergang zu III)
|
Arabin
|
Metarabin
(Bassorin) |
Holz-
substanz |
Feuchtigkeit
|
Asche
|
|
|
Acacia
|
binervata
|
76,57
|
4,24
|
1,62
|
16,01
|
0,771
|
|
„
|
dealbata
|
76,37
|
4,163
|
1,0
|
16,3
|
1,12
|
|
„
|
elata
|
74,20
|
6,85
|
—
|
17,73
|
0,581
|
|
„
|
glaucescens
|
66,59
|
12,30
|
0,5
|
16,48
|
3,18
|
|
„
|
penninervis
|
70,30
|
11,42
|
—
|
16,67
|
0,66
|
|
III. Gruppe (Metarabin-Gruppe)
|
Arabin
|
Metarabin
(Bassorin) |
Holz-
substanz |
Feuchtigkeit
|
Asche
|
|
|
Acacia
|
decurrens (Cambewarra)
|
41,07
|
32,96
|
—
|
23,26
|
2,38
|
|
„
|
decurrens (Rydalmere)
|
23,45
|
49,88
|
—
|
25,45
|
1,706
|
|
„
|
decurrens (Gosford)
|
30,10
|
44,45
|
—
|
20,57
|
3,418
|
|
„
|
decurrens (Valley)
|
29,10
|
46,20
|
—
|
21,02
|
2,827
|
|
„
|
decurrens (Sydney)
|
17,20
|
56,14
|
—
|
23,83
|
2,08
|
|
„
|
mollissima
|
23,82
|
52,10
|
—
|
21,66
|
2,081
|
|
„
|
mollissima var. Leichhardtii
|
9,20
|
66,59
|
—
|
21,20
|
2,28
|
|
„
|
mollissima var. Leichhardtii
|
7,90
|
63,80
|
—
|
23,83
|
3,80
|
|
„
|
vestita
|
38,99
|
46,40
|
1,2
|
11,63
|
0,954
|
D. Amerikanisches Acaciengummi.
Ohne große Bedeutung ist z. B. das sog. Paragummi aus Brasilien, das von A. Angico MART. gesammelt wird und dem Arab. G. ähnlich ist. LEMELAND fand in einem Gomme de Brésil (Angico) 7,8% Unlösliches, 12,75% Wasser, 2,2% Asche, 20,6% Galaktane, 70,2% Pentosane. Es lieferte Arabinose und drehte αD = +46°94. Auch VÉE analysierte (1888) brasilianisches G. Das Cujigummi aus Caracas wird von A. micrantha BENTH. abgeleitet. Wasser löst nur 26%.
Eine gute Übersicht über die Beschaffenheit der Acaciengummis gibt folgende Tabelle von MARTINA.
[S. 437]
|
Name des
Gummis |
Ort der
Herkunft |
Asche
% |
Kalk in
Gummi % |
Kalk in
der Asche % |
Schleimsäure
% |
Galaktose
% |
Furfurol
% |
Pentosen
% |
Gesamt-
glukosen % |
Galaktose
+Pentosen % |
|
Arabisches
|
Arabien
|
3,60
|
1,04
|
28,88
|
22,98
|
30,66
|
13,57
|
27,14
|
58,30
|
57,80
|
|
„
|
Senegal
|
3,25
|
0,90
|
27,69
|
19,72
|
26,29
|
12,97
|
25,94
|
57,58
|
52,23
|
|
„
|
Ghezireh
|
2,75
|
0,94
|
34,13
|
12,42
|
17,89
|
19,32
|
36,62
|
60,66
|
54,52
|
|
„
|
Senegal
|
3,30
|
0,95
|
28,70
|
15,13
|
20,17
|
16,75
|
33,50
|
60,59
|
53,67
|
|
„
|
„
|
7,16
|
1,21
|
16,89
|
22,68
|
30,24
|
16,58
|
33,16
|
64,34
|
63,40
|
|
„
|
„
|
3,30
|
1,07
|
29,39
|
12,30
|
16,68
|
22,40
|
44,80
|
61,53
|
61,48
|
|
„
|
Aden
|
3,70
|
1,33
|
35,40
|
18,68
|
24,90
|
15,26
|
30,52
|
56,90
|
55,42
|
|
„
|
Mogador
|
3,50
|
0,78
|
22,30
|
18,10
|
24,13
|
13,90
|
27,80
|
50,31
|
51,93
|
|
„
|
Neu-Holland
|
0,50
|
—
|
—
|
45,82
|
61,09
|
10,85
|
21,70
|
43,75
|
82,79
|
|
„
|
Egypten
|
3,60
|
0,64
|
17,77
|
14,95
|
19,93
|
15,56
|
31,12
|
55,10
|
51,05
|
|
„
|
Keggias
|
3,15
|
1,17
|
37,14
|
10,27
|
13,69
|
21,06
|
42,12
|
57,72
|
55,81
|
|
G. Chartum
|
Obernil
|
3,05
|
1,22
|
40,00
|
5,67
|
7,56
|
24,60
|
49,20
|
63,90
|
56,76
|
|
G. bianca
|
Sudan
|
3,30
|
1,00
|
30,30
|
6,72
|
8,96
|
17,60
|
35,20
|
42,76
|
44,16
|
|
Arabisches
|
Ostindien
|
4,16
|
0,97
|
23,31
|
14,75
|
19,66
|
17,68
|
35,96
|
56,52
|
55,62
|
|
G. Galam
|
Senegal
|
3,00
|
0,53
|
17,66
|
15,15
|
20,20
|
13,91
|
27,82
|
47,16
|
48,02
|
|
G. Adansonii
|
„
|
4,05
|
0,61
|
15,06
|
4,00
|
5,34
|
21,10
|
42,20
|
46,11
|
47,54
|
|
A. Senegal
|
„
|
3,30
|
0,78
|
23,63
|
10,03
|
13,37
|
13,89
|
27,78
|
43,80
|
41,05
|
|
A. nilotica
|
Egypten
|
2,80
|
1,36
|
45,00
|
5,91
|
7,88
|
21,44
|
42,88
|
49,13
|
50,16
|
|
„ „
|
„
|
2,60
|
0,77
|
29,61
|
13,40
|
17,86
|
30,10
|
60,20
|
70,80
|
78,06
|
|
A. homaloph.
|
Melbourne
|
2,20
|
0,78
|
35,45
|
55,41
|
73,77
|
9,75
|
19,50
|
71,57
|
93,27
|
|
A. Lebbeck
|
Isle d. France
|
3,25
|
0,49
|
15,07
|
22,99
|
30,75
|
17,10
|
34,20
|
66,20
|
64,90
|
|
A. dealbata
|
Van Diemensland
|
0,65
|
—
|
—
|
39,09
|
52,12
|
8,89
|
17,68
|
73,93
|
69,80
|
|
A. della Vesta
|
Australien
|
0,75
|
—
|
—
|
45,49
|
60,65
|
10,27
|
20,54
|
59,86
|
81,19
|
|
A. Angico
|
Brasilien
|
2,89
|
—
|
—
|
1,23
|
1,63
|
40,35
|
80,70
|
74,22
|
82,33
|
II. Gummi von Pflanzen, die nicht zur Gattung Acacia gehören.
A. Indische Gummis.
Außer den oben genannten G. von Acaciaarten produziert Vorderindien noch eine ganze Anzahl anderer G. und bringt einige auch zur Ausfuhr. (1887 schon 60000 Quint.) Obenan steht hier das G. von Feronia Elephantum CORR., einer in Vorder- und Hinterindien, Ceylon und Java vorkommenden baumartigen Aurantiee, die viel G. aus der Rinde ausschwitzt. Dies Wood apple gum ist das wertvollste indische G. Es findet sich in kleinen farblosen bis rötlich-braunen unregelmäßigen Tränen oder großen Klumpen oder Stalaktiten oder hornförmigen Stücken, ist, wenn nicht mit anderen G. vermischt (was öfter vorkommt), ganz (oder doch zu 75%) in Wasser löslich und gibt eine Lösung, die stärker viskos ist als die des G. arab. Die Lösung rötet Lakmus, dreht rechts (+0,4°, FLÜCKIGER) und wird gefällt durch Alkohol, Ammonoxalat, Alkalisilikat, Eisenchlorid, Bleiacetat und Bleiessig, Ätzbaryt, nicht durch Borax und Pottasche. Es enthält 17% Wasser und 5,12% Asche und gibt mit HNO3 Schleimsäure. Es ist mit G. arab. nicht identisch. Feroniableiarabat gab z. B. 14,76% PbO. Bleiarabat 30,6% PbO. LEMELAND fand im G. von Feronia Eleph. 8,4% Unlösliches, 17,7% Wasser, 4,3% Asche, 51,8% Galaktane, 40,1% Pentosane. Es lieferte Galaktose und drehte αD = −6°41′. Es ist das beste indische Ersatzmittel fürG. arab. und wird als solches von der Pharmacopoea indica empfohlen. Da es keine Oxydasen enthält, ist es also in mancher Hinsicht besser als jenes (GORIS et LEFÈVRE).
Ein anderes wichtiges G. ist das auch unter dem Namen Ghattigummi, G. indicum Gháti oder Dhaurag. (s. oben S. 435) im Handel vorkommende G. der Combretacee Anogeissus latifol. WALL. (und A. pendula EDZW.). Es bildet jedenfalls die Hauptmasse des Ghati von Bombay (Pharm. indic.) und wird in großen Mengen exportiert, etwas auch aus franz. Indien und Nord-Nigeria. Es bildet rundliche oder wurmförmige, bernsteingelbe oder farblose, opake Stücke mit glasigem Bruch, frei von Rissen, löst sich, wenn rein, in Wasser, hat die doppelte Viskosität wie G. a., ist also sehr wertvoll, seine besten Sorten auch für pharmazeutische Zwecke wohl brauchbar.
[S. 438]
Weniger wichtig sind dann die folgenden indischen G. (vgl. Pharmacogr. indic.). Zunächst das G. von Melia Azadirachta L. (Meliacee) in großen Tränen oder wurmförmigen Stücken, farblos bis bernsteinfarben, leicht löslich in Wasser, die Lösung gelatiniert durch Eisenchlorid und Bleiessig, nicht durch Borax oder Bleiacetat (wird auch in Réunion, Gouadeloupe und Franz. Indien gesammelt, BOCQUILLON). Swietenia Mahagoni (Meliacee) aus der Rinde, helle Fragmente, löst sich leicht in Wasser, Lösung reduziert FEHLINGsche Lösung. — Pithecolobium dulce (Mimosee) in rundlichen Tränen von rotbrauner Farbe; in Wasser löslich. — Pithecolobium Saman (Mimosee) liefert ein schlechtes G., das in Wasser aufquillt. — Prosopis spicigera, viele Risse, sehr brüchig, gibt eine dunkel gefärbte viskose Lösung, ein wertvolles Gummi, ähnlich dem Mesquileg. — Albizzia procera wächst bei Bombay. Das G. bildet rötlich-braune, glatte Tränen, wird beim Liegen opak und löst sich dann nicht mehr vollständig, enthält oft Hyphen, Kristalle und Gewebetrümmer. — Albizzia stipulata gibt ein dunkelgefärbtes G., das in Wasser nur aufquillt und nur wenig löslich ist. — Albizzia Lebbeck bildet glatte Stalaktiten, ist nicht immer ganz löslich. — Albizzia odoratissima, große transparente Tränen von Bernsteinfarbe, quillt nur mit Wasser. — Albizzia amara BOIV., süßlich, mit hoher Klebkraft. — Anacardium occidentale L. (Acajoug. Cashawag.), gelbe bis rotbraune Stalaktiten, trübe löslich, reduziert Fehlingsche Lösung, dreht links. Wird auch in Brasilien, Martinique und Guadeloupe gesammelt (BOCQUILLON, Beschreibung in WIESNER, Rohstoffe). Semecarpus Anacardium in Cochinchina, Indien, Neucaledonien, Réunion (enthält 96% Bassorin) — Spondias Mangifera, gelblich bis rotbraun, mit viel Wasser einen Schleim gebend. — Odina Wodier ROXB. in großen brüchigen, rissigen Tränen und Stalaktiten von heller bis Bernsteinfarbe. — Mangifera indica. LEMELAND fand im G. von Mangifera indica 60,64% Unlösliches, 16,5% Wasser, 4% Asche, 30,36% Galaktane, 42% Pentosane. Das G. lieferte Arabinose. Es drehte αD = −25°33′. Buchanana laitifol. ROXB. völlig löslich. — Bauhinia purpurea wenig löslich. — B. variegata L., enthält viel Stärke und Calciumoxalat, unregelmäßige Stücke, nicht vollständig löslich. — Cedrela Toona (Meliacee) von den Nilagiris, bildet einen dicken Schleim. Wird beim Aufbewahren unlöslich. — Terminalia Belerica in Tränen und wurmförmigen Stücken, schwillt nur in Wasser, enthält Kristalle. — Terminalia tomentosa WIGHT et ARN., nur zum Teil löslich. — Aleurites moluccana, teilweise löslich, enthält oft Pilzhyphen. — Poinciana regia, enthält viel Kalkoxalatsphärokristalle, löslich in Wasser zu einem dicken Schleim, reduziert etwas FEHLING. — Chloroxylon Swietenia aus Bangalore, in Wasser kaum löslich. — Eriodendron orientale, ähnlich dem Cochlospermumg. (WIESNER). — Bombax malabaricum ROXB. und B. pentandrum L., Malabargummi. — Aegle Marmelos. — Diospyros melanoxylon. — Moringa pterygosperma (gomme de ben ailé Moscherus, G. Shega, auch aus Réunion), wohl eher ein Traganth (s. d.), wie das von Cochlospermum Gossypium (s. unter Traganth). Beschreibung bei WIESNER. — Über die Sterculiaceeng. siehe unter Traganth (S. 406) und Bull. Imp. Inst. London 1910, 361.
Unter den ostindischen Sorten finde ich 1910 bei GROSSMANN auch Camporeg. (Cownpore ist eine der besten technischen G. Sorten Indiens, MORPURGO), in der Liste von FRITZ ein Elas-India (?) aufgeführt.
Übersicht der Löslichkeit und der Reaktionen von indischen Gummis. (Nach Pharmacographia indica.)
|
A. Dem arabischen ähnliche Gummis, in Wasser löslich.
|
|||
|
Neutrales Bleiacetat
|
Eisenchlorid
|
Borax
|
|
|
Acacia arabica
|
—
|
—
|
Gelatinisiert
|
|
„ leucophloea?
|
—
|
—
|
Gelatinisiert
|
|
Anogeissus latifolia
|
—
|
—
|
Gelatinisiert
|
|
Acacia modesta
|
Wird niedergeschlagen
|
Gelatinisiert
|
—
|
|
Feronia Elephantum
|
Wird niedergeschlagen
|
Gelatinisiert
|
—
|
|
Swietenia Mahagoni
|
Wird niedergeschlagen
|
Gelatinisiert
|
—
|
|
Acacia Catechu
|
—
|
Gelatinisiert
|
Gelatinisiert
|
|
Pithecolobium dulce
|
—
|
Gelatinisiert
|
Gelatinisiert
|
|
Melia Azadirachta
|
—
|
Gelatinisiert
|
—
|
|
Prosopis spicigera
|
Wird niedergeschlagen
|
Gelatinisiert
|
Gelatinisiert
|
| [S. 439]
B. Gummis, die sich leicht in Wasser lösen, aber einen mehr oder weniger trüben Schleim bilden, infolge unlöslicher, suspendierter Substanzen.
|
|||
|
Bleiessig
|
Eisenchlorid
|
Suspendierte
Substanzen |
|
|
Anacardium occidentale
|
—
|
—
|
Ein gelbliches Öl
|
|
Odina Wodier
|
—
|
Gelatinisiert
|
Ein gelbliches Öl
|
|
Bauhinia variegata
|
Wird niedergeschlagen
|
Gelatinisiert
|
Stärkekörner
|
|
Poinciana regia
|
—
|
Gelatinisiert
|
Calciumoxalat in
Sphaero-Kristallen |
|
Keines dieser Gummis wurde durch Borax gelatinisiert.
|
|||
|
C. Gummis, die unvollkommen löslich sind und einen mehr oder weniger gelatinösen Schleim bilden mit einer großen Menge Wasser.
|
|||
|
Neutrales Bleiacetat
|
Eisenchlorid
|
Borax
|
|
|
Cedrela Toona
|
—
|
—
|
—
|
|
Albizzia Lebbeck
|
—
|
Gelatinisiert
|
—
|
|
Acacia Farnesiana
|
—
|
Gelatinisiert
|
—
|
|
Albizzia procera
|
—
|
Gelatinisiert
|
—
|
|
Spondias mangifera
|
Wird niedergeschlagen
|
Gelatinisiert
|
—
|
|
Aleurites moluccana
|
Gelatinisiert
|
—
|
Gelatinisiert
|
|
D. Gummis, die zu einer gelatinösen Masse aufschwellen, sehr wenig löslich.
|
|||
|
Albizzia odoratissima — Albizzia stipulata — Bauhinia purpurea — Terminalia belerica — Chloroxylon Swietenia.
|
|||
Auch LÜHN bestimmte bei zahlreichen indischen Acacien- u. and. Gummis Viskosität, Klebkraft, Asche, Verhalten zu Alkohol, Eisenchlorid und Bleiacetat. Ebenso untersuchte MASING (1880) zahlreiche indische Sorten. (Siehe Lit.)
B. Javanische Gummis.
In Java finden sich wenige Gummis, das Klima ist zu feucht. Das beste ist das wasserlösliche Mimbagummi von Azadirachta indica JUSS. (PRINSEN Geerligs).
C. Australische Gummis.
Das Gummi der australischen Meliacee Flindersia maculosa ist vorzüglich; es enthält c. 80% Arabin, 16,5% Wasser und 2,6–2,7% Asche (MAIDEN). Dann liefern Eucalyptusarten (WIESNER), z. B. Euc. rostrata (BROWNSCOMBE) Gummi, sowie Grevilleaarten, z. B. Gr. robusta (RÖSER und PNAUX). Weitere australische Gummis erwähnt MAIDEN. Sie stammen von Mezoneurum Scortechinii F. V. M., einer Caesalpiniee (Barristergummi, quillt nur in Wasser), Panax dendroides var. angusta F. V. M., einer Araliacee (nur quellbar), Panax Murrayi F. V. M. (löslich). Auch andere Panaxarten (P. elegans, P. sambucifol. var. angustum) werden angegeben (HARTWICH).
D. Amerikanische Gummis.
Das Cajougummi (s. oben S. 438) ist das Gummi von Anacardium occidentale L. Es ist löslich in Wasser. — Das Mesquitég. (Mezquite, Misquit, Miquit) aus den südlichen Vereinigten Staaten, Mexiko und Südamerika, besonders von Texas bis Kalifornien, von der Mimosee Prosopis glandulosa TORREY u. and. Prosopisarten (vgl. WIESNER, Rohstoffe), ist eine untergeordnete Sorte, die nur in der Technik und Malerei brauchbar ist. Einige Sorten sind löslich in Wasser, von süßem Geschmack, andere lösen sich nur teilweise (WIESNER). VALENTA und STOHMANN stellen diesem Gummi ein günstiges Prognostikon. — Das amerikanische Chewing gum stammt von Prosopis dulcis SCHIEDE. — Das Sonorag. Mexikos, früher von Mimosa coccifera abgeleitet (SOUBEIRAN), ist wohl auch ein Prosopisg. Bei seiner Bildung ist, wie es scheint, ein Tier (Coccus?) beteiligt. Die Mexikaner nennen es auch tzinacantuitlatl (= stercus vespertilionum).[S. 440] Ebenso wird das Goma de cujé yaque aus Venezuela von Prosopisarten abgeleitet. Außer den angeführten Prosopisarten werden noch besonders genannt: P. horrida KUNTH, P. inermis H. B. K., P. pubescens BENTH. — Das Ciruelagummi aus Caracas stammt von Bunchosia glandulifera H. B. K. Es ist vollständig in Wasser löslich (HARTWICH). — Das Guaramachog. aus Caracas von Pereskia Guamacho ist nur zu 48% löslich, das Cederng. aus Caracas von Cedrela odorata sogar nur zu 25%. — Das Chagual- oder Magueygummi aus Chile, das lösliche und nur zum Teil lösliche Stücke, meist Hohlzylinderfragmente, enthält und bei dessen Bildung auch ein Tier (Castnia elegans) beteiligt ist, stammt von Bromeliaceen, und zwar Puya-(Pourretia)-Arten (WIESNER, HARTWICH). Es löst sich meist nur zu c. 16–18% in heißem Wasser (HARTWICH), ist daher eines der bassorinreichsten. Die Gallerte färbt sich mit Soda gelb. Es enthält 13,46% Wasser und 2,43% Asche (WIESNER). Doch kommen sehr verschiedenartige Produkte unter dem Namen im Handel vor. Die Farbe schwankt zwischen farblos und schwarz. — Das «Goma de orore» von Venezuela stammt von Pithecolobium hymenaeaefol. BENTH., das «Goma de caro» von ebenda von Enterolobium cyclocarpum GRIS. (ERNST, vgl. bei WIESNER), das «Goma de tuna» von Venezuela und den Antillen von Opuntia ficus indica (ERNST, HANAUSEK). — DOMIMGUEZ beschreibt zwei argentinische G.: Cebil von Piptadenia Cebil GRISEB. (enthielt 80,78% Arabin) und Brea von Caesalpinia praecox R. et PAV. (mit 77,9% Arabin). Er erwähnt auch ein brasilianisches G. von Piptadenia rigida BENTH., das 80,7% Arabinose aber nur 1,63% Galaktose und 1,2% Schleimsäure lieferte. Die Herkunft des Perugummi ist unbekannt. Einige (GINTL, HOEHNEL) leiten es von einer Asphodelusart ab, WIESNER bestreitet die Ableitung.
Lit. Cordofang.: DAVID a. a. O. — BEAM, III Rep. Wellc. res. Labor., Khartoum 1908. — Senegalg.: SOUBEIRAN, Des gommes du Sénégal. J. ph. chim. 1856. — FLÜCKIGER, Schweiz. Wochenschr. 1869. — VUILLET, Gommes etc. du Sénégal. Bull. jard. col. Paris 1901. — Somalig.: REVOIL, Voyages au Cap des Aromates. Paris 1880. — DURAND, Voyage au Sénégal. 1802. — CORRE, Journ. pharm. 1876. — Pharm. Post 1896 und Bull. soc. pharm. du Sud Ouest. — WÖRDEHOFF und SCHNABEL, Zeitschr. trop. Landwirtsch. 1897. — Somalig.: MILES, Roy. geogr. Soc. 1872. — Capg.: VÉE, Thèse. Paris 1888. — HAHN, Zeitschr. Ges. f. Erdkunde. 1868, 214. — Tunisg.: DOUMET-ADANSON, Note sur l’acac. gommifère de la Tunesie. Rep. pharm. 1874. — Mogadorg.: J. D. HOOKER und JOHN BALL, Journal of a tour in Marocco and the Great Atlas etc. London 1878. Bot. Jahresb. 1878, 899. — G. aus Deutsch-Südwestafrika: HARTWICH, Apoth. Zeit. 1897 u. 1898, Nr. 22. — THOMS, Tropenpfl. 1898. — SIEDLER, Ber. d. pharm. Ges. 1898. — K. DIETERICH, Ebenda 1898. 87. — WARBURG, Zeitschr. trop. Landw. 1898. — MANNICH, Tropenpfl. 1901, 284. — GESSERT, Zeitschr. f. trop. Landwirtsch. 1898. — G. aus Deutsch-Ostafrika: VOLKENS, Notizbl. d. K. Bot. Gart. Nr. 14 (1898). — BUSSE, Reisebericht V, 1900. Naturw. Wochenschr. 1901. Ber. d. pharm. Ges. 1904. — WAAGE, Ber. d. pharm. Ges. 1893. — THOMS, Notizbl. d. Bot. Gart. 1899. — MANNICH, Gummiarten Deutsch-Ostafrikas. Tropenpfl. 1902, 201. — Togo: FENDLER, Tropenpflanzer 1903, 228. — Angola: MOLLER, Tropenpfl. 1898. — Nord-Nigeria: G. from North. Nig. Bullet. Imper. Instit. London 8 (1910). — Indische G.: FLÜCKIGER, Pharm. Journ. 10 (1869) 641. — HANBURY a. a. O. — PREBBLE (East Ind. gums). Pharm. Journ. 1892, 683 u. 1893, 22. — GORIS et LEFÈVRE, Ghati-Gummi. Bull. Sc. pharmacol. 1904, 17. — LEMELAND (G. von Mangifera indica). Journ. pharm. 1904, 584. — MASING, Vergl. Unters. einiger indischer Handelssorten d. arab. G. (Tabelle). Arch. pharm. 59 (1880) 34. — LÜHN, Indische G. Pharm. Zeit. 1902. — RIDEAL und YOULE, Pharm. Journ. 1891, 147. — DYMOCK, Veget. mat. med. West. Ind. 1885. — Pharmacograph. indic. — Javag.: PRINSEN Geerligs, Rev. cult. col. 1902. — Austral. G.: MAIDEN, Chemistry and commercial possibilities of wattle gum Pharm. Journ. 20 (1890) 869 und Panaxgum Pharm. Journ. 1892. — J. WIESNER, Unters. über d. Sorten von sog. Eucalyptusgummi, welche in d. Samml. d. Öster. Apoth. Ver. enthalten sind. Zeitschr. d. Öster. Ap. Ver. 1871. — F. V. MÜLLER, Select plants for industr. cult. in Victoria. 1876. — BROWNSCOMBE, G. Eucal. rostr. Pharm. Journ. 1899. — RÖSER et PNAUX, Anal. de la gomme du Grevillea robusta. Journ. ph. 10 (1899) 398. — MAIDEN, Proc. Linn. Soc. New South Wales 1891 u. 1892. — Amerikan. G.: SYMES, Notes on Brazilian Drugs Yearbook of ph. 1882. — SOUBEIRAN, La gomme de Sonora. Journ. pharm. 1855, 196. — MILLER, Mezquite gum. Pharm. journ. 1876. — HARTWICH, Chagual-Gummi. Z. öster. Ap. Ver. 1896, 565 (dort die Literatur). — HOEHNEL, Öster. Chem. Zeit. 1900. — DOMIMGUEZ, Note sur deux gommes d. l. Rep. Argent. Rev. farmac. Buenos Aires 1904.
[S. 441]
LEMELAND, Contrib. à l’étude d. quelqu. gommes (Gezireh, Cordofan, Brésil, Cochlosperm., Feronia u. and.). Thèse 1905. — THOMAS MABEN, Notes on some gum samples. Pharm. Journ. 20 (1890), 717, Pharm. Zeit. 1891, 122. — SIMMONDS (Gummisorten des Hand.), Bull. of pharm. 1891. — MARTINA, l’Orosi 1894 (Apoth. Zeit. 1894, 296). — BOCQUILLON (Gummisort. d. franz. Hand.). Rep. de pharm. 1899, 194. — T. F. HANAUSEK, Gummi in LUEGER, Techn. Lexikon. — HARTWICH, in HAGER-FISCHER-HARTWICH, Pharmaz. Praxis. — WIESNER, Gummi u. Harze und Rohstoffe. — VALENTA, Klebe- und Verdickungsmittel. Catal. d. colon. franc. Exposition intern. Paris 1867. — COOKE, Rep. of the gums etc. of the East India Museum 1874. — GEHE & CO., Handelsberichte. — FLÜCKIGER, Pharmakogn. (dort auch die Lit. der Reisen). — USES, Propert. a. production of gums, Bullet. Imper. Inst. London 6 (1908) 29.
Handel. Hauptgummihäfen sind Hamburg, London, Bordeaux, Marseille, Triest, Antwerpen, New York, Melbourne, dann auch Hâvre, Liverpool, Barcelona. Hamburg importierte 1908 seewärts 32758 dz Gummi arabicum; davon aus Ägypten: 17576, Brit. Ostindien: 4210, kleinere Mengen aus Westafrika (1084), Argentinien, Kamerun, Marocco, Australien, Syrien, Arabien, Persien, beträchtliche Mengen über London und Frankreich. Die Einfuhr an Gummi Senegal ging von 1087 (1907) auf 512 dz (1908) zurück; dagegen kam erheblich mehr (1383 dz), über Portugal. Deutschland importierte 1909: 25424 dz Gummi aus Ägypten (aus Brit. Indien 13590 dz). Triest importierte 1908: 8487, 1909: 4484 dz Nilgummi. Frankreich importierte 1908: 74145 Quint.; davon entfielen auf Ägypten 30550, auf den Senegal 28525. Bordeaux importierte 1909: 24807 quint. Senegal und 5804 quint. Nilgummi. Die Einfuhr von Gummi arabicum aller Art nach London betrug 1906: 12779, 1907: 10776, 1908: 8540, 1909: 10733 packages. Die britische Einfuhr an Gummi arabicum betrug 1908: 63786, 1909: 84710, 1910: 107367 cwt (die Ausfuhr 1909: 20440, 1910: 33068 cwt). Nordamerika importierte G. arab. 1907: 7084468, 1908: 4895897 und 1909: 4153958 pounds. Nordamerika importierte G. Senegal 1907: 298258, 1908: 148618, 1909: 111942 pounds. Die Ausfuhren s. bei den einzelnen Sorten.
Morphologie und Anatomie der Droge. Bestes Cordofangummi bildet mehr oder weniger rundliche, seltener wurmförmige, helle, weißliche oder höchstens gelbliche Stücke von verschiedener Größe (bis nußgroß), die außen matt und von zahlreichen Rissen durchzogen sind und leicht in kleinmuschelig-eckige, scharfkantige, glasglänzende, zuweilen leicht irisierende Fragmente brechen. Bei 100° erweitern und verlängern sich die Risse und das Gummi wird bröckelig. Das Senegalgummi ist meist etwas rötlich, was besonders bei Betrachtung in größerer Masse hervortritt, und zeigt weniger Risse. Es wird aber im Schwefelsäureexsikkator auch stark rissig (FLÜCKIGER). Wurmförmige Stücke sind bei ihm häufiger. Während die Risse beim Cordofangummi stets bis in tiefere Schichten reichen, sind sie beim Senegalgummi auf eine oberflächliche Schicht beschränkt. Dadurch lassen sich selbst die besten Sorten Senegalgummi von dem Cordofangummi unterscheiden (WIESNER). Mikroskopisch zeigen die Fragmente des Gummipulvers bisweilen eine leichte Streifung (WIESNER, KOCH) und bei beginnender Lösung Körnelung, eine eigentliche Struktur, etwa wie beim Traganth, oder Zellwandreste sind nicht wahrzunehmen. Nur sehr selten finden sich in den guten Sorten kleine Stärkekörner oder mit Stärke erfüllte Rindenzellen. Wenn man sehr große Mengen löst, verdünnt und lange absetzen läßt, findet man bisweilen dergleichen, häufiger sind, auch in den guten Sorten, Bastfasern, wie überhaupt Fragmente des Rindengewebes. Gummischleim muß stets coliert werden.
In aus schlechteren Sorten hergestelltem Pulver fand KOCH: Bastfasern, Holzelemente, Kork, Pilzmyzel, Pollenkörner, Haare, Blattfragmente und Gesteinstrümmer, aber Stärke auch nur in Spuren.
Abbild.: WIESNER, Rohstoffe. — KOCH, Mikr. Anal. d. Drogenpulver IV, S. 169. —
Chemie. JOHN führte den Namen Cerasin, CHEVREUL den Namen Arabin[S. 442] ein, GUÉRIN fügte dann noch das Bassorin hinzu und so haben sich bis heute die drei Gruppen erhalten, obwohl schon BERZELIUS darauf hinwies, daß dies keinen tieferen Einblick in die Chemie dieser Gruppe zu tun erlaube. Arabin ist in Wasser löslich, Cerasin und Bassorin quellen nur darin. Die letzteren unterscheiden sich nur dadurch, daß Cerasin mit Alkalikarbonaten gekocht Calciumkarbonat abscheidet und in Lösung geht, Bassorin scheidet bei gleicher Behandlung keinen Kalk ab. Cerasin kann also als metarabinsaurer Kalk betrachtet werden. Beide reduzieren FEHLINGsche Lösung nicht und geben bei der Hydrolyse Arabinose und Galaktose. Im G. arabicum ist nur Arabin enthalten, im Kirschgummi Cerasin, im Traganth (s. d.), Chagual- und Moringagummi Bassorin. NEUBAUER und FRÉMY gelang es Cerasin in Arabin überzuführen.
GUÉRIN fand im G. arabicum kein Bassorin, 79,4% wasserlösliches Arabin, 17,6% H2O und 3% Asche; im Senegalgummi kein Bassorin, 81,1% wasserlösliches Arabin, 16,10% Wasser und 2,8% Asche. Auf 150° erhitzt wird G. arabicum zum Teil unlöslich, nimmt also die Eigenschaften des Kirschgummis an (GELIS). Mit Natronlauge färbt sich Gummi nicht, nach einigen Stunden wird es gelblich, damit erwärmt rasch schwarz (FLÜCKIGER). Alkohol von 52 vol % löst Gummi nicht, verdünnter etwas, im Verhältnis zu seinem Wassergehalt. In dem doppelten Gewichte Wasser löst sich G. arabicum langsam aber vollständig (Unterschied von den bassorin- und cerasinhaltigen Gummis) zu einem klebenden, aber nicht fadenziehenden, hellgelblichen Schleim von saurer Reaktion. Das Verhalten zu Wasser wechselt bei den einzelnen Sorten sehr. Nur die Gummis, welche sich in Wasser, bis auf einige beigemengte Pflanzenreste, vollständig zu einem filtrierbaren oder doch kolierbaren Schleime lösen, sind für pharmazeutische Zwecke brauchbar. Andere Gummis «geben einen scheinbar völlig homogenen Schleim, der aber nicht filtrierbar ist, andere eine mehr oder weniger konsistente Gallerte, bei anderen wieder quellen die einzelnen Körnchen so weit auf, daß scheinbar ein gleichmäßiger Schleim entsteht, in dem aber bei genügender Verdünnung die einzelnen Körnchen sich erkennen lassen, bei anderen trennt sich der Schleim bald in zwei Teile, einen gewöhnlich sehr konsistenten dicken und einen wässrigen, dünnen, und schließlich kommen Sorten vor, die nur mehr oder weniger aufquellen» (HARTWICH). Bleichen mit Chlor oder schwefliger Säure vermindert die Löslichkeit. Der Gummischleim wird durch Beimischung eines gleichen Volumens Alkohol weiß und gallertig, klärt sich aber auf weiteren Zusatz des fünffachen Volumens Wasser wieder vollständig. Auch durch Wasserglas, Eisenchlorid, Ferrisulfat (LASSAIGNE) und Boraxlösung (LAMBERT und GIESEKE) wird der Schleim zu einer steifen Gallerte verdickt. Der Gummischleim ist eine kolloidale Lösung. Er ist mit Bleiacetat ohne Fällung mischbar (Unterschied von den Schleimen), erleidet dagegen selbst in einer Verdünnung 1 : 50000 durch Bleiessig noch eine Fällung (LASSAIGNE). Gerbsäure fällt Gummilösung nicht (Unterschied von Leim). G. arabicum läßt sich aus der Lösung mit Ammoniumsulfat, Ammoniumphosphat oder Kaliumacetat nicht aussalzen (POHL). Die bei der Gärung des Gummischleims entstehende Säure ist Milchsäure (Arabinsäure liefert hierbei fast nur Milchsäure, BOURQUELOT). Gummischleim neigt nicht zur Schimmelbildung. Bei längerer Aufbewahrung bildet sich Zucker. Die Jodabsorption des G. arabicum bestimmte GRÉLOT (100 g absorbierten 7 mg J). Jod und Natriumbicarbonat bilden aus G. arabicum etwas Jodoform, mit Kalk erhitzt entsteht neben Aceton auch Metaceton (FRÉMY). Essigsäureanhydrid bildet Acetylarabine (SCHÜTZENBERGER und NAUDIN).[S. 443] Hefe und Diastase sind ohne Einfluß auf Arabin. G. arabicum reduziert FEHLINGsche Lösung auch bei 60–70° nicht.
VAUQUELIN fand bereits, daß das G. arabicum ein organisches Kalksalz ist. Die Säurenatur des Arabins (der Arabinsäure) erkannte C. NEUBAUER (1857). Er betrachtete das Arabin als das saure (Kali-, Magnesium- und) Kalksalz der Arabinsäure. Das Calcium läßt sich durch Oxalsäure fällen oder nach Zusatz von HCl durch Dialyse entfernen. Auch FRÉMY betrachtete das Gummi als das Kalksalz einer sehr schwachen wasserlöslichen Säure (acide gummique), die durch Hitze in ein unlösliches Isomeres (acide metagummique, Metarabinsäure) übergeht. Kalk verwandelt die unlösliche Säure wieder in Calciumgummat. Auch Calciumgummat wird durch Hitze unlöslich. GRAEGER stellte die Metarabinsäure zu den Pektinen. Ob die Metapektinsäure (Zellulosesäure FRÉMYS) mit der Arabinsäure SCHEIBLERS aus Rüben und diese mit der Arabinsäure NEUBAUERS identisch ist, erscheint im Lichte der neueren Untersuchungen zweifelhaft. Das G. arabicum wird seit SCHEIBLER als ein wechselndes Gemenge von zwei Bestandteilen, einem rechts- und einem linksdrehenden aufgefaßt (Rechts-Arabin und Links-Arabin). Im normalen Kalksalz der Arabinsäure sind 2,15 bis 2,50% CaO enthalten (NEUBAUER). Zur Darstellung der Arabinsäure (NEUBAUER, SCHEIBLER) wird das Gummi in Wasser gelöst, filtriert, mit Essigsäure (BÉCHAMP) angesäuert und dialysiert — es dialysieren Zucker und anorganische Salze —, die eventuell mit Essigsäure angesäuerte im Dialysator verbleibende Lösung wird mit Alkohol fraktioniert gefällt. Eine so dargestellte Arabinsäure enthält aber, wie ich gezeigt habe, stets Stickstoff und alle bisherigen Analysen sind, da es unmöglich ist, die stickstoffhaltige Substanz quantitativ abzutrennen, mit N-haltigem Material gemacht worden (TSCHIRCH und STEVENS). Die übrigens vorwiegend in den ersten Alkoholfällungen enthaltenen N-haltigen Bestandteile lassen sich zum Teil auch dadurch entfernen, daß man die mit Kochsalz versetzte Lösung zunächst mit einer mit Essigsäure angesäuerten Tanninlösung fällt.
Der Arabinsäure, dem Arabin der Autoren, das auch im Tierreich gefunden wurde (? STÄDELER), wird bald die Formel (C12H22O11)n resp. C12H20O10.H2O (NEUBAUER, SCHEIBLER), bei 120° getr. C6H10O5, bald die viel kompliziertere C89H142O74 oder C91H142O74 (O’SULLIVAN) gegeben. Jedenfalls ist ihr Molekulargewicht sehr groß (über 2000, GLADSTONE und HIBBERT). Sie löst sich, nur wenn sie feucht ist, in Wasser leicht, trocken quillt sie in Wasser nur langsam auf. Die wässrige Lösung reagiert sauer und dreht links. Das Drehungsvermögen wird sehr verschieden angegeben (−25,5° bis −98,5°, ja sogar Rechtsdrehung) und steht im Zusammenhang mit der relativen Menge der bei der Hydrolyse abgespaltenen Araban- und Galaktangruppen (GUICHARD), neben denen auch zuweilen bei gewissen Gummis Glykosan- (nicht aber Fruktosan- und Mannan-) Gruppen vorhanden sind. RÜMPLER erhielt sie in mikroskopischen Nadeln. Durch Erhitzen über 100° geht sie in Metarabinsäure über, die in Wasser nur froschlaichartig aufquillt. Bei höherem Erhitzen entsteht Furol (SCHIFF), beim Erhitzen mit Kalk viel Aceton neben wenigen Furanderivaten, mit Salpetersäure Schleimsäure, bei der Kalischmelze CO2, Ameisensäure, Essigsäure, Propionsäure, Oxalsäure und Bernsteinsäure (HLASIWETZ und BARTH), durch Destillieren mit starker Salzsäure Furol (aus den linksdrehenden Arten das meiste, HERZFELD). Da die Lösung der Arabinsäure sauer reagiert, hat man daher in der Bestimmung der Acidität ein Mittel der Identifizierung in der Hand.
Die Säurezahl einiger G. bestimmte zuerst WILLIAMS. BEAM fand bei Cordofan hard variety: 9,89–12,15% Wasser, 2,66–3,28% Asche, Acidität (mg KOH auf 1,0) 2,66–2,93,[S. 444] bei Cordofan softer: 11,69–12,14% Wasser, 2,77–2,86% Asche, Acidität 2,48–2,57. Bester Hashab grosse gum (Turkey) enthielt: 9,03% Wasser und 0,34% Unlösliches und zeigte eine Acidität von 3,14. — Granular sorts cleaned: 8,70% H2O und 2,67% Unlösliches, Acidität = 2,95. — Siftings: 7,45% H2O und 20,12% Unlösliches, Acidität = 1,95. BEAM fand bei Senegalgummi picked: 9,18–11,20% Wasser, 2,45–3,33% Asche, Acidität 2,45–3,33. Bei Senegal crude gomme du bas du fleuve: 9,60–10,50% Wasser, 3,33–3,41% Asche, Acidität 2,14–2,50. Galam: 10,19–10,57% Wasser, 3,22–3,39% Asche, Acidität 2,50–2,54. Salabreda: 11,51% Wasser, 2,81% Asche, Acidität 3,56.
Daß bei der Hydrolyse des Gummis ein Zucker entsteht, fand bereits LUDWIG (1859). Bei der Hydrolyse der Gummis (und der Arabinsäuren) entstehen neben Gummisäuren (O’SULLIVAN) Pentosen und Hexosen. Sie enthalten also Hexoso-Pentosane. Es entstehen aber selbst bei derselben Handelssorte wechselnde Mengen der Zucker, woraus man schließen muß, daß es verschiedene Arabinsäuren gibt oder wechselnde Gemenge vorliegen. Unter den Hydrolysierungsprodukten wurde in erster Linie Arabinose (S. 274) (GUÉRIN VARRY, SCHEIBLER, CLAËSSON, VON LIPPMANN, KILIANI) und Galaktose (S. 274) (Kiliani) gefunden, bisweilen auch etwas Glukose (VOTOCEK und VONDRACEK) und Xylose (HAUERS u. TOLLENS); nach ULLIK soll auch ein Mannan in einigen Gummis enthalten sein, was der Bestätigung bedarf. Doch herrschen stets Arabinose und Galaktose beträchtlich vor. Daß arabisches Gummi bei der Oxydation mit Salpetersäure Schleimsäure gibt, fand bereits GUÉRIN Varry. Entsprechend der wechselnden Menge Galaktose zeigt auch die bei der Behandlung mit Salpetersäure entstehende Schleimsäure verschieden hohe Beträge [bis 66,7%(?) MAUMENÉ]. Man kann aus der Menge der gebildeten Schleimsäure (S. 282) die Galaktosemenge berechnen (TOLLENS, KILIANI) (75 Schleimsäure = 100 Galaktose). Die rechtsdrehenden Gummiarten liefern meist weniger Schleimsäure als die linksdrehenden. KILIANI erhielt bei verschiedenen Gummis 14,3–38,3% Schleimsäure, bei Cordofan- und Senegalgummi 20,7–24%, (vgl. auch die Tabelle von MARTINA S. 437). Daneben treten Oxalsäure, Weinsäure (LIEBIG), Mannozuckersäure, Trioxyglutarsäure, Zuckersäure, Arabonsäure, Galaktonsäure auf.
Den Pentosanen kommt die Phloroglucin- und die Orcin-Reaktion zu. Phloroglucin in Salzsäure (20%) gibt beim Erwärmen eine kirschrote Lösung (IHL), die einen Absorptionsstreifen zwischen D und E FRAUNHOFER zeigt (TOLLENS, WHEELER und ALLEN). Orcin in Salzsäure gibt in der Kälte eine blauviolette, beim Erwärmen erst rötliche dann violette Färbung, zuletzt blaugrüne Flocken, die in Alkohol gelöst ein Band zwischen C und D geben (REICHL, REINITZER, ALLEN u. TOLLENS). Ebenso kommt die Eigenschaft des Gummis beim Kochen mit 12% Salzsäure Furfurol (S. 274) zu liefern (STONE und TOLLENS) den Pentosanen zu, und man kann aus der Menge des gebildeten Furfurols die Arabinose berechnen. G. arabicum ergab c. 28% (GÜNTHER), Kirschgummi 45,5–59% (CHALMOT, FLINT und TOLLENS). Der Pentosangehalt des Gummis schwankt in weiten Grenzen zwischen 20,65% im australischen und 51,21% im argentinischen Gummi (HEFELMANN). Die Cerasingummis enthalten mehr Pentosane als Galaktane (LEMELAND). (Bei der Furfurolreaktion tritt auch Lävulinsäure und Ameisensäure auf.) HEFELMANN fand keine Beziehung zwischen der Menge der Pentosen und dem Handelswert. (Vergl. auch die Tabelle von MARTINA S. 437).
Im Gummi von Acacia Senegal und anderen Acaciaarten fand ROSENTHALER neben Pentosen auch Methylpentosen und WIDTSOË und TOLLENS konnten Methylpentosane nicht nur in G. arabicum und Traganth, sondern auch im Gedda-, Brasil- und Kirschgummi nachweisen. Möglicherweise enthält das G. arabicum auch Fucosan. (S. 292).
[S. 445]
EDIE erhielt (nach KROEBER und RIMBACH bestimmt) Pentosen, als Arabinose berechnet, bei Cordofan: 33,52–35,49%, bei Senegal 33,66–34,59%. Die Galaktose (bestimmt durch Hydrolyse mit Essigsäure und Reduzieren mit Fehlingscher Lösung, enthält wohl auch die Pentosane, TOLLENS) betrug bei Cordofan: 50,52–53,04%, bei Senegal: 51,72–53,17% (BEAM). In dem rechtsdrehenden Gummi von Acacia arabica WILLD. fand MEININGER 21,85% Galaktan und 50,43% Pentosane (die Hydrolyse lieferte Galaktose und Arabinose), in dem rechts- (+ 53,94°) drehenden Gummi von Acacia horrida WILLD.: 27,36% Galaktan, 36,5% Pentosane und 2,83% Methylpentosane (die Hydrolyse lieferte Galaktose und Arabinose), in dem links- (−19,37°) drehenden Gummi von Acacia pycnantha BENTH.: 58,72% Galaktan, 16,98% Pentosane und 2,92% Methylpentosane (die Hydrolyse lieferte Galaktose und Arabinose). Auch das Opuntiag. liefert Arabinose und Galaktose (HARLAY), ebenso alle anderen untersuchten Acaciagummis (MARTINA, vgl. S. 437, STONE) und das Pfirsich-, Kirsch- und Pflaumengummi (STONE, BAUER) — Kirschgummi ist ein gutes Material zur Arabinosedarstellung (BAUER, KILIANI) — ferner das Rübengummi (LIPPMANN), das Gummi von Mangifera indica (LEMELAND), das Weingummi (HUBERT). Der G. von Cochlospermum Gossypium und das von Feronia elephantum liefern bei der Hydrolyse Galaktose und eine Pentose, die mit Arabinose nicht identisch ist (LEMELAND). Das Chagualgummi liefert Xylose und i-Galaktose (WINTERSTEIN), ebenso das Laplatagummi, aber kein Acacieng. gab Xylose (HAUERS), Es enthalten Ostafrikan. G.: 22,59% Galaktan, 29,53% Pentosane; Cochlospermum Gossyp.: 45,28% Galaktan, 32,97% Pentosane (LEMELAND); Feronia elephantum: 51,84% Galaktan, 40,16% Pentosane; Aprikosengummi: 23,6% Galaktose, 48,57% Arabinose (LEMELAND); Chagualgummi lieferte: 28,47% Galaktose, 45,29% Pentose (WINTERSTEIN); Mangifera indica G. 30,36% Galaktose, 42,06% Pentose; Laplatag.: 0,62% Galaktose, 55,31% Pentosen.
Nach O’SULLIVAN sind aber Arabinose und Galaktose nur die Endprodukte der Hydrolyse und es entstehen zunächst Zwischenprodukte, beim arabischen Gummi inaktive, beim Geddagummi rechtsdrehende. Diese sauren Zwischenprodukte zerfallen dann in Arabiose (Arabinon) bzw. Arabinose und in einfachere Säuren und diese dann erst bei mehrstündiger Hydrolyse in d-Galaktose und eine stark rechtsdrehende Gummisäure, die O’SULLIVAN Geddinsäure (C23H38O22) nannte. Im arabischen Gummi sind vielleicht Arabinose und Galaktose als Ester einer Isogeddinsäure (ZEISEL, O’SULLIVAN nennt sie Arabinsäure) (C23H38O22) vorhanden. Die Gummisäuren sind starke Säuren, werden nur durch abs. Alkohol aus ihren Lösungen gefällt und geben bei weiterer Hydrolyse keine Zucker. O’SULLIVAN nimmt an, daß die Gummis resp. die Arabinsäure gemischte Glykosidogummisäuren der allgemeinen Formel:
enthalten, bei denen n eine konstante, p eine variable Zahl ist. Die Arabinsäure des G. arabicum faßt O’SULLIVAN als Diaraban-Tetragalaktan-Isogeddinsäure auf = C23H30O18.4 C12H20O10.2 C10H16O8 = C91H142O74 (Mol.-Gew. 2418). Werden diese Araban-Galaktan-Geddinsäuren vorsichtig hydrolysiert, so wird zunächst der Arabanrest als Arabinon (C10H18O9 [α]D = +198,5°) abgespalten (s. oben) und es entsteht eine n-Galaktangummisäure, die dann in Galaktose und die entsprechende Gummisäure (Geddinsäure oder Isogeddinsäure) gespalten wird. Andere (E. FISCHER) halten die Arabinsäure für eine der Lakto- und Maltobionsäure analog konstituierte Glykosidosäure. Die SULLIVANsche Formel kann übrigens nicht richtig sein, da auch Methylpentosane im Gummi nachgewiesen sind (s. oben).
Alle Gummis enthalten (durch Dialyse zu entfernenden) reduzierenden Zucker, bei Cordofan Hashab von einer Spur bis 0,15% (EDIE). Der Zuckergehalt des G. arabicum des Handels schwankt ebenfalls, im allgemeinen beträgt er 0,6–1,1% (REINITZER).
Im Acaciengummi sind mindestens vier Enzyme (Gummifermente, Gummasen)[S. 446] vorhanden, eine Oxydase, eine Peroxydase und eine Amylase (Malzdiastase) (WIESNER, BOURQUELOT, TSCHIRCH, REINITZER, s. oben S. 414), sowie Emulsin (Amygdalin spaltend), das VOLCY-BOUCHER in allen Gummis und Gummiharzen auffand. BERTRAND hält die Gummioxydase für Lakkase. Eine große Menge von Reaktionen des Gummis sind auf diese Enzyme zurückzuführen, z. B. wird Pyrogallol durch Gummi in Purpurogallin übergeführt (STRUWE 1872 — darauf gründeten CLERMONT und CHAUTART 1882 eine fabrikatorische Darstellung des Purpurogallins). Daß Guajaktinktur durch G. arabicum gebläut wird, erkannten zuerst GÖTTLING und BOULAY (1809). Auch die Unverträglichkeit des G. arabicum mit zahlreichen Arzneimitteln [Pyramidon (TANZI), Chinaextrakt, Pyrogallol, Guajakol, Vanillin, Thymol, Phenol, Creosol, Eserin, Adrenalin, Morphin] beruht auf dem Gehalt an Enzymen, besonders Oxydasen, TRAUBES Oxydationsfermenten (BOURQUELOT) und deshalb läßt die Pharmac. helvetica den Gummischleim eine halbe Stunde im Dampfbade erhitzen und dadurch die Enzyme «abtöten». Ein so behandelter Schleim bläut Guajak nicht mehr. Gummipulver eignet sich aus dem gleichen Grunde nicht zum Verdünnungsmittel zu starken Opiums. Die Oxydase wird im trockenen G. arabicum selbst durch zweistündiges Erhitzen auf 100° nicht zerstört, ja nicht einmal durch einstündiges Erhitzen auf 115°. Erst beim Erhitzen auf 120° ist sie abgetötet, das Gummi löst sich dann aber nicht mehr in Wasser und quillt nur darin auf. Auf die Oxydasen haben Aldehyde (z. B. Formalin) keinen Einfluß (SELIGMANN).
Daß im Gummi stickstoffhaltige Bestandteile sich finden, war bisher übersehen worden, nur GUÉRIN gibt einmal 0,14% N an. Ich habe mit STEVENS gezeigt, daß bei vielen Gummis zwar die LASSAIGNEsche Stickstoffprobe mit Na negativ ausfällt, daß dagegen mit KOH sich stets Ammoniak entwickelt und Pyrrol gebildet wird. BACH zeigte dann, daß die von ihm abgeänderte LASSAIGNEsche Reaktion gelingt, wenn man statt Na viel K nimmt. MEININGER fand in allen Acaciengummis (A. Senegal, A. pycnantha, horrida, Adansonii, arabica) Stickstoff und zwar zwischen 0,71 und 2.19% (in Senegal z. B. 1,81%. RIDEAL fand bei Acaciengummis nur 0,031 bis 0,082% N). Das Gummi von Melia Azadirachta enthält 4,49%, das von Feronia elephantum 1,57, das von Anacardium occident. 0,92% N. Woher der Stickstoff stammt ist unbekannt, vielleicht sind die Enzyme Glukoproteïde. Ob das Schäumen der Gummilösungen auf den Enzymen beruht (WIESNER) wissen wir nicht bestimmt.
In den schlechteren Gummisorten finden sich auch Gerbstoff, Harz, aromatische Substanzen (der Art von CZAPEKS Hadromal), Farbstoffe. BOURQUELOT führt die Färbung gefärbter Gummis darauf zurück, daß die Oxydasen die aus der Rinde mit aufgenommenen Gerbstoffe im feuchten Zustande oxydieren und dunkler färben. Gegenden mit vorwiegend trockenem Klima sollen daher weniger gefärbtes Gummi liefern.
Niemals enthält reines G. arabicum von Stärke mehr wie Spuren (s. oben S. 441), Kristalle oder Reste von Zellhäuten.
FROMM stellte experimentell fest, daß längeres Lagern die Eigenschaften des Gummis verändert.
Bei den guten Gummisorten schwankt der Wasser- und Aschegehalt nur in sehr engen Grenzen (s. oben S. 444). HAUKE fand 1,7–3,1 (FLÜCKIGER 2,5 bis gegen 4) Asche und gibt als obere Grenzzahl 3,5% an. Oberste Grenze für Wasser 15%, für Asche 4% (Pharm. helv. IV), 5% (D. A. V). Die Asche ist rein weiß. 100 g Cordofangummi enthielten 0,198–0,266 Mg, 0,596–0,730 K und 0,773–0,818 Ca (BEAM).
[S. 447]
Über die Zusammensetzung der Asche gibt folgende Tabelle von RIDEAL und YOULE, die auch andere Gummis berücksichtigt, Aufschluß.
|
Asche
|
NaCl
|
K2CO3
|
CaCO3
|
MgCO3
|
Calcium-
phosphat usw. |
|
|
Aden-Gummi
|
3,29
|
0,29
|
17,2
|
53,9
|
29,48
|
—
|
|
Cap-Gummi
|
3,05
|
1,14
|
15,4
|
57,9
|
28,89
|
—
|
|
Indisches Gummi
|
2,00
|
0,37
|
12,6
|
58,5
|
29,82
|
—
|
|
Eastern-Gummi
|
2,98
|
0,24
|
26,8
|
43,5
|
—
|
—
|
|
Senegal-Gummi
|
3,03
|
0,14
|
21,5
|
54,9
|
15,96
|
—
|
|
Bestes arab. Gummi
|
3,01
|
0,94
|
24,2
|
57,25
|
—
|
—
|
|
Gutes arab. Gummi
|
3,15
|
2,30
|
29,9
|
46,23
|
—
|
—
|
|
Amrad arab. Gummi
|
2,24
|
0,14
|
7,39
|
67,2
|
16,62
|
4,86
|
|
Ghatti arab. Gummi
|
2,45
|
0,25
|
7,8
|
53,5
|
8,4
|
33,8
|
|
Austral. Gummi
|
2,09
|
1,91
|
3,21
|
20,8
|
0,45
|
65,9
|
|
Brasil. Gummi
|
1,39
|
0,46
|
17,74
|
11,8
|
0,45
|
67,14
|
Das Verhalten zahlreicher Gummis zu Reagentien studierten MASING (1879), HOLFERT (1888), MARTINA (1894, bestimmte auch die Schleimsäuremengen, vgl. S. 437) und HIRSCHSOHN (1904). Es ist aber dabei nicht viel herausgekommen: eine scharfe Charakterisierung ist zurzeit noch nicht möglich.
Lit. Älteste Untersuchungen der Gummiarten: FOURCROY et VAUQUELIN, Ann. d. chim. 6 (1790) 178, VAUQUELIN, Ebenda 54 (1805), CRUIKSHANK, Scher. Journ. 3, 289, LAUGIER, Ebenda 72 (1909) 81, Gilb. Ann. 42 (1812) 228. Ältere Analysen von BERZELIUS (Ann. de chim. 95, 77), PROUT (Phil. transact. 1827), GUÉRIN-VARRY (Journ. d. chim. méd. 7, 742), GUIBOURT, (Ann. Pharm. 9, 221 und Drog. simpl.), MULDER (Journ. pr. Chem. 16, 246. Pharm. Centralbl. 1839, 137), GOEBEL, GAY-LUSSAC u. THÉNARD, BERTHOLLET, SAUSSURE, — die Analysen wiedergegeben in PEREIRA, Heilmittellehre II, 618 und bei MEININGER (s. unten). — JOHN, Schweigg. Journ. 6 (1812) 374. — GUÉRIN, Ann. chim. phys. (2) 49 (1832) 248, Schweigg. Journ. 65 (1832) 220, Pogg. Ann. 29 (1833) 50. — LAMBERT u. GIESEKE, Schweiggers Journ. 1826. — LASSAIGNE, Arch. Pharm. 1852. — NEUBAUER, Journ. pr. Ch. 62 (1854) 193 und Lieb. Ann. 102 (1857) 105. — GELIS, Compt. rend. 44, 144. — URRN in Gmelins Handb. 1862, IV, 642. — FRÉMY, Sur la compos. et la mode de production des gommes dans l’organisat. végét. Journ. pharm. 1860, 81. — L. PATROUILLARD, Rech. sur la gomme arabique, sur la transformat. en dulcite. Journ. pharm. 1879, 532. — GRAEGER, N. Jahrb. d. Pharm. 38, 129. — STÄDELER, Lieb. Ann. 121, 26. — HEKMEYER, Rép. chim. appl. 1858, 214. — JOLLY, Et. sur les gommes Thèse. Paris 1870. — GIRAUD, Thèse Paris 1875. L’Union pharm. 16, 249. — E. MASING, Vergl. Unters. d. wichtigsten Handelssorten d. arab. Gummis u. seiner Surrogate. Arch. Ph. 15 (1879) 216 u. 17 (1881) 34. — KOCH, Über Holzgummi. Sitz.-Ber. d. Dorp. Nat. Ges. 1886 und Holzgummi u. dessen Verbreitung im Pflanzenreiche. Ph. Z. f. Rußl. 1886. — VÉE, Et. sur les gommes dit. arab. Thèse Paris 1888. — LUTZ, Contribut. à l’étude chimique et botanique des gommes. Thèse Paris 1895. — GELIS, Journ. pr. Chem. 71, 378. — WILLIAMS, Chem. News 58, 224. — SCHEIBLER, Ber. d. chem. Ges. 1, 58 u. 108, 6, 612, 17, 1729. — VON LIPPMANN, Ebenda 17, 2238. — TOLLENS, Handb. d. Kohlenhydrate, Landw. Versuchsstat. 39, 416 und Chem. Zeit 25, 857. — WHEELER und TOLLENS, Ber. d. chem. Ges. 22, 1046 und Zeitschr. d. Ver. f. Rübenzuckerind. 39, 848. — ALLEN und TOLLENS, Lieb. Ann. 260, 289. — WIDTSOË und TOLLENS, Ber. d. chem. Ges. 1900, 143. — HAUERS u. TOLLENS, Ebenda 1903, 3306. — HERZFELD, Zeitschr. Ver. f. Zuckerind. 41, 667. — GUICHARD, Bull. soc. chim. (3) 19, 9. — MAUMENÉ, Bull. Soc. chim. (3) 9, 138. — GARROS, Contrib. à l’étude d. acid. gumm. etc. (Prunose) Thèse, Paris 1894. — ULLIK, Chem. Centralbl. 92, 432. — RÜMPLER, Ber. d. chem. Ges. 33, 3475 — BÉCHAMP, Bull. soc. chim. III, 7, 586, Compt. rend. 51, 255. Journ. pharm. 1878, 51. — REICHL, Dingl. Polyt. J. 235, 232. — REINITZER, Zeitschr. phys. Chem. 14, 453. — HEFELMANN, Wasser- u. Pentosangeh. d. G. a. Zeitschr. f. öffentl. Chem. 1901. — O’SULLIVAN, Journ. chem. soc. 1884, 41 und 1891, 1029 (Chem. Centralbl. 1890 u. 1892). Chem. News 48, 301; 61, 23; 64, 271. Chem. Zeit. 25, 569. — ZEISEL, Gummi in Wiesner, Rohstoffe. — FLÜCKIGER, Pharmakogn.[S. 448] — TSCHIRCH, Gummi in Realenzyklop. d. ges. Pharm. 2. Aufl. — KRÖBER und RIMBACH, Zeitschr. Angew. Chem. 15 (1902) 477. — GRÉLOT, Journ. pharm. 1906. — KILIANI, Ber. d. chem. Ges. 13, 2304; 15, 34. — CLAËSSON, Ebenda 14, 1270. — VOTOCEK und VONDRACEK, Ber. d. d. chem. Ges. 37, 3858. — VOTOCEK und SEBOR, Zeitschr. f. Zuckerind. in Böhmen 24, 1. — FISCHER und MEYER, Ber. d. chem. Ges. 22, 1943. — FISCHER und BERNSCH, Ebenda 27, 2483. — MEININGER, Beitr. z. Kenntn. einiger Gummiarten. Dissert. Straßburg 1908. — HAUERS, Dissert. Göttingen 1902. — LEMELAND, Journ. pharm. 19, 584, 20 (1904) 253 und 21 (1905) 289 und Contrib. à l’étude de quelqu. échant. d. gomme Thèse. Paris 1905. — ROSENTHALER, Zeitschr. anal. Chem. 1909, 165. — LEO LIEBERMANN, G. a. und G. Senegal. Apoth. Zeit. 1890, 273. — RIDEAL, Pharm. Journ. 1892, 1073. — RIDEAL and YOULE (Ind. G.), Pharm. Journ. 1891, 147. — MARTINA, Jahresb. d. Pharm. 1894, 56. — GARROS, Chem. Zeit. 1894, 1094. — HIRSCHSOHN, Beitr. z. Unters. einiger Gummisorten d. Hand. Pharm. Centralh. 1904. — BOUCHER (chem. Const. d. G.). Bull. pharm. Sud-Est 1907. — BOURQUELOT, L’orig. d. l. color. d. cert. gommes. Journ. pharm. 1897; 164.
Enzym: GÖTTLING, Bull. d. pharm. 1 (1809), 220. — BOULAY, Ebenda, p. 225. — PLANCHE, Journ. de pharm. 6 (1820), 16. — STRUWE, Lieb. Ann. 163 (1872), 162. — CLERMONT und CHAUTARD, Compt. rend. 94. — WIESNER, Über d. Gummiferment. Sitzungsber. d. Wien. Akad. 92 (1885), 40 (Monatshefte f. Chem. 6 [1885] 592). — BÉCHAMP, Faits pour serv. à l’hist. d. l. g. a. Bull. soc. chim. 9 (1893) 45. — LUTZ, Contrib. à l’étud. chim. et bot. des gommes Thèse. Paris 1895. — BERTRAND, Compt. rend. 120 (1895), 268. — BOURQUELOT, Sur la pres. d. ferm. oxyd. dans quelqu. subst. médicam. C. r. Soc. d. biolog. 4 (1897), 25. — GRAFE, Stud. über d. Gummiferm. WIESNER Festschrift 1908. — MIKOSCH, Sitzungsb. d. Wien. Akad. 115 (1906) 911. — GRÜSS, D. Oxydasen u. d. Guajacreaktion. Ber. d. d. Bot. Ges. 1898, 134. — TSCHIRCH und STEVENS, Japanlack. Arch. Pharm. 1905, 532 und über d. Gummienzyme. Pharm. Centralh. 1905, 501. — BACH, Stickstoffgeh. d. Oxydationsferm. Ber. d. d. chem. Ges. 1908, 226. — REINITZER, Über d. wahre Natur d. Gummifermentes. Zeitschr. phys. Chem. 14 (1890) 453 u. über d. Enzyme d. Acacieng. Ebenda 61 (1909) 352. — TSCHIRCH, Chem. u. Biolog. d. pflanzl. Sekrete. Leipzig 1908. — VOLCY-BOUCHER (Emulsin). Bull. soc. Pharm. Sud-Est 1908, 297. — FIRBAS, Einw. von G. auf Morphin. Pharm. Post 1905.
Physikalische Eigenschaften. Das Gummi verhält sich im allgemeinen wie ein Kolloid (GRAHAM), doch zeigt die Lösung osmotischen Druck, verhält sich also nicht wie ein typisches Kolloid (LINEBURGER). Aus dem kryoskopischen Verhalten leiten GLADSTONE und HIBBERT ein Molekulargewicht der Arabinsäure von c. 2000 und LINEBURGER ein solches von 2400 ab, was mit der O’SULLIVANschen Formel (s. oben S. 445) gut stimmen würde. Der osmotische Druck einer 6% Lösung von Cordofangummi betrug, bestimmt im Osmometer von MOOR und ROAF, bei 32° C.: 152–170 mm Quecksilber, bei 22° C.: 141 mm. Beim Senegalgummi betrug der osmotische Druck bei 16,5° C. 114 mm Quecksilber.
Das spezifische Gewicht ist wegen der oft eingeschlossenen Luft nicht leicht zu bestimmen. Reines Gummi hat bei 15° ein spez. Gewicht von 1,487, bei 100° getrocknet: 1,525 (FLÜCKIGER). Ein anderes Muster Sudangummi zeigte ein spez. Gewicht von 1,316–1,482 (PEREIRA). Das spez. Gewicht des Angra-Pequenagummi war = 1,123–1,134 (HARTWICH).
Die Härte ist verschieden — man unterscheidet ja im Handel hartes und weiches Gummi —, im Durchschnitt ist sie etwa die des Steinsalzes.
Brechungsvermögen. Das G. arabicum ist infolge innerer Spannungen doppelbrechend.
Wichtig für die Unterscheidung der Sorten ist die Bestimmung der optischen Aktivität, des Drehungsvermögens. Sie variiert bei Cordofan- und Senegalgummi bei einer 10% Lösung im 100 mm-Rohr zwischen −1° und +3°21′, in abnormen Fällen zwischen −5° bis +9°. Die besten Sorten sind stets linksdrehend (FROMM).[S. 449] EDIE fand bei Untersuchung zahlreicher Muster, daß alle Cordofan-Hashab-Gummis linksdrehend sind und die Drehung in engen Grenzen schwankt. Auch von anderen Beobachtern wurden Cordofangummi und Senegalgummi so gut wie ausnahmslos linksdrehend gefunden (WIESNER, SCHEIBLER, FLÜCKIGER). (In der Literatur ist meist die direkte Drehung αD, nicht die spezifische αD angegeben.) Die Drehung des Cordofangummi schwankte nach EDIE bei 10% Lösung und 100 mm Rohr zwischen −2,77 und −3,14°, also in sehr engen Grenzen und betrug bei 10% Lösung und 100 mm Rohr nach der Hydrolyse: + 5,35 bis +5,56° (22 Muster). Bei Senegalgummi betrug die Drehung vor der Hydrolyse: −2,70 bis −2,93, nach der Hydrolyse: +5,42 bis +5,48°, bei Gedarefgummi −3,09° (nachher +5,33°). Wie hieraus ersichtlich, ist auch die Bestimmung der Drehung nach der Hydrolyse von Wichtigkeit. LEMELAND fand linksdrehend außer Cordofang. auch Aprikosengummi −1° 93, Mangifera indica −25° 33, Feronia elephantum −6° 41, MANNICH (10% Lös. 100 mm Rohr) die Gummis von A. Senegal −1,1°, A. spirocarpa −2,6°, DIETERICH: Amradgummi linksdrehend, FROMM Cordofang.: von −2° 23′ bis −2° 47′, Senegal: 1° bis 2° 51′, MEININGER das Gummi von A. pycnantha −19,37°. Doch kommen Anomalien vor. So beobachtete FROMM Rechtsdrehung: bei arab. Gummi +1° und bei Senegal +9° 8′, +3° 21′, +8° 31′ und −4° 52′ und FLÜCKIGER und WIESNER fanden das Feroniagummi rechtsdrehend, aber das ist beim Cordofan- und Senegalgummi — ich zweifle nicht daran — auf Vermischung mit Gummis, die nicht von A. Senegal stammten, zurückzuführen.
Andere Gummis zeigen dagegen stets Rechtsdrehung. SCHEIBLER fand (1873), daß unter den Sennaargummis rechtsdrehende sich finden, was FLÜCKIGER bestätigte. Geddagummi ist stets rechtsdrehend. Die Drehung schwankt zwischen αD +45 und +54° (O’SULLIVAN) GUICHARD fand Salabreda- und berberisches Gummi rechtsdrehend. Ebenso dreht Ghezirehgummi regelmäßig rechts (c. +3°) wie Mogadorgummi (FLÜCKIGER). Das Gummi von A. horrida (Angra Pequena-G.) drehte +2° 20′, +3° und +3° 20′, nach Extraktion mit Alkohol +3°, +3° 40′ und +4° 20′ (HARTWICH). LEMELAND fand rechtsdrehend (αD?): Gezireh +45°, Brasil +46° 94′, Cochlosperm. Gossyp. +77° 152′. MANNICH fand rechtsdrehend das Gummi von Acacia Kirckii +2,6°, A. Seyal +5,1°, A. arabica +7,98°, A. stenocarpa +4,75°. Weitere Angaben im Kapitel Handelssorten (S. 436 u. 437). Im allgemeinen findet man angegeben, daß die Gummis, die relativ wenig (bis 20,7%) Schleimsäure bilden, rechts drehen, die, welche über 21% Schleimsäure bilden, dagegen links (WIESNER). Das scheint aber nicht richtig zu sein. Es fehlt eine speziell hierauf gerichtete Untersuchung.
Eine der wichtigsten Methoden zur Wertbestimmung des Gummis ist die Bestimmung der Viskosität. Sie erfolgt im Viskosimeter. Der erste, der Bestimmung der Viskosität der Gummata vorschlug, war SACC (1857). Er benutzte das Viskosimeter von OCHS (Bestimmung der Zeit des Einsinkens eines Senkkörpers). DUCLAUX bediente sich des Compte-gouttes de Salleron, dem er die Form einer Pipette gab. Dann beschrieben VÉE (1888) und LUNGE (1892) Viskosimeter für Gummilösungen. LUNGES Viskosimeter ist eine Spindel von bestimmter Schwere. Man bestimmt die Zeit, die diese braucht, bis sie bis zu einer bestimmten Marke eingesunken ist. Andere Viskosimeter bestimmen die Ausflußgeschwindigkeit des Schleims aus einer Bürette mit bestimmter Ausflußöffnung. So beruhen z. B. das Viskosimeter von ENGLER, das REISCHAUERsche und das nach letzterem konstruierte von E. SCHMID darauf, die Ausflußgeschwindigkeit aus einem Rohre bestimmter lichter Weite (2 mm)[S. 450] zu messen. Zum Vergleich dient entweder Wasser, Rüböl oder eine Rohrzuckerlösung bestimmter Konzentration. FROMM benutzte ENGLERS Viskosimeter für Gummilösungen. Das sehr gute Ausfluß-Viskosimeter von MERVEAU (Fig. 151) berücksichtigt den Einfluß, den Druckhöhe, Temperatur und Querschnitt der Ausflußöffnung besitzen. Seltener benutzt wird das OSTWALDsche Viskosimeter. Das teuerste, aber beste, ist das Torsionsviskosimeter (Fig. 150). Die Bestimmung der Viskosität mit dem Torsionsviskosimeter wurde von BEAM mit einer 20 oder 30% Lösung gemacht.
Torsionsviskosimeter.
Viskosimeter von Merveau.
Groß ist die Zahl der für Öle und Firnisse vorgeschlagenen Viskosimeter. Ich nenne nur die von HUGUET, SCHUBLER, REDWOOD, ALLEN, SCHMID, ENGLER, BARBEY, VALENTA. Dann seien die Viskosimeter von NEUMANN, WENDER, MAYER, HESS, YVON, Grorert und DEMICHEL und das Laktoviskosimeter von MICAULT genannt. Sie sind auch für Gummilösung brauchbar.
BEAM fand 1906 mit dem Torsionsviskosimeter von DOOLITTLE, bei 90° F. gemessen, die Viskosität bei Cordofan hard bei 10% Lösung = 94–112, bei 20% Lösung = 93,5–111, bei Cordofan softer bei 20% Lösung = 87,5–92. Bei Senegalgummi bei 10% Lösung = 83–98, bei 20% Lösung = 92,5–104 (bez. der Umrechnung der Grade vgl. bei BEAM. Die Temperatur muß genau beachtet werden). Bestes Cordofan gross gum (Turkey) zeigte im Torsionsviskosimeter 32° Retardation entsprechend der Viskosität einer 61,85% Rohrzuckerlösung. MERVEAU bestimmte (1910) mit einem von ihm konstruierten Ausflußviskosimeter (Fig. 151) bei 15° die Viskosität von Cordofangummi zu 5,27, die des Gomme pelliculée de l’Inde zu 7,9,[S. 451] die des Gomme d’Aden Mokri zu 3,81. Mit steigender Temperatur geht die Viskosität herab. Sie beträgt z. B. im obigen Falle beim Cordofangummi bei 30°: 4,12, bei 40°: 3,87 und bei 50° nur noch 3,28. Die Viskosität des Angra Pequena-G. betrug 1,72, 2,052, 3,39 und 3,67 (HARTWICH). Bei gewöhnlicher Temperatur bereitete Lösungen haben eine größere Viskosität, wie heiß bereitete gleicher Konzentration. Beim Aufbewahren des Gummis nimmt die Viskosität ab. Gummis mit hoher Klebkraft zeigen auch eine hohe Viskosität, einen hohen Säuregrad und eine negative Drehung (FROMM).
Methoden zur Bestimmung der Klebefähigkeit rühren von DALÉN und HIRSCHSOHN her. Die Klebefähigkeit des Gummi prüfte HIRSCHSOHN in der Weise, daß er eine bestimmte Menge Gips mit einer bestimmten Menge 10% Gummilösung verrieb und die Masse zu Stangen formte. Diese wurden durch unten angehängte Gewichte auf ihren Zerreißungspunkt geprüft. G. arabicum riß bei 1000 g Belastung, Senegalgummi bei 1600 g, australisches Gummi bei 1400 g, ostindisches Gummi bei 1500 g («Kunstgummi» erst bei 1800–2000 g) Belastung. Die DALÉNsche Methode beruht darauf, daß man Saugpapier von bekannten Festigkeitseigenschaften mit der zu prüfenden Gummilösung tränkt, trocknet und von neuem nach den bekannten Methoden die Festigkeit prüft.
Auch die Bestimmung der Emulgierungsfähigkeit ist praktisch nicht ohne Bedeutung. HIRSCHSOHN hat sie bei verschiedenen Gummis bestimmt.
Lit. Osmometer: MOOR and ROAF, Biochemic. Journ. 7, 34. — Viskosimeter: SACC, Essai des gommes employées pour épaissir les couleurs. Journ. d. pharm. 1867, 119. — DUCLAUX, Ann. chim. phys. 21 (1870) u. 25 (1872). — VÉE, Etude sur les gommes dites arabiques. Thèse 1888. — LUNGE, Nouv. viscos. pour l’examen des gommes. Ann. chim. an. 1896, 411. — BEAM, Second Report of Wellcome Res. Labor. 1906, 232. — M. J. MERVEAU, Recherches sur la viscosité et en particulier sur la viscosité des gommes. Thèse Paris 1910 (hier d. Literatur). — LUNGE, Zeitschr. angew. Chem. 1895, 437. Apoth. Zeit. 1897, Nr. 75, 1898, Nr. 22. — FROMM, Zeitschr. anal. Chem. 40 (1901) 143. — Drehung: GRAHAM, Lieb. Ann. 121, 56. — GLADSTON u. HIBBERT, Chem. News 59, 277. — LINEBARGER, Am. journ. sc. (3) 426. — GUICHARD, Bull. soc. chim. (3) 9, 19. — DIETERICH, G. vom Hinterland von Angra Pequena a. a. O. — BÉCHAMP, Compt. rend. 51, 255. — SCHEIBLER a. a. O. — WIESNER a. a. O. — FLÜCKIGER a. a. O. — MANNICH, Gummiarten Deutsch-Ostafrikas. Tropenpfl. 1902, 201. — FROMM, Zeitschr. Anal. Chem. 40 (1901), 143. — DALÉN, Mitt. d. k. techn. Versuchsanstalt 1894, 149. — HIRSCHSOHN, Pharm. Zeitschr. f. Rußl. 1893, 803.
Verfälschung und Prüfung. Für pharmazeutische Zwecke kommen nur die besten Cordofan- und Senegalsorten in Betracht. Als Klebstoff sind alle anderen guten G. zulässig. Das Gummi arab. officin. muß sich zu einem hellgelblichen, schwach sauer reagierenden, geruchlosen Schleime langsam aber vollständig lösen, der die oben (S. 442) angegebenen Eigenschaften besitzt und Fehlingsche Lösung kaum sichtbar reduziert. Jodlösung darf auch in der heiß bereiteten Lösung weder eine blaue (Stärke) noch eine weinrote Färbung (Dextrin) geben. 10 ccm des Gummischleims (1=10) sollen sich z. B. mit einem Tropfen n./10 Jod rein gelb färben (Pharm. helv. IV). Auch nach dem Kochen und Wiedererkalten darf die Mischung durch einen weiteren Tropfen der Jodlösung keine Violettfärbung annehmen. Dextrinhaltiges Gummi dreht stark rechts. Auf Dextrin, das öfter im Gummi vorkommt, kann mit Anilinsulfat (PIETRO) oder auch in der Weise geprüft werden, daß man 3 ccm einer Lösung, die aus 15 gtts Liqu. ferr. sesquichlor., 15 gtts einer gesättigten Lösung von rotem Blutlaugensalz, 5 gtts verd. Salzsäure (sp. Gew. 1,165) und 60 ccm Wasser[S. 452] besteht, mit 6 ccm einer 20% Lösung des G. vermischt. Die Lösung von reinem G. wird gelb und bleibt es 10–12 Stunden lang, bei Anwesenheit von Dextrin wird die Lösung blau. Die Prüfung auf Gelatine (Leim) gründet GAUTIER auf die Eigenschaft derselben durch Formaldehyd in der Wärme unlöslich zu werden (G. wird nicht angegriffen). G., das mit schwefliger Säure gebleicht wurde (Verfahren PICIOTTO), gibt mit Baryumchlorid eine Fällung, solches, das mit Chlor gebleicht wurde, mit Silbernitrat. PICIOTTO empfahl auch Reinigung gefärbter G. mit Alaun und KOH, so daß auch hierauf zu prüfen wäre. Auch mit Schwefelsäure soll G. gereinigt werden (?). Reines Cordofang. erhärtet mit Borax zu einer gummiähnlichen Masse, dasselbe geschieht mit bas. Bleiacetat und Eisenchlorid, mit Kalisilikat gelatiniert es. Eine Mischung von Traganthschleim mit Acaciengummi ist dicker als die entsprechende reine Mischung (WHITE). VÉE empfiehlt als bestes Mittel, Verfälschungen aufzudecken, Bestimmung des Rotationsvermögens, und dem möchte ich beistimmen (vgl. oben S. 449) und außerdem Bestimmung der Drehung nach der Hydrolyse vorgeschlagen. In der Pharmazie sollte nur schwach linksdrehendes G. zugelassen werden. Für die Technik ist das wichtigste die Bestimmung der Viskosität (HEFELMANN). FROMM hält für die Wertbestimmung wichtig festzustellen: Löslichkeit, Viskosität, Säuregrad, Drehung, Dehnung und Klebfähigkeit, sowie Feststellung, ob die Lösung schäumt und ob sie reduziert (s. oben S. 427 u. 433). RIDEAL und YOULE (1891) halten auch die Bestimmung des Wassergehaltes für ein gutes Mittel zur Charakterisierung und Aufdeckung von Fälschungen. JAKSCH u. and. empfehlen Bestimmung der Löslichkeit. Auch die Bestimmung der Emulgierungsfähigkeit ist bei G. a. officinale nicht ohne Bedeutung (HIRSCHSOHN).
Mit dem Mikroskop lassen sich die meisten Fälschungen des Pulvers, besonders bei Anwendung von Jodlösung, erkennen: Traganth (vgl. Fig. 140, S. 397), Dextrin (schon von HAGER 1869 beobachtet, und oft vorkommend) (vgl. Fig. 73, S. 200), Stärke (Reisstärke, WILSON), Mehle (Maismehl, bis 50%! FERNAU). Man geht von einem Glycerinpräparat aus. Die Fragmente von beigemengtem wasserlöslichem Dextrin färben sich mit etwas jodhaltigem verd. Glycerin violett-rötlich, bevor sie sich lösen (KOCH). Als anorganische Verfälschung des Pulvers wurde Borax (5%, FERNAU) beobachtet. Im Senegalg. findet sich bisweilen Bdellium (s. oben S. 425), ein Gummiharz, das zu 70% in Alkohol und Äther löslich ist.
Als Ersatzmittel des G. a. kommen jetzt nur in Betracht: Capgummi, Berberisches G. und die blassen Varietäten vom indischen Amradg. und Ghattig. (MABEN). Nur für technische Zwecke kommen in Betracht (für pharmazeutische Zwecke auszuschließen!) die Surrogate: Gummi aus Mesembryanthemumfrüchten (1898), Kunstgummi aus Dextrin, durch NaOH und Na2CO3 löslich gemachtes Kirschgummi, der gummöse Rückstand der Myrrhentinkturbereitung (gibt einen vorzüglichen Klebleim! ALCOCK). Ein neueres Gummiersatzmittel besteht aus mit Stärke versetztem eingetrocknetem Carageenschleim (Tropenpflanzer 1905, 282).
Lit. HOPFF (Verhalten gegen Reagentien), Jahrb. prakt. Pharm. 15, 234. — HIRSCHSOHN, Vgl. Vers. mit Natur- und Kunstgummi. Pharm. Zeitschr. f. Rußl. 1893 und Zeitschr. Allg. Österr. Ap. Ver. 1904. Ph. Centr. H. 1904, Nr. 20. — MABEN (Reagentien), 1891 a. a. O. — KARL DIETERICH, Wertbestimmung. Zeitschr. anal. Ch. 40, 408. — GAUTIER, Compt. rend. 1898. — WHITE (Vergleich mit Traganth). Brit. Pharm. Conf. 1904. — WILSON, Reisstärke. Pharm. Journ. 1889, Nr. 988. — MASING, Arch. Ph. 1879/80. — HOLFERT, Jahrb. d. Ph. 1888. — RIDEAL, ebenda 1892. — MARTINA, ebenda 1894. — JAKSCH, Chem. Zeit. 1891, 77. — RIDEAL und YOULE, Chem. Drugg. 1891, 788. — O. FROMM, Wertbest. v. G. a. Zeitschr. anal. Chem. 40 (1901),[S. 453] 143. — HARTWICH in Pharm. Praxis. — KOCH, Atlas. — A. FERNAU, Untersuchungsergebn. b. offiz. Präp. u. Drog. im Jahre 1902/1903 in Östr. Jahresb. f. Pharm. IV, 1903, 150. — MITLACHER, Zeitschr. d. allg. Östr. Apoth. Ver. 1904, 1480. — PIETRO, Proc. Am. ph. assoc. 1894, 901. — SOLLMANN, Response of gums etc. to Moores Reaction. Am. journ. pharm. 1911, 176.
Anwendung. G. arabicum ist das am meisten in der Medizin gebrauchte Mucilaginosum. Es wird als einhüllendes Mittel, dann besonders bei Katarrhen, aber auch bei Diarrhöen angewendet. Gummi ist Bestandteil vieler Hustenmittel (Gummibonbons) und wird auch als Bindemittel für Emulsionen benutzt. Man benutzt es auch als Hilfsmittel beim Pulvern einiger Drogen (Fruct. Capsici, Fruct. Colocynth.). Vor dem Pulvern ist das Gummi zu trocknen, dies darf nicht über 30–40° und länger als einen Tag geschehen, da sich sonst das Gummi verändert. Da Gummi aus der Luft Feuchtigkeit anzieht, ist es in gut verschlossenen Gefäßen aufzubewahren. Lösungen des G. arabicum dürfen nicht zugesetzt werden: Mineralsäuren, Metallsalze, Bleiessig, Brom- oder Eisensalze, Sulfate, Oxalate, Silikate, Alkohol und alkoholische Tinkturen, sowie, es sei denn, daß die Lösung «sterilisiert» wurde, die oben (S. 446) genannten Substanzen. Technisch wird es als Klebemittel (Briefmarken! die Reichsdruckerei braucht jährlich über 60000 kg) und bei Appreturen (bes. der Seidenwaren), in der Färberei, Druckerei, bei der Bereitung von Tinte, Farben und Zündhölzern, die feinsten Sorten auch in der Liqueurfabrikation und der Confiserie (Pasta gummosa) benutzt. Mit Kaliumchromat gibt Gummi eine lichtempfindliche Masse (EDER).
G. arabicum ist ein gutes Nahrungsmittel, denn die Verbrennungswärme der Arabinsäure beträgt bei konstantem Volum 4004 Cal. für 1 g (1369,4 Cal. für 1 g-Mol.). Salzsäurehaltiger Magensaft wirkt glykosebildend (FUDAKOWSKI), mindestens 46% werden verdaut (VOIT). In Australien leben die Eingeborenen in der trockenen Jahreszeit fast nur von Acaciengummi oder Koljang (PREISS). Auch die Tuaregs der Sahara verzehren das Gummi (DUVEYRIER), ebenso die Eingeborenen in Ostafrika (HOLST). Im Somaliland wird das «süße» Gummi (d. h. G. arab., das «bittere Gummi» ist Myrrha) gekaut und dient bei langen Märschen oft als einzige Nahrung. Während des Mahdiaufstandes im Sudan lebten die Heere besonders von Gummi (s. oben S. 427). Frisches vom Baume gebrochenes G. stillt auch den Durst. DAVID schützte sich in Cordofan durch Gummigenuß vor dem Verdursten.
Geschichte. G. a. findet sich nicht bei den Sanskritschriftstellern, die arabisch-persischen beschreiben es unter dem Namen Samgh-i-arabi (DYMOCK). Der Autor des Makhzan beschreibt G. a. als das G. des Baumes ammughilán oder mughilán, gelblich-weiß, durchscheinend und gänzlich löslich in Wasser (Pharmacogr. ind.). In der Schatzkammer des RHAPSENIT in Medinet-Abu finden sich Darstellungen von Gummibäumen und fand sich Gummi (kami-en-punt) selbst, das die Ägypter seit den ältesten Zeiten aus dem Lande Punt (vgl. I, S. 459) holten. In zahlreichen Rezepten des Papyrus EBERS wird die ägyptische Acacia und Gummi erwähnt. THEOPHRAST erwähnt einen Wald der Gummiacacie in der Thebais in Ägypten. Und auch in dem botanischen Lexikon Kitâb aš šaǧar (X. Jahrh.) stehen die Nilacacien. Die ἄκανθα des THEOPHRAST (hist. pl. IV, 2, 8), von der er sagt «γίνεται δὲ ἐκ ταύτης καὶ τὸ κόμμι καὶ ῥέει καὶ πληγείσης καὶ αὐτόματον ἄνευ σχάσεως», wie des DIOSKURIDES ἀκακία aus Ägypten (I, cap. 133), die er als gummilieferndes Dorngewächs beschreibt, und des PLINIUS Spina (XIII, 20) war die Nilacacie, der Sontbaum (altägypt. cant, sont, šent [die hieroglyph. Zeichen I, S. 468], arab.: charad, śeģer fetna, sense-locht): Acacia nilotica DEL. (A. vera), deren vorzügliches Holz und deren schöne Blumen zu Kränzen und medizinisch in Ägypten angewendet wurden, und die auch Gummi lieferte. Auch STRABO (VII, 1) erwähnt Haine der thebaischen Akantha und HERODOT (II, 96) gedenkt des Gummi unt. and. bei der Einbalsamierung der Leichen, und vergleicht den Baum mit dem kyrenäischen Lotus (Diospyros Lotus). In Kyphivorschriften (I, S. 473) finden sich Acacienfrüchte (sannâr), deren Zeichen bei den hieroglyphischen[S. 454] Inschriften oft als Determinativ hinter Leguminosenfrüchte gesetzt wird (I, S. 466), und die noch heute in Ägypten zum Gerben dienen. Die Blüten, deren Duft die Ägypter im Zimmer liebten, waren Ingredienz von Heilmitteln, z. B. der ägyptischen Salbe (αἰγυπτίον μύρον das μύρον λευκὸνwurde mit den Blüten der A. Senegal bereitet). Blühende Zweige finden sich auf Tempelwänden dargestellt (WÖNIG, Fig. 140). Das Gummi der Nilacacie, das heute in Ägypten nur noch für den Hausbedarf gelegentlich gesammelt wird, war auch in alter Zeit, wie es scheint, kein großer Handelsartikel, denn schon im XVI. Jahrh. n. Chr. bezogen die Ägypter das Gummi, das sie unter anderem zur Bereitung von Malfarben benutzten (mu-nu-qemi = Gummiwasser zum Malen steht z. B. im Totenbuche), aus dem Lande Punt, d. h. von der Somaliküste, aus (oder über?) Süd-Arabien (Cane), vom Roten Meer oder der Küste von Suakim (KRALL). Das ānte von Punt war arabisches Gummi (KRALL). Im römischen Altertum und im Mittelalter kam alles Gummi von der Somaliküste oder über Yedda. Im Periplus (I, S. 535) fehlt das Gummi merkwürdigerweise, oder verbirgt es sich unter dem Worte mocrotu (?). PLINIUS bemerkt, daß das ägyptische Gummi 3 Denare das Pfund koste und daß schlechte Gummisorten von dem Mandel- und Kirschbaume, das schlechteste von der Pflaume stamme. Das beim Tabernakelbau viel benutzte Holz shittah, shittim (Exodus 25, 30), war das sehr harte Holz einer Acacia, entweder Seyal (TRISTRAM) oder arabica (CHARPENTER) oder horrida, mit rundlichen Blütenständen. Der brennende Busch des Moses (seneh) wird von TRISTRAM für Acacia nilotica gehalten. Auch von einem «Tal der Acacien» ist in der Bibel die Rede. Karaz ist die Frucht der Acac. nilotica DEL. Die Alten verwendeten ihr Extrakt. DELILE (Flore d’Egypte) hält die ἄκανθα διψὰς des THEOPHRAST (hist. pl. IV, 8) für A. Seyal (= spina sitiens des PLINIUS, Lib. 13, 1). Des HIPPOCRATES Acacia (ἄκανθα) war (nach DIERBACH) A. Senegal, «die weiße Acacie», da sie weißes Holz, weiße Rinde und weiße Blüten besitzt, nach anderen A. arabica. Arzneilich benutzte das G. auch HIPPOCRATES, doch nur wenig, und im ganzen Altertum und Mittelalter wurde es medizinisch und technisch nicht viel beachtet. Doch kennt z. B. SCRIBONIUS LARGUS Acacia. Bis zum XIV. Jahrh. scheint nur ostafrikanisches G. benutzt worden zu sein. Mit der Erschließung Westafrikas im XV. Jahrh. (I, S. 729) erscheint dann auch das Senegalgummi im Handel. Es erlangt aber erst im XVII. Jahrh. in Frankreich Bedeutung und ist erst seit den dreißiger Jahren des XIX. Jahrh. ein ernstlicher Konkurrent des arabischen. Es setzte sich am Ende des XIX. Jahrh. ganz an seine Stelle, als während der blutigen Unruhen im Sudan der sudanische Gummihandel ganz aufhörte. Jetzt hat das cordofanische G. wieder die Führung (vgl. oben S. 428). Das Mittelalter brauchte nicht viel G. PEGOLOTTI (I, S. 702) erwähnt das G. ar. unter den Drogen, die nach Pfund, nicht nach Quintal gehandelt wurden. Die arabischen Ärzte benutzten das Gummi und von ihnen übernahm es die Schola salernitana. In der Alphita (I, S. 640) steht Acacia cirra (Acassia cira id est dura), bei SERAPION Arbor gummi arabici = Acacia, Spina babylonica, achachie. Die Abbildung des Baumes bei POMET (I, S. 942) ist unkorrekt. Er nennt als Synonyme des Gomme arabique: G. thebaique, Sarracene, de Babylone ou Achantine ou d’Acacia d’Egypte. Das G. kam Ende des XVII. Jahrh. via Arabien nach Marseille, war aber damals selten und wurde durch die «gomme du Senega» ersetzt. Außer diesem unterscheidet POMET noch ein G. turique, G. vermiculée und G. d’Angleterre.
Das Altertum unterschied die Gummis nicht von den Harzen. Auch noch im Mittelalter gingen unter dem Namen Gummi auch die Harze (z. B. gumma colofonia, gummi pini in der Alphita, und auch noch später [Nördlinger Register 1480]: gumi pini, in der Berluliste [1724]: gum copal). Das hat sich bis heute erhalten. In den Grossistenlisten figuriert immer noch Gummi Benzoes, G. Mastix, G. Elemi. Die Jahrtausende sind über diese falsche Bezeichnung hinweggegangen, ohne Spuren zu hinterlassen. Ja, unter Gummi par excellence versteht man heutzutage oft — Kautschuk! Daß G. a. von dem Amygdalaceeng. (gummi qui exit de arbore ceraso vel pruno) verschieden ist, war schon im XII. Jahrh. bekannt.
Der Bezeichnung Gummi arabicum begegnen wir schon im Altertum, bei DIODORUS SICULUS, bei NICOLAUS DAMASCENUS (I, S. 573), ORIBASIUS (I, S. 589) u. and. Und auch in der Alexandrinischen Zolltafel (I, S. 569) steht onyx (commis [?] oder gummi) arabicum — bei SCRIBONIUS LARGUS (I, S. 577) dagegen commi alexandrinum und bei ALEXANDER TRALLIANUS κόμμι λευκόν. — Die Bezeichnung blieb dann durch das ganze Mittelalter erhalten. Sie findet sich z. B. bei SERAPION (I, S. 605). Gomarabische steht unter den Einfuhrartikeln von Pisa (1305) und Telamone (1379), dann in der Liste von Paris (1349, I, S. 706) und PAXI erwähnt gomma rabica unter den Artikeln des venetianischen Handels (FLÜCKIGER). In der Alphita (I, S. 649), in den[S. 455] Tabulae, bei PLATEARIUS sowie den Sinonoma BARTHOLOMEI steht: gummi arabicum — Sanig, Sanag arabicum. Im Inventaire LEFORT (I, S. 804) steht: «2 onces de gomme arabique tauxée 2 blancs», was auf keinen großen Bedarf schließen läßt. Im Droits de courtage établis à Paris au XVᵉ siècle (ed. DORVEAUX) steht «gomme arabic VI d. t. la bale». CORDUS (I, S. 799) unterschied: G. splendidum, arabicum und vermiculatum (Traganth?). Er verwendete auch Succus et fructus arboris Acaciae. Gummi arabic. steht in der Frankfurter Liste (I, S. 812), dem Eßlinger Drogenverzeichnis (I, S. 815) und zahlreichen Taxen. In der Taxe von Hamburg 1587 steht Gummi arabicum = Dinten Gummi. Die Berluliste (I, S. 950) hat neben gum arabicum auch gum cerasorum. Aber die Bezeichnung arabicum bedeutet nicht, daß Arabien das Land ist, wo das G. produziert wurde, ebenso wenig wie wir aus dem häufigen Beisatz aegypticum, indicum, aethiopicum, romanum irgend welche Schlüsse auf das Produktionsland ziehen dürfen. Über Arabien kam G. aber sicher schon im Altertum und Mittelalter. Auch IBN KORDADBAH (I, S. 616) nennt es bei Yemen.
Acacia Senegal ist schon von PROSPER ALPIN (I, S. 770) beschrieben, sodann von ADANSON (XVIII. Jahrh.) und endlich von GUILLEMIN und PERROTTET (a. a. O.).
Lit. FLÜCKIGER-HANBURY, Pharmacographia. — FLÜCKIGER, Pharmakognosie. — WÖNIG, Die Pfl. d. alt. Ägypt. — Die Acacien Ägyptens in JORET, Les plant. dans l’antiquité I, 144. — PEREIRA, Heilmittellehre.
Prunoideengummi.
Amygdalaceengummi, Kirschgummi, gummi nostras, gomme du pays, cherry gum.
Zu technischen Zwecken wurde der Gummi der Kirsche (Prunus Cerasus) und Pflaume (P. domestica u. and.) schon im XII. Jahrh. benutzt (THEOPHILUS oder ROGKER Schedula divers. art. in EITELBERGER, Quellenschr. f. Kunstgesch. 1874) und die HILDEGARD (I, S. 667) erwähnt ein Gummi de Persico (Pr. Persica?) als Heilmittel. Außer diesen wird auch das Gummi des Mandelbaumes (Prunus Amygdalus) und der Aprikose (P. armeniaca) gesammelt und in Böhmen das G. von Amygdalus spartioides (HOFFMEISTER). 1891 kam aus Buschir ein Prunus-G. von P. Bopkarensis ROYLE und P. Puddum ROXB. (SICKENBERGER), 1906 persisches G. besonders von Amygdalus leiocarpa BOISS. in den Handel (HILLIER). SCHINDLER bemerkt (1881), daß das Djedk-i-ardjin genannte Gummi Persiens von dieser Pflanze bei Kerman gesammelt wird und in Afghanistan sammeln die Eingeborenen Pflaumen- und Aprikoseng. (AITCHISON). Der cherry gum Indiens wird von Prunus Puddum abgeleitet (COOKE) und mindestens ein Teil des Bassorag. und des Hog gum (vgl. S. 405) ist ebenfalls Amygdalaceeng. In China wird Pfirsichg. (táu-kian) gesammelt, ebenso in Indien (aru, reck, mandala, DRAGENDORFF). Jetzt ist Prunoideeng. nur wenig in Gebrauch (unter anderem beim Kattundruck), da es nur wenig löslich ist und mit Wasser aufquillt. Es ist der Typus des Cerasingummis.
Die Bildung des Prunoideengummis erfolgt in, infolge von Verwundungen vom Cambium im Jungholz gebildeten, Gummiparenchyminseln (MIKOSCH), aber auch in der Rinde (WIGAND, TSCHIRCH), s. auch oben S. 410–416. Prunoideengummi ist blaßgelb bis rötlichbraun, doppelbrechend, hat glänzende, muschelige Bruchflächen, außen ist es meist trübe. Es wird durch Alkalien braun, durch Salzsäure rotviolett. Es enthält 13–14% Wasser und 2–3,5% Asche. Während sich alle Arabingummis in Chloralhydrat (60%) klar lösen, hinterlassen die Cerasingummis einen gequollenen Rückstand, die Bassoragummis (Traganth) geben eine klare Lösung, über der sich eine klare gequollene Masse absetzt (MACH, WIESNER).
Das Prunoideeng. wird meist als metarabinsaurer Kalk betrachtet (FRÉMY). Der lösliche Teil des Kirschg., der (nach SCHMIDT) bis 52,1% betragen kann, ist kein Arabin (GARROS), er wird durch Bleiessig nicht gefällt. Pfirsich- und Mandelg. scheint mehr lösliches G. zu enthalten als Kirschgummi. Pfirsich- und Pflaumengummi geben bei der Oxydation Schleimsäure. Kirschgummi enthält c. 39,96% Pentosane und liefert bei der Hydrolyse Galaktose und (bis 50%) Arabinose (HAUERS) — die Arabane überwiegen also. Die gleichen Produkte lieferten neben unbekannten Zuckerarten auch das Pfirsich- und Aprikosengummi (LEMELAND, STONE). Kirschgummi gibt bei der Hydrolyse keine Xylose (Kirschholz viel!) oder doch nur sehr geringe Mengen (BROWNE und TOLLENS). Über das Cerasin vgl. oben S. 442. Das Cerasin der Kirsche soll sich durch ein in der Kirsche befindliches (nicht durch ein anderes Amygdalaceen-) Enzym in Arabin überführen lassen (GARROS). Oft enthält das Kirschg. auch Zucker und Gerbstoff[S. 456] (SCHMIDT), stets eine Oxydase. Bei der Hydrolyse des Pflaumeng. erhielt GARROS eine neue (?) Pentose, die Prunose. LEMELAND fand im Aprikoseng. 8,83% in Wasser Unlösliches, 16,1% Wasser, 3,3% Asche, 23,6% Galaktane, 48,5% Pentosane. Es lieferte Arabinose und drehte −1°93. In Pflaumeng. waren dagegen 20,8% Unlösliches, 15,4% Wasser, 2,5% Asche, 13,3% Galaktane und 76,3% Pentosane enthalten. Es lieferte Arabinose und drehte kaum. MARTINA gibt folgende Übersicht:
|
Art des
Gummis |
Asche
% |
Kalk in
Gummi % |
Kalk in
der Asche % |
Schleimsäure
% |
Galaktose
% |
Furfurol
% |
Pentosen
% |
Gesamt-
glykosen % |
Galaktose
+ Pentosen % |
|
Aprikosen
|
4,20
|
1,85
|
44,04
|
9,16
|
12,21
|
17,27
|
34,54
|
43,48
|
46,75
|
|
Pflaumen
|
2,15
|
1,07
|
49,76
|
5,19
|
6,92
|
31,03
|
62,06
|
66,47
|
68,98
|
|
Kirschen
|
2,50
|
1,00
|
40,00
|
6,13
|
8,17
|
23,07
|
46,14
|
56,38
|
54,31
|
Durch eine Lösung von 1% NaOH und 2,5% Na2CO3 löslich gemachtes Kirschg. ist als «Kunstgummi» im Handel. Auch durch Erhitzen mit Wasser unter Druck werden unlösliche G. löslich.
Lit. MIKOSCH, Sitzungsb. d. Wien. Akad. 1906, 911 (dort die Lit.). — WIGAND, Pringh. Jahrb. 3. — TSCHIRCH, Angew. Anatomie S. 210, Fig. 211. — WIESNER, Rohstoffe. — SICKENBERGER (Prunusg.). Chem. Zeit. 1890, 350. — C. HOFFMEISTER, Amygdalusg. Ber. d. d. bot. Ges. 1898. — Aprikoseng.: LEMELAND, Journ. pharm. 1905, 443. — HILLIER, Kew Bull. 1906, 109. — HUERRE (G. d. Mandelbaums). Journ. pharm. chim. 1908, 561. — HAUERS, Dissert. Göttingen 1902. — LEMELAND, Journ. pharm. chim. 21, 443. — STONE, Ber. d. d. chem. Ges. 23, 2574. — GARROS, Journ. ph. 1892, 535. Bull. soc. chim. (3) 7, 625. — ALLEN und TOLLENS, Lieb. Ann. 260, 289. Ber. d. chem. Ges. 23, 137. — MARTINA, Apoth. Zeit. 1894.
B. Drogen, welche vorwiegend aus Membraninen bestehen, die keine Polysaccharide enthalten oder von denen es nicht sicher ist, ob sie solche enthalten.
Zu dieser Gruppe gehören Kork, Pollenin, Pilzzellulose und die Diatomeenschalen. Neuere Untersuchungen haben es zweifelhaft gemacht ob in diesen Polysaccharide vorkommen, da die als Beweis angeführte Reaktion, daß die mit Kali behandelten Membranen mit Jodreagentien (z. B. Jod-Schwefelsäure, Chlorzinkjod) sich violett färben, auch auf andere Substanzen, beim Kork auf die Phellonsäure, bei der Pilzzellulose auf Chitosan zurückgeführt werden kann.
Die Drogen dieser Gruppe mögen also den Zellulosindrogen gegenüber gestellt und ihnen hier angehängt werden.
1. Suberino-Membranindrogen.
Ein höchst eigenartiges Membranin ist der Kork, der hier als Suberinomembranin bezeichnet werden mag, da er eine Bildung sui generis ist. Die ältere Annahme ging dahin, daß die Korkmembran eine durch Suberin (V. HÖHNEL) «inkrustierte» Zellulosemembran sei. Daß dies nicht richtig ist, wissen wir jetzt bestimmt. Ob die Suberinlamelle überhaupt Polysaccharide enthält ist unsicher und neuerdings bestritten worden (GILSON, WISSELINGH). Die älteren Beobachtungen von PAYEN, MOHL, FRÉMY und URBAIN, KÜGLER, WIESNER, HABERLANDT und VON HÖHNEL stützten sich auf die Tatsache, daß die Korkmembran nach Behandeln mit kochendem Alkali sich mit Chlorzinkjod und Jodschwefelsäure violett färbt, was als «Zellulosereaktion» angesprochen wurde. Aber es ist zu berücksichtigen, daß auch die Phellonsäure und ihre Salze, die beim Behandeln von Kork mit kochenden Alkalien[S. 457] entstehen, durch Chlorzinkjod violett werden (GILSON), also die Zellulosereaktion vortäuschen können. V. WISSELINGH bestreitet daher das Vorkommen von Zellulose in der Suberinlamelle. Bemerkenswert ist auch, daß bisher aus Kork allein weder Hexosen noch Pentosen isoliert werden konnten. Charakteristisch für den Kork sind jedenfalls andere Verbindungen als Polysaccharide, besonders Fettsäureester, weniger aromatische Reste. Die wichtigste Gruppe ist die der Fettsäuren, die KÜGLER zuerst darin (1884) nachwies und die dann GILSON und V. SCHMIDT näher studierten. Gefunden wurde neben Stearinsäure, besonders Phellonsäure, Suberinsäure und Phloionsäure. Der Phellonsäure schreibt SCHMIDT die Formel:
zu. Sie wäre dann eine hydroaromatische Verbindung. Bei der Aufspaltung des Ringes bei Behandeln mit HNO3 entsteht Korksäure:
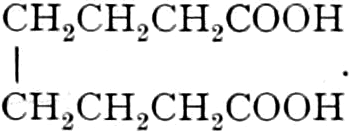
Wie diese Säuren gebunden sind, ist noch nicht aufgeklärt. Die geringe Menge Glycerin, die KÜGLER bei der Verseifung erhielt (auf 30% Säuren nur 2,65% Glycerin, V. SCHMIDT fand mehr), deutet darauf, daß nur relativ geringe Mengen der Säuren als Glycerinester vorliegen können, das meiste ist wohl anders gebunden. GILSON denkt an zusammengesetzte Ester, Kondensations- und Polymerisationsprodukte verschiedener Säuren, CZAPEK auch an laktonartige Anhydride, V. SCHMIDT an Anhydride und Polymerisationsprodukte. Keinesfalls können wir den Kork als ein Gemisch von Fett und Zellulose auffassen, wie man dies früher tat und Zellulose findet sich, wenn überhaupt, nur als Ligninomembranin in der Mittellamelle (und der Innenlamelle, GILSON). Daneben finden sich auch aromatische Reste im Kork. Korkzellmembranen speichern Chlorophyll, Alkanna (CORRENS), Cyanin (ZIMMERMANN) Sudan III (LAGERHEIM), was auf die Fettsäuren zurückzuführen ist und färben sich mit Osmiumsäure, müssen also ungesättigte Verbindungen enthalten. Mikrohistochemisch ist die Korkmembran dadurch ausgezeichnet, daß sie in konz. Schwefelsäure, selbst nach längerer Einwirkung, sich nicht löst (MITSCHERLICH, 1850). Ebenso ist sie in Kupferoxydammon, in kaltem und heißem SCHULTZEschen Gemisch (chlorsaures Kali und Salpetersäure), in kalter Chromsäurelösung unlöslich. Konz. Kalilauge färbt besonders beim Erwärmen gelb, dabei tritt zuerst Körnelung auf und dann gelbe Tropfen.
Ich habe schon 1888 darauf aufmerksam gemacht, daß nicht alle in konz. Schwefelsäure unlöslichen Membranen als «verkorkt» zu betrachten sind. Besonders bei Drogen kommen oft durch postmortale Infiltration mit Phlobaphenen mehr oder weniger gefärbte Membranen vor, die sich nicht in Schwefelsäure lösen und doch nicht verkorkt sind.
Vgl. ferner das mikrohistochemische Verhalten bei Suber.
Suber.
Syn. Suber quercinum, Kork, — liège (franz.) — cork (engl.) — corcho (span.) — sughero (ital.) — kurk (holl.) — korkki (fin.) — para (ung.) — suberin (russ.) — plutovina (kroat.) — korek (böhm.) — φελλός (griech.).
[S. 458]
Die Korkeiche (Korkbaum, Korg- oder Karchbaum [CORDUS], Gorckenbaum, Sohlenholz, Pantoffelholz) heißt franz. chêne liège, engl. Cork-tree, holl. Korkboom, vlothout, ital. sughero, suvero, port. sobro, sobrereiro, span. alcornoque (in Catalonien suro, surera, in Galicien subreiro), in Algerien, Tunis und Marocco: kerrouch oder fernan. Den Baum nannten die Römer Suber (so schon bei VIRGIL) oder corticis arbor, den Kork vielfach kurz Cortex (Katexochebegriff!), da von allen Rinden die wichtigste — das deutet also auf vielfache Benutzung (FLÜCKIGER).
Etym. Sûber von sub (= unter) und suere (= nähen) wegen der Verwendung zu Schuhsohlen (s. Geschichte), aus dem gleichen Grunde auch zu subire in Beziehung gebracht. Kork, seit SCHOTTEL 1663 gebucht (KLUGE) — ich finde Kork aber schon 1659 im Rostocker Catologus (s. Taxen, I, S. 825) —, aus span. corcho = Korkholz, Pfropf, frühengl. cork, dies von cortex über scorzia, scorza (ital. von excortea) — liège von levis, also = der leichte Stoff — Pantoffelholz wegen der schon von PLINIUS erwähnten Benutzung für Schuhe — Pantoffel aus ngr. παντοφελλός = Ganzkork.
Stammpflanze und systemat. Stellung. Quercus Suber L. Fagaceae — Castaneae. — (Quercus Sect. Lepidobalanus Endl. c. Suber.)
Sehr ähnlich und fast nur durch zweijährige Fruchtreife, einjährige, etwas breitere Blätter unterschieden ist die einen in geringerer Menge in den Handel gebrachten, übrigens guten Kork liefernde, in Südostfrankreich (zwischen Gironde und Adour), Portugal und Spanien heimische, härtere (über den 45° hinausgehende) Quercus occidentalis GAY. (in Frankreich: Corcier), die einige für eine Varietät der Korkeiche halten (Querc. Suber var. latifolia). Der Kork der in Mittelitalien und der Provence häufigen Qu. Pseudo-Suber SANTI (Bastard von Q. Suber und Cerris?) ist minderwertig (MATHIEU). Als Faux lièges gelten (in Algier) die Hybriden: Qu. numidica TRABUT (Qu. Suber × Qu. Afares = Qu. Pseudo-Suber DC. ex parte) und Qu. Fontanesii (Qu. Suber × Qu. Cerris).
Beschreibung der Stammpflanze. Die Korkeiche bildet einen bis 10, ja 16 selten 20 m hohen immergrünen Baum von 3–5 m Stammumfang, mit großer, unregelmäßiger, aufgelöster, zerzauster, meist nicht sehr reich belaubter Krone (vgl. I, Fig. 86 u. 89 u. Taf. X). Die jüngeren Zweige sind grau oder gelblich-filzig, die jüngeren Stämme und Äste sind mit einem glatten, rotbraunen Kork bedeckt, der mit den Jahren sehr dick und rissig und grauweiß wird und sich schließlich vom 50. Jahre an zum Teil in kleinen Schuppen ablöst. Die 2–3 Jahr dauernden Blätter sind elliptisch, eiförmig, eiförmig-länglich bis länglich (wie bei anderen immergrünen Eichen von erstaunlicher Vielgestaltigkeit, RICKLI), 3–7 cm lang, 1,5–3 cm breit, auf 5–12 mm langem Stiel, meist scharf bis dornig-gezähnt, selten ganzrandig, in der Jugend graufilzig. Die männlichen Kätzchen mit filzigen Spindeln, stumpf sechslappigem Perigon und behaarten Antheren. Die weiblichen Infloreszenzen fast sitzend. Früchte im ersten Jahr reifend. Cupula verkehrt-eiförmig-halbkugelig mit locker angedrückten graufilzigen Schuppen. Eichel zweimal länger als die Cupula, glänzend hellbraun. Der Baum blüht meist im April und Mai. Die Samen reifen vom September bis Januar. Sie sind bitter und als Viehfutter weniger brauchbar als die von Q. Ilex var. Ballota, doch kommen auch Varietäten mit süßen Samen vor. Die Wurzel treibt reichlich Schößlinge.
Verbreitung. Größere Bestände der Korkeiche lassen sich nördlich vom 45. Breitengrade nicht halten. Ihre Polargrenze fällt zusammen mit der Isotherme von 13,5° C. Sie gedeiht am besten auf Hügeln und mittleren Gebirgen (200–800 m in Algier, 400 bis 600 m in Spanien). In Spanien geht der Baum bis 1200 m, in Algerien bis 1300 m. Sein Alter übersteigt nicht 200 Jahre. Die Korkeiche findet sich in der Westprovinz des Mittelmeerdrogenreiches (s. die Karte) in Südostfrankreich, Spanien, Portugal, Balearen, Sardinien, Korsika, Sizilien, Italien, Istrien, Dalmatien und Nordwestafrika, besonders Algier und Tunis, aber bis ins Innere von Marocco.[S. 459] Sie bildet Wälder oder ist (selten) in Alleekultur (I, Taf. V). Sie wurde neuerdings in die Südstaaten Nordamerikas und an die atlantische Küste südwärts von Virginien eingeführt.
Mit Benutzung der Karten von Müller und Lefebvre gezeichnet von A. Tschirch.
In Spanien sind c. 300000 ha der regenreicheren Provinzen mit Korkwald bedeckt, meist als Mischwald (mit Steineiche) an niederen Gebirgshängen in einer Meereshöhe von 500–600 (800) m, vornehmlich in Catalonien, Nieder-Andalusien und Estremadura. Catalonien besitzt die schönsten und bestkultivierten Korkwälder des ganzen Korkgebietes (Abhänge der Pyrenäen und des catalonischen Gebirges, Ebene von Ampurdan). Besonders schön sind die 80000 ha großen Wälder der Provinz Gerona, zwischen Junquera und Figueras, an den Abhängen der Sierra de las Gabarras (La Bisbal) und im östlichen Bergland (Gerona bis Arbucias) sowie an der Küste (Blanes, Calonge) (s. die Karte).
Die Korkeichenwälder Nieder-Andalusiens, die 112000 ha bedecken, befinden sich in den Provinzen Huelva, Sevilla, Cadiz und Cordoba, die meisten in der Provinz Huelva: in der westlichen Sierra Morena, der sog. Sierra Aracena (Aracena im Quellgebiet des Odiel, Huelva und Murtija) und im Süden (Lepe, Ayamonte, Almonte) in der Provinz Sevilla: zwischen Sevilla und Utrera und in der Sierra de Pedroso, in der Provinz Cadiz: auf den Bergen zwischen Guadiaro und Guadalete und den Sierras de Gazules, de Algeciras, de Palma und de Tarifa — hier fast reine Bestände bildend, weiter oben Mischwald (mit Qu. Lusitanica und Ilex). Schöne Korkwälder liegen auch bei San Roque und in den Tälern des Guadiaro, Jogerganta und Rio Guadarranque, zwischen Arcos de la Frontera und Medina-Sidonia (dort die «Lomas de alcornoque» = Korkhügel); in der Provinz Cordoba: Sierra de Cordoba bis zum Guadalquivir. Von den andalusischen Korkdistrikten liefert Cortes den meisten Kork (1896: 11005 t), dann Jerez und Alcalá, weniger Huelva, Easares und Cadiz u. d. and. Distrikte. In der Sierra Aracena bildet die Korkeiche in Höhen von 400–600 m gemischte Bestände mit Q. Ilex und Q. Ballota (REIN).
Die Korkwälder Granadas liegen in der Provinz Malaga (Sierra de Antequera, Hochebene von Ronda, Sierra de Bermeja zwischen Marbella, Estepona und Gaucin, Sierra Contraviesa), die von Estremadura in der Provinz Cáceres (zwischen Mérida und Cáceres bis zum Rio Tiétar und Toril). Auch die Provinz Burgos in Altkastilien hat Korkwälder, sowie Asturien, weniger Galicien.
Die Korkwälder Portugals umfassen (1911) c. 500000 ha (WEBER), sie liegen besonders im Süden in den Gebirgsketten von Algarve (z. B. den Tälern der Serra de Monchique) im südlichen Alemtejo, in Estremadura (Tal des Sado, Palmella), endlich im südlichen Beira — weniger in Mittel- und Nordportugal (Serra de Cintra). Die Korkwälder längs der Westküste bestehen besonders aus Quercus occidentalis.
Frankreichs Korkwälder umfassen 1911 c. 150000 ha. Die meisten liegen in der Provence (Var, Alpes maritimes), weniger in der Gascogne (Landes, Lot-et-Garonne, Gironde — fast ausschließlich Q. occidentalis), in Languedoc (Roussillon) und auf Corsica (Bavella). In Corsica bildet die Korkeiche besonders im Süden (Portovecchio, Monaccia) ausgedehnte Wälder (RICKLI). Die Korkwälder der Landschaft Roussillon umfassen nur 1928 ha, liefern aber den besten französischen Kork. Die Korkwälder der Provence bedecken 113600, die der Gascogne 24100, die Corsicas c. 9000 ha (1911: 15000 ha, WEBER).
Italien hat nur noch wenige Korkeichen (immerhin 80000 ha WEBER), mehr Sardinien und besonders Sizilien, die wenigsten Dalmatien. In Italien wurde früher unerhörter Raubbau getrieben und viele Korkeichen für Bauholz geschlagen. Jetzt forstet man wieder auf.
In Algerien findet sich die Korkeiche besonders in der Kabylie du Djurdjura und im Gebiete des Tell (Atlas tellien), einem hügeligen bzw. gebirgigen Landstrich von 100–150 km Breite mit mediterranem Klima, wo das von ihr bestandene Gebiet (in einer Höhe von 10 bis 1300 m, bes. 200–800 m [TRABUT] — zone de chêne-liège —) 1900: 480000 ha einnahm, davon waren 273713 ha Staatswaldungen, der Rest Privat- und Gemeindewald. 1911: 508000 ha (WEBER). Viele Korkeichen finden sich in den Depart. Oran (Tlemcen, Oran, Ammi-Moussa, Tiaret, Mascra, Sidi bel Abbes) und Alger (Djurdjuraberge, Tizi Ouzou, Azazga, Sahelthal, Djebel-Djurdjuraberge, bes. Bouïra und Aumale, dann Ténes, Cherchel, Alger, Tenied el Hâad, Orleansville, Medéa u. and.). Die meisten und schönsten aber in Constantine (von Bougie bis La Calle: Djidjelli, El Milia, Taher, Collo, von Philippeville bis Bône, St. Croix[S. 460] (Edoughberge) im Innern: Constantine, Souk-Arrhas). In Algier bildet Q. Suber mit andern Eichen die Zone der Bergwälder (TRABUT). Sie findet sich mit Qu. Afares besonders in der mittleren Region dieser Zone.
In Tunis beträgt das Korkwaldareal 116000 ha. Es ist alles Staatsdomäne. Die schönsten Korkwälder liegen im Bergland Khoumirie (Tabarka bis La Calle, Beja bis Bizerta und Cap Blanc). Dann an der algerischen Grenze Ghardimaou bis Souk Arrhas, ferner von Souk el Arba bis Fernana.
In Marocco finden sich enorme aber wenig zugängliche Korkeichenwälder (c. 1 Mill. ha, WEBER). Viel im Er Riff bis zur Muluja (Tetuan, Andjira, Ceuta), ferner zwischen Tanger und Rabat (Mamora, El Araisch u. and.). Marocco könnte also, wenn erschlossen, fast soviel liefern wie alle übrigen Länder zusammengenommen.
(Nach der Zusammenstellung in E. A. MÜLLER, Über die Korkeiche, Abh. d. Wien. Geograph. Ges. II [1900] Nr. 7 mit Karte.) Vgl. auch LEFEBVRE, Les forêts de l’Algérie 1900 (dort sind auch die übrigen Länder berücksichtigt) und LAPIE, Etud. phytogéogr. de la Kabylie du Djurjura 1909. Über die Höhengrenzen vgl. KOCH, Beitr. z. Kenntn. d. Höhengrenzen d. Vegetation im Mittelmeergebiet. Halle 1910.)
Die Korkeiche flieht Kalk und gedeiht am besten auf silurischem Schiefer und verwittertem Granit. Viele Korkeichen wurden durch Brände und unverständige Ausbeutung auf Gerberlohe vernichtet. In Frankreich und Algerien sind neue Korkwälder angelegt worden. Meist wird zunächst Mischkultur mit reichbelaubten Bäumen oder Wein bevorzugt.
Die ursprüngliche Heimat ist wohl Nordafrika, über die übrigen Länder ist die Korkeiche vielleicht durch eine sehr alte Kultur verbreitet (? FLÜCKIGER). Doch ist auffällig, daß PLINIUS sie weder in Spanien noch in Nordafrika erwähnt, die er doch als Beamter bereiste. Über die Kultur der Korkeiche vgl. SEMLER, Tropische Agrikultur II, 230.
Lit. GAY, Not. sur une nouv. espèce de chêne franc. Ann. sc. nat. 4, 7 (1856), 223. — DE CANDOLLE, Ebenda 4, 18, 49. — KOTSCHY, Die Eichen Europas und des Orients. Wien 1859–1862 m. 40 Taf. — PRANTL, Fagaceae in ENGLER-PRANTL, Pflanzenfam. — MATHIEU, Flore forestière. Paris 1877. — LAMEY, Le chêne-liège en Algérie 1870. — TRABUT, Les Hybrides du Quercus Suber. Associat. franc. p. l’avenc. Paris 1889. — LUERSSEN, Mediz.-pharm. Bot. — WIESNER, Rohstoffe. — MÜLLER, Die Korkeiche 1900 (dort auch die Reiseliteratur). — BATTANDIER et TRABUT, Flore de l’Algérie 1888/89. — TRABUT, Les zones botan. de l’Algérie. Assoc. franc. p. l’avenc. 1888 und De Djidjelli aux Babors. Bull. Soc. bot. France 1889. — TRABUT et MARES, l’Algérie agricole en 1906. Alger 1907. — Corsica: RICKLI, Bot. Reisestud. auf ein. Frühlingsf. durch Corsica. Zürich 1903. — Derselbe: Bot. Reisestud. von d. span. Mittelmeerküste. Zürich 1907. — FLÜCKIGER, Arch. Pharm. 1879. — Abbild.: Erste in CLUSIUS, Rariorum plant. historia 1601, 22 (Suber latifolium); dann auch bei MATTHIOLI (der eine Suberis consideratio schrieb) und NEES VON ESENBECK, Plant. med. Supplem. — PABST-KÖHLER, Medizinalpfl. t. 152. — Abbild. des Baumes bei POMET, Hist. gen. d. Drog. p. 136 (stilisiert), von VALENTINI im Museum kopiert. — Gute Abbildung des Baumes auch in KOTSCHY, Die Eichen Europas u. d. Orients 1862, taf. 33. Vgl. ferner I, Fig. 86 u. 89 und Tafel V. — Abbild. von algerischen Korkwäldern in: LAPIE, Etude phytogéograph. de la Kabylie du Djurjura. Paris 1909. Cap. I Les forêts de chêne-liège.
Pathologie. Wie andere Bäume, so wird auch die Korkeiche von holzzerstörenden Hymenomyceten besiedelt. Es wurden auf ihr Agaricus melleus, verschiedene Polyporus-, Fomes-, Trametes-, Lenzites-, Stereum-Arten und andere beobachtet (E. FISCHER). Die Insekten behandelt LAMEY (Le chêne liège Paris 1893). Eine Liste der wichtigsten auch in MÜLLER, Korkeiche (Abhandl. d. Wien. Geogr. Ges. 1900). Sehr gefürchtet ist Formica ligniperda LATR. (vgl. bei KÜGLER a. a. O. weiter unten).

(Basinger phot.)
Gewinnung. Nicht überall wo Korkwälder vorkommen wird marktfähiger Kork erzeugt, der beste in der spanischen Provinz Catalonien, besonders im Nordosten bei Junquera, Gerona und näher am Meer bei Toca, Palaforgell und San Feliu de Guixols an der Küste, dann in der Sierra Aracena, dem Quellgebiete des Odiel, der sich in den Busen von Cadiz ergießt, des Huelva eines Nebenflusses des Guadalquivir und des Murtija, der in den Ardila, einen Nebenfluß des Guadiana mündet. [S. 461]Mittelpunkt der Korkproduktion ist in diesem Gebiet Aracena und Fuente Heridos. Die sehr ausgedehnten Korkwälder Portugals (s. die Karte) werden ebenfalls stark ausgebeutet. Schon 1879 wurden fast 9½ Mill. kg Kork von dort ausgeführt. Eine von Jahr zu Jahr wachsende Korkproduktion befindet sich in Algier, wo sich die Korkwälder, sowohl die staatlichen wie die privaten, durch vernünftige Schutzeinrichtungen zu großer Blüte entwickelt haben, besonders im Departement Constantine bei Bona, Calle und weiter westlich. Auch Tunis produziert jetzt viel Kork. In Frankreich produziert das Depart. du Var, les Alpes maritimes, Lot-et-Garonne, des Landes, Pyrénées-Orientales und Corsica; in Italien: außer dem Festlande, Sardinien und Sizilien. Der Dalmatinische und der Istrianer ist minderwertig. Über die Produktion aller Länder orientiert LEFEBVRE, Les forêts de l’Algérie. Paris 1900.
Die Korkeiche wird erst, wenn sie 8–25 (in Algier 15) Jahre alt ist, zur Korkgewinnung herangezogen. Die besten Korkplatten liefern Bäume im Alter von 5–100 Jahren auf magerem, steinigem Boden. Derselbe Baum kann in Pausen von 8–10 Jahren immer wieder Kork liefern bis er 150 Jahre und älter geworden ist. Eine vernünftige Korkproduktion scheint dem Baume nichts zu schaden.

Lager von Rohkork des Schweiz. Konsuls Borgeaud in Algier.
[Auf der Ricklischen Studienreise phot. von Businger.]
Die Korkeiche produziert im normalen Laufe ihrer Entwicklung eine ziemlich mächtige Korkschicht, die bei einem 130 mm dicken Stamm schon 15 mm erreichen kann. Diese Korkschicht wird mit der Zeit rissig und wird außen partiell abgestoßen, so daß eine außerordentlich unregelmäßige Umrißlinie entsteht. Dieser Kork ist, da stark zerklüftet, jedenfalls wenig zusammenhängend und kaum elastisch, auch in der Richtung der Jahresringe leicht zerreißbar, zur Stöpselfabrikation nicht zu brauchen und wird nur für Schwimmhölzer (Netze), zur Bedachung, zur Bekleidung von Gefäßen, für Gartenmöbel, zu Korkstaub und zur Kohle- und Spanischschwarz-Bereitung, ja bisweilen nur als Feuerungsmaterial benutzt. Dieser normale Kork trägt den Namen liége mâle, kurz: le mâle, männlicher Kork oder Jungfernkork, in Spanien: corcho bornio oder virgin, in Portugal: cortiça virgem. Er zeigt eine deutliche Schichtung, aber die Schichten, die wohl als vom normalen Phellogen erzeugte Jahreszuwachszonen zu betrachten sind, sind nur sehr schmal: 0,9 mm, ja gar nur 0,5 mm (DE CANDOLLE) oder schmäler, besonders die innersten. Die Zellen sind zum größten Teil typische Korkzellen, d. h. im Querschnitt tafelförmig und der Kork daher wenig elastisch. Sklereïden sind häufig, oft enthalten die Zellen braune Phlobaphenmassen. Dieser männliche Kork wird von den Bäumen mit der Axt entfernt. Dieser Prozeß, der als démasclage (span. descorcho) bezeichnet wird, wird zum ersten Male meist an 25–30 Jahre alten Bäumen von mindestens 35–40 cm Umfang nicht eben sehr sorgfältig ausgeführt. Da die Schälung etwa bis zum Phellogen erfolgt, so bleibt der Rest der primären und die ganze sekundäre Rinde am Baum. Sie färbt sich nach dem Ablösen an der Oberfläche erst rosenrot, dann rotbraun. Sie trägt den ganz passenden Namen mère, Korkmutter, denn in ihr erfolgt die Neubildung des Sekundärkorkes. Bald in der primären, bald in einer mehr oder weniger tiefen Schicht der sekundären Rinde, also in sehr verschiedener Tiefe, entsteht ein neues Phellogen und bald setzt nun eine sehr ausgiebige Neubildung von Kork ein. Der neugebildete Kork trägt den Namen liège femelle ou de réproduction, weiblicher Kork, in Spanien: corcho segundero oder fino. Er ist viel gleichmäßiger, und da die Jahreszuwachszonen viel breiter sind, auch viel mächtiger als der männliche. Außen ist er mehr oder weniger rissig und trägt hier als schmale braune Schicht die mère extérieure, die abgestorbenen Reste der primären oder der primären und des äußeren Teiles[S. 462] der sekundären Rinde — je nach dem Orte seiner Bildung. Seine Zellen sind relativ groß und weit, Sklereïden sind selten, daher ist er sehr elastisch. Er kann schon im ersten Jahre eine Dicke von 2, im dritten schon eine Dicke von 19 mm erreichen. Für gewöhnlich läßt man ihn aber 9–12 Jahre am Baum. Die Regierung in Algier ordnete an, daß in den Staatswäldern der Kork nicht eher geschält werden darf, als bis er eine Mindestdicke von 25 mm erreicht hat. Kork für Champagnerkorke muß 15 Jahre alt werden (HARTWICH). Bisweilen werden Stamm und Äste geschält; in Gerona nur der Stamm. Mit der Schälung (démasclage) wird in Algier Ende Mai oder Anfang Juni, in Spanien, Portugal und Frankreich einige Wochen später kurz nach dem ersten Safttrieb begonnen. Zu dieser Zeit löst sich der Kork am leichtesten ab. Sie erfolgt in der Weise, daß der Arbeiter (rusquier, tireur) mit der Axt (franz. picasson, hachette de démascleur, span. dastral) in bestimmten Abständen (c. 1 m) zunächst Horizontalschnitte (Gürtel- oder Ringelschnitte) macht und diese durch ein oder zwei Längseinschnitte verbindet, dann hebt man den Kork an einer Stelle etwas ab, schiebt den am Ende meißelartig zugeschärften Axtstiel dazwischen und löst meist mit einem Rucke die ganze Schicht von der am Baume bleibenden mère intérieure ab. Klopfen befördert die Ablösung (I, Fig. 86 u. 89). Mit der Axt nicht erreichbare Stellen werden mit der burxa abgelöst, einem 2 m langem zugeschärften Hebel. Der neugebildete Kork löst sich meist leicht in der Phellogenschicht ab. Wurde ein Längsschnitt gemacht, so erhält man Röhren (canon), bei zwei Schnitten Platten (planches, planchas). Obwohl oft empfohlen wurde den Baum nach dem Schälen mit einer Schutzhülle von Gras oder Moos zu umgeben (ähnlich wie bei der Erzeugung der Renewed barks der Cinchonen, vgl. I, Taf. XXXIII), scheint dies in der Praxis doch nirgends zu geschehen. Die Ernte muß vor Eintreten der starken Hitze oder der Regenzeit beendet[S. 463] sein. Die großen, etwas gekrümmten Korkplatten werden dann aus dem Walde in die Fabrik gebracht (I, Fig. 87) und die außen ansitzenden Reste der Korkmutter (mère extérieure, s. oben) abgeschabt. Dieser Prozeß heißt démérage (I, Fig. 91). Dann werden die Platten (liège démérés) in großen kupfernen Pfannen ½¾ Stunden in siedendes Wasser getaucht (I, Fig. 88) und schließlich übereinander geschichtet möglichst flach gepreßt (Fig. 152 u. I, Fig. 90). Das Kochen entfernt viel Gerbstoff und andere Stoffe (20–30% des Kork) und macht die Platten elastisch. Der Kork schwillt hierbei um 30% auf. Das Kochen und Abkratzen unterbleibt bisweilen (lièges bruts), alsdann werden die frischen Platten nur durch Beschweren flach gestreckt. Bisweilen wird die äußere Schicht erst nach dem Sieden mit dem Kratzeisen (raclette, raspador) oder dem Hobeleisen (doloire, dolatero) oder mit Maschinen abgekratzt (raclage) oder mit Feuer abgesengt (flambage). Die fertigen Platten werden durch den classeur (viseur) klassifiziert und oft durch hydraulische Pressen zu Ballen von 70 bis 80 kg zusammengepreßt und mit Alfagras oder eisernen Reifen umschlossen.

Lager von fertig bearbeitetem Kork des Schweiz. Konsuls Borgeaud in Algier.
[Businger phot.]
Wird der Kork auf einmal vollständig weggenommen, so erneuert er sich langsamer aber in besserer Qualität als nach einer nur teilweisen Schälung. Gebirgige Gegenden liefern weniger, aber besseren Kork, als das Tiefland, wärmere besseren als kältere. Die Güte des Korkes ist also auch abhängig vom Klima und Standort aber auch von einer nicht zu engen Pflanzweite, vom Boden und dem Wetter. Der 9–12 Jahr nach der Entfernung des männlichen Korkes geerntete erste erneuerte Kork ist ziemlich schwammig, mit jeder neuen Ernte, die immer in Pausen von 8–12 (Algier-Tunis 8–9, Spanien-Portugal 10, Frankreich 12) Jahren am gleichen Baume, wie es scheint sehr lange, erfolgen kann — in Algier schält man zehnmal —, verbessert sich der Kork und ist schon nach der vierten oder fünften Ernte, wenn der Boden mager[S. 464] und trocken ist, tadellos. In der spanischen Provinz Gerona wird der Kork Ende Juni und Anfang Juli gesammelt. Jeder Stamm wird dort nur alle 10–12 Jahre geschält. Bisweilen ist es vorteilhaft, dem Baume 18 Jahre Ruhe zu gönnen. Bei älteren Bäumen (von 120–150 Jahr Alter) werden die Jahreszuwachszonen sehr schmal, so daß man die Pausen auf 14–16 Jahr erhöhen muß, bei 200 Jahr alten Bäumen lohnt die Produktion nicht mehr (LAMEY). Bei jüngeren Bäumen wird nur der Stamm, bei älteren auch die dickeren Äste, die den feinsten Kork liefern, dem démascler (descorchar) unterworfen. Um die gefürchtete Rissebildung zu verhindern, macht man nach dem Ablösen des Korkes in die Korkmutter einen Längseinschnitt (Taf. X), bisweilen auch 2–4, aber niemals an der Nordseite des Baumes. Der Ertrag der Bäume wechselt nach Alter und Umfang. Jüngere Bäume liefern 3–10, sechzig- bis hundertjährige 15–36, noch ältere 44–55 kg Rohkork (LAMEY). Ernten von 100 bis 600 kg pro Baum gehören zu den großen Seltenheiten, sind aber beobachtet (ARTIGAS, LAMEY). Der Rohkork heißt im Großhandel Korkholz.
Die Démasclage schädigt den Baum nicht, soll seine Lebensdauer sogar erhöhen. Die Größe der Rohkorkplatten schwankt meist zwischen 0,3 und 0,8 qm und 5 und 20 cm Dicke, doch sah HARTWICH Platten von 135 cm im Quadrat. Der andalusische Kork ist hell und meist sehr weich, der katalonische rötlich und härter, der portugiesische gelbrot. Zur Stöpselfabrikation werden meist nur Platten von wenigstens 22 mm Dicke benutzt. Man stellt aus den zuvor eingeweichten Platten (mit der Hand oder mit Maschinen) zunächst Parallepipeda her und schneidet daraus dann die Korke. Bei Maschinenschnitt — eine Korkschneidemaschine kann in 10 Stunden 20–25000 Korke schneiden — erhält man mehr Abfall (bis 50%) wie bei Handschnitt. In Spanien wird viel Kork in Hausindustrie geschnitten. Die Jahresringe müssen auf dem Stöpselkopf als Querstreifen sichtbar sein, d. h. der Kork muß so geschnitten werden, daß eventuelle Lentizellenkanäle rechtwinklig zur Achse des Korkes stehen. Bei sehr breiten Korken ist dies nicht der Fall. Dieselben schließen daher auch nicht luftdicht.
Die bedeutendsten deutschen Stöpselfabriken liegen in Bremen und Delmenhorst (Oldenburg), Raschau (Sachsen), Berlin, dann finden sich auch solche in Thüringen, Baden, Hessen, ferner der Schweiz (Genf) und in England, Österreich (Wien), die größten Fabriken aber in Spanien und Frankreich (Bordeaux). Die fertigen Korke passieren Sortier- und Zählmaschinen. Vor dem Sortieren werden die Korke bisweilen mit Salzsäure oder Oxalsäure oder schwefliger Säure behandelt (Oxalsäure gibt ihnen eine rötliche Färbung). 9⁄10 des Korkes wird auf Stöpsel verarbeitet, 1⁄10 auf anderes (s. hinten).
Die 19% Gerbstoff enthaltende Rinde nicht zur Korkgewinnung tauglicher Bäume wird in Sizilien, Algerien und Tunis auf Gerberlohe verarbeitet. Viele Korkbäume wurden z. B. in Sardinien geopfert, um die Rinde zu gewinnen. In Marocco wird noch viel Korkrinde zu Gerberlohe und Holzkohle verarbeitet, da die Regierung die Ausfuhr des Korkes verboten hat. Die Rinde der Korkeiche ist reicher an Tannin wie die aller anderen Eichen. Die Produktion beträgt jetzt 60–70000 quint. (LEFEBVRE). Auch der nach der ersten démasclage gebildete Kork, der 18% Gerbstoff enthält, dient in Algier als Gerbematerial. Die Früchte (Tardias, Palomeras) dienen zur Schweinemast. Der Wohlgeschmack der Schinken von Bayonne wird auf die Mast mit Eicheln von Querc. occidentalis zurückgeführt.
Lit. JAUBERT DE PASSA, Mem. soc. d’agric. d. l. Seine 1837. — WILLKOMM, Jahrb. Akad. Tharand 1859. — TORRENT, Le liège. Boulon. 1880. — CASIMIR DE CANDOLLE, De la product. nat. et artific. du liège dans le chêne liège. Mém. Soc. d. phys. et d’hist. nat. Genève 16 (1861) 1. — P. ARTIGAS Y TEIXIDOR, El Alcornoque y la industria taponera Madrid 1875. Alcornocales,[S. 465] industria taponera Madrid 1885 und Alcornocales é industria corchera Madrid 1895 (New Remed. New York 1880 und Bot. Jahresber. 1880, 2, 749). — DE GRAFIGNY, Le liège et ses applications. Paris 1888. — A. LAMEY, Le chêne-liège, sa culture et son exploitation. Paris 1893. — J. REIN, Geograph. u. naturwissensch. Abhandl. Leipzig 1892. — SEMLER, Tropische Agrikultur (dort Details). — E. A. MÜLLER, a. a. O. (s. oben).
Handel. Die Korkproduktion Portugals übertrifft die aller anderen Länder. MÜLLER schätzte sie 1900 auf 50 Mill. und die Korkausfuhr erreichte schon 1897 fast 47 Mill. kg, während die Korkproduktion Spaniens von ARTIGAS auf nur 30 Mill. kg geschätzt wird. Die Ausfuhr Spaniens schwankt jetzt zwischen 8 und 9 Mill. kg pro Jahr (MÜLLER). Der portugiesische Kork ist aber weniger geschätzt und daher ist der Wert der spanischen Ausfuhr größer als der der portugiesischen. Die Hauptausfuhrhäfen sind auf der Karte unterstrichen. 1896 hatte die algerische Ausfuhr die spanische erreicht. Sie ist im Steigen begriffen. Sie betrug 1897: 11,9, 1898: 8,3 Mill. kg. Der algerische Kork steht dem spanischen und portugiesischen an Wert nach. Die Staatsdomänen, die alljährlich den Ertrag versteigern, lieferten 1898 5¼ Mill. kg. Die Produktion an liège brut betrug in Algier 1899: 45000 quint. aus Staatsdomänen, 6000 aus Gemeindewaldungen, 108000 aus Privatwaldungen (LEFEBVRE). Der Export von Tunis betrug 1908: 800000 quint. Frankreich produziert jährlich 120–130000 quint Rohkork (LEFEBVRE). Frankreich führte 1908 12428000 kg Kork ein, besonders (⅔) aus Algier, dann aus Spanien, Portugal, Tunis und Italien. Italien exportierte 1897 c. 1½ Mill. kg. Die Produktion wurde 1900 auf 8000 quint geschätzt. (Sardinien und Sizilien je 12000 quint.)
1911 wurde die jährliche Korkproduktion wie folgt geschätzt in Tonnen (t): Portugal: 74500, Spanien: 23300, Algerien: 17100, Frankreich: 12000, Italien: 3800, Corsica: 1600 (ALFRED WEBER). Korkbörsen finden sich in Marseille und Bône (Algier).
Man unterscheidet bei dem Rohkork nach der Plattendicke 4 Kategorien: I. 31 mm und darüber, II. 26–30 mm, III. 23–25 mm, IV. 22 mm. Die Menge der jährlich fabrizierten Stöpsel schätzt LAMEY (1893) auf 6 Milliarden, davon entfallen auf Spanien 2 Milliarden. Der tägliche Bedarf an Stöpseln auf der Erde wird neuerdings auf 20 Millionen geschätzt (HOEHNEL). Deutschland verbraucht für über 12 Mill. M. Kork im Jahr. Die Gesamtproduktion dürfte einen Wert von 100 Mill. M. erreichen.
Lit. LEFEBVRE a. a. O. — MÜLLER a. a. O. — SEMLER, Tropische Agrikultur. — V. HOEHNEL in WIESNER, Rohstoffe — Kork-Industrie-Zeitung (Red. ALFR. WEBER).
Korkzellen aus Flaschenkork im Querschnitt an einem Jahresring, in 2 Sclereïdenbildung.
[Tschirch gez.]
Anatomie. Die subepidermale Korkbildung beginnt bei Quercus Suber schon im ersten Jahr, die Epidermis wird im dritten abgeworfen (KÜGLER). Das Phellogen bildet reichlich Korkzellen. Über den männlichen Kork s. oben S. 461. Der aus dem weiblichen Kork (s. oben S. 461) dargestellte Flaschenkork wird seiner Hauptmasse nach aus dünnwandigen, im Querschnitt nahezu quadratischen oder radialgestreckten, in Radialreihen angeordneten, bis 100 mik breiten Korkzellen gebildet, deren Wand wohl infolge der Behandlung bei der Fabrikation bisweilen wellig verbogen erscheint. In den Zellen findet man bisweilen kleine Prismen von in Chloroform löslichem Cerin, seltener Plasmareste oder Oxalatdrusen (HOEHNEL), immer Luft. Hier und da — bei guten Sorten selten — ist in dies gleichförmige Gewebe eine Brachysklereïde mit[S. 466] durchweg stark verholzter, nicht sehr dicker Wand und variablem Umriß eingebettet. Zahlreicher sind diese einen rotbraunen Inhalt führenden Sklereïden (Fig. 154, 2) in den jahrringartigen und in der Tat den Jahreszuwachsen entsprechenden Zonen die in unregelmäßigen Abständen und zarten, geschlängelten Bogenlinien den Kork durchziehen, die feine Musterung desselben hervorrufen und aus mehreren Reihen etwas dickwandigerer Zellen von Tafelform bestehen (Fig. 154, 1), deren Wand gebräunt ist und die bisweilen auch bräunlichen Inhalt führen. FLÜCKIGER erwähnt neben diesen noch «falsche Jahresringe» aus zusammengefallenen Zellen, die sich aber beim Erwärmen mit Wasser zu normalen Zellen strecken. Die besonders bei schlechten Korksorten häufigen braunen bröckligen Stellen, die beim Pressen des Korkes ein braunes Mehl entlassen, bestehen aus lockeren, aus dem Gewebeverbande gelösten Sklereïden und Sklereïdennestern, gemengt mit wenigen rundlichen obliterierten Korkzellen. KÜGLER hat (da bei der normalen Rinde Lentizellen auftreten und von diesen Risse ausgehen) diese Nester mit Lentizellen in Verbindung gebracht und in der Tat sieht man auf Querschnitten besonders schlechter Sorten Rohkork oft, daß die braunen mehligen Stellen des Innern nach außen hin in eine der zahlreichen von außen eindringenden Spalten münden, an deren Ausführungsöffnung vielleicht eine Lentizelle lag. Bisweilen durchsetzen diese braunen Streifen sogar die ganze Korkschicht. Die zahlreichen Löcher, die man auf der Innenseite der Rohkorkplatten sieht, gehören zu diesen Streifen, die vielleicht auch zu den Markstrahlen in Beziehung stehen. Wenn man berücksichtigt, wie außerordentlich die normale Transpiration des Stammes durch den riesigen Korkpanzer behindert ist, so kann man hier sehr wohl an eine besondere Form von Lentizellen denken, da diese ja bekanntlich der Durchlüftung dienen. Bei den nicht mehr bis zum Phellogen reichenden funktionslos gewordenen erschiene dann auch die Sklerose der Zellen verständlich. Aber es liegt jedenfalls im Interesse des Kultivateurs, die Bildung dieser braunen Stellen zu verhindern. Wie es scheint gelingt dies durch öftere Wiederholung der Démasclage bei alten Kulturen und dadurch, daß man nach Ablösung des Korkes einen Längseinschnitt in die Korkmutter macht (Taf. X). Sicher ist, daß dadurch die Bildung zahlreicher Risse vermieden wird. Die dünne Wand und das weite Lumen der Korkzellen (Fig. 154) geben dem Flaschenkork seine Geschmeidigkeit. Bemerkenswert erscheint es, daß als Folge der Prozedur, die behufs Erzeugung des weiblichen Korkes an den Stämmen der Korkeiche vorgenommen wird — Entfernung des normalen Korkes bis zum Phellogen — hier mutatis mutandis dieselbe Erscheinung zu beobachten ist wie bei den Schälwunden, die die Rinde bis zum Cambium entfernen. Bedeckt man nämlich eine solche Wunde, z. B. bei Cinchona Succirubra, so erzeugt das Cambium zunächst eine große Menge weiter dünnwandiger Parenchymzellen (renewed bark). Es scheint also eine allgemeine Erscheinung zu sein, daß die auf Schälwunden neu erzeugten Gewebe weiter und dünnwandiger sind als die normalen Gewebe. Die äußeren Jahreszuwachszonen sind erheblich breiter als die inneren, die infolge des Druckes der äußeren oft nur sehr schmal sind. Ich zähle an einer 30 mm dicken Korkplatte 11 Jahresringe. Der äußerste ist 4,5–5, der zweite 5–5,5 mm breit, der dritte 3,5–4, der vierte bis sechste 2–3 mm, die innersten 0,5–1 mm breit. Dieselbe Zone besitzt nicht überall die gleiche Breite. Der Kork ist um so besser je breiter die Jahreszonen, je dünner und weiter die Korkzellen und je weniger Sklereïdennester und -streifen vorhanden sind. Der männliche Kork enthält nur schmale, 0,5–1 mm breite Jahreszuwachszonen, eng beieinander liegende Jahresringe und daher mehr dickwandige Zellen.
[S. 467]
Mikrohistochemie. Die Membran der Korkzellen besteht aus zwei Schichten, der Mittellamelle, die zwei Zellen gemeinsam ist und der Suberinlamelle, zu denen bei dickeren Zellen noch eine verholzte Innenhaut tritt (HÖHNEL). Die Mittellamelle ist sehr schwer zu sehen, auch nach Zusatz von Chlorzinkjod, welches die ganze Wand gelb, oder Phloroglucin-Salzsäure, welches sie rot färbt, tritt sie kaum deutlicher hervor. Erst wenn man einige Zeit mit Soda kocht, auswäscht und mit Fuchsin färbt, hebt sich die Suberinlamelle von der Mittellamelle ab. Läßt man einige Stunden in konz. Kalilauge liegen, wäscht aus und setzt Chlorzinkjod hinzu, so färbt sich die Suberinlamelle rotviolett oder kupferrot (Phellonsäure- nicht Zellulose-Reaktion, GILSON, WISSELINGH). Die Färbung tritt nicht ein, wenn man nach der Kalibehandlung vor dem Zusatz von Chlorzinkjod mit Alkohol kocht, wobei das Kaliumphellonat gelöst wird. Kocht man mit 40% Kalilauge, so färbt sich nach dem Auswaschen die Suberinlamelle mit Chlorzinkjod rosa. Bei längerem Kochen wird sie zerstört, der Mittellamelle wird das Lignin entzogen und diese färbt sich nun nach dem Auswaschen mit Chlorzinkjod blau (Cellulosereaktion), ebenso wie die nun bisweilen (bei dickeren Zellen) sichtbar werdende Innenlamelle. Bei den dünnwandigen Zellen ist die Innenlamelle (Celluloseschlauch HÖHNELS) nicht zu sehen. SCHULTZEsche Macerationsflüssigkeit löst die Mittellamelle. Bei kürzerer Einwirkung wird ihr nur das Lignin entzogen und sie reagiert dann nach dem Auswaschen blau (oder gelb) auf Chlorzinkjod. Legt man nach kurzer Einwirkung von SCHULTZEscher Macerationsflüssigkeit in Kali und wäscht aus, so färben sich Mittellamelle (und, wo vorhanden, auch Innenlamelle) mit Chlorzinkjod blau, die Suberinlamelle kupferrot. Nach Behandeln mit Kupferoxydammoniak färbt sich die Suberinlamelle mit Chlorzinkjod gelb, da Kupferphellonat gebildet wird. GILSON schließt aus obigen Reaktionen, daß die Suberinlamelle keine Cellulose enthält, und nur in Mittellamelle (und Innenlamelle) Cellulose vorkommt in Form von sog. verholzter Membran (vgl. S. 263). Beim Behandeln mit SCHULTZEschem Gemisch treten aus der Korkmembran Tropfen aus (Ceresinsäurereaktion von HÖHNEL).
VAN WISSELINGH schreibt mir (1911): «Daß die Suberinlamelle keine Cellulosegrundlage hat, geht aus folgendem hervor: Bei Erwärmung in Glycerin auf 300° (in zugeschmolzenen Röhrchen) wird die Korklamelle meistenteils ganz zersetzt und entfernt ohne Zurücklassung von Cellulose, während dünne cellulosehaltige Wände noch unvermindert oder deutlicher die Cellulosereaktionen zeigen. Durch Erwärmen mit einer Lösung von Kaliumhydroxyd in Glycerin (10proz. auf dem Objektträger), sowie bei Behandlung mit alkoholischer Kalilauge bei gewöhnlicher Temperatur wird die Suberinlamelle ganz entfernt ohne Zurücklassung von Cellulose. Bei Untersuchung echter Korkzellwände habe ich niemals Anzeichen für Anwesenheit von Cellulose oder anderen Kohlehydraten in der Suberinlamelle erhalten.»
Erwärmt man Schnitte in Wasser, so sieht man, daß die Korkmembranen über dem Gipsblättchen sich neutral verhalten, daß aber mit dem allmählichen Erkalten die frühere optische Reaktion wiederkehrt (AMBRONN) — kann beliebig oft wiederholt werden —. Daraus schließt Ambronn, daß in diesen Membranen die Einlagerungssubstanz in kristallinischer Form mit gleichsinniger Orientierung der kleinsten Teilchen vorhanden ist. Verkorkte Membranen verlieren auch durch Behandlung mit Kalilauge ihre normale optische Reaktion, das Achsenverhältnis kann sich sogar umkehren (DIPPEL) oder sie werden wenigstens neutral (AMBRONN).
Lit. MOHL, Entwickl. d. Korkes. Diss. 1836 u. Vermischte Schrift. Bot. Zeit. 1847, 497. — MITSCHERLICH, Monatsber. d. Berl. Akad. 1850. — SCHACHT, Anat. u. Phys. 1856 I, 287. — SANIO, Vgl. Unters. über d. Bau u. Entw. d. Korkes. Pringsh. Jahrb. 2 (1858). — DE BARY, Anatomie. — TSCHIRCH, Angew. Anatomie. — HANAUSEK, Techn. Mikroskop. — VON HÖHNEL, Über den Kork u. verkorkte Gewebe überhaupt. Sitzungsb. d. Wien. Akad. 76 (1877), 527. — ROSS, Contr. alla conosc. del periderma Malpighia 1890. — ZIMMERMANN, Reakt. von Kork und Cuticula. Zeitschr. f. wiss. Mikrosk. 9 (1892) 59. — KÜGLER, Über d. Kork von Quercus Suber. Arch. Pharm. 22, 217. — VAN WISSELINGH, Sur la paroi des cellules subéreuses. Arch. Néerland. 22, 1888 und 26, 1893. — GILSON, La subérine et les cellules du liège. La Cellule 6. — AMBRONN, Über d. opt. Verhalt. d. Cuticula u. d. verkorkten Membranen. Ber. d. d. bot. Ges. 1888. — DIPPEL, Mikroskop II. — Erste Abbild. der Korkzellen in ROBERT HOOKE, Micrographia or some physiological descriptions of minute bodies made by magnifying glasses. London 1667 fol. 112, observat. XVIII Taf. XI.
Chemie. BRUGNATELLI erhielt 1787 bei Behandlung des Korkes mit HNO3 Korksäure oder Suberinsäure, (CH2)6(COOH)2 (s. oben S. 457), die BOUILLON LA GRANGE[S. 468] als verschieden von der Oxalsäure erkannte. CHEVREUL, der die acide subérique zur Sebacinsäure THÉNARDS in Beziehung brachte, erhielt beim Behandeln des Korkes mit siedendem Wasser unter Druck 14% Extrakt, darin Farbstoffe, Gallussäure, stickstoffhaltige Substanzen, Eisen, Kalk und Magnesiaverbindungen und aus dem ungelösten Rückstand durch Extraktion mit Alkohol, neben Harz, krist. Cerin oder Korkwachs (C32H20O BOUSSINGAULT, C25H20O3 DÖPPING, C17H28O SIEWERT). Er ist der Ansicht, daß die Farbstoffe, Harze und Fette dem Zellinhalt angehören. Den mit Wasser und Alkohol erschöpften Rückstand nannte er Suberin (DOEPPING nannte den in Wasser, Alkohol, Salzsäure und Äther unlöslichen Teil so). BOUSSINGAULT fand das Suberin größtenteils in Alkali löslich, aus der Lösung fällen Säuren die Substanz, welche mit HNO3 Korksäure bildet. Die zur Oxalsäurereihe gehörige Korksäure kann auch aus Ricinusöl, Leinöl u. and. Ölen, Cocos und Palmfett, Walrat, Stearin- und Ölsäure mittelst HNO3 dargestellt werden (ETAIX, VANZETTI, BROMEIS, ARPPE, DALE u. and.), wo sie neben Azelainsäure entsteht (ARPPE) und wird synthetisch aus Dibromhexan (wie Azelainsäure aus Dibrompentan) erhalten (BRAUN). Sie entsteht auch durch Reduktion der Octadiidisäure (LESPIAU und VAVON). DÖPPING erhielt durch Behandeln des Cerins mit Salpetersäure Cerinsäure (C42H34O3) und gab dem in HNO3 unlöslichen Teil den Namen Korkzellulose (C6H10O5). SIEWERT fand krist. Fettsäuren im Alkoholextrakt (2,5% Decakrylsäure: C10H18O2, Eulysin: C24H36O3). Phellylalkohol (Cerin) war zu 1,75% vorhanden. Die Corticinsäure ist ein unreiner Körper.
PAYEN fand, daß der mit Salzsäure, Essigsäure, Kalilauge und Wasser extrahierte, von den «Inkrusten» (bes. Fetten) befreite Kork (der Kartoffel) in Kupferoxydammon löslich ist. Er hält ihn für Zellulose, ebenso WIESNER und HABERLANDT den nach Extraktion mit Chromsäure oder SCHULTZEscher Macerationsflüssigkeit erhaltenen Rückstand. Nach FRÉMY und URBAIN enthält der Kork 43% Cutose (= Suberin), 29% Vaskulose, 12% Zellulose und «Parazellulose» und 15% in Säuren und Alkalien lösliche Stoffe (Cutose + Vaskulose = Suberin, CHEVREUL). V. WISSELINGH fand das Suberin in auf 250–290° erhitztem Glycerin löslich.
Die Fettsäuren untersuchte zuerst KÜGLER. Er fand im Chloroformextrakt neben krist. Cerin, F. 250° (C20H32O), das THOMS als phytosterinartig erkannte und C30H50O2 oder C32H54O2 formulierte, Glycerin und Stearinsäure und eine neue krist. Säure: Phellonsäure (C22H42O3), welche Säuren KÜGLER reichlicher durch Kochen des mit Chloroform erschöpften Korkes mit alkoholischer Kalilauge erhielt. GILSON fand im Kork neben Cerin 44% Fettsäuren (acides subérogéniques) und in diesen 8% einbasische krist. Phellonsäure (F. 95–96°, C22H43O3 GILSON, C22H42O3 KÜGLER, Konstitutionsformel nach V. SCHMIDT s. oben S. 457), deren in Wasser unlösliche Alkalisalze mit Chlorzinkjod rotviolett werden (Kupferphellonat wird braun), 36% amorphe Suberinsäure (halbflüssig, C17H30O3) und sehr wenig krist. Phloionsäure (Nadeln, F. 120–121, C11H21O4 oder C22H40O7 kann fehlen), deren Alkalisalze sich mit Chlorzinkjod nicht färben. V. SCHMIDT, der in dem Chloroformextrakt des Korkes (neben Cerin) ebenfalls Glyceride der Fettsäuren fand, nimmt in der Korksubstanz die Fettsäuren in der Form verseifbarer Anhydride an (s. oben S. 457). Nach ISTRATI und OSTROGOVICH wird Cerin von Friedelin (C43H70O2, F. = 263,5) begleitet. KÜGLER gibt im Korke von Quercus Suber an: 2,9% Cerin, 30,10% Fettsäuren, 2,65% Glycerin, 12% «Lignin», 8% Huminsubstanzen, 22% «Zellulose» (?), 5% Wasser, 0,5% Asche.
[S. 469]
Woher die Pentosane stammen, die COUNCLER aus Rinden erhielt, ist zweifelhaft. Möglicherweise enthält die verholzte Mittellamelle ein Xylan (CZAPEK), vielleicht aber stammen sie auch von Nucleoproteïden (des Inhaltes?). Der Stickstoffgehalt des Korkes, der 1,5–3% beträgt und den schon HOFMEISTER (1867) der Membran zuweist, sollte mit Rücksicht auf die bei der Pilzzellulose gemachten Erfahrungen einem erneuten Studium unterworfen werden. Er wird jetzt meist auf die Proteïnkörper des Inhaltes bezogen. Ferner wurden im Kork gefunden: der aromatische Aldehyd des Holzes, das Hadromal (vielleicht als Kohlehydratester, CZAPEK), Vanillin (KÜGLER, BRÄUTIGAM, BÜTTNER, THOMS) und vielleicht auch Coniferin (? KÜGLER) — wenn man Kork erhitzt bemerkt man einen aromatischen Geruch — sowie Gallussäure (DRABBLE und NIERENSTEIN). Die gerbstoffartigen Substanzen (z. T. Phlobaphene, z. T. wohl auch Phoroglukotannide?) gehören wohl dem Inhalte an. Der größte Teil derselben wird übrigens durch das Brühen des Korkes (S. 463) entfernt. Doch zeigt eine Abkochung Gerbstoffreaktion. Der männliche Kork ist so stark gerbstoffhaltig, daß er als Gerbematerial vorgeschlagen wurde.
Über die hier besonders wichtige Mikrohistochemie vgl. oben unter Anatomie.
Bei Einwirkung von HCl, H3PO4, Essig- und Ameisensäure (und CO2) auf ein Gemisch von Formaldehyd und einem Phenol, von Gerbsäure oder Oxybenzoësäure entstehen Kondensationsprodukte, die ähnliche Reaktionen zeigen, wie Kork z. B. unlöslich in Kupferoxydammon und Schwefelsäure und löslich in Kali sind (BAEYER, KLEEBERG, CARO, MÖHLAU und KAHL, DRABBLE und NIERENSTEIN). Eine diesen Kondensationsprodukten, die DRABBLE und NIERENSTEIN Phellemsäure nennen, ähnliche Substanz isolierten die Genannten auch aus Kork. V. SCHMIDT fand, daß, wenn man das Gemisch der aus Kork extrahierten rohen Fettsäuren erhitzt, Wasserabspaltung eintritt und ein Produkt erhalten wird, das ganz indifferent und impermeabel für Gase ist, wie Kork, und daß, wenn man Filtrierpapier mit den Fettsäuren tränkt und auf 140° erhitzt, man ein ganz dem natürlichen Korke gleichendes Produkt erhält.
Die Zusammensetzung des gereinigten Korkes wurde zu C = 67,8, H = 8,7, N = 2,3, O = 21,1% (DOEPPING) oder C = 65,7, H = 8,5, N = 2,3, O = 29,5 (MITSCHERLICH) angegeben. V. HÖHNEL gibt die Zusammensetzung des Suberins zu 74% C, 10% H und 16% O an.
Aus Korkabfällen wird Leuchtgas dargestellt, der dabei entstehende Teer enthält 27% leichte Öle, unter denen sich viel Naphthalin befindet, ferner Benzol und Toluol, 27% schwere Öle, die Phenole nur in geringer Menge enthalten, sowie 11% fluoreszierendes Öl, mit viel Anthracen. Das Teerwasser enthält Essigsäure und Homologe derselben, Methylalkohol, Blausäure, Methylamin und Ammoniak (BORDET).
Die Asche des Flaschenkorkes beträgt c. 0,5% (0,54–0,64% KÜGLER) der Trockensubstanz. Sie enthält viel Mangan (27,7% Mn3O4 KÜGLER) und Kalk (25% CaO), dann 11,3% SiO2. 8,5% K2O.
Das bei der Herrichtung der Korkplatten durch Abkratzen erzielte «Korkholzabschabsel» enthält nach dem Sieben: 44,91% Sand und SiO2, 20,87% CaO, 4,62% MgO, 3.79% Fe2O3, + Al2O3, 5,55% K2O, 1,07% Na2O, 1,88% P2O5, 12,06% CO2, 5,25% Glühverlust. Es wird als Kalidünger empfohlen (MASTBAUM).
Das spez. Gewicht des Korkes gibt ROLLMANN zu 0,12–0,195, MUSCHENBROCK zu 0,24 an. Doch ist bei diesen Versuchen wohl nicht die Luft entfernt worden, denn mit Wasser oder Alkohol gut ausgekochter Kork sinkt in kaltem Wasser unter (FLÜCKIGER), muß also schwerer als Wasser sein. Selbst außerordentlich dünne Korklamellen lassen sich nur sehr schwer (Kochen mit Alkohol) ganz von der Luft befreien (TSCHIRCH).
Das reine Korkgewebe ist wenig hygroskopisch, dagegen ziehen die braunen Lentizellen-Streifen begierig Wasser an (KÜGLER).
Lit. CZAPEK, Biochemie (dort und bei KÜGLER die Lit.). — BRUGNATELLI, Elementi di chim. II. Crells Ann. 1787. — JOHN, Chem. Schrift. IV. — BOUILLON la Grange, Ann. d.[S. 470] chim. 23 (1797), 42. — CHEVREUL, Ann. de chim. 62 (1807), 323, 96 (1815), 141, Schweigg. Journ. 16 (1816), 323. — BOUSSINGAULT, Journ. pharm. chim. 1836. — MITSCHERLICH, Lieb. Ann. 75 (1850). — DOEPPING, Lieb. Ann. 45 (1843), 286. — SIEWERT, Chem. Centralbl. 1856, Journ. pr. Chem. 104 (1868) 118. Zeitschr. Ges. Naturw. 30 (1867). — PAYEN, Compt. rend. 1868. — KOROLL, Quant. chem. Unters. d. Kork- usw. Gew. Diss. Dorpat 1880. — FRÉMY und URBAIN, Journ. pharm. chim. 1882. — KÜGLER, Der Kork von Querc. Suber. Arch. d. Pharm. 1884, 217. Dissertat. Straßburg 1884 (und A. MEYER, Ber. d. d. bot. Ges. 1883). — DE GRAFFIGNY, Le liège. Paris 1888. — GILSON, Le Subérine et les cellules de liège. Diss. Straßb., La Cellule VI (1890), 63 (und in FLÜCKIGER, Arch. Pharm. 1890, 690). — VAN WISSELINGH, Sur le paroi des cellules subéreuses. Arch. Néerland. 12 (1888) und 26 (1893). Chem. Centrbl. 1892 II, 516. — BRÄUTIGAM, Pharm. Centralb. 1898, 685. — BÜTTNER, Ebenda. — THOMS, Pharm. Centrh. 1898, 699. Chem. Centrbl. 1898 II, 1102. — ISTRATI u. OSTROGOVICH, Compt. rend. 128 (1899), 1581. — VON SCHMIDT, Monatsh. f. Chem. 25 (1904), 277 u. Öster. Chem. Zeit 1911, 21. — DRABBLE und NIERENSTEIN, Biochem. Journ. 1907 (Chem. Centralbl. 1907 II, I. 79). — MASTBAUM, Chem. Zeit. 30 (1906), 39. — BORDET, Compt. rend. 92 (1881), 728. — ROLLMANN, Polyt. Centralbl. 27, 465 (1873).
Anwendung. Die Verwendung des Korkes beruht auf seiner Eigenschaft, sich infolge der Dünnwandigkeit der Zellen leicht zusammendrücken zu lassen, gegen Lösungsmittel und Fäulnis relativ resistent zu sein, wegen seines hohen Luftgehaltes auf Wasser zu schwimmen und (z. T. auch wegen der eingeschlossenen Luft) Wärme sowie Schall schlecht zu leiten. Doch wird Kork von konz. Mineralsäuren, den Halogenen, Ammoniak und einigen ätherischen Ölen (bes. Terpentinöl) angegriffen. Die Verwendung des Korkes als Verschlußmittel beruht auf der Eigenschaft der Suberinlamelle für Wasser und Wasserdampf, sowie für die Dämpfe der meisten Flüssigkeiten impermeabel zu sein. Kork ist auch für Gase, z. B. Luft, undurchlässig (WIESNER, Wiener Anzeiger 1879). Zum Teil mag dies auch darauf zurückzuführen sein, daß die Zellen selbst Luft enthalten, die sich nicht verdrängen läßt (TSCHIRCH). Die Undurchlässigkeit des Korkes hängt mit seiner Funktion bei der Pflanze zusammen. Denn die Korkschicht bildet ja den vornehmsten Schutz gegen Verdunstung. Sonst wird der Rohkork auch zu Einlegesohlen, zur Umhüllung von Dampfleitungen, zu Schalldämpfern, zu Belegen für Eisbehälter, zu Schwimmgürteln verwendet — die Korkabfälle zu künstlichen Korkplatten, zu Linoleum und Kamptulikon (Kortizin). Bei der Linoleumbereitung wird Korkpulver mit Linoxin (in Oxydierhäusern oxydiertes Leinöl, s. S. 323) behandelt. Der männliche Kork ist nur zu Schwimmkörpern, Korksteinen u. dergl. verwendbar.
Lit. ED. HANAUSEK, Technologie d. Drechslerkunst 1897 und ERDMANN-KÖNIG, Allgem. Waarenkunde. — T. F. HANAUSEK in Luegers Lexikon.
Geschichte. THEOPHRAST beschreibt (Hist. pl. III, 17, I u. IV, 15, 1) eine Korkeiche φελλός), die er nach Tyrrhenium (d. h. nach Westen) verlegt, und sagt, daß wenn die Rinde φλοιός) entfernt werde, sie in 3 Jahren wieder wachse. φελλός des THEOPHRAST deutet SPRENGEL als Quercus Pseudo-Suber DESF. PAUSANIAS kennt eine Eiche in Arkadien, deren Rinde so leicht ist, daß sie als Ankerzeichen (Bojen) oder als Flossen an Fischnetzen befestigt, auf dem Wasser schwimmt (HEHN). Auch die Benutzung des Korkes zu Schwimmgürteln war den Römern bekannt (Sage von CAMILLUS). Es war PLINIUS bekannt, daß sich die «Rinde» erneuert und er erwähnt die Verwendung des Korkes zu Verschlüssen (obturamenta). PLINIUS sagt: «Suberi minima arbor, glans pessima, rara: Cortex tantum in fructu, praecrassus ac renascens, atque etiam in denos pedes undique explanatus. Usus ejus ancoralibus maxime navium, piscantiumque tragulis et cadorum obturamentis: praeterea in hiberno feminarum calceatu. Quamobrem non infacete Graeci corticis arborem appellant. Sunt et qui feminam ilicem vocant: atque ubi non nascitur ilex, pro ea subere utantur, in carpentariis praecipue fabricis, ut circa Elin et Lacedaemonem. Nec in Italia tota nascitur aut in Gallia omnino». Auf den Gebrauch des Korkes als «Schwimmer» spielen auch AESCHYLOS, PLUTARCH, PINDAR und ARCHIAS an (daher Cortex natarius z. B. bei FESTUS). VIRGIL erwähnt die Verwendung als Dachbedeckung, wozu die Korkplatten noch heute in Algier benutzt werden. VARRO sagt: Die besten Bienenstöcke sind die aus Cortex gemachten. Auch COLUMELLA (I, S. 572) kannte das schlechte Wärmeleitungsvermögen der Korkplatten und empfiehlt sie als Umhüllung der Bienenstöcke, zur Herstellung einer gleichmäßigen Temperatur. «Siva illa (regio) ferax est suberis, haud dubitantur utilissimas alvos faciemus ex cortibus quia nec hieme rigent, nec candent aestate» (De re rustica IX, 6) — wozu sie noch jetzt in Südspanien und Algier benutzt werden.[S. 471] QUINTUS SERENUS SAMMONIACUS (Liber medicinalis) erwähnt einen Trank aus Korkrinde als Blutstillungsmittel.
«Die Sitte, Gefäße mit verharztem Kork zu verschließen, stammt, wie es scheint, von den Galliern» (SCHRADER). Sie wird bei CATO, COLUMELLA und HORAZ (cortex adstrictus pice) erwähnt. Doch war das Verkorken bei den Römern selten, die Gefäße mit Holz, Pech, Gips, Kreide oder Wachs verschlossen oder Öl auf die Flüssigkeiten gossen — was bekanntlich in Italien noch heute beim Wein geschieht. «Die Kunst, die enge Öffnung eines Gefäßes mit der elastischen Rinde der Korkeiche zu verschließen, geht in ein hohes Altertum hinauf, und allgemein geworden ist sie erst seit den letzten Jahrhunderten, und zwar sehr langsam. Erst das Aufkommen enghalsiger Glasflaschen, die zuerst im XV. Jahrh. auftreten und die Notwendigkeit, derartige Flaschen gefüllt versenden zu müssen, brachte den Kork in allgemeinen Gebrauch» (HEHN-SCHRADER). Im Mittelalter bediente man sich zum Verschließen von Fässern der Holzpflöcke, bei kleineren Gefäßen der Verschraubung oder des Wachsverschlusses. 1410 führte Danzig Kork aus Lissabon ein (I, S. 811). CLUSIUS sagt 1601 (a. a. O.): «Verum in Hispaniis primum illum praecrassum corticem dum taxat detrahere solent: quo non modo ad cadorum obturamenta, alvearia et nonnulla etiam vasa rustici utuntur, sed etiam ad tuguriorum, parietum, et murorum praetexta, praesertim in ea Baeticae parte, quam Estramaduram vocant, ubi interdum totis pagis aedes magnis suberis fragmentis imbricum loco tectas conspicere licet.»
POMET erwähnt 1694, daß die abgelösten Korkplatten in mit Wasser gefüllten Gräben übereinander geschichtet und mit Steinen beschwert, dann nach dem Ablassen des Wassers getrocknet und zu Ballen vereinigt wurden. Er nennt als besten Kork den spanischen, daneben aber auch schon einen französischen aus der Gascogne und von Bayonne. Die Korkkohle erwähnt POMET unter dem Namen Noir d’Espagne als Malerfarbe. Er gedenkt der Verwendung des Korkpulvers als Blutstillungsmittel und äußerlich bei Hämorrhoiden. VALENTINI (I, S. 912) sagt: «Die Apotheker stopfen und verwehren die Gläser damit.» Im Catologus von Rostock 1659 steht Suber, Pantoffelholz oder Kork 1 Loht = 2 Kr. Die Idee, Wein-, speziell Champagnerflaschen mit Korkstopfen zu verschließen, wird dem Pater Kellermeister der Abtei Haut-Villiers DOM PÉRIGNON (1636–1715) zugeschrieben. Um diese Zeit erlangte die Sitte jedenfalls Verbreitung.
Nach ARTIGAS soll die regelrechte Kultur des Baumes und Gewinnung des Korkes in Spanien erst in der zweiten Hälfte des XVIII. Jahrh., und zwar in Gerona begonnen haben. Catalonien liefert auch heute noch den besten Kork. Von dort breitete sie sich nach Andalusien und Estremadura und die südlichen Provinzen Frankreichs und Portugals aus. Von 1830 an wurden die Korkwälder Algeriens durch die französische Regierung erschlossen, 1847 erreichte die Ausfuhr des Korkes dort bereits 46683 kg. Um diese Zeit wurde auch die Privatindustrie für die Gewinnung interessiert, große Strecken verpachtet und gegen die sehr gefährlichen Waldbrände strenge Verfügungen erlassen, z. B. das Ziehen von Gräben und Beseitigung des Unterholzes angeordnet, schließlich auch die Gewinnung gesetzlich geregelt. Jetzt bildet der Kork einen der wichtigsten Ausfuhrartikel des Landes. Auch in Tunis begann die geregelte Gewinnung mit der französischen Okkupation (1881), die Démasclage 1884 (LAMEY).
ROBERT HOOKE sah zuerst mit seinem sehr einfachen Mikroskope die Zellen des Korkes (Micrographia 1667) und erkannte, daß der Kork zur Rinde eines Baumes gehören müsse, was damals noch nicht bekannt war. JOHNSTON bestätigte das letztere. HOOKE benutzte bei der Beschreibung des anatomischen Baues des Korkes zuerst den Ausdruck «cell» (er verglich ihn mit Bienenwaben). Der Ausdruck wurde dann auf alle «Zellen» übertragen. HOOKE schätzte die Anzahl der Zellen im Kubikzoll auf 1200 Millionen (FLÜCKIGER).
Die ersten Korkstöpselschneidereien (taponerias) sollen c. 1760 in Llagostera bei Gerona entstanden sein. 1789 wurden Korkstöpsel in Stuhr (Oldenburg) geschnitten (FLÜCKIGER). Korkpantoffeln wurden aber schon im XV. Jahrh. in Danzig fabriziert (PABST).
Auf Flaschenkork läßt sich bekanntlich sehr gut schreiben. Die Benutzung des Korkes anderer Pflanzen zum Schreiben finden wir schon im Altertum (vgl. S. 256). Die altindischen Bhûrja- (= Birken) Manuskripte sind auf den Blätterkork der Betula Bhojpattra WALL. geschrieben (DYMOCK). Auch heute wird noch Birkenkork zum Daraufschreiben benutzt, z. B. bei den Tanguten (PRSCHEWALSKI 1878). Ich erhielt 1909 aus Amerika einen auf Birkenkorkpapier geschriebenen Brief und sah 1908 in Frankreich Visiten- und Geschäftskarten auf dünne Flaschenkorkscheiben gedruckt.
[S. 472]
Lit. FLÜCKIGER, Pharmakogn. — BECKMANN, Beitr. z. Gesch. d. Erfind. 1790. — HEHN, Culturpfl. 1877. — BLÜMNER, Technol. u. Terminol. d. Gewebe. 1879. — DYMOCK, Mat. med. West. India 1885.
Ersatzmittel. Keine andere Pflanze bildet eine Korkschicht, die technisch wirklich brauchbar und exportfähig ist, da keine den Kork der Korkeiche an Elastizität, Weichheit und Dicke erreicht. Immerhin dienen einige andere Korke an den Produktionsorten zu ähnlichen Zwecken, wie z. B. der Kork von Ulmus campestris var. suberosa. Auch einige Rinden und Hölzer werden gelegentlich in den betreffenden Ländern wie Kork, z. B. zum Verschluß von Calebassen u. dgl. benutzt, so die Rinde von Pinus Merkusii in Johore und die von Melaleuca Leucadendron in Südasien, das schwammige Holz von Anona palustris in Südamerika, das weiche Holz von Ochroma Lagopus SW. in Westindien, das einiger Nyssaarten in Nordamerika (Nyssa aquatica liefert das Tupeloholz), das des Baobab und der Herminiera elaphroxylon in Afrika, sowie das Holz von Bombax, Aeschynomene und Alstonia-Arten in Asien. Endlich wird auch das Holz von Hibiscus tiliaceus, von einigen Erythrinaarten (Erythrina acanthocarpa liefert den Marble-Cork) und Lianen und das Mark von Agaven und Fourcroyen als «Korkholz» benutzt (SEMLER). In Slavonien wird Süßholz für Stöpsel verwendet (HOEHNEL).
Neuerdings wird als Ersatz für Kork das Holz einer Mimose (Mareabaum) vom Tschadsee angegeben, dessen spez. Gew. noch geringer ist als das des Korkes. Aber weder dieses noch der sog. Kaffrarian Marble Cork, der ebenfalls ein Holz ist (JOS. MOELLER), kann den Kork ersetzen, da auch seine Zellen verholzt und nicht verkorkt sind.
Künstlicher Kork von GRÜNZWEIG & HARTMANN besteht aus gepulvertem «Korkholz» und Stärkekleister, dem Leinöl oder Teer zugesetzt wird (vgl. auch oben S. 469). Über künstlichen Kork findet sich eine Zusammenstellung in M. SCHALL, Verfahren z. Herstellung künstlicher Korkmassen. Kunststoffe 1 (1911), 141.
Lit. SEMLER, Trop. Agrikult. — Dingl. polyt. Journ. 250 (1883). — T. F. HANAUSEK in Luegers Lexikon. — HOEHNEL in WIESNER, Rohstoffe. — JOS. MOELLER, Bot. Zeit. 1879, 719 und Pharm. Centralh. 1886, 240. — Tropenpflanzer 1904 u. 1907.
2. Pollenino-Membranindrogen.
Als Anhang an die Suberino-Membranindrogen mag der Pollenino-Membranindrogen gedacht werden, denn die Polleninmembran der Pollenkörner und Sporen ist jedenfalls verwandt mit der Cuticula und diese mit dem Kork.
FOURCROY erkannte bereits 1801 die Ähnlichkeit des Korkes und der Cuticula. MITSCHERLICH erhielt aus beiden die gleichen Produkte, aber in verschiedenen Mengen. (Er verglich Kartoffelkork mit Aloë-Cuticula.) Nach VAN WISSELINGH und FRÉMY sind die Cuticula und die verkorkte Membran nicht identisch. WISSELINGH erhielt z. B. keine Phellonsäure aus der Cuticula und die Fettsäuren scheinen andere zu sein. FRÉMY und URBAIN nannten die «inkrustierende» Substanz der Cuticula Cutose. Es ist nicht nachgewiesen, daß die Cuticula Polysaccharide enthält. Denn die Tatsache, daß die mit Kali anhaltend behandelte Cuticula die Jodreaktion gibt (HOFMEISTER), kann auch anders gedeutet werden (s. oben). Jedenfalls zeigt aber die Cuticula viel Ähnlichkeit mit der Korkmembran (VON HÖHNEL, ZIMMERMANN); sie ist resistent gegen konzentrierte Schwefelsäure (MOHL, MULDER) und auch gegen Fäulnis (BROGNIART), gibt nach Behandeln mit kochendem Kali die Reaktionen mit Jod («ähnlich» wie Cellulose, MOHL), liefert mit Salpetersäure Korksäure und Bernsteinsäure (MITSCHERLICH) und wird von kochender Kalilauge angegriffen (SCHACHT), ist aber dagegen widerstandsfähiger wie Kork (VON HÖHNEL). Sie zeigt gewisse Aldehydreaktionen (GENEAU DE LAMARLIÈRE). Auch lassen sich aus ihr durch Einwirkung heißen Wassers wachsartige Substanzen ausschmelzen (DE BARY). Bei Behandlung mit kochender Lauge soll die krist. Stearocutinsäure (C56H48O8) und die flüssige Oleocutinsäure (C28H20O8) entstehen (FRÉMY u. URBAIN).
Die Wand der Sporen und Pollenkörner, die mit dem Namen Pollenin (BRACONNOT, JOHN) bezeichnet wurde, einem Namen, den ich hier wieder aufnehme, zeigt vielfach die Eigenschaften einer cuticularisierten Membran (BIOURGE), sie ist z. B. unlöslich in konz. Schwefelsäure, Alkohol und Äther. Sie ist jedenfalls eine[S. 473] komplizierte Substanz. Ältere Angaben von einem Stickstoffgehalt des Pollenins bedürfen der Nachprüfung. Bei einigen Pollenkörnern beträgt der Prozentsatz an Pollenin ziemlich viel (beim Pinuspollen z. B. c. 22%, PLANTA).
Lit. BROGNIART, Ann. sc. nat. 1830 u. 1835. — MITSCHERLICH, Lieb. Ann. 75 (1850). — SCHACHT, Lehrbuch. — MOHL, Bot. Zeit. 1847. — MULDER, Phys. Chem. 1844. — HOFMEISTER, Pflanzenzelle. — COHN, De Cuticula. Linnaea 1850. — FRÉMY, Rech. chim. sur la Cuticule. Compt. rend. 1859. — A. WIGAND, Intercellularsubstanz und Cuticula. Braunschweig 1850. — KABSCH, Unters. über d. chem. Beschaff. d. Pflanzengewebe. Pringsh. Jahrb. 1863. — V. HÖHNEL, Öster. Bot. Zeitschr. 1878. — DE BARY, Bot. Zeit. 29. — FRÉMY und URBAIN, Ber. d. d. chem. Ges. 1877, 90, Compt. rend. 93 (1882), 926 u. 100 (1885) 19. Ann. sc. nat. (6) 13 (1882), 360. — AMBRONN, Opt. Verh. d. Cuticula. Ber. d. d. Bot. Ges. 1888. — VAN WISSELINGH, Sur la cuticularisation et la cutine Arch. Néerland. 28 (1894), 373, Over Cuticularisatie en Cutine Ned. Kruidk. Arch. VI. und Verh. d. Akad. Amsterdam 1894. — GÉNEAU DE LAMARLIÈRE, Bull. Soc. Bot. 1903, 268. — CZAPEK, Biochemie (dort die Lit.).
Pollenin: BRACONNOT, Ann. chim. phys. (2) 42 (1829). — JOHN, Schweigg. Journ. 12 (1814). — FRITZSCHE, Pogg. Ann. 32 (1834), 481. — BERZELIUS, Lehrbuch, 3. Aufl. 1837, VI, 474. — PLANTA, Landw. Versuchsstat. 1884 und 1885. — KRESLING, Arch. Ph. 1891, 389. — TH. BIOURGE, Le Cellule 8 (1892) 45.
Lycopodium.
Syn. Sem. lycopodii, Sporae lycopodii, Hexenmehl, Bärlappsamen, Bärlappsporen, Streupulver, Blitzpulver, Erdschwefel, Alpenmehl, Blumenstaub, gelber Puder, Pillenmehl, Schlangenmehl, Wurmmehl, Pöschpulver, Puderbleiweiß, Steinpulver, — in der Schweiz: Zäpflimehl, Tröcknipulver, — lycopode, souffre végétal (franz.) — earth-moss seeds, vegetable sulphur, clubmoss (engl.) — nikt, heksemel (schwed.) — ulvefoed (dän.) — wolfsklaauw (holl.) — licopodio (ital.) — spori plauna (russ.) — plavuň (böhm.) — widlak (poln.).
Bärlapp, Wolfsklaue, Wolfsranke, Teufelsklaue, Krähenfuß, Druden-Fuß oder Kraut, Johannisgürtel, Schlangenmoos, Zigeunerkraut, Blitzkraut, Hexenkraut, Briszweig, Gäbali, Gertel, Gertlein, Kohlerkraut, Kosen, Rimpe, Saukraut, Sausanne, Zigeunerkraut (PRITZEL-JESSEN); — in der Schweiz: Freselmehlkraut, Kolbenmoos, Lienle, Wolle, Schäbel — mousse terrestre, griffe, patte ou pied de loupe, plicaire — im Tessin: erba scaretta, musco terrestre. — In England: common club moss, stagshorn. — Im Mittelalter: bryon (?), soldana (?) — bei BOCK: Muscus terrestris, Beerlap, Bärlappen, Teuffesklawen, Seil- oder Gürtelkraut, Neunheyl, Neungleych, Weingrein, Harschar — bei CORDUS: Katzenleiterlein, Minzengrün, chamaepence — bei GESNER: Tüfelsschlüssel, muscus ursinus, pes ursinus — bei CAMERARIUS: Dehnkraut — bei TABERNAEMONTANUS: Löwenfuß, pes leoninus, pes lupinus. Weitere Namen in NEMNICH, Polyglotten-Lexikon.
Stammpflanze. Lycopodium clavatum L. Spec. pl. ed. I, 1101 (Lyc. officinale E. NECK., Meth. musc. 150, L. inflexum SW.). In zahlreichen Varietäten (z. B. tristachyum mit weit abstehenden Blättern, curtum u. and.), von denen einige (L. trichiatum, L. venustulum, L. inflexum) auch als Arten betrachtet werden.
Etym. Der Name Lycopodium findet sich zuerst bei DODONAEUS (Pemptad. 1583, 469), der hinzufügt i. e. pes lupi. Es ist also eine griechische Übersetzung von Wolfsfuß, Wolfsklaue, gebildet aus λύκος (= Wolf) und πόδιον (= Füßchen). Auch TABERNAEMONTANUS hat Lycopodium. — Clavatum (= keulenförmig, clava = Keule) nach der Form des Sporangienstandes. Bereits bei CASPAR BAUHIN steht muscus terrestris clavatus, bei LOBELIUS muscus clavatus = pes leoninus. — Die Bildungen Wolfsfuß, Wolfsklaue, pied de loupe, pes lupinus, Löwenfuß, pes leonis, pes ursinus, Bärlappen, Drudenfuß, Teufelsklauen sind abgeleitet von den einen zottigen Eindruck machenden beblätterten Laubsprossen, — muscus terrestris, Schlangenkraut, von der Eigenschaft am Boden zu kriechen. TABERNAEMONTANUS sagt «Mooss oder Beerlap», benutzt[S. 474] also beides als gleichbedeutend. (Über mos vgl. S. 264.) — Bärlapp = Bärenpfote (lappo = Hand, Pfote). — Hexenmehl wohl wegen des plötzlich an der Ähre auftretenden und verstäubenden Sporenmehls, auch andere Namen (Drudenfuß, Teufelsklauen) verraten in die Pflanze hineingelegte mystische Beziehungen.
Systemat. Stellung. Pteridophyta — Lycopodiales — Lycopodiaceae — (Lycopodium Sectio Clavata).
Die Gattung Lycopodium umfaßt etwa 100 Arten, die über die ganze Erde verteilt sind.
Beschreibung der Stammpflanze. Auf einem kleinen, sehr vielgestaltigen, mit Wurzelhaaren besetzten thalloidischen Vorkeim (Prothallium), der die Antheridien und Archegonien trägt, also die geschlechtliche Generation darstellt, und der sich sehr langsam, erst in 7–12 Jahren, und ziemlich tief im Boden heranbildet, entsteht nach Befruchtung der Eizelle des Archegoniums aus dieser die junge Pflanze, die ungeschlechtliche Generation. Der auf der Erde oft zwischen Moos kriechende, mit dichotom verzweigten fädigen Wurzeln im Boden befestigte Stengel kann 1 m lang werden. Er verzweigt sich ziemlich reich. Ein Teil der aufstrebenden oder aufrechten, 5–15 cm langen Äste ist bis zur Spitze dicht mit spiralig gestellten, 3–4 mm langen, lanzettlichen, in eine hyaline Spitze auslaufenden Blättern besetzt. Ein anderer Teil läuft in die meist lang (8–18 cm) gestielten, ährenartigen, gelblichen, walzenrunden, 3–6 cm langen, 3–4 mm breiten Sporangienstände («Blüten») aus, die zu 1–4 (meist 1–2, in warmen Ländern auch mehr wie 4) an der Spitze des mit wenigen Blättchen besetzten Stieles angeordnet sind.
Die Sporophylle (Fruchtblätter, Deckblätter, Tragblätter, Bracteen) sind 3 mm lang, ebenso breit, eiförmig, am Grunde fast herzförmig, am Rande durch Vortreten einiger Randzellen fein gezähnt und laufen oben in eine lange farblose Borste aus, so daß der Sporangienstand behaart erscheint. Die Sporangien sind ¼ schmäler als die Sporophylle und sitzen auf der Blattoberseite.
Die Anlage der Sporangien erfolgt bereits, wenn das Sporophyll sich noch in meristematischem Zustande befindet. Eine an der inneren Seite der Blattbasis gelegene Zellgruppe streckt sich senkrecht zur Blattfläche. In dieser Protuberanz wird nach Innen zu durch perikline Teilung der Oberflächenzellen das Archesporium abgeschieden. Es sind meist drei nebeneinanderliegende Reihen (c. 20 Zellen), welche das Archespor bilden (BOWER). Während aus diesen, und zwar besonders aus den mittleren und inneren, durch lebhafte Zellteilungen das Gewebe der Sporenmutterzellen hervorgeht, dehnt sich die äußere Hüllzelllage durch antikline Zellteilungen aus, das Sporangium wölbt sich vor und wird durch Wachstum des Basalgewebes emporgehoben. Das letztere treibt Vorsprünge in die sporogenen Massen, die die Ernährung erleichtern. Die äußere Hüllzelllage wird dann durch perikline Zellteilung mehrschichtig. Die innerste Schicht teilt sich dann nochmals und scheidet nach innen die plasmatischen Tapetenzellen ab. Schließlich ist das ganze sporogene Gewebe mit Ausnahme des Scheitels des Sporangiums von der Tapetenschicht umgeben. (SADEBECK in PRITZEL, Lycopodiaceae, Fig. 370, ENGLER-PRANTL, Pflanzenfam.) Die Entwicklung der Sporen aus den Sporenmutterzellen stimmt hier, wie bei allen Pteridophyten, mit der der Mikrosporen (Pollen) der höheren Pflanzen überein: Es entstehen aus dem Kern der Sporenmutterzellen zwei Tochterkerne und durch Teilung dieser vier Enkelkerne, die sich mit einer Membran umgeben und zu Sporenzellen werden. Nach der hierauf erfolgenden Lostrennung von den Schwesterzellen findet die Ausbildung der Sporenhülle und damit zugleich auch diejenige der Sporen statt (SADEBECK).
Lycopodium clavatum.
A Ast in natürl. Größe, a Blatt vergrößert, b Sporophyll mit geöffneten Sporangien, c–e Sporen in 900fach. Vergr. [nach Luerssen]
B Prothallium mit jungem Pflänzchen von Lyc. annotinum [nach Fankhauser].
Das Sporangium ist ein tangential gestreckter, nierenförmiger, einfächeriger Sack, der mit einem dicken, bündelfreien Stielchen der Basis des Sporophylls ansitzt. Die Wand des Sporangiums ist oben zweischichtig, unten bis fünfschichtig. Die Zellen[S. 475] der äußeren Schicht sind mit Verdickungen an den inneren und seitlichen Wänden versehen. Das Sporangium ist ganz mit gleichartigen gelblichen Sporen erfüllt und springt im Juli oder August durch einen tangential über den Scheitel laufenden Spalt in zwei muschelförmige Klappen auf. Die Verstreuung der Sporen erfolgt durch den Wind. Die Sporen sind mit einem Netzwerk kleiner Leisten bedeckt, über welches ein Häutchen ausgespannt ist, das nicht benetzbar ist. «Durch diese Vorrichtung wird die Spore befähigt, durch die Hohlräume des Bodens tief in die Erde zu gleiten;[S. 476] bei dieser Wanderung wird aber die Membran allmählich abgerieben und die unter ihr befindlichen Kammern, welche benetzbar sind, werden frei gelegt. Ist dieses Ziel erreicht, so haftet die Spore an den Bodenteilchen und findet so eine bleibende Stätte, an welcher die Keimung erfolgt» (SCHUMANN). Aus der Spore geht das Prothallium (s. oben) hervor.
Vorkommen. Die Pflanze findet sich in Mittel- und Nordeuropa, Sibirien, Japan, Nord- und Südamerika, Südafrika, auf den Marianen und Sandwichinseln und in Australien, ist also über die ganze Erde verbreitet. Sie findet sich in Europa mit Ausnahme der Steppengebiete auf Haiden, in lichten Wäldern, an trockenen Stellen der Moore, auf Bergabhängen, buschigen Wiesen und besonders in Nadelwäldern an etwas frischeren Stellen (in der Schweiz in moorigen Wäldern besonders auf kieshaltigem Boden), in den wärmeren Gegenden besonders im Gebirge, in den Tropen nur dort, in Europa bis 2000 m.
Übersicht über die deutschen Lycopodium-Arten in LUERSSEN, Med. pharm. Botanik.
Lit. PRITZEL, Lycopodiaceae in ENGLER-PRANTL, Pflanzenfam. (dort weitere Lit.). — SADEBECK, Gefäßkryptogam. in Schenks Handb. d. Botan. 1879. — LUERSSEN, Mediz. pharm. Bot. I. — DAVID ET WEBER, Et s. l. Lycopod. en gen. et en part. sur le Lycop. clav. Soc. synd. d. pharm. d. l. côte d’Or Bull. 15 (1896). Jahresb. d. Pharm. 1897, 140. — Der Vorkeim der Lycopodien wurde von FANKHAUSER in Bern entdeckt (Bot. Zeit. 1873). Vgl. darüber ferner BRUCHMANN, Über d. Prothallien u. d. Keimpflanz. mehrerer europäisch. Lycopodien u. zwar über die von Lycopodium clavatum, L. annotinum, L. complanatum und L. Selago. Mit 7 Taf. Gotha 1898. — Abbild. in BERG-SCHMIDT, Atlas II. Aufl. t. 157. — PABST-KÖHLER, Medizinalpfl. t. 49. — NEES VON ESENBECK, t. 13. — BENTLEY-TRIMEN, Med. pl. t. 299 und vielfach anderwärts.
Pathologie. An den Sporangienähren von Lycopodium clavatum kommen mehrere Ascomyceten vor: Helotium Sommierianum P. MAGN., Mollisia Lycopodii LE BRET. et MALBR., Sphaerella Lycopodii PECK. — In den Sporophyllen von Lycopodium annotinum treten die Perithecien von Leptosphaeria Crepini (WESTD.) DE NOT. auf; die befallene Ähre wird durch den Pilz sehr auffällig geschwärzt; in den Sporangien sind die Sporen zwar noch zu finden, aber sie erscheinen abgestorben und zwischen ihnen ziehen sich die Mycelhyphen des Pilzes hin. (ED. FISCHER.)
Einsammlung und Handel. Lycopodium wird besonders in vielen Teilen Rußlands (besonders im Gouvern. Wladimir) gesammelt (I, S. 101), dann in beschränktem Maße in der Schweiz [Kanton Bern, Emmenthal, Entlebuch, I, S. 98, Zug, Schwyz (SCHÜRMANN)], in Deutschland (besonders in den Gebirgen), in Österreich und Schweden. Rußland exportierte 1910: 8000 Pud. (FERREIN). 1910 sank ein russischer Dampfer, der einen großen Teil der Lycopodiumernte an Bord hatte und die Preise stiegen daher. Frankreich bezog 1897 c. 8000 kg Lycopodium via Deutschland. Bisweilen (z. B. 1910) litten die Pflanzen unter Frühjahrsfrösten oder zu starker Sommerhitze, dann war die Ernte gering, die Preise stiegen auf das Doppelte und die Fälschungen (s. unten) wurden wieder häufiger (1909). Auch die russische Revolution brachte Preisschwankungen. Die Sporangienstände werden im August und September gesammelt, auf Tellern oder Schüsseln an der Sonne getrocknet, ausgeklopft und dann durch ein Haarsieb von den Beimengungen (Sporophylle, Stengel usw.) befreit. In Rußland wird das Lycopodium zunächst in Säcke aus fester, ziemlich feiner Leinwand getan, diese werden umgeben von groben Hanfsäcken, und diese stecken in Bastmatten aus Schilf geflochten mit Tauen umschnürt. So ist ein Verstäuben ausgeschlossen. Diese «Bauernware» enthält c. 10%[S. 477] Verunreinigungen, Bruchstücke von Stengeln und Blättern (WEIGEL 1905). Sie wird von den Drogenhäusern durch mehrmaliges Sieben gereinigt. Für pharmazeutische Zwecke ist nur prima doppelt oder dreifach gesiebtes sog. «leichtflüssiges» Lycopodium zu benutzen. Dies Lycopodium ist in Säcken à 50 kg und Kisten à 10 Pack. à 10 kg im Handel (GROSSMANN).
Lit. GEHE, Handelsberichte. — CAESAR und LORETZ, Handelsb. — WEIGEL, Pharm. Centralh. 1905. — SCHÜRMANN, Schweiz. Wochenschr. 1908.
Beschreibung der Droge. Lycopodium bildet ein feines, blaßgelbes, sehr bewegliches, geruch- und geschmackloses, nicht hygroskopisches Pulver, das in die Flamme geblasen verpufft (auch Farnsporen und Kamala verpuffen ähnlich), langsam erhitzt aber ruhig abbrennt. Es muß beim Ausgießen leicht «strömen» und darf nicht feucht sein. Da die Sporen ein mit Wasser nicht benetzbares Häutchen besitzen, (s. oben), so schwimmen sie auf dem Wasser, trotzdem ihr spez. Gewicht höher ist. Sie sinken aber darin unter, sobald man sie mit Wasser kocht oder mit Alkohol benetzbar macht.
Anatomie. Die Lycopodiumsporen sind tetraëdrisch mit gewölbter Basis und drei flachen oder — seltener — etwas eingesunkenen Pyramidenflächen (Fig. 155 u. 156). Das Exosporium zeigt ein Leistenwerk von fünf- bis sechsseitigen Maschen, das besonders schön hervortritt, wenn man Schwefelsäure zum Präparat hinzufließen läßt. An den Ecken der Leistenmaschen finden sich kleine Knötchen. Am Rande der Spore erscheinen die Leisten als kleine Stacheln, deren Spitzen durch ein sehr zartes, in der Mitte eingesunkenes Häutchen (s. oben) verbunden sind. In der Nähe der Kanten der Pyramidenflächen verschwinden die Leisten meist ganz oder werden unregelmäßig. Die Größe der Sporen beträgt 25–40, meist 30–35 mik. Durch Kali werden die Sporen gelb, wäscht man dann aus und läßt Jodschwefelsäure zufließen, so färbt sich das Exosporium braun, das diesem innen als zartes Häutchen anliegende Endosporium blau. Zerdrückt man das in Schwefelsäure liegende Präparat, so tritt aus jeder Spore ein Öltropfen hervor.
Lit. Abbild. in fast allen Lehrbüchern der Pharmakogn., z. B. in KOCH, Atlas IV, VOGL, Atlas t. 58, MOELLER, Lehrbuch und Atlas, KARSTEN-OLTMANS, Lehrbuch, BERG Atlas, LUERSSEN, Med. pharm. bot. etc. etc.
Chemie. Die Sporen enthalten c. 45% Pollenin und 47,4 (FLÜCKIGER), 48,5 (BUKOWSKY) bis 49,34% (LANGER) fettes Öl. Dieser Prozentsatz ist nur bei Chloroformextraktion der unter Alkoholzusatz mit Sand zerriebenen Sporen zu erhalten, Äther liefert auch nach 10 Tagen nur 40,9%. Unzerkleinerte Sporen geben an Chloroform nur 2–4% ab (daraus erklärt sich die frühere Angabe von BUCHOLZ: Öl 6%). Das sauer reagierende Öl von der Konsistenz des Olivenöls setzt sich (nach LANGER) aus 80–86,67% einer flüssigen Ölsäure, wechselnden Mengen Glycerin und eines Gemisches fester Fettsäuren zusammen. Die flüssige Lycopodiumölsäure (C16H30O2) betrachtet LANGER als α-Dekyl-β-Isopropylakrylsäure. Zu etwas abweichenden Resultaten kam BUKOWSKY. Er fand im Öl frischer Sporen neben 0,3% Phytosterin (C25H42O. F. = 132–133°, CADETS Wachs?), 80% Ölsäure (C18H34O2), 3% Arachin-, Stearin- und Palmitinsäure und 2% Lycopodiumsäure (C18H36O4, isomer mit der Dioxystearinsäure), sowie 8,2% Glycerin. Das von ihm untersuchte Öl war neutral, erstarrte noch bei −22° nicht und ähnelte dem Mandelöl. Die Lycopodiumölsäure LANGERS und Myristicinsäure konnte er nicht finden. Er vermutet, daß sie Umsetzungsprodukte sind und LANGER, dessen[S. 478] Öl sauer reagierte, alte Sporen untersuchte. Es bleibt zu untersuchen, ob LANGERS mit Ölsäure homologe Lycopodiumölsäure: C16H30O2, die er 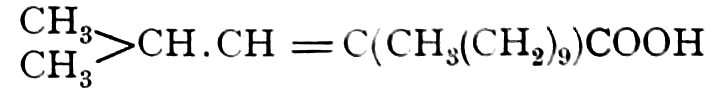 schreibt, aus Ölsäure, C18H34O2, die bald CH3.(CH2)13C = CH.CH2COOH (SAYTZEFF), bald CH3(CH2)7.CH=CH.(CH2)7COOH (BARUCH) geschrieben wird, hervorgehen kann, was mir bei obiger Formel sehr unwahrscheinlich erscheint. Identisch ist sie damit nicht, denn LANGER erhielt aus seiner Ölsäure bei der Oxydation Dioxypalmitinsäure, BUKOWSKY aus der seinigen Dioxystearinsäure. Eine neue Untersuchung des Öls von RATHJE ergab (wesentlich in Bestätigung von LANGER): 81% Lycopodiumölsäure, 3,2% Lycopodiumsäure (Dioxystearinsäure), 1,13% Stearinsäure, 0,85% Palmitinsäure, 2% Myristicinsäure, im Mittel 7,8% Glycerin, 0,43% Unverseifbares, 0,03% anorganische Substanz. Das Fett ist bei den Sporen Reservestoff.
schreibt, aus Ölsäure, C18H34O2, die bald CH3.(CH2)13C = CH.CH2COOH (SAYTZEFF), bald CH3(CH2)7.CH=CH.(CH2)7COOH (BARUCH) geschrieben wird, hervorgehen kann, was mir bei obiger Formel sehr unwahrscheinlich erscheint. Identisch ist sie damit nicht, denn LANGER erhielt aus seiner Ölsäure bei der Oxydation Dioxypalmitinsäure, BUKOWSKY aus der seinigen Dioxystearinsäure. Eine neue Untersuchung des Öls von RATHJE ergab (wesentlich in Bestätigung von LANGER): 81% Lycopodiumölsäure, 3,2% Lycopodiumsäure (Dioxystearinsäure), 1,13% Stearinsäure, 0,85% Palmitinsäure, 2% Myristicinsäure, im Mittel 7,8% Glycerin, 0,43% Unverseifbares, 0,03% anorganische Substanz. Das Fett ist bei den Sporen Reservestoff.
Die Sporen enthalten auch c. 3% Zucker (BUCHOLZ, REBLING), darin 2,1% Saccharose (LANGER). Stärke fehlt (entgegen der Angabe von RIEGEL, FRITSCHE und WINKLER). Kocht man Lycopodium mit Wasser und dampft die Flüssigkeit ein, so erhält man einen gallertigen Rückstand, der sich mit Jod grünlich färbt (WINKLER). Der Stickstoffgehalt beträgt 1,48% (ALCOCK, 1,021–1,075% BUTLER, 0,857% LANGER). Die trockene Destillation liefert eine «ammoniakalische» Flüssigkeit. Beim Kochen mit Kali entsteht Methylamin (LANGER). Dies dürfte das flüchtige Alkaloid gewesen sein, das FLÜCKIGER bei Destillation eines Auszuges von 8 kg Lycopodium mit Ätznatron in sehr geringer Menge erhielt. [In Lyc. complanatum fand BÖDEKER das alkaloidische Lycopodin (C32H52N2O2), in Lyc. Saururus ADRIAN und BARDET Piliganin (C15H24N2O), ein amorphes Alkaloid.]
Lycopodium oxydiert, da es Sauerstoff zu aktivieren vermag, mit Alkohol maceriert, diesen zu Acetaldehyd (LANGER). Schmelzendes Kali bildet einen Körper mit fäkalem Geruch und eine mit Protokatechusäure verwandte Substanz. RIEGEL gibt auch Zitronensäure, Apfelsäure, Leim, Harz und Gummi an (?). Lufttrockenes Lycopodium verliert bei 100° nur 4% Feuchtigkeit (FLÜCKIGER). Sein spez. Gewicht beträgt 1,062 (FLÜCKIGER).
Schon NEUMANN gibt in seiner Chymia medica (1752) an, daß Lycopodium verbrannt «nur ein leichtes Gewebe, so überaus wenig wäget» zurückläßt. Der Aschengehalt ganz reiner Sporen beträgt denn auch nur 1,15–1,16% (LANGER) oder höchstens 1,5% (EVELL), die Handelsware enthält aber meist mehr. D. A. V und Pharm. helv. IV limitieren die obere Grenze zu 3%, ebenso HAUKE, der 1,11–4,8% (meist 1–3% wie CAESAR und LORETZ) in der Handelsware fand. CAESAR und LORETZ empfehlen (1910) zur Aschenbestimmung das Lycopodium mit Sand gemischt zu glühen und vor Schluß 5–10 Tropfen rauchende HNO3 und dann Oxalsäure zuzufügen. Die rein weiße Asche der Sporen enthält Tonerde (CADET) und zwar 15,30% Al2O3 (LANGER; BUCHOLZ gibt 8,5% an, nach FLÜCKIGER soll sie tonerdefrei sein).
Die Lycopodien gehören zu den «Aluminiumpflanzen» (CADET, JOHN, RITTHAUSEN). Das Kraut von Lycopodium clavatum enthält in der Asche nach SOLMS (1856) 27%, nach ALDERHOLDT (1852) 26,65%, nach CHURCH (1888) aber nur 15,24%, L. complanatum nach ALDERHOLDT 51,85 bez. 57,36%, L. complanatum var. Chamaecyparissus nach SOLMS 54%, L. alpinum nach CHURCH 33,5, L. Selago 7,29%, L. cernuum 16,09%, Al2O3. Aluminium ist sonst bei Pflanzen nicht gerade häufig, doch findet es sich in der Asche vieler Flechten (Variolaria, Cetraria islandica, S. 270) und Moose und in Spuren in vielen anderen Gewächsen (vgl. WOLFF,[S. 479] Aschenanalys. Besonders aluminiumreich sind die Blätter von Symplocos lanceolata (c. 50%) und das Holz von Orites excelsa (36–45%), vgl. RADLKOFER). Aluminium fehlt in anderen Gefäßkryptogamen, z. B. den Farnen (außer einigen Baumfarn), in Equisetum, Salvinia, Marsilia und Selaginella (CHURCH), aber auch einige Lycopodien enthalten es nur in Spuren. Es findet sich bei den Lycopodien in löslicher Form, wohl an organische Säuren gebunden, als Malat (RITTHAUSEN) oder als Tartrat (AROSENIUS).
Ferner wurde in der Asche der Sporen gefunden: 45,7% P2O5, 18,41% Fe2O3, 9,3% K2O, 5,1% Na2O, ferner SO3, CaO, MgO (je c. 1%) und 0,22% Cl nebst Spuren Mn (LANGER).
Lit. NEUMANN, Chymia medica 1704. — BERGIUS, Mat. med. 1782 (beschreibt die trockene Destillat.). — BUCHHOLZ, Taschenb. f. Scheidekünstler 1807, GEHLENS Journ. VI, 573. — WICHMANN, Arch. Pharm. 35, 38. — FRITSCHE, Poggend. Ann. 32, 481. — JOHN, Handwörterb. d. Chem. 3, 231. — SCHWARTZE, Tabellen I (1819). — WINCKLER, Buchn. Rep. 34, 58. — FLÜCKIGER, Pharmakogn. I. bis III. Aufl. — REBLING, Arch. d. Pharm. 84 (1855), 11. — KAMP (Lyc. chamaecyp.) Lieb. Ann. 100, 300. — LANGER, Bestandth. d. Lycopodiumsporen. Arch. Ph. 1889, 241 u. über die Lycopodiumölsäure ebenda S. 625 (Diss. Erlangen 1889). — BUKOWSKY, Bestandt. d. Lycopodiumöls. Dissertation Dorpat 1889 u. Pharm. Zeit. f. Rußl. 1889, 359. — A. RATHJE, Neuere Unters. d. Fette von Lycopod. etc. Arch. Ph. 1908, 692. — ALCOCK, Pharm. Journ. 1906, 23, 100. — BUTLER, in FLÜCKIGER Pharmakogn. — BÖDEKER, Arch. d. Pharm. 1881, 304. — ADRIAN, Jahresber. d. Ph. 1886, 60. — ARATA u. CANZONERI, Pharm. Zeit. 1892, 409. — Asche: CAESAR-LORETZ, Handelsber. 1897 u. and. — H. EVELL, Jahresber. d. Pharm. 1892, 10. — HAUKE a. a. O. — Aluminium: RITTHAUSEN, Journ. prakt. Chem. 53 (1851), 413. — ALDERHOLDT, Lieb. Ann. 82 (1852), 111. — SOLMS-LAUBACH, Lieb. Ann. 100 (1856), 297. — CHURCH, On the occurence of Aluminium in certain Vascular Cryptogams. Proc. Royal Soc. 44 (1888), 121 (Pharm. Journ. 1889, 846). — FLURI, Einfluß v. Aluminiumsalzen auf das Protoplasma. Diss. Basel 1908. — RADLKOFER, Über Tonerdekörper im Pflanzenreich. Ber. d. bot. Ges. 1904.
Verfälschungen. Fast regelmäßig findet man im Lycopodium sehr kleine Mengen von Fragmenten der Sporangienwand, die durch ihre knotig verdickten Zellen sofort auffallen. Sofern diese nur in sehr geringer Menge vorhanden sind, ist das Lycopodium nicht zu beanstanden. Bruchstücke von Stengeln und Blättern, besonders faserige, dürfen nicht anwesend sein, auch nicht in Spuren.
Von organischen Verfälschungen sind neuerdings beobachtet: Stärke verschiedener Herkunft (seit 1896 in jedem Jahr, DÖLL), Mehl (1909), Weizenstärke (DÖLL, KOCH 1908), Reisstärke, Kartoffelstärke (DÖLL, auch in Amerika 1899, in Deutschland 1908, bis 30%), Dextrin (1904), Buchsbaumpulver (PERROT 1907), Harzpulver (1904) und besonders Pinuspollen (WEIGEL 1904, 1899 bis 20% beobachtet). Neuerdings (1908) haben die Fälschungen mit Stärke und Pinuspollen wieder auffällig zugenommen (CAESAR und LORETZ), da Locopodium teuer ist. Ferner werden angegeben verschiedene Mehle, z. B. Erbsenmehl (PEREIRA), und nicht näher bezeichnete Stärkesorten [bis 20% (1909), bis 50% (1891) BROWN], mit Methylorange gefärbte Maisstärke, Curcumapulver, Holzmehl (PEREIRA), Wurmmehl, Kolophonium und andere Harze und andere Pollenkörner, besonders von Corylus, Larix, Cichorium, Cannabis (von mir nie beobachtet).
Von den anorganischen Verfälschungen steht Talcum obenan, das auch neuerdings (1904) oft beobachtet wurde (Stärke und Talcum werden schon 1826 erwähnt!). Dann werden genannt: Kreide (SCRIBA), Gips (HANBURY), Magnesia, Schwefel (WALPLEY), Baryumsulfat (?), Sand.
Als Substitution wurde besonders Pinuspollen beobachtet. Das «ungarische» (oder «österreichische») Lycopodium, das sich 1904 im Handel fand, bestand ganz[S. 480] aus Pinuspollen (MITLACHER). Pinuspollen wird in den Karpathen in ziemlichen Mengen gesammelt (VOGL). Ferner: gepulvertes österreichisches Fichtenharz (GALLOIS 1906), gepulverter Bernstein (VAN ITALLIE), ein Sklereïden, Bastfasern und Kork enthaltendes Rindenpulver (VAN ITALLIE). 1904 tauchte in Amerika unter dem Namen Lykopodine ein dem echten Lycopodium äußerlich ähnlicher «Lycopodiumersatz» auf, der aus Talcum, Dextrin und Harzpulver bestand.
Die meisten Verfälschungen und Substitutionen sind leicht mit dem Mikroskop zu erkennen (Fig. 156), die Stärkesorten und Mehle durch ihre Formen (vgl. S. 153 bis S. 198) und auch durch die Jodreaktion, das Dextrin (nicht im Wasserpräparat! vgl. S. 200) mittelst Jodglycerin, das Curcumapulver an den gelben Kleisterballen, die Holz- und Rindenpulver an den geformten Elementen. Das Talcum bildet farblose eckige Kristallsplitter, der sublimierte Schwefel rundliche, zu Ketten oder Massen vereinigte dunkle, strukturlose oder kristallinische Körper.
Der Pollen der Abietineen (speziell der von Pinus silvestris wird gesammelt) ist oval und besitzt nicht genau an den beiden Seiten angefügte Luftsäcke (Fig. 156), die von der an diesen Stellen blasig aufgetriebenen Exine gebildet werden und die von halbkugeliger Gestalt und mit netziger Oberflächenzeichnung versehen sind. Das Pollenkorn selbst enthält Öltropfen. Die Größe beträgt je nach der Pinus- oder Abies-Species 54 bis 126 mik. Alkoholische Fuchsinlösung färbt sofort violett, Lycopodium erst beim Erwärmen (VOGL).
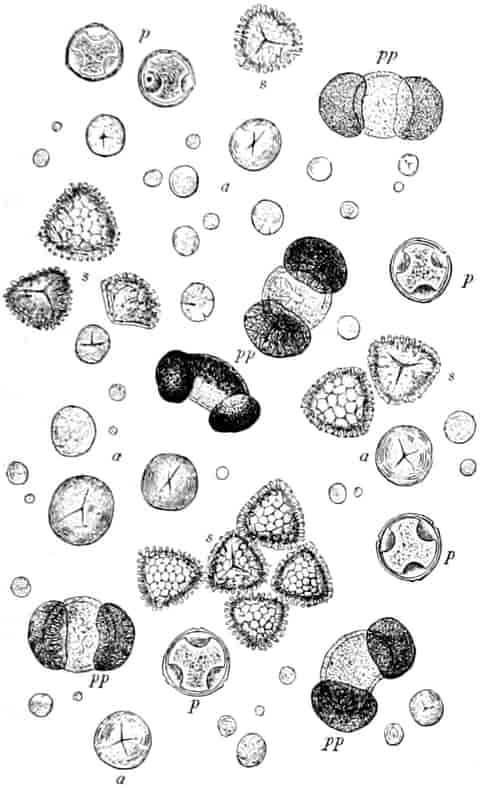
Mit Pinuspollen (pp), Coryluspollen (p) und Roggenstärke (a) vermischtes Lycopodium (s).
[Nach VOGL.]
Der Pollen von Corylus Avellana (Fig. 156) ist kugelig, glatt und an der äquatorialen Zone an drei etwa gleichweit von einander entfernten Stellen mit breiten stumpfen, am Scheitel mit einem Loche in der Exine versehenen Papillen versehen. Die drei Poren (Austrittsstellen des Pollenschlauches) treten besonders bei Behandeln mit Essigsäure und beim Eintrocknen gut hervor. Der körnige Inhalt erscheint dreistrahlig. Unterhalb der Poren ist die Intine kreisförmig von der Exine abgehoben. Rings um den Porus ist die Exine schwach wulstig verdickt. Durchmesser 26–30 mik. Der Pollen von Typha besteht aus Gruppen von zu vieren miteinander verbundenen Pollenkörnern (Tetraden). Die Pollenkörner von Cichorium zeigen eine stachlige Exine. Die Pollenkörner von Cannabis sativa sind rundlich und besitzen drei deutliche Austrittsstellen für den Pollenschlauch. Die Pollenkörner von Larix decidua sind eiförmig (MOELLER).
Die Pollenkörner sind sämtlich tiefer gelb gefärbt als Lycopodium. Eine kleine Menge von Stärkekörnern kann in das Lycopodium zufällig dadurch hineingelangen, daß es in Rußland bisweilen in Mehlsäcken versandt wird, oder daß in den Drogenhäusern Stärkestaub hineingelangte. 1% kann man tolerieren. Nach dem Kochen mit Wasser darf letzteres durch Jodwasser nicht blau werden (CAESAR[S. 481] und LORETZ). Auch einige Pinuspollenkörner können zufällig hineingelangen, da ja die Pflanze in Nadelholzwäldern wächst (doch stäubt die Kiefer viel früher als die Lycopodiumarten).
Die anorganischen Beimengungen erhöhen den Aschengehalt, verraten sich aber auch schon teils im Mikroskop, teils beim Vermischen des Lycopodium mit Wasser oder Chloroform. Reines Lycopodium schwimmt auf Wasser, mineralische, in Wasser unlösliche Beimengungen sinken zu Boden. Auch auf Chloroform und Schwefelkohlenstoff schwimmt reines Lycopodium. Der Schwefel verrät sich durch die beim Verbrennen entstehende schweflige Säure. Die Harze lösen sich in Alkohol oder Alkoholäther.
Lit. CAESAR-LORETZ, Handelsb. — Journ. of pharmac. 1898. — GALLOIS, Journ. pharm. chim. 1906, 242. — PERROT, Bull. sc. pharm. 1907, 350. — MITLACHER (1904). — WEIGEL, Pharm. Centralh. 1904. — BROWN, Bull. of ph. 1891, 10. — PEREIRA, Heilmittellehre. — Abgebildet sind Pinuspollen in MOELLER, Lehrbuch, VOGL, Atlas, BERG, Atlas, PLANCHON-COLLIN u. and., Larixpollen bei MOELLER, Cannabispollen ebenda, Cichoriumpollen ebenda, Coryluspollen bei VOGL.
Anwendung. Als Streupulver (allein und mit Salicylsäure oder Zinkoxyd) bei Intertrigo, zum Aufstreuen auf wunde Stellen, besonders bei Kindern, usw. eignet sich Lycopodium gut, da es leicht haftet, mit Wasser nicht benetzbar ist und nicht zusammenballt. Die gleichen Eigenschaften und seine Indifferenz empfehlen es auch als Konspergierungsmittel der Pillen.
Zum Bestreuen der Pillen wird es in den Apotheken so viel benutzt, daß der Staub der Apotheke und alle Geräte und Utensilien derselben immer Lycopodiumsporen enthalten. Dies muß beachtet werden, wenn man aus der Apotheke bezogene Objekte mikroskopisch untersucht. (Ein Botaniker beschrieb einmal die Lycopodiumsporen als den Dauerzustand eines Schleimpilzes [!], den er in aus einer Apotheke stammendem Fleisch gefunden hatte und den er wegen der Netzleisten der Sporen: Haplococcus reticulatus nannte [!]).
Mit Salpeter gemischt dient es zur chinesischen Moxa. Die innerliche Anwendung, z. B. bei Dysurie, Blasenkatarrh, besonders als Emulsion (Linctus diureticus HUFELAND), in Pastillenform usw. kommt kaum noch in Betracht. Etwas verbraucht die Gießerei zum Ausstreichen der Formen. Eine große Menge L. (zuweilen Hunderte von Kisten) verbraucht die Feuerwerkerei besonders an den Nationalfesten, z. B. in Nordamerika. Die Sitte stammt aus Persien (OLEARIUS, Persian. Reiß-Beschreib.). Herba Lycopodii wird kaum noch (als Diuretikum) benutzt. Das Kraut von L. Selago ist ein russisches Volksheilmittel. Es wirkt drastisch und abortiv. Auch das Kraut von L. Saururus wirkt drastisch. (Vgl. HUSEMANN, Arzneimittellehre).
Geschichte. Das etwas bitter schmeckende Kraut (Herba Lycopod. s. Musci clavati) war früher als das Sporenpulver besonders beim Volke in Gebrauch und ist noch da und dort (Polen) Volksheilmittel, ebenso wie Herba Selaginis s. musci erecti s. cathartici (von L. Selago), das auch gegen Ungeziefer benutzt wird. (Weitere Angaben über arzneilich verwendete Lycopodien in DRAGENDORFF, Heilpflanzen.) Vielleicht ist die Herba terrestris, pes pulli der Alphita ein Lycopodium. Die patres botanices sowie DODONAEUS, TABERNAEMONTANUS, BAUHIN, PARKINSON, RAY benutzten die ganze Pflanze und ein daraus destilliertes Wasser. JOH. RAY (I, S. 911) bespricht sie und ROLFINK († 1677) rühmt sie als Antiepilepticum. Die erste Abbildung der Pflanze findet sich in BOCK, Hist. stirp. 1552 p. 555 (vgl. I, S. 327, Fig. 316), weitere bei TABERNAEMONTANUS (I, S. 847), bei CORDUS u. and. LONICERUS sagt (Nat. histor. op. nov. 1551) von den Sporangienständen, «asparagos», sie seien «leves et molles, ceu farina aut pulvere conspersos, mox decidentes, quos pro flore licebit sumere», erkannte sie also bereits als «Blüten». Der von CLUSIUS (Rarior. pl.) abgebildete Muscus terrestris lusitanus ist vielleicht auch ein Lycopodium (oder eine Selaginella?). DODONAEUS tadelt den groben Mißbrauch Lycopodium clavatum in den Apotheken für Spica celtica (Saliunca = Valeriana celtica L.) zu geben. Schon ANGUILLARA (Semplici 1561) erwähnt eine «Spica celtica commune» mit Früchten «simili al[S. 482] Pepe lungo», welche statt der echten Spica celtica gebraucht werde. Darin ist wohl (mit BERG) Lycopodium zu erblicken.
Die erste Angabe über medizinische Anwendung der Sporen zum Bestreuen von Wunden findet sich bei SCHRÖDER in dessen Pharmacop. medico-chymica 1649 (FLÜCKIGER), doch findet sich L. weder in DALE, Pharmacologia London 1693 (HANBURY), noch in der BERLU-Liste (I, S. 950), noch in der Londoner Pharmacopoee, noch bei POMET. Wohl aber steht Sem. Lycopodii in der Taxe von Ulm 1664, Franckfurt 1669 und 1718, Basel 1701, im Gießener Catalogus 1688 als Synonym auch Muscus terrestris, in der Taxe von Schwäbisch-Hall 1700: Beerlapp- oder Gürtelkrautsamen (vgl. die Taxen im I. B.), muß also schon damals viel benutzt gewesen sein. Der Preis des Sem. Lycopodii betrug (Reform. d. Stadt Frankfurt 1718) 1 Lot = 4 Kr.
Der Züricher Stadtarzt JOH. MURALT († 1733) rühmte L. gegen Intertrigo (DIERBACH). BERGIUS erwähnt 1782 das Farina Lycopodii s. Pollen gegen Excoriatio und VALENTINI sagt (im Museum 1704), G. W. WEDEL ausschreibend, dem wir eine Monographie: De musco terrestri clavato Jenae 1702 verdanken: «Es heilet auch allerley Räudigkeit, Verwundungen, Rothlauff, Jucken an heimlichen Örtern, absonderlich wenn die kleine Kinder allda wund werden». Besonders durch WEDELS Dissertation scheint man auf die Lycopodiumsporen, die auch innerlich bei zahlreichen Krankheiten angewendet wurden (vgl. in NEUMANN Chymia medica) aufmerksam geworden zu sein. Die merkwürdigen Eigenschaften des L. — ein staubfeines trockenes Pulver, das fast keine Asche gibt, das zur Hälfte aus Öl, das man doch nicht extrahieren konnte, besteht und im Lichte rückstandslos verpufft! — haben den Chemikern viel zu schaffen gemacht. BERGIUS z. B. nennt es eine «vera cera cruda»; LÉMERY sagt, es habe viel sal essentiale, NEUMANN, daß die partes resinosae mit den partibus oleosis «surschagiret» sind. Doch erkannten schon LÉMERY, KÖNIG und NEUMANN, daß wirklich Öl darin enthalten ist.
Paralleldrogen. Ähnlich wie die Sporen von Lyc. clavatum, die die meisten Pharmacopoeen ausdrücklich verlangen, können auch die Sporen anderer Lycopodien, die alle tetraëdrisch sind, aber zum Teil eine andere Skulptur des Exosporiums zeigen, gebraucht werden und werden dort, wo die Arten häufiger vorkommen, auch ebenso benutzt. — Pharmacop. american. läßt sie auch zu —. So z. B. die beiden in Norwegen ebenso benutzten Lycopodium complanatum L. (L. Chamaecyparissias A. BR.). Sporen fast gleich wie bei L. clavat. Breite 28–30 mik. und Lyc. annotinum L., Netzleisten sehr weitmaschig (Fig. 157, 2), Breite etwa wie bei L. clav. Kleine Sporangienähren haben: L. Selago L. mit getüpfeltem Exosporium (Fig. 157, 3), Breite 24–33, meist 27–30 mik. L. inundatum L.: Exosporium mit welligen Leisten. L. alpinum L. und L. dendroideum MICH. (Nordamerika, MAISCH). Die Sporen von L. phyllanthum haben Tüpfel, die von L. densum Stacheln. In Deutschland ist nur L. clavatum häufig, in der Schweiz auch L. Selago, in Skandinavien auch L. complanatum und annotinum (SCHÜBELER), seltener sind in Deutschland L. annotinum, alpinum, inundatum und complanatum.
Lit. FLÜCKIGER, Pharmakogn. — MAISCH, Jahresb. d. Ph. 1870, 34. — SCHÜBELER, Pflanzenwelt Norwegens. — Abgebildet sind bei PRITZEL in ENGLER-PRANTL, Pflanzenfam. I, 4, 587 die Sporen von Lycopod. phyllanthum, densum und inundatum.
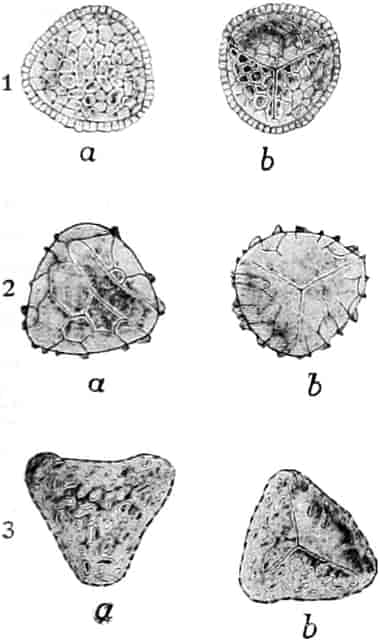
1. Lycopodium clavatum. 2. L. annotinum. 3. L. Selago.
[Aus Kommetar Svenska Farmak.]
3. Mycino-Membranindrogen.
Früher nahm man gestützt auf die Tatsache, daß sich die in Kupferoxydammon unlöslichen (FRÉMY) Pilzzellmembranen (Fungin BRACONNOT, Metazellulose FRÉMY) nach Behandeln mit Kali durch Jodschwefelsäure violett färben, an, daß ihre Substanz[S. 483] aus einer «inkrustierten» Zellulose bestehe, die DE BARY «Pilzzellulose» zu nennen vorschlug. Ich habe den Komplex der Inkrusten 1888 als Mycin bezeichnet (entsprechend dem Lignin und Suberin). Diese Auffassung ist jetzt verlassen. Nach STAEDELER, WINTERSTEIN, GILSON, WISSELINGH und WESTER enthalten die Zellmembranen der verschiedensten Pilze Chitin, eine Substanz (von ODIER 1823 so benannt), die bei den niederen Tieren weit verbreitet ist und z. B. in den Panzern und Flügeldecken der Insekten und Crustaceen, in der Haut der Seidenraupe und den Knorpeln der Sepien einen Hauptbestandteil bildet. Die quantitativen Bestimmungen WESTERS zeigen jedoch, daß das Chitin in den Pilzzellmembranen noch von anderen Substanzen begleitet sein muß, denn er fand den Chitingehalt z. B. bei Secale cornutum zu 5% und bei Hymenomycetenfruchtträgern zu 5–7%. Zellulose scheint der Begleiter aber nicht zu sein (WESTER). TANRET nennt ihn Fungose (C6H10O5)6 (?). Die Chitinmengen scheinen übrigens zu schwanken, denn während GILSON und ESCOMBE nur 0–10% Glukosaminchlorhydrat aus Secale cornutum erhielten, erhielt IWANOFF 20–40% davon. Keinesfalls ist die jetzt viel verbreitete Ansicht, daß Pilzzellmembranen nur aus Chitin bestehen, richtig. Gefunden wurde Chitin von WINTERSTEIN und GILSON in Agaricus campestris, Boletus edulis, Polyporus officinalis u. and. von GILSON und TANRET in Aspergillus, Bovista, Cantharellus und Claviceps purpurea, von WISSELINGH und WESTER in zahlreichen anderen Pilzen (und auch einigen Flechten) mit Ausnahme der Myxomyceten und Bakterien. Neuerdings wurde es aber auch in Bakterien aufgefunden.
Wir dürfen jetzt annehmen, daß das Chitin und auch noch das bei der Behandlung mit Kali aus ihm neben Essigsäure hervorgehende Chitosan (Mycosine GILSON) hochmolekulare, der Stärke und dem Glykogen, deren Jodreaktion das Chitosan teilt [es wird durch Jod und verd. (1%) H2SO4 tief violett], analoge Polysaccharide sind, die aber stickstoffhaltig und am Stickstoffe acetyliert sind (LEDDERHOSE, FRÄNKEL und KELLY, GILSON, SUNDWICK, SCHMIEDEBERG). Es kommt also dem Chitin kaum die einfache Formel C18H30N2O12, vielleicht eher die höhere Formel C60H100N8O38 (SUNDWICK) zu, und auch das Chitosan muß komplizierter als C14H28N2O10 zusammengesetzt sein. Jedenfalls entstehen beim Behandeln der Pilzzellmembranen mit Salzsäure zunächst mehr oder weniger große Mengen des von d-Glukose:
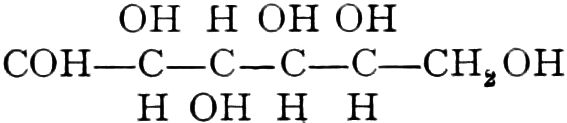
abzuleitenden d-Glukosamins:
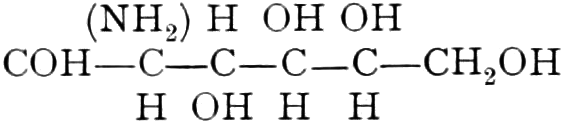
und schließlich ein Chitose genannter Zucker, den E. FISCHER als hydriertes Furanderivat auffaßt, und:
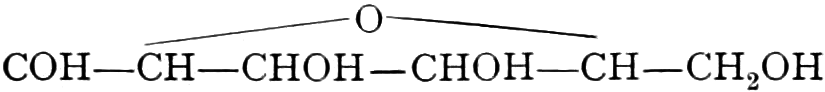
schreibt. Das synthetisch aus d-Arabinose dargestellte d-Glukosamin ist, wie neuere Untersuchungen zeigten, identisch mit dem aus Chitin erhaltenen (E. FISCHER und LEUCHS). OFFER betrachtet das Chitin als ein polymeres Monoacetyldiglukosamin.
VAN WISSELINGH schreibt mir (1911): «Im Widerstreit mit früheren Ansichten kommt bei den Pilzmembranen im allgemeinen keine Cellulose vor. Nur in einigen Fällen findet sich diese Wandsubstanz bei den Pilzen, nämlich bei den Myxomyceten, Peronosporeen und Saprolegnieen.[S. 484] Das Vorkommen von Chitin bei den Pilzmembranen ist dagegen eine sehr allgemeine Erscheinung. Wenn man die Bakterien, die Saccharomyceten und die drei obengenannten Familien nicht berücksichtigt, so findet man bei den Pilzen fast ohne Ausnahme Chitin in den Zellwänden. Auch bei Plasmodiophora Brassicae (Myxomyceten) kommt diese Wandsubstanz vor. In keinem einzigen Falle sind Chitin und Cellulose nebeneinander in den Pilzmembranen nachgewiesen. Dagegen fehlen in einigen Fällen beide Stoffe in der Zellwand, nämlich bei Bakterien, Saccharomyces Cerevisiae, Fuligo septica und Cetraria islandica. Neben Chitin und Cellulose kommen noch mehrere Stoffe in den Pilzmembranen vor. Wahrscheinlich gehören dieselben zu den Kohlehydraten; im allgemeinen sind sie aber noch wenig bekannt, auch fehlen noch charakteristische Reaktionen für ihre Nachweisung.»
Fettsäuren sind bis jetzt aus den Pilzzellmembranen, die übrigens (s. Mikrochemie) eine sehr verschiedene Zusammensetzung zeigen, nicht isoliert worden, so daß sie also von den Korkmembranen stark abweichen. Nach WINTERSTEIN enthalten die Membranen einiger Pilze auch Eiweiß; nach ihm sind vielleicht in ihnen mucinähnliche Stoffe in Verbindung mit Kohlehydraten enthalten. WINTERSTEIN isolierte aus Boletus edulis und Polyporus betulinus Paradextran (liefert bei der Hydrolyse Traubenzucker). Auch IWANOFF nimmt bei Hutpilzen neben Chitin stickstofffreie Zellmembranstoffe in der Membran an. Alles in allem betrachtet scheint in der sog. Pilzzellulose ein Mittelglied zwischen den Kohlehydraten und Eiweißstoffen vorzuliegen, in dem besonders polymere Amidoglukosen eine Rolle spielen.
Über den mikrohistochemischen Nachweis des Chitins teilt mir VAN WISSELINGH (1911) Folgendes mit. «Chitin kann mit großer Schärfe mikrochemisch nachgewiesen werden. Die zu prüfenden Objekte werden im Ölbade in zugeschmolzenen Röhrchen auf 160 oder 180° mit konzentrierter Kalilauge erhitzt. Hierdurch wird das Chitin in Chitosan umgesetzt. Nach Abkühlung werden die Objekte mit absolutem oder mit 95proz. Alkohol sorgfältig ausgewaschen und in destilliertes Wasser gebracht, worauf hintereinander Jodjodkalilösung und sehr verdünnte Schwefelsäure (0,5% J und 1% H2SO4) hinzugefügt werden. Chitinhaltige Zellmembranen und chitinhaltige Teile von Zellmembranen sind dann schön rotviolett gefärbt. Nach der Erhitzung mit Kalilauge färben chitinhaltige Membranen sich mit Chlorzinkjod blau. Diese Reaktion ist jedoch weniger scharf als die mit Jod und Schwefelsäure. Das Auswaschen mit Alkohol dient dazu, um einem Zerfließen der Präparate vorzubeugen, welches stattfindet, wenn man sie von der Kalilauge unmittelbar ins Wasser überträgt. Chitosan ist löslich in verdünnter Salzsäure (2½proz.) und in sehr verdünnter Essigsäure. Mit konzentrierter Kalilauge erhitzte Membranen lösen sich unmittelbar in diesen verdünnten Säuren, falls sie ausschließlich aus Chitosan bestehen. Chitin leistet einer Erhitzung in Glycerin auf 300° Widerstand, während viele andere Wandsubstanzen und Bestandteile des Zellinhalts zersetzt und entfernt werden. Diesem Prozeß kann man die Umsetzung des Chitins in Chitosan vorhergehen lassen, falls es nötig ist zur Verschärfung der Reaktion andere Substanzen zu entfernen.»
Lit. LEDDERHOSE, Ber. chem. Ges. 9 (1876), 1200, Zeitschr. phys. Chem. 2 u. 4. — STÄDELER, Lieb. Ann. 111, 21. — WINTERSTEIN, Zur Kenntn. d. in d. Membr. d. Pilze enth. Bestandt., Zeitschr. f. phys. Chem. 19, 521 u. 21, 134. Ber. d. chem. Ges. 26, 3098, 27, 3113; 28, 167 u. 1374. Ber. d. Bot. Ges. 11, 441 und 13, 65. — GILSON, Ber. d. chem. Ges. 28, 821. Rech. chim. sur la membr. cellul. d. champignons, La Cellule 1894 und Bull. soc. chim. 1894. Compt. rend. 1895. — SUNDWICK, Zeitschr. f. phys. Chem. (1881), 5, 385. — SCHMIEDEBERG, Arch. exper. Path. 28, 355. — FRÄNKEL und KELLY, Sitzungsb. d. Wien. Akad. 1901. — OFFER, Bioch. Zeitschr. 1907. — TANRET, Bull. soc. chim. III, 17, 921. — VON WISSELINGH, Mikrochem. Unters. über d. Zellwände d. Fungi. Zeitschr. f. wiss. Botan. 31, 619. (Dort auch die mikrochem. Reaktion auf Chitin.) — WESTER, Studien über d. Chitin. Dissert. Bern 1909 (dort weitere Literatur) und Verbreit. u. Lokalisat. d. Chitins im Tierreiche. Zoolog. Jahrb. 1910. — E. FISCHER u. TIEMANN, Ber. d. chem. Ges. 27 (1894), 138. — E. FISCHER, Ebenda 35 (1902), 3789, 36 (1903), 24 und 2587. — Weitere Lit. in CZAPEK, Biochemie, RÖHMANN, Biochemie und in ZELLNER, Chemie d. höh. Pilze.
[S. 485]
Fungus igniarius.
Agaricus quercinus praep., Fungus quercus, Fungus s. boletus chirurgorum, Feuerschwamm (daher igniarius von ignis = Feuer), Wundschwamm, Blutschwamm, Zunder (daher fomentarius von fomentum = Zunder) — agaric de chêne, amadou (franz.) — surgeons agaric, touchwood, german tinder (engl.) — vuurzwam (holl.) — esca (ital.) — tapló (ung.).
Die Stammpflanze muß zu Fomes FRIES und nicht zu Polyporus gezogen werden, da der Fruchtkörper von Anfang an holzig, derb und dauerhaft und konzentrisch gefurcht ist.
Fomes fomentarius.
A Hut von oben gesehen. B Hut median-längsdurchschnitten. C Röhrenhymenium von unten gesehen.
[Nach Luerssen.]
Fomes fomentarius (L.) FRIES, Syst. mycol. I, 374 (Polyporus fomentarius FRIES, Boletus fomentarius L., Agaricus fomentarius LAM.) ist ein zu den Hymenomycetinae, Polyporaceae — Polyporeae, Sectio Fomentarii, gehöriger, in Europa,[S. 486] Sibirien (bis über den Polarkreis), Nordamerika und auf Malakka vorkommender Pilz, der, ein echter Parasit, auf Laubbäumen, vorwiegend auf Buchen (und Birken) vorkommt.
Die Infektion des Baumes erfolgt stets durch Wunden. Das Mycelium verbreitet sich vorwiegend zwischen Rinde und Holz und erzeugt schließlich, von der Mitte des Stammes nach oben fortschreitend, den mehrere Jahre andauernden Hymenialkörper (den Hut). Dieser ist hufförmig-polsterartig, an der Peripherie halbkreisförmig oder halbelliptisch, sitzt mit sehr breiter Fläche ungestielt dem Stamme an und wird an der Anheftungsstelle bis 50 cm hoch, 30 cm breit und 25 cm tief. Auf der Rückenfläche (Oberseite) ist er entfernt konzentrisch gefurcht, kahl, nackt, anfangs rußfarbig oder bräunlich-grau, dann perl-grau mit welligen, ungleich dicken, parallelen Zonen; auf der Bauchseite ist er flach oder schwach vertieft; bräunlichgrau, später rostbraun. Innen weich, flockig, rostfarbig-gelbbraun mit c. 3 mm dicker, sehr harter, zäher, dauerhafter, aus Paraplectenchym (Pseudoparenchym) bestehender Rinde. Die Hymenialschicht liegt auf der Unterseite. Sie läßt sich leicht abtrennen. «Unter der Rinde liegt eine etwas umfangreichere, weichere rostbraune Schicht, auf welche eine dicke atlasglänzende, zartflockige und sammetweiche, hellzimtfarbene Schicht, welche parallel zur Hymenialschicht gezont ist» (BERG-SCHMIDT) folgt. Diese geht allmählich in die unterste, dunklere, dichtere, grobflockige Basalschicht des Hutes über. Diese drei Schichten bilden das Plectenchym. Nur die mittlere liefert den Feuerschwamm. Die Hymenialschicht (Schlauchschicht), die nun nach unten hin folgt und meist umfangreicher ist als der obere Hutkörper, besteht aus dichtem Plectenchym und ist von zahlreichen, vertikal verlaufenden, 0,5 mm weiten Röhren (Röhrenhymenium) durchzogen (daher Polyporus von πολύς und πῶρος), in welche die Basidien hineinragen, von denen je vier ellipsoidische Basidiosporen abgeschnürt werden. Die Hymenialschicht zeigt den Jahreszuwachsen entsprechende Zonen.
In den Fruchtkörpern dieses und anderer Baumpilze leben die Larven vieler Käferarten, z. B. [Cistelae, Melandryidae, Mordellidae] Mycetochares bipustulata ILL., Eustrophus (Mycetophagus) dermestoides FABR., Orchesia micans. PAYK., Hallomenus binotatus QUENS. u. a. (ISRAËL).
Der auf verschiedenen Laubhölzern, besonders Weiden, wachsende, in Europa, Sibirien, Nord- und Südamerika, Afrika und Australien vorkommende Weidenschwamm, Fomes igniarius (L.) FRIES (Polyporus igniarius FR., Boletus igniarius L.) besitzt einen meist kleineren, flacheren, reichlicher gezonten, am Rande gewulsteten Hut (Abbild. bei HENNINGS), der im Alter rissig wird und dessen rostbraune holzige Schwammschicht viel härter ist als die des F. fomentarius, daher einen schlechteren Feuerschwamm liefert, übrigens meines Wissens jetzt nirgends mehr darauf verarbeitet wird. Das gleiche gilt von den Fruchtträgern von Fomes marginatus (Polyporus marginatus FR.). Dagegen soll F. applanatus verwendbar sein (FLÜCKIGER). Der Fruchtkörper von Fomes igniarius ist anfangs kugelig-knollig, später huf- oder polsterförmig, 6–20 cm lang, bis 10 cm dick, erst mit flockigem, gelbbraunem Filze, später kahl mit harter, grauer oder schwärzlicher Rinde, mit konzentrischen Furchen und stumpfem Rande (HENNINGS). Weitere Polyporeen bei SYDOW in Realenzyklopäd. d. Pharm., bei LUERSSEN und HENNINGS.
Feuerschwamm wird besonders in den Karpathen in Siebenbürgen (im Szekler Lande und im Comitat Haromszék im Südosten), dann im Gouvernement Archangelsk, aber auch in Böhmen, Ungarn (Temesvar), Galizien, Kroatien, Thüringen (früher c. 1000 cwts jährlich, FLÜCKIGER), im Harz und Schwarzwald (Todtnau im Wiesenthal), bei Ulm und Fredeburg (Westfalen), sowie in Schweden gesammelt und verarbeitet. Die mittlere lockere Schicht «Zunderschicht» des im August und September gesammelten Fruchtkörpers (s. oben) wird mit einem Messer herausgeschnitten, in Wasser oder schwache Aschenlauge oder verd. Natron- oder Kalilauge[S. 487] eingeweicht, durch Waschen gereinigt, getrocknet und durch Klopfen der auf Steine aufgelegten Stücke mit hölzernen Hämmern in eine weiche Platte verwandelt, die dann meist noch gewalzt wird. Diese «Felle» erreichen (aber jedenfalls nur in seltenen Fällen) eine Länge von 110 cm, eine Breite von 50 cm und eine Dicke von 1,5 cm (FLÜCKIGER). Man fertigt aus Feuerschwamm auch Kleidungsstücke, Mützen, Westen.
Der Wundschwamm des Handels besteht aus sehr langen, 2,5–5,5 mik dicken, geraden oder wellig gebogenen, locker durcheinander geschlungenen Hyphen mit sehr dünner, bräunlicher Membran, zwischen denen keinerlei Substanzen sich abgelagert finden und die auch nahezu inhaltsleer sind.
SCHLOSSBERGER und DÖPPING geben dem Zellstoff des Feuerschwamms die Zusammensetzung 45,37% C, 6,82% H. Der Fruchtträger enthält Methylpentosane (WICHERS und TOLLENS), ein Fett, das eine hohe Säurezahl besitzt (ZELLNER). Ferner wurde gefunden: eisenbläuender Gerbstoff 0,6% und in einem jungen Fruchtträger ein glykosid-(salicin-)spaltendes Ferment (BOURQUELOT). Die Asche beträgt 1,09% (FLÜCKIGER).
Polyporus igniarius enthält Oxalsäure (BOUILLON LAGRANGE), Apfelsäure (derselbe, BRACONNOTS acide fongique, Schwammsäure), eisenbläuenden Gerbstoff. Die Polyporsäure scheint ein pathologisches Produkt zu sein, sie findet sich jedenfalls nicht regelmäßig (STAHLSCHMIDT). ZELLNER fand in Polyporus igniarius Ergosterin, Harz, Fettsäuren, Fumarsäure (?), Mannit, Glukose, Phlobaphene, gummiartige Kohlehydrate und sehr wenig Eiweißkörper, von Fermenten ein fettspaltendes, ein diastatisches, ein glykosidspaltendes und ein Cellulose lösendes. Die Membranen geben, mit HCl destilliert, Furol, enthalten also wohl Pentosane. Bei Destillation mit Alkalien liefert der Pilz Amanitol und Aminbasen (sehr wenig). Asche 7,85–8,67. (Darin 23,82% K2O, 23,93% CaO, 19,91% SO3 6,67% MgO, 2,29% SiO2, 2,85% Fe2O3 + Al2O3, 1,78% P2O5, 0,87% Na2O, 0,42% S als Sulfid.) CaSO4 war reichlich vorhanden, die Tonerde in wasserlöslicher Form.
Als Blutstillungsmittel wird Feuerschwamm jetzt vielfach durch Eisenchloridwatte ersetzt. Die Wirkung beruht wohl auf einer kapillaren Aufsaugung des Blutserums und dadurch bedingter rascher Gerinnung des Blutes infolge Verklebung der Blutkörperchen. Die Hyphen bilden sehr feine Röhren. Als Blutstillungsmittel wurde früher auch der ebenfalls Fungus chirurgorum genannte saprophyte Bovist (Lycoperdon caelatum BULL.) benutzt.
Zur Darstellung des Zunder, der seit Einführung der Zündhölzer nur noch in Gebirgsdörfern da und dort benutzt wird, wird der Schwamm mit Salpeter getränkt. Ein solcher Schwamm ist als Blutstillungsmittel unverwendbar. Daher muß der Schwamm stets auf Salpeter geprüft werden. Guter Wundschwamm muß weich und dehnbar sein, angezündet ohne Knistern und ohne Funkensprühen verglimmen und leicht und reichlich Wasser aufnehmen. Das ausgedrückte Wasser muß rückstandslos verdunsten und darf keine Salpeterreaktion (mit Diphenylamin) geben. Feuerschwamm hält auch nach dem Ausdrücken leicht das doppelte Gewicht Wasser zurück.
Die Verwendung eines «Schwammes» beim Feuermachen erwähnt PLINIUS (16, 77) mit den Worten: «teritur ergo lignum ligno, ignemque concipit attritu, excipiente materia aridi fomitis, fungi vel foliorum facillimo conceptu.» — «Fungus» findet sich auch bei SERAPION (I, S. 605).
Lit. Abbild. in BERG-SCHMIDT, Atlas II. Aufl., t. 160 (dort die Liter.), PABST-KÖHLER, Arzneipflanzen, t. 139, LUERSSEN, Med. pharm. Botan., HENNINGS in ENGLER-PRANTL, Pflanzenf., HARTWICH in HAGERS Pharm. Praxis, BERG, Anatom. Atlas, VOGL, Atlas. — FLÜCKIGER, Pharmakogn. — BOUILLON-LAGRANGE, Ann. d. chim. 51, 75. — BRACONNOT, Ebenda 79[S. 488] und 87. — SCHLOSSBERGER u. DÖPPING, Lieb. Ann. 52 (1844), 106. — BOURQUELOT, Bull. soc. myc. 1894. — ZELLNER, Monatsh. f. Chem. 29, 1171 und Chemie d. höh. Pilze 1907.
4. Silico-Membranindrogen.
Die Abteilung der Bacillariaceen (Diatomeen) ist unter anderem dadurch ausgezeichnet, daß die bekanntlich eine ganz außerordentlich mannigfaltige Zeichnung zeigenden (Fig. 159, vgl. auch Fig. 107 u. Fig. 108) Membranen der Zellen der sehr kleinen Pflanzen sehr reich an Silicium sind. Daneben findet sich aber ein Membranin, das nicht Zellulose zu sein scheint. Wenn man nämlich das Silicium mit Flußsäure entfernt, so färbt sich der Rückstand mit Jodschwefelsäure auch dann gelb, wenn man zuvor mit Kalilauge oder SCHULTZEscher Flüssigkeit behandelt (PFITZER). Wie das Silicium gebunden, ob eine «Silicozellulose» oder, was wohl das wahrscheinlichere ist, ein Kieselsäureester vorliegt, wissen wir nicht. Jedenfalls kommen auch Alkalien in der Schale vor, denn wenn man ohne zuvor mit Säuren zu kochen direkt verascht, bekommt man oft ein Glas. Kocht man aber mit Salpetersäure oder SCHULTZEschem Gemisch aus und glüht dann, so bleibt die Schale mit allen ihren, auch den feinsten Skulpturierungen erhalten. Das gleiche finden wir bei den Kieselguren, deren organische Substanz durch Fäulnis zerstört wurde. Wir können also die Kieselgurdiatomeen, die längst ihre Chromatophoren, ihr Plasma und die organische Grundsubstanz ihrer Membranen nicht mehr besitzen, auch heute noch nach der Struktur ihrer nunmehr vorwiegend aus Kieselsäure bestehenden Schalen diagnostizieren.
Häufiger vorkommende Diatomeen.
a Surirella splendida, b Meridion circulare, c Nitzschia linearis, d Nitzschia acicularis, e Epithemia Zebra, f Tabellaria fenestrata, g Synedra Ulna, h Gomphonema acuminatum, i Rhoicosphenia curvata, k Cocconema cistula, l Navicula stauroptera, m Stauroneis phoenicenteron.
[Aus Hager-Mez, Das Mikroskop.]
[S. 489]
Lit. Siehe unter Kieselgur. Über die Verkieselung der Membran höherer Pflanzen vgl. MOHL, Bot. Zeit. 1861 und SACHS, Flora 1862, sowie MILIARAKIS, Die Verkieselung lebender Elementarorgane bei den Pflanzen. Diss. Würzburg 1884.
Kieselgur.
Der Kieselgur (Infusorienerde, Bergmehl, Infusorienmehl, Kieselmehl, Diatomeenpelit) des Handels bildet ein leichtes, sehr feines, weißes oder grauweißes Pulver, das, wie die mikroskopische Untersuchung lehrt, so gut wie ausschließlich aus den zum Teil ganzen, zum Teil zertrümmerten Kieselschalen von Diatomeen (Bacillariaceen) besteht, die keine organische Substanz mehr enthalten. Nur selten finden sich die Nadeln des Süßwasserschwammes darunter. Er findet sich in bisweilen ziemlich mächtigen Lagern in Böhmen (Biliner Polierschiefer, Franzensbader K.), in Ungarn (Zabresta), in Toskana (Castel del Piane bei Santa Fiora) und in Deutschland (Lüneburger Heide, im Habichtswald, bei Kassel, am Hochsimmer in der Nähe des Laacher Sees, bei Altenschlürf und Steinfurth im Vogelsgebirge), in Finland (Lillhagshyön, Degernfors), Schweden (Drepenäre), Norwegen, Rußland, in Amerika (New York, Oregon, Nevada, Virginien und bes. Kalifornien). Richmond, Berlin und Königsberg stehen zum großen Teil auf stellenweise 23 m mächtigen Kieselgurlagern. Das Lager bei Ebstorf in der Lüneburger Heide ist 13 m, das in Zabresta 5 m mächtig. Die mächtigsten sind die von Fremont in Oregon (U. S. A.). Dort, wo wir nur aus Diatomeenschalen bestehende Kieselgurlager finden, können wir sie kaum für Sedimente von Süß- oder Salzwasserseen halten — die meisten Diatomeen sind Süß- oder Salzwasserbewohner —, da ihnen sonst wohl die Kieselreste anderer Organismen und anorganische Schlammbestandteile beigemengt wären, sondern diese sind wohl Produkte großer Quellen, die nur eben die Oberfläche naß erhielten.
Die Kieselgurlager enthalten, da die Diatomeen sehr klein sind, ganz ungeheuere Mengen dieser Organismen. Nach BRUN sind in einem Kubikmillimeter 8000, nach SCHUMANN in einem Kubikfuß 3 Billionen Diatomeen enthalten. Schon ein Kubikmeter enthält also schwindelerregende Mengen. Die ältesten Diatomeenformen reichen bis zur Kreide und ins Tertiär, die meisten sind viel jünger (Alluvium, Diluvium).
Der meiste Kieselgur, der in Deutschland technisch und in der Medizin verwendet wird, stammt aus den Lagern der Lüneburger Heide, wo sich verschiedene Fundstellen finden (Oberohe, Ebstorf, Hützel im Luhetal), deren Zusammensetzung nicht stark voneinander abweicht. Von dort werden jährlich 300–400 Doppelladungen exportiert.
Ein aus der Lüneburger Heide (von Oberohe oder Ebstorf) stammendes Muster, das Dr. KELLER-ESCHER in Zürich vor einiger Zeit bezog, bestand aus folgenden Arten: Synedra (S. Ulna dominiert, sie findet sich massenhaft), Fragilaria, Gomphonema, Melosira, Navicula, Epithemia, Cymbella, Amphora, Stephanodiscus und Cocconeïs.
Nach einer mir 1911 von O. MÜLLER-Berlin gesandten Bestimmung besteht der Kieselgur von Lüneburg aus: Melosira granulata (EHR.) Ralfs, Melosira crenulata. KG. (italica), Melosira arenaria MOORE, Melosira (crenulata var.) tenuis KG., Synedra (Ulna var.) splendens KG., Cymbella Ehrenbergii KG., Cymbella (Cocconema) lanceolata EHR., Cymbella cistula. HEMPR. u. var. maculata, Cymbella cuspidata KG., Epithemia sorax KG., Epithemia Hyndmanni W. SM., Epithemia turgida (EHR.) KG. und var. granulata GRUN., Cymatopleura (elliptica var.) hibernica[S. 490] W. SM., Campylodiscus hibernicus EHR., Surirella Campronii BRÉB., Surirella biseriata (EHR.) BRÉB., Surirella elegans EHR., Cyclotella operculata var. major KG., Pinnularia viridis u. var. KG., Pinnularia major KG., Navicula sculpta EHR., Eucyonema ventricosum KG., Gomphonema constrictum var. capitata EHR., Amphora ovalis KG., Stephanodiscus astrasa (EHR.) GRUN., Navicula gastrum (EHR.) DONK., Navicula elliptica KG., Cocconeïs pediculus EHR., Epithemia zebra (EHR.) KG. u. var. proboscoidea GRUN., Cymatopleura elliptica (BRÉB.) W. SM.
Ganz ähnlich ist nach KELLER ein Lager bei Celle zusammengesetzt: Synedra (bes. Ulna), Amphora, Cocconeïs, Cymbella, Epithemia, Eucyonema, Fragilaria, Gomphonema, Melosira, Navicula und Stephanodiscus.
Kieselgur von Eger nach Ehrenberg.
Die runden Scheiben sind Campylodiscus Clypeus Ehrbg., die schiffchenähnlichen Schalen Anomoeonis (Navicula) sculpta Pf. (in der Mitte) und bohemica Pf. (oben und unten).
[Aus Pfitzer, Bacillariaceen in Schenks Handb. d. Botanik.]
Beide Lager, das in der Lüneburger Heide und das von Celle, sind Süßwasserablagerungen.
Eine Infusorienerde von Eger (Franzensbad) enthält hauptsächlich Campylodiscus Clypeus EHRB. und Navicula (Anomoeoneis sculpta und bohemica (Fig. 160), daneben (nach KELLER) Cymbella und Nitzschia.
Von italienischen Erden sind im Handel:
Monte Amiato (Süßwasserdiatomeen), bestehend aus (etwa 12 Spezies) Navicula, Epithemia, Cymbella, Synedra, Cymatopleura, Amphora, Stauroneis, Cyclotella, Fragilaria und Melosira (KELLER).
Santa Fiora (Süßwasserdiatomeen), bestehend aus Amphora, Cocconeïs, Cymatopleura, Cymbella, Epithemia, Fragilaria, Gomphonema, Melosira, Navicula, Pleurosigma, Stauroneis, Synedra, Tabellaria (KELLER).
Als Beispiel einer Meereswasserdiatomeenablagerung sei das Tripelgestein von[S. 491] Richmond in Virginien erwähnt (Fig. 161), das Coscinodiscus Gigas, Actinoptychus biternarius, ferner Aulacodiscus, Paralia marina, Actinocyclus, Grammatophora, Navicula, Pleurosigma und Hemiaulus enthält (PFITZER).
Bei der Untersuchung eines Kieselgur ist zu beachten, daß die Diatomeen eine «Schalenseite» und eine «Gürtelseite» besitzen, also je nach seiner Lage dasselbe Objekt ein verschiedenes Aussehn zeigt.
Im Handel findet man jetzt folgende Sorten: Extra weiße calcinierte, Rosa calcinierte, Weiße geschlämmte und geschlämmte und calcinierte Infusorienerde (PROLLIUS).
Tripelgestein von Richmond in Virginien.
1 Coscinodiscus Gigas Ehrbg., 2 Actinoptychus biternarius Ehrbg., 3 Aulacodiscus sp., 4, 5 Paralia marina Heib., 6 Actinocyclus sp., 7, 8 Grammatophora sp., 9 Navicula gemina A. S., 10 Pleurosigma sp., 11 Hemiaulus sp.
[Aus Pfitzer, Diatomeen in Schenks Handb. d. Botanik.]
Für medizinische Zwecke wird besonders die Terra silicea calcinata praecipitata (d. h. geschlämmte und calcinierte) benutzt.
Die im Handel befindliche weiße (nicht die grüne!) Infusorienerde besteht fast nur aus Kieselsäure.
Der weiße (und grüne) Kieselgur der Lüneburger Haide z. B. enthält 97,3 (79,8)% Kieselsäure, 1 (1,9)% Tonerde, 1 (2,6)% Eisenoxydul, 0,3 (0,4)% Magnesia, 0,2 (0,3)% Kalk, 0,2 (15!)% Wasser und organische Substanz. Im grünen Kieselgur, der ungeglüht für unsere Zwecke unverwendbar ist, findet sich auch eine Spur Phosphorsäure.
[S. 492]
Die Verwendung des Kieselgur beruht darauf, daß die hohlen Schalen oder Schalenfragmente so rasch jede Feuchtigkeit kapillar aufsaugen, daß z. B. ein auf ein Kieselgurstäbchen fallender Tropfen Wasser sofort aufgesaugt wird. Von Wasser nimmt Kieselgur ⅕ des Gewichtes auf. Auch Gase und Dämpfe werden von Kieselgur rasch absorbiert (z. B. Closetgase, FRANK). Kieselgur wird deshalb in der Medizin als aufsaugendes und daher austrocknendes Mittel in der Dermatologie benutzt, ferner zur Bereitung von Streupulver, Desinfektionspulver, Zahnpulver, als Verbandmittel.
Brom darf über See nur in Form von Bromkieselgurstäbchen versandt werden, d. h. das Brom muß von solchen Stäbchen, die meist 8–10 mm dick sind, aufgesaugt werden. Denn das Platzen einer Flasche mit 1 kg Brom könnte zum Erstickungstode der Besatzung führen. Diese Bromkieselgurstäbchen haben sich auch zur Desinfektion von Aborten bewährt.
Der Dynamit ist von Kieselgur aufgesogenes Nitroglycerin und die Kieselgurplatten dienen ähnlich wie die unglasierten Tonteller zum Trocknen von Niederschlägen. Kieselgur ist auch vorzüglich geeignet zum Klären trüber Flüssigkeiten (Soxhlet; SCHWEISSINGER). Man streut es auf das Filter oder verrührt die Flüssigkeit damit.
Auch die Eigenschaft des Kieselgur Wärme schlecht zu leiten wird benutzt (Isoliermassen für Dampfleitungen, Eisschränke und Trockenkästen — Beschläge von Retorten), sowie die Eigenschaft sehr fein und dabei doch sehr hart zu sein, die ihn als Poliermittel von Goldwaren empfiehlt. Und endlich dient er auch als Ersatz des Quarzes in der Glasfabrikation. (Weitere Anwendungen bei ANDÉS.)
Im dreißigjährigen Kriege sowie noch 1719 und 1733 in Wittenberg diente das «Bergmehl» als Zusatz zum Mehl und auch in Schweden und Finland wird es (nach BERZELIUS) ebenso benutzt. Es besitzt natürlich keinen Nährwert und wirkt nur ähnlich wie die Kleie, darmreizend, also die Ausnutzung der eigentlichen Nährstoffe fördernd.
Die Bacillariaceen, von LEEUWENHOEK (1702) entdeckt (er sah Synedra Ulna), von EHRENBERG zu den Tieren, von KÜTZING zu den Pflanzen gestellt, sind wegen der zierlichen Zeichnung ihrer Schalen jetzt auch beliebte Testobjekte zur Prüfung der mikroskopischen Objektive (bes. Pleurosigma).
Lit. SCHÜTT, Bacillariales in ENGLER-PRANTL, Pflanzenfam. (mit vielen Abbild.). — PFITZER, Die Bacillariaceen in SCHENKS Handb. d. Botan. — BRUN, Les diatomées des Alpes et du Jura 1879. — ANDÉS in LUEGERS Lexikon der Technik. — PROLLIUS in Realenzyklopaed. d. Pharm. — Chem. Analysen auch im Artikel Kieselgur in FEHLINGS Handwörterbuch (1878). — Abbildungswerke: A. SCHMIDT, Atlas der Diatomeenkunde. Leipzig 1874–1877. — VAN HEURCK, Synopsis des Diatom. de Belgique 1880/81 und Treatise on the Diatomaceae 1896.
5. Carbono-Membranindrogen.
Wenn pflanzliche Membranen unter Luftabschluß der Zersetzung anheimfallen, so vollzieht sich an ihnen ein langsamer Carbonisierungsprozeß. Der Wasserstoff und der Sauerstoff und ein Teil des Kohlenstoffes gehen als Wasser und Kohlensäure fort und die Membran reichert sich immer mehr an Kohlenstoff an: sie beginnt sich zu bräunen und wird schließlich schwarz. Dieser Carbonisierungsprozeß, der also ein langsamer innerer Verbrennungsprozeß vom Charakter der trockenen Destillation ist, läßt sich in seinen einzelnen Phasen an der Kohlenbildung verfolgen. Während die Zellulose 44,4% Kohlenstoff enthält, finden wir im Torf 56–60%, in der Braunkohle 60–70%, in der Steinkohle 75–90% und im Anthracit c. 94%. Auch die Zellinhaltsbestandteile werden zum Teil verbrannt, aber ebenfalls nicht vollständig. Denn wie wir aus der Leuchtgasfabrikation ersehen, treten unter den Produkten der[S. 493] trockenen Destillation der Kohle auch Ammoniak und Schwefelverbindungen auf, die als aus den Plasmaresten der schon vor Jahrhunderttausenden von Jahren abgestorbenen pflanzlichen Zellen entstanden zu denken sind.

(Aus Regel, Thüringen.)
Slavischer Kohlenmeiler.
[Aus Heusler, Technologie.]
Der sich im Laufe sehr langer Zeiträume unter dem Drucke der darüber liegenden Erdschichten nur sehr langsam vollziehende Carbonierungsprozeß wird außerordentlich beschleunigt, wenn man die pflanzlichen Organe der trockenen Destillation unterwirft. Dies geschieht bei der Darstellung der Holzkohle in den Holzmeilern — man unterscheidet stehende (Fig. 162) und liegende und gemauerte (Fig. 163) Meiler — oder in Retorten. Die Meiler werden mit einer Lehmdecke versehen und dann bei b (Fig. 162) angezündet. Zunächst verdampft das Wasser («Schwitzperiode», Taf. XI), dann treten unten helle Dämpfe aus (Periode des «Treibens»). Das «Zubrennen» ist beendigt, wenn der austretende Rauch blau ist. Bei der Darstellung der Meilerkohle gehen die nebenher auftretenden Teerprodukte und der Holzessig verloren — nur beim gemauerten Meiler werden sie unten bei K (Fig. 163) abgelassen —, bei der Retortenholzkohle werden Holzteer, Holzessig und roher Holzgeist (Methylalkohol und Aceton) gewonnen. Das Produkt ist, abgesehen von den Aschebestandteilen, fast reiner Kohlenstoff. Das was wir hier in einer Phase sich vollziehen sehen — die Überführung der Zellulosine in Kohlenstoff —, vollzieht sich bei den Steinkohlenpflanzen in zwei Phasen. In der ersten werden die Pflanzenteile im Laufe der Jahrhunderttausende in Steinkohle, in der zweiten bei der trockenen Destillation diese in Coaks übergeführt, der, abgesehen von den Aschebestandteilen, auch fast reiner Kohlenstoff ist.
Gemauerte Meilerstätte.
[Aus Heusler, Technologie.]
Immerhin enthält die käufliche Holzkohle, Carbo ligni (Charbon végétal, Carbone vegetale), nicht selten außer Kohlenstoff noch Kohlenstoff-Wasserstoff-Sauerstoffverbindungen, so daß D. A. V und Pharm. helv. IV vorschreiben, daß sie in bedecktem Tiegel so lange geglüht werden solle als noch Dämpfe entweichen. Erst eine so behandelte Holzkohle erfüllt dann die Forderung, daß sie an Weingeist nichts abgeben, sowie siedendes Wasser nicht färben darf (Teerprodukte) und ohne Flamme vollständig bis auf 2% (Pharm. helv.) bzw. 5% (D. A.) Asche verbrennen soll.
Stellt man durch die Holzkohle nach geeigneter Präparation Dünnschliffe her,[S. 494] so findet man die Membranen geschwärzt und es zeigt sich, daß die guten Holzkohlesorten aus Laubhölzern dargestellt werden. Pharm. helv. verlangt ausdrücklich Laubholzkohle, besonders Carbo Tiliae. Die Carbo Belloci ist Carbo Populi. Auch Brotkohle (C. panis) wird benutzt. Die Meilerkohle ist meist Fichtenholzkohle. (Vgl. auch NETOLITZKY, Mikrosk. Unters. d. Kohlepulv. Pharm. Post 1903.)
Die Benutzung der Holzkohle beruht auf ihrer Eigenschaft übelriechende Gase (wie überhaupt Gase) und viele andere Stoffe zu absorbieren. Sie dient daher als Desinfektionsmittel zum Aufstreuen auf putride Wunden, zu Zahnpulvern und innerlich bei Gasbildung im Magen, und muß in gut verschlossenen Gefäßen aufbewahrt werden. Sie dient auch zur Räucherkerzenfabrikation.
Die Carbo animalis, Tierkohle, Fleischkohle (meist aus 3 Teilen Kalbfleisch mit 1 Teil Kalbsknochen dargestellt) und die Carbo ossium, Knochenkohle, Spodium (aus Knochen bereitet) besitzt diese Eigenschaften in noch ausgeprägterem Maße, besonders die, von den, im Gegensatz zur Holzkohle, hier sehr erheblichen Mengen anorganischer Bestandteile (die 3⁄5 resp. 8⁄10 ausmachen können) befreite Tierkohle dient als Entfärbungsmittel, nimmt aber auch Alkaloide und Bitterstoffe aus den Lösungen auf und absorbiert reichlich Gase. (ROSENTHALER und TÜRK, Über die absorbierenden Eigenschaften verschiedener Kohlensorten. Arch. Pharm. 1906, 517.)
Carbo animalis wird neuerdings (1909) gegen Vergiftungen durch Pilze, sowie andere pflanzliche Gifte (MUCK), sowie auch bei Eiterungen und granulierenden Knochenwucherungen bei Knochentuberkulose empfohlen (MERCKS Jahresbericht 1911). Die alte Medizin unterschied viele Kohlen: Hirundines ustae (Schwalbenkohle), Talpae ustae (Maulwurfsk.), Cuculi usti (Kuckucksk.), Carbo picae (Elsterkohle), Cinis bufonum, Soleae ustae u. v. a.
An dieser Stelle mag auch die Torfwatte (vgl. auch S. 276) und der Torfmull eingereiht werden, deren Rohmaterial besonders an der Nordseeküste, in Friesland und Holland gewonnen wird. Man unterscheidet nach der Provenienz und den darin vorkommenden Pflanzenteilen: Moortorf (bes. Sphagnumarten), Heidetorf (bes. Erica tetralix), Wiesentorf (Gräser, z. B. Eriophorum, dann Carex, Scirpus), Holztorf (bes. Erlen, Weiden). In den Mooren wird Torfstreu (grob — der von dem Brenntorf abfallende Grus) und Torfmull (feines Torfpulver) dargestellt. Die Torfwatte wird durch Verarbeitung von besonders lockerem, langfaserigen Obertorf gewonnen. Sie dient als Packmaterial, als Wärmeisolierungs-, Konservierungs- und Desinfektionsmittel und besonders in der Verbandstofffabrikation. Torfstreu saugt das achtfache ihres Gewichtes Wasser auf, die Torfwatte das zwanzigfache.
Über die Anatomie vgl. ROYER, L’ouate de tourbe et ses applications, Trav. lab. mat. méd. Paris 1910.
Das zu Moosbinden benutzte Torfmoos ist dagegen nicht in diese Gruppe zu ziehen. Es ist das unveränderte, noch nicht carbonisierte, meist aus Sphagnumarten (Sph. cymbifolium, acutifolium u. and.) bestehende gewaschene und getrocknete Moos der Torfoberflächen, das aber auch das dreizehnfache seines Gewichtes Wasser aufzusaugen vermag.
II. Albuminoiddrogen.
An die Membranindrogen, die nicht mit Sicherheit zu den Polysacchariden gezählt werden können, mag eine Gruppe von Drogen angeschlossen werden, von denen einige eine äußerliche Ähnlichkeit mit den Faserstoffdrogen besitzen (wie die Seide und Wolle), die aber alle kolloidale Albuminoide enthalten oder aus diesen bestehen. Die Spaltungsprodukte der Albuminoide, die einerseits Säuren, andererseits Basen sind, gehören vorwiegend zur aliphatischen Reihe, z. B. Glycocoll, Leucin, Serin, die Asparaginsäure, die Glutaminsäure, Lysin (α-ε-Diaminocapronsäure) und Arginin, oder enthalten doch einen aliphatischen Kern wie die Phenylaminopropionsäure und das Tyrosin. Daneben finden sich allerdings auch[S. 495] zyklische Verbindungen wie das Prolin. Ferner sind darin über das Glukosamin zu den Kohlehydraten hinüberleitende Hexonbasen gefunden worden.
Alanin = CH3.CH(NH2).COOH.
Serin = CH2OH.CH(NH2).COOH.
Phenyl-α-aminopropionsäure (Phenylalanin) = C6H5.CH2.CH(NH2).COOH.
Tyrosin = C6H4OH.CH2.CH(NH2).COOH (β-Oxyphenyl-α-Aminopropionsäure).
δ-Leucin =
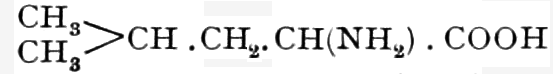
Asparaginsäure = COOH.CH2.CH(NH2).COOH.
Glutaminsäure = COOH.CH2.CH2.CH(NH2).COOH.
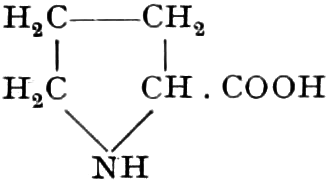 |
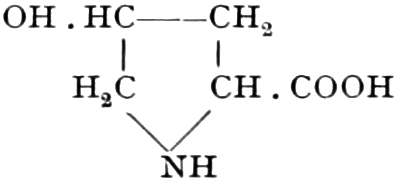 |
|
Prolin
(α-Pyrrolidincarbonsäure) |
Oxyprolin
(Oxypyrrolidincarbonsäure) |
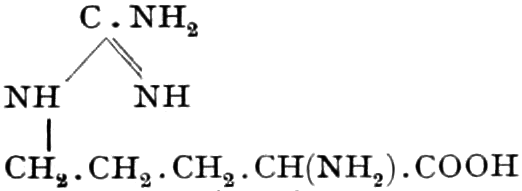 |
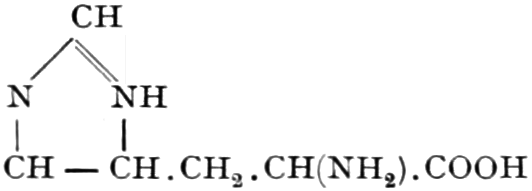 |
|
Arginin
|
Histidin
|
Zu den Albuminoiden gehören die Keratine, Elastin (im elastischen Gewebe), Kollagen (leimgebende Substanz) und Glutin, die wichtigsten Albuminoide des Körpers der Wirbeltiere; ihnen reihen sich an das Spongin (in den Schwämmen), Kornein (im Achsenskelett der Korallen) und die Bestandteile der Seide (Seidenleim und Fibroin) und der Wolle.
1. Gelatine.
Die farblose, durchsichtige, geschmack- und geruchlose Blätter bildende Gelatine (Gelatina in foliis, in tabulis) wird aus Knochen dargestellt, kann aber auch aus Sehnen oder Knorpel dargestellt werden [die Technik unterscheidet vom Leim: Lederleim (aus Haut) und Knochenleim]. Die medizinale Gelatine, die als Gelatina animalis und G. soluta sterilisata in den Pharmakopoeen sich befindet, ist ein meist aus Kalbsfüßen dargestellter, mit besonderer Sorgfalt gereinigter Knochenleim. Der Leim geht durch Kochen mit Wasser aus albuminoïden Kollagenen (leimgebenden Substanzen) hervor, die sich bei den Vertebraten als Grundsubstanz in den Fibrillen des gewöhnlichen Bindegewebes (Bänder, Sehnenfascien) und als organische Grundsubstanz der Knochen und Knorpel, meist mit Mukoiden und Albumoiden vereinigt, finden.
Das Kollagen verschiedener Gewebe scheint eine verschiedene Zusammensetzung zu haben. Die käufliche Gelatine enthält 51,45% C, 7,08% H, 17,47–18,18% N und 0,41–0,46% S (SADIKOFF). In chemisch-technischem Sinne unterscheidet man zwei Leimformen, den Knochenleim (Glutin) und den Knorpelleim (Chondrin). Chondrin ist aber ein Gemisch (MÖRNER).
Die Darstellung des Knochenleims erfolgt in der Weise, daß man die gewaschenen Knochen entfettet und ihnen den Leim dann durch Kochen mit Wasser oder Behandeln mit überhitzten Dampf entzieht.
Leim oder Glutin (Glutein, Colla) ist ein kompliziert zusammengesetzter Eiweißkörper (C13H20N4O5?), der bei der Spaltung 16,5% Glycocol), 14% Glutaminsäure, 9,3% Arginin, 5% α-Prolin, 5–6% Lysin, 3% Oxy-α-Prolin, 2,1% Leucin[S. 496] und weniger wie 1% NH3, Alanin, Asparaginsäure, Serin, Phenylalanin und Histidin liefert und auch einen Kohlehydratkomplex enthält. Auffallend ist der hohe Gehalt an Glycocoll, die Armut an NH3 und Histidin und das Fehlen von Tyrosin und Tryptophan. Von basischem Stickstoff enthält der Leim 35,38% des Gesamtstickstoffs. Das Glutin verschiedener Provenienz zeigt eine etwas verschiedene Zusammensetzung. Glutin aus Sehnen enthält 50,9–50,11% C, 6,56–6,80% H, 17,81–18,59% N, 0,26–0,53% S, Glutin aus Knorpel enthält 50,22–50,46% C, 6,8–7,12% H, 17,72–17,80% N, 0,52–0,63% S (SADIKOFF). Über andere Glutine vgl. die Tabelle bei OPPENHEIMER, Handb. d. Biochemie I, 337. Auch reinste käufliche Gelatine enthält immer Spuren Eiweiß. Es ist sehr schwer, aus ihr wirklich reines Glutin darzustellen (SADIKOFF). Leim quillt in Wasser, ist aber darin unlöslich, mit heißem Wasser gibt er eine kolloidale Lösung, die stark klebt. Über die Bedingungen der Gelatinierung, Erstarrung, Quellung und den Schmelzpunkt sind die Arbeiten von PAULY und RONA, OSTWALD und die Zeitschrift für Kolloidchemie zu vergleichen.
Durch längeres Kochen seiner wässrigen Lösung oder zweitägiges Verweilen bei 37° verliert der Leim seine Fähigkeit zur Gelatinierung. Es entsteht β-Gelatine (NASSE), die eine niedrigere spez. Drehung als die linksdrehende Gelatine besitzt (NASSE, FRAMM, KRÜGER). Die Reaktionen des Leims siehe bei OPPENHEIMER. Durch Essigsäure, Ferrocyankalium und Schwefelsäure wird Glutin nicht gefällt (Unterschied von den echten Eiweißkörpern). Gerbsäurelösung erzeugt noch in sehr verdünnten Lösungen einen weißen, flockigen Niederschlag. Auf der Bindung der Gerbsäuren durch Leim beruht die Verwendung von Hautpulver zur Bestimmung der Gerbstoffe.
DIETERICH fand in Gelatina alba D. A. IV 1,83–2,14% Asche und 17,28 bis 17,46% Wasser, in Gelatineleim 1,14–3,07% Asche und 11,72–20,59% Wasser, im Knochenleim 1,57% Asche und 17,66% Wasser. Die Asche darf nicht über 2% betragen (D. A. V) und soll kein Kupfer enthalten.
Medizinal-Gelatine darf nicht gebleicht sein. Das D. A. V läßt auf schweflige Säure prüfen: die mit Wasser angequollene Gelatine wird mit Phosphorsäure erhitzt und ein angefeuchteter Kaliumjodidpapierstreifen in die Mündung des Kolbens gehängt.
Die sterilisierte Gelatine wird subkutan, intravenös und in Form von Klysma als Hämostatikum benutzt, zu welchem Zwecke Gelatine schon im III. Jahrh. n. Chr. in China und Japan in Gebrauch war, in Europa seit 1896. Reines Glutin bewirkt durch Agglutination der Blutkörperchen eine Gerinnung des Blutes (KAPOSI), während seine Derivate, ebenso wie das Hirudin, gerinnungshemmend wirken. Bei der Darstellung der Gelatina sterilisata muß also Peptonisierung vermieden werden. Die Sterilisierung erfolgt im Autoklaven bei 100° an drei aufeinanderfolgenden Tagen je 15 Minuten lang. Zwischen den Sterilisationen werden die Röhrchen im Brutschrank bei 35° gehalten (Pharm. helvet. IV. Ebenda eine Prüfung der Gelal. sterilisat.).
Die gewöhnliche reine Gelatine dient zu Gelatine-Bougies, zu medizinischen Gallerten (nach ALMÊN) und zu Fruchtgelees. Rote (meist mit Fuchsin oder Bordeauxrot extra gefärbte) sowie braune Gelatine (Weinschöne) sind vom medizinischen Gebrauch auszuschließen, die eine dient zur Herstellung von Gelees (wie die weiße G.), die andere zur Klärung trüber Weine. An Klebefähigkeit steht die Gelatine der Hausenblase nach. Die photographischen Trockenplatten werden jetzt meist mit einer Jod-, Brom- oder Chlorsilber-Gelatine hergestellt, da Silber-Gelatinen sehr lichtempfindlich sind. Ebenso spielt die Chromgelatine in den photographischen Reproduktionsverfahren eine große Rolle, da der «Chromleim» durch das Licht auch in heißem Wasser unlöslich wird (EDER).
DIOSKURIDES erwähnt κόλλα (ξυλοκόλλα, ταυροκόλλα) und seine medizinische Benutzung[S. 497] zu äußerlichen Zwecken. Als bester Leim galt der weiße Leim von Rhodus, «wo er aus Ochsenhäuten gemacht wird».
Lit. Über Leimbereitung vgl. DAWIDOWSKY, Die Leim- und Gelatinefabrikation. Wien 1893, VALENTA, Klebe- und Verdickungsmittel und T. F. HANAUSEK, Artikel Leim in LUEGERS Lexikon (dort auch die Handelssorten). — HELL, Artikel Gelatine in Real-Enzyklop. d. ges. Pharm. — OPPENHEIMER, Handb. d. Biochem. — RÖHMANN, Biochemie. — LEVENE, Über d. Spaltung d. Gelatine. Zeitschr. phys. Chem. 37 (1902), 81. — SADIKOFF, Sehnenglutin, Knorpelglutin, Zeitschr. f. phys. Chem. 39 (1903). — OSTWALD, Pflüg. Arch. 108 (1906). — NASSE bei Oppenheimer I, 338. — DIETERICH, Helfenberger Ann. 1900–1904. — KISSLING, Fortschr. auf d. Gebiete d. Chem. usw. des Leims. Chem. Zeit. 35, 423. — Über Gelatinepräparate vgl. den Gehe Codex.
2. Os Sepiae.
Die im Rücken des in allen europäischen Meeren vorkommenden, zu den Kephalopoden gehörenden Tintenfisches, Sepia officinalis L. sitzende Schulpe wird nach Verwesung des Tieres vom Meer ausgeworfen. Sie ist das weiße Fischbein, Os Sepiae. Sie bildet eine flache, beiderseits gewölbte, in der Mitte bis 2 cm dicke, bis 2,5 cm lange und 7 cm breite, an den Enden zugeschärfte Schuppe, die neben 80–85% Calciumcarbonat vornehmlich aus Leim- und Knorpelsubstanz besteht. (Beschreibung des Tieres und der Schulpe bei VOGL und BERG.)
3. Cornu cervi raspatum.
Das geraspelte Geweih des Hirsches, Cervus Elaphus, enthält neben 57,5% Calciumphosphat und 1% Calciumcarbonat 27% Knorpelsubstanz.
4. Ichthyocolla.
Fischleim, Colla piscium, Ichthyocolla, Hausenblase, Colle de poisson, Ichthyocolle, Isinglass, Fishglue, ist die getrocknete, präparierte, innere, pulpöse und vaskuläre Haut der Schwimmblase verschiedener in europäisch-asiatischen Gewässern vorkommenden, zu den Knorpel-Ganoiden gehörenden Acipenser-(Stör-)Arten, zu denen der Hausen A. Huso L. (Bjeluga) gehört, der im Schwarzen Meere und den in dieses mündenden Strömen vorkommt, ferner der Scherg oder Sewerjuga (A. stellatus PALL.) im Kaspischen und Schwarzen Meer, der Sterlet (A. Ruthenus L.) im Schwarzen und Asowschen Meer, im Baikalsee und Nördlichen Eismeer und der Ossetr (A. Güldenstädtii BR.) im Schwarzen und Kaspischen Meer und dem Baikalsee. Die Fische sammeln sich zur Laichzeit an den Flußmündungen und gehen auch in großen Scharen in die Flüsse (Wolga, Ural, Emba, Dnjestr, Dnjepr) hinauf und werden dort in großen Mengen gefangen. Der Eierstock bildet den Caviar, die Schwimmblase die rohe Ichthyocolla. Ein Fisch liefert 100–150 g Hausenblase. Die Blasen werden aufgeschnitten, abgewaschen (bisweilen in Kalkwasser eingeweicht) und auf Bretter gespannt getrocknet. Die halbgetrockneten Scheiben werden durch Reiben von der äußeren, nicht leimgebenden Silberhaut befreit und dann, das Innere nach außen gekehrt, aufgespannt, fertig getrocknet (Blätterhausenblase, I. in foliis), oder in eine der anderen Handelsformen gebracht («gebrackt»). Mehrere, gefaltet übereinander gelegte Blätter bilden die Bücherhausenblase, zusammengerollte die Rollenhausenblase, ausgewalzt und in Fäden geschnitten ist die Fadenhausenblase (I. in filis), zwischen zwei Nägeln hufeisenförmig, herzförmig oder lyraförmig gebogen die Leier-, Klammern-,[S. 498] Kranz- oder Riegelhausenblase. Schlechte Sorten sind die Klumpen-, Zungen-, Band- oder Krümelhausenblasen. Die tongs und Beutel sind unpräparierte Schwimmblasen.
Rußland exportiert im Jahr c. 100000 kg. Handelszentren für Hausenblase sind besonders Nischni Nowgorod und Petersburg (bisweilen wird die Hausenblase erst hier gebrackt). In den Dogghallen Londons sah ich große Mengen. Die beste Sorte ist die Astrachaner, besonders die sog. Patriarchenhausenblase (Blätter und Klammern), die meist von A. Güldenstädtii stammt und deren Oberfläche ein sehr charakteristisches blaues Irisieren zeigt, dann die kleinen Blätter von A. stellatus (Blätter und Bücher) und die dicken und reinen Blätter von A. Huso.
Hamburg importierte 1908 Hausenblase (echte und unechte) 220810 kg, davon aus Japan: 182580 (Agar?), russischen Ostseehäfen: 7670, Brasilien: 6810, China: 5410.
Deutschland führte 1909: 148 dz Hausenblase aus Rußland ein.
Der deutsche Großhandel unterscheidet (1910): Beluga, Blätter extraf. Salianski, nat. Blätter und Schnitzel und gebleichte Blätter und Schnitzel in vielen Sorten, dann (weniger wichtig): Premislowoy, Assetrowa, Astrachan, uralische Hausenblase usw. [sowie (als Sekundaware): Samovy (s. hinten unter Paralleldrogen) und sibirische Hausenblase]. In London werden besonders gehandelt (1907): Brasilianische Zungen (tongues), Maracaibo (Herzform), Venezuela (Zungen und Taschen).
Die Hausenblase bildet weiße oder gelbliche, durchscheinend-hornartige, in der Richtung der Fasern zerreißbare, bisweilen geschmacklose, aber stets etwas, manchmal sogar ziemlich stark riechende Stücke, die bisweilen mit schwefliger Säure oder durch Schnee und Salz gebleicht sind (die Formen abgebildet bei DIETERICH). Sie quillt in kaltem Wasser und löst sich in kochendem Wasser zu einer kolloidalen, stark klebenden, neutralen oder schwach alkalischen Flüssigkeit, die, wenn konzentriert, gelatiniert. Die wenig haltbare Lösung wird durch Zusatz von 1⁄15 Glycerin haltbar (MEYER). Das Bindegewebe der Hausenblase besteht aus sehr charakteristischen, büschelig-pinselig angeordneten Fibrillen (Abbild. bei PROLLIUS).
SCHERER gibt die Zusammensetzung zu 49,5% C, 6,9% H, 18,8% N, 24,8% O an, also annähernd wie bei dem Glutin (s. d.). JOHN gibt 70,5% Tierleim, 16% Osmazom, 4% Milchsäure, K-, Na- und Ca-Salze, 2,5% unlösliche Haut und 7% Wasser an. Die Asche wird meist zu 0,5 (HENKEL, REDWOOD) bis 1,5 (ja sogar bis 5%), der unlösliche Rückstand zu 2–28% (2–15 DIETERICH), selten nur zu 1,5% (COP), das Lösliche zu 70–98% angegeben.
Russische, speziell Astrachaner Hausenblase ergab PROLLIUS: 0,2–1,2% Asche (höchstens 0,9% LETHEBY), 16–19% Wasser, 0,7–3% in Wasser unlöslichen Rückstand. MEYER fand in russischer Hausenblase 12% Unlösliches. K. DIETERICH fand (1909) bei russischer Hausenblase (Saliansky, Beluga, Samovy) folgende Grenzwerte: Wasser 13–20%, Asche 0,5–1,7% (darin 8–33% K2CO3), lösliche Anteile 65–81%, unlösliche 1–19%, Fett 0,1–1,2%, Collagen 79–85% (Rohglutin 66–82%). Die Jodzahl betrug 19–45, die Säurezahl 0–6. Die optische Drehung des Glutins war stets links, Schwefel war stets vorhanden. WINDISCH fand 15% N, SCHLIEPER bis 0,54% S (der hohe Gehalt wohl von der Bleichung mit S). Der Hauptbestandteil der Hausenblase ist also Collagen bzw. Glutin.
Hausenblase wird in der Pharmazie besonders zur Bereitung des Englisch-Pflaster und zum Klären trüber Flüssigkeiten (hierfür unentbehrlich!) benutzt, weniger zur Herstellung von Gelatinen (nur die ungebleichten Sorten!), viel in der Technik, z. B. zu Kitten.
[S. 499]
Als Paralleldrogen können gelten: Hamburger Hausenblase von Acipenser Sturio L. gilt als eine gute Ersatzsorte. Hudsonsbay H. von A. brevirostris und rubicundus, meist in tongs. Die in immer größeren Mengen im Handel erscheinenden Neufundland- und Kanada-H. stammen jetzt meist von Gadus-, Merluccius- und Phycis-Arten. Samowij-H. von Silurus glanis (im Russischen Som), dem Wels, liefert in Rußland schöne dünne weiße Blätter. Indische H. von S. raita und Polynemus-Arten in Beuteln und Pfeifen, oft kalkhaltig. Chinesische H. von Sciaena lucida und Anguilla pekinensis, in langen Streifen. Brasilianische (Para) H. von Silurus- und Pimolarus-Arten in Röhren, Klumpen und Scheiben. Bandhausenblase von New York von Merluccius vulgar. (36% in Wasser unlöslich) und Gadus Morrhua. Westindische H. von Silurus Parkeri und Maracaibo H. (Herzform), beide 1910 im Handel. Isländische H. von Gadus Morrhua (vgl. hierzu auch PEREIRA, Heilmittellehre). Alle diese geben Lösungen von geringerer Viskosität und geringerer Klebkraft als die echte Hausenblase (PROLLIUS). Viele besitzen einen starken Fischgeruch und unangenehmen Geschmack. Im deutschen Handel waren 1910 die südamerikanischen Sorten: Brasilianische H. (Zungen), Maracaibo und Venezuela (Taschen).
In Hamburger H. fand PROLLIUS (1883) 1,3% Asche, 19% Wasser und 2,3% Unlösliches; Indische H. enthielt 8,6%, Nordische 10,8%, Isländische 21,6% Unlösliches. In amerikan. Hausenblase strip (Streifen) fand MEYER (1873) 30%, in sheet (Blätter) 18% Unlösliches.
Falsche Hausenblasen, die nichts mit Fischblasen zu tun haben, sind die falsche Parahausenblase (Eierstöcke des Silurus Parkerii), der Mainzer Fischleim, Leim aus Därmen von Lämmern und Ziegen, der in den Donaufürstentümern aus Haut, Därmen und Magen von Knorpelfischen dargestellte Leim, die Ichthyocolle francaise aus Blutfibrin und Tannin, die japanische H. (Agar) u. and. Nicht selten findet sich eine verfälschte H. im Handel, die durch Eintauchen der Blätter in Leimlösung oder Einlegen von Leimblättern zwischen die Buchhausenblase dargestellt wurde (REDWOOD und LETHEBY).
K. DIETERICH fand (1904) bei falschen Hausenblasen folgende Grenzzahlen in %:
|
H2O
|
Asche
|
K2CO3 in
der Asche |
Löslich in
H2O |
Unlöslich in
H2O |
Fett
|
Collagen
|
Rohglutin
|
Säurezahl
|
Jodzahl
|
|
|
Chinesische H.
|
11–17
|
0,9–2,3
|
32–53
|
68–86
|
2–15
|
0,1–1,2
|
81–88
|
69–74
|
0
|
39–46
|
|
Amerikanische H.
(Brasilien, Venezuela, Maracaibo Abfälle) |
13–18
|
1–3,7
|
6–37
|
59–75
|
9–25
|
0,1–0,8
|
80–87
|
66–75
|
0–2,76
|
30–47
|
|
Verfälschte
Saliansky (mit Leim getränkt) |
16
|
0,6
|
72
|
82
|
1,5
|
0,3
|
83
|
82
|
3,8
|
37
|
Alle drehen links, alle enthalten Schwefel.
PLINIUS kennt Ichthyocolla, die man im Altertum, wie es scheint, besonders von A. Huso gewann. Er hat auch gehört, daß sie «aus dem Bauche» stammt und daß die pontische H., da am schnellsten löslich, am meisten geschätzt werde. Bei DIOSKURIDES finden sich Angaben über die medizinische Benutzung der ἰχθυοκόλλα (ἰχθύς = Fisch, κόλλα = Leim).
Lit. BRANDT-RATZEBURG, Med. Zoologie. — PEREIRA, Heilmittellehre. — JACKSON, Essay on british Isinglass. — VALENTA, Klebe- und Verdickungsmittel. — ROYLE, On the prod. of isinglass along the coasts of India 1842. (Dort Abbildungen der Zubereitung von JACKSON.) — WAGNER, Chem. Technol. — FISCHER-HARTWICH, Pharm. Praxis. — MOELLER-HUSEMANN in Realenzyklop. — VOGL, Arzneikörper. — BERG, Pharmakognosie (dort eine Beschreibung der Fischarten). — C. MEYER, Sol. of isinglass in water Am. journ. pharm. 1873, 258. — PROLLIUS, Über Collapiscium. Pharm. Centralh. 1883, 335. — K. DIETERICH, Zur Pharmakodiakosmie u. chem. Analyse d. Hausen- u. Fischblas. Dresden 1909. — WEIGEL, Pharm. Centralh. 1904. — HELFENBERGER Annalen 1897, 1900–1904. — Ältere Analysen von JOHN (in GMELINS Handb. d. Chem. II, 1468) und SALLY (bei ROYLE). — Vgl. auch die I, S. 390 erwähnten Werke.
[S. 500]
5. Catgut.
Das Rohmaterial für das Catgut liefern die Därme des Schafes, die von gesunden Tieren entnommen, frisch verarbeitet und von allen Fett- und Fleisch-, Schleim- und Zottenteilen befreit werden müssen. Der Darm wird in zwei schmale Bänder aufgespalten und jedes dieser Bänder nach dem Aufspannen durch ein Drillierrad gedreht, wodurch sie sich von c. 3,1 m auf 3 m verkürzen und die Bänder zu Fäden werden. Stärkere Fäden erhält man durch Zusammendrillieren mehrerer Darmbänder. Die fertig drillierten Catgutfäden werden, in Rahmen gespannt, an einem mäßig warmen Orte getrocknet und dann mit Schmirgel und Öl abgeschliffen und (mit Carbolsäure, Jod, Sublimat, Glycerin oder Wacholderöl) sterilisiert. Neuerdings wird Catgutsterilisation (statt mit Alkoholdämpfen) mit Chloroform empfohlen. Starker Alkohol macht Catgut brüchig, in 90% hält es sich lange, ebenso in 3% Phenolwasser. Die Verwendung des Catgut, das aus einem Collagen besteht und dessen Fäden eine hohe Zugfestigkeit besitzen, beruht darauf, daß seine Substanz in der Wunde innerhalb 8–20 Tagen vollständig resorbiert wird.
Neuerdings (1904) sind von KIEFFER die Beinsehnen der Kraniche und Reiher als Catgutersatz empfohlen worden.
Über steriles Catgut vgl. LENTZ und LOCKEMANN, Klin. Jahrb. 1909, 566, LÈRAT, Journ. pharm. Liège 1909 (vgl. auch Jahresber. Pharm. 1909, 361).
6. Spongia.
Der Bade- oder Meerschwamm besteht aus verschiedenen zur Gattung Euspongia gehörenden Spongien (Hornfaserschwämmen) besonders des Mittelmeeres (Coelenteraten), die etwas unterhalb des Meeresspiegels bis zu ziemlichen Tiefen (200–300 m) an Felsen oder anderen Gegenständen festgewachsen sind und durch die «Schwammfischer» herausgeholt werden.
Die wertvollsten Schwämme werden an den Küsten Syriens (von Kap Carmel bis Iskenderum) und Kleinasiens (Südwestspitze) und der Inseln Rhodos, Symi und Kalymnos durch Taucher und Taucherglocken gefischt. Diese syrischen (Soria) Schwämme, die meist in Smyrna gehandelt werden, stammen von Euspongia officinalis var. mollissima SCHULZE, Eusp. officinalis var. adriatica SCHULZE und Euspongia officin. var. lamella SCHULZE und Eusp. zimocca. Die gröberen (Pferdeschwämme) von Hippospongia equina elastica LENDENFELD kommen von der Nordküste Afrikas, die Marseiller Schwämme (Eponges brunes de Barbarie) von Euspongia communis von der tunesischen Küste (Sfax, Golf von Gabès). Die an der Küste Istriens und Dalmatiens mit vierzinkigen Gabeln gefischten, weniger geschätzten, leicht zerreißbaren Schwämme sind meist Euspongia adriatica, dann auch Eusp. nitens und quarnerensis (VOGL). Die großporigen Bahamaschwämme sollen von Varietäten der Mittelmeerarten stammen (HYATT).
Hauptproduktionsgebiete sind: der griechische Archipel, das Küstenland von Syrien, Ägypten, Tripolis und Tunis, die Küsten von Istrien und Dalmazien, das Rote Meer und der persische Golf; dann das Caraibische Meer (Antillen und Bahamainseln). Hauptausfuhrhäfen: Smyrna, Aden, Tripoli (in Syrien), Rhodus, Sira, Aegina (im griech. Archipel), Bengasi, Tripolis (Afrika), Sfax, Avana, Nassau (Bahamainseln), Keywest (Florida). Wie zur Zeit des ARISTOTELES so sind auch heute noch besonders Griechen Schwammfischer — selbst drüben in Amerika. Ein sehr geübter kann 100–150 Pf. Rohschwamm am Tage fischen.
Im Mittelländischen Meer werden nicht weniger als vier verschiedene Methoden bei der Schwammfischerei angewendet. Die reicheren Händler rüsten ein 5–6 Tonnen schweres Boot mit einer mehr als 12 Mann starken Besatzung aus. Jedes Boot ist mit moderner Taucherausrüstung (Skaphanderapparat) versehen und hat wenigstens 10 Professionstaucher an Bord. Die Taucher gehen hinunter auf den Grund bis 15–30 Faden tief, sammeln so viele Schwämme wie möglich und tun sie in ein an ihrem Körper befestigtes Netz. Diese Methode gestattet ein sehr gründliches Sammeln der erreichbaren Schwämme, so daß gelegentlich die Schwamm-Ansiedlungen[S. 501] überfischt wurden, auch zerstören die schweren Stiefeln der Taucher viele Schwämme. Um den Gebrauch des Tauchapparates etwas einzuschränken, ohne jedoch eine vernünftige Ausnutzung zu schädigen, erhebt die türkische Regierung einen schweren Zoll auf den Gebrauch desselben. Andere Staaten am Mittelländischen Meer tun das Gleiche.
Die zweite Methode ist in Kleinasien, Tunis, Tripolis usw. sehr in Gebrauch. Der gebrauchte Apparat ist eine Art Baggermaschine mit Schleppnetz, in Tripolis «gangara», in Tunis «arth» genannt, die im wesentlichen die Struktur der gewöhnlichen Auster-Baggermaschine hat. Vier bis sieben Mann, in einem Boot zu drei Tonnen halten die Maschine in Gang. Da das Baggern Tag und Nacht geschehen kann, so ist diese Methode sehr produktiv; doch kann natürlich der fortgesetzte Gebrauch des Apparats die Schwamm-Kolonien ernstlich gefährden, auch werden viele Schwämme durch das Fahren der Maschine auf dem Seeboden zerdrückt oder zerrissen.
Die dritte und vierte Methode, die früher allein in Gebrauch waren, werden jetzt noch in einigen Teilen des Mittelländischen Meeres, ferner ausschließlich bei der Fischerei in Florida, Bahama und Cuba angewendet. Es ist dies das Harpunieren oder mit Haken herausholen und ferner das Tauchen ohne besonderen Apparat. Das erstere geschieht bei niedrigem Wasser und ruhigem Wetter und ist eine sehr einfache Prozedur. Aus den Booten bestimmt man die Lage der Schwämme. Da die Wellen die Beobachtung hindern, benutzt man ein sogenanntes «water glass, Wasserteleskop, Schwammglas» (ein kräftiges Eisenrohr, ungefähr 20 Zoll lang und vierzehn Zoll im Durchmesser, an dessen einem Ende eine Glasscheibe befestigt ist). Das Ende dieses Rohres wird ins Wasser gesetzt und nun ist ein klares Beobachten der Schwammbeete möglich. Die Schwämme werden dann mit Harpunen, die mit Zacken und einem hölzernen Schaft versehen sind, aufgespießt und in das Boot gebracht. — Früher kam es in den Tunesischen Gewässern vor, daß man Schwämme aus relativ tiefem Wasser vermittelst Harpunen heraufholte. Die Griechen waren so geschickt in der Handhabung der Harpunen, daß sie einen Speer hinten an den Schaft des andern werfen konnten. Die vereinigte Länge ermöglichte es, den Schwamm auch aus tieferem Wasser heraufzuholen.
Die letzte und am meisten verbreitete Methode ist das Aussenden eines unbekleideten Tauchers ohne besonderen Apparat. Dazu werden kleine Boote mit 3–4 Mann gebraucht; diese senken einen flachen Stein, an dem ein starkes Tau befestigt ist, ins Wasser. Der Taucher steht aufrecht auf dem Stein, indem er sich an dem Seil hält, so läßt man ihn auf den Seeboden bisweilen 50 oder gar 80 m herab und er sammelt während 1–2 Minuten rasch so viele Schwämme wie möglich und tut sie in ein auf dem Rücken angebrachtes Netz. Möglichst junge Männer werden als Taucher gebraucht; der Druck des Wassers wirkt aber oft ungünstig auf das Rückenmark und Paralyse kann die Folge sein. Diese Methode wird in gewissen Teilen des Mittelländischen Meeres, an der Ostküste Afrikas und auch im Caraibischen Meer angewendet.

Kultur von Meerschwämmen auf dem Dreieck.
[Aus dem Prometheus.]
In den Fischereigründen von Florida, Bahama und Cuba werden die Schwämme durch Speerwerfen gewonnen. Die Speere sind dreizinkige Gabeln, die sich in ein schweres eisernes Rohr fortsetzen. An diesem ist oben ein Stab befestigt, den man je nach der Tiefe des Wassers verschieben kann. Wie im Mittelländischen Meer wird auch hier ein «water glass» angewendet,[S. 502] doch ist es nur ein Eimer, in den man an Stelle des Bodens ein Stück festes Glas eingesetzt hat. (Nach The sponge industry in Bull. Imperial Institut London 5 [1907], 393.)
Die Züchtung der Schwämme lehrte OSCAR SCHMIDT (1862) und BUCCICH. In Tunis ist dann 1897 bei der Insel Kerkennah der, wie es scheint, erfolgreiche Versuch gemacht worden, Spongien zu kultivieren (HÉRAIL). Auch die 1901 einsetzenden Versuche der United States Commission of fish and fisheries waren erfolgreich. Nachdem schon 1897 HARRIS in Amerika Versuche mit auf galvanisierten Draht gereihten Schwammstücken gemacht, benutzt MOORE jetzt (1910) Cementunterlagen (Dreiecke und Scheiben), die mit Stiften versehen sind (Fig. 164). Die Kultur gründet sich auf die Tatsache, die CAVOLINI (1785) und LIEBERKÜHN (1855) fanden, daß sich der Schwamm aus kleinen, zerschnittenen Stücken wieder regeneriert.
Für den Handel werden die Schwämme durch Auspressen von ihrer gallertigen Körpersubstanz und dann von den eingeschlossenen oder aufsitzenden Steinchen, Muscheln, Korallen usw. befreit, gewaschen und getrocknet und auch wohl (mit SO2, Brom oder Kaliumpermanganat) gebleicht.
Von den zahlreichen Handelssorten dürfen für den pharmazeutischen Gebrauch, z. B. zur Herstellung der schon PLINIUS bekannten Spongia pressa, bei denen es auf eine möglichst große Aufsaugefähigkeit ankommt, nur die besten, feinporigen, hellgelbbräunlichen Champignon-, Damen- oder Badeschwämme benutzt werden, deren Asche nur etwa 3–4% beträgt. Badeschwamm läßt sich schwer sterilisieren. Man behandelt nacheinander mit Lösungen von Permanganat, Natriumbisulfit, dem etwas HCl zugefügt wurde, Phenol und Sublimat (1 : 2000) (TERRIER et VERCAMER). Die Schwämme werden aber jetzt meist durch Gazetampons ersetzt. Spongiopiline (Schwammfilz) ist mit hygrophiler Baumwolle oder Schafwolle zu einem Filz verarbeiteter Pferdeschwamm.
Hauptmarkt für die Mittelmeerschwämme ist Triest, das jährlich für über £ 100000 exportiert, dann Paris, London, Hâvre, weniger Livorno und Venedig. Die Bahamaschwammfischerei macht große Fortschritte. 1907 standen dort schon 500 Schoner und 2500 Boote in ihrem Dienst und der Export betrug 1906 bereits über 1½ Mill. lbs. (bei den Bahamaschwämmen unterscheidet man velvet, sheepwoot, hardearth). Auch Florida exportiert schon viel (1906: 50953 lbs) und sehr beträchtlich ist die Schwammfischerei auch bei Cuba (Bull. Imp. Inst. 1907). Neuerdings tauchen auch Schwämme von Australien im Handel auf.
Deutschland führte 1909 3576 dz rohe Meerschwämme ein, besonders von den Bahamainseln, den Ver. Staaten, Griechenland, Österreich, Cuba, Großbritannien; bearbeitete vorwiegend aus Österreich und Griechenland.
Die besten (soprafine) Schwämme sind die syrischen und vom Archipel, die mittelmäßigen (zimocche) die von Salonici und die barberischen, die schlechten (communi oder di Gerba) die Marseiller und die venetischen. Die beste Sorte ist der feine Levantiner Schwamm (Becherschwamm, turkey cup, coupe turque, fine douce de Syrie), von Syrien, Mandruka (an der ägyptischen Küste), Kreta und Cypern — von der Varietät mollissima (werden mit M. 125 bis 800 das Kilogramm bezahlt!), der zweitbeste der Levantiner (turkey toilet sponge) von der var. adriatica, die dritte der Ohren- oder Mundschwamm (Levantinerlappen, Elephantenohr) von der var. lamella — eignet sich besonders für chirurgische Zwecke — und die vierte der Zimokkaschwamm. Der groblöcherige Pferdeschwamm (Honigwabenschwamm, Honeycomb) kommt von Marseille bis zu den Dardanellen und dem Roten Meer vor: Adria, Küsten Kleinasiens, Ägypten, Algier, Tunis, Tripolis, Archipel, Kreta, Corsica.
Die besten amerikanischen Wollschwämme stammen von Rock Island (Florida) besonders von Hippospongia canaliculata var. gossypina. Ferner liefern die Bahamas, Cuba, Mexiko, Honduras Schwämme, besonders die zweite Sorte, die Yellow sponges und die Velvet sponges, die wohl von Hippospongia equina var. maeandriformis LENDF. stammen. Die Gras- und Drahtschwämme sind minderwertig. Kein amerikanischer Schwamm erreicht an Güte die Levantiner.
CROOCKEWIT nannte die Substanz des Schwamms Fibroin und fand in ihr (1845) Jod, Schwefel und Phosphor und 3,7% Asche (POSSELT 3,59%). STÄDELER zeigte, daß sie sich nicht durch Kochen mit Wasser in Leim verwandelt. Er nannte sie zum Unterschiede vom Fibroin der Seide Spongin und erkannte, daß sie bei der Hydrolyse Leucin und Glycocoll (von KRUKENBERG bestätigt), aber kein Tyrosin liefert. NADLER fand im Spongin J und Br. STANFORD schätzt den Jodgehalt des Sch., der aber sehr schwankt, auf c. 0,5%. Nach KRUKENBERG ist das Spongin keine einheitliche Substanz. Es gibt weder die Xanthoproteïnreaktion, noch die mit[S. 503] MILLONS Reagens. ZALAKOSTAS fand bei der Behandlung mit Barythydrat: Leucin, Leuceïnhydrat, Butalanin, Glykalanin und Spuren von Tyrosin. Auch durch Behandeln mit Wasser bei 160° geht der Schwamm nicht in Lösung (FLÜCKIGER). Die auch in heißem Wasser unlösliche Gerüstsubstanz der Spongien, die nach Extraktion der Badeschwämme mit Wasser, Alkohol, Äther und verd. Säure zurückbleibt, das Spongin, ist ein jodhaltiges Albuminoid (48,51% C, 6,30% H, 14,79% N, 0,73% S, 1,5% J, c. 28% O. HARNACK). Einige Spongien enthalten auch Brom. Bei der hydrolytischen Spaltung liefert Spongin 13,9% Glycocoll, 7,5% Leucin, 6,3% Prolin, 18,1% Glutaminsäure, 4,7% Asparaginsäure, 5–6% Arginin, 3–4% Lysin (ABDERHALDEN und STRAUSS). Durch den hohen Gehalt an Glycocoll und das Fehlen von Tyrosin erinnert das Spongin an Elastin und Glutin, unterscheidet sich aber von beiden durch den hohen Gehalt an Glutaminsäure. Durch Behandlung mit kalter 38% Schwefelsäure zerfällt das Spongin in lösliche Körper und das unlösliche, aber in Natronlauge lösliche Jodospongin, einen 8,2% Jod enthaltenden Körper (C56H87JN10S2O20 HARNACK), durch Kochen mit Salzsäure wird aus Spongin das 4,86% Jod enthaltende Spongomelanoidin (ROSENFELD) abgespalten.
Daß die aus unverkäuflichen Badeschwämmen oder Abfällen der Mundierung dargestellte, bei Kropfkuren seit Langem vom Volke benutzte Schwammkohle, Carbo Spongiae (Spongia usta oder tosta, Kropfschwamm) Jod enthält, ist längst bekannt. J. C. STRAUB in Hofwil (Bern) vermutete bereits 1819, daß die Carb. Spong. Jod enthalte und DUMAS wies es 1820 einwandfrei nach (FLÜCKIGER). Sie enthält neben Fe, SiO2 und Ca auch Brom (0,76 MgBr2). Der Schwamm liefert etwa 33% Kohle. Die Schwammkohle muß bei mäßiger Temperatur, womöglich in geschlossenen Trommeln, aus gut gewaschenem, von Sand befreitem Schwamm hergestellt werden. Sie enthält nach älteren Analysen 0,99–1,09 (HERBERGER) bzw. 2,14% (PREUSS und RAGGAZINI) NaJ, nach E. RICHTER im Durchschnitt 0,67 (0,31–0,81) % Jod. Sie darf nicht mehr wie 6% in Salzsäure Unlösliches enthalten (RICHTER). Die Schwämme werden oft mit Sand beschwert. Auch das Achsenskelett der Gorgonia enthält einen 7% Jod enthaltenden Körper, das Gorgonin (DRECHSEL).
Die aus den Schwämmen ausgelesenen Korallen usw. wurden früher als Lapis Spongiarum (Kropfstein) benutzt.
PLINIUS (9, 69 und 31, 47) kennt schon drei Spongia-Arten (tragos, manos und achilleum) und die Handelssorten: afrikanische und rhodische und wußte, daß es Tiere sind. Er kennt (wie auch GALEN) die blutstillende Wirkung, besonders des in Essig getränkten Schwammes, mit dem ja auch die Blutung von Christi Wunden gestillt wurde, und nennt eine Menge Krankheiten, gegen die sie und die Schwammasche angewendet werden. Die weichsten kamen schon damals von der Küste von Lycien. Aus ähnlichen Quellen schöpft DIOSKURIDES (V, 137), der außer dem σπόγγος auch die σπόγγων λίθοι kennt. Er erwähnt ihre Benutzung ähnlich wie Charpie. Auch ARISTOTELES kennt die σπόγγοι. Bei IBN BAITHAR, der die tierische Natur der Schwämme leugnet, finden sich die Bezeichnungen: ilfondsch elbahr, gaim, gamâm und gamlaw.
Lit. HYATT, A revision of the North American Poriferae (wichtig für die Systematik und Classification). — H. F. MOORE, The commercial sponges and the sponge fisheries. Washington 1910 und A practical method of sponge culture. Washington 1910. — Deutsch Amer. Apoth.-Zeit. 1905 Nr. 12 — Pharm. Centralh. 1898, 803 und 1905, 802. — MÉRAT-LENS, Dict. mat. méd. 6 (1834), 511. — FLÜCKIGER, Grundriß und Artikel Schwamm in FEHLINGS Handwörterbuch (1898). — HUSEMANN in Realenzyklop. d. Ph. — Pharm. Journ. 1877, 107 und 1883, 108. — Am. journ. ph. 1881, 182 mit Abbild. (aus Manufact. a. Builder 1881). — LEDENFELD, Pharm. Journ. 17 (1887), 937. — ECKHEL, Le spugne da bagno in riguardo al modo di raccoglierhe. Triest 1873, mit Karte u. Taf. — The sponge industry, Bull. Imper. Instit. London 5 (1907) 382 (Gesamtüberblick). — VOGL, Arzneikörper (dort und in Arch. Pharm. 53 (1874), 56 ist die Schwammfischerei beschrieben). — K. SAJÓ, Die Badeschwämme. Prometheus 1911, 290 (m. vielen Abbild.). — HÉRAIL, Trait. d. pharmac. 1901. — ZWIEDINEK V. SÜDENHORST, Syrien 1873 u. Arch. d. Pharm. 1876. — HYATT bei HOLMES, Pharm. Journ. 17 (1887), 761. — HERBERGER in DÖBEREINER Apotherb. III, 1842. — CROOCKEWIT, Jahresb. d. Chem. 1843, 24. — POSSELT, Ebenda. — STÄDELER, Lieb. Ann. III (1859), 12., Journ. pr. Chem. 78, 169. — NADLER, Jahresb. d. Ph. 1862. — STANFORD, Pharm. Journ. 15, 1884. — KRUKENBERG, Ber. d. chem. Ges. 1856, Ref. — ZALOKOSTAS, Compt. rend. 1888, 252. Journ, ph. 19 (1889) 104. — DUMAS, Bibl. univ. d. Genève 14 (1820), 301. — HUNDESHAGEN, Zeitschr. ang. Chem. 1895, 473. — HARNACK, Zeitschr. phys. Chem. 24 (1898), 421. — ROSENFELD, Arch. f. exp. Pathol. 45 (1900). —[S. 504] ABDERHALDEN u. STRAUSS, Zeitschr. phys. Chem. 48 (1906). — KOSSEL und KUTSCHER, Ebenda 31 (1900). — DRECHSEL, Zeitschr. f. Biol. 33 (1896). — E. RICHTER, Über Schwammkohle Apoth. Zeit. 1911, 317 (dort zahlreiche Analysen).
7. Seide.
Der von zwei Drüsen der Raupe des Seidenspinners, Bombyx Mori L. zur Herstellung der Cocons sezernierte und durch einen Ausführungsgang herausgequetschte Seidenfaden besteht aus zwei, durch eine klebrige, von zwei andern Drüsen beim Austritt des Fadens in den Ausführungsgang abgeschiedene, Sericinhülle miteinander verbundenen, Fibroinfäden (Fig. 165). Die Hülle wird im Degummierungsprozeß gelöst und dadurch die Fäden getrennt. Das Degummieren (Entbasten, Entschälen) der Rohseide erfolgt durch neutrale Seifenlösungen, Borax, Carbonate usw. Bei «halbgekochter» Seide ist die Sericinhülle nicht ganz entfernt. Der Querschnitt des soliden Fadens ist rund oder rundlich-dreieckig oder etwas abgeplattet (Fig. 165), die Oberfläche glatt oder feingestreift; Luftkanälchen fehlen, die fibrilläre Struktur kann durch Jod-Schwefelsäure sichtbar gemacht werden. Die Dicke beträgt 8–25, meist c. 15 mik. (HÖHNEL).
Die Seidenraupen sondern etwa 8–10% ihres Gewichtes an Seide ab (SCHLOSSBERGER). Die Menge der produzierten Seide ist der Menge der verfütterten Maulbeerblätter proportional. Das Tier wird in den Cocons entweder durch Hitze oder durch Kälte (drei Wochen unter 0° bis −8° LOVEREDO) getötet.
Die Rohseide ist oft durch ein Lipochrom (DUBOIS) gelblich gefärbt, das bei der gelben Seide in der Sericinhülle sich befindet; der Fettgehalt der Rohseide beträgt 0,036–0,06%. Jodlösung färbt hellbraun bis rotbraun, MILLONS Reagens rot, Zucker und Schwefelsäure rosa. Kalilauge löst, ebenso alkoholische Glycerin-Kupferlösung (LÖWE), schwer Kupferoxydammon, das Wolle ungelöst läßt. Konz. Schwefelsäure löst alle Seidenarten, nachdem sie sich zunächst unter Aufquellen verkürzt haben. Beim Kochen mit Salzsäure tritt kaum Violettfärbung ein, wohl aber rasch Lösung (die Sericinhülle löst sich nicht, ebensowenig Wolle und andere Haare). Konz. Chromsäure löst S. ebenso wie Wolle (nicht Baumwolle und Lein), Salpetersäure färbt gelb, Pikrinsäure wird gespeichert (nicht von Pflanzenfasern). Taucht man S. in eine Mischung von Bleizuckerlösung und überschüssiger Kalilauge, so färbt sie sich nicht (Wolle wird braun). S. löst sich in Chlorzinklösung bei 30–40° (Wolle nicht, PERSOZ). Farbstoffe werden stark gespeichert.
Die Fäden der sog. wilden Seiden (Yamamayseide, Tussahseide) sind dicker und deutlich gestreift. Bei allen exotischen Seiden sind Fibrillen sichtbar, die bei der echten Seide meist ganz zu einer homogenen Masse zusammengeflossen sind (HÖHNEL). Die Seidenfäden sind doppelbrechend, die Farben zwischen gekreuzten Nicols sind sehr lebhaft. Die Fibroinfäden sind zweiachsig, Sericin ist doppelbrechend (PANEBIANCO).
Seide.
a Roher Seidenfaden von Bombyx Mori, in der Mitte die beiden Fibroinfäden, b die Sericinhülle, c ein Doppelfaden querdurchschnitten, d einfacher Seidenfaden, e Querschnitt desselben, f Faden von Tussahseide, g Querschnitt desselben.
[Aus Hager-Fischer-Hartwich, Pharm. Praxis.]
Seide enthält keinen Schwefel. Das Fibroin zeigt die Zusammensetzung 48,63% C, 6,08% H, 18,97% N, 26,32% O. Sericin liefert nur 0,1–0,2% Glycocoll und 5% Alanin, Fibroin 36% Glycocoll und 21% Alanin. Der Arginingehalt ist bei beiden gleich (4%), der Tyrosingehalt beim Sericin nur halb so hoch (5%). Sowohl das kollagenartige Sericin wie das Fibroin sind Eiweißkörper. Das[S. 505] Sericin, das dem Glutin nahe steht, geht durch Behandeln mit 1% HCl und Kochen mit Wasser als «Seidenleim» in Lösung. Das Fibroin ist ein relativ einfacher Eiweißkörper, der sich durch einen sehr hohen Tyrosingehalt von allen bisher bekannten Albuminoiden scharf unterscheidet (FISCHER und SKITA). Es reagiert auf MILLONS Reagens und zeigt auch die Biuret-Reaktion (wie das Sericin). Fibroin ist in konz. Säuren und Alkalien löslich und aus den Lösungen durch Neutralisation wieder fällbar. Der hohe Gehalt an Monoaminosäuren im Vergleich zu dem Gehalt an Basen stellt es dem Elastin zur Seite, den hohen Gehalt an Glycocoll teilt es mit dem Leim, von dem es sich aber durch seinen hohen Tyrosingehalt (10%) unterscheidet. Monoaminodikarbonsäuren fehlen ganz. Bei der Hydrolyse des Seidenleims entsteht das Serin. E. ABDERHALDEN und JUL. SCHMIDT erhielten bei der Hydrolyse von Leim befreiter Cocons der Tai-Tsao-Seide 25,2% der trockenen aschefreien Substanz Glycocoll, 18,2% Alanin, 0,9% Leucin, 1,2% Serin, 2,1% Asparaginsäure, 2,0% Glutaminsäure, 1,0% Phenylalanin, 7,8% Tyrosin und 1% Prolin. Die gleichen Substanzen wurden von ABDERHALDEN und WELDE bei der Hydrolyse der Cheefoo-Seide erhalten (auch ungefähr in den gleichen Mengenverhältnissen, doch Glycocoll nur halb so viel).
In der Chirurgie wird von der Nähseide (Ligaturseide) sowohl die mit schwacher Seifenlösung in der Wärme ausgelaugte, dann mit 2%iger Sodalösung und endlich mit Wasser gewaschene drellierte Seide, sowie auch die geflochtene Seide (Turners Patentseide) benutzt. Ferner: Seidewatte, Seidenabfallgewebe (Bourettestoff), Seidenraupendarm (fil de florence, Silkwormgut, Wormsilk) und Schutztaffet (silk protectiv).
Zur Sterilisierung chirurgischer Seide empfiehlt AUSIN (1904) die Diffusionsströme, die beim Mischen von Wasser und Alkohol entstehen: Auskochen mit Wasser während 20 Minuten, dann Auskochen mit 95% Alkohol während 30 Minuten. Aus dem Alkohol wird die Seide noch warm herausgenommen und sofort zur Naht benutzt. Die Seide kann ohne Schaden sechsmal dieser Operation unterworfen werden.
Über die Seiden anderer Bombyxarten vgl. bei VON HÖHNEL.
Er gibt bereits eine Menge, aber ausnahmslos in der Chirurgie nicht verwendbare, Seidensurrogate (Chardonnetseide [Soie francaise], Viscoseseide, Kunstseide (LEHNER), Vivier (soie de France) Cadoret, Siriusseide), die meist aus Cellulose, besonders dem Tetraacetat oder -nitrat dargestellt werden oder von nicht nitrierter Cellulose ausgehen (PAULYS Celluloseseide) oder das Viskoid (Cellulosexanthogenat) benutzen (STEARN). Lösungen von Cellulosenitraten in Äther-Alkohol geben, wenn sie in dünnem Strahl in Wasser einfließen einen Faden von Seidenglanz, ebenso Lösungen der Zellulose in Kupferoxydammon, wenn sie in verdünnte Säuren einfließen. Die Entzündlichkeit der nitrierten Fasern kann durch «Denitrieren» mit Schwefelammon vermindert werden. Viskose ist eine Lösung von Zellulose in einem Gemisch von Alkali und Schwefelkohlenstoff. Die Viscoseseide hat einen eckigen Querschnitt (SÜVERN und MACH). Künstliche Seide wird bisweilen «animalisiert», d. h. mit einem aus den Abfällen natürlicher Seide bzw. Wolle (aus Fibroin oder Lanigeninsäure) bereiteten Firnis glänzend gemacht. Auch Gelatine ist zur Herstellung künstlicher S. benutzt worden (Vanduaraseide, nicht mehr im Handel).
DUYK gibt folgende Unterschiede zwischen natürlicher, gelatinierter und Celluloseseide sowie Wolle an. Natürliche Seide, gelatinierte S. und Wolle brennen schwer und entwickeln dabei den Geruch nach verbranntem Horn. Celluloseseide brennt leicht und mit dem Geruch brennender Baumwolle, 2% Natronlauge löst Seide, Wolle und Haare beim Kochen, Celluloseseide nicht. Konzentrierte Natronlauge greift Celluloseseide stark an, beim Verdünnen mit Wasser entsteht eine Gelatine. Salpetersäure färbt alle tierischen Fasern gelb (Xanthoproteinreaktion), Celluloseseide und pflanzliche Fasern nicht. MILLONS Reagens färbt Seide dunkelrot, Wolle gelblich-schwarzrot, Celluloseseide nicht. Ammoniakalische Nickeloxydullösung (1 Nickelcarbonat, 6 Ammoniak, 6 Wasser) löst nur Seide, weder künstliche Seide noch Wolle oder Pflanzenfasern, konzentrierte Schwefelsäure löst künstliche Seide. Jodwasser und verdünnte Schwefelsäure färbt Celluloseseide blau, Seide gelb, Kupferoxydammon löst Celluloseseide, Seide nicht. HERZOG empfiehlt (Chem. Zeit. 1904) zur Unterscheidung natürlicher und künstlicher Seide Congorot, Benzoazurin und Methylenblau. (Vgl. auch bei HÖHNEL.)
Die Festigkeit beträgt nach HASSAK und HERZOG in Kilogramm für 1 mm Querschnitt:
|
trocken
|
feucht
|
trocken
|
feucht
|
trocken
|
feucht
|
||||||
|
bei
|
echter Seide
|
37
|
37
|
bei
|
Lehnerseide
|
16,9
|
1,5
|
bei
|
Gelatineseide
|
6,6
|
0,0
|
|
„
|
Chardonnetseide
|
12
|
2,2
|
„
|
Celluloseseide
|
19,1
|
3,2
|
„
|
Acetatseide
|
10,22
|
5,8
|
[S. 506]
Lit. H. SILBERMANN, Die Seide, ihre Gewinnung und Bearbeitung. Dresden 1897 (m. Abbild.). — VON HÖHNEL, Mikroskopie d. techn. verwend. Faserst. 1905. — VOGEL u. REISCHAUER, N. Rep. d. Pharm. 8 (1860): 529. — E. FISCHER und SKITA, Zeitschr. phys. Chem. 33 (1901) 171 und 35 (1902), 224. — OPPENHEIMER, Handb. d. Biochemie. — WEYL, Ber. d. d. chem. Ges. 1888. — Die Chemie der Seide auch in FEHLINGS Handwörterbuch (1898). — WITT, Kunstseide, Färberzeit. 1904. — DUYK, Monogr. d. Ersatzmittel d. Seide, die künstliche S. u. ihr Nachw. in Geweben. Bull. ass. belg. Chim. 1901, 166. Schweiz. Wochenschr. 1903, 488. — BERL, Glanzstoff-Kunstseide. Kunststoffe 1 (1911) 151. — HERZOG, Z. Kenntn. d. neueren Acetatseide. Chem. Zeit. 1910, 347 und Die Unterscheid. d. natürl. u. künstl. Seiden. Dresden 1910.
8. Schafwolle.
Wenn vollständig, besteht das Wollhaar aus der schuppigen Epidermis, aus der faserigen Rindenschicht und der aus übereinander stehenden Zellen bestehenden Markschicht. Von diesen Schichten kann die Markschicht fehlen (feine Merinowolle), die Rindenschicht kann reduziert, die Epidermis abgerieben sein (Shoddy). Die Länge kann 20 cm erreichen, die Breite wechselt (Merino 12–37 mik, Leicester 30–90 mik).
Jodjodkali färbt braun, MILLONS Reagens beim Erwärmen ziegelrot. Kalilauge löst, beim Verbrennen tritt Geruch nach verbranntem Horn auf. Durch Kochen mit verdünnter Schwefelsäure (oder Behandeln mit Wasser bei 150°) geht Wolle fast vollständig in Lösung. Die Lösung bildet mit sauren Teerfarbstoffen Niederschläge (Farblack), auch Gerbsäure und Kaliumbichromat fällen (KNECHT, BREINDL). Der Wollfaser wird meist folgende Zusammensetzung zugeschrieben: 50,2% C, 22,84% O, 6,72% H, 16,54% N, 3,7% S. Der Wärmewert beträgt pro g 5510,2 cal. (STOHMANN u. LANGBEIN). WANKLYN und COOPER erhielten (1879) bei der alkalischen Oxydation der Wolle Cyanpropionsäure. SCHÜTZENBERGER (1878) stellt die Schafwolle zu den Albuminoiden. Er erhielt aus ihr Leucin, Tyrosin, Glycoprotein, «Leucine der Buttersäure, Valeriansäure und Propionsäure und Leuceïne der Butter- und Valeriansäure». Die Wolle enthält jedenfalls Keratine, d. h. schwefelhaltige Albuminoide. Die chemische Zusammensetzung der Wollfaser scheint ähnlich wie die des Horns und der menschlichen Haare zu sein. Sie liefert bei der Hydrolyse Aminosäuren, Leucin, Tyrosin usw. und enthält im Keratinanteile an Sauerstoff gebundenen Schwefel (RAIKOW). Natronlauge entzieht der Wolle den Schwefel. PRUDHOMME nimmt in der Wolle (wie im Albumin) die Gruppe
aber keine NH2-Gruppen an.
Die Wolle fixiert sowohl saure wie basische Farbstoffe; sie zeigt gleichzeitig saure und basische Eigenschaften. Zahlreiche Theorien des Färbeprozesses von Wollgeweben sind aufgestellt worden. KNECHT glaubt, daß die Aminosäuren der Wolle mit den Farbbasen Lacke bilden, der Tyrosinkomplex scheint bei dem Färben nicht beteiligt zu sein u. and. mehr.
Da Schafe bisweilen in arsenhaltigen Bädern gewaschen werden, ist auch die unbearbeitete Wolle oft arsenhaltig (ABENIUS 1900). Beim «Waschen» der Rohwolle wird das an Cholesterinestern reiche Wollfett (Analysen bei KLEINSCHMIDT, Jahresb. d. Chem. 1887, 2335 u. and.) und ein Waschwasser enthalten, das Caprinsäure, Ammoniak, Methylamin und Dimethylamin liefert (Buisine).
Wolle findet namentlich in der Form von Flanellbinden medizinische Anwendung, seltener als Filz und Crepon.
Lit. Das Mikroskopische in HÖHNEL, Mikroskop. d. techn. verwend. Faserstoffe 1905.
III. Säuredrogen.
Unter diesem Namen mögen alle die Drogen zusammengefaßt werden, die niedere aliphatische Säuren, besonders die sog. Pflanzensäuren, oder saure Salze derselben als charakteristische Bestandteile enthalten. Die niederen Fettsäuren der Ameisensäurereihe sind in kleinen Mengen in den verschiedensten Pflanzen als häufige und[S. 507] regelmäßige Stoffwechselprodukte nachgewiesen. Bakterien vermögen sie ebensowohl aus Zucker und anderen Kohlehydraten wie aus Eiweißstoffen zu bilden (das Detail in CZAPEKS Biochemie).
Daß die aliphatischen Säuren, besonders die sog. Pflanzensäuren zu den Kohlehydraten Beziehungen besitzen, kann jetzt keinem Zweifel mehr unterliegen. Wir können uns plausible Vorstellungen davon bilden, wie Zucker im Abbauprozeß in die Säuren übergehen und aus den Säuren umgekehrt Zucker synthetisch entstehen kann. Als Beispiel für den Abbau mag folgendes, von E. FISCHER aufgestelltes Schema dienen:
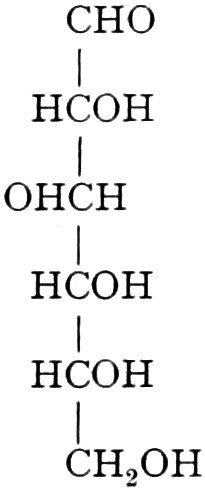 |
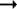 |
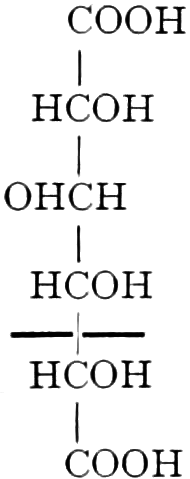 |
 |
 |
+
|
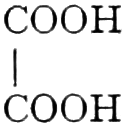 |
|
d-Glukose
|
d-Zuckersäure
|
d-Weinsäure
|
d-Oxalsäure
|
Ferner sei erwähnt, daß es gelungen ist, aus Maltose, Saccharose, Dextrose und Lävulose im Prozesse der sog. Zitronensäuregärung Zitronensäure aufzubauen (WEHMER, BUCHNER, WÜSTENFELD, HERZOG und POLOTZKY). BUCHNER und WÜSTENFELD denken sich den Prozeß in der Weise verlaufend, daß der Zucker zunächst in Kohlensäure und Alkohol gespalten, der Alkohol assimiliert und aus dem Plasma der gealterten Zelle unter dem Einfluß eines proteolytischen Enzyms neben Stickstoffverbindungen Zitronensäure abgespalten wird.
Weniger sicher ist der Übergang von den Pflanzensäuren zu dem Zucker zu verfolgen. Wir sehen zwar, daß die unreifen Früchte reich an Pflanzensäuren sind und daß diese ganz oder fast ganz beim Reifen und Nachreifen verschwinden und an ihrer Stelle Zucker auftritt, ob aber hier (nach LIEBIG) ein direkter Übergang stattfindet wissen wir nicht. Allerdings haben Versuche von C. GERBER an reifenden Früchten zu Vorstellungen geführt, warum Apfelsäure führende Früchte in kalten Klimaten reifen können, aber nicht weinsäurereiche (wie z. B. Trauben): Nur in diesen Früchten ist ein Übergang der Säure in Zucker bei relativ niedriger Temperatur möglich. Noch schwerer wie Apfelsäure und Weinsäure wird Zitronensäure angegriffen. Erst bei c. 30° kommt sie bei Gegenwart von Zucker für die Atmung in Betracht. Zitronen werden durch Lagern (Nachreifen) nicht süß. Doch liegen die Verhältnisse hier wohl weniger einfach als sich dies GERBER denkt. Bemerkenswert ist z. B. auch, daß alle jungen Feigenfruchtstände, bevor sie süß werden, Auszüge geben, die stark nach Caprylsäure riechen, ganz ähnlich wie Cocosfett (TSCHIRCH).
Die niederen Fettsäuren können wir uns ebenso als direkte Assimilationsprodukte der Kohlensäure wie aus Spaltungsprodukten von Kohlehydratresten hervorgegangen denken. Oft entstammen sie dort, wo wir sie in Drogen oder Drogendestillaten antreffen, auch der Zersetzung von Estern ätherischer Öle, denn die Primäröle die wir in der Pflanze antreffen, sind oft Ameisensäure-, Essigsäure-, Buttersäure und Baldriansäure-Ester. Die aliphatischen Säuren treten also auch in die Sekrete ein und[S. 508] den Charakter eines Schutzsekretes besitzt z. B. die Ameisensäure auch bei den Formicae (s. d.).
Die höheren Fettsäuren bilden bekanntlich mit dem Glycerin Ester, die wir Fette nennen und die im Anschluß an das vorstehende Kapitel in einem besonderen Abschnitte behandelt werden sollen.
Eine scharfe Methode zur quantitativen Trennung der verschiedenen, oft gleichzeitig auftretenden Pflanzensäuren existiert nicht, oft macht bereits der qualitative Nachweis der einzelnen Säuren in einem Gemisch Schwierigkeiten. Als Beispiel für eine der brauchbareren Methoden kann die folgende angeführt werden (BERG und GERBER). Die Säuren werden mit Bleizucker gefällt, das Blei wird mit Schwefelwasserstoff entfernt und das Filtrat mit Kalk gesättigt. Die hierbei entstehenden unlöslichen Calciumsalze (A) werden mit Essigsäure behandelt, welche das Calciumoxalat ungelöst läßt, während die essigsaure Lösung Weinsäure und Phosphorsäure aufgenommen haben kann. Auf erstere wird mit MOHLERS Reagens geprüft, auf letztere mit Molybdänlösung. Die löslichen Calciumsalze (B) werden mittelst Ammoniumoxalat vom Kalk befreit, worauf das saure Filtrat auf Citronensäure und Äpfelsäure untersucht wird. Die Citronensäure wird mittels 66proz. Schwefelsäure bei 50–60° in Acetondicarbonsäure übergeführt, letztere wird ausgeäthert. Äpfelsäure kann isoliert werden durch Auskochen der getrockneten Ammoniumsalze mit 95proz. Alkohol, wobei nur Malate in Lösung gehen, während Tartrate und Citrate im Rückstande bleiben. Durch diese Methode hat man z. B. in Mesembryanthemum-Arten, in welchen man früher nur Oxalsäure annahm, Citronensäure, Oxalsäure, Äpfelsäure und Phosphorsäure nachweisen können (EULER, Pflanzenchemie).
Lit. BUCHNER und WÜSTENFELD, Biochem. Zeitschr. 1909, 395. — HERZOG und POLOTZKY, Zeitschr. phys. Chem. 49 (1909), 125. — C. GERBER, Ann. sc. nat. 1897. — TSCHIRCH, Chem. u. Biolog. d. pflanzl. Sekrete. — CZAPEK, Biochemie. — EULER, Pflanzenchemie.
I. Ameisensäuredrogen.
Die Ameisensäure oder Methansäure, H.COOH, findet sich frei und gebunden in den Nadeln der Tanne (ASCHOFF), den Brennhaaren der Nessel, in den Früchten von Tamarindus indica (s. d.), Sapindus Saponaria (GORUP-BESANEZ), Arctostaphyllos, Gingko, Ceratonia (S. 144), im Honig (S. 12), in unreifen Wacholderbeeren, Weintrauben, im Safte von Sempervivum (DÖBEREINER), im Milchsafte von Bassia latifolia (HECKEL und SCHLAGDENHAUFFEN), in der Prozessionsraupe, in Muskeln, Milz und Thymus des Menschen und anderwärts, aber meist nur in sehr geringen Mengen; in größerer nur in den Ameisen (Zusammenstellung bei BERGMANN, Bot. Zeit. 1882, 731).
Formica.
Die geschlechtslosen Arbeiter der gemeinen Waldameise, Formica rufa L., einer durch Europa verbreiteten, in Kolonien lebenden, Nadelholzwälder bevorzugenden Hymenoptere sind ungeflügelt, 4–7 mm lang, mit braunroter Brust und daranansitzenden sechs rotbraunen Beinen versehen, und tragen in dem breit-eiförmigen, fünfgliederigen, bräunlich-schwarzen, durch einen zweigliederigen Stiel mit der Brust verbundenen Hinterleibe eine mit einer scharfen ätzenden, vorwiegend aus einer ziemlich konzentrierten Lösung von Ameisensäure bestehenden Flüssigkeit gefüllte Giftdrüse, deren Inhalt sie bei Angriffen weit fortzuspritzen vermögen.
Die Giftdrüse findet sich bei den Weibchen und Arbeitern stets in der hinteren Region des Hinterleibes (Abdomens) ventral von der Rectalampulle, zwischen Anus und den Geschlechtsorganen. Sie ist ein ziemlich komplizierter Apparat (MEINERT, Forel), an dem man unterscheidet:[S. 509] die eigentliche, das ameisensäurehaltige Gift sezernierende Drüse, das Sammelreservoir (die Giftblase), den ausführenden Abschnitt (mit oder — bei Formica — ohne Stachel) und die accessorische oder Nebendrüse, welche ein anderes öliges Sekret bildet. Die «Giftblasen mit Polster» (Fig. 166 A) finden sich bei den Formiciden, die «Giftblasen mit Knopf» (Fig. 166 B) bei den Myrmiciden (FOREL). Bei beiden Typen zeigt die Giftdrüse einen tubulösen Bau und besteht aus Röhren, deren Wände aus Drüsenzellen gebildet werden. Der das Polster bildende Teil, der die dorsale Decke der Giftblase darstellt, besteht aus einem (z. B. bei Camponotus, dessen Polster nur 2 mm lang ist) bis 20 cm langen, in unzähligen Windungen zusammengelegten Schlauche. Bei den Formiciden, denen der Stachel fehlt, ist der Ausführungskanal breit (Fig. 166 A) und mündet, frei, ohne Stachel, in die Kloake, bei den Myrmiciden ist er schmal und steht mit dem Stachel in Verbindung. Der Giftapparat ist die Hauptverteidigungswaffe der Ameisen. Die stachelfreien Formiciden beißen mit ihren Mandibeln eine Wunde und spritzen in diese das Gift oder senden, wenn sie den Feind nicht erreichen können, das Gift, durch die Bauchpresse ejakuliert (FOREL), ihm entgegen. Stört man einen Haufen von Formica rufa und pratensis, so ergießt sich ein meterweit reichender Sprühregen, der auf der Haut eine leichtere Entzündung hervorruft, wie die Bißwunden. Das Gift ist für die Ameise selbst schädlich und ein von anderen Drüsen sezerniertes alkalisches Sekret dient zu seiner Neutralisation (JANET) — die Ameisenhaufen reagieren alkalisch. Die Analdrüsen sezernieren stark riechende Substanzen (FOREL).
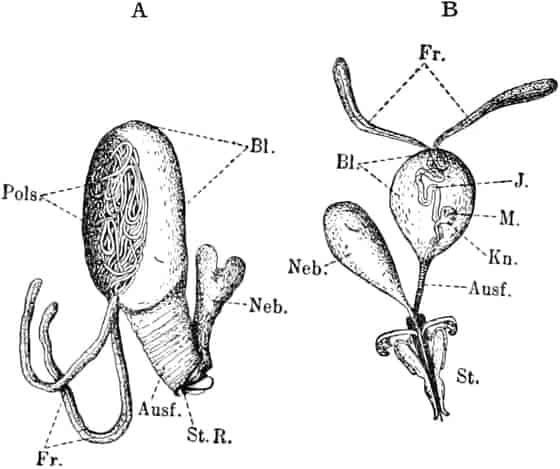
Giftapparat A von Formica rufibarbis ☿; B von Myrmica laevinodis ☿; Ausf. Ausführgang des Giftapparates, Bl. Sammelblase, Fr. freies Ende der Drüse, J. in die Blasenintima eingeschlossener Teil des Drüsenschlauches, Kn. «Knopf», M. Mündung der Drüse in das Blasenlumen, Neb. Nebendrüse, Pols. «Polster», St. Stachel, St. R. Stachelrudiment.
[Aus Escherich, Die Ameise.]
Die Natur des Ameisengiftes ist unbekannt. Es enthält bei den Camponotinen (Formica rufa und pratensis) jedenfalls Ameisensäure. Aber ich bin der Ansicht, daß auch hier, wie bei der Nessel, ein Enzym und nicht nur die Ameisensäure das die Entzündung erzeugende Agens ist. Auch FÜRTH macht nicht die Ameisensäure für die eigentliche Wirkung verantwortlich. Die Giftblasen mit Knopf enthalten ein anderes Sekret (FOREL), das sich z. B. bei Myrmica rubida mit Alkohol trübt. Die Ameisen enthalten außer der Ameisensäure noch einen Riechstoff (1% «ätherisches Öl», NEUMANN, MARGGRAF, JOHN), Fett (MARGGRAF) und Eiweiß, angeblich auch Weinsäure (? HERMBSTÄDT) und Apfelsäure (? PFAFF), sowie «Gallerte», so daß eine (1,25% H.COOH (D. A. V.) enthaltende) Auflösung von Ameisensäure in Spiritus, die meist jetzt als Spir. formicae (Ameisengeist, Esprit de fourmis, Spirito di formica) bezeichnet wird, nicht als gleichwertig mit einem weingeistigen Auszug oder Destillat frisch gesammelter Ameisen betrachtet werden kann.
Die Ameisen werden in der Weise gesammelt, daß man an einem heißen sonnigen Tage im Juni oder Juli eine oben mit Honig bestrichene Medizinflasche bis zur Mündung in einen Ameisenhaufen eingräbt. Die Ameisen kriechen, angelockt vom Honig, in die Flasche, aus der sie nicht wieder herauszukommen vermögen.
Auch die in hohlen Bäumen vorkommende schlankere, bräunlich-schwarze Formica nigra L. kann eventuell zur Ameisenspiritusbereitung herangezogen werden.
[S. 510]
Sowohl das durch Destillation der Ameisen mit Spiritus dargestellte Eau de magnanimité, sowie das Ameisenöl (huile de Fourmis) sind jetzt nur noch Volksmittel.
Die Säure der Ameisen war schon Ende des XV. Jahrh. durch Röten der in den Ameisenhaufen gefallenen Cichorienblätter erkannt worden (PFAFF), wurde 1670 von SAM. FISCHER durch Destillation der Ameisen mit Wasser dargestellt und von WRAY schon in ziemlich starker Konzentration erhalten, und darauf zuerst von P. G. SPERLING, dann von NEUMANN studiert, der auch das ätherische Öl (Ol. essentiale aethereum) in den Ameisen auffand. MARGGRAF erkannte 1749 die Eigenart der Ameisensäure und auch SUERSEN stellte die besondere Natur der Ameisensäure des «eintzigen demonstrativen Acidum animale», wie NEUMANN sagt, fest, die FOURCROY und VAUQUELIN für eine Verbindung der Apfelsäure mit Essigsäure erklärt hatten. PFAFF glaubte, daß sie bei der Oxydation mit HNO3 Essigsäure liefert (es entsteht aber hierbei Oxalsäure) und DUMAS, PELIGOT und STAS zeigten, daß sie bei Oxydation von Holzgeist entsteht. Schon BRUNSCHWYG stellte (1500) ein Destillat aus Ameisen her, doch findet sich Spir. Formicarum erst in Arzneitaxen aus der Mitte des XVII. Jahrh. (FLÜCKIGER).
Lit. ESCHERICH, Die Ameise. Braunschweig 1906 (mit vielen morphol. und anat. Abbild. u. Literaturnachweisen). — FÜRTH, Vergl. chem. Physiol. d. nied. Tiere. Jena 1903. — Über die Giftdrüse vgl. MEINERT, Bidrag til de danske Myrers Naturhistor. Kjobenhavn. Kogl. Videnk. Selsk. Skrift 1860 und FOREL, Les fourmis de la Suisse, Denkschr. d. Schw. Naturf. Ges. 1874 und d. Giftapparat u. d. Analdrüs. d. Ameisen. Zeitschr. f. wissensch. Zoolog. 30 (Suppl.) 1878, 28 (mit vorzügl. Abbild.). — Über den Verschluß der Giftdrüse und die Ausspritzung des Giftes vgl. JANET, Etudes sur les fourmis No. 18. Paris 1898. — CH. JANET, Les fourmis Soc. zoolog. de France 1896. — JANET, Essai sur la constitut. morph. d. l. tête de l’insecte. Paris 1899, hier und bei ESCHERICH ein guter Längsdurchschnitt durch eine Ameise. — SPERLING, Dissert. de chymica formicarum analysi. Viteb. 1689. — NEUMANN, Chymia medica 1753 III, 38 (dort die älteste Lit.). — GEOFFROY, Mat. méd. — MARGGRAF, Schriften I, 340. — HERMBSTÄDT, Chem. Vers. mit Ameisen. Phys. chem. Vers. II, 1. — FOURCROY-VAUQUELIN, Gehl. Allg. Journ. Chem. II, 42. — SUERSEN, Ebenda IV, 3. — PFAFF, System d. Mat. med. 1815, 5, 252 (dort weitere Lit.). — DUMAS-PELIGOT, Lieb. Ann. 15, 7. — DUMAS-STAS, Ebenda 35, 137. — BERG-GARCKE, Pharmakogn. 1879, 613. — VOGL, Kommentar. — FLÜCKIGER a. a. O.
II.
Von den weiteren Säuren ist die Essigsäure ebenso weit verbreitet wie Ameisensäure (Vgl. BERGMANN a. a. O.) und begleitet diese oft. Als Ester findet sie sich auch in Sekreten. Propionsäure ist selten. Sie findet sich z. B. in den Blüten von Achillea Millefolium (KRAEMER), in den Früchten von Gingko (BÉCHAMP) und in Amanita Muscarius (BORNTRÄGER). Sie tritt oft bei der Oxydation und der trockenen Destillation organischer Substanzen, als Spaltungsprodukt längerer Kohlenstoffketten auf, und findet sich daher z. B. im Holzessig. n-Buttersäure ist in den Früchten von Sapindus und Tamarindus (GORUP) und in Tanacetum, verestert in Sekreten, z. B. in Pastinaca und Heracleum gefunden worden. (Zusammenstellung in HUSEMANN-HILGER, Pflanzenstoffe.) Die Butter enthält 2% n-buttersaures Glycerin. Isobuttersäure findet sich in den Früchten von Ceratonia (S. 144), der Rhiz. Arnicae (SIEGEL) und verestert im Römisch Kamillenöl (KÖBIG).
III. Baldriansäuredrogen.
Die Normal-Valeriansäure ist selten, die Isovaleriansäure (Isopropylessigsäure, 3-Methylbutansäure):
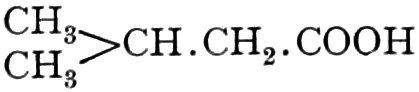
dagegen sowohl in Rhiz. valerianae, wie in Angelica Archangelica (MEYER, ZENNER), der Rinde von Viburnum Opulus und im Delphintran (CHEVREUL) gefunden worden.
[S. 511]
Rhizoma Valerianae.
Syn. Rad. valerianae minoris, montanae s. silvestris, Phu minus, Baldrianwurzel, Marien-, Magdalenen-, Mond-, Augen-, Wend-, Speik- oder Katzenwurzel, Speer-, Brach-, Hexen- oder Katzenkraut, Ballerjan, Balderbracken, Polter Johann, Tollerjahn, Dreefoot, Benediktiner-, St. Georgen- oder Gürgen-Kraut, — in der Schweiz: dammarge, tannmark, menten, katzenbuckel, risch tamara (in Graubündten) — valériane sauvage, souche de valériane officinale, herbe aux chats, guérit tous (franz.) — common valerian, vandal root, all-heal (engl.) — valeriana silvestre s. minore (ital.) — valeriaan, faldriaan, koortswortel (= Fieberwurzel) (holl.) — vandelrot, velamsrot, velandrot (schwed.) — vendelród, venderód, vendingsrod (norw.) — velandsurt, danmarks graes (dän.) — semlänoi ladan (russ.) — virma juuri (fin.) — macska gy˝kőnke (ung.) — νάρδος (griech.). — In Indien: kálávála, jalalakan.
Bei PLINIUS und DIOSKURIDES und auch bei IBN BAITHAR und ALHERVI: Fû oder Phu — althd.: baldrian, denmarka — mhd.: valdran, waldrian, tenemarg, abpiss, waldrion — nd.: bolderian, bullerjahn, balderjan, ballerjaon, balderjân, valeraen. In der Alphita, Circa instans, bei SERAPION, in den Tabulae und den Synonomae Bartholomei (I, S. 640) finden sich die Bezeichnungen: Valeriana, Ualariane, Fu, Amantilla (so noch jetzt in Italien), Fistra, Vau, maturella, matrella, matura, matha. Im Mittelalter wurden die Namen Nard, Spiek, Seliank, Saliunk (bes. für Val. celtica benutzt), Theriakskraut, Katzentheriak auch auf Val. off. übertragen und auch die Bezeichnungen marinella, marcinella, marconella, valentina herba benedicta, s. genicularis antilla, agriomela, serpyllum majus, herba gate, dania major, ballariana, maturesia, nancilla benutzt (BRUNSCHWYG). Bei der HILDEGARD: denemarcha — im Ortus sanitatis: boldrian, — bei BRUNSCHWYG: denemarcha, danmarks graes. — bei BOCK, FUCHS: balderian, baldrian, baldrion, denmarck, Augenwurzel, Katzenkraut, Wendwurzel, bei TABERNAEMONTANUS: dania major, großes Dönnmarck.
Etym. GRASSMANN deutet Baldrian etwas abenteuerlich als Balder Johann(es), bringt (wie PERGER und GÜNTHER) die ersten Silben mit dem Gotte Balder, dem Sohn Odins und der Frigga, in Verbindung (baldrs-brâ ist aber Anthemis Cotula) und betrachtet die zweite als «christliches» Anhängsel (?). (Die Balders Feuertod zu Ehren brennenden Sonnwendfeuer wurden später Johannisfeuer). Ob der Ausdruck Wend- oder Wendelwurz auf die Sonnwende deutet (PRUCKMAYR), bleibe dahingestellt. Balder war der «wohlwollende» Gott. Auch die nordische Bezeichnung für Baldrian: velands urt (= Wielandswurz) deutet vielleicht auf die Heilkraft, da Wieland nicht nur der Götterschmied, sondern auch der Götterarzt war. JAC. GRIMM verwirft die Ableitung des Wortes Baldrian von Balder. SCHRADER denkt an Verstümmelung und Umdeutung aus velandsurt. Ich habe (I, S. 1058) der mir jetzt unwahrscheinlich erscheinenden Ansicht von SÖHNS und MARTIN beigepflichtet, daß Valeriana zu Ehren des PLINIUS VALERIANUS (nicht des Kaisers VALERIAN) benannt worden sei, eines römischen Arztes, dessen apokryphe Pflanzenbeschreibung aber wohl ein Werk der Mönche des Mittelalters ist und die sicher richtige Ansicht vertreten, daß umgekehrt Baldrian aus Valeriana umgebildet worden sei (b und v wechseln häufig, das d könnte aus Gründen des Wohllautes eingeschoben sein, KANNGIESSER). Immerhin könnte man auch an Beziehungen von Valeriana zu valere (= gesunden, sich wohl befinden) denken (WEIGAND, WITTSTEIN). So sagt bereits CASPAR BAUHIN: «Officinis et herbariis Valeriana dicitur a multis quibus valet virtutibus». Auf die starke Heilwirkung bezieht sich ja auch die serbische Bezeichnung Odaljan (von odoljeti = überwältigen) — böhmisch: Odolen — und das polnische dolega (doleka = Gewalt) sowie einige französische und englische Namen (s. oben). Da der Name Valeriana, den SCHRADER kaum als echte romanische Bildung anerkennen will, zum ersten Male in einer lateinischen Übersetzung einer arabischen Schrift (der des ISAAC JUDAEUS) vorkommt, halte ich eine Ableitung aus dem Arabischen für möglich. SEYBOLD pflichtet dem bei und schreibt mir (1911), daß er Valeriana als umgebildet aus (Sun)bal berr(ān)ī (sunbal berrī oder berrānī = wilde Narde) glaube ansehen zu sollen. Das erscheint auch mir plausibel. — Daß die alte, schon bei der HILDEGARD auftretende Bezeichnung denemarcha auf Dänemark zu beziehen ist (danmarks graes), wie SCHRADER meint, ist unwahrscheinlich.[S. 512] HARTWICH denkt an tamm-mark, d. h. zahme, kultivierte Mark. Mark ist der Name für das ähnliche Sium latifolium (s. Verwechslungen) und Tamme findet sich oft (Tamme morren = Daucus Carota, Tammschlee = Prunus insititia, weitere bei PRITZEL-JESSEN) bei kultivierten Pflanzen. (In einer Frankfurter Handschrift aus dem XII. Jahrh. steht neben tenemarg: samsucus.) PRUCKMAYR deutet (recht abenteuerlich) — Dennmark als Tinn-mark (= Becher-Mahr, Napf-Mahr oder Saufteufel), da Mittel gegen das Delirium (?). Der Name, in vielen Formen vorhanden (s. oben) und bis auf unsere Tage, z. B. im Berner Oberland, erhalten, gehört zweifellos zu Valeriana, obwohl in der Synonoma (I, S. 639) an einer Stelle ein Petroselinum macedonicum auch «stanmarche» genannt wird. — Die Namen Katzenkraut, Katzenwurz usw. deuten auf die Idiosynkrasie der Katzen für den Baldrian, die durch das Kraut und die Wurzel geradezu in Verzückung geraten, der Ausdruck Ratzenwurzel, daß B. auch ein Mittel gegen Ratten und Mäuse ist (Ortus sanitatis).
Lit. PRUCKMAYR, Deutsch. Pflanzennam. Valeriana. Zeitschr. d. Öster. Apoth. Ver. 1880, 469. — GRASSMANN, Deutsche Pflanzennamen 1870. — Söhns, Unsere Pflanzen 1897. — HARTWICH, Schweiz. Wochenschr. 1896, 494. — PRITZEL-JESSEN, Volksnamen d. Pflanz. — PERGER, Deutsche Pflanzensagen 1864. — KANNGIESSER, Etymol. d. Phanerog. Pflanzennomenklatur. — JAC. GRIMM, Deutsche Mythologie. — FLÜCKIGER, Pharmakogn. — SCHRADER, Reallexikon.
Stammpflanze und systemat. Stellung. Valeriana officinalis L. Flor. suec. 34. Spec. plant. ed. I, 31. — Valerianaceae (Sect. Euvaleriana). Die Gattung Valeriana hat etwa 100 Arten.
Ändert nach der Länge der Ausläufer und den Blättern ab: V. angustifol. TAUSCH (= var. β minor KOCH) in Japan: kesso oder kanokosô, in trockenen Wäldern und auf Hügeln, schmälere, oft ganzrandige Fiedern, stärker behaart, kleinere, gedrängte Blütenstände; Var. α major mit starkem Stengel und tief gezähnten Fiedern; V. exaltata MIKAN, keine Ausläufer; Blättchen breit, ei-lanzettlich, wird bis 2 m hoch; V. excelsa (V. sambucifolia MIK.) in Frankreich, lange Ausläufer, wenig (4–5)jochige Blätter, die unteren Blätter grob gesägt. V. Mykani SYME mit breiten grobgezähnten Fiedern (in England) (Taf. XII); V. latifolia (in Japan), V. Dioskuridis (im Orient), V. capensis, V. dubia, V. javanica usw., die bald als Varietäten, bald als Arten betrachtet und dann als Ser. 3 V. offic. mit 12–14 Arten zusammengefaßt werden (HÖCK). Es sind mindestens 10, zum Teil auch habituell recht gut charakterisierte und daher als Arten beschriebene Varietäten unterschieden worden. Die Variabilität ist sehr groß (IRMISCH). DUFRESNE unterscheidet vier deutsche Varietäten: V. excelsa, V. latifolia (s. media), V. tenuifolia (von der er die Formen V. officinalis und pratensis unterscheidet) und V. lucida. Früher wurde nach den Standorten der Bergbaldrian (silvestris) vom Sumpfbaldrian (palustris) unterschieden. Bei der Ser. V. officinalis zeigen fast alle Arten eine so nahe Beziehung zu der Spezies, nach welcher diese Gruppe benannt ist, daß Höck eine direkte Abstammung von dieser Art annehmen möchte.
HÖCK stellt zur Ser. (3) V. officinalis: V. petrophila (Südwestkleinasien und Armenien), V. ficariaefolia (Persien), V. heterophylla (Sibirien), V. Stracheyi (Himalaya), V. sambucifolia (Skandinavien, England, Pyrenäen, Schlesien, Karpathen, Rußland, Serbien), V. officinalis, V. capensis (Kapland), V. sisymbrifolia (Persien, Kleinasien), V. Dioscoridis (Kleinasien, Griechenland), V. Arnottiana (Khasiaberge), V. Hardwickii (Himalaya), V. javanica (Java), V. Hookeriana (Himalaya), V. Moonii (Ceylon), V. Jaeschkei (Himalaya).

(Stafford Allen and Sons Ltd., Manufacturers of Pharmaceutical products Long Melford, Suffolk phot.)
Beschreibung der Stammpflanze. V. offic. ist ein ausdauerndes Kraut, das sich durch Ausläufer erneuert. Aus dem 2–3 cm dicken basalen Teile des Stengels, der den Charakter eines rhizomartigen Speichersprosses besitzt (Zentralwurzelstock) entspringen 5–15 cm lange und 2–3 mm dicke, mit 2–3 schuppenförmigen Niederblättern besetzte Wandersprosse (Nebenwurzelstöcke), die an der Spitze speichersproßartig anschwellen und aus deren Knospe ein neuer Stengel sich entwickelt, der aber erst im folgenden Jahre zur Blüte kommt. Der angeschwollene Teil des Nebenwurzelstockes wird später zum Zentralwurzelstock und entsendet dann wieder Wandersprosse. Zuweilen unterbleibt die Bildung von Wandersprossen und die neuen Achsen «entstehen unmittelbar in der Achse der Grundblätter des Mutterstockes». Die Bewurzelung erfolgt an den Speichersprossen. Der bis 1,2 m und darüber hohe Stengel ist aufrecht, stielrund, gefurcht, hohl, kahl, an den Blattansätzen zottig. Die Blätter bilden dekussierte, mit der stengelumfassenden Scheide paarweis miteinander verschmolzene Blattpaare, sie sind unpaarig gefiedert, 5–16jochig, die grundständigen langgestielt, die oberen sitzend, kahl, an den Scheidenrändern zottig, Fiederblättchen gegenständig oder abwechselnd, lanzettlich spitz, mehr oder weniger an der Spindel herablaufend, gesägt oder fast ganzrandig, das oberste Paar mit dem Endblättchen verschmolzen. Es gibt breit- und schmalblätterige Formen (s. oben S. 512). Die endständigen oder in den Achseln der Blätter entspringenden trugdoldigen, meist vielblütigen Infloreszenzen bilden eine dekussierte Rispe, deren oberste Äste zu Dichasien werden, die in Wickel auslaufen. Die hermaphroditen, c. 4–5 mm langen, weißen oder fleischroten, von zwei Vorblättern behüllten Blüten besitzen einen unterständigen, glatten, bis 2 mm langen, oblongen, einfächerigen Fruchtknoten mit einem hängenden anatropen Ovulum, einen aus zehn pappusartigen, linealen, zur Blütezeit eingerollten Blättchen bestehenden Kelch, eine 3–4 mm lange, zygomorphe, ungleich-fünflappige, trichterförmige Corolle, die am Grunde mit einem kurz-spornartigen Nectarium versehen ist, drei der Corolle inserierte Stamina (das obere und linke untere sind abortiert) und einen Griffel mit drei spreizenden Narben. Bei dem sog. männlichen Zustande der Blüte ragen die Stamina weit aus der Blüte hervor, beim sog. weiblichen sind sie zurückgekrümmt und der Griffel überragt die Blumenkrone. Die Gattung Valeriana zeigt deutlichen Übergang von Proterandrie zur Diclinie. Die c. 5 mm lange, einsamige Frucht ist eine Achaene, sie ist von dem großen fiederhaarigen, als Flugapparat dienenden Pappus gekrönt und besitzt einen Rücken-, zwei Seiten- und drei Bauchnerven. Der Same ist endospermfrei.
Der Baldrian ist vom arktischen Rußland an durch fast ganz Europa verbreitet, nur im Süden ist er spärlicher und fehlt in Portugal, Süd-Spanien, Südost-Frankreich. Er findet sich ferner in der Krim, Kleinasien (die Form V. Dioskoridis SIBTH. von Vorderasien bis zur Balkanhalbinsel), in Kaukasien und Türkisch-Armenien, Nord-Kaschmir, Süd-Sibirien, Mandschurei, Japan (hier besonders die var. angustifol.) In Indien findet sich die Form V. dubia BUNGE, in Java die Form V. javanica BL. (in den Gebirgen des Monsungebietes etwa sechs Formen oder Arten). Eingeführt ist er in Südafrika (V. Capensis THBG. ist = V. offic. var.) und Nordamerika, z. B. in New-York, New-Jersey (var. silvatica?).
Die Pflanze findet sich auf feuchten Wiesen, an Gräben, Bächen, Flußufern, Waldrändern, sowohl in den Niederungen wie den Bergregionen. Die Bergformen pflegen aromatischer zu sein als die Sumpfformen.
Blüht in Deutschland im Juni und Juli (bis August).
Lit. FERNANDO Höck, Beitr. z. Morphol., Gruppier. u. geograph. Verbreit. d. Valerianaceen. Englers Bot. Jahrb. 3 (1882) 1 (hier die Lit.). — EICHLER, Blütendiagramme. — Entwicklungsgesch. d. Blüte in WINNICKI, Diss. Bern 1908. — LUERSSEN, Med. pharm. Bot. (dort die system. Lit. der Familie). — HENKEL, U. S. Dep. Agric. 1906. — TIMBAL-LAGRAVE, Jahresb. Pharm. 1867, 50. — IRMISCH, Beitr. z. Naturgesch. d. einheim. Valeriana-Arten, insbes. V. offic. u. dioica. Abh. Naturf. Ges. Halle 1853 mit 4 Taf. (Morphol. auch d. Rhizome). — CHATIN (s. unter Anat.). — TCHIHATCHEFF, Asie mineure 1856. — REGEL, Tent. flor. ussuriens. Mem. Ac. St. Petersb. 1862. — HERDER, Bull. Soc. imp. Nat. Moscou 1864, I, 229. — BEEBY, Journ. Bot. 1888. — Abbild.: HAYNE, Arzneigew. III, 32. — NEES VON ESENBECK, t. 254. — BERG-SCHMIDT, Atlas, II. Aufl. t. 10. — PABST-KÖHLER, Medizinalpfl. I, t. 47. — BENTLEY-TRIMEN,[S. 514] Medic. pl. t. 146. — SYME, Bot. t. 666 und in zahlreichen Floren usw. Schon in DODONAEUS, Purgant., eine gute Abbild. d. Ausläufer. Die Abbild. bei GUIBOURT ist V. sambucifolia (TIMBAL-LAGRAVE).
Pathologie. Über die pflanzlichen Schädlinge teilt Prof. E. FISCHER folgendes mit: Auf den oberirdischen Teilen von Valeriana officinalis sind verschiedene parasitische Pilze beobachtet, unter denen wir besonders Erysiphe Cichoracearum (DC.) und Uromyces Valerianae (SCHUM.) WINT. erwähnen; doch dürften dieselben, wenn sie sich nicht sehr intensiv entwickeln, die Entwicklung der Rhizome kaum beeinträchtigen.
ISRAËL berichtet über die tierischen Schädlinge:
Falter: Melitaea dictynna ESP. Raupe an Plantagoarten, Melampyrum pratense, Valeriana officinalis, Valerianella olitoria usw. Gortyna flavago HB. Raupe in den Stengeln vieler markhaltiger Pflanzen, z. B. Senecio, Valeriana, Petasites, Lappa, Verbascum, Sambucus. Caradrina quadrimaculata F. Raupe an Stellaria, Alsine, Valeriana, Fumaria usw. Eupithecia valerianata HB. Räupchen an Blüten und Früchten von Baldriangewächsen. Sonst leben die meist sehr kleinen Raupen der Eupithecien meist in den Dolden der Umbelliferen, Blüten und Früchte verzehrend. Schistodepressaria pulcherimella STT. Das Räupchen dieser Gelechidee rollt die Blätter von Umbelliferen und Baldrian zusammen.
Gradflügler: Thrips (spec?). Auf Baldrianblüten und anderen Gewächsen (Helleborus, Eupatorium) trifft man oft ein und dieselbe kleine Physapode.
Kultur und Erntebereitung. Baldrian wird in Deutschland in Sachsen (Bockau, Lauter, Zschorlau), Franken (Schweinfurt), Harz (Pansfelde, Aschersleben, Ermsleben, Ballenstedt), Thüringen (Cölleda, Heldrungen, Ringleben, Neuhausen, Gebesee) [— weitere Orte I, S. 64 —], in Holland, Frankreich (Houdan), Belgien (Hennegau, I, S. 69), Ungarn (I, S. 68), Schweden (seit 1761) und in England (z. B. bei Chesterfield in Derbyshire) gebaut. HANBURY nennt 1872 die Orte: Ashover, Wolley Moor, Morton, Stretton, Higham, Shirland, Pilsley, North und South Wingfield, Brackenfield, gegenwärtig sind die Kulturen beschränkter und finden sich namentlich bei letzterem Orte am River Amber (N. SMITH) und in den Long Melfort Medicinal Herb Farms in Suffolk (Taf. XII). Baldrian wird auch in den Vereinigten Staaten (New York, New Hampshire, Vermont) und in Japan kultiviert. Versuchskulturen befanden sich 1904 in Washington. Die Fortpflanzung wird durch die Schößlinge (nicht durch Samen) besorgt.
Von der wildwachsenden Pflanze wird die Baldrianwurzel besonders in Gebirgsgegenden [Thüringen, Harz, Ardennen, Vogesen (Dep. Vosges und Ardennes), Schweiz, Österreich] gesammelt, da die Pflanze auf trockenem, steinigem Boden ölreicher ist. Doch ist im deutschen Großdrogenhandel zurzeit vorwiegend kultivierter Baldrian.
1910 unterschied der deutsche Handel: Harzer, Thüringische, Belgische und Holländische Rhiz. valerian. Die mit vielen Nebenwurzeln besetzte, mehr gelbliche Rad. Valerianae montanae Hercynica, besonders die kleinzöpfige, echte Gebirgsware von der wilden Pflanze, wird meist der Rad. valer. min. Thuringica cultivata, und selbst der nachgekämmten und der großzöpfigen kultivierten Harzer V. vorgezogen (CAESAR-LORETZ 1910). Am geringsten bewertet wird die R. val. minor. citrina aus Belgien und Frankreich.
Der eigenartige Geruch tritt erst beim Trocknen stärker hervor, frische Wurzel riecht wenig und anders als die Droge (s. unten S. 520). Es unterliegt keinem Zweifel, daß gerade beim Baldrian während des Trocknens auch bei gewöhnlicher Temperatur, besonders aber bei etwas höherer, in den absterbenden Zellen, solange noch Wasser vorhanden ist, tiefgreifende Veränderungen durch die Enzyme hervorgerufen werden.[S. 515] CHOAY hat daher vorgeschlagen, bei 0° im Vakuum zu trocknen. Das ist nicht nötig, wenn das Enzym (wie BOURQUELOT vorschlägt) durch Erhitzen der frischen Pflanze abgetötet wird (s. hinten). Die getrocknete Droge verändert sich weiter nicht, wenn sie trocken aufbewahrt wird.
Die Kultur erfolgt in England in der Weise, daß man die Tochterknollen wilder Valeriana — man benutzt besonders Valer. Mikani SYME (s. oben S. 512) — als Stecklinge benutzt. Die Blütenanlagen der sich entwickelnden Pflanzen werden abgeschnitten. Man läßt nur die tieferliegenden Blätter stehen. Im September bis Oktober wird die ganze Pflanze ausgegraben, Stengel und Blätter beseitigt, die dickeren Rhizome längs durchschnitten, und alle in mit Löchern versehenen Kästen in fließendem Wasser gewaschen. Das Trocknen erfolgt auf Brettern in der Wärme im November und Dezember. Trockenheit schädigt die Kulturen. Es entwickeln sich dann nur wenige Blätter. In Cölleda werden die vom Zentralknollen losgetrennten Ausläufer gepflanzt (bisweilen in Mischkultur mit Rüben). Nach einem Jahr wird das Rhizom samt den Wurzeln gegraben, gewaschen und meist mit eisernen Kämmen von den feinen Nebenwurzeln befreit («gekämmte» Wurzel) und entweder auf kurzgeschnittenen Wiesen oder, auf Fäden aufgereiht, an der Hauswand getrocknet (A. MEYER 1891). Die Drogenhäuser kämmen dann noch nach (CAESAR-LORETZ). Die Wurzeln werden bisweilen zu Zöpfen geflochten (wie bei Angelica). In Pansfelde a. Harz werden die Ausläufer der wilden Pflanze zum Anbau benutzt.
In Deutschland wird im Herbst (September, Oktober) nach der Blütezeit gegraben, da die Droge dann ölreicher ist als im Frühjahr (ZELLER). SALADIN VON ASCOLI bezeichnet (im Compendium aromatariorum 1488) den August als den günstigsten Monat und auch die alten Kräuterbücher nennen als Sammelzeit «zwischen zwei Unser Lieben Frauen Tagen», d. h. 15. August bis 15. September. Die wendische Volkssitte schreibt den Tag vor Johannis vor (BECKENSTEDT). — Im Frühjahr zu sammeln (wie PFAFF und noch Ph. austr. VIII vorschlägt) empfiehlt sich nicht, da dann Verwechslungen mit am gleichen Standort vorkommenden Pflanzen leicht möglich sind. Es darf die Droge sowohl von der kultivierten wie der wildwachsenden Pflanze gesammelt werden (D. A. V und Ph. helv. IV treffen keine besonderen Bestimmungen). 9–10 Teile frische geben 2–3 Teile trockene Droge. Die Wurzel wird durch das Trocknen dunkler. Das Nachtrocknen erfolgt am besten in der Kalk-Kiste.
Die Jahresproduktion von Harzer Baldrian beträgt 200–400 cwts. (In erster Linie kommt Pansfelde hier in Betracht, CAESAR-LORETZ). Eine gute Thüringer Mittelernte beträgt 800 bis 900 cwts (GEHE). Die Vollernte 1000–2000 cwts (CAESAR-LORETZ). Nach Hamburg kamen belgischer Baldrian 1905: 24500, 1908: 35500 kg, und holländischer B. 1908: 6100 kg (TUNMANN). Frankreich verwendet besonders deutschen B. (L. PLANCHON). In Japan wird Valeriana var. angustifol. MIQ. (nach HOLMES dagegen: V. latifolia) kultiviert. Hamburg empfing 1908: 3700 kg japan. B. (TUNMANN).
Baldrian ist in Blechbüchsen aufzubewahren und schon beim Trocknen auf dem Trockenboden gegen Katzen zu schützen (s. oben S. 512). Der Ortus Sanitatis (I, S. 688) sagt bereits: «Die katzen ryben sich an diß krut und werffen darvider ihren samen, und darumb sol diß krut vervaret werden vor den katzen, da es zu artzney gebrucht sal werden.» Baldrian hat auch für Ratten und — Forellen Anziehungskraft.
Lit. UPSHER SMITH, Cultivat. of valerian rhizome in Derbyshire. Year book ph. 1904, 557. — SCHWABE, Medizinkräuterbau in Thüringen. Pharm. Zeit. 1876 (Handelsbl.) — GEHE, Handelsber. 1885 u. flgd. — TUNMANN, Drogenhandel Hamburgs. Apoth. Zeit. 1910. —[S. 516] FLÜCKIGER-HANBURY, Pharmacographia. — HOVORKA-KRONFELD, Volksmedizin. — BOURQUELOT und HÉRISSEY haben (Journ. pharm. 1911) einen Apparat konstruiert, frische Pflanzen mit siedendem Alkohol zu sterilisieren.
Valeriana officinalis L.
1. Centralknollen (I) mit den Nebenknollen (II) durch Ausläufer (ws) verbunden. 2. Querschnitt durch den Centralknollen. 3. Querschnitt durch einen Nebenknollen.
[Tschirch-Oesterle, Atlas.]
Valeriana officinalis.
Längsschnitt durch einen Nebenknollen, unten der Rest des Ausläufers (Wandersprosses).
[Tschirch-Oesterle, Atlas.]
Morphologie der Droge. Die unterirdischen Organe des Baldrian werden bald als Rhizoma (Ph. helv. IV), bald als Radix (D. A. B. V) bezeichnet. Die richtigste Bezeichnung wäre «Rhizoma cum radicibus», denn die Droge besteht aus dem mit Wurzeln (und Ausläufern) besetzten Rhizome oder «Knollstock» (BERG), der oben noch meist durch Stengel- und Blattreste beschopft ist. «Das Rhizom zerfällt in eine dünne ausläuferartige Wandersproßregion und in eine diese oben abschließende knollige Speichersproßregion. Die erstere vermittelt die Verbreitung des Rhizoms im Boden. Im typischen Falle figuriert ein Speichersproß, dessen zugehörige basale Wandersproßregion abgestorben ist als Zentralknollen oder Zentralwurzelstock (Fig. 167). Wie die Keimungsgeschichte lehrt, geht der Zentralknollen aus dem Hypocotyl hervor (TSCHIRCH und DYE). Derselbe entsendet nach verschiedenen Seiten Ausläufer und diese Wandersprosse verdicken sich alsdann an ihrer Spitze knollenartig, auf diese Weise Nebenknollen oder Nebenwurzelstöcke bildend, die alsdann ihrerseits wieder Ausläufer entsenden» (TSCHIRCH). Die Speichersprosse sind reich bewurzelt. Die Wandersprosse tragen bisweilen an den Knoten einige Wurzeln. Die Droge enthält also sowohl dicke Zentral- wie dünnere Nebenwurzelstöcke. Beide stehen vertikal im Boden und sind im Innern gekammert (Fig. 168). Die Kammern entsprechen den[S. 517] Internodien. Die Zentralknollen sind oft mehrere Zentimeter dick, außen durch die Blattreste geringelt, oben mit dem Knospenrest, unten mit der Wandersproßnarbe versehen, die Nebenknollen sind dünner und tragen an der Spitze mehr oder weniger lange Blatt- und Stengelreste, unten gehen sie in die Wandersproßregion über, die wie ein echter Ausläufer, überall gleich dick und an den Knoten mit Niederblättern und Wurzeln besetzt ist. Die mit zahlreichen feinen Nebenwurzeln besetzten Wurzeln werden bis 30 cm lang und sind meist etwa 2–3 mm dick, frisch — wie die Wurzelstöcke — hell, nach dem Trocknen graubraun, außen etwas geschrumpft und sehr brüchig, die einen (Ernährungswurzeln, TSCHIRCH) nach dem Aufweichen weich und biegsam, die anderen (Befestigungswurzeln, TSCHIRCH) starr und fest. Der Baldrian zeigt also Heterorhizie (hier 1905 von mir zuerst nachgewiesen). Die kräftiger riechenden kleineren Wurzelstöcke der Gebirgsdroge wurden früher als Rad. valerian. montana s. anglica unterschieden. Die kultivierte Droge pflegt reicher bewurzelt zu sein als die wilde.
Baldrian schmeckt eigenartig süßlich-gewürzhaft und bitterlich.
Anatomie. Das Lupenbild des Rhizomquerschnittes ist unregelmäßig im Umriß (Fig. 167, 2 u. 3), das Cambium erscheint als dunkle, unregelmäßige Linie, vom unregelmäßigen Gefäßbündelring treten Bündel in die Wurzeln. Die meisten Wurzeln (s. unten) besitzen einen sehr schmalen runden Zentralzylinder, der im Querschnitt kleiner ist als die oft 3–4mal dickere Rinde (Fig. 169, 1).
Valeriana officinalis.
1. Querschnitt durch eine Ernährungswurzel. 2. Querschnitt durch eine Befestigungswurzel von etwa gleichem Durchmesser, c. 2,5 mm.
[Neuber phot.]
Die Speichersproßregion (Zentral- und Nebenknollen) trägt außen Kork, dann folgt eine Stärke (Körner bis 8 mik., HARTWICH) führende dünnwandige Rinde, deren Zellen bisweilen Tüpfelung zeigen, und endlich die verkorkte Endodermis, die von unverkorkten Zellen unterbrochen und bei älteren Knollen bisweilen durch Sklereïden verstärkt ist. Innerhalb derselben liegt der Gefäßbündelzylinder, der bei den Nebenknollen aus einem, bei den Hauptknollen oft aus zwei Kreisen von kollateralen Bündeln besteht, die bei letzteren im Gefäßteil oft Libriform, sonst nur unregelmäßig radial angeordnete Spiral- und Tüpfelgefäße und Holzparenchym führen. Zwischen dem Siebteil und der Endodermis liegt oft ein breiter Collenchymbeleg. Von dem Gefäßbündelzylinder treten viele Bündel in die Ausläufer und Wurzeln.[S. 518] Seine Elemente werden dadurch und durch eine Stauchung des ganzen Organs verbogen, im Längsverlauf unregelmäßig. Das ebenfalls Stärke führende parenchymatische Mark ist in ziemlich regelmäßigen Abständen geschwunden, so daß Kammern entstehen (Fig. 168). In den stehenbleibenden Diaphragmen (Marklamellen) finden sich reichlich sehr stark verdickte Sklereïden. Die Diaphragmen entsprechen den Knoten, die Kammern den Internodien.
Die ausläuferartige, im Querschnitt kreisrunde, nur wenige Millimeter dicke Wandersproßregion zeigt einen ähnlichen Bau, nur ist das Mark viel schmäler und nicht geschwunden, die Internodien sind länger, aber an den Knoten liegen auch hier Sklereïden führende Querbrücken. Der Gefäßbündelkreis ist durch interfaszikulares Libriform geschlossen. Der Gefäßteil führt Spiral- und Tüpfelgefäße. Die Hypodermis führt das Öl.
Valeriana officinalis.
Querschnitt durch eine pentarche Ernährungswurzel, bei der eben der primäre Bau in den sekundären übergeht.
[Nach Bonnet.]
Die Wurzeln zeigen stets noch die primäre Rinde, die hier nicht (wie sonst gewöhnlich) abgeworfen wird, lassen also da und dort noch auf der Epidermis Wurzelhaare erkennen. Der Zentralzylinder ist von der stärkefreien Endodermis umgeben. Aus der primären Bündelanlage, die meist triarch ist, aber di- bis octarch sein kann, entwickeln sich zwei ganz verschiedene Wurzeltypen: Ernährungswurzeln (Fig. 169, 1) mit großem, Stärke führendem Mark, kleinen wenig gliederigen, in einen Kreis gestellten, keine mechanischen Elemente führenden Gefäßteilen und Befestigungswurzeln (Fig. 169, 2) mit großem, strahlig gebautem, reichlich Libriform führendem Holzzylinder und kleinem Mark (TSCHIRCH und NEUBER). Bei den Ernährungswurzeln unterbleibt die Bildung sekundären Gefäßteiles entweder ganz oder es entstehen nur wenige Elemente zwischen den primären Anlagen. Alsdann ist der Übergang des primären Baues des Bündels in den sekundären meist noch schön zu sehen (Fig. 170). Die primäre Rinde folgt dem Dickenwachstum des Zentralzylinders. Ihre Zellen sind relativ dickwandig und erfüllt mit einfachen, rundlichen oder zu 2–6 zusammengesetzten bis 30 mik. großen[S. 519] Stärkekörnern. Bei Alkoholmaterial sieht man da und dort Sphaerokristalle. Das unter der verkorkenden Epidermis liegende, ebenfalls verkorkte, einreihige Hypoderm, das die Wurzel also mantelartig umgibt, enthält [neben bisweilen beobachteten prismatischen Kristallen von Kampher (?), VOGL] das ätherische Öl, das durch Schwefelsäure zuerst kirschrot, dann violett und blau wird (ZACHARIAS). Löst man Epidermis und Hypoderm von der Wurzel ab, so ist der Rest geschmacklos (A. MEYER). Das Öl kommt also nur im Hypoderm vor, nicht in Interzellularlücken der Rinde (SCHLEIDEN). ZACHARIAS sah bei den Ölzellen außer der Suberinlamelle eine verholzte und eine Zellulosehaut. Bisweilen ist eine resinogene Schicht, die aus einer Schleimmembran hervorgeht, zu sehen (TSCHIRCH).
Bei längere Zeit in Glycerin liegenden Schnitten beobachtet man überall in Rinde und Mark kleine spießige Kristalle. Erwärmt man den in Wasser liegenden Schnitt und läßt erkalten, so entstehen größere büschelförmige Kristalle.
Valeriana officinalis.
Randpartie einer Wurzel, stärker vergrößert. oez die Öl führende Hypodermis.
[Tschirch-Oesterle, Atlas.]
Das Pulver enthält sowohl die Elemente der Wurzeln wie die der Rhizome, führt daher sowohl Sclereïden wie dünn- und dickwandiges, stärkeführendes Parenchym und dessen Fragmente, Stärkekörner von 3–15 (8–12 KOCH), selten 18 oder 20–30 mik Durchmesser, schmale Ring-, Spiral- und weitere Tüpfelgefäßfragmente (Breite der Gefäße 8–60, die Tüpfelgefäße meist 30–40 mik KOCH) und Libriform mit linksschiefen Spaltentüpfeln. Die Fetzen der Wurzelhaar tragenden Epidermis und der gestreckten Hypodermzellen treten besonders bei Behandlung mit konz. Schwefelsäure hervor. (Verkorkt sind: Endodermis, Hypodermis, Epidermis, Kork). Die mit Stärke gefüllten Parenchymzellen lassen nach Behandlung mit Chloral ein zartes Plasmanetz erkennen. Oxalatkristalle fehlen, dagegen findet man oft Sandkörner und bisweilen Elemente der Stengel und Blattstiele.
Lit. TSCHIRCH-OESTERLE, Anatom. Atlas (dort das Detail). — TSCHIRCH, Heterorhizie bei d. Dikotylen. Flora 1905. Die Einwände von FLASKÄMPER (Flora 1910) gegen die Heterorhizie sind unberechtigt. Die Befestigungswurzeln sind nicht Alterszustände der Ernährungswurzeln. — A. MEYER, Wissensch. Drogenkunde I, 215 (m. Abbild.) u. DAMMERS Lexik. d. Verfälsch. 1887. — VOGL, Kommentar 1908. — BERG, Anatom. Atlas t. 16. — HÉRAIL-BONNET, Manupilat. pl. II. — GODFRIN-NOËL, Atlas man. de l’hist. d. drog. 1887, t. 19 u. 26. — Mikrophotographien in BRAEMER-SUIS, Atlas de photomicrographie 17 u. 18. — KARSTEN-OLTMANNS, Pharmak. Fig. 84–87. — HARTWICH in Hagers Pharm. Praxis. — IRMISCH a. a. O. — HOECK, Beitr. z. Morph. d. Valerianac. Englers Bot. Jahrb. 1882 und a. a. O. — CHATIN, Etudes bot. chim. et méd. sur les Valérianées. Paris 1872 (m. 14 Taf.) (hier auch die Rhizome der übrigen Valerianaarten). — HOLFERT (prim. Bau) Arch. Ph. 1889. — NEUBER, Vgl. Anat. d. Wurz. usw. Dissert. Bern 1904. — ZACHARIAS, Sekretbeh. m. verkorkt. Membr. Bot. Zeit. 1879, 617. — MAISCH (Mexic. Val.) Am. journ. ph. 1886, 168. — Die Keimung und Entwicklungsgeschichte der unterirdischen Organe ist beschrieben in C. A. DYE, Entwicklungsgesch. Unters. d. unterird. Org. von Valeriana usw. Dissert. Bern 1901 (mit zahlr. Abbild.). — Das Pulver: KOCH, Atlas II, t. 24. — MOELLER, Atlas t. 107. — GREENISH-COLLIN, Veget. Powders pl. 119.
Chemie. Baldrianwurzel enthält (nach LINDENBERG 1886) in Prozenten: 11,57 Wasser, 0,36 Fett, 0,9 äther. Öl, 0,31 flüchtige Säure löslich in Äther, 0,85 Harz und Wachs, 0,975 Harz löslich in Alkohol, 1,64 Gerbstoff, 0,565 Citronen- und Weinsäure, 5,32 Zucker, 14,39 andere Substanzen löslich in Wasser, 7,83 Eiweißsubstanzen, 16,7 Metarabin, Phlobaphene usw., 12,87 Stärke, 11,65 Zellulose, 16,8 Lignin u. and., 4,31 Asche.
[S. 520]
Die von PENTZ (1829) und GROTE (1831) im Baldrian aufgefundene, von TROMMSDORFF als besondere Säure erkannte, studierte und benannte Baldriansäure (Valeriansäure, s. oben S. 510), die PENTZ fälschlich für Essigsäure hielt, findet sich in der Droge zu 0,25–1,4% (in frischer Wurzel 0,6%, SCHOONBRODT), teils frei, teils als Kaliumsalz und Borneolester (im Öl, s. unten), begleitet von Apfelsäure (TROMMSDORFF, SCHOONBRODT) und Magnesium, Calcium- und Kaliummalat, sowie von Buttersäure, Ameisensäure (als Calciumformiat), Essigsäure (ASCHOFF) und Methyläthylessigsäure (SHIMOYAMA und HYRANO).
Vollständig kann man die Baldriansäure aus der Wurzel, besonders solcher, die ziemlich frisch ist, nur dann erhalten, wenn man zunächst die Ester (s. unten) mit einer Säure oder Alkali verseift und dann erst mit einer Säure (am besten Phosphorsäure) destilliert. KATZ gründet die Wertbestimmung der Tinctur. valer. auf die Titration der durch Destillation mit Phosphorsäure (nach vorherigem Eindampfen mit Soda) übergetriebenen Baldriansäure. Die aus der Wurzel gewonnene Säure ist das Hydrat C5H10O2.H2O. Sie besteht fast ganz aus optisch inaktiver Isovaleriansäure: (CH3)2CH.CH2.COOH, der kleine Mengen rechtsdrehender Methyl-Äthyl-Essigsäure:
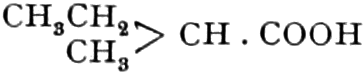
Ameisensäure, Essigsäure und Capronsäure beigemengt sind. Auch in der synthetisch aus Amylalkohol (DUMAS, STAS, CAHOURS) mittelst Chromsäuregemisch (BALARD 1845) dargestellten Säure ist neben Isovaleriansäure etwas Methyl-Äthyl-Essigsäure vorhanden. Die Identität des Ac. valerianic. e radice mit der synthetischen Baldriansäure und der 1817 im Fette der Delphine (besonders Delphinus globiceps) von CHEVREUL entdeckten Acide delphinique ou phocénique stellte DUMAS fest, die Identität der bei der Spaltung des Athamantins entstehenden Säure mit Baldriansäure WINCKLER (1842). Daß es mehrere Baldriansäuren gibt, fand DESSAIGNES (1851).
SCHOONBRODT fand gelegentlich seiner umfangreichen vergleichenden Untersuchung frischer und trockener Arzneipflanzen, daß frische, stets viel Zucker enthaltende, Baldrianwurzel nur wenig riecht, obwohl sie mehr ätherisches Öl enthält als getrocknete, dieses Öl aber keinen starken Geruch besitzt, getrocknete dagegen, die weniger süß schmeckende Extrakte liefert, weniger Öl gibt, dieses aber stark nach freier Baldriansäure riecht, von welcher sich in ganz frischer Wurzel nichts findet. CARLES zeigte, daß es ein Enzym ist, welche beim Absterben gelegentlich des Trocknens die Zersetzung der Ester der Baldriansäure bewirkt (Baldrian enthält auch Mangan in der Asche). Schon beim Absterben des Rhizoms, mehr noch beim Trocknen, werden also die Säuren in Freiheit gesetzt.
BÜHRER (Clarens) erhielt bei, auf meine Veranlassung (1909) angestellten, Titrationen von Auszügen mit verd. Alkohol mit n/10 NaOH einen Verbrauch an ccm (auf 1 g frische Wurzel berechnet):
Wurzel aus Chaux de fonds, frisch 1,4. Bei 70° getrocknet 1,9.
Wurzel vom Rhonetal bei Aigle, frisch 1,6. An der Luft getrocknet 2,4. Bei 70° getrocknet 2,8. Dialysat 3,0.
Wurzel aus dem Elsaß (Mühlhausen), frisch 3,7. An der Luft getrocknet 4,7.
Pflanzen verschiedener Standorte zeigen also ziemliche Verschiedenheiten.
Neben Gummi, Schleim und Stärke findet sich auch Zucker und zwar sowohl Dextrose als Saccharose (HARLEY, KROMER, in Thüringer Baldrian 0,73 bis 1,42‰, in russischem 0,3‰) — bisweilen setzt sich Saccharose aus äther. Baldriantinktur ab —, sowie eine Oxydase (CARLES) und ein hydrolytisches Enzym (TSCHIRCH). Ferner (in frischer Wurzel) zwei, wie es scheint, mit Kaffeegerbsäure verwandte, durch Blei fällbare Baldriangerbsäuren (C14H9O8 und C12H8O9, CZYRNIANSKY). Schon[S. 521] RUNGE fand eine «grünige Säure», deren Salze an der Luft grün werden. Das bekannte Nachdunkeln der Baldriantinkturen kann nicht auf das Enzym zurückzuführen sein, da es besonders bei der ätherischen Tinktur hervortritt. Es ist wohl auf diese Gerbsäuren oder das Öl zurückzuführen. Die Alkaloide Chatinin und Valerin (WALICZEWSKY) bedürfen näherer Untersuchung. Chatinin wird von den gewöhnlichen Alkaloidreagentien gefällt. Es soll zu 0,015% in der frischen Wurzel enthalten sein. Neuerdings beobachtete auch CHEVALIER in frischem Baldrian ein sehr zersetzliches Alkaloid. Auch ein Glykosid (HARLEY) und ein Harz werden angegeben. Alkaloid, Glykosid und Harz (?) werden beim Trocknen zerstört (CHEVALIER). TROMMSDORFF erwähnt einen eigentümlichen Extraktivstoff «Baldrianstoff» (Valerianin) und einen gelben Farbstoff.
Die europäische Rhiz. valerian. enthält 0,1–1% der Trockensubstanz (am meisten in holländ. Wurzel, SCHIMMEL) ätherisches Öl. Der Gehalt ist abhängig vom Boden (KIONKA). Schon FR. HOFFMANN, BOERHAAVE, GEOFFROY wußten, daß frische Wurzel weniger Öl gibt als getrocknete. Das gelbgrüne bis bräunlichgelbe, ziemlich dünnflüssige, schwach saure Öl wird mit der Zeit dunkelbraun und dickflüssig und scheidet Borneol ab. Es besitzt ein spez. Gewicht von 0,93–0,96 (Ardennen- und Vogesenöl 0,875–0,900) und dreht links (−8 bis −13°). Säurezahl: 20–50, Esterzahl: 80–100, Verseifungszahl: 100–150. Es enthält (besonders nach BRUYLANTS und OLIVIERO) mehr oder weniger freie Baldriansäure und auch ziemlich viel (9,5% GEROCK) Baldriansäure-l-Bornylester, dann die l-Bornylester der Ameisen-, Essig- und Buttersäure (je 1%), ferner l-Camphen, l-Pinen, Citren (?), Terpineol, ein Sesquiterpen (Siedep. 160–165°) einen Alkohol C15H26O (Sp. 190°) und einen stark links drehenden Alkohol C10H20O2 (F. 132°). Borneen, Valeren, Valerol (GERHARDT, PIERLOT) sind zu streichen. Auch ein Blauöl (Azulen), das bei c. 300° übergeht, ist nachgewiesen (FLÜCKIGER). (KOPP gibt diesem Blauöl FLÜCKIGERS die Formel C23H34O2?). Bei spektralanalytischer Untersuchung eines Blauöls, das bei 210–265° überging, fand ich vier Bänder: I. λ = 0,720 bis 0,750 μ, II. λ = 0,650–0,670 μ, III. λ = 0,590–0,610 μ, IV. λ = 0,555 bis 0,575 μ, matt. Ein Tropfen Baldrianöl färbt sich mit 20 Tropfen Schwefelkohlenstoff und 1 Tropfen Salpetersäure tief violett (FLÜCKIGER). Das aus frischen wildwachsenden Pflanzen dargestellte Öl hat ein geringeres spez. Gewicht (0,875–0,900, OLIVIERO) als aus der Droge bereitetes.
Das zu 8% (nach SHIMOYAMA 2,7%) erhältliche, also viel reichlicher gebildete, schwerere (spez. Gew. 0,990–0,996) Öl der japanischen Var. angustifolia (Kessoöl) ist ähnlich zusammengesetzt, es enthält ferner ein Sesquiterpen (Sp. 260–280°) und das linksdrehende (αD = −70°6′) Kessylacetat (Sp. 178–179°). Das Blauöl (C14H23O2COCH3) siedet auch bei c. 300° (BERTRAM, GILDEMEISTER, WALBAUM). Die spektralanalytische Untersuchung des Öls ergab für die vier Azulenbänder (s. oben) eine ähnliche Lage wie beim deutschen Baldrianöl (TSCHIRCH). Die V. mexicana lieferte bei der Destillation fast gar kein äther. Öl, sondern fast nur Baldriansäure (89% des Hydrates, SCHIMMEL & CO.). KEMP erhielt aus Indischer Narde (s. unten S. 525) 0,9% eines linksdrehenden Öles vom spez. Gew. 0,974, beim Erhitzen nimmt das Öl eine grünliche Fluoreszenz an (PREBBLE, vgl. auch LAFITE, Pharm. Zeit. 1887, 465 und ASAHINA, Journ. pharm. soc. Japan 1907 und SCHIMMELS Ber. 1907). In der Valeriana celtica findet sich 1,5 bis 1,75% (bzw. 0,1% HAENSEL) Öl, in dem ein Sesquiterpen und Palmitinsäure (?) nachgewiesen wurde (SCHIMMEL 1887, HAENSEL 1909).
Der Extraktgehalt schwankt von 17,64–24,03% (RÖDER), 17,35–31,95% (DIETERICH), 26% (CARLES). Zweijährige Rhizome geben die höchste Extraktausbeute,[S. 522] Pharm. austr. verlangt wenigstens 15%. Da die Wurzeln noch die Wurzelhaare besitzen (s. oben S. 518), die bekanntlich mit den Bodenteilchen verwachsen (richtiger: verkleben), so ist Baldrianwurzel durch Waschen niemals ganz von Erde zu befreien — auch die «staubfreie» des Handels enthält Erde —. Der Aschengehalt schwankt daher sehr. Besonders schlecht gewaschener Baldrian enthält oft viel Asche (bis 30,8% PETERS, bis 41% HAUKE, bis 43,98% RÖDER 1906). 4,7–8,4% sind bei gutem Baldrian beobachte Zahlen (HAUKE). GADD und SYDNEY wollen nicht über 9% hinausgehen. HAUKE gibt als obere Grenzzahl für ganze Wurzel 10%, für Pulver 12% an. Pharm. helv. 12%. Die Asche ist grau. Phosphate, Sulfate und Silikate fand darin schon TROMMSDORFF.
Lit. TROMMSDORFF, N. Journ. Pharm. 18 (1809), 3, 24 (1832), 134, 26 (1834), 1., Über die Valeriansäure u. ihre Verbind. Ann. d. Pharm. (6) 1833, 176, 10 (1834), 213. — PENTZ, Arch. Ph. 28, 337. — GROTE, Arch. Pharm. 32, 160, 33 (1830), 160, 38 (1831), 4. — RIEGEL, Journ. pr. Chem. 11 (1845), 316. — (Darstellung der Säure: WINKLER, Buchn. Rep. 1833, BONAPARTE, J. chim. méd. 1842 u. 1843, RABOURDIN, Journ. pharm. 1844, 310, WITTSTEIN, Buchn. Rep. 87 [1845]). — ASCHOFF, Arch. Pharm. 48 (1846), 275]. — CZYRNIÁNSKY, Über d. nicht flücht. Säur. d. W. v. V. offic. Lieb. Ann. 71 (1849), 21. — SCHOONBRODT, Journ. d. méd. Bruxelles 45 und 46, Deutsch in WITTSTEIN, Vierteljahrsschr. 18, 73 (Jahrb. Ph. 1869, 17). — CARLES, Valeriane et Oxydase. Journ. pharm. 12 (1900), 148. Rep. pharm. 1903, 289. — LINDENBERG, Unters. d. Rhiz. von V. offic. u. V. Hardwickii. Pharm. Zeitschr. f. Rußl. 1886. — KATZ, Wertbest. homöop. Urtinkt. Pharm. Centralh. 1901, 291. — HAUKE (Asche), Wien 1902. — PETERS, Apoth. Zeit. 1909, 538. — WALISZEWSKI, Un. pharm. 1891, 109 (Apoth. Zeit. 1891, 186). — SHIMOYAMA und HYRANO (Mitt. Med. Fak. Tokio 1890. Apoth. Zeit. 1892, 440 (Kesso). — K. DIETERICH (Extraktgehalt), Helfenb. Ann. 1900, 211. — HARLEY, Saccharose dans l. org. vég. etc. Thèse Paris 1905. — KROMER, Pharm. Centralh. 49 (1908), 397. — CHEVALIER, Compt. rend. 144 (1907), 154. — KIONKA, Biochem. Centralbl. 1905, 452. — ZAVATTI und SESTINI. Zeitschr. anal. Chem. 8 (1869), 388. — HOLZMANN, Arch. Ph. 1898, 409.
Öl: GRABERG, in CRELL, Die neuesten Entdeck. 6 (1782), 123. — TROMMSDORFF, Trommsd. Journ. d. Pharm. 18 (1809), 3 und Neues J. d. Ph. 24 (1832), 134. Lieb. Ann. 6 (1833), 176 u. 10 (1834), 213. — PFAFF, Syst. d. Mat. med. 1815 (dort d. ält. Lit.). — ETTLING, Lieb. Ann. 9, 40. — ROCHLEDER, Ebenda 44 (1842), 1. — GERHARDT, Ebenda 45 (1843), 29, Journ. pr. Ch. 28 (1843), 34. — GERHARDT und CAHOURS, Annal. d. chim. 3 (1841), 60. — KOPP, Arch. Ph. 55 (1876), 204. — ZELLER, Ausb. äth. Öl aus offiz. Pfl. Stuttg. 1855. — PIERLOT, Compt. rend. 48, 1018. — BRUYLANTS, Bull. Ac. r. méd. Brux. II, 1209. Journ. pharm. 1878, 349. Ber. d. chem. Ges. 11 (1878), 452. — OLIVIERO, Compt. rend. 117 (1893), 1096. Bull. soc. chim. 11 (1894), 150 u. 13 (1895), 917. Et. chim. sur l’huile essent. de Valer. Thèse Paris 1895. — GEROCK u. BRONNERT, Journ. pharm. Els. Lothr. 19 (1892), 82. — FLÜCKIGER, Arch. d. Pharm. 209 (1876), 204. — SCHIMMEL, Ber. 1887, 1891, 1894 und 1897 und GILDEMEISTER-HOFFMANN, D. äther. Öle. — TSCHIRCH, Harze u. Harzbehälter.
Kesso: BERTRAM u. GILDEMEISTER, Arch. Ph. 228 (1890), 483. — BERTRAM u. WALBAUM, Journ. pr. Ch. 49 (1894), 18.
Verfälschungen und Verwechslungen. In erster Linie werden genannt: Valeriana sambucifol. (TIMBAL-LAGRAVE), besonders in Böhmen, Veratrum album (BENTLEY 1877, KASPAR 1886) — die Unterschiede beschreibt BENTLEY (übersetzt bei WITTSTEIN) —, Sium latifolium L. var. longifolium L. (BERNBECK 1880), Cypripedium macranthum und Cynanchum Vincetoxicum (CHARBONNIER bis 36%) mit gelblich-weißem Rhizom. Dann finde ich (z. B. bei WITTSTEIN) angegeben: (von mir nicht beobachtet) Valeriana dioica L. (Rad. valerian. palustr., Rad. Phu minor.) mit dünnem Rhizom, Valeriana Phu L. (Rad. valerian. major., hortens., pontici oder Phu) mit großem Rhizom und dicken hellen Wurzeln (vgl. Paralleldrogen), Ranunculus acris, polyanthemos und repens L. (HOPPE 1807), Sium angustifol., Serpentaria virgin., Geum urbanum L. (Rad.[S. 523] caryophyllat.), Scabiosa arvensis L. (REVEIL bis 22%), Succisa pratensis MÖNCH., Betonica officinalis L., Eupatorium cannabinum L., Arnica montana L., Spigelia und Helleborus-Arten. Alle nehmen, wenn dem Baldrian beigemengt, den Geruch an. Man muß zur Unterscheidung das Mikroskop zuhilfe nehmen. Besonders gefährlich, aber leicht kenntlich, sind die Beimengungen der giftigen Rhizome von Veratrum und Sium, von denen aber nur das Letztere an gleichem Standorte vorkommt. Ein gekammertes Rhizom besitzt Cicuta virosa, scheint aber nie im Baldrian beobachtet zu sein.
Der rote Baldrian der Gärten ist Centranthus ruber, der griechische Baldrian Polemonium coeruleum.
Lit. TIMBAL-LAGRAVE, Journ. chim. méd. (5), 3, 589 (Jahresber. Pharm. 1867, 50). — BENTLEY, Pharm. Journ. 7 (1877), 649. — BERNBECK, Arch. Ph. 1880, 431. — L. PLANCHON, Precis 1906. — WITTSTEIN, Handwörterb. d. Pharm. 1882.
Anwendung. Rhiz. valerian. wird als Tonico-Excitans (bei Ermüdung, FÉRÉ 1904), Antispasmodicum, Nervinum, Antihystericum und Antiepilepticum benutzt [die Anwendung als Antiepilepticum wird auf FABIUS COLUMNA († 1460) zurückgeführt]. Es ist ein wichtiges krampfstillendes Mittel (z. B. bei Krampfkolik) und spielt unter den Volksheilmitteln (hier auch als Diureticum, Fieber- und Wurmmittel), sowie unter den Mitteln des Pfarrer KNEIPP eine große Rolle. (Über die Verwendung in Rußland vgl. DEMITSCH, Russische Volksheilmittel in KOBERT, Studien I.) «Plus la préparation contient d’acide valérianique, moins elle est active» (POUCHET 1904). Da der Isovaleriansäure-Borneolester, C10H17O.OC5H9 (s. oben S. 521), als der wirksame Bestandteil des Baldrian betrachtet wird, bringt man ihn — synthetisch dargestellt — seit 1904 unter dem Namen Bornyval als Mittel gegen Neurasthenie, Hysterie und Herzleiden, meist in Gelatineperlen à 0,25 g, in den Handel. An der Wirkung des Baldrian sind aber jedenfalls auch andere Körper noch beteiligt. CARLES schlug daher (1903) vor, ein von ihm «Pan-Valériane» genanntes Fluidextrakt durch Extraktion der Droge mit 18% Weingeist, dem 5% Ammoniak zugesetzt worden war, zu bereiten. KALLE schlug Zusatz von Ammonsalzen bei Bereitung der Baldriandestillation vor (Pharmac. Un. Stat. hat die alte Tinct. valer. ammon.). Ich sehe keinen Vorteil im Ammoniakzusatz. Das Dialysatum Valerianae GOLAZ (Saxon) wird aus der frischen Pflanze bereitet. In Frankreich wird der frische Saft empfohlen oder Darstellung der Präparate aus der frischen Pflanze unter Erhaltung der Oxydase. Die Bereitung der als sehr wirksam erkannten Präparate aus der frischen Pflanze sollte aber besser in der Weise erfolgen, daß man die frisch gegrabenen und gewaschenen Wurzeln zehn Minuten in Wasser von 80° bringt, um das Enzym zu töten und dann erst extrahiert (TSCHIRCH). Dabei bliebe denn auch wohl das Alkaloid, dem eine Wirkung auf den Augapfel und die Medulla oblongata zugeschrieben wird, sowie das Glykosid erhalten. BOURQUELOT schlägt Sterilisation durch Eintragen in siedenden 90% Alkohol vor. Jedenfalls ist aus der «sterilisierten» Wurzel oder mittelst siedenden Alkohols bereitete Baldriantinktur haltbarer, da das Enzym seine Wirkung nicht mehr ausüben kann (LESUEUR).
Lit. LOUIS PLANCHON, Prec. d. mat. med. 1906, II, 187 (dort weitere Angaben). — LESUEUR, Infl. d. mod. de prép. etc. Thèse Paris 1910. — BOURQUELOT, Journ. pharm. 1911.
Geschichte. Im Altertum hieß eine der medizinisch verwendeten Narden Phu (wohl ein poetischer Name). PLINIUS sagt (XII, 26) bei Narden: «In nostro orbe proxime laudatur Syriacum, mox Gallicum, tertio loco Creticum, quod aliqui agrium vocant, alii phu, folio olusatri etc.» Die Beschreibung, die DIOSKURIDES (I, 11) vom φοῖ gibt, den er auch νάρδος αγρία nennt,[S. 524] und den er als im Pontus vorkommend angibt, stimmt auf Valeriana officinalis (SPRENGEL, V. o. kommt im Orient vor), resp. auf die wohl nur als eine der kleinasiatischen Formen der Officinalis oder jedenfalls als eine naheverwandte Art zu betrachtende, von HAWKINS aufgestellte, V. Dioscoridis, Sibth. fl. Graec. (SIBTHORP, FRAAS). Er erwähnt, daß sie mit der geruchlosen Wurzel der Oxymyrsine (Ruscus aculeatus) verfälscht werde und beschreibt die Unterschiede. Bei SCRIBONIUS LARGUS (I, S. 578) findet sich Phu und Phu pontici semen, das auch als Valeriana Dioskuridis zu betrachten ist. Bei den Hippokratikern spielte der B. (wie noch heute) eine große Rolle in der Frauenpraxis und er war auch ein Bestandteil des berühmten Antidots von SOTIRA (I, S. 593) und der Pastillen des ANDROMACHUS (ebenda). Der Name Valeriana tritt zum ersten Male in der lateinischen Übersetzung des aus dem X. Jahrh. stammenden arabischen Werkes über die Nahrungsmittel des ISAAC JUDAEUS (I, S. 598 op. omn. 1515, cap. 45) auf: «Fu id est valeriana, melior rubea et tenuis et quae venit de armenia et est diversa in sua complexione». Er findet sich dann auch im XI. Jahrh. bei CONSTANTINUS AFRICANUS (De omnibus medico cognitu necessariis Bas. 1539, 348): Fu id est valeriana. Naturam habet sicut Spica Nardi» und im gleichen Jahrhundert auch (nach HANBURY) in den angelsächsischen tierärztlichen Büchern (I, S. 684). Ob das Fu des ISAAC JUDAEUS (s. oben S. 511) Val. offic. war, ist zweifelhaft, aber wahrscheinlich, wohl aber dürfen wir in dem Fu i. e. valeriana des CONSTANTINUS AFRICANUS unsere Pflanze erblicken, da er sie ausdrücklich der Spica Nardi und der Celtica gegenüberstellt und auch das Fu des SIMON JANUENSIS (I, S. 664) ist Baldrian. Die mittelalterlichen Namen und die der Patres s. oben S. 511. Ricettario Fiorentino (I, S. 793) unterscheidet valeriana domestica (maggiore) und v. silvatica (minore). Nur die erstere soll benutzt werden. CORDUS bezeichnet Phu auch als Gartenseliunk und Spikwurzel. Valeriana findet sich im Gothaer Arzneibuch aus dem XIV. Jahrh. (I, S. 679) und in der Frankfurter Liste (1450), im Nördlinger Register (1480) steht Fu neben spica nardi und spica celtica, in SALADINS Compendium (I, S. 665) Phu. Das Braunschweiger Register (1521) hat nur noch valeriane (auch ein Baldrianwasser — wie BRUNSCHWYG (1500) ein Denmarckwasser), aber Rad. Phu majoris (= V. Phu) steht noch 1724 bei BERLU (I, S. 951). Bei BRUNFELS steht: «Fu id est Valeriana vel Potentilla vel Amantilla. Sec. Diosc. multi appellant Narduun agrestem. Circa instans dicit Fu intelligitur radix et sic est. Et multi vulgares vocant eam herbam Benedictam.» FUCHS (I, S. 843) gibt eine vorzügliche Abbildung unseres Baldrian, den er Phu germanicum nennt. BOCK (I, S. 841) bildet ab: Valeriana vera (Nardus agrestis), V. vulgaris und V. exigua. Bei JEAN BAUHIN steht: Valeriana major odorata radice; bei POMET, der eine Abbildung gibt: La grande valeriane. POMET setzt sie im Gegensatz zur Petite Valeriane, deren Wurzeln einige Phu pontique nennen. GEOFFROYS Traité 1757 (I, S. 947) kennt drei Arten Valériane: La valériane des jardins ou la grande Val. (V. hortensis, Phu folio Olusatri Dioscoridis BAUHIN Pinax), La valériane sauvage ou des bois ou petite Val. (V. sylvestris major BAUHIN Pinax) und La Val. des marais ou petite V. aquatique (V. palustris minor BAUHIN Pinax). — Die wilde Valeriana ist unsere V. officin., die Garten-V. wohl V. Phu, der kleine Wasserbaldrian V. dioica. LINNÉ übernahm Valeriana als Gattungsname und unterschied: V. officinalis, V. Phu und V. celtica (= Nardus celtica Dioscoridis BAUHIN Pinax). Die Kultur des B. ist erst spät versucht worden. Er fehlt noch bei KARL, im St. Galler Klosterplan, bei MACER und STRABO, sowie im Kalender des HARIB (I, S. 612). In den Destillierbüchern des XVI. Jahrh. sind Vorschriften für Baldrianwurzeldestillate mit Wasser und Wein enthalten. Das Öl erhielten FR. HOFFMANN, BOERHAVE, CL. J. GEOFFROY sowohl aus trockener wie aus frischer Wurzel (PFAFF). Dann beschrieb es GRABERG und TROMMSDORFF, der die Wurzel untersuchte, nannte (1830) die Säure Valeriansäure. Alte Dissertationen über Valeriana sind: J. C. SPIES, De Valeriana, Helmst. 1724 und M. ALBERTI, De Valerianis officinalibus, Hal. 1732 (I, S. 928 u. flgd.).
In der germanischen Götterlehre wird die Pflanze erwähnt. Die Göttin HERTHA trug einen Baldrianstengel als Reitgerte (PERGER). Im nordischen Altertum hieß sie Wielandswurz (s. oben S. 511). Im Volksglauben ist Baldrian ein kräftiges Schatzkraut gegen Hexen und Teufelszauber und gegen Elfenneid (SCHILLER, Tier- und Kräuterb. d. Mecklenb. Volk.). («Hättst du nicht Dosten und Baldrian, wöllt ich den Kragen dir umdrehet han», ruft der Hexenmeister). Der Bräutigam muß am Hochzeitstage einige Blätter der Pflanze bei sich tragen. Das Rhizom gilt aber als Antaphrodisiacum, mit Bibernell zusammen dann auch als Pestmittel «Baldrian und Bibernell, hält die Pestilenz zur Stell». (Das finnische rutto juuri bedeutet Pestwurz.) Nach SCHAMBACH wird beim Graben der Wurzel in Mecklenburg gesungen: «Balderjan! Most upestan, Most hengan, Most helpen allen Minschenkindern. Un allen Naversrindern!» (RELING und[S. 525] BOHNHORST). In Sachsen ist der Vers bekannt: «Trinkt Baldrian, sonst müßt ihr alle dran» (weiteres bei SÖHNS). In Serbien lautet ein Spruch: «Dies kostbare Kraut zu vernachlässigen warnt die vila» (GRIMM). Baldrian ist auch Bestandteil einiger Pestlatwergen.
Im Mittelalter und dem Beginn der Neuzeit scheint der Baldriangeruch beliebt gewesen zu sein, da der Baldrian zum Parfümieren von Zimmern, Kleidern und Wäsche benutzt wurde (TURNER, New Herball 1568, LANGHANS, Garden of Health 1633), ähnlich wie im Altertum V. celtica L. und Nardostachys Jatamansi DC. (s. unten). In England wurde B. in früheren Zeiten setwall (sonst auch für Zedoaria benutzt) genannt und viel gebraucht. GERARDE bemerkt in seinem Herball (1567), daß die ärmeren Klassen in Nord-England keine Speise ohne B. bereiteten (HANBURY). Also auch der Geschmack muß beliebt gewesen sein.
Paralleldrogen. Von dem Indian and Colon. addend. to Brit. Pharm. (I, S. 22) wird als Ersatz der V. officin. auch das Rhizom von Valeriana Wallichii DC. (V. villosa WALL., V. Jatamansi JONES, V. Spica VAHL), in Indien: dálá, wálá, bálá, tagar (weitere Namen in Pharmac. indic.) — zugelassen, die von Kashmir bis Bhután bis zu Höhen von 10000 Fuß und in den Khásiabergen vorkommt (Dict. econ. prod. India). Die stark nach Baldriansäure riechende Wurzel liefert c. 1% äther. Öl und enthält 3,13% Gerbstoff, 6% Zucker, 14% Stärke und 1% Harz (LINDENBERG, Pharm. Zeitschr. f. Rußl. 1886).
Ähnlich wie diese wird das Rhizom von Valeriana Hardwickii WALL. (V. tenera WALL., V. javanica BL., V. acuminata ROYLE) in Indien: tágger, die Wurzel: ásárun, die an den gleichen Standorten wie V. Wallichii vorkommt und auch sehr hoch (bis 12000 Fuß) steigt, aber wohl nur eine Form der V. offic. ist, benutzt. Es soll dies die syrische Narde der Alten (s. unten) gewesen sein (ADAMS).
BIDIE (Pharm. ind.) empfiehlt als Baldrianersatz ferner die in den Nilagiris wachsende, bei der Destillation viel Baldriansäure gebende Valeriana Brunoniana, (Pharm. indic.).
O’SHAUGHNESSY bezeichnet (Bengal Disp.) als einen brauchbaren indischen Ersatz des Baldrian auch Nardostachys Jatamansi DC. (Patrinia Jatam. DON., kaum von N. grandiflora DC. zu trennen) — in Indien: Jatamánsi (sansc.) báluchar, bhutakesi (= Teufelshaar), arab.: sumbulul-aa sáffir (bei IBN BAITHAR: sambal). Es ist dies die echte indische Narde (Nardus indica, Spica Nardi, sunbul hindi, sennbol (arab.), nerd (hebr.), die in den nordindischen Gebirgen (Himalaya), besonders in Nepal, Kumaon und Bhutan bis 17000 Fuß hoch steigt. Aber deren von faserigen Niederblattresten umhülltes Rhizom riecht nicht nur nach Baldriansäure, sondern auch nach Moschus und Patchouli. Wegen dieses eigenartigen Geruches wurde diese Narde im Altertum viel zur Bereitung wohlriechender Salben (νάρδος πιστική = echte oder flüssige Narde TRISTRAM) zur Salbung des Körpers (vgl. I, S. 1014) benutzt, wie wir aus der Bibel und HORAZ erfahren. Sie dient noch heute (mit Galgant, Prunus Mahaleb, Andropogon muricatus, Pogostemon Patchouli u. and.) zur Bereitung des von den indischen Frauen benutzten Haarwaschwassers Angalepan (Pharmac. indica) — war aber auch bereits bei den Hippokratikern Heilmittel. Sie wurde schon von PLINIUS von der unechten Narde (Ozaenites vom Ganges) und dem Pseudonardus (Nardus italica = Lavendel) unterschieden. Später diente zu gleichem Zwecke die in den südlichen und östlichen Alpen wachsende, bei den Alpenbewohnern als Speik bekannte römische oder keltische Narde oder Saliunca, Nardus ex Apulia (Valeriana celtica. L.), die auch ein Bestandteil des Mithridats (bei AVICENNA) war, der die keltische gut von der indischen unterschied. Zum gleichen Zweck diente auch die Moschuswurzel von Ferula Sumbul. Aber auch Andropogonarten (Schoenos, indisches Gras) wurden bisweilen als indische Narde bezeichnet, galten aber schon im Altertum nicht als echte Narden.
Die indische Narde wird schon in Susrutas erwähnt. Der Autor von MAKHZAN EL-ADWIYA vergleicht sie mit dem Schwanze des Zobels. Es ist zweifelhaft, ob νάρδος aus dem iranischen (npers.: nârd) oder dem semitischen (hebr.: nêrd) Kulturkreise stammt. Alle Ausdrücke gehen auf das indische nálada (schon in Atharvaveda als Aromapflanze genannt). PERIPLUS nennt νάρδος als Exportartikel indischer Häfen. ALEXANDER traf die Pflanze in Gedrosien (ARRIAN, Anabasis VI, 22). Durch die Bibel verbreiteten sich got. nardus, ahd. narda (SCHRADER). DIOSKURIDES kennt außer νάρδος (νάρδου στάχυς GALEN, Spica nardi PLINIUS, Nardos ARRIAN, Nardifolium COLUMELLA), von der er eine aus Gebirgen stammende «syrische» (aber nicht in Syrien gesammelte), eine von dem Tale des Ganges exportierte (Gangitis) und eine sampharitische (wohl über Arabien kommende) unterscheidet (er weiß, daß die Gebirgsnarde die beste ist) noch: νάρδος κελτική (von Ligurien und Istrien) und ν. ὀρεινή (aus Cilicien und Syrien). Die syrische (d. h. hier indische) Narde[S. 526] ist jedenfalls Nardostachys Jatamansi, die vom Ganges vielleicht ein Andropogon (nach anderen Nardostachys grandifol.), die keltische: Valeriana celtica, die Bergnarde wohl V. tuberosa. Was die sampharitische ist, ist unklar. Des PLINIUS Gallische Narde (s. oben S. 525) ist vielleicht Valeriana saxatilis (SPRENGEL). SCRIBONIUS LARGUS nennt die keltische Narde Saliunca, COLUMELLA Nardum celticum. Im Liber de simpl. ad Paterniam stehen die Namen: Salvicula, Saliunca und Saloincha. SCRIBONIUS LARGUS bemerkt, daß Nardus indica, celtica und italica, Spica nardi (Lavendula?) und indisches Gras ähnlich riechen, was ich aber nicht finden kann. Auch CELSUS (I, S. 587) kennt indische, syrische und gallische Narde. Narde steht sowohl im Periplus (I, S. 535) wie in der Alexandrinischen Zolltafel. In der mittelalterlichen Literatur wird die echte Narde nur noch einmal unter den Räuchermitteln beim Einzug HEINRICH VI. in Rom erwähnt (FLÜCKIGER-HANBURY). In den Destillierbüchern (z. B. BRUNSCHWYG) ist sie nicht mehr genannt, wohl aber Spikenard und Spica (HOFFMANN). Die echte Narde kommt hier und da noch nach London und die keltische Narde wird noch jetzt in den schweizerischen und italienischen Alpen gesammelt und von Triest nach dem Orient exportiert (FLÜCKIGER).
Als Paralleldroge kann kaum gelten das wenig aromatische Rhiz. valerianae majoris von Valeriana Phu L., einem als Gartenpflanze da und dort (Schlesien, Livland) kultivierten, in Armenien, Kaukasien, dem Ural und Südsibirien einheimischen Gewächs, wohl aber alle oben (S. 512) angeführten, zur Sectio Officinalis gehörenden Arten (bez. Varietäten), besonders die V. angustifolia (V. offic. var. angustifolia MIQ.) Japans (kesso, kisso, kanoko-so), mit kurzem, reich bewurzeltem Rhizom — seit 1879 im Handel. In Frankreich wird durch die Herboristen oft Val. excelsa POIR. gesammelt (CAMUS 1901). Ferner sei erwähnt die Valeriana mexicana DC. (s. oben), neben welcher in Mexico auch V. ceratophila HBK. und V. toluccana DC. medizinisch benutzt und bisweilen nach Europa gebracht werden (HOLMES). Weitere, ähnlich wirkende Valerianaarten in DRAGENDORFF, Heilpflanzen und in PLANCHON-COLLIN, Drogues simples 1896.
Lit. GILDEMEISTER-HOFFMANN, Äther. Öle, II. Aufl., S. 208. — Abbild. der indischen Narde: ROYLE, Illustrations of the Himalayan Bot. t. 54 (kopiert bei NEES). — JONES, On the spikenard of the ancients Transact. Asiat. Soc. Bengal. Calcutta 1889. — ROXBURGH, ebenda. — FLÜCKIGER-HANBURY, Pharmacogr. — FLÜCKIGER, Pharmakogn. — DYMOCK, Mat. med. West. Ind. — TRISTRAM, Nat. history of the bible. — Pharmacogr. indica. — Dict. econom. prod. of India. — GUIBOURT, Hist. nat. d. drog. (dort Näheres über die Narden, auch Abbild.). — SCHRADER, Reallex. d. indogerm. Altert.
IV.
Die Produkte der Oxydation der Hexosen sind Glukonsäuren (Hexonsäuren), z. B. Glukuronsäure (S. 77), Glukonsäure, Zuckersäure (S. 77), Schleimsäure (S. 282), bei stärkerer Oxydation tritt aber Zerfall ein und es entsteht Glykolsäure, Oxalsäure, Traubensäure, Weinsäure. Schon SCHEELE beobachtete (1776), daß bei der Oxydation von Zucker Oxalsäure auftritt. Bei der Aufspaltung des Zuckers bei der alkoholischen Gärung (?) und der intramolekularen Atmung entsteht aber auch dl-Milchsäure (α-Oxypropionsäure), CH3.CH(OH).COOH, die sich zuweilen im Wein findet und bei der intramolekularen Atmung der Zuckerrübe sich bildet und die in größerer Menge bei der Milchsäuregärung des Trauben-, Milch- und Rohrzuckers auftritt.
Die Glykolsäure (Oxyessigsäure), CH2OH—COOH, findet sich im Zuckerrohr und kommt auch im Rübensaft und unreifen Trauben vor. Sie liefert oxydiert zunächst die in unreifen Früchten (Wein, Stachelbeeren und Äpfeln) vorkommende Glyoxylsäure: COH—COOH, dann Oxalsäure: COOH—COOH.
Die Oxalsäure ist bei den Pflanzen und auch den Drogen weit verbreitet (C. SCHMIDT, BAYLEY, PAYEN, vgl. die Zusammenstellung in CZAPEK, Biochemie), besonders als Calciumoxalat, das zuerst SCHEELE (1785) im Rhabarber auffand, das die Mikroskopiker aber schon früher gesehen hatten (I, S. 341), und von dem besonders die Flechten reichliche Mengen, bis zu 66% des Trockengewichtes (Lecanora esculenta), enthalten. Oxalsäure tritt auch als saures Kaliumsalz auf (in Oxalis-, Rheum- und Rumexarten).
[S. 527]
An die Oxalsäure schließen sich dann an:
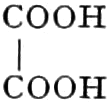 |
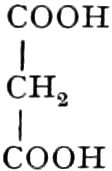 |
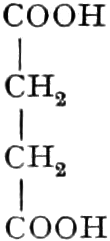 |
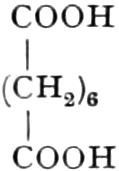 |
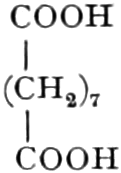 |
|
Oxalsäure
|
Malonsäure
|
Bernsteinsäure
|
Korksäure
|
Azelainsäure
|
von denen besonders die Bernsteinsäure in unreifen Früchten (Wein, Stachelbeeren, Johannisbeeren, Äpfeln, Bananen), aber auch in Atropablättern, Rhabarberstielen und in der Zuckerrübe, sowie als Harzester (TSCHIRCH und AWENG) im Bernstein vorkommt und endlich die sich an die Bernsteinsäure anschließende Gruppe der Oxysäuren:
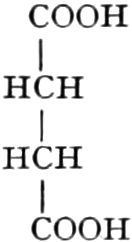 |
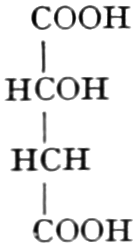 |
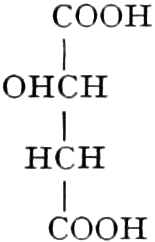 |
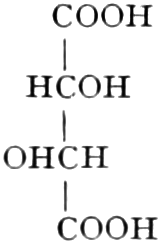 |
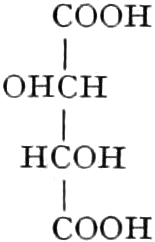 |
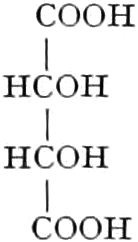 |
|
Bernsteinsäure
|
d-Apfelsäure
|
l-Apfelsäure
|
d-Weinsäure
|
l-Weinsäure
|
Meso-
weinsäure |
 |
 |
||||
|
Racemische Apfelsäure
|
Racemische Weinsäure
|
||||
Die von SCHEELE (I, S. 968) entdeckte Apfelsäure (DONOVANS Acide Sorbique) ist als l-Apfelsäure weit verbreitet (BRACONNOT, Übersicht bei CZAPEK). Sie findet sich meist gebunden, aber auch frei, besonders reichlich in den Vogelbeeren (VOGEL, HOUTON LABILLARDIÈRE, LIEBIG), den sauren Äpfeln, — und dem daraus dargestellten Extractum ferri pomati —, dann auch in Kirschen, Pflaumen, Weintrauben, Heidelbeeren, Ananas, den Beeren von Hippophaë, und Berberis, den Blättern des Tabak (VAUQUELIN), des Chelidonium majus und Rheum (3,5% saures Malat), dem Euphorbium (25% Calciummalat, TSCHIRCH und PAUL) und in vielen Pilzen (z. B. Polyporus officinalis). Besonders reichlich ist Apfelsäure aber in den Blättern der Crassulaceen (25–30% des Trockengewichtes) enthalten; die hier vorkommende Säure soll aber eine vierte stereoisomere, rechtsdrehende Form sein, die mit keiner der übrigen übereinstimmt (ADERSON).
Von den ungesättigten niederen Fettsäuren interessieren uns nur:
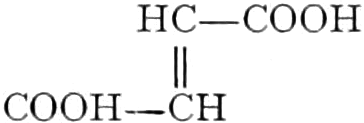 |
und
|
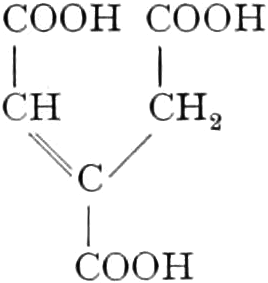 |
|
Fumarsäure
|
||
|
Aconitsäure
|
von denen die erstere in Pilzen häufig ist, und auch z. B. in Cetraria islandica (S. 268), aber auch in Phanerogamen (Fumariaceen, Papaveraceen) vorkommt, die andere in Rüben und Ranunculaceen (Aconitum, Adonis, Delphinium) vorkommt. «Vielleicht begleitet sie ständig die verwandte Citronensäure» (EULER).
V. Weinsäuredrogen.
Ganz außerordentlich verbreitet ist die Weinsäure, zwar nicht die l-Weinsäure, auch nicht die Mesoweinsäure und die Traubensäure (racemische oder d + l Weinsäure),[S. 528] wohl aber die d-Weinsäure ([α]20D = +15,06°, F. 170°), die zuerst SCHEELE (1769) aus Weinstein isolierte. Sie findet sich — vornehmlich gebunden — in den Weinbeeren (S. 40), den Maulbeeren, Tamarinden, Ananas, Gurken und vielen anderen Früchten, Wurzeln, Blättern und Zwiebeln (revisionsbedürftige Übersicht bei HUSEMANN-HILGER), aber wohl kaum, wie HILGER (a. a. O.) meint, «im Zellsafte aller entwicklungsfähigen Pflanzenteile».
Das beste Material zur Darstellung der d-Weinsäure ist noch heute der rohe Weinstein, der als Droge in den Handel kommt. Er bildet gelbliche und rötliche Krusten, die zur Reinigung zunächst in siedendem Wasser gelöst werden. Die geklärte Lösung wird mit Tierkohle und Ton entfärbt und zur Kristallisation gebracht. Aus dem so entfärbten Weinstein wird die Säure mit Schwefelsäure abgeschieden.
Pulpa Tamarindi.
Syn. Fruct. tamarindi, Siliquae indicae — Rohes Tamarindenmus — pulpe brute de tamarins (der Baum: tamarinier de l’Inde) (franz.) — tamarind (der Baum: tamarind tree) (engl.) — tamarinde (holl.) — tamarindo (ital.) — tamarinda (ung.) — tamarindi (fin.) — ὀξυφοῖνιξ (griech.).
Arab.: tamr hindī, andeb (in Cordofan: ardeb), humar, sabárá. — pers.: anbalah — in Indien: amli, imli (hind.), chintz (bomb.) puliyam-pazham (tam.) tentul (beng.) — im Sanscrit: tintidi, amlikā (weitere in WATT, Dict. ec. pr.) — mal.: asam manies oder a. djawa, asem (asem kerandji ist Dialium indum), kamal. — bei den späteren Griechen: βελφηνικήα τεμαρέντι. — Bei ALHERVI (I, S. 601) tamr ulhindî (pers.) — In dem Lehrgedichte des OTHO CREMONENSIS (XIII. Jahrh., vgl. I, S. 627) und bei SERAPION (I, S. 607): thamarindus. — Bei IBN BAITHAR (I, S. 608) stehen außer Tamr hindi auch die Namen: subâr (für den Baum: subâri), humar, hamar (auch für Asphalt benutzt!), hamar heißt im Arab. rot (MARTI). Deutet wohl auf die Farbe der Früchte. — Bei ABU HANIFA: elhumar — bei CONSTANTINUS AFRIKANUS: Oxyfoenicia sunt dactyli Indiae. — Auch in der Alphita und bei BARTHOLOMAEUS (I, S. 655) findet sich Oxi fenica (fincon, inde dactilus indicus vel tamarindus) = dactalus acetosus und auch in Circa instans (I, S. 637), bei JOH. ACTUARIUS und in den mittelenglischen Medizinbüchern aus dem XIV. Jahrh. (I, S. 683) steht Oxyfenica. Der Ausdruck (= palmae acidae) blieb bis ins XVII. Jahrh. erhalten (FLÜCKIGER). Im Mittelalter und noch bei C. BAUHIN auch: Siliqua arabica (Siliqua syriaca ist Ceratonia) — bei RUMPF: Tamarindus C. Bauhini, Tamar sive dactylus Indorum, Palmula indica et deresilde Arabum — in Brasilien: Jutay (PISO). — Tamarindus auch bei RAY, ALPINI und TOURNEFORT — bei RHEEDE: balam pulli.
Etym. Tamarindus von arab.-pers. tamr (tamar chald. u. hebr.) = Palma (Dattel) und hindi = indisch, also indische Palme (Dattel) (so schon von GARCIA DA ORTA erklärt). Vielleicht auch tamr = Frucht überhaupt (PEREIRA) — οξυφοίνικα, Oxifenica = Sauerdattel (φοῖνιξ = Dattel, hier nicht = rot, wie LÉMERY will). — Der Malaie drückt im Namen: Asam (= sauer), manies (= süß) sehr charakteristisch den Geschmack des Fruchtmuses aus.
Stammpflanze und systemat. Stellung. Tamarindus indica L., Gen. pl. I, 581 (Rumph. herb. amb. 2, 90 t. 23), nebst der in Westindien kultivierten kleinfrüchtigen, wenigsamigen, herben Var. occidentalis (T. occidentalis GÄRTNER) — auch die javanische T. ist kleinfrüchtig (TSCHIRCH). Der Autor des Makhzan el Adwija beschreibt zwei indische Arten: die rote süßere, kleinsamige Guzerat-Varietät (die bessere) und die gewöhnliche rötlichbraune. Diese werden in Indien noch jetzt unterschieden. ROXBURGH und DE CANDOLLE unterscheiden T. occidentalis DC. und T. indica DC. als Arten.
Leguminosae, Caesalpinioideae — Amherstieae (die Gattung Tamarindus hat nur eine Art).

(Tschirch phot.)
Beschreibung der Stammpflanze. Die Tamarinde ist ein immergrüner Baum, der eine Höhe von 25 m erreicht (Taf. XIII) aber langsam wächst. Er braucht viel Licht und ein dauernd warmes, tropisches Klima, nimmt aber, da tiefwurzelig, mit relativ trockenem Boden fürlieb. «Sein schöner, ebenmäßiger Wuchs, die dichtbelaubte und infolge der feingefiederten Blätter doch lichte und reichgegliederte Krone, die den Boden in weitem Umkreis beschattet, die weitausladenden Äste und der elastische, aber feste Stamm geben dem schönen Baum ein prächtiges Aussehn (Taf. XIII). Kraftvoll und doch zierlich, ist er eine herrliche Zierde der Landschaft vollends dann, wenn er im Schmucke seiner zahlreichen wohlriechenden, feingeaderten Blüten prangt oder mit tausenden rehbrauner, an langem Stiele herabhängender Fruchthülsen beladen ist» (TSCHIRCH, Indische Heil- und Nutzpflanzen). Ich traf in Java aber oft Tamarinden ohne Blüten und dann wieder solche mit nur spärlichen. Auch RUMPHIUS sagt: «Flores sunt rari et vagi». Auf den Blattreichtum geht die griechische Bezeichnung δένδρον πολύφυλλον (bei THEOPHRAST) und in Java sagt man: «Er hat Schulden wie der Tamarindenbaum Blätter.» Der bis 8 m im Umfang messende Stamm hat ein sehr geschätztes Holz, das von Insekten nicht angegangen wird.

Blüte von Tamarindus indica L. im Längsschnitt.
[Nach Luerssen.]
Die alternierenden Blätter sind paarig gefiedert, 10–20 jochig, die fast sitzenden, ganzrandigen Fiederblättchen 12–20 mm lang, lineal-länglich, abgerundet gestutzt oder ausgerandet, ungleichhälftig, unterseits blaugrün, die häutigen Nebenblättchen hinfällig. Die Blätter zeigen Schlafbewegung (s. unter Geschichte). Die zygomorphen, hermaphroditen Blüten stehen in endständigen Trauben. Das enge, röhrige, kreiselförmige Receptaculum ist mit dem drüsigen Discus ausgekleidet, der vierzählige Kelch in der Knospe dachig. Von den vier, dem Rande des Receptaculums inserierten, weißlichen, dann blaßgelblichen und abfallenden, häutigen Kelchblättern sind die beiden oberen (hinteren) zu einem breiten, fast ovalen Blatte verwachsen, die beiden unteren (vorderen) sind länglich. Von der ursprünglich fünfzähligen Corolle sind die zwei vorderen Blätter zu pfriemenförmigen Spitzchen abortiert, von den drei hinteren (oberen) ist das mittlere schmäler, fast sitzend und etwas kahnartig zusammengelegt, die beiden seitlichen breit genagelt, alle drei weiß und rot geadert, etwa gleich groß, wellig gekerbt. Von den neun zu einer, oberseits offenen, Scheide verwachsenen Staubfäden sind nur die drei vorderen Kelchstamina fertil, die anderen sechs als spitzchenförmige, an der Spitze der Scheide sitzende Staminodien entwickelt. Der gestielte einfächerige Fruchtknoten trägt einen, wie die Stamina, bogenförmig gekrümmten Griffel mit kleiner gestutzter Narbe und enthält eine ganze Anzahl Ovula (Fig. 172). Die Frucht hängt an einem mehrere Zentimeter langen Stiel. Sie wird sehr verschieden lang (selten über 15 und bis 20 cm, meist viel kürzer, besonders bei den kleinfrüchtigen Sorten). Sie ist länglich, kurz und scharf zugespitzt, meist etwas gekrümmt und mäßig zusammengedrückt, an den Stellen, wo die Samen liegen, meist etwas aufgetrieben, oder gar infolge von Einschnürungen knotig gegliedert. Sie ist ein nicht aufspringendes Legumen, dessen Bauchnaht kaum deutlich hervortritt,[S. 530] mit gelbbraunem oder hellbraunem, fast warzig-rauhem, sehr zerbrechlichem, etwa 0,5 mm dickem Exocarp, das außen bisweilen auf hellem Grunde ein feines dunkles Netzwerk erkennen läßt. Das Mesocarp ist ein weiches Fruchtmus, an dessen äußerem Rande auf der konkaven Rückenseite der Frucht ein derbes Bündel bis zur Spitze verläuft, während auf der konvexen Bauchseite zwei starke und 2–4 zwischen diesen liegende schwächere Bündel verlaufen (Fig. 174), von denen aber nur die stärkeren die Spitze der Frucht erreichen, die 2–4 schwächeren aber meist schon vorher blind endigen. Von allen gehen fast in rechtem Winkel Sekundärnerven ab, die zu Anastomosen führen. Dieses Bündelsystem läßt sich bei der trockenen Frucht oft als grobfaseriges Netzwerk in toto vom Mesocarp außen ablösen. Das Endocarp ist als papierdünne zähe Pergamenthaut entwickelt und zwischen den Samen gefächert. Es kleidet die 1–12 ovalen Fächer der Hülse aus, die innen bisweilen spiegelglänzend erscheinen und je einen glänzend rotbraunen, der Bauchnaht angehefteten, endospermfreien Samen einschließen (Fig. 173).
Früchte bildet die Tamarinde vom zehnten Jahre an. In Java blüht der Baum im November und Dezember zu Beginn der Regenzeit. Die Früchte sind dort im Februar vollreif, was man an der Brüchigkeit des Epicarps erkennt. Sie werden mit Bambusstangen abgeschlagen, was ohne Schwierigkeit möglich ist, da der Fruchtstiel sehr spröde ist (TSCHIRCH). In Vorderindien blüht T. im April und Mai. Ein Baum liefert dort 5–6 maunds (c. 412–494 lbs.) Früchte. In Westindien sind die Früchte im Juni bis August reif (HOOPER). Die Eingeborenen Vorderindiens betrachten die Ausdünstungen des Baumes als schädlich. SEMLER empfiehlt, die Früchte mit der Hand oder die nicht erreichbaren mit einer sog. Pfropfreiserschere zu pflücken.
Tamarindus indica. Radialer Längsschnitt durch die Frucht — schematisch.
[Tschirch.]
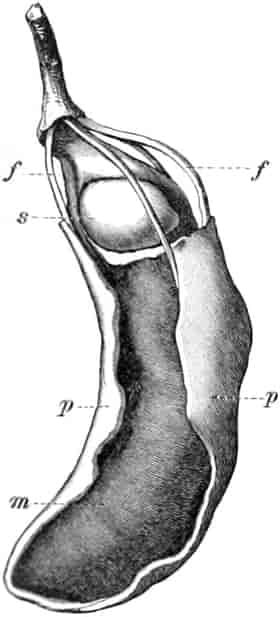
Tamarindus indica. Frucht geöffnet, das Epikarp (p) abgetragen, so daß das Fruchtfleisch (Mesokarp, m), die Gefäßbündel (f) und ein Same (s) sichtbar werden.
[Aus Vogl, Kommentar.]
Die Tamarinde ist ursprünglich im tropischen Afrika bis südlich zum Sambesi einheimisch. Der Baum durchzieht das Gebiet des Senegal, des Niger, Angola und des Tsad-Sees, geht in die Nilländer, durch den äußersten Nordosten Afrikas nach Mosambik bis ungefähr 24° s. B., während er seine Nordgrenze bei ungefähr 14½° n. B. am weißen Nil (nach SCHWEINFURTH schon bei 12° n. B.) erreicht (FLÜCKIGER). Er wurde aber sehr frühzeitig nach Arabien, Indien, Cochinchina, den Philippinen, Java, wie überhaupt nach Südasien gebracht und ist vielleicht sogar dort wie in Nordwest-Australien (F. VON MÜLLER) schon ursprünglich heimisch. Nach Tahiti kam T. schon durch COOK. Nach dem tropischen Amerika, besonders nach den Westindischen Inseln, Mexiko, Ecuador, Guayaquil, Brasilien, Argentinien ist die T. durch die Europäer im XVI. Jahrh. gebracht worden, hier hat sich eine Varietät (s. oben) entwickelt. DYMOCK[S. 531] glaubt, daß die T. in Süd-Indien einheimisch ist. BRANDIS bezweifelt es. Die Pflanze hat jedenfalls viele einheimische indische Namen. CRAWFURD hält sie auch für in Java einheimisch. Sie hat eigene malaiische Namen und spielt im Volksleben eine Rolle. Ich habe sie wild in Java nicht angetroffen. Eigentliche Anpflanzungen, Tamarindenwälder, traf ich nirgends in Süd-Asien, dagegen sehr oft den Baum in Alleekultur (I, Fig. 34) und auch wohl in den Kampongs (Taf. XIII). Dies gilt auch für Vorder-Indien (frequently planted in avenues and topes, HOOPER 1907). Einer der größten Plätze der Erde, der Koningsplein in Batavia, ist von einer Tamarindenallee umgeben. T. ist ein vorzüglicher Schattenbaum. Jetzt ist T. durch Kultur über alle tropischen Länder der Erde verbreitet, aber Versuche, bessere Spielarten in der Kultur zu erzielen, sind nirgends gemacht worden (SEMLER).
Lit. TAUBERT in Engler-Prantl. — LUERSSEN, Med. pharm. Bot. — ROXBURGH, Flor. Ind. III, 215. — BRANDIS, Forest flor. northw. a. centr. India 1874, 163. — BENTHAM, Flor. austral. II, p. 294. — OLIVER, Flor. trop. Africa II, 308. — FICALHO, Plantas uteis da Africa portugueza Lisboa 1884. — CRAWFURD, Dict. of Ind. islands 1856, 425. — HOOPER, Tamarindus Agric. Ledger 1907, Nr. 2. — F. V. MÜLLER, Not. s. 1. végét. de l’Australie. Melb. 1866. — MACFADYEN, Flora of Jamaica 1837, 335. — M. PÉREZ MACIEL, Bot. Min. Agr. Buenos Aires 3 (1905), 110. — DE CLERCQ, Nieuw plantkund. wordenboek. Nederl. Ind. 1909. — Die Kultur ist beschrieben in SEMLER, Tropische Agrikultur II, 209. — Abbild.: TSCHIRCH, Ind. Heil- u. Nutzpfl. t. 49 u. 50, BERG-SCHMIDT, Atlas I. Aufl. t. 9, PABST-KÖHLER, Medizinalpfl., t. 131, NEES, plant. med. t. 343, HAYNE, Arzneigew. X, t. 41, BENTLEY-TRIMEN, Med. plant. t. 92, WOODVILLE, t. 161, BOT. MAG., t. 4563, TAUBERT in Engler-Prantl, Pflanzenfam. III, 3, Fig. 79 und vielfach anderwärts. — Die ersten Abbildungen der T. finden sich in BONTIUS, Histor. nat. Indiae 1658 (I, S. 897) und bei PISO (I, S. 893). — RHEEDE bringt (Hort. malabar. I, t. 23) unter Balam pulli s. Maderam pulli (braman.: sinza) eine gute zweifarbige Abbildung eines fruchttragenden Zweiges, daneben Blüte und Samen sowie eine ausführliche Beschreibung. — RUMPF (Herb. Amb. 2, 90) gibt unter Tamarindus (= Assam djava) eine sehr ausführliche Beschreibung und auf Taf. XXIII eine gute Abbild. eines blühenden Zweiges mit Frucht u. Samen. — Ältere Beschreibungen: RAY, histor. plant. p. 1748. — SLOANE, Cat. pl. Jam. p. 147 (Synonyme). — MARCGRAF, Bras. hist. p. 107.
Pathologie. Den größten Schaden richten an der Tamarindenernte die Affen an, die «reinen Tisch» zu machen pflegen; dann Papageien und andere Vögel, Eichhörnchen und fliegende Füchse, weniger Insekten (SEMLER).
Gewinnung und Handelssorten. Pulpa tamarind. kommt besonders aus Ostindien und Westindien in den Handel. Die Levante scheint nichts von Bedeutung mehr in den Großhandel zu liefern, wenigstens fanden sich 1911 im deutschen Handel weder levantinische noch ägyptische Tamarinden, die zu POMETS Zeit im Handel vorherrschten. Die in Deutschland gebräuchlichen ostindischen, braunen «Calcutta» (black tamarinds) sind dunkelbraun oder fast schwarz und fest, nicht feucht, die in England vorgezogenen westindischen (red tamarinds) heller, gelbbraun oder rotbraun, oft feucht und weniger sauer. Die Endocarphüllen sind bei der westindischen Tamarinde nicht so lederartig, wie bei der ostindischen, die Farbe des Muses und des wässrigen Auszuges heller, der Samengehalt höher, die Gefäßbündel länger und dicker, der Geschmack süßer, die Samen sitzen oft noch zu 2–4 in der Hülle (BRUNNER).
Im deutschen Handel fanden sich 1911 Calcutta- und Madras-Tamarinden und in kleineren Mengen die westindischen Barbados. Die beiden ersteren Sorten, von denen Calcutta meistens die bessere Qualität ist [sie findet sich in Fässern (Oxh.) zu c. 250–350 kg], werden in der Hauptsache zum Ansetzen der Kautabaksaucen gebraucht, gehen aber auch in sehr großen Posten nach Süddeutschland,[S. 532] der Schweiz und Italien, um dort zur Herstellung von Fruchtsäften verwendet zu werden. Für medizinische Zwecke dürften Madras- (in Fässern zu c. 200 kg) und Calcutta-T. weniger verwendet werden, eine größere Verwendung für derartige Zwecke, in der Hauptsache als Abführmittel, finden die westindischen Barbados-Tamarinden, die aber von deutschen Firmen fast garnicht, sondern ausschließlich von englischen Firmen in den Handel gebracht werden (CAESAR und LORETZ).
Der indische Markt unterscheidet mehrere Qualitäten, je nach dem Gehalt an Schalen, Samen und Fasern. Die guten Sorten werden einem Nachreifungsprozeß an der Sonne unterworfen. Die Tamarinden müssen, um ein schönes Aroma aufweisen zu können, genügend lange in Indien liegen bleiben, damit der richtige Gärungsprozeß im Produktionsland stattfindet. Je früher die Verladung der Tamarinden von Calcutta erfolgt, desto weniger haltbar ist meistens die Ware, und auch das Aussehn der zu früh verschifften Ware ist nicht dunkelbraun, sondern fuchsig (CAESAR und LORETZ). Erst durch diesen Gärungsprozeß wird also das frisch hellrotbräunliche Fruchtmus schwarz. In Indien wird das von dem Epicarp und den Samen befreite Mus oft mit 10% Salz gemischt und mit den Füßen zu einer gleichmäßigen Masse geknetet. Diese Pulpa gelangt nicht zur Ausfuhr nach Europa. In Guzerat, Dekkan, Kontan wird das Fruchtmus bisweilen mit Seewasser zu einem breiigen Teig geknetet und dieser in Säcke verpackt (FLÜCKIGER). Mit Zucker werden ostindische Tamarinden nur selten präpariert. In Indien wird T. produziert in Nasick, Poona, Juneer, Kaira, Tullgaum. Am meisten geschätzt ist die Guzeratsorte. Calcutta ist wichtigster Tamarindenhafen für den Export nach Europa, weniger Madras und Bombay. Bombay exportiert viel nach Sind, Persien und dem Roten Meer.
Hamburg empfing 1909: 148600 kg (TUNMANN); Triest importierte 1903 noch 5039, 1904: 3217, 1908: 217, 1904 nur 4 quint Tamarinden.
In Westindien werden die Früchte von der Schale sorgfältig befreit, in Fässern übereinander geschichtet und kochender Sirup darüber gegossen bis das Faß voll ist (oder vorher zwischen die Früchte Zucker geschichtet, WRIGHT). Es ist auch nicht mit Zucker behandeltes westindisches Mus im Handel. Das westindische Tamarindenmus, das, da es keinem Gärungsprozeß wie das ostindische unterworfen wird, rotbräunlich gefärbt ist, gelangt in Fässern aus St. Kitts, Nevis, Antigua, Montserrat, Dominica, Martinique, Barbados, Grenada und Guayaquil vorwiegend nach London. Die brasilianischen Tamarinden werden besonders nach Nordamerika verschifft. Amerika importierte 1897 für 2699 Dollars Tamarinden.
Am oberen Nil (Cordofan, Sennaar, Darfur, Arabien) wird die Pulpa in bis 1 kg schwere Kuchen gepreßt, die an der Sonne getrocknet werden. Diese sind schwarz und fest und außen oft sehr unrein. Sie wurden früher bisweilen als ägyptische Tamarinden im Handel angetroffen und kamen über Alexandrien nach Marseille, spielen jetzt aber nur im afrikanischen Binnenhandel eine Rolle. Ähnliche Kuchen formt man in Senegambien und Arabien. Auf den Märkten in Java und Singapore traf ich sowohl die ganzen Früchte, wie das zu Kuchen vereinigte, in Pisangblätter eingeschlagene Fruchtmus.
Lit. FLÜCKIGER-HANBURY, Pharmacographia. — DYMOCK, Veg. mat. med. West. Ind. — Pharmac. indic. — WRIGHT, Med. pl. of Jamaica. — LUNAN, Hort. Jamaicens. II (1814), 224.
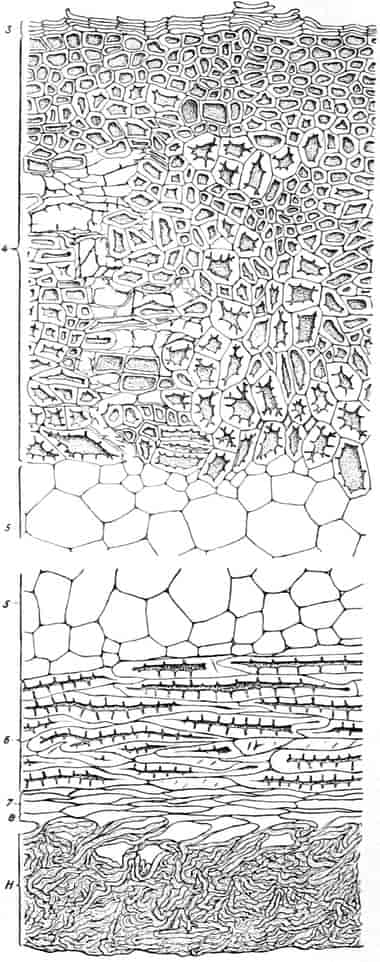
Tamarindus indica L. Querschnitt durch die Fruchtschale. 3–4 Epikarp. 5 Mesokarp. 6–8 und H Endokarp. H Haarschicht, verfilzt.
[Nach Hallström.]
Beschreibung der Droge. Die Droge bildet ein nicht sehr appetitlich aussehendes, entweder schwarzbraunes oder schwarzes (Calcutta-T.) oder rotbraunes (westindische T.) Mus, das hauptsächlich aus dem weichen, aber bald hart werdenden Mesocarp[S. 533] (Sarcocarp) der Frucht, das sich schon beim Trocknen der Frucht vom Epicarp ablöst, besteht und in das einmal die derben Mesocarpbündel, dann die papierdünnen, die Fruchtfächer auskleidenden Endocarptaschen und endlich die Samen eingebettet sind. Alle diese Teile treten besonders beim Aufweichen des Muses deutlich hervor. Die Samen sind wenig regelmäßig, verkehrt-eiförmig, rundlich, fast viereckig, etwas zusammengedrückt, braunrot oder rotbraun, glänzend, bis 17 mm breit, bis 8 mm dick, mit schmaler Randfurche, die dem Nabelstreifen entspricht. Die Samen sind auch nach Einweichen in Wasser steinhart und nicht zu schneiden («pisa ipsius saxea fere sunt duritate», J. BONTIUS 1642), sägt man sie aber durch und legt sie in Wasser, so werden sie schneidbar und die äußere Schicht der Samenschale rollt sich an den Samenrändern (nicht im Mittelfelde!) in einzelnen sich kräuselnden Schuppen ab — eine für die Tamarindensamen höchst charakteristische, anatomisch zu begründende Erscheinung. Das Mittelfeld ist etwas eingesunken und zeigt Parallelstreifen. Der etwas dickere Rand ist grobwarzig. Der Samenkern besteht fast nur aus den großen, hornigen, plankonvexen Cotyledonen, zwischen denen ein kleines, etwas zurückgezogenes Würzelchen und eine noch kleinere Plumula sichtbar wird. Das Durchschnittsgewicht der Frucht beträgt 6–10 g. Von 100 Teilen Frucht kommen 41 Teile auf das Fruchtfleisch, 30 Teile auf die Schale und 29 Teile auf die Samen (pulp: 55, seeds: 33.9, shell and fibre: 11,1, HOOPER).[S. 534] 100 Samen wiegen 75,88 g. Der Gehalt der Pulpa an Samen darf 10% nicht übersteigen. K. MÜLLER fand 2 bis 9,8% (in nicht revisionsfähiger Ware 20,6 und 38%), BRUNNER 3,45–37% (in 15 von 21 Mustern unter 10%), ADAM 7–8%. Werden 20 g gut durchgemischtes Tamarindenmus mit 190 g Wasser übergossen und durch zweistündiges Schütteln ausgezogen, so müssen beim Abdampfen von 100 g des Filtrates mindestens 5 g trockenes Extrakt bleiben (Ph. helv. IV). Der Droge dürfen nur geringe Mengen des Epicarps (äußere Hüllschicht, D. A. V) und nur wenige Pilzsporen beigemengt sein. Die Droge schmeckt schwach süßlich und stark sauer und riecht eigenartig (nicht dumpfig!). Man bewahrt sie in Steintöpfen auf. Sie wird leicht hart.
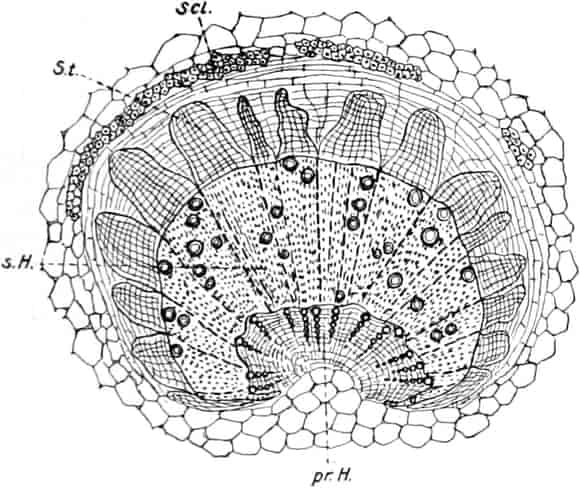
Tamarindus indica L. Querschnitt durch ein Hauptbündel der Fruchtschale aus dem Mesokarp.
[Nach Hallström.]
Anatomie. Die Fruchtknotenwand läßt noch die Bauchnaht erkennen, d. h. die Stelle, wo die Ränder des Carpells verwuchsen. Auf der Rückenseite liegt ein großes Bündel, die Mittelrippe des Carpells, gegen die Bauchnaht hin beiderseits je ein etwas kleineres und rechts und links von der Bauchnaht je zwei ganz kleine Bündel — also im ganzen sieben, drei große, bis zur Spitze gehende und vier kleine kurze. Von diesen gehen dann später zahlreiche Zweige ab, die das Fruchtfleisch durchziehen. Die Innenwand wird später von Haaren ausgekleidet. Zwischen den Samenfächern unterbleibt diese Haarbildung und die Endocarpstreifen legen sich mit schwach papillöser Epidermis fest aufeinander (HÄLLSTRÖM). Das Epicarp der reifen Frucht (Fig. 175) besteht zum überwiegenden Teile aus kurzen drei-, vier- oder vieleckigen Sklereïden mit dicker gestreifter und reich getüpfelter Membran und verschieden großem, mit einer braunen, durch Eisenchlorid sich schwärzenden, in Kali aber kaum löslichen Phlobaphenmasse erfülltem Lumen. Außen ist es von einer abschülfernden Korkschicht bedeckt, die aus einem subepidermalen Phellogen hervorgeht, das die außerhalb liegenden Partien abstößt, wodurch die Zeichnung der Oberfläche der Frucht (s. oben S. 530) bedingt wird. In den äußersten kleinen Sklereïden und in dem zwischen die Sklereïden eingestreuten Parenchym finden sich bisweilen wohl ausgebildete monosymmetrische Kalkoxalatkristalle. Die Sklereïden liegen entweder zu Gruppen vereinigt oder isoliert. Die Fruchtschale ist daher in hohem Grade zerbrechlich. Nach Innen zu geht die Sklereïdenschicht in das lockere Parenchym der Mittelschicht der Fruchtschale, das Mesocarp, über, von dem einige Schichten der Schale anzuhängen pflegen, der übrige Teil ist samt den Samen von der Schale abgelöst und liegt als eine kompakte Masse im Innern des Ganzen, einen ziemlichen Zwischenraum zwischen sich und der äußeren Fruchtschale lassend. Diese Mittelschicht der Fruchtschale, das Mesocarp, bildet das sog. «Fruchtmus». Sie besteht aus vielen Zellreihen sehr zartwandiger, parenchymatischer Zellen. Ihre Wand wird durch Jod schwach gebläut (FLÜCKIGER). Betrachtet man das Mus der Droge unter dem Mikroskop in Glycerin oder Öl, so[S. 535] sieht man zahlreiche, meist infolge Pektinbildung in der Zwischenzellsubstanz mehr oder weniger isolierte, 80–160 mik. große Zellen, die einen braunen zuckerreichen Inhalt und häufig auch zahlreiche kleine, 1,5–18 mik. große Stärkekörner enthalten. Daneben findet man drei Kristallformen: derbe, unregelmäßig ausgebildete, gestreckt-prismatische, tafelförmige und um einen Punkt angeordnete nadelförmige Kristalle (TSCHIRCH). Besonders die großen Tafeln des erst in heißem Wasser löslichen Weinsteins treten gut hervor, die anderen Kristalle sind Weinsäure und Zucker, die sich schon in kaltem Wasser lösen. Gefäßbündel durchziehen besonders reichlich die äußersten Partien der Mittelschicht der Fruchtschale, so daß bei dem Ablösen der Mittelschicht von der äußeren Fruchtschale auf ersterer ein reich verzweigtes Netz zarter und gröberer Gefäßbündel oberflächlich aufzuliegen pflegt. Für die Entwicklung von Schimmelpilzen ist dieser feuchte Raum und der gute Nährboden sehr geeignet. Man findet denn auch dort oft zahlreiche Kolonien. Auch in den tiefer liegenden Partien finden sich Bündel. Dieselben sind jedoch meist zarter — auch weniger zahlreich. Die oftmals von Kristallkammerfasern begleiteten Bündel der Tamarindenfruchtschale zeichnen sich durch einen oft ziemlich breiten Bastzellpanzer und viel Libriform aus, demgegenüber die wenigen getüpfelten und Spiral-Gefäße und der Siebteil nur einen kleinen Raum einnehmen. Das große Rückenbündel wird von relativ wenigen Bastzellgruppen begleitet, führt aber in dem mächtigen Holzkörper reichlich Libriform. Auch sein Siebteil ist stark entwickelt (HÄLLSTRÖM). Der innerste Teil der Fruchtschale, das Endocarp, das die Samenfächer als Pergamenthaut auskleidet, ist dreischichtig. Unmittelbar an das Mesocarp nach innen zu schließt sich ein drei- bis fünfreihiger Bastzellpanzer, dessen tangential gestreckte, bis 300 mik. lange, bis 18 mik. breite Zellen ziemlich stark, aber ringsum gleichmäßig verdickt, und mannigfach verbogen, also fest miteinander (gegen tangentialen Zug) verzahnt sind. Diese Bastzellen besitzen große, linksschiefe Spaltentüpfel. An diese Schicht schließt sich eine Zone dünnwandiger Zellen und an diese die silberglänzende, jedes einzelne Samenfach rings auskleidende Haut, die von außerordentlich langgestreckten dünnen, hin und her gebogenen und miteinander verfilzten Zellen (Fig. 175 u. 177) gebildet wird, die sich in der Nähe der Querwände der Samenfächer oft zu einzelnen Fäden isolieren, so daß sich dort ein zartes, durchbrochenes Netz langer Zellen von einer Seite zur anderen spannt. Diese Schicht geht aus den die Fruchtknotenhöhle auskleidenden Haaren hervor (TRÉMEAU). Calciumoxalat (FLÜCKIGERS Quarzkörnchen?) findet man außer in den Kristallkammerfasern der Bündel (s. oben) auch in der an die Pergamenthaut angrenzenden Schicht des Mesocarps, weniger im übrigen Mesocarp (HÄLLSTRÖM).
Tamarindus indica. Die Haarschicht des Endokarps. Beginnende Verfilzung.
[Nach Hällström.]
Die Samen werden von einer Testa umhüllt, deren äußerste Schicht aus c. 190 mik. langen und 8–11 mik. breiten, radial gestellten, mit spaltenförmigen[S. 536] Lumen versehenen Palissadensklereïden gebildet wird. Diese Sklereïdenschicht ist an dem Rande des Samens einreihig. Die Zellen besitzen hier eine sehr gegen Wasser empfindliche Wand, so daß sich Teile der Schicht im Wasserpräparat abrollen. Dadurch wird die oben (S. 533) erwähnte Erscheinung bedingt. Ihre Wand ist außen braun, innen hell. An dem breiten eingesunkenen Mittelfelde der Breitseiten des Samens (s. oben S. 533) ist die Palissadenschicht zweireihig. Außen liegt eine gefärbte, innen eine farblose Palissadensklereïdenreihe, die genau aufeinander passen, so daß sich das Spaltenlumen durch beide fortzusetzen scheint. Man kann aber zwischen beiden eine zarte Trennungsmembran sehen. Das erweiterte Lumen der inneren Reihe enthält kleine Körnchen. Die Palissadenschicht des Mittelfeldes ist nicht empfindlich gegen Wasser (s. oben S. 533). Unter der Palissadensklereïdenschicht folgt eine Zone heller, bisweilen knochenförmiger oder doch radialgestreckter, oft chlorophyllführender Zellen mit stark quellbarer Wand. Die knochenförmigen Zellen sind am eingesunkenen Mittelfelde besonders hoch und gut ausgebildet. Dann folgt eine verschieden mächtige Schicht kleiner ausgebuchteter oder sogar sternförmiger derber Zellen, die einen rotbraunen, in Wasser unlöslichen Inhalt führen und viele Interzellularen zwischen sich lassen (VOGL stellt ihren Inhalt den Inklusen der Ceratonia an die Seite). Die innerste Schicht endlich, die sich in Wasser ebenfalls stark streckt, wird von großen, dünnwandigen, in den inneren Schichten oft radialgestreckten Zellen gebildet, die ebenfalls einen rotbraunen Inhalt führen. Zwischen den beiden Schichten liegt bisweilen eine Zone obliterierter Zellen. Die beiden den Samenkern bildenden plankonvexen Cotyledonen besitzen sehr stark verdickte, mit großen Tüpfeln versehene Zellen, deren sekundäre Wand sich mit reinem Jod nicht (NÄGELI), wohl aber mit jodwasserstoffhaltiger Jodlösung bläut, die also aus Amyloid besteht (vgl. oben S. 263) und deren enges Lumen vollgepfropft ist mit in Ölplasma (TSCHIRCH) eingebetteten kleinen, nur 4–7 mik. großen Aleuronkörnern. Procambiumstränge durchziehen das Interzellularen führende Gewebe. Erhitzt man den Schnitt mit Wasser zum Sieden, so lösen sich die sekundären Amyloidmembranen und es bleibt nur das Netzwerk der primären Membranen und die Öltropfen übrig. Das Amyloid der Tamarinden verhält sich also ähnlich wie Lichenin (s. oben S. 263). Die c. 3 mm lange kegelige Radicula trägt oben die c. 1 mm lange Plumula, an der der kegelige Vegetationspunkt und eine Gruppe junger Blattanlagen sichtbar ist, die schon deutlich die Fiederung zeigen (Fig. 173).
Lit. NÄGELI, Reakt. von Jod auf Stärkekörner und Zellmembranen. Sitzungsb. d. Münch. Akad. 1863 (Buchn. Rep. 13 [1864] 145). — TRÉMEAU, Rech. s. l. devel. du fruit et de l’orig. d. la pulpe d. l. casse et du tamarin. Thèse Paris 1892. — K. H. HÄLLSTRÖM, Z. Entwickg. d. Fruchtwand v. Cer. Sil. u. Tamar. ind. Ber. d. pharm. Ges. 1910, 446. — VOGL, Commentar 1908. — PAMMEL, Journ. appl. Micr. I, 37.
Chemie. Der charakteristische Bestandteil der Tamarinden ist der Weinstein, das primäre Kaliumsalz der d-Weinsäure (S. 527).
Der Weinstein war schon im Altertum bekannt und wurde auch zur Darstellung von Pottasche benutzt. Für Faex vini, τρύξ οἴνου, kam im XI. Jahrh. der Name Tartarum, dann Tartarus auf, welches Wort wohl aus dem arabischen durdijjᵘⁿ umgebildet und dann umgedeutet wurde (durdijj = Bodensalz, sowohl beim Öl wie beim Wein, in tartarus = Unterwelt). MARGGRAF fand in ihm 1764 das Alkali. SCHEELE zerlegte 1769 das Calciumtartrat und isolierte die Weinsäure (Sal essentiale Tartari), die er auch in den Tamarinden nachwies. Aber bereits ANGELUS SALA, dem wir eine Tartaralogia verdanken (I, S. 868), hatte (1647) Weinstein im eingedampften Auszuge der Tamarinden beobachtet und CORNETTE sowie DE LASSONE hatten[S. 537] sein Vorkommen in den T. bestätigt. Weinsäure neben Weinstein fand schon DE LASSONE in den T. SCHEELE erkannte sie 1770 als eine besondere Pflanzensäure, die er in den T. nicht von Citronensäure und Apfelsäure begleitet fand (RETZIUS erhielt 1776 Weinsäure rein und kristallisiert, I, S. 967).
VAUQUELIN zeigte 1790, daß der ausgepreßte Saft von Tamarinden (und anderen Früchten) in der Ruhe zu einer zitternden durchscheinenden Gallerte erstarrt. Das Pektin, von VAUQUELIN gélatine (gelée végétale) genannt, von BRACONNOT 1834 in Pektin umgetauft, wurde also in der Tamarinde entdeckt. VAUQUELIN fand in Prozenten: 12,51 Zucker, 5,11 Gummi, 6,25 Gélatine, 9,4 Citronensäure, 1,56 freie Weinsäure, 3,25 Weinstein, 0,42 Apfelsäure, 37,5 Matières féculentes, 24 Wasser; SCHEELE fand keine Citronensäure (s. oben). FLÜCKIGER-HANBURY geben kleine Mengen an (FLÜCKIGER 1889: 7,17%); die Angabe NESSLERS, daß Tamarinden 13,5% davon enthalten, beruht wohl auf einem Beobachtungs- oder Rechenfehler. Die bei der Destillation mit verd. Schwefelsäure übergehende Ameisensäure, Essigsäure (GRÜNZWEIG) und (in Spuren) Buttersäure (GORUP-BESANEZ) betrachten die meisten Autoren als aus der Weinsäure (und Citronensäure) bei der Gärung hervorgegangen, also als sekundäres Produkt, da Weinsäure bei der Oxydation diese drei Säuren liefert. 1 g der im Handel befindlichen Pulpa vermag meist 14–17 ccm n/10 Natron zu neutralisieren (FLÜCKIGER). Bei der Dialyse des Muses dialysiert vornehmlich Weinstein und im Dialysator bleibt das Pektin (FLÜCKIGER, TSCHIRCH).
K. MÜLLER fand in der von den Samen befreiten Pulpa von Calcutta T. 21,92 bis 32,58 (im Mittel 27)% Wasser, 12,2–20,2 (M. 16,2)% unlöslichen Rückstand, 4,66–6,01 (M. 5,27)% Weinstein, 5,29–8,80 (M. 6,63)% Weinsäure, 0,64–3,95 (M. 2,20)% Citronensäure (+ Apfelsäure, die in sehr geringer Menge vorhanden). 1 g brauchten im Mittel zur Neutralisation 17,6 n/10 Ammon. Die wasserfreie Pulpa enthielt im Mittel 7,2% Weinstein und 9,09 Weinsäure. BRUNNER fand (1891) in Calcutta T. (und einer Sorte westindischer T.) 20,4–29,27 (22,79)% Wasser, 29,05–56,13 (21,53)% Extrakt, 12,16–21,52 (15,42)% Cellulose, 0,66–4,68 (5,37)% Schleimstoffe, 14,93–22 (20,47)% Zucker, 3,6–5,87 (4,62)% Weinstein, 4,29–7,92 (6,84)% Weinsäure, 0,78–3,08 (3,72)% Citronensäure, Spuren Apfelsäure (nicht regelmäßig). Die Asche des Löslichen betrug: 2,81–4,87%, die des Unlöslichen 0,721–2,27%. Schwermetalle waren nicht nachweisbar. BABO und MACH erhielten im Mus 34,33% Zucker als Invertzucker berechnet, 15,51 freie Säure auf Weinsäure berechnet, 6,61 Weinstein, 8,23 freie Weinsäure, 4,4 Apfelsäure, keine Citronensäure, 3,3 Asche. Auch ADAM erhielt (1905) keine Citronensäure, dagegen mehr l-Apfelsäure als die früheren Autoren und etwas Milchsäure und Essigsäure. ADAM fand in kernfreiem Mus: Acidität (als Weinsäure ausgedrückt): 15,4%, Weinstein 7,74%, Weinsäure im Weinstein 6,17%, freie Weinsäure 10,18%, hieraus Gesamtweinsäure berechnet 16,35%, flüchtige Säure, als Essigsäure, 0,014%, Milchsäure 0,465%, Apfelsäure + Milchsäure, als Apfelsäure berechnet, 2,01% — in Wasser unlöslich 12,36, Wasser 30,5, Asche 2,89, Rohprotein 3,22, Invertzucker 24,73. Die Lösung dreht links, nach Vergären bleibt eine schwache Rechtsdrehung bestehen. In 100 T. Fruchtfleisch javan. Tamarinde fand PRINSEN GEERLIGS 5,81 Dextrose und 2,51 Lävulose; Saccharose fehlte. Eine andere Analyse javan. T. von BOSZ (1910) ergab dagegen 41,91% reduz. Zucker, keine Saccharose, 0,44% Fett, 8,16% Stärke, 26,9% Wasser, 3,03% Asche.
Die Asche der Pulpa tamarindi enthält bisweilen Kupfer (über die Verbreitung des Kupfers bei Drogen vgl. TSCHIRCH, Das Kupfer vom Standpunkt d. gerichtl. Chem. usw. Stuttgart, Enke 1893).
REMEAUD untersuchte aus Früchten von Indo-China selbst dargestelltes Tamarindenmus. Er fand in 100 g ganzer Frucht: Epicarp und Gefäßbündel 24,35, Endocarp: 7,76, Samen 37,07, Pulpa 29,31. Die Pulpa enthielt:
[S. 538]
|
In 100 g
|
Präparierte
Pulpa |
Gereinigte
Pulpa |
Rohe Pulpa
ohne Samen |
|
Trockenes Extrakt
|
62,831
|
73,04
|
73,015
|
|
Wasser (und bei 100° flüchtige Bestandt.)
|
37,169
|
26,96
|
26,965
|
|
Asche
|
2,816
|
3,259
|
3,198
|
|
Unlöslich in Wasser
|
6,246
|
7,078
|
12,348
|
|
Gesamtsäure (auf Weinsäure berechnet)
|
11,729
|
15,340
|
15,888
|
|
Weinstein
|
6,055
|
7,340
|
6,575
|
|
Phosphorsäure
|
0,248
|
0,375
|
0,275
|
|
And. Säuren (nicht bestimmt, auf Weinsäure berechnet)
|
3,603
|
5,378
|
5,906
|
|
Invertzucker
|
42,307
|
34,284
|
32,000
|
|
Saccharose
|
0,669
|
0,460
|
—
|
|
Pektin
|
0,352
|
—
|
1,379
|
Es ist also auch heute noch nicht sicher festgestellt, ob Tamarinden Citronensäure enthalten oder nicht. Nach einem vorläufigen Versuche zu urteilen, halte ich ihr Vorkommen in den ostindischen T. des Handels für zweifelhaft. Vielleicht wird die ursprünglich vorhandene Citronensäure durch den Gärungs- bzw. Nachreifungsprozeß (oben S. 532) zerstört.
DIETERICH fand (1894) in kernfreiem Mus: 10,83–16,10% «Säure» (durch Titration ermittelt und auf Weinsäure berechnet), 19,5–34,26% Zucker und 41,7–57,37% Extrakt. 1904 in Pulpa Tamar. cruda: 3–12% Kerne, 88–97% kernfreie Pulpa, 35–49,51% bei 100° getrocknetes wässeriges Extrakt, 9,66–13,85% «Weinsäure», 20–37,4% Invertzucker.
Gute Tamarinde sollte nicht mehr als 15% Zellulose und 22% Wasser enthalten und nicht weniger als 45% Extrakt geben.
Die Substanz, welche die abführende Wirkung bedingt, ist unbekannt. SOUBEIRAN und REGNAUD führen sie auf den Weinstein, die Säuren und ein (unbekanntes) principe résinoide zurück. Doch dürfte auch der Zucker daran beteiligt sein.
Die Samen (die Samenkerne) enthalten in Prozenten: 10,5 (9,35) Wasser, 13,87 (18,06) Eiweiß, 4,5 (6,6) Fett, 63,22 (62,88) Kohlehydrate, 5,36 (0,66) Faser, 2,55 (2,45) Asche (HOOPER). Ölgehalt nach (SCHÄDLER) 15–20%. Der Samenkern gibt, da er Amyloid enthält, mit Wasser gekocht eine dickliche, mit Jod sich bläuende Lösung (s. Anatomie), die bei der Hydrolyse Galaktose, beim Behandeln mit Salpetersäure Schleimsäure liefert. Das Öl des Samen scheint in den (94,9%) Fettsäuren Arachinsäure zu enthalten. Säurezahl: 0,84, Verseifungszahl: 183, Jodzahl: 87,1 (HOOPER).
Ein Exsudat des Baumes von Calciumoxalat beobachtete PREBBLE (Pharm. ind.).
Lit. SALA, Opera medico-chym. Frankf. 1647, 137. — DE LASSONE, Hist. d. l. Soc. Méd. Paris II, 269. — SCHEELE, Phys. u. chem. Werke II, 379 (1770). — RETZIUS, Versuche mit Weinstein u. dessen Säure. Abh. d. Schwed. Akad. 1770. — VAUQUELIN, Analyse du Tamarin et reflexions s. quelqu. unes d. s. prép. medic. Ann. d. chim. 5 (1790), 92 (dort die ältere Lit.: ROUELLE, CARTHEUSER, BUCQUET). — GORUP-BESANEZ, Buttersäure in den Früchten des Seifenbaumes (Sapind. Saponaria) nebst einigen Bemerk. über d. flücht. Säuren d. Tamarinden. Lieb. Ann. 69 (1849), 369. — C. GRÜNZWEIG, Über Buttersäuren verschied. Ursprungs. Lieb. Ann. 162 (1872), 227. — PFAFF, Syst. d. Mat. med. — K. MÜLLER, Über Tamarinden, Pharm. Centralh. 1882, 581. (Arch. Pharm. 1883, 42). — F. J. H. BRUNNER, Bestandt. d. Fruct. Tamar. Apoth. Zeit. 1891, 53. — NESSLER u. BARTH, Zeitschr. anal. Chem. 1882, 63. — PRINSEN GEERLIGS, Zuckergeh. Chem. Zeit. 1897, 719. — BOSZ, Bull. Kolon. Mus. Haarlem Nr. 46, 1911. — DIETERICH, Helfenb. Ann. 1888, 1893, 1894. — ADAM, Beitr. z. Kenntn. d. Tamar. Zeitschr. d. Öster. Apoth. Ver. 1905, 797. — BABO u. MACH, Handb. d. Weinb. u. d. Kellerwirtsch. II, 766. — O. REMEAUD, Sur l. comp. d. l. pulpe de tamarin. Journ. pharm. 1906,[S. 539] 424. — Die Methoden zum Nachweis und zur Bestimmung der Weinsäure und Citronensäure (sowie des Weinstein) bei K. MÜLLER (a. a. O.), BRUNNER (a. a. O.), ADAM (a. a. O.), REMEAUD (a. a. O.). Vgl. ferner bei BARBET (Chem. Centralbl. 1859, 366), SCHNITZLER (Ebenda 1862, 317), FLEISCHER (Arch. Ph. 1874, 97), ALLER (Arch. Pharm. 1876), CAILLETET (Ebenda 1878), SALZER (Ebenda 1888) und in SCHMIDT, Pharmazeut. Chemie. Vgl. auch oben S. 508. Eine ganz scharfe Methode, kleine Mengen von Citronensäure neben Weinsäure nachzuweisen, gibt es zurzeit noch nicht.
Pektin: SOUBEIRAN, VAUQUELIN, PAYEN, BRACONNOT (vgl. unter Pektin S. 277); — FRÉMY, Chem. Unters. über d. Reifen der Früchte, Pektose, Pektase (deutsch v. GRÄGER) 1851 (Ref. in Arch. Ph. 68 [1851], 72); — Übersicht bei REICHARDT, Die Gruppe der Pektinkörper. Arch. Pharm. 56 (1877), 116 und in GMELINS Handb. 1862.
Samen: HOOPER, Agric. Ledger 1907, Nr. 2. — SACHSSE, Chemie d. etc. Kohlenhyd. 1877. — TOLLENS, Kohlenhydrate I, 227. — SCHÄDLER, Öle. — Über Amyloid s. oben S. 263.
Verfälschung. Als Verfälschungen sind beobachtet besonders beigemischte Samen und Fruchtwandstücke, dann Wurzelteile (1891), Melasse. Eine Verfälschung mit Zucker, anderen Musen usw. lohnt bei dem billigen Preise der Tamarinden nicht (Pflaumenmus erwähnt schon MESUË). In schlechtem Mus finden sich bisweilen Maden und Milben. Als zufällige Beimengungen können (von den beobachteten) Leinsamen und Kürbiskerne gelten. Kupfer (durch Einstellen eines blanken Messers nachzuweisen) ist neuerdings nicht mehr beobachtet (s. oben S. 537).
Anwendung. Die Tamarinde ist noch heute ein sehr beliebtes gelindes Abführmittel, wie zur Zeit des MESUË, wo wir im Grabaddin (I, S. 599) das Tamar Indorum unter den medicinis solutivis als Bestandteil der Laxirlatwergen antreffen (s. Geschichte). Die allerdings stark vereinfachte Senna-Tamarindenlatwerge steht noch in unseren neuesten Arzneibüchern und die Tamarindenkonserven (Confectio s. conserva t., Tamarindenkonserven KANOLDT, Tamar indien GRILLON) erfreuen sich großer Beliebtheit. (Der Tamarindenmolken, Serum lactis tamarindinatum, der Anfang des XIX. Jahrh. sehr beliebt war, ist jetzt aus der Mode gekommen.) T. wurde also schon während des Mittelalters in Europa als Purgativ benutzt. LINSCHOTEN empfiehlt sie besonders als billiges Abführmittel an Stelle von Rhabarber, Manna usw. PALUDANUS berichtet, daß die Türken und Ägypter sie viel bei Fieber brauchen. Tamarindenlimonade wird von Fieberkranken auch heute noch gern als erfrischendes Getränk genommen. Die als unschätzbare, köstliche Gabe der Natur von den Reisenden bezeichnete Frucht des den größten Schmuck der Negerländer bildenden Baumes, die von höchster Bedeutung für die trockenen, vegetationsarmen Länder, namentlich die Binnenländer Afrikas, ist (ROHLFS, BARTH, MUNZINGER), wird bei Reisen durch den dunklen Erdteil teils zur Herstellung erfrischenden Trankes, teils auch dazu benutzt, verdorbenes Wasser trinkbar zu machen. In Cordofan ist das Fruchtmus zu Ballen geformt, allein und mit Senna, auch Abführmittel, ebenso sind die Rinde und die Wurzel dort in Gebrauch. BONTIUS (I, S. 897) beschreibt ein in Java aus Tamarinden bereitetes Bier von delikatem Geschmack und großer Bekömmlichkeit für den Tropenbewohner. Das gleichzeitige Vorkommen von Zucker und Weinstein ladet geradezu dazu ein, die Tamarinden zur Kunstweinfabrikation heranzuziehen, was denn auch schon seit längerer Zeit auch bei uns (wie seit langem in Indien) geschieht. Tamarindenfruchtsirupe und Bonbons sind besonders in Italien beliebt. Mit Butter und Zwiebel bildet das Mus eine sehr erfrischende Nahrung, mit Zwiebeln, Honig und Pfeffer ein beliebtes Mittel gegen Klimakrankheiten in Afrika. In Indien werden daraus mit Zucker oder Gewürzen beliebte Leckereien bereitet und das Mus auch für Saucen, Currie etc., sowie zur Bereitung der sog. Tamarindenfische benutzt. Man findet T. auf jedem Markt in Südasien (TSCHIRCH). Dann dienen T. auch zum Saucieren des Kau- und Schnupftabaks. Bei Hungersnot, wie sie ja in Vorderindien häufig ist, spielt der Same eine ziemlich große Rolle. Er wird als famine food besonders in der Präsidentschaft Madras und Central-India, dann auch in Bengalen und den Zentralprovinzen benutzt (HOOPER) und eignet sich wegen seiner Zusammensetzung (oben S. 538) hierzu sehr gut, besonders wenn er von der gerbstoffhaltigen Schale befreit wird. Die Samen werden daher zur Entfernung der Schale geröstet und eingeweicht und die Kerne dann gekocht oder gebacken oder vermahlen und dem Mehl zugesetzt. Roh werden sie wie Betel gekaut. Der aus den Samen bereitete Kleister (s. oben S. 536) dient zum Stärken. Sie finden[S. 540] auch medizinische Anwendung äußerlich und innerlich (DYMOCK). In Indien werden von der Tamarinde auch die angenehm sauer schmeckenden, ebenfalls abführenden Blätter, die Blüten, die Rinde und das Gummi benutzt, wie auch die Asche der Rinde und die Blätter (Pharmac. ind.).
Lit. HOOPER, Agr. Ledg. 1907. — BARTH, Reis. u. Entdeck. in Nord- u. Central-Afrika 1858 I, 614, III, 334, 400. — ROHLFS, Reisen durch Nordafrika 1872, 23. — MUNZINGER, Ostafrikan. Studien 1864. — DYMOCK, Veg. Mat. med. West. Ind.
Geschichte. Unter den Heilpflanzennamen des alten Ägyptens ist keiner bis jetzt als auf T. sich beziehend sicher erkannt worden. Aber unter den Drogen, die z. B. der Papyrus EBERS als Bestandteile der Composita anführt, sind noch sehr viele nicht gedeutet. Vielleicht ist die Frucht vom Kesebtbaum, die dort unter den Abführmitteln steht, die der Tamarinde (EBERS deutet sie, mir nicht einleuchtend, als Ricinus, der aber andere Namen hatte; in Cordofan heißt die T. heut: ardeb). Der Baum kam im Altertum nicht in Ägypten vor, ist aber wohl die κερατία des STRABO (I, S. 532), die dieser (Lib. XVII, c. 2, § 1) um 20 n. Chr. in Äthiopien (wo ja Ceratonia nicht vorkommt) erwähnt (ERNST MEYER). — In Abyssinien traf F. ALVAREZ (1520) den Baum. — Doch haben sich die Ägypter des Tamarindenmuses, wie es scheint, beim Färben der Mumienbinden und beim Einbalsamieren bedient (JOHN). Die von GARDNER WILKINSON als Tamarindensamen gedeuteten, in einem Grabe von Theben gefundenen Gebilde erwiesen sich nicht als solche (BIRCH u. HANBURY). Der Tamarindenbaum war den Griechen bekannt. Er ist das δένδρον πολύφυλλον des THEOPHRAST, wie schon SPRENGEL ganz richtig vermutete. Sie trafen ihn auf dem Alexanderzuge am persischen Golf auf der Insel Bahrein (BRETZL). Doch bedienten sich die Alten nicht der Früchte. Die täglichen periodischen Bewegungen der Fiederblättchen der Tamarinde — am Abend legen sich die Fiederblättchen zusammen und die Spindel senkt sich nach unten — Bewegungen, die wir jetzt als nyctitropische bezeichnen, beobachtete zuerst ANDROSTHENES auf dem Alexanderzuge auf der Insel Bahrein und THEOPHRAST beschreibt (hist. pl. IV, 7, 8), offenbar nach dieser Quelle, die Erscheinung des Pflanzenschlafes bei der Tamarinde (Abbild. bei BRETZL) ganz korrekt und in meisterhafter Kürze. Die Erscheinung ist also bei der Tamarinde entdeckt worden. Sie fiel auch den Europäern, als diese Indien im XVI. Jahrh. betraten, sofort auf, z. B. GARCIA DA ORTA, ACOSTA u. and. Die alte Sanskritliteratur hat mehrere Namen für T. In der indischen Medizin spielte das Mus keine sehr große Rolle, wird aber in Indien noch jetzt benutzt. Unter den Abführmitteln von SUŚRUTAS (I, S. 504) findet sich wohl Cassia fistula, aber nicht die Tamarinde. Schon im alten Indien bedienten sich aber die Silberschmiede des Muses zum Weißsieden des Silbers (ähnlich wie später und noch heute des Weinsteins). Die medizinische Verwendung des Tamarindenmuses hat sich im Mittelalter von Indien über Arabien nach Europa verbreitet. Die Araber haben die T. jedenfalls von den Indern kennen gelernt, wie schon ihr Name tamr hindi = «Indische Datteln» zeigt. ALEXANDER TRALLIANUS (I, S. 591) kannte die T. noch nicht. ALHERVI (X. Jahrh., vgl. I, S. 601) beschreibt das schwarze, wie Pflaumen schmeckende, Mus der Tamr ul hindî gut mit seinen Fasern und Samen, wie wir es noch heute im Handel finden. ABU HASAN (bei IBN BAITHAR) und IBN SÎNÂ (I, S. 603) erwähnen die abführende und «herzstärkende» Wirkung der Früchte und ihren sauer-süßen Geschmack. Auch die Samen wurden von den Arabern arzneilich benutzt. Bei MESUË (XII. Jahrh., I, S. 600) steht Tamar indi unter den Abführmitteln neben Pruna und Cassia. Als Vorkommen erwähnt ABU HANIFA: Scharâh, Omân, ABU HASÂN: Yemen, Indien, Nigritien, Bassora. MESUË nennt Cambaya und Guzarate, SERAPION: Indien, BONIFAA (fälschlich): Syrien. 1270 wurden sie in Aden verzollt (I, S. 699). MARCO POLO erwähnt sie. Die Tamarinden stehen auch sowohl im ältesten wie im jüngsten persischen Werke über Pharmakologie: sowohl bei ALHERVI (MUWAFFAK, X. Jahrh. I, S. 601) wie im MAKHZAN EL ADWIYA (XVIII. Jahrh. I, S. 614). Sie nehmen aber im mittelalterlichen Handelsverkehr keine hervorragende Rolle ein (FLÜCKIGER). Die Schule von Salerno übernahm die T. von den Arabern als Oxifenica und Dactyli acetosi. So z. B. bei PLATEARIUS und SALADIN, der sie für eine Palmenfrucht hielt. Tamarinden sind (meist in Verbindung mit Cassia fistula, Senna, Rosinen, Pflaumen und Manna) Bestandteil des Electuarium lenitivum Nicolai Alexandrini, des El. de Sebesten Bartholomai Montagnanae, des Diaprunum compositum Nicolai, des Diacatholicum Nicolai, der Confectio Hamech Mesuë u. and. Die Bezeichnung Indische Dattel oder Sauerdattel hat viel Verwirrung angerichtet. Noch der Ricettario fiorentino (I, S. 794), ja selbst noch POMET (I, S. 942), der eine schlechte Abbildung der Pflanze gibt, und VALENTINI (I, S. 912)[S. 541] geben (wie die Araber, z. B. MESUË) eine Palme als Stammpflanze an, obwohl doch bereits GARCIA DA ORTA (I, S. 736), ACOSTA (I, S. 739), LINSCHOTEN (I, S. 743) und BONTIUS (I, S. 897) den Baum im allgemeinen richtig beschrieben und zum Teil ausdrücklich die Unterschiede von den Palmen hervorgehoben hatten, RHEEDE (I, S. 898) eine gute Abbildung und RUMPHIUS (I, S. 900) eine Abbildung und eine ausführliche Beschreibung gegeben und auch ALPINI (I, S. 910) z. B. die Schlafbewegungen der Blätter gut beschrieben hatte. Den Baum lernte man also erst kennen, als der Seeweg nach Ostindien gefunden war (I, S. 728). Er hieß damals in Guzarat ambili, in Malabar puli (GARCIA DA ORTA). Auch in BARBOSAS berühmter Preisliste (I, S. 741) figurieren die T. und in des PIRES Brief an MANUEL (I, S. 742) wird aus Cochin über die großen Mengen der T. in Malabar, Coromandel und Java berichtet. T. war also schon im Anfang des XVI. Jahrh. in Java zu finden. Da HERNANDEZ (I, S. 761) die Tamarinde (Mizquitl, Hoxinue, Quahunachaztli) 1570 beschrieb und abbildete, so muß sie schon bald nach der Eroberung Mexicos dorthin gebracht worden sein. HERNANDEZ sagt von ihr: «nuper ad eas oras translata». Auch nach Westindien ist T. durch die Spanier sehr frühzeitig gebracht worden. Sie ist jetzt dort wie in Ecuador sehr häufig. In Brasilien trafen sie PISO und MARCGRAF (I, S. 893) schon 1648. In älteren deutschen Glossarien und Arzneibüchern fehlen die Tamarinden (FLÜCKIGER). Bei CORDUS (I, S. 803) steht Tamarindus pulpa et semen, Tamarin im Inventar LEFORT (I, S. 805) und in zahlreichen Pharmakopoeen, Taxen und Listen, wie z. B. in der Frankfurter Liste, im Eßlinger Drogenverzeichnis (1550) und der Taxe (1571) findet sich die Tamarinde.
Lit. UDOY CHÂND DUTT, Mat. med. of the Hindus. — DYMOCK, Veget. mat. med. West. Ind. und Pharmac. ind. — KANNY-LALL DEY, The indigenous drugs of India. Calcutta 1896. — WÖNIG, Pfl. d. alt. Ägypt. — BRETZL, Bot. Forsch. d. Alexanderzuges. — ERNST MEYER, Bot. Erläut. z. Strabons Geograph. 1852. — JORET, Le Naturaliste (2) 10, Nr. 36. — FLÜCKIGER, Pharmakogn.
VI. Citronensäuredrogen.
Von den dreibasischen Säuren kommen für uns:
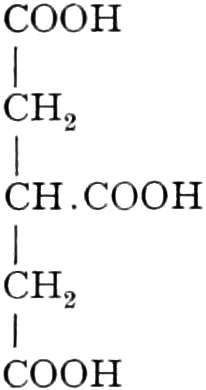 |
und
|
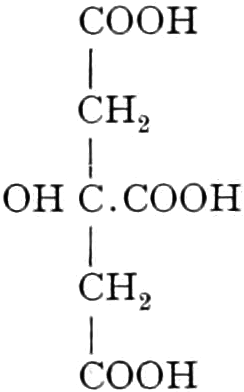 |
|
Tricarballylsäure
|
|
Citronensäure
(Oxytricarballylsäure) |
in Betracht, von denen die erstere in unreifen Rüben gefunden wurde (LIPPMANN), die von SCHEELE 1784 entdeckte, von LIEBIG 1838 als dreibasisch erkannte Citronensäure aber in zahlreichen Früchten vorkommt, wie den Citrusarten, den Preißelbeeren, Johannisbeeren, Heidelbeeren (S. 64), Stachelbeeren, Kirschen (S. 73) sich aber auch im Zuckerrohr, in der Zuckerrübe und in Tabaksblättern findet (revisionsbedürftige Zusammenstellung in HUSEMANN-HILGER, Pflanzenstoffe, dann bei CZAPEK und im BEILSTEIN) und bei der sog. Citronensäuregärung (s. oben S. 507) entsteht. Es sind besonders einige Citromycesarten (C. Pfefferianus, citricus, lacticus, tartaricus, oxalicus), die unterhalb 20°, bei mangelhafter Stickstoffnahrung bisweilen 50% und mehr des Zuckers (am besten eignet sich Maltose, weniger Saccharose, Dextrose und Lävulose) in Citronensäure überzuführen vermögen (BUCHNER und WÜSTENFELD, WEHMER, HERZOG und POLOTZKY). Frei und neben wenig oder gar keiner Apfelsäure findet sich Citronensäure in den Früchten von Citrus limonum, Vaccinium vitis idaea, V. oxycoccus und V. macrocarpum (1,4%[S. 542] FERDINAND), sowie Oxycoccus palustris (2–2,8% KOSSOWICZ); neben Apfelsäure (etwa zu gleichen Teilen) findet sich Citronensäure in der Johannisbeere (1%), ferner in der Stachelbeere, der Heidelbeere, Himbeere und in Rubus chamaemorus, sowie im Kraute von Chelidonium majus; neben Apfelsäure und Weinsäure in den Vogelbeeren (und vielleicht auch in der Tamarinde, VAUQUELIN). Von den Citronenpreßsäften des Handels enthält am meisten fremde Säuren der Saft der Bergamotte, dann der Limottensaft, am wenigsten der Saft der Citrone (WARRINGTON). Mikrochemisch läßt sich Citronensäure als Silbersalz nachweisen.
Synthetisch kann Citronensäure aus Glycerin über Dichlorhydrin — β-Dichloraceton — Dichloracetoncyanhydrin — Dichloracetonsäure und deren Dicyanid (GRIMAUX u. ADAM) (bzw. aus Acetondicarbonsäure) erhalten werden, aber weder diese Synthese, noch die von ADREONI und KÉKULÉ, die von der Apfelsäure ausgehen, werden praktisch ausgeführt. Sie sind zu teuer. Noch immer liefert die Natur die billigste Citronensäure (in der Citrone und, nach WEHMER, mittelst Citromyces (S. 507), vgl. Chem. Zeit. 17, 1180 u. 21, 381 u. 1022).
Die Citronensäure bemerkte schon vor 1732 zuerst BOERHAAVE (I, S. 957) in den Citronen und studierte die Wirkung des Saftes auf Metalle. Sie wurde dann von RETZIUS (1776) isoliert, aber erst von SCHEELE (1784) kristallinisch erhalten. Daß Citronensäure von Weinsäure verschieden ist, fand außer SCHEELE auch RETZIUS (I, S. 966).
Frische Citronen kommen vom Gardasee, wo sich große, sehr eigenartige Kulturen befinden (vgl. I, Fig. 27 u. 28), die jährlich c. 15 Mill. Citronen liefern, dann aus Sizilien, das jährlich c. 50 Milliarden produziert. Italien exportierte 1909: 2560628 Quint. Limoni anche in acqua salata. Riesige Citrus-Kulturen finden sich in Kalifornien (I, Fig. 31). Hamburg importierte 1908: 236943 dz Citronen, davon kamen 225609 aus Italien, 10273 aus Spanien, geringe Mengen aus Frankreich, Griechenland, das jährlich c. 60 Mill. κίτρον τὸ κοινὸν produziert, und Syrien. Man kann Citronen dadurch konservieren, daß man die Anheftungsstelle mit Paraffin überzieht und die Früchte in Salz einbettet.
Das mittlere Gewicht einer Citrone beträgt 153,8 g (OLIVIERI E GUERRIERI). Bei den Citronen kommt c. 35–38,50% auf die Schale, c. 59% auf das Fruchtfleisch und c. 2,5% auf die Kerne — sie liefern bis 37–44,5% Saft. Eine gute Citrone gibt durchschnittlich 24,8 g Saft und liefert c. 2,41 g krist. Citronensäure. Ältere Citronen enthalten keine Citronensäure mehr (STODDART). 1000 kg guter Citronen sollen 55 kg und 1000 kg Johannisbeeren 7,5–10 kg krist. Citronensäure geben. Außer diesen wird auch der Preißelbeersaft, der 1–1,2% enthält, zur Darstellung der Citronensäure im Großen empfohlen (GRÖGER). Im Liter des Saftes unreifer Maulbeeren finden sich 26,85 g Citronensäure (WRIGHT und PATTERSON). Echter Citronenpreßsaft hat ein spez. Gewicht von c. 1,043–1,045 und einen Durchschnittsgehalt von 9,72% C. (STODDART). Er enthält aber oft nur 186 bis 280 g Citronensäure in der Gallone, d. h. nur 4–6% (WARRINGTON), doch steigt der Gehalt auch auf 11,3% (5,2–7,6% bildet die Regel bei gutem Saft, HENSEL und PRINKE). Fremde Säuren enthält Citronensaft meist nur 2,5%, Limettensaft 7–8%, Bergamottensaft 12–13%.
Im Citronensaft wurde neuerdings gefunden: 10,44% Extrakt, c. 1,42% Invertzucker, 0,52% Saccharose, 5,39–5,83% Citronensäure, 0,32% Stickstoffsubstanz und 0,2% Asche (Zusammensetzung der Asche bei KÖNIG). In 100 ccm Saft unreifer Citronen fanden sich 7,52 g, im Safte reifer 7,27 g Citronensäure, der Säuregehalt bleibt also etwa gleich (BORNTRÄGER), doch steigt der Gehalt bisweilen bis 8,30 g in 100 ccm, wovon 1,57 g als Ester gebunden (SPÄTH und SENDTNER).
[S. 543]
Citronensaft wird für den Großhandel in Italien aus den Früchten von Citrus medica L. subsp. Limonum (RISSO) HOOKER fil. (Citrus Limonum RISSO, C. medica var. β L.), der Citrone oder Limone — Sugo di Limone — und Citrus medica RISSO (C. medica cedro GALLESIO, C. m. var. α L.), der Cedrolimone — Sugo di Cedro —, viel seltener aus denen von Citrus Aurantium L. subspec. Bergamia (RISSO et POITEAU) WIGHT et ARNOTT, der Bergamotte, in Westindien (Montserrat) aus denen von Citrus Limetta RISSO dargestellt.
Über die zur Citronensäuregewinnung nötigen Rohprodukte, die in Süditalien hergestellt werden, hat RAVASINI (1911) an Ort und Stelle folgende Auskünfte, erhalten:
Die Orte der Citronensaftverarbeitung in Sizilien und Calabrien. Die Orte, wo Agro-cotto bereitet wird mit —— unterstrichen, die, wo Cedrato di calce hergestellt wird, mit ××××× bezeichnet.
[Ravasini gez.]
Die Citronensäure wird technisch ausschließlich aus dem Safte der Citronen und Cedrolimonen, der in Süditalien, namentlich in Calabrien und Sizilien, bereitet wird, gewonnen. Die Citronenfrüchte werden, wenn sie ihre volle Reife erlangt haben, geschält (I, Fig. 165) — die Schalen werden zur Bereitung der Limonen(Citronen-) Essenz verwendet (I, Fig. 166) —, und der Saft des Fruchtfleisches mittelst hölzerner zylindrischer Pressen (torchi) ausgepreßt (I, Fig. 176). — Ein Liter des so erhaltenen Citronensaftes enthält 55–60, im günstigsten Falle 70 g Citronensäure. — Da die Citronensäuredarstellung nicht in Italien selbst ausgeführt wird, so muß dieser Saft, um exportiert werden zu können, vorerst eingedampft werden, was in großen Gefäßen aus glasiertem Ton ausgeführt wird. Der eingedampfte Saft wird noch warm filtriert und kommt dann unter dem Namen Agro-Cotto in großen hölzernen Fässern von 100–250 kg Inhalt an die ausländischen Fabriken zur Versendung. Dieser konzentrierte Citronensaft, Agro-Cotto, stellt eine sirupähnliche bräunliche Flüssigkeit dar, welche am Citrometer 60° zeigen muß, d. h. sie besitzt eine Dichte von 1,2394 und enthält c. 400 g kristall. Citronensäure im Liter. Die Darstellung von Agro-Cotto findet in folgenden Provinzen und folgenden Orten Süditaliens statt: Reggio Calabria (bei Gallina, Motta S. Giovanni und Gallico), Catania (bei Acireale, Giarre, Calatabiano, Fiumefreddo und Riposto), Messina (bei Guidomandri, Nizza Sicilia, Milazzo, S. Teresa di Riva und Giardini), Siracusa (bei Floridia), Palermo und auf der Insel Ischia[S. 544] nahe Neapel (hier wenig). Deutschland importierte 1909: 1705 dz Citronensaft, besonders aus Italien. Neuerdings wird Citronensaft aus den zerquetschten geschälten Früchten durch Centrifugieren dargestellt. Dieser ist leicht zu klären.
Behufs der Reindarstellung der Citronensäure wird der rohe Citronensaft mit Kalk neutralisiert und der so erhaltene citronensaure Kalk dann durch Waschen mit Wasser von den löslichen, nicht mit Kalk unlösliche Verbindungen eingehenden fremden Saftbestandteilen befreit und dann mit Schwefelsäure zerlegt. Die zur Kristallisation gebrachte Lauge liefert zunächst gefärbte Kristalle (rohe Citronensäure, in der Kattundruckerei benutzt), die dann mit Kohle gereinigt werden. Die reine Citronensäure, das Acidum citricum des Handels, ist das Monohydrat. Die Ausbeute beträgt c. 5,5 % (bei Johannis- und Preißelbeeren nur 1–1,5%).
Um den kostspieligen Transport des verhältnismäßig wenig verwertbares Material enthaltenden Citronensaftes zu umgehen, ist man auf den Gedanken gekommen, an Ort und Stelle die Citronensäure in unlösliches Tricalciumcitrat («Citrato di calce» [oder calcio] oder, wie in Sizilien meistens genannt, «Cedrato di calce») zu verwandeln und dieses letztere an Stelle des Saftes in den Handel zu bringen. Diese Operation wird folgendermaßen ausgeführt. Der durch Pressung erhaltene Citronensaft wird zuerst einige Zeit sich selbst überlassen bis Gärung eintritt, was die Absonderung von Eiweiß- und Schleimsubstanzen bewirkt (der Schleim entstammt besonders der Samenschale). Nun werden in einer großen gemauerten, gewöhnlich 10000 Liter Flüssigkeit fassenden Cisterne, die mit einem mechanisch beweglichen Aufrührer und einem Serpentinrohr versehen ist, 2000 Liter Citronensaft und 8000 Liter kaltes Wasser zusammengebracht. Man rührt alles gut um und läßt durch das Serpentinrohr so lange kaltes Wasser durchfließen, bis die ganze Flüssigkeitsmenge auf eine Temperatur von 5° erniedrigt worden ist. Nun wird das Umrühren durch weitere 10 Minuten fortgesetzt und schließlich 50 Liter eines Summachextraktes hinzugefügt, durch dessen Tanningehalt die Fällung aller Eiweiß- und Schleimsubstanzen vervollständigt wird. Die Flüssigkeit wird jetzt durch eine Filterpresse geführt, wobei der Niederschlag beseitigt wird, und kommt aus dieser entweder in 2000 Liter fassende hölzerne Wannen oder (was bei neueren Installationen zu finden ist) wieder in gemauerte Cisternen, welche aber mit einer durchlöcherten Serpentine versehen sind, durch welche soviel Dampf eingeführt wird bis die Flüssigkeit zum Sieden gelangt. Man ermittelt nun in einem kleinen Flüssigkeitsquantum die in diesem enthaltene Säuremenge und setzt auf jede 100 kg Säure 45 kg gebrannten Kalk oder 57 kg Kalkhydrat hinzu, wobei sich sogleich citronensaurer Kalk absetzt, welcher in einer Filterpresse aufgefangen, durch 10 Minuten mit heißem, durch weitere 10 Minuten mit lauem und durch folgende 5 Minuten mit kaltem Wasser ausgewaschen wird.
Getrocknet wird dieser Citronenkalk in hölzernen Fässern aus Catania und Palermo meistens nach Nordamerika, Frankreich, Deutschland und England exportiert, wo er zur Citronensäurefabrikation Verwendung findet. Italien selbst fabriziert keine Citronensäure und wird sogar die hier zum Verbrauch kommende Quantität fast ausschließlich aus England und Deutschland bezogen, aus letzterem Lande 1909: 359 dz. «Citrato di Calce» wird dagegen schon in folgenden Provinzen und an folgenden Orten dargestellt: Reggio Calabria (bei Gallina und Palizzi), Messina (bei Roccalumera und San Filippo del Mela), Siracusa (bei Modica), Palermo (bei Bagheria).
Es ist vorauszusehen, daß mit der Zeit die Darstellung vom Citrato di Calce jene von[S. 545] Agro-Cotto ganz verdrängen wird. — In der Provinz von Palermo, wo sechs Fabriken zu finden sind, die den konzentrierten Preßsaft und Cedrato di Calce darstellen, hat sich schon eine von diesen in eine größere Aktiengesellschaft verwandelt, die über 70000 kg im Jahre Citrato di Calce exportieren soll. — Die Provinz Messina allein soll über 1 Million kg konzentrierten Citronensaft (Agro-Cotto) im Jahre darstellen, was sicher eine enorme Quantität darstellt, wenn man bedenkt, daß man, um 100 kg gewöhnlichen (nicht konzentrierten Saftes) zu erzielen, 2000–2800 Citronen benötigt. Die Exportziffern sind folgende: Gewöhnlicher, nicht konzentrierter Zitronensaft (Succo di cedro e di limone crudo) 1908: 9250, 1909: 6172, 1910: 6014 quint. Konzentrierter Citronensaft (Agro-Cotto): 1908: 8366, 1909: 1178, 1910: 8352 quint. Cedrato di calcio: 1908: 77101, 1909: 23809, 1910: 64755 quint. (RAVASINI).
Citronensaft kann dadurch haltbar gemacht werden, daß man den mit Talcum geklärten Saft mit 10% Zucker aufkocht. Die Konservierung des Citronensaftes kann auch durch Alkohol oder Erhitzen auf 100° oder durch Filtration geschehen (JUDICIS). Citronensaft ist eines der besten durstlöschenden Mittel. Citronensaft und Citronensäure werden zur Limonadenbereitung in großen Massen verbraucht. Citronensaft (nicht Citronensäure) gilt auch als das beste Mittel gegen Scorbut — Schiffe sind verpflichtet für lange Fahrt Citronensaft an Bord zu nehmen —, dann wird er auch jetzt vielfach zu den sog. Citronenkuren bei Gicht und als Entfettungsmittel benutzt.
Die Citronensäure des Handels ist oft mit Weinsäure verfälscht oder sogar durch sie ersetzt. Das D. A. V läßt auf Weinsäure durch folgende Reaktion prüfen: Eine Mischung von 1 g Acid. citric. und 10 ccm H2SO4, die in einem mit H2SO4 gespültem Mörser bereitet wurde, darf sich höchstens gelb, nicht aber braun färben, wenn sie in einem mit H2SO4 gespülten Probierrohr eine Stunde lang im Wasserbade nicht über 90° erwärmt wird.
Lit. STODDART, Pharm. Journ. (2) 10, 203. — WARRINGTON, Ebenda 2, 384. — GRÖGER, N. Jahrb. d. Chem. 39, 194. — WEHMER, Citronensäuregärung 1893. — HERZOG und POLOTZKY, Citronensäuregärung. Zeitschr. phys. Chem. 49 (1909), 125. — BUCHNER und WÜSTENFELD, Citronensäuregärung. Biochem. Zeitschr. 1909, 395. — WÜSTENFELD, Dissert. Berlin 1908. — KÖNIG, Nahrungs- u. Genußm. 4. Aufl. (dort zahlreiche Limonen-Analysen von OLIVIERI E GUERRIERI, DANESI E BOSCHI u. and.). — JUDICIS, Zeitschr. d. Öster. Apoth. Ver. 1880, 467. — HALLERBACH, Die Citronensäure u. ihre Derivate 1911 (dort die Lit.).
IV. Fett- und Wachsdrogen.
Die Beziehungen der Fette zu den Kohlehydraten sind oben (S. 5) erörtert. Es darf als erwiesen betrachtet werden (VALLÉE, ANDRÉ, GERBER), daß in der Pflanze Mono- und Polysaccharide in Fette übergehen. Ebenso findet der umgekehrte Vorgang statt. Physiologisch spielen die Fette bei den Pflanzen die Rolle von Reservestoffen wenigstens überall da, wo sie, wie in den Früchten und Samen, in größerer Menge auftreten (das Fruchtfleisch der Ölpalme enthält 65–72%, Leinsamen 35–42%, Ricinussamen 46–53%, Mandeln c. 53%, Wallnußsamen 64%, Copra 67% Fett — auch die Knollen von Cyperus esculentus enthalten 28% Fett, sonst sind Rhizome fettarm). Sie werden bei der Keimung verbraucht. Und diese Fälle sind es denn auch, bei denen allein ihre technische Gewinnung lohnt. Ebenso ist das Fett der Sporen Reservestoff (vgl. Lycopodium).
Bei den Tieren finden sich die Fette im sog. Fettgewebe, das besonders im intermuskulären und subkutanen Bindegewebe, im Mesenterium und im Knochenmark auftritt. Aber auch außerhalb des Fettgewebes können die Fette in allen Zellen des Tierkörpers abgelagert werden und finden sich auch in tierischen Sekreten, wie z. B. der Milch.
Im weiteren Sinne gehören auch die Wachsdrogen zu den Fettdrogen und sie sollen denn auch diesen hier angeschlossen werden.
[S. 546]
Bei beiden handelt es sich um aliphatische Ester, deren Bestandteile azyklisch sind, nur in der Cholesteringruppe begegnen wir zyklischen Verbindungen.
Die Fette und Wachse setzen sich also aus Säuren und Alkoholen zusammen.
Die Säurehälfte gehört zu folgenden Fettsäurereihen (ich folge der Einteilung von LEWKOWITSCH):
I. Säuren der Essigsäurereihe: CnH2n+2O2. Die niederen Säuren dieser Reihe (Buttersäure, Baldriansäure, Capronsäure, Caprylsäure, Caprinsäure) sind flüchtig, auch noch die Laurinsäure ist mit Wasserdämpfen flüchtig, aber schon die Myristicinsäure erst bei Anwendung von gespanntem Dampf, — das erklärt ihr Auftreten in vielen sog. ätherischen Ölen —, die höheren Fettsäuren der Reihe (Palmitinsäure, Stearinsäure, Arachinsäure, Behensäure, Carnaubasäure, Cerotinsäure, Melissinsäure) auch mit diesem nicht.
Die homologe Reihe der gesättigten Fettsäuren enthält folgende Glieder:
|
HCOOH Ameisensäure
|
 |
flüchtige,
riechende Fettsäuren unter 31°C flüssig |
||
|
CH3COOH Essigsäure
|
||||
|
C2H5COOH Propionsäure
|
||||
|
C3H7COOH Buttersäure
|
||||
|
C4H9COOH Baldriansäure
|
||||
|
C5H11COOH Capronsäure
|
||||
|
C6H13COOH Önanthsäure
|
||||
|
C7H15COOH Caprylsäure
|
||||
|
C8H17COOH Pelargonsäure
|
||||
|
C9H19COOH Caprinsäure
|
||||
|
C10H21COOH Undecylsäure
|
||||
|
C11H23COOH Laurinsäure F = 43,6°
|
||||
|
C12H25COOH Ficocerylsäure F = 57°
|
||||
|
C13H27COOH Myristinsäure F = 53,8°
|
||||
|
C14H29COOH Isocetinsäure (?) F = 55°
|
||||
|
C15H31COOH Palmitinsäure F = 62°
|
||||
|
C16H33COOH Daturinsäure F = 54,5° (57°)
|
||||
|
C17H35COOH Stearinsäure F = 69,3°
|
||||
|
[C18H37COOH Nondecylsäure F = 66,5°]
|
||||
|
C19H39COOH Arachinsäure F = 77°
|
||||
|
[C20H41COOH]
|
||||
|
C21H43COOH Behensäure F = 83–84°
|
||||
|
[C22H45COOH]
|
||||
|
C23H47COOH Lignocerinsäure F = 80,5°
|
||||
|
Isomer damit: Carnaubasäure F = 72,5° und
|
||||
|
Pisangcerylsäure F = 71°
|
||||
|
C24H49COOH Hyänasäure F = 77–78°
|
||||
|
C25H51COOH Cerotinsäure F = 78,5°
|
 |
Wachssäuren
|
||
|
[C26H53COOH]
|
||||
|
C27H55COOH Geocerinsäure F = 82°
|
||||
|
[C28H57COOH]
|
||||
|
C29H59COOH Melissinsäure F = 88,5°
|
||||
|
C32H65COOH Psyllostearylsäure F =
94–95° |
||||
Margarinsäure ist ein Gemisch (von konstantem Schmelzpunkt) von Palmitin- u. Stearinsäure.
II. Säuren der Ölsäurereihe: CnH2n−2O2; ungesättigte Säuren:
|
C4H7COOH Tiglinsäure
|
|
 |
C15H29COOH Hypogaeasäure
|
|
C15H29COOH Physetölsäure
|
|
|
C15H29COOH Lycopodiumölsäure
|
|
 |
C17H33COOH Ölsäure
|
|
C17H33COOH Rapinsäure
|
|
|
C17H33COOH Elaïdinsäure
|
|
|
C17H33COOH Isoölsäure
|
|
 |
C18H35COOH Döglingsäure
|
|
C18H35COOH Jecoleïnsäure
|
|
 |
C21H41COOH Erucasäure
|
|
C21H41COOH Brassidinsäure
|
|
|
C21H41COOH Isoerucasäure
|
Die höheren Säuren sind mit Wasserdampf nicht flüchtig; ihre Bleisalze sind in Äther löslich.
III. Säuren der Linolsäurereihe: CnH2n−4O2, in trocknenden Ölen, absorbieren leicht Sauerstoff (vgl. S. 553):
 |
C17H31COOH Linolsäure
|
|
C17H31COOH Taricinsäure
|
|
|
C17H31COOH Hirseölsäure
|
|
|
C17H31COOH Telfairasäure
|
|
|
C17H31COOH Elaeomargarinsäure
|
IV. Säuren der Linolensäurereihe: CnH2n−6O2:
C17H29COOH. Linolensäure, Isolinolensäure und Jecorinsäure.
V. Säuren der Isansäurereihe: nH2n−8O2. Isansäure, Terapinsäure.
VI. Säuren der Lanopalminsäurereihe. Hydroxylierte Säuren: CnH2nO3:
C16H32O3 Lanopalminsäure, C31H62O3 Coccerinsäure.
VII. Säuren der Ricinolsäurereihe. Hydroxylierte Säuren: CnH2n−2O3:
C18H34O3 Ricinolsäure, Isoricinolsäure, Ricinelaïdinsäure, Ricinsäure und Quittenölsäure.
VIII. Säuren der Dioxystearinsäurereihe: CnH2nO4:
C18H36O4 Dioxystearinsäure, C30H60O4 Lanocerinsäure.
[S. 547]
IX. Säuren der Reihe: CnH2n−2O4, zweibasisch, gesättigt: C22H42O4 Japansäure.
Medullinsäure, Moringasäure, Theobrominsäure, Crotonoleïnsäure, Umbellulsäure sind zu streichen (LEWKOWITSCH). Die einzelnen Fettsäuren und Alkohole sind beschrieben in LEWKOWITSCH, Chem. Technol. u. Analys. d. Öle usw.
Die Alkoholhälfte der Ester gehört in folgende Reihen:
I. Alkohole der Äthanreihe CnH2n+2O: C13H28O Pisangcerylalkohol, C16H34O Cetylalkohol (Äthal), C24H50O Carnaubylalkohol, C26H54O Cerylalkohol, C30H62O Myricylalkohol (Melissylalkohol), C33H68O Psyllostearylalkohol.
II. Alkohole der Allylreihe: CnH2nO: C12H24O Lanolinalkohol.
III. Alkohole der Reihe:CnH2n−6O: C17H28O Ficocerylalkohol.
IV. Alkohole der Glycolreihe CnH2n+2O2: C30H62O2 Coccerylalkohol.
V. Alkohole der Reihe CnH2n+2O3: C3H8O3 Glycerin.
VI. Alkohole der hydroaromatischen Reihe: C26H44O Cholesterin, Phytosterin und Isocholesterin, C27H44O Sitosterin u. and. Phytesterine.
Die Fette im engeren Sinne sind alle Glycerinester, wie — nachdem SCHEELE das Glycerin entdeckt — zuerst CHEVREUL feststellte und BERTHELOT (1854) durch die Synthese bestätigte. Die Bindung der Fettsäuren am Glycerin erfolgt entweder in der Weise, daß alle drei Hydroxyle des Glycerins mit der gleichen Fettsäure abgesättigt sind nach dem Typus:
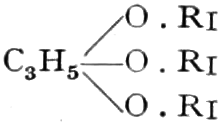
also z. B. Tripalmitinsäure-, Tristearinsäure- und Trioleïnsäure-Glycerinester entstehen — man bezeichnet diese als Tripalmitin, Tristearin und Trioleïn — oder die drei Hydroxyle mit zwei oder drei verschiedenen Fettsäuren sich nach dem Typus:
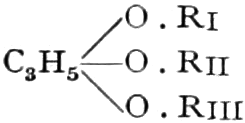
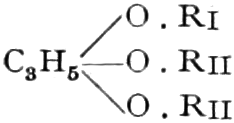
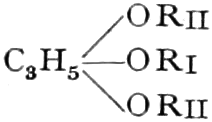
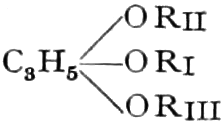
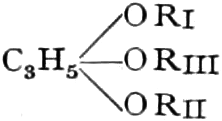
paaren, also gemischte Glyceride entstehen. Auch diese sind in den von der Natur gebildeten Fetten neuerdings häufig gefunden worden, seit BELL und LEWIN ein Oleopalmitobutyrat:
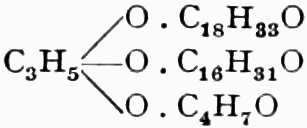
in der Butter annahmen und HEISE (1896) ein Oleodistearin:
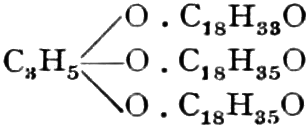
im Mkányifett und der Kokumbutter auffand, das nach SACK auch im Fett der Mangifera indica auftritt.
Der Vergleich der Formeltypen zeigt, daß es auch zahlreiche Strukturisomere geben muß, deren Zahl bei den Säuren, die doppelte Bindungen besitzen, noch durch den Wechsel in der Lage dieser letzteren vermehrt wird. Die Stereoisomerie der Fettsäuren wurde durch das Studium der Spaltungsprodukte der Ozonide bestätigt (HARRIES und THIEME). Ob Fette, bei denen nicht alle Hydroxyle des Glycerins mit Fettsäuren verestert sind, z. B. vom Typus:
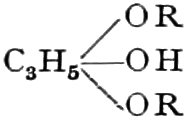
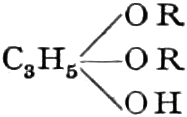
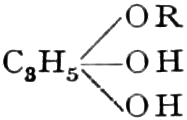
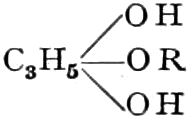
in der Natur vorkommen, ist noch zweifelhaft. Bisher ist nur ein Diglycerid, das Dierucin, gefunden worden.
[S. 548]
Die eigentlichen Fette sind also nach der Formel:
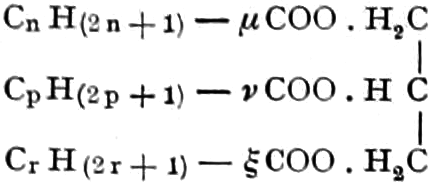
zusammengesetzt, wobei n = p = r oder n nicht = p bzw. r und μ = η = ξ oder μ nicht η bzw. ξ sein kann. μ, η, ξ sind kleine gerade Zahlen.
Die Wachse besitzen zumeist die Formel:
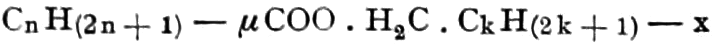
Der charakteristische Alkohol ist gesättigt oder ungesättigt, aliphatisch oder zyklisch, aber einwertig. x kann eine kleine gerade oder ungerade Zahl bedeuten (ULZER und KLIMONT).
Auch in gewissen Lecithinen sind Fettsäurereste enthalten, z. B. im Distearyllecithin:
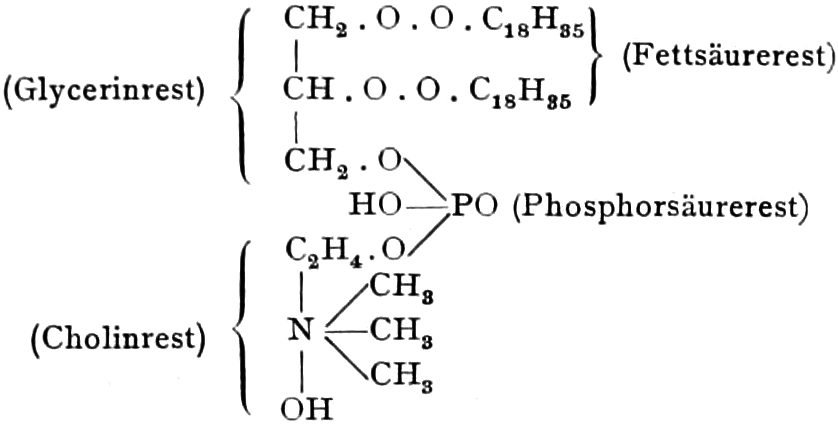
Es darf als Regel gelten, daß die Fette nie nur aus einem Glycerid bestehen, und daß ein oder mehrere Glyceride (besonders die der Palmitinsäure, Stearinsäure und Ölsäure, d. h. Palmitin, Stearin und Oleïn) vorzuherrschen pflegen. Das Vorkommen von Glyceriden niederer Fettsäuren gibt einem Fette einen besonderen Charakter (Cocosöl). Unter den natürlichen Bedingungen feste Fette gibt es in den Pflanzen nicht. Ich fand in den Tropen, d. h. in der Heimat der betreffenden Pflanzen, auch Palmfett, Cocos- und Cacaofett flüssig.
Die elementare Zusammensetzung der Öle, d. h. ihr Bruttogehalt an C, H und O ist ziemlich übereinstimmend, nur Palmkern-, Cocos- und Ricinusöl zeigen abweichende Zahlen, besonders einen niedrigeren Kohlenstoffgehalt.
In Wasser sind die Fette außerordentlich schwer löslich, in kaltem Alkohol etwas besser (leicht nur Ricinus-, Croton- und Olivenkernöl), leicht in Äther, Schwefelkohlenstoff, Chloroform, Benzol und Petroläther (Ricinusöl löst sich nicht in Petroläther). Beim Erhitzen der Fette über 260° (am besten unter Zusatz von saurem Kaliumsulfat) tritt Zersetzung ein und es entwickeln sich (aus dem Glycerin) Dämpfe von Acrolein: CH2n−4=CH.COH. Bei der Destillation entstehen bisweilen (Ricinusöl) gallertige Massen. Beim Durchleiten von Luft durch erhitzte Öle werden diese viskoser. Schwefel wird von Ölen, die ungesättigte Fettsäuren enthalten, addiert. Die Produkte (Factis) sind Kautschuksurrogate. Salpetrige Säure verwandelt Öle mit ungesättigten Fettsäuren der Ölsäurereihe (z. B. Olivenöl, Mandelöl) in feste Massen (Elaidinsäureglyceride). Fette, die Ölsäure, CH3.(CH2)7CH=CH(CH2)7COOH, enthalten, — es sind dies fast alle — liefern bei der Oxydation zuerst Dioxystearinsäure:
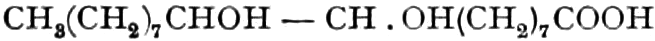
dann Pelargonsäure CH3(CH2)7COOH und Azelainsäure COOH(CH2)7COOH. Ölsäure liefert mit Ozon ein Ozonid (HARRIES):
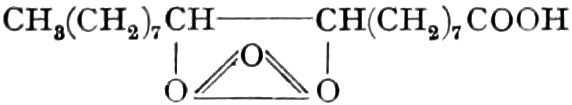
Dies Ozonid der Ölsäure zerfällt in Nonylaldehyd bzw. Pelargonsäure und Azelainsäure bzw. deren Halbaldehyd.
Je größer das Jodabsorptionsvermögen eines Fettes ist, um so leichter absorbiert es auch Sauerstoff. Es hängt dies also mit den doppelten Bindungen zusammen (vgl. S. 553).
[S. 549]
Trockene Luft wirkt, wenn jede Feuchtigkeit und das Licht ausgeschlossen wird, auf Fette nicht ein. Trockene Fette bleiben daher in zugeschmolzenen Röhren unbeschränkte Zeit unverändert. Ist etwas Feuchtigkeit zugegen, so werden geringe Mengen Fettsäuren gebildet, aber das Fett wird noch nicht ranzig. Feuchte Fette werden dagegen an Luft und Licht bald ranzig. Es spalten sich unter dem Einflusse der fettspaltenden, in Wasser unlöslichen, nur in Gegenwart von Säuren wirksamen, also durch diese (Milchsäure? HOYER) aktivierten Enzyme (Lipase, Steapsin — zuerst von GREEN und SIGMUND 1891 nachgewiesen), die z. B. in den Samen regelmäßig vorkommen, aber auch sonst häufig sind (die einzelnen Lipasen sind untereinander verschieden, DUNLAP und SEYMOUR), die Ester auf, die Fettsäuren werden frei und die Säurezahl steigt. Diese Aufspaltung erfolgt sehr viel rascher durch Kochen mit Wasser, durch überhitzten Wasserdampf, durch Mineralsäuren, die als Katalysatoren wirken, Alkalien, Kalk oder Metalloxyde (PbO) (Seifen-, Pflaster-, Stearinkerzen- und Glycerinfabrikation). Bleiben die Fette mit der Substanz aus der sie bereitet wurden, z. B. mit dem stets enzymreichen Fruchtfleisch, in Berührung, so spalten sich die Glyceride schnell und es kann dann das Fett bis zu 70% (Bagasseolivenöl) oder fast ganz (Palmöl) in Fettsäuren zerfallen. Die primäre Ursache des Ranzigwerdens sind also Enzyme in Gegenwart von Feuchtigkeit, wodurch zunächst die Fette sauer werden, aber ranzig sind sie damit noch nicht. Sie werden es erst, wenn die sauren Fette der Luft und dem Lichte ausgesetzt und dadurch oxydiert werden (RITSERT, DUCLAUX, LEWKOWITSCH, GEITEL). Mikroorganismen können Ranzidität einleiten, sind aber nicht nötig dazu (DUCLAUX, RITSERT, MJOEN). Fette mit Glyceriden ungesättigter Fettsäuren neigen mehr dazu ranzig zu werden, als solche von höheren, gesättigten Fettsäuren. Ranzige Fette geben im allgemeinen eine höhere Acetylzahl (LEWKOWITSCH) und zeigen eine geringere Verbrennungswärme (STOHMANN).
Wird durch erwärmte Öle Luft oder Sauerstoff geblasen, so erfolgt eine energische Oxydation, das spezifische Gewicht steigt, die Öle werden viskos («geblasene Öle»).
Die meisten Fette sind optisch-inaktiv, rechtsdrehend sind z. B. Ricinusöl, Crotonöl, Lorbeeröl und Sesamöl. Die Zahl für die mittlere Molekularrefraktion ist bei den meisten Ölen ziemlich dieselbe, z. B. Leinöl 447, Olivenöl 447, Sojabohnenöl 450, Sesamöl 451 (KLIMONT).
Mikroskopisch betrachtet zeigen die festen oder halbfesten Fette regelmässig reichliche Kristallbildungen, vorwiegend Nadeln, eingebettet in tropfbar-flüssige Massen.
Die Wachse sind chemisch den Fetten sehr ähnlich, haben aber eine ganz andere physiologische Funktion; als Überzüge auf des Vegetations- und Reproduktionsorganen von Pflanzen warmer Klimate dienen viele als Schutz gegen Verdunstung, Benetzung, Licht. Bei anderen ist die Funktion unklar. Das Bienenwachs dient zum Bau der «Zellen». Die Wachsester sind schwerer verseifbar als die Fettester.
Die Methoden der Analyse der Fette sind physikalische und chemische. Von den physikalischen kommen in Betracht: Die Bestimmung des spez. Gew., des Schmelz- und Erstarrungspunktes, des Brechungsexponenten (mit dem Refraktometer), der Viskosität (mit dem Viskosimeter, vgl. oben S. 450, am gebräuchlichsten sind ENGLERS und REDWOODS Viskosimeter), des Rotationsvermögens, des mikroskopischen und spektroskopischen Verhaltens, der Konsistenz, der Löslichkeit, des elektrischen Leitungsvermögens und des Verhaltens im Kolorimeter. Bei den chemischen Methoden unterscheidet man: Die Bestimmung der Säurezahl, der Verseifungszahl (Köttstorferzahl), der Jod- (und Brom-)zahl (HÜBL, WIJS), der Reichert-Meissl- bzw. Reichert-Wollnyzahl (flüchtige Fettsäuren), der Hehnerzahl[S. 550] (Unverseifbares und unlösliche Fettsäuren) und der Acetylzahl. FOKIN benutzte die «Wasserstoffzahl», d. h. die Zahl ccm H bei 0° und 760 mm D (1 l = 0,098 g), welche mit 1 g Substanz bei Behandlung mit molekularem Platin in Reaktion treten, um die Zahl der doppelten Bindungen in ungesättigten Fettsäuren zu bestimmen. Bisweilen werden auch die Glycerinmenge und die Diglyceride bestimmt. Qualitative Reaktionen sind die Elaidinprobe, die Sauerstoffabsorptionsprobe und die Hexabromidprobe (zum Nachweis der Linolensäure). Auch die Bestimmung der Temperaturerhöhung beim Vermischen mit konz. Schwefelsäure wird vielfach zur Identifizierung der Öle benutzt (MAUMENÉS Probe). Für genauere Untersuchungen ist auch die Prüfung der isolierten Fettsäuren (auf Menge, spez. Gew., Schmelz- und Erstarrungspunkt, Siedepunkt, Löslichkeit, Brechungsexponent usw.) nötig. Der Fettgehalt von Drogen wird durch Extrahieren mit niedrig siedendem Petroläther im Soxhlet, Verseifen des Extraktionsrückstandes und Abziehen des Unverseifbaren bestimmt.
Die meisten Öle sind gelblich, einige fast farblos (manche Sorten von Olivenöl und Ricinusöl), andere tiefgelb (Leinöl, frisches Palmfett), die Fette meist rein weiß (Cocosfett, Schweinefett). Einige sind durch Farbstoffe gefärbt, die sich beim Auspressen im Fett lösten. So ist Lorbeeröl durch Chlorophyll, Muskatbutter durch einen gelbroten, Astrocaryafett durch einen zinnoberroten Farbstoff gefärbt. Ein Chlorophyllgehalt der fetten Öle, der besonders bei Olivenöl und Hanföl beobachtet wurde, läßt sich leicht mit dem Spektroskop nachweisen (TSCHIRCH 1884).
Die direkte Synthese der gewöhnlichen Glyceride gelingt mit fast theoretischer Ausbeute durch Erhitzen stöchiometrischer Mengen von Fettsäure und Glycerin auf 200–250° unter gewöhnlichem Druck, wenn man das bei der Reaktion entstehende Wasser fortwährend entfernt und den atmosphärischen Sauerstoff mittelst eines inerten Gasstromes (CO2) fernhält (BELUCCI 1911. Weitere Synthesen bei SCHACHT.) Auch mit Hilfe von Enzymen ist sowohl im Organismus wie in vitro ein Aufbau von Fetten möglich, da, wie zuerst HANRIOT gezeigt hat, z. B. die fettspaltende Serolipase auch reversibel synthetisierend wirkt (biochemische Fettsynthese). Solche Synthesen gelangen BODENSTEIN und DIETZ, TAYLOR, POTTEVIN u. and.
LEWKOWITSCH gibt folgende Einteilung der Fettkörper:
- Öle (flüssig),
- vegetabilische:
1. trocknende, 2. halb trocknende, 3. nicht trocknende. - animalische:
1. von Seetieren: α) Fischöle, β) Leberöle, γ) Tran.
2. Von Landtieren.
- vegetabilische:
- Fette (fest), a) vegetabilische, b) animalische.
Alle vegetabilischen Öle und Fette enthalten als Begleiter Phytosterine, alle animalischen Cholesterine. Die chemischen Beziehungen derselben zu den Fetten sind noch nicht aufgeklärt.
Eine ziemlich vollständige tabellarische Übersicht über die Zusammensetzung, sowie die physikalischen und chemischen Konstanten von 225 pflanzlichen und tierischen Fetten und 10 Wachsen findet sich in ULZER-KLIMONT, Allgem. physiol. Chemie d. Fette 1906. Genaueres bei LEWKOWITSCH.
Der mikrohistochemische Nachweis der Fette gelingt in allen Fällen, wo das Öl ungesättigte Säuren (z. B. Ölsäure) enthält mittelst Osmiumsäure: die Tropfen färben sich im Wasserpräparat bei gelindem Erhitzen mit dem Reagens braun (die Reaktion tritt aber auch bei anderen Substanzen mit doppelten Bindungen ein). In den Samen, welche ich selbst angesehen habe (und das ist eine große Zahl) ist das fette Öl in den Zellen niemals in Tropfen, sondern in innigster Mischung oder Verbindung mit dem Plasma vorhanden. Es färbt sich daher die ganze zwischen den Aleuronkörnern liegende Masse mit Osmiumsäure braun, wenn man den Schnitt direkt in diese einträgt. Dieses von mir Ölplasma genannte Gebilde wird aber durch Wasser zersetzt und es treten daher Tropfen hervor, wenn man den Schnitt in Wasser legt. Auch in den Zellen der Vegetationsorgane entsteht das Öl immer im Plasma und dieses ist wohl regelmäßig ölhaltig. Bisweilen entsteht es in sog. Oleoplasten (Elaeoplasten, Ölbildnern). Doch bestreitet UHLMANN, daß es sich hier um fettes Öl handelt.
Ein weiterer Nachweis der Fette beruht auf ihrer Verseifbarkeit mit Alkalien. Man legt den Schnitt in Kaliammoniak: es entsteht eine wasserlösliche Seife (MOLISCH[S. 551] 1891). Die Verseifung tritt schon bei gewöhnlicher Temperatur bei längerem Liegen ein und es treten dabei charakteristische Kristalle auf (HARTWICH und UHLMANN). Die Fetttropfen nehmen auch Farbstoffe begierig auf, wie z. B. Alkanna, Chinolinblau, Sudan, Chlorophyll und den roten Farbstoff, der bei der RASPAILschen Zuckereiweißreaktion entsteht.
In der Therapie spielen die Fette besonders eine Rolle als Salben- und Linimentvehikel. Alle Öle wirken zudem, wenn eßlöffelweise genommen, abführend, auch per anum, Gummiölemulsionen dagegen stopfend. Die gepreßten Öle verhalten sich nicht ganz gleich wie die mit Lösungsmitteln extrahierten des gleichen Objektes.
In der Pharmazie benutzt man auch die mit Kohlensäure gesättigten Öle (Brauseöle), sowie die bromierten und jodierten Fette. Der Lösungsfähigkeit des Phosphors in Öl bedient man sich zur Herstellung des Ol. phosphoratum.
Die Verbrennungswärme der Fette ist sehr beträchtlich. Während die Kohlehydrate im Durchschnitt nur 3900 g-Kalorien geben, geben die Fette im Durchschnitt 9300 g-Kal. Sie spielen daher im Stoff- und Kraftwechsel der Organismen eine große Rolle und sind wertvolle Nahrungsmittel.
Die Frucht- und Samenöle werden meist durch Pressung (kalte oder warme) gewonnen (vgl. I, S. 134). Die hierbei erhaltenen Preßkuchen, die immer noch mehr oder weniger Fett zurückhalten, sind wertvolle Futter- oder Düngemittel, da in ihnen sich noch das ganze Eiweiß (besonders in Form von Aleuronkörnern) befindet. Neuerdings werden aber auch viele Fette durch Extraktion, besonders mit Schwefelkohlenstoff und Benzin resp. Petroläther (weniger mit Tetrachlorkohlenstoff, Chloroform, Aceton, Benzol, Chloräthylenen oder Chloräthanen) gewonnen. Bei beiden Methoden gehen auch in Fett lösliche Begleiter der Fette in Lösung (Farbstoffe, giftige Substanzen, ätherische Öle s. oben).
Die Apparate zur Ölgewinnung sind abgebildet bei STIEPEL a. a. O.
Der Bedarf an Pflanzenfetten ist ein ungeheurer. Deutschland allein führte 1906 für 30 Mill. Mark Pflanzenöle und für 202,49 Mill. Mark Ölsamen ein (TUNMANN). Von tropischen Ölen kommen jährlich über 2000 Mill. kg an den Weltmarkt. Marseille ist ein wichtiger Ölhandelsplatz für Oliven, Arachis, Sesam, Copra und ihre Öle.
Die Methoden zur Reinigung der Fette beziehen sich auf die Entfernung mechanischer Verunreinigungen, gelöster Eiweißstoffe, Harze, Pflanzenschleim, freier Fettsäuren, Riechstoffen (Desodorisation) oder sind Bleichmethoden oder Methoden, welche auf eine Geschmacksverbesserung oder größere Haltbarkeit abzielen oder eine Erhöhung des Schmelzpunktes oder Herabsetzung des Erstarrungspunktes bezwecken (Demargarinierung).
Geschichte. Schon das Urvolk der Sumerer bediente sich des Oliven- und Ricinusöls, die Babylonier des Sesamöls. Öl (mrḥt) und Talg (ʿd) werden sehr oft in ägyptischen und auch in babylonischen Rezepten genannt (vgl. I, S. 467). OEFELE nennt (I, S. 486) 16 tierische Fette, die in babylonischen Apotheken zu finden waren. Die Gewinnung von Öl (umgebildet aus lat. oleum) aus Pflanzen durch Auspressen ist also sehr alt. Das Olivenöl wurde besonders zu Beleuchtungszwecken schon im alten Ägypten benutzt, ebenso in Palästina schon zu MOSIS Zeit. Als Salbmittel bedienten sich seiner auch die alten Griechen, die es von den Ägyptern kennen lernten (HERODOT). Auch das Öl der Mandeln und Nüsse war bereits den Alten bekannt. Sie benutzten die Öle auch als Speiseöle und zur Enfleurage, d. h. zum Ausziehen von Wohlgerüchen aus Pflanzen (viele Vorschriften bei DIOSKURIDES). Als Salbengrundlage begegnen wir dem Wollfett (Oisippus) schon in sehr früher Zeit (PLINIUS). Die Bereitung der Butter aus Pferdemilch durch starkes Schütteln kannten bereits die Skythen (HERODOT) und HIPPOKRATES nennt das Produkt schon βούτυρον. DIOSKURIDES, der das Buttern beschreibt, erwähnt Butter aus Schaf- und Ziegenmilch. Seife, aus Buchenasche und Ziegenfett in Germanien und Gallien bereitet, erwähnt PLINIUS (Hist. nat. 28, 191) als gallische Erfindung. Sapo ist entweder keltischen Ursprungs oder stammt aus ahd. seifa, seifar (= Schaum), agls. sápe, urgerm. saipa und hängt wohl mit lat. sêbum (= Talg) zusammen.[S. 552] Die Gallier und Germanen benutzten die Seife zum Rotfärben der Haare (agls. taelg = Talg und Farbe — bei OVID: femina canitiem germanis inficit herbis) und so wurde sie auch zunächst in Rom benutzt, bis man sapo spissus herstellen lernte und zum Waschen anwendete. Schon damals scheint der Unterschied von harter und weicher Seife bekannt gewesen zu sein. Die Gallier bereiteten harte mit der Asche von Seepflanzen (Soda), die Germanen weiche mit der Asche von Landpflanzen (Kali) und auch GALEN, der Seife, aus Rinder-, Ziegen- und Hammelfett mit Aschenlauge und Kalk bereitet, kennt, erwähnt deutsche Seife zum Waschen und als Heilmittel. Übrigens blühte auch im alten Rom die Seifensiederei um Christi Geburt, wie wir aus Pompeji wissen (in früherer Zeit dienten Aschenlauge, Nitrum (Soda), alkalisches Wasser und gefaulter Urin, auch wohl saponinhaltige Pflanzen zum Waschen). AËTIUS (VI. Jahrh.) erwähnt die schwarze Seife, ebenso die Arzneibücher von Wales (I, S. 683). Später war Marseille und sodann Venedig Sitz großer Seifenfabriken (daher Sapo venetus). Die Bleipflasterdarstellung war den Alten ebenfalls bekannt (DIOSKURIDES, PLINIUS). Nach Germanien kam das Öl, die Sache und das Wort, wohl erst im III. Jahrh. n. Chr. (oleum über kelt. und got. alêw, ahd. olei, agls. ele in Öl). TACHENIUS wußte, daß Alkalien und Metalloxyde die Fette verändern und daß in ihnen eine Säure enthalten ist. MORAY beschrieb (1665) das Walrat, HOMBERG (1687) die Gewinnung des Cacaofettes, LEMÉRY (1708) das Bienenwachs; GEOFFROY, der (1741) die Löslichkeit der Öle studierte, wußte, daß die Seife eine andere Löslichkeit hat, wie das ihr zu Grunde liegende Öl, und MACQUER fand (1745) Säuren in der Seife. FRÉMY erkannte die Analogie der Bleipflasterbildung mit der Seifenbildung. Die Entdeckung, daß rauchende Salpetersäure viele Öle verdickt, machte schon BOYLE (1661) und der Marseiller Apotheker POUTET fand, daß die salpetrige Säure der Grund der Bildung des von ihm Elaïdin genannten Körpers ist. MACQUER meinte (1745), daß ein Fett um so dicker sei, je mehr es «Säure» enthalte. Dann untersuchten noch im XVIII. Jahrh. BUCHNER, DE ROI, VALLERIUS, SALUCES, WATSON u. and. viele Öle und CARTHEUSER (I, S. 962) das Wachs, den Talg, die Seife und die tierischen Fette. CRELL unterwarf sie der trockenen Destillation (1778) und führte (für die flüchtigen Säuren) den Namen Fettsäuren ein. Dem Prozesse des Ranzigwerdens wandte schon J. C. GEHLEN in seiner Dissertatio de oleis pinguibus rancidis Lips. 1776 seine Aufmerksamkeit zu. FOURCROY, der das Leichenwachs auffand, vereinigte dies mit dem von GREN (1788) entdeckten Gallensteinfett (Cholesterin) und dem Walrat zu der Klasse der Fettwachse (Adipocire). SCHEELE entdeckte zwar das Glycerin oder Ölsüß, principium dulce oleorum (De materia saccharina peculiari oleorum expressorum et pinguedinum 1783) und erkannte, daß es beim Erhitzen aller Öle und Fette mit Bleiglätte entsteht, vermochte aber nicht die Natur der Fette aufzuklären, so daß noch LAVOISIER sie für Kohlenwasserstoffe hielt! Die Natur der Fette, wie der Prozeß der Seifenbildung, wurde in einer denkwürdigen umfassenden Untersuchung der tierischen Fette 1811–1823 von CHEVREUL aufgeklärt, der auch bereits feste (acide margarique, a. stéarique), flüssige (acide oléique) und flüchtige (acide delphique [= Baldriansäure] Buttersäure, Capron- und Caprinsäure) unterschied, und die Namen Stearin (von στέαρ = Talg), Elain (von ἔλαιον = Öl) und Cetin (Walrat) einführte. HEINTZ und BERTHELOT setzten die Untersuchungen von CHEVREUL fort. Sie zerlegten die Margarinsäure in Palmitin- und Stearinsäure. BERTHELOT, LUCA und WURTZ erkannten das Glycerin als dreiwertigen Alkohol.
Lit. BECKMANN, Beitr. z. Gesch. d. Erfind. — CHEVREUL, Les corps gras d’origine animale. Paris 1815–1823 (Neudruck 1889). — BERTHELOT, Am. chim. (3) 41, 216 (1854). — HANRIOT, Compt. rend. 1896, 1897 und 1901. — P. SCHACHT, Beitr. z. Synthese der Fette. Diss. Zürich 1908. (Dort eine Liste d. synthet. dargest. Glyceride und eine Literaturübersicht.) — GRÜN, Über d. Konstitut. d. Fette. Habilitationsschr. Zürich 1907. — CORELLI, Unters. über d. Spalt. v. Fett. Diss. Zürich 1909. — SKOPNIK, Synth. dreifach gemischt. Glyceride. Diss. Zürich 1909. — DUNLAP und SEYMOUR, Journ. amer. chem. soc. 27 (1905), 935. — Verbrennungswärme d. Fette: STOHMANN, Journ. prakt. Chem. 31, 32, 42, 44 und 45 und SHERMAN u. SNELL, Journ. am. chem. soc. 1901, 164. — KLIMONT, Zeitschr. angew. Chem. 24, 254 (1911). — HEISE, Arbeit. aus d. kais. Gesundheitsamt (1896) 12, 540; 13, 302. — BELUCCI, Atti R. Accad. dei Lincei (5) 20, I 235 (1911). — FOKIN, Zeitschr. anal. Chem. 1909. — MOLISCH, Histochemie 1891. — HARTWICH und UHLMANN, Nachw. fett. Öle durch mikrochem. Verseif. Arch. Pharm. 1903, 111. — UHLMANN, Dissert. Zürich 1902. — BELL, Chemistry of foods II. — LEWKOWITSCH, Chem. Technologie u. Analyse d. Öle, Fette und Wachse. Braunschweig 1905. — ULZER und KLIMONT, Allgemeine u. physiol. Chemie d. Fette. Berlin 1906. — EULER, Pflanzenchemie. — MARCUSSON, Laboratoriumsbuch für d. Industrie[S. 553] d. Öle und Fette 1911. — TSCHIRCH, Einige prakt. Ergebn. meiner Unters. über d. Chlorophyll. Arch. Pharm. 1884. — Verzeichnis der fettliefernden Pflanzen bei MIKOSCH, in WIESNER, Rohstoffe, II. Aufl. — Untersuchungsmethoden: LEWKOWITSCH in LUNGE, Chem. Techn. Untersuchungsmeth. 5. Aufl. III (1905). — BENEDIKT-ULZER, Analyse d. Fette u. Wachsarten. — Für das Technische: HEFTER, Technologie d. Fette u. Öle 1906. — SCHÄDLER, Technol. d. Fette. 2. Aufl. 1892. — STIEPEL, Fette, Öle, Wachse in WEYLS Einzelschriften z. chem. Technolog. 1911 (reich illustriert). — Über die Fortschritte berichtet der Jahresbericht auf dem Gebiete d. Fette, Öle u. Wachsarten in der Chem. Revue über die Fett- und Harzindustrie. — Ein Spezialkomitee für die einheitliche Untersuchung von Fetten und pflanzlichen Ölen der Amer. chemical Society schlug 1910 einheitliche Methoden vor (Rev. über d. Fett- u. Harzindustr. 1911, 84).
I. Vegetabilische Öle und pflanzliche Öldrogen.
1. Trocknende Öle.
In den trocknenden Ölen sind Fettsäuren mit mehreren doppelten Bindungen enthalten, die also eine hohe Jodzahl zeigen und welche durch Sauerstoffaufnahme erhärtende Oxyde bilden. Ölsäure gehört nicht zu diesen, wohl aber Linolsäure und Linolensäure. Sie geben nicht die Elaidinreaktion, wohl aber, wenn Linolensäure vorhanden, Hexabromid. Die Sauerstoffaufnahme des Leinöls, die Linoxin(Linoxyn-)bildung erfolgt immer an den doppelten Bindungen. ROCH denkt sich dieselbe folgendermaßen:
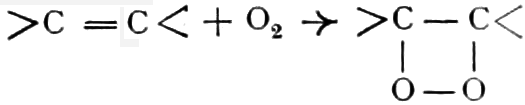
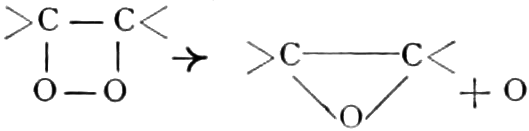
Linoxin ist in allen Lösungsmitteln unlöslich. Die Sauerstoffaufnahme ist (z. B. beim Leinöl) lebhafter, wenn man erst mit Sikkativen (Manganborat, Bleioxyd) kocht.
GENTHE hielt den Vorgang beim Trocknen des Leinöls für eine molekulare Autoxykatalyse und die Sikkative nur für Pseudokatalysatoren, FOKIN für eine hemimolekulare Autoxykatalyse, FAHRION meint, daß bei der Autoxydation zuerst Peroxyde entstehen, daß diese alsdann umgelagert werden und dadurch zu Wasserabspaltung und Komplexbildung führen. Die Sikkative ändern den Chemismus des Autoxydationsvorganges nicht, sondern wirken nur als Katalysatoren beschleunigend oder abkürzend.
Bei Einlegen in die MOLISCH’sche Kaliammoniakmischung liefern die trocknenden Öle kleine Sphärite (UHLMANN).
Lit. MULDER, Chemie d. austrocknenden Öle. Deutsch. von MÜLLER. 1867. — ROCH, Trocknende Öle. Zeitschr. angew. Chem. 1911, 80. — HAZURA, Monatsh. f. Chem. 9, 180. — HEHNER u. MITCHELL, Analyst. 1898, 313. — ROLLETT, Chem. Centralbl. 1909, II, 1984. — FAHRION, Zeitschr. f. angew. Chem. 23 (1910), 722 u. 1910, 1106. — GENTHE, Ebenda 19, 2087. — FOKIN, Ebenda 22, 1451. — ORLOW, Journ. Russ. Phys. Chem. Ges. 42, 658 (Chem. Centralbl. 1910, II, 1529). — H. INGLE (Bemerk. über Leinöl), Journ. Soc. chem. ind. 30, 344.
Semen Lini und Oleum Lini.
Sowohl über die Stammpflanze, Linum usitatissimum, wie über den Samen und sein Öl (Leinöl, Leinsamenöl, huile de lin, linseed oil, oil of flaxseed) ist bereits oben (S. 314) berichtet worden. Der Ölgehalt des Leinsamens schwankt von 24,66 bis 44,46% der Trockensubstanz (KÖNIG); obere Grenze der Asche 5% (HAUKE).
HARRY INGLE, der mehrere tausend Leinöle untersuchte, fand Jodzahl und spez. Gew. bei:
|
Baltischem Leinöl
|
195
|
0,9357
|
|
Calcutta Leinöl
|
185
|
0,9322
|
|
Deutschem Leinöl
|
181,5
|
0,9322
|
|
Englischem Leinöl
|
185
|
0,9332
|
|
Laplata Leinöl
|
179,5
|
0,9315
|
|
Menhaden Leinöl
|
182
|
0,9328
|
[S. 554]
FAHRION gibt jetzt (vgl. oben S. 323) dem Leinöl folgende Zusammensetzung: Unverseifbares 0,6%, gesättigte Fettsäuren 9,3%, Ölsäure 17,5%, Linolsäure 30%, Linolensäure 38%.
Linolsäure (C17H31COOH) enthält zwei doppelte Bindungen, addiert also vier Atome Brom, gibt oxydiert zunächst Sativinsäure (Tetraoxystearinsäure), dann Azelainsäure: COOH(CH2)7COOH.
Linolensäure (C17H29COOH) ist auch eine ungesättigte Säure (s. oben S. 546). Sie liefert ein Hexabromid und gibt oxydiert Linusinsäure (Hexaoxystearinsäure). Beide Säuren sind flüssig.
Die Annahme einer Isolinolensäure (HAZURA) oder β-Linolensäure (ERDMANN, BEDFORD und RASPE) erschien nach ROLLETT unbegründet, doch halten ERDMANN und BEDFORD (1910) ihre Angaben aufrecht.
Das Komitee der Amer. Soc. for testing materials schlägt (ungefähr übereinstimmend mit BENEDIKT-ULZER) folgende Konstanten für reines Leinöl vor: spez. Gewicht 0,935–0,932, Brechungsexponent bei 25°: 1,4805–1,4790, Säurezahl 6, Verseifungszahl 192–189, Jodzahl (HANUS) 190–178, Unverseifbares 0–1,5. Doch fand MEISTER bei absolut reinen Leinölen unter 170, der bisher angenommenen unteren Grenze, liegende Jodzahlen (160,2 bis 164,5).
Die Verbrennungswärme des Leinöls beträgt bei konstantem Volumen 9364 bis 9379, bei konstantem Druck 9379 bis 9394 g-Kalorien (SHERMAN und SNELL). Der Entflammungspunkt liegt bei 205–225° (RAKUSIN).
Hamburg importierte 1908 seewärts 33211 dz Leinöl, davon aus den Niederlanden 25975; 1907 geringe Mengen auch aus den russischen Ostseehäfen und Schweden. Frankreich importierte 1908 18955 Quint. Leinöl, die Hälfte etwa aus Belgien, dann aus China, England und den Niederlanden.
Britisch Indien exportierte Linseed 1907/08: 2290185, 1908/09: 1405467 cwts nach England und engl. Besitzungen und 1907/08: 3907697, 1908/09: 1804080 cwts nach anderen Ländern. Die Gesamtausfuhr an Leinöl betrug 1908/09: über 36000 Gallons. Die Vereinigten Staaten exportierten 1908: 4277313, 1909: 882899 bushels Flaxseed, 1908: 367883, 1909: 273029 Gallons Linseed oil und 1909: 682764545 pounds Linseedoilcake.
In dem Leinsamenpreßkuchen (Leinkuchen, Placenta sem. lini, Pain ou gâteau de lin, linseedcake) sind neben dem Schleim auch alle stickstoffhaltigen Substanzen des Samens enthalten, also das Protein Edestin, krist. Globulin, ein Albumin, wenig Proteosen und Peptone (OSBORNE und CAMPBELL), ferner Lecithin (SCHULZE und STEIGER), Lipase (SIGMUND), Protease (WILL), ein glykosidspaltendes Enzym (DUNSTAN, HENRY und AULD), Linamarin (Phaseolunatin, s. oben S. 322) und Reste des fetten Öls.
Die Zusammensetzung des Leinpreßkuchen in % ergibt sich aus folgender Tabelle:
|
KÖNIG
|
GAROLA
|
WAGNER
|
HOLDE-
FLEISS |
|||
|
Min.
|
Max.
|
Mittel
|
||||
|
Wasser
|
9,54
|
20,50
|
12,19
|
12,86
|
10,40
|
13,43
|
|
Stickstoffhaltige Substanz
|
19,00
|
36,18
|
29,48
|
30,87
|
25,94
|
25,27
|
|
Fett
|
3,78
|
16,34
|
9,88
|
8,75
|
12,30
|
11,43
|
|
Stickstofffreie Substanz
|
24,54
|
46,58
|
29,91
|
28,48
|
34,81
|
30,72
|
|
Cellulose
|
5,42
|
16,50
|
9,69
|
11,88
|
10,75
|
11,72
|
|
Asche
|
5,13
|
16,50
|
9,69
|
7,16
|
5,80
|
7,40
|
Da der Leinpreßkuchen als Futtermittel sehr geschätzt, aber relativ teuer ist, so wird er oft verfälscht angetroffen, besonders mit Mohnsamen- und Arachispreßkuchen. COLLIN fand darin auch die Samen von Chenopodium polyspermum, Spergularia arvensis, Cerastium triviale, Spergula arvensis, sowie Leguminosensamen.
[S. 555]
Das Flachswachs besteht aus Phytosterin, Cerylalkohol, Palmitin-, Stearin-, Öl-, Linol- und Linolensäure. F. = 61,5, Jodzahl 10.
Lit. Vgl. oben unter Trocknende Öle. — Chem. Lit. zusammengestellt in WEHMER, Pflanzenstoffe. — Über die Bestandteile der Aleuronkörner vgl. TSCHIRCH und KRITZLER, Ber. d. pharm. Ges. 1900, 264. — Preßkuchen: COLLIN-PERROT, Les résidus industriels.
Fructus Cannabis und Oleum Cannabis.
Syn. Hanfsamen: graine de chanvre, hemp seed, seme di canape. Die Pflanze: Hanf, Bästling, Hämp oder Hemp, in Österreich: Harf, Pastök und Hanef; in der Schweiz: Werch (die Frucht: Hausset), Tregel, Tschenevo, in Bünden: Chanf, im Tessin: Canape, Canapule. Die männliche Pflanze: Hanfhahn, fälschlich (weil kleiner) femmel oder fimmel (von femella = Weibchen — deutet auf späte römische Einflüsse), die weibliche Pflanze: Hanfhenne, Hänfin, Samenhanf, fälschlich mastel, masch, mäschel (von mas) — so schon im Corpusglossar. Bei GERARDE (Herbal 1633): der männliche wird Carl- oder Winter-H. genannt, der weibliche Barren- oder Sommer-H. — hemp (engl.) — chanvre, chènevis (franz.), cambre (norm.), chène (wallon.) — canappa (ital.) — câñamo (span.) — cánhamo (port). — hennep (holl.) — hamp (norweg.) — hampa (schwed.) — konópel (russ.) — καννάβι (griech.).
Bei DIOSKURIDES: κάνναβις, — bei PLINIUS: cannabis, — bei den späteren Griechen: σχινόστροφος, ἀστέριον. — Bei SIMON SETH: κανναβουρόσπερμα; — im Mittelalter: canabus, canapus, caniva, canopus, sechedenchi; bei der HILDEGARD: hanff, cannabus; — bei ALHERVI: schâh-dânadsch — bei IBN BAITHAR: kunnab. — In der Alphita, bei SERAPION und BARTHOLOMAEUS steht: canaps, cannabis, canapis caulis et canabit, cotumb, scehedenegi canabis, canurus, hemp. — ahd. hanaf, anord. hampr, mhd. hanef, hanf, nhd. hanf, nnd. hemp, angels. haenep, ndl. kennep, arab. kinnub, cannab, sansc. goni, sana, indrasana (= INDRAS Hanf), shanapu, banga, ganjika, beng. ganga. Die Früchte heißen hind.: ganjé-ke-bij, tam.: ganja-virai, beng.: ganja-bij — im pers. shahdánah = Königssamen (Pharm. ind.). In China heißt der Hanf ho-ma, ta-ma oder ya-ma (auch für andere Gespinstpflanzen benutzt, DRAGENDORFF), die Frucht: ho-ma-jin.
Etym. Die frühere Annahme, daß das Wort Hanf aus cannabis entstanden sei, ist jetzt aufgegeben (KLUGE, SCHRADER). Beide Worte werden jetzt von der gemeinsamen Wurzel canna, ken (çaṇa im Sanskrit = Rohr) abgeleitet, die sich im čeremissischen kehe, kiné (= Hanf) findet und die auch im turko-tartar. kin-dūr (= Hanf) bulgar. kenevir (= Leinwand) und magyar. kender (= Hanf) auftritt. Die Endsilbe bis bringt SCHRADER zu dem syrjänischen und wotjakischen piš, puš (= Nessel) in Beziehung. (Bei WRIGT-WÜLCKER Agls. a. O. E. Vocabularies I, 198: cannabum haenep vel pis.). Cannabis wäre also selbst Lehnwort und ein Doppelwort, das Hanf-Nessel(ein Pleonasmus!) bedeutete. Alban. heißt der H. kanep, lit. kanapis, aslov. konoplja, armen. kanap, npers. kanab. (Die Ableitung von cannabis und Hanf aus der in Banga und Gangika enthaltenen Sanskritwurzel ang oder an [DE CANDOLLE] leuchtet mir nicht ein.) Der Name kann nicht bis in die indogermanische Urzeit, ja nicht einmal bis in die Epoche vor dem Abzug der Griechen nach Süden zurückreichen, da der H. den Griechen noch unbekannt war, während er damals im südlichen Rußland schon gebaut wurde. «Die Germanen erfuhren Einfluß südlicher Kultur etwa erst in den ersten Jahrhunderten unserer Zeitrechnung. Es gibt kein Lehnwort aus dem Griech. oder Latein., das die erste Lautverschiebung vollständig mitgemacht hätte. Wenn aber Verschiebung der Konsonanten in germ. hanapiz gegenüber κάνναβις vorliegt, so ist dies ein Beweis dafür, daß das Wort ein paar Jahrhunderte n. Chr. bei den Germanen bereits eingebürgert war» (KLUGE). — Der in alten Pflanzenglossaren auftretende Name für H. agrius (von ἄγριος = wild) deutet vielleicht darauf, daß H. an wüsten Plätzen ausgesät wurde und viel halbwild wuchs (FISCHER-BENZON). Auf die Verwendung der Faser zu Stricken deutet die Bezeichnung σχοινόστρωφον (= Stricke drehend, bei DIOSKURIDES, von σχοινίον und στρέφειν), die Namen Bästling, Bast, Bösling, Werch. Die einfachere Form canna, κάννη, im altindischen çaṇa, deutet vielleicht (GRASSMANN) auf Rohr, das auch zu Flechtwerken diente (KANNGIESSER), auf die sternförmige Fingerteilung der Blätter der Name ἀστήριον (bei DIOSKURIDES).
[S. 556]
Stammpflanze und systemat. Stellung. Cannabis sativa L. (Spec. pl. ed. I, 1027) mit einigen Varietäten und Formen (s. unten). In Amerika wird von der typica eine var. americana unterschieden, in Algier eine als Kif.
Urticales — Moraceae — Cannaboideae (neben Humulus). Cannabis Tourn. hat nur eine Art.
Beschreibung der Stammpflanze. Der Hanf ist eine einjährige, krautige, diklin-diöcische (bisweilen monöcische) Pflanze mit straffem, aufrechtem, bis 3 m hohem und 5 cm dickem, undeutlich kantigem, kurz rauhhaarigem Stengel, der aber in der Kultur (z. B. bei der var. gigantea und der var. chinensis DEL. in China) doppelt so hoch, in der Poebene doppelt mannshoch werden kann, bei der var. pedemontanus aber nur 1,5 m hoch ist. Die Stengel enthalten in der Rinde zahlreiche Bastfasergruppen (s. Hanffaser, S. 254). Die Verzweigung ist bei der weiblichen Pflanze dichter als bei der männlichen (bei der var. pedemontana reich und abstehend). Die Blätter, unten dekussiert, oben spiralig angeordnet, sind gestielt, (3-) 5-, 7–9fach gefingert. Der Stiel besitzt oben eine seichte Regenrinne. Die sitzenden, rauhhaarigen Blättchen sind lanzettlich, beiderseits zugespitzt, scharf gesägt (DIOSKURIDES vergleicht sie mit denen der Esche), die pfriemlichen Nebenblätter fein behaart. Die lockeren männlichen Infloreszenzen sind nur unten laubig.
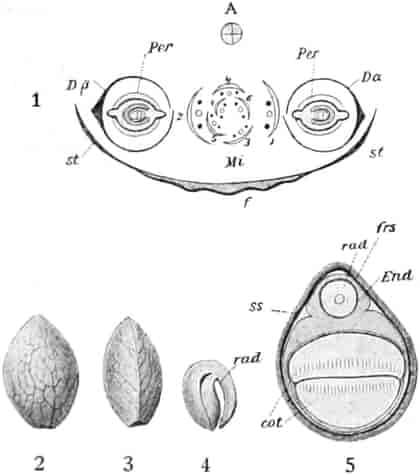
Cannabis sativa L.
1. Diagramm der weiblichen Infloreszenz. 2 Frucht von der Fläche, 3 Frucht von der Kante gesehn. 4 Keimling herauspräpariert. 5 Querschnitt durch die Frucht und den Samen.
[Tschirch-Oesterle, Atlas.]
Die achselständigen Partialinfloreszenzen der männlichen Pflanze sind Doppelrispen: die Hauptachse verkümmert, unter ihrer Spitze entspringen zwei gleichwertige Rispen. An der Spindel der letzteren entspringen in der Achsel von Deckblättern unten kleine Dichasien, oben Wickel (reichblütige Dichasien mit Wickeltendenz und stark gestreckter Sympodialachse). Am Ende der Hauptachse der Pflanze steht eine echte Rispe. Die kurzgestielten aktinomorphen Blüten besitzen ein 5 mm langes, grünliches, aus fünf lineal-lanzettlichen Blättchen bestehendes Perigon, fünf epipetale Stamina mit linealer, mit Längsspalt aufspringender Anthere und kurzem Filament. Pollen rundlich (vgl. S. 480). Ein Stempelrest fehlt. Die dichte buschige weibliche Infloreszenz ist bis fast zum Gipfel laubig.
Bei den achselständigen weiblichen Partialinfloreszenzen ist die Hauptachse entwickelt. Sie wird zu einem Laubtrieb (Fig. 179, Mi). Die beiden Vorblätter (D α u. β) werden zu Deckblättern der zwei weiblichen Blüten. Sie umhüllen diese in Form einer innen offenen, außen behaarten Scheide, die länger ist wie der Fruchtknoten. In den Laubblattachseln der Zweige zweiten Grades wiederholt sich dasselbe und so entsteht der buschige Wuchs, der die meist kräftigeren weiblichen Pflanzen von den locker beblätterten männlichen unterscheidet. Das aus zwei Blattanlagen hervorgehende Perigon umgibt die Basis des einfächerigen, sitzenden Fruchtknotens becherförmig eng. Der eiförmige zusammengedrückte Fruchtknoten enthält ein vom Scheitel der Blütenachse gebildetes (ZINGER), hängendes, anatropes[S. 557] Ovulum und trägt zwei lange fadenförmige, in papillöse Narben auslaufende Griffel, die nach der Befruchtung abfallen. Die gelblich-graue, platte, kahle Frucht ist ein Nüßchen, das von dem sich vergrößernden Deckblatt umhüllt ist. Die Mikropyle der Samenanlagen ist zur Zeit der Reife nicht mehr vorhanden. Der Pollenschlauch wächst durch das Gewebe der Fruchtknotenwand zum Nucellus (ZINGER). Die ganze Pflanze, besonders aber die weibliche Infloreszenz, besitzt einen starken narkotischen Geruch, der von Öldrüsen herrührt, die namentlich auf allen Blattorganen sitzen (s. Anatomie).
Blüht in Deutschland im Juli bis August.
Die ursprüngliche Heimat des Hanf ist wohl die Gegend am Caspisee. Er ist sicher wild noch jetzt südlich von diesem See, und bei Lenkoran, sowie bei Astarte (BUNGE). Häufig angetroffen wird er auch in Sibirien, am Irtysch südlich vom Baikalsee, in Dahurien (Gouvern. Irkutzk), im Ural, an der Wolga, in Persien, Altai, West-China, Kaschgar, Kaschmir und im Himalaya. Im Himalaya steigt der Hanf bis 3000 m. Er ist jetzt durch Kultur über die Länder der gemäßigten Zone beider Hemisphären verbreitet. Daß er am Missouri wild wachse (WHERREL) ist aber nicht richtig. Nach Afrika ist er ebenfalls eingeführt worden, denn LIVINGSTONE fand ihn im Gebiete des Congo und Sambesi.
Die physiologische Varietät indica (auch wohl als Art Cannabis indica LAM. unterschieden) weicht nur im Wuchs ab (sie ist kleiner) und in der viel reicheren Ausbildung der Drüsenhaare und demgemäß stärkerem, fast betäubendem Geruch; die Art des Sekretes ist aber wohl dieselbe wie bei unserem Hanf (WOOD). Sie liefert keine spinnbare Faser (s. Herb. cannabis). Die Ableitung der Cannabis sativa des Nordens von dem indischen Hanf (WIESNER) leuchtet mir nicht ein. Eher dürfte das Umgekehrte der Fall sein.
Lit. ENGLER, Moraceae in ENGLER-PRANTL, Pflanzenfam. — LUERSSEN, Mediz. pharm. Botan. II, 528. — EICHLER, Blütendiagr. — BUNGE, Bull. Soc. Bot. France 1860, 30. — LEDEBOUR, Flora rossica. — DE CANDOLLE, L’origine d. pl. cult. — HÜGEL, Kaschmir. 1840. — ROYLE, Illustr. of the bot. of the Himalayan mont. 1839 und Fibrous plants of India. Cultivation of hemp in India. — GARNIER, Exploration in Indo-Chine 1873. — ZINGER, Beitr. z. Kenntn. d. weibl. Blüten u. d. Infloresz. d. Cannabineen. Flora 85, 189.
Abbild.: BERG-SCHMIDT, Atlas 2. Aufl., t. 129 (dort die systemat. Lit.). — PABST-KÖHLER, Medizinalpfl. t. 13. — NEES VON ESENBECK, Plant. med. t. 102. — HAYNE, Arzneigew. t. 35. — REICHENBACH, Icon. fl. Germ. t. 655. — BENTLEY and TRIMEN, Medic. plant. t. 231. — RHEEDE, Hort. mal. t. 60 u. 61. — RUMPHIUS, Herb. Amb. V, t. 77.
Pathologie. Prof. ED. FISCHER teilt Folgendes über die pflanzlichen Schädlinge mit: Auf Stengeln und Blättern des Hanfes sind verschiedene Parasiten beobachtet, von denen die meisten nicht sehr erhebliche Schädigungen hervorrufen dürften. Wir erwähnen unter denselben Peronospora Cannabina OTTH., Dendrophoma Marconii CAV., Septoria Cannabis (LASCH) SACC., Phyllosticta Cannabis SPEG. Wichtiger ist die als Hanfkrebs beschriebene Erkrankung, welche durch eine Sclerotinia (Scl. Kauffmanniana TICHOMIROFF, nach DE BARY mit Scl. Sclerotiorum LIBERT übereinstimmend) hervorgerufen wird, deren Mycel den Stengel durchwuchert und an dessen Oberfläche sowie im Markraum Sklerotien bildet. Die sog. Brusonekrankheit des Hanfes, bei welcher am Stengel etwas vorspringende, weissgraue Flecken und ein Absterben des Gewebes bis zum Holzkörper beobachtet wird, ist nach V. PEGLION eine Bakteriose. Endlich leben auf Cannabis sativa die beiden phanerogamischen Parasiten Orobanche ramosa L. (Phelipaea ramosa C. A. MEYER) und Cuscuta europaea L.
Kultur und Handel. Der Hanf wird besonders zur Gewinnung seiner Faser, weniger wegen der Früchte und des aus ihnen gepreßten Öls, in Indien als narkotisches Genußmittel (zur Bereitung des Haschisch I, S. 1042) gebaut; in größerem[S. 558] Maßstabe in Rußland in den Gouvernements Smolensk, Kaluga, Tela, Orel, Kursk, Tschernigoff. Ferner wird Hanf angebaut in China, Ostindien (hier die var. indica), Persien, Österreich, Ungarn, Deutschland (Baden, Elsaß, Rheinlande), Nordamerika (hier auch in Form der var. americana) und Neu-Seeland. Er gedeiht ebenso in der Nähe des Polarkreises (Archangel) wie in Indien. Hanf findet sich bisweilen in den Gärten der Bauern und Fischer in Kleinkultur (Kampongkultur I, S. 48), die daraus die Faser gewinnen (FISCHER-BENZON). Der Hanf liebt im allgemeinen ein nicht zu nasses, warmes Klima und eine geschützte Lage. Er verlangt einen kräftigen, tiefgründigen Boden. Der Hanf reift in 13–14 Wochen und welkt nicht eher als bis die Früchte reif sind. Die Früchte fallen zur Reifezeit aus der Hülle. Man trocknet sie rasch an der Luft. Die Früchte werden in Mitteleuropa im August gesammelt.
In Amerika kennt man folgende Sorten von Cannabis sativa-Früchten: barren hemp, black seeded hemp, chinese hemp, common h., East India h., German h., Indian h., Imperial Kentucky h., Russian h., New Zealand h. Der Hanfsamen von C. s. var. americana heißt: American hemp, auch wohl (fälschlich) chinese h. (WHERRELL).
Im deutschen Handel ist Hanfsaat in Ballen von c. 100 kg.
Hamburg führte von Fr. Cannabis 1908: 1082800 kg, 1909: 592100 kg ein und 1908: 780300 kg, 1909: 342500 kg seewärts aus (TUNMANN). Deutschland importierte 1909: 77526 dz «Hanfsaat» besonders aus dem europ. Rußland und Österreich und exportierte 59188 dz, besonders nach Frankreich.
Lit. OPPENAU, Der Hanfbau im Elsaß, seine Geschichte u. Bedeutung. 1897. — O’SHAUGHNESSY, Bengal dispens. and Pharmac. 1841. — WATT, Dict. econom. prod. India. — Wherrell s. unten. — TUNMANN, Apoth. Zeit. 1911.
Beschreibung der Droge. Die nußartigen, einfächerigen, einsamigen Schließfrüchte, die je nach der Sorte etwas verschieden in Form, Größe, Glanz, Marmorierung und Aderung sind, und denen bisweilen noch bräunliche Reste des Deckblattes anhaften, sind c. 3–5 mm lang und c. 2 mm breit (die Früchte der var. gigantea sind größer, HARZ), oval, breit-eiförmig etwas zusammengedrückt, an den Kanten, besonders an der dem Würzelchen entsprechenden Seite, gekielt (Fig. 179) und hier bei der Keimung zweiklappig aufspringend. Das Gewicht einer Frucht beträgt c. 4 mg. Die dünne, harte, zerbrechliche, glatte und glänzende Schale ist grau, grünlichgrau, grünlichbraun oder graubraun, innen meist olivenbraun, durch ein zierliches, von der Basis aufsteigendes, besonders bei Betrachtung mit der Lupe deutliches Adernetz zarter Gefäßbündel gezeichnet (Fig. 179). Der an der Spitze der Frucht angewachsene, von einer zarten, grünlichen, neben der Spitze der Radicula eine braune Chalaza zeigenden Samenhaut bedeckte Same enthält reichlich Endosperm nur um die Radicula. Er ist aus einem camptotropen Ovulum hervorgegangen, daher ist der Embryo hakenförmig gekrümmt (Fig. 179, 4). Dieser besitzt breite, fleischige Cotyledonen und eine anliegende Radicula, deren Spitze gegen die Spitze der Frucht gerichtet ist. Zwischen den Cotyledonen liegt die kleine Plumula. Die Früchte schmecken ölig, süßlich, etwas schleimig, die Emulsion widerlich. Hohle oder zerbrochene (stets ranzige) Früchte sind zu beseitigen. Aufgesprungene keimen nur zu 54% (HARZ). Man bewahrt Hanffrüchte am besten in hölzernen Gefässen auf.
Lit. MUTH, Unters. über d. Früchte d. Hanf. Jahresb. d. Verein. d. Vertret. d. angew. Botanik 1906. — TSCHIRCH in Realenzyklop. — HARZ, Landwirtsch. Samenkunde.
Anatomie. Die Fruchtknotenwand ist haar- und drüsenfrei. Das Perigon trägt einige Öldrüsen, ganz besonders ist aber das große, in einen langen, lanzettlichen Zipfel auslaufende Deckblatt außer mit Cystolithenhaaren (wie die Laubblätter) über und über mit Öldrüsen besät (vgl. TSCHIRCH-OESTERLE, Anatom. Atlas), die beim indischen Hanf sehr dicht stehen, bisweilen[S. 559] mehr wie 16 Secernierungszellen enthalten und auf langen Stielen emporgehoben sind. Platzt die Cuticula der Drüsen, so verklebt das Sekret den ganzen weiblichen Blütenstand, was besonders beim indischen Hanf stattfindet.
Die Fruchtschale besteht aus zwei Schichten, einer weichen äußeren und einer harten inneren. Die äußere besteht aus vier Schichten: der Epidermis, einer Zone unregelmäßiger Zellen, eine Schicht brauner, quergestreckter und einer Reihe heller quadratischer Zellen. In der subepidermalen Zone verlaufen die zarten Bündel, die die Zeichnung der Frucht (s. oben u. Fig. 179) bedingen. Die Hartschicht der Fruchtschale besteht aus einer Reihe sehr eigenartiger Palissadensklereïden (Fig. 180, scl). Die grünliche Samenschale besteht aus zwei Schichten, einer äußeren einreihigen, die aus eigentümlichen langen, eine grünliche Substanz enthaltenden Schlauchzellen besteht und einer inneren breiten, stark obliterierten Nährschicht (Fig. 180 N).
Das aleuronreiche, der Samenschale anhaftende Endosperm ist gegen die Cotyledonen hin durch eine Quellschicht (TSCHIRCH) abgeschlossen (Fig. 180 Qu). Die subepidermale Schicht der Oberseite der Cotyledonen zeigt palissadenartige Streckung. Das Gewebe der Cotyledonen und der Radicula ist erfüllt mit in Ölplasma eingebetteten, Globoide und Kristalloide einschließenden, c. 4–8 mik. langen Aleuronkörnern. Die Angabe WHERRELLS, daß auch Stärkekörner in großer Menge vorkommen, beruht auf einen Irrtum. Jede Zelle enthält einen lappigen Zellkern.
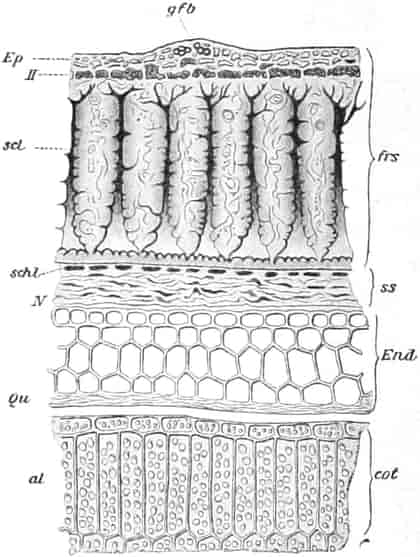
Cannabis sativa L.
Querschnitt durch die Fruchtschale (frs), Samenschale (ss), das Endosperm (End.) und die innere Schicht eines Cotyledon.
[Tschirch-Oesterle, Atlas.]
Lit. TSCHIRCH, Anatomie, Fig. 36, 148, 157, 533. — TSCHIRCH-OESTERLE, Anatom. Atlas (dort das anatom. Detail). — TSCHIRCH, Cannabis in Realenzyklop. d. Pharm. — WINTON, Anatom. d. Hanfsam., Zeitschr. d. Unters. d. Nahrungs- u. Genußm. 1904; auch Conn. Agric. Exp. Stat. Rep. 1903, 175. — COLLIN-PERROT, Les résidus industriels (p. 115 die Preßkuchen mit Abbild.). — MOELLER-WINTON, Mikroskop. d. Nahrungsm. und WINTON-MOELLER, Microscopy of vegetable foods (mit Abbild.). — HARZ, Landw. Samenkunde (mit ungenauen Abbild.). — MACCHIATI, Anat. del frutto e germinat. del seme della canapa Bull. Staz. agrar. di Modena 1889. — BENECKE, Mikrosk. Unters. d. Kraftfutterm. 1886. — COLLIN, Guide pratique 1893. — T. F. HANAUSEK, Nahrungs- u. Genußm. 1884. — BÖHMER in KÖNIGS Unters. landwirtsch. u. gewerbl. wichtig. Stoffe 1898.
Chemie. Eine ältere Analyse (BUCHHOLZ) gibt an, daß die Früchte enthalten in Prozenten: 19,1 Öl, 1,6 Harz, 1,6 Zucker und Extraktivstoff, 9 gummiges Extrakt, 24,7 lösliches Eiweiß, 5 Dextrin, 38,3 Faser. ANDERSON fand 22% Eiweiß, Phosphate 2,4%, übrige Asche 4%. Die lufttrockenen Früchte ergaben im Durchschnitt zahlreicher Analysen (BOUSSINGAULT, DIETRICH und KÖNIG, ANDERSON, SCHÄDLER) in Prozenten: 8,92 Wasser, 18,23 Stickstoffsubstanz, 32,58 (31,42–33,6) Fett, 21,06 stickstofffreie Extraktstoffe, 14,97 Rohfaser, 4,24 Asche — in der Trockensubstanz: 20,01 Stickstoffsubstanz und 35,77 Fett.
FRANKFURT fand (1894) in der Trockensubstanz in Prozenten: 18,63 Eiweiß[S. 560] (Myosin, Vitellin), 3,36 Nucleïn usw., 0,88 Lecithin, 30,92 Glyceride, 0,07 Cholesterin, 2,59 Rohrzucker (E. SCHULZE) und sonstige lösliche Kohlehydrate, 11,02 Pentosane, 0,68 organische Säuren (Citronensäure), 26,33 Rohfaser, 5,51 Asche (LEUCHTWEISS: 5%). Der wässrige Auszug der unzerkleinerten Früchte schmeckt süßlich und reduziert FEHLINGsche Lösung in der Kälte, durch Eisenchlorid wird er nicht gefärbt (FLÜCKIGER).
In der von 3,5–6,5% (2,2–7,39 WHERRELL) schwankenden Asche findet sich in %: 20,28 Kali, 23,64 Kalk, 36,46 Phosphorsäure, 11,9 Kieselsäure, 5,7 Magnesia, 1 Eisenoxyd, 0,78 Natron, 0,19 Schwefelsäure, 0,08 Chlor.
Ferner wurde in der Hanffrucht gefunden: Edestin (OSBORNE und CAMPBELL), krist. Globulin (RITTHAUSEN, OSBORNE), Anhydrooxymethylenphosphorsäure (?), als Ca-Mg-Salz = Phytin (?) (POSTERNAK), Trigonellin und Cholin (SCHULZE und FRANKFURT, MARINO ZUCCO, JAHNS), 3,36% Nucleïn, 0,88% Lecithin und die Enzyme: Emulsin (SIMON), Lipase (SIEGMUND), Protease (WILL).
In den Aleuronkörnern finden sich hauptsächlich Globuline. Die Kristalloide enthalten wenigstens zwei Globuline von verschiedener Löslichkeit, die Globoide neben Globulinen in anscheinend fester Bindung Ca, Mg und H3PO4 mit einem organischen Rest, die Grundsubstanz neben Globulinen wenig Albumosen (TSCHIRCH und KRITZLER).
Durch Pressung erhält man 15–30% Öl (und 70–85% «Hanfpreßkuchen»), durch Ätherextraktion bis 34,5% Öl (FLÜCKIGER); noch höhere Zahlen erhielten MUNCH (1866): 35,5% und WHERRELL (1897) mit Petroläther und Äther: 35,65%. Als Durchschnittsgehalt kann man 32% annehmen.
Das Hanföl, Oleum cannabis (huile de chanvre, de chènevis, hemp seed oil, olio di canape) zeigt die Elementarzusammensetzung C = 76,0, H = 11,3, O = 12,7, ist frisch gepreßt hellgrün bis grünlichgelb, wird aber bald braungelb und hat meist einen unangenehmen Geruch. Es enthält neben den Glyceriden der Stearin- und Palmitinsäure vorwiegend das Glycerid der Linolsäure (c. 70%) neben 15% Linolen- und Isolinolensäureglyceriden (vgl. S. 546). BAUER und HAZURA fanden darin eine eigentümliche Fettsäure: Hanfölsäure, C18H32O2, die aber wohl mit Linolsäure identisch ist (?). Nach LEWKOWITSCH fehlt Stearinsäure. Der Gehalt an freier Säure beträgt c. 5% (BAUER, HAZURA, GRÜSSNER), der Gehalt an unverseifbaren Bestandteilen (Phytosterin + Lecithin) beträgt 1,08%. Das spez. Gewicht ist = 0,925–0,931. Das Öl verdickt sich bei −15 und erstarrt bei −27°. Die Verseifungszahl beträgt 190–194,9, die Jodzahl ist sehr hoch: 140–166 (meist 148 bis 157), die Acetylzahl der Fettsäuren 7,5, die Sauerstoffabsorption, direkt bestimmt: 13,4%, die Temperaturerhöhung bei der MAUMENÉschen Probe beträgt 95–99° (ULZER und KLIMONT), Brechungsexponent in Oleorefraktometer +30 bis 37,5, der Entflammungspunkt liegt bei 250–265° (RAKUSIN) (weitere Konstanten bei LEWKOWITSCH a. a. O.). Das Öl wird rasch ranzig. Da die Fruchtschale stets Chlorophyll enthält und dieses in Öl löslich ist, so findet man diesen Farbstoff auch, wie die spektralanalytische Untersuchung lehrt (TSCHIRCH), im Öl. Das mit Äther ausgezogene Öl ist bräunlichgrün.
Die in 12–15 kg schweren Broten in den Handel gebrachten Hanfsamenpreßkuchen (pain de chènevis, tourteau de chanvre) enthalten c. 10% Wasser, 6–10,17% Öl, 21–31% Stickstoffsubstanz, 17,3–24,7% Faser und 7–8% Asche (CORNEVIN, GAROLA, DIETRICH und KÖNIG). Narkotische Bestandteile, etwa der Art wie sie die Blätter zeigen, enthält die Frucht nicht. Sie kann also nicht zu Berauschungszwecken (I, S. 1042) benutzt worden sein. Wohl aber zeigten die Preßkuchen bei Tieren abführende Eigenschaften.
[S. 561]
Lit. BUCHOLZ, Arch. Pharm. (2) 78, 211. — ANDERSON, Journ. Agric. of the Highland Soc. 1855, 128 (Arch. Pharm. [2] 78, 211. Jahresber. d. Chem. 1855, 727). — LEUCHTWEISS, Lieb. Ann. 50 (1844), 417. — SIMON, Pogg. Ann. 43, 404. — KÖNIG, Nahrungs- u. Genußmittel (dort weitere Lit.). — SAMOGGIA, Staz. sperim. agr. ital. 31 (1898), 417. — FLÜCKIGER, Pharmakogn. — J. B. BOUSSINGAULT, D. Landwirtsch. in ihren Bezieh. z. Chemie 3, 202. — WILL, Ber. d. chem. Ges. 1875, 1570. — SCHÄDLER, Technol. d. Fette 1883. — FRANKFURT, Landw. Versuchsstat. 43 (1894), 145 u. 307. — SCHULZE und FRANKFURT, Zeitschr. phys. Chem. 20 (1895), 511. — LEWKOWITSCH, Chem. Technol. d. Öle usw. (dort die analyt. Liter.) — ULZER-KLIMONT, Chem. d. Fette. — WHERRELL, Bull. of pharmacy 1897, 340. — OSBORNE u. CAMPBELL, Journ. amer. chem. soc. 18 (1896), 609. — POSTERNAK, Compt. rend. 137 (1903), 202. — MARINO-ZUCCO, Gaz. chim. ital. 1895, 262. — SIEGMUND, Monatsh. f. Chem. 1890, 272. — BAUER u. HAZURA, Ebenda 1886, 216. — HAZURA, Ebenda 7, 637 u. 8, 147. — TSCHIRCH u. KRITZLER, Aleuronkörner. Ber. d. pharm. Ges. 1890, 246. — Lit. der Aschenanalysen des H. in WEHMER, Pflanzenstoffe. Analysen der Hanfsamenpreßkuchen in HARZ, Landwirtsch. Samenkunde, BÖHMER, Die Kraftfuttermittel und in DAMMERS Illustriert. Lexik.
Verwechslungen und Substitutionen. In Amerika fand WHERRELL als «Hanf» (hemp) bezeichnet folgende Sorten: Agrimony hemp: Eupatorium cannabinum, Ambareehemp (oder Deckarreeh.): Hibiscus cannabinus, Africanh.: Sanseveria guineensis, Bastardh.: Datisca cannabina, Bengalh. (Bombayh. brownh., Madrash., Sunnh.): Crotolaria juncea, Bowstringh.: Sanseveria zeylanica, Black indianh. (Canadianh.): Apocynum cannabinum und A. androsaemifolium, Jubbulporeh.: Crotolaria tenuifolia, Manilah.: Musa textilis, Nettleh.: Galeopsis Tetrahit, Rajinahalh.: Marsdenia tenacissima, Sisalh.: Agave sisalana, Waterh.: Acnida cannabina, White Indianh.: Asclepias incarnata, Wildh.: Ambrosia trifida. Die Herkunft von Chilianh. ist zweifelhaft. Diese Sorten sind vornehmlich Faserpflanzen.
Das Hanföl dient seinerseits vielfach (z. B. in Amerika) als Verfälschungsmittel des Leinöls. Die Hanfpreßkuchen werden mit allem möglichen, z. B. Salz, in Frankreich mit Tourteau de Pulghère oder de Pignon d’Inde (Jatropha Curcas) verfälscht (COLLIN). Letztere Beimengung ist gefährlich.
Lit. ORTA WHERRELL, Hemp seed and hemp seed oil. Bull. of pharm. 11 (1897), 340 (mit Abbild.).
Anwendung. Die Emulsion der Frucht (Emulsio seminis cannabis) dient als reizmilderndes Mittel besonders bei Blasenleiden, das Öl in der Tierheilkunde als Einreibung bei übermäßiger Milchsekretion, ferner zur Herstellung von Schmierseife, «grüner Seife», die hier, da das Öl grün ist, wirklich eine grüne Farbe hat. Aus dem Samenkern wird Phytin dargestellt, das aber ein Gemenge ist [Inosit-Phosphorsäure (?) und Glukuron-Phosphorsäure?]. Hanföl ist während der griechisch-katholischen Fastenzeit Hauptnahrungsmittel des russischen Volkes (HEHN). Der Hanf ist auch Volksheilmittel in Rußland (KOBERT, Studien I). Die Hanfsamenpreßkuchen werden, da sie schlecht schmecken und abführend wirken, nur wenig als Futtermittel, viel als Düngemittel und in sehr beträchtlichen Mengen (in Frankreich bis 150000 kg pro Jahr) zum Füttern der Fische benutzt (COLLIN). Die Hanffrüchte sind ein beliebtes Vogelfutter. In Nordwest-Europa werden sie geröstet und mit Salz zu Brot, Suppen usw. gegessen. In England dient Hanf als Liebesorakel, in Serbien die Blüte als Aphrodisiacum.
Lit. COLLIN-PERROT, Residus industr. — Phytin: LEVENE und NEUBERG, Biochem. Zeitschr. 1909, 399 u. 406.
Geschichte. Da die Heimat des H. in Asien sich befindet, ist es erklärlich, daß besonders die Skythen und die Chinesen sowie andere asiatische Völker von jeher die Hanfkultur betrieben, die Mittelmeerländer aber die Leinkultur (ENGLER). Die Heimat der Hanfkultur ist also wahrscheinlich im nordwestlichen oder zentralen Asien (vielleicht auch in Südrußland) zu suchen. DE CANDOLLE nimmt an, daß skythische Stämme den Hanf (um 1500 n. Chr. etwas vor dem trojanischen Kriege) von Centralasien und Rußland nach dem Westen brachten. Den Hanf[S. 562] kannten die alten Ägypter nicht, ebensowenig die Phönikier. Er fehlt auch im alten Testament (HEHN). Weder Hanfsamen noch die Faser sind im alten Ägypten nachzuweisen (BUSCHAN), auch nicht in den Schriften der Ägypter und Hebräer. Dagegen wird er schon in den ältesten Schriften Chinas (z. B. im Shuking 500 n. Chr.) erwähnt und das chinesische Wörterbuch Rha ya (I, S. 520) unterscheidet bereits den männlichen und weiblichen Hanf (BRETSCHNEIDER). Auch Pen ts’ao kang mu (I, S. 518) führt Hanfsamen auf und der Hanfkultur gedenkt das landwirtschaftliche Werk Tsʿi min yao shu (I, S, 522). In Nordindien wurde H. schon 800 bis 900 n. Chr. gebaut. Das sanskritische çaṇa bezieht sich wohl auf Cannabis, obwohl es auch Crotularia juncea bedeuten kann (L. von SCHROEDER bei WIESNER). In Atharvaveda wird çaṇa als Heilmittel, in Sûtras (600 n. Chr.) werden Stricke aus çaṇa erwähnt. H. findet sich auch in Sušrutas und Charakas und anderen indischen Werken. Auf iranisch-skythischem Boden ging angeblich der Hanfrausch dem Weinrausch vorher. Jedenfalls ist die Bekanntschaft mit dem Hanf bei den arischen Indogermanen sehr alt (sansc. bhan̄gâ = Hanf). Über die Benutzung der Fasern und der Frucht bei den Skythen berichtet HERODOT (vgl. I, S. 1042). Er erwähnt wilden und kultivierten H. in Syrien, HESYCHIUS Kleider aus H. MOSCHION gedenkt der Faser. Die Griechen kannten ihn zur Zeit des HERODOT nicht, auch THEOPHRAST erwähnt den H. nicht. Bei den Römern wird Hanf zuerst bei LUCILIUS (100 n. Chr.) erwähnt. Nach ATHENAEUS scheinen sich zur Zeit HIERO II. von Syracus Kulturen in Gallien befunden zu haben (HEHN). Erst DIOSKURIDES meint, daß die Frucht die Zeugung vernichte. Er erwähnt, daß die Faser die kräftigsten Stricke liefere. Das Kraut wurde im Altertum nicht benutzt (erst BERLU [I, S. 949] erwähnt es). Auch PLINIUS gedenkt des H. zur Verfertigung von Stricken. Er erwähnt, daß er im Frühling ziemlich dicht gesät und die Frucht zur Zeit des Herbstäquinoktiums geerntet und an der Sonne, dem Wind oder im Rauche getrocknet werde; der rosëische im Sabinergebiete erreiche die Höhe eines Baumes. Von einer medizinischen Anwendung der Früchte erfahren wir wenig. Bei SCRIBONIUS LARGUS fehlen sie; dagegen finden sie sich im Edikte des DIOCLETIAN (I, S. 569). Prähistorische Funde des Hanf fehlen in Mittel- und Westeuropa (HEER, SORDELLI). Das erste hanfene Gewebe stammt aus der Zeit der Völkerwanderung (BUSCHAN). Wahrscheinlich haben die Germanen den H. und seinen Namen sowie die Kultur etwa im IV. oder V. Jahrh. n. Chr. von demselben südosteuropäischen Volke erhalten, von dem direkt oder indirekt auch den Griechen die Sache und der Name übermittelt wurde (KLUGE). Die Germanen lernten also den Hanf erst zu HERODOTS Zeit kennen, die Skythen bauten ihn (HERODOT [IV, 74, 75]: «Der Hanf wächst wild und angebaut im Lande der Skythen») und er stammt wohl aus Bactrien und Sogdiana, den Caspischen und Aralgegenden, wo er noch jetzt in Üppigkeit wächst (KLUGE). Dagegen meint HOOPS, daß sich zum Flachs schon in vorgermanischer Zeit der Hanf gesellt haben müsse, da sein germanischer Name die erste Lautverschiebung mitgemacht hat. Jedenfalls wurde Hanf schon in vorrömischer Zeit in ganz Deutschland und auch in den nordischen Ländern kultiviert (HOOPS). Daß dies in altnordischer Zeit in Nordeuropa der Fall war, geht aus verschiedenen (bei HOOPS mitgeteilten) Dokumenten aus dem XIII. und XIV. Jahrh. hervor. Bischof OTTO von Bamberg fand H. bei den heidnischen Slaven in Pommern. Von den Angelsachsen wurde er auch in ihrer neuen Heimat angebaut. KARL DER GROSSE schrieb im Capitulare den Anbau von canava auf seinen Landgütern vor (SCHRADER, ich finde H. dort nicht). H. fehlt im St. Galler Klosterplan, im Hortulus und bei MACER FLORIDUS, was auf keine beträchtliche Kultur deutet. Daß Hanf im Mittelalter in Spanien gebaut wurde, geht aus IBN ALAWWÂMS landwirtschaftlichem Werke (I, S. 611) hervor. Als ein Bestandteil des berühmten Würzburger Rezeptes aus dem XIII. Jahrh. (I, S. 624) findet sich auch Canape sem. (hanofsamo). In den angelsächsischen Leechdoms (c. 1000) steht: «herba chamepitys baet is henep» und «deos wyrt be man cannane silfatica et obrum naman henep nemneb». Auch das Gothaer Arzneibuch (I, 680) gedenkt des hennep, das Züricher Arzneibuch aus dem XII. Jahrh. des hanifsâmin und die mittelenglischen Medizinbücher (I, S. 693) der hempe. Große medizinische Bedeutung scheinen die Hanffrüchte im Mittelalter und in der neueren Zeit aber nicht besessen zu haben, denn sie fehlen in vielen Taxen und Medikamentenlisten. Immerhin steht H. in der Alphita, bei SERAPION und BARTHOLOMAEUS (I, S. 644) und die Araber bedienten sich seiner, auch der Früchte, die IBN BAITHAR habb elsamanat nennt. Die erste Abbildung der Pflanze findet sich im Codex Constantinopol. des DIOSKURIDES (I, S. 554), eine weitere im Ortus sanitatis (vgl. I, Fig. 382). Schon RUMPHIUS gedenkt des Unterschieds zwischen indischem und europäischem H. Hanfsamen werden schon 1629 in der Plymouth Colony in Nordamerika erwähnt (Encycl.[S. 563] brit.). H. kam also frühzeitig nach Amerika. Im XVIII. Jahrh. wurde H. in Ägypten gebaut (FORSKAL). Hanffasern wurden in alten Papieren nachgewiesen (WIESNER), aber seltener als Leinfasern.
Lit. HEHN (SCHRADER und ENGLER), Kulturpflanzen. — SCHRADER, Reallexikon. — DE CANDOLLE, L’origine des plantes cultivées (dort weitere Lit.); auch PRODROMUS XVI. — BUSCHAN, Vorgeschichtl. Botan. — FISCHER-BENZON, Altdeutsche Gartenflora. — HOOPS, Waldbäume u. Kulturpflanzen. 1905. — WIESNER, Rohstoffe, II. Aufl. — BLÜMNER, Technol. u. Terminol. d. Gewerbe. 1875. — BRETSCHNEIDER, Chin. botanic. works 1870 u. Botanicon sinicon. — FLÜCKIGER, Pharmakogn.
Semen Papaveris und Oleum Papaveris.
Syn. Mohnsamen, Magsamen, Man, Mannkoppensaad, Mahnblom, Maon, Ölmagen, Schlafmohn — Pavot officinal, Ponceau (franz.) — papavero (ital.) — garden poppy, white p. (engl.) — maan kop, klaproos, heul (holl.) — valmun (fin.) — valmuë (norw.) — mak (ung.) — μήκων (griech.) — kashkásh, post (hind.) — ahiphena (sanscr.) — afiun, afiyun (arab., pers., ind.).
In der Schweiz: Kolben, Lichtschnuppen, Mageel, Magsaamen, Pavo, Röttiliöl, in Bünden: Machoca oder Matschöa. In Tirol: Echter Magen, Ölmagen, Magenpflanze (die Mohnköpfe: mog’n gugg’l, die Samen: mag’n, DALLA TORRE). — slav. mak — litauisch aguná — esthn. maggona — lett. maggons. — athd. mago — mthd. elmagen, magesaeme, magöl, swatz und wis magsam, magsat, magsamlyn, mahen, masem, masame, mauden, magnesam, moinsayd, ölmag, olimage, omahenmilch — mnd. maen, mahnmilch, manecop, mangksaat, — im Mittelalter: cadia, codion, opium — bei IBN BAITHAR: ḫašhāš — bei der HILDEGARD: Papaver. — Im Ortus: magsamen — bei MEGENBERG: magenkopf, magenkraut — bei CORDUS: mahn — bei BOCK: mägle, magle, mön, ölsamen. — Bei FUCHS: mon — bei LONICERUS: magen.
Etym. μήκων (dorisch μάκων) kehrt in mehreren slavischen und südkaukasischen Sprachen als mak wieder (die Griechen erhielten die Sache und das Wort aus der Gegend des Kaukasus) und dies ist auch in der Tiroler Bezeichnung Magen (s. oben) erhalten geblieben — mit einer angeblichen Verwendung als Magenmittel hat dies also nichts zu tun. Doch hieß μήκων auch die Blase des Tintenfisches, was auf die Form der Frucht deuten könnte. Einige denken auch an Beziehungen von μήκων zu sansc. mah (= groß), andere (PICTET) an Beziehungen zu lit. mēgmi (= schlafen), was GRASSMANN einleuchtender findet. Der Name Mohn, wohl mit μήκων urstammverwandt, läßt sich weit in die Urgeschichte Europas zurückverfolgen: altschwed. valmôghe neben mhd. mâhen, althd. mâgo — daraus lit. magone und estn. magun, altslav. makñ, altpr. moke. An die Samen erinnert der (Rendsburger) Name Hirsebräu, Magsamen u. and. Papaver ist nicht sicher erklärt. Man hat dies Wort als altes Participium mit — ver gebildet aufgefaßt: «Das Gedunsene» (lat. papula, pampinus) (SCHRADER). Andere meinen, es sei aus apio, capio, ἅπτω (= fassen) umgebildet (das p ist vorgesetzt), also soviel wie Faß, wegen der Tonnenform der Früchte (KANNGIESSER). Es hängt wohl kaum mit kelt. papa (= Brei) zusammen, obwohl Mohnbreie seit alter Zeit sehr beliebt waren (s. unten). Aus papaver entstand im agls. popaeg, dann popig und engl. poppy, sowie franz. pavot und ponceau (dies aber auch von puniceus, φοινίκεος = scharlachrot abgeleitet). Das holländische heul ist mit huile und Öl verwandt, das bei Mohnsamen oft vorkommt (s. oben).
Stammpflanze. Papaver somniferum L. Spec. pl. ed. I, 508 (P. opiiferum FORSK., P. officinale GMEL.) mit den Varietäten bzw. Varietätengruppen:
α setigerum (DC.) (auch als Art: P. setigerum DC.),
β nigrum (DC.) (ursprünglich α nigrum DC., P. somniferum GMEL., P. somnif. var. glabrum BOISS.),
γ album (DC.) (ursprünglich β album DC., P. officinale GMELIN) — weitere im Text. In den Gärten werden auch Sorten mit anders gefärbten und gefüllten Blüten kultiviert.
Wild ist der Gartenmohn bisher nirgends angetroffen worden. Als seine Urform gilt jetzt allgemein Papaver setigerum DC., welche Art sich noch jetzt im ganzen[S. 564] Mittelmeergebiet, besonders in Spanien, Algier, Corsica, Iles d’Hyères, Sizilien, Griechenland (Peloponnes) und Cypern findet (DE CANDOLLE, BOISSIER, Flor. orient. I, 116). In Nordfrankreich wird auch heute noch P. setigerum neben P. somniferum gebaut.
Systemat. Stellung. Papaveraceae — Papaveroideae — Papavereae. Sect. II. Mecones BERNH.
Beschreibung der Stammpflanze. Die einjährige, in allen Teilen milchende Pflanze bildet einen stielrunden, bereiften, 0,5–1,5 m hohen kahlen Stengel. Die grundständigen Blätter sind gestielt, oblong bis eioblong, ungleich-, eingeschnitten- oder buchtig-gezähnt, die oberen sitzend, mit tief-herzförmigem Grunde stengelumfassend, eiförmig, spitz, einfach oder doppelt gesägt, mit blaugrüner, bereifter Unterseite. Die Blätter (auch die Kelchblätter) sind bei var. nigrum und album kahl, bei var. setigerum laufen die Zähne des Blattes in Borsten aus und vereinzelte Borsten finden sich auch auf Blättern, Blütenstielen und dem Kelch; var. nigrum hat weniger tief gelappte Blätter. Blütenstiel abstehend behaart. Die Blüten stehen am Ende der Hauptachse oder von Seitenachsen. Die Knospe ist nickend. Die zwei c. 2 cm langen, meist kahlen und bläulich bereiften, in der Knospenlage dachziegelig deckenden Kelchblätter werden beim Aufblühen abgeworfen. Die in der Knospenlage geknitterte, nach dem Aufblühen leicht abfallende Blumenkrone erreicht einen Durchmesser von 10 cm und mehr. Sie ist bei γ album weiß mit violettem Grunde (bei einigen Spielarten auch rot oder lilafarben), bei β nigrum mehr oder weniger dunkel purpurn mit schwarz violettem Grunde. Die vier c. 4 cm breiten Kronenblätter sind fast kreisförmig, oben gestutzt oder ausgerandet mit äußerst kurzem Nagel. Die zahlreichen freien Staubfäden sind nach oben keulenförmig angeschwollen und besitzen dithekische Antheren mit ellipsoidischen Pollenkörnern. Der sehr kurz gestielte kugelige Fruchtknoten ist einfächerig und zeigt zahlreiche (7–20), in der Zahl mit den Narbenschenkeln übereinstimmende, 5–8 mm tief einspringende Samenleisten, an denen sehr zahlreiche anatrope Samenknospen sitzen. Die sitzende strahlenförmige Narbe zeigt zahlreiche (bei setigerum 7–8, bei nigrum 10–12) nach unten geschlagene Narbenlappen, in deren Längslinien die spaltenförmigen, den Samenleisten entsprechenden und über diesen liegenden Narbeneingänge sich finden. Die je nach der Varietät kugelige, eiförmige, eiförmig-längliche oder ellipsoidische kahle Frucht ist je nach den Varietäten und Spielarten sehr verschieden groß (von Haselnußgröße bis 7,5 cm und mehr), kurz gestielt (bei der var. apodocarpon HUSSENOT ungestielt), von der nun horizontal abstehenden viellappigen Narbe bekrönt, unter der sich die großen, mit Klappen sich öffnenden Poren finden, mit denen sie meist aufspringt (bisweilen bleibt sie aber auch geschlossen, z. B. bei var. album und apodocarpon). Bei var. album, stipitatum HUSS. und hortense HUSS. ist die Narbenscheibe am Rande gekerbt, bei var. apodocarpon HUSS. gegen den Rand hin abwärts gebogen, bei var. album mit freien, abstehenden, dicken, bei var. hortense mit dünnen, papierartig-häutigen Lappen. Sie ist durch die großen, in die Höhlung einspringenden, pergamentartigen, an den Ansatzstellen der Samen gefleckten Samenleisten unvollständig gefächert und zeigt außen die Verwachsungsnähte der Carpelle als seichte Längsfurchen. Der auf dem Fruchtknoten sichtbare Reif verschwindet später und die Frucht erscheint dann glatt und glänzend. Die sehr zahlreichen (bis 2000 — schon HOMER spricht in der Ilias von der καρπῶ βριθομένη, der mit Samen gefüllten Frucht —), kleinen nierenförmigen, grubig punktierten Samen, die bald weiß (var. album), bald[S. 565] bläulich-schwarz (var. nigrum) sind und einen gekrümmten, in Endosperm eingebetteten Keimling besitzen.
Blütezeit: Juni bis August.
Lit. PRANTL-KÜNDIG in ENGLER-PRANTL, Pflanzenfamilien. — DE CANDOLLE, Urspr. d. Kulturpfl. 1884. — RITTER, Erdkunde von Asien. — LUERSSEN, Mediz. pharm. Bot. — WILLKOMM ET LANGE, Prodr. flor. hisp. — BOISSIER, Flor. orient. I, 116. — LEDEBOUR, Flor. rossica. — Abbild.: BERG-SCHMIDT, Atlas II. Aufl., t. 116, PABST-KÖHLER, Medizinalpflanz. t. 37, NEES V. ESENBECK, Pl. med. t. 404 (album), HAYNE, Arzneigew. VI, t. 40, BENTLEY-TRIMEN, Med. plants t. 18, WOODVILLE t. 138.
Pathologie. Über die pflanzlichen Schädlinge berichtet Prof. ED. FISCHER: Einer der wichtigsten Parasiten der Papaver-Arten ist Peronospora arborescens DE BY., ein «falscher Mehltau», welcher auf den Blättern Verfärbungen hervorruft und namentlich an Keimpflanzen Schaden stiften kann. — Auf den Kapseln von Papaver somniferum werden angegeben: Alternaria Brassicae BERK. var. somniferi, Phoma morphaea SACC., Sphaerella morphaea SACC. Ein ausführliches Verzeichnis der Krankheiten der indischen Mohnpflanze in WATT, Dict. econom. prod.
Kultur. Der Mohn gedeiht überall, wo das Wintergetreide fortkommt. Er liebt aber warme und windstille Lage. Er wird ausschließlich als Sommerfrucht kultiviert und zeigt eine kurze Wachstumsdauer (120–140 Tage). Mohn wird jetzt auf der ganzen Erde — Zentraleuropa, Indien, Persien, China, Kleinasien, Afrika, Nordamerika, Australien (Neusüdwales) — gebaut (in Norwegen bis zum Polarkreise), besonders in Algier, Tunis und Ägypten wird viel Mohn kultiviert. Die Kultur erfolgt teils zur Samen- bzw. Ölgewinnung (in Europa, Afrika und Amerika) — zur Ölgewinnung besonders die Varietäten mit schwarzen Samen —, teils zur Opiumbereitung (Asien) — besonders die Varietäten mit weißen Samen. Die Praxis unterscheidet P. s. officinale, Schließmohn oder Dreschmohn (Pavot blanc et aveugle) mit geschlossen bleibenden und P. s. vulgare, Schütt- oder Schüttelmohn (Pavot oeillette, gris et noir) mit sich öffnenden Kapseln (s. oben), und die Samen nach der Farbe: weiße, rote, blaue, graue, braune, violette, schwarze (in Macedonien wurden 1883 nach der Farbe vier Sorten unterschieden). Offizinell sind nur die weißen Samen. Blauer Mohn soll ertragreicher sein, der weiße aber ein feineres Öl liefern (HART). Im Handel ist deutsches, levantinisches und ostindisches Öl von Pendschab, Bengalen und den Nordwestprovinzen.
In Indien gilt das Öl der Bengalpflanze für besser als das der Malvapflanze. Hamburg importierte 1908 61239 dz Mohnsamen, davon kamen aus Brit. Ostindien: 54564, von den russischen Häfen am Schwarz. u. Asowschen Meere 2885, aus Kleinasien 1524, von altpreußischen Ostseehäfen 1136; weniger als 1000 dz aus russischen Ostseehäfen, den Niederlanden, Persien, Ostafrika. British-Indien exportierte Poppy seeds nach England und engl. Besitzungen 1907/08: 965, 1908/09: 882 cwts, nach anderen Ländern 1907/08: 1256562, 1908/09: 790028 cwts. Die Vereinigten Staaten importierten 1909: 52086 bushels poppy seed und 6598 gallons poppy seed oil. Frankreich importierte 1908: 213349 Qint. Mohnsamen besonders aus Engl. Indien. Frankreich importiert jährlich für mehr als 6 Mill. Frs. Mohnsamen zur Ölgewinnung (COLLIN). Auch Mohnpreßkuchen bilden einen bedeutenden Handelsartikel.
Morphologie der Droge. Die Samen von P. s. β nigrum messen 0,88–1 mm, die von P. s. γ album 1,17–1,29–1,41 mm, die von P. s. α setigerum 0,66–0,97 mm (die des Pfahlbaumohn 0,75–1 mm, HARTWICH). Das Gewicht von 1000 Samen schwankt zwischen 0,239 g (indischer Mohn) und 0,531 g (österreichischer Mohn). Auf 1 kg kommen 1880000–4184100 Samen (HARZ). Die allein offizinellen weißen Samen sind 1–1,5 mm lang und 0,3–0,5 mg schwer, nierenförmig — das eine Ende etwas spitzer als das andere — und außen mit, besonders bei Betrachtung mit der[S. 566] Lupe, hervortretenden großen, polygonalen (meist sechseckigen) Netzleisten versehen, die bei den dunklen Sorten besonders deutlich sind. Diese Maschen des Samens bildete schon HOOKE (1667) ab. In der Einbuchtung des Samens sieht man als gelbliche Erhöhung den Rest des Funiculus und das Hilum, das mit der als gelber Fleck sichtbaren Chalaza durch eine kurze, das Bündel führende Raphe verbunden ist (A. MEYER). Durchschneidet man den Samen median-längs, so sieht man, eingebettet in Endosperm, den gekrümmten, im Querschnitt walzenrunden Keimling, zwischen dessen Cotyledonen eine kleine kegelige Plumula sichtbar ist. Die Radicula zeigt nach dem spitzen Ende des Samens. Sie ist etwa so dick als die beiden Cotyledonen. Mohnsamen ist geruchlos und schmeckt angenehm, milde-ölig. Man bewahrt ihn nicht über ein Jahr.
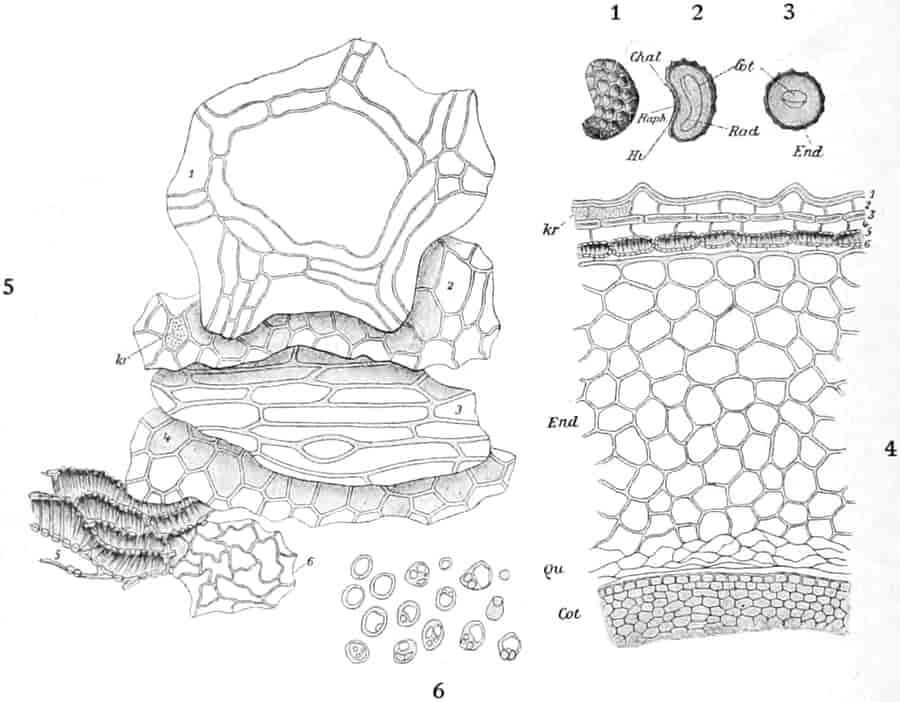
Papaver somniferum L.
1 Same von außen. 2 Same längsdurchschnitten. 3 Same querdurchschnitten. 4 Querschnitt durch die Samenschale (1–6), das Endosperm (End) und den äußeren Teil des Cotyledons (Cot). 5 Succedane Flächenschnitte durch die Samenschale (die Zahlen 1–6 korrespondieren mit den gleichen Zahlen in Fig. 4). 6 Aleuronkörner.
[Tschirch-Oesterle Atlas.]
Anatomie. Die Samen gehen aus anatropen Ovulis hervor, die zwei Integumente mit sechs Zellschichten erkennen lassen. Aus diesen wird die sehr schmale Samenschale, deren Struktur erst nach Behandeln mit Salzsäure und Kalilauge sichtbar wird (MOELLER empfiehlt auch Färben mit Chlorzinkjod oder Safranin). Die äußerste Schicht, die die meisten Autoren für eine sehr schmale zusammengefallene Zellreihe halten, was sie auch wohl ist (und nicht eine verdickte Wand), erscheint in regelmäßigen Abständen kielartig emporgezogen. Diese Verwölbungen, in welche sich auch die darunter liegenden Schichten etwas vorstülpen, bilden die Leisten, welche in ihrer Vereinigung zu polyedrischen Maschen das für den Mohnsamen so charakteristische Maschennetz der Oberfläche erzeugen. An den Leisten sind die Epidermiszellen schmal, zwischen den Leisten in den Tälern der Maschen so groß wie ein[S. 567] Maschental (Fig. 181). Die Cuticula dieser Zellen enthält Calciumcarbonat ein- und aufgelagert. Die zweite Zellreihe besteht aus dünnwandigem, tafelförmigem Parenchym, das dicht erfüllt ist mit feinkörnigem Calciumoxalat, dem auch größere Kristalle beigemengt sind (MEYER), dann folgt die Hartschicht, die der schalenförmigen Einwölbung der Epidermis folgt und die aus gestreckten, flachen, stark verdickten Zellen besteht, deren Wände mit Chlorzinkjod violett werden. Die darauf folgenden drei Schichten (Fig. 181, 4. 4–6), die aus dem inneren Integumente hervorgehen, sind meist stark obliteriert. Nach Behandlung mit Kali unterscheidet man eine äußere Parenchymzellreihe, dann eine Reihe getüpfelter, gekrümmter, nicht sehr langer Zellen und zu innerst liegt eine Reihe dünnwandiger Zellen. In der inneren Krümmung des Samens ist die Samenschale dort, wo die Raphe verläuft, durch Vermehrung des Parenchyms dicker. Die Mikropyle ist noch sichtbar. Bei den blauen Mohnvarietäten findet sich in den inneren Schichten der Samenschale (Fig. 181, 4. 4 u. 5) ein brauner gelbstofffreier Farbstoff und die Membranen der Schicht 3 sind gelbbraun gefärbt. Die bläuliche Farbe kommt dadurch zu stande, daß über diesen braunen Schichten die Oxalatschicht liegt, deren mit Luft durchmischte Körnchen den Samen zudem bereift erscheinen lassen. Legt man den Samen in Salzsäure, so wird er braun (A. MEYER). Das breite, parenchymatische Endosperm führt zahlreiche in maschiges, den Zellkern einschließendes Ölplasma eingebettete, 1–7 (meist 4–5,5) mik große, Globoide und Kristalloide führende Aleuronkörner (Fig. 181, 6). Zu innerst liegt typisches Quellgewebe (Fig. 181, 4 Qu). Das Gewebe des Keimlings zeigt noch kaum eine Differenzierung, die Procambiumstränge sind undeutlich; die Zellen enthalten die gleichen Inhaltsstoffe wie das Endosperm, doch sind die Aleuronkörner kleiner. Stärke fehlt dem Samen.
Die Preßkuchen (und das Pulver) sind leicht an den Elementen der Samenschale zu erkennen, besonders an den großen Netzleisten, an der Faser- und Tüpfelzellenschicht.
Lit. (Fast jeder Autor beschreibt die Samenschale anders wie sein Vorgänger.) A. MEYER, Wissensch. Drogenkunde (mit Abbild.). — TSCHIRCH-OESTERLE, Anatom. Atlas (dort das anatom. Detail). — TSCHIRCH, Kleine Beitr. z. Pharmakobot. usw. 1897, Nr. 17. — VOGL, Nahrungs- u. Genußm. — MICHALOWSKI, Beitr. z. Anat. u. Entwicklungsgesch. von Papav. somnif. Diss. Breslau 1881. — HARZ, Landwirtsch. Samenk. — T. F. HANAUSEK in WIESNER Rohstoffe. — MOELLER-WINTON, Nahrungs- u. Genußm. und WINTON-MOELLER, Microscopy (mit Abbild.). — KARSTEN-OLTMANNS, Lehrb. d. Pharm. — BENECKE, Kraftfuttermittel. 1886. — BERG, Anatom. Atlas u. Pharmakogn. — BÖHMER, Ölkuchen in Dammers Lexikon. — GODFRIN, Etude histol. s. l. tégum. sémin. des Angiosp. Soc. d. sc. de Nancy 1880. — MEUNIER, Les tégum. sém. des Papaveracées in La Cellule 1891. — Die Preßkuchen in COLLIN-PERROT, Les résidus industr. (mit Abbild.).
Chemie. Die Samen enthalten nach älteren Analysen (SACC) 54,61% fettes Öl, 23,26% Schleim und pektinartige Substanz, 12,64% Eiweiß (Stickstoff 2–3%) und 5,93% Zellulose, 3–3,5% Wasser, 6–7,7% Asche. Im Durchschnitt enthält Mohnsamen in Prozenten: 8,15 Wasser, 19,53 Stickstoffsubstanz, 40,79 Fett, 18,72 stickstofffreie Extraktstoffe, 5,58 Rohfaser, 7,23 Asche (in der Trockensubstanz 21,26 Stickstoffsubstanz, 44,41 Fett) (BOUSSINGAULT, HOFFMANN, DIETRICH und KÖNIG, SCHÄDLER, HESSE, GREITHERR — bei KÖNIG). Nach neueren Angaben (MACH 1902 u. and.) in Prozenten: 47,4–51,4 Rohfett, 20–22,68 Rohproteïn (18,4–21,6 Eiweiß), 5,1–5,6 Rohfaser, 3–3,9 Pentosane, 1–1,8 Amide u. a., 9,5–10,5 stickstofffreie Extraktstoffe, 3,87–4,5 Wasser, 5,6–6,36 Asche. Ferner enthält der Same 0,25–0,94% Lecithin (SCHULZE und FRANKFURT), Diastase (in reifendem Samen, BRASSE), Emulsin (SIMON 1838) und Lipase (SIGMUND). Die Asche (6,04%,[S. 568] WOLFF) enthält 31,36 P2O5, 35,36 CaO, 13,62 K2O. In der Samenschale sind 8,7% Calciumoxalat enthalten (WEISS).
Die Angaben, daß Mohnsamen Morphin enthalte (nach MEURIN 0,003%, nach ACCARIE 0,06%), haben sich nicht bestätigt (SACC, MACH, CLAUTRIAU). HESSE gab (1865) Rhoeadin darin an.
Die Samen liefern bei der Pressung 40–50% fast geruchloses, angenehm schmeckendes, fettes Öl, Mohnöl, Oleum papaveris (huile d’oeillette, h. de pavot, h. blanche, poppy seed oil, olio di papavero, papaverzaadolie μεκωνέλαιον). Das kaltgepreßte Öl ist farblos oder goldgelb (weißes Mohnöl), das warmgepreßte dunkler (rotes Mohnöl). Es trocknet so gut wie Leinöl, ist aber wohlschmeckend. Die Elementarzusammensetzung ist: 76,5 bis 76,63 C, 11,2–11,63 H, 11,74–12,3 O (SACC). Nach 24stündigem Einlegen in halbkonzentriertes Kaliammoniak (HARTWICH-UHLMANNsche Mischung) treten im Tropfen kurze und lange, lockig gebogene Nadeln und reichlich Sphärite auf.
Es enthält von festen Fettsäuren 6,67% (TOLMAN und MUNSON), wahrscheinlich nur Palmitinsäure (LEWKOWITSCH) — nach älteren Angaben auch Stearinsäure. Die flüssigen Fettsäuren bestehen aus 5% Linolensäure, 65% Linolsäure und 30% Ölsäure (HAZURA und GRÜSSNER), Isolinolensäure ist fraglich; da die Fettsäuren aber nur sehr wenig oder kein Hexabromid geben, kann die Menge der Linolensäure nur sehr gering sein (LEWKOWITSCH). Das Unverseifbare (Phytosterin, F. 136–137°)beträgt c. 0,5%. Der Lecithingehalt des Rohfettes wird zu 13,27% (?) angegeben (STELLWAAG).
Das spez. Gewicht liegt zwischen 0,924 und 0,927 (ALLEN), der Erstarrungspunkt bei −17 bis −19° (GIRARD), der Schmelzpunkt bei −22°, die Verseifungszahl ist (189) 190,1–197,7 (DIETERICH, VALENTA, LEWKOWITSCH), die Jodzahl 132–136 (LEWKOWITSCH), 137,6–143,3 (DIETERICH), bei mit Petroläther aus dem Samen extrahierten Öl 153,48–157,52 (UTZ), die REICHARD-MEISSL-Zahl 0, die Hehnerzahl 95,38 (DIETZELL), 94,97 (bei ostindischen Ölen, CROSSLEY und LE SUEUR), die Maumenéprobe zeigt (74) 86–88,5°, der Brechungsexponent im Oleorefraktometer +23,5 bis +29° (JEAN), im Butterrefraktometer bei 15°: 78,1–78,4° (UTZ), bei 25°: 72–74,5. Die Verbrennungswärme des Mohnöls beträgt 9442 kal. (STOHMANN), 9397 g-kal. (SHERMAN). Der Entflammungspunkt liegt bei 250° (RAKUSIN).
Die freien Fettsäuren zeigen bei 100° ein spez. Gewicht = 0,888, ihr Erstarrungspunkt liegt bei 16,5°, ihr Schmelzpunkt bei 20–21° (DE NEGRI und FABRIS), die Neutralisationszahl ist 199, die Jodzahl 116,3–139 (die der festen Fettsäuren 149,6), die Acetylzahl 13,1, der Brechungsexponent 1,4506 (THÖRNER). Die technischen Mohnöle sind reich an freien Fettsäuren (bis 17,73%).
Die Zusammensetzung der Preßkuchen ergibt sich aus folgender Tabelle:
|
Weißer indischer Mohn
|
Schwarzer Mohn
|
||||
|
Artois
|
Levant
|
||||
|
DÉCUGIS
|
GAROLA
|
BOUSSINGAULT
|
DÉCUGIS
|
||
|
Wasser
|
11,15
|
10,90
|
11,70
|
9,70
|
|
|
Fette
|
5,13
|
7,24
|
10,10
|
9,18
|
|
|
Stickstoffhalt. Substanz
|
34,50
|
38,12
|
37,80
|
35,38
|
|
|
Stickstofffreie Substanz
|
 |
33,90
|
19,462
|
23,30
|
24,61
|
|
Cellulose
|
|||||
|
Asche
|
16,13
|
13,20
|
6,00
|
12,93
|
|
Die Preßkuchen des Mohn enthalten im Mittel 5,50–6% Stickstoff, 2,75–3,50% Phosphorsäure.
[S. 569]
Lit. SACC, Ann. chim. phys. (3) 27 (1849) 473 (Jahresber. d. Pharm. 1849, 64). Journ. pr. Chem. 1850, 307. — ACCARIE, Journ. chim. méd. 1833, 431 (Jahresb. d. Chem. 4 [1835] 250). — MEURIN, Journ. d. pharm. 23 (1853), 339. — CLAUTRIAU, Ebenda 20 (1889), 161 und Bull. Soc. Belg. Mikr. 1894, 35. — WOLFF, Aschenanalysen I, 105 (Asche auch: WILDENSTEIN, Journ. pr. Chem. 54 [1851], 100). — MACH (Monograph.), Landw. Versuchsstat. 57 (1902), 419. — SCHULZE u. FRANKFURT, Landw. Versuchsstat. 1894, 307. — BRASSE, Compt. rend. 1884, 878. — SIMON, Poggend. Ann. 43 (1838), 404. — SIGMUND, Monatsh. f. Chem. 11 (1890), 272. — HANSEN, Fermente, Arbeit. Bot. Inst. Würzburg III, 252. — WEISS in MEYER, Drogenkunde. — Analysen bei KÖNIG, Nahrungs- u. Genußm., HARZ a. a. O. u. COLLIN-PERROT a. a. O.
Öl: OUDEMANS, Scheik. Verhand. 1858, II 180 (Jahresb. d. Chem. 1858, 304); Journ. d. pharm. 44 (1863), 362 (Jahresb. d. Pharm. 1863, 159). — MULDER, Journ. pr. Chem. 1865, 323 u. Chem. d. austrocknend. Öle 1867. — HAZURA u. FRIEDRICH, Monatsh. f. Chem. 1887, 247 (Jahresb. d. Pharm. 1887, 296). — HAZURA u. GRÜSSNER, Monatsh. f. Chem. 1888, 198. — HEFTER, Fette u. Öle II (1908) 100. — SCHAEDLER, Technol. d. Fette. — LEWKOWITSCH a. a. O. — TOLMAN u. MUNSON, Journ. amer. chem. soc. 1903, 690. — UTZ, Chem. Zeit. 1903, 1177 u. 1904, 257. — STELLWAAG, Landw. Versuchsstat. 37, 135.
Verfälschungen. Speisemohnöl wird mit Sesamöl (BAUDOUINsche Reaktion!) und Haselnußöl verschnitten, Malermohnöl oft durch Wallnußöl ersetzt, das aber 1,4 bis 1,9% Hexabromid (Mohnöl nichts davon) liefert und dadurch erkannt werden kann.
Anwendung. Mohnöl dient zu Speisezwecken, auch zur Verfälschung des Olivenöls und zur Herstellung weißer Malerfarben, mit Mastix und Japanwachs als «Wachsöl». Zur Schmierseifenfabrikation werden nur die schlechtesten Sorten verwendet. In der Pharmazie wird Mohnöl jetzt vielfach durch das bessere Sesamöl oder Erdnußöl ersetzt (D. A. V). In der Medizin dient Mohnsamen zu Emulsionen.
Die wohlschmeckenden Preßkuchen sind — schon allein wegen ihres Phosphorsäuregehaltes — ein vorzügliches Futtermittel. Sie zeigen keinerlei giftige Eigenschaften.
In der Niederlausitz (z. B. in Guben) wird ein aus Milch, Semmel und Mohnsamen bereitetes Gericht unter dem Namen «Mopielen» am Weihnachtsabend gegessen (TSCHIRCH). Die Sitte stammt wohl aus Schlesien, wo der Mohn mo genannt wird. Auch in Tirol findet sich als Festspeise ein Gericht aus Milch, Semmel, Honig und Mohnsamen (DALLA TORRE). Die noch heute übliche Sitte, Backwerk mit Mohnsamen (oder Lein- bzw. Sesamsamen) zu bestreuen, ist uralt (HEHN).
Geschichte. Die Heimat der Mohnkultur ist das nördliche Kleinasien. Die Griechen erhielten den Mohn von der Südküste des schwarzen Meeres. Dort lag die Stadt Sinope, die in der hesiodischen Theogonie noch ihren ursprünglichen Namen Mekone (= Mohnstadt) führte (HEHN), der auf reichliche Mohnkultur deutet. HOMER, THEOPHRAST, DIOSKURIDES gedenken des Mohn. DIOSKURIDES kennt auch schon die Varietät mit weißen Samen. Die Römer kannten, wie Funde in neolithischen Pfahlbauten zeigen, den wilden Mohn schon in vorgeschichtlicher Zeit, den Gartenmohn zur Zeit der Könige. Nach den Pfahlbaufunden bauten in der neolithischen Periode und der Bronzezeit die Bewohner Mitteleuropas eine zwischen Papaver somniferum und P. setigerum stehende Art (HEER), aus deren Samen sie Mohnkuchen buken und wohl auch bereits das Öl preßten und die man als Pfahlbaumohn bezeichnet hat. Sie steht P. setigerum noch ziemlich nahe (HARTWICH) und ist als eine Zwischenstufe zwischen beiden zu betrachten. «Der Mohn darf der ältest erreichbaren Schicht europäischer Kulturpflanzen zugeschrieben werden» (SCHRADER). Dem ägyptisch-semitischen Kulturkreise ist er ursprünglich fremd. Auf altägyptischen Monumenten fehlt der Mohn und Samen sind in Gräbern nicht gefunden worden. Erst PLINIUS (XX, 18) berichtet, daß sich die Ägypter des Mohnsaftes bedienten. Die Pflanze wird also wohl damals auch dort gebaut worden sein. Auch die Nachrichten aus Palästina über die Samen und ihr Öl (I, S. 489) stammen erst aus der römischen Zeit. PLINIUS, DIOSKURIDES, CELSUS (I, S. 587) und GALEN erwähnen bereits verschieden gefärbte Samen. GALEN hält sie für schwer verdaulich. Als Arzneimittel finden sie sich bereits bei SCRIBONIUS LARGUS (I, S. 578, Papaver silvat. und nigrum) und ALEXANDER TRALLIANUS (I, S. 592), als[S. 570] Handelsartikel im Edikt des DIOCLETIAN (I, S. 569). Der Anbau des Mohn ist in Deutschland alt, denn die ahd. Bezeichnung mâhan ging ins Vulgärlatein über (so mahunns, mahonns, manns in zahlreichen Glossen). Mohnkultur in Italien wird aber erst bei VIRGIL erwähnt. Den Gartenmohn brachten die Benediktiner nach Deutschland. Er steht im Capitulare KARLS, im St. Galler Klosterplan und bei MACER. Nach dem Kalender des HARIB (I, S. 612) soll Mohnsamen im August gesammelt werden. In der Alphita (I, S. 655) steht Papauer album (whatpopy), P. nigrum (blakpopy) und P. rubeum (redpopy), bei CORDUS: Papaver album, rubrum und nigrum, in der Frankfurter Liste (I, S. 812) Papaueris albi et nigri. Der Anbau des Mohn (zur Opiumgewinnung) reicht in Indien nicht weiter als bis ins XVI. Jahrh. zurück, doch finden sich Mohnsamen (khastila) schon im Glossar des SUVARNĀDIVARGA (I, S. 505). Die Mohnkapsel galt wegen der zahlreichen Samen schon den Hellenen als Symbol der Fruchtbarkeit. Man findet sie oft mit Ähren zusammen in der Hand der DEMETER, der Göttin des ehelichen Segens, aber auch sonst auf Münzen und anderen Bildwerken des Altertums (zahlreiche Abbildungen in LOCHNERS Mekonopaignion, Nürnberg 1718). Die Pflanze war der APHRODITE geweiht. Der Same wurde gegen den weißen Fluß benutzt (AIGREMONT). Mohnköpfe gab man auch HYPNOS, THANATOS und NYX in die Hand (GUBERNATIS). In Böhmen findet sich der Aberglaube, daß die Braut, der man Mohnkörner in den Schuh schüttet, unfruchtbar bleibt.
Lit. HEER, D. Pfl. d. Pfahlbauten. Neujahrsbl. d. Zürch. Naturf. Ges. 1866. — HARTWICH, Pap. somnif. u. dess. in d. Pfahlbaut. vorkomm. Reste. Apoth. Zeit. 1899. — NEUWEILER, D. prähist. Pflanzenreste Mitteleuropas. Zürich 1905. — FLÜCKIGER, Pharmakogn. — DE CANDOLLE, L’origine d. pl. cultiv. — GUBERNATIS, Mythologie des plantes.
Zu den trocknenden Ölen gehören ferner folgende Samenöle:
- Perillaöl von Perilla ocymoides.
- Tungöl (Holzöl), Ölfirnißbaumöl von Aleurites cordata.
- Kekunaöl von Aleurites triloba.
- Stillingiaöl, Talgsamenöl von Stillingia sebifera.
- Weiß-Acacienöl von Robinia Pseudacacia.
- Cedernnußöl von Pinus Cembra.
- Walnußöl von Juglans regia.
- Safloröl von Carthamus tinctorius.
- Echinopsöl von Echinops Ritro.
- Amooraöl von Amoora Rohituka.
- Spargelsamenöl von Asparagus offic.
- Nigeröl von Guizotia oleifera.
- Sonnenblumenöl von Helianthus annuus.
- Gelbacacienöl von Caragana arborescens.
- Argemoneöl von Argemone mexicana.
- Kiefern-, Fichten-, und Tannensamenöl.
- Madiaöl von Madia sativa.
- Erdbeeröl von Fragaria vesca.
- Rotrepsöl, Nachtviolenöl von Hesperis matronalis.
- Bilsenkrautsamenöl von Hyoscyamus niger.
- Celosiaöl von Celosia cristata.
- Indisches Lorbeeröl von Laurus indica.
- Resedasamenöl von Reseda luteola.
2. Halbtrocknende Öle.
Die halbtrocknenden Öle bilden den Übergang von den trocknenden zu den nichttrocknenden Ölen. Ihre Jodzahlen liegen zwischen denen beider Gruppen. Linolensäure fehlt in ihnen, sie enthalten aber Linolsäure. Die Gruppe der Baumwollsamenöle zeigt trocknende Eigenschaften mehr als die Rübölgruppe.
Semen Gossypii und Oleum Gossypii.
Die Stammpflanze der Baumwollsamen ist oben S. 230, die Morphologie und Anatomie S. 238 beschrieben. Dort auch die Geschichte.
Bis 1852 wurde der Baumwollsamen meist weggeworfen (vgl. S. 245). Seit dieser Zeit wird das Öl gepreßt und der Preßkuchen als Futter- und Düngungsmittel benutzt.
Besonders ist amerikanische und ägyptische Baumwollsaat im Handel, dann auch ostindische (Bombay), levantinische (Smyrna, Mersine, Alexandrette).
[S. 571]
British Indien exportierte cotonseeds 1907/08: 3683634, 1908/09: 2777844 cwts nach England und engl. Besitzungen und 1907/08: 566238, 1908/09: 905528 cwts nach anderen Ländern. Die Vereinigten Staaten exportierten 1909: 51626741 pounds cotton seed, 51087329 gallons Cotton oil und 1233750327 pounds cotton seed oil cake. In Nordamerika besteht eine Cotton-Oil-Compagny. 1894 gab es dort schon 252 Cotton-Oil-Fabriken. Ägypten exportierte schon 1897: 7½ Mill. hl Baumwollsamen. Frankreich führte 1908 355633 Quint. Baumwollsamen ein, vorwiegend aus Ägypten (298520 Qint), sehr viel weniger aus Engl. Indien, der Türkei, Haïti, den Ver. Staaten, Portorico, Columbien und Algier. Frankreich importierte 1908: 516580 Quintalm. Baumwollsamenöl, das meiste aus den Vereinigten Staaten. In großem Stil wird in Frankreich Olivenöl mit Cottonoil vermischt und als «Olivenöl» exportiert.
Baumwollsamen enthalten 44,4–60% Kern und 40–54,8% (nach anderen 66–71%) Hülsen. In den Samen ist 18,67 (Levante, Mersine) bis 23,93% (ägyptische), im Durchschnitt c. 20% Öl enthalten, in den Kernen 37,41 (ägyptische) bis 39,28% (Bombay) Öl (LEWKOWITSCH); die beim Schälen abfallenden «Hülsen» enthalten davon kaum 1–3%. Das Öl wird sowohl aus geschälten wie ungeschälten Samen gepreßt.
In Ergänzung der Angaben auf S. 245 sei über die Zusammensetzung der Samen noch folgendes angegeben. Sie enthalten ungeschält im Mittel in Prozenten: 11,1 Wasser, 19,69 Stickstoffsubstanz, 20,86 Fett, 23,43 stickstofffreie Extraktstoffe, 21,1 Rohfaser, 3,8 Asche (WAGNER-CLEMENT 1908). Der geschälte Samen enthält im Mittel in Prozenten: 7,28 Wasser, 29,55 stickstoffhaltige Substanz, 27,23 Fett, 24,07 stickstofffreie Extraktivstoffe, 4,62 Rohfaser, 7,25 Asche, doch schwanken die Zahlen je nach Herkunft der Samen. Vom Fett sind z. B. auch nur 17% beobachtet, von stickstofffreien Extraktstoffen 24,5–32,5 (noch größere Schwankungen bei BRYDE). Die Samenkerne enthalten 5,49% Pentosane (SKINNER). Ferner sind nachgewiesen: 42,3% des Globulins Edestin (OSBORNE und VOORHEES) und 44,3 bzw. 11,4% zweier weiterer Globuline, Proteose (OSBORNE), Nucleïn, Betain, Cholin, Lecithin, Melitriose (Raffinose, Melitose, Gossypose), Stärke (? SACC), Zucker, Wachs, Dextrin. In der 3–6% betragenden Asche ist viel MgO (16–20%), P2O5 (26–31%) und K2O (27–37%), auch etwas Titan (0,02%, WAIT) gefunden worden.
Die ägyptischen und Bombay-Samen gelten als die ölreichsten. Sie werden vorwiegend in Deutschland, England, Frankreich und Italien verarbeitet. Der Samen wird vor dem Pressen meist geschält.
Das Baumwollsaatöl, Oleum Gossypii (huile de coton, cotton oil, olio di cotone, katoenolie, βαμβακέλαιον) enthält je nach dem bei der Fabrikation angewendeten Drucke mehr oder weniger flüssige Glyceride. Die Elementarzusammensetzung ist C=76,30 bis 76,50, H=11,33–11,73, O=12,17–12,39 (KÖNIG). Von festen Fettsäuren, die 22,3–32,6% des Öls betragen (TWITSCHELL, FARNSTEINER, TOLMAN, MUNSON), sind besonders Palmitinsäure, weniger (c. 3,3%) Stearinsäure nachgewiesen, von flüssiger Linolsäure (18,45–21% der Fettsäuren, LEWKOWITSCH) und Ölsäure (c. 76,55% der flüssigen Fettsäuren). Da kein Hexabromid entsteht, muß Linolensäure fehlen. Dagegen scheinen 3,6% Oxyfettsäuren (FAHRION), aber keine Arachinsäure vorhanden zu sein. Die Cottonölsäure (PAPASOGLI) ist zweifelhaft, ebenso der mit Wasserdampf flüchtige, schwefelhaltige Körper DUPONTS.
Das spez. Gewicht ist 0,922–0,928. Gehalt an freien Fettsäuren (auf Ölsäure berechnet) 0,15–0,5%, Unverseifbares (bes. Phytosterin, F. 136–137°) 0,73–1,64%, Erstarrungspunkt 0 bis −1°, Refraktometerzahl (im ZEISS-Butterrefraktometer bei[S. 572] 25°): 67,6–69,4, Verseifungszahl 191–198, Jodzahl 102–111, Temperaturerhöhung bei der Maumenéprobe 67–84°. Die Fettsäuren zeigen einen Erstarrungspunkt von 34,9–35,1 und einen Schmelzpunkt von 27–30° (beides relativ hoch!) und eine Acetylzahl von 16,6. Bei der Elaidinprobe wird das Öl dickflüssig oder butterartig. Der leicht erstarrende Teil (das Öl soll 70% Palmitin enthalten) wird als Baumwollstearin oder Cottonmargarin bezeichnet, der flüssigbleibende wird in erster Linie als Speiseöl benutzt. Die Verbrennungswärme des Baumwollsamenöls beträgt bei konstantem Volumen 9390–9401, bei konstantem Druck 9405–9416 g-cal. (SHERMAN und SNELL). Im Öl werden auch ein Aldehyd (?), eine schwefelhaltige Substanz (? s. oben) angegeben.
Das Öl wird in ungeheueren Quantitäten als Speiseöl und in der Margarinefabrikation, die geringeren Sorten auch in der Seifenfabrikation, verbraucht und dient auch zur Verfälschung des Olivenöls, des Schweineschmalzes und anderer Speiseöle und Fette.
Der Nachweis von Baumwollsamenöl in diesen Fetten und Ölen ist daher «eine der wichtigsten Aufgaben der Fettanalyse» (LEWKOWITSCH). Die wichtigste Reaktion ist die HALPHENsche (Erhitzen des in Amylalkohol gelösten Öls mit Schwefel und Schwefelkohlenstoff im Wasserbad — es tritt Rotfärbung ein). Die Reaktion bleibt aus, wenn das Öl zuvor auf 150–250° erhitzt wurde und tritt auch ein an Fett von Tieren, die mit Baumwollpreßkuchen gefüttert wurden. — Dann die auch an erhitztem Öl eintretende Probe mit Salpetersäure (spez. Gewicht 1,375), wobei nach längerem Stehen Braunfärbung eintritt. Die BECHIsche Silbernitratprobe ist unzuverlässig.
Die Zusammensetzung des Baumwollsamenpreßkuchen ergibt sich aus folgender Tabelle:
|
geschält
|
roh
|
|||||
|
GAROLA
|
VÖLCKER
|
GAROLA
|
DÉCUGIS
|
|||
|
Wasser
|
7,78
|
9,28
|
12,44
|
9,30
|
||
|
Fette
|
12,87
|
11,05
|
5,86
|
6,10
|
||
|
Stickstoffhalt. Substanzen
|
47,81
|
41,12
|
28,00
|
24,10
|
||
|
Stickstofffreie Substanzen
|
20,84
|
 |
22,50
|
40,64
|
 |
54,50
|
|
Cellulose
|
3,80
|
8,14
|
||||
|
Asche
|
6,90
|
8,05
|
4,92
|
5,96
|
||
Vgl. auch S. 245. Da die Preßkuchen nicht ganz ungefährlich sind, dürfen sie nur bei ausgewachsenen Tieren mit Vorsicht in kleinen Partien verfüttert werden.
In China werden seit Jahrhunderten aus Baumwollsamen Futterkuchen hergestellt.
In Nordamerika wird der Samen noch jetzt vielfach nur als Düngemittel benutzt.
Lit. WAGNER u. CLEMENT, Zeitschr. Unters. Nahr.- u. Genußm. 16 u. 17. — HEFTER, Fette u. Öle. 1908. — MATTHES und HEINTZ, Arch. Pharm. 1909, 161. — LEWKOWITSCH a. a. O. — Weitere Liter. in WEHMER, Pflanzenstoffe. — KÖNIG, Nahrungsm. (dort [B. I, S. 615] d. Liter.). — BÖMER, Zeitschr. Nahr.- u. Genußm. 1901, 872. — VÖLCKER, The analyst. 1903. COLLIN-PERROT, Resid. industr. — SKINNER, Exp. Stat. Rec. 1902. — BRYDE Ebenda. — WOLFF, Aschenanalysen. — OSBORNE und VOORHEES. Journ. am. chem. soc. 1894, 778. — FAHRION, Zeitschr. ang. Chem. 1892, 172. — PAPASOGLI, Publ. del labor. chim. d. gabelle 1893, 90. — DUPONT, Bull. soc. chim. 1895, 696. — Über Cottonölmargarin vgl. DE NEGRI u. FABRIS, Zeitschr. analyt. Chem. 1894, 563 u. HART, Chem. Zeit. 1893, 1520. — Über die Substanz, die die Halphenreaktion bedingt, vgl. SOLTSIEN, Zeitschr. öffentl. Chem. 1899, 306, CHARABOT und MARSH, Bull. Soc. chim. 1899, 552, RAIKOW, Chem. Zeit. 1899, 760 u. 892; 1900, 562 u. 583; 1902, 10, GILL und DENISON, Journ. am. chem. soc. 1902, 397. — ROSENTHALER Zeitschr. Nahr. u. Genußm. 1910, 453.
[S. 573]
Semen Sesami und Oleum Sesami.
Syn. Sesamsamen, Kuntschuksamen, — sésame, jugoline, benné (franz.) — sesame (engl.) — sorgelin (span.) — gergelim (port.) — sesamo, giuggiolena (ital.) — simsim (arab.) — til, gingil, gingelin, gergelim (hindost.) — salid (abyss.) — moa, chima (chines.) — koba (japan.) — kundschut (buchar., pers., türk.) — in Westafrika: bennyseed, in Ostafrika (kisuaheli): mfuta, im malaiischen Archipel: widjen bidjen (wohl aus bidji = Same) — lenga (mak.), ringa (biman.), watu (sund.).
Etym. Das Wort Sesam ist uralt. Es findet sich schon im Babylonischen. šam šamni (= Pflanze des Öls), ging als Lehnwort ins Ägyptische šmšmt über (vgl. I, S. 467), dann ins Koptische šemsêm, ins Griechische σήσαμον (bei den späteren Griechen: σησαμάτον, σησάμινον, σέμσεμ; bei den Neugriechen σησάμι oder σουσάμι) und das Lateinische sesamum. Es findet sich auch im Aramäischen und Syrischen (schuschᵉmā;, šûmšemâ) und Arabischen (sâsim, simsim). Das indische Gingeli ist aus dem arabischen chutchulân umgebildet. Davon abgeleitet: Bei BARTHEMA (1510): zerzalino; bei CASTANHEDA (1552) und GOUVEA (1602): gergelim; bei FREDERICKE (1599): zezeline; bei MOCQUET (1610): gerselin; bei THEVENOT (1661): telselin. — Til, tila ist das Sanskritwort für Sesam. Benné ist westafrikanischen Ursprungs und steht vielleicht zu ben (= Moringa) in Beziehung (?).
Stammpflanze und systemat. Stellung. Sesamum indicum DC., zusammengezogen aus Sesamum indicum L., Spec. pl. ed. I, p. 634 und S. orientale L., ebenda (S. luteum KETZ., S. oleiferum MOENCH) mit vielen Kulturvarietäten bzw. Formen. DE CANDOLLE nimmt zwei Rassen, eine mit schwarzen, eine mit weißen Samen und mehrere nach der Form der Blätter unterschiedene Varietäten an. Er unterscheidet von seinem S. indicum die Varietäten: α grandidentatum (S. indicum L.), β subdentatum (S. indicum Sims.) und γ subindivisum (S. orientale L.).
Pedaliaceen — Pedalieae (Sesamum) Sect. Sesamotypus BENTH et HOOK. fil.
Beschreibung der Stammpflanze. Die bis 1 m hohe einjährige, dem Fingerhut äußerlich ähnliche Pflanze hat einen vierkantigen, nur oben kurz-rauhhaarigen Stengel und unten gegenständige, gestielte, eiförmige, 3–5lappige, grob- und unregelmäßig gezähnte, oben alternierende, fast sitzende, lanzettliche, meist ganzrandige Blätter. Die großen Blüten entspringen einzeln (die beiden Seitenblüten der Cyma sind abortiert) in den Achseln der oberen Blätter. Der außen behaarte Kelch ist bis fast zum Grunde geteilt, mit vier schmal lanzettlichen, spitzen Blättern. Die weiße (oder rote) Blumenkrone zygomorph, trichterförmig erweitert, am Grunde rückwärts schwach höckerig, weit aus dem Kelche herausragend, bis 35 mm lang, mit fünf Lappen, von denen die drei vorderen, die die Unterlippe bilden, größer sind als die zwei hinteren. Von den vier Staubfäden sind zwei länger. Sie tragen eine längliche Anthere, die mit einer Längsspalte aufspringt und am Connectiv eine Drüse. Das fünfte, hintere Stamen ist als pfriemliches Staminodium entwickelt. Das Gynaeceum trägt einen Griffel mit zwei lanzettlichen Narbenlappen und ruht auf einem niedrigen drüsigen Diskus. Es besteht aus zwei Carpellen, die unten durch falsche Scheidewände in je zwei Kammern geteilt sind. Die Frucht ist daher unten vier-, oben einfächerig. Die zahlreichen Ovula sitzen an zentral-winkelständigen Placenten. Die Frucht ist eine hellbraune, bis 35 mm lange, bis 7 mm breite, in eine ziemlich lange Spitze auslaufende, mit vier Längsfurchen versehene Kapsel, die sich bei der Reife bis fast zum Grunde dadurch aufspaltet, daß sich die falschen Scheidewände in zwei Platten trennen.
Abbild.: STAPF in Engler-Prantl, Pflanzenfamilien IV, 3b, 263. — VOGTHERR-KÖHLER, Medizinalpfl. Ergänzungsb. t. 58 (dort die weitere botan. Literatur). — BENTLEY-TRIMEN, Med.[S. 574] plant. t. 198. — WIGHT, Illust. Ind. Bot. t. 163. — Bot. Mag. t. 1688. — Älteste Abbild. CAMERARIUS, Hortus medicus —, RUMPHIUS, Herb. amb. t. 76 und RHEEDE, Hort. Mal. IX, 54, 55.
Pathologie. Über die pflanzlichen Schädlinge berichtet Prof. ED. FISCHER: MALKOFF hat in Bulgarien auf Sesamum eine mit Auftreten von Bakterien (er nennt Bacillus Sesami und Pseudomonas Sesami) verbundene Krankheit beobachtet, bei der auf den Blättern Flecken auftreten, die Stengel schwarz werden und schließlich vertrocknen. — In anderen Fällen (so in Turkestan, in Indien) wurde ein Absterben von Sesampflanzen beobachtet, das sehr wahrscheinlich durch Neocosmospora vasinfecta E. SMITH hervorgerufen wird, einen Pilz, der auch eine Krankheit der Baumwollpflanzen (s. dort) verursacht. (A. DE JACZEWSKI, Über das Vorkommen von Neocosmospora vasinfecta E. SMITH auf Sesamum orientale. Annales Mycologici I 1903, p. 31). Sesam hat von tierischen Feinden wenig zu leiden.
Kultur und Handel. Sesamum indicum wird in den Tropen und Subtropen beider Hemisphären gebaut, vornehmlich in Vorder- und Hinterindien (Siam), Himalaya, Afghanistan, Persien, Arabien, Rußland, China, Japan, Formosa, Java, Kleinasien (Hafen: Smyrna), Arabien, Palästina (Hafen: Jaffa), Ägypten, Griechenland, Sizilien (bei Syracus und im Süden), Malta, Gozo, Algier, West- und Ostafrika (Natal, Sansibar, Madagaskar, Mossambik, Senegal, Lagos) und den wärmeren Gebieten Nord- und Südamerikas (Brasilien, Westindien, Curaçao). Hauptproduktionsgebiet ist Vorderindien, das viel Sesam verbraucht und noch mehr exportiert. Dort sind ungeheuere Flächen mit Sesam bebaut. In der Präsidentschaft Madras allein 400000 ha. Die Pflanze verlangt eine möglichst gleichmäßige Temperatur und mindestens drei Monate gleichmäßige Wärme, sowie trockenen, kalkhaltigen, lehmigen, stickstoffreichen Sandboden. Man sät in Indien die schwarze Varietät im März, die weiße im Juni; die erste reift im Mai, die andere im August. Die Frucht wird ausgedroschen. Bisweilen werden, da die Vegetationszeit nur drei Monate beträgt, zwei Ernten im Jahr erzielt.
Im Handel unterscheidet man besonders indische und Levantiner Samen (letztere von der Form Orientale), sowie weißen, gelben, braunen und schwarzen oder gemischtfarbigen Sesam. Selbst dieselbe Varietät produziert Samen verschiedener Farbe. Im allgemeinen zeigen die Samen von S. indicum weiße, gelbliche oder bräunliche, die von S. orientale schwarzbraune bis violettschwarze Farbe (HARZ). In Indien heißt der hellgelbe safed til, der schwarze kala til. Der schwarze produziert mehr Samen, der weiße das feinste Öl.
Gleichmäßig gelblich-weiß ist der Levantiner Kurrachée und Sansibar-Sesam, mit grauen Samen gemischt der Bombay-Sesam, braun der ägyptische und Smyrna-Sesam, schwarz der indische.
Deutschland importierte 1909: 779401 dz Sesamsamen besonders aus China und Brit. Indien (zusammen über 700000 dz), dann aus Portugies. Ostafrika, Nied. Indien, der asiat. Türkei, Japan und Brit. Westafrika. Frankreich importierte 1908: 554036 Quint. Sesamsamen. Davon kam das meiste, etwa zu gleichen Teilen, aus China und Engl. Indien, kleinere Mengen aus der Türkei, noch weniger aus Niederl. Indien, Westafrika, Indochina. Marseille ist ein wichtiger Sesamimporthafen. Dann auch Triest. British Indien exportierte Sesamsamen 1904/05: 65532, 1908/09: 17977 cwts nach England und engl. Besitzungen und 1904/05: 2451225, 1908/09: 1639315 cwts nach anderen Ländern. Von Sesamöl 1908/09: 104306 cwts nach England usw. und 69904 cwts nach anderen Ländern. Siam exportiert etwa 4 Mill. kg Samen. China verschiffte aus den Vertragshäfen 1897: 44899 piculs, Ostafrika für über 200000 M. Die Vereinigten Staaten importierten 1909: 1274032 pounds Sesamöl.
Lit. SEMLER, Trop. Agrikult. — WATT, Dict. econom. prod. — FLÜCKIGER-HANBURY, Pharmacogr. — WARBURG, Sesamkultur in unser. Kol. Zeitschr. trop. Landwirtsch. 1898. — THOMS, Sesamsaat aus Togo. Tropenpfl. 1898.
[S. 575]
Morphologie der Droge. Die Samen sind 1,5–4, meist c. 3 mm lang, c. 1 bis 2 mm breit und 1 mm dick, je nach der Sorte gelblich-weiß, rötlich oder braun bis schwarz, verkehrt eiförmig, etwas zugespitzt, flachgedrückt, spatelförmig. An den vier Kanten laufen vier mit der Lupe gut sichtbare, schmale Rippen. Dadurch erscheint der Same im Querschnitt undeutlich vierkantig. Die flachen Breitseiten sind infolge eines undeutlichen Netzwerkes feingrubig runzlig. In der Mitte der einen flachen Seite verläuft die Raphe. Das Endosperm ist etwa halb so dick wie ein Cotyledon. Die ölreichen Cotyledonen sind flach, zwischen ihnen liegt der Keimling. Der Geschmack ist angenehm milde-ölig.
Anatomie. Die Samenschale zeigt zwei Schichten. Die äußere besteht aus beim trockenen Samen zusammengefallenen, nach dem Aufweichen palissadenartig gestreckten, dünnwandigen Zellen, die, ihrer Außenwand angeheftet, eine in einer Tasche sitzende große Calciumoxalatdruse führen (Fig. 182) und bei den dunklen Varietäten auch den in Alkali löslichen Farbstoff (in Form von Pigmentkörpern, HARTWICH) enthalten. Von der Fläche betrachtet sind sie isodiametrisch und bieten (auch im Preßkuchen) ein für den Sesamsamen außerordentlich charakteristisches Bild, denn es sind nur wenige Fälle (von BENECKE und COLLIN) beobachtet, wo diese Kristalle fehlten. An den vier Eckleisten (s. oben) des Samens sind die Epidermalpalissaden fächerartig angeordnet (Fig. 182 I). Hier fehlt ihnen auch meist die Kristalldruse. Die zweite Schicht ist die aus mehreren Reihen obliterierter dünnwandiger, kleine Prismen oder Zwillingskristalle (COLLIN, HANAUSEK) enthaltender Zellen bestehende Nährschicht. Bei den dunklen Sorten führt auch sie Farbstoff. Das Endosperm ist mehrschichtig. Seine Zellen sind etwas dickwandiger als die Zellen der bifacial gebauten breiten Cotyledonen (Fig. 182), enthalten aber wie diese in Ölplasma eingebettete, Globoide und Kristalloide führende, Aleuronkörner. Diese sind im Endosperm 2–6, in den Cotyledonen bis 10 mik. groß.
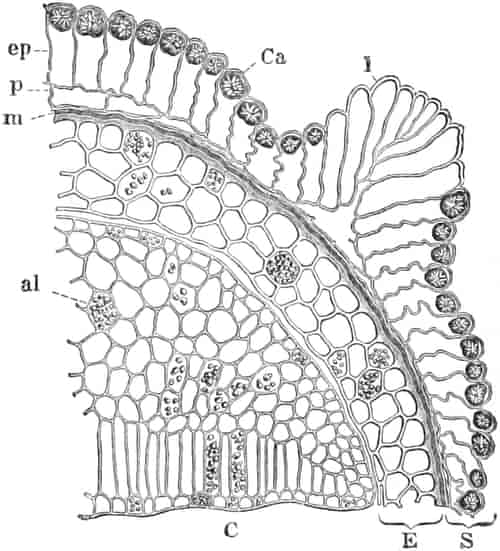
Sesamum indicum DL.
Querschnitt durch Samenschale (S), Endosperm (E) und einen Cotyledon (C).
[Nach Moeller-Winton.]
Lit. FLÜCKIGER, Z. Kenntn. d. Sesamsam. Schweiz. Wochenschr. 1865. — BENECKE, Die verschied. Sesamarten u. Sesamkuchen d. Handels. Pharm. Centralh. 1887, 545 und Anleit. zur mikrosk. Unters. d. Kraftfutterm. 1886. — BÖHMER, Die Kraftfuttermittel 1903. — MOELLER-WINTON, Mikroskop. d. Nahr.- u. Genußm. 2. Aufl. — COLLIN-PERROT, Les résid. industr. — T. F. HANAUSEK in Wiesner Rohstoffe II. Aufl. — HARZ, Landwirtsch. Samenk. — HEBEBRAND, Über d. Sesam. Landw. Vers. Stat. 1898, 45. — KOBUS, Kraftfutter u. s. Verfälsch. Landw. Jahrb. 1884, 813. — HARTWICH in Realenzyklop. d. Pharm.
Chemie. Die Samen enthalten im Mittel in Prozenten: 5,50 (5,25–6,5) Wasser, 20,30 (19,5–22,7) Rohproteïn, 14,98 stickstofffreie Extraktstoffe, 7,15 (6,4–8,4) Rohfaser, besonders Pentosane, 4,5–6,47 Asche. Ferner enthalten die Samen 47 bis 57% im Durchschnitt 50–53% (indische Saat) bzw. 56–57% (Levantiner) Öl[S. 576] (die indischen Pressen liefern nur 22–31% Öl), Saccharose (VALLÉE, 0,64% BOURQUELOT) und reduzierenden Zucker (0,14% BOURQUELOT), ein Pentosan (E. SCHULZE, WITTMANN), Lecithin und Cholin (im Preßkuchen, E. SCHULZE), Phytin (POSTERNAK), Conglutin, Globulin, Legumin (RITTHAUSEN), Amide, einen 1,95% Schwefel enthaltenden Proteïnstoff. Über 96% des Stickstoffes sind als Eiweißstickstoff vorhanden. Der Gehalt an Calciumoxalat beträgt 0,2–1,8%.
Das Sesamöl, Oleum Sesami (huile de sésame ou de benné, sesame oil, gingeli, gingili oder jinjili oil, til oder teel oil, benné oil, olio di sesamo), ist kalt gepreßt hellgelb, geruchlos und von angenehmem Geschmack. Die Elementarzusammensetzung des Öls der schwarzen (und weißen) Samen ist C = 76,17 (77,38), H = 11,44 (11,59), O = 12,39 (11,03) (KÖNIG). Es enthält 12,1–14,1% feste Fettsäuren (FARNSTEINER) und 78,1% flüssige (LAUE). Letztere bestehen vorwiegend aus Ölsäure, weniger aus Linolsäure, die festen aus Palmitin- und Stearinsäure, sowie etwas Myristicinsäure (KREIS). Die Menge des Unverseifbaren, das aus Phytosterin, Sesamin und Rotöl besteht, beträgt 0,95–1,32%, die freien Fettsäuren des kaltgepreßten Öls 0,47–5,75%. Das Öl dreht rechts (+0,8° bis +1,6°, UTZ) infolge seines Gehaltes an Phytosterin (F. 137, VILLAVECCHIA und FABRIS) und an durch Eisessig aus dem Öl extrahierbaren, zu 0,2–0,5% vorhandenen Sesamin [C18H18O5, Nadeln, F. 118°, TOCHER; (C11H12O3)2, F. 123°, VILLAVECCHIA und FABRIS; C33H30O10 (?), BÖMER und WINTER]. Letzteres wird durch Nitroschwefelsäure erst grün, dann hellrot, welche Reaktion die U. St. Ph. zur Identifizierung des Öls benutzt. Ferner wurde daraus ein aus einem krist. Kohlenwasserstoff (F. 91–92°) entstehendes (CANZONERI und PERCIABOSCO), dickes, stickstofffreies, rotbraunes Öl isoliert (TOCHER, VILLAVECCHIA), das die Rohrzucker-Salzsäurereaktion des Öls, die (von CAMOIN gefundene) sog. BAUDOUINsche Reaktion, bedingt und das vollständig in die flüssigen Fettsäuren übergeht, wenn diese mit der Bleisalz-Äthermethode abgeschieden werden. Da die BAUDOUINsche Reaktion auf der Bildung von Furfurol aus der vom Rohrzucker abgespaltenen Lävulose beruht, kann der Rohrzucker bei der für Sesamöl höchst charakteristischen Probe, die noch kleinste Mengen Sesamöl nachzuweisen erlaubt, durch Furfurol ersetzt werden (VILLAVECCHIA und FABRIS). Alle aromatischen Aldehyde mit zyklischem Kern geben mit Sesamöl Farbenreaktionen (BREINDL). Ferner findet sich im Sesamöl das phenolartige Sesamol (KREIS).
Das spez. Gewicht des Öls beträgt bei 15°: 0,921–0,926 (am höchsten bei russischen Ölen), bei 98°: 0,867–0,870 (Ph. helv. IV), der Erstarrungspunkt liegt bei gepreßtem Öl bei −4 bis −6° (bei extrahiertem Öl bei +5°), der Brechungsexponent (im Butterrefraktometer bei 25°) 66,2–69, die Verseifungszahl 187,6 bis 194,6, die Jodzahl 103–114,5 (bei Curaçaoöl 116,8), die Reichertzahl 0,35, die Reichert-Meißlzahl 1,2, die Hehnerzahl 95,6–95,86, die Temperaturerhöhung bei der Maumenéprobe 63–68°. Die Fettsäuren zeigen die Jodzahl 108,9–112, eine Acetylzahl 11,5, der Erstarrungspunkt liegt bei 18,5–28,5°, der Schmelzpunkt bei 21–31,5. Bei der Elaidinprobe wird das Öl nicht fest. Die Verbrennungswärme des Sesamöls beträgt 9395 g-cal. bei konstantem Volumen (SHERMAN und SNELL). Der Entflammungspunkt liegt bei 240° (RAKUSIN). Die Pharm. helv. IV gibt als Identitätsreaktion neben der BAUDOUINschen noch an, daß bei Überschichten von Salpetersäure (1,4) zunächst mit Sesamöl und dann mit Resorcin-Benzol, nach dem Umschütteln eine vorübergehende rot- bis blauviolette Färbung auftreten soll.
[S. 577]
Die Zusammensetzung der Sesamkuchen (Preßkuchen) ergibt sich aus folgender Tabelle:
|
GAROLA
|
WOLKER GRANDEAU
|
DIETRICH u. KÖNIG
|
||||
|
Sesam
|
Indischer Sesam
|
|||||
|
schwarz
|
weiß
|
Max.
|
Min.
|
Mittel
|
||
|
Wasser
|
9,58
|
8,06
|
10,20
|
16,40
|
8,10
|
12,45
|
|
Stickstoffhaltige Substanz
|
41,50
|
36,87
|
33,75
|
42,31
|
32,20
|
36,57
|
|
Fett
|
10,76
|
11,34
|
15,38
|
15,84
|
5,70
|
11,86
|
|
Stickstofffreie Substanz
|
20,10
|
25,05
|
24,13
|
30,81
|
14,10
|
21,12
|
|
Cellulose
|
7,06
|
8,14
|
5,00
|
13,28
|
6,10
|
8,12
|
|
Asche
|
11,00
|
10,54
|
11,54
|
11,40
|
7,45
|
9,88
|
Die Levantiner Sesamkuchen gelten als eiweißreicher. Sesamkuchen können unbedenklich verfüttert werden.
Lit. DE LA SOUCHÈRE (Baudouinreaktion), Zeitschr. anal. Chem. 1882, 445. — LAUE, Journ. Soc. chem. ind. 1901, 1083. — UTZ (vgl. Unters. von afrik., ind. u. levantin. Öl), Pharm. Zeit. 1900, 522. — TOCHER, Pharm. Journ. 1891, 639; 1893, 700. — VILLAVECCHIA und FABRIS, Zeitschr. angew. Chem. 1893, 505. — HAZURA und GRÜSSNER, Monatsh. f. Chem. 1889, 242. — BREINDL, Chem. Zeit. 1899. — FARNSTEINER, Chem. Zeit. 1896, 213. — BENEDICT-ULZER, Analyse d. Fette. — KREIS, Chem. Zeit. 1902, 1014; 1903, 116 u. 1030 u. Über Farbenreaktionen fetter Öle. Verhandl. der Basler Naturf. Ges. 1903. — SOLTSIEN, Vierteljahrschr. Nahr. u. Gen. 1893, 372. — BELLIER (Farbenreaktionen des Öls), Ann. chim. anal. appl. 1899, 217. — CIUPERCESCO (Reaktion auf Sesamöl), Bulet. asociat. farmac. Romania 1903. — LEWKOWITSCH a. a. O. — KÖNIG a. a. O. Weitere Lit. in WEHMER, Pflanzenstoffe und bei KÖNIG.
Verfälschung. Gebleichtes und verdorbenes Öl wird durch Phloroglucin-Salzsäure stark rot. Baumwollsamenöl kann durch die Halphensche Reaktion erkannt werden. Eine Lösung von 2 g Sesamöl in 10 ccm Chloroform und 20 ccm absolutem Alkohol soll nach Zusatz von drei Tropfen Phenolphthaleïn und 2 ccm n/10 Kali eine bleibende Rotfärbung zeigen (Prüfung auf altes saures Öl, Ph. helv. IV). Als Verfälschung sind beobachtet: Arachisöl, Baumwollsamenöl, Rüböl.
Anwendung. Die besten Sorten sind, da sie nicht leicht ranzig werden und sich jahrelang unzersetzt halten, dem Olivenöl gleichwertig. Sie werden daher auch in der Enfleurage benutzt. Die Öle zweiter und dritter Pressung dienen besonders zur Seifenfabrikaton. Es ist in Deutschland gesetzlich vorgeschrieben, daß der Kunstbutter (Margarine) und dem Kunstkäse 5 resp. 10% Sesamöl zugesetzt werden muß, damit die Identifikation mit der BAUDOUINschen Reaktion möglich ist. Die besten Sorten werden mit Mohnöl, Baumwollöl und Arachisöl verfälscht, die geringeren mit Rüböl. Aus dem mit Honig versetzten Mehl wird der χαλβᾶς bereitet, eine im Orient sehr beliebte Fastenspeise (HELDREICH). Auch in Indien sind viele Tila-Zubereitungen bis heute in Gebrauch. In Vorderasien und Ägypten wird das Brot mit Sesam bestreut, in Sizilien mit den zuvor gerösteten Samen (GINGGIOLINA). Herba Sesami wird in den Vereinigten Staaten medizinisch benutzt.
Paralleldrogen. Sesamum radiatum SCHUM. et THONN (S. foetidum ATZEL, S. occidentale HEER et RGL., bei den Suaheli ufuta muita = wilder Sesam), in West- und Ostafrika heimisch, wird als Ölpflanze und zur Gewinnung der Samen besonders in Afrika, dann auch auf Ceylon, in Hinterindien, auf den Philippinen und in Amerika (Guyana) kultiviert und liefert auch Sesamöl, sowie den sog. «dickschaligen» Sesamkuchen (BENECKE). Ihre Samen sind schmal berandet und auf den flachen Seiten radial gestreift. Die Epidermiszellen der Samenschale sind innen und an einem Teile der Seiten verdickt und tragen hier die Calciumoxalatkristalle (BENECKE). Sesamum angustifolium (OLIV.) ENGL., in Deutsch-Ostafrika und Sansibar heimisch, liefert ebenfalls brauchbare Ölsaat, doch sind die Samen kleiner.
Das sog. «deutsche» Sesamöl ist Leindotteröl, von Camelina sativa.
Geschichte. Sesamsamen und das Öl wurden seit den ältesten Zeiten, z. B. schon bei den Sumerern (I, S. 475) benutzt, doch fehlen prähistorische Funde. Die ursprüngliche Heimat der[S. 578] Pflanze ist nicht mit Sicherheit bekannt. DE CANDOLLE hält, da BLUME (Bijdragen p. 778) angeblich wilden S. in Java fand, diese Insel (resp. die Sundainseln überhaupt) für die Heimat des S. und meint, daß er vor 2–3000 Jahren nach Indien und ins Euphrattal und etwa 1000 n. Chr. nach Ägypten gekommen sei. WATT bestreitet dies. Er hält, allerdings mit einem Fragezeichen, die Pflanze für in Indien heimisch, da er in Behar und im Himalaya angeblich wilde Formen sammelte. Die Kultur des Sesam tritt in Indien jedenfalls schon zur Zeit des ATHARVAVEDA auf, wo sie neben der von Reis, Gerste und Bohnen genannt wird. Ebendaselbst wird das Sesamöl (taila, tila) schon zu Opferzwecken verwendet. SCHRADER meint, daß die Pflanze von Indien sehr frühzeitig in die Euphratländer vorgedrungen sein muß, wo sie die Stelle des Ölbaumes vertrat. Auf einem ägyptischen Denkmale aus der XX. Dynastie ist das Bestreuen der Brote mit einem Samen (Sesam?) dargestellt (UNGER). Doch kann dies auch ein anderer Same sein. Sesam findet sich auch in einigen Rezepten des Papyrus EBERS (1500 n. Chr.). Trotzdem BRUGSCH in einem ägyptischen Texte des V. Jahrh. n. Chr. Sesam fand und in Afrika 9 andere Arten vorkommen, dürfte die von DE PRUYSSENAERE geäußerte Ansicht, Sesam sei ursprünglich in Afrika heimisch, nicht zutreffend sein. Nach Ägypten, wo er jetzt eine große Rolle spielt, scheint S. aber schon in vorgeschichtlicher Zeit gekommen zu sein (SCHWEINFURTH). Da die Ägypter aber den Namen von den Babyloniern erhielten (s. oben S. 573), erhielten sie wohl auch die Pflanze von daher. HERODOT (L. I, 193) berichtet, daß die Babylonier nur aus Sesam Öl bereiteten. Der Anbau muß also dort schon in früher Zeit sehr ausgedehnt gewesen sein.
Auch aus anderen Quellen wissen wir, daß die Babylonier sich des Sesamöls bedienten (I, S. 467). Auch einige indische Namen des S. — gingeli, gergelium aus arab. schulchulan — deuten von Indien nach Westen und so meint denn WATT, daß S. zuerst vielleicht irgendwo zwischen dem Euphrattale und Bochara südlich von Afghanistan und Nordindien kultiviert wurde, und von dort nach Indien und den Archipel kam, ehe er nach dem Westen gelangte. Alles deutet auf ein semitisches Volk, das die Sesamkultur einführte. Ich bin daher geneigt, die Urheimat des S. nach Mesopotamien und die östlich daran anstoßenden Länder zu verlegen. Von dort gelangte der S. wohl schon mit den Ariern im II. Jahrtausend n. Chr. einerseits nach Indien und dann auch nach Ägypten. Doch erscheint es auch möglich, daß die Kultur des S. an mehreren Zentren unabhängig von einander begann. Nach Ostasien gelangte S. wahrscheinlich nicht vor Beginn unserer Zeitrechnung. Die ersten Angaben datieren aus dem V. bzw VI. Jahrh. Erst im Tsi min yao chou wird S. in China erwähnt (BRETSCHNEIDER). Die Portugiesen brachten S. von der Küste von Guinea nach Brasilien.
Nach der Brahmapurâna wurde S. durch YAMA, den Gott des Todes, geschaffen und er wird daher in Indien besonders bei den Totenfeiern viel benutzt. Sesam repräsentiert das Lebensprinzip, das Symbol der Unsterblichkeit, er ist dem Soma heilig und neben Reis und Honig Bestandteil einiger Totenspeisen. Die alten Sanskritschriftsteller berichten über die verschiedenen Sorten der Sesamsamen, über das Öl und seine medizinische Anwendung. Sesamöl war das erste in Indien gepreßte Öl (DUTT), tila (sansk.) findet sich bereits in den Veden. S. kehrt auch oft in indischen Sprüchwörtern (GUBERNATIS) und in Volkserzählungen wieder. Das «Sesam öffne dich» des ALI-BABA in Tausend und einer Nacht zeigt, daß man in dem kleinen Samen alle Geheimnisse der Zauberei beschlossen glaubte. In der Bibel scheint Sesam zu fehlen. Allerdings zitiert Pharmakographia Jesaia 28, 27, aber das dort (neben Kammon, d. h. Cuminum) stehende ḳeṣach ist nicht klar zu deuten, die griechische Bibelübersetzung hat μελάνθιον, die Vulgata gith (beide = Nigella sativa), die englische Übersetzung fitches, in der deutschen (von KAUTZSCH) steht Dill (vielleicht ein mißverstandenes til; dann würde der Übersetzer an Sesam gedacht haben), in anderen steht Wicke. HERODOT erwähnt σήσαμον, ebenso ALKMAN (VII. Jahrh. n. Chr.). HIPPOCRATES bediente sich des Samen als Expectorans (I, S. 540). THEOPHRAST erwähnt an vielen Stellen das σήσαμον. DIOSKURIDES und PLINIUS berichten, daß Sesam z. B. in Ägypten gebaut wurde. PLINIUS sagt, daß er von Indien komme (der ägyptische ist wohl Ricinus). Auch im Edikte des Diocletian (I, S. 569) finden sich Sesamsamen. Der Periplus (I, S. 535) erwähnt Sesamöl als Ausfuhrartikel von Moscho, Barygaza und Ariakes. VARRO erwähnt S. COLUMELLA kannte den Sesambau aus eigener Anschauung (I, S. 573). Nach dem Norden ist S. nicht gekommen. Im Mittelalter wurde suseman (oder sempsen) in Cypern, Ägypten und Sizilien kultiviert. Das Öl war ein Exportartikel von Alexandrien nach Venedig. Sesampreßkuchen wurden, wie Aruch, ein talmudisches Wörterbuch des Mittelalters, berichtet, mit Jasminblüten parfümiert als Seife benutzt (LÖW). Sesamum steht bei CORDUS, aber noch[S. 579] nicht in der Alphita, Sesamöl im Luminare majus und Lumen Apothekariorum (I, S. 793). Trotz des hohen Alters der Sesamölgewinnung ist das Öl für Europa doch erst seit der zweiten Hälfte bzw. dem Ende des XIX. Jahrh. von größerer Bedeutung geworden.
Lit. DE CANDOLLE, L’origine des plantes cultivées. — GUBERNATIS, Mythologie des plantes II, 345. — DUTT, Hind. mat. med. — WATT, Dict. econom. prod. — HEHN, Kulturpflanzen. — SCHRADER, Reallexikon. — LÖW, Aramäische Pflanzennamen. — FLÜCKIGER-HANBURY, Pharmacographia.
Semen Tiglii und Oleum Crotonis.
Syn. Grana tiglii, tiglia, s. tilli, S. moluccana, Sem. Crotonis, Sem. Cataputiae minoris, Croton- oder Purgierkörner, Granatillsamen, Graines ou semences de Tilly ou de Moluques, Petits pignons d’Inde — croton seeds — tilho (port.). Die Pflanze: Purgierbaum, Purging Croton, Croton cathartique. Im Hort. Malabar.: Gajapala, Cadel auanucu. Im Herb. Amboinens.: Granum moluccum. In BAUHINS Pinax: Pinus indica nucleo purgante. Die Samen in Indien: Jamalgata pills — sansc.: jajapála, kanakaphála — hind.: jamál-gota — tam.: nervalan — mar.: jepal — auf Java: tjeraken, mal.: tjemekijan — in China: pa-tow, pa-teú, chʿuan-pei, chiang-tsu, tou-jin.
Stammpflanze und systemat. Stellung. Croton Tiglium L., Spec. pl. ed. I, 1004 (1753) (Croton acutus THNBG., C. Jamalgota F. HAMILTON, Kurkas tiglium RAFINSQU., Tiglium officinale KLOTSCH, Anisophyllum acutifolium BOUV.).
Euphorbiaceae, Platylobeae — Crotonoideae — Crotoneae (Croton). Untergattung Eucroton Subsectio Medea MÜLL. ARG.
Etym. Croton von κρότων = Zecke nach der Form des Samens (vgl. bei Ricinus). Tiglium von τίλος = Durchfall (nicht von der Moluccen-Insel Tilho). Granatill aus Grana tilli oder dilla, dem alten Handelsnamen der Droge.
Beschreibung der Stammpflanze. Croton Tiglium ist ein kleiner, höchstens 4–6 m hoher immergrüner, diclin-monöcischer Baum oder Strauch mit oblongen oder eioblongen, zugespitzten, entfernt sägezähnigen, im Alter kahlen Blättern, die am Grunde, dort wo der Blattstiel ansitzt, zwei Nektarien tragen. Der Blütenstand ist eine androgyne Traube. Die Einzelblüten stehen einzeln oder zu zwei bis dreiblütigen Büscheln. Die männlichen Blüten stehen am oberen Teile des Blütenstandes (oder der letztere trägt nur solche). Ihr tief fünfteiliger grüner Kelch zeigt oblong-lanzettliche, am Rande und an der Spitze dünnsternhaarige Blätter. Die fünf weißen, lanzettlichen, mit den Kelchblättern alternierenden, anfangs ausgebreiteten, dann zurückgerollten, besonders am Grunde dicht zottigen Blumenblätter überragen den Kelch nicht. Die 15–20 freien Staubgefäße überragen den Kelch. Die weiblichen, am Grunde des Blütenstandes stehenden Blüten haben einen bis zur Mitte fünfteiligen Kelch mit oblongen, sternfilzigen Zipfeln, sehr kleine kurzgestielte Blumenblättchen und einen großen, goldgelben, dicht mit Sternhaaren bedeckten, kugeligen, dreiteiligen Fruchtknoten, der drei Griffel mit je zwei langen fädigen Narben trägt und in jedem Fache ein Ovulum enthält. Die kugelig ellipsoidische Kapselfrucht, die den Haarbelag abwirft und daher (durch die Haarbasen) außen nur rauh, sonst aber kahl erscheint, ist 2–2,2 cm lang und 1,6–2 cm breit, gelb bis hellbräunlichgelb. Sie zerfällt in drei Kokken (daher: Tricoccae), die sich von der Mittelsäule lösen und bis zur Mitte zweiklappig aufspringen. Jede der Kokken enthält einen Samen mit reichlichem Endosperm.
Croton Tiglium ist in Ostindien (Malabar, Bengalen, Ceylon) heimisch und findet sich auch in Assam, Birma und Malakka und wohl auch auf Java, Borneo, Amboina und den Philippinen wild. Nach China und Japan ist C. seit langem eingeführt; neuerdings (1898) auch nach Kamerun. Ich traf C. in Java und Ceylon da und dort als Heckenpflanze kultiviert. Er[S. 580] ist sturmfest und wächst rasch. Besonders wird er in Vorderindien, China, Java, Mauritius und den Philippinen — in beschränktem Maße — angebaut. Jetzt kommen viel Samen aus China. Der Crotonbaum ist leicht durch Samen fortzupflanzen, bedarf gar keiner Pflege und nimmt mit dem schlechtesten Boden vorlieb. Er kann, wenn der Boden nicht sumpfig ist, bis zu Höhen von 1000 m und mehr kultiviert werden. Er dient auch als Schattenbaum (vgl. I, S. 52) in Kaffee-, Cacao-, Vanille- und Cardamomenpflanzungen (SEMLER).
Lit. J. SCOTT, Med. plant. Ceylon Edinb. 1819. — MARCHAND, Adansonia I, 232. — HAMILTON, Transact. Linn. Soc. 14, 258. — ROXBOURGH, Flor. Ind. III, 682. — HOOKER, Flor. Brit. Ind. — PAX, Euphorb. in ENGLER-PRANTL, Pflanzenfam. III, 5, Fig. 25. — SEMLER, Trop. Agrikultur. — PEREIRA, Heilmittellehre II, 210. — WEYNTON, Commerc. prod. Assam Ph. journ. 18 (1887), 162. — J. U. LLOYD, Western Drug. 1898. — Abbild.: BERG-SCHMIDT, Atlas 2. Aufl. t. 87 (dort die weitere botan. Lit.), NEES VON ESENBECK, Düsseld. Abb. t. 138, BENTLEY-TRIMEN, Med. plant. t. 239, BAILLON, Bot. méd. Fig. 2676–2682 und BURMANN, Thes. zeylan. t. 90.
Morphologie der Droge. Die Samen besitzen die Größe kleiner Ricinussamen, meist sind sie etwa 10–12 mm lang, c. 8 mm breit und c. 6 mm dick, ovallänglich, an beiden Enden stumpf, aber beiderseits, namentlich auf dem Rücken, infolge eines freilich wenig vorspringenden, stumpfen, namentlich an der oberen Hälfte sichtbaren Längskiels kantig-konvex, daher im Querschnitt undeutlich vierkantig-rautenförmig, nicht rein oval, die eine Seite ist etwas flacher als die andere. Die etwas abgeflachte Bauchseite zeigt eine deutliche Raphe. Außen sind sie schwach glänzend, rötlichbraun oder matt schmutzig-grau, an den Stellen wo die äußere Schicht abgerieben ist mit dunkleren Flecken, wo diese ganz fehlt stumpf-schwarz, auf der Rückenseite gegen das Hilum und die Chalaza etwas längsstreifig und furchig, auf der Bauchseite mehr glatt.
Die Samenschale ist dünn (c. 0,3 mm), spröde und zerbrechlich, innen grausilberglänzend, die dünnhäutige innere Samenhaut läßt sich leicht ablösen; bricht man den Samen auf, so bleibt sie oft am Samenkern haften und bedeckt diesen als eine zarte Hülle, die ein reich verzweigtes, von der Chalaza ausgehendes Adernetz, besonders nach Behandeln mit Phloroglucinsalzsäure, deutlich hervortreten läßt. Der leicht in zwei plankonvexe Hälften zerfallende Samenkern — bei der Droge oft geschwunden — ist im Querschnitt ölig-fettglänzend, besitzt ein dickfleischiges Endosperm und dünne, breit-blattartige, an der Basis herzförmige, nicht aneinander, aber am Endosperm festhaftende Cotyledonen mit deutlicher Nervatur, eine kleine Plumula und eine c. 3 mm lange, gegen das Hilum gerichtete Radicula. Die Caruncula ist nur klein und am trockenen Samen kaum noch zu erkennen. Unterhalb derselben tritt das Hilum deutlich hervor, von ihm läuft die Raphe zur am anderen Ende des Samens liegenden, undeutlich hervortretenden Chalaza. Die Schalen betragen 31,6%, der Kern 68,4% des Samens (FLÜCKIGER). Der Samenkern, der in zwei plankonvexe Hälften aufspaltet (ISA BEN ALI vergleicht diese mit Sperlingszungen), schmeckt anfangs milde ölig, bald wird der Geschmack aber scharf kratzend, lange anhaltend brennend. Die Schale ist geruchlos und fast ohne Geschmack. Der geruchlose Kern entwickelt beim Erwärmen einen scharfen, die Augen angreifenden und die Haut reizenden Geruch.
Crotonsamen findet sich im Handel in Säcken von 50–60 kg oder in Fässern (GEHE) (nach HANBURY in cases, bales or robbins).
Anatomie. Aus dem äußeren Integument des Ovulums, in dem das Raphebündel verläuft und das neben der Mikropyle einen kleinen Obdurator und, aus der[S. 581] Mikropyle bruchsackartig herausragend, das Ende des Nucellus zeigt (ein Pseudonucellus ist hier nicht wie bei Ricinus zu finden), entstehen drei Schichten: eine auch in der Droge noch meist Stärke und einen braunen Farbstoff führende, aus polygonalen Zellen bestehende Epidermis, eine mehrreihige, mehr oder weniger zusammengefallene parenchymatische Nährschicht und eine Schicht dünnwandiger Palissaden, die kleine Interzellularen zwischen sich lassen. Diese äußere Schicht läßt sich leicht abreiben. Alsdann tritt die aus der Epidermis des inneren Integumentes hervorgehende, aus stark radial gestreckten, schief gestellten, dickwandigen, dunkel gefärbten, etwa 250 mik. hohen Palissadensklereïden bestehende Hartschicht hervor, innerhalb welcher die oben erwähnte nährschichtartig zusammengefallene Silberhaut liegt, in der die reich verzweigten Ausläufer des Raphenbündels rückläufig vom Chalazaende zum Hilumende verlaufen. In den Zellen des Endosperms und der Cotyledonen finden sich reichlich Aleuronkörner von der gleichen Gestalt wie bei Ricinus mit deutlichen Globoiden und Kristalloiden, eingebettet in Ölplasma. Sie messen im Endosperm 8–13 mik. In den blattartigen Cotyledonen, die sich vom Endosperm ablösen lassen, sind sie kleiner.
Lit. TSCHIRCH, Croton in Realenzyklop. d. Pharm. — SCHLOTTERBECK, Beitr. z. Entwicklungsgesch. pharmakognost. wichtig. Samen. Diss. Bern 1896 (mit Abbild.). — VOGL, Commentar. — PLANCHON-COLLIN, Drog. simpl.
Handel. Das Öl wird in Indien aus den reifen, schwach gerösteten und geschälten Samen bei gelinder Wärme ausgepreßt. Auch ein mit Lösungsmitteln extrahiertes tritt bisweilen im Handel auf. Seine Zusammensetzung ist eine andere. Pharm. helv. IV verwirft es ausdrücklich. Keinesfalls darf ein mit Alkohol extrahiertes Öl benutzt werden. Der Handel kennt außer dem hell- bis bräunlichgelblichen ostindischen, über Bombay, Cochin und Madras exportierten Öle, das als sehr wirksam gilt, auch ein braungelbes englisches. Eine gute Sorte ist das in kleinen Fläschchen mit der Signatur: «Croton oil sold by A. Short, Ratcliff, Highway London» in den Handel gebrachte (HAGER-FISCHER-HARTWICH, Pharm. Praxis). Es ist Selbstdarstellung des Öls durch Pressen oder Extrahieren mit Äther vorgeschlagen worden. Geschieht dies, so müssen die Preßkuchen, Filter usw. verbrannt werden, da sie giftig sind.
Chemie. Die Purgierkörner enthalten (nach KÖNIG) im Durchschnitt in Prozenten: Wasser 5,71, Stickstoffsubstanz 18,77, Fett 36,81, stickstofffreie Extraktstoffe 9,95, Rohfaser 25,23, Asche 3,53. (Fett in der Trockensubstanz 39,04%.) Die Samen enthalten 30–45% Öl — liefern aber bei der Pressung sehr viel weniger (s. unten) —, c. 18% Eiweiß, c. 4% Asche und c. 6% Wasser, ferner Lipase (DUNLAP und SEYMOUR, BRAUN fand kein fettspaltendes Enzym), Invertin, Amylase, Raffinase, ein proteolytisches Enzym tryptischer Natur (SCURTI und PAROZZANI). Das lipolytische Vermögen des Crotonsamen äußert sich merkwürdigerweise nicht am Crotonöl, wohl aber an Sesam-, Oliven-, Ricinus- und Mandelöl, die zum Teil nahezu vollständig durch die Lipase verseift werden. Das hydrolytische, Ester aufspaltende Enzym der Samen vermag auch Saccharose zu invertieren und Stärke zu verzuckern (SKURTI und PAROZZANI). ELFSTRAND fand in den Samen zwei giftige Eiweißkörper (Toxalbumine, Agglutinine), Crotonglobulin und Crotonalbumin, die er aus ihrem Gemisch [Crotin (BRAUN)] isolierte. Sie verlieren durch Erhitzen ihre Giftigkeit. Crotin ist ein Plasmagift. Es greift die Stromata der Blutkörperchen gewisser Tiere an, bringt Milch zum Gerinnen, ist aber nicht fettspaltend. Verdauung im Brutschrank schwächt es nicht ab (KOBERT). Schon STILLMARK gab einen dem Ricin ähnlichen Körper an. Die Eiweißkörper des Samens liefern bei der Hydrolyse: Arginin, Histidin, Lysin, Glutamin, Leucin, Phenylalanin usw. (S. 495).
[S. 582]
Zweifelhaft sind das giftige (dem Cascarillin ähnliche) Alkaloid Ricinin (TUSON 1864) und Gummi. Das Alkaloid Crotonin (BRANDES = Tiglin ADR. DE JUSSIEU) ist zu streichen (WEPPEN). Es ist fettsaure Magnesia (SOUBEIRAN). ELFSTRAND fand kein Alkaloid. Die von SCHLIPPE angegebene Angelicasäure ist Tiglinsäure, die flüchtige Jatrophasäure (PELLETIER und CAVENTOU, BUCHNER) ist wohl kein Individuum. Sie soll mit der Crotonsäure (BRANDES) identisch sein (s. unten). Die Asche der Schalen beträgt 2,6%, die der bei 100° getrockneten Kerne 3% (FLÜCKIGER-HANBURY).
Das aus den Samen durch kalte Pressung der von der Schale befreiten Samen in Vorderindien gewonnene Crotonöl, Oleum crotonis, (Granatillöl, huile de croton, Croton oil, olio di crotontiglio, crotonolie, κροτωνέλαιον) ist gelb bis gelbbraun und enthält folgende Säuren teils frei, teils in Form von Glyceriden: Stearinsäure, Palmitinsäure, Myristicinsäure, Laurinsäure (SCHLIPPE), Valeriansäure, Buttersäure, Essigsäure (GEUTHER und FRÖLICH), Ameisensäure (SCHMIDT und BERENDES), Ölsäure (? SCHLIPPE, BENEDICT-ULZER) und Tiglinsäure (nach SCHMIDT und BERENDES = Methylcrotonsäure von FRANKLAND und DUPPA), andere (GEUTHER, BUCHHEIM) geben auch Oenanthylsäure, Capronsäure, Crotonoleïnsäure (? ROBERT und SIEGEL) und höhere Glieder der Ölsäurereihe (SCHMIDT und BERENDES) an.
Beim Destillieren mit Soda entsteht Oenanthol (STILLÉ und MAISCH). Beim Stehen scheidet sich ein Stearin ab, an der Luft verdickt sich das Öl, bei der Elaidinprobe bleibt es flüssig (die Anwesenheit von Ölsäure ist also wenig wahrscheinlich, LEWKOWITSCH).
Das Öl zeigt folgende Konstanten (DULIÈRE, LEWKOWITSCH, JAVILLIER, WIJS): spez. Gewicht bei 15° = 0,9437 (bei 100°: 0,8874), bei einem Öl das zu 53,4% in Alkohol löslich war: 0,9375, bei einem zu 24,4% löslichen: 0,9428. Pharm. helv. IV: 0,940–0,950, D. A. V: 0,940–0,960. Oleum Crotonis, welches auf den Philippinen gepreßt worden war, zeigte ein geringeres spez. Gewicht und war von geringerer Reizwirkung als hier gepreßtes (GEHE 1898). Löslichkeit in Alkohol (92%): 1 : 63, Erstarrungspunkt −16° (SCHÄDLER), Brechungsexponent (bei 40°): 1,4710–1,4724 (Ph. helv. IV), Oleorefraktometerzahl bei 22°: +35, Säurezahl (nach BÜRSTYN): 21,8, bei gepreßtem Öl: 27,3, Verseifungszahl meist: 210,3 bis 215,6 (nach Ph. U. S. bis 218), Verflüssigung der Fettsäuren bei 16,4–16,7°, Hehnerzahl: 88,9–89,1, Reichert-Meißlzahl: 12,1–13,56, Jodzahl (nach 2 Stunden): 100,37–101,91 (nach 24 Stunden): 103,63–104,39 (DULIÈRE), 106,6–109,1 (WIJS), 101,7–104,7, selten 122,3 (LEWKOWITSCH), Acetylzahl des Öls: 38,64, Jodzahl der Fettsäuren: 111,23–111,76, Erstarrungspunkt der Fettsäuren: 18,6–19, Säurezahl derselben: 201 (BENEDIKT).
Das durch kalte Pressung erhaltene Öl stimmt ziemlich mit dem durch Petroläther extrahierten überein, dagegen unterscheiden sich die Öle, die durch heiße Pressung oder Ätherextraktion gewonnen wurden, ziemlich von jenen — schon in der Farbe. Folgende Tabelle läßt dies erkennen:
|
Durch Pressen
gewonnen |
Durch Äther
ausgezogen |
Durch Alkohol
(95%) ausgezogen |
Handelsware
|
|
|
Jodzahl (HÜBL)
|
109
|
108
|
92,2
|
—
|
|
Verseifungszahl
|
192,2
|
194,5
|
260,6
|
205,6
|
|
Säurezahl
|
27,3
|
30,9
|
60,1
|
—
|
|
Gefrierpunkt
|
−7°C
|
−7°C
|
−8°C
|
—
|
|
Ausbeute an Öl in %
|
12,5
|
38
|
12
|
—
|
[S. 583]
Durch Schütteln mit Weingeist wird das Öl in einen scharfschmeckenden, in Alkohol gehenden und einen fast geschmacklosen Anteil zerlegt (NIMMO 1823). In weniger als einem Teile absoluten Alkohol ist das gepreßte Öl löslich. Bei Zusatz größerer Mengen Alkohol tritt Scheidung ein. Beim Erhitzen auf 75° löst sich 1 Vol. Öl in 2 Vol. Abs. Alkohol (JAVILLIER). In 55–60 T. (36 SCHÄDLER) Alkohol löst es sich, wenn frisch, klar, ebenso in Äther, Chloroform, Schwefelkohlenstoff und flüchtigen Ölen. Es löst sich auch in Petroläther (Unterschied von Ricinusöl). Crotonöl wird durch Schwefelsäure braun. Beim Behandeln mit kolloiden Metallen der Platingruppe geht Crotonöl in einen rötlichen, nicht mehr wirksamen Talg über, der bei 49–51° schmilzt (PAAL und ROTH).
Crotonöl zeigt sowohl hautreizende, wie abführende Eigenschaften. BUCHNER und BRANDES schreiben die Wirkung der flüchtigen Crotonsäure (= Jatrophasäure PELLETIER, nicht = Crotonsäure SCHLIPPE) zu, deren Dämpfe heftig die Haut und die Schleimhäute reizen. SENIER glaubte (1883) den purgierenden Körper von dem hautreizenden, pustelerzeugenden trennen zu können, diesen in dem alkohollöslichen, jenen in dem alkoholunlöslichen Anteile des Öls suchen zu müssen (6 Öl + 7 Alkohol), aber es ist noch heute fraglich, ob nicht beide Wirkungen auf die gleiche Substanz zurückzuführen sind. BUCHHEIM (1873), sowie KOBERT und HIRSCHHEIDT (1888) hielten die ölige Crotonölsäure für die wirksame Substanz des Crotonöls, die nicht als Glycerid, wohl aber als freie Säure sowohl haut- wie darmreizende Wirkung besitzen sollte. Diese Säure ist aber sicher ein Gemisch, wohl einer harmlosen Fettsäure mit einer sehr giftigen harzartigen Substanz. Also nicht die Crotonölsäure (C10H18O3, SIEGEL) bzw. das zu 4% angegebene Crotonol [C9H14O2 (?), SCHLIPPE] ist der wirksame Bestandteil, sondern vielleicht ein in ihr enthaltener harzartiger Körper, der durch Soda verändert wird. Diese blasenziehende Substanz nennen DUNSTAN und BOOLE, die die Crotonölsäure als ein Gemisch betrachten, Croton resin. Sie geben ihr die Formel (C13H18O4)2 bzw. C26H36O8 und halten sie für ein Lakton komplizierter Struktur. Sie bildet ein gelbliches, amorphes, in Wasser unlösliches Harz, ist also auch wohl noch kein reiner Körper. Bemerkenswert ist, daß die oben genannten Toxalbumine in das Öl übertreten, so daß auch sie an der giftigen Wirkung des Öls beteiligt sein können. Der giftige Bestandteil ist also noch nicht mit Sicherheit ermittelt. Die älteren Forscher sahen ihn in einer flüchtigen Substanz und in der Tat reizen die Dämpfe erhitzten Crotonöls die Haut und die Schleimhäute heftig.
Lit. BRANDES, Chem. Unters. d. Samen v. Croton Tigl. Arch. Pharm. 1823, 173 (dort die ältere Lit.). — WEPPEN, Lieb. Ann. 76 (1849), 254. — BUCHNER, Leichte Darstell. d. Jatrophasäure. Rep. d. Pharm. 19, 185. — TUSON, Journ. chem. soc. 1864, 195. — DUNLAP u. SEYMOUR, Journ. am. chem. soc. 1905, 935. — SCURTI u. PAROZZANI, Gazz. chim. ital. 1907, I, 476 u. 486. — STILLMARK, Arbeit. d. pharmak. Inst. Dorpat III, 1889. — HIRSCHHEIDT, Ebenda IV, 1890. — SIEGEL, Ebenda. — ELFSTRAND, Über giftige Eiweiße, Upsala 1897 (Jahresb. d. Pharm. 1897, 105). — BRAUN, Crolin. Ber. d. chem. Ges. 1903, 3004.
Öl: PELLETIER u. CAVENTOU, Nouv. journ. de méd. 2 (1818), 172 (Journ. pharm. 4). — SCHLIPPE, Lieb. Ann. 35 (1840), 307 u. 105 (1858) 1 (Wittsteins Vierteljahrsschr. 1858). — BUCHHEIM, Über die scharfen Stoffe. Vierteljahrsschr. 22 (1873), 485. — E. SCHMIDT u. BERENDES, Z. Kenntn. d. flücht. Säuren d. Crotonöls. Lieb Ann. 191 (1878) 94. — E. SCHMIDT, Ber. d. chem. Ges. 1877, 835. — FRANKLAND u. DUPPA, Lieb. Ann. 136, 9. — GEUTHER u. FRÖLICH, Über d. flücht. Säur. d. Crotonöls. Zeitschr. f. Chem. N. F. 6 (1870), 26 u. 549. — SENIER, The purgative princ. of croton oil und the vesicating principle of croton oil. Pharm. Journ. 1878, 8, 705 und 1883, 14, 446. — ZINNEL, Am. journ. pharm. 1890, 122. — ROBERT und SIEGEL, Bull. of pharm. 1893. — WARRINGTON, Pharm. Journ. 6 (1865), 382. — SOUBEIRAN, Nouv. trait. de pharm. II, 54. — KOBERT, Chem. Zeit. 1887, 416. — DUNSTAN and BOOLE, Croton oil an enquiry into the nature of its vesicating constituent. Pharm. Journ. 1895, 45, 5 (Proc. Roy.[S. 584] Soc. 1895, 238). — JAVILLIER, Note sur l’huile de croton. Journ. pharm. 1898, 7, 524. — PAUL und ROTH, Ber. d. chem. Ges. 1909, 1541. — DULIÈRE, Ann. pharm. Louvain 1899, 229. — BENEDIKT-ULZER a. a. O. — LEWKOWITSCH a. a. O. — SCHÄDLER a. a. O.
Anwendung. Das Crotonöl wird gewöhnlich zu den drastischen Abführmitteln gerechnet, da schon ein Tropfen (= 0,022 g. 45 gtt. = 1 g) starke Abführwirkung hervorruft (dos. max. 0,05!). Es gehört aber nicht eigentlich zu diesen. Denn die Wirkung ist die Folge einer Vergiftung durch einen außerordentlich heftig wirkenden, auf der Haut Blasen ziehenden Stoff, der selbst die Verwendung des Öls als Pruriginans (Vesicans, Rubefaciens), wozu es bei der berüchtigten BAUNSCHEIDTschen Behandlungsmethode (neben Euphorbium und Daphne Mezereum) benutzt wird, nicht empfehlenswert erscheinen läßt. Das Malefizöl des Pfarrers KNEIPP ist ein Gemenge von 1 T. Crotonöl und 6 T. Mandelöl. Fast alle Jahr hört man von bedenklichen Vergiftungen durch Crotonöl. Die Substanz sollte aus den Pharmakopoeen gestrichen werden. Ärzte bedienen sich ohnehin seiner kaum noch, nur in der Tierheilkunde wird es bei uns noch benutzt. Doch wird es von den Ärzten und dem Volke in Indien in mannichfacher Weise innerlich und äußerlich auch heute noch angewendet (Dict. econ. prod. of India), z. B. zur Herstellung des «poma cathartica» (aus Orangen). Auch die Anwendung des Crotonöls als Diureticum und Bandwurmmittel ist zu widerraten, da wir für beides bessere Mittel genug besitzen. Die Angabe von RADZIEJEWSKI (Arch. f. Anat. Phys. u. wissensch. Med. 1870, 37), daß Crotonöl auch in die Haut eingerieben und in die Venen eingespritzt, drastisch wirke, hat keine Bestätigung erfahren (BUCHHEIM). Beim Menschen können schon vier Samen tödlich wirken. In Frankreich ist 1901 eine Verfälschung der Jodtinktur mit Crotonöl beobachtet worden (DURIEN). Der von Fett und dem giftigen Prinzip befreite, sehr eiweißreiche Preßkuchen wird von BURKILL (Ann. Rep. Indian Museum Calcutta 1908) als Diabetikernahrung empfohlen.
Lit. KOBERT, Pharmakotherapie. — PEREIRA, Heilmittellehre. — DURIEN, Bull. sc. pharm. 1901. — AINSLIE, Mat. med. — Pharmacogr. indica.
Das weiße Holz des Stammes — Lignum Pavanae, Panavae seu moluccanum — schmeckt ebenfalls scharf und brennend und wirkt wie der Same, doch milder. Die Wurzel wird in der Heimat der Pflanze gegen Wassersucht angewendet. Sie purgiert wie auch die Blätter.
Prüfung. Pharm. helvet. IV verlangt ein spez. Gewicht von 0,940–0,950. Ein Tropfen Crotonöl sinke in einer Mischung von 5,2 ccm Weingeist (90 vol. %) und 4,8 ccm Wasser unter und steige nach Beimischen von 1,4 ccm Wasser an die Oberfläche. 2 ccm Öl mit 1 ccm rauchender Salpetersäure und 1 ccm Wasser kräftig geschüttelt, dürfen nach einem Tage keine festen Ausscheidungen zeigen oder ganz erstarren. Das Verlangen (z. B. der Pharm. brit), das Öl solle neutral sein, ist schwer zu erfüllen. Die Handelsöle geben stets eine Säurezahl. Die Anwesenheit von Ricinusöl im Crotonöl verrät sich durch höheres spez. Gewicht, niedrigere Jodzahl und beträchtlich höhere Acetylzahl. PECKOLT beobachtete das Curcasöl (s. unten) als Verfälschungsmittel. Crotonöl soll sich in 5 T. (Ph. helv. IV) bzw. 2 T. (D. A. V) abs. Alkohol bei Erwärmen lösen. Wird das Öl nicht in möglichst gefüllten Flaschen vor Licht geschützt, aufbewahrt, so wird es rasch braun.
Paralleldrogen. Ähnlich werden in Indien die Samen von Croton polyandrus ROXB. (Baliospermum montanum MÜLL.-ARG.) und von Croton oblongifolius ROXB., die Kowli seeds, benutzt (FLÜCKIGER-HANBURY) und, wie es scheint, auch die Samen von Croton oblongifolius THWAITES (C. persimilis MÜLL.-ARG.), wenigstens fanden sich solche 1896 im Handel (GEHES Handelsbericht, HARTWICH). Die Samen von Croton Pavana (oder Parana) HAMILTON sollen fast noch heftiger als Crotonsamen wirken. (Einige betrachten C. Pavana aber als Synonym mit C. Tiglium.) Über weitere Crotonarten vgl. TSCHIRCH in Realenzyklop. d. Pharmac. IV, 178. SEMLER a. a. O., Dict. ec. prod. India und DRAGENDORFF, Heilpflanzen. Über die brasilianischen Crotonarten und ihre Verwendung PECKOLT, Ber. d. pharm. Ges. 1905. Die Samen von Croton purgans MED. (Jatropha Curcas L.), die besonders von den portugiesischen Kolonien und den Capverden kommen, wo die Pflanze Heckenpflanze ist (sie stammt aus Westindien und Neugranada), enthalten ein Öl (Curcasöl, Purgiernußöl, huile de Pignon d’Inde, Curcas Oil, Purgingnut Oil, Physicnut Oil, olio di Curcas), das 10% feste Fettsäuren enthält und dessen[S. 585] flüssige Fettsäuren etwa zu gleichen Teilen aus Ölsäure und Linolsäure bestehen. Auch die Öle der Samen von anderen Euphorbiaceen, wie Anda Gomesii JUSS., Hura crepitans L., Aleurites triloba FORST. wirken abführend (BUCHHEIM).
Lit. GEHE, Handelsbericht 1896. — HOOPER, Crot. oblongifol. in Burma. Pharm. journ. 1904, 956. — KLEIN, Zeitschr. angew. Chem. 1898, 548.
Geschichte. Die Crotonsamen waren den alten indischen Ärzten wohl bekannt und werden in den Sanskritwerken unter den Namen Jayapala, Tittiriphala und Kanakaphala erwähnt. In Bhavaprakasa wird eine Arzneimischung Mahanaracha rasa beschrieben, die besonders aus Myrobalanen, Pulpa cassiae, der Rinde von Baliospermum axillare und Picrorhiza Kurrova, dem Milchsaft von Euphorbia neriifolia, der Wurzel von Ipomoea Turpethum, den Knollen von Cyperus rotundus und Crotonsamen bereitet wird (Pharmacogr. indica). Nach Persien gelangten die Samen von China, hießen daher Hab-el-khatai (Samen aus Kathay). Crotonsamen waren den alten Arabern bekannt und gelangten durch sie in die europäische Medizin. SERAPION (I, S. 644), AVICENNA und IBN BAITHAR (I, S. 610) gedenken ihrer und der Benutzung als Purgans. Bei SERAPION heißen sie Cataputhia minor = mendana, bei IBN SINA dand el sini, auch dend oder dende, dend auch bei IBN BAITHAR, der ABU CHORAIDSCH, HONAIN, RHAZES u. and. zitiert. RHAZES, der indischen und chinesischen dend unterscheidet, sagt bereits: «Wenn dieses Arzneimittel nicht mit großer Umsicht genommen wird, so hat es tödliche Wirkung.» Crotonsamen sind seit 1578 in Europa bekannt, in welchem Jahre sie CHRISTOVAL ACOSTA im Tractado (I, S. 738) als Piñones de Maluco (pini nuclei malucani) beschrieb und die Pflanze abbildete. Er sagt von den Samen «tambien las buenas mugeres de aquellas partes, amigas de sus maridos, les dā hasta quatro destos por la boca, para embiar a los pobretos al otro mundo» (HANBURY). Croton findet sich auch bei CORDUS (I, S. 798). Die Pflanze wurde dann auch im Hortus Malabar. (I, S. 898) und in RUMPFS Herbar. amboinense t. IV p. 48–42 beschrieben und abgebildet. In BURMANNS Thes. zeylanic. heißt sie Ricinoides indica folio lucido, fructu glabro grana Tiglia officinis dicto. Weitere Beschreibungen finden sich bei DALE, (I, S. 938), in TRILLER, Dispens. pharmac. univers. 1764, bei GEOFFROY (GARSAULT bildet sie ab), POMET u. and. Die Samen, im XVII. Jahrh. offizinell und viel benutzt, wurden dann obsolet und erst wieder beachtet, als 1812 WHITE und MARSHALL, die ihre Anwendung von einem Parsen gelernt, in AINSLIES Mat. med. of Hindoostan auf sie hinwiesen und das Öl, das schon BORELLUS 1657 beschrieb, durch die englisch-indischen Ärzte (CONWELL, PERRY, FROST u. and.) empfohlen wurde (HANBURY). Namentlich CONWELLS Schrift Recherches sur les propr. méd. et l’emploi en méd. de l’huile de Croton Tiglium 1824 und WILSONS Empfehlung in den Transact. of the med. and phys. soc. of Calcutta I, 249 trugen viel zur Einführung des Öls bei, so daß Oleum Tiglii in die Londoner Pharmakopoëe 1824 und die U. S. Pharm. 1830 aufgenommen wurde. Die äußerliche Anwendung datiert besonders von BAMBERGERS Schrift De olei crotonis externe adhibiti efficacia Berolin. 1833. Eine Zusammenstellung dir älteren medizin. Literatur bei BRANDES im Arch. d. Pharm. 1823.
Zu den halbtrocknenden Ölen der Baumwollsamenölgruppe gehören ferner folgende Samenöle:
- Leindotteröl, deutsches Sesamöl von Camelina sativa.
- Kleesamenöl von Trifolium pratense und repens.
- Sojabohnenöl von Soja hispida.
- Kürbissamenöl von Cucurbita Pepo.
- Wassermelonenöl von Cucumis Citrullus.
- Melonenöl von Cucumis Melo.
- Maisöl von Zea Mais.
- Daphneöl von Daphne Gnidium u. and. Daphnearten.
- Weizenkernöl von Triticum vulgare u. and.
- Daturaöl von Datura Stramonium.
- Bucheckernöl von Fagus silvatica.
- Kapoköl von Eriodendron anfractuosum.
- Citronenkernöl von Citrus Limonum RISSO.
- Schwammkürbisöl von Luffa aegyptiaca.
- Paranußöl von Bertholletia excelsa.
- Sorghumöl von Sorghum cernuum.
- Coumonöl, Patavaöl von Oenocarpus batana und bacaba.
- Pinotöl, Parapalmöl, Parabutter von Euterpe oleracea.
[S. 586]
Semen Rapae und Oleum Rapae.
Rübsen und Rapssamen — Rüböl.
Stammpflanzen und Systemat. Stellung. Brassica campestris L. (B. Rapa L., B. asperifolia LAM.). Der Rübsen, Rübenkohl mit der var. annua KOCH. (B. R. oleifera annua METZG., B. R. ol. praecox DC., B. campestr. KOCH, B. praecox KITAIBEL). Sommerrübsen, Sommerlevat und der var. β oleifera Dc. (B. Rapa oleifera Dc., B. R. ol. biennis METZG., B. R. ol. hiemalis MARTENS), Winterrübsen, Wintersaat, Rübsaat, Bivitz, Awehl, Navette.
Brassica Napus L. Der Raps, Reps, Rapskohl mit der var. annua KOCH (B. N. oleifera annua METZG., B. N. oleifera praecox RCHB.), Sommerraps, Sommerkohlsaat und der var. β oleifera DC. (B. N. oleifera biennis RCHB., B. N. ol. hiemalis DÖLL), Winterraps, Winterkohlraps, Setzölsamen, Ölraps. — Napus, νᾶπυ, ist wahrscheinlich ein ägyptisches Wort.
Cruciferae Sinapeae Brassicinae (Brassica), Sectio Eubrassica PRANTL.
Der Großhandel unterscheidet europäische Colza (von in Europa kultiviertem Raps und Rübsen) und indische Colza. Diese letztere stammt von verschiedenen Cruciferensamen und ist oft ein Gemenge, in dem Sinapis glauca, Brassica juncea, S. dichotoma und Eruca sativa dominieren (BURCHARD und KJAERSKOU). Die Colza de Guzerat, Cawnpore gelb und Calcutta weiß besteht aus einer gelben und einer braunen Varietät von Sinapis glauca, Colza Cawnpore braun, Calcutta braun, Ferozépore und Pondichéry aus Brassica juncea und dichotoma mit etwas Eruca sativa. In der Colza bigarré von Bombay finden sich alle vorgenannten Samen.
Andere Sorten, die als ostindischer Raps gehen, sind: Lalka-Tora, Piarka-Tora, Natua-Sarson, Ulti-Sarson, Jauda-Sarson, Seti-Sarishá, Makhan-Dhana-Sarisha und Rai. Rai wird von Brassica juncea HOOK. f. et THOMS, Sarson von B. glauca ROXB., Tori von B. Napus L. var. dichotoma PRAIN abgeleitet (PRAIN, WITTMACK).
Beschreibung der Pflanzen und der Samen. Der Rübsen ist eine ein- (annua) oder zweijährige (hiemalis) Pflanze mit aufrechten, bis 1,25 m hohem, meist ästigem Stengel, grasgrünen, gestielten, leierförmig-fiederspaltigen, beiderseits steifhaarigen Grundblättern und blaugrün bereiften, unten leierförmig-gezähnten, oben mit tief-herzförmigem Grunde stengelumfassenden, ganzrandigen Stengelblättern. Blütentraube während des Aufblühens flach, die Knospen von den obersten, geöffneten, mittelgroßen, goldgelben Blüten überragt. Kelchblätter zuletzt wagerecht-abstehend, die kürzeren Staubfäden abstehend. Schoten auf abstehenden Fruchtstielen linealisch, allmählich in einen konischen Schnabel verlängert, fast aufrecht, holperig. Samen einreihig, kugelig, grubig punktiert.
Der Raps hat lauter blaugrüne Blätter, die Grundblätter leierförmig-fiederspaltig, die unteren stengelständigen leierförmig, die oberen länglich. Blütentraube schon während des Aufblühens verlängert, Knospen die obersten geöffneten, mittelgroßen, goldgelben Blüten überragend. Kelchblätter zuletzt aufrecht-abstehend. Schoten samt Fruchtstielen abstehend.
Die Samen des Rübsen messen 1–1,5 mm im Durchmesser. Ihre vorwaltend dunkelrot- bis schwärzlich-braune Oberfläche ist, mit der Lupe betrachtet, fein- oder flach-netzrunzelig (feiner als beim schwarzen Senf) und feinkörnig. Die Samen des Raps sind größer, c. 2 mm, bläulich-schwarz, wie bereift. Es gibt außer den braunen auch helle Spielarten. 1886 kam unter dem Namen «Gelbsaat» ein weißer Rapssamen in den Handel, der als weißer Senf ausgegeben wurde (STEFFECK). Die Sommervarietäten blühen im Juli-August, die Wintervarietäten im April-Mai des zweiten Jahres.
PATHOLOGIE. Über die pflanzlichen Schädlinge berichtet Prof. ED. FISCHER: Die wichtigsten Erkrankungen der Raps- und Rübsenpflanzen sind folgende: In den Wurzeln, besonders der rübenbildenden Varietäten, siedelt sich der Myxomycet Plasmodiophora Brassicae an, der die als «Kropf» oder «Hernie» bekannten Geschwülste bedingt. Der sog. «Rapskrebs» wird von einer Sclerotinia hervorgerufen, welche im Mark und Rindengewebe des Stengels ihre kleinen, schwarz berindeten, knöllchenförmigen Sclerotien bildet. — Verschiedene Pilze siedeln sich auf den Blättern an: die beiden auf Cruciferen verbreiteten Peronosporeen Albugo candida und Peronospora parasitica, erstere kleine milchweise Epidermisauftreibungen, letztere einen weißlichen Schimmelanflug bildend; beide können auch auf die jungen Schoten übergehen. Blattflecken werden hervorgerufen von Sphaerella brassicicola, Phyllosticta Brassicae und Napi, Cercospora Bloxami. Einer der schädlichsten Parasiten ist der «Rapsverderber» Alternaria Brassicae (BERK) SACC. (Polydesmus exitiosus KÜHN). Er ruft die sog. Schwärze hervor, welche darin[S. 587] besteht, daß auf den Blättern und besonders auch auf den Schoten kleine schwarzbraune Flecken auftreten, dann aber auch das umgebende Gewebe vertrocknet. Auf Brassica Napus sind endlich auch Bakterienkrankheiten beschrieben worden: die eine derselben wird als Weißfäule bezeichnet, die andere ist die sog. Braunfäule, welche sonst hauptsächlich auf Brassica campestris vorkommt. (Näheres vgl. in SORAUERS Handbuch der Pflanzenkrankheiten 3. Aufl., Bd. 2, p. 47 ff.)
Über die tierischen Schädlinge berichtet Herr ISRAËL:
An Brassica oleracea L., Napus L., nigra KOCH, Sinapis, Raphanusarten und verwandten Pflanzen leben sehr viele Insektenarten. Es seien erwähnt:
Käfer: Haltica oleracea L., flexuosa ILL., nemorum L., Psylliodes chrysocephala L. schädlich an Brassica- und Sinapisarten. Meligethes aeneus FABR. Die Larven dieses Käfers, die in den Schoten leben, verwüsten oft ganze Rapssaaten. Der Käfer frißt Blätter und Blüten. Balaminus brassicae FABR. und andere schwer bestimmbare Balaminusarten leben als Larven in den Schoten von vielen Cruciferen und anderen Pflanzen. Baridius chloris. FABR. und andere Baridiusarten leben in den unteren Stengelteilen von Brassica Napus usw. Ceutorhynchus erysimi FABR. floralis PAYK., sulcicollis GYLL. und viele andere Glieder der sehr artenreichen Centorhynchusgattung leben auf Raps und anderen Cruciferen, die Larven in den Stengeln oder Früchten. Sulcicollis erzeugt an den Wurzeln Coleopterocecidien (Wurzelgallen).
Falter: Pieris brassicae L., Rapae L., Napi L. Raupen an Brassicaarten usw. Agrotis segetum W. V. Raupen nicht nur an Getreidewurzeln, sondern auch an denen des Rapses und anderer Pflanzen. Mamestra brassicae L., oleracea L. und sehr viele andere Eulenraupen leben an allen möglichen Kohlarten. Botys extimalis SC. Die Raupe dieser Pyralide lebt in den Schoten des Rapses und Rettigs usw.
Fliegen: Sargus formosus SCOP., Tipula oleracea L., Ocyptera brassicaria FABR. Die Larven dieser Fliegen leben in den Knollen von Brassica usw. Anthomyia brassicae BOUCHÉ, Larve in den Stengeln von Kohlarten. Cecidomyia brassicae WINN., Larve in den Schoten von Brassica- und Sinapisarten.
Kultur und Handel. In Europa werden Raps und Rübsen, die wohl aus Südeuropa stammen, besonders in Deutschland, Rußland, Ungarn, England und Italien, in Frankreich und Belgien besonders Winterraps gebaut. Es sind die bei uns am meisten kultivierten Ölpflanzen. Raps liebt ein gemäßigtes, mehr warmes und feuchtes Klima, Rübsen gedeiht auch in trockenem, rauhem Klima auf leichterem Boden, liefert aber 10% weniger Ertrag. Die indische Colza wird in den Nordwestprovinzen, Pendschab, Cawnpore, Guzerat, Calcutta und Bombay, gebaut.
Die Ausfuhr von Rapssamen (rape) aus Ostindien betrug 1908/9: 40064 cwts. Die Ausfuhr von Mustard- oder Rape oil betrug 1906/7: 273684 Gals, 1907/8: 273465 Gals, 1908/9: 170675 Gals.
Anatomie. Die Samenschale des Rübsen und Raps, die ähnlich der des schwarzen Senf (s. d.) gebaut ist, zeigt, von der Fläche betrachtet, bei schwacher Vergrößerung ein Maschennetz. Die verdickten Teile der radialen Sklereïdenwände erscheinen im Querschnitt ungleich hoch oder fast gleich hoch (ostind., die indischen Samen zeigen denn auch ein deutlicheres Maschennetz, KINZEL). Die schmale Schleimepidermis quillt nicht oder wenig. Die Samen umgeben sich daher, in Wasser geworfen, nur mit einer sehr schmalen Schleimhülle. Nur in der Höhe des verdickten Teiles der Sklereïden, dem Durchmesser und dem Rande derselben — ob gerade oder krumm — machen sich Unterschiede bemerklich (Details bei OLIVA). Das Lumen der Sklereïden erscheint, von der Fläche betrachtet, beim Rübsen enger wie beim Raps (HARZ). Eine Pigmentschicht ist deutlich. Die lappigen, Globoide führenden Aleuronkörner sind am größten bei den Solitären des Winterraps.
Chemie. Die Zusammensetzung der Samen ist im Durchschnitt:
|
Wasser
|
Stickstoff-
subst. |
Fett
|
Stickstofffreie
Extraktstoffe |
Rohfaser
|
Asche
|
|
|
Raps
|
7,28
|
19,55
|
42,23
|
20,78
|
5,95
|
4,21
|
|
Rübsen
|
7,86
|
20,48
|
33,53
|
24,41
|
9,91
|
3,81
|
|
Indian Rape
|
5,90
|
22,67
|
41,20
|
15,66
|
10,08
|
4,49
|
Bei der Spaltung des Glykosids entsteht hier Crotonylsenföl C4H7NCS (STEIN).
[S. 588]
Das Rüböl (Kohlsaatöl, Colzaöl, huile de colza, Rape oil, Colza oil, Olio di colza, Raapolie, κραμβέλαιον) wird meist nicht nach den Stammpflanzen als Rapsöl (huile de navette, Rape oil) und Rübsenöl (huile de rabette, Rubsen oil) unterschieden. Es wird in der Weise gewonnen, daß die Samen zwischen Walzen gemahlen werden und das Mehl gepreßt oder mit Schwefelkohlenstoff oder Petroläther extrahiert wird. Das extrahierte ist reiner, aber der Extraktionsrückstand ist nicht als Viehfutter oder doch nur in Mischkuchen zu verwenden. Die Samen enthalten 33–43 (resp. 50)% Öl. Beim Pressen erhält man 30–33% beim Winterraps, beim Rübsen 16–18%. Das rohe Öl ist dunkel. Es wird meist mit 1% Schwefelsäure raffiniert. Dies Öl ist hellgelb, riecht charakteristisch und schmeckt unangenehm herbe. In 100 T. Alkohol lösen sich 0,534 T. KÖNIG gibt die elementare Zusammensetzung des Rapsöls zu C = 77,91–78,20, H = 12,02–12,08, O = 9,72–10,07%, die des Rübsenöls zu C = 77,21, H = 13,36, O = 9,43% an. Rüböl enthält 1,02 (oder weniger) feste Fettsäuren (TOLMAN u. MUNSON), Arachinsäure und Lignocerinsäure (das Gemisch beider = rohe Arachinsäure [PONZIO, ARCHBUTT] oder Behensäure [REIMER und WILL]), von ungesättigten Fettsäuren: Erucasäure und Rapinsäure und wohl auch Säuren der Linol- und Linolensäurereihe. Das «Stearin» ist fast reines Trierucin (LEWKOWITSCH) bzw. Dierucin (REIMER und WILL). Das Unverseifbare bilden die Phytosterine: Brassicasterin (C28H46O) und Sitosterin (? WELSCH). Es beträgt 0,5–1%, selten mehr, nie über 2% (LEWKOWITSCH). Technisches Rüböl enthält freie Fettsäuren (0,7–6,64% auf Ölsäure berechnet). Europäische Rüböle zeigen, gleichviel welcher Provenienz, große Übereinstimmung. Die Unterschiede, die SCHÄDLER von den Ölen der vier Varietäten angibt, sind nicht durchgreifend, übrigens auch sehr gering. Das spez. Gew. ist = (0,9112) 0,9132–0,9175 (meist nicht über 0,916, LEWKOWITSCH), der Erstarrungspunkt liegt bei −4 bis −6°, die Verseifungszahl ist 167,7 (CROSSLEY und LE SUEUR) bis 179 (ALLEN), meist 171–176 (LEWKOWITSCH), die Jodzahl 98,1–103,6 (LEWKOWITSCH), selten bis 105, die Reichertzahl 0–0,79 (CROSSLEY), die Hehnerzahl 94,56–96,3, Maumenéprobe 49–64° C. Das ostindische Rüböl (Colzaöl) zeigt ein spez. Gew. 0,9141–0,9171, Verseifungszahl 169,4–173,4, Jodzahl 94,1–104,8, Reichert-Meißlzahl 0–0,79, Hehnerzahl 94,56–96,3, Säurezahl 1,42 bis 2,57 (CROSSLEY und LE SUEUR). Altes Rüböl zeigt hohe Acetylzahlen (14,7–41,7, GRIPPER). Die Fettsäuren zeigen den Erstarrungspunkt 17–18,5°, Schmelzpunkt 16–22°, Jodzahl 96,3 bis 105,6, Acetylzahl 6,3, die flüssigen Fettsäuren eine Jodzahl von 114,3–125,5.
Rüböl verdickt sich beim Stehen und wird ranzig, jedoch ohne zu trocknen. Es steht also zwischen den halbtrocknenden und den nicht trocknenden.
Die rohen Cruciferenöle sind alle schwefelhaltig (143–240 mgr S. im Liter Öl), jedoch sollen kaltgepreßte und gut raffinierte Rüböle keinen Schwefel enthalten, wohl aber bisweilen die mit CS2 extrahierten.
Verfälschungen. Rüböl wird mit Leinöl, Hanföl, Mohnöl, Leindotteröl, Baumwollsamenöl, Ravisonöl, Hederichöl, mit Fischölen und Tranen, Mineralöl, Harzöl und Walratöl verfälscht. Über deren Nachweis vgl. bei LEWKOWITSCH.
Anwendung. Rüböl wird besonders als Brennöl und Schmieröl, seltener als Speiseöl und zur Margarinebereitung und in der Pharmacie (als Olivenölersatz, wozu es nicht immer brauchbar ist) und zur Seifenfabrikation benutzt. Es ist schwer verseifbar und wird leicht ranzig. Rüböl wird viel als Wanzenvertilgungsmittel benutzt. (Wanzen werden durch jedes Öl fast sofort getötet: sie ersticken darin.)
Lit. PRANTL in ENGLER-PRANTL, Pflanzenfamilien. — LUERSSEN, Mediz. pharm. Bot. — HARZ, Landw. Samenk. — T. F. HANAUSEK in WIESNER Rohstoffe, II. Aufl. — OLIVA, Vgl. Anat. u. entwicklungsgesch. Unters. über d. Cruciferensamen (Bern 1905). Zeitschr. d. Österr. Apoth. Ver. 1905 (dort d. anatom. Detail m. Abbild.). — HARTWICH-VUILLEMIN, Beitr. z. Kenntn. d. Senfsam. Apoth. Zeit. 1905. — KÖNIG, Nahrungs- u. Genußm. — GROSS, Stud. über d. Rapspfl. Öster.-ung. Zeitschr. f. Zuckerind. 1900. — SCHRÖDER, Unters. d. Sam. d. Brassicaart. Landwirtsch. Versuchsstat. 14, 1871. — SEMPOLOWSKI, Diss. Leipzig 1874. — COLLIN-PERROT, Residus industriels (Anatomie und Zusammensetzung des Preßkuchen). — LEWKOWITSCH a. a. O. (dort d. chem. Liter.). — SCHÄDLER a. a. O. — MIKOSCH, Pflanzenfette in WIESNER Rohstoffe, II. Aufl. — STEFFECK, Landw. Versuchsstat. 33 (1886), 411. — WELSCH, Sterine. Diss. Freiburg i. B. 1909. — M. SCHMITT, Sind Rapskuch. infolge zu hohen Senfölgehalt. schädlich? Diss. Bern 1909 (dort d. Lit.).
[S. 589]
Die indischen Colzasorten bei BURCHARD, PRAIN und KINZEL, Journ. f. Landw. 1894 u. 1896.
Zu den halbtrocknenden Ölen der Rübölgruppe gehören ferner folgende Samenöle:
- Ravisonöl, Black sea rape oil von einer südrussischen wilden Varietät von Brassica campestris.
- Hederichöl von Rhaphanus Rhaphanistrum.
- Schwarzsenföl von Brassica nigra.
- Indian mustard oil von Brassica juncea.
- Weißsenföl von Sinapis alba.
- Jambaöl von einer Brassica-Varietät.
- Ackerrettichöl von Sinapis arvensis.
- Rettichöl von Raphanus sativus.
- Gartenkressensamenöl von Lepidium sativum.
- Leindotteröl von Camelina sativa.
- Rotrapsöl, huile de julienne von Hesperis matronalis.
- Das Ol. sinapis pingue aus holländ. schwarz. Senf ist ein gutes Öl für pharmazeutische Zwecke (SCHAUMANN, Ph. Zeit. 1910, 160).
- Die Cruciferenöle enthalten alle Erucasäure.
Die Gruppe des Arachisöls bildet den Übergang zu den nichttrocknenden Ölen.
Fructus Arachidis und Oleum Arachidis.
Syn. Erdnuß, Erdeichel, Erdmandel, Erdpistazie, Erdbohne, Schokoladenwurzel, Mandubibohne. Aschantinuß — pistache de terre, noix de terre, arachide — ground nut, pea nut, monkey nut, manila nut, earth nut, — grondnooten. In Brasilien: mundubi. Auf den Capverden: mancarra. In Spanien und Südfrankreich: cacahuete. In Indien: buchanaka (Sansk.), múng phali, viláyetí-múng (hind.). In China: loh-hwa-sang.
Beschreibung der Stammpflanze und der Droge. Die zu den Luguminosae — Papilionatae — Hedysareae — Stylosanthinae gehörige, nicht in Afrika (FLÜCKIGER, SCHWEINFURTH, WILLKOMM, PETERS), sondern in Süd-Amerika (Brasilien) einheimische, jetzt in vielen tropischen und einigen subtropischen Gegenden kultivierte, wild nicht bekannte, vielleicht eine Kulturform von Arachis prostrata darstellende Stammpflanze der Erdnuß, Arachis hypogaea L. Spec. plant. ed. I, 741 (A. asiatica LOUR.), ist ein einjähriges Gewächs, dessen Wurzeln zahlreiche stickstoffbindende Wurzelknöllchen bildet und bis 1 m lange, auf dem Boden ausgebreitete Stengel besitzt. Die verkehrt eiförmigen, stumpfen Fiedern der Blätter sind gewimpert. Die langgestielten, einzeln oder zu zweien in den Blattachseln stehenden gelben Blüten sind zweierlei Art. Die oberen sind unfruchtbar und fallen später ab, die in der Nähe des Bodens befindlichen dagegen fruchtbar. Nach der Befruchtung verlängert sich der Fruchtstiel, bisweilen bis auf 20 cm, und bohrt die junge Frucht in den Boden (Fig. 183). Hier, also unterirdisch, entwickelt sich die Frucht zur Reife (daher hypogaea und Erdnuß). Die Pflanze lockt in Indien zur Blütezeit große Mengen roter Ameisen an, die den Boden rings um die Pflanze auflockern und so das Eindringen der Fruchtknoten erleichtern (WATT, Dict. econ. prod.). In Spanien liefert eine Pflanze bisweilen 80–100 Früchte.
Die Hülsen liegen zur Reifezeit bis 10 cm unter dem Boden und müssen daher ausgepflügt oder ausgehackt werden. Sie sind einfächerig, enthalten aber bisweilen mehr wie einen (2–3, selten bis 5) Samen (Fig. 183, rechts) und sind alsdann zwischen diesen eingeschnürt. Auf der graugelblichen bis strohgelblichen Oberfläche sind die nicht aufspringenden, 2–4 cm langen, walzlichen Früchte mit Netzleisten versehen, die bei den Varietäten verschieden stark hervortreten, bei var. vulgaris z. B. oft verwischt, bei var. reticulata (Fig. 183) stark entwickelt sind, und in denen die von viel sklerotischen Fasern begleiteten Bündel liegen (MOELLER-WINTON). An der Spitze tragen sie eine Griffelnarbe (callus stigmatiformis).
Die Samen sind länglich-zylindrisch oder länglich-eiförmig, 6–18 mm lang, 3–6 mm breit, am einen Ende, dort wo Hilum und Radicula liegt, schief und kurz gescheitelt, am anderen (an der Chalaza) gewölbt oder schief abgeflacht (HANAUSEK). Unter der Spitze liegt der Nabel, von dem die Raphe zur Chalaza läuft. Hier gabelt sich das Bündel und seine sechs Äste kehren in der Samenschale in regelmäßigen Abständen zur Spitze zurück. Die nicht ablösbare braune Samenschale besitzt eine Epidermis, deren braune Zellen zahlreiche, von der Außenwand in das Lumen weit vorspringende gerade oder gekrümmte, schmale oder breite Zapfen zeigen, so daß sie, besonders von der Fläche betrachtet, ein sehr eigenartiges, für die Erdnuß charakteristisches, kammartig gezähntes Bild darbieten (Abbild. bei VOGL und HANAUSEK). Die breite Nährschicht besteht in ihren inneren Schichten aus einem obliterierten[S. 590] Sternparenchym, in dem die zahlreiche Spiralgefäße führenden Gefäßbündel verlaufen. Die innere Epidermis ist erhalten. An sie schließt sich eine schmale Schicht an, die als ein Nucellarrest betrachtet wird. Das Gewebe der dickfleischigen, leicht auseinander fallenden Cotyledonen ist von einer Spaltöffnungen führenden Epidermis bedeckt und besteht aus großen, relativ dünnwandigen, getüpfelten Zellen, die Interzellularen zwischen sich lassen und neben Ölplasma, 3–15 mik. große Stärkekörner und 4–13 mik. große, oft ziemlich unregelmäßige, globoidführende Aleuronkörner enthalten. Das Vorkommen von Stärke und Aleuron in derselben Zelle ist sehr charakteristisch für die Erdnuß.

Arachis hypogaea.
[Aus Sadebeck, Kulturgewächse der deutschen Kolonien.]
[S. 591]
Pathologie. Über die pflanzlichen Schädlinge berichtet Prof. ED. FISCHER: In Java, in Indien, in Deutsch-Ostafrika tritt eine Krankheit der Erdnuß auf, welche von Septogloeum Arachidis RACIBORSKI hervorgerufen wird. Die Blätter bekommen dunkle, gelbumsäumte Flecken und fallen dann ab, die Früchte schrumpfen zusammen und werden wertlos. Weniger wichtig sind andere auf den Blättern auftretende Parasiten: Cercospora personata (BERK. et CURT.) ELL., Puccinia Arachidis SPEG. und Uredo Arachidis LAGH. — Sehr verderblich ist nach KAROSEK (Gartenflora 1904) in Deutsch-Ostafrika eine der Mosaikkrankheit des Tabaks ähnliche Erkrankung (ZIMMERMANN, Pflanzer 1907). Einer anderen gedenkt Braun (a. a. O.).
Kultur und Handel. Arachis hypogaea gehört zu den wichtigeren Kulturpflanzen der Tropen, die nicht allzu große Ansprüche stellt und einen leichten aber kalkhaltigen (SADEBECK 1877) Boden, sowie viel Wärme verlangt. Trockner Sand gibt die hellsten, humusreicher, feuchter Boden dunkle Samen. Die Samen keimen nach 8–14 Tagen, die Früchte sind nach 4–5 Monaten reif. Das Enthülsen der Samen geschieht bei großen Betrieben (z. B. in Amerika) mit Maschinen. Die Fruchtschalen dienen als Brennmaterial. Der Versand geschieht in Säcken. Im Kleinbetrieb liefert der Hektar 1500–1800 kg, im Großbetrieb viel mehr. Das wichtigste Exportland ist Westafrika, besonders die französischen Kolonien. Senegambien liefert aus dem Norddistrikt (Rufisque, Cayor, Galam) die besten, weniger gute aus dem Süden (Kapamanze), die schlechtesten kommen aus Sierra Leone und Lagos. Man unterscheidet die guten Cayor- von den weniger gutes Öl gebenden Galam-Nüssen. Ausfuhrplätze sind: Galam, Cayor, Rufisque, Gorea, Albreda, Gambia, Sedhiou, Carabana, Casamance und Rio Nunez. Ferner liefert der Sudan, die Gegend des Tsadsees, Darfur, die Mombattuländer, Ostafrika, Sansibar, Mosambique viel Erdnüsse. Sehr bedeutend sind die Kulturen in Ostindien (Coromandel, Madras, Südindien, Bengalen, Bombay), Franz.-Indien und in Nordamerika (Virginien, Georgia, Tennessee, Nord-Carolina), wo die Kulturen bis 40° n. B. reichen, geringeren Umfang haben sie in Cochinchina, Burma, China, Japan und den Sundainseln, sowie den Antillen, Mexiko, Brasilien, Argentinien, Portugies. Ost- und Westafrika und den deutsch-afrikanischen Besitzungen (Togo, Kamerun, Deutsch-Ostafrika). Relativ unbedeutend sind sie in Ägypten, Tunis, Algier, Spanien, Portugal, Südwestfrankreich und Unteritalien. Aus den Tropen gelangen nach Europa meist die ungeschälten Erdnüsse, da die geschälten leicht verderben, schimmeln und ranzig werden. Haupteinfuhrhäfen sind Marseille, Hamburg, London, Liverpool, Rotterdam und Triest.
Die Produktion an Erdnuß ist enorm. Indien allein exportierte 1907/08: 1524055, 1908/09: 1513364 cwts groundnuts und 1908/09: 93034 gals groundnut oil. Nordamerika 1907: 6386012, 1909: 5501107 lbs peanuts. Frankreich importierte 1901: 120400208 kg graines d’arachides entières und 58132221 kg Arach. décortiquées, Marseille 1908: 85,6 Mill. kg A. décort. und 102 Mill. kg A. ent. Die Ölmühlen Frankreichs verarbeiten jährlich mehr wie 100000 t Erdnüsse (COLLIN). Deutschland importierte 1910: 69,13 Mill. kg, Hamburg 1909: 19,54 Mill. kg Erdnüsse.
Chemie. Geschälte Erdnüsse (d. h. die Samen) enthalten im Mittel in Prozenten: Wasser 7,48, Stickstoffsubstanz 27,52, Fett 44,49, stickstofffreie Extraktstoffe 15,65, Rohfaser 2,37, Asche 2,49 (in der Trockensubstanz 48,09% Fett). Der Eiweißgehalt übertrifft den der Erbse und Bohne. Erdnüsse enthalten viel Stärke (s. oben), 4–5% der Stickstoffsubstanz sind in Form von Amiden vorhanden. Nachgewiesen ist darin Vernin (im Embryo) und Arginin (SCHULZE und CASTORO), Cholin, Lecithin, Conglutin (RITTHAUSEN), von Enzymen besonders eine sehr aktive Lipase (DUNLAP und SEYMOUR), Saccharose (BURCKHARD), angeblich auch ein nicht giftiges Alkaloid (Arachin — vielleicht Cholin?). Der Pentosangehalt beträgt 4,12% (WITTMANN). Apfelsäure (PAYEN und HENRY) ist zweifelhaft.
Der Ölgehalt des Samens schwankt außerordentlich. Tropische Erdnüsse enthalten bis 55, subtropische oft nur 20%. SADTLER fand in Erdnüssen vom Senegal 51, vom Kongo 49, von Ostafrika 49, von Bombay 44, von Madras 43, von Amerika 42% Öl. 43 bis 45% sind Durchschnittszahlen. Das Öl wird in hydraulischen Pressen zunächst zweimal kalt, dann warm abgepreßt — oft in den gleichen Pressen wie Sesamöl. (Es gibt daher bisweilen schwache BAUDOUINsche Reaktion!) Nur das erste, helle, kalt geschlagene Öl ist zu pharmazeutischen Zwecken und als Speiseöl brauchbar. Das Öl wird in den Produktionsländern (Indien, Westafrika), aber auch in Südfrankreich (z. B. Marseille) und Deutschland (Harburg) gepreßt. Das Öl von Rufisque und Gambia gilt als besser als das von Bombay und Coromandel.
[S. 592]
Das Erdnußöl, Oleum arachis (huile d’arachide, arachis oil, peanut oil, earthnut oil, olio di arachide, aardnoten olie, ἀραχέλαιον, in Indien: katchung oil), setzt beim Erkalten eine kristallinische Masse ab (margarine d’arachide). Die festen Fettsäuren bestehen aus Arachinsäure (ALLEN, GÖSSMANN), Lignocerinsäure (KREILING), Stearinsäure (HEHNER und MITCHELL) und vielleicht auch Palmitinsäure (CALDWELL) — der Gehalt an Arachinsäure beträgt c. 5% (4,5–5,5) —, die flüssigen aus Ölsäure, Hypogaeasäure (GÖSSMANN und SCHEVEN, SCHRÖDER, HAZURA), Linolsäure (HAZURA und GRÜSSNER). Die kalt geschlagenen Öle enthalten nur geringe Mengen freier Fettsäuren, die technischen Öle mehr (indische bis 16,5%, CROSSLEY und LE SUEUR). Arachisöl kann durch Abscheidung der krist. Arachinsäure (d. h. roher, mit Lignocerinsäure vermischter) identifiziert und quantitativ in Ölgemischen bestimmt werden (RENARD, LEWKOWITSCH, TORTELLI-RUGGERI, KREIS — Vorschrift in Pharm. helv. IV). Verseift man das Öl mit alkoholischer Natronlauge, verjagt den Alkohol, scheidet die Fettsäuren mit Salzsäure ab und löst diese in siedendem Alkohol, so scheidet sich die Roharachinsäure in perlmutterglänzenden Kristallen (F. = 70–71°) ab. Erdnußöl gibt die BELLIER-Reaktion (Resorcin-Benzol + HNO3, spez. Gew. 1,4).
Das spez. Gewicht des Öls beträgt: 0,911 (afrikan. Öl) bis 0,9256 (ostind.) — Pharm. helv. IV verlangt 0,917–0,921 bei 15° und 0,864–0,865 bei 98° —, der Erstarrungspunkt −2,6 bis +3°, die Verseifungszahl 185,6–194,8 (CROSSLEY und LE SUEUR), die Jodzahl 83,3–105 — Pharm. helv. IV verlangt 85–100 — (meist 90–96), die Reichert-Meißlzahl 0–1,60, die Hehnerzahl 94,87–96,31, die Maumenéprobe ergab 45,5–75°, der Brechungsexponent ist bei 40° 1,4626–1,4642 (Ph. helv. IV).
Der Erstarrungspunkt der Fettsäuren liegt bei 22–32,5°, ihr Schmelzpunkt bei 27–35°, die Jodzahl ist 95,5–103,42, die Jodzahl der flüssigen Fettsäuren 104,7–128,5 (vgl. bei LEWKOWITSCH). Nach vierstündigem Einlegen in konzentriertes Kali, dem konz. Ammoniak zugesetzt wurde, entstehen im Öltropfen kurze, in halbkonzentriertem lange, gebogene, oft lockenförmig gekrümmte Nadeln — für dies Öl sehr charakteristisch —, nach 24 Stunden auch Sphaerite (HARTWICH-UHLMANN).
Erdnußmehl (Erdnußgrütze) enthält im Mittel in Prozenten: Wasser 6,67 (6,26), Stickstoffsubstanz 48,92 (47,46), Fett 14,61 (17,50), stickstofffreie Substanz 22,99 (21,01), Rohfaser 3,91 (3,90), Asche 4,90 (3,87) (KÖNIG).
Erdnußschalen enthalten nur 5,68% Stickstoffsubstanz und 2,5% Fett, aber 53,2% Rohfaser.
Anwendung. Die schwach gerösteten Erdnußsamen schmecken ähnlich wie Mandeln und werden, ebenso wie die rohen, in den Tropen (Brasilien, Indien, Afrika), aber auch neuerdings in Europa viel gegessen. Sie sind jetzt regelmäßig in «Südfruchthandlungen» neben Feigen und Datteln zu finden. Frisch haben sie einen nußartigen Geschmack. Reichlicher Genuß von Erdnüssen soll Kopfweh verursachen (?). Unter dem Namen Austria-Bohnenkaffee, wie afrikanischer Nußbohnenkaffee, kommen die durch Pressen von einem Teile des Öls befreiten, aber immer noch c. 17 (WILLERT), 19 (RÖHRIG, VOGL) oder gar fast 28% Fett zurückhaltenden gerösteten Samen in den Handel (Beschreibung bei VOGL). Sie sehen den Kaffeebohnen ähnlich. Arachisöl ist ein brauchbarer Ersatz des Olivenöls. Nach Indian and Colonial Addendum Brit. Pharmacop. ist Olivenöl durch Arachisöl zu ersetzen in Indien, den afrikanischen, australischen und östlichen Kolonien (vgl. I, S. 22). Es liefert ein vorzügliches Bleipflaster (DYMOCK). In Spanien dienen die Preßrückstände mit Cacao, Zucker und Gewürz gemischt der ärmeren Bevölkerung als Nahrungsmittel. Man kann in Zeiten der Not aus Erdnußpreßkuchen ein billiges Brot backen. — Die Erdnußpreßkuchen, aus denen eine Grütze hergestellt wird, bilden ein oft verfälschtes wertvolles Nahrungsmittel (vegetabilisches Fleisch, NÖRDLINGER), ein sehr geschätztes Mastfutter (UHLITZSCH, COLLIN-PERROT) und ein gutes Düngemittel. Erdnußmehl wird giftig durch beigemengte Ricinuskuchen (SCHMIDT) oder durch Wechselwirkung mit beigefutterten anderen Nahrungsstoffen (? KRÜGER). Erdnußöl wird mit Mohnöl, Sesamöl (Furfurolprobe!), Baumwollsamenöl (HALPHENS Reaktion!) und Rüböl verfälscht (Nachweis bei LEWKOWITSCH).
Geschichte. Die Erdnuß war, was ebenfalls für ihren amerikanischen Ursprung spricht, im Altertum und Mittelalter unbekannt. Zuerst wird die Manifrucht 1547 bei FERNANDEZ DE OVIEDO (I, S. 755) in dessen Cronica de las Indias Lib. VII, cap. 5 fol. 1074 von Hayti erwähnt, wo sie von den Eingeborenen kultiviert wurde. MONARDES (I, S. 780) berichtete 1569, daß sie bei den Indianern am Maranon in großem Ansehn stehe. Die französischen Kolonisten[S. 593] unter COLIGNY trafen mandobi 1555 in Brasilien, SLOANE Arachidna Indiae utriusque in Westindien und JEAN DE LÉRY (I, S. 764) beschrieb die Pflanze. Abbildungen finden sich dann bei JOHANNES DE LAET in dessen Histoire du nouveau monde 1640 und bei MARCGRAF (I, S. 893) unter dem Namen mundubi (HANBURY). Erdnüsse finden sich auch unter den altperuanischen Grabbeigaben (DE CANDOLLE). 1697 wurde die Pflanze in Helmstedt kultiviert (STISSER, Botanica curiosa). Der Name Arachis wird zuerst von RAY, dann von PLUMIER und SLOANE benutzt (BENTLEY-TRIMEN). Er ist abgeleitet von ἀράχιδνα, womit von THEOPHRAST eine andere Leguminose (nach SPRENGEL: Lathyrus amphicarpus DORTH) bezeichnet wurde. Die Arbeiten von SONNINI, Traité de l’arachide ou pistache de terre Paris 1808 und CADET, Sur la cacahuaté ou mani d’Amérique in Journ. pharm. I (1815), 37, sowie die chemische Untersuchung von PAYEN und HENRY (Journ. chim. Amérique. 1825, 431) lenkten in Europa die Aufmerksamkeit auf die Erdnuß. Aber erst der französische Colonist JAUBERT in Gorée, nahe den Capverden, führte sie 1840 als Ölsaat nach Marseille ein, wohin von dann an steigende Mengen von der Westküste von Afrika gelangten (1867 schon 66 Mill. kg). In der zweiten Hälfte des XIX. Jahrh. breitete sich die Kultur der Erdnuß über die Erde aus. Um 1860 kam sie über China nach Indien (DYMOCK) — sie heißt in Indien noch heute chini-badam (= chinesische Mandel). Die Kultur nahm dort einen so raschen Fortgang, daß schon 1877: 7130 cwts nuts und 20387 cwts oil von Madras exportiert werden konnten und 1897 schon 112000 acres unter Erdnuß standen. Nach Westindien kam sie zuerst von Brasilien, dann — in neuerer Zeit — von Afrika aus. Zuerst kam das Öl in die Pharmacopeia of India, erst neuerdings auch in europäische Pharmacopoeen, z. B. die Pharm. helvet. IV.
Lit. CARRÈRE ET HOLLE, Le Sénégambie française 1855. — DUVAL, Colonies et politique coloniale de France 1864. — MAVIDAL, Le Senegal. Paris 1863. — FAIDHERBE, Le Senegal 1889. — POITEAU, Ann. sc. nat. bot. 19 (1853), 268. — FLÜCKIGER-HANBURY, Pharmacographia. — BEYERINCK und WIJS, Aardnoot en de aardnooten-olie. Bull. Kolon. Mus. Haarlem 1896 (Monographie). — TAUBERT in Engler-Prantl, Pflanzenfam. — SCHWEINFURTH, Im Herzen Afrikas I 273. — SEMLER, Trop. Agrikultur. — BLOCK, Geogr. Verbr. d. Erdn. u. Bedeut. als Nahrungsm. Zeitschr. f. Kolonialpolit. VI. — WATT, Dict. econ. prod. — F. KURTZ, Sitzungsber. d. Bot. Ver. d. Prov. Brandenb. 1875. — SADEBECK, D. Kulturgew. d. deutsch. Kolonien 1899. — WARBURG, Fette u. Öle aus deutschen Kolonien. Chem. Centralbl. 1897. — WOLDT, Deutschl. Interess. im Niger- u. Kongogebiet. — VOGL, Nahrungs- u. Genußm., Fig. 159 u. 160. — BENTLEY-TRIMEN, Med. pl. t. 75 (dort d. ältere Lit.). — BENECKE, Mikr. Unters. d. Kraftfutterm. 1886. — BÖHMER, Ölkuchen in DAMMERS Lexikon d. Verfälsch. — BILTERYST, Rech. de l’arach. etc. Journ. pharm. 1897, 29. — WINTON, Anatomy of the peanut etc. Conn. Agr. Exp. Stat. Rep. 1904, 191. — MÖLLER-WINTON, Mikroskopie, Fig. 317–322. — T. F. HANAUSEK in Wiesner, Rohstoffe II. Aufl. (mit Abbild.). — FLÜCKIGER, Arch. Pharm. 1869. — FLÜCKIGER-HANBURY, Pharmacographia — Pharmacogr. indica. — HARZ, Landwirtsch. Samenkunde. — BENSON, The ground nut. Dep. Land. Rec. agric. Madras 1899. — K. BRAUN, Die Erdnuß (Kultur). Pflanzer, Amani, 1910 (Flugblatt). — Erdnußindustr. in d. Ver. Staaten. Chem. Zeit. 1900, Nr. 38. — SADTLER, Peanutoil and its uses in pharm. Am. Drugg. 31 (1897). Lipase: DUNLAP und SEYMOUR, Journ. am. soc. 27, 935. — KÖNIG, Nahrungs. u. Genußm. (dort die chem. Literatur). Weitere chem. Lit. in WEHMER, Pflanzenstoffe.
Öl: HAZURA und GRÜSSNER, Monatsh. f. Chem. 1889, 242. — HARTWICH und UHLMANN, Arch. Pharm. 1903, 111. — KREIS, Chem. Zeit. 1895, 451. — BACZEWSKI, Arachis. Ber. chem. Ges. 1896. — LEWKOWITSCH, Chem. Techn. d. Öle 1905 (dort d. Lit.). — Erkennung von Erdnußöl in anderen Fetten: GUARNIERI, Staz. sper. agr. ital. 1909, 408. — MUNTZ, PAULMYER u. RIVALS, Monit. scient. 1909. 785. — Preßkuchen: NÖRDLINGER, Erdnußgrütze. Zeitschr. Angew. Chem. 1892, 689. — TUSON, Pharm. Journ. 7 (1876) 332. — UHLITZSCH, Landw. Versuchsstat. 1892, 385. — KLINGENBERG, Zeitschr. f. phys. Chem. 1882, 155. — COLLIN-PERROT, Residus industr. (Fig. 65. Querschn. durch die Fruchtschale).
3. Nichttrocknende Öle.
Die nichttrocknenden Öle zeigen eine niedrigere Jodzahl als die trocknenden und die halbtrocknenden. Linolensäure scheint ganz zu fehlen, Linolsäure nur in geringer[S. 594] Menge vorhanden zu sein. Sie erhärten wegen ihres Gehaltes an Ölsäure bei der Elaidinprobe.
Semen Amygdalae dulcis und Oleum Amygdalae.
Syn. Amygdala dulcis, süße Mandel — amande douce (franz.) — sweet almond (engl.) — mandorla dolce (ital.).
Der Baum: Mandelbaum — amandier (franz.) — almond tree. (engl.) — amandelboom (hol.) — mandola, mandorlo (ital.) — almendro (span.) — amendoeira (port.) — mandelträd (schwed.) — mindaluve derevo (russ.) — him-ho-gin (chin.).
Bei THEOPHRAST: ἀμυγδαλῆ (die Frucht ἀμυγδάλη) — bei DIOSKURIDES: ἀμυγδαλέα und ἀμύγδαλον — bei COLUMELLA und PLINIUS der Baum: amygdala (die Frucht nux graeca, so schon bei CATO). Später dann (z. B. in Medicina Plinii IV. Jahrh.): amandola, bei CARL: amandalarios, bei ALBERTUS MAGNUS: amigdalus, bei der HILDEGARD: amygdalus, — in der Alphita (I, S. 654) oleum amigdalinum (metopium ex amigdalis amaris) — bei IBN BAITHAR: lauz, lawz (Ol. amygdalar. = duhn al-lauz al murr) — bei NAJM AD-DYN MAHMUD (I, S. 611) laouz ḥoulou — aramäisch und syr. schegʿdā, — hebr. schaked, luz oder lus — arab. louz davon berberisch: talouzet (die Mandel: schekedim) — pers. badam. — Der Mandelbaum hat keinen Sanskritnamen. Bei Sanskritschriftstellern findet sich der (persische) Name bádám. (hind.) oder vádam (tam.). — In China: hang, die süßen Mandeln: hangjin und tʿien-mei.
Etym. ἀμυγδάλη ist wohl sicher ein Lehnwort, doch ist, bemerkt SCHRADER, seine Quelle noch nicht nachgewiesen (GRASSMANN: der Name stammt wahrscheinlich aus Asien). Im persischen Makhzan heißt ein Gummi liefernder Baum ammughilán oder mughilán (oben S. 453). Dies dürfte auf eine Amygdalacee gehen und aus dem dem Worte zugrunde liegenden persischen Stamme ist vielleicht das griechische ἀμυγδάλη hervorgegangen. Die bittere Mandel heißt im Persischen munga, die Bohne im Indischen mudga. Amygdalus stammt also möglicherweise aus dem Persischen oder Indischen — vielleicht liegt auch die Urheimat der Pflanze in Persien, das heute noch viel Mandeln produziert. ἀμυγδάλη ist freilich auch der Name der phrygischen Cybele (und bedeutet große Mutter), und da der früh aus dem Winterschlaf erwachende Mandelbaum aus dem Blute der Göttermutter entstanden sein sollte, so zog MOWERS den Namen amygdalê hierher, was aber SCHRADER ablehnt. Die Ableitung von ἀμυχή (wegen der vielen Ritzen der Steinschale, HERODIANUS) wird abgelehnt, ebenso die von syr. ah-mügdala (= schöner Baum). Aus ἀμυγδάλη ging dann unter volksetymologischer Anlehnung an mandere und amarus das lat. amandula, amandola und dann das ital. mandorla hervor (SCHRADER), angls. magdalatreow, mhd. mandel, ahd. mandala, nach BAIST aus lat. amandula bzw. amundala. Bei Prunus sagt Isidorus (in seiner bekannten Weise!) «Pruna est, quam diu ardet; pruna autem perurendo dicta». Andere leiten Prunus (s. auch oben S. 57) von πύρινος = feurig oder προῦνος = wilder Ölbaum oder πρῶμος = frühzeitig ab (KANNGIESSER).
Stammpflanze und systemat. Stellung. Prunus Amygdalus STOKES (Amygdalus communis L.) var. physiologica dulcis TSCHIRCH (Prun. Amygd. STOK. var. β dulcis P. DC., Amygdalus dulcis J. BAUH.) mit zahlreichen Spielarten.
Die Botaniker unterscheiden von Prunus Amygdalus STOKES Bot. mat. med. III, 101, non BAILLON (Amygdalus communis L. Spec. pl. ed. I 473) die «Varietäten» var. β dulcis P. DC. mit harter Steinschale und süßlich schmeckenden Samen, Blumen vor den Blättern, var. α amara HAYNE mit harter Steinschale und bitteren Samen, Staubgefäße bisweilen unterwärts behaart, var. γ fragilis BORKHAUSEN mit zerbrechlicher Steinschale und süßlichen Samen (Knack- oder Krachmandeln), Blumen gleichzeitig mit den Blättern, var. δ macrocarpa mit großer Frucht und harter Steinschale. Blumen heller rot, vor den Blättern und var. ε persicoides SÉR. (Pfirsichmandel mit mehr fleischiger Frucht, wohl ein Bastard mit dem Pfirsich). In Turkestan gibt es wilde Mandeln mit glattem Stein. Da es kein einziges durchgreifendes systematisch-botanisches Merkmal gibt, welches den die süße Mandel liefernden Baum von dem die bitteren liefernden unterscheidet (die als Unterschied angeführten Drüsen am Grunde der Blätter von dulcis fehlen auch hier bisweilen), der einzig durchgreifende Unterschied vielmehr ein chemischer ist, der[S. 595] auf der Bildung von Amygdalin in den Samen der bitteren Mandel beruht, so kann man auch nicht von einer Varietät im botanischen Sinne sprechen, sondern muß den von mir eingeführten Begriff der physiologischen Varietät hier benutzen. Oft genügt schon Umpflanzen in besonders guten Boden, um einen «bitteren» Mandelbaum zum «süße» Früchte Tragen zu veranlassen (LIPPMANN).
Die meisten Forscher betrachten die süße Mandel als durch Veredelung aus der bitteren hartschaligen hervorgegangen. Doch kommen in Kerman in Südwestpersien wilde (oder verwilderte?) süße und bittere Mandeln nebeneinander vor.
Rosaceae — Prunoideae, Untergattung II Amygdalus TOURN.
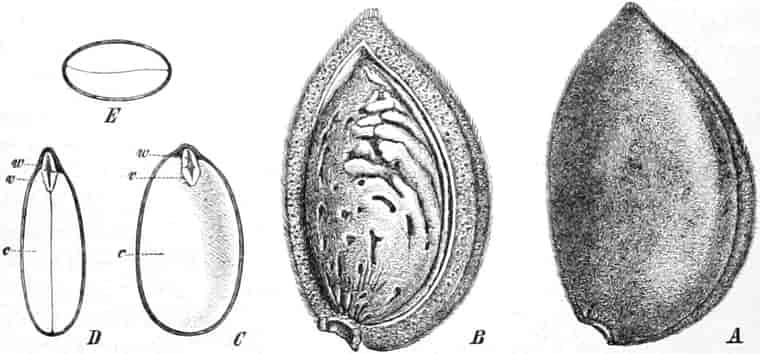
Prunus Amygdalus.
A Frucht von außen. B Frucht aufgeschnitten, um den Steinkern zu zeigen. C und D Same längs durchschnitten. E Same quer durchschnitten.
[Nach Focke in Engler-Prantl, Pflanzenfamilien.]
Beschreibung der Stammpflanze. Der Mandelbaum ist von mäßiger Höhe (selten bis 10 m) und besitzt eine breitästige Krone oder ist nur strauchig, nur an den Kurztrieben blühbar. Die spiralig gestellten, 4–10 cm langen Blätter besitzen 1,2–2,5 cm lange Stiele. Die kahle Spreite wechselt bei Prunus Amygdalus nach der Form (lanzettlich bis eilanzettlich) und der Ausbildung des Randes (sehr schwach gekerbt oder gesägt). Bisweilen finden sich am Grunde der Lamina ein oder zwei Drüsen. Die kurzgestielten, perigynen Blüten sitzen zu 1–3 an der Spitze der Kurztriebe. Die Kelchröhre, der Axenbrecher, ist 4–5 mm lang, glockenförmig, kahl, wenig deutlich zehnnervig, innen mit einem Nektar absondernden Gewebe ausgekleidet, etwa bis zur Hälfte behaart. Sie löst sich von der heranreifenden Frucht durch einen ringförmigen Spalt ab. Die fünf, unten braunroten, oben grünen Kelchblätter sind abstehend, oblong bis oblong-lanzettlich, am Rande gewimpert, die fünf bis 2 cm langen, zart rosenroten, mit dunkleren Adern durchzogenen Blumenblätter sind oblong bis breit-umgekehrt-eiförmig, an der Basis kurz keilförmig-genagelt, an der Spitze etwas ausgerandet (der Pfirsich hat dunklere Blüten), die etwa 30 ungleich langen, in fünf episepalen, dem Rande des Achsenbechers inserierten, Phalangen angeordneten Stamina besitzen rosenrote Filamente. Das der Basis des Achsenbechers stiellos inserierte Gynaeceum besteht aus einem am Grunde dicht behaarten Carpell und läuft in einen langen Griffel mit kopfiger Narbe aus. Die einfächerige Frucht ist eine etwa 3,5–4 (selten bis 6) cm lange und 2,5–3 cm breite, seitlich zusammengedrückte Steinfrucht (drupa), die an der Rückenseite eine Furche besitzt, an der die Frucht aufspringt. Das graugrünliche Epicarp ist sammetartig behaart, das Mesocarp lederig zäh, das Endocarp als gelbe, derbe Steinschale (coque) entwickelt, die an der Vorder- und Rückenseite breit und scharf gerandet, innen glatt und glänzend, aber außen mit unregelmäßigen Vertiefungen versehen ist (Fig. 184 B) (bei den dünnschaligen Krachmandeln ist die Steinschale dünn und zerbrechlich). Von den zwei anatropen, an der Bauchnaht hängenden Ovulis, die in dem Fruchtknoten liegen, schlägt meist das eine fehl (wo es sich ebenfalls entwickelt, entstehen die sog. «Vielliebchen»), so daß in der Fruchthöhle nur ein Same liegt, der[S. 596] vorwiegend aus den beiden plankonvexen Cotyledonen besteht. Prunus Amygdalus blüht vor Austreiben des Laubes oder gleichzeitig mit dem Erscheinen der ersten Blättchen im März bis April, im Süden schon im Februar. Der Fruchtansatz erfolgt in Italien im März. Er leidet daher von Frühjahrsfrösten. Die Urheimat des Mandelbaums ist wahrscheinlich im westlichen Asien, vielleicht besonders in Persien, zu suchen (s. oben). In Mesopotamien, Kurdistan, Turkestan (BOISSIER) und dem Antilibanon (bis 3200 m), sowie Karmel (TRISTRAM), am Hermon, wo er zwischen 1000 und 1600 m gebüschbildend auftritt, ferner in Persien (am Berge Avroman in Kurdistan zwischen 2200 und 2900 m), in Afghanistan (ATCHISON), im oberen Zarafshanthal, in Turkestan, im Tschotkalgebirge (CAPUS) und Transkaukasien (MEDWEDEW) findet sich der Mandelbaum, der süße und der bittere, wild, ob auch in Sizilien, Griechenland (HELDREICH) und Algerien (COSSON) ist zweifelhaft. Im Mittelmeergebiet ist er wohl nur verwildert. Die Mandel reift ihre Früchte nördlich der Alpen nur in der Rheinebene, am Oberrhein, an der Bergstraße, in der Rheinpfalz und im Wiener Becken. An der südöstlichen Küste Norwegens, c. 59° n. B., reift sie noch bisweilen in warmen Sommern (SCHÜBELER).
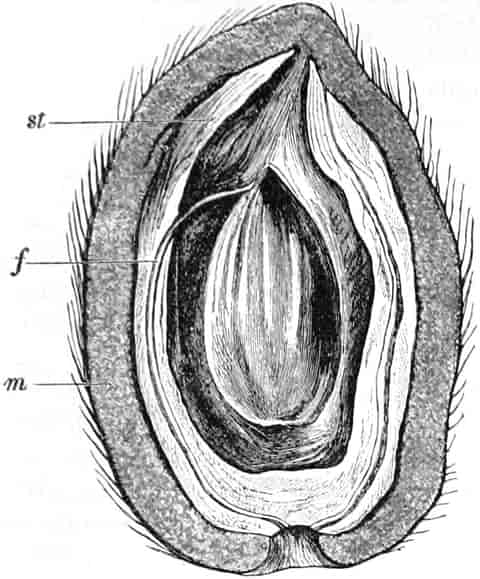
Prunus Amygdalus.
Längsschnitt durch die Drupa. m Mesokarp. st Endokarp (Steinschale). f Funiculus.
[Nach MOELLER, Lehrbuch.]
Lit. FOCKE, Rosaceen in Engler-Prantl. — BAILLON, Hist. d. pl. (Monogr. Rosac. 1869). — DE CANDOLLE, L’orig. d. pl. cult. u. Géogr. botan. — BOISSIER, Flor. orient. — CHRIST, Pflanzenleb. d. Schweiz. — CAPUS, Sur l. plant. cultiv. qu’on trouve à l’état sauvage etc. dans le Thian Schan. Ann. sc. nat. (7) 18 (1884) 278. (FLÜCKIGER, Pharm. Zeit. 1884, 878.) — SCHÜBELER, Kulturpfl. Norwegens 1862. — HELDREICH, Nutzpfl. Griechenlands 1862. — Abbild.: BERG-SCHMIDT, Atlas 2. Aufl., t. 62 (dort die botan. Lit.). — PABST-KÖHLER, Medizinalpfl. t. 94. — BENTLEY-TRIMEN, Medic. plants t. 99. — NEES VON ESENBECK, Plant. med. t. 312 u. 313.
Pathologie. Über die pflanzlichen Schädlinge berichtet Prof. ED. FISCHER: Amygdalus communis wird ebenso wie alle unsere Steinfruchtarten von Clasterosporium carpophilum (LÈV.) ADERH. befallen. Dieser Pilz greift Blätter, Blattstiele, Triebe und Früchte an; verursacht auf den Blättern runde abdorrende Flecken und auf den Früchten schorfartige Bildungen. (Lit. ADERHOLD, Über die Sprüh- und Dürrfleckenkrankheit des Steinobstes. Landwirtschaftl. Jahrbuch 1901, derselbe: Über Clasterosporium carpophilum und die Beziehungen desselben zum Gummiflusse des Steinobstes. Arbeiten der Biol. Abt. des Reichsgesundheitsamtes für Land- und Forstwirtschaft II 1902.) Wichtig ist ferner Gloeosporium amygdalinum BRIZI, welches die Anthracnose des Mandelbaumes hervorruft und namentlich dann schädlich ist, wenn es die jungen Früchte befällt, da diese zum Absterben oder Abfallen gebracht werden (s. BRIZI, Eine neue Krankheit des Mandelbaumes. Zeitschr. f. Pflanzenkrankheiten, Vol. VI 1896, p. 65).
Über die tierischen Schädlinge von Prunus Amygdalus vgl. Cerasus (S. 72) und Cydonia (S. 330). Die trockenen Mandeln werden oft von Sitodrepa panicea und Coccotrypes zerstört (I, S. 379).
Kultur. Der Mandelbaum wird in Südeuropa, im Orient, Nordafrika und England kultiviert. Er verlangt ein warmes, lufttrockenes, subtropisches Klima, jedenfalls keine Fröste[S. 597] zur Blütezeit und trockenen, lockeren, tiefgründigen, kalkhaltigen Boden. Die bittere Mandel ist klimahärter (SEMLER). Die Kultur der süßen Mandel ist im südlichen und südwestlichen Frankreich beträchtlich, wird aber dort nur als Nebengewerbe betrieben. Mandelpflanzungen legt man in Italien gern dort an, wo vorher Oliven standen (VALIANTE). In Italien werden die Wildlinge, welche man als Unterlage für die Pfropfreiser guter Varietäten der Mandel braucht, aus hartschaligen einsamigen Mandeln gezogen. Die Mandel wird aber auch oft auf den Pflaumenbaum und den Pfirsich gepfropft. Der gepfropfte Baum gibt vom 15. Jahre an Früchte, vom 30–40. Jahre den Maximalertrag. Dieser beträgt 50 l Früchte = 8–9 l Samen (A. MEYER). 1 Hektar liefert c. 500 kg. geschälte M. In Persien, wo der Baum sehr häufig ist und die Mandeln viel benutzt werden, wird er besonders in Yedz und Kirman, dann auch in Afghanistan kultiviert. Die Steinschale wird mit einem hölzernen Hammer aufgeklopft oder (in Amerika) mit einer Maschine aufgebrochen. In Südfrankreich werden die Mandeln geschwefelt (Schwefelbleiche). Die besten Spielarten hat Frankreich und Californien. SEMLER nennt folgende: Amande des dames (A. dela princesse), Languedoc, Sultana, Pistache, Douce à coque duce, Jordanmandel, breite Valencia und die kalifornischen: Excelsior, Non plus ultra, Nonpareil, Suprema u. and. Der Ertrag einer Mittelwelternte wird auf 35–50 Mill. kg geschätzt (TUNMANN). Die Hälfte davon liefert Italien, speziell Sizilien.
Lit. BIANCA, Manuale della coltivazione del Mandorlo in Sizilia. Palermo 1874.
Handelssorten. Süße Mandeln kommen aus Südfrankreich (Provence, bes. Aix), Italien (Puglia, Apulien, Florenz, Bari, Neapel, Sizilien, bes. Avola bei Syracus), Spanien (Malaga, Valencia, Alicante, Mallorca), Portugal (Lissabon, Oporto), Dalmatien, Griechenland (Aegina, Chios), der Levante, Syrien, Persien, Süd-Rußland, Nordafrika, Marokko (Rebat, Mogador), Tripolis, Algier und den Canarischen Inseln, sowie Kalifornien. Die spanischen, besonders die Valencia- und Alicantesorten sind die größten und besten, auch die Malaga-Mandeln (sog. Jordan-M.) sind groß und gut, ebenso die Florentiner (Ambrosia) Mandeln, die südfranzösischen und italienischen (z. B. die Puglieser, Communmandeln) sind kleiner und dicker und weniger gut. Am wenigsten geschätzt sind die berberischen aus Afrika, die persischen, syrischen und griechischen.
Die Oporto-, Malaga- und Valencia-Mandeln kommen gewöhnlich in Körben und Fässern, die anderen in Ballen, Säcken und Matten von 100 kg, die Barbarice- (Marokko) Mandeln in Seronen à 100 kg in den Handel.
Die bitteren Mogadormandeln sind meist mit süßen Mandeln vermischt. Die Krachmandeln (amandes à la princesse) kommen besonders aus Südfrankreich und Sizilien. Nach Indien gelangen viel Mandeln vom persischen Golf. Mandelöl ist in Indien kein Handelsartikel. Auch Amerika liefert jetzt viel Mandeln. Die chinesischen Mandeln sind die genießbaren Kerne einer Aprikosenart (HANCE, BRETSCHNEIDER).
Handel. Italien produziert jährlich c. 20 Mill. kg Mandeln. Es exportierte mandorle sonza guscio 1908: 177683, 1909: 105913 quint.; mandorle col guscio, 1908: 22872, 1909: 10762 quint. Frankreich führte 1908: 45410 Quint. Amandes en coques und 58185 Qint. A. sans coques ein, besonders aus Spanien, der Türkei und Italien, weniger aus Griechenland und Marokko, unbedeutende Mengen aus Algier und Tunis. Frankreich exportiert für 16 Mill. M. jährlich (SEMLER). Hamburg importierte 1908 seewärts 75391 dz Mandeln, davon aus Italien: 40884, Spanien: 15407, Marokko: 13210, Frankreich: 4816. Weniger wie 1000 dz kamen aus Kleinasien, Persien, den kanarischen Inseln, Syrien, der europäischen Türkei, Griechenland, Portugal usw. Deutschland importierte 1909: 6921000 kg Mandeln (2600000 aus Italien, 1300000 aus Marokko, 625000 aus Frankreich, 1700000 aus Spanien, 640000 aus der Levante, 56000 aus Portugal). Nach TUNMANN (Drogenhandel Hamburgs Apoth. Zeit. 1911) 1909: 9,66, 1910: 11,12 Mill. kg.
Morphologie der Droge. Die Droge besteht aus den aus der Steinschale (s. oben) herausgelösten, in der Form wechselnden, bald mehr länglichen (Provencer),[S. 598] bald mehr rundlichen (Puglieser), im allgemeinen spitz eiförmigen, etwas flach gedrückten, bikonvexen (wo zwei Samen ausgebildet wurden plankonvexen oder konkavkonvexen) Samen. (Nur die Krachmandeln sind noch mit dem hier dünnen und zerbrechlichen Endocarp und dem diesem aufsitzenden, zum Mesocarp gehörenden anastomosierenden, weitmaschigen Gefäßbündelsystem bedeckt.) Sie besitzen eine wechselnde Größe je nach den Spielarten, pflegen aber meist größer zu sein als die bitteren — es gibt aber auch kleinsamige Sorten (s. oben). (Früher wurden als Varietäten A. fructu majori und A. fructu minori unterschieden.) Die größten Sorten (Malaga-, Jordan-M.) sind bis 4, die meisten 1,5–2,5 cm lang. Provencer Mandeln messen c. 2,8 : 0,9 cm, Puglieser Mandeln c. 2,0 : 1,4 cm (HARTWICH). Sie zeigen eine hellbraune, mit derbem, zimtbraunem, leicht abreibbarem Reif bedeckte («bestäubte»), groblängsrunzelige Samenschale, die von dunkleren, vertieften Adern durchzogen ist. Etwas unterhalb der meist ziemlich scharfen Spitze liegt das Hilum. Von ihm läuft die selten kielartig hervortretende Raphe zu der am abgerundeten breiten Ende des Samens etwas seitlich verschoben liegenden, als große runde Erhebung sichtbaren Chalaza. Hier tritt das Raphebündel ins Innere und sendet von hier zahlreiche (16–18), rückläufig nach der Spitze des Samens hin streichende verzweigte Bündelchen, die die Samenschale von Unten nach Oben durchziehen.
Legt man den Samen in warmes Wasser, so löst sich die Samenschale samt dem Nucellus- und Endospermreste (s. unten) leicht vom Samenkern ab. Der letztere besteht aus zwei plankonvexen, weißen, öligfleischigen Cotyledonen (Fig. 184), die außen die Abdrücke der Samenschalbündel zeigen und die mit ihrem etwas verschmälerten Grunde der kurzen, gegen das spitze Ende des Samens gerichteten Radicula derart angewachsen sind, daß letztere zur Hälfte frei hervorragt, während ihre andere Hälfte nebst der relativ großen länglich-eiförmigen Plumula von den Cotyledonen eingeschlossen ist.
Süße Mandeln schmecken ölig-süß. Sie geben mit Wasser zerstoßen eine weiße Emulsion, die weder Bittermandelgeruch noch Blausäurereaktion zeigt.
Anatomie. Die Fruchtschale spaltet sich leicht in eine äußere weiche und eine harte innere Schicht. Die letztere, die Steinschale, zeigt zu äußerst ein von Sklereïden durchsetztes Parenchym. Die harte Schicht ist fast ganz aus Sklereïden verschiedener Größe aufgebaut. In der Mitte sind dieselben quergelagert, schmal und stark verdickt, innen längsgelagert, alle farblos oder gelblich. Zwischen den Sklereïden finden sich bisweilen Kristallzellen mit Drusen und Einzelkristallen (MOELLER).
Prunus Amygdalus.
97 Same von außen, Ch Chalaza, R Raphe, n Hilum, g Gefaßbündel der Samenschale. 98 Same längs durchschnitten, s Samenschale, nc Nucellus, e Endosperm, oa Plumula. 99 Ovulum natürl. Größe. 100 Ovulum längs durchschnitten, ii inneres, i äußeres Integument, g Funikularbündel. 101 junger Same. 102 derselbe längs durchschnitten (Bezeichnungen wie in 100). 103 fast ausgebildeter Same längs durchschnitten. 104 Querschnitt durch die Randschicht des Samens, E äußere Epidermis, p Nährschicht, Ei innere Epidermis der Samenschale, N Nucellusrest, En Endosperm. 105 innere Epidermis und äußere Nucellusschicht aus dem Stadium 103. 106 innere Nucellus- und äußere Endospermschicht des nahezu reifen Samens. 107 Nährschicht (p) aus einem unreifen Samen.
[Aus Arthur Meyer, Wissenschaftl. Drogenkunde.]
Die bitteren und süßen Mandeln stimmen anatomisch überein. Der Same geht aus einem anatropen Ovulum hervor, welches zwei Integumente besitzt. Das äußere, sehr kurze Integument ist der Spitze des inneren inseriert (Fig. 186, 100). Es nimmt an der Bildung der Samenschale nur an der Spitze des Samens geringen Anteil (A. MEYER). Bedeckt ist der Same mit einem braunen grobschülferigen bzw. körnigen Überzuge. Dieser besteht aus sehr großen, oft 120–335 mik. hohen und 70–135 mik. weiten, kegel-, pauken- oder tonnenförmigen, geraden oder mannigfach verbogenen und ausgestülpten, von oben gesehen rundlichen, rundlich-eckigen oder mannigfach verzogenen Zellen mit dicker Wand (Fig. 186, 104 u. 188) und dort, wo die Zellen an andere angrenzen, deutlichen runden oder spaltenförmigen Tüpfeln, zwischen welche Zellen nicht minder zahlreich sehr dünnwandige, daher zusammengefallene Zellen eingestreut sind, die sogar oft die Mehrzahl bilden, so daß die Gruppen der dickwandigen Zellen inselartig auftreten. Sämtliche Zellen dieses Überzuges sind als sklereïdenartige Korkzellen[S. 599] zu betrachten. Die dünnwandigen sind vollständig oder nahezu vollständig verkorkt, die dickwandigen zeigen eine breite verholzte Mittelpartie und zwar ist die ganze, oft 5,5 mik. breite Mitte der Membran, die eine deutliche zarte Streifung zeigt, verholzt, färbt sich also mit Phloroglucinsalzsäure rot, mit Chlorzinkjod gelb. Beiderseits von dieser[S. 600] Mittelschicht, sowohl an der inneren als an der äußeren Seite, liegt eine zarte, gegen Schwefelsäure resistente Lamelle, die innen so zart zu sein pflegt, daß sie sich oft als feines Häutchen ablöst. Die für die typische Korkzelle charakteristische Zelluloselamelle ist hier bald vorhanden, bald fehlt sie, wenigstens konnte ich sie an der Handelsware nicht überall mit Jodschwefelsäure nachweisen. Die Zellen enthalten einen körnigen, auf Gerbstoff reagierenden Inhalt und im unreifen Samen Stärke. Diese sehr eigentümlichen, meist in einfacher Schicht — sehr selten sah ich zwei übereinander — den Samen bedeckenden Gebilde (Tonnenzellen MOELLER, Riesenzellen VOGL), zeigen den Charakter trichomartiger Sklereïden. Ihre Verwachsung mit der darunter liegenden Schicht der Samenschale ist oft eine so lockere, daß die dickwandigen sich aufs leichteste von ihr ablösen lassen, gewissermaßen herausfallen und daher an den Runzeln des Samens ganz oder fast ganz abgescheuert sind. Um ihre Form studieren zu können muß man daher die Schnitte durch die Falten legen. Bei besonders günstigen Präparaten sieht man, daß sie in der Tat der darunter liegenden, meist zweizelligen leeren Schicht eingefügt sind; über 3–6 Zellen dieser subepidermalen Zone liegt für gewöhnlich eine dieser Tonnenzellen. Die subepidermale Zone ist selten deutlich, am besten ist sie noch nach Zusatz von Kali sichtbar zu machen. Ihre Zellen sind sehr zartwandig und enthalten bisweilen eine Oxalatdruse. Wand und Inhalt färben sich mit Eisenchlorid schmutziggrün (VOGL). Die nächstfolgende, relativ mächtige, durch Chlorzinkjod sich schmutzig violett färbende Schicht der Samenschale ist die Nährschicht (TSCHIRCH), sie besteht aus dünnwandigem, reichdurchlüftetem, stark obliteriertem Sternparenchym, welches besonders in den äußeren Schichten bisweilen einen braunen Farbstoff führt und nach Innen zu durch eine einreihige Epidermis abgeschlossen ist. Bis hierher reicht die Samenschale. In der Nährschicht verlaufen die Gefäßbündel (s. oben), die Spiralgefäße führen und von Kristallkammerfasern mit rhomboëdrischen Kristallen oder Drusen begleitet werden. HARTWICH gibt in der Nähe der Bündel auch Sklereïden an. An die Nährschicht schließt sich nach Innen zu eine einreihige, inhaltslose, stark zusammengefallene Schicht, die als Nucellusrest angesprochen wird (A. MEYER) und dann folgt eine Zone, die man als das sehr zarte Endosperm aufzufassen hat, dessen allein deutlich erhaltene äußerste Schicht aus sehr verschieden großen, im Flächenschnitt meist 21–27 mik. langen, 16–22 mik. breiten, in einfacher, doppelter oder (am Würzelchen) mehrfacher Schicht angeordneten, relativ dickwandigen, farblosen Zellen besteht, die neben einem stets sehr deutlichen Zellkern viele sehr kleine lappige Aleuronkörner enthalten, welche durch Wasser rundlich aufgebläht, durch verdünntes Kali bis auf sehr kleine, Molekularbewegung zeigende Körnchen (Globoide) gelöst werden. Die Wände dieser Schicht färben sich mit Chlorzinkjod blau, die innersten Schichten des Endosperms sind zu einer «Quellschicht» (TSCHIRCH) obliteriert und machen die Samenhaut beim Einlegen in Wasser so schlüpfrig, daß der Samenkern leicht herausgleitet. Die plankonvexen Cotyledonen besitzen auf der Außen- (der morphologischen Unter-)seite eine sehr kleinzellige Epidermis, deren Zellen in der Richtung der Organsachse gestreckt, etwa 40–62 mik. lang und 11 mik. breit sind. Das Gewebe der Cotyledonen besteht aus dünnwandigen, mit sehr zarten Verdickungsleisten versehenen Zellen, die Interzellularkanäle reichlich zwischen sich lassen. Ein Palissadengewebe ist auf keiner Seite ausgebildet. Die Epidermis der Innen(Ober-)seite der Cotyledonen ist großzelliger als die der Außenseite, die Zellen sind in der Längsachse des Organs nicht gestreckt, sondern nahezu isodiametrisch. Sie enthalten beide ein feinkörniges Aleuron.
[S. 601]
Die Cotyledonen werden von in ein oder zwei, der ebenen Innenseite genäherten, Reihen angeordneten (bisweilen schon Spiralgefäße führenden) Procambiumsträngen durchzogen, welche sowohl bei den bitteren, wie den süßen Mandeln das Emulsin führen (JOHANNSEN 1887) und zwar in dem Pericycel (zone péricyclique, per in Fig. 187) und der Endodermis (End in Fig. 187, GUIGNARD 1890). Das Grundgewebe der Cotyledonen ist bei beiden Mandeln frei von Emulsin. Es enthält bei beiden gleichgestaltete Aleuronkörner (5–10 in jeder Zelle, LÜDTKE) von sehr unregelmäßigem Umriß und sehr verschiedener Größe. Meist sind sie rundlich oder gestreckt mit welliger Kontur und oft reichlicher Lappung des Randes. Besonders die größeren, solitärartig ausgebildeten führen oftmals eine kleine Druse von Kalkoxalat, alle 1–3 kleine, rundliche oder wulstig verbogene Globoide, die übrig bleiben, wenn man den Schnitt sukzessive mit Äther, Wasser und verd. Kali behandelt. Kristalloide fehlen. Selten sind Prismen von Oxalat. Die Aleuronkörner haben eine Größe von 2,5–13 mik., die Solitäre messen 16–17 mik. Außer diesen Aleuronkörnern ist bei süßen und bitteren Mandeln in den Zellen noch Ölplasma (TSCHIRCH) vorhanden, das bei den bitteren Mandeln das Amygdalin einschließt. Konzentrierte Schwefelsäure färbt das Gewebe der Cotyledonen rot (RASPAILsche Reaktion auf Zucker-Eiweiß). Der Farbstoff wird von den Öltropfen aufgenommen. Die kurze kegelförmige Radicula sowohl wie die zu einem spitzen Kegel ineinander gefalteten Primordialblätter, die den Vegetationspunkt zwischen sich haben und die beide amygdalinfrei und sehr emulsinreich sind (JOHANNSEN) — hier findet sich das Emulsin im Pericycel (GUIGNARD) —, sind in allen Zellen dicht mit kleinen rundlichen Aleuronkörnern vollgepfropft. Stärke fehlt dem Samenkern.
Gefäßbündel eines Cotyledon des Mandelsamens.
[Nach Guignard.]
Die Aleuronkörner der Mandel verhalten sich, wie Untersuchungen, die ich mit KRITZLER ausgeführt habe, zeigen, anders wie die von Linum, Ricinus, Cannabis usw. Die in Wasser sehr leicht lösliche Grundsubstanz besteht aus dem Globulin Amandin. Sie ist löslich in 1,5 und 10% Ammoniumsulfatlösung, unlöslich in der konz. Lösung des Salzes, löslich in 1,5 und 20% Magnesiumsulfat, schwer oder teilweise löslich in der konz. Lösung, löslich in Chlorammonium, Kaliummonophosphat und Kochsalzlösung jeder Konzentration, sowie in Kalkwasser, unlöslich in konz. Kochsalzlösung, der eine Spur Essigsäure zugesetzt wurde. Salzsäure von 0,1–0,2% fällt körnig, 3% und stärkere löst. Die in Wasser unlöslichen Globoide enthalten ein mit Ca, Mg und Phosphorsäure gepaartes Globulin, das nicht in 1%, wohl aber in 5 und 10% Kochsalzlösung, nicht in 1%, wohl aber in 20% Magnesiumsulfatlösung löslich ist, in 1 und 5% Ammonsulfat ist es unlöslich, löslich in 10 und 20%, Chlorammon löst schwer, Kaliummonophosphat in allen Konzentrationen leicht, ebenso Salzsäure.
Die Mandelkleie (tourteau d’amandes, pâte d’amandes, furfur s. farina amygdalarum) ist der gepulverte Preßrückstand, den man bei der Darstellung des Mandelöls erhält, besteht also jetzt meist aus bitteren Mandeln. Man findet in ihm in erster Linie die Fragmente der Cotyledonen, aber auch meist auf den ersten Blick die Tonnenzellen der Samenschale, Oxalatdrusenzellen und Spiralgefäße (Abbild. bei VOGL und COLLIN-PERROT), im Ölpräparate zahlreiche Aleuronkörner mit Globoiden und Oxalatdrusen. VOGL empfiehlt Färben des Präparates[S. 602] mit Cochenille. In der Mandelkleie finden sich oft Preßkuchen anderer Amygdalaceensamen, bisweilen besteht sie ganz aus Aprikosensamenpreßkuchen (COLLIN). Das unter dem Namen «Mandelkleie» (son d’amandes, bran of almonds) im Handel befindliche, zu kosmetischen Zwecken benutzte Präparat ist ein Kunstprodukt (vgl. HAGER-FISCHER-HARTWICH, Pharm. Praxis), das nicht einmal immer Mandeln enthält.
Das Pulver der Mandelschalen (d. h. des Endocarps, s. oben), das als Verfälschungsmittel von Gewürzpulvern (Pfeffer), in der Schokolade- und Biskuitfabrikation beobachtet worden ist und auch zum künstlichen Altern von Weinen und Spirituosen benutzt wird (1905), besteht fast ganz aus Sklereïden, entweder gestreckten, spindel-, spatelkeulenförmigen, geraden oder knieförmig gebogenen, bis 150 je 300 mik langen, mit linienförmigem Lumen oder kürzeren, bis 120 mik langen, breiteren, gerundet-eckigen oder ausgeschweiften, dicht getüpfelten, relativ weitlumigen, sowie Übergangsformen zwischen diesen. Daneben findet sich bisweilen dünnwandiges Parenchym, Kristallzellen und Bruchstücke von Gefäßen.
Lit. A. MEYER, Wissensch. Drogenkunde (dort die Entwicklungsgeschichte). — BERG, Anatom. Atlas. — TSCHIRCH, Angew. Pflanzenanatomie 1888, Fig. 36. — WIGAND, Lehrbuch 1887. — VOGL, Kommentar 1908 und Nahrungs- u. Genußm., Fig. 261 u. 262. — SCHIMPER, Anleitung 1900. — MÖLLER-WINTON, Mikrosk. d. Nahrungs- u. Genußm. 1905. — HARTWICH, in Realenzyklop. d. Pharm. — KARSTEN-OLTMANNS, Lehrb. d. Pharmak., Fig. 400–403. — LOUIS PLANCHON, Prec. de mat. méd. I, Fig. 148 u. 149. — GARCIN, Du noyau des drupes Ann. Soc. bot. Lyon 1890, 27, Contrib. à l’étude d. péric. charnus Lyon 1890, Rech. s. l’histogen. d. péric. charn. Ann. soc. nat. (7) 1890, 175. — GODFRIN, Etud. histolog. s. l. tégum. sémin. d. Angiosp. Soc. d. sc. nat. Nancy 1880, 109. — COLLIN-PERROT, Resid. industr., Fig. 69 u. 70. — T. F. HANAUSEK in Wiesner Rohstoffe, II. Aufl. — JOHANNSEN, Sur la localisation de l’émulsine dans les amandes Ann. sc. nat. (7) 6 (1887). 118. — THOMÉ, Bot. Zeit. 1865, 240. — GUIGNARD, Sur la localisat. dans les amandes etc. Journ. pharm. chim. 21 (1890), 233. — TSCHIRCH u. KRITZLER, Mikrochem. Unters. über d. Aleuronkörner. Ber. d. pharm. Ges. 1900, 214 und KRITZLER, Dissert. Bern 1900. — LÜDTKE, Beschaffenh. d. Aleuronk. Ber. d. pharm. Ges. 1891, 58. Mandelschalen: Pharm. Centralh. 1905.
Chemie. Die Zusammensetzung der (trockenen) süßen Mandeln ist im Mittel (nach KÖNIG) in Prozenten: Wasser 6,27, Stickstoffsubstanz 21,4, Fett 53,16, stickstofffreie Extraktstoffe 13,22, Rohfaser 3,65, Asche 2,3. In der Trockensubstanz: Stickstoffsubstanz 22,83, Fett 56,71% (FLEURY, COLBY, SCHÄDLER, KÖNIG und CRAUCH). Die Krachmandeln werden regelmäßig geschwefelt, um ihnen eine hellere Farbe zu geben. In 100 g Kernen fand KRATSCHMER 13 mg, in 100 g Schalen 117 mg schweflige Säure. Im Pericarp finden sich 0,84% Saccharose und 5,67% reduzierender Zucker (BOURQUELOT), sowie eine Spur fettes Öl (VALLÉE), Gerbstoff, Weinsäure mit Spuren Citronensäure und Apfelsäure (FLÜCKIGER).
Die Samen enthalten neben Dextrose (0,09% BOURQUELOT, auch FLÜCKIGER erhielt im Auszuge mit kaltem Wasser einen in der Kälte reduzierenden Zucker) c. 2 bis 3% Saccharose [2,97% BOURQUELOT, 2,1% LANGLEY, nach PELOUZE bis 10% (?) Saccharose, aber keinen reduzierenden Zucker?], gummiartige Stoffe, 2,38 (GODET) bis 3,8% (WITTMANN, LANGLEY) Pentosane (unlösliche Pentosane des Hemizelluloserückstandes der entfetteten Kerne: 15,5% GODET) und angeblich Gentiobiose, Stärke findet sich nur im unreifen Samen (LECLERC). Ferner enthält der Same ein chromogenes gelbes, mit Alkalien kirschrot werdendes Glykosid (SCHEITZ und LUDWIG) und Emulsin (= Synaptase, ROBIQUET). Das Emulsin ist ein Gemisch. Es enthält ein hydrolysierendes (δ-Emulsin) und ein synthetisierendes (σ-Emulsin) Enzym (ROSENTHALER), nach ARMSTRONG und HORTON, CALDWELL und COURTAULD sogar drei: ein Enzym, welches β-Glukoside spaltet (β-Glukosidase), ein Enzym, welches Milchzucker spaltet, (eine Laktase, Glukolaktase) und Amygdalase. Sodann ist vorhanden: ein fettspaltendes Enzym (Lipase, DUNLAP und SEYMOUR, MARIO TONEGUTTI), oft[S. 603] Invertin (Invertase, BOURQUELOT und HÉRISSEY, 1903), ein Phytosterin (BENECKE), Asparagin (0,3% HENSCHEN 1872, PORTES 1876), Cholin (GUARESCHI), sowie neben Pepton und Albumosen (zusammen 0,25%, LEMPORT) und einer sehr geringen Menge eines in der Wärme gerinnenden Eiweißkörpers (COMMAILLE) das globulinartige Proteid Amandin (PROUST, COMMAILLE, den Namen behalten OSBORNE und CAMPBELL bei, = Glutine DENIS (?), nicht = Conglutin, RITTHAUSEN), das bei der Hydrolyse Glycocoll, Alanin, Valin, Leucin, Prolin, Phenylalanin, Asparaginsäure, Glutaminsäure, Tyrosin, Arginin, Histidin, Lysin, Tryptophan und Ammoniak liefert (OSBORNE und CLAPP). Mandelkerne entwickeln schon mit Kalkwasser erwärmt Ammoniak (FLÜCKIGER).
Das Globulin Amandin ist ein Phytovitellin. Es zeigt die Zusammensetzung: C = 51,30, H = 6,90, N = 19,32, O = 22,04, S = 0,44 (OSBORNE und CAMPBELL). Es gibt mit Chlornatrium und Quecksilberchlorid keine Fällung und wird durch Magnesiumsulfat teilweise gefällt; bei 80° scheiden sich aus der Lösung Flocken aus. Es ist bisher nur in Amygdalaceen gefunden worden. Es kommt wohl vorwiegend in der Grundsubstanz der Aleuronkörner vor (s. Anatomie). Laktase und Emulsin finden sich außer in den Mandeln auch in Pfirsich-, Aprikosen- und Apfelkernen (BOURQUELOT und HÉRISSEY), Emulsin, das im Pflanzenreich weit verbreitet ist, auch in Lichenen, sowie Pilzen, vielen Gymnospermen und Monocotylen (HÉRISSEY, HEUT). Amygdalin scheint in der süßen Mandel ganz zu fehlen oder nur in Spuren vorhanden zu sein [ALMÉN, SCHEITZ und LUDWIG (1872)]. In den Samenschalen findet sich ein eisengrünender Gerbstoff (LUDWIG).
Die Asche der Samen beträgt 3,05% (FLEURY), 4,9% (KÖNIG), 5% (ZEDLER). Sie enthält in Prozenten: Kali 27,95, Natron 0,23, Kalk 8,81, Magnesia 17,66, Eisenoxyd 0,55, Phosphorsäure 43,63, Schwefelsäure 0,37.
Der Gehalt der Samen an Öl beträgt etwa 50%, steigt aber auf 54,9 (FLEURY), 55,3 (VOHL), 55,42 (FLÜCKIGER), ja 57,3% (LANGLEY, in «chines. süßen Mandeln», s. oben S. 597). Beim Pressen erhält man 38–45%.
Das Mandelöl, Ol. Amygdalae s. Amygdalarum expressum (huile d’amande, almond oil, olio di mandorle, amandelolie, ἀμυγδαλέλαιον), das ebenfalls und oft in größerem Umfange aus den bitteren Mandeln oder aus einem Gemische beider dargestellt wird — beide Öle stimmen im wesentlichen miteinander überein —, wird meist durch kalte Pressung der zerkleinerten ungeschälten Samen in Zwillichsäcken gewonnen. Es besteht fast ausschließlich aus Olein, enthält kein Stearin (GUSSEROW, HEHNER und MITCHELL), dagegen 5,71% Linolsäure (FARNSTEINER) — reine Ölsäure kann daher nicht aus Mandelöl dargestellt werden —, freie Fettsäuren fehlen ganz (SALKOWSKI erhielt einmal 0,75%). Mandelöl wird nur langsam ranzig. Noch nach einem Jahre erhielt LEWKOWITSCH nur geringe Säurezahlen (0,79, 3,1).
Das spez. Gewicht beträgt 0,914–0,920, meist 0,9178–0,9183 (LEWKOWITSCH), der Erstarrungspunkt liegt bei −10 (GIRARD) bzw. −21 (MABEN), die Verseifungszahl beträgt 189,5–195,4, die Jodzahl 93–101,26 (meist 96–98), die Bromzahl 69,87–74,37 (TELLE), die Hehnerzahl 96,2, die Maumenézahl 51–54°, die Bromthermalprobe 17,6–21°, der Brechungsexponent (bei 40°) 1,4632–1,4642 (Pharm. helv. IV) im Butterrefraktometer (bei 15,5°) 70,9 Skalenteile, die Thermozahl, im Thermoleometer von TORTELLI bestimmt, ist 50,7.
Der Erstarrungspunkt der Fettsäuren liegt beim Öle aus süßen Mandeln bei 9,5–10,1, bei dem der bitteren Mandeln bei 11,3–11,8° (LEWKOWITSCH), der[S. 604] Schmelzpunkt der Fettsäuren liegt bei 13–14°, ihre Neutralisationszahl beträgt 204 mg KOH, ihre Jodzahl ist 93,5–95,5 bei süßen, 94,1–96,5 bei bitteren Mandeln (DE NEGRI und FABRIS) (die Jodzahl der flüssigen Fettsäuren 101,7).
Das Mandelöl ist also durch eine niedrige Jodzahl und niedrigen Schmelzpunkt der Fettsäuren ausgezeichnet.
Die Charakteristika einiger Mandelöle und verwandter Öle ergaben sich aus folgender Tabelle (LEWKOWITSCH).
|
Art des Öles
|
Spezifisches
Gewicht |
Verseifungs-
zahl |
Jodzahl
|
Butter-
refrakto- meter b. 40°C |
Säure-
zahl |
Fettsäuren
|
Farbenreaktionen
|
||
|
Nautrali-
sationszahl |
Versei-
fungszahl |
Biebers Probe
(H2SO4 + rauch. HNO3) |
Phloroglucin-
Salpetersäure- probe |
||||||
|
Mandelöl ausgepreßt aus:
|
|||||||||
|
1. Süßen Valenciamandeln
|
0,91995
|
207,6
|
99,4
|
57,5°
|
5,16
|
207,8
|
207,6
|
Farblos
|
Keine Färbung
|
|
2. Geschälten süßen
Valenciamandeln |
0,9182
|
191,7
|
103,6
|
57,5°
|
2,9
|
196,4
|
201,7
|
Farblos
|
Keine rote Färbung
|
|
3. Süßen sicilianisch.
Mandeln |
0,9178
|
183,3
|
100,3
|
57,0°
|
0,79
|
198,8
|
202,2
|
Farblos
|
Keine rote Färbung
|
|
4. Bitteren Magazanmandeln
|
0,9180
|
188,6
|
102,5
|
56,5°
|
3,1
|
196,8
|
203,1
|
Farblos
|
Schwach rot
|
|
5. Kleinen indischen
Mandeln |
0,91907
|
189,2
|
96,65
|
57,0°
|
2,9
|
195,8
|
200,7
|
Farblos
|
Schwach rot
|
|
6. Bitteren Mogadormandeln
|
0,9183
|
194,98
|
104,2
|
57,0°
|
1,3
|
197,1
|
203,2
|
Farblos
|
Keine rote Färb.
|
|
7. Pfirsichkernöl
|
0,9198
|
191,4
|
95,24
|
57,5°
|
3,0
|
196,8
|
205,0
|
Zuerst farblos,
dann rot |
Tiefrote Färb.
|
|
8. Aprikosenkernöl
|
0,9200
|
192,4
|
107,4
|
58,0°
|
2,3
|
198,0
|
202,0
|
Rotfärbung
|
Tiefrote Färb.
|
|
9. Aprikosenkernöl
Mogador |
0,9172
|
198,2
|
107,9
|
57,0°
|
2,8
|
194,0
|
200,7
|
Schwach rot
|
Weniger tiefrot
als 8 |
|
10. Kalifornisches
Aprikosenkernöl |
0,92026
|
190,3
|
108,7
|
58,0°
|
1,2
|
197,8
|
202,8
|
Sehr schwach rot
|
„ „ „
|
Nach dem Eintragen in konz. Kali-Ammoniak (HARTWICH-UHLMANNsche Mischung), verhält sich Mandelöl ähnlich wie Olivenöl (s. d.). Die Verbrennungswärme des Mandelöls beträgt bei konstantem Volumen 9454, bei konstantem Druck 9469 g-cal. (SHERMAN und SNELL). Bei der Keimung wird das Fett aufgebraucht (FLEURY 1865).
Die Mandelpreßkuchen, die, wenn sie ausschließlich von süßen Mandeln stammen, was aber zurzeit jedenfalls selten ist (s. oben), als Futtermittel benutzt werden können (Prüfung auf Blausäure im Destillat!), enthalten im Durchschnitt in %: Wasser 6,69, Fett 15,15, stickstoffhaltige Substanzen 41,28, stickstofffreie Substanzen 20,63, Cellulose 8,94, Asche 4,31 (COLLIN-PERROT).
Mandelschalen enthalten in %: Wasser 9,65, Stickstoffsubstanz 2,08, Fett 1,15, in Zucker überführbare Stoffe 16,74, sonstige stickstofffreie Substanzen 18,5, Rohfaser 48,76, Asche 3,17 (in der Asche im Mittel 11,17% K2O).
Lit. BOULLAY, Anal. d. amand. douc. Journ. pharm. 1817, 337 und Buchn. Rep. 6, 395. — SACHS (Vgl. Unters. d. süß. u. bitt. Mand.), Berl. Jahrb. f. Pharm. 1816. — PROUST, Journ. chim. phys. 54, 199. — VALLÉE, Compt. rend. 136 (1903) 114. — PELOUZE, Ann. Chim. phys. 45 (1855), 324 (Journ. pharm. (3) 27, 321). — SCHEITZ und LUDWIG, Die Bestandt. d. süßen Mandeln. Arch. Pharm. 1872, 420. — BOURQUELOT, Journ. pharm. chim. 18 (1903), 241 u. Arch. Pharm. 1907, 173. — LECLERC DU SABLON, Compt. rend. 123, 1084. — WITTMANN,[S. 605] Zentrbl. d. Landw. Versuchswes. v. Österr. 1901, 131. — LEMPORT, Über d. Pepton d. süß. Mand. Pharm. Zeitschr. f. Rußland 1897, 528. — ORTLOFF (Analyse d. Emulsins). Arch. Pharm. 98 (1846). 12. — HÉRISSEY (Emulsin in Lichenen). Journ. pharm. chim. 1898, 578 u. Rech. sur l’émulsine. Thèse Paris 1899. — BRACHIN, Lactase Thèse Paris 1904. — HEUT, Emulsin. Arch. Pharm. 1901, 581 (dort d. Lit.). — ROSENTHALER, Biochem. Zeitschr. 1908–1910. — CALDWELL und COURTAULD, Proc. Royal Soc. 79, 350. — ARMSTRONG und HORTON, Ebenda 80, 321. — EULER, Allg. Chem. d. Enzyme. 1910. — E. FISCHER, Vers. m. Emulsin. Ber. d. chem. Ges. 1894, 2990. — BENECKE, Lieb. Ann. 122, 249 u. 127, 105. — PORTES, Journ. pharm. chim. 1877, 30. — LANGLEY, Journ. am. chem. soc. 1907. — OSBORNE u. CAMPBELL, Journ. am. chem. soc. 1896. 609. — OSBORNE u. CLAPP, Am. journ. phys. 1908, 470. — MUSS-ARNOLT, Transact. am. ph. assoc. 23, 106. — COMMAILLE, Thèse Marseille, Jahresb. d. Chem. 1866, 712. — RITTHAUSEN, Eiweißkörper 1872 u. Journ. pr. Chem. (2) 23, 24 und 26. — BOURQUELOT u. HÉRISSEY, Compt. rend. 137 (1903), 56 u. Journ. pharm. 1903. — BARBIERI, Journ. pr. Chem. (2) 18, 102. — MARIO TONEGUTTI, Pharm. Centralbl. 1911, 332 u. 744. — DUNLAP und SEYMOUR, Journ. am. soc. 27, 935. — GODET (Stickstofffreie Bestandt.), Diss. Zürich 1909. — KÖNIG, Nahrungs- und Genußm. (dort d. chem. Lit.). — Älteste Analyse: ZWINGER (HEGNER), Analysis fruct. amygd. Basil 1703.
Öl: FLEURY, Ann. chim. phys. 4 (1865) 38. — VOHL, Dingl. Polyt. Journ. 200 (1871) 410. — FLÜCKIGER, Pharmakogn. — HAZURA und GRÜSSNER, Monatsh. f. Chem. 10, 242 (Ber. d. chem. Ges. 1889 Ref. 578). — LEWKOWITSCH a. a. O. — HEHNER und MITCHELL, Analyst 1896, 328. — ALLEN und BREWIS, Pharm. Journ. 1900, 87. — Über das Mandelgummi vgl. oben S. 455 u. HOFFMEISTER, Ber. d. d. Bot. Ges. 1898, 289.
Anwendung. Die süßen Mandeln dienen außer zur Ölpressung zur Bereitung der Emulsio amygdalarum, Syr. amygd. usw., sowie in der Küche und der Patisserie.
Epidermiszellen der Samenschale. 1 der Mandel, 2 des Pfirsich, 3 der Aprikose, 4 der Reineclaude, 5 der Zwetsche.
[Nach Hannig.]
Verfälschungen und Substitutionen. Ganze Mandeln werden oft mit Aprikosen-, Pfirsich- und Pflaumen-«Kernen» verfälscht. Pfirsichkerne sind flacher, breit eiförmig, scharfrandig, kleiner, ihre Schale ist sehr dünn, braun. Die Tonnenzellen verjüngen sich nach außen, so daß sie sich nur an der Basis berühren. Pflaumenkerne sind mehr lang als breit-eiförmig, dick, abgerundet mit dünner brauner Schale, mit unangenehmem Nachgeschmack. Die Tonnenzellen ähneln denen der Aprikose. Aprikosenkerne sind breit-herzförmig, flach, ihre Schale ist lederig, die Tonnenzellen sind meist kleiner als beim Pfirsich und der Mandel, in Flächenschnitten nicht wahrnehmbar. Geschmack ähnlich den Pflaumenkernen, Geruch nach dem Brühen unangenehm süßlich (WITTMACK und BUCHWALD, MOELLER).
HANNIG gibt folgende auf die Epidermiszellen (und die Nerven) gegründete Bestimmungstabelle:
1. Epidermiszellen am Nabelfleck (Chalaza) zusammenhängend (selten mit zerstreuten kleinen Lücken. Außenplatte verdickt (2).
Epidermiszellen am Nabelfleck in kleinere oder größere Gruppen aufgelöst oder ganz isoliert (3).
2. Epidermiszellen in der Flächenansicht groß, bis 100 µ[S. 606] Durchmesser, dünnwandig. Außenplatte nicht getüpfelt (bei tieferer Einstellung der Außenplatte zuweilen kaum erkennbare Punktierung), Außenplatte nicht (oder nur ganz ausnahmsweise) rissig aufgesprungen, in der Seitenansicht: Außenplatte kappenförmig verdickt (Pfirsich).
Epidermiszellen in der Flächenansicht beträchtlich kleiner, stark und unregelmäßig verdickt, sehr stark getüpfelt (vereinzelte Zwetschen).
3. Epidermiszellen in der Flächenansicht groß, bis 120 µ Durchmesser, dünnwandig. Außenplatte auffallend rissig gesprungen, sehr oft ganz abgebrochen, nicht getüpfelt (selten kaum erkennbare Punktierung bei tieferer Einstellung der Außenplatte). Die Seitenwände erscheinen gar nicht, oder erst bei tieferer Einstellung getüpfelt. Tüpfel zerstreut. In der Seitenansicht: Außenplatte nicht kappenförmig verdickt. — Nervenendigungen glatt zugespitzt, nicht baumartig verästelt, Nervenstämme ohne baumartig verästelte Abzweigungen (Mandel).
Epidermiszellen meist kleiner (etwa 60 µ), dickwandig, stark getüpfelt.
4. Nervenendigungen baumartig verzweigt, Nervenstämme mit kurzen, baumartig verästelten Abzweigungen. Epidermiszellen ziemlich klein, Außenplatte stets getüpfelt. In der Flächenansicht: Epidermiszellwände gleichmäßig dickwandig (Aprikose).
Nervenendigungen ohne baumartig verzweigte Enden oder Abzweigungen. Seitenwände sehr stark getüpfelt, unregelmäßig verdickt (5).
5. Samenschale braun, Tüpfel oft verzweigt, Tüpfelkanäle nach der Außenseite der Membran zu verdickt (Zwetsche).
Samenschale hellgelb, Tüpfel selten verzweigt, Tüpfelkanäle nicht nach außen verdickt (Reineclaude).
|
Epidermiszellen der Samenschale
|
||||
|
Durchmesser
|
Höhe
|
|||
|
Mandeln (Bari, Marokko, Provence)
|
23–124 µ
|
(69–84 µ)
|
64–144 µ
(ausnahmsweise 200 µ) |
(136–159 µ)
|
|
Pfirsiche (einheimische)
|
48–106 µ
|
(38–59 µ)
|
52–104 µ
|
(66–87 µ)
(ausnahmsweise 165 µ) |
|
Aprikosen (Lyon, Vaucluse, einheimische)
|
34–66 µ
|
(60–102 µ)
franz. bis 111) |
36–62 µ
|
(42–54 µ)
|
|
Reineclauden (einheimische)
|
32–64 µ
|
(«Pflaumen»
66–102 µ) |
34–48 µ
|
(48–60 µ)
|
|
Zwetschen (einheimische, kalifornische)
|
36–64 µ
|
(etwas kleiner wie die «Pflaumen»)
|
36–56 µ
|
(ungefähr wie die Pflaumen)
|
[Nach HANNIG, die Zahlen von WITTMACK und BUCHWALD in Klammern.]
Alle diese anderen Kerne sind bitter. Neuerdings kommen aber auch süße Aprikosenkerne aus Japan (und China) in den Handel (Analyse derselben bei ROSENTHALER und SCHAEFFER, Pharm. Centralh. 1911, 507). Zerbrochene und von Insekten beschädigte Mandeln sind zu verwerfen. Sie werden leichter ranzig als ganze. Zur Verfälschung benutzte «Mandeln in Flocken», die 1909 im Handel waren, erwiesen sich als zerschnittene Arachissamen (COLLIN), andere als geraspelte Copra. Mit Eau de Javelle gebleichte Mandeln waren 1909 im Handel (DEBRUN). Die sog. Amygdalae virides sind die Samen von Pistacia vera L. Der sog. «Mandelkaffee» hat mit der Mandel nichts zu tun. Er besteht aus den gerösteten und gemahlenen Knollen von Cyperus esculentus bzw. Rüben- oder Cichorienkaffee.
Lit. Wittmack und Buchwald, Untersch. d. Mand. von ähnl. Samen. Ber. d. Bot. Ges. 1901, 584 (mit Taf.). — HANNIG, Untersch. d. Mand. v. ähnl. Samen. Zeitschr. f. Unters. d. Nahrungsm. 1911, 577 (mit Abbild.).
Als Verfälschungsmittel des Mandelöls werden genannt: Mohnöl, Sesamöl, Nußöl, Baumwollsamenöl, Olivenöl, Arachisöl und besonders Pfirsich- und Aprikosenkernöl. Die beiden letzteren ersetzen oft (z. B. in Amerika 1903) das reine Mandelöl. Das sog. Ol. am. gallicum ist Aprikosenkernöl, rein oder mit Pfirsichkernöl gemischt. Sie sind z. Z. noch nicht mit Sicherheit im Mandelöl nachzuweisen. Reines Mandelöl bleibt mit Salpetersäure von 1,4 spez. Gew. farblos oder wird leicht gelb, reines Aprikosenkernöl wird orangegelb, reines Pfirsichkernöl[S. 607] gelblichbraun. Bei der Elaidinprobe ist die Ölschicht farblos beim Mandelöl, rötlich beim Aprikosen- und Pfirsichkernöl (SCHIMMEL). Vgl. auch die Tabelle auf S. 604. Mandelöle, die eine Jodzahl von über 105 geben, sind verdächtig.
Lit. NÉLIS (Nachweis fremder Öle), Ann. de Pharm. 1896. — LEWKOWITSCH, Soc. publ. Analysis. London 1904. — DIETERICH, Pfirsichkernöl. Pharm. Centralh. 1896. — SCHIMMEL, Ber. 1897 u. 1907 (chines. u. japan. Pfirsichkerne). — CHWOLLES (Prüf. auf Pfirsichkernöl). Chem. Zeit. 1903. — ALLEN und BREWIS, Almond oil and its substitut. Pharm. Journ. 1900, 87.
Geschichte. Die Mandel wird in der Bibel oft erwähnt (z. B. in der Genesis). Der Baum blüht in Palästina zuerst von allen Bäumen, daher hebr. schaked, d. h. sich beeilen. ARONS Reis war ein Mandelreis. Bei großen Festen tragen die Juden noch heute Mandelzweige in die Synagoge. Die Frucht der Mandel war das Modell für die Leuchter des Tabernakels (TRISTRAM). Sie scheint in Ägypten nicht kultiviert worden zu sein, denn die Juden brachten Mandeln dorthin als Geschenk. Schon die alten Hebräer und die Griechen kannten bittere und süße Mandeln. Deutlich werden sie als Amygdala amara und dulcia bei SCRIBONIUS LARGUS (I, S. 576) auseinander gehalten. Nach Griechenland kam die Mandel aus den Pontusgegenden. Der Name der Frucht wird zuerst bei PHRYNICHUS, einem Dichter der älteren attischen Komödie im V. Jahrh. n. Chr. erwähnt, als ναξία αμυγδάλη (ATHENAEUS II, 52), dann bei XENOPHON (ANABASIS IV, 4): ἀμυγδάλιον χρῖσμα. DIOSKURIDES erwähnt das ἀμυγδάλινον ἔλαιον. Daß die Römer die Mandel von den Griechen erhielten, zeigt der Name nux graeca. Nach PLINIUS wird Mandelöl aus zuvor gedörrten und gestoßenen bitteren Mandeln gepreßt. Die Scriptores rei rusticae erwähnen ihren Anbau, SCRIBONIUS LARGUS und ALEXANDER TRALLIANUS ihre medizinische Anwendung. Sie finden sich abgebildet in Pompeji (I, S. 575, SCHOUW, COMES). CATO erwähnt die Avellanae graecae, COLUMELLA nennt sie nuces graecae, SCRIBONIUS LARGUS amygdalae, CELSUS nux amara. Prähistorische Reste fehlen. In der Terramare wurden keine Mandeln gefunden, ebensowenig in der Saalburg. Der «Mandelkern» aus dem spätrömischen Pfahlbau von Fulda ist fraglich (WITTMACK). 760 n. Chr. werden Mandeln in der Charter des Klosters von Corbie (I, S. 714) erwähnt. Die mittelalterliche Kochkunst verbrauchte enorm viel Mandeln, wie z. B. das Inventar des JEANNE D’EVREUX 1372 (I, S. 716) und die Rezepte des Kochs RICHARD II. (1390) zeigen. In KARLS Capitulare (LXX, 83) wird die Kultur der Amandalarii empfohlen. Die Mandel wurde zur Karolingerzeit in Süddeutschland und Nordfrankreich naturalisiert und gelangte erst nach der normannischen Eroberung nach England. Noch zu TURNERS Zeit (1548) gedieh sie dort nur in Gärten. Im späten Mittelalter fanden sich Kulturen bei Speyer. BOCK erwähnt solche in der Pfalz, GESNER bei Straßburg, Lindau, Torgau, Breslau. Der chinesische Pentsao aus dem X. oder XI. Jahrh. erwähnt den Mandelbaum aus Indien und Persien. Im Mittelalter bezog Deutschland die Mandeln — wie noch heute — aus Italien. MARINO SANUTO (I, S. 722) erwähnt sie als Gegenstand des venetianischen Handels. Sie wurden damals auf den griechischen Inseln, z. B. auf Cypern, kultiviert. In Norwegen waren Mandeln im XIV. Jahrh. bekannt. In The spices, groceries etc. (1303, I, S. 84) stehen Ammigdalae, ebenso in der Danziger Preisliste 1410, ambrosianische Mandeln in den Braunschweiger Inventaren (1598 u. 1658) und der Frankfurter Taxe (1689). Der Autor des Makhzan erwähnt zwei Arten, die dickschalige und die dünnschalige (kaghazi), und kennt eine Art Enfleurage, bei der Mandeln benutzt werden, und die Benutzung der Schalenasche zu Zahnpulvern. POMET erwähnt verschiedene Methoden der Mandelölgewinnung. Er empfiehlt die noch heute übliche. MALPIGHI bildet (in Opera tab. XLIII N.) einen guten Längsdurchschnitt durch die Frucht und den Samen der Mandel ab. «Die Mandel mußte frühzeitig, wie die Nuß, mit der sie Ähnlichkeiten zeigt, als Sinnbild der sich verjüngenden Natur, des sorgsam eingeschlossenen Lebenskeimes, der männlichen Zeugungskraft oder der weiblichen Gebärmacht gelten» (AIGREMONT). Es knüpfen sich an sie viele stark erotische Sagen. (Einige teilt GUBERNATIS mit). Sie galt auch als die von der Natur dargebotene Bestätigung der unbefleckten Empfängnis Mariae: «Christus wurde gezeuget in Marien, wie der Mandelkern sich in der unverletzt bleibenden Mandel bildet» (CONRAD von Würzburg, Goldene Schmiede). Die Sitte, sich Weihnachten mit Mandeln zu beschenken, rührt daher. Auch in der Volkserotik und bei den Hochzeitsbräuchen spielt die Mandel, deren Form an den Hoden erinnert, eine Rolle.
Lit. DE CANDOLLE, L’origine d. pl. cult. — HEHN, Kulturpflanz. — TRISTRAM, Nat. history of the bible. 1898. — FLÜCKIGER und HANBURY, Pharmacogr. — Pharmacogr. indica. — HOOPS, Waldbäume und Kulturpflanzen 1905. — AIGREMONT, Volkserotik und Pflanzenwelt. — GUBERNATIS, La mythologie des plantes.
[S. 608]
Fructus Olivae und Oleum Olivae.
Syn. Ölbaum, Olive, — Olivier (franz.) — Olive tree (engl.) — Olijfboom (holl.) — Oljetraed (schwed.) — öljypuu (finn.) — olivo (span.) — oliveira (port.) — arab. aceytuno, der wilde acebuche, das Öl: aceite — russ., bulg., serb. mālina, maslicna, maslina (maslo slav. = Öl). Bei den Berbern der Ölbaum zitun (arab.), der Oleaster sebbūdj. Bei IBN BAITHAR Olea europaea = zajtūn, Oleum olivarum = zajt. Zeitu findet sich im hebräischen, phönikischen, arabischen und aramäischen. Der Ausdruck ging dann in das persische, kurdische, kaukasische und tartarische über (s. unten); goth. alev, alevabagms; althd. olbir, olei, oliboum; mhd. oele, ol, olbaum, olvyn sussolpawm; mnd. oly, ulber, ullebom. Bei LUTHER: ole, bei ALBERTUS MAGNUS: oliva, bei der HILDEGARD (I, S. 667) Oleybaum und Baumoleum.
Etym. Das Babylonisch-Semitische kennt keinen Namen für Olive. Der älteste Name der Olive ist das hebräische sait, der sich auch im phönik., aramäisch. und arab. findet, als seitun ins pers. türk., georg., malaii. und javan. überging, — syr. zayto, chald. zêtâ, äthiop. zayt — und von den Arabern (mit der Sache) auch nach Algerien (zitun, das Öl zit) und Andalusien (aceytuno, das Öl aceite) gebracht wurde. Der Stamm scheint auch im armenischen (dzêtʿ) und ägyptischen (tʿet-t, tat) wiederzukehren und auch im berberischen tazemmourt enthalten zu sein. Das griech. ἐλαία (= Ölbaum) und ἔλαιον (= Öl) leitet LAGARDE vom armenischen iul (= Öl) ab, was HÜBSCHMANN und SCHRADER aber nicht gelten lassen. Das römische oleum, oliva ging dann ins italienische (ulivo), französische (olivier) und spanische (olivo, oliveiro) über. LAGARDE leitet auch sowohl das semitische wie das ägyptische Wort aus dem armenischen oder einer nahestehenden Sprache ab. Das got. alév (= Öl) alêvabagms (= Ölbaum) ist vielleicht durch keltische Vermittelung aus olîva entstanden.
Stammpflanze u. systemat. Stellung. Olea europaea β sativa DC. (Olea sativa LK. u. HFFMNSG.) mit einer großen Anzahl (c. 300) Sorten, von denen einige zu Tafeloliven eingesalzen, andere zur Ölpressung benutzt werden.
ANTOINE GOUAN beschreibt schon 12 Sorten. Die Enzyklopädie (1765) 19, SEMLER 25, DUCHESNE 43. DEGRULLY bildet (1907) 23 französische, 12 algerische, 17 tunesische ab und erwähnt 43 italienische und 21 spanische Sorten. Die californischen Sorten sind abgebildet in Yearbook U. St. Dep. of agricult. 1897.
Oleaceae — Oleoideae — Oleineae (Olea) Sectio Euelaea DC.
Beschreibung der Stammpflanze. Der Ölbaum hat eine graugrüne, im Alter rissige Rinde, unbewehrte Zweige mit rundlichem Querschnitt, gegenständige, sehr kurzgestielte, lederige, immergrüne, lanzettliche, ganzrandige, am Rande etwas umgeschlagene Blätter, die oberseits grün, unterseits durch zahlreiche, schildförmige Haare silbergrau sind. Die zu kleinen achselständigen, rispigen Trauben vereinigten Blüten sind hermaphrodit und besitzen einen spitz-vierzähnigen bleibenden Kelch, eine kurzröhrige, tief-vierlappige weiße Krone, zwei am Grunde der Krone inserierte Staubgefäße mit kurzem Filament und großer Anthere und einen oberständigen, zweifächerigen Fruchtknoten mit kurzem Griffel und zwei Ovulis (Fig. 189). Die Frucht ist eine Drupa (das Wort drupa schon bei PLINIUS) mit einfächeriger, einsamiger (seltener zweifächeriger, zweisamiger), brauner, heller geaderter, etwas zusammengedrückter, harter, in der Form der Fruchtform folgender Steinschale. Der Same ist mit einer netzaderigen Schale umgeben, enthält reichlich Endosperm und einen geraden Keimling mit kurzem, nach oben gerichtetem Würzelchen und blattartigen Cotyledonen.
«Schön im Sinne der Romantik ist der Baum der Minerva nicht (vgl. Taf. XIV), aber nichts erweckt mehr das Gefühl der Kultur und friedlichen Ordnung und zugleich der Dauer derselben, als wenn er in offenen gereinigten Hallen mit dem kaum merklich flüsternden Laube an gewundenen Stämmen die Hügel ersteigt oder die geneigten Ebenen leicht beschattet und gern gesteht man ihm dann mit COLUMELLA das Prädikat prima omnium arborum zu» (HEHN).
Die Olive ist der Fruchtbaum der Mittelmeerländer par excellence. Das Mittelmeergebiet[S. 609] ist pflanzengeographisch das Reich des Ölbaums (DE CANDOLLE, GRISEBACH, FLAHAULT, TH. FISCHER), seine Polar- und Höhengrenze fällt mit der des Ölbaumes zusammen. Die Mittelmeerflora ist im wesentlichen eine Küstenflora und demnach liebt auch der Ölbaum das Küstenklima.
«Der Ölbaum ist also in jeder Hinsicht ein echt mediterranes Gewächs, ja geradezu das charakteristischste unter den immergrünen laubtragenden Holzgewächsen der Mittelmeerländer». «In lichten Hainen, die sanften oder terassierten Hänge der reichgegliederten Mittelmeerländer, selten die Ebene bedeckend, verleiht er mit seinen graugrünen, kleinen, steifen Blättern, die sich alle 2–3 Jahre erneuern, seinen, wenn er alt wird, knorrigen Stämmen, der Mittelmeerlandschaft ein ganz eigenartiges Gepräge» (TH. FISCHER).
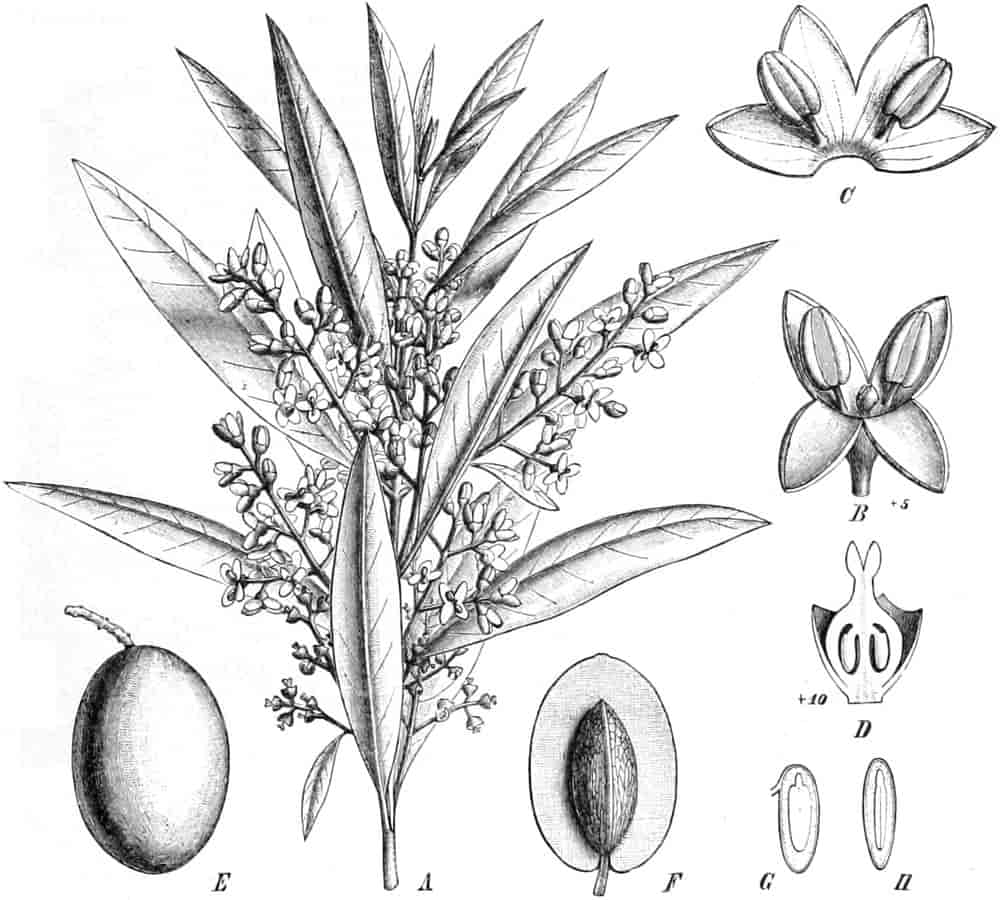
Olea europaea.
A blühender Zweig. B Blüte. C Krone ausgebreitet. D Kelch und Fruchtknoten. E Frucht. F Frucht durchschnitten, um den Steinkern zu zeigen. G und H Same im Längsschnitt.
[Nach Knoblauch in Engler-Prantl, Pflanzenfam.]
Er erreicht selten mehr als 10 m Höhe. Meist wird er im Alter hohl, «der Stamm zerspringt und löst sich in eine Gruppe knorriger, gespensterhaft verzerrter Stämme mit wunderlich verstrickten Gliedern auf» (Fig. 190). Er erscheint dann auseinandergeborsten, wie mit Toren versehen, schraubenförmig gedreht, im unteren Teile fast wie ein Felsblock (JUL. SCHMIDT). Die silbergraue Belaubung ist dünn, die Olivenhaine daher licht. Die Olive ist unverwüstlich. Im Garten Gethsemane bei Jerusalem werden 8 uralte Ölbäume gezeigt, die angeblich schon zu Christi Zeit erwachsen waren (RITTER). Auch anderwärts, besonders in Algier, finden sich solche alte Oliven. Der Ölbaum bedeckt z. B. in Ligurien, Apulien, Niederandalusien, dem tunesischen Sahel in lichten[S. 610] Hainen ganze Landschaften in einem polwärts sich unmittelbar an die Dattelpalmenzone anschließenden Gürtel. In Italien kann man die Zahl der Ölbäume auf 100, in Spanien auf 300 Millionen schätzen, in Tunis auf 20, in Corsika auf 36 Millionen. Die Olivenkultur reicht in Algarvien bis 1400′, in der Sierra Nevada bis 3000′ bzw. 4200′, bei Nizza bis 2400′, am Ätna bis 2200′, in Macedonien bis 1200′, in Cilicien bis 2000′ (GRISEBACH).
Der dornige, mehr buschige, selten stattliche, wilde Ölbaum, ἐλεῖα ἀγρία (DIOSKURIDES), κοτίνος (THEOPHRAST), Oleaster (PLINIUS), Olea europaea α Oleaster DC., der kleine, wenig fleischige, längliche, schwarze Früchte hervorbringt, mehr oder weniger vierkantige Zweige und längliche oder eiförmige Blätter besitzt, ist vom Ostrande des Hochlandes von Iran (BELLEW) über Syrien, Griechenland (HELDREICH), Italien (CARUEL) bis Spanien, Algerien und zu den westlichsten Tälern des Atlas verbreitet und wohl in allen diesen Ländern ursprünglich heimisch. Blätter des Ölbaums wurden im Pliocen bei Mongardino gefunden (CAVARA). Er wird nie zu einem Ölbaum, wie schon THEOPHRAST wußte — wie der Ölbaum durch Verwilderung nie zu einem Oleaster — und ist bestimmt verschieden von diesem. Der Oleaster bleibt hinter der Polargrenze des Ölbaums zurück. Er erreicht sie nicht. In Südchile und Mexiko, wo der Ölbaum kultiviert wird, ist Oleaster ganz unbekannt. Ob er die Urform, die Urolive, ist, aus der sich die Kulturolive entwickelt hat, wissen wir nicht, aber es darf wohl angenommen werden, daß entweder er oder ein naher orientalischer Verwandter die Urform ist. Von beiden verschieden ist der schon von THEOPHRAST unterschiedene indische Ölbaum (Olea cuspidata WALL.).

Alte Olivenbäume bei Rom.

(Ravasini phot.)
Lit. DEGRULLY ET VIALA, L’Olivier Montpellier 1886–1890. — DEGRULLY, L’olivier 1907 (m. zahlr. Abbild.) und Ann. Ec. nat. agric. Montpellier 1906. — A. COUTANCE, L’Olivier. Paris 1877. — G. CAPPI, La coltivazione dell’ Olivo. San Remo 1875. — THEOB. FISCHER, Der Ölbaum, seine geogr. Verbreit., seine wirtschaftl. u. kulturhist. Bedeut. Peterm. Geogr. Mitt., Ergänzungsheft Nr. 147, 1904 (mit einer Karte). — PASQUALE, Stud. bot. ed agronomici sull’ ulivo e sua varieta. Rend. R. Acad. scienz. etc. Napoli 1873. — PICCONE, Prim. stud. p. una monogr. d. princ. var. d’ulivo etc. Genova 1879. — TRABUT, L’Olivier en Algérie 1900. — G. CARUSO, Monografia dell’ ulivo in Enciclopedia agraria III, 1882 und Coltivazione degli ulivi e la manifattura dell’ olio 1870. — CABRIE, Der Olivenbaum, seine Cultur usw. 1901. — ALOI, L’olivo e l’olio 1903. — BRIZZI, Olivicultura 1903. — FLAMINIO BRACCI, Olivicultura ed oleificio 1907. — Kurze Übersicht: P. D’AYGALLIERS, L’olivier et l’huile d’olive. Paris 1900 (mit Abbild.). — EASTMANN, Olivenkultur in Californien. Pharm. Era 1896. — Über die Kulturen in Indien, Cuba usw. Brit. and Colon. Drugg. 1897. — WILLKOMM, Grundzüge der Pflanzenverbreitung auf d. Iber. Halbinsel 1896. — GRISEBACH, Vegetat. d. Erde. — SEMLER, Trop. Agrikult. — Abbild.: PABST-KÖHLER, Medizinalpfl. t. 109. — BERG-SCHMIDT, Atlas I. Aufl. t. 33. — NEES VON ESENBECK, Pl. med. t. 212. — BENTLEY-TRIMEN, Med. pl. t. 172 und in den oben genannten Werken.
Pathologie. Über die pflanzlichen Schädlinge berichtet Prof. ED. FISCHER: Auf dem Ölbaum sind sehr zahlreiche parasitische Pilze beobachtet worden, die mehr oder weniger erhebliche Schädigungen hervorrufen. Unter denselben interessieren uns zunächst vor allem die auf den Früchten auftretenden. Es sind das hauptsächlich sogenannte Imperfekte, die mehr oder weniger große, vertiefte und verfärbte Flecken hervorrufen und eventuell schließlich auch ein teilweises oder vollständiges Verschrumpfen oder Lederigwerden des Fruchtfleisches herbeiführen können: Gloeosporium olivarum D’ALMEIDA (La gaffa des olives en Portugal. Bulletin de la société mycologique de France XV 1890, p. 90), Macrophoma dalmatica (V. THÜM.) BERL. ET VOGL. (s. A. MAUBLANC, Sur une Maladie des Olives due au Macrophoma dalmatica. ibid. XX 1904, p. 229), Cylindrosporium Olivae L. PETRI (s. Annales mycologici V 1907, p. 320). — Ein eigentümlicher Hyphomycet ist Cyclogonium oleagineum CAST., welcher in der Epidermisaußenwand der Blätter sein Mycel entwickelt und dunkle rundliche Flecke hervorruft, aber auch auf Fruchtstiele und Früchte übergeht. Er ist in neuerer Zeit in Frankreich, Italien, Algier und im Kaukasus beobachtet worden. (Über denselben s. BOYER in Journal de Botanique V 1891, p. 434.) — Andere Erkrankungen wirken mehr indirekt auf den Fruchtertrag nachteilig ein; so die sogenannte Bruscakrankheit, die in neuerer Zeit auf den Discomyceten Stictis Panizzei DE NOT. zurückgeführt wird und der Rußtau (Capnodium salicinum). — Die wichtigsten Krankheiten des Ölbaumes behandelt L. DEGRULLY, L’Olivier, Montpellier 1907. — Ein Verzeichnis der damals auf Olea europaea bekannten Pilze gibt VON THÜMEN in Bollettino della società Adriatica di Scienze naturali in Triest. Vol. VIII 1883, p. 215 ff.
Die tierischen Schädlinge sind beschrieben und abgebildet bei DEGRULLY a. a. O. Dort auch die Beschreibung ihrer Bekämpfung (Fumigation etc.). Von tierischen Feinden werden genannt: die Olivenfliege (Mucha dell’ ulivo), Dacus oleae, deren Larve sich vom Fruchtfleische nährt und auch neuerdings wieder in Südfrankreich und Ligurien riesigen Schaden anrichtete und gegen die es noch kein Mittel gibt. Dann Tinea oleella FABR., die den Kern angreift, Psylla oleae FORK., die die Blüten schädigt. Über den nach TRABUT durch Bakterienimpfung durch Insekten zustande kommenden Olivenhonig vgl. oben S. 113.
Lit. CAPPI, La coltivazione dell’ Olivo 1875. — TRABUT, L’olivier en Algérie 1900 (mit Abbild.). — PAOLI A TAGLIAFERRI, La Mosca delle olive ed il modo di combatterla, Firenze 1909. — D’AYGALLIERS a. a. O.
Kultur. In Attika, dem klassischen Lande des Ölbaumes (HERODOT behauptet, daß es eine Zeit gegeben habe, wo nur in Athen Ölbäume zu finden waren?), wurde die Olivenzucht und die Ölausfuhr staatlich überwacht. Im ganzen Altertum galt das Fällen von Ölbäumen als Verbrechen und die äußerste Grausamkeit des Feindes äußerte sich im Altertum und äußert sich noch heute im Niederhauen der Oliven, d. h. in der Vernichtung der Existenzbedingungen. Noch heute werden (z. B. in Sizilien und Sardinien) hohe Prämien auf die Anpflanzung der Olive gesetzt. An den Boden stellt der Ölbaum keine hohen Ansprüche. «Olea maxime collibus, siccis et argillosis gaudet» (COLUMELLA). Er liebt warme, trockene, durchlässige, poröse, kalihaltige Kalkböden. Die besten Oliven, das feinste Öl kommen von diesen. Überschwemmungen darf der Boden nicht ausgesetzt sein. Man legt die Olivenhaine gern auf terassierten sonnigen Hängen (Taf. XIV), nicht in der Ebene an. Auf feuchtem fettem Boden wird die Frucht größer, liefert aber weniger und schlechteres Öl. Der[S. 612] Ölbaum meidet Gegenden mit reichlichen, besonders zur Zeit seiner Fruchtreife niedergehenden Niederschlägen. Die Fruchtreife verlangt hohe, trockene Wärme — je höher die Wärme, um so größer der Ölgehalt. Während z. B. 1909 1 dz Früchte 15,7 Liter Öl gaben, wurden in dem ungünstigen Jahre 1910 aus der gleichen Menge nur 14,8 Liter erzielt. Aber auch im Winter darf die Temperatur nicht stark sinken und Frühjahrsfröste sind besonders gefährlich. Doch kann der Ölbaum Temperaturen bis −8° aushalten, aber nicht lange. Die südliche und Polargrenze der Olive ergibt sich aus der Karte, ebenso die Verbreitung des Ölbaumes im Mittelmeerdrogenreich. Die Olive blüht im März (Südspanien, Nordafrika), April (Süditalien, Mittelspanien) oder Mai (Südfrankreich). Die Früchte werden im Laufe des Oktober reif. Doch dehnt sich die Ernte oft 3–4 Monate, ja über den ganzen Winter aus. Meist beginnt die Ernte im Oktober und endigt im März-April, nur ganz im Süden wird sie manchmal bis Juni hingezogen. Der Baum trägt nur an vorjährigem Holz Früchte. Die aus Samen erzogenen Oliven müssen gepfropft werden (die Samen keimen langsam, besser wenn sie zuvor in Aschenlauge gelegt werden). Zur Vermehrung werden außer Ablegern und Wurzelschößlingen auch die an den Wurzeln sitzenden Knoten (ovoli) benutzt, auch diese werden meist gepfropft. Die Kulturolive wird oft auf den Oleaster gepfropft. Die veredelten Ölbäume beginnen nach 3 Jahren Früchte zu tragen und kommen nach 8–10 Jahren zu vollem Ertrage, den sie dann bei guter Pflege (Düngung, Zurückschneiden) jahrhundertelang beibehalten können. Vom zehnten Jahre an ist der Baum rentabel. Man erntet die Olive, wenn sie ⅚ reif ist. Der Ertrag wechselt natürlich sehr. Ein großer Baum liefert in Italien bis 110 l Oliven, die etwa 13 kg Öl geben, in Sfax (Algier) ein volltragender Baum 320 l. Meist liefert ein ausgewachsener Ölbaum aber nur durchschnittlich 63 kg Früchte. Vollernten erfolgen durchschnittlich nur alle 7 Jahre, in der Zwischenzeit ist der Ertrag unbedeutend (RICKLI, Corsica). Meist folgt auf eine gute Ernte eine schlechte. In Italien rechnet man auf 3 Jahre 1½ volle Ernten. Doch erzielt man in Californien durch sorgfältige Pflege alle Jahre Vollernten. Man pflanzt die Bäume etwa in Entfernungen von 5 m oder weiter, damit das Licht leicht Zutritt findet. In Südfrankreich kommen 125–200 Bäume auf den Hektar, in Sizilien und Smyrna 100, in Tunis oft nur 17. In Mischkultur mit Olive ist (in Sizilien) Sumach, bisweilen auch die Rebe, in Corsika auch Weizen, Artischocken, Gerste oder Bohnen. Die Kultur der Olive ist bei SEMLER a. a. O. ausführlich beschrieben.
Verbreitung der Olivenkultur. Portugal hat fast in seiner ganzen Ausdehnung, mit Ausnahme allein des Nordens (die Polargrenze fällt fast mit der politischen Grenze zusammen), Olivenhaine (oliveiras), 200000 ha sollen in diesem Lande unter Oliven stehen, doch ging die Olivenkultur lange Zeit zurück. Die Ausfuhr von Olivenöl betrug 1900: 379509 hl. Neuerdings hebt sie sich wieder. Viele Ortsnamen erinnern an die Olive (Oliveira, Olivaes, Azeitas).
Spanien hat von allen Ländern die meisten Olivenhaine (1154000 ha sollen (1899) unter Oliven stehen) und liefert das schlechteste Olivenöl. Die nördlichen Gegenden haben, mit Ausnahme des Ebrotales, keine Olivenkultur, wohl aber die ganze Mittelmeerküste (Katalonien, Valencia, Murcia) die Balearen und große Bezirke des Innern um Madrid und südlich davon. Die für die Olivenkultur wichtigste Landschaft ist Andalusien, dann Katalonien und Aragonien. WILLKOMM schildert einen 90 km langen Olivenhain in Niederandalusien. Obenan stehen die Provinzen Cordoba und Sevilla. Dann folgen Lerida und Tarragona und in weitem Abstand Badajoz, Murcia, Ciudad Real, Toledo, Valencia, Malaga und Zaragoza. Spanien verbraucht selbst viel Oliven und Öl, exportiert aber doch noch jährlich für 18–57 Mill. Pes. Öl über Malaga, Sevilla, Cadiz, Barcelona.

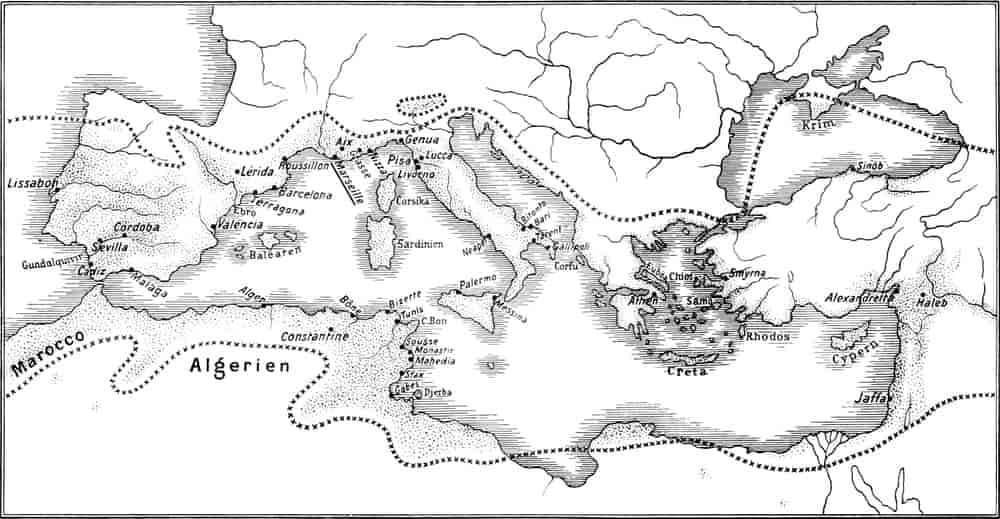
Mit Benutzung der Karte von Theobald Fischer gez. von A. Tschirch.
In Frankreich finden sich Olivenhaine nur im Süden an der Mittelmeerküste, vorwiegend in der Provence, Roussillon, Languedoc, Alpes maritimes, Var, Bouches du Rhône, sowie auf Corsika. Ein Teil des südfranzösischen Arrondissement Grasse ist ganz mit Oliven bestanden. Grasse liefert das feinste Öl der Provence, dann Aix und Nizza. 130–150000 ha sind mit Oliven bestanden, die etwa 2 Mill. dz Oliven liefern. Marseille ist ein wichtiger Handelsplatz für Olivenöl. Es führt viel aus Spanien und Tunis ein und viel auch aus.
Nächst Spanien ist Italien das olivenreichste Land (900000 ha). Sein Landschaftsbild wird durch die Olive geradezu beherrscht. Nur Piemont hat keine Olivenzucht, sonst alle Landschaften, besonders die Küsten, fast ganz Sizilien und ein großer Teil Sardiniens. Obenan steht Apulien, dann folgt Sizilien und die Tyrrhenische Südregion, endlich Toskana, Marken und Umbrien, Ligurien, Latium, Sardinien. Eine italienische Mittelernte liefert 2–3 Mill. hl. Olivenöl, fast ebensoviel wie das viel mehr Oliven beherbergende Spanien. Italien führt Ol. oliv. besonders aus Bari, Palermo, Messina, Livorno, Genua, Gallipoli, Porto Maurizio, Neapel, Tarent aus. 1890 betrug die spanische Ernte 3, die italienische 1,3 Mill., die französische 300000 hl Oliven.
Olivenkultur findet sich auch in Albanien, Epirus, Thessalien, Mittel-Griechenland (Olivenhain am Kephissos bei Athen), Peloponnes (Argolis, Messenien), Korfu, Leukas, Lesbos und anderen Inseln, besonders Kreta, das eine wahre Oliveninsel ist. Die jährliche Olivenproduktion Griechenlands beträgt c. 141 Mill. kg, wovon c. 6,5 Mill. kg exportiert werden, die jährliche Ölproduktion 25 Mill. kg, wovon die Hälfte exportiert wird (EMMANUEL). In der Türkei sind namentlich am Marmarameere, auf den Inseln des ägäischen Meeres und in Kleinasien Olivenkulturen. Kleinasien hat aber für die Olivenzucht nur geringe Bedeutung, in Betracht kommt fast nur die Westküste und die ihr vorgelagerten Inseln (Chios, Samos). Cypern ist reich an Ölbäumen. Die Levante produziert jährlich c. 100000 t (Smyrna z. B. 1906: 15000 t). Syrien das Urland der Olivenzucht, hat auch heute noch viel Olivenhaine — Alexandrette exportiert Öl — und auch in Palästina ist der Ölbaum häufig. Der Ölberg bei Jerusalem trägt noch heute Ölbäume. Tripolis, das im Altertum und Mittelalter zu den wichtigsten Bezugsländern für Olivenöl gehörte, deckt heute nicht einmal den eigenen Bedarf. Großen Aufschwung hat in letzter Zeit die Olivenzucht in Tunis und Algerien (Djurdjura) genommen, so z. B. um Sfax, im Sahel (Sahel bringt jetzt die besten Oliven hervor). Freilich zu der Bedeutung, die sie in diesen Ländern im Altertum besaß, ist sie noch lange nicht wieder gekommen. Immerhin erzeugt doch Tunis schon jährlich 30 Mill. Liter Öl. Im Sahel (Susa, Monastir) stehen c. 600 Quadratkm. unter Oliven. Auch Marocco besitzt (z. B. in Sus, Haha) viele Olivenhaine, die aber zum Teil bewässert werden müssen. Bedeutend ist die Olivenzucht in den Tälern des Atlas. Endlich findet sich die Olive auch noch auf den Canaren.
Nach Amerika brachten den Ölbaum die Spanier, nach Mexiko 1519 CORTEZ, nach Peru c. 1560 AMBROSIO DE RIVERA, nach Californien im XVIII. Jahrh. die Franziskaner. Jetzt finden sich Olivenpflanzungen auch in einigen südamerikanischen Staaten (Chile, Peru). Besonders nimmt aber die Kultur der Olive in Nordamerika einen großen Aufschwung, seit das Agricultur Department sich seiner angenommen hat. Schon 1907 deckte Kalifornien einen Teil des Bedarfes von U. S. A. Und auch in Südafrika und Südaustralien wird jetzt die Olive angepflanzt und Öl exportiert. 1902 zählte man in Australien schon c. 67000 Olivenbäume, die 11327 galls. Öl lieferten. (Nähere Angaben über die Verbreitung der Olive in TH. FISCHER, Der Ölbaum 1904.)
Die californische Olivenzucht liefert vorwiegend Salzoliven. Die besten Salzoliven kommen aber von Andalusien.
Die Olive gedeiht in Peru, Chile, Südcarolina, Florida, den Bermuden, auf Jamaica, im Südwesten der Kapkolonie, auf Kawau-Island (bei Auckland) bei Sydney, in Vorderindien und Japan — in allen diesen Ländern sind Kulturversuche gemacht worden.
Eine Karte der Verbreitung der Olivenkultur in Frankreich bei DEGRULLY (a. a. O.). Die Kultur der Olive, die Pfropfung, Beschneidung, Düngung usw. ist beschrieben bei DEGRULLY TRABUT, CAPPI u. and. Lit. s. oben S. 610. Im übrigen vgl. die hier beigegebene Karte.
Sciarbottatojo. Apparat, welcher in Italien zum Waschen der Oliven gebraucht wird, links von außen, rechts innere Einrichtung.
[Ravasini.]

Einfache Ölmühle der Araber in Algier.

Frantojo. Moderne Mühle, in der die Früchte zu einem Brei gemahlen werden.

Strettoi, welche zum Pressen der mit dem Fruchtbrei gefüllten Fiscoli dienen.
Erntebereitung. Die Ernte ist in Italien verschieden. RAVASINI berichtet mir darüber das Folgende. Entweder werden sie mit der Hand gepflückt (brucatura, raccolta a mano Taf. XV) — dies ist unbedingt nötig, wenn man feine Tafeloliven oder feinstes Öl erhalten will — oder vom Baume auf darunter gebreitete Tücher (I, S. 94) geschüttelt (scotitura) bzw. abgeklopft (bacchiatura, abbacchiatura) — in Calabrien und[S. 614] Sizilien üblich — oder die abgefallenen aufgelesen (raccattatura, raccolta a terra). Auch in Portugal werden noch jetzt die Früchte vielfach von den Bäumen abgeschlagen. Infolgedessen folgt auf ein gutes Jahr meist ein schlechtes (MASTBAUM 1904). Das Pflücken wird in Italien besonders von Frauen und Kindern besorgt, die die Früchte dabei in Tuchtaschen oder geflochtene Strohkörbe oder auf ein unter den Baum gebreitetes Tuch (recane) werfen. Die abgeklopften oder abgeschüttelten werden mit hölzernen rechenartigen Werkzeugen (in Calabrien cernigghi genannt) zusammengeharkt und dann in Strohkörben vereinigt. Diese werden auf dem Kopf oder den Schultern in die Ölmühle getragen. Hier werden sie von Erde, Blättern, Staub usw. befreit, die unreifen oder überreifen Früchte ausgelesen (cernita) und dann gewaschen. Das Waschen geschieht jetzt vielfach, besonders bei größeren Quantitäten, in besonderen Apparaten (sciarbottatojo), die diese Arbeit sehr vereinfachen (Fig. 191). Die[S. 615] gewaschenen Oliven kommen dann in die Ölmühlen (oleifici), die oft noch sehr primitiv sind (I, Fig. 174 und Fig. 192) und an denen die Bauern, von denen fast jeder Wohlhabendere eine Ölpresse besitzt, im Laufe der Jahrhunderte wenig geändert haben (vgl. I, Fig. 175). Erst in neuerer Zeit, wo sich die Ölpresserei allmählich zu zentralisieren beginnt, ist der Betrieb modernisiert worden. Die Oliven werden zunächst mit Mühlsteinen (frantoj), die, nicht bis zum Boden reichen also die Steinkerne nicht mit zertrümmern, zermahlen (frangitura) (Fig. 193). Der Brei des Fruchtfleisches wird nun in die oben und unten offenen, schon von PLINIUS erwähnten geflochtenen Körbe, Fiscoli (Abbild. in I, Fig. 173) gebracht, von denen 20 bis 25 in den hölzernen oder eisernen Pressen (torchi, strettoi, Fig. 194) übereinandergepackt werden und nun mit der Hand gepreßt. Neuerdings werden in den größeren Etablissements auch hydraulische Pressen benutzt, aber am fiscolo hält man auch bei diesen fest. Das beste Olivenöl, wie solches in der Pharmazie ad usum internum benutzt wird, wird in Fabriken mit Dampfbetrieb aus bei beginnender Reife gesammelten,[S. 616] zuvor auf Horden oder in besonderen Trockenapparaten zum Trocknen ausgebreiteten Früchten durch mäßiges Pressen hergestellt. Eine zweite stärkere Pressung, die aber auch noch nicht die Kerne zertrümmern darf, liefert Secunda-Speiseöl und für medizinische Pflaster und Seifen benutzbares Öl, eine dritte Brenn- und Maschinenöl. Die erste Pressung, die in Frankreich nur 12% Öl gibt, liefert das beste Öl, das durch Baumwolle filtriert, als Olio vergine (huile vierge, Jungfernöl) in den Handel kommt. Der Preßrückstand wird mit kaltem oder warmem Wasser nochmals zermahlen und dann wieder in die Presse gegeben. Dies zweite Öl (Olio mangiabile, O. di seconda pressione, O. di pasta franta, O. di macina, O. di rinozzolo) hat nicht mehr das charakteristische Olivenaroma wie das erste. Aus den Preßrückständen (sansa) erhält man mittels Schwefelkohlenstoff, Benzin, Petroläther oder Wasserdampf das gewöhnliche, nur technisch benutzbare Baumöl (Olio di sansa, O. di ciancia, O. al solfuro, Sulfuröl, in Frankreich huile de ressence, h. d’enfer). Als Extraktionsmittel wird in Marseille außer Schwefelkohlenstoff auch Tetrachlorkohlenstoff verwendet. Das mit Schwefelkohlenstoff extrahierte Öl, das einen schlechten Geruch und Geschmack besitzt, kann durch Behandeln mit Alkohol verbessert werden. Die z. B. in Sizilien übliche Methode, die zerquetschten Oliven zunächst in einer Zisterne (enfer) gären zu lassen, führt zwar zu hohen Ölausbeuten, aber zu einem fettsäurereichen Öl (Tournantöl). Zur Herstellung ganz feiner Ölsorten werden die Früchte bisweilen geschält, d. h. von der äußersten Fruchthaut befreit, entkernt, das Fleisch in Mörsern zerrieben und zwischen Tüchern gepreßt. Eine Wertverminderung des Öls wird durch das Mitzerquetschen der Kerne nicht bewirkt, da bei dem gewöhnlichen Herstellungsverfahren nur geringe Mengen davon hineingelangen (PASSERINI) und die Samen nur Spuren einer Lipase enthalten (MARCILLE). Manchmal wird in Frankreich mit dem Pressen eine Art Schlemmprozeß in sog. Pastenmühlen (auf eine Pastenmühle kommen 6–10 Pressen) kombiniert. Die Preßrückstände werden mit Wasser zu einer Paste angerieben und diese durch Schlämmen mit Wasser in mit Rührwerken versehenen Bassins in die schwereren und die ölreicheren, leichteren Bestandteile getrennt, die dann gesammelt und in Tüchern gepreßt werden (Chem. Rev. 1903). Dies Öl ist minderwertig.
Die Trester dienen als Dünger, die abgeschlemmten Steinkerne auch als Brennmaterial. Doch werden die Steinkerne (Olivenkerne) neuerdings auch auf Öl verarbeitet und gemahlen zur Verfälschung von Gewürzen benutzt. Über das Filtrieren und Zentrifugieren vgl. I, S. 134.
Das in den ersten Monaten der Ernte gepreßte Öl ist dunkler und hat obstähnliches Aroma und einen etwas scharfen Geschmack, das Öl wird um so heller, dünnflüssiger und milder, je mehr sich die Olive ihrer Reife nähert. Der Versand erfolgt in Italien nicht vor dem Januar. Die anfangs trüben Öle klären sich beim Lagern während 90 Tagen in großen (meist mit Porzellan- oder Marmor- oder Tonplatten ausgekleideten) Zisternen, indem sich die Schleimteilchen usw. zu Boden setzen. Diese werden durch Watte abfiltriert. Die weniger guten Ölsorten werden oft in Raffinerien gereinigt. Dort werden die besseren Sorten nach Dekantation filtriert oder mit Citronensaft oder Eichenrindeauszug, bzw. einer Tanninlösung, die mit einem Weidenbesen eingerührt werden, geklärt, die schlechteren mit 0,5–2% Schwefelsäure behandelt. Ein Bleichen des Öls wird (außer durch Tannin) auch dadurch bewirkt, daß man das fein verstäubte Öl womöglich bei Sonnenlicht in ein mehrere Meter tiefer liegendes Wasserbassin fallen läßt.
Die größte Ölmenge soll die in Spanien kultivierte var. hispanica, das feinste Öl[S. 617] die in der Provence und bei Genua und Lucca kultivierte var. pignola liefern. Oliven, deren Fleisch nicht das dreifache Gewicht des Kernes hat, geben zu wenig Öl aus (COUTANCE). Die Qualität des Öles ist abhängig von der Olivensorte, dem Reifegrade der gepreßten Frucht, der Art des Erntens und dem Verfahren beim Pressen. Die feinsten Öle werden auf Flaschen abgezogen, die anderen auf Fässer bzw. Barells.
Die Oliven in Salzwasser (Colymbades) finden sich während mehrerer Monate als Nachtisch jeder italienischen Mahlzeit, werden aber auch viel exportiert. Die Olive muß, um hierzu tauglich zu werden, nur ¾ reif sein und zuvor 6–12 Stunden in eine Kalk-Pottaschelauge eingelegt und dann sorgfältig während mehrerer Tage gewaschen, d. h. vollständig entbittert werden. Dann legt man sie in Salzwasser, wechselt dies alle Monate einmal und fügt schließlich etwas wilden Fenchel hinzu (RAVASINI). Beschreibung anderer Methoden der Olivenpickelsbereitung bei SEMLER.
Lit. MINGIOLI, Manuale pratico di oleificio 1871 und Oleificio moderno in Nuova Enciclopedia agraria italiana. Torino 1901 (m. zahlr. Abbild.). — SEMLER, Trop. Agrikult. — SKINNER, Ölindustrie in Frankreich. Consularbericht in Oil, Paint and Drug. Rep. 1903 (Chem. Rev. d. Öl- u. Harzind. 1903, 188). — Über die Veränder. d. Oliven von der Ernte bis zur Verarbeitung vgl. die Unters. d. Versuchsstat. in Lissabon (Ref. in Chem. Rev. 1904, 39). — Die Mühlen, Pressen, Wasch- und Raffinierapparate sind abgebildet bei MINGIOLI a. a. O. — Die primitive Gewinnung des Olivenöls auf Mallorca beschreibt POLLATSCHEK (Chem. Rev. 1907, 4).
Handelssorten. Von den italienischen Ölen sind die aus der Riviera, aus Toskana (Lucca, Pisa), Apulien (Bari, Bitonto, Gallipoli) die geschätztesten, die Provinzen Marken, Umbrien, Latium liefern gute Speiseöle, Sizilien dagegen minderwertige Sorten. Die besten Sorten (Jungfernöl) werden als Provencer, Aixer, Genueser oder Lucca Öl bezeichnet — Provenceröl ist eine Qualitätsbezeichnung und keineswegs nur für Öl aus der Provence in Gebrauch —, die Sekundasorten (Baumöl, grünes Olivenöl, huile lampante, h. marchande) als Gallipoli-, Puglieser-, Bari-, Lecce-, Monte San Angelo-Öl, Tertiasorten kommen von Messina, Malaga, Korfu und Tunis. Die schlechtesten, zur Seifenfabrikation benutzten Öle heißen Lavati (gewaschene), auch Nachmühlenöl, Höllenöl, Sottochiari. Dann ist auch gebleichtes sog. weißes Baumöl (als Maschinenöl, Lilienöl) und Ol. oliv. denaturatum (zur Seifenfabrikation, mit Nelken- oder Rosmarinöl denaturiert) im Handel (WEIGEL 1904).
In Italien werden die Öle eingeteilt in:
I. Oli commestibili: 1. sezione oleinati; a) oli vergini, b) oli mangiabili; 2. sezione stearinizzati: oli grassi.
II. Oli non commestibili: 1. materia prima avariata, o fondacci di oli di semi di olive: oli avariati, 2. oli estratti dai residui: a) oli di sansa o di panelli, b) oli di morchia o di semi, c) oli d’inferno, d) oli al solfuro; 3. oli alterati, a) oli rancidi, b) Oli inaciditi.
Tunesisches Öl kommt aus dem Norden (Tunis, Bizerte, Cap Bon, Medjerdah), dem Zentrum (Sousse, Mahdia, Monastir), dem Süden (Gabès, Safsa, Djerba) und von Sfax. Außer den französischen und italienischen Ölen sind auch spanische, portugiesische, griechische, dalmatinische, syrische, marokkanische, türkische, Krim, persische, indische (Pendschab), australische und kalifornische Olivenöle im Handel. Bedeutenden Aufschwung nimmt die Ölproduktion in Californien und Südaustralien. Californien z. B. ist schon jetzt ein wichtiges Produktionsland für Oliven geworden. Im Geschmack stehen die toskanischen Öle obenan, dann folgen die ligurischen. Die californischen stehen diesen weit nach. Im deutschen Handel war 1911 neben italienischem Öl — Baumöl und Speiseöl — (in Brls. und Fässern von 50, 180, 200 kg) auch Malaga-, Marokko- und Candiaöl zu finden.
Handel. Der Ertrag an Olivenöl betrug in Italien 1909/10: 2127097 hl. Das meiste lieferte die adriatische Seite (838050), dann die Mittelmeerseite (521010) und Sizilien (435176); weniger[S. 618] Toskana, Latium, Sardinien und die Marken. Unbeträchtliche Mengen: Lombardei, Ligurien, Venetien, Emilia. (Nach RAVASINI betrug die Olivenölproduktion Italiens 1909: 2559200 hl, 1910: 1384580 hl.) Die Olivenernte betrug 1909: 15292000, 1910: 9366200 dz (Normalernte 20,3 Mill. dz). Italien exportierte olio d’oliva lavato al solfuro 1907: 124881, 1908: 78242, 1909: 55668 und olio d’oliva d’altra specie 1907: 388427, 1908: 368788, 1909: 184481 (1910 im Ganzen 205054) dz. Die Vereinigten Staaten von Nordamerika importierten olive oil (for Mfg. purposes) 1908: 1789001, 1909: 695223 gallons und olive oil (Salad) 1908: 3548649, 1909: 3728386 gallons. Hamburg importierte 1908 34275 dz. Olivenöl; davon kamen aus Marokko: 9918, Frankreich: 7314, Italien: 6201, Spanien: 5343, Griechenland: 2477, weniger als 1000 dz aus Kleinasien, der europäischen Türkei, Tunis, Algier, Portugal usw. Die Einfuhr von Olivenöl nach London betrug 1906: 2658, 1907: 7512, 1908: 8953, 1909: 5072 casks. Frankreich importierte 1908 492149 Quint. Olivenöl, besonders aus Spanien und Tunis, dann aus Algier, Italien und Griechenland, wenig aus der Türkei und Marocco.

Zweig eines Olivenbaumes (Sorte Rouget).
[Nach Degrully, L’olivier.]
Morphologie und Anatomie der Frucht. Die Form der Frucht wechselt nach der Sorte und ebenso die Größe. Einige Sorten sind groß wie eine Aprikose, andere erreichen nur die Größe einer kleinen Kirsche — alle sind mehr oder weniger oval (Fig. 195) oder kugelig-eirund, am Scheitel stumpf oder etwas zugespitzt, meist c. 2 bis 3,5 cm lang, an der Oberfläche glatt, kahl. Der sehr harte Steinkern ist schief-länglich oder keulenförmig, etwas zusammengedrückt (Fig. 195), spitz, gefurcht oder grobrunzelig, gelblich oder bräunlich, durch Fehlschlagen meist einfächerig und einsamig. Der Same ist 9–11 mm lang, länglich zusammengedrückt, mit reichlichem Endosperm versehen. Die anfangs grüne Frucht wird beim Reifen erst rot, dann schwarz. Das Verhältnis der drei Bestandteile ist bei frischen Oliven: Fleisch mit Schale 71,5–80,5%, Stein 17,3–23%, Samen 2–5,5% (SCHÄDLER, KÖNIG).
Die Epidermis der Fruchtschale besteht aus dickwandigen polygonalen Zellen, die ebenso wie die folgenden Parenchymreihen bei der reifen Frucht einen purpurnen Farbstoff enthält, der durch konzentrierte Schwefelsäure sich rot färbt (HANAUSEK). Das Mesocarp besteht vorwiegend aus ölführendem Parenchym, in das große Astrosklereïden eingestreut sind, deren Wand durch Alkali gelb wird. Das als 1–3 mm dicke Steinschale[S. 619] entwickelte Endocarp besteht aus fest miteinander verzahnten Sklereïden, die oft bis fast zum Verschwinden des Lumens verdickt sind und ziemlich mannigfache Formen zeigen (die «Matta Livorno», die zur Gewürzfälschung benutzten gemahlenen Olivenkerne, besteht fast ganz aus ihnen). Zu innerst liegt eine Schicht obliterierten Parenchyms (MOELLER). Die Samenschale besteht, abgesehen von der relativ großzelligen Epidermis mit dickwandigen, von der Fläche betrachtet knotig gegliederten Zellen, aus der zum Teil obliterierten Nährschicht, in der die Bündel verlaufen, der Same besonders aus dem großen Endosperm, in dem sich zahlreiche in Ölplasma eingebettete Aleuronkörner finden. Auch das zartzellige Gewebe des Keimlings enthält dergleichen. Die Entwicklungsgeschichte von Frucht und Same bei ALQUATI (s. Lit.). Während früher (DE LUCA, GERBER) das Mannit als das Material bezeichnet wurde, aus dem das Öl in der Olive entsteht — Mannit kommt aber in den Früchten der Olive nicht oder nur in geringer Menge vor, nur in den Blättern ist er reichlich zu finden; lufttrockene Blätter enthalten c. 3,4%, die Rinde 1,9% d-Mannit (POWER und TUTIN) — hat HARTWICH d-Glukose, die sich in den Früchten nachweisen läßt, als Muttersubstanz angenommen, conform den Vorstellungen EMIL FISCHERS (S. 4). Stärke kommt auch in der jungen Frucht nur in den Schließzellen der Spaltöffnungen vor. Das Öl entsteht im Plasma der Zelle. Über die besonders durch die Sklereïden und die Samenschalepidermis charakterisierten Oliventrestern (tourteau de ressence) vgl. bei VOGL (a. a. O., Fig. 264) und COLLIN-PERROT (a. a. O., Fig. 81).
Lit. BOTTINI, Sulla struttura dell’ oliva. Nuov. giorn. bot. it. 21 (1889), 369. — PAPASOGLI, Stud. genet. e morfolog. sull’ ulivo. Nuov. giorn. bot. ital. X. — PIERA ALQUATI, Stud. anatomici e morfologici sull’ ulivo. Att. Soc. Ligust. scienze naturali XVII, 1906. — PIROTTA, Contrib. all’ anat. comp. della foglia, I. Oleaceae 1885. — BÖHMER, Ölkuchen in DAMMERS Lexikon. — T. F. HANAUSEK, Nahrungs- u. Genußm. u. Zeitschr. Nahr. Unters. 1894, 95. — LANDRIN, Falsific. d. poivre à l’aide des grignons d’olive. Journ. pharm. 10, 194. — MACÉ, Subst. aliment. 1891. — MOELLER-WINTON, Mikroskopie, Fig. 364 u. 365. — SCHIMPER, Anleit. z. Unters. Nahr.- u. Genußm. 1900. — VOGL, Nahrungs- u. Genußm. — VILLIERS-COLLIN, Substanc. aliment. — COLLIN-PERROT, Residus industr. — HARZ, Über d. Entsteh. d. fett. Öls in d. Oliven. Sitzungsber. d. Wien. Akad. 1870. — SPAMPANI (Bild. d. Öls in d. Olive). Bull. soc. bot. ital. 1899, 139. — DE LUCA, Rech. sur l. form. d. l. mat. grasse dans l. olives. Ann. sc. nat. bot. (4) 15, 92 und 18, 125. — GERBER, Rech. sur l. respir. d. olives et sur l. relat. exist. entre les valeurs du quotient respirat. et la format. de l’huile. Journ. bot. 1901. — HARTWICH u. UHLMANN, Nachw. d. fett. Öles u. s. Bild. bes. in d. Olive. Arch. Pharm. 1902, 471. — UHLMANN, Entsteh., Vorkommen u. Nachw. d. fett. Öls m. bes. Berücks. d. Olivenöls. Dissert. Zürich 1902.
Chemie. Die Olive zeigt folgende Zusammensetzung:
|
In der natürlichen Substanz
|
In der
Trockensubstanz |
|||||||||||
|
nach KÖNIG
a. a. O. |
Anzahl
der Analysen |
%
Wasser |
%
Stickstoff- Substanz |
%
Fett |
%
Stickstoff- freie Extrakt- stoffe |
%
Rohfaser |
%
Asche |
%
Stickstoff- Substanz |
%
Fett |
%
Stickstoff |
||
 |
||||||||||||
|
Oliven-
frucht |
 |
a) Fruchtfleisch
|
2
|
30,07
|
5,24
|
51,90
|
10,49
|
2,34
|
7,49
|
74,22
|
1,19
|
|
|
b) Steinschale
|
2
|
9,22
|
3,50
|
2,84
|
83,32
|
1,12
|
3,85
|
3,68
|
0,61
|
|||
|
c) Samen
|
2
|
10,58
|
18,63
|
31,88
|
36,75
|
2,16
|
20,83
|
35,65
|
3,33
|
|||
Die Früchte enthalten die Enzyme Olease (TOLOMEI) und Emulsin (BOURQUELOT), ein rotes Pigment (LANDERER) und Wachs. Das in allen Teilen des Ölbaumes[S. 620] enthaltene Glykosid Oleuropein, dessen Einheitlichkeit von POWER und TUTIN bezweifelt wird, ist am reichlichsten in den Früchten am Ende Juli zu finden (BOURQUELOT und VINTILESCO). Die Asche beträgt bei dem Fleisch 2,68, bei dem Stein 4,16, bei dem Samen 2,16%; bei Kaligehalt der drei 80,9 bzw. 58,8 bzw. 30,25%; der Phosphorsäuregehalt 1,33 bzw. 16,74 bzw. 28,24%; der Kalkgehalt 7,46 bzw. 7,45 bzw. 30,39% (KÖNIG). Der Ölgehalt der Früchte steigt vom August (5,02%), September (16,3%), Oktober (21,33%), Dezember (22,73%) bis Januar (22,85%) und sinkt dann im Februar etwas (20,84%, HARTWICH u. UHLMANN). Der Gehalt der Früchte an Öl variiert zwischen 20 und 70 (BENEDIKT-ULZER), 40 und 60% (LEWKOWITSCH, im Fruchtfleisch: 50–70%). — Zur Bestimmung ist Schwefelkohlenstoff zu benutzen, nicht Äther (PEANO).
Olivenöl, Oleum olivae s. olivarum [Provenceröl, huile d’olive (franz.), olive oil (engl.), olijfolie (holl.), olio d’oliva (ital.), puuöljy (fin.), olivaolaj (ung.), ἔλαιον ἐλαιῶν (griech.)]. Die Farbe des Olivenöls schwankt von farblos bis goldgelb. Geringe Sorten sind oft durch Chlorophyll grün gefärbt. Die Zusammensetzung des Öls variiert nach der Kulturvarietät, dem Reifegrad, der Erntemethode und dem Verfahren der Pressung. Die Elementarzusammensetzung des Olivenöls ist C = 76,67 (77,2), H = 11,95 (11,3), O = 11,38 (11,5)% (KÖNIG). Olivenöl löst sich nur sehr wenig in Alkohol, etwas mehr in Eisessig, besser in Äther, leicht in Chloroform, Benzol und Schwefelkohlenstoff. Beim Durchschütteln von 2 ccm Olivenöl mit 1 ccm rauchender Salpetersäure und 1 ccm Wasser entsteht (bei 10°) ein grünlich-weißes Gemenge, das nach 2–3 Stunden in eine feste weiße Masse und eine kaum gefärbte Flüssigkeit sich scheidet. Bei dieser sog. Elaidinprobe liefert Olivenöl von allen Ölen das härteste Elaidin und wird am schnellsten (höchstens in 3 Stunden) fest. Nach dem Eintragen in konz. Kali, dem konz. Ammoniak zugesetzt wurde (Vorschrift bei HARTWICH-UHLMANN), ist infolge kalter Verseifung und Ausscheidung von fettsauren Salzen nach 22 Stunden der ganze Tropfen in ein Haufwerk von Nadeln umgewandelt, zwischen denen Sphärite sichtbar sind.
Die festen Fettsäuren bestehen aus Palmitinsäure und Arachinsäure. Stearinsäure fehlt (HEHNER und MITCHELL). Bei italienischen Ölen beträgt der Gehalt an festen Fettsäuren 5–17,72, bei californischen 2–12,96% (TOLMAN und MUNSON), bei tunesischen 15–25% (BERTAINCHAUD). Letztere Öle erstarren schon bei +10° und werden daher oft «demargariniert». In algerischen und tunesischen Olivenölen finden sich höchstens ganz geringe Mengen Arachin- und Lignocerinsäure. Die flüssigen Glyceride enthalten auf 93% Ölsäure c. 7% Linolsäure (HAZURA und GRÜSSNER). HOLDE und STANGE erhielten 1–2% eines gemischten Glycerids (Oleodimargarin oder Oleodidaturin oder Oleodipalmitin?) und auch im festen Anteil sind gemischte Glyceride vorhanden (Margaro- oder Palmitoolein?). Freie Fettsäuren enthält gutes Olivenöl wenig, die technischen Öle dagegen oft 5–25% (ARCHBUTT, weitere Lit. darüber bei BENEDICT-ULZER). Das Tournantöl (s. oben S. 616) enthält eine große Menge (26%) freier Fettsäuren. Auch im «Olivenölfett», in ligurischen und sardinischen Sulfurölen sind viel freie Fettsäuren (46–57%) enthalten, in portugiesischen Bagasseölen sogar 60–70%. Alle diese Öle sind aus gegorenen Trestern bereitet, die eine fettspaltende Lipase (Olease, TOLOMEI) enthalten. Die flüchtigen Fettsäuren (auf Ölsäure berechnet) betragen 0,18–1,69% (DUGAST). In ranzigem Olivenöl wurden gefunden: Ameisen-, Essig-, Önanthyl-, Azelaïn- und Korksäure, sowie Önanthaldehyd (SKALA).
Das spez. Gewicht beträgt 0,9141–0,9203, meist unter 0,917 (Schweiz.[S. 621] Lebensmittelbuch: 0,916–0,918 bei 15°, 0,862–0,863 bei 100°). Der Erstarrungspunkt liegt zwischen −6 und +10°, die Verseifungszahl beträgt 185–203, die Jodzahl 78,28–93,67 (bei guten europäischen Ölen meist zwischen 81,6 und 84,5, Schweiz. Lebensmittelb.: 79–88) — je reifer die Olive, desto höher die Jodzahl des Öls (PAPARELLI) — die Bromzahl 51,2–54 (TELLE), die Reichert-Meißlzahl 0,6, die Hehnerzahl 94,96–95,14%, die Maumenéprobe 41,5–47°, die Bromthermalprobe 13,5–15°, der Brechungsexponent ist (bei 40°) 1,4612–1,4626 (Pharm. helv. IV), die Butterrefraktometerzahl (bei 15,5) 66,9–69,2 Skalenteile (Schweiz. Lebensmittelbuch: Refraktionszahl [bei 40°] 53–55). Die Fettsäuren zeigen den Erstarrungspunkt bei 17–24,6°, Schmelzpunkt bei 19 bis 31°, die Jodzahl 86,1 bis 90,2 (die flüssigen Fettsäuren haben die Jodzahl 92,8 bis 104,2). Das elektrische Leitvermögen ist weit geringer als das aller anderen Öle (675mal kleiner als das des sonst schlechtest leitenden Öles, ROUSSEAU). Man bestimmt es mit dem PALMIERIschen Diagometer. Der Entflammungspunkt liegt bei 240° (RAKUSIN). Es dreht rechts (THURSTON). Olivenöl neigt wenig zum Ranzigwerden. Beim Ranzigwerden nimmt die Verseifungszahl zu, die Jodzahl ab (RYAN und MARSCHALL).
Das Unverseifbare beträgt 0,46–1,62%, meist weniger als 1%. Es ist vornehmlich Phytosterin (BÖMER, SOLTSIEN, GILL und TUFTS), von BENEKE 1862 hier gefunden, daneben findet sich ein unverseifbares Öl, Ampelosterin (SANI). Olivenöl ist der Typus der nichttrocknenden Öle. Es gibt daher bei der Maumenéprobe und der Bromthermalreaktion die geringste Temperaturerhöhung (LEWKOWITSCH). Der bittere und herbe Geschmack einiger Öle rührt von Eugenol, Catechin, Gallussäure, Tannin und einem unbekannten Bitterstoffe her (CANZONERI). Kupfer scheint ein normaler Bestandteil des Olivenöls zu sein. Kupfern der Bäume erhöht den Gehalt (0,5 mg pro kg Öl) an Cu nicht (PASSERINI).
Neuerdings wird auch aus Olivenkernen, d. h. den noch in der Steinschale eingeschlossenen Samen Öl (Olivenkernöl, huile de noyaux d’olive, olive kernel oil, olio di noccioli d’oliva) gepreßt bzw. extrahiert. Das Öl enthält 10% feste Fettsäuren, unter denen Palmitinsäure und Stearinsäure, aber keine Arachinsäure sich findet. Oliventrester enthalten in % im Durchschnitt: Wasser 8,38, Stickstoffsubstanz 8,25, Fett 15,25 (nach DÉCUGIS bis 29,15), in Zucker überführbare Substanz 13,59, sonstige stickstofffreie Stoffe 14,92, Rohfaser 37,05, Asche 2,56, Alkoholextrakt 2,46.
Lit. BENEKE (Phytosterin), Studien, Gießen 1862. — KLEIN, Zeitschr. angew. Chem. 1898, 848 u. 1900, 635 u. 904. — TOLOMEI, Atti Real. Accad. d. Lincei 1896. — BOURQUELOT ET VINTILESCO, Journ. pharm. chim. 1908, 303 u. 1910, 292. — POWER und TUTIN, Oleuropein. Pharm. Journ. 1908. — KÖNIG, Nahrungs- u. Genußm. (dort weit. Lit.). — Öl: HEHNER und MITCHELL, Analyst 1896, 328. — ARCHBUTT, Journ. Soc. Chem. Ind. 1897, 311. — HAZURA und GRÜSSNER, Monatsh. f. Chem. 1888. — HOLDE und STANGE, Mitt. d. Techn. Vers. Anst. Berlin 1901 und 1902. — DUGAST, L’industrie oléicole 1904. — SANI, Att. Acc. Linc. 1900 und Staz. sperim. agrar. ital. 1902, 701. — BENEKE, Studien, Gießen 1862. — GILL und TUFTS, Journ. amer. chem. soc. 1903, 498. — SOLTSIEN, Zeitschr. öffentl. Chem. 1901, 184. — BÖMER, Zeitschr. Unters. Nahrm. 1898. — SKALA, Staz. sperim. agrar. ital. 30 (1897), 613. — LEWKOWITSCH a. a. O. (dort die Lit.). BENEDICT-ULZER, Analyse d. Fette. 5. Aufl. 1908 (dort weitere Lit.). — Zahlreiche Aufsätze in der Chem. Rev. der Fett- und Harzindustrie der letzten Jahre. — HARTWICH und UHLMANN, Nachweis fett. Öle durch mikrochem. Verseif. Arch. Ph. 1903, 11. — RUSSELL W. MOORE (Best. d. freien Fetts. im Olivenöl). Chem. Zeit. 1900, Rep. 122. — BACH (Einfl. von Denaturierungsmitteln), Zeitschr. f. öffentl. Chem. 1897, 169. — RAKUSIN, Entflammungspunkt. Chem. Zeit. 1905, 690. — THURSTON, Mercks Rep. 1907. — LEFELDT, Ber. pharm. Ges. 1906. — Jodzahl: THOMSON und DUNLOP, Analyst. 1906. — HELFENBERGER Ann. 1905. — BACHMANN, Proc. Minnes. Ass. 1907. — Baudouins Reaktion: EVANS SONS LESCHER[S. 622] und WEBB, Analytical Notes 1906/07. — Licht: DROSTE, Apoth. Zeit. 1907. — Cu in Olivenöl: BRAITHWAIT, Pharm. Journ. (3) 18, 12 und PASSERINI, Chem. Centralbl. 1906, II, 541. Year book 1907, 116. — CANZONERI, Gazz. chim. it. 27, II, 1.
Über algerische Olivenöle vgl. ARCHBUTT, Journ. soc. chem. ind. 26 (Chem. Rev. 1907, 200, 1908, 19) und DUGAST, Zeitschr. angew. Chem. 1904, 821. — MILLIAN (tunesische Öle). Zeitschr. Nahrungsm. 1904, 586. — GUOZDENOVIČ (dalmatin. Öl). Zeitschr. Nahrm. Hyg. 1897, 181. AHRENS und HETT, Über marokkanisches Öl. Zeitschr. öffentl. Chem. 1903, 284. — TOLMAN u. MUNSON (Californ. Olivenöl). Journ. am. chem. soc. 1893 und 1903, 956. — MOERK (Verschied. Öle), Am. journ. pharm. 1889.
Über die Bestandteile der Blätter und der Rinde vgl. POWER und TUTIN, Constit. of olive bark und C. of olive leaves. Transact. Chem. Soc. 1908.
Verwendung. «Zwei Flüssigkeiten gibt es», sagt PLINIUS (XIV, 150), «die dem menschlichen Körper angenehm sind, innerlich Wein, äußerlich Öl» und auch der hundertjährige POLLIO ROMILIUS und der die 100 Jahre überschreitende Philosoph DEMOKRIT erhielten sich durch Wein, Honig und Öl so lange gesund. Die Lampe der Stiftshütte, wie die vor dem Bilde der ATHENE wurde ebenso mit Olivenöl gespeist wie heute die ewige Lampe in St. Peter in Rom. Mit Olivenöl wurden alle Könige gesalbt von SAUL und CHLODWIG bis auf unsere Tage, und die letzte Ölung haben mit ihm unzählige Menschen erhalten. Für viele Millionen ist im Mittelmeergebiet seit dem Altertum bis heute die Olive und ihr Öl unentbehrliches Nahrungs- und Genußmittel, für viele Gegenden wichtigster oder gar einziger Exportartikel. Überall wo die Olive vorkommt, wird das meiste Öl im Lande selbst verbraucht.
Olivenöl wird in der Medizin als einhüllendes Mittel bei Magen- und Darmentzündungen, Vergiftungen usw., zu medizinischen Ölen, Salben, Linimenten, Seifen und Pflastern verwendet. Im Var dienen die Oliventrester als Schweinefutter. Außer zur Ölbereitung, zu der allgemein kleinfrüchtige Sorten herangezogen werden, werden die Oliven, besonders die großfrüchtigen, auch zur Herstellung der sog. Salzoliven benutzt, die eine beliebte Zuspeise sind (s. oben). Auch das Olivenholz ist wegen seiner schönen Zeichnung sehr geschätzt. Olivenhonig erwähnt schon DIOSKURIDES (I, Cap. 37, περὶ ἐλαιομέλιτος).
Verfälschungen. Olivenöl wird mit Sesamöl, Rüböl, Nußöl, Baumwollsamenöl, Mohnöl, Arachisöl (mit Arachisöl verfälschtes Olivenöl ist als Nut sweet oil im Handel) und Schmalzöl (dem flüssigen Teile des Schweinefettes) verfälscht, neuerdings auch mit Mineralöl, das mit Methylazodimethylanilin gefärbt war (CUTOLO 1910). Man achte auf die oben (S. 619) angegebenen Konstanten! Alle zur Verfälschung des Olivenöls benutzten Öle haben höhere Jodzahlen. Olivenöl färbt sich nicht mit HNO3 spez. Gewicht 1,4, gibt zumeist weder die BELLIER-, noch die BAUDOUIN-, noch die ALLEN-, noch die SOLTSIEN-, noch die HALPHEN-Reaktion. (Weiteres bei LEWKOWITSCH a. a. O.) Bei tunesischem Olivenöl tritt aber bisweilen die BAUDOUINsche Reaktion ein (MARCILLE 1909), — auch bei italienischen Ölen beobachtet (BEHRE) — die Färbung verschwindet aber meist rasch (ZEGA und TODOROVIC). Auch die KREISsche Phloroglucin-Salpetersäure-Reaktion tritt bei Olivenöl bisweilen schwach ein (DIETZE). Dagegen ist bisher kein Olivenöl beobachtet, das die SOLTSIENsche Zinnchlorür-Reaktion (Zeitschr. f. öffentl. Chem. 1897, 63) gab (BEHRE). Zu beachten ist auch, daß BELLIERS Reaktion nur bei frischen Samenölen eintritt (SOLTSIEN erhielt sie auch einmal bei Palm-[Fruchtfleisch-]öl).
Die tropischen Öle der Cocos- und Ölpalme, von Sesam und Arachis beginnen das Olivenöl zu verdrängen, namentlich seit 1908/09 eine Olivenmißernte in Italien eintrat. Selbst der D. A. V ersetzt das Ol. olivarum commune durch Ol. arachidis und Sesami. Doch ist der Name «Olivenöl» auch nach den Beschlüssen des internationalen Kongresses zur Unterdrückung von Nahrungsmittelfälschungen 1909, der die Namen «bestes Speiseöl» und «feinstes weißes Tafelöl» auch für mit Baumwoll-,[S. 623] Erdnuß- oder Sesamöl versetzte Olivenöle freigab, nur für das Öl der Olive reserviert worden. Neuerdings (1909) wurde reines Baumwollöl (BARNARD) und reines Sesamöl (RICKLE und KURTZ) als «Olivenöl» im Handel angetroffen. Das sog. «Javaolivenöl» stammt von einer Sterculia (KREIS).
Lit. Prüfung des Olivenöls bei BENEDICT-ULZER und LEWKOWITSCH. — TOLMAN and MUNSON, Olive oil and its substitutes. U. S. Dep. Agric. Bur. chem. Bull. 77, 1903. — TORTELLI und RUGGERI, Meth. z. Nachw. von Baumwollsamen-, Sesam- und Erdnußöl im Olivenöl. Chem. Zeit. 1898, 600. — BLAREZ (Nachweis von Arachisöl im Olivenöl). Chem. Centralbl. 1907, I, 767. — MARCILLE, Ann. d. falsific. 1909, 224. — DIETZE, Pharm. Zeit. 1909, 260. — BEHRE, Pharm. Centralh. 1907, 489. — Sesam und Leinöl: RIDGELY, Oil, Paint and Drug Rep. New York 1907. — Arachisöl: BLAREZ, Bull. soc. pharm. Bord. 1906, 295. — Cottonöl: BARNARD, Rep. Indiana Bd. Health 1906, 294. — SPÄTH, Süddeutsch. Apoth. Zeit. 1906, 136.
Geschichte. «Der Ölbaum gehört zu den Erziehern der Menschheit zu höherer Ordnung» (TH. FISCHER). «An ihm haftet die Poesie der menschlichen Kultur. Wenn man unter einem grauen Ölbaume am Meeresstrande sitzt, wird man in das fromme sonnige Morgenland entrückt, wo unsere Phantasie zu Hause ist, seitdem uns die Mutter die Bilderbibel aufschlug und vom Ölberge in Jerusalem erzählte. Und wieder rauscht aus diesem Baume die Poesie der Hellenen und die Weisheit der Minerva und sie versetzt uns in das Land des HOMER, des PINDAR und ÄSCHYLUS und unter die Musen und Götter des Olymp. Ein christlich-hellenischer Baum ist der Ölbaum, ein doppelt heimischer» (F. GREGOROVIUS). Der Ausgangspunkt der Olivenkultur ist unbekannt (Kilikien?, Syrien?). Die orientalischen Völker haben aus ihm eine Kulturpflanze gemacht. In das Mittelmeergebiet wurde die domestizierte Olive vom Osten her eingeführt. Die Kultur der Olive hat sich auf der Linie Ägypten-Syrien-Kleinasien-Griechenland verbreitet (SCHRADER). ENGLER und SCHRADER nehmen an, daß sich der wilde Ölbaum über das Mittelmeer verbreitete, bevor er domestiziert wurde. Ölbaum, Feige und Weinstock waren im Altertum die Sinnbilder des Wohlstandes und Glückes. Nach MASPERO soll der Ölbaum in Ägypten seit den ältesten Zeiten sich finden, da sein Name schon in Texten der VIII. Dynastie erwähnt wird (?). Er scheint dorthin frühzeitig gekommen zu sein. Auf Inschriften wird er (I, S. 468) als bek, bek-t, beka, baka erwähnt und ist auf Denkmälern dargestellt, z. B. auf dem Gartenplane zu Tell-el-Amarna aus der XVIII. Dynastie (WÖNIG, Fig. 154). Ölblätter sind in Stirnkränzen (um 1000 n. Chr., WÖNIG, Fig. 117 a) und auch sonst in ägyptischen Gräbern oft gefunden worden, Öl (mrḥt) wird sehr häufig in Rezepten, z. B. des Papyrus EBERS, erwähnt. Ölamphoren fanden sich in den Vorratskammern der Villen und ihr Bild als Hieroglyphe bedeutet sowohl Flüssigkeit wie Wohlgeruch. Das Öl wurde zu Speisen, zum Salben und als Opfergabe benutzt, zu den gleichen Zwecken diente es den Juden des alten Testamentes. (Über Salböl vgl. I, S. 1014.) Sehr lange bekannt ist der Ölbaum in Syrien, auch in Palästina ist er uralter Besitz. Die Juden fanden ihn vor, als sie nach dem gelobten Lande zurückkehrten, und auch die Ölgewinnung ist dort uralt und war so umfangreich, daß die Phönikier zur Zeit SALOMOS einen Teil des als Nahrung, als Brennstoff, zum Opfern und Salben benutzten Öls exportierten. Auch das Pfropfen der Olive auf den Oleaster war schon damals bekannt, der Ölzweig NOAHS das Symbol des Friedens. Palästina besaß umfangreiche Olivenhaine und das gewonnene Öl war vorzüglich. Auch die Sumerer bedienten sich seiner vielleicht schon (I, S. 467). Dagegen scheint in Babylonien ganz allgemein das Sesamöl das Olivenöl ersetzt zu haben (vgl. oben S. 551 u. 577). Bei den Griechen war die Olive der heilige Baum der ATHENE, der Baum, den sie aus einer eingestoßenen Lanze auf der Akropolis hatte hervorsprießen lassen. Sie erscheint denn auch auf zahlreichen Münzen mit einem Olivenkranz oder einem Ölbaum. Wer eine dem Staate gehörige Olive ausgrub oder beschädigte, konnte wegen Gottlosigkeit belangt werden. Der Ausgangspunkt der Olivenkultur in Griechenland scheint also Athen gewesen zu sein. Dort fanden sich die der ATHENE heiligen μορίαι. Nächst Attika war Sikyon die olivenreichste Landschaft Griechenlands (die Olive hieß denn auch sicyonia bacca). ÄSCHYLUS nennt die Insel Samos ἐλαιοφύτος, THALES erwähnt auf Milet, Chios und Delos Olivenhaine. Auf Santorin wurden im Tuff Bauholz aus Oleaster und Ölpressen aus der Zeit vor 2000 n. Chr. gefunden (FOUQUÉ) und in Mykenä Olivenkerne aus der gleichen Zeit (TSUNTAS, SCHLIEMANN bei HEHN, SCHRADER). In den homerischen Gesängen wird Oleaster (κότινος) und Olivenöl oft erwähnt, sowie der Ölbaum, der schon damals in Griechenland viel kultiviert wurde (ILIAS XVII, 53–55). Das Öl spielte in der Technik der homerischen Linnenindustrie[S. 624] bereits eine Rolle. Die Kultur der Olive kam also in vorhomerischer Zeit nach Griechenland (SCHRADER). Schon auf den Vasen ältesten Stils finden wir die Olivenernte dargestellt. Zu STRABOS Zeit gab es an Kleinasiens Nordküste große Olivenpflanzungen. Die Phönikier, welche das Olivenöl zu einem Gegenstande des Welthandels machten, brachten den Ölbaum nach Tunis und Tripolis und vielleicht auch schon nach Sizilien (HEHN), die Griechen nach Barka, Sizilien, Unteritalien, in die Provence und die Kyrenaika. Nach Italien kam der Ölbaum zur Zeit des TARQUINIUS PRISCUS von Griechenland — aus griech. ἐλαίϝα wurde olîva, aus ἐλαίϝον oleum, aus ἀμόργη («Hefe» des Olivenöls) amurca, aus δρύππα (überreife Olive) druppa. Auch die Worte orchis, cercitis, trapetum stammen aus dem Griechischen (HEHN). Italiens Hügel bedeckten sich vom VII. Jahrh. n. Chr. an mit Olivenhainen, die vom Süden allmählich auch nach Mittelitalien vordrangen (V. Jahrh.). Die älteste Olivenlandschaft Italiens war Apulien, das noch heute das beste Öl hervorbringt. Name (oliva, oleum) und Sache und die Methoden der Ölbereitung erhielten die Römer also von den Griechen. Die Olivenölausfuhr beginnt zur Zeit des POMPEJUS. Bereits im I. Jahrh. n. Chr. war das italienische Öl das den Handel beherrschende (HEHN). Zuletzt kam der Baum nach Ligurien. VIRGIL, COLUMELLA, VARRO und PALLADIUS beschreiben die Kultur und Pflege der zahlreichen Sorten und die Bereitung der Salzoliven. Auf den Wandgemälden Pompejis ist die Olive dargestellt (I, S. 575). Bei DIOSKURIDES findet sich ἀγριελαία (κότινος = wilder Ölbaum), ἤμερον ελαία (Kulturolive), κολυμβάδες ἐλαῖαι (Salzoliven) und das Öl (ἔλαιον) der wilden wie der kultivierten Olive und mancherlei Präparate daraus, sowie das Öl der unreifen Olive (Omphakion). Bereits DIOSKURIDES wußte, daß nicht völlig reife Oliven das beste Öl geben und PLINIUS beschreibt die Ölgewinnung etwa so wie sie noch jetzt in Italien auf dem Lande da und dort geübt wird. GALEN, ORIBASIUS, CELSUS besprechen die medizinische Anwendung des Öls, ATHENAEUS NAUCRITITES (I, S. 574) gibt einige interessante Details und GARGILIUS MARTIALIS schildert den Olivenmarkt in Rom. Nach Spanien, das zu STRABOS Zeit schon viel Öl exportierte und das große Pflanzungen besaß, die durch die Araber noch wesentlich vermehrt wurden, kam die Olive schon durch die Phönikier. Von der Olivenzucht in Carthago spricht schon MAGO (I, S. 571). Die Nordküste von Afrika lieferte im III. und IV. Jahrh. n. Chr. große Mengen Öl nach Rom. Leptis minor mußte schon zu CÄSARS Zeit jährlich c. 1 Mill. kg Olivenöl nach Rom senden. Mitteltunesien war zur Kaiserzeit ein einziger großer Olivenhain. In den Trümmern der Städte dieses Landstriches, dem heutigen Algier, sind zahlreiche Ölmühlen, Pressen, ja ganze Ölfabriken gefunden worden. Die einwandernden arabischen Nomaden zerstörten dann die Kulturen und nur die um Sahel entgingen ihnen. Das Öl par excellence war schon im Altertum Olivenöl. Nach Marocco kam die Olivenkultur erst relativ spät von Andalusien aus.
Erwähnt wird die Olive bei ISIDORUS HISPALENSIS, PAULUS AEGINETES, SIMON SETH. Bei SERAPION (I, S. 604) steht oliva et oleum quae sunt ex eis, bei IBN BAITHAR (I, S. 608) zajtūn (zajt = Olivenöl). IBN BATUTA (I, S. 618) sah Ölbäume in Syrien. Bei GARIOPONTUS (I, S. 623) findet sich olivae olea (lacrima oleae). In der Alphita, bei SERAPION und in den Synonyma desselben steht olea, oliva arbor et fructus oleum = oleum olivae, zaiton, cait = oleum. Bei CORDUS steht sowohl Ol. olivarum wie Ol. omphacinum (ex immaturis olivis expressum), im Braunschweiger Register (I, S. 815): olive und oliveti, im Inventar LEFORT (I, S. 805): uille d’olive. Bemerkenswert ist des PIER VETTORI (1499–1585) Trattato delle lodi e della coltivazione degli ulivi (mehrmals gedruckt, 1569, 1574, 1621) und des G. PORTA, L’olivetum 1588. Die ersten Versuche einer Klassifikation der Kulturvarietäten finden sich bei CAESALPINI, CLUSIUS, C. BAUHIN. Noch im XVIII. Jahrh. erschienen mehrere Monographien über die Olive (PRESTA, SIEURE, GANDOLFI, MOSCHETTINI). Die Pariser Académie erteilte DE LA BROUSSE einen Preis für eine Arbeit über die Schädlinge der Olive. 1782 schrieb die Académie in Marseille einen Preis aus für die beste Monographie der Olive. Den ersten Preis erhielt BERNARD, den zweiten P. J. AMOUREUX, den dritten COUTURE. Olivenkernöl wurde schon im XVIII. Jahrh. in Spanien gepreßt.
Die Elaidinprobe entdeckte der Marseiller Apotheker POUTET (Instr. pour reconn. la falsificat. de l’huile d’olive) und BOUDET studierte sie 1832 näher (Ann. chim. phys. [2] 50, 391. Lieb. Ann. 4, 1).
Lit. HEHN-ENGLER-SCHRADER, Kulturpflanz. — TRISTRAM, Nat. hist. of the bible. 1898. — WÖNIG, D. Pfl. d. alt. Ägypt. — CAVARA, Bull. Soc. geol. ital. 1886. — DE CANDOLLE, L’orig. d. pl. cult.
Zur Olivenölgruppe gehört außer dem Olivenkernöl noch das Haselöl und das Benöl.
[S. 625]
Semen Ricini und Oleum Ricini.
Syn. Ricinus, Wunderbaum, Läusebaum, Christpalme, Hundsbaum, Kreuzbaum. Die Samen: Brech-, Purgier-, Treib-, Zecken-Körner. In der Schweiz: Springkernen, mirasole; in Italien auch: girasole. — common oil nut tree, common palma-Christ, castorplant (engl.); ricin (franz.); ricino, fico d’inferno, fagiolo romano, turchesco oder d’India (ital.); wonderboom (holl.); κίκι (n.-griech.); pei-ma-tsu oder pi-ma-tsze (chin.); fima, kara-gasira, himashi, togoma (jap.). In Indien: arandi, erandi, rand (hind.); bherendá (beng.); eri (assam.); eranda, ruvuka, vatári (= antirheumatisch), rakla eranda (sansc.); kinnatu, bedánjir (pers.). In Turkestan: kanap, kundschut. In Chorassan: Ziegenfeige — mal. sund. jav. (z. B. auf Java): djarak, auch kaliki (mal.); djarak djawa (in Palembang); auf Sumatra auch dulang (bat.); auf den Philippinen: tangan, tavang oder lingan sina. In Niederl.-Westindien: krapatta (nach portug. carapatto).
Ägypt. dqm, die Früchte qꜣqꜣ (kiki, auch im Koptischen kyki) — die hieroglyphischen Zeichen I, S. 470. — Bei HERODOT: σιλλικύπριον. — Bei THEOPHRAST und NICANDER: κρότων. — Bei DIOSKURIDES: κίκι, σήσαμον ἄγριον, σέσελι κύπριον (in [] stehen, d. h. später eingeschoben sind die ägyptischen Namen Systhamna und Trixis, der Prophetenname αἷμα πυρετοῦ (= Fieberblut, vgl. I, S. 472), die römischen Namen ricinus und lupa). — Bei den späteren Griechen auch: μπανδάτζη, μπαρδάνη, σίκις, σύσταμνα, χίφονα. — Bei PLINIUS: ciki, croton, trixis, sesamum silvestre. — Im Mittelalter: Agnus Christus, Palma Christi, rauscher oder türkischer Hanf, Cataputia major. — In der Alphita und bei BARTHOLOMAEUS: cataputhia, cathapucia = semen spurgie, kerva, pentadactylus. — Bei IBN BAITHAR (I, S. 610) Ricinus commun. = ḫirwaʿ, Ol. Ricini = duhn al-ḫirwaʿ. — Bei NAJM AD-DYN MAHMUD (I, S. 611) Ricinus = kharouaʿ, arab. auch kerua, kherûa, kerroa, charua. — Im Corpus glossar: ricinus, crotonia. — Bei ALBERTUS MAGNUS: arbor mirabilis. — Bei MEGENBERG: wunderleich paum. — Im Niederländ. Herbar (1483): kruzebom. — Bei GESNER: wundelbaum. — Bei TABERNAEMONTANUS: Mollenkraut, Zeckenbaum.
Etym. «κροτων heißt er wegen der Ähnlichkeit mit dem Tier», sagt DIOSKURIDES, und PLINIUS bemerkt «ricinum vocant a similitudine seminis», das Tier, das die Griechen Croton, die Römer Ricinus nannten, ist der Holzbock, die Holzteke, Zecke, Hundelaus (Ixodes Ricinus L.), daher der Baum Läusebaum oder Zeckenbaum genannt wurde. Die Samen sehen dem mit Blut vollgesogenen Tiere nicht unähnlich. Aber wahrscheinlich verhält sich die Sache, wenigstens für Ricinus, umgekehrt, das Tier ist nach der Pflanze benannt und Ricinus aus κίκι, κίκινος (hebr. kikar, s. oben) umgebildet. — Wunderbaum wegen des raschen Wachstums nach der mißverstandenen biblischen Erzählung (vgl. Geschichte). — Im XVIII. Jahrhundert wurde R. auf Jamaika kultiviert. Man verwechselte ihn dort mit Vitex Agnus castus, dem Agno casto der Portugiesen. Von diesem Casto stammt der in England übliche Name Castoroil für Ricinusöl (FLÜCKIGER-HANBURY). — Palma Christi, Pentadactylus und Teufelsblatt (folha do inferno) bezieht sich auf die Form des Blattes.
Stammpflanze. Ricinus communis L., Spec. pl. ed. I 1007 (Ricinus inermis JACQ., R. lividus JACQ., R. speciosus BURM., R. spectabilis BLUME, R. viridis WILLD., Croton spinosus L.).
Variiert außerordentlich in Form, Größe und Bestachelung der Früchte, Form, Größe und Farbe der Samen, Stärke der Bereifung der Blätter und Stengel. MÜLLER-ARGOV. unterscheidet folgende 16 Varietäten: α megalospermus, β rugosus, γ purpurascens, δ lividus (Südafrika), ε armatus (Malta), ζ leucocarpus, η Benguelensis, η Reichenbachianus, ι badius, κ amblyocalyx, λ africanus, μ genuinus, ν Rheedianus, ξ microcarpus, ο undulatus, ρ speciosus (Java). Dazu kommen dann noch die var. brasiliensis, die PECKOLT erwähnt, var. viridis WILLD. (Indien), var. americanus ALD., var. tunisensis (Nordafrika), var. ruber RPF., var. inermis JACQ. (Indien), var. sanguineus (großsamig), var. giganteus, var. metallic., var. macrophyllus, die wahrscheinlich den R. von St. Eustatius liefernde var. Zanzibariensis (oder zanzibarinus), die ich aus Amani[S. 626] in zahlreichen Spielarten mit verschieden gefärbten Samen 1909 erhielt und die auch als Art betrachtet wird, u. and. mehr. Viele Varietäten und Spielarten besonders in Indien. Meist unterscheidet man in Indien zwei Hauptformen:
1. Die Large seeded Form, groß, perennierend, Windschutz-Heckenpflanze mit vielen großen Samen, gibt aber weniger gutes Öl (technisches und Lampenöl).
2. Die Small seeded Form, kleiner, meist einjährig, mit kleineren Samen, gibt mehr und besseres Öl (Medizinalöl).
Ferner die Varietäten pyra: keine Seitenzweige und mulli kottai: glatte, nicht stachelige Früchte. Die mohammedanischen Schriftsteller erwähnen zwei Arten Samen, rote und weiße, die ersten als wirksamer. Auch RUMPHIUS unterscheidet weißen und roten Ricinus, DYMOCK große rotsamige und graue, braunfleckige Varietäten. (Letztere werden medizinisch bevorzugt.) Die Varietäten bleiben in der Kultur ziemlich konstant.
Systemat. Stellung. Euphorbiaceae — Platylobeae-Crotonoideae-Acalypheae-Ricininae. Ricinus hat nur diese eine Art.
Beschreibung der Stammpflanze. Die diclin-monöcische Pflanze wird 2–4 m hoch, nimmt aber in den Tropen und Subtropen Baumform an (bis 13 m). Auf den Azoren und im wärmeren Mittelmeergebiet wird Ricinus ausdauernd und strauchartig bzw. ein kleiner Baum (Taf. XVI). Die Pflanze hat die Größe eines kleinen Feigenbaumes, sagt DIOSKURIDES. CLUSIUS, BELON, RAY berichten über große baumartige Ricinus in Spanien, Creta und Sicilien. Diesseits der Alpen und in Norditalien ist Ricinus einjährig und wird kaum höher als 5 engl. Fuß. Der Stengel ist grün oder bräunlich-rot, häufig bläulich bereift. Die spiralig gestellten, langgestielten, exzentrisch-schildförmig angehefteten Blätter besitzen einen am Grunde und an der Spitze mit Drüsen (gegen unberufene Gäste?) versehenen Blattstiel und eine bis 1 m breite Spreite, die in 7–11 eioblonge oder lanzettliche, zugespitzte, kahle, bisweilen bereifte, einfach oder doppelt gezähnte Lappen handförmig geteilt ist. (Zarte Mädchen und schwellende Brüste vergleicht der Inder mit den zarten weichen Blättern der Aranda.) Der rispige, ursprünglich terminale, aber beiseite gedrängte Blütenstand trägt unten die männlichen, oben die weiblichen Blüten; die männlichen besitzen eine fünflappige Blütenhülle, zahlreiche Stamina mit baumartig verzweigten Filamenten, an deren letzten Enden die dithezischen gesonderten Antheren (bisweilen mehr als 1000) sitzen; die weiblichen besitzen eine fünfzählige, frühzeitig abfallende Hülle und einen blaugrauen, eiförmigen, mit zahlreichen Weichstacheln besetzten, dreifächerigen, oberständigen Fruchtknoten, der an der Spitze einen kurzen Griffel trägt, welcher in drei rote zweispaltige Narben ausläuft. Jedes Fach enthält ein anatropes hängendes Ovulum mit einer die Micropyle überdeckenden Funicularwucherung. Die Frucht ist eine dreifächerige, kugelige, je nach der Varietät glatte oder mehrweniger bestachelte Kapsel, die in 3 Kokken zerfällt, welche elastisch aufspringen und die Samen fortschleudern. Alle Teile der Pflanze sind sehr spröde. Sie ist in Indien das Symbol der Zerbrechlichkeit. «Zerbrechlich wie Aranda» ist eine gewöhnliche Redensart in Indien. Ricinus reift seine Samen noch in England und bei Christiania (SCHÜBELER). Über die Krankheiten der indischen Ricinuspflanze vgl. bei WATT.
Die Heimat der Pflanze ist das tropische Afrika (BALL, DE CANDOLLE). Sie findet sich wild in Abyssinien, Sennaar, Cordofan; verwildert in Ägypten, Algier, Marocco und den Canaren, Arabien, Persien, Indien, Syrien, Anatolien, Griechenland.

(Nach Hamilton.)
Ricinus trägt aber alte Sanscritnamen. Der älteste ist eranda, dann ruwu ruwuka, uruwuka, die rote raktairanda, so daß einige Ricinus auch für in Indien einheimisch halten (FLÜCKIGER-HANBURY, BENTLEY-TRIMEN). WATT fand ihn neben anderen sicher in Indien einheimischen Pflanzen angeblich wild im Himalaya (Dict. econ. prod.). Doch betrachtet auch er das Indigenat für zweifelhaft. Immerhin ist es möglich, daß Ricinus auch in Indien einheimisch ist. Die Arier können die Pflanze jedenfalls nicht nach Indien gebracht haben. Sicher ist, daß Ricinus schon im hohen Altertum in Indien in Kultur stand. AITCHINSON fand aber weder das einheimische Öl noch die einheimischen Ricinussamen in Afghanistan in Anwendung.
Lit. MÜLLER-ARG., Linnaea 34, 143 und DE CANDOLLE, Prodromus XV, 1016 (dort die Lit.). — PAX in ENGLER-PRANTL, Pflanzenfam. — LEDEBOUR, Flor. ross. I, 501. — MIQUEL, Flor. Ned. Ind. I, II, 391. — HOOKER, Flor. Brit. Ind. V, 457. — Pharmacogr. indica. — WATT, Dict. econom. prod. India. — F. F. BRUYNING, De Wonderboom of Christus palm, Tijdschr. voor tuinbouw 1896, 53 (mit 4 Taf.). — ROXBURGH, Flora indica. — Tropenpflanzer 1900, Nov. — Über Ricinushybriden vgl. VAN DER STOK, Teysmannia 1909 u. 1910.
Abbild.: BERG-SCHMIDT, 2. Aufl. t. 89 (dort weitere Lit.). — PABST-KÖHLER, Medizinalpfl. t. 160. — NEES VON ESENBECK, Plant. med. t. 140. — HAYNE, Arzneigew. X, t. 48. — BENTLEY-TRIMEN, Med. pl. t. 237. — GRESHOFF, Schetsen van Ind. Nuttige planten t. 31. — Bot. Mag. t. 2209. — Ältere: RHEEDE, Hort. Mal. II, t. 32. — RUMPHIUS, Herb. Amb. IV, t. 41 (hier eine ausführliche Beschreibung). — GARSAULT, Fig. d. plant. décr. dans Mat. méd. de Geoffroy.
Älteste Abbildung im Codex constantinopol. des DIOSKURIDES (vgl. I, S. 554) unter κρότων ἡ κήκι No. 170.
Kultur. Im großen und ganzen kann Ricinus fast überall da kultiviert werden, wo Mais zur Reife kommt, doch endet seine Ertragsfähigkeit vor der Maisgrenze. Er braucht Wärme, Feuchtigkeit und fruchtbaren, phosphorsäure-, kali- und kalkreichen Boden und wächst sehr rasch. In Indien ist er oft in Mischkultur. Kappen des Gipfeltriebs vermehrt die Zahl der Fruchtstände. Die Früchte werden 5–7 Monate nach der Aussaat reif (nicht alle einer Staude zu gleicher Zeit), werden aber vor dem Aufspringen geerntet. 5 dz Samen sind ein guter Ertrag pro Hektar (SEMLER). Trockenheit beeinträchtigt in Indien die Ölausbeute. Ricinus wird besonders in British-Indien, dann in Niederländ.-Indien (Java), China, am Kongo, in Senegambien, Sierra Leone, Sansibar, in den deutsch-afrikanischen Kolonien, Ägypten, Kleinasien, Syrien, in den südlichen Vereinigten Staaten, Kansas, Californien, Mexico, Brasilien, Surinam, Westindien (San Salvador, Curaçao), Spanien, Algier, Süd- und Nordfrankreich, England und Nord-Italien kultiviert. Die italienischen Kulturen finden sich besonders in der Nähe von Legnago (Venetien), so z. B. bei Roverchiara und San Pietro di Marobio, dann in der Nähe von Verona bei Montorio Veronese, Zevio und Tregnago in größerem Maßstabe, weniger in der Lombardei (RAVASINI). Neuerdings (1896) sind auch in Südrußland Anbauversuche gemacht worden. In Sicilien, Sardinien, Calabrien und der Riviera trifft man ihn vielfach verwildert. Die italienischen Kulturen können den Bedarf nicht mehr decken. Die größten Kulturen befinden sich in Indien. Dort wird Ricinus kultiviert in Madras, Mysore, Coong, Bengalen (Rajshahye, Cooch Behar, Chota Nagpore, Chittagong, Patna, Dacca, Presidency Burdwan, Orissa, Northwestprovinces und Oudh), Bombay, Panjab (das Detail in WATT, Dict. econom. prod. India). 1909 war die bebaute Fläche um 11% gegen 1908 zurückgegangen. AITCHISON sah in Chorassan und im Harirutdistrikt Ricinus am Rande der Felder kultiviert. In Niederländisch-Indien steht sowohl der rote wie der weiße Ricinus (djarak meirah und d. malaka) in Kampongkultur in Java, in Tegal, Madiun, Kediri, Surabaja und Probolinggo. STANLEY fand Kulturen des Ricinus in Afrika am oberen Ituri (Aruwimi), in der Nähe des Albert Njansa. In Nordamerika wird besonders die Stammform und die var. sanguineus kultiviert. Ricinusvarietäten werden bei uns jetzt in Gärten viel als ornamentale Zierpflanzen (Mittelstück von Rabatten) gepflanzt. Von tierischen Schädlingen werden die Kulturen meist gemieden (SEMLER).
[S. 628]
Lit. SEMLER, Trop. Agrikultur. — GRESHOFF, Ind. Mercuur 1896. — Die Kultur in Indien ausführlich in WATT, Dict. — SCHULTE IM HOFE, Tropenpfl. 1902. — Pharm. Zeit. 1904, 99. — DYNNIKOW (Kult. in Südrußland), Farmaceft 1896. — WRIGHT, Castor oil plant in Ceylon Agr. Journ. Roy. Bot. Gard. Ceylon 1904.
Gewinnung des Öls. Die Darstellung des Öls erfolgt entweder durch Pressen, Auskochen oder Extrahieren.
Das Auskochen der zerdrückten Samen und Abschöpfen des Öls wurde sowohl in Ost- wie in Westindien geübt. Das Öl gerösteter Samen ist braun und sauer (westindische Öle). In Jamaika z. B. wurden wenigstens früher die Samen mit Wasser ausgekocht, das oben schwimmende Öl abgehoben, nochmals erwärmt und dann durchgeseiht (WRIGHT).
Ricinusöl wird jetzt besonders in Californien, Mexico, Italien und Indien gewonnen, durch Pressung der im Herbst gesammelten, in Trockenöfen bis zum Erweichen erhitzten Samen besonders in den beiden zuerst genannten Staaten. Das gepreßte Öl wird mit der gleichen Menge Wasser vermengt und 1–2 Stunden gekocht. Dann wird das Öl vom Wasser getrennt und der Sonnenbleiche ausgesetzt.
Das deutsche und schweizerische Arzneibuch verlangen ausdrücklich mit Wasser ausgekochtes Öl. In Frankreich werden die Samen zweimal kalt gepreßt, wobei 40–45% Medizinalöl erhalten werden. Die dritte heiße Pressung und das durch Wasserdampfeinwirkung erhaltene Öl dient nur technischen Zwecken.
Die Reinigung des Öls kann auch durch Erhitzen seiner Lösung in absolutem Alkohol im Autoklaven und darauffolgendes Auswaschen mit Wasser geschehen (D. R. P. 93596).
Über die Gewinnung des Öls in Italien berichtet mir RAVASINI (1911) folgendes. «Sie wird namentlich bei Montorio Veronese (nahe Verona), wo sich eine große modern eingerichtete Fabrik befindet, und nahe Legnago in den oben (S. 627) genannten kleinen Orten, hier mehrfach im Kleinen, betrieben. So vereinzelt fand ich sie auch bei Forli und in der römischen Provinz nahe Frosinone bei Alatri. Einrichtungen zur Ricinus-Ölgewinnung sind aber auch bei größeren pharmazeutischen Unternehmungen in Betrieb zu finden, so z. B. in Mailand, Padua, Verona und in Neapel, dienen aber wohl nur für den Lokalgebrauch.
Zur Ölgewinnung bedient man sich in Italien hauptsächlich der italienischen Samen und nur wenn diese nicht genügen importiert man solche aus dem Auslande, meistens aus British-Indien und Ceylon; das beste Ricinusöl stammt aber aus den italienischen Samen. Die frischen Samen werden in Walzwerken enthülst, die Kerne sorgfältig gereinigt und ausgelesen, zerstampft und in hydraulischen Pressen zwei bis dreimal nacheinander in der Kälte gepreßt. Nur das Öl erster Pressung wird zu medizinischen Zwecken verwendet. Alles andere, sowie das aus den entweder in der Wärme noch weiter ausgepreßten oder mit Schwefelkohlenstoff extrahierten Rückständen gewonnene Öl dient zu technischen Zwecken als Brenn- oder Schmieröl.
Das zu pharmazeutisch-medizinischen Zwecken bestimmte Öl wird mehrmals mit Wasser ausgekocht, bis alles Eiweiß abgeschieden ist. Alsdann wird alles Unreine abgeschöpft und behufs Entfernung des Wassers das Öl entweder in flachen Gefäßen einige Tage stehen gelassen oder man begünstigt durch Erwärmen die Verdunstung des Wassers, filtriert mehrmals und füllt dann das Öl sofort in viereckige Blechkanister, die verlötet werden, ab.
[S. 629]
Aus 100 kg Ricinussamen erhält man c. 26–29 kg Öl erster Pressung, 10 kg Öl zweiter Pressung, 8 kg Öl dritter Pressung. — Durch weiteres Pressen in der Wärme oder durch Extrahieren mit Schwefelkohlenstoff kann man noch weitere 5 bis 10 kg Öl gewinnen. Die übrigbleibenden Rückstände werden als ausgezeichnetes Düngemittel in Mais-, Hanf- oder Olivenpflanzungen verwertet.»
Die Gewinnung des Öls geschieht bei den Eingeborenen Vorderindiens (nach SCHULTE AM HOFE) folgendermaßen. Die Samen werden in einem eisernen Topfe oder über offenem Holzkohlenfeuer soweit erhitzt (geröstet), daß man sie eben noch mit der Hand anfassen kann, dann sofort durch vorsichtiges Stampfen von den Schalen befreit und die Kerne in Jutebeuteln in eisernen Plattenpressen kalt, d. h. bei 20–30°, gepreßt (erste, kalte Pressung, das Öl ist hell). Dann wird durch ein Holzkohlenfeuer die Presse und ihre Platten erwärmt und weiter gepreßt (warme Pressung, das Öl ist dunkler). Das Öl wird dann mit Wasser solange gekocht und die sich abscheidenden Eiweißsubstanzen und Unreinlichkeiten abgeschöpft, bis sich das Öl geklärt hat. Dann läßt man es zur Verdunstung der letzten Reste des Wassers in flachen Gefäßen stehen und bringt es in große, 70 l fassende, bis zum Hals in die Erde eingegrabene, als Vorratsgefäße dienende Tonkrüge, in denen es die letzten Unreinheiten absetzt. In den englischen Ölpressereien wird im allgemeinen ebenso verfahren. Die verschiedenen Pressungen werden gesondert aufgefangen.
Die Bereitung des Öls in Madras erfolgte nach einer älteren Angabe von PRICE entweder in der Weise, daß die Samen geröstet, im Mörser zerkleinert, in das vierfache kochenden Wassers gebracht und das Öl abgeschöpft wurde (die Prozedur wurde wiederholt), oder indem der Same gekocht, dann an der Sonne getrocknet, zerstoßen und ausgekocht wurde (liefert ein besseres Öl), oder indem der Same über Nacht in Wasser eingeweicht, dann auf der Ölmühle gemahlen und das Öl dadurch entfernt wurde, daß man ein Stück Tuch in den Brei tat und dies dann in einen Topf ausdrückte. Die geringeren Sorten heißen in Indien Lampenöl. Die großsamigen Sorten liefern nur dieses. Auch in Westindien wird jetzt das Öl durch Auspressen gewonnen. Die nicht entschälten, aber gereinigten Samen werden schwach erwärmt (nicht geröstet!), dann in großen hydraulischen Pressen gepreßt. Die abfließende Mischung wird dann mit Wasser gekocht, der Schaum abgeschöpft und das Öl abgezogen. Das Öl wird dann nochmals vorsichtig mit Wasser gekocht und dadurch geklärt. (Darstellung des Öls in Indien ausführlich in WATT, Dict. econom. prod. India.)
Versuche in der indischen Regierungsfarm Saidapet haben ergeben, daß die kalte Pressung 36,5% eines sehr reinen Öls ergibt, daß schwach geröstete Samen 32%, stark geröstete 27% schmutziges Öl liefern, wenn sie gekocht und das Öl abgeschöpft wurde und daß, wenn die Samen gemahlen und das Öl ausgekocht wird, 30,43% Öl erhalten werden. Die gewöhnliche durchschnittliche Ausbeute beträgt bei den Eingeborenen in Indien c. 25%. Man rechnet, daß bei ihnen ein acre 5 cwts Samen und 27 lbs Samen 7 lbs Öl liefern (WATT).
Bei rationeller Bearbeitung erhält man aber beträchtlich mehr. Die erste kalte Pressung liefert alsdann 26–29 %, die zweite kalte Pressung 13–14 %, die dritte warme noch 7% (SCHÄDLER). Die Öle zweiter und dritter Pressung werden nur für technische Zwecke benutzt.
In Nordamerika werden die Samen im Ofen eine Stunde trocken erwärmt, dann gepreßt, das Öl mit Wasser eine Stunde gekocht, vom Wasser getrennt und in große Zinkbütten geleitet, wo es 8 Stunden bleibt, schließlich an der Sonne gebleicht (100 kg liefern 36 l Öl). Das feinste Öl wird auch hier aus geschälten Samen bereitet (SEMLER).
Das Öl wird im Großen auch durch Extraktion dargestellt. In Frankreich[S. 630] und Italien hat man es z. B. mit Alkohol extrahiert. Dies Öl soll sogar medizinisch wirksamer sein. Auch das mit CS2 extrahierte Öl wirkt stärker als gepreßtes.
Aber nur das kaltgepreßte Öl erster Pressung darf als Arzneimittel benutzt werden. Dies «medizinische Ricinusöl» wird stets aus geschälten Samen dargestellt. Die Samen werden durch Walzen, welche so eingestellt sind, daß nur die Schalen, nicht aber der Kern zertrümmert wird, von den Schalen befreit und die Schalentrümmer durch einen Luftstrom entfernt. Das Öl wird durch Aufkochen mit Wasser raffiniert. Hierbei wird das etwa in das Öl übergetretene Enzym zerstört. Ein so raffiniertes Öl hält sich jahrelang, ohne sauer und ranzig zu werden (LEWKOWITSCH).
Handel. Der Großhandel unterscheidet erste und zweite Pressung. In Indien wurden schon 1889 36 Mill. Liter Öl gewonnen, davon wurden aber c. 9 Mill. im Lande verbraucht. Viel Öl wird in Amerika dargestellt und auch Rußland bringt jetzt große Mengen Ricinussamen hervor und preßt auch viel Öl (1906 war kaukasisches Öl im Handel). Im deutschen pharmazeutischen Großhandel sind jetzt besonders italienisches, dann französisches und amerikanisches Ricinusöl. Die letzteren haben einen unangenehmen Geschmack. Das italienische wird bevorzugt. Daneben findet sich aber indisches, brasilianisches, javanisches Öl.
Im Handel unterscheidet man in Italien (nach RAVASINI) folgende Sorten:
Zu pharmazeutischen Zwecken:
a) das aus italienischen Samen gewonnene Öl erster Pressung, welches die beste Qualität darstellt, wird als: «Olio di ricino fiore d’Italie» bezeichnet; davon sind zwei Sorten «Speciale» und «Extra» im Handel;
b) das aus ausländischen Samen erhaltene Öl erster Pressung heißt: «Olio di ricino prima pressione»; gute Sorte. Findet sich auch unter dem Namen «Olio de ricino fiore indiano» im Handel.
Zu technischen Zwecken:
a) eine bessere Sorte: «Olio ricino commune» und
b) eine schlechtere Sorte: «Olio ricino per uso industriale» oder «Olio ricino per le arti».
Dies italienische Ricinusöl zu pharmazeutischen Zwecken kommt in viereckigen Blechkanistern à 5, 10 und 20 kg Inhalt in Handel. Das zu technischen Zwecken gebrauchte entweder in Kisten mit je zwei Blechkanistern à 18 kg Inhalt oder in Fässern (Barrels) à c. 180 kg.
GROSSMANN unterscheidet: Ol. ric. med. extra prima weiß «Crème» (das teuerste), in Kisten à 4 Kan. à 20 kg, dann prima weiß, dies auch in Barrels von c. 180 kg. Dann: erste Pressung und zweite Pressung.
Ricinussamen kommen besonders aus Calcutta, Bombay, dem Senegal, Italien, der Levante und Amerika in den Handel. Von den indischen geht viel nach Italien (DYMOCK). Sie sind zurzeit ein großes Spekulationsobjekt, so daß die Preise stark schwanken.
Marseille ist Hauptmarkt für Ricinussamen (1895 gelangten dorthin 22672 t). British Indien exportierte Castor oil nach England und Kolonien 1907/08: 1485431, 1908/09: 1076692 gall., nach anderen Ländern 1907/08: 23114, 1908/09: 23275 gall. Italien exportierte 1909: 56 und importierte 1909: 126684 quint. semi di ricino und exportierte 1907: 5391, 1908: 3454, 1909: 2292, 1910: 4766 quint. olio di ricino. Deutschland importierte 1909: 80990 dz Ricinussamen aus Brit. und Nied. Indien und 84934 dz Ricinusöl besonders über Belgien und Großbritannien, etwas auch aus Italien. Hamburg importierte 1908: 63482 dz Ricinussamen, davon stammten 56233 aus Brit. Ostindien, 6446 aus Nied. Ostindien, nur wenig aus Ostafrika. Hamburg importierte 1908 seewärts: 34660 dz Ricinusöl. Davon kamen aus Großbritannien: 25664, Belgien: 6076, Frankreich: 2451, Italien: 234, den Niederlanden: 229. Die Einfuhr von Castor oil nach London betrug 1906: 767, 1907: 827, 1908: 317, 1909: 178 casks und 1906: 1040,[S. 631] 1907: 949, 1908: 828, 1909: 599 cases. (1897 importierte England 155850 cwts Castor seeds aus Frankreich, Indien, Belgien und Italien.) Frankreich importierte 1908 huile de ricin et de pulghère 10032 Quint. Nordamerika importierte 1896: 22890, 1909 aber nur 6847 gall. Castor oil.
Lit. SCHULTE IM HOFE, Fabrik. u. Verwend. v. Ricinusöl in Indien. Apoth. Zeit. 1900, 824. — AINSLIE, Mat. med. I, 256. — WATT, Dict. econ. prod. Ind. — Pharm. Zeit. 1904, 1052. — WRIGHT, Med. pl. of Jamaica, London med. journ. 8. — VORDERMAN, Castorolie-Fabricage op Java. Teysmannia 1894, 713.
Morphologie des Samens. Die Samen sind von sehr verschiedener Größe und sehr verschiedener Farbe. Selbst bei derselben Varietät finden sich Spielarten mit großen und kleinen Samen. Die Länge der Samen schwankt von 9–22, die Breite von 6–15, die Dicke von 4,5–9 mm. Die größten sind die vom Kongo und die Sansibar. Die medizinalen Samen messen meist 4,5 : 6 : 9 mm, gehören also zu den kleinsten. Das Gewicht von 100 Samen beträgt 11,8–107 gr, das Gewicht des Kerns beträgt 60,8–80,6% (BRUYNING). Am häufigsten ist bei den medizinalen Samen die Grundfarbe ein gesprenkeltes Silbergrau, in welches unregelmäßige, nicht sehr breite, längsgestreckte, rotbraune Flecke eingestreut sind. Die Variationen kommen besonders dadurch zu stande, daß entweder die grauweiße Grundfarbe prävaliert und die Flecke zurücktreten oder umgekehrt die braunen Flecken, die in allen Nuancen des Braun bis zu Schwarz vorkommen, die Oberhand gewinnen, in wenigen großen oder zahlreichen kleinen Flecken auftreten, ja ganz die Grundfarbe verdrängen. Der Same ist ellipsoidisch, etwas plattgedrückt, an der Bauchseite bisweilen zugeschärft. Er trägt an der Spitze eine helle, mützchenartige Caruncula. Die Samenschale ist spröde und brüchig, glänzend und glatt. Das reichlich entwickelte, weiße, ölig-fleischige Endosperm zerfällt leicht in zwei Hälften. Innen liegen ihm die beiden dünnen, geaderten, blattartigen Cotyledonen auf.
Anatomie. Das hemianotrope Ovulum hat zwei Integumente. Eine große Funicularwucherung (Obdurator) legt sich über die Mikropyle. Durch reichliche Vermehrung des Gewebes an der Chalaza entsteht eine becherartig den Embryosack umfassende, von Gefäßbündeln durchzogene Wucherung, die den Nucellus nach oben schiebt, ein Pseudonucellus (SCHLOTTERBECK). Aus dem äußeren Integumente gehen drei Schichten hervor: die aus polygonalen Zellen bestehende Samenschalepidermis, deren Außenwand mit unregelmäßigen zentripetalen, «gekröseartigen» (MOELLER) Verdickungen versehen ist und die bei den gefärbten Stellen der Samenschale den Farbstoff führt, ein 4–6reihiges, reichdurchlüftetes, aus sternförmigen Zellen bestehendes Schwammparenchym, in dem das Raphebündel zur Chalaza läuft und eine Reihe etwas palissadenartig gestreckter, dünnwandiger, c. 20 mik hoher Zellen, deren Seitenwände bisweilen wellige Verbiegungen zeigen. Aus dem inneren Integument geht zunächst die nun folgende breite, außerordentlich harte Makrosklereïdenschicht hervor, die aus stark radial gestreckten, radial oder schief radial gestellten, miteinander verzahnten, bis 200 mik hohen, 8–15 mik breiten (MOELLER) Palissadensklereïden mit dicker, brauner, verholzter Wand besteht, sodann die Nährschicht. Diese besteht beim unreifen Samen aus einem aus sehr zahlreichen Zellreihen aufgebauten, reich durchlüfteten Gewebe, das aber beim reifen Samen ganz zusammengefallen ist, aber Oxalatkristalldrusen und nadelförmige, oft sternförmig vereinigte Fettkristalle enthält (COLLIN-PERROT) und das die zahlreichen Bündelchen führt. Es ist dies die sich als weißes Häutchen leicht vom Samenkern ablösende innere Samenhaut der Autoren. Ihre Zellen enthalten oft Calciumoxalat und auch wohl Fett. Löst man die harte Schale von einem reifen Samen vorsichtig ab und legt den Kern in Phloroglucinsalzsäure, so sieht man, daß[S. 632] das von der Chalaza ausgehende reichverzweigte Bündelnetz nicht bis ganz zur Spitze reicht, der oberste Teil also nicht von der Chalazawucherung umschlossen ist. Da der echte Nucellus ganz resorbiert wird, so liegt hier nur Endosperm (SCHLOTTERBECK). Der Obdurator ist beim reifen Samen durch die Caruncula ganz verdrängt. Sein Gewebe besteht aus reichgetüpfelten, bisweilen Stärke führenden Zellen. Die Zellen des reichlich ausgebildeten, die Hauptmasse des Samens ausmachenden Endosperms sind dünnwandig und enthalten, in Ölplasma eingebettet, zahlreiche längliche oder kugelige, meist 7,5–15, selten bis 20 mik große Aleuronkörner (Fig. 196), die außer Grundsubstanz meist 1–2 wohlausgebildete Kristalloide und ein großes oder mehrere kleinere Globoide enthalten (LÜDTKE).
Die Kristalloide der Aleuronkörner von Ricinus sind unlöslich in Wasser, 1% Kochsalzlösung, 1 und 5% und konz. Magnesiumsulfat, 1% und konz. Ammonsulfat, 1% Chlorammon, 20% Kaliummonophosphat, konz. Dinatriumphosphat, löslich in 10% Kochsalz, 20% Magnesiumsulfat, 10% Ammonsulfat, 10 und 20% Chlorammon, Kalkwasser und Salzsäure. Die Grundsubstanz löst sich in Wasser und allen übrigen verdünnten Salzlösungen. Die Globoide sind unlöslich in Wasser, 1% Kochsalz, 1% Magnesiumsulfat und Kalkwasser, sonst in Salzlösungen im allgemeinen leicht löslich, sehr schwer in konz. Magnesiumsulfat (TSCHIRCH und KRITZLER).
Aleuronkörner des Ricinussamens.
A in starkem Glycerin, B in verdünntem Glycerin, C in Glycerin erwärmt, D nach Behandeln mit Jodtinktur und Schwefelsäure, das Ölplasma ist zurückgeblieben.
[Nach Sachs.]
Die innerste Schicht des Endosperms besteht aus der Quellschicht (TSCHIRCH). Die nur 130 mik dicken Cotyledonen sind breit blattartig und den Innenseiten des in der Mitte gespaltenen Endosperms mit breiter Fläche fest angefügt. Sie enthalten in dünnwandigen Zellen Aleuronkörner, die sehr viel kleiner als die des Endosperms, oft nur 1 mik, meist jedoch 2–4 mik lang sind. In den Procambiumsträngen, die als zartes Adernetz die Cotyledonen durchziehen, sind die Aleuronkörner noch kleiner. Ober- und Unterseite ist bei den Cotyledonen nicht different ausgebildet. Da beim Verfüttern der Preßkuchen wiederholt Vergiftung beobachtet wurde, ist der mikroskopische Nachweis von Ricinuskuchen oft erwünscht.
Lit. GRIS, Note sur le dével. d. l. graine du Ricin. Ann. sc. nat. (4) 15 (1861) 17 (1862) und (5) 2 (1864). — HARZ, Landwirtsch. Samenkunde. — PAMMEL, Seed coats of the Gen. Euphorbia. Shaw School of bot. 1891, 543. — G. KEYSER, Beitr. z. Entwicklungsgesch. d. Samendecken bei d. Euphorb. m. bes. Berücks. v. Ricin. commun. Ber. d. pharm. Ges. 1892 (dort die Lit.). — SCHLOTTERBECK, Beitr. z. Entwicklungsgesch. pharmakogn. wicht. Samen. Dissert. Bern 1896 (mit vielen Abbild.). — LÜDTKE, Aleuronkörner. Ber. d. pharm. Ges. 1891, 58. — GRAM (Samensch. d. Euphorb.), Bot. Tidskrift 1896, 358. — COLLIN, Tourteau de Ricin. Journ. pharm. chim. 1903, 361 u. Guide prat. 1893. — BÖHMER, Kraftfuttermittel 1903, Ölkuchen in DAMMERS Lexikon 1887 und in KÖNIG, Landwirtsch. wicht. Stoffe 1891. — T. F. HANAUSEK in WIESNER Rohstoffe. — SACHS, Lehrbuch (Aleuron). — TSCHIRCH, Angew. Anatomie, Fig. 36. — TICHOMIROW, Lehrbuch 1900. — VOGL, Kommentar 1892. — MOELLER, Mikroskopie II. Aufl., Fig. 348–350. — Preßkuchen: COLLIN-PERROT, Resid. industr., Fig. 14 u. 15.
Chemie. Die Zusammensetzung der ungeschälten Samen ist im Durchschnitt in %: Wasser 6,46, Stickstoffsubstanz 18,75, Fett 51,37, stickstofffreie Extraktsubstanz 1,5, Rohfaser 18,1, Asche 3,1 (KÖNIG).
[S. 633]
SCHÄDLER fand in geschältem italienischem (und indischem) Samen in %: Öl 52,6 (55,2), Eiweiß 20,5 (19,3), Zucker 2,1 (2,2), Asche 2,9 (3,4), Wasser 8 (7,3). Die Samenkerne (und Schalen) enthalten in % (nach MAILLOT): Öl 52,2 (0), sonst in Alkohol und Äther löslich 4,2 (10,4), Eiweiß 26,6 (15,3), Zucker 2,2 (0), Rohfaser 5,7 (59,6), Asche 2,4 (3,1), Wasser 4,4 (10,5). FLEURY fand (1865) im Samen 3,23% N. (= 20% Eiweiß), 46,6% Öl, 2,2% Zucker und Schleim, 18% Cellulose.
|
Die Preßkuchen zeigen folgende Zusammensetzung
|
JOHNSTON
|
DÉCUGIS
|
||
|
Amerikan.
Ricinus |
aus ganzen
Samen |
aus geschälten
Samen |
||
|
Wasser
|
2,54
|
9,85
|
10,38
|
|
|
Fett
|
18,20
|
5,25
|
8,75
|
|
|
Stickstoffsubstanz
|
27,00
|
20,44
|
46,37
|
|
|
Nicht stickstoffhaltige Substanz
|
 |
43,42
|
49,44
|
24,00
|
|
Rohfaser
|
||||
|
Asche
|
6,14
|
15,02
|
10,50
|
|
|
Stickstoff
|
4,32
|
3,67
|
7,42
|
|
|
Phosphorsäure
|
2,04
|
1,62
|
2,26
|
|
Die Eiweißkörper bestehen aus viel Globulinen, wenig Albumin, Nucleoalbumin und Glykoproteïn (TAYLOR, OSBORNE, MENDELL und HARRIS).
Nachgewiesen ist z. B. das Globulin, Edestin (Osborne und Campbell) (= Conglutin C = 51,65, H = 6,89, N = 18,75, O = 21,86, S = 0,85%), das durch Chlornatrium nicht, wohl aber durch Magnesiumsulfat vollständig gefällt wird und bei der Dialyse oktaëdrische Kristalle oder Sphäroide gibt. Es ist auch in vielen anderen Samen (Hanf, Lein, Kürbis, Baumwolle, Cocos, Weizen, Roggen, Mais) gefunden worden. Die Kristalloide der Aleuronkörner bestehen aus einem Globulin, die Globoide enthalten ebenfalls ein Globulin, daneben aber, oder damit verbunden, das Ca-Mg-Salz einer gepaarten Phosphorsäure, die Grundsubstanz neben einem Globulin wohl auch Albumosen (TSCHIRCH und KRITZLER). In den Keimpflanzen: Asparagin, freie Fettsäuren, aber kein Glycerin, viel Zucker, Pepton (GREEN), in den etiolierten Keimpflanzen Glutamin (SCHULZE).
TUSSON isolierte 1864 aus den Samen das krist. Ricinin. Es enthält Stickstoff, ist aber kein Alkaloid. WAYNE fand es auch in den Blättern; SCHULZE in den Keimpflanzen (SCHULZE nennt es Ricidin). (WERNERS Ricinin war etwas anderes, nämlich das Magnesiumsalz einer organischen Säure.) Das Ricinin (nach SOAVE: C17H18N4O4 F. = 194°, nach EVANS = C12H13N3O31) bildet bitterschmeckende, sublimierbare, optisch aktive, neutrale, wasserlösliche Kristalle, die keine Alkaloidreaktionen geben, wohl aber die WEIDELsche und die Murexidreaktion. MAQUENNE und PHILIPPE fanden es zu 0,2% in den Preßkuchen (F = 201,5°). Es erwies sich als ein Pyridinderivat von der Formel C8H8N2O2. Es zerfällt folgendermaßen:
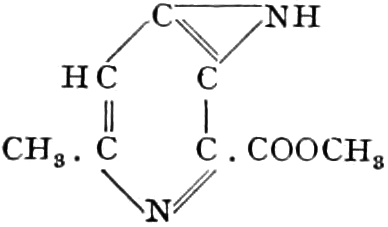
KOH
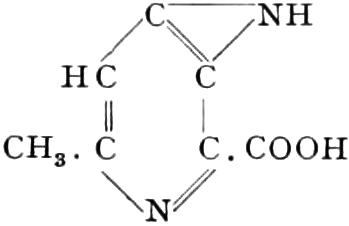
bei 150°
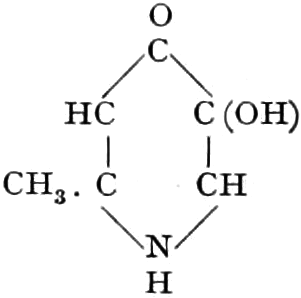
Es ist giftig (SOAVE; CORNEVIN bestreitet 1897 die Giftigkeit), besitzt aber keine abführenden Eigenschaften (DEY). Vom Ricinin ist im Samenkern 0,03%, in der Samenhaut das fünffache enthalten. In grünen Ricinuskeimpflanzen war die Menge des[S. 634] Ricinins auf das zwölffache, in etiolierten auf das fünfzehnfache gestiegen. Etiolierte Keimpflanzen enthalten 2,43%, grüne 1,33% Ricinin (SCHULZE und WINTERSTEIN). Ricinin wird auch in den Schalen (zu 1,5‰) angegeben (SOAVE).
Das Vorkommen von Amygdalin bedarf der Bestätigung.
In den reifenden Samen sind proteolytische und lipolytische Enzyme gefunden worden (GREEN, NICLOUX). Reifer Ricinussamen enthält eine sehr kräftige, zur Fettspaltung technische Verwendung findende (D. R. P. 145413) Lipase (CONNSTEIN, HOYER und WARTENBERG; noch wirksamer ist übrigens Chelidoniumlipase, FOKIN), die in 24 Stunden 90% der Fette aufspaltet. Daneben werden angegeben: Invertase und Maltase (TAYLOR), ein Labenzym (BRUSCHI), ein diastatisches (BRASSE) und tryptisches Ferment, sowie ein die Fettspaltung beschleunigendes säurebildendes Enzym (HOYER). Die keimenden Samen enthalten ein proteolytisches, dem Trypsin ähnliches, ein fettspaltendes und ein Labferment. Diese sollen im ruhenden Samen als Zymogene enthalten sein (GREEN, NICLOUX). Bei der Keimung werden die Globuline und Albumosen des Samens in Peptone und Asparagin umgewandelt. Im keimenden Samen sind neuerdings neben Milchsäure und Essigsäure Katalase, Peroxydase und eine Reductase (Hydrogenase) gefunden worden (DELEANO). M. NICLOUX schreibt die lipolytische Eigenschaft des Ricinussamens übrigens dem Cytoplasma («Lipasoidin») zu, nicht einem löslichen Enzym. LAMY erhielt aber das Enzym in Lösung.
Die giftige Wirkung der Samen beruht auf einem Gehalte von etwa 3% an dem Toxalbumin Ricin. 1889 fand STILLMARK dies Ricin auf, das bereits BÜBNOW und DIXSON 1887 in Händen gehabt und Ricinon genannt hatten. STILLMARK extrahierte mit NaCl, fällte mit Magnesiumsulfat und dialysierte den Niederschlag. Ricin ist enorm giftig, mit 1 g kann man 1½ Mill. Meerschweinchen töten (EHRLICH), 0,006 (= 10 Samen) töten einen Menschen (doch wirken schon unter Umständen drei Samen giftig). Schon 0,002 mg der Substanz pro 1 kg Körpergewicht wirken bei Kaninchen, 0,04 mg bei Hunden tötlich (OSBORNE und MENDEL). Ricin ist ein agglutinierendes Toxin (STILLMARK). Es bildet mit Abrin (in Abrus precatorius) Crotin (vgl. S. 581), Curcin (SIEGEL, in Jatropha Curcas), Robin (POWER), und Phallin (in Amanita phalloides), sowie den GRESHOFFschen Urticaceentoxinen die Gruppe der pflanzlichen Blutagglutinine, d. h. der die Blutkörperchen zur Verklebung und Ausfällung bringenden Toxalbumine, die KOBERT als Gemische eines Albumins mit einem Globulin betrachtet. Es wirkt agglutinierend auf Frosch-, Säugetier-, Menschen- und Vogelblut, nicht auf Fischblut. Es bringt Milch zum Gerinnen. Verdauung im Brutschrank schwächt es nicht ab (KOBERT). Die Angabe, daß Ricin durch feuchte Hitze von 90° und trockene von 130° seine Giftigkeit verliert (MIESSNER), ist nicht richtig (MOOSER). Ricin nach der Phasindarstellungsmethode (Biochem. Ztschr. 18 [1909] II, 549) bereitet, agglutiniert und enthält eine toxische Komponente, ist also ein Phasin. Aber das Phytotoxin (α Phytalbumose) Ricin, das erste aus einer höheren Pflanze isolierte Proteid von toxalbuminartigem Charakter ist möglicherweise gar kein Eiweißkörper. Denn JACOBYS durch tryptische Verdauung von allen Eiweißkörpern befreites, keine Eiweißreaktionen mehr gebendes Ricin besaß noch vollkommen seine Giftigkeit und die agglutinierenden Eigenschaften. Auch das reinste Ricin ist noch ein Gemisch. JACOBY betrachtet es als aus Vollgift, Toxintoxoid und Agglutinintoxoid bestehend. EHRLICH zeigte, daß sich das Ricin wie ein Bakterientoxin verhält, also im Körper die Bildung eines Antitoxins des Antiricins hervorruft[S. 635] und daß man also durch Einverleibung von Ricin Immunität gegen Ricin erzielen kann. Das Ricin spielt daher im Ausbau von EHRLICHS Seitenkettentheorie eine Rolle. Das Antiricin des Immunserums ist ziemlich resistent gegen Wärme und Säuren. Das Ricin war das erste Gift, welches man (durch EHRLICH) kennen lernte, das ein Antitoxin im Blutserum erzeugt. Dann erst folgten Abrin, Crotin, Schlangengifte und die Bakterientoxine.
Daß Ricinussamen giftig sind und schwere Magendarmentzündungen hervorrufen können, ist seit langem bekannt. BEAUVISAGE stellte 1894 die bekannten 155 Vergiftungsfälle zusammen. Aber auch die Preßkuchen sind unter Umständen giftig, da außer der Hauptmenge der Lipasen auch das Ricin in ihnen zurückbleibt. (Ricin ist in Öl unlöslich.) Aber Tiere sind sehr verschieden empfindlich gegen das Gift (vgl. oben). Pferde z. B. vertragen bis 100 g der Samen (BIERBAUM), ebenso sind Hühner ziemlich ricinimmun. Auch kann man durch langsame Gewöhnung oder durch Ricininjektionen (CORNEVIN) die Tiere gegen Ricin immunisieren, da ja im Blute Antiricin entsteht (Schafblutserum enthält sogar normal ein Antiricin) und so ist selbst die vorsichtige Verfütterung der an sich giftigen Preßkuchen, wenn man langsam steigende Mengen gibt, ohne Schädigung möglich (KOBERT), freilich immerhin nicht ganz unbedenklich, so daß NAGEL vorschlug, die Ricinuskuchen durch Ausziehen derselben mit 10% Kochsalzlösung zu entgiften (Ricin geht in Lösung). Neuerdings wird übrigens behauptet, daß bisweilen Vergiftungen mit Ricinuspreßkuchen durch Beimischung der Preßrückstände anderer giftiger Samen zu stande kämen (? BIERBAUM).
Der Nachweis, ob ein Preßkuchen Ricin enthält, kann auf biologischem Wege erbracht werden. 10 g des Preßkuchen werden 24 Stunden mit 100 g Glycerin bei 37° digeriert, filtriert und mit Alkoholäther gefällt. Der Niederschlag wird gewaschen, getrocknet und mit 10% Kochsalzlösung eine Stunde digeriert, dann filtriert und auf 200 ccm verdünnt. 1 ccm der Lösung wird mit 0,1 ccm Antiricinserum überschichtet und im Thermostaten gehalten. Bei Anwesenheit irgendwie wesentlicher Mengen Ricin tritt sofortige Fällung ein, bei geringen Mengen nach einiger Zeit, bei Abwesenheit von Ricin bleibt die Lösung klar (MOOSER).
MAILLOT fand in den Schalen 0,5% Gallussäure und in den Kernen 1% Äpfelsäure. Lösliche Pentosane enthalten die Samenkerne nicht, unlösliche sind in den entfetteten 2,12% enthalten. Die unlöslichen Pentosane des Hemicellulosenrückstandes betragen 18,27% der entfetteten Kerne. Die Samenschalen enthalten 18,77% Pentosane (GODET). Ferner enthalten die Samen c. 2% Saccharose (E. SCHULZE, VALLÉE, GRAM) und Invertzucker (GREEN u. JACKSON), Lecithin, Bernsteinsäure (GRAM), Gummi, einen Bitterstoff und nach GREEN und JACKSON, die die saure Reaktion des Saftes darauf zurückführen, neben organischen Säuren eine Spur freie Phosphorsäure. Die Asche der Kerne beträgt 2,1–3,6%, die der Schalen 3,1–5% (BRUYNING). Die Asche der ganzen Samen beträgt 3–4%. Sie enthält 31,9% Phosphorsäure und 19,8% Magnesia (SCHULZE u. GODET). Über die Lokalisation der einzelnen Stoffe sind neue Untersuchungen nötig. Bemerkenswert ist, daß DIERBACH den «scharfen Stoff» als ausschließlich in der zarten weißen Samenhaut lokalisiert angibt, BOUTRON und HENRY ihn im Eiweißkörper, JUSSIEU im Embryo suchen.
Ricinussamen enthalten im Kern bis 64,5% Öl (BRUYNING 1896). Der Ölgehalt der Kerne (und das spez. Gew. des Öls) differierten bei den einzelnen Varietäten. Sie betragen z. B. nach PECKOLT bei var. microcarpus 56,17 (spez. Gew. 0,971), var. genuinus 45,4 (0,970), var. badius 43,29 (0,962), var. brasiliensis 43,29 (0,963). GRESHOFF fand bei Javasamen das Gewicht von 100 Samen 19,2–21,8–31 g und[S. 636] den Ölgehalt des Kerns 50–58%, bei Senegalsamen 100 Samen 45,4 und 9,8 g und den Ölgehalt 61–64%, bei Curaçaosamen 100 Samen 9,5, Ölgehalt 62% (der Kern betrug 70–78,2% der Samen). In den ganzen Samen sind meist 45–53% Öl enthalten (LEWKOWITSCH). Je wärmer das Klima, um so größer der Ölgehalt (SEMLER).
Ricinusöl, Oleum Ricini (Ol. palmae christi, Ol. granae regiae, huile de ricin, castor oil, lamp oil, olio di ricino, wonderolie, κικινέλαιον) ist sehr dickflüssig, fast farblos und schwach gelblich mit einem Stich ins Grünliche; fast ohne Geruch, von sehr eigenartigem, hinterher kratzendem Geschmack, der bei amerikanischen Ölen stärker hervortritt als bei italienischen und französischen. Es trocknet nicht ein, selbst wenn es in sehr dünnen Schichten der Luft ausgesetzt wird, sondern wird ausschließlich eine zähe Masse. Nach dem Einlegen in konz. Kali, dem konz. Ammoniak zugesetzt wurde, treten im Öltropfen sehr kleine Nadeln auf, ganz vereinzelt kleine Sphärite (HARTWICH und UHLMANN). Das Öl besteht aus einer geringen Menge Tristearin (MANGOLD, KRAFFT), etwas, c. 1%, Di(hydr)oxystearin (JUILLARD, HALLER, Dioxystearinsäure = Margaritinsäure, BUSSY und LECANU) und Hydroxystearin (JUILLARD) und vorwiegend (über 80%) dem Glycerinester der Ricinolsäure. Palmitin, Olein, Caprylalkohol (BOUIS), Önanthylalkohol (KOLBE) fehlen, Isoricinolsäure (HAZURA und GRÜSSNER) ist fraglich. Durch Alkoholyse mit Methyl-, Äthyl-, Propyl- und Isobutylalkohol unter Zusatz von 1–2% HCl konnte HALLER die Glyceride der Stearin-, Ricinol- und Dioxystearinsäure, nicht aber die beiden isomeren Ricinoleïne von HAZURA und GRÜSSNER erhalten. Es muß aber, wie die Jodzahl zeigt, eine geringe Menge einer anderen ungesättigten Säure außerdem vorhanden sein. Die sich beim Erkalten zu 3–4% ausscheidende feste Masse besteht aus Tristearin und Triricinoleïn. Die hydroxylierte Fettsäure (Dihydroxystearinsäure) macht nur 1% der Fettsäuren aus. Vielleicht ist auch etwas Sebacinsäure darin. Amerikanisches Öl ist reicher an festen Glyceriden als indisches und italienisches Öl. Die Elementarzusammensetzung des Öls ist: C = 74, H = 10,26, O = 15,71 (KÖNIG). Bei der Elaïdinprobe liefert Ricinusöl eine weiße, feste Masse (Ricinelaïdin kristallisiert leicht).
Das Ricinusöl ist besonders durch sein hohes spez. Gew., sein Verhalten zu Lösungsmitteln, seine hohe Acetylzahl, niedrige Verseifungszahl, konstante Jodzahl und seine große Viskosität charakterisiert. Von allen Pflanzenölen besitzt es das höchste spez. Gew. und die größte Viskosität. Während z. B. die spez. Viskosität (SCHÜBLER) beim Olivenöl bei 15° nur 21,6 beträgt, ist sie beim Ricinusöl 203,3! Es gibt die HALPHENsche Reaktion nicht und läßt sich mit Traganth, Kalkwasser, Casein und Seife emulgieren (BOURDIER). Das spez. Gew. beträgt (bei 15,5°) bei Medizinalöl 0,9591–0,9622, bei indischen Ölen bis 0,9679 (D. A. V: 0,950 bis 0,970, Pharm. helv. IV: bei 15° 0,960–0,970, bei 98° 0,909–0,910), 44 Tropfen = 1 g. Bei 0° wird es durch Abscheidung kristallinischer Flocken trübe, bei weiterer Abkühlung butterartig. Der Erstarrungspunkt liegt bei −10 bis −12° (SCHÄDLER); bei europäischem oft erst bei −18° (SCHÄDLER). Verseifungszahl: 176,7–186,6 (180,6–191,2 DIETERICH); Jodzahl: 81,4–96,6 (80,2–87,8 BACHMANN; 81,17 bis 86,28 DIETERICH); Bromzahl (bei kalt extrah.): 52,25 (TELLE); Reichert-Meißlzahl: 1,1–1,4; Gehalt an Unverseifbarem 0,3–0,37 (THOMSON und BALLANTYNE); Acetylzahl (146,7) 149,9–150,5 (LEWKOWITSCH); Maumenéprobe: 46–47°; Bromthermalprobe: 14,7–15°; Brechungsexponent bei 15°: 1,4795–1,4803 (STROHMER), bei[S. 637] 40°: 1,4694–1,4721 (Pharm. helv. IV); Oleorefraktometerzahl +43–46 (JEAN). Refraktometerzahl (im Zeiss-Butyrorefraktometer) bei 35°: 72, bei 20°: 81,2, bei 15°: 84,5. Ricinusöl dreht rechts, im 200 mm-Rohr bei 20° C. +23,4 bis +26,1° (nach DEERING und REDWOOD im HOFFMANN-LAURENT-Polarimeter +7,6° bis 9,7°, nach PETER +40,7°, nach DOWZARD: +8,3 bis +9°, nach RAKUSIN +8 bis +8,5 Saccharimetergrade). Einige Proben drehten aber links (FLÜCKIGER). Viskosität (in REDWOODS Viskosimeter) 1160–1190 Sec. bei 100° F. Der Entflammungspunkt liegt bei 255–270° (RAKUSIN).
Die Fettsäuren zeigen bei 15,5° C. ein spez. Gew. = 0,9509, Erstarrungspunkt +3° C. (HÜBL), Schmelzpunkt 13°, Säurezahl 183,1–187 (192,1), Verseifungszahl 189–191,1, Jodzahl 87–93,9 (Jodzahl der flüssigen Fettsäuren 106,9), Acetylzahl 153,4–156, Brechungsindex (bei 60° C.) 1,4546.
Der Gehalt des Öls an freien Säuren schwankt bei gepreßten Ölen zwischen 0,68 und 14,61 (Mittel 9,28)% (NÖRDLINGER). Bei extrahierten von 1,18–5,25, bei technischen von 1,46–2,16 bzw. 3,5–6,04 (ULZER). Medizinalöl darf höchstens 1,5% freie Säure enthalten. Die meisten Handelsöle enthalten nur geringe Mengen freie Fettsäuren. EVENS SONS LESCHER AND WEBB fanden in 10 English grade (first pressure) 0,4–0,49% freie Säure (auf Ölsäure berechnet), in 5 English second pressure 10–14%, in 50 Calcutta (good seconds) 0,6–2,1%, in 3 italienischen (pharmazeut.) Ölen 0,5–0,6%, in 3 französischen (pharmazeut.) Ölen 0,4 bis 0,5%. Raffiniertes Öl hält sich lange ohne sauer und ranzig zu werden (LEWKOWITSCH). Bei einem 4 Jahre der Luft ausgesetzten Medizinalöl hatte die Jodzahl nicht abgenommen, nur das spez. Gew. war von 0,9591 auf 0,9629 gestiegen und es ließen sich 1% freie Fettsäuren nachweisen (LEWKOWITSCH). Durch «Blasen» steigt das spez. Gew. von 0,9623 auf 0,9906, die Säurezahl von 1,1 auf 5,7, die Verseifungszahl von 179 auf 190,6, die Acetylzahl von 146,9 auf 164,8; die Jodzahl sinkt auf 70,01 (LEWKOWITSCH).
Ricinusöl ist in Petroläther, Petroleum und Vaselinöl fast vollständig unlöslich, nimmt aber das gleiche Volumen Petroläther auf und 1½ vol. Petroleum. Es löst sich in allen Verhältnissen in Eisessig und abs. Alkohol, ferner bei 15° in 3 Teilen (D. A. V, 2,4–2,94 Teilen VAN ITALLIE) und bei 25° in des gleichen Menge 90prozentigen Alkohol — ein für Ol. ricini sehr charakteristisches Verhalten, das es von fast allen anderen Ölen unterscheidet. Durch Erhitzen auf 300° wird ein Öl (Floricin) erhalten von entgegengesetzten Lösungsverhältnissen (NÖRDLINGER).
Ricinusöl esterifiziert sich mit Säuren (Oxalsäure, Essigsäure, Ameisensäure usw.) ziemlich leicht (LIDOFF). Die Kohlensäureester, durch Sättigen des Öls mit CO2 erhalten (DIETERICH), besitzen den kratzenden Geschmack des Öles nicht und höhere Resorbierbarkeit. Durch Behandeln des Ricinusöls mit englischer Schwefelsäure (und Neutralisieren mit Ammoniak) wird das Türkischrotöl erhalten. Dies ist ein Gemisch, in dem Ricinolsäureschwefelsäurester, Dioxystearinsäureschwefelsäureester, polymere Ricinolsäuren, Ricinolsäure und Isoricinolsäure (angeblich ein Gemisch von Ricinolsäure mit Dioxystearinsäure) resp. deren Salze neben unverändertem Ricinusöl enthalten ist (SCHEURER-KESTNER, JUILLARD, BOGAJEWSKY). Oxydation des Öls mit Salpetersäure liefert Pimelinsäure (GANTHER und HILL). Behandelt man Ricinusöl mit einigen Tropfen Salpetersäure und neutralisiert mit Soda, so tritt der Geruch nach Önanthsäure auf (DRAPER).
[S. 638]
Die purgierende Substanz des Öls ist (nach BUCHHEIM und HANS MEYER) die Ricinolsäure (Ricinölsäure, Ricinoleïnsäure); vielleicht nehmen aber an der Wirkung auch noch andere unentdeckte Substanzen teil (FINNEMORE und DEANE). Die Ricinolsäure, von CLAUS 1876 entdeckt, erhielt KRAFFT kristallinisch F = 16–17°. Sie ist eine ungesättigte Säure, wahrscheinlich aber nicht
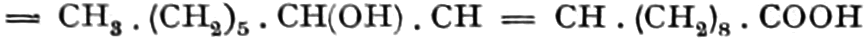
(JUILLARD), sondern:
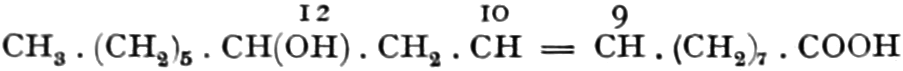
(KRAFFT, BEHREND, GOLDSOBEL) und zwar die rechtsdrehende labile Form der Oktadeken 9 ol 12 Säure 1. Sie besitzt den gleichen kratzenden Geschmack wie Ricinusöl und geht durch salpetrige Säure in die isomere Ricinelaïdinsäure:
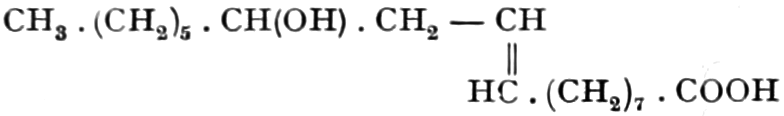
über. Da durch Oxydation der flüssigen Säuren des Ricinusöls mit alkalischem Permanganat zwei isomere Trihydroxystearinsäuren entstehen, so nehmen HAZURA und GRÜSSNER zwei isomere Säuren, Ricinolsäure und Isoricinolsäure, im Öle an. (GRÜN erhielt aus Ricinolsäure mehrere isomere Dioxystearinsäuren). Jedoch zeigte MANGOLD, daß diese Supposition unnötig ist, da bei der Oxydation von Säuren mit doppelten Bindungen zwei stereoisomere Säuren entstehen müssen. SCHEURER-KESTNER fand, daß Wasser von 150° Ricinusöl zerlegt und dabei Ricinolsäure und Diricinolsäure gebildet werden, bei höherer Temperatur werden Tetra- und Penta-Ricinolsäuren erhalten. Ricinolsäure polymerisiert sich also leicht, auch schon allein z. B. bei mehrjährigem Liegen bei gewöhnlicher Temperatur (MEYER). — Die Säure- und Jodzahlen nehmen hierbei ab. — Die Polymeren gehen aber durch alkoholische Kalilauge wieder in Ricinolsäure über. Die aus den sorgfältig gereinigten Salzen abgeschiedene Ricinolsäure wirkt abführend wie das Öl oder stärker wie dieses. Ebenso ist das Glycerid wirksam (MEYER).
H. MEYER hat festgestellt, daß auch synthetisches reines Ricinolsäureglycerid, durch Erhitzen von Ricinolsäure mit Glycerin auf 280–300° im Kohlensäurestrom erhalten (sowie Ricinelaïdinsäure) wie Ricinusöl wirken. Die Ricinelaïdinsäure und das Ricinelaïdin sind aber nur wirksam in Emulsion, nicht in Substanz (Ricinolsäuretriglycerid gibt kein festes Elaïdin). DOTT und STOCKMANNS durch Behandeln mit überhitztem Dampf erhaltene Säuren waren nicht wirksam. Die Säuren waren wohl polymerisiert (H. FINNEMORE und H. DEANE), nach MEYER sind aber auch diese wirksam. Ricinusöl und Ricinolsäure verlieren ihre Wirkung nicht durch Erhitzen auf 300°, auch nicht durch Behandeln mit trockener Salzsäure, wohl aber durch Sättigen mit Brom. Die Ricinolsäure wird durch Behandeln mit Mineralsäuren in die unwirksame Pseudoricinolsäure übergeführt. Die mit Ausschluß von Mineralsäuren dargestellten Alkylester sind wirksam. Aber nur die Ricinolsäureverbindungen führen ab, die im Darmkanal entweder selbst löslich sind (Alkaliseifen) oder durch Spaltung löslich werden (Glycerin- und andere Alkylester), während Ricinolamid und ricinolsaure Magnesia unwirksam sind (H. MEYER).
Die optische Drehung des Ricinusöls (s. oben) beruht auf der ein asymmetrisches Kohlenstoffatom besitzenden Ricinolsäure (DOWZARD). Ricinolsäure liefert oxydiert 2 Trioxystearinsäuren C17H32(OH)3COOH, davon ist eine ätherlöslich (F. 114), eine nicht (F. 137–140). Beim Verschmelzen mit Alkalien liefert Ricinolsäure Methylhexylkarbinol und Sebacinsäure, bei Destillation[S. 639] unter vermindertem Druck Önanthol und Undecylensäure (CH2=CH-(CH2)8COOH), mit alkoholischem Ammoniak Ricinolamid. Bei der trockenen Destillation des Ricinusöls geht Undecylensäure und Önanthaldehyd (Cognacöl) über und in der Retorte bleibt das Glycerid der zweibasischen Triundecylensäure zurück, das bei weiterem Erhitzen in Acrolein, Wasser und Triundecylensäureanhydrid zerfällt (THOMS und FENDLER).
Lit. Ältere Literatur: HUNGERBYHLER, De oleo ricini. Amsterdam 1780. — FUCHS, Trommsd. Journ. 1, 118. — PFAFF, Mat. med. — ROCHLEDER, Pflanzenchemie 1858. — PEREIRA, Elements. — LECANU u. BUSSY, Journ. pharm. 13, 80. — BUSSY, Journ. pharm. 1845. — BOUIS, Ann. chim. 44, 123. — SAALMÜLLER, Lieb. Ann. 1847, 108. — GEIGER, Handb. d. Pharm. II, 1671 (Analyse). — BOUTRON-CHARLARD ET HENRY, Journ. pharm. (2) 10 (1824) 466. — DIERBACH, Geigers Magaz. f. Pharm. 9, 235.
Ferner: KÖNIG, Nahr. u. Genußm. (dort weitere Lit.). — TAYLOR, Journ. of biol. chem. 1906. — OSBORNE, Amer. journ. of physiol. 1903 und 1905 und Journ. amer. chem. soc. 1892 und 1896. — PFEFFER (Aleuron), Jahrb. wissensch. Bot. 1872, 439. — TSCHIRCH und KRITZLER, Ber. d. pharm. Ges. 1900. — KRITZLER, Diss. Bern 1900. — E. SCHULZE, Zeitschr. phys. Chem. 1899 u. Ber. d. chem. Ges. 1897. — SCHULZE u. GODET, Zeitschr. phys. Chem. 1908, 156. — VALLÉE, Journ. pharm. chim. 1903. — GRAM, Landw. Versuchsstat. 1903, 257. — GREEN und JACKSON, Proc. Royal Soc. 1905. — GREEN, ebenda 1890 u. 1891. — Analyse von Stamm, Wurzel und Blatt bei BECK, Amer. journ. ph. 1888.
Ricinin: TUSON, Journ. Chem. Soc. 17 (1864) 195. — WAYNE, Amer. Journ. ph. 46 (1874) 97. — SCHULZE, Ber. d. chem. Ges. 1897, 297. — EVANS, Journ. Amer. Chem. Soc. 22 (1900) 39. — SOAVE, Ann. chim. farm. 21 (1895), 49 (Abs. Chem. Soc. 1896, 386). — WERNER, Pharm. Zeit. f. Rußl. 9 (1870) 33. — MAQUENNE ET PHILIPPE, Compt. rend. 138 (1904), 506, 139 (1904), 840. — DEY, Indigenous drugs of India, p. 273. — SCHULZE und WINTERSTEIN, Zeitschr. phys. Chem. 1904, 211.
Enzyme: CONNSTEIN, HOYER und WARTENBERG, Ber. chem. Ges. 35 (1902). — HOYER, Zeitschr. phys. Chem. 1907, 414 u. Ber. d. chem. Ges. 1904, 1436 (dort d. Lit. d. technischen Fettspaltung durch Ricinuslipase). — FOKIN, Chem. Rev. Fett- u. Harzind. 1904. — BRUSCHI, Att. Accad. Lincei 16 (1907) II, 360. — GREEN, Proc. Royal Soc. 48 (1890), 370. — SIGMUND, Monatsh. 1890, 272. — DELEANO (Keimung) Centralb. f. Bakteriol. 1909, 130. — NICLOUX, Compt. rend. 138, 352, 1175 u. 1288. — LAMY, Bull. chim. farm. 1904, 607. — Lit. der Lipase auch in WEHMER, Pflanzenstoffe und EULER, Enzyme.
Ricin: DIXSON, Australasian Med. Gaz. 6 (1887) 137. — STILLMARK, Arbeit. d. pharmakolog. Inst. Dorpat 3 (1889), 59, Arch. Pharm. 1888, 804. Chem. Centralbl. 1889, II, 978. — CUSHNY, Arch. f. exp. Path. 41 (1898) 439. — OSBORNE and MENDEL, Amer. journ. phys. (Abs. Chem. Soc. 1904, 2, 198). — EHRLICH, Deutsch. Med. Wochenschr. 1891, Fortschr. d. Mediz. 1897. — KOBERT, Vegetabil. Blutagglutinine, Sitzungsb. d. Naturf. Ges. Rostock 1899. — JACOBY, Hofmeist. Beitr. z. chem. Phys. 1 (1902), 51, 2 (1902) 535. — EHRLICH, Deutsch. Med. Wochenschr. 1891. — FR. ASSMANN, Pflüg. Arch. 137, 489 (Chem. Centrbl. 1911, 820). — JACOBI, Mercks Ber. 1901. — MOOSER, Chem. Zeit. 1911, Nr. 77. — BEAUVISAGE, Toxicité des graines de ricin. Paris 1894. — BIERBAUM, Diss. Gießen 1906. — NAGEL, Journ. Soc. Chem. Ind. 1902, 30. — CUSHNY, Über das Ricinusgift. Archiv f. experiment. Pathol. und Pharmakol. XLI. — CRUZ, Etude toxicologique de la ricine. Annales d’Hygiène publique 1898. — CORNEVIN, Atténuation de la toxicité des graines de ricin. Journ. pharm. chim. 1897, 316 u. Ann. agron. 1897. — RIVIÈRE, Le Ricin, Alger 1897. — KOBERT, Giftigk. d. Preßk. Apoth. Zeit. 1900, 840 u. Lehrb. der Intoxikationen (dort d. Lit.). — SCHULTE IM HOFE, Nochmals zur Frage der Giftigkeit der Preßkuchen, welche bei der Herstellung des Ricinusöls erhalten werden. Apoth. Zeit. 1900, 877. — Literaturübersicht über die Phytotoxine bei JACOBY, Biochem. Centralbl. 1903 und BRIEGER in Festschrift f. KOCH 1903.
Öl: KRICH (und BUCHHEIM), Exp. quaed. pharmacolog. de ol. Ricin. Dorpat 1857. — SIKKEL, Dissert. Freiburg 1892. — PECKOLT, Ber. d. pharm. Ges. 1905, 22. — KRAFFT, Ber. d. chem. Ges. 1888, 2730. — HAZURA und GRÜSSNER, Monatsh. f. Chem. 1888, 476. — JUILLARD, Bull. Soc. chim. 1895, 238. — HALLER, Compt. rend. 1907, 144, 462. Chem. Zeit. 1907, 359. — SCHEURER-KESTNER, Compt. rend. 1891, 213, 201. — MEYER, Pharm. Zeitschr. f. Rußl. 30 (1891), 282. — HELL und KITROSKY, Ber. d. chem. Ges. 24, 979. — MANGOLD, Beiträge zur Kenntn. d. Ricinusöl-, Ricinelaidin- und Ricinstearolsäure. Monatshefte 1894, 307.[S. 640] DEERING und REDWOOD (Ind. Öle). Journ. Soc. chem. Ind. 1894, 959. — LIDOFF, Chem. Rev. 1900, 127. — VAN ITALLIE, Chem. Zeit. 1890, 367. — GANTHER und HILL, Ber. d. chem. Ges. 1884, 2212. — BACHMANN, Proc. Minnes. Pharm. Ass. 1907. — BOURDIER, Journ. pharm. chim. 1907, 201. — EVENS SONS, Analyt. Notes 1907. — LIEBREICH (kaukas. Öl), Ther. Monatsh. 1906, 444. — LEWKOWITSCH a. a. O. — BENEDICT-ULZER a. a. O. — URBAIN, Les corps gras 1906.
Ricinolsäure: CLAUS, Ber. d. chem. Ges. 1876, 1, 916. — JUILLARD, Bull. Soc. chim. 13 (1895) 240. — BEHREND, Ber. d. chem. Ges. 28, 2248 u. 29, 706. — KRAFFT, ebenda 10, 2034; 11, 1444 u. 2218; 12, 1668; 15, 1691; 17, 2985; 21 (1888), 2730. — GOLDSOBEL, ebenda 27 (1894) 3, 121. — HAZURA und GRÜSSNER, Monatsh. f. Chem. 9 (1888), 475. — DIEFF, Journ. pr. Chem. 39 (1899), 339. — MANGOLD, Monatsh. f. Chem. 13 (1892), 326. — SCHEURER-KESTNER, Compt. rend. 113 (1891), 201. — HANS MEYER, Arch. Pharm. 235 (1897), 184 u. Arch. exper. Pharm. 28 (1891), 145 u. 38 (1897), 336. — DOTT and STOCKMANN, Pharm. Journ. 1892, 22, 745. — WOLDENBERG, Über d. Schwefelsäureester d. Ricinolsäure. Diss. Zürich 1908 (dort die Liter.). — WETTERKAMP, Derivate d. Ricinols. Diss. Zürich 1909 (dort d. Lit.). — BUSSY und LECANU, Journ. pharm. (3) 13, 57. — DOWZARD, Pharm. Journ. 1900. — PETER, Chem. Zeit. 1887. — H. FINNEMOORE and H. DEANE, Brit. Ph. Conf. Year Book 1905 u. Pharm. Journ. (4) 21, 137. — GRÜN, Ber. d. chem. Ges. 1906, 4400 u. Habilitationsschr. — THOMS und FENDLER, Arch. Pharm. 1900, 690 u. 1901, 1.
Verfälschung. Trübes, nicht mit Wasser gekochtes Öl ist als Arzneimittel immer zu verwerfen, da etwa beigemengtes Ricin oder Fragmente der Samenkerne wegen ihres Ricingehaltes das Öl giftig machen können. Als Verfälschungen werden genannt Sesamöl, Leinöl, Rüböl, Harzöl, Cocosöl, Cottonöl und geblasene Öle, die alle die oben (S. 636) angegebenen Konstanten verändern. Als Verfälschung wird auch gebleichtes Sesamöl angegeben. EVENS SONS fanden Mineralöl und Leard oil. Über den Nachweis von Crotonöl im Ricinusöl vgl. MAZUCHELLI, Rep. pharm. 1905, 361.
3 ccm Ol. ric., 3 ccm Chloroform (oder CS2) und 1 ccm Schwefelsäure durcheinander geschüttelt sollen rotbraun, aber nicht schwarzbraun werden (heißgepreßtes Öl, fremde Öle). Wenn 10 Teile Ol. ric. mit je 5 Teilen Weingeist und Natronlauge unter Erwärmen verseift werden, so darf kein Geruch nach «Butteräther» (d. h. Caprin-Capryl-Capronsäure-Äthylester) auftreten (Cocosfett).
Anwendung. Ricinusöl zeigt die allen fetten Ölen zukommende abführende Wirkung in verstärktem Maße und wird denn auch seit den ältesten Zeiten (Vorschrift im Papyrus EBERS, um 1500 n. Chr.) als mildes Abführmittel benutzt. Ebenso alt ist die Anwendung als Haarwuchsmittel (s. Geschichte), neu die Benutzung zur Darstellung des Collodium elasticum. Die Ägypter bereiteten u. a. aus Ricinusöl eine Salbe um die Haut geschmeidig zu erhalten (HERODOT). Auch STRABO (XVII, 2 § 5) kennt diese Verwertung des Öls. In Italien ist Ricinusöl Nationalheilmittel: «Purga il sangue e rinfresca», sagt von ihm der Italiener. Die Frühjahrskuren mit täglich einem halben Glas Ricinusöl durch mehrere Tage sind dort außerordentlich beliebt. In China dient frisches Ricinusöl bisweilen als Speiseöl! (SCHÄDLER). Aber 90% des Öls verbraucht die Industrie in der Woll- und Baumwollappretur, zur Herstellung des Türkischrotöls (s. oben), in der Türkischrotfärberei, in der Leder-, Seifen- und Schmierölindustrie, zum Denaturieren des Spiritus. Sehr viel verbraucht Indien als Lampenöl und Schmieröl (besonders für Eisenbahnwagen). Das Öl wird z. B. in Bengalen und Chorassan (AITCHISON) ganz allgemein als Brennöl benutzt. Es eignet sich zum Lampenöl sehr gut, denn es übertrifft an Leuchtkraft alle anderen Öle («no other oil can vie with this light, it being almost electrical in its brilliancy», sagt WATT, Dict. econ. pr. India). Auch das meiste javanische Öl wird für technische Zwecke verwendet, doch fabrizierte 1894 eine Ölfabrik in Kediri auch Medizinalöl. Das geringere Öl und die Preßrückstände dienen zur Gasgewinnung und zu Feuerungszwecken. Die Preßkuchen werden auch zu Düngezwecken verwendet, nachdem sie noch von den Ölresten durch Extraktion befreit wurden. Der Preßkuchen, der 4,8% N, 1,6% Phosphorsäure und 1,2% Kali enthält, dient in Südeuropa als Düngemittel der Weinberge, in Amerika als solches der Mais- und Hanf-, in Java der Zuckerrohr-, in Bengalen der Kartoffel-, Betel- und Getreidefelder. Die Marseiller Preßkuchen gehen ausschließlich nach Pertuis und Cavaillon und werden dort zur[S. 641] Düngung der Primeurs und Kartoffeln benutzt. Er ist auch ein gutes Ratten- und Mäusegift, so daß man zwei Fliegen mit einer Klappe schlägt, wenn man damit die Felder düngt. In Indien dienen angeblich die wegen des Ricin giftigen Preßrückstände bzw. ihr Dekokt als Viehfutter. SCHULTE IM HOFE bestreitet dies und glaubt, daß sie nur in kleinen Dosen als Lactagogum gegeben werden. In Rußland müssen die Preßkuchen unschädlich gemacht werden. Es geschieht dies durch trockene Destillation, wobei Gas gewonnen wird, und durch Verfeuern. KOBERT schlägt den Erlaß eines solchen Gesetzes auch für Indien und Italien vor.
Als Geschmackskorrigens des Öls wird in Europa Pfefferminzessenz und Kaffee, in Indien Ingwerdekokt benutzt. Man gibt das Öl mit einem angewärmten Löffel oder in warmem Kaffee oder anderen Flüssigkeiten — auch in Brausemischungen, als Emulsion, als Gallerte, in Gelatinekapseln. Festes Ricinusöl läßt sich mit Casein und Laktose (WINTERNITZ) oder Gummi und Magnesia (WASSERZUG) herstellen. Unter dem Namen «lösliches Ricinusöl» (soluble castor oil) versteht man aber ein geblasenes, halbtrocknendes, vegetabilisches Öl (blown oil), das durch das Einblasen von Luft dem Ricinusöl ähnlich geworden ist. Die oft behauptete Wirkung von Ricinusöl bei Rheumatismus sollte näher erforscht werden. In Indien wird Same und Wurzel als Antirheumaticum seit langem benutzt, auch ein indischer Name der Pflanze (s. oben S. 625) besagt dies. Wie Ricinusöl wirkt auch das Öl des Tamborbaumes (Omphalea oleifera und cardiophylla) aus Sonsonate (Salvador). Auch die Samen anderer Omphaleaarten purgieren (HEMSLEY). Die Blätter von R. gelten in Europa und Amerika (im Gegensatz zu Indien!) als Lactagogum. Die Blätter werden in Indien äußerlich und innerlich auch als Emenagogum benutzt. Die Fasern der Stengel sind zur Papierfabrikation zu gebrauchen. In Assam werden die Erie-Seidenraupen (Bombyx Cynthia, Attacus Ricini BOISD.) auf Ricinus gezüchtet. Nach einem Bericht des britischen Konsuls in Maracaibo wird die Ricinuspflanze in Südamerika in verschiedenen Gegenden als Mittel gegen die Moskitoplage mit Erfolg um die Häuser angepflanzt. Die eigenen Erfahrungen des Konsuls bestätigten die Zweckmäßigkeit des Mittels.
Lit. HEMSLEY, Pharm. Journ. (3) 1882, 301. — WINTERNITZ, Pharm. Zeit. 1907, 363. — WASSERZUG, Pharm. Era 1907, 470. — ANONYM, (Die Ricinuspflanze gegen die Moskitos). Advance Sheets of Consular Report. Durch Deutsches Kolonialblatt, 1901, 160.
Geschichte. Ricinusöl war bereits den Sumerern bekannt. Ricinus (kiki = R. comm. oder R. africanus) wurde im alten Ägypten ganz allgemein angebaut. Es berichten darüber die alten Schriftsteller (PLINIUS z. B. sagt, der kikus wächst in Ägypten sehr häufig, HERODOT berichtet von Kulturen der Silicyprien an Fluß- und Seeufern). Auch heutzutage wird Ricinus noch in Ägypten kultiviert. Wir finden die Pflanze dargestellt auf Monumenten (z. B. dem Gartenplane von Tell-el-Amarna, vgl. I, Fig. 366) und ihre Samen sind oft und gut erhalten in Gräbern (schon c. 4000 n. Chr. CAILLAUD) gefunden worden (UNGER, WÖNIG). Im Papyrus EBERS finden sich in vielen Rezepten die Samen (Früchte), das Mark, die Wurzelrinde und die Blätter der Pflanze und (eingeschoben in den Text) eine Angabe über die Verwendung des Ricinus, der Samen als Purgans und Haarwuchsmittel, des Öls als Salbe für riechende Geschwüre. Das kikajon, kykwyn des alten Testaments, das in einer Nacht zum Schutze des Propheten JONA emporwuchs, wurde mit Gurke oder Epheu, dann auch mit Ricinus übersetzt. TRISTRAM und NIEBUHR halten jedoch daran fest, daß kikajon die Gurke (= el kerra, in Palästina: kurah) und nicht Ricinus (= el keroa, in Palästina: khurwah) sei. Das κρότων des THEOPHRAST ist nach FRAAS R. commun., nach Sprengel R. africanus. Nach HERODOT (II, 94) wurden die Samen entweder zerstampft und gepreßt oder gebraten und ausgekocht und das Öl abgehoben. Die Bereitung des Öls schildert auch PLINIUS. Der Same wurde mit Wasser gekocht und das Öl abgeschöpft oder (in Ägypten) eingesalzen und dann ausgepreßt. DIOSKURIDES erwähnt in Ägypten nur das Auspressen der gemahlenen Samen in Flechtkörben. DIOSKURIDES beschreibt die Darstellung des κίκινον ἔλαιον. Die in der Sonne getrockneten, von der Schale befreiten Früchte werden in einem Mörser zerstoßen, in einem Kessel mit Wasser ausgekocht und das Öl mit einer Muschel abgeschöpft. DIOSKURIDES erwähnt neben äußerlichen Anwendungen und zur Pflasterbereitung die wurmtreibende und brechenerregende Wirkung des Öls und daß es unangenehm purgiere. Die Hippokratiker scheinen die Abführwirkung nicht gekannt zu haben, wohl aber GALEN. Das Öl wurde im Altertum, wie es scheint, vorwiegend zum Brennen benutzt, z. B. in Ägypten. STRABO erwähnt (XVII, c. 2 § 5) seine Verwendung auch zum Salben bei ärmeren Leuten. Einige beziehen den Ricinus des PLINIUS und STRABO auf Ricinus africanus WILLD. Die Wurzel, die Blätter und das Öl wurden von den Indern, die[S. 642] die Pflanze Jahrhunderte vor Christi Geburt kannten, schon frühzeitig als Purgans-, Rheumatismus- und Augenmittel und bei Frauenleiden in der Lactationsperiode benutzt. SUŚRUTAS erwähnt das Öl und die frische Pflanze (Pharmac. ind.). In den indischen Sprichwörtern ist die Pflanze ein Symbol der Zerbrechlichkeit (auch kirwa bezeichnet eine zarte Pflanze). Die Araber lernten die Pflanze wohl in Indien kennen. Sie nannten die Samen daher simsim-el-hindi (= indischer Sesam) und bedienten sich der Samen besonders innerlich, der Blätter äußerlich. In den Pflanzenglossaren ist Ricinus selten (eine Angabe bei FISCHER-BENZON). Bei ALBERTUS MAGNUS und MEGENBERG findet er sich (s. oben). Er wurde also schon damals in Europa kultiviert. Das Mittelalter scheint das Öl nur äußerlich verwendet zu haben. TURNER (Herbal 1568) erwähnt R. als eine Gartenpflanze Englands und das Öl als Oleum cicinum s. ricininum. GERARDE (I, S. 909) nennt das Öl auch Oleum de cherua. Dann wurde das Öl vergessen. Es fehlt bei DALE (1693) und war auch zur Zeit von HILL, LEWIS (I, S. 949) fast unbekannt. Durch die Dissertation des in Westindien lebenden PETER CANVANE, On Ol. palmae Christi 1764 (in 2. Aufl. 1769; auch französ.) wurde die Aufmerksamkeit wieder auf das Öl als ein mildes Purgans gelenkt und die Samen wurden in die Londoner Pharmakopoee 1788 aufgenommen. WOODVILLE sagt 1790 in seiner Med. Bot., daß das Öl neuerdings öfter gebraucht werde. Damals kam der Same und das Öl aus Jamaica. 1799 exportierte Jamaica 236 casks Öl und 10 casks Samen. Später trat dann das ostindische Öl auf und die Einfuhr stieg nun rasch. 1820 kamen schon für 7102 £ Öl von dorther nach London (Pharmacographia). HEYER schlug (CRELLS, Neuest. Entdeckungen 1781) vor, Ricinus comm. im Apothekergarten zu ziehen, die Samen selbst zu ernten und das Öl selbst zu pressen. Kultiviert und verwildert war Ricinus, der sich überall leicht ansiedelt, schon zu RHEEDES Zeit in Malabar, zu RUMPHIUS Zeit auf Java und Amboina, ebenso später in Japan und China. Nach Amerika wurde R. sehr frühzeitig kurz nach der Entdeckung gebracht. PISO nennt schon einheimische brasilianische Namen: nhambu-guacu (figuero inferno der Portugiesen).
Lit. WÖNIG, Pflanz. d. alt. Ägypt. — JOACHIM, Papyrus Ebers. — DE CANDOLLE, L’origine d. plant. cult. — FLÜCKIGER-HANBURY, Pharmacographia. — Pharmacographia indica. — TRISTRAM, Nat. hist. of the bible.
Zur Ricinusölgruppe gehört nur noch das ähnlich sich verhaltende Traubenkernöl.
II. Animalische Öle.
1. Öle von Seetieren.
Die Öle der Seetiere unterscheiden sich in vielen Punkten von denen der Landtiere, z. B. durch hohe Jodzahlen, — sie enthalten viel ungesättigte Fettsäuren — durch die große Menge Hexabromid, die sie liefern, durch ihre Fähigkeit Sauerstoff zu absorbieren und die Eigenschaft bei der Elaidinprobe kein Elaidin zu liefern. Sie ähneln also den trocknenden vegetabilischen Ölen. Mit der Gruppe der Öle von Landtieren sind sie durch Übergänge verbunden (LEWKOWITSCH).
a) Fischöle.
Die Fischöle werden aus allen Körperteilen der gewöhnlicheren Fische (Hering, Sardinen, Lachs, Sprotte usw.) durch Auskochen erhalten. Der Dorsch dagegen enthält nur in der Leber, nicht im Fleisch beträchtlichere Mengen Öl. Zu dieser Gruppe gehören nur Öle, die nicht oder kaum medizinische Anwendung finden, wie das Menhadenöl von Alosa Menhaden (Brevoortia tyrannus), das Sardinen- oder Japanische Fischöl von Clupea sardinus und das Lachsöl (huile de saumon) von Salmo salar. Ferner das Stichlingsöl (Stichlingstran) von Gasterosterus trachurus, das Heringsöl von Clupea harengus, das Störöl von Acipenser Sturio, das Sprottenöl von Clupea sprattus, das Karpfenöl von Cyprinus carpio u. and. (Konstanten bei LEWKOWITSCH. Näheres über diese Öle bei BENEDIKT-ULZER.)
Die Fischöle enthalten, wenn rein, keine Gallenstoffe (Cholesterin, Lipochrome). Sie geben daher nicht die charakteristischen Reaktionen der Leberöle (siehe unter Ol. jecoris).
[S. 643]
b) Leberöle.
Die Leberöle (fälschlich auch Trane genannt) sind durch eine beträchtliche Menge von Cholesterin sowie durch Lipochrome und andere Gallenstoffe ausgezeichnet. Sie geben daher in Schwefelkohlenstoff gelöst mit konz. Schwefelsäure eine blaue, wenn ranzig eine purpurne Färbung (LEWKOWITSCH, TICHOMIROW, KAISER). Werden in Chloroform gelöste Leberöle mit Phosphormolybdänsäurelösung durchgeschüttelt, so entsteht nach der Scheidung an der Berührungsstelle ein blauer Ring.
Oleum Jecoris Morrhuae.
Syn. Oleum jecoris Aselli, Ol. jec. Gadi, Ol. morrhuae (so z. B. in U.S. Pharm.). Lebertran, Dorsch-, Kabliau-, Stockfisch-Lebertran, Dorschleberöl, Kabeljauleberöl — huile de foie de morue (franz.) — Codliver oil, Coal- oder dogfish oil (engl.) — Olio di fegato di merluzzo (ital.) — levertraan (hol.) — csukamáj olaj (ung.) — ἔλαιον ἥπατος ονίσκον (gr.).
Etym. Der früher allgemein (auch jetzt noch vom D. A. V.) benutzte, wie es scheint, zuerst bei SCHERER auftretende Name Ol. jec. Aselli ist nach dem alten, schon seit über 100 Jahren verlassenen Namen des Dorsches, Asellus major, gebildet. Die Worte Asellus und Callarias schon bei PLINIUS. (Asellus = Eselchen, wegen der eselsgrauen Farbe des Tieres.) Die in Pharm. helv. IV gewählte Bezeichnung Ol. jecoris ist nicht glücklich, da es auch andere Leberöle gibt und nur das Dorschleberöl benutzt werden soll. Die beste Bezeichnung scheint mir Ol. jecoris Morrhuae zu sein, da es auch andere Aselli und andere Gadi gibt. — Tran erst im nhd. (Stellen bei KLUGE), ndl. traan, dän. schwed. tran. Heimat und Grundbedeutung unbekannt. — Dorsch (nhd., — anord. porskr, dän. torsk.) ist wohl aus torsk umgebildet. — Klippfisch hat mit Klippe (= Fels) nichts zu tun, sondern ist korrumpiert aus klapfisk, d. h. aufgeschnittener Fisch, von klappet = aufgespalten. — In einem Tractatus de piscibus (Handschr. aus dem XIII. Jahrh.) wird von einem Fische berichtet: «genus piscis a nostris mo(r)rude ab ore, quia mourre vocant os cum prominentibus labris» (vgl. SCHELENZ, Pharm. Centralh. 1906, 166) und in einer Handschrift aus dem Jahre 1309 heißt es: «Item grossa bestia onerata ... piscibus alecibus, Morua et similibus, debet pro pedagio octo denarios» (DU CANGE). Hier läßt sich also der Übergang von morrude in mourre und morua (aus dem dann morue, der heutige Name des Dorsch in Frankreich wurde) direkt verfolgen. Woraus aber morrude entstand, ist unklar (ob aus merluc? maris lucidus = Seehecht?). — Cod (zuerst 1357 in Act. 31 Edw. III Stat. 3. «Les trois sortz de lob, lyng et cod» MURRAY) kaum zu γάδος, eher zu kodde, kudse zu ziehen.
Herkunft. Der Lebertran ist das Öl der Lebern in erster Linie von:
Gadus morrhua L. (incl. G. callarias, ruber und ogat, Morrhua vulgaris und callarias, Asellus major und varius), dem Kabeljau oder Dorsch (Dösch, Pomuchel, Pamuchel; port.: bacalão, norw. skrei oder torsk, franz.: morue, cabeliau, ital. baccalare, engl. und amer.: cod) (Fig. 197), eines zu der durch drei Rücken-und zwei Afterflossen, die bestimmt von der letzten Rücken- und zweiten Afterflosse geschiedene Schwanzflosse und einen Bartfaden an der Spitze der Unterkinnlade gekennzeichneten Gattung der Schellfische (Gadus) — Pisces, Anacanthini, Gadoidei (oder Teleosteae Malacopterygiae) — gehörenden Fisches von 0,75–1,5 m Länge und bis 20, ja 42 kg Schwere, der auf grauem Grunde mit kleinen gelblichen Flecken getüpfelt, längs der Seitenlinie weiß gestreift und auf dem lichten Bauche ungefleckt ist (Farbe und Flecke wechseln).
Der Fisch bewohnt den nördlichen Teil des atlantischen Meeres und die angrenzenden Gebiete des Eismeeres und zwar vorzugsweise die unteren Wasserschichten bis c. 120 Faden Tiefe (GÜNTHER) und kommt nur zur Eiablage an seichtere Stellen[S. 644] (25–50 Faden). Er kommt in ungeheuren Massen zwischen dem 50. und 75. Grade n. B. vor und überschreitet nach Süden meist nicht den 40. Grad n. B. Er ist einer der fruchtbarsten Fische. Ein Fisch enthält meist 1¼, bisweilen 4 (BRAYDLEY) oder gar 9⅓ Mill. (LEEUWENHOEK) Eier und ist im fünften Jahre fortpflanzungsfähig. Auf der östlichen Seite des Verbreitungsgebietes fällt die Laichzeit in den März, auf der westlichen, amerikanischen, Seite in den Mai und Juni. Zu dieser Zeit erscheint der Fisch in riesigen Scharen, «in Bergen», wie die Norweger sagen, d. h. in dicht gedrängten, meilenlangen, oft mehrere Meter hohen Heeren an den Küsten und Sandbänken und wird hier entweder in Netzen (Norwegen) — Nöter-, Senk-, Zieh-, Sperrnetze, Garne — oder mit der Handangel (Tiefseeangel) oder der c. 2000 m langen, meist mit 1200 bis 3600 Angelschnüren besetzten Grundschnur (an den übrigen Plätzen) leicht in großen Massen gefangen. Als Köder dienen Fische (z. B. Heringe und Lodden) oder Muscheln.

1 Schellfisch (Gadus aeglefinus), 2 Wittling (G. merlangus), 3 Dorsch (G. callarias), 4 Kabeljau (C. morrhua).
[Aus Brehms Tierleben.]


Die Flotille der Dampf-, Motor- und Segelboote der Dorschfischer bei Bolstad (Lofoten).
[Wilse phot.]
Die meisten Boote (c. mit 14500 Fischern) fischen mit Langleine, die zahlreiche, an seitlichen, vier Fuß voneinander entfernten Leinen befestigte Angelhaken besitzt. Oft wird ein solcher stamp an den anderen befestigt, so daß meilenlange Langleinen entstehen. Jeder Ottring ist mit 3–5 Fischern bemannt. Neuerdings wird aber mit Langleine auch von großen, gedeckten Segel-, Motor- oder Dampfbooten aus gefischt, die nach amerikanischem Muster 3 bis 5 Jollen, dories, d. h. offene Boote mit flachem Boden für 2 Mann mitführen, mittels welcher die Leinen gesetzt und wieder gehoben werden (BULL). Viele Boote (mit c. 12500 Fischern) fischen auch mit Netzen, deren Maschen drei Zoll weit sind und die ebenfalls aneinander gebunden werden. Diese Boote heißen Femböring. Aber neuerdings wird nicht nur von großen und kleinen offenen Booten, sondern auch von gedeckten Fahrzeugen (Motor- und Dampfbooten) mit Netzen gefischt. Nur die kleinen, mit 2–3 Mann bemannten, Boote fischen mit Handleine. Sie bilden die Minderzahl (c. 2300 Fischer). Allein, wenn in Finmarken die Fischerei sehr reich ist, dann nehmen alle Arten von Booten daran teil. Die im Netz gefangenen Fische sind meist größer (12 Pfund mit Lebern von 11¼ Unze), die mit der Leine gefangenen sind kleiner (10 Pfund mit Lebern von 9½ Unze). Die Avantgarde erscheint im Vestfjord in der ersten Woche des Januar, die Hauptfangzeit ist der März. Gegen Mitte März beginnt die Laichzeit, dann geht der Fisch nicht an den Köder und die See trübt sich durch die riesigen Mengen der Eier und Samen der «Hochzeitzüge» der Dorsche. Der Fisch erscheint entweder in dünnen Bändern oder in ganz kompakten Massen, bald ganz oben, bald tief, bald in der Nähe des Landes, bald weit davon entfernt, bald bei den Westlofoten, bald bei den Ostlofoten. Sobald die Fische aus dem Netz genommen sind, wird es wieder ausgeworfen. Ein Netzboot fängt täglich c. 300–400 (bis 800), ein Leinenboot c. 200 (bis 400) Fische. Der Fisch wird durch einen Einschnitt hinter den Kiemen getötet, dann geöffnet, Leber und Rogen in verschiedene Behälter getan, der Rest der Eingeweide ins Meer geworfen und der Fisch selbst nach Entfernung des Kopfes an Land verkauft. Für Ordnung sorgt eine königliche Aufsichtsbehörde, ein Inspektorgeneral mit c. 50 Beamten (Gesetz vom Jahre 1857). Sie kontrolliert die Fangplätze, gibt das Signal zur Ausfahrt, verteilt die Plätze und sammelt das statistische Material. Der Fisch liebt eine Seewärme von c. 4–6° C (DAMAS). Ihr geht er nach. Der Wechsel in der Temperatur der Meereswasserschichten kommt dadurch zu stande, daß der Golfstrom mit dem Polarstrom hier zusammenstößt (s. d. Karte).
[S. 646]

Das Öffnen der Dorsche und Beseitigen der Köpfe an Land auf Röst (Lofoten).
[Wilse phot.]

Ein norwegischer Fischer mit einem besonders großen Dorsch.
[Nach einer Photographie von Scott & Bowne.]
Diese regelmäßigen Wanderzüge des Fisches, die sich sowohl gegen die norwegische Küste (Lofoten und Finmarken), die südlicheren Gebiete der Nordsee (Doggerbank) und die schottische Küste (Newhaven) wie auch gegen die Küsten Neufundlands richten, hängen allerdings zunächst mit der Laichzeit zusammen (bei den Lofoten laichen die Dorsche auf der Nordwest- und Südostbank, s. d. Karte) sind aber auch als Raubzüge zu betrachten, da die gefräßigen Dorsche ihrem Nahrungstriebe folgend, den Zügen des Herings und der Lodde folgen, die eben jene Gegenden zu dieser Zeit aufsuchen. Bei den Lofoten dauert der Fang meist vom Januar bis etwa 12. oder 24. April. Hier ist im März die Laichzeit. Der Schluß des Fanges ist meist Ende April. In Finmarken (70° n. B.) dauert der Fang in der Regel von November bis Ende März (Winterskrei oder Winter-Kabeljau) und von März bis etwa 24. Juni (Frühjahrs- oder Lodde-Fisch). Bei Bergen und Aalesund in Romsdalen (63° n. B.) erscheint der Fisch im Januar und Februar. Bedeutend ist der Dorschfang auch außerhalb der großen Inseln Senjen und Kvalö (westlich und südwestlich von Tromsö). Hier liegen die «Banken» (Laich-Bänke) viel weiter vom Lande entfernt und tun hier die oben erwähnten größeren modernen, zweimastigen Motorboote, die überhaupt jetzt mehr und mehr die «Nordlandsboote» (Femböring und Ottring) verdrängen, ausgezeichneten Dienst. Der Fang dauert hier besonders von Januar bis März (SVENDSEN).[S. 647] Stürmisches Wetter verzögert oft den Anfang der Fischerei und zwingt zu frühzeitigem Schluß. In schlechten kalten Jahren (z. B. 1902 u. 1903), in denen der Fisch südlichere Gegenden (z. B. England) aufsucht (1902 wurden dort doppelt so viel gefangen als 1901!) wird der Fang erst im Mai oder Juni, ja bisweilen erst Anfang Juli beendet.

[Wilse phot.]
In der Umgebung von Neufundland, wo auch die Franzosen noch alte Fischereirechte besitzen, wird besonders auf der sog. Bank von Neufundland und den französischen Besitzungen bei St. Pierre und Miquelon der Dorsch vom 15. April bis Ende September gefangen. Er ist hier im September am fettesten. Den Fang (mit der ligne à la main, ligne de fonds, senne, faulx) schildert ROUSSET (a. a. O.). In Island (Reykiavik, Patrixfjord, Dyrefjord, Faskrudfjord) dauert der Fang in zwei Saisons und an verschiedenen Stellen vom Februar bis August.

Hafen von Mehavn (Finmarken) mit Segel-, Dampf- und Motorbooten. Im Vordergrunde die großen Behälter, in denen die Lebern aufgesammelt werden behufs Bereitung von natürlichem Dorschleberöl.
[Bull phot.]
Der frische Fisch heißt Kabeljau (Cod), der frische der kleinen Varietät Dorsch, der Schellfisch Kaddock, der an Stangengerüsten getrocknete Stockfisch, der aufgeschnitten mit Salz bestreute und getrocknete Klippfisch, der in Fässern eingesalzene Laberdan.
Herr H. BULL, Direktor der Fiskeriforsøkstationen i Bergen berichtet mir ferner: «Von anderen Fischen, deren Leber in Norwegen für die Bereitung von Leberölen verwendet werden, muß in erster Linie der Sej, Gadus virens, dann die Brosme (Brosmius brosme), die Länge (Molva vulgaris), der Schellfisch (Gadus aeglefinus) und der Eishai (Laemargus microcephalus) genannt werden. Der Sej entstammt der Küstenfischerei, gibt ein sehr schönes Dampföl, das aber beim Abkühlen viel Stearin abscheidet; auch das kalt geklärte Öl enthält viel (etwa 15%)[S. 648] feste Fettsäuren und ist dadurch gekennzeichnet; dasselbe wird vielfach mit dem reinen Dorschleberöl vermischt und die Mischung als solches verkauft. Die Brosme sowie die Länge entstammen der Hochseefischerei (an den Abhängen der Hochplateaus im Meere), kommen daher nicht frisch ans Land, und das aus denselben durch Fäulnis bereitete Öl dürfte wohl nur für technische Zwecke verwendet werden. Dasselbe gilt vom Schellfischöl, weil demselben, auch dem Dampföl, ein unangenehmer Geruch anhaftet. Das Eishaileberöl (Dampföl) ist zwar schön, aber, weil vorwiegend eine Wachsart enthaltend, medizinisch nicht verwendbar.»
Neuerdings werden auch von deutschen Hochseefischern sowohl in der Nordsee als auch in der Ostsee außer dem Kabeljau auch die Lebern einiger anderer verwandter Fische auf technischen und Medizinaltran verarbeitet, nämlich die des kleineren, gestreckteren Schellfisches, Gadus aeglefinus L. (Morrhua aeglefinus und punctatus, Asellus minor, Egrefin), der im Februar und März zur Laichzeit in großen Scharen an der friesischen Küste erscheint und die des in der Ostsee vorkommenden sog. gewöhnlichen Dorsches, einer kleineren Varietät von Gadus morrhua, die LINNÉ als eigene Art, G. callarias L., abtrennte, die aber oben mit zur Art G. morrhua gezogen wurde (nicht ein Jugendzustand, wie man früher annahm). Das D. A. V. läßt auch die Leberöle dieser beiden Fische zu; Ph. austr. VIII auch die anderer Gadusarten.
Auf der Doggerbank in der Nordsee dauert der Fang vom Dezember bis Mai. Die deutsche Dampftranproduktion erhält aber ihr Rohmaterial besonders durch Schiffe der deutschen Hochseedampferflotte aus den Gegenden Islands.
Die medizinisch nicht zu verwendende Handelsmarke Coast Cod oil wird aus den Lebern des Meer- oder Seehecht, Kümmel- oder Hechtdorsch, Merluccius vulgaris (Gadus merluccius), des Leng, Molva vulgaris (Gadus molva, Lota molva, Asellus longus), des Sejfisch, Wittling oder Weißling, Gadus merlangus (Merlangus vulgaris, Fig. 197), des Köhler, Gadus virens (Merlangus virens s. carbonarius, in dorscharmen Jahren auch sonst zur Lebertrangewinnung herangezogen H. MEYER), des Schellfisch (s. oben) und des Eishai oder Haakjerring (Laemargus oder Seymnus borealis und brevipinna) dargestellt. Französische Fischer (von Boulogne und Graveline) fangen in der Nordsee besonders den Leng (Elingue). Haifischleberöl wird in Island, Norwegen und Californien gewonnen.
Leberöle werden auch noch dargestellt außer von der Brosme, dem Lub oder Torsk (Brosmius brosme), der an den Küsten Norwegens, bei den Faröer Inseln und Island häufig ist, von dem Meerengel (Rhina squatina, Squatina vulg.), dem Thunfisch (Thynnus vulg.), dem Dorn- oder Nadelrochen (Raja clavata) und Glattrochen, Tepel, Tegel, Fleten (Raja batis).
Lit. Abbild. u. Beschreibung: BRANDT-RATZEBURG, Mediz. Zoologie 1833, t. IX. — MARTINY, Naturgesch. d. f. d. Heilk. wicht. Tiere 1854, t. XI. — GUIBOURT, Hist. nat. d. drog. simpl. VII. Aufl. — BREHM, Tierleben. — BEAUREGARD, Mat. méd. zoolog. 1901, Fig. 72.
Gewinnung. Die Gewinnung des Lebertrans erfolgt an der norwegischen Küste, besonders bei den Lofoten, einer felsigen Inselgruppe unter 67–69° n. B., in dem Vestfjord zwischen diesem und dem Festlande (vgl. die Karte), wo die ersten Züge der Fische schon Ende Dezember, die Hauptmassen aber erst von Mitte Januar an, besonders aber im Februar-April erscheinen. Meist dringen sie zwischen den Inseln am südwestlichen Ende der Gruppe (Moskenaes und Vaerö, Flakstadö, Röst und Ost- und West-Vaagö) in den Fjord ein und verteilen sich in diesem, in der Tiefrinne (s. d. Karte) nach Norden geführt, an den Laichstellen, «Banken». Dann wird Dorschfang und Trangewinnung auch an anderen Küstenpunkten Norwegens, wie z. B. in Romsdalen, im Throndhjemer Fjord, bei Aalesund und im nördlichen Finmarken betrieben — Finmarken liefert jetzt viel Öl — sowie an den Küsten Islands, den Faröer-, Shetland- und Orknay-Inseln. Endlich wird auch bei Neufundland, Neuengland, Neuschottland und in der Nordsee «Tran geschmolzen» (die Geestemünder senden schon 200 Schiffe auf den Fang), weniger in der Ostsee.
Die hauptsächlichsten Dorschfangorte der norwegischen Küste.
[Mit Benutzung der Karten von Peckel Möller, gez. von A. Tschirch.]
In Finmarken gebräuchlicher Apparat zur Dampftranbereitung.
A Konischer Behälter aus Holz, B Deckel, C Dampfrohr, D, E Ablaßhähne.
[Bull gez.]
Auf den Lofoten gebräuchlicher Apparat zur Dampftranbereitung.
A Schmelzkessel, B Wasserbad, D, F, G Feuerung.
[Bull gez.]
Die Fabrikation erfolgt in den norwegischen Gewässern meist in Fabriken an Land, seit die Segler zum Teil durch Dampfboote ersetzt wurden, also der Fang, der übrigens meist in der Nähe der Küste erfolgt, rasch an Land gebracht werden kann. Das Gewicht[S. 649] einer Leber beträgt im Durchschnitt ½ Pfund. Die größten beobachteten Lebern wogen gegen 11 Pfund. Die Farbe guter Lebern ist sahnenartig, die Konsistenz weich. Magere Lebern sind zäh und rötlich, kranke fleckig und grünlich. Es wechselt dies nach den Jahren («auf 7 fette folgen 7 magere Jahre», sagt der Fischer). In den norwegischen Gewässern wird möglichst bald, nachdem der Dorsch gefangen ist, die große, sehr fettreiche Leber herausgeschnitten, die Gallenblase und event. kranke Teile abgetrennt, die Leber gewaschen und nun entweder zerschnitten und unter gelindem Drucke ausgepreßt (Pharm. helv. IV «das durch gelinden Druck ausfließende Öl») oder in großen[S. 650] Kesseln durch Einleiten von Dampf rasch aufgekocht bzw. durch Heizen der schmalen, hölzernen, doppelwandigen Kessel mit Dampf von außen auf 60–70° (nicht über 80°, Pharm. nederl.) erhitzt oder endlich in einen 200–300 l fassenden Kessel von Weißblech oder verzinntem Eisen gebracht und dieser auf ein direkt oder durch Dampf geheiztes Wasserbad gesetzt. — Die Wasserbadmethode (Fig. 204), die die älteste und die zeitraubendste ist, aber die höchste Ausbeute und die beste Qualität Öl liefert, wird besonders auf den Lofoten und südlich, die Dampfmethode (Fig. 203) in Finmarken geübt. — Diese Methoden werden an Land benutzt (1898 gab es 120 Dampfapparate). Zum Gebrauche auf den Schiffen bedient man sich abgestumpft-konischer hölzerner Gefäße, in die man, nachdem die Lebern eingebracht sind, überhitzten Dampf leitet (1898 gab es deren 40). Die deutschen Hochseefischer benutzen zum Ausschmelzen der Lebern in den Dampfkessel der Maschinen der Schiffe eingelassene Gefäße. Hauptsache ist bei allen diesen Methoden, daß die Leber frisch ist und daß die Erhitzung nicht zu hoch ist (nicht über 70°) und nicht zu lange (nicht über ¾ Stunde) dauert. Das bei diesen Methoden austretende Öl wird abgeschöpft, durch Absetzenlassen geklärt und bevor es in die mit Holz umgebenen Weißblechtonnen gefüllt wird, filtriert. Schon hierbei scheidet sich, da ja die Temperatur zu jener Zeit in den Gegenden, wo die Gewinnung erfolgt, niedrig ist, ein Teil der festen Fettbestandteile ab. Um diese Bestandteile noch weiter abzuscheiden und ein auch bei 0° klar bleibendes Öl zu erhalten, wird dann der Lebertran durch Kältemischungen (Eis und Kochsalz) in Kühlkammern auf etwa −5° abgekühlt oder auch nur der Winterkälte ausgesetzt und bei möglichst niedriger Temperatur durch Filterpressen oder Filtersäcke filtriert. Das Abgeschiedene, durch hydraulische Pressen vom Öl befreite geht als «Fischstearin» in die Seifenfabrikation oder als «Fischtalg» in die Gerbereien. Da die Luft bei dieser Fabrikationsweise verändernd auf den Lebertran einwirkt, findet neuerdings da und dort das Ausschmelzen in einer Kohlensäureatmosphäre statt (PETER MOELLER). HEYERDAHL empfahl in einer Wasserstoffatmosphäre zu arbeiten. Dieser sorgfältig aus frischen Lebern an der norwegischen Küste bereitete Lebertran ist der sog. helle Medizinaltran, Dampflebertran, norwegischer Medizinal-Dorschtran oder Fabriktran I. Qualität, der von einigen Pharmakopoeen (D. A. V., Ph. austr.) ausdrücklich verlangt wird. Aber auch der durch einfaches Auspressen oder spontanen Austritt (s. unten) gewonnene sog. natürliche Lebertran kann noch in seinen besten Sorten medizinisch benutzt werden.
Bei dem in Ostende benutzten Verfahren von HENSEVAL und HUWART vermischt man die gut gewaschenen Lebern mit ⅕ Wasser und leitet unter Umrühren soviel Dampf von ¼ Atm. ein, daß die Temperatur nach 40 Minuten 70–75° beträgt. Nach ½ Stunde Ruhe wird das Öl (¾ der Gesamtmenge) abgeschöpft (durch Pressen wird eine Sekundasorte gewonnen). Das abgeschöpfte Öl wird dann, nachdem es zwei- bis dreimal mit Wasser von 50° gewaschen, in hermetisch geschlossenen Behältern im Eiskeller abgekühlt, um das Stearin abzuscheiden.
Nach dem WILD-ROBBschen Patent wird jetzt guter Lebertran durch Ausschmelzen der Lebern im Vakuum mit Dampfmantel bereitet. Das Öl läuft durch ein Vakuumfilter in einen Tankwagen, wo es auf 4° abgekühlt wird. Das Stearin wird durch dicht nebeneinander gehängte Filtersäcke abgetrennt.
Minderwertige, von der medizinischen Verwendung auszuschließende Transorten werden im Verfolg des oben beschriebenen Verfahrens durch stufenweises stärkeres Erhitzen und Auspressen der Lebern gewonnen (Sekundatran für technische Zwecke).
In Island ist die Gewinnung des Dampftranes ähnlich wie in Norwegen, doch nur gering, infolge ungenügender Mengen frisch zu beschaffender Lebern. In Nordamerika (Canada, Neufundland),[S. 651] auf den britischen Inseln und der Nordseebank wird sie durch zu hohe Lufttemperatur und daher zu rasche Fäulnis der Lebern behindert. Dagegen hat sich der «PETER MÖLLER-Prozeß», wie die Gewinnung des Dampftrans nach ihrem Erfinder genannt wird, auch in den Bezirken von der russisch-norwegischen Grenze bis zum Weißen Meer eingeführt. An der Murmanküste besteht etwa ein Dutzend woers, kleine Dampffactoreien, deren östlichste Korabelnaja ist (PECKEL MÖLLER).

Verladen des Lebertrans in Bergen.
[Klischee von Scott & Bowne.]
Minderwertige Sorten sind die sog. natürlichen, naturellen, früher als Bauerntrane bezeichneten, die in der Weise gewonnen werden, daß man die aus den Fischen herausgelösten Lebern, oft ohne die Gallenblase abzulösen, in Fässern (Barrels, Fig. 201) übereinander schichtet, diese verspundet und deren Inhalt erst nach mehreren Wochen oder gar Monaten, wenn die Fischer heimgekehrt sind, also die Masse schon zum Teil in Fäulnis übergegangen ist, weiter verarbeitet. (Die ersten Lebern kommen im Januar, die letzten im April in die Fässer.) Das aus den Fässern freiwillig ausfließende oder oben abgeschöpfte Öl ist noch relativ hell, gelb bis orange gefärbt (Ol. jecoris naturale flav., citrinum, helles Rohmedizinalöl, Norw. Raa-Medizinaltran) und gilt in seinen besten Sorten als zur Not noch für medizinische Zwecke brauchbar, obwohl der Trangeschmack sich zuweilen recht unangenehm bemerklich macht (die Pharmakopoeen lassen es nicht zu!). Indessen gibt es vielfach gute Qualitäten, die in bezug auf Geschmack oft einem guten Dampftran vorgezogen werden (BULL). Das bei weiterem Faulen bis Juni an die Oberfläche kommende Öl ist der Norw. Blanktran und das bei fortgesetzter Fäulnis erhaltene dunkelbraune Öl der Norw. Braun-Blanktran. Die dann aus den Lebern in Töpfen und Kesseln auf offenem Feuer ausgekochten Trane aber, die abscheulich riechen und noch abscheulicher schmecken, und eine mehr oder weniger braune (Ol. jecoris fuscum) oder gar fast schwarze Farbe (Ol. jec. nigr., Gerbertran) besitzen, sind nur zu technischen Zwecken verwendbar (Norw. Brauntran). Der beim Auskochen der Lebern zurückbleibende Rückstand heißt graxe. Die Bauerntrane werden durch Abkühlen nicht demargariniert, sind «unracked», enthalten also viel feste Fettsäuren (s. unten). Nach dem Bauerntranverfahren[S. 652] wird noch jetzt, besonders an der Küste von Neufundland, dann auch an der schottischen Küste, in Island und Norwegen viel Lebertran dargestellt (WEIGEL, ROUSSEL), der zudem noch oft mit Robben- und Menhadentran (s. oben) versetzt wird (SAGE). Besonders scheint die Methode, die 3 : 1 m großen Fässer (cajot) unten mit einem Fichtenbusch als Filter zu versehen und das spontan abfließende Öl am unteren Teile abzuziehen, beliebt zu sein, neben der Methode die Lebern in große Behälter (foissière) zu werfen, die bis 3000 Stück aufnehmen können und in denen, da der Behälter sich nur langsam füllt, die Masse allmählich in faulige Gärung übergeht und einen derartigen Gestank entwickelt, daß es verboten ist, diese Behälter in der Nähe von Straßen zu errichten.
In Ostende wurde früher die zerkleinerte Leber in einen Fischmagen gelegt und dieser aufgehängt. Der Tran floß bald spontan aus. Neuerdings sind auch mit Lauge und Kohle entfärbte sowie sonnengebleichte Leberöle im Handel.
Der Bauerntran geht nach Bergen. Dort lagert das Öl zunächst, um alles Wasser abzuscheiden. Dann wird es bewertet — meist auf eine sehr primitive Weise: Eintauchen der Finger und Prüfen durch Mund und Nase. Der bei der Dampftrangewinnung erhaltene Rückstand der extrahierten Lebern (Graxe) wird getrocknet, gemahlen und als Dünger verwendet, oder, trotzdem er c. 6–10 % Öl enthält, fortgeworfen. Auch die abgeschnittenen Köpfe der Fische (Fig. 199) werden auf Dünger verarbeitet (1893: 17,7 Mill. Köpfe in drei Fabriken), die Schwimmblasen bisweilen auf Leim. Der Rogen geht als Köder nach Frankreich.
Lit. BREFELD, D. Stockfischlebertr. in naturhistor. etc. Hinsicht. Hamm 1835. — VOGL, Kommentar. — SOUBEIRAN, Journ. pharm. 1866, 161 u. 324. — R. HOWDEN (Gewinn. d. L. auf den Lofoten). Pharm. Journ. 9 (1868), 312 (deutsch: Arch. Pharm. 18 [1868], 235). — HEINRICH MEYER, Medizinal-Dorschlebertran 1884. — KÖNIG, Abhandl. der Naturw. Ges. Isis 1895 (Ref. von SCHELENZ in Pharm. Zeit. 1899, 381). — F. PECKEL Möller, Codliver oil and chemistry. London 1895. — ROUSSEL, La morue et l’huile de foie de morue. Thèse Paris 1900. — HENSEVAL u. HUWART, Beitr. z. Stud. d. Fischlebertrane. Chem. Rev. d. Fett u. Harzind. 1907, 191. — NIELSEN, Instruct. sur la prep. de l’huile d. foie de morue Bull. d. Pêches marit. 1897. — RUMP u. LEHNERS, Schweiz. Wochenschr. 1904, 160. — KOCH (Produkt. in Neufundl.), MERCKS Rep. 1907, 340. — STEIN (Island), Österr. Apoth. Zeit. 1906. — BROUSFIELD (Lofoten, Liste der Stationen). West. Drugg. 1905, 435. — THOMSON (Neufundland). Proc. Amer. pharm. Assoc. 1905, 691. — GEHE, Handelsber. — Die Seefischerei Norwegens 1901. — Sea fisheries of the united kingdom 1902. — Die Geestemünder Hochseefischerei 1902, herausgeb. z. Intern. Fischerei-Ausst. in Wien. — Mitteil. d. deutschen Seefischereivereins.
Handel. Der Großhandel unterscheidet meist: I. Dampftran (weiß, hellblond, gelb, album); II. Natürlicher Tran. 1. Medizinaltran (hellblank, blond, citrinum); 2. blanker T. (hellbraunblank, flavum); 3. braunblanker T. (fuscum); 4. brauner T. (braunschwarzer, nigrum, Gerbertr.), und nach der Herkunft besonders: Norwegischer-Neufundland-Labrador-Tran. Der Handel unterscheidet auch «ungeklärte» und «bei 0° nicht dick werdende» Trane, oder auch sommerfiltrierte und winterfiltrierte (bei Japantran). Die frühere Bezeichnung Fabriktran und Bauerntran ist nicht mehr üblich.
Der norwegische Medizinal-Dorschtran ist sowohl als Dampftran (in Blechtonnen à 100 kg) — die bei weitem teuerste Sorte — wie als natürlicher Dorschtran (in Holztonnen à 100 kg) im Handel. Letzterer in den Sorten «hellgelb, kältebeständig D. A. V.», — nur ⅔ des Preises vom Dampftran — gelb, madeirafarbig, rotbraun — letztere nur zu technischen Zwecken benutzbar. Der Dampftran verdrängt jetzt allmählich die sog. natürlichen Trane. Von technischen Tranen führt GROSSMANN 1911 an: Dreikronen, Grönländer, Robben, Japan, Leber (brauner), Gerber Ia, Neufundland.
[S. 653]
Schon 1893 waren c. 40000 Menschen, darunter 26683 Fischer auf c. 6000 Schiffen allein in Norwegen mit Kabeljaufang beschäftigt, der Ertrag betrug c. 27 Mill. Fische, die 17,7 Mill. Köpfe für Dünger, 31100 hl Rogen und 31500 hl Leber ergaben. 60 Fabriken erzeugten 18600 hl Medizinaltran. Dampftran wird erzeugt auf den Lofoten-Ydersiden, in Finmarken, Tromsoe, Nordmöre, Romsdalen und Söndmöre. Hauptstapelplatz für norwegischen Lebertran ist Bergen. Dann exportiert auch Aalesund, viel weniger Christiania und Tromsö. Die norwegische Dorschfischerei beschäftigt jetzt über 6000 Fahrzeuge und erzeugt in guten Jahren bis 80000 t Leberöle im Jahr. 1902 richteten Seehunde große Verwüstungen unter den Dorschen an, auch gingen die Dorsche weiter südlich, besonders 1903 war aber ein Fehljahr, da die Lebern sehr ölarm waren (s. unten). Der Preis pro hl stieg daher von 70–75 M auf 485 bis 525 M. 1902 kam aus dem gesamten norwegischen Fischereigebiete: 19878 hl Dampftran und 14054 hl gewöhnlicher T. In den Jahren 1903 und 1904 aber infolge geringen Fanges und Fettarmut der Lebern kaum der vierte Teil. Die Zahl der in Norwegen gefangenen Dorsche betrug 1905: 44,5, 1906: 46,5, 1907: 47,6, 1908: 48,2, 1909: 56,5, 1910: 55,7, 1911: 64,4 Millionen. (Zu anderen Transorten abgesetzte Lebern 1903: 7012, 1904: 7810, 1906: 18097, 1907: 21384, 1908: 25584 hl.) Der Export betrug 1909: Dampftran 40240, Medizinaltran 9900, blanker T. 4296, braunblanker 8263, brauner 17915. Norwegen erzeugte Dampftran 1905: 41807, 1906: 42908, 1907: 46889, 1908: 59104, 1909: 50460, 1910: 41024, 1911: 43318 hl. Das Verhältnis der Lofotenproduktion zu der ganz Norwegens ergibt sich aus folgenden Zahlen: Die Lofoten allein erzeugten 1901: 15889, 1902: 9628, 1903: 614, 1904: 3293, 1905: 31187, 1906: 33177, 1907: 36387 hl. Alle Fischereien Norwegens 1901: 29500, 1902: 22200, 1903: 2952, 1904: 18500, 1905: c. 42000 hl. Über sog. Medizinaltran fehlen genaue Zahlen. Die Menge der zur Bereitung anderer Sorten Tran, die nicht Dampftran sind, übrig bleibenden Mengen Dorschleber betrugen 1909: 27663, 1911: 12729 hl. Dazu kommen noch nicht unbeträchtliche Mengen (c. 1–2000 t) außer Kontrolle gewonnener Tran. Der Neufundländer Tran der canadischen Fischer sowie der Labradortran kommen meist über London, der der französischen Fischer geht nach Frankreich. Die besten Sorten sind dem norwegischen gleichwertig. Sie werden in Nordamerika bevorzugt. Die Vereinigten Staaten importierten 1908: 246680, 1909: 209155 galls. codliveroil und exportierten 1908: 306439, 1909: 327115 galls. fishoil. Neufundland exportiert etwa 50–70000 t Tran.
In Bergen besteht eine Fiskeriforsøkstationen, die alle Produkte des Meeres auf ihre Verwertung hin studiert (Direktor: H. BULL).
Lit. Handel: Chem. Drugg. London 1907, 206 und 448. — GEHE & Co., Handelsber. — GROSSMANN, Liste. — Handelsber. in Schweiz. Wochenschr.
Bildung des Öls in der Leber. ROUSSEL hat die Bildung des Öls in der Dorschleber in Frankreich studiert (a. a. O. mit Abbild.). Vom Dezember bis Februar sind nur wenige Öltröpfchen in den Leberzellen zu finden, während des März und April steigt deren Menge und sie erreicht ihr Maximum vom August bis November. Die Anhäufung des Öls ist kein pathologischer Prozeß, sondern eine Folge von Überernährung.
Chemie. Der Fettgehalt der Dorschleber schwankt von 10–60% (BENEDIKT-ULZER). Er betrug 1899: 56, 1900: 54, 1901: 51, 1902 aber nur 42%, 1906 wieder 52%. In normalen Jahren liefern 250–400 (im Mittel 320) Lebern 1 hl Tran, in schlechten (1903) sind 2000–4000 dazu nötig. Auf Jahre, in denen die Leber einen abnorm hohen Fettgehalt zeigt (1908), folgen meist solche mit geringerem Gehalt (1909 u. 1910). Fettarme Lebern geben beim «Schmelzen» kein Öl. (KÜKENTHAHL bemerkt, daß die Riesenleber des Eishai (s. oben S. 647) so tranreich ist, daß sie 2–3 norwegische Tonnen Tran liefere?). Die Zusammensetzung des Lebertrans ist natürlich verschieden, je nachdem ein natürlicher, kalt ausgetretener, ein heiß ausgeschmolzener, ein abgekühlter, demarginierter (solchen verlangt z. B. D. A. V.) oder ein nicht abgekühlter Lebertran vorliegt. «Stearinfreie» Öle heißen im Handel Racked oils. Im Durchschnitt wird angegeben: Flüssige Säuren 87–92,7, feste 6,7–12,7, Glycerin[S. 654] 10–11% (die älteren Angaben: Oleïn 98,87, Margarin 0,81 sind nicht richtig). Die elementare Zusammensetzung entspricht etwa C = 78,1, H = 11,61, O = 10,28. In den festen Anteilen, dem Transtearin, finden sich vorwiegend die Glyceride der Stearin- und Palmitinsäure, etwas Myristinsäure (BENEDIKT-ULZER) und eine oder mehrere ungesättigte Fettsäuren neben anderen noch unbekannten Bestandteilen. Glyceride der Essigsäure, Buttersäure (die Buttersäure sollte als Propyläther vorhanden sein? WINKLER), Valeriansäure und Caprinsäure finden sich nicht im Dampfmedizinaltran; die REICHERT-MEISSL-Zahl ist immer sehr niedrig. Die freien Säuren treten jedoch als sekundäre Produkte in Tranen aus faulenden Lebern auf (SALKOWSKY und STEENBACH). Über die flüssigen Fettsäuren ist wenig Sicheres bekannt. HEYERDAHL nahm im stearinfreien Öl 4% Palmitinsäure, 20% Jecoleïnsäure und 20% Therapinsäure an. (Er nimmt in der außerordentlich oxydablen Therapinsäure vier doppelte Bindungen an. Die Jecoleïnsäure faßt er als Isomeres der Döglingsäure auf.) Die Existenz der Jecorinsäure (C18H30O2) und der Asellinsäure (C17H32O2, FAHRION) sowie der Jecoleïnsäure und Therapinsäure (HEYERDAHL), sowie der BULLschen Säure, C23H36O2, betrachtet LEWKOWITSCH aber als unbewiesen. HEIDUSCHKA und RHEINBERGER betrachten das beim Stehen von in Chloroform gelösten Lebertranfettsäuren mit HÜBLscher Jodlösung sich abscheidende kristallinische Produkt als Tetrachlortetrajodtherapinsäure C17H26O2(ClJ)4. FAHRION erhielt die von einigen als Hauptbestandteil angegebene Physetölsäure nicht. LUCKS Gadinsäure ist zu streichen. Die Döglingsäure, die SCHARLING an Dodekatylalkohol gebunden im Döglingtran angibt, ist wahrscheinlich Ölsäure (LEWKOWITSCH). BULL, dem wir die besten Untersuchungen über die Fettsäuren des Trans verdanken, trennte die flüssigen Fettsäuren durch die Löslichkeit ihrer Kali- bzw. Natronsalze in vier Anteile, die sich durch ihre Jodzahl unterscheiden. Sie beträgt bei A: 67,5, bei B: 135,6, bei C: 322,4, bei D: 347. Es sind also zum Teil ungesättigte Säuren. BULL erhielt ferner (durch Fraktionierung der Methyläther der Säuren) Myristinsäure, Palmitinsäure, Fettsäure: C16H30O2 (6%), Stearinsäure, Ölsäure (aber nicht 99% DELATTRE oder 70% SCHAPER), Gadoleïnsäure C20H38O2, und Erucasäure. LEWKOWITSCH betrachtet es als durch die Bromierungsversuche (HEHNER u. MITCHELL, WALKER und WARBURTON, LEWKOWITSCH) bewiesen, daß Säuren der Reihe CnH2n−6O2 (vgl. S. 546) im Dorschleberöl vorkommen, die aber nicht Linolensäure sein können. BENEDIKT und ULZER, die dies bestreiten, betrachten als mit Bestimmtheit nachgewiesen folgende ungesättigte Säuren der Ölsäurereihe: die Palmitoölsäure (BULL, C16H30O2), Ölsäure, Gadoleïnsäure (BULL C20H38O2 F. = 24°) und Erucasäure (BULL) und nehmen als bewiesen (?) an, daß auch Säuren der Reihe CnH2n−10O2 darin vorkommen [C20H30O2 (?) C23H36O2 (?)], die sich durch sehr große Oxydierbarkeit auszeichnen. Die aus Japantran und anderen Tranen isolierte Clupanodonsäure gehört zur Reihe CnH2n−8O2 (MITSUMARU TSUJIMOTO). Jedenfalls besteht das Gemisch der flüssigen Fettsäuren vorwiegend aus ungesättigten Säuren.
Der Gehalt an freien Säuren ist beim Dampftran sehr gering (0,34–0,6% PARRY und SAGE, 0,24–0,69% SALKOWSKY — Säurezahl: 0,72–1,45 bzw. 1,68 DIETERICH). Doch reagieren alle Trane sauer (GARCANO). Der Säuregehalt ist um so größer, je dunkler das Öl gefärbt ist. So beträgt die Säurezahl bei hellem naturale: 8,2–12,6, bei blankem: 11,9–15,9, bei braunblankem naturale: 19,2–36,8 (BENEDIKT-ULZER). Besonders viel enthalten die Leberöle, die aus zerfallenen, gefaulten Lebern dargestellt wurden, da bei diesen die Glycerinester durch die Lipasen verseift[S. 655] wurden. Bei ihnen steigt die Säurezahl bisweilen bis auf 54,4 (HEYERDAHL). An Luft und Licht entstehen im Tran aus den ungesättigten Säuren Oxyfettsäuren.
Die Farbe des Lebertrans rührt von einem im Lichte ausbleichenden Lipochrom her (P. MÖLLER, von DE JONGH als Gaduin bezeichnet). Auf diesem beruht auch die Blaufärbung durch Schwefelsäure (s. unten S. 657).
Das Unverseifbare besteht aus Cholesterin und beträgt bei Medizinaldampftran 0,3–1,64% (0,46–1,32 ALLEN und THOMSON, im Durchschnitt 0,3 SALKOWSKY), bei den technischen Ölen oft viel mehr (bis 7,89 durch alkohol. Natron Unverseifbares).
Ferner sind 0,035–0,05% organische Basen (Ptomaine?) in dunklen Dorschleberölen nachgewiesen (GAUTIER und MOURGUES), und zwar Butylamin, Isoamylamin, Hexylamin, Dihydrolutidin und Trimethylamin (sämtlich Zersetzungsprodukte des Lebereiweißes). Ferner die nicht flüchtigen Basen Morrhuin (C19H27N3) und Asellin (C25H32N4), sowie ein lecithinartiger Körper (GAUTIER und MOURGUES), der vielleicht zu den Phosphatiden gehört und mit dem Jecorin identisch ist. GAUTIER und MOURGUES nennen noch die Basen Merlusin (C8H12N2), Homomorrhuin(C20H29N3), Nicomorrhuin (C20H28N4), Tyrosamin und Morrhuamin. Die meisten dieser, nähere Untersuchung verlangenden, Basen bilden Öle, finden sich übrigens nur in den gefärbten sog. natürlichen Ölen (s. oben), nicht im Dampftran, der stets stickstofffrei befunden wurde (EBERLE). Sodann nennen die genannten Autoren noch die Morrhuinsäure, die sie als ein Pyridinderivat der Formel:
betrachten (LEWKOWITSCH bezweifelt ihre Existenz).
Das Morrhuol (Gaduol) ist ein mit 90% Alkohol bereiteter eingedampfter Auszug des Lebertran, der die «wirksamen Bestandteile» (?) enthalten soll (CHAPEAUTEAUT), aber wohl vorwiegend nur die Phosphatide und Basen, sowie etwas der Fettsäuren enthält. Es ist eine bitterschmeckende, unangenehm riechende Masse. Brauner Tran liefert 4,5–6%, heller 2,5–3%.
Die Asche beträgt bei hellem Öl 0,1515% (bei braunblankem 0,0678, bei braunem 0,0817% DE JONGH), im Lofotentran 0,009 (VAN DER BURG). Nachgewiesen ist außer Ca, Mg, Na, Fe, Mn, Chlor (0,102%), Phosphor (0,018%), Schwefel (0,041%) und Brom (0,004%), besonders Jod. Letzteres wohl in organischer Bindung (PERSONNE 1849). Der Phosphor steckt wohl im Lecithin.
Frische Dorschleber enthält mehr wie zweimal so viel Jod als der Tran. Der Jodgehalt des Trans wird sehr verschieden angegeben. Für blonde Trane 0,02, gelbe 0,031% Jod (ANDRES), hellblanker 0,0377, braunblanker 0,0405, brauner 0,035 (RIEGEL); Labradortran: 0,015% (SCHAPER). BIRD erhielt dagegen nur 0,0012 bis 0,0021%; STANFORD gar nur im Durchschnitt 0,000322%, GIRARDIN und PREISSER: 0,0007–0,0008. FLÜCKIGER gibt 0,0004% an. Die niedrigsten Werte finden sich bei VON SANTEN: 0,00022 (weißer) - 0,00065 (braunblanker). Die Angabe von GARROD (Mat. med.): 0,06% ist jedenfalls zu hoch. CARLES fand (1882) in farblosem, gereinigtem Tran nur außerordentlich geringe Spuren von Phosphatiden und Jod. Doch hält BIRD (im Gegensatz zu BENTLEY und REDWOOD, CHEVALIER und GOBLET, sowie HERBERGER) Jod für einen konstanten Bestandteil des Trans.[S. 656] Brom enthält der Tran nur 1⁄10 von dem Gehalte an Jod. Den Bromgehalt gibt RIEGEL auf 0,0037–0,0048% an. Der Rochenlebertran enthält etwa ebenso viel Jod und Brom wie der Dorschlebertran (RIEGEL). Die Bestimmung des Jods kann, wie WACKENRODER angibt, am besten (?) in der verkohlten Transeife erfolgen, muß aber mit allen Kautelen vorgenommen werden (Salpeterschmelze), da sonst, wie die Untersuchung des Jodothyrins zeigt, Spuren von Jod leicht übersehen werden.
Gallenfarbstoffe und Gallensäuren fehlen. Ein Phosphatid fand bereits DE JONGH und GOBLEY (1844). Die Substanzen, welche dem Lebertran (und and. Fischölen) den Geruch geben, sind angeblich hauptsächlich aldehydischer Natur. Sie sollen aus den ungesättigten Fettsäuren durch den Luftsauerstoff entstehen (SERVAIS), doch zeigt auch z. B. die ungesättigte Clupanodonsäure des Japantrans selbst schon deutlichen Fischgeruch (MITSUMARU TSUJIMOTO), wie das Glycerid der Isansäure aus Isanöl (HÉBERT. Ob diese aber ganz rein waren?). Vielleicht sind auch die Basen (s. oben) an dem Geruche beteiligt, denn besonders die dunklen Öle riechen stark. Die sich aus Tranen bei längerem Stehen bisweilen abscheidende harzartige Masse scheint ein Umwandlungsprodukt der ungesättigten Fettsäuren zu sein (MITSUMARU).
Lebertran löst sich in Äther, Chloroform und Schwefelkohlenstoff und bei 80° zu 6% in absol. Alkohol, siedender Alkohol löst 7% (SCHÄDLER). Bei der Elaidinprobe erstarrt Lebertran nicht, sondern bildet eine dicke rote Masse. Bei der Behandlung des Lebertrans mit Salpetersäure entsteht neben Sebacinsäure, Brassylsäure und Korksäure nur wenig Azelainsäure (EBERLE).
Das spez. Gew. von Dampfdorschlebertran beträgt bei 15° 0,920–0,927 (GARCANO, KREMEL) bis 0,929 (WIJS) bzw. 0,931 (PARRY, SAGE) — BULL beobachtete meist c. 0,926 (Pharm. helv.: 0,925–0,930 bei 15°, 0,873–0,874 bei 98°; D. A. V.: 0,924–0,932) — bei gelbem Medizinaltran: 0,922–0,929, bei hellem naturale I: 0,9262–0,9275 (WEIGEL), bei naturale II: 0,9245–0,9293 (BENEDIKT-ULZER), bei Neufundländer: 0,925 (MANN), bei isländ.: 0,923 (BRYDE), bei techn. hell: 0,9232 bis 0,9252, bei hellbraun: 0,9217–0,9256, bei braun: 0,9310–0,9410. Die Trane von höherem spez. Gew. geben auch eine höhere Jodzahl (WIJS).
Die Verseifungszahl bei Dampftran: 186,3 (BULL) bis 189 (KREMEL) resp. 199 (PARRY), 184–195 (Ph. austr. VIII), Verseifungszahl heiß: 185,4–192,5 (DIETERICH).
Die Jodzahl: 148 (BULL) bis 181 (WIJS), bei selbst ausgeschmolzenem: 160,7 bis 203, bei gutem Dampftran c. 160–170 (159–168,5 PARRY, nach Pharm. helv. IV: 150–170, D. A. V.: 155–175), bei naturale: 156–159, bei gelbem: 129–150, bei Neufundländer: 139,2, bei isländ.: 137,5. (Pharm. austr. VIII hat 120–145. Auch WEIGEL gibt niedrigere Zahlen für Dampftran: 141,11, DIETERICH: 122,2 bis 135,9, GARCANO: 126,8). Bei längerer Aufbewahrung fällt die Jodzahl und das Refraktionsvermögen nimmt zu (THOMSON u. DUNLOP). Bromzahl bei bernsteingelbem: 83,44, bei braunem: 83,10 (TELLE).
Die REICHERT-MEISSL-Zahl: 0,1–0,7 (0,85 PARRY), bei selbst ausgeschmolzenem 0,48–0,86; das Unverseifbare im Dampftran meist 0,60–0,87%, bis 1,64 (BENEDIKT-ULZER), 1,6 (PARRY); durch alkohol. Natron unverseifbar bei Dampftran: 1,3 bis 2,6, bei naturale: 1,85–2,65, bei braunblank: 3,45–7,83, bei braun: 7,46 bis 7,89 (BULL und LILLEJORD). Hehner-Zahl: 95,3–96,5 (LEWKOWITSCH, FAHRION).
Ätherunlösliches Bromid: 32,64 (BULL) bis 45% (ULZER), bei naturale hell 47,1. Maumenéprobe: 113–116° (BAYNES, ALLEN); Brechungsexponent bei 15°:[S. 657] 1,4800–1,4852 (STROHMER), 1,4792–1,4811 (PARRY), bei 40°: 1,4700–1,4736 (Pharm. helv. IV); Oleorefraktometer bei 22°: +40 – +46 (PEARMAIN, DOWZARD); Butterrefraktometer bei 20°: 77,5–83,2 (UTZ). Die Thermozahl (bestimmt im Thermoleometer TORTELLI) beträgt 107 (bei Robbentran 72,1, bei Walfischtran 75,6, bei Sardinenöl 112,5).
Die Lebertrane sind vorwiegend linksdrehend (RAKUSIN); Dorschtran meist inaktiv (LIVERSEEGE). Die Verbrennungswärme beträgt bei frischem Dorschleberöl 9452 g-Kal. bei konstantem Druck und 9437 g-Kal. bei konstantem Volumen (SHERMANN u. SNELL).
Gesamtfettsäuren: 95,72%. Die Menge der ungesättigten Fettsäuren betrug bei 13 Proben 12,1–13,5, bei 3 Proben 14,7–15,5, bei 2 Proben 11,5–11,9%. Schmelzpunkt der Fettsäuren: 21–25 (PARRY) bis 26,5 (BULL); mittleres Molekulargewicht: 287,6–292,5 (PARRY) und Jodzahl 130,5 (THÖRNER), 164–171 (PARRY).
Der Erstarrungspunkt (meist 0–3,5° BARTHE) wechselt natürlich, je nachdem der Tran der Kälte kürzere oder längere Zeit oder gar nicht ausgesetzt war. Durch das Abscheiden des Stearins durch Abkühlen gehen dem Tran übrigens keine wertvollen Bestandteile verloren, auch die Konstanten ändern sich kaum (MOREAU).
Reaktionen: 1 gtt. Ol. jec. in 20 gtts. Chloroform (VOGT oder 1 ccm in 3–4 ccm SALKOWSKI) gelöst soll auf Zusatz von einem Tropfen Schwefelsäure bei lebhaftem Umrühren mit dem Glasstab zuerst blau, dann blauviolett, rotviolett und schließlich verblassend amethystfarbig werden — SALKOWSKIS sog. Gaduinreaktion — (Unterschied von anderen Leberölen, von Fischölen, wie Haifisch- und Robbentran) — Schellfisch-, Sejfisch-, Brosmentran werden grünblau-violett-rot. Bei älteren Ol. jec. soll die Gaduinreaktion undeutlich sein (BEDALL, WIEBETITZ, WEIGEL).
3 gtt. Salpetersäure von spez. Gew. 1,4 färbt 15 gtts. Lebertran feurig rosenrot (Unterschied von Robbenspecktranen, Sej-, Hai- und Lengfischtran; ähnlich verhalten sich Brosmen- und Schellfischtran) — KREMELS Reaktion — Bei Salpetersäure, spez. Gew. 1,5, treten bei Dorschtran vorübergehend blaue Streifen auf (VOGT). Der Vorschlag VREVENS, den Lebertran in Äther zu lösen, mit starkem Alkohol zu fällen und die überstehende Flüssigkeit in einer flachen Schale mit rauchender Salpetersäure zu versetzen — es tritt vorübergehende Himmelblaufärbung ein — ist überflüssig und gefährlich (Explosionsgefahr!).
Werden zu einer gekühlten Mischung von 20 gtts. Chloroform, 40 gtts. Essigsäureanhydrid und 3 gtts. H2SO4, 3 gtts. Lebertran zugesetzt und umgeschüttelt, so tritt vorübergehend intensiv-blaue Färbung ein, die bald in Olivgrün übergeht — LIEBERMANNS Cholestolreaktion — (Unterschied von Schellfisch-, Sejfisch- und Lengfischtran und von Specktranen — Brosmentran wird auch blau).
Die Bellierreaktion (salpetrigsäurefreie Salpetersäure, spez. Gew. 1,4, und Resorcinlösung) gibt bei Dorsch-, Schellfisch- und Brosmentran Orangerotfärbung, Lengfisch-, Sejfisch- und Haifischtran werden tieffuchsinrot, Robbentran himbeerrot (KREIS). Mit Königswasser geschüttelt gibt Dorschtran ein grünlich-dunkelgelbes Liniment. Robbentran wird schwachgelb (RÖSSLER). 1 gtt. eines Gemisches von 2 Teilen Salpetersäure und 1 Teil Schwefelsäure färbt 15 gtts. Dorschtran lachsrot. Andere Trane und Fischöle werden grünlichbraun, orangerot oder braun (MANN). Isländische Trane verhalten sich wie norwegische (STEIN), die amerikanischen zeigen Abweichungen (TOLMANN, KEBLER).
Lit. PECKEL MÖLLER, Codliveroil 1895 (dort eine chem. Bibliographie). — Ältere Lit. siehe unter Geschichte und bei GUIBOURT. — WURZER, Hufel. Journ. 1822, 31 (erste chem. Unters.). — SPAARMANN, Geig. Mag. 1828, 302. — WACKENRODER, Arch. Pharm. 24 (1841). — STEIN, Journ. pr. Chem. 21 (1840), 308. — GOBLEY, Journ. pharm. chim. 5, 305. — PERSONNE, Mém. Acad. méd. 15 (1849) 1068. — RIEGEL, Arch. Pharm. 120 (1852). — DE JONGH, Lieb. Ann. 48, 362; Arch. Pharm. 88 (1844), 189. — SCHARLING, Jahresb. d. Chem. 1847/48. — HOFSTÄDTER (Physetölsäure), Lieb. Ann. 91, 177. — LUCK, N. Journ. Pharm. 1856, 249. — DELATTRE in GUIBOURT, Hist. nat. d. drog. 1876. — SCHAPER (Olein), Jahresb. d. Pharm. 1869, 340. — WINKLER,[S. 658] Arch. Pharm. 126(1853), 185. — CHEVALLIER ET BAUDRIMONT, Dict. d. alter. et falsific. 1878. — MAUMENÉ, Compt. rend. 92, 721 (1880). — VAN DER BURG, Arch. Pharm. 17 (1880), 204. — CARLES, Journ. pharm. chim. 1882. — STANFORD, Pharm. Journ. 1883. — ANDRES, Wertbest. d. Lebertr. Pharm. Zeitschr. f. Rußl. 28 (1889), 145. — HAGER, Pharm. Centralh. 26, 13. — HEYERDAHL, New. chem. research. on cod liver oil bei PECKEL MÖLLER (1895). — LEWKOWITSCH a. a. O. — BENEDIKT-ULZER a. a. O. — FAHRION, Chem. Zeit. 1893, 521 u. 1899, 161. Zeitschr. angew. Chem. 1893, 140. — BULL, Chem. Zeit. 1899, 996 u. 1043, 1900, 814 u. 845. Jahrb. d. Chem. 10, 386 und Ber. d. chem. Ges. 1906, 3570. — BULL und JOHANNESEN, Tidskr. f. kemi 1908, 273. Chem. Zeit. 1909, 73. — DOWZARD, Pharm. Journ. (4) 6 (1898) 532. — UMNEY and BENNET, Chem. Drugg. 1903, 37. — HARVEY, Journ. Soc. chem. ind. 1902, 694. — KREMEL, Pharm. Centralh. 1884, 337. — MANN, Journ. soc. chem. ind. 1903. — VOGT, Schweiz. Wochenschr. 1905, 674. — THOMSON und DUNLOP, Brit. Col. Drugg. 1906. — KREIS, Schweiz. Wochenschr. 1906, 721. — UTZ, Zeitschr. f. öffentl. Chem. 8, 304. Seifensiederzeit. 33, 398. — GAUTIER und MOURGUES, Compt. rend 107, 254, 626 und 740. Bull. soc. chim. (3) 2, 236 und Les alcaloïdes de l’huile de foie de morue. Paris 1890 (dort auch physiolog. Studien über die Basen). — JORISSEN u. HAIRS, Journ. pharm. Liège 1896. — HENSEVAL und HUWART a. a. O. — TOLMANN (Amer. Leberöle), Journ. Amer. chem. soc. 1906, 388. — RAKUSIN, Chem. Zeit. 30, 1247. — PARRY and SAGE, Pharm. Journ. 1895, 119. — PARRY (Phys. u. chem. Konst.), Chem. Drugg. 1905, 491. — SALKOWSKY, Zeitschr. anal. Chem. 1887, 557. Berl. Klin. Wochenschr. 1907, 2. — SHERMANN u. SNELL, Journ. Am. Chem. Soc. 1901, 164. — SCHARLING (Elementarzusammens. einiger Trane), Journ. pr. Chem. 43, 257. — Die Aschebestandteile bei KÖNIG, Nahr.- u. Genußm. I, 66. — BEDALL, Prüf. d. Lebertr. Pharm. Centralh. 43 (1902), 118. — LYTHGOE (opt. Eigensch.), Pharm. Journ. 1905, 278. — MITSUMARU TSUJIMOTO, Journ. Coll. Eng. Tokyo 4, Nr. 5 (Chem. Rev. 1909, 85). — TOLMANN (Amer. Trane), Journ. Amer. chem. soc. 1906, 388. — NIELSEN a. a. O. — STEIN (Isländ. T.), Arch. for pharm. og kem. 1906. — SERVAIS, Geruch d. Lebertr. Chem. Rev. d. Fett. usw. 1903, 231. — LIVERSEEGE, Analyst 1904. — GARCANO, Rev. intern. de fals. 11, 92 (1898). — MOREAU ET BIÉTRIX (Ist L., der sich bei 0° trübt, gefälscht?), Union pharm. 1905, 385 (Pharm. Zeit. 1905, 834). — VREVEN, Ann. pharm. 1906, 117. — EBERLE, Oxydat. d. Lebert. Diss. Bern 1893. — BARTHE, Bull. sc. pharm. 1905. — PROCTER u. BENNET (Bromzahl), Journ. soc. chem. ind. 25, 798. — HUSEMANN-MOELLER, Lebertran in Real-Encyclop. d. Pharm.
Jod: HOPFER DE L’ORME, Hufelands Journ. 1836. — GIRARDIN ET PREISSER, Journ. pharm. chim. 1, 504. — WACKENRODER, Ann. Pharm. 32 (1837), 170. Arch. Pharm. 120 (1852) 23. — NADLER, Schweiz. Zeitschr. f. Pharm. 1862, 77. — SCHAPER, Wittsteins Vierteljahrschr. 18 (1869) 359. — M. BIRD, Does cod liver oil contain 0,05% of Iodine? Pharm. Journ. 12 (1882) 641. — CARLES, Repert. 1882 (Pharm. Journ. 12 [1882] 604). — RIEGEL, Arch. Pharm. 70 (1852) 18 (Journ. ph. 22, 79) — ANDRES, Pharm. Zeitschr. Rußl. 28, 145. — STANFORD, Chem. News 48, 233. — HEYERDAHL, Chem. Centralbl. 67, I, 171. — JUNG, Lieb. Ann. 48, 362. — DE JONGH a. a. O.
Über das Jod bei Meerestieren und Pflanzen vgl. auch SARPHATIS, Preisschr. in Buchn. Rep. 59 (1837) 303. 250000 bis 1000000 T. Meerwasser enthalten 1 T. Jod. Der Gehalt und die Art der Bindung ist verschieden, letztere ist teils organisch, teils anorganisch (GAUTIER).
Verfälschung. Als Verfälschung des Dampfdorschlebertran kommen außer den schlechten Dorschtranen in Betracht:
1. Leberöle von anderen Gadusarten, wie z. B. das des Schellfisch und des gewöhnlichen Dorsch (S. 644), des Sej und Köhler. 2. Leberöle anderer Fische, wie das des Brosmen, Leng, Seehecht, Glattrochen, Eishai und japan. Hai, Thunfisch und Meerengel (vgl. S. 648). 3. Fischöle von den oben S. 648 aufgeführten Fischen, besonders Menhaden- und Sardinenöl. 4. Trane von den S. 663 aufgeführten Fischen, besonders Robben-, Walfisch-, Delphin- und Dugongtran. 5. Vegetabilische Öle (Sesam, Lein, Rapa, Cotton usw., nach BISHOP auch Arachis). 6. Mineralöle (PÖHL, bis 30% BAUMANN).
Die Konstanten der Tieröle sind in der folgenden Tabelle zusammengestellt.
[S. 659]
|
Leberöle
des |
Spez. Gew.
|
Verseifungs-
zahl |
Jodzahl
|
Unverseif-
bares % |
Reichert-
zahl |
Refrak-
tion (25°) |
Hehnerzahl
|
|
Brosmen
|
0,9222–0,9264
|
180–185–05
(187,8) |
150,5–162,4
|
0,67–1,02
(4,92) |
0,32–1,9
|
67,5
|
—
|
|
Sej
|
0,925–0,9309
|
177–189
(193) |
162,2–177,9
(123–137) |
0,70–6,52
|
0,38–0,7
|
72,2
|
—
|
|
Eishai
|
0,9105–0,9186
|
146,1–164,7
|
111,9–116,6
(128,2–131,4) |
10,2–15,06
(20,8–21,8) |
0,8
|
64,9
|
86,9
|
|
Japan. Hai
|
0,9156–0,9158
|
148,5–163,5
|
128,3–136,5
|
14,1–21,5
|
—
|
—
|
—
|
|
Schellfisch
|
0,9298–0,934
|
186,3–193
|
154,2–179
(187,7) |
0,57–2,42
|
0,35–1,1
|
72,2
|
93,3
|
|
Leng
|
0,9200–0,9270
|
181,6–188
|
130,9–133
|
2,23–6,44
|
0,7
|
—
|
—
|
|
Glattrochen
|
0,9307
|
185,4
|
157,3
|
—
|
0,97
|
—
|
—
|
|
Thunfisch
|
—
|
—
|
155,9
|
1–1,08
|
—
|
—
|
95,79
|
|
Meerengel
|
0,9307
|
185,4
|
157,3
|
0,97
|
—
|
—
|
94,7
|
|
Seehecht
|
0,9270
|
—
|
—
|
—
|
—
|
—
|
—
|
|
Fischöle
von |
|
|
|
|
|
|
|
|
Menhaden
|
0,927–0,933
|
188,7–193,0
|
139,2–178,8
|
0,61–1,60
|
1,2
|
80,7
|
—
|
|
Sardinen
|
0,9279–0,9338
|
190,6–196,16
|
156,2–193,2
|
0,48–1,01
|
—
|
50–53
(45°) |
94,5–97,08
|
|
Jap. Fischöl
|
0,916–0,9338
|
198,8–193,7
|
100–171,3
|
0,52–0,86
|
—
|
—
|
95,52–97,04
|
|
Lachs
|
0,9258
|
182,2
|
161,42
|
—
|
0,55
|
—
|
95,02
|
|
Sprotte
|
0,9274
|
194,5
|
122,5–142
|
1,36
|
1,4
|
—
|
95,1
|
|
Trane
von |
|
|
|
|
|
|
|
|
Robbe
|
0,924–0,927
|
178–196,2
|
127–129,4
|
0,38–0,79
(1,05) |
0,07–0,22
|
72,7
|
92,8–95,96
|
|
Walfisch
|
0,917–0,9307
|
182,1–224,4
|
110,1–146,55
|
—
|
0,7–2,07
|
65
|
93,5–95,18
|
|
Delphin
|
0,9266
|
|
|
|
|
|
|
|
Körper
|
—
|
197,3–203,4
|
99,5–126,9
|
—
|
5,6
|
—
|
93,07
|
|
Kinnbacken
|
—
|
290
|
32,8
|
—
|
65,92
|
—
|
66,28
|
|
Dugong
|
0,919–0,9203
|
197,5–202
|
66,6–69
|
—
|
2,5
|
66,3
|
–
|
KEBLER vertritt die Ansicht, daß der amerikanische Lebertran dem norwegischen gleichwertig sei. GANE fand bei Neufundlandtran spez. Gew. 0,9275, freie Säuren 1,15%, Schmelzp. der Fettsäuren 24°, «Verseifungsäquivalent» 292, Jodzahl 164. ROUSSEL fand bei französischen Neufundlandtran (von St. Pierre und Isle aux chiens) spez. Gew. 0,9233–0,9272, freie Säure 1,0–2,6%, Verseifungszahl 109–114, Jodzahl 148,38–160,68. GANE fand bei Coast oil (s. oben S. 648) spez. Gew. 0,925–0,9265, freie Fettsäuren 2,06–3,94%, Schmelzp. der Fettsäuren 24–28°, Verseifungsäquivalent 284–301, Jodzahl 150–160. WINGÅRD fand rationell bereiteten Robbentran (von Phocaarten) nur wenig von Dorschlebertran abweichend. Er enthält mehr ungesättigte Fettsäuren. Über die Zusammensetzung der Leberöle der Adlerroche (Myliobatus Aquila) und von Centrina Salviani vgl. HUWART (Chem. Rev. d. Fett- u. Harzind. 1908, 200), über Walfischtran HEIDENREICH und WAGLE, Tidsschr. for kemi 1911, Nr. 12, über Robben- und Haifischtran TITAROWSKI und CHESNOKOW (ebenda 1910, 263), über den Tran von Lampris Luna EBERLE (Diss. Bern 1893). Über zahlreiche andere Trane HENSEVAL und HUWART (ebenda 1907, 191), über japan. Sardinenöle TRUJIMOTO (Journ. Coll. Eng. Tokio 1906); über Japantran OKADA (Chem. Zeit. 1907, 1135); über Delphintran HART (Chem. Zeit. 1908, Nr. 69).
Verfälschungen mit anderen Leberölen, Tranen und Fischölen sind namentlich in Jahren, wo der Lebertran teuer war (1902 und 1903) in größtem Umfange beobachtet worden. Sogar durch Digestion mit geräucherten Fischen «parfümierte» billige Pflanzenöle gingen einmal als Lebertran. 1907 waren farblose Lebertranemulsionen im Handel, die nur aus Robbentran bereitet waren. In gebleichten Tranen wurde Blei gefunden.
Unter dem Namen Fucol wurde (1904) ein Surrogat in den Handel gebracht, das durch[S. 660] Digerieren vegetabilischer Öle (Sesamöl) mit Seealgen (bes. geröst. Fucus vesiculos.) bereitet wurde. Ebenso findet sich ein Öl im Handel, das durch Vermischen von reinem Leberöl mit «jodiertem Sesamöl» (Jodipin) hergestellt wurde (gibt weniger Bromid!).
Lit. LEWKOWITSCH a. a. O. — BENEDIKT-ULZER a. a. O. — WEIGEL (Verf. mit Japantr.), Pharm. Centralh. 1904, 553. — WIEBELITZ, Pharm. Zeit. 1904, 513. — BAUMANN, Apoth. Zeit. 1898, 869. — KREMEL, Pharm. Post. 1884, 31. — PÖHL (Mineralöl), Pharm. Post. 1888, 37. — GANE, Cod liver oil and its adulterations. Proc. Am. pharm. ass. 1903, MERCKS Rep. 1903, Am. Drugg. 1904. — BISHOP, Chem. Zeit. 1889, Rep. 306. — LIVERSEEGE (andere Trane), Analyst 1904, 210. Pharm. Journ. 1904, 656. — TÖLLNER (Fucol), Pharm. Zeit. 1904, 69. — Zeitschr. Angew. Chem. 1904, 397. — WINGÅRD, Svensk. farm. tidsschr. 1911, No. 10 (Apoth. Zeit. 1911, 533). — SCHAMELHOUT (Kremels Reaktion), Proc. Am. pharm. ass. 1905, 694. — TOLMAN, Journ. am. chem. soc. 1906, 388. — CASPARI, Proc. Miss. pharm. ass. 1906, 104. — HELFENBERGER, Annalen 1906. — HALPHEN, Bull. Soc. chim. France 1907, 280. — PROCTER and BENNET, Exam. of marine oils, Pharm. Journ. 77 (1906) 453. — EVANS SONS LESCHER and WEBB, Analyt. Not. 1906 u. 1907. — BAIRD, Proc. Mass. pharm. ass. 1907, 40. — KEBLER, Am. journ. pharm. 1905, 491. — THOMSON and DUNLOP, Journ. soc. chem. ind. 1905, 741.
Der vorstehende Artikel wurde von Herrn Direktor BULL in Bergen durchgesehen.
Prüfung. «Für die Bewertung von Medizinalöl liefern neben der Geruch- und Geschmackprobe — guter Tran muß milde schmecken, darf nur wenig im Schlunde kratzen und nicht bitter sein — die Säurezahl, Jodzahl und REICHERT-MEISSL-Zahl die wichtigsten Anhaltspunkte» (LEWKOWITSCH). Niedrige Säure- und REICHERT-MEISSL-Zahl, hohe Jodzahl, das ist das Charakteristikum eines guten und unverfälschten Lebertrans. Beträgt das Unverseifbare mehr als 1,5%, so können Vermischungen mit Haifisch- oder Sejfischleberöl, die beide neuerdings öfter als Dorschleberöl verkauft wurden, vorliegen (raffiniertes Haifischleberöl gab aber einmal auch nur 0,7%). Ist die REICHERT-MEISSL-Zahl höher als 0,5, so waren wahrscheinlich die Lebern nicht frisch; beträgt der Gehalt an freien Säuren mehr als 1,5%, so liegt kein Dampftran vor. Im Mittel muß die Jodzahl etwa 167 betragen (LEWKOWITSCH), nicht unter 148 bzw. 154 (WIJS). BULL und JOHANNSEN wägen das durch Brom in der Äther-Eisessiglösung entstehende Bromid der Fettsäuren. Das Öl soll etwa 32,64–37,77% Bromid liefern (Haifischleberöl gibt nur 12,7–15%). Auch der Gehalt an gesättigten Fettsäuren (nicht über c. 11%) gibt wertvolle Fingerzeige (BULL).
Die Bestimmung der Jodzahl erfordert einige Übung. — Die leichte Abscheidung von in Benzol und Äther sehr schwer löslichen Bromiden aus Fischtranen benutzten EISENSCHIML und COPTHORNE (Chem. Rev. d. Fett- u. Harzind. 1910, 107) sowie MARCUSSON und HÜBER (ebenda 1911, 114) zum Nachweis dieser in Pflanzenölen. Unterscheidung der Trane nach der Löslichkeit ihrer Natronseifen in Wasser ist von BOEGH und THORSEN 1904 vorgeschlagen worden. Während 100 Teile siedender Alkohol 7 Teile Lebertran lösen, lösen sie 15 Teile Robbentran und 50 Teile Walfischtran (SCHÄDLER).
Der sichere Nachweis einer Verfälschung des Morrhuaöls mit anderen Leberölen ist nur selten möglich, etwas leichter läßt sich eine Beimengung von Fischölen und Tranen ermitteln (s. die Tabelle S. 659). Zum Nachweise pflanzlicher Öle ist Bestimmung des Schmelzpunktes der Stearine empfohlen worden (SALKOWSKI, BÖMER).
Aufbewahrung. Da Ol. jec. wegen der großen Menge ungesättigter Fettsäuren leicht Sauerstoff aufnimmt und besonders am Licht ranzig wird — es schmeckt alsdann abscheulich — ist es in ganz gefüllten kleinen Gläsern (H. MEYER), vor Licht und Wärme geschützt, aufzubewahren — jedenfalls nicht in halbgefüllten Fässern. Beim Ranzigwerden entstehen wahrscheinlich auch Oxyfettsäuren. Die Sauerstoffaufnahme beträgt bei der LIVACHEschen Probe in drei Tagen in 100 Teilen: 6,383[S. 661] (JEAN) — bei Mohnöl in zwei Tagen 6,8, bei Leinöl 14,3. Lebertran hält sich um so besser, je reiner er ist. Gebleichter Lebertran ist nicht haltbar.
Anwendung. Die Wirkung des Öls beruht nur zum Teil auf dem Jod (ein mit Jod angereicherter Lebertran ist als Ol. jec. jodatum in Benutzung), hauptsächlich aber wohl auf den vom Magen leicht emulgierbaren, daher gut verdaulichen Fetten. Der Magen nimmt von ihm viel mehr an als von anderen Fetten. Fischfette enthalten übrigens mehr Kohlenstoff (s. oben) als die Fette der Wiederkäuer. Lebertran ist jedenfalls ein vorzügliches, die Ernährung unterstützendes, den Kräftezustand hebendes Mittel. «Er ist ein geeignetes Mittel, um Kranken mit schwacher Verdauung in ausreichendem Maße Fett für die Ernährung zuzuführen» (SCHMIEDEBERG). Er besitzt eine hohe Verbrennungswärme (s. oben). Er wird Kindern jetzt gern in Form einer Emulsion gegeben, der meist in Nachahmung der SCOTTschen Emulsion Hypophosphite zugesetzt werden. Doch ist es nicht leicht, eine bei jeder Temperatur und langem Liegen haltbare Emulsion zu erhalten. Die Herstellung einer solchen mittelst eines Auszuges einer Saponindroge oder eines Saponins erscheint mir unzulässig, da die Saponine nicht harmlose Substanzen sind. Bei der Bereitung der Emulsion kommen u. a. Zucker, arabisches Gummi, Tragant, Caseïn (LÉGER), Pancreatin (DEFRÊNE) und Carrageen (BARBI) in Betracht.
Geschmackkorrigentien sind: Bittermandelöl, Zimtöl, Anisöl, Zitronenöl, Pfefferminzöl — Ausspülen des Mundes mit Pfefferminzwasser sowie Pfefferminzplätzchen empfahl schon SCHERER 1822 — Saccharin, Chloroform, Essigäther, Sardinen, Kaffee, Mischen mit Arak, Rum oder Bier, Nachtrinken von süßem Wein, Nachkauen von Brotrinde oder grünem Käse, oder man erwärmt den Lebertran im Eßlöffel, bis er dünnflüssig wird (auf c. 45°C). PAVESIS «desodorierter» Lebertran wird durch Erhitzen mit gemahlenem Kaffee und Kohle erhalten.
«Fester Lebertran» kann durch Vermischen der Lebertran-Eiweißemulsion mit Cacao erhalten werden (SZIGETI und SZILÁW), auch durch Zusammenschmelzen mit Walrat. Andere feste Arzneiformen in Real-Enzyklop. d. ges. Pharm.
Der Lebertran mit Malzextrakt und der moussierende sind von DIETERICH eingeführt. Man mischt ihm auch Eisen, Phosphor, Chinin, Kreosot bei.
Sog. Lebertranersatzmittel sind das Butyromel, Jecorin (BERKENHEIER), Lipanin (Gemisch von Olivenöl und Ölsäure, MERING). Der Lebertran ist aber durch nichts zu ersetzen. Er ist ein sehr wertvolles Arznei- und Nährmittel. MACKENZIE, ein begeisterter Verehrer des Lebertrans, behauptet (Chem. Drugg. 1899, 697), daß sich das mittlere Lebensalter der Europäer seit dem Gebrauche des Lebertrans um 2–8 Jahre verlängert habe (?). Immerhin ist zu bemerken, daß, wie neuere Untersuchungen (1911) von WINGÅRD und klinische von WILKENS gezeigt haben, rationell bereiteter Robbentran (Ol. phocae medicinale) dem Dorschlebertran ebenbürtig ist. Er weicht auch chemisch nur wenig von diesem ab.
Die technischen Leberöle werden in der Lederindustrie (Sämischgerberei), als Schmiermittel usw. benutzt.
Geschichte. PLINIUS berichtet, daß das Fett aller Fische mit Honig ein gutes Augenmittel sei und das Volk benutzt das Äschenfett (von Salmo Thymallus) noch heute zum gleichen Zwecke. PLINIUS erzählt auch (31, 27): «Einige rösten die Leber des Delphins in einem irdenen Geschirre so lange, bis ein ölartiges Fett darausquillt und hiermit reiben sie ein». Eine innerliche Anwendung des Fischleberöls war den Alten unbekannt, obwohl sie sowohl die Lebern von anderen Tieren wie mehrere Fische arzneilich anwendeten. In den hippokratischen Schriften wird Seehundstran als Riechmittel bei Hysterie empfohlen. Auch das Mittelalter beachtete den[S. 662] Tran nicht. Der Codfisch des Nordens wird schon in EIGILS Sage (930 n. Chr.) erwähnt. Jedenfalls seit dieser Zeit erscheint er Jahr für Jahr an der norwegischen Küste. Tran und getrocknete Fische wurden seit c. 1000 n. Ch. nach England exportiert. Die Grönländer, Lappen und Eskimos benutzen den Lebertran seit undenklichen Zeiten. LEMERY kennt 1721 nur das Äschenfett, POMET und VALENTINI beschreiben den Walfang und erwähnen den Walfischtran von Grönland, Spitzbergen, den Besitzungen der Holländer im Eismeer und Bergen. Seit Jahrhunderten werden Dorschzähne in Frankreich bei Bluthusten benutzt.
PERCIVAL empfahl 1783 in dem London Medic. Journal VIII, 393 das «Tranöl» bei chronischem Rheumatismus. Ihm folgte BARDSLEY 1807 (Medic. Reports 18). Schon damals stand das Öl in Lancashire in großem Ansehn. KAY, PERCIVAL und BARDSLEY behandelten Gicht, Rheumatismus, Skrophulose und Hautausschläge mit Fischtran und schon BARDSLEY erkannte seine fettbildende Wirkung. Auf dem Kontinent wurde Lebertran 1822 durch Hofrat SCHERER in Siegen in der Schrift: «Erfahrungen über die großen Heilkräfte des Lebertrans gegen chronischen Rheumatismus» (HUFELANDS Journ. der prakt. Heilk. 1822, 6, 31) als souveränes Rheumatismusmittel, von anderen auch als Laxans, Diaphoreticum und Diureticum und 1825 bei Phtise empfohlen. SCHERER bedauert, daß der Lebertran in den Apotheken fehle und man ihn von Krämern und Gerbern beziehen müsse. Er empfiehlt seine Aufnahme in die Pharmakopoee. Als Ol. morrhuae erscheint der Lebertran denn auch bereits in der Pharmac. borussica IV (1827), als Ol. jecoris Aselli in der Ph. hassiaca von 1827 (SCHELENZ). POSSELT erwähnt 1828 «Gichttran», ohne Erwärmen durch Abtröpfeln von Gadus callarias gewonnen. In Frankreich führte ihn CARRON DE VILLARS 1837 ein (HUSEMANN). In England kam er durch TAUFLIED (London med. gaz. 1840) und BENNET (1841) in Aufnahme. Noch 1839 wurden in Londoner Apotheken frische Dorschlebern gehalten. Erst 1841 wurde dort Neufundlandtran eingeführt. Weit verbreitet war die Schrift von HERM. KLENCKE, Der Lebertran als Heilmittel, Leipzig 1842 (auch franz. [Anvers.] und holländ. 1843).
Die erste Untersuchung des Trans finden wir schon bei CHEVREUL (Rech. chim. sur l. corps gras d’orig. anim. Paris 1823). Ferner beschäftigten sich mit ihm WURZER (Buchn. Rep. 21, 122), MARDER (Pharm. Centralbl. 1837, 536, Arch. Pharm. 32 (1830), 90 und 1838, 153) und HERBERGER (ebenda 1839, 854) — besonders aber L. J. DE JONGH (Disquisitio comparativa chimico-medica de tribus olei jecoris aselli speciebus 1843, auch deutsch und franz., sowie im Journ. f. pract. Chem. 19, 151), der dadurch mit MULDER (Scheik. ondez. levertr.) in einen Streit geriet. DE JONGH brachte auch selbst einen besonders reinen Tran in den Handel, der damals eine große Rolle spielte.
Seit etwa 70 Jahren wird der Lebertran, seit Jahrhunderten Volksmittel in Skandinavien, in England als Nahrungsmittel benutzt (Chem. Drugg. 1910, 51). Noch zu PEREIRAS Zeiten kam er aber ausschließlich aus Neufundland, wo er damals noch in der gleichen Weise wie dies PENNANT 1792 in seiner Artic zoology beschreibt, gewonnen wurde: Man warf die Lebern in Fässer, die unten ein mit Fichtenreisern verstopftes Loch besaßen und stellte diese in die Sonne. Das beim Faulen der Lebern ausfließende Öl wurde unten aufgefangen. Doch kochten auch damals schon die Fischer in Newhaven bei Edinburgh die Lebern in eisernen Töpfen aus und filtrierten das Öl durch ein Tuch mit etwas Sand (BENNET). In der Mitte des XIX. Jahrh. war Lebertran das bei Skrophulose am häufigsten angewendete Mittel und da man in jener Zeit alle etwas schwächlichen Kinder für skrophulös hielt, hat fast die ganze damals aufwachsende Generation oft wochenlang den gefürchteten Tranlöffel täglich an den Lippen gehabt. — Ein Patient erhielt einmal 265 Pfund in 6 Monaten! — Ich denke noch heute mit Schaudern daran. Denn der ganz leidlich schmeckende Dampftran war damals noch nicht erfunden! Erst 1853 begannen in Norwegen die ersten Versuche, Lebertran mit Hilfe von Dampf darzustellen; im größeren Maßstabe geschah dies aber erst seit 1890. Anfang der sechziger Jahre erschien des Kaufmanns BASCHIN heller Tran im Handel. Es war PETER MÖLLER, der 1853 die Methode, aus frischen Lebern mit Hilfe von Dampf helle Trane darzustellend, erfand (PETER MÖLLERS Steam process). Während er 1853 kaum 20 Barrels Dampftran erhielt und auch diese kaum an die an dunkle Trane gewöhnten Händler absetzen konnte, wurden 40 Jahre später schon 30000 Barr. erzeugt. 1893 bestanden schon 52 Dampftran-«Fabriken», richtiger «Kochereien».
In Neufundland fischen die Franzosen seit 1533, besonders seit unter SULLYS Protektion eine Kolonie in Canada gegründet wurde, gingen jährlich über 100 Schiffe hinüber. Trotzdem[S. 663] der Utrechter Vertrag die Rechte Frankreichs stark beschnitt, sehen wir noch 1792 jährlich 210 französische Schiffe dort dem Fang obliegen. In Labrador wird der Dorsch seit 1869 gefischt. 1889 begann man auch in Amerika in größerem Maßstabe Dampftran darzustellen. 1890 errichtete NIELSEN eine Fischzuchtanstalt auf Dildo in Neufundland. (Rapp. s. la propagat. artific. de la morue 1892). Auch in Norwegen und Canada sind Zuchtversuche gemacht worden. Künstliche Brut wurde zuerst 1878 in Gloucester versucht. 1899 wurden dort bereits 100 Mill. Eier künstlich ausgebrütet (Merck. Rep. 1899).
Der Grund, warum sich die hellen Dampftrane nur langsam einführten, lag daran, daß man lange Zeit glaubte, daß die von GAUTIER und MOURGUES 1890 in den dunklen Tranen entdeckten Alkaloide die wirksame Substanz sind, was aber keineswegs der Fall ist. Lebertranemulsionen erwähnt schon PEREIRA: «Doch tritt bei ihnen der unangenehme Geschmack nur noch mehr hervor». 1843 empfahl DESCHAMPS (Gaz. d. hopitaux No. 49) eine Lebertranseife, DUCLON 1846 einen Lebertransirup, später POHL Gelatinekapseln; 1860 erschien JEANNELS Eisenlebertran. Den größten Einfluß auf die Lebertrantherapie gewann aber die zweifellos vortreffliche SCOTTsche Emulsion.
KOPP (bei DIERBACH) vermutete Jod im Tran und der Apotheker HOPFER DE L’ORME wies es 1836 nach (Lieb. Ann. 21 (1836) 73 und Hufel. Journ. f. prakt. Med.), was WACKENRODER, BRANDES, BLEY, MARCHAND und GMELIN (Ann. d. Pharm. 30, 1839 321) bestätigten. Das Brom fand DE JONGH, ALLEN 1885 das Cholesterin. Die Bildung von «Propylamin» beim Destillieren mit Kali beobachtete schon WINCKLER (1852). Während die nach der älteren Methode bereiteten gefärbten Trane infolge der beigemengten Fäulnisprodukte schlecht schmeckten und Aufstoßen hervorriefen, sind die nach dem PETER MÖLLER-Prozeß (s. oben S. 651) bereiteten hell und schmecken besser. Die von Peter Möller 1857 geäußerte Vermutung, daß der Lebertran, da er ganz anders wirke als andere Öle, andere Fettsäuren enthalten müsse als die übrigen Fette, hat sich durch die von PECKEL MÖLLER 1880 inaugurierten Untersuchungen HEYERDAHLS als richtig erwiesen.
Lit. FLÜCKIGER, Lebertran in Fehlings Handwörterbuch. — KÖNIG, Isis 1895. — SCHELENZ, Gesch. u. wirtschaftl. Bedeut. d. Lebertrans. Pharm. Zeit. 1899, 331. — PECKEL MÖLLER a. a. O.
c) Trane.
Die eigentlichen Trane werden aus dem Speck oder auch aus dem ganzen Tiere ausgeschmolzen. Sie bestehen fast ausschließlich aus Glyceriden, einige (Delphin-, Meerschweintran) enthalten auch Walrat. Sie sind für uns nur als Verfälschungsmittel des Lebertrans von Interesse (vgl. die Tabelle S. 659), dürften aber medizinische Beachtung verdienen (vgl. S. 661).
Hierher gehören der Robben- oder Seehundstran von Phoca vitulina, groenlandica, lagura, caspica etc., der Walfischtran von Balaena mysticetus (der echte Wal), B. australis, Balaenoptera longimana, borealis. Das Schildkrötenöl von Thalassochelys corticata, das Dugongöl von den Seekühen, Halicore australis und indicus, der Delphintran von Delphinus globiceps und der Meerschwein- oder Braunfischtran von Delphinus phocaena.
2. Öle von Landtieren.
Die Öle der Landtiere ähneln den nichttrocknenden vegetabilischen Ölen. Sie geben relativ niedrige Jodzahlen, absorbieren nicht leicht Sauerstoff und liefern harte Elaidine. Sie spielen in der Medizin eine untergeordnete Rolle. Es gehören hierher zunächst die sog. Klauenöle, das Schafpfoten- oder Hammelklauenöl, das Pferdefußöl und das Ochsenklauenöl, dann das Eieröl (aus Eidotter) und die flüssigen Öle, die aus Schmalz und Talg durch Auspressen erhalten werden (s. bei Adeps und Sevum).
III. Vegetabilische feste Fette und solche enthaltende Drogen.
Die Vertreter dieser Klasse von Fetten sind in der gemäßigten Zone fest, wie z. B. die tropischen Fette (Cacao, Cocos), oder von Salbenkonsistenz, wie die Fette der Subtropen (Laurus), jedenfalls nicht flüssig (s. oben S. 548). Je weicher sie sind, um so mehr enthalten sie gewöhnlich ungesättigte Fettsäuren (Ölsäure, Linolsäure).[S. 664] Für einige (Cacao, Muskat) war früher die an die Konsistenz erinnernde, jetzt als irreführend verlassene Bezeichnung «Butter» in Gebrauch.
1. Myristinsäuregruppe.
Die Vertreter dieser Gruppe enthalten Myristin, den Glycerinester der Myristinsäure CH3(CH2)12COOH (vgl. S. 546). Die Myristinsäure ist im Pflanzenreiche weit verbreitet, besonders aber bei den Myristicaceen zu finden. Nachgewiesen ist sie z. B. in Myristica fragr., M. surinamens., M. Otoba, M. Bicuhyba u. and., Virola surinamensis und venesualensis; ferner im Cocos-, Palmkern- und Dikafett, sowie im Walrat (NÖRDLINGER, REIMER, WILL, THOMS, MANNICH). Aus den Virolafetten läßt sich die Myristinsäure leicht darstellen (REIMER und WILL).
Semen Myristicae, Macis und Oleum myristicae.
Syn. Nux moschata, Nucleus moschatus, Sem. nucistae, Muskatnuß, Moschatennuß, Bisamnuß, Macisnuß, noix (de) muscade; die Pflanze muscadier (franz.), nutmeg (engl.) — notemuskaat, notmuskaat, noten (holl.) — noce moscada (ital.) — nuez moscada (span.) — muskot träd (schwed.) — muscadnöd (dän.).
Der Arillus, die Macis: Muskatblüte, Macisblüte, Muskatblume (so noch in Preislisten 1911 [!], trotzdem der Sachverhalt seit 700 Jahren bekannt ist). Fleur de muscade (franz.) — mace (engl.) — macio (span.) — folie, foelie (holl.) — Arillus myristicae, Flores macidis. Macis wird jetzt meist als Femininum behandelt (als Masculinum bei CLUSIUS in Exoticorum libr. 1605 und in GARCIA Aromat. 1593).
sansc.: jáji-phalam, jatiphala (phalam im Pali = Frucht), hind.: jáé-phal, jaiphal (Macis: ápatri) (weitere vorderind. Namen in Pharmacogr. indica und in WATT, Dict. econ. prod.); mal. pala (die Frucht: bua pala) in Atjeh: bak pala (weitere indische Namen bei DE CLERCQ). — arab.: jouzbuvá, jauz-ut-trib, ganz būwa oder ǧauz bauwa (Macis: basbás, bisbasa) — pers. jouzbóyah (Macis = bazbáz) — chines. Muskatnuß: juh-tau-kʾau oder jou tou kʾou (tou kʾou = Cardamom), Macis: jou tou hua (jou = fleischig, hua = Blume.)
Bei SIMON SETH: κάρυον αρωματικόν. — Bei MYREPSUS: μοσχοκάρυδον, κάρυον μυρεψικόν. In den Glossae iatricae: νώς μυριτζικά μοσχοκάριδα. Bei den späteren Griechen auch: νούκη μοσχάτα, νάσκαφτον (weitere bei LANGKAVEL). — Im alten Indien: jâti-kôça = dschati-kosa (Macis: dschati-patra). Daß sie sich von Indien westwärts durch den Handel verbreitete, zeigt die Aufnahme des indischen jâti-kôça in das Syrisch-Aramäische (LAGARDE, LÖW). — Bei AHROUN: jeusbane — bei AMRÂN: Macis: adaches — bei AVICENNA: jausiband (Macis: befbase) — bei SERAPION: jeuzbeve, jusbegue, jumbague (Macis = bisbese) — bei AVERRHOËS: geoza (Macis: besbese) — bei IBN BAITHAR: djouz bou (Macis: besbassa). — Macis bei den alten Arabern, z. B. AVICENNA: bisbese, besbâssa befbase (später, z. B. von SERAPION mit thaliphaphar, thâlisfar, talifar [= Halarrhena antidysenterica] zusammengeworfen). — Bei CONSTANTINUS AFRICANUS: nux muscata. — Bei ALBERTUS MAGNUS: muscata. — Bei der HILDEGARD: nuz muscata. — In der Alphita: nux miristica, cayon mirifica. Bei BARTHOLOMAEUS: nux mirifica. — In den Tabulae: nux muscata. — In den Synonyma Serapionis: jeumbave, jumbague. — Bei ACTUARIUS: nux unguentaria, quam myristicam adpellant. — In den dänischen Urteböger (I, S. 684): nux moscata und matae, muscatan blomae. — Bei MEGENBERG: matzenpaum, muskatpaum. — In den mittelenglischen Medizinbüchern: lichebane, nux mustica, macys. — Im Gothaer Arzneibuch: muscate, muschate, muscatenblome, muschatenblome. — Bei HARPESTRENG: nux moscata (Macis: muscatae blomae, matae). — In der Ordinancie van der Dumwagen (XIV. Jahrh.): musschaten und musschaten bloymen. — In The forme of cury (1380): noiez mugedez. — Im niederdeutschen Arzneibuch (XIV. Jahrh.): muschate. — Bei HANS FOLCZ (1485): muscat plue (= Macis). — Im Inventar LEFORT (I, S. 805): noys muguette, massis und uille de musterlin. — In den Droits de[S. 665] courtage etc. (XV. Jahrh.): nois muguettes und massiz. — In der Frankfurter Liste (I, S. 812): nuces muscati und maces. — Bei MARCO POLO (1295): noci moschiate. — Im Roteiro des VASCO DA GAMA (I, S. 814): noz nozcada. — Bei ACOSTA: jauziband, seygar. — In Ricettario fiorentino (I, S. 793) noce moscada. — Bei LEVINUS LEMNIUS (De miraculis occultis naturae 1567): nux myristica seu moschata. — Bei RUMPF: gjauz-bawa (Macis: besbase).

(Links Zingiber, rechts die riesige Elettaria speciosa.) Um die Größenverhältnisse zu zeigen, ist mein malaiischer Diener mit aufgenommen.
[Tschirch phot.]
Etym. Myristica, zuerst bei PETRUS D’EBULO (1191), von μυριστικός = balsamisch, (μύρον = Balsam, d. h. ein wohlriechender Saft (der βαλανός μυρεψική des DIOSKURIDES und CELSUS ist sicher nicht zu deuten) — fragrans = wohlriechend — muscata zuerst bei CONSTANTINUS AFRIKANUS, muscat schon im PARCIVAL; dies wie das mhd. muscait, muscart, mnd. muschade, muscatenblome, das franz. muguette, musguette von moschatus, was aber mit Moschus nichts zu tun hat. Die Worte muscatum, moschatum, moschelinum, wurden für etwas wohlriechendes lange bevor die Muskatnuß bekannt war, benutzt (z. B. schon bei ORIBASIUS). Sie wurden dann auf sie übertragen. In Byzanz erhielt das Gewürz — aber nicht wegen der Ähnlichkeit des Geruches, wie SCHRADER meint, denn die besteht nicht — den Namen μοσχοκάρυδον, woraus latein. nux moschata, mhd. nuzmuscata (bei der HILDEGARD) muskât (bei MEGENBERG) wurde. — Das pers. gauz-i-buya (jouz bóyah) bedeutet wohlriechende Nuß. Das arabische jausiband heißt Nuß von Banda. — Unter nuces indicae wurden früher bisweilen Muskatnüsse verstanden, später dann aber (außer der Nuces vomicae und den Arecanüssen) die Cocosnüsse (s. d.), die wohl auch als nuc. ind. grandis (z. B. bei NICOLAI) unterschieden wurden; nach WARBURG ist die nux indica (avellana de la India) wahrscheinlicher Moringa oleifera. Bei CORDUS heißt die Muskatnuß nux indica moschata (und moschocaryon). — Im botanischen Sinne ist die Muskatnuß keine Nuß, d. h. keine Schließfrucht, nicht einmal der ganze Same, sondern nur der Samenkern. Der korrekte Name wäre also Nucleus seminis myristicae. — Macis umgebildet aus Macer (macir, machis, machir, μάκειρ). Im Altertum (SCRIBONIUS LARGUS, DIOSKURIDES usw.) bedeutete dies die Rinde von Ailanthus malabarica DC. in der früharabischen Zeit (RHAZES) wohl auch die Wurzelrinde von Holarrhena antidysenterica WALL. (Wrightia antidysenterica GRAH.), erst vom XI. Jahrh. an den Muscat-Arillus. — Das holl.: foelie, fuly (im Dordrechter Zollerlaß 1340: foelghen) = Macis, ist wohl zu folium, feuille zu stellen (oder altportugiesisch soviel wie Blüte?). — Muskatbutter heißt im mal. minjak pala. Minjak ist die mal. Gruppenbezeichnung für Öl und Fett. pala (mal.) wohl von ind. (pali) phala = Frucht par excellence.
Stammpflanze und Systematische Stellung. Die Banda Muskatnuß, die Bandamacis und das Ol. myristicae werden geliefert von:
Myristica fragrans HOUTTUYN, Hist. nat. II, 3 p. 333 (1774) (M. officinalis L. f. [non MART.] 1781, M. moschata THUNBG. 1782, M. aromatica LAM. 1788).
Myristicaceae (Myristica) Eumyristica.
Von den 235 Arten der Familie gehören 179 dem südlichen Asien bis Papuasien, 38 Südamerika, 11 Afrika, 4 Madagaskar, 2 dem trop. Australien, 3 Polynesien an (WARBURG). Aber dauernd aromatisch sind die Samen und Arillen nur einiger weniger auf die Molukken und Papuasien beschränkter Arten.
Beschreibung der Stammpflanze. Der meist ein Alter von 60 (selten 80 bis 100) Jahren erreichende Baum, der in seinem in der Jugend pyramidenförmigen Wuchs, wie schon RUMPF und VALENTIJN ganz richtig angeben, einem Birnbaum gleicht, d. h. er ist in der Jugend mit pyramidaler (Taf. XIX), im Alter mit breiter Krone versehen — JAGOR sagt, er hält die Mitte zwischen Lorbeer und Orange, BARBOSA beschreibt ihn als lorbeerartig, auch ALBERTUS MAGNUS gebraucht diesen Vergleich — wird in den Molukken 12–18 (je 20) m hoch. «In ihm kommt nicht die tropische Fülle und Kraft zum Ausdruck, wie in den Feigenbäumen, den Palmen und Dipterocarpen, er bleibt auch im Alter zierlich und klein» (TSCHIRCH). Die Verzweigungen beginnen in einer Höhe von 5–6 m. Beim Anschneiden des Stammes und der Zweige fließt ein roter Saft aus, der zu einem Kino erhärtet (TSCHIRCH 1888).[S. 666] Die kahlen, immergrünen, ganzrandigen Blätter sind länglich-elliptisch oder ei-lanzettlich, kurzgestielt, meist c. 8–12 cm lang und laufen in eine lange Träufelspitze aus. Sie enthalten Ölzellen, erscheinen daher durchscheinend punktiert. Die der Befruchtung durch Insekten angepaßten Blüten sind diklin-diözisch, doch ohne scharfe Scheidung: an den weiblichen Bäumen finden sich besonders in der Jugend oft männliche, an männlichen da und dort auch weibliche Blüten (WARBURG). Die weiblichen bilden meist zweistrahlige, in den Blattachseln stehende Cymen, die nickenden männlichen reichere Infloreszenzen, Dichasien mit traubenartigen Endgliedern. Beide ähneln der Maiblume. Ihr sympetales, c. 6 mm langes, glockenförmiges Perigon ist bleichgelblich und hat 3–4 Zipfel und an der Basis eine Bracteola. Sie duften sehr lieblich, orangenartig (TSCHIRCH), etwas an Jasmin erinnernd (HOOKER). Doch habe ich in Java nicht bemerkt, daß man einen blühenden Baum auf weite Strecken hin riecht. Doch das mag wohl dort, wo tausende beieinander stehen, sich anders verhalten. Die männlichen Blüten führen eine zentrale, aus 9–16 Staubfäden monadelphisch verwachsene Staminalsäule, die weiblichen einen gestreckten, mit zweispaltiger Narbe versehenen, aus einem Carpell gebildeten, dickschaligen, außen rostroten Fruchtknoten, in dem sich ein basal angeheftetes Ovulum findet. Die einfächerige, einsamige Frucht ähnelt einem glattschaligen Pfirsich (WARBURG) oder einer Quitte (PIGAFETTA).
«Die pfirsichgroßen, eirunden, lichtgelben Früchte lugen freundlich aus dem frischen Laube hervor und der aus der aufgeplatzten Frucht hervorleuchtende, lebhaft rote Arillus, der sich wirkungsvoll von der tiefbraunen Samenschale abhebt (Fig. 211), fügt dem Bilde eine neue, kräftige Farbe hinzu. Fast das ganze Jahr ist der Baum mit Blüten und Früchten bedeckt» (TSCHIRCH, Indische Heil- und Nutzpflanzen). BIRKMORE nennt sie die bei weitem schönste Frucht des ganzen Pflanzenreichs. Der Baum beginnt im 8.-9. Jahre zu blühen. Der Höhepunkt des Ertrages wird im 14.-16. Jahr erreicht. Die Bäume können bis ins 60., ja 80. Jahr tragen. Die Blüte reift in 9 Monaten zur Frucht (een noteboom staat in al zijn ontwickelings-perioden aan den mensch gelijk VAN GORKOM). In Banda kommen auf 100 weibliche Bäume etwa 2–3 männliche. 1% genügt zur Sicherung der Befruchtung (DE STURLER). Man läßt aber meist mehr als Windbrecher stehen. Das Aufspringen der Früchte erfolgt durch Spannungen im Perikarp, die Einleitung durch ein kleinzelliges «Schwellgewebe» an der Basis des Perikarps und an der Basis des Samens, die Erweiterung des Spaltes durch den Arillus (JANSE).
Der Arillus ist biologisch als Anlockungsmittel für Vögel zu betrachten, die ihn verspeisen, den Samen verschlucken und so verbreiten. Beim Aufspringen der Frucht wirkt er nicht primär (BAILLON), sondern nur sekundär (JANSE) mit. Die Samen von Myristica fragrans werden durch Vögel verbreitet, besonders durch die mit metallisch glänzendem Gefieder versehenen Waldtauben Carpophaga (Columba) aenea und C. perspicillata TEMM., die auf den Bandainseln noteneeter (= Nußesser) oder burong pala (= Muskatvogel) genannt werden (Myristicovora, Casuarius, Megapodius, Buceros verbreiten die Samen anderer Arten und kommen für M. fragr. nicht in Betracht).
singt schon CAMOENS (Deutsch von WOLLHEIM DA FONSECA).
[Mit Benutzung der Karte von Warburg, gez. von Tschirch.]
Die Tauben verschlucken, angelockt durch den lebhaft gefärbten Arillus, entweder die Samen und geben sie mit den Exkrementen wieder von sich (RUMPF, VALENTIJN) oder bringen sie nur in den Kropf (MOSELEY, FORSTER) und speien sie nach einiger Zeit wieder aus. Jedenfalls keimen Samen, die diese Behandlung durchgemacht haben, gut, während sonst der Myristica-Same rasch, z. B. schon durch[S. 667] Trocknen, seine Keimkraft verliert, was, wie ich gezeigt habe, darauf beruht, daß hierbei das sehr weiche Gewebe des Keimlings rasch schrumpft und die in den Leitbahnen steckenden Endzipfel der Cotyledonen abreißen. Denn die Keimung erfolgt in der Weise, daß die beiden Cotyledonen, als Saugorgane fungierend, sich auf den Leitbahnen (s. S. 679) vorwärts schieben und allmählich das ganze Endosperm durchwachsen und aussaugen (TSCHIRCH). Die Arten der Gattung Myristica zeigen einen merkwürdigen Endemismus. Die Heimat der Muskatnuß sind die Bandainseln (nutmeg isles), eine kleine, noch keine Quadratmeile große, oft von Erdbeben heimgesuchte Inselgruppe der östlichen Molukken (s. die Karte). Lontor oder Groß-Banda ist die[S. 668] größte dieser Inseln, Banda neira liegt nördlich, Rosengain östlich, Ay und Run westlich davon. Auf den eigentlichen Molukken (richtiger Malukken), wo die Gewürznelke zu Hause ist, scheint der Baum nur sehr selten gewesen zu sein. WARBURG betrachtet den ganzen inneren vulkanischen, die Bandasee umschließenden Südmolukkenkreis als die Urheimat der echten Muskatnuß (s. die Karte). Wild dürfte jetzt M. fragr. nur ganz vereinzelt zu finden sein.
Lit. HOUTTUYN, Natuurl. hist. volg. Linné II, 333 (1774) und Aamerk. over de bloem van de Noot-Moskat Maatsch. Wetensch. Haarlem 26 (1789). — THUNBERG, Acta Holmiae 1782 (deutsch 1785 in N. Abh. d. k. schwed. Akad.). — THUNBERG und RADLOFF, Diss. De Myristica Upsala 1788. — LAMARCK, Mém. s. l. genre du Muscadier Hist. d. l’ac. d. sc. 1788. — BICKMORE, Trav. in the East Indian Archipel. 1868, 225. — WALLACE, The Malay Archipel. 1869, 452. — BERNSTEIN, Peterm. geogr. Mitt. 1873, 209. — PRANTL, Myristicac. in ENGLER-PRANTL, Pflanzenfam. — WARBURG, Ebenda, Nachträge. — WARBURG, Z. Charakt. u. Glied. der Myr. Ber. d. bot. Ges. 1885 und Monogr. d. Myristicac. Nov. Act. Leop. Car. Ac. 68. — HOOKER und THOMSON, Flor. ind. I. — A. DE CANDOLLE, Santalaceae et Myristicaceae. 9 tab. Lips. 1860. — A. DE CANDOLLE, Note sur la fam. d. Myristicac. Ann. sc. nat. (4) 4, 20 und Prodromus. — EICHLER, Blütendiagr. — BAILLON, Hist. des pl. II. — KING, Spec. of the Myr. of brit. Ind. 1891.
Abbild., älteste: CLUSIUS, Exoticor. libr. 1605. — VALENTIJN, Beschrijv. van boomen, planten etc. 1726. — RUMPF, Herb. Amboin. 1743 II, t. IV. — POMET, Hist. des drog. (schlechte Abbild.) — GÄRTNER, De fructibus, 1788–91. — BLUME, Rumphia I (1835) t. 55–64 (schöne Abbild.). — WARBURG a. a. O. (4 Taf.). — TSCHIRCH, Ind. Heil- u. Nutzpfl. t. 63–65. — REICHENBACH, Ic. exot. t. 276–277. — NEES VON ESENBECK, Plant. med. t. 133. — BENTLEY-TRIMEN, Med. pl. t. 218 (dort weitere Abbild. zitiert). — PABST-KÖHLER, Medizinalpfl. t. 132. — BERG-SCHMIDT, Atlas t. 119 u. vielfach anderwärts.
Pathologie. In Trinidad werden die Muskatnüsse besonders von Trogosita mauritanica L., Trilobium ferrugineum FABR., Carpophilus sp., Laemophloeus sp., Hypothenemus sp. und Lasioderma sp. zerstört (HART). In Banda zerstört der «Muskatwurm» die Nüsse (vgl. auch unter «Kalken» S. 672).
Lit. HART, Pharm. Journ. 1894, 818 (Apoth. Zeit. 1894, 104).
Kultur und Erntebereitung. Die Droge stammt nur von kultivierten Bäumen.
Trotz der strengsten Aufsicht ist doch der Muskatbaum aus seiner ursprünglichen Heimat (s. oben S. 667) schon zur Zeit des Monopols in andere Länder gebracht worden, so z. B. nach Mauritius durch die Franzosen (POIVRE 1749 bzw. 1770), durch diese auch nach Bourbon (1772), Madagaskar und den Seychellen (1780), Sansibar und Westafrika sowie nach Cayenne; durch die Engländer nach St. Vincent 1882 (in Cayenne gestohlene Bäume!), Trinidat, Jamaica und der Antilleninsel Grenada. Aber außer auf Grenada haben an keiner dieser Stellen die Muskatbäume in größerem Umfang Fuß gefaßt. Die Kultur ist noch heute vorwiegend auf die Heimat des Gewürzes beschränkt geblieben. Nur in Sumatra, wohin schon die Engländer um 1800 die Pflanze brachten (die Insel gehörte damals der englisch-ostindischen Kompagnie) — hier besonders an der Westküste, weniger in Padang, Palembang, Atjeh und Lampong — hat sie sich gut entwickelt, dann auch auf Java, Borneo, Celebes (Minahassa), Ambon — dort und in Halmaheira hat die Kultur große Fortschritte gemacht — Ceram, Ternate. Besonders aber ist Penang, wohin sie ebenfalls die Engländer (ROXBURGH) um 1800 brachten, für die Muskatkultur wichtig geworden, weniger die übrigen Straits settlements (z. B. Singapore). Der Muskatnußbaum (Muscadeira) wurde gleichzeitig durch LUIZ DE ABREU (1809) nach Rio de Janeiro und durch MANOEL MARQUES nach Para gebracht.
Jetzt mag es (nach WARBURGS Schätzung 1897) rund 1050000 tragende Muskatbäume auf der Erde geben. Davon entfallen auf Banda c. 400000, Sumatra 190000, auf die Malaiische Halbinsel 130000, auf Minahassa 100000, auf Westindien 70000, der Rest auf Java, Ambon und Halmaheira. Es kultivieren jetzt (1911) Muskat: Auf den Molukken: die Bandainseln, Ternate, Amboina, Halmaheira, Sangirinseln;[S. 669] in Nord-Celebes: Menado (Minahassa), auf Sumatra: Benkulen, Padang, Pajakomba (Pad. Bovenland.), Deli, Langkat, Sardang, auf Borneo (wenig), auf Java (Batavia, Pamanukan) hier allenthalben auch in Kampongkultur (I, S. 48), in den Straits settlements: Singapore, Penang, Malacca, in Ceylon an verschiedenen Orten, in Vorderindien: Bengalen, in Hinterindien; in Westindien: Grenada (weniger auf Jamaica, Tobago, Trinidad, St. Lucia) und in Brasilien. 1898 hat man mit Muskatkultur in Kamerun begonnen. Die Kulturen auf Bourbon und Mauritius scheinen aufgegeben zu sein. Die meisten und besten Muskatnüsse kommen aber noch heute von den Bandainseln.
Die Muskatnußplantage heißt dort Perk (d. h. Park), der Kultivateur Perkenier. Perks finden sich jetzt besonders auf den Bandaeilands: Lontor, Neira, Ay (seit alter Zeit «das Eldorado der Muskatkultur»), Run, Rosengain (vgl. die Karte). Die Nüsse müssen bald und in der Schale ausgesät werden, da sie rasch ihre Keimkraft verlieren, am besten sogar die ganzen Früchte vor völliger Reife. Der Muskatnußbaum verlangt einen tiefgründigen, lockeren und weichen Boden mit gut durchlässigem Untergrund. Er liebt welliges Terrain (was er z. B. in Banda findet) und ein feuchtwarmes Tropenklima ohne ausgesprochene Trockenperiode. Die Bandainseln liegen 4° 32′ s. B. und haben rein ozeanisches Klima.

Muskatnußernte im Notemuskaat-Tuin mit dem an einem Stocke befestigten Gai-Gai.
[Abbild. aus dem Koloniaal-Museum in Haarlem.]
Er verlangt Windschutz. Als Windbrecher dienen besonders Canarium, Casuarina und Cerbera-Arten. Da der Baum ein Waldbaum war, gibt man ihm auch in den Kulturen gern Schattenbäume, in Banda werden in unregelmäßigen, ziemlich weiten Abständen besonders Canarium commune (Kanari) und C. mehenbethene (Kanari Ambon) zwischen die Muskatbäume gepflanzt sowie Aleurites moluccana (Kemiri), Calophyllum, Arenga, und in der Nähe der Wohnungen Fruchtbäume (Jambu, Mangostan, Durian, Tamarinde, Mango, Peté [Parkia] u. and.). In Java und Celebes wird auch der Dadap (Erythrina), sowie Albizzia moluccana als Schattenbaum[S. 670] gepflanzt, sowie Nauclea, Cananga. In englisch Indien werden dagegen keine Schattenbäume gepflanzt (der Engländer liebt es nicht, welche zu pflanzen). Zu starke Beschaltung beeinträchtigt den Ertrag. Um die jungen Pflänzchen der Plantage zu schützen, pflanzt man in Java bisweilen Bananen oder Hibiscus dazwischen (TSCHIRCH).
Gai-Gai. Körbchen mit Gabel zum Einsammeln der Muskatnüsse.

Pflückkörbchen für Muskatnüsse.
[Kew Museum, Greenish phot.]
Ein Arbeiter kann täglich 1000–1500 Nüsse ernten. Ein Baum liefert auf den Bandainseln 1–2 kg Nüsse (bei sorgfältigerer Kultur 2½ kg). Obgleich der Baum das ganze Jahr Blüten und Früchte trägt und dauernd von die Befruchtung vermittelnden Insekten umschwärmt ist, pflegt man, wie ich in Indien auf Befragen erfuhr doch nur dreimal im Jahr zu ernten («drei Klimzeiten»): Ende Juli bis Anfang August, November bis Ende März und Anfang April. Die Haupternte ist im Juli-August, die besten Nüsse liefert aber die Frühjahrsernte. In Sumatra ist die Haupternte im November-Dezember, die zweite im April-Juni. Man sammelt nur ganz reife Samen, da wie ich in Indien feststellte, das Endosperm bis fast zur Reife milchig bleibt. In Grenada läßt man die reifen Früchte vom Baume fallen und liest sie von dem vom Unkraut gesäuberten Boden auf. In Banda werden die reifen Früchte gepflückt. Etwa seit Mitte des XIX. Jahrh. bedient man sich beim Pflücken des seitlich offenen, an einem langen Stiele befestigten Pflückkörbchens (Gai-Gai, Fig. 208, auch I, Fig. 198), seltener, wie ehedem, der Holz- oder Eisenhaken. Die gepflückten Nüsse werden aus dem Gai-Gai dann in einen Tragkorb, Fig. 209, geschüttet. Das Pericarp wird auf den Bandainseln gewöhnlich an Ort und Stelle von den Sammlern entfernt und die Nüsse zweimal täglich auf der Estate abgeliefert. Hier wird noch am gleichen Abend die Macis abgelöst (mit der Hand oder einem Messer, vgl. I, Fig. 198) und dann auf Bambutellern bzw. Matten oder Hürden an der Sonne oder in Trockenhäusern getrocknet. Sobald die Macis welk geworden ist, drückt man sie mit den Händen (oder Füßen) platt. Sie ist in 2–4 Tagen trocken. Die ursprünglich lebhaft rote Farbe ist nun in[S. 671] Goldgelb übergegangen und der frisch fleischige glänzende Arillus ist matt, hornartig und brüchig geworden. Bei Regenwetter trocknet man über Holzkohlenfeuer oder dem Feuer der Schalen der Kamirifrüchte. Die Sitte, Macis durch Besprengen mit Seewasser geschmeidig zu machen, scheint abgekommen zu sein, nur geschimmelte wird noch bisweilen mit Seewasser gewaschen.

Notemuskaat-Kombuis (Trockenhaus).
[Abbild. aus d. Koloniaal-Museum Haarlem.]
Die «Nüsse» kommen in das Trockenhaus (droog kombuis, noten kombuis, Fig. 210), wo sie auf Gestellen (para-para) aus Bambu oder Sagoblattstielen, die 4–5 Fächer (pettaks) haben, etwa 1′ hoch aufgeschichtet und langsam über einem mäßigen Feuer bei höchstens 60° unter öfterem Umwenden und Herabschütten auf das nächst tiefere Fach getrocknet werden. (In Grenada werden die Nüsse in flachen Kästen mit durchlöchertem Blechboden im Schatten getrocknet.) Nach 3–6 Wochen sind sie soweit trocken, daß der Samenkern beim Schütteln in der Schale «rammelt». Hierbei stirbt der Keimling ab. Minahassa und Amboina exportiert viel Samen in der Schale (noten in dop) z. B. nach London, China, Indien. Meist wird aber, bevor die Nüsse nach Makassar, Batavia oder Singapore gehen, die Schale, die c. ¼ des Gewichtes beträgt, dadurch entfernt, daß man die Samen mit Steinen, schmalen Brettern, Stäben oder Holzhämmern aufschlägt. Die Schalen dienen als Brennmaterial. Sodann werden die Samenkerne sortiert (garbuliert, vgl. I, Fig. 198). Die Garbulatie entfernt zunächst die zerbrochenen Nüsse (stukkende Noten, broken nutmegs), dann die Rompen (die mageren Nüsse) und trennt die vetten oder gaven Noten von den middelbaren oder noch weiter nach der Größe. Nun werden die Samenkerne entweder direkt verpackt und ungekalkt, bisweilen unter Zusatz von Nelken oder Pfeffer (um[S. 672] die Insekten abzuhalten), in luftdichtem Verschluß versandt (besonders nach England) oder der Kalkung unterworfen.
Diese Kalkung, die der europäische Kontinent und Amerika verlangt, geschieht entweder in der Weise, daß man die Nüsse trocken mit gelöschtem Kalk einreibt (trockene Kalkung, früher in Singapore und Sumatra in Gebrauch) oder indem man sie in einen aus Seewasser und gebrannten Korallen bereiteten Brei einrührt (Molukken, Minahassa) und dann zum Trocknen (zweeten) ausbreitet. Früher wurden die gekalkten Nüsse noch einem Schwitzprozesse unterworfen, was, wie ich (1889) erfuhr, jetzt nicht mehr üblich ist. Es ist sicher, daß das Kalken, wenn es, wie einige meinen, den Zweck haben sollte, die Keimkraft der Muskatnuß zu vernichten, unsinnig und zwecklos ist, da die Keimkraft schon beim Trocknen erlischt. Es hat aber gar nicht diesen Zweck. Versuche, die ich mit gekalkten und ungekalkten Muskatnüssen unter Hinzufügung von lebenden Exemplaren der Sitodrepa panicea (I, S. 379), der am meisten die Nüsse zerstörenden Larve, angestellt habe, zeigten, daß das Kalken ein nahezu sicherer Schutz gegen Insektenfraß ist. Die Tiere bohrten keinen gekalkten Samen an und gingen auf diesen rasch zugrunde, während sie im Kontrollversuch die ungekalkten Samen rasch zerstörten. Dieser Versuch lieferte also den Beweis für die Richtigkeit der Ansicht der meisten neueren Beobachter, die im Kalken einen Schutz gegen Insektenfraß glaubten sehen zu müssen. MILBURN (Oriental Commerce 1813) glaubte, daß das Kalken die «Poren» schließe; REINWARDT, daß es in den Randschichten das Fett verseife. Bisweilen werden die Muskatnüsse erst in London gekalkt (HELBING). In Singapore wird in die Kisten — unnützerweise — bisweilen eine Hand voll Pfeffer geworfen. Wichtiger ist das dort übliche Auspichen der Falze (TSCHIRCH), wie überhaupt, daß Fässer und Kisten gut gedichtet werden. Dem englischen Geschmack entsprechend erzeugen die englischen Kolonien (Penang, Singapore) viel ungekalkte Nüsse (brown nutmegs). Das endgültige Sortieren der Muskatnüsse erfolgt in London, Rotterdam und Amsterdam.
Schon während der Dauer des Monopols wurden die zerbrochenen oder wurmstichigen Nüsse auf Muskatbutter verarbeitet und diese in Steinkrügen exportiert. Es geschah dies an Ort und Stelle und auch jetzt noch wird ein wenig davon auf den Bandainseln dargestellt und in Pisang- oder Palmenblätter eingehüllt in den Handel gebracht. Ich habe solche Ringel von c. 700 g Schwere 1889 aus Indien mitgebracht und noch 1894 erschienen 26 Steene (Blöcke) à 0,7 kg in Amsterdam. Das meiste wird aber in Europa (Holland, Deutschland) teils durch warmes Auspressen, teils durch Extraktion der minderwertigen Muskatnußsorten bzw. des Bruchs gewonnen. Die Darstellung der Muskatbutter erfolgt entweder in der Weise, daß man die gemahlenen Nüsse auf Haarsieben mit Wasserdampf erhitzt und dann zwischen erwärmten Platten auspreßt, das vom Wasser befreite Fett schmilzt und eventuell im Heißwassertrichter filtriert oder durch Pressen des Pulvers in erwärmten hydraulischen Pressen oder durch Extraktion mit Äther. Es ist Brauch sie in ¼, ½, ¾ oder 1 kg schweren, in Papier gewickelten Riegeln in den Handel zu bringen. Man erhält durch Auspressen der Samenkerne 20–23 (selten bis 28) % Fett — auf den Molukken nur 12–14%. Das Rohmaterial zur Muskatbutterbereitung kann mit Zollrückvergütung eingeführt werden, wenn die Herstellung des Produktes und die Vernichtung der Rückstände unter Zollkontrolle erfolgt.
Lit. REINWARDT, Reis naar het oostelijk gedeelte van den ind. Arch. i. h. j. 1821. Amsterdam 1858. — VAN GORKOM, Oostind. Cultures (auch Kultur auf Sumatra usw.). —[S. 673] SEMLER, Trop. Agrik. — TSCHIRCH, Ind. Heil- u. Nutzpfl. — LUMSDAINE, Cultiv. of nutmegs etc. in Bencoolen. Proc. agric. soc. Sumatra 1820. Pharm. Journ. II (1852) 516, CHRISTY, New Commerc. pl. — WEDDIK und TEIJSMANN, Notenmuskaat Kultuur op Java. Nat. Tijds. v. Ned. Ind. 2 (1839), 589. — SEEMANN, Hookers Journ. bot. 1852, 83. — OXLEY, Some account of the nutmeg and its cultivat. Journ. Ind. Arch. 2 (1848) 641 u. (1856) 127. — CRAWFURD, Dict. Ind. Islands 1856. — COLLINGWOOD, Nutmeg and other cultivat. in Singapore. Journ. Linn. Soc. bot. 10 (1869), 45. — EGGERS, Die neuen Gewürzinseln (in Westindien). Naturw. Wochenschr. 1890, 121. — MILBURN, Oriental Commerce London 1813. — WARBURG, Die Muskatnuß. Ihre Geschichte, Botanik, Kultur, Handel u. Verwertung sowie ihre Verfälschungen u. Surrogate. Leipzig 1897. — O. KAMMERLING ONNES, Banda nutmegs and mace. Being an account of their history, cultivation, trade and use. Amsterdam 1899. — Abbildungen des Koloniaal Museum. — J. M. JANSE, de nootmuskaat cultuur in de Minahassa en op de Banda Eilanden. Med. Slands Plant. Buitenzorg 1898. 4 Tafeln. — TSCHIRCH, Kalken der Muskatnüsse. Schweiz. Wochenschr. 1898.
Handel. Im Handel finden sich (1911) besonders Banda-Muskatnüsse, weniger geschätzt sind die von Java und Menado, sowie von Westindien. Seit den siebziger Jahren des XIX. Jahrh. produziert auch Penang, Menado und Sumatra Muskatnüsse. — Ende der achtziger Jahre schon gegen 1,5 Mill. —, die übrigen Produktionsorte siehe unter Kultur. Die Bandaernte geht meist über Makassar und Singapore. Viele Nüsse werden erst in diesen Hauptmuskathäfen (wie auch in Surabaja auf Java) aufgeklopft und gekalkt. Die ungeschälten Nüsse werden in Jutesäcken versandt, die geschälten in Kisten (zu 187 kg u. and.). Die Auslese oder eine erneute Auslese erfolgt in Amsterdam und London. Die Einteilung in gute (gave): Vette und middelbare (medium) und schlechte: magere (gerimpelte, inferior) und geinfecteerde (aangestokene, d. h. wurmstichige) sowie brokene (d. h. zerbrochene) hat sich aus der Zeit des Monopols bis heute erhalten. Die drei zuletzt genannten Sorten bilden die vorwiegend zur Muskatbutterbereitung benutzten sog. Ölnüsse (oil nuts) und gehen wohl auch unter dem Namen Rompen. Der Großhandel unterscheidet runde und längliche (diese besonders aus Westindien) Nuces moschatae majores mediae, minores. Die holländischen Marktberichte unterscheiden folgende Größen, Stück aufs kg: 150/160, 160/170, 170/180, 180/190, 190/200, 200/210, 210/220. Dies ist die teuerste Gruppe I (Preis c. 380–482 M pro 100 kg). Die zweite Gruppe umfaßt die Größen 220/230, 230/240 u. s. f. in Abständen von je 10 bzw. 20 Stück bis 380/400 (Preis c. 287–376 M). Auch der deutsche Großhandel unterscheidet bei den in Kisten à 30 oder 60 kg in den Handel gebrachten Bandanüssen die Sorten nach der Zahl der auf 1 kg gehenden Nüsse z. B. bei GROSSMANN: 160/170 — 210/220 — 240/250 — 300/320 — 350/400 Stück pro kg. Die westindischen (in Fässern à 60–70 kg) haben meist 170/180 Stück pro kg.
In Banda unterscheidet man von der Macis die Sorten E, F, und G (C und D sind nicht mehr im Handel), E ist die beste. Dann unterscheidet man noch foelie separaat (vom Typus abweichend, nicht klassifiziert) und gruis. Die Macis von Java, Padang, Menado und Penang wird nicht so sorgfältig sortiert wie die von Banda. Man unterscheidet prima, secunda und separat. Die unreife, aus der geschlossenen, vom erkletterten Baume gebrochenen Frucht herausgelöste Macis heißt Klimmfoelie (d. h. durch klettern = klimmen) erhalten. Die Macis kommt in Fässern (aus Teakholz) à 150 kg oder in Kisten à 50 kg in den Handel. Man unterscheidet im deutschen Großhandel: extrafein fleischig und prima, hell sowie Macis grus (letztere in verschiedenen Qualitäten); im englischen: gute, ganze (good, gave E, F, G) und Grus (chips, gruis).
Muskatnüsse und Macis werden in Amsterdam vierteljährlich verauktioniert, im Jahr etwa ¾-1 Mill. Nüsse und ¼ Mill. Macis. Außer Amsterdam sind Rotterdam, London und New York, weniger Hamburg Hauptmärkte. Die Gesamtweltproduktion schätzt WARBURG (1897) auf c. 2 Mill. kg Nüsse und 0,5 Mill. kg Macis; davon entfallen 37,4% auf Banda, 19,6% auf Sumatra, 12,5% auf die Malaiische Halbinsel, der Rest auf Minahassa, Ambon, Westindien, Java, Halmaheira. Singapore exportiert etwa 2500–3500 piculs Nüsse jährlich, Java 1905: 243731, 1906: 277112 kg notenmuskat und 1905: 57176, 1906: 47012 kg foelie. In Penang, das 1860 391000 kg Nüsse und 131000 kg Macis exportierte, vernichtete eine Krankheit die Bäume in wenigen Jahren. Jetzt hat sich die Produktion wieder gehoben. Ceylon exportierte 1906 nur 155 cwts nutmegs. Während zwischen 1888 und 1894 pro Jahr 485415–808400 kg echte Nüsse nach Holland kamen, betrug die Einfuhr langer nur 30345–76600 kg pro Jahr. 1889–1894 kamen jährlich zwischen 117775 und 197600 kg Macis nach Holland. Holland[S. 674] importierte 1896: 1002000 kg Nüsse und 288000 kg Macis. 1902 kamen nach Holland 762280 kg Muskatnuß) (gewone not), 55910 kg Papuanuß, 203255 kg Foelie und 310 kg Papuamacis (GORKOM, Specereijen in Beschr. Catal. Kolon. Mus. Haarlem 1903). 1909 betrug die Einfuhr von Notemuskaat: 1151 t, 1910: 1060 t. Deutschland importierte 1909: 5963 dz Muskatnüsse und Macis, besonders aus Nied. Indien etwas (521 dz) auch aus Brit. Indien, 1910: 6011 dz. und Muskatbutter (via Holland): 1908: 1100 kg, 1909: 1300 kg, 1910 (via England) 2900 kg (TUNMANN). Hamburg importierte 1908: 1706 dz Muskatnüsse, davon kamen aus Nied. Ostindien: 266 (über die Niederlande: 883), aus Brit. Ostindien: 256, Singapore: 173 dz. Hamburg erhielt: 1907: 89500, 1908: 170600, 1909: 179100 kg Muskatnüsse und 1907: 73200, 1908: 94000, 1909: 68900 kg Macis (TUNMANN). London 1908: 10411, 1909: 10725 Kisten Nutmegs und 1908: 1153, 1909: 1272 Kisten Macis. New York ist nächst Amsterdam der zweite Muskatmarkt der Erde. Die Vereinigten Staaten importierten 1908: 2043470, 1909: 2644791 pounds nutmegs und 1908: 425183, 1909: 653610 pounds mace. Ausführliche Angaben über den Handel in früherer Zeit in WARBURG, Muskatnuß 1897.
Myristica fragrans HOUTT.
Frucht durch einen Längsschnitt geöffnet. frs Fruchtschale, Ar Arillus, ss Samenschale.
[Nach Tschirch-Oesterle, Atlas.]
Morphologie. Bei einem Gewicht von 60 g kommen auf das Pericarp 48,3, auf den Arillus 2,1, die harte Schale 2,9 und den Samenkern 6,7 g (REINWARDT). Die rundlich-ovale Beerenfrucht ist gelb oder rot überhaucht und glatt, 3–6 (selten bis 7,5) cm lang, frisch c. 45–62 g schwer und besitzt beiderseits eine Furche, in der die Frucht zweiklappig aufspringt, die Spitze liegt meist etwas exzentrisch. Innerhalb des fleischigen, etwa 1 cm dicken, zusammenziehend schmeckenden Pericarps liegt der Arillus, der bei der unreifen geschlossenen Frucht gelblich-weiß ist, reif tief karminrot wird. (Nur selten bleibt er dauernd elfenbeinfarben.) Er umschließt die Basis des Samens becherartig und ist nach oben in 10–15 flache Lappen zerschlitzt (Fig. 211). Schon MASSIMILIANO vergleicht ihn mit einem Netz, das die Frucht umhüllt. Da er sich früher bildet als die Samenschale ihre definitive Gestalt und Härte erreicht hat, so zeigt diese, der der Arillus in der Frucht fest anliegt, die Abdrücke desselben. Der Same ist in der Form und Größe variabel, meist breit-elliptisch oder eiförmig und 1,5 bis 4,5 cm lang und 1–2,5 cm breit. Die harte Samenschale ist tief dunkelbraun, schwach glänzend. An der Basis, dort wo der Arillus angewachsen ist, sieht man das Hilum als ovalen hellen Fleck und die Mikropyle als kleines dunkles Loch, vom Hilum streicht die Rapherinne bis fast zur Spitze, wo die Chalaza in Form eines exzentrisch gelegenen Buckels sich findet. Der hell-zimtbraune, bei den gekalkten Nüssen weiß bestäubte Samenkern, aus dem allein die Droge besteht, ist 10–33 (meist 20–30) mm lang (die kleinsten 10–11, die größten 33 mm WARBURG) und 15–28 (meist 15–20) mm breit. Sowohl der Arillus wie die Samenschale bis zum Primärperisperm sind abgelöst. Der Samenkern ist bedeckt von der inneren Schicht des Primärperisperms und der vom Meristem nach außen erzeugten Schicht des Sekundärperisperms, von dem auch die braunen Zapfen gebildet werden (VOIGT), die dem Querschnitt und Längsschnitt ein so charakteristisches Aussehn geben (Fig. 212). Diese Ruminationsfalten wurden im XVII. Jahrh. vielfach mit arabischen Schriftzügen (literae arabicae) verglichen. An den Stellen, wo die Zapfen sich an das übrige Perisperm ansetzen, welche Stellen den vertieften Stellen der Furchen der runzeligen Außenseite entsprechen, verläuft ein Bündel. Diese Bündel anastomosieren[S. 675] untereinander und bilden, da sich der Kalk hauptsächlich in den vertieften Stellen absetzt, das helle Netzwerk, welches der Oberfläche der Muskatnüsse das eigenartige Ansehn gibt. Die Stelle, wo beim Ovulum die Mikropyle liegt, ist auch am Samenkerne deutlich sichtbar (Fig. 212 Mp). Kurz vor der etwas seitlich gelegenen Basis, dem Hilumsende des Samens, endigen die Perispermalbündel blind. Es folgt nun eine ovale Rinne und dann ein breiter heller Buckel, der die Lage des zweiten Integumentes markiert. In der Mitte des Buckels ist die Mikropyle als ein kleines rundes Loch oder Spitzchen zu sehen. Hier erfolgt auch der Austritt des Keimlings bei der Keimung. Von dem Buckel geht eine seichte, dem Raphebündel der Samenschale entsprechende Furche zu der Stelle am anderen Ende des Samenkerns, die der Chalaza entspricht. Diese gleichfalls exzentrisch gelegene Stelle ist durch eine dunklere Vertiefung markiert, in der ein Spitzchen sichtbar ist: das Ende des hier abgelösten Raphebündels. Auch der Keimling liegt etwas exzentrisch. Er ist bei der Droge meist stark geschrumpft, oder ganz geschwunden. Die Cotyledonen bilden einen gelappten Becher. Ihre Endzipfel ragen in die Keimbahn hinein. Die besten Nüsse sind rund (bzw. eiförmig) und glatt (d. h. wenig geschrumpft).
Semen myristicae
von außen, quer und längs durchschnitten, das Albumen ruminatum und die Leitbahnen zeigend.
[Nach Tschirch-Oesterle Atlas.]
Bisweilen kommen, wenn 2 (oder 3) Ovula angelegt wurden, 2 (oder 3) Samen zur Ausbildung (Zwillingsnuß, pala bakamar — schon von CLUSIUS erwähnt und in NIC. SCHULTZES Dissertatio de nuce moschate 1709 abgebildet). Solche Muskatnüsse, die man neuerdings viel im Handel findet, sind nicht rund, sondern plankonvex. — Andere Abnormitäten sind: die nur erbsen- bzw. pfefferkorngroße und nur c. 0,15 g schwere sog. Königsnuß, pala radja, die schon im Museum Wormianum 1655 Nux moschata regia genannt wird; sie besitzt meist einen relativ dicken Arillus. — Die samenschalenfreie Diebsnuß (pala pentjuri), die nur zur Hälfte mit Arillus bedeckte Pfaffennuß (pala domine) und die nach WARBURG von monözischen Bäumen stammende pala boy. — Rompen, Rumpfnüsse, Rümpfe (pala rumpi) sind unreif abgefallene oder vom Winde vorzeitig heruntergeschlagene, stark schrumpfende Samen, die seit dem XVII. Jahrh. zur Darstellung von Ol. nucistae benutzt werden (RUMPH) und zu diesem Zwecke (als «Ölnüsse») auch heute noch exportiert werden.
Der trockene Arillus, die Macis, ist an der Basis becherartig geschlossen, hier auch etwas dicker, nach oben hin ist er in zahlreiche Lappen zerschlitzt, die sich bisweilen übereinanderschieben, aber niemals zu einem so festen Knäuel wie bei der Bombay-Macis (Fig. 216), wo an der Spitze des Samens ein fester Kegel dicht über- und durcheinander geschobener Arillarlappen liegt. Etwas unterhalb der Stellen, wo die Lappen sich zerschlitzen, zeigt der Arillus schon tiefe Längsfurchen. Die Droge ist gelbbräunlich, sehr brüchig. Sie quillt in kaltem Wasser wenig. Die Oberfläche erscheint, mit der Lupe betrachtet, streifig punktiert. «Die Streifen verlaufen der Länge nach an den[S. 676] Zipfeln, allmählich schräge und fast konzentrisch gegen die Spitze sich aufrichtend» (VOGL). Bisweilen ist der Arillus bleichgelb und rot gesprenkelt (pala kakerlak) oder ganz weiß (weiße Muskat, pala putieh, p. holanda). Oft sind gute Nüsse von spärlicher Macis umgeben und spärliche Nüsse von kräftig entwickelter (V. HOGENDORP).
Anatomie. In der Korolle und dem Blütenstiel finden sich neben Ölzellen Astrosklereïden und gestreckte Milchröhren. Die etwa 10 mm dicke Fruchtschale der reifen Frucht ist mit eigenartigen, sympodial sich verzweigenden (WARBURG) Sternhaaren bedeckt und enthält neben Astrosklereïdennestern, die den äußeren Schichten eine ziemliche Härte verleihen, zahlreiche, reich verzweigte Milchröhren mit braunem Inhalt (Kinoschläuche). Diese «Kinoschläuche», die zuerst von TSCHIRCH (1888) und HÄLLSTRÖM im Pericarp beobachtet und abgebildet wurden, finden sich auch in der Rinde, der Markscheide, der Blütenstandsachsen, im Perigon, den Staubfäden und den Cotyledonen (WARBURG).
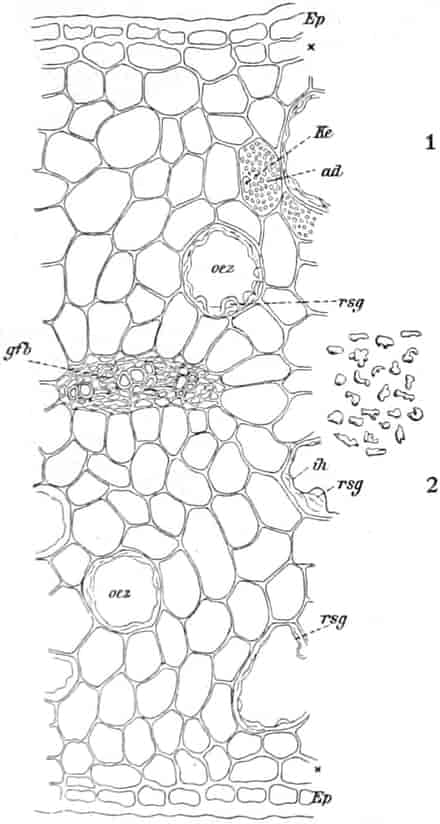
Myristica fragrans HOUTT.
1 Querschnitt durch den Arillus (Bandamacis). 2 Isolierte Amylodextrinstärkekörner.
[Nach Tschirch-Oesterle, Atlas.]
Der Arillus, die Macis, wird frühzeitig, schon in der noch ungeöffneten Blüte, angelegt. Er entspringt sowohl vom Funiculus wie vom Exostomrande, ist also eine Zwischenform zwischen Arillus und Arillodium. Schon bei einem 2,5 mm großen Samen stoßen seine Lappen an der Spitze des Samens zusammen. Der farbige Arillus zeigt an seiner Basis ein vertieftes ovales Feld mit den Eintrittsstellen der Gefäßbündel. Er ist beiderseits von einer Epidermis bedeckt, deren sehr langgestreckte (300–600 mik VOGL), an den Enden meist zugespitzte, im Querschnitt rechteckige oder tangential (nie radial) gestreckte Zellen auf der Außenseite stark, aber auch auf der Innenseite verdickt sind. Die Verdickungsschicht besteht aus Cellulose und quillt stark. Bisweilen findet sich an der Basis des Arillus und hier, wie überhaupt (oft bis zur Mitte) die Innenseite bevorzugend, ein ein- oder mehrschichtiges Hypoderm (Papuamacis [vgl. S. 690] zeigt beiderseits reichlich Hypodermbildung). Das Grundgewebe besteht aus dünnwandigem (bei Papuamacis dickwandigem) Parenchym, dessen Zellen zahlreiche rundliche, scheiben- oder stäbchenförmige, bisweilen wulstig verbogene, 1,5–10 mik lange Amylodextrinstärkekörner (TSCHIRCH) enthalten, die in Ölplasma (?) eingebettet sind. Sie färben sich mit Jod rotbraun, quellen in Wasser, besonders warmem, und lösen sich in siedendem. Die kolloidale Lösung färbt sich mit Jod rot. Ich habe während meines Aufenthaltes in Buitenzorg (1888) Amylodextrinstärke auch in den Arillen anderer Myristicaarten gefunden (s. weiter unten). Im frischen Arillus findet sich, wie ich 1888 in Buitenzorg feststellte, in allen oder doch den meisten Amylodextrinzellen ein roter Farbstoff. Geht der Arillus in Fäulnis über, was bei auf den Boden fallenden Früchten rasch eintritt, so scheidet sich der Farbstoff in roten Kristallen (Nadeln,[S. 677] Blättchen) aus, die ich übrigens auch einige Male im frischen Arillus fand. Das Auftreten der Amylodextrinkörner geht mit dem Erröten des Arillus Hand in Hand. Der junge, noch in der unreifen Frucht eingeschlossene Arillus ist bleich und enthält keine Amylodextrinstärkekörner. Der geruchlose Arillus von Myr. glauca u. Myr. silvestris enthält rote Chromatophoren; Jod färbt die Farbstoffkristalloide erst blaugrün, dann gelb. Bei dem Arillus von Myr. glauca färbt Jod die roten Chromatophoren erst blau, dann blaugrün (TSCHIRCH). Eingebettet in das Grundgewebe finden sich regellos verteilt, jedenfalls nicht die Randschichten bevorzugend, meist einzeln, selten zu 2–3gliedrigen Gruppen vereinigt, bis 105 (meist c. 70) mik große, bisweilen noch Öltropfen enthaltende, meist aber leere Ölzellen mit verkorkter Wand und deutlicher resinogener Schicht (TSCHIRCH) und innerer Haut. Die resinogene Schicht wird durch Alkalien braun, Kalipyrochromat und Chromat färbt nur wenig. Zahlreiche kleine (Spiralgefäße führende) Gefäßbündel, die oft stark obliteriert sind, durchziehen das Gewebe in der Längsrichtung.
Bei der Bombay-Macis (s. d.) enthalten die inneren Ölzellen ein gelbes, durch Ammoniak grünlich werdendes, die äußeren ein gelbrotes Sekret, das durch Ammoniak orange- bis rubinrot sich färbt. Kali löst das Sekret vollständig. Im mit Alkohol betupften Schnitt färbt Kalipyrochromat die Sekretzellen braunrot bis braunschwarz, Barytnitrat schwach blutrot. Papuamacis ist arm an Ölzellen. Sowohl Bombay- wie Papuamacis enthalten Amylodextrinstärkekörner. Bei der erstgenannten sind die Körner etwas größer (3,5–10 mik) und mehr rundlich, bei der zweiten 3–13 mik, knochenförmig, viereckig oder rundlich (vgl. auch weiter hinten).
Das Pulver der Macis besteht vorwiegend aus den Amylodextrinstärkekörnern. Im Chloralpräparat werden Spiralgefäße, Epidermiszellen und Fragmente der Ölzellen sichtbar. Stärke fehlt. Doch sah ich einige Male Reste der stärkeführenden Samenschalepidermis, die beim Ablösen der Macis von der Samenschale mit abgerissen wird. Die meiste Macis wird gemahlen. Das Pulver gilt um so besser, je heller es ist.
Der Fruchtknoten enthält nur ein anatropes Ovulum. Das äußere Integument ist zurückgezogen, ausschließlich das innere, nur bis zur Hälfte des Nucellus reichende bildet die Mikropyle. Der Same geht aber hauptsächlich aus dem nur vom äußeren Integumente bedeckten hinteren Teile des Ovulums hervor (Details im Anatomischen Atlas). Auch die äußere Samenschale ist also im überwiegenden Teile des Samens ein Produkt des äußeren Integumentes und an der Bildung der inneren Samenschalpartien beteiligt sich nur an der Spitze des Samens das innere Integument, im übrigen sind sie Bildungen des Hüllperisperms. Die äußere Samenschale zeigt vier Schichten (vgl. Fig. 214): Eine äußere, von einer auch im reifen Samen oft noch Stärke führenden Epidermis bedeckte Parenchymschicht, in der die Gefäßbündel verlaufen, eine einreihige Schicht dünnwandiger Palissaden (Außen- oder Nebenpalissaden), eine breite Schicht hoher, stark verdickter Palissaden (Innen- oder Hauptpalissaden) und eine Reihe von Querfasern (diese fehlen bei Myristica argentea). Im bei weitem größten Teile des Samens gehen die Querfasern aus der Epidermis des Nucellus bzw. Perisperms, die Innenpalissaden aus der inneren Epidermis des äußeren Integumentes und die Außenpalissaden aus der unter dieser liegenden subepidermalen Zellreihe hervor. Nur dort, wo das innere Integument liegt, geht die Querfaserschicht aus der äußeren Epidermis dieses Integumentes hervor und nur in einem ebenfalls kleinen Gebiete um die Chalaza beteiligt sich auch die subepidermale Zellage des Nucellus an der Bildung der Mittelschicht.
Die 850–950 mik hohen, 15–19 mik breiten Innenpalissaden zeigen meist stark spiralleistenförmig verdickte Wände und führen Oxalatkristalle. Sie sind ungleich hoch, so daß die Außenseite dieser Schicht Berge und Täler bildet. An den Stellen, wo die Wellenberge liegen, führen die dort kurzen Außenpalissaden gewöhnlich braunen Inhalt, im unreifen Samen Gerbstoff. An der Spitze des Samens liegt an der Stelle, wo die Mikropyle lag, ein die beiden Integumente durchsetzender Kanal, der der Radicula bei der Keimung als Austrittsöffnung dient.[S. 678] An der Basis des Samens, der Chalaza, tritt das Raphebündel durch eine ovale Öffnung in das Innere des Samens ein.
Myristica fragrans HOUTT.
1 Samenschale (1–6) und Hüllperisperm (pPsp Primärperisperm, sPsp Sekundärperisperm). 2 Ein in das Endosperm (End) eindringender Hüllperispermzapfen.
[Nach Tschirch-Oesterle, Atlas.]
Die sog. innere Samenschale, von der allein der Samenkern, die Muskatnuß des Handels, bedeckt ist, geht im größten Teile des Samens nicht aus Teilen der Integumente hervor, sondern ist eine Bildung des Nucellus resp. Perisperms, also keine echte Samenschale (VOIGT, Details im Anatom. Atlas). In diesem sog. Hüllperisperm (A. MEYER) entsteht nämlich in den inneren Schichten ein Meristem und dieses erzeugt Sekundärperispermschichten. Die eigenartigen Zapfen und Leisten, die zu den sog. Ruminationsfalten des Samens werden, sind Bildungen dieses Sekundärperisperms. Das ringsumlaufende Primärperisperm ist hell und bündelfrei und besteht aus Parenchymzellen, die nicht alle Phlobaphen führen. Das kleinzelligere äußere, ringsumlaufende Sekundärperisperm ist mit Phlobaphenen erfüllt und führt aus nachträglich angelegten Procambiumsträngen entstehende Gefäßbündel, und zwar ausschließlich an den Stellen, von denen die Zapfen abgehen. Dies Sekundärperisperm ist aber nur der äußere Teil des von dem Meristem gebildeten Gewebes. Der nach innen zu abgeschiedene Teil wird bis auf geringe, am Rande der Zapfen sichtbar bleibende Reste nachträglich wieder resorbiert. Die Ruminationszapfen werden viel früher angelegt als das Endosperm. Ich fand noch in ziemlich weit entwickelten Samen das ganze schon reich gekammerte Innere von einer milchigen Flüssigkeit erfüllt. Erst ganz zuletzt wird vom Rande der Zapfen her das Endosperm angelegt, und erst wenn die Frucht aufspringt, beginnt sich der Inhalt der Endospermzellen zu differenzieren. Die von den Zapfen her gebildeten Endospermstreifen stoßen in der Mitte zusammen und verwachsen hier. Diese der Quellschicht bei anderen Samen entsprechende Zone zeigt auch hier ein abweichendes Verhalten. Während die übrigen Endospermzellen außer Stärke und Aleuron reichlich Fett enthalten, ist in dieser Zone, die in Form weißer, den Ruminationszapfen in einiger Entfernung folgenden Linien auf jeder durchsägten Muskatnuß sichtbar ist, nur Stärke vorhanden. Diese Linien sind, wie ich gezeigt habe,[S. 679] die Keimbahnen, auf denen die als Saugorgane dienenden Lappen der in das Endosperm eindringenden Cotyledonen bei der Keimung des Samens wandern, ernährt von der sich lösenden Stärke. Das ganze Endosperm ist beim frischen Samen farblos, weiß oder hornartig-fettglänzend. Es zeigt, herauspräpariert, wie ich mich in Indien überzeugte, keinerlei Geruch und besitzt einen nußartigen Geschmack.
Dort, wo der Embryo liegt, wird nicht nur kein Sekundärperisperm gebildet, sondern sogar das Nucellusgewebe vollständig resorbiert, das innere Integument, das hier an der Bildung der Samenschale teilnimmt, grenzt unmittelbar an den Embryo. Die Droge, d. h. der Samenkern, zeigt also, wenn man sie der Länge nach median durchsägt, folgendes Bild (Fig. 212). Zu äußerst liegt das Primärperisperm (Hüllperisperm I), ein aus gestreckten, dünnwandigen, verholzten Zellen bestehendes, bisweilen Phlobaphenmassen enthaltendes Gewebe, in dem sich (bisweilen korrodierte) Kristalle in Form von Prismen, Blättchen, Wetzsteinen oder Zwillingen finden (Weinstein?). Die äußersten Zellen enthalten bei der gekalkten Droge sehr kleine Kalkkörnchen. Auf das Primärperisperm folgt das sich, da kleinzelliger, gut abhebende, äußere Sekundärperisperm (Hüllperisperm II), das, da es reich an Phlobaphenen ist, die natürlich braune Farbe der ungekalkten Muskatnüsse bedingt. Die Ruminationszapfen führen im unreifen Samen Stärke, im reifen frischen Samen zahlreiche große, oft aneinander stoßende Ölzellen, die ganz von einem hellgelben Öle erfüllt sind (Fig. 214). In der Droge besteht das Ruminationsgewebe aus meist leeren Zellen mit braunen Wänden, die infolge Infiltration resistent sind gegen Schwefelsäure. Die Endospermzellen enthalten eingebettet in bisweilen in Nadeln oder Blättchen auskristallisiertes Fett (resp. Ölplasma), meist je ein durch Cochenille tingierbares (VOGL) Aleuronkorn mit oft vortrefflich rhomboëdrisch oder in Form einer sechsseitigen Tafel ausgebildetem, oft lichtgelb gefärbtem Kristalloid (abgebildet bei BUSSE und im Anatom. Atlas) — Globoide sind sehr selten —, sowie einfache oder zu 2–12 (selten bis 20) zusammengesetzte 3–18 (meist 10) mik große, mit einem Spalt versehene Stärkekörner. Die Stärke der Leitbahnen ist kleiner. Stärkearme und fettreiche Samen besitzen die am besten ausgebildeten Aleuronkörner. Bisweilen werden die großen Aleuronkörner von einigen kleinen begleitet. Hier und da finden sich im Endosperm gebräunte Zellen. Diese enthielten im unreifen Samen Gerbstoff.
Das Pulver der Muskatnuß bietet wenig Charakteristisches. Es besteht vorwiegend aus Stärkekörnern und Fettschollen. Erhitzt man das Pulver mit Chloral, so erscheint das ganze Präparat mit Öltropfen übersät, die beim Erkalten kristallinisch erstarren. Gefäßbündelfragmente und Fetzen des Hüllperisperms finden sich allenthalben zerstreut.
Lit. BERG, Anat. Atlas. — FLÜCKIGER, Arch. Pharm. 1871, 31. — VOIGT, Bau u. Entwickl. d. Samens u. Samenmantels von Myr. fragr. Diss. Göttingen 1885 und Bau u. Entw. von Sam. mit ruminiert. Endosp. usw. Ann. Jard. Buitenz. 7 (1887) 151. — A. MEYER, Wissensch. Drogenkunde. — TSCHIRCH-OESTERLE, Anat. Atlas t. 56 und 57. — BUSSE, Gewürze, Arbeit. d. kaiserl. Gesundheitsamtes 11 (1895) 390 und 12 (1890) 628. — TSCHIRCH, Ges. naturforsch. Freunde 1887, Ber. d. Botan. Ges. 1888 und Angew. Anatomie. — TSCHIRCH (Keimungsgesch.), Ber. d. pharm. Ges. 1894, 260. — HALLSTRÖM. Vgl. anat. Stud. über d. Samen d. Myristicac. (in TSCHIRCH, Indische Fragmente). Arch. Pharm. 1895 mit 3 Taf. — LÜDTKE (Aleuron), Ber. d. pharm. Ges. 1891, 56. — PLANCHON, Devel. et caract. d. vrais et d. faux arilles Ann. sc. nat. (3) 3, 303. — BAILLON, Sur l’origine du macis etc. Compt. rend. 78, 799. Adansonia 5 (1870) 177, 11 (1876), 329 und Dict. d. botan. I (1876), 258. — TSCHIRCH, Tagebl. d. Straßburger Naturforschervers. 1885. — WARBURG, Haarbild. d. Myrist. Ber. d. bot. Ges. 1895. — PLANCHON-COLLIN, Drogues simpl. I, Fig. 315–320. — HARTWICH in Pharm. Praxis II, Fig. 41–49. — VILLIERS ET COLLIN, Subst. aliment. — MOELLER-WINTON, Mikroskopie, Fig. 385[S. 680] bis 395. — VOGL, Kommentar. — GOLTSINSKI, Myr. fragr. Dissert. Moskau 1894 (russisch) m. 7 Taf. — PFEIFFER, D. Arillargeb. d. Pflanzens. Engl. bot. Jahrb. 13 (1891) 524. — COSTERUS, Double nutmegs. Ann. jard. bot. Buit. XV 1898, 40. — JANSE, Ann. jard. bot. Buitenzorg 1899, 17. — KRAEMER (Pulver), Proc. Amer. Pharm. Ass. 1898, 327. — Abbild. auch in ROSEN, Anatom. Wandtafeln t. 27. — HASSAK, Wandtaf. für Warenkunde t. 6.
Chemie. Das Pericarp enthält 17,8% Wasser, 8,6% durch Äther Extrahierbares, 46,3% in Wasser lösliche Substanzen (darin Gerbstoff) und 1,7% Weinsäure (FROMBERG).
Die Samenkerne, die Muskatnüsse, enthalten im Durchschnitt in Prozenten: Wasser 7,38 (4,2–12,2), Stickstoffsubstanz 5,49 (5,2–6,1), äther. Öl 3,05 (2,5–4), Fett 34,27 (31–37,3 resp. 32,2 FRÜHLING), Alkoholextrakt 11,98, stickstofffreie Extraktstoffe inkl. Stärke 37,19 (29,9–41,8), Rohfaser 9,92 (5,6–12), Asche 2,7 (2,2–3,3) (KÖNIG 1–4%), obere Grenzzahl (nach HAUKE) 3,5%; die Praxis verlangt als Maximum der Asche: 5%. Nach neueren Bestimmungen enthalten die Nüsse 8 bis 10%, äther. Öl (SCHIMMEL & CO.) und 30–40% Fett. BUSSE fand 30,3 bis 40,5% Fett (nur bei der geringsten Sorte 15,65%), GRESHOFF 27,5–42,8%. «Trockenverlust»: 9,3–15%, Gesamtasche: 1,7–4,6% (bei Ölnüssen bis 6,7%). Gerbstoffe sind nur wenig vorhanden. Der alkoholische Auszug färbt sich mit Eisenchlorid kaum dunkler. Muskatnuß enthält wechselnde Mengen Stärke (nach KÖNIG 23,67%), sowie 1,52% reduzierenden Zucker und 0,56% Saccharose (BOURQUELOT). Ferner ein Xylan (BRACHIN), eine Lipase (MASTBAUM), ein Saponin (DEKKER) und Farbstoffe. (Vgl. auch weiter unten unter Preßkuchen.) Magere Nüsse haben ein spez. Gew. = 1,059, middelbare 1,070, vette 1,115. Diese sinken also in Wasser von 15° unter.
Die Samenschalen enthalten 1% Fett, 2,2% Asche und 62,6% «Cellulose» (RANWEZ).
Die Muskatbutter (Muskatfett, Oleum s. butyrum s. balsamum nucistae, Ol. nuc. moschatae expressum, Ol. myristicae, beurre de muscade — butter of nutmeg, expressed oil of nutmeg — notenzeep, bandazeep, muskaatzeep, notenvet) bildet ein bräunlichgelbes bis rötlichbraunes festes Fett von der Konsistenz eines weichen Talgs, muskatartigem Geruch und bitterem Geschmack. Durch langes Mazerieren mit Alkohol kann es fast farblos und geruchlos erhalten werden, da die Fettsubstanz in kaltem Alkohol wenig löslich ist, Riech- und Farbstoffe dagegen sich darin lösen. In 4 (nach DIETERICH: 10–12) Teilen siedendem Alkohol ist es bis auf die bisweilen darin vorkommenden Pflanzenreste löslich, ebenso in Äther, Chloroform und Benzol. Letzteres läßt den größten Teil der Farbstoffe ungelöst. Bei 45–51° schmilzt es zu einer rotbraunen, trüben Flüssigkeit, die keinen merklichen Bodensatz zeigen darf (Ph. helv. IV). Mikroskopisch betrachtet zeigt die Muskatbutter reichlich Kristallnadeln von Myristin, bisweilen auch Gewebsreste des Samens und Stärkekörner. Beim Einlegen in die HARTWICH-UHLMANNsche Kali-Ammoniakmischung entstehen große sternförmige Konglomerate kurzer, derber Kristallnadeln. Die Muskatbutter ist ein nicht immer konstantes Gemisch von Fett, ätherischem Öl und «Farbstoff». Letzterer ist seinerseits wieder ein Gemisch verschiedener, nicht näher bekannter Körper. KOLLER fand (1864) in %: Äther. Öl 6, Myristin 70, «Elaïn» 20, saures Harz 3, «Butyrin» (nebst Spuren flüchtiger Säuren) 1.
Das Fett besteht zu c. 45% aus Myristin (Sericin, PLAYFAIR), dem Glycerinester der von PLAYFAIR 1841 entdeckten Myristinsäure (C14H28O2). Behandelt man das Fett mit kaltem Alkohol, so bleibt das Myristin zurück und kann durch Umkristallisieren[S. 681] aus Äther in bei 55° schmelzenden Kristallen erhalten werden. Der in kaltem Alkohol lösliche Teil besteht vorwiegend aus Olein. POWER und SALWAY fanden 1908 in ausgepreßtem Muskatfett in % (außer 12,5% äther. Öl): Trimyristin 73,0, Olein 3,0, Linolsäureglycerid 0,5, sehr wenig Ameisensäure-, Essigsäure-, Cerotinsäure-Ester, Unverseifbares 8,5, Harz 2. In dem Unverseifbaren ist (zu 5% des Ganzen) eine Substanz C18H22O5, dann Myristicin (C11H12O3) und eine kleine Menge Phytosterol, C20H34O (F. = 134–135°), enthalten. Stearinsäure (RÖMER) fehlt.
Muskatbutter zeigt folgende Konstanten: Spez. Gew. 0,95–1,04 (REINWARDT), 0,945–0,996 (DIETERICH), meist 0,990–0,995. Schmelzpunkt: 41,5–48° (bis 51° URICOECHEA), 33–57° (DIETERICH). Erstarrungspunkt: 41,5–42 (RÜDORFF, WIMMEL). Verseifungszahl: 134,5–178, also stark schwankend. V. Z. h.: 153,3–196,1 (DIETERICH). Säurezahl: 14–44,8, bisweilen aber auch 56–86,8, ja 93,2, 118,8 u. 125 (DIETERICH). Jodzahl: 33,3–57,3 (DIETERICH), 48–65,1 (WIJS). Die Schwankungen in der Jodzahl rühren nicht von dem ätherischen Öl her (LEWKOWITSCH). Brechungsexponent bei 40°: 1,4700–1,4705 (UTZ). Butterrefraktometer bei 40°: 66,4–67,2 Skalenteile (UTZ). Erstarrungspunkt der Fettsäuren: 40° und Schmelzpunkt derselben 42,5 (HÜBL). Die sog. «Konstanten» sind also sehr inkonstant. Mit Äther extrahiertes Fett zeigte spez. Gew.: 0,996, Schmelzpunkt: 51°, Säurezahl: 22,4, Verseifungszahl: 154–159,6. Das durch Pressen erhaltene Öl ist nicht ganz identisch mit dem durch Extraktion erhaltenen, wennschon ziemlich ähnlich. Denn POWER und Salway fanden 1908:
|
Ausgepreßtes
Fett |
Mit Äther
extrahiertes Fett |
Ausgepreßt.
Fett frei von äther. Öl |
Gesamte
Fettsäuren |
|
|
Schmelzpunkt
|
48°
|
50°
|
49°
|
49°
|
|
Dichte 50°/50°
|
0,9399
|
0,9337
|
0,9443
|
0,9012
|
|
Säurezahl
|
11,2
|
12,9
|
218,3
|
0,9012
|
|
Verseifungszahl
|
174,6
|
180,5
|
199,6
|
—
|
|
Jodzahl
|
57,8
|
45,7
|
35,7
|
23,1
|
⅔ des ätherischen Öls des Samenkerns treten in das Fett über (REINWARDT), welches wenigstens 4–8% ätherisches Öl zu enthalten pflegt.
[S. 682]
Das ätherische Öl der Muskatnüsse und der Macis ist «kaum zu unterscheiden». Die Unterschiede sind nur quantitative (SCHIMMEL). KOLLER erklärte sie für identisch (?); doch hat das Macisöl ein etwas höheres spez. Gew. und ein etwas anderes Drehungsvermögen als Muskatnußöl [Macisöl: 0,890–0,930 αD = +10–20°. Muskatnußöl: 0,865–0,920 αD = +14–30°]. Das Muskatnußöl enthält mehr Terpene (SCHIMMEL). Im Handel gehen beide unter dem Namen Macisöl. Aber es ist unzulässig das Öl der Muskatnüsse dem Öl der Macis einfach zu substituieren und ganz unzulässig (D. A. IV) das Wort Muskatnußöl als synonym mit Ol. Macidis anzuführen oder (D. A. V) das Öl der Samenkerne ebenfalls Ol. Macidis zu nennen, auch wenn man die Drehung auf αD 20° = +7° – +30° und das spez. Gewicht auf 0,870–0,930 erweitert. Es enthält Pinen (SCHACHT), (WALLACH, VAN ROMBURGH = Macen), Dipenten (SEMMLER, Myristicen GADSTONE ist ein Gemisch von Dipenten und Pinen). Cymol (WRIGHT) fehlt (SEMMLER) oder ist vielleicht aus dem Myristicol (C10H16O WRIGHT, GLADSTONE), das wohl kein Individuum ist, entstanden, dem aber BRÜHL die Formel:
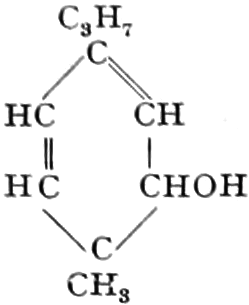
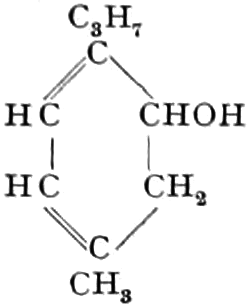
gibt. In den höher siedenden Anteilen: Myristicin (C11H12O3) nach SEMMLER:
nach Macis riechend — vielleicht aus einem primär vorhandenen flüssigen Phenoläther erst bei der Verarbeitung entstehend. SALWAY schreibt die bei der Oxydation entstehende Myristicinsäure:
(das Myristicin von JOHN und MULDER ist Myristinsäure, FLÜCKIGER). In den zuletzt übergehenden Anteilen findet sich ein Phenol (SEMMLER). Bei der Destillation des Öls geht oft Myristinsäure über (FLÜCKIGER). POWER und SALWAY fanden im Öl (1907): Eugenol und Isoeugenol (c. 0,2%), d-Pinen und d-Camphen (c. 80%), Dipenten (c. 8%), d-Linalool, d-Borneol, i-Terpineol, Geraniol (zusammen c. 6%), einen neuen Alkohol, der bei der Oxydation ein Diketon (C8H14O2) gibt, einen citralähnlichen Aldehyd, Safrol (c. 0,6%), Myristicin (c. 4%), Myristinsäure (0,3%, etwas auch als Ester), dann Ameisensäure, Essigsäure, Buttersäure, Octylsäure und eine neue Säure, C13H18O3, alle als Ester. Myristicol halten POWER und SALWAY für ein Gemisch, in dem Terpineol vorwaltet. SCHIMMEL & Co. destillierten 1893 bedeutende Mengen Muskatnußöl, zum Teil aus den Preßrückständen der Muskatbutterbereitung.
Im Preßkuchen fanden POWER und SALWAY die Bestandteile des Muskatfettes wieder, speziell Phytosterol, die Substanz C18H22O5, Myristinsäure und Trimyristin, Essigsäure, Cerotinsäure, Eugenol, Isoeugenol, viel d-Glukose, Gerb- und Farbstoffe, sowie Harze, endlich als neu eine sehr geringe Menge Diacetylpuranol (C23H38O4[COCH3]2).
Banda Macis. Banda Macis enthält in Prozenten: Wasser: (4,9) 17,59–18,21, Protein: (4,6) 5,44–7,8, Fett: 18,6–29,1, äther. Öl: 3,37–5,26. In Zucker überführbare Stoffe: 41,2–44,59, Alkoholextrakt: 45,1–55,7, Holzfaser: 3,7–4,93 (bis 8,9), Asche: 1,6–4,1 (ARNST und HART, LAUBE und ALDENDORFF, KÖNIG). Der Fettgehalt beträgt meist 22,64–23,68% (BUSSE), 18,6–29,08% (LAUBE und ALDENDORFF, RICHARDSON, ARNST und HART), in der Trockensubstanz bis 35%. Macis enthält ätherlösliches Harz: 1,18–4,09%, alkohollösliches Harz: 3,83–3,95%, Asche:[S. 683] 1,70–2,8 (BUSSE). Obere Grenzzahl der Asche (nach HAUKE): 2,5%. HAUKE fand 1,61–2,32%. Macis enthält (nach der Natriumsalicylatmethode bestimmt): 8,38 bis 8,44% äther. Öl (LENZ). Macis liefert destilliert 4–15 (ja bis 17)% äther. Öl (SCHIMMEL, SEMMLER) vom spez. Gew. 0,890–0,930. HÄNSEL stellt ein terpenfreies Macisöl her.
Das «Fett» der Macis zeigt eine vom Samenfett abweichende Beschaffenheit, wie aus den Beobachtungen von SPÄTH, die sowohl bei BENEDICT-ULZER wie bei LEWKOWITSCH fälschlich auf Samenfett bezogen werden, hervorgeht. Er fand bei aus Macis (von Banda, Menado, Penang und Sansibar — wohl alle von M. fragr.) extrahiertem Fett Schmelzpunkt: 25–26°, Verseifungszahl: 169,1–173, Jodzahl: 75,6–80,8, Reichert-Meissl-Zahl: 4,1–4,2, Refraktometeranzeige: 74–84,5. Demgegenüber bemerkt FLÜCKIGER (1891): «Indem ich Macis mit siedendem Äther erschöpfte und diesen abdestillierte, erhielt ich 24,5% bei 100° getrocknetem, weichem, harzartigem Rückstand, in welchem ich nicht imstande war, Fett nachzuweisen.» Offenbar ist hier als «Fett» oft ein Gemenge bezeichnet worden, das noch vielerlei andere Bestandteile enthält und dem vielleicht eigentliches Fett ganz oder fast ganz fehlt.
Schon HENRY fand (1824) in der Macis einen eigenen gummiartigen Stoff, der sich mit Jod purpurn färbte und mit Schwefelsäure Zucker gab. FLÜCKIGER nannte den Körper «Maciscellulose». Ich zeigte 1888, daß Banda-Macis neben Dextrin und Zucker (c. 2–4%, nach FLÜCKIGER 1,4%) 25% Amylodextrinstärke enthält (vgl. oben S. 676). Dieselbe läßt sich in der Weise daraus darstellen, daß man durch kaltes Wasser Dextrin und Zucker, durch kalten Alkohol das ätherische Öl und den Farbstoff, durch siedenden Alkohol und Äther das «Fett» entfernt und dann durch oft wiederholtes vielstündiges Auskochen des Rückstandes die Amylodextrinstärke in Lösung bringt. Der Rückstand liefert 46,5% Amylodextrinstärke (TSCHIRCH). BRACHIN fand in Macis keine Saccharose, sondern ein rechtsdrehendes Pektin und Galaktane.
Durch Einschnitte in die Rinde liefern Myr. fragrans, Myr. malabarica, Myr. glabra und Myr. succedanea einen dem Malabarkino ähnlichen Stoff, der krist. Calciumtartrat enthält (SCHÄR). Auch Myr. Teysmanni, Virola sebifera u. and. verhalten sich ähnlich (EIJKMANN).
Lit. JOHN, Myristicin, ein näherer Bestandteil der Muskatennuß. Chem. Schriften 5 (1821), 61. — BONASTRE, Pres. d. l. fécule dans la noix musc. Journ. pharm. 9 (1823), 281. — HENRY, Examen du Macis. Ebenda 10 (1824), 281. — FROMBERG, Natuurk. Tijds. Ned. Ind. 11, 207. — EIJKMANN, Ned. Tijdschr. 1887. — SCHÄR (Kino), Pharm. Journ. 1896. — FLÜCKIGER, Pharmakogn. — BUSSE, Muskatnüsse. Arbeit. d. Kais. Gesundheitsamt. 11 (1895), 391. — KÖNIG, Nahr.- u. Genußm. — FRÜHLING, Z. Unters. gemahl. Gew. Chem. Zeit. 1886, 525. — ARNST und HART, Zeitschr. angew. Chem. 1893, 136. — BALLAND, Journ. pharm. 1903, 294. — BRACHIN, Ebenda 1903, 16. — MASTBAUM, Chem. Rev. d. Fettind. 1907, 5. — DEKKER, Pharm. Weekbl. 1909, 16. —
Fett. PLAYFAIR, Ann. d. Pharm. 37 (1841), 153. Edinb. Phil. Mag. 1841. — BRANDES, Ann. d. Pharm. 7, 52. — BRILMANN, Tijds. Ned. Ind. 1841, 318. — COMAR, Jahresb. d. Chem. 1859, 366. — KOLLER, Viertelj. pr. Pharm. 13 (1864), 504, N. Jahrb. Pharm. 23, 136. — RICKER, N. Jahrb. Pharm. 19, 17. Jahresb. d. Pharm. 1863, S. 37. — WITTE, Ebenda 38. — H. SCHIFF (Myristinsäure), Lieb. Ann. 1880. — RÖMER, Vork. kohlenstoffreich. Fettsäuren. Dissert. Halle 1882. — E. SCHMIDT u. RÖMER, Arch. Pharm. 1883, 34. — Helfenberger Ann. 1902, 1904, 1905. — HOOPER, Agricult. Ledger 1907. — POWER u. SALWAY, Transact. chem. Soc. 1908, 1653.
Äther. Öl. Ältere Unters. b. GILDEMEISTER-HOFFMANN. — SCHACHT, Dissert. de oleo macidis 1862. Arch. Pharm. 1862, 106. — KOLLER, N. Jahrb. d. Pharm. 23 (1864), 136. — CLOËZ, Journ. pharm. 1864, 150. — GLADSTONE, Journ. chem. soc. 1872, 1. — WRIGHT, Ebenda [S. 684] 1873, 549. — WALLACH, Lieb. Ann. 227 (1884), 288 u. 252 (1881), 105. — FLÜCKIGER, Pharm. Journ. 5 (1874), 136. — SEMMLER, Ber. d. chem. Ges. 23 (1890), 1803 und 24 (1891), 3818. — BRÜHL, Ebenda 21, 472. — THOMS (Myristicin), Constitut. d. Myristicins Arb. d. pharm. Inst. Berlin I, 18, Naturforschervers. Cassel 1903. — SCHIMMELS Ber. 1893, 1898. — ALLEN AND BREWIS (Optische Drehung), Pharm. Journ. 66 (1901), 328. — SALWAY (Nitromyristicins.), Transact. chem. soc. 1911.
Macis. HENRY, Examen du Macis, Journ. pharm. 10 (1824), 281. — FLÜCKIGER, Arch. Pharm. 1871. — TSCHIRCH, Ber. d. Bot. Ges. 1888, 138. — HALLSTRÖM, Arch. Pharm. 1895. — BRACHIN, Hydrat d. carb. d. la Noix muscade et d. Macis. Journ. pharm. 18 (1903), 16. — BUSSE, Arb. d. kais. Gesundheitsamtes 12, 628. — ARNST u. HART, Zeitschr. ang. Chem. 1893, 136. — FLÜCKIGER, Pharmakognosie. 3. Aufl. — KÖNIG, Nahr. u. Genußm. — Vgl. auch hinten unter Bombay-Macis. — Asche: HAUKE, Aschengehalte 1902. — MOOR AND PRIEST, Pharm. Journ. 1900, 112.
Verfälschungen. Selbst die ganzen Muskatnüsse werden verfälscht. Eine ganze Schiffsladung aus Holz nachgemachter Muskatnüsse beobachteten CHEVALIER und BAUDRIMONT (1861), aus Mehl, Ton und Muskatnußpulver zusammengesetzte künstliche wurden 1831 und 1833 beobachtet, aus Leguminosenmehl und Muskatpulver zusammengeknetete erwähnt BUSSE, solche aus Buchweizenmehl, Ton, Muskatbutter und Farbstoff WAAGE (1898). Am häufigsten sind aus einem Gemisch von gemahlenem Muskatnußbruch und mineralischen Substanzen durch hydraulische Pressen hergestellte im Handel (VAN DER PLANKEN und RANWEZ 1900). Sie haben sogar einen eigenen Handelsnamen («Bombay Muskatnüsse»). Beim Durchschneiden der gefälschten Nuß beobachtet man das Fehlen jeglicher vegetabilischen Struktur, beim drei Minuten langen Behandeln mit kochendem Wasser wird die Nuß weich und läßt sich zwischen den Fingern zerreiben. Der Aschengehalt beträgt 11–18% (bei der echten Nuß 2–3%), der Fettgehalt nur c. 15%, auch sind diese gefälschten Nüsse im allgemeinen schwerer. Oft finden sich — auch heute noch — wurmstichige Nüsse, deren Bohrlöcher mit Kalk oder einer Kalk-Fett-Mehlmischung verstopft wurden. Dagegen scheinen «extrahierte» Nüsse nicht mehr beobachtet zu sein. Die Angabe, daß die Löcher wurmstichiger Muskatnüsse durch Sassafraspulver ausgefüllt wurden, erscheint mir sehr unwahrscheinlich. Die langgestreckten Nüsse von M. argentea, M. fatua und M. malabarica kommen wegen ihrer abweichenden Form nicht als Verfälschungen in Betracht.
Das Muskatnußpulver fand RANWEZ (1900) mit dem Pulver der Schalen verfälscht. Bisweilen wird das Muskatnuß- und Macispulver durch Verreiben mit Milchzucker hergestellt, da beide wegen des Ölgehaltes schwer zu pulvern sind.
Als Verfälschung der Macis, besonders des Pulvers, ist neuerdings (seit 1881) vielfach Bombay-Macis (vgl. S. 691) beobachtet worden. Bombay-Macis scheint besonders nach Holland (Amsterdam) und Deutschland exportiert und erst dort zur Verfälschung der Macis gemahlen zu werden. BUSSE empfiehlt zur Erkennung der Bombay-Macis die Chromatprobe (WAAGE): Erhitzen des alkoholischen Auszuges mit Kaliumbichromat, Bombay-Macis-Auszug färbt sich braun, Banda-Macis höchstens chromgelb; ferner die Ammoniakprobe (TSCHIRCH-HALLSTRÖM): Bombay-Macis-Auszug wird tieforange bis gelbrot, Banda-Macis gelblich-rosa und die Barytprobe (BUSSE): mit dem Auszuge getränkte, getrocknete Filtrierpapierstreifen werden durch Eintauchen in siedendes, gesättigtes Barytwasser und nachheriges Trocknen bei Banda-Macis blaßrötlich, bei Bombay-Macis ziegelrot. Ich empfehle den spektralanalytischen Nachweis (s. S. 691). Da Bombay-Macis sehr viel «Harz» enthält (vgl. S. 691), so ist eine Banda-Macis, die nach dem Entfetten mit Petroläther mehr als 4% Ätherextrakt liefert, verdächtig. NESTLER (Über Macisverfälschungen. Ztschr. f. Unters. d. Nahrungsmittel [1903], Nr. 22) fand unter 104 Macisproben, die innerhalb 4 Jahren untersucht wurden, 37 Proben als verfälscht. In 17 Proben war ein mehr oder weniger starker Zusatz von Bombay-Macis zu Banda-Macis, in anderen Banda-Macis und Kukuruzmehl oder Bombay-Macis und Kukuruzmehl gemacht worden. Einige Proben enthielten überhaupt keine Macis, sondern waren künstlich aus Kukuruzmehl, gepulverter Semmel, Sandelholz und Curcuma hergestellt worden. Zur Fälschung fanden[S. 685] sich überhaupt Zusätze von Kukuruzmehl, gepulverter Semmel, Sandelholz, Curcuma oder Zimtrindenpulver, einzeln oder mehrere gemischt, vor. Auch von anderer Seite ist Curcuma als Verfälschung beobachtet (Borsäurereaktion des Auszuges) sowie das gemahlene Pericarp der Frucht. Ferner sollen Nüsse, Zwieback (SPÄTH), Ocker und Schwerspath vorgekommen sein. Papuamacis ist im Pulver weder mikroskopisch noch chemisch sicher nachzuweisen. Die Arillen der M. fatua scheinen jetzt nicht mehr (wie im XVII. Jahrh.) als Verfälschung benutzt zu werden.
Die mittlere Zusammensetzung der drei Macissorten wird durch folgende bei König reproduzierte Tabelle illustriert:
|
Bezeichnung
|
Anzahl der
Analysen |
Wasser
|
Stickstoff-
Substanz |
Gesamt-
Äther- extrakt (Fett, Harz, usw.) |
Ätherisches
Öl |
Fett-
Petrol- äther- Extrakt |
Harz
löslich in |
Stärke
(Amylo- dextrin- stärke) |
Sonstige
strickstoff- freie Extrakt- stoffe |
Roh-
faser |
Asche
|
Von der
Asche in Wasser löslich |
|
|
Äther
|
Alkohol
|
||||||||||||
|
%
|
%
|
%
|
%
|
%
|
%
|
%
|
%
|
%
|
%
|
%
|
%
|
||
|
Echte Macis
|
20
|
10,48
|
6,33
|
23,25
|
7,43
|
21,85
|
2,59
|
3,89
|
24,54
|
29,12
|
4,20
|
2,11
|
1,03
|
|
Papua „
|
6
|
9,18
|
6,68
|
54,28
|
5,89
|
52,72
|
0,88
|
1,92
|
8,78
|
14,41
|
4,57
|
2,10
|
1,11
|
|
Wilde
(Bombay) Macis |
5
|
7,04
|
5,05
|
60,06
|
Spur
|
32,64
|
30,99
|
3,19
|
14,51
|
3,79
|
8,17
|
1,38
|
0,97
|
Die Bestimmung des Petrolätherextraktes, Harzes, der Stärke und Rohfaser sind nicht in allen Proben ausgeführt, daher entsprechen diese Zahlen nicht ganz denen für die anderen Bestandteile.
Fälschungen der Muskatbutter sind jetzt relativ selten. Doch kommt bisweilen gefärbter und durch Erwärmen mit Muskatnußbruch parfümierter Talg als Muskatbutter im Handel vor. In früherer Zeit wurden Cetaceum, Talg, Butter, Cacaobutter, Palmöl, Wachs angegeben — (ob aber wirklich beobachtet?). Auch ein Parfümieren mit Sassafras finde ich angegeben (BERNAYS 1883). Muskatbutter muß sandfrei sein, also zu einer klaren Flüssigkeit schmelzen. Als Verfälschung ist das Fett der M. argentea beobachtet (KRASSER). Verfälschung mit Ucuhubafett ist an der Rotfärbung mit konz. H2SO4 oder H3PO4 zu erkennen (SCHÄDLER). UTZ hat die Bestimmung des Brechungsindex zur Erkennung von Fälschungen benutzt. Ein Zusatz von Schweinefett, Cacaobutter, Cocosfett, Olivenöl und Talg erniedrigt, ein Zusatz von Lanolin, Paraffin, Vaselin oder Wachs erhöht die Refraktometeranzeige.
Lit. SOUBEIRAN, Nouv. Dict. d. Falsific. etc. 1874. — CHEVALIER ET BAUDRIMONT, Dict. altérat. et d. Falsific. d. subst. aliment. 1882. — BUSSE, Muskatnüsse, Arbeit. d. Kais. Gesundheitsamt. 11 (1895), 390 u. Nachweis von Bombay-Macis. Zeitschr. Nahrungsm. 1904. — VAN DER PLANKEN und RANWEZ, Falsific. d. noix de musc. Ann. de Pharm. 1900, 6, 1. — RANWEZ, Fals. d. l. poudre d. musc. par les coques de musc. Ann. ph. 1900. — KRASSER, Verfälsch. d. Muskatnüsse u. d. Macis. Zeitschr. d. Österr. Apoth. Ver. 1897, 791 und Bemerk. über Ol. myrist. u. Oleum Mac. Ebenda S. 824. — WAAGE, Handwörterb. d. Pharm. 1893, II, 169. — NESTLER, Macisverfälschungen. Zeitschr. Unters. d. Nahrungsm. 1903. — SCHINDLER, Pharm. Zeit. 1902, Nr. 38. — UTZ, Chem. Rev. d. Fett- usw. Industr. 1903, 11. (Siehe auch unter Bombaymacis S. 692.)
Anwendung. In Zucker eingemachte unreife Muskatfrüchte von Ambon sind in Indien sehr beliebt (sie kamen schon im XVII. Jahrh. nach Europa, BAUHINS nux condita des RUELLIUS, in der Straßburger Taxe 1646: Nux moschata condita indica, in der Prager Taxe 1659: Nuc. ind. cond.), ebenso ein aus der Fruchtschale hergestelltes Gelée (maniessan pala, maniessan = Süßigkeit, Leckerei). Auch das Fruchtfleisch wird in Zucker oder Essig eingelegt als Konfekt oder Pickle in Indien gegessen. Die Macis wird von vielen Vögeln verspeist (s. oben S. 666).
Bei größeren Mengen der Droge ist narkotische Wirkung beobachtet. Es gibt noch heute Leute, die Muskatnüsse als sympathetisches Mittel gegen Furunkeln am Halse tragen. Muskatnuß[S. 686] gilt als Rheumatismusmittel und wird auch als Stomachicum, Stimulans und Carminativum bei Magen- und Darmkatarrh und Dyspepsie, auch als Substitut für Opium benutzt. Viel verwendet war GOELIS Kinderpulver (pulvis nucis moschatae cps. sive antiscrophulosus Goelisii). Ein Abortivum sind sie nicht, obwohl das Volk sie als solches gelegentlich benutzt. Die Maximaldose gibt U. S. Pharm. auf 0,5 g an. Es unterliegt keinem Zweifel, daß die Muskatnuß infolge von im Ruminationsgewebe sitzenden Substanzen unbekannter Zusammensetzung in größeren Dosen giftig wirken kann (bisweilen schon bei einer halben Muskatnuß). Schon RUMPH, BONTIUS, LOBELIUS, SCHMID und CULLEN berichten über solche Fälle und WIBMER hat die bis 1837 beobachteten zusammengestellt. (Einige Vergiftungsfälle auch in LEWINS Toxicologie.) PURKINJE schildert die Wirkung: Verringerung der Sinnestätigkeit, Trägheit der Bewegungen, an Besinnungslosigkeit grenzende Schlaflosigkeit; PEREIRA spricht von Betäubung und Gefühllosigkeit. HERMANN wollte schon im XVII. Jahrh. einen Stoff isoliert haben, der wie Opium einschläfernd wirkt (zitiert bei VALENTINI) Über die toxische Wirkung, die POWER und SALWAY auf das Öl beziehen, da sie weder Alkaloide noch ein Toxalbumin nachweisen konnten, vgl. CUSSNY, Proc. Royal Soc. Med. 1908, I, 39, WALLACE, Contrib. to medical research dedicat. to VAUGHAN. Ann. Arbor 1903, POWER AND SALWAY, Chem. exam. and physiol. act. of nutmeg. Amer. journ. pharm. 1908 und MENDELSOHN, Deutsch. Med. Wochenschr. 1907, 2201. Über die angebliche Abortivwirkung: F. JÜRSS, Beitr. z. Kenntn. d. Wirk. einig. als Volksabortiva benutzten Pflanzen (Tanacetum, Thuja, Myristica). Stuttgart 1904.
Muskatbutter wird im Archipel als Einreibungsmittel bei Rheumatismus verwendet, in Europa noch jetzt zu Einreibungen des Unterleibes (Magenbalsam), bei Kolik, Diarrhöe usw. (meist mit Wachs und Olivenöl gemischt, Balsamum nucistae). Das beim Volke beliebte KLEPPERBEINsche Magenpflaster enthält Ol. myristicae, wie das in Frankreich benutzte Pomatum nervinum.
Die auf den sich in der Nähe der Notenkombuis aufhäufenden und dort oft in besonderen Gruben verrottenden abgelösten Fruchtschalen sich entwickelnde Agaricinee (djamur pala = Muskatpilz) wird gegessen.
Geschichte. Die Alten kannten die Muskatnuß und die Macis nicht. Weder das κωμακόν des THEOPHRAST (vielleicht Cubebe?), noch das narcaptum (nascaphton) oder der βάλανος μυρεψικί (glans unguentaria [Moringa oleifera?]) des DIOSKURIDES, noch das caryopon des PLINIUS (das Samenöl einer syrischen Pflanze?), noch der macer, macir, machir, μάκειρ der Alten (nach THOMSON [Mitteilung an HANBURY] die Rinde des schon von ACOSTA als Macer abgebildeten Ailanthus malabarica DC.) beziehen sich hierauf. Das bei PLAUTUS (im Pseudolus III, 2) vorkommende Wort macis ist dort eine Phantasiebildung. Der Name macer wurde erst von SERAPION und AVERRHOES auf die Macis übertragen und blieb ihr dann. Nur eine einzige Stelle kann uns zweifelhaft machen, die nämlich bei CELSUS (V, 18): «glandis, quam βάλανον μυρεψικήν Graeci vocant, cortex», doch stimme ich WARBURG bei, daß auch hier nicht Macis gemeint ist. Es ist wahrscheinlich, daß die Myristica von den Ureinwohnern der Bandainseln gar nicht beachtet wurde (CRAWFURD). Den Indern war die Muskatnuß kaum viel früher wie den Europäern bekannt. Doch findet sie sich schon in SUŚRUTAS als dschati (= jadi) erwähnt (weitere Nachweise bei MARTIUS). Jedenfalls kam Muskatnuß erst durch die Araber nach Europa. Die erste, aber unsichere Erwähnung finden wir in einem Räuchermittel, Suffumigium moschatum, das AËTIUS (VI. Jahrh., vgl. I, S. 591) mitteilt. Dasselbe besteht aus Nelken, Nardus, Costus, Calmus, Santel und Nuces indicae; letztere können, wie CAESALPINI und FLÜCKIGER meinte, an dieser Stelle Muskatnuß bedeuten. Deutlicher erwähnt sie im VII. Jahrh. das syrische Compendium von AHROUN (ARON, bei SERAPION zitiert): Jeusbaue est nux muscata et affertur a India. Ausführlicher, auch über die Heilkraft, spricht sich dann ISHAC BEN AMRÂN (I, S. 598) aus (Stelle aus SERAPION zitiert bei WARBURG), der von der Macis bemerkt: Est cortex nucis muscatae und sie schon gut von der harten Samenschale und dem Samenkern unterscheidet. Muskatnuß steht im Kitâb aš šagar (vor 980).
Im X. Jahrh. erwähnt die Muskatnuß auch KURDADBAH (I, S. 616) unter den Ausfuhrartikeln Indiens. Weiter nach Osten verlegt MASUDI (I, S. 616) die Heimat und EDRISI (I, S. 617) nennt die Inseln des Meeres Senf (= Sandji, d. h. Sunda, WARBURG). Später finden wir sie dann bei RHAZES (I, S. 597), MESUË (I, S. 599), ALGÂFAQÎ (I, S. 608), der Macer und Macis gut auseinander hält, AVICENNA (I, S. 602), SERAPION (I, S. 604) und vielen anderen. Doch blieb die Pflanze noch lange unbekannt und noch IBN BATUTA hält im XIII. Jahrh. die Muskatnuß für die Frucht des Nelkenbaumes und Macis für die Blüte des Muskatbaumes, und JACOBUS[S. 687] VITRIACUS († 1244) und THOMAS CANTIPRATENSIS wiederholten das, was PLATEARIUS sagte: Le macis est le fleur ou l’ecorce de la noix muscade.
In der europäischen Literatur erwähnt die Muskatnuß zuerst SIMON SETH (I, S. 593) als κάρυον ἀρωματικόν und CONSTANTINUS AFRICANUS (I, S. 633) gedenkt sowohl der nux muscata wie der Macis. Wir finden sie bei der HILDEGARD (I, S. 667), die sich ausführlich über die medizinische Verwendung äußert, bei ALBERTUS MAGNUS (I, S. 675) im Grabaddin, im Antidotarium NICOLAI, bei MATTHAEUS SILVATICUS, SIMON JANUENSIS, im Circa instans (I, S. 635), in der Alphita (I, S. 654), bei HARPESTRENG im XIII. Jahrh. (I, S. 684) und in zahlreichen Taxen und Listen (I, S. 810 u. f.). NICOLAI erwähnt ein Oleum moschelinum (muscalinum), wozu Muskatnüsse («nuces indicae» — hier vielleicht aber Behennüsse?) gebraucht wurden.
Wir sehen, daß genuesische Kaufleute 115810 Pfund nucum muscatarum aus Alexandrien auf Lager hatten (FLÜCKIGER), finden die nois mouscades 1180 im Tarif der Zollstätte Accon (I, S. 699) Und 1228 unter den in Marseille zu verzollenden Waren (FLÜCKIGER), sowie 1191 unter den bei der Krönung Kaiser HEINRICHS benutzten Räuchermitteln (I, S. 715), beim Festspiele von Treviso 1214, wo eine von Damen verteidigte Burg unter anderem mit Muskatnüssen beschossen wurde, in der Kölner Verordnung 1259 (I, S. 712), in der Liste des bischöflichen Haushaltes 1303–1310 und vielfach anderwärts (Näheres bei WARBURG). Sie waren im XIII. Jahrh. schon nicht mehr unerschwinglich teuer, Anfang des XIV. Jahrh. wurden sie in Konstantinopel pfundweise (PEGOLOTTI) und 1380 in Brügge (wie die Macis = machos) schon ballenweise gehandelt. Immerhin wurden Muskatnüsse doch in Rezepten (z. B. im Antidotarium Nicolai) nicht dem Gewicht, sondern nach Stück verordnet und silberbeschlagene Muskatnüsse finden sich oft neben anderen Kostbarkeiten (noch 1519 in Zürich, KELLER), im Louvre auch aus Muskatnüssen hergestellte zierliche Gefäße aus dem XIV. Jahrh. In Stettin erhielt noch 1617 bei der Taufe jeder Gevatter «Neun Muscatennuß in Papier eingewükhlet».
Die richtige Erkenntnis, was Macis ist, die schon AMRÂN hatte, bricht sich aber erst im XIII. Jahrh. in der Alphita Bahn: «Macis non est flos nucis moscatae ut quidam credunt, sed adhaeret ipsi nuci moscatae circum quamque ut potest videri in avellanis». Ähnlich äußert sich wenig später SIMON JANUENSIS. Noch ALBERTUS MAGNUS, ja sogar noch CONTI (1419) hatten sie für die Blüte gehalten.
MARCO POLO erwähnt die Muskatnüsse, ebenso der Reisende MASUDI (916–920) von den östlichen indischen Inseln. Der erste Bericht aber über den Muskatnußbaum von einem, der ihn in seiner Heimat, als welche BARTHEMA schon Bandam nennt, gesehen, stammt von dem Portugiesen DUARTE BARBOSA (1516), in dessen berühmter Preisliste Muskatnuß und Macis figurieren (vgl. I, S. 741). — Erstere 1 farazuola zu 10–12 fanoes, letztere zu 25–30 fanoes —. (Vor der Entdeckung des Seeweges nach Ostindien kostete 1 Pfund Nüsse 4 sh 6 d, 1 Pfund Macis 9 sh (CRAWFURD) — etwa so viel wie eine Kuh!). 1623 war in London der Preis für ein Pfund Muskatnüsse 3 Shilling, für Macis 5½ - 8½ Shilling (FLÜCKIGER). PIGAFETTA (I, S. 742), der im Dienste Spaniens auf MAGALHAẼS Expedition die Maluccen betrat, beschreibt die Frucht nach eigener Anschauung vortrefflich.
Nachdem zuerst die Spanier, dann die Portugiesen (seit 1529) die Bandainseln besessen hatten, eroberten die Holländer die Inseln und errichteten (1602) die vereinigte holländische Kompagnie. Von 1608 an waren sie im alleinigen Besitz der Inseln, teilten das Land in einzelne Perks (1623), verjagten oder rotteten zunächst die Bevölkerung auf den Bandainseln (c. 10000 Eingeborene), dann (seit 1633) auch die Muskatnußbäume auf allen anderen Inseln des Archipels (Run, Rosengain, Seroua, Nila, Dammer, Kelang, Ceram, Gorom, Matabello, Tewer, Kouwer, Roma, Kisser usw., s. d. Karte auf S. 667) — etwa 60000 (LAUTS) — aus, führten Sklaven als Arbeitskräfte der Perkeniere ein, und bestraften die unbefugte Anpflanzung außerhalb der eigentlichen Bandainseln, sowie den Schmuggel mit Nüssen auf das härteste. Die Hongitogten (Hongizüge, Hongifahrten) waren Kontrollfahrten der Kriegsschiffe (vgl. I, S. 918), die durch Kommissarissen extirpateurs (ein hübscher Titel!) am Lande unterstützt wurden. Diese Hongitogten dauerten bis in die Mitte des XVIII. Jahrh. und wurden erst 1824 definitiv aufgehoben. Als Perkeniere wurden hauptsächlich ältere holländische Soldaten oder Beamte eingesetzt. Zur Verhinderung der Überproduktion und Preisdrückung wurde die Ernte oft jahrelang gespeichert oder ganze Schiffsladungen ins Meer versenkt oder große Vorräte verbrannt (1760 in Amsterdam, — pour huit millions argent de France! (BOMARE) — 1773 in Batavia c. 250000 Pfund.) Die Kompagnie, die das Gewürzmonopol etwa 200 Jahre besaß, zahlte von 1605–1700 zwischen 15 und 75%[S. 688] Dividende. Dann ging es mit ihr bergab und 1798 trat der Staat die Erbschaft der total verschuldeten Kompagnie an, die sich 1808 auflöste. Von 1796–1802 und 1810–1816 besaßen die Engländer die Bandainseln, von 1816 an gehören sie wieder den Holländern, die den Gewürzhandel zunächst als Regierungsmonopol betrieben (noch bis 1862 wurden die Muskatbäume auf den Nebeninseln ausgerottet!). 1864 erlosch auch dies. Seitdem Freikultur eingeführt ist, sind die Bandainseln in wirtschaftlichem Aufschwung. In China war die Muskatnuß kaum vor dem VIII. Jahrh. bekannt (BRETSCHNEIDER).
Im XVI. Jahrh. ging die Muskatnuß nach Lissabon, zur Zeit der niederländisch-indischen Kompagnie nach Holland. Dort wurden die Nüsse zu von der Kompagnie festgesetzten Monopolpreisen verkauft. Von 1600–1700 wurden im Jahre durchschnittlich bis 666747 Pfund Nüsse und bis 183270 Pfund Macis auf den Bandainseln produziert, von 1700–1777 zwischen 400- und 700000 Pfund Nüsse und 90–176000 Pfund Macis, 1860 wurde die Million Pfund überschritten (WARBURG).
Zuerst eine indische Kostbarkeit zu Geschenken an Vornehme, als Riechmittel, zu Räucherungen und Salben benutzt, dann (im XIV. Jahrh. und schon früher in Vorderindien, MARTIUS) wertvolles Gewürz, das aber, das zeigen uns die «Kochbücher», immer breiteren Schichten zugänglich wird — die Muskatnußreibe steht heute auf jeder holländischen Tafel — wird die Muskatnuß im XVI. und XVII. und besonders im XVIII. Jahrh. ein wichtiges Heilmittel, dem J. H. DIETZ 1681 eine Dissertatio unter dem Titel Moschocaryologia und CH. F. PAULLINI 1704 gar eine umfangreiche, 900 Seiten starke lateinische Μοσχοκαρυογραφία widmete (I, S. 926), in welchem kritiklosen Sammelsurium die Muskatnuß bei 138 (!) Krankheiten empfohlen wird. In nicht weniger als 86 Rezepten in des CORDUS Dispensatorium (I, S. 795) findet sich Muskatnuß oder Macis, und noch SCHRÖDERS wertvolle Pharmacopoea med. chym. (I, S. 890) enthält folgende Präparate: Conditae nucistae, Condita macis, Aqua nucistae, Oleum nucistae stillatum, Ol. nucistae expressum, Sal commune nucistae, Ol. macis stillatum, Ol. macis expressum, Extr. olei nucist. express., Balsamus Macis, Balsamus nucistae. Ende des XVIII. Jahrh. verblaßte ihr Ruhm, doch nennt noch MURRAYS Apparatus medicaminum (I, S. 952) eine ganze Reihe von Krankheiten. Ein Conditum nucum moscatarum sive indicarum findet sich in der Frankfurter Reformatio 1718 (I, S. 831).
Olij van muscatenn und oley van muscatenblomen sowie muschatenblomenconfect steht schon in der Lübecker Verordnung von Gewürtz und Apothekerwaaren um 1530, ja wir dürfen sogar schon in dem uille de musterlin des Inventar LEFORT 1439 (I, S. 811) Ol. myristicae sehen. Über die Bereitung der Muskatbutter aus den erwärmten und zerriebenen Samen mittelst einer Presse berichtet schon ACOSTA 1578 (I, S. 738) und auch LINSCHOTEN (I, S. 743) erwähnt, daß in Banda aus Nüssen und Macis Öl bereitet werde, und CLUSIUS sah Ol. nucistae 1581 bei dem Apotheker MORGAN in London in 1 : 3 : 3 Zoll großen Platten. Ol. nucistae und Oleum macidis finden sich dann in der Taxe von Worms (I, S. 817) und TABERNAEMONTANUS (I, S. 847) gibt bereits 1613 drei Methoden an, Ol. nucistae selbst herzustellen. Es kam im XVII. und XVIII. Jahrh. in guter Qualität aber auch aus Banda. Doch klagt bereits POMET (I, S. 941), daß es viel gefälscht werde. RUMPHIUS (I, 8. 899) und VALENTIJN beschreiben die Herstellung der Muskatbutter (das oly slaan = Ölschlagen) auf den Moluccen, die auch noch im XVIII. und XIX. Jahrh. dort geübt wurde (BOMARE, THUNBERG). In der Mitte des XIX. Jahrh. unterschied man meist englische (aus Penang) und holländische (aus Banda) Muskatbutter.
Das destillierte Muskatnuß- und Macisöl war bereits den Verfassern der Destillierbücher des XVI. Jahrh. (CORDUS, RYFF, PORTA, WINTHER, vgl. I, S. 875) bekannt. Sie finden sich in der Taxe von Berlin 1574, von Frankfurt und Worms 1582 und im Dispensator. Noricum 1589 (GILDEMEISTER-HOFFMANN). Aus Muskatnüssen destilliertes Öl erwähnt TABERNAEMONTANUS und GESNER. Es wurde noch in der ersten Hälfte des XIX. Jahrh. in Banda destilliert, neuerdings in Singapore und Benkulen, aber nur gelegentlich. Das Macisöl erwähnt DODONAEUS (im Cruydeboek 1563), ACOSTA (I, S. 738). RUMPHIUS und auch VALENTINI kannten außer dem destillierten auch ein rotes durch Auspressen aus der frischen Macis bereitetes und es scheint auch dem Destillat Macispulver zugesetzt worden zu sein, um ein gefärbtes Öl zu erhalten.
Die ersten chemischen Untersuchungen der Öle rühren her von: VALENTINI, Macis vulgo sed perperam Muskatenblume dicta. Diss. Gießen 1719. NEUMANN, Chymia medica 1749. BONASTRE, Trommsd. N. Journ. d. Pharm. 2 (1824) 231.
[S. 689]
GARCIA beschrieb zuerst die Frucht. Die erste richtige Beschreibung der Pflanze gab aber Clusius 1605 nach in Salzwasser eingelegten Fruchtzweigen (die Abbildung taugt aber nichts). Ausführlicher behandeln die Pflanze RUMPF (I, S. 899) und VALENTINI, dem wir ein gutes Habitusbild verdanken. Auch in NIC. SCHULTZE, Dissertatio de nuce moschata 1709 findet sich eine recht gute Abbildung, und gut ist auch der botanische Teil in C. M. VALENTINIS Dissertatio de macide 1719 (s. oben). Noch AMATUS LUSITANUS (1533), SCALIGER (1566), LONICER (1609) warfen Macis und Macer durcheinander.
Lit. MARTIUS, Z. Literaturgesch. d. Muskatnuß und Muskatblüte. Sitzungsb. d. Münch. Akad. 1860, 154 (Buchn. Rep. 9 [1860] 529). — WARBURG, Wer ist der Entdecker d. Gewürzinseln (Moluccen). Verh. Ges. Erdkunde 1896. — WARBURG, Die Muskatnuß 1897 (hier eine ausführliche historische Darstellung). — HEYD, Levantehandel. — FLÜCKIGER, Pharmakognosie. — FLÜCKIGER-HANBURY, Pharmacographia. — PEREIRA, Elements. — Über die Muskatbutter im XVII. Jahrh.: Fragmenta ex relatione jurata Abrahami Boudenii et Goerickii Hauptii Commissariorum desuper Arboribus Nucum Moschatarum earumque Viridario in Banda de Dato 20. Dez. 1682. De Padbrugge exhibita in Valentini Histor. simplic. reform. 1716 (Ref. in WARBURG, Muskatnuß). — C. M. VALENTINI, Dissertatio de macide 1716. — THUNBERG, Dissert. de myristica. Upsala 1788. — CRAWFURD, Dict. of the Indian Islands. — LEBER, Appréciation de la fortune privée an moyen âge 1847. — ROGERS, History of the agriculture and prices in England 1866.
Andere nutzbare Muskatarten.
Myristica argentea WARBURG, Neu Guinea oder Papua Muskat, Lange not, Nootmoschat van Nieuw Guinea, Papua noten, Mannetjes noten van Nieuw Guinea, Pferdemuskat. Ein im westlichen Neu-Guinea heimischer Baum von mittlerer Größe, mit breiter pyramidaler Krone und Stelzenwurzeln, bis 25 cm langen, elliptisch länglichen Blättern, deren Unterseite auf der Unterseite silberglänzend sind, weshalb WARBURG, der sie auffand, die Art als argentea bezeichnet.
Die großen kahlen, eiförmig-elliptischen, an beiden Enden abgerundeten Früchte werden bis 8,5 cm lang. Der rote, nur in wenige breite Lappen geteilte, sehr aromatische Arillus wird beim Trocknen dunkel schmutzig-rotgelb, gelbbraun, rot- oder graubraun. Der schlanke Same (Fig. 215) ist 3½-4 cm lang, gestreckt oval-elliptisch. Seine Schale zeigt seichte Arillusabdrücke. Ihr fehlt die Querfaserschicht (s. bei Myrist. fragr.). Das Endosperm ist stärkereich, die weitmaschigen, mehr zerstreuten und gröberen Ruminationsfalten stark aromatisch (Abbild. bei WARBURG, t. 2). Die zuerst von VALENTINI erwähnte, von PEREIRA richtig beschriebene und abgebildete Papuanuß, die in West-Neu-Guinea noch heute die Rolle des Geldes spielt, kommt regelmäßig, besonders aus der Landschaft Onin am Mc. Cluers Golf, in den Handel, meist unter dem Namen lange Muskatnuß, Long-Papua oder wild nutmeg. Sie bildet den wichtigsten Exportartikel Neu-Guineas und wird stets in der Schale exportiert. Bisweilen unterscheidet man Macassar- und Papuanüsse als verschiedene Sorten (nur die erstgenannten gelten als gut), doch besteht kein Unterschied (BUSSE). Der Export (besonders über Macassar, Singapore und Java) betrug Ende des vorigen Jahrhunderts c. 430000 kg mit Schale (= 250000 kg ohne Schale (WARBURG)). Ihr Preis beträgt kaum die Hälfte der echten Muskatnüsse, ihr Umsatz etwa 1⁄12 bis 1⁄10. Das Aroma ist der echten ähnlich, aber weniger fein, der Samenkern, da bröckelig, schlecht zu verreiben.
Same von Myristica argentea mit dem Arillus bedeckt.
[Nach Busse.]
Die Zusammensetzung der Papuamuskatnüsse ist im Durchschnitt in % Wasser 9,92, Stickstoffsubstanz 6,95, äther. Öl 4,7, Ätherextrakt 35,47, Stärke 29,25, stickstofffreie Extraktstoffe 8,93, Rohfaser 2,07, Asche 2,74, Alkoholextrakt 16,78 (KÖNIG). Der Fettgehalt ist etwa derselbe wie bei der echten (31,6–39,3% BUSSE), nach anderen 52 bis 54%. Das Fett ist heller als bei Banda-Muskat. Das ätherische Öl ist minderwertig (SCHIMMEL & CO.). Da sie nicht gekalkt werden, sind sie sehr dem Insektenfraß ausgesetzt.
Der Arillus, unter dem irreführenden Namen Foelieschillen, Macisschalen oder[S. 690] Macassarmacis im Handel — WAAGE schlug vor, sie Papua-Macis zu nennen — enthält sehr viel «Fett» (52–54% BUSSE), 8,75% «Stärke» und c. 3,5% äther. Öl, das aber ebenfalls minderwertig ist (SCHIMMEL & CO.). Die Asche beträgt 1,89–2,51%, ätherlösliches Harz 0,36 bis 1,39%, alkohollösliches Harz 1,74–2,09% (BUSSE). Das Fett der «Macisschalen» zeigt Schmelzpunkt: 28,5–29, Verseifungszahl: 148,2–148,8, Jodzahl: 71,3–73,4, Reichert-Meißlzahl: 1,6–1,7, Refraktometeranzeige bei 40°: 80–82 (SPÄTH).
Das Gewebe des Arillus enthält nur wenige Ölzellen. Die Epidermiszellen sind unregelmäßig, nicht radial gestreckt, die Amylodextrinstärkekörner sind ähnlich wie bei Bandamacis, sie werden von bisweilen krist. Fett begleitet (VOGL). Die Reaktionen mit Ammoniak und Kali sind undeutlich. (Anatomie der Samen und Arillen bei HALLSTRÖM.) Meist werden die Nüsse mit dem Arillus exportiert und dieser erst in Macassar oder Banda abgetrennt (WARBURG). Der Arillus der Myr. argentea riecht sassafrasähnlich (WAAGE). Die Macis ist im Handel meist nur in Bruchstücken zu finden. 1888 wurden schon 10445 kg «Macisschalen» in Holland zum Verkauf gebracht. 1894 kamen 13160 kg Papuamacis in den Handel. Die Samen wurden früher fälschlich von M. fatua abgeleitet.
Myristica fatua HOUTT., unechte Muskat, mal. Pala laki-laki (= männliche Muskat), in Banda: bala fuker (= Berg Muskat), mannetjes Noten (= männliche Muskatnuß, da angeblich die Zeugungskraft mehrend) (PISO, RUMPH). Ein dicht belaubter, diözischer, in Banda und Ambon heimischer Baum mit schmaler, nicht pyramidenförmiger Krone, aus der Stammbasis hervortretenden Adventivwurzeln (Abbild. in WARBURG, Monogr. t. XI), großen, bis 33 cm langen, auf der Unterseite infolge eines Haarüberzuges glanzlosen Blättern und großen, bis 7 cm langen, dicht rostrot behaarten, breitelliptiscben Früchten.
Der fast von der Basis an zerschlitzte Arillus hat ein wenig angenehmes, beim Trocknen schwindendes Aroma. Die bräunlichen Samen sind 3,5–4 cm lang und 2,5–3 cm breit und umschließen einen trockenen, fast gar nicht aromatischen Samenkern (WARBURG, t. III, Fig. 10 u. 11). Wird jetzt kaum noch gesammelt, aber in Südostasien medizinisch benutzt, doch sind Intoxikationen beobachtet (RUMPH). Die erste Beschreibung und Abbildung findet sich in LOBELIUS, Plantar. stirp. hist. 1576, ausführlicher bespricht sie CLUSIUS, PISO und VOGELS (Zehenjähr. Ost-Indian. Reisebeschr. 1704), sowie RUMPH. Näheres bei WARBURG. Die Anatomie der Samenschale und des Arillus bei HALLSTRÖM.
Myristica speciosa WARB. Batjan Muskat., in den Bergwäldern auf Batjan (s. d. Karte S. 667). Besitzt eiförmige Früchte, einen sehr aromatischen Arillus und eiförmige, c. 3,5 cm lange Samen, deren Kern sowohl in Form wie Aroma, wie auch dem Verlauf der Ruminationsfalten dem der echten Muskatnuß sehr ähnlich ist. Er enthält 34,3% eines bei 63° schmelzenden Fettes (GRESHOFF). Die Samen dieser Art sind den echten Muskatnüssen gleichwertig. Die Pflanze wird aber bisher nirgends kultiviert.
Myristica succedanea BL., Halmaheira Muskat. Die der M. fragrans sehr nahestehende, in Halmaheira (s. d. Karte S. 667) einheimische Art besitzt rundlich-eiförmige Früchte, deren Samen in Form, Geruch und Geschmack den Sem. myrist. ähneln.
Myristica Schefferi WARB., Oninmuskat in West-Neaguinea hat gewürzige Samen. Die Arillen von M. succedanea, M. speciosa und M. Schefferi sollen auch verwertbar sein (WARBURG).
Viele Arten, z. B. viele afrikanische und alle amerikanischen, besitzen kein Aroma. Andere gewürzige Arten in WARBURG (Die Muskatnuß).
Nicht gewürzig ist:
Myristica malabarica LAM., Malabarmuskat, wohl des CLUSIUS Nux myristica mas. Bei RHEEDE (Hort. malab.), der sie zuerst beschreibt: panam palka, noz de moluco falso, Nux myristica spuria (auch MAKHZAN EL ADWIYA erwähnt sie). Kleiner, eleganter, in Vorderindien (Westküste der Dekkanhalbinsel, Concan, Canara, Nord-Malabar) heimischer Baum mit rostroten Früchten, deren schlanke, zylindrische, bis 4,5 cm lange Samen (in Bombay: kaiphal) dicht von dem bis 6,5 cm langen Arillus bedeckt sind. Der Samenkern besitzt etwa die Größe und Form einer Dattel. Die schmalen Lappen des Arillus sind an der Spitze knäuelig zusammengedreht. (Fig. 216).
Die dunkelbraunrote bis purpurrote, nicht aromatische Macis dieser Pflanze erschien 1880 unter dem Namen Bombaymacis (in Bombay: rampatri) im Handel und ich habe dieselbe 1881 zuerst auch anatomisch beschrieben und abgebildet und namentlich auf die Unterschiede gegenüber der Bandamacis aufmerksam gemacht. Sie bestehen darin, daß dieser Macis meist[S. 691] innen eine dünne zerknitterte Haut (Epidermis der Testa) anliegt, daß die relativ großlumigen Epidermiszellen im Querschnitt meist radial gestreckt sind (Fig. 217) und Hypoderm meist fehlt, die ein braunes, die inneren ein gelbes Sekret führenden, bis 120 mik großen Ölzellen sehr viel zahlreicher und vorwiegend in den Randschichten auftreten, auch oft zu größeren Räumen verschmelzen, die Mitte des Arillus dagegen ölzellenfrei ist. FLÜCKIGER wies in der Besprechung meiner Mitteilung im Bot. Jahresber. 1881, II, 692 ganz richtig darauf hin, daß diese Macis nach DYMOCK von Myr. malabarica abstamme, deren Früchte DYMOCK (in der Mat. med. West. India 1883) beschrieb, welche Ableitung dann von WARBURG bestätigt wurde. Ich habe später mit HALLSTRÖM (Indische Fragmente 2, 1895) Samen und Arillen dieser und anderer Arten näher studiert und wir haben im Ammoniak, der Kalilauge (deren sich bereits HANAUSEK, FRÜHLING und SCHULZ bediente), dem Baryumnitrat und dem Kalibichromat (das bereits WAAGE benutzte) zur Unterscheidung vorzüglich brauchbare Reagentien gefunden (weniger Bleiessig, den HEFELMANN empfahl, HCl und H2SO4, die WARBURG benutzte, und die Filtrierpapierprobe des alkoholischen Auszuges, deren sich FRÜHLING und SCHULZ bedienten). Die genannten Reagentien geben starke Färbungen bzw. stark gefärbte Lösungen mit Bombaymacis, keine oder geringe mit Bandamacis und sind auch mikrohistochemisch brauchbar. BUSSE hat dann auch Barytwasser als unterscheidendes Reagens benutzt (s. oben S. 684 unter Verfälschungen). Die Grundparenchymzellen enthalten auch bei dieser Macis Amylodextrinstärkekörner, bei denen aber hier die rundlichen Formen prävalieren.
Myristica malabarica, Arillus (Bombay-Macis).
[Nach Busse.]
Bombaymacis enthält 29,59–34,2 Fett, 27,64–37,56% ätherlösliches Harz, 2,58–3,52% alkohollösliches Harz und 1,23–1,29% Asche (BUSSE). Nach ARNST und HART in Prozenten: Wasser 7,04, Protein 5,24, Fett 56,75, äther. Öl 0,25, in Zucker überführbare Stoffe 29,19, Holzfaser 8,17, Asche 1,36. Nach FRÜHLING und SCHULZ 5,8% Wasser, 39,2% Fett und 1,42% Asche. Der Farbstoff (C29H38O7?) soll aus einem krist. Chromogen (C29H42O5?) hervorgehen (HELD). Äther extrahiert auch 30,5% Harz, der die Farbstoffreaktionen gibt (SOLTSIEN). Der Ätherextrakt beträgt 56,7 (ARNST und HART) bzw. 61,9–67,1% (BUSSE). Die alkalische Lösung des Sekretes gibt im Spektralapparat ein breites Absorptionsband im Grün und Blau, das den alkalischen Auszügen der Bandamacis fehlt (TSCHIRCH). Dies ist das beste Unterscheidungsmittel (s. auch oben S. 684). Das Fett zeigt eine ganz von dem der Bandamacis abweichende Beschaffenheit. Schmelzpunkt: 31–31,5, Verseifungszahl: 189,4–191,4, Jodzahl 50,4–53,5, Reichert-Meißlzahl 1–1,1, Refraktometeranzeige bei 40° 48–49 (SPÄTH). Im Fett fand HILGER Stearin-, Palmitin- und Ölsäure, sowie Phytosterin. Bombaymacis enthält auch Dextrose (HELD) und angeblich vereinzelte Stärkekörner (?) (WAAGE). Bombaymacis wird in Indien als Tonicum und bei Erbrechen benutzt, auch als Gewürz (DYMOCK). Im Amsterdamer Handel heißt die Bombaymacis meist wilde Foelie oder Sorteering A und B.
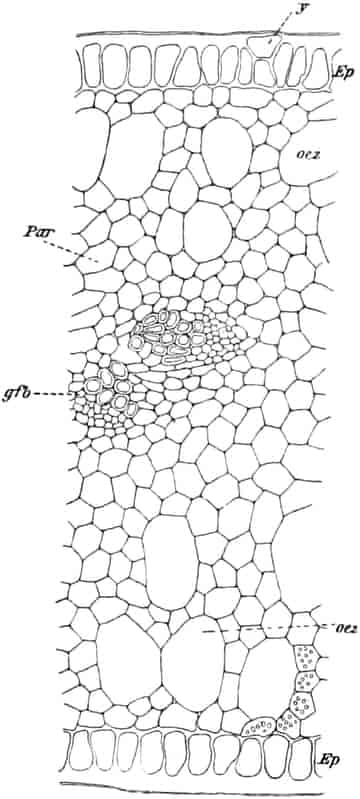
Myristica malabarica. Querschnitt durch den Arillus (Bombay-Macis).
[Nach Tschirch-Oesterle, Atlas.]
Auch die fetthaltigen Samen (in Indien: jangli-jaiphal) kommen in den Handel. Sie werden in Indien medizinisch benutzt, ebenso ihr Öl (Poondy oil). HOOPER fand in den Samenkernen (und der Macis) von M. malabarica in Prozenten: Wasser 6,9 (4,07), Fett und Harz 40,76 (63,26), Eiweißsubstanzen 6,5 (7,31), Kohlehydrate 42,18[S. 692] (20,8), Faser 2,33 (3,06), Asche 1,33 (1,5). Die Samen enthalten 29,6–34,2% Fett (Schmelzp. 31–31,5. Verseifungszahl 189,4 bis 191,4, Jodzahl 50,4–53,5), das frei ist von Myristinsäure.
Fettliefernd sind folgende Myristicaceen:
Myristica canarica BEDD. (candlenut tree) pindi, pundee-kai in Indien. HOOPER fand (1907) in den Samen (und der Macis) in Prozenten: Wasser 7,25 (5,15), Fett 49,4 (54,6), Proteinsubstanzen 7,31 (6,12), Kohlehydrate 14,65 (28,48), Faser 20,14 (3,4), Asche 1,25 (2,25). — Myristica angolensis WELW. enthält im Samenkern über 70% Fett. — Horsfieldia Irya (GÄRTN.) WARB., von Ceylon bis zu den Moluccen, liefert das Naharanfett, Früchte 18 mm Durchmesser. — H. Iryaghedi (GÄRTN.) WARB., von Ceylon, in Java viel kultiviert, tjampaka silan (= Michelia tjampaca von Ceylon), Früchte 3 cm lang. Das Fett dient zur Kerzenfabrikation. Die Samen sind ein Ersatz der Betelnüsse (Anatomie bei TSCHIRCH-HALLSTRÖM). — Gymacranthera canarica (KING) WARB. von Südindien, Samen 16 mm, liefern das Mangalorefett. — Pycnanthus Kombo (BAILL.) WARB., von Westafrika, von Sierra Leone bis Angola. Die 72% Fett enthaltenden Samen brennen wie Kerzen.
Virola surinamensis (ROL.) WARB. von Süd- und Mittelamerika, vom Amazonas und Guiana bis Martinique. Die 15 mm großen runden Samen (Ölnüsse, oil nuts, Ucuhubanüsse) sind Handelsartikel. Sie enthalten 73% Fett, das reich an Myristin ist und als Ölnußfett im Handel ist. Die Samen enthalten prächtig ausgebildete Aleuronkristalloide (TSCHIRCH). Bau der Samenschale bei TSCHIRCH-HALLSTRÖM. Das einen Ausfuhrartikel von Para bildende, von WARBURG zu dieser Pflanze gezogene Urukuba-, Ucuhuba-, Ucuaba-, Bicuiba-, Bicuhyba- oder Ocubafett, Ocubawachs, der Virolatalg, wird aber von MIKOSCH (in WIESNERS Rohstoffen) zu Myristica officinalis (MART.) WARB. und der wohl damit identischen (?) Virola Bicuhyba (SCHOTT) WARB. — der bekanntesten südamerikanischen Myristicacee — gestellt, von denen die zweite jedenfalls ein Samenfett aus Brasilien in den Handel liefert (die Samen sind nicht Handelsartikel). Es ist reich an Myristinsäure (REIMER und WILL) und riecht cacaoähnlich. Schmelzpunkt 42,5–43° (NÖRDLINGER). (Die Anatomie bei TSCHIRCH-HALLSTRÖM, die Keimungsgeschichte bei FRITZ MÜLLER.) — Virola sebifera AUBL., Talgmuskatnußbaum mit 8 mm großen Samen (mit 40–50% Fett). WARBURG glaubt, daß sich die Angaben AUBLETS (in Plant. de la Guayane) über Fettgewinnung aus dieser Art auf V. surinamensis beziehen. Jedenfalls ist das sog. Virolafett dem oben erwähnten sehr ähnlich. — Auch die peruanischen Virola peruviana (A. D. C.) WARB. und V. venosa BENTH. sowie die V. guatemalensis (HEMSL.) WARB. (Anatomie bei TSCHIRCH-HALLSTRÖM) liefern Fett, ebenso Dialyanthera Otoba (H. u. B.) WARB., die Moscada la Sᵃ Fé, das sog. Otobafett, die amerikanische Muskatbutter, die neben Myristin und Olein, Otobit (C24H26O5) enthält (URICOECHEA). — Die Samen des Cujo, Virola venezuelensis WARB. enthalten 47,5% Fett, das hauptsächlich aus Trimyristin besteht (THOMS und MANNICH). Über fettliefernde Myristicaarten vgl. auch WIJS, Vetten, Oliën en Wassen Beschreijv. Catal. Koloniaal Museum Haarlem 1906.
Lit. WARBURG, Über die nutzbaren Muskatnüsse. Ber. pharm. Ges. 1892, 211. — JOS. MOELLER, Über Muskatnüsse. Pharm. Centralh. 1880. — TSCHIRCH und HALLSTRÖM, Vergleich. anatom. Stud. über d. Samen d. Myristicac. u. ihre Arillen (Myr. fatua, malabarica, argentea, corticosa, cahyba, Bicuiba, subalulata, Teysmanni, glabra, Virola surinamens., guatemalens., sebifera. Horsfieldia Iryaghedhi, macrosoma, glabra, Knema intermedia, glauca). Arch. Pharm. 1895. — GRESHOFF, Teijsmannia 1890, 380. — TSCHIRCH-OESTERLE, Anatom. Atlas. — WAAGE (Papuamacis). Ber. d. pharm. Ges. 1891, 140. Pharm. Centralh. 1893, 131. — WARBURG (Papuanuß), Engl. bot. Jahrb. XIII, 311. — BUSSE a. a. O. — WINTON, OGDEN und MICHELL (Papuam.). Connect. Agric. Exper. Stat. 1898 u. 1899. — VORDERMAN, Pala lelaki. Teysmannia 1894. — Pharmacogr. indic. — WATT, Dict. econom. prod. — Myristica gibbosa u. Kingii. Agricultural Ledger 1900, Nr. 5.
Bombaymacis: TSCHIRCH, Pharm. Zeit. 1881, 556. — FRÜHLING und SCHULZ, Chem. Zeit. 1886, Nr. 34. — T. F. Hanausek, Jahresber. d. Wien. Handelsakad. 1887 (Jahresb. d. Pharm. 1887, 109) u. Zeitschr. f. Nahrmunt. 1890, 77; 1894, Nr. 1. — HEFELMANN, Pharm. Zeit. 1891, 122. — Waage, Ber. d. pharm. Ges. 1892, 229 u. 1893, 164. Pharm. Centralh. 1892, 372. — TSCHIRCH und HALLSTRÖM, Arch. Pharm. 1895 (mit 3 Taf.). — HILGER (und HELD), Z. chem. Charakt. d. Bombaymacis. Forschungsber. I (1894) 136. — HELD, Z. chem. Charakt. d. Samenmant. d. Myristicaart., spez. d. sog. Bombaymacis. Diss. Erlangen 1893. — SOLTSIEN,[S. 693] Pharm. Zeit. 1893, 467. — ARNST und HART, Zeitschr. angew. Chem. 1893, 136. — BUSSE a. a. O. — DYMOCK, Veg. mat. med. West. India 1883. — SPÄTH, Forschungsber. 1895, 148. — MUTER u. HACKMANN, Pharm. Journ. 29 (1909) 132. — VOGL, Nahrungsm. (dort mikrochem. Reaktionen). — HOOPER, The fats of indian nutmegs (Myr. canarica, malabarica, Bicuhyba, officinalis, surinamensis etc.). Agricult. Ledger 1907.
Bicuiba: BRANDES, Ann. Pharm. 7 (1833) 52. — TSCHIRCH (Ucuhuba). Arch. Pharm. 1887, 619. — LÉWY, Ann. chim. phys. (3) 13 (1845) 449. — PECKOLT, Zeitschr. Öster. Apoth. Ver. 1865, 484. Arch. Pharm. 107 (1861) und 108. — REIMER u. WILL, Ber. d. chem. Ges. 8, (1885), 2011. — VALENTA, Zeitschr. ang. Chem. 1889, 3. — NÖRDLINGER, Ber. d. chem. Ges. 1885, 2617. — STUTZER, Pharm. Centralh. 1887. — URICOECHEA (Otobafett), Lieb. Ann. 91 (1854) 369. — THOMS u. MANNICH, Gewinnung von Myristinsäure aus d. Sam. v. Virola venezuelens. Ber. d. pharm. Ges. 1901, 263. — FRITZ MÜLLER (Keimung), Ber. d. bot. Ges. 1887, 468.
Als Surrogate der Muskatnuß, die aber kaum als solche bezeichnet werden können, führt WARBURG folgende auf und bildet sie a. a. O. ab:
Calebassen-Muskatnuß von der Anonacee Monodora Myristica DUNAL. in Westafrika («Afrikanische Macisbohnen»). Die Samen enthalten ein äther. Öl, in dem sich l-Limonen, Myristicol, Pinen und Dipenten findet (THOMS, Bestandt. d. Samen von Monodora Myristica aus Kamerun, Arb. d. pharm. Inst. Berlin I, 1903).
Chilenische Muskatnuß von der Monimiacee Laurelia sempervirens (R. et P.) Tul. in Chile.
Pflaumen-Muskatnuß von der Monimiacee Atherosperma moschatum LABILL., in Australien.
Madagassische Muskatnuß von der Lauracee Ravensara aromatica. SONN. («nuces caryophyllatae», «clove nuts», «noix giroflé»). Vgl. SCHÄR, Notizen über Nuces caryophyllatae. Arch. Pharm. 223, 787.
Brasilianische Muskatnuß von der Lauracee Cryptocarya moschata MART. («noz muscada do Brasil»).
Guyana Muskatnuß von Acrodiclidium Camara R. SCHOMB. in Brit. Guyana («Wilde Muskat», «Camara- oder Ackawai-Nuß»).
Californische Muskatnuß von der Conifere Torreya californica TORR. («Californian nutmeg») von der Sierra Nevada (und T. taxifolia). Vgl. TORREY, Pharm. Journ. 14 (1854) 83, MÖLLER, Pharm. Centralh. 1880.
Macisbohnen, große, von Acrodiclidium Puchuri major (MART.) MEZ. vom Amazonas («Pichurimnuß»).
Macisbohnen, kleine, von Aniba Puchury minor (MART.) MEZ. vom oberen Amazonas.
2. Laurinsäuregruppe.
Die Vertreter dieser Gruppe enthalten neben Myristinsäure auch Laurinsäure, also Fettsäuren mit niedrigem Molekulargewicht. Sie geben daher eine hohe Verseifungszahl, und da sie nur wenig ungesättigte Fettsäuren enthalten, eine niedrige Jodzahl. Die Laurinsäure findet sich in den Lorbeerfrüchten, in den Früchten von Cylicodaphne sebifera (GORKOM) und von Mangifera gabonensis (OUDEMANS), im Cocosfett (GÖRGEY, OUDEMANS), im Walrat, den Pichurimbohnen (STHAMER), im Wachs der Beeren von Myrica cerifera (MOORE), im Fruchtfett von Litsaea sebifera, im Crotonöl (SCHLIPPE, S. 582), in dem von Coccus axin stammenden Axinfett (HOPPE-SEYLER) und (in beträchtlicher Menge) im Fett des Fieberbusches (Lindera Benzoïn). Nach PARTHEIL und FERIÉ ist sie in Fetten weiter verbreitet als bisher angenommen wurde. Sie fanden sie z. B. in beträchtlicher Menge in der Butter und dem Schweinefett. Sie kann aus den beiden zuerst genannten Materialien oder aus Tangkallafett, das 95,96% Trilaurin enthält, dargestellt werden (KRAFFT).
[S. 694]
Fructus Lauri und Oleum Lauri.
Syn. Baccae Lauri, Lorbeeren, — baccae κατ’ ἐξοχὴν sind baccae lauri — die Pflanze: Lorbeer, Lore, — Laurier commun. (franz.) — bay tree, sweet bay, true laurel, laurel tree, roman laurel (engl.) — alloro, lauro (ital.) — laurel (span.) — loireiro (port.) — laurierboom (die Früchte: bakke-laarboontjes, oder kurz bakke-laar) (holl.) — lagerbärsträd (schw.) — lawrowoe derewo (russ.) — δάφνη oder βαϊηά (gr.).
Bei HOMER, HESIOD, THEOPHRAST und DIOSKURIDES: δάφνη, bei PLINIUS, SCRIBONIUS LARGUS u. and.: laurus (die Alten bezeichneten mit laurus mehrere Pflanzen, auch z. B. Ruscusarten). — Bei den späteren Griechen: κοκκόδαφνον, βάκας, δαύνη. — Bei AVICENNA: granum ademest. — Bei ABU HANIFA: eldehmast (pers.), elrand (syr.). — Bei IBN BAITHAR: gâr, elgâr, rand. — Im Capitulare CARLS (I, S. 620): lauros. — Bei ALBERTUS MAGNUS (I, S. 674) und der HILDEGARD: laurus. — Im Gothaer Arzneibuch: lorbere, loerbere, lorebere. — In Circa instans: laurus. — In der Alphita: laurus i. e. dampnis. — Auch bei SERAPION, BARTHOLOMAEUS usw. (I, S. 646) dampnis oder damphius, dampnilion (oleum laurinum), damniechoticae (dampnothecae, dampnocoti = bacca lauri). — Im Inventar LEFORT (I, S. 805): bois (= baies) de lorier und uille de lorin (de bois de lorier). — In der Frankfurter Liste (I, S. 812): baccarum lauri. — Das in der Bibel vorkommende Wort ezrach (Psalm. 37, 35) bedeutet vielleicht Lorbeer. So wird es wenigstens vielfach übersetzt (TRISTRAM). Ob kelil auf Laurus geht (I, S. 489), ist zweifelhaft. — ROYLE hält das Malabatrum der Alten für Fol. Lauri (?).
Etym. Laurus fraglich ob von luo, lavo (= waschen); deutete dann auf den Charakter des Baumes als reinigender Sühnebaum, wahrscheinlicher von dem kleinasiatischen δυαρεία oder von kelt. blawr oder lauer (= grün) — δάφνη (wenn nicht aus einer kleinasiatischen Sprache) vielleicht von δέφω (= benetzen), also auf dasselbe wie oben (waschen) hindeutend, oder von einer Wurzel, die brennen bedeutet (LEGERLOTZ), also durch aromatische Räucherung reinigender Baum (SCHRADER) oder von φαίνομαι (= glänzen) mit dem verstärkenden δα wegen der glänzenden Blätter (KANNGIESSER). — Lorbeer aus ahd. lôberi = Beere des Lôrboumes, lôr (lore) ist laurus, der wohl schon vor dem VII. Jahrh. in Deutschland bekannt war (KLUGE). — althd. auch Lorblatt, mhd. lôrber, lorberepaum, lorbaum, lorper, bekeler, mnd. laurboum. — Der Titel Baccalaureus ist angeblich von baccae lauri abgeleitet.
Stammpflanze und Systemat. Stellung. Laurus nobilis L. Spec. plant. ed. I 369. (L. vulgaris BAUH.) Lauraceae, Lauroideae-Laureae. Laurus hat nur 2 Arten, die obige und Laurus canariensis (auf den Canaren und Madeira). Man unterscheidet von ihm folgende Varietäten: α latifolia NEES, β lanceolata MEISSN., γ angustifolia NEES, δ undulata MEISSN., ε floribunda MEISSN.
Beschreibung der Stammpflanze. Der diklin-diözische Lorbeer erreicht eine Höhe von 5–10 m. In Italien wird er 5–6,5 m hoch, in Istrien und Dalmatien in Forstkultur bis 15 m. Er besitzt eine dichte, ästige, runde Krone und kahle glänzende grüne Zweige. Die kahlen, glänzenden, immergrünen, infolge zahlreicher Ölzellen durchscheinend punktierten Blätter sind 6–12 cm lang, oblong-lanzettlich, spitz oder stumpflich, am Rande wellig (nicht gekerbt!) und tragen bisweilen auf der Rückseite in den Nervenachseln kleine Domatien (Milbenwohnungen). Die achselständigen Infloreszenzen bestehen aus 2–3 dekussierten Trauben, die 4–6 gelblich-weiße Blüten und eine Gipfelblüte besitzen. Die männlichen Blüten besitzen 4 Perigonblätter und 10 (8–12) in zwei- bzw. vierzähligen Wirteln angeordnete Stamina, deren große eiförmige Antheren nach Innen mit zwei Klappen aufspringen. Die Stamina des äußeren Kreises tragen am Filament je zwei gestielte Drüsen. In der Mitte der Blüte sitzt ein Griffelrest. Die weiblichen Blüten zeigen vier mit großen sitzenden Drüsen[S. 695] versehene Staminodien. Der einfächerige Fruchtknoten enthält ein anatropes hängendes Ovulum und trägt an der Spitze einen Griffel mit unregelmäßig gelappter Narbe.
Der Lorbeer ist eine Charakterpflanze des Mittelmeerdrogenreiches. Er findet sich noch jetzt wild (und zum Teil verwildert) in Kleinasien, Syrien, Griechenland, Dalmatien, Istrien, Italien, Sardinien, Spanien, Marocco, Algier. Kultiviert wird er im ganzen Mittelmeerdrogenreich und hält noch in Westfrankreich (Cherbourg) und Südengland, ja sogar in Irland und Schottland und an geschützten Stellen an den Schweizerseen aus. In den wärmeren Teilen Italiens und auf Sardinien wächst Laurus wild, Bestände bildend; weiter nördlich wird er kultiviert, wie bei Brescia und Verona, am Gardasee (Gargnano, Maderno), doch sah ich wilden (oder verwilderten?) Lorbeer auch am Lago di Lugano. Blütezeit: März und April; Fruchtreife im Herbst.
Lit. BAILLON, Monogr. d. Laurac. etc. Hist. d. pl. 1870. — PERROT, Contr. à l’étude histol. des Laurac. Thèse Paris 1891. — LUERSSEN, Med. pharm. Bot. (dort d. Lit. d. Familie). — Abbild.: BERG-SCHMIDT, Atlas, 2. Aufl. t. 125 (dort die botan. Lit.). — PABST-KÖHLER, Medizinalpfl. t. 1. — BENTLEY-TRIMEN, Med. plant. t. 221. — NEES VON ESENBECK t. 132. — HAYNE, Arzneigew. t. 18.
Morphologie der Droge. Die beerenartigen Steinfrüchte (in Italien: coccole di lauro) sind meist eirund, seltener kugelig, c. 8–15 mm lang, oben leicht bespitzt, am Grunde mit einer hellen Stielnarbe, außen dunkelolivgrün bis braunschwarz, runzelig, glänzend, innen gelb, einfächerig, einsamig. Die dünne, spröde und leicht zerbrechliche Fruchtschale ist mit der zarten Samenhaut verwachsen. Der endospermfreie Samenkern zerfällt leicht in die zwei plankonvexen, hellzimtbraunen Cotyledonen, die am einen Ende die kleine Plumula und Radicula einschließen. Die Früchte schmecken balsamisch-gewürzhaft, bitter und etwas herbe.
Anatomie. Die Epidermis des Pericarps der Drupa besteht aus 15–30 mik breiten getüpfelten Zellen, die ebenso wie die kleinzellige subepidermale Zellreihe einen in Chloral mit purpurroter Farbe sich lösenden Farbstoff führen. Spaltöffnungen sind wenig zahlreich. Das von (Spiralgefäße führenden) Gefäßbündeln durchzogene Mesocarp besteht aus dünnwandigem Parenchym, in dessen Zellen sich neben Chlorophyllkörnern braunrote Massen und Körner finden, die sich durch Eisenchlorid blau, durch Kali braungelb färben (VOGL) und, eingestreut in dieses, zahlreiche rundliche, 60–70 mik große Ölzellen mit verkorkter Wand, die einen Öltropfen oder einen Harzklumpen oder ein strahlig-fächeriges Kristallaggregat (VOGL) enthalten. Das Endocarp besteht aus großen, radialgestreckten, c. 75 mik hohen farblosen Palissadensklereïden mit buchtig-welligem Querschnitt. Die Samenschale besteht, abgesehen von der derberen Epidermis, aus einer obliterierten zartwandigen Nährschicht, in der zarte Bündel verlaufen. Die Cotyledonen sind von einer derben Epidermis bedeckt, unter der eine kleinzellige, ebenfalls stärkefreie Schicht folgt, und bestehen vorwiegend aus derbwandigem Parenchym, dessen Zellen, eingebettet in Ölplasma, zahlreiche rundliche oder ovale, einfache oder (oft zu 2 oder 3) zusammengesetzte, c. 3–8 mik große Stärkekörner und ein unregelmäßiges, lappiges oder länglich-kantiges, 10–30 mik großes, oft mit den Stärkekörnern verklebtes Aleuronkorn enthalten, das sich mit Cochenille färbt (VOGL). Eisenchlorid färbt den Inhalt, besonders der peripheren Zellreihen, olivbraun. In das Stärkeparenchym eingebettet finden sich auch hier verkorkte Sekretzellen mit innerer Celluloselamelle, deren Sekret (bald flüssig, bald fest) hier wohl, wie bei den Blättern, in einer resinogenen Schicht entsteht (TSCHIRCH und BIERMANN) und sich mit Safranin rot färbt. In dem Gewebe streichen zarte Bündel mit engen Spiralgefäßen,[S. 696] die von vereinzelten stabförmigen Librosklereïden begleitet werden. Letztere finden sich auch im Grundgewebe verstreut. Sie werden bis 120 mik lang und besitzen abgestutzte oder knochenförmige Enden und ein relativ weites Lumen (VOGL).
Im Pulver prävaliert die Stärke. Als «Leiter» dienen die Palissadensklereïden der Fruchtschale.
Verwechslung mit Kokkelskörnern wird angegeben. Aber diese sind sehr bitter, kugelig-nierenförmig und zeigen aufgebrochen zwei keulenförmige Einstülpungen der Fruchtschale, um welche sich der halbmondförmige Samen herumlegt.
Lit. VOGL, Kommentar 1908 (ausführliche Beschreibung) und Nahrungs- u. Genußm. — MOELLER-WINTON, Mikroskopie, Fig. 433–436. — MOELLER, Lehrbuch und Leitfaden. — PLANCHON-COLLIN, Drog. simpl. — WIGAND, Lehrbuch. — TSCHIRCH, Harze u. Harzbehälter. — RUDOLPH MÜLLER, Ber. d. Bot. Ges. 1905, 292.
Handel. Lorbeerfrüchte kommen vom Gardasee in Säcken von c. 90 kg, Lorbeerblätter aus der Levante in Ballen à 30, 50 und 100 kg in den Handel. Lorbeeröl, express. echt Gardasee ist in Kisten à 2 Can. à 18 kg und (das billigere) in Barrels von c. 200 kg im Handel (GROSSMANN). Lorbeerblätteröl war 1911 aus Dalmatien u. Syrien im Handel. Hamburg importierte 1907: 179300, 1908: 191200 kg Fol. Lauri besonders aus Griechenland, Kleinasien und (wenig) über Triest.
Chemie. Eine neuere Gesamtuntersuchung der Früchte fehlt. BONASTRE fand (1824) in Prozenten: Wasser 6,4, unkristallisierbaren Zucker 0,4, Stärke 25,9, Harz 1,6, «Öl» 12,8, «Stéarine» 17,1, Wachs 0,12, äther. Öl 0,8, Asche 1,4 und das kristallinische Laurin (Lorbeercampher, 1%), GROSOURDI 22% Stärke, Lauretin (?) und Lauretinsäure (?). Die obere Grenze der Asche beträgt 4% (Pharm. austr. VIII). Der Fettgehalt der Cotyledonen beträgt 30 (FLÜCKIGER) bis 31,5%. An Äther geben die Früchte c. 25% ab, nach dem Verjagen des ätherischen Öles auf dem Wasserbade bleiben 21–23% zurück (MÖLLER). Die Asche der Schalen beträgt 3,2, die der Cotyledonen 1,2%. Das ätherische Öl wird zu 0,8–1% angegeben.
Das Lorbeeröl oder Lorbeerfett, Oleum Lauri (Ol. lauri expressum s. unguinosum, Oleum laurinum, Lorbeerbutter, Loröl, Lorettosalbe, huile oder beurre de laurier; laurel oil, bayberry oil; olio oder burro di lauro, olio d’alloro; laurierolie; δαφνέλαιον) wird durch Auspressen der zerkleinerten und erwärmten frischen Früchte oder durch Auskochen mit Wasser erhalten und vornehmlich am Gardasee und auch in Griechenland für den Handel dargestellt. Die Gewinnung des Öles wird in Italien am Gardasee, bei Garguano und Maderno ziemlich in Großem vorgenommen. Zu diesem Zwecke werden die frischen Lorbeeren zuerst gestoßen, dann einige Zeit mit Dampf erhitzt oder mit Wasser gekocht und zwischen erwärmten Platten gepreßt. Das erhaltene Öl wird im geschmolzenen Zustande absetzen gelassen, klar abgegossen, im Dampftrichter filtriert und in Fässern von c. 100 kg in den Handel gesetzt (RAVASINI 1911). Pharm. austr. VIII. verlangt das aus den frischen Früchten durch Auskochen mit Wasser und Auspressen gewonnene Öl. Lorbeeröl ist ein salbenartiges, körnig-kristallinisches, grünes Gemenge von Fett, Chlorophyll und ätherischem Öl, das unter dem Mikroskope neben Chlorophyllkörnern zahlreiche Fettkristalle erkennen läßt und sich beim Erwärmen auf dem Dampfbade (ja schon bei 40°) zu einer dunkelgrünen, aromatisch riechenden, bitter schmeckenden Flüssigkeit klärt. An heißen Sommertagen ist es halbflüssig. Im gleichen Gewicht Äther oder Benzol löst es sich zu einer trüben Flüssigkeit, die jedoch keinen merklichen Bodensatz absetzt.
Spez. Gew.: 0,93317 (CLOËZ), bei 98,5°: 0,8806 (ALLEN), Erstarrungspunkt: 24–25° und Schmelzpunkt: 32–36° (VILLON, DE NEGRI) bis 30,2 (UTZ), Säurezahl 3,96–10,42 (EISENSTEIN), 7,89–42,42 (DIETERICH), 26,3 (LEWKOWITSCH),[S. 697] Verseifungszahl (mg KOH) 197,5–198,9 (ALLEN, DE NEGRI, LEWKOWITSCH), 201 bis 208 (EISENSTEIN), 200–214 (Ph. austr. VIII), bei heißer Verseifung: 196,32 bis 254,80 (DIETERICH), 200,9 (MATTHES), Jodzahl 67,8–80,5 (DE NEGRI, LEWKOWITSCH), 49 (HÜBL), 75–78,4 (WIJS), 82,2–82,43 (MATTHES), nach HÜBL-WALLER 74,7–83,92 (UTZ), Reichertzahl: 1,6 (ALLEN), Reichert-Meißlzahl 3 bis 3,2 (MATTHES, EISENSTEIN), 1,79–2,61 (UTZ), Polenskezahl: 2,8, Acetylzahl (wahre): 5,108 (MATTHES), Hehnerzahl (nach Abzug des Unverseifbaren): 85,8, Unverseifbares 1%; Brechungsexponent (bei 40°): 1,4645–1,4666 (Ph. helv. IV), 1,4643 (MATTHES).
Die Jodzahl der Fettsäuren liegt bei 81,6–82 (LEWKOWITSCH), 82,81–99,82 (UTZ); Refraktion der Fettsäuren 1,4545–1,4550 (UTZ).
Die Zusammensetzung ist nicht genau bekannt (BONASTRES Lauretin, Laurelsäure, Staurolaurin, Stearolauretin, Phaïosinsäure sind unreine Körper). Meist wird das bei 45° schmelzende Trilaurin (Laurostearin, BONASTRE, MARSSON), das Glycerid der Laurinsäure (MARSSON) als Hauptbestandteil angegeben (SCHIFF, MARSSON, STAUB); in geringeren Mengen finden sich darin die Glyceride der Myristinsäure (MARSSON, STAUB) und Ölsäure (FLÜCKIGER, wird aber bestritten); fraglich sind Palmitin-, Stearin- und Linolsäure (STAUB). ALLEN fand geringe Mengen flüchtiger Fettsäuren. Bei der Destillation im Vacuum tritt im Destillat Trilaurin auf (KRAFFT). Die von MARSSON 1842 entdeckte, seidenglänzende Nadeln oder Schuppen bildende Laurinsäure (C12H24O2) kann als eine gesättigte Säure (S. 546) nach dem Verfahren von PARTHEIL und FERIÉ über das Lithium- und Bleisalz von den ungesättigten Säuren getrennt werden. Das Unverseifbare («Harz» der früheren Autoren) besteht nach MATTHES und SANDER aus Myricylalkohol (Melissylalkohol C30H62O), dem festen Kohlenwasserstoff Lauran (C20H42, mit Bryonan verwandt), Phytosterin (F = 132–133°) und einem ungesättigten Öle mit der Jodzahl 191,95, das noch nicht rein erhalten werden konnte. Aus der Jodzahl des Ol. lauri kann also nicht, wie dies LEWKOWITSCH tut, auf einen beträchtlichen Gehalt an Ölsäure geschlossen werden. Sie wird durch dies Öl, das einen sehr charakteristischen aromatischen Geruch besitzt, erklärt. In siedendem Alkohol löst sich Lorbeeröl so gut wie vollständig. Beim Erkalten scheidet sich Trilaurin ab (FLÜCKIGER, LEWKOWITSCH). Läßt man das Filtrat verdunsten und nimmt das Fett weg, so scheidet sich bisweilen das Laurin (BONASTRE, nach DELFFS = C22H30O3 Lorbeerkampfer?) ab, das zu 1% im Fett enthalten sein soll und wohl ein unreines Gemisch der von MATTHES erhaltenen Körper darstellt. MARSSON und STAUB konnten den Körper nicht erhalten.
Das dem fetten Öle beigemengte ätherische Öl, das als «äther. Lorbeeröl aus Früchten» im Handel ist (SCHIMMEL, HÄNSEL), enthält viel (50%) Cineol (wohl der Laurineenkampfer der früheren Autoren) neben l-Pinen (WALLACH) («Lauren» ist ein Gemenge beider). Die Nelkensäure (GLADSTONE) fand BLAS nicht. Eugenol (GLADSTONE) konnte FLÜCKIGER nicht darin finden, ist aber wohl darin. Bei der Destillation des Lorbeeröls mengt sich dem ätherischen Öle Laurinsäure bei (BLAS, vgl. S. 546). Ob das äther. Öl des Ol. laurin. mit dem der Blätter ganz identisch ist, ist noch fraglich. Das Öl der Beeren ist etwas dickflüssiger und riecht weniger fein als das der Blätter (SCHIMMEL & CO.). In diesem letzteren wurde gefunden: Cineol (WALLACH, 50% THOMS und MOLLE), l-Pinen (WALLACH), Eugenol (frei [1,7%] und verestert [0,4%]), Geraniol (THOMS), Sesquiterpen, Sesquiterpenalkohol,[S. 698] vielleicht auch Phellandren (HÄNSEL), Buttersäure, Essigsäure, Valeriansäure und Capronsäure, die Säuren frei, die drei letzteren auch als Ester.
Das Ol. laurin. gibt im Spektralapparat die charakteristischen Chlorophyllbänder (TSCHIRCH). Daß das Chlorophyll meist in ein Metallsalz (Zink- oder Kupferphyllocyanat TSCHIRCH) übergeführt ist, zeigt die Tatsache, daß eine Lösung des Lorbeeröls in Alkohol durch Salzsäure nicht verändert wird (reines Chlorophyll wird durch Salzsäure gelb, TSCHIRCH). Auch Ammoniak verändert die grüne Farbe nicht.
Das indische Lorbeeröl (Indian Laurel oil) stammt von Laurus indica (welcher?). Das dickflüssige Öl enthält 33% freier Fettsäuren, hat ein spez. Gew. 0,926, und erstarrt auch bei −15° noch nicht. Verseifungszahl 170, Jodzahl 118,6 (DE NEGRI und FABRIS, Chem. Zeit 1896 Rep. 161).
Lit. BONASTRE, Baies de laurier et de leur mat. crist. Journ. pharm. (2) 10 (1824), 30 u. 11 (1825) 3. — BRANDES, Arch. Pharm. 72 (1840) 160. — MÖLLER in FLÜCKIGER, Pharmakogn. — GROSOURDI, Journ. chim. med. 1851, 562.
Fettes Öl: DELFFS, Lieb. Ann. 88 (1853), 354. — BOLLEY, Ebenda 106, 229. — MARSSON, Ebenda 41 (1842), 329. — STHAMER, Ebenda 53 (1848) 393. — GÖRGEY, Ebenda 66, 303. — BLAS, Ebenda 134 (1865). — SCHLIPPE, Lieb. Ann. 105 114. — HEINTZ, Poggend. Ann. 92, 429 u. 93, 519. — OUDEMANNS, Journ. pr. Ch. 81, 356. — LEWKOWITSCH a. a. O. — BENEDIKT-ULZER a. a. O. — SCHÄDLER a. a. O. — STAUB, Bestandt. d. Lorbeeröls. Diss. Erlangen 1879. — MATTHES und SANDER, Lorbeerfett, insbes. über d. unverseifb. Anth. Arch. Pharm. 1908, 165. — KRAFFT, Ber. d. chem. Ges. 13, 1415. — DE NEGRI und FABRIS, Zeitschr. Anal. Chem. 1894, 547. — SCHÄDLER, Zeitschr. Anal. Chem. 1894, 569. — SCHIFF (Laurostearin), Ber. d. chem. Ges. 1874, 781. — PARTHEIL und FERIÉ, Arch. Pharm. 1903, 552. — RÖMER, Diss. Halle 1882.
Äther. Öl: WALLACH, Lieb. Ann. 252 (1889) 95. — GLADSTONE, Journ. chem. soc. 1864, 2, 1 (Jahresber. d. Chem. 1863, 547). — FLÜCKIGER, Pharmakogn. — BLAS, Lieb. Ann. 134 (1865) 1. — BRÜHL, Ber. d. chem. Ges. 1888, 157. — F. MÜLLER, Ebenda 1892, 547. — BARBAGLIA, Att. soc. toscan. scienz. nat. 1889 (Pharm. Journ. 1889, 824). — GILDEMEISTER-HOFFMANN, Äther. Öle S. 524. — STAUB a. a. O. — THOMS und MOLLE (Äth. Öl der Blätter). Arch. Ph. 1904, 161; auch Arb. d. pharm. Inst. Berlin I, 1903 und MOLLE, Diss. Basel 1903. — SCHIMMELS Ber. 1897, 1899, 1909. — HÄNSELS Ber.
Darstellung des Ol. lauri: MÉNIGAULT und SOUBEIRAN, Journ. pharm. 1835, 510 und SOUBEIRAN, Nouv. trait. d. ph. — DUHAMEL, Traité d. arbres etc. I, 351. — PEREIRA, Elements.
Prüfung. Wenn man 1 Teil Lorbeeröl mit 2 Teilen Alkohol (90%) auf dem Dampfbade erwärmt, so darf die hierbei entstehende Abscheidung bei der mikroskopischen Prüfung keine Kristalle (Beschwerungsmittel) und auch keine Gewebsreste der Lorbeerfrucht oder andere Elemente zeigen. Sind fremde Farbstoffe zum Auffärben benutzt worden, so bewirkt Salzsäure oder Ammoniak einen Farbenumschlag in dem alkoholischen Auszuge des Öls. Es sind (durch Erwärmen mit Lorbeerfrüchten oder -blättern) parfümierte und (mit Curcuma, Indigo, Anilinfarben, Chlorophyllauszügen) gefärbte Surrogate aus Talg, Öl und Schweinefett im Handel beobachtet (das «Chlorophyll» des Handels enthält meist Kupferphyllocyanat TSCHIRCH). Derartige Falsifikate wurden schon im XVII. Jahrh. beobachtet (POMET). Fremde Farbstoffe (z. B. Curcuma, Indigo) sind meist in Benzol nicht löslich. Curcuma wird durch Ammoniak braun, Teerfarben (oft) durch Salzsäure gelb. Schweinefett kann mit der Cholesterinacetatprobe nachgewiesen werden (BÖMER, Zeitschr. Nahr. u. Gen. 1901, 1091).
Lit. UTZ, Pharm. Praxis 2 (1903), 354. — MORPURGO, Riv. chim. farm. (Bull. sc. pharm. 1905, 255). — Helfenberger Ann. 1900, 902, 1904.
Anwendung. Lorbeerfett, beim Volke noch sehr beliebt, ist ein Bestandteil sog. Nervensalben (Ungt. rosmar. cps. und Ungt. nervinum) und dient zu Einreibungen bei Rheumatismus, auch gegen Krätze und in der Tierheilkunde («Alte lorie»). Die Hiengfongessenz ist ein kampferhaltiger parfümierter Auszug aus Lorbeerblättern und Früchten. Die STURZENEGGERsche Bruchsalze enthält Ol. laurin. Das rohe Fett scheint im Norden bei Samojeden und Lappen als Genußmittel beliebt zu sein[S. 699] (FLÜCKIGER). 1907 wurden in Plymouth vom Volke die Früchte als Abortivum benutzt (HOLMES, Pharm. journ. 1910). Lorbeeröl gilt als gutes Insektenschutzmittel (Bremsenöl). Die Früchte wie die Blätter dienen als Gewürz. Der Geruch des Lorbeer gilt als den Verwesungsgeruch vertreibend. Lorbeerblätter dienen in Süditalien als Packmaterial für Succus Liquiritiae und Feigen (RAVASINI).
Geschichte. Lorbeergewächse sind in Mitteleuropa schon im Tertiär nachzuweisen. Laurus nobilis ist im Travertin bei Rom und Florenz, in quaternären Tuffen (mit der Feige) in Frankreich gefunden worden. Während also der Baum in Südeuropa heimisch ist und von hier nach Osten vordrang, ist der eigenartige Kultus des Lorbeers von Kleinasien über Thrakien nach Europa gelangt. Der Lorbeer, die δάφνη der Griechen (so schon bei HOMER), wurde schon frühzeitig ein Götterbaum. Daphne, die liebliche Tochter des Flußgottes, von Apoll verfolgt, flehte um Verwandlung in einen Baum, und wurde in einen Lorbeer verwandelt — mit seinen Blättern bekränzte Apoll sich dann die Schläfe. APOLLO KATHARSIOS erwählte ihn sich «als Zeichen der von ihm ausgehenden Reinigungen» (HEHN). Er ist der Baum der Sühne. Er findet sich bei allen apollinischen Heiligtümern, dem APOLLO zu Ehren wurden die Daphnephorien (Sonnenfeste) in Theben gefeiert, um den Dreifuß der PYTHIA schlangen sich Lorbeerzweige; es war der prophetische Baum (μαντικόν φυτὸν). Der Lorbeerkranz schmückte den Seher und Sänger; das Lorbeerreis diente zur Abwehr von Unheil und Krankheit; das Kauen seiner Blätter verlieh prophetische Gaben, das Besprengen mit ihm reinigt (Lustratio), es schützt vor Blitzgefahr. Der Lorbeer ist das Symbol des Sieges, des Friedens, des Ruhms, der Tugend, der Jungfräulichkeit, der Wahrheit.
THEOPHRAST behandelt den Lorbeer eingehend, auch seine Kultur, und HIPPOCRATES bediente sich der Früchte, der Blätter und des Öls. Auch in Italien war der Lorbeer, Laurus, immer Tempel- und Gartenbaum. Er findet sich denn auch jetzt noch gewöhnlich nicht in den Macchien und war ein heiliger Baum. PLINIUS sagt: «adeoque in profanis usibus pollui laurum et oleam fas non est.» Mit ihm schmückten die Römer nicht nur APOLLO und BACCHUS, sondern auch die LIBERTAS, SALUS, AESCULAP und HERCULES und er spielte auch bei dem Feste des MERCUR eine Rolle, war doch DAPHNIS ein Sohn des HERMES. Mit Laurus wurden die Sieger in Delphi und die Triumphatoren in Rom (wie noch heute wahres und vermeintliches Verdienst) gekrönt, wie schon PLINIUS (XV, 39) berichtet, welcher vielerlei von ihm erzählt und meint, daß er beim Brennen durch lautes Knistern einen Abscheu vor dem Feuer andeute. Sein Laub wird, was dem Blatte keines anderen Baumes geschieht (als Laurea), besonders vom Baum unterschieden. Er findet sich auf einem Wandbilde in Pompeji. PLINIUS berichtet auch (XV, 7), daß das Lorbeeröl entweder durch Pressen aus den Früchten oder aus den Blättern und Fruchtschalen mit dem Öl der unreifen Olive bereitet werde und daß man ihm bisweilen Styrax und andere wohlriechende Stoffe zusetze. DIOSKURIDES (I, 49) läßt δαφνέλαιον — ebenso wie PALLADIUS das oleum ex lauri baccis — durch Auskochen überreifer Früchte mit Wasser und Abschöpfen des Öls bereiten oder aus Olivenöl mit Lorbeerblättern oder Früchten. Er rühmt seine anregende Wirkung und weiß, daß es brechenerregend ist. Das Oleum laurinum steht neben Lauri bacae bei SCRIBONIUS LARGUS (I, S. 578), das δάφνινον ἔλαιον auch bei ALEXANDER TRALLIANUS (I, S. 591).
Den Baum kennt CARL und ALBERTUS MAGNUS. Wir finden Lorbeeröl im Gothaer (I, S. 679), die Blätter des Lôrbaumes im Tegernseer Arzneibuch. Die HILDEGARD empfahl Früchte, Rinde und Blätter des Baumes, und zu gleicher Zeit wird auch das Öl in England genannt (von ALEXANDER NECKAM) und in der Alphita (I, S. 652) steht bei Laurus: «Inde dampnocce et dampnelicon (i. oleum confectum ex oleo et baccis lauri)». Die arzneiliche Anwendung der Beeren erwähnten ISHAK BEN AMRAN, RHAZES, ELGÂFAKI u. and. Das Öl scheinen die Araber nicht benutzt zu haben. Ein Magenmittel der HILDEGARD enthält sowohl Rinde wie Blätter des Lorbeer, ein Mittel gegen Nierengeschwulst des Tegernseer Arzneibuchs (XIII. Jahrh.) die Blätter. ABU HANIFA erwähnt Lorbeerwein. Blätter, Früchte und Öl waren schon im Mittelalter beliebte Gewürze. So findet sich oile laurin in der Liste der 1359 und 1360 für den in London gefangen gehaltenen französischen König JOHANN angeschafften Gewürze (FLÜCKIGER, Pharmak. S. 931). Und 1434 nahmen die Dänen Schiffern aus Danzig u. a. auch drei Tonnen Lorole weg (Hansarecesse II, 1 [1876] 283, bei FLÜCKIGER). Nach dem Luminare majus (I, S. 793) soll Ol. laurinum durch Kochen der zerriebenen frischen Früchte mit Wasser,[S. 700] Kolieren, Abschöpfen des Öls und Wiederholen der Operation bereitet werden. Lumen apothecariorum läßt die Fruchtschale zuvor beseitigen. Bei CORDUS (I, S. 800) finden sich Lauri baccae, Laurus (fol.) und Laurinum oleum. Er erwähnt, daß es besonders aus Italien komme und bisweilen aus Olivenöl, Lorbeerblättern und Grünspan nachgemacht werde. Im Braunschweiger Register (I, S. 814) steht ol. de bacc. lauri neben ol. laurinum (wohl das mit Ol. Olivae bereitete). Die Lauri folia, daphnidis folia stehen in der Taxe von Worms (I, S. 817) und in anderen Taxen, das ätherische Lorbeeröl in der Frankfurter Taxe von 1582. In der Taxe von Bremen 1665: Baccae lauri longae et rotundae. Bei BERLU (I, S. 950) steht außer baccae lauri, Ol. laurin. com. und Ol. laurin. fland. ein Oleum nervinum, das wohl ein Ol. lauri comp. war. POMET (I, S. 941), der von einer Verwendung der Früchte bei den Färbern und des Öls bei den Hufschmieden spricht, sagt, daß das Öl, das nur wenig in der Pharmazie benutzt werde, in dem Languedoc und der Provence, besonders in Caluisson bei Montpellier, aus frischen, mit Wasser gekochten Früchten dargestellt werde. Er knüpft an die häufige Verfälschung oder gar Substitution desselben durch graisse Verdit eine Betrachtung über Fälschung von Drogen überhaupt.
Lit. HEHN-SCHRADER, Kulturpfl. — GUBERNATIS, Mythologie d. plant. — FLÜCKIGER, Pharmakognosie. — MAYER, A library of national antiquities I, 1857. — TRISTRAM, Nat. hist. of the bible.
Fructus Cocos, Copra und Oleum Cocos.
Syn. Kokospalme, Cocotier (franz.), Cocoanut, coconut (engl.), Klapper- oder Kalappusboom (hol.), Cocco (ital.), coco (span.), coquo, coqueiro (port.). Im malaiischen Archipel: kalapa, klapa, klopo (jav. mal. sund.) — bei RUMPHIUS und THUNBERG: kulapa — andjoro (Saleijer) (Zahlreiche and. Namen in DE CLERCQ, Woordenboek) — in Rioux: anur — in Indien: nárel, nárryal (hind. beng.), náriyál (guz.), tenha (tam.), tengino-káyi (can.), tenga (malab.), pol, polgahá (singh.) (Zahlreiche weitere Namen im Dict. econom. prod. India) — in Ceylon: tenkay. — Chines.: ye-tsu (= Baum Ye, Kopf des Königs von Yüe) — in Brasilien: inaiaguacuiba — in Chile: cocotero. — Cocos ist indeklinabel, also nicht Oleum cocois.
Die Nux indica des Mittelalters — so z. B. bei SERAPION (I, S. 605) und bei CORDUS — war in erster Linie die Cocosnuß. Jedenfalls die N. i. magna (so in der Alphita). Bei CLUSIUS (I, S. 786) steht Coccus Nux indica, im Nördlinger Register wird Nux magna s. communis (die Cocosnuß) der Nux indica gegenübergestellt. In der Braunschweiger Taxe (1574) heißt die Copra: Nucis indicae maio. pulpa, in der Kopenhagener Taxe (1619): Nucis indicae medulla.
Etym. Cocos (seit MAGALHAẼS in Gebrauch) von port. coco, coquo = Maske, da die geschälte Frucht drei Öffnungen hat, die sie dem Gesicht einer Meerkatze (macoco) ähnlich macht (GARCIA DA ORTA). Auch die Hindus nennen sie náral (= Kopf) und benutzen sie bei gewissen Ceremonien als Kopf für Puppen. Ich sah solche Puppen auch in Java. — Der Sanskritname nalikera, narikela ging ins Persische (nargil) und Arabische (narjil) über und kehrt im Taïtaischen ari, haari und malaiischen nura und auch in dem argéllia bei KOSMAS ALEXANDRINUS wieder. — Das sumatranische njior kehrt im philippinischen niog, im Bali njo, in Tahiti niuh und im madagassischen wua-niu wieder. — Das malabarische tenga = Südfrucht. — Bei den Sanskritschriftstellern finden sich die bezeichnenden Synonyme punga (= erheben), rasayana-taru (= Delikatessenbaum), trinaraja (= König der Gräser), scanda taru (= Stammbaum), dur aroha (= schwer zu besteigen), kurcha sekhara (= gekrönt mit einem Bündel Früchte), dridha phala (= harte Frucht habend), rasa phala (= saftige Frucht habend), dridha nira (= starken Saft habend), langala (= penis), sada phala (= immer Frucht), dirghawr kscha (= Langbaum), kalpawr kscha (= nützlicher Baum), — Nucifera = Nüsse tragend, — Copra (schon bei GARCIA DA ORTA) von khóprá (hind.), — Coir, keir oder kair (sansc. kera) aus ind. kayaru (= flechten). — Arrak (arak, arack, arrack) aus orraqua (ind. = Palmbranntwein, so schon bei GARCIA).
Stammpflanze und Systemat. Stellung. Cocos nucifera L. Spec. pl. ed. I 1188. (und in beschränktem Maße auch Cocos butyracea L. «La Palma real del Brasil»), Palmae, Ceroxylinae — Cocoineae — Attaleeae, Unterg. Eu-Cocos. Die 30 Arten der Gattung Cocos sind in Amerika heimisch (wegen C. nucif. s. Geschichte).
[S. 701]
Cocos nucifera bildet zahlreiche Varietäten. Schon GARCIA DA ORTA erwähnt zwei, von denen die eine zur Bereitung des Palmweins (çura), die andere wegen der Früchte gehalten wird. RUMPH hat 10 Varietäten Calappa. BLUME nennt in der Rumphia 18 auf den Sundainseln und 39 auf den Philippinen. Die Varietäten haben verschiedenen Wuchs und verschieden große Früchte. Im malaiischen Archipel unterscheiden die Eingeborenen durch besondere Namen besonders die Var. alba, canarina, cupuliformis, eburnea, machaeroïdes, macrocarpa, pumila, regia, rubescens, saccharita und viridis (DE CLERCQ). Weitere in TSCHIRCH, Ind. Heil- u. Nutzpflanzen, S. 148. Dort auch die ceylanischen Varietäten. Zur Coirbereitung dienen besonders die Var. rutila, cupuliformis und stupposa. Die Varietäten von Ceylon, Nouméa, den Seychellen, Pondichéry, Mayotte, Madagaskar und Sansibar beschreibt PRUDHOMME. Ceylon hat 8, Neu-Guinea und Bismarckarchipel 10 bis 12, Samoa 6.
Beschreibung der Stammpflanze, Morphologie und Anatomie der Frucht. Die Cocospalme bildet einen schlanken, in leichtem Bogen aufwärts strebenden, bis 25 m hohen Baum, an dessen durch Blattnarben geringeltem, an der Basis angeschwollenem und dort mit Adventivwurzeln besetztem Stamme ich niemals Epiphyten sah. Seine riesige, aus 10–30, bis 4 ja 6 m langen Blättern bestehende schöne, im Umriß kreisförmige Krone scheint fast zu schwer für den dünnen Stamm (Fig. 220, vgl. auch I, Fig. 19 u. 32 u. Taf. IV). In den Blattachseln stehen die bis 2 m langen monözischen, von einer meterlangen Spatha bescheideten Blütenkolben, meist zu mehreren, die mit unscheinbaren, gelblichen, männlichen, 6 Stamina und 6 lanzettliche Perigonblätter enthaltenden Blüten besetzt sind und nur am Grunde ansehnlichere, gelblich-grüne, weibliche Blüten tragen, die, umgeben von derben Perigonblättern, einen aus drei Fruchtblättern bestehenden Fruchtknoten mit sitzender Narbe zeigen. Jeder Fruchtstand, von denen die Palme mehrere bildet, enthält 10–30 Früchte.

Cocos nucifera mit Früchten beladen.
[Koloniaal-Museum Haarlem.]
Die meist kopfgroße, bis 30 cm lange, eiförmige, stumpf-dreikantige Frucht, welche in 6–8 Monaten zur Reife kommt, ist eine einfächerige, einsamige Drupa (Steinfrucht, also fälschlich: Cocosnuß genannt). Zwei Fächer des Fruchtknotens schlagen fehl. Das Epicarp ist derb, graubraun und glatt und infolge eines Wachsüberzuges von Wasser nicht benetzbar. Die Frucht kann daher, ohne daß sie leidet, durch die Meeresströmungen weithin getragen werden. Das Mesocarp ist bis 5 cm breit, grobfaserig. In ein aus getüpfelten Zellen bestehendes, schon beim Trocknen der Frucht schwindendes Grundgewebe sind zahlreiche, von derben Bastbelegen bescheidete Gefäßbündel eingebettet, die als Coïr oder Cocosfaser Verwendung finden. Die Bastfasern der Coirbündel werden von Sklereïden und Kiesel-Stegmata begleitet. Das steinharte, 0,3 bis 1 cm dicke, aus braunen, stark verdickten Sklereïden bestehende Endocarp zeigt drei große Keimlöcher (K Fig. 219). Mit ihm verwachsen ist die dünne braune Samenschale und das an diese sich anschließende 0,7–2 cm dicke weiße, derbfleischige Endosperm, das aus der Steinschale herausgelöst und von der Samenschale bedeckt unter dem Namen Copra in den Handel kommt[S. 702] und das Cocosöl liefert. Innerhalb desselben findet sich eine trübe Flüssigkeit, die Cocosmilch, die wohl auch zum Endosperm zu rechnen ist, jedenfalls bei der Keimung aufgebraucht wird. Die unreife Frucht ist ganz mit dieser Flüssigkeit erfüllt. Aus ihr setzt sich erst allmählich das feste Endosperm am Rande ab. In den reifen Früchten des Handels ist das milchige Endosperm meist eingetrocknet und der Same besteht daher vornehmlich aus dem hohlkugeligen äußeren Endosperm, das als dicke Schale den zentralen leeren Hohlraum umschließt (Fig. 219).
Das äußere Endosperm ist von einer mehrreihigen, aus mit braunem Inhalt versehenen Zellen bestehenden, von Gefäßbündeln durchzogenen Samenhaut bedeckt, die allmählich über dünnwandige Sklereïden hin, die der Copra des Handels oft noch außen anhängen, in die innere Sklereïdenschicht des Endocarps übergeht. Das Endosperm besteht vorwiegend aus stark radialgestreckten, dünn- und glattwandigen Zellen, deren Wand mit Jodschwefelsäure blau wird und dabei Spiralstreifung hervortreten läßt. Die Zellen enthalten Fetttröpfchen und -massen, zierliche Büschel von Fettkristallen und große Aleuronkörner mit sehr zahlreichen sehr kleinen Globoiden und einigen wohlausgebildeten Kristalloiden. Der Fettinhalt erfüllt die Zellen nahezu ganz. Große rundliche Tüpfel werden meist erst bei Behandlung mit Kali sichtbar. Der innerste Teil des Endosperms besteht aus mehr rundlichen, dickwandigeren, die an das Lumen grenzende Partie aus obliterierten Zellen. Der Keimling ist klein und liegt in das Endosperm eingebettet unter dem mit einem Deckel verschlossenen Keimloch des nicht fehlgeschlagenen Faches. Das Mesocarp beträgt 30–57,3%, die Steinschale 11,6–19,6%, das Endosperm 18,5–37,8%, die Cocosmilch (bei unreifen Früchten) 12–13% (BACHOFEN).
Cocos nucifera, Frucht geöffnet. Epi derbes Epicarp, Mes faseriges Mesocarp (Coir), End hartes Endocarp, T braune Samenschale, Alb weißes Endosperm (Copra). Die die Höhlung erfüllende Cocosmilch ist ausgeflossen.
[Nach Winton.]
Die Cocospalme trägt das ganze Jahr über Blüten und Früchte. Sie liebt die Meeresnähe, ist daher auf allen südasiatischen Inseln reichlich zu finden. Bei vielen kleineren, z. B. den Koralleninseln, bildet sie das wichtigste Glied der Vegetation. Bei den größeren, wie Java und Ceylon, bevorzugt sie unbedingt die Küsten, ohne jedoch im Inneren ganz zu fehlen. Die am Küstenrande wachsenden sah ich oft schräg gegen das Wasser geneigt. Die Anbaugrenze liegt etwa 150 km von der Küste. Sie braucht nicht zu geringe Luftfeuchtigkeit und ziemlich hohe gleichmäßige Temperatur (Mittel: 22° C.). Sie liebt brakigen Boden, Wind und Sonne. In Ceylon traf ich Cocos noch im Hochland des Inneren und in Java in den Preangerregentschaften, z. B. bei Bandoeng. Die Keimung erfolgt in der Weise, daß der Cotyledon, als Saugorgan fungierend, in die die Cocosmilch enthaltende Höhlung hineinwächst, diese schließlich ganz ausfüllend, und die Plumula und Radicula den Deckel des Keimloches beiseite schieben. Die ersten Blüten erscheinen im vierten Jahre, etwa im 15.-20. Jahre erreicht der Baum seinen höchsten Ertrag, der dann bis ins 60., ja 100. Jahr (meist etwa 50–80 Jahre lang) erhalten bleiben kann. Ein Baum kann bis 200 Früchte jährlich hervorbringen. Der Durchschnittsjahresertrag eines Baumes sind 60 Früchte (SEMLER, 50–70 TSCHIRCH), der Durchschnittsmonatsertrag in Java 5–10 (TSCHIRCH). Man erntet nur vollreife Früchte.

[Aus Preuß, Plantagenkultur auf Samoa.]
Das von Cocospalmen bestandene Areal schätzt FERGUSON 1910 auf 1582000 ha. Die meisten finden sich auf Ceylon (307500 ha), das eine wahre Cocosinsel ist und mehr als 50 Mill. Cocos enthält, — ich sah dort Cocoswälder von 10 Meilen Länge, Polgahawela ist nach der Cocos benannt — ferner Südamerika (202000 ha). Dann folgt Britisch Indien (Madras, Malabar,[S. 703] Coromandel), die Sundainseln (Java: 210000 ha), die Philippinen (170000 ha), Neu Guinea, Samoa, die Fidschi- und die pacifischen Inseln, Zentralamerika, Westindien, Columbien (Carthagena), Siam, Indochina, Ostafrika, Madagaskar, Sansibar und Mauritius, Westafrika (Togo). Von französischen Kolonien kommen in Betracht: Senegal, Martinique, Réunion, Tahiti, franz. Guyana, franz. Indien und Neucaledonien. Die Cocospalme stellt keine großen Anforderungen an den Boden. Sie ist «nützlich, anmutig und bescheiden» (TSCHIRCH, Ind. Heil- u. Nutzpfl.).
Lit. MARTIUS, Hist. nat. palmar. III, 123, t. 62, 75, 88. — MIQUEL, Flor. Ned. Ind. — DRUDE in Flora Brasiliens. und Engl.-Prantl, Pflanzenfam. — SEMLER, Trop. Agrikultur. — FERGUSON, Ceylon Handbook und Coconut planters manual. Colombo. — SADEBECK, Die Kulturgewächse d. deutschen Kolonien 1899. — TSCHIRCH, Ind. Heil- u. Nutzpflanzen (dort die Kultur beschrieben). — VAN GORKOM, Oostind. Cultures. — Bijdragen tot de kennis van den kocospalm in Bull. 41 des Kolon. Museum Haarlem 1909 mit Beiträg. v. VAN OIJEN, TABEL, WONG TANI, WELBORN und BAKKER (mit Abbild.). — H. ZAEPERNICK, D. Kultur d. Kokospalme, Tropenpflanzer, Beihefte Nr. 6, 1911. — WATT, Dict. econom. prod. of India (Kultur in Ostindien). — H. MARSHALL, Contribut. to a natural and economical history of the Coconut tree. Mem. Wernerian nat. hist. Soc. — The Coconut Palm. Bureau of Science of the Philippines Government. — COOK, History of Coconut Palm in America. 14 pl. Washington 1910. — COPELAND, On the water relations of the Coconut Palm. — WALKER, The Coconut and its relation to the production of oil Manila 1906. — PRUDHOMME, Le cocotier. Cult. industr. et commerce dans les principaux pays de product. Coprah, huile, fibre de Coco et dérivés divers. mit 80 phot. Paris 1906. — P. HUBERT, Le cocotier 1906. — PREUSS, Die Cocospalme u. ihre Kultur. 1911 (m. zahlr. Abbild.).
Abbild. Ältere bei RHEEDE, Hort. malab. t. 1–4 und RUMPHIUS, Herb. Amb. — BERG-SCHMIDT, Atlas 2. Aufl. t. 143 (dort weitere Lit.). — KÖHLERS Medizinalpfl. — SADEBECK a. a. O., Fig. 15–19. — TSCHIRCH a. a. O., t. 94. — Bull. 41 des Kon. Mus. Haarlem. Auch auf zahlreichen Titelblättern (Tropenpflanzer, HÄCKELS Reisebriefe) findet sich Cocos. — Karte über die Verbreitung der Cocospalme in SCOBEL, Handelsatlas.
Anatomie: WINTON, Anat. of the fruit of Coc. nuc. Amer. Journ. sc. 12 (1901), 538. Am. Journ. pharm. 1901, 523. — MOELLER, Rohst. d. Tischler- u. Drechslergew. 1884. — MOELLER-WINTON, Mikroskopie, Fig. 510–519 (dort weit. Lit.). — PFITZER (Keimung), Ber. d. Botan. Ges. 1885, 32. — WITTMACK, Die Keimung der Cocosnuß. Ber. d. Bot. Ges. 1896, 145. — COLLIN-PERROT, Residus industr., Fig. 4 u. 5.
Pathologie. Es liegen verschiedene Angaben vor über Pilze, welche bei Erkrankungen der Stämme von Cocos nucifera beobachtet wurden (Pestalozzia Palmarum, Pythium palmivorum, Thielaviopsis ethaceticus) und dadurch auch indirekt den Fruchtertrag beeinträchtigen mögen (ED. FISCHER). Die tierischen Schädlinge der Cocospalme in WATT, Diction., bei WELBORN (in Bull. 41 d. Kolon. Mus. Haarlem), ZÄPERNICK (a. a. O.) und VOLKENS (Über eine Schildlauskrankheit d. Cocospalmen in Togo u. auf d. Karolineninsel Yap. Notizbl. d. k. bot. G. Berl. Nr. 25 [1901]). — SCHWARTZ, Bekämpf. der Cocospalmen-Schildlaus (Aspiodotus destructor) Tropenpfl. 1909, 114, sowie bei PRUDHOMME a. a. O. In Samoa ist Cocos frei von Krankheiten (PREUSS). Ratten, fliegende Füchse, Wildschweine, Kakadus und Ameisen, sowie eine große Wespe, ein Käfer (Promecotheca), ein Nashornkäfer sind ihre größten Feinde. Besonders finde ich genannt die Käfer: Oryctes, Xylotrupes, Pimelotus, Scapanes, Oryctoderes, Rhynchophorus. Gegen zweifüßige Diebe sah ich in Ceylon, wo die Cocosgärten Nachts bewacht werden, eine ingeniöse Einrichtung. Die Stämme trugen auf halber Höhe ein trockenes Cocosblatt, dessen Mittelrippe von unten nach oben verlief und dessen Fiedern zu je 3–4 zusammengenommen um den Stamm gelegt waren, wodurch eine mehrere Meter lange Röhre entstand. Sobald ein Dieb sie erreicht, weckt er durch das raschelnde Geräusch, das hierbei entsteht und das in der stillen Tropennacht weithin vernehmbar ist, den Wächter.
Kultur und Erntebereitung. Die Kultur ist einfach. Doch braucht die Palme Pflege, besonders Bewässerung. «Die Cocos tragen nicht, wenn du nicht zu ihnen gehst und mit ihnen sprichst», sagt der Singhalese. Düngung steigert den Ertrag von 40–50 auf 80–100 Früchte pro Baum. (Über die Düngungsversuche vgl. bes. PRUDHOMME a. a. O.). Die Aussaat erfolgt in Keimbeeten in Salz und Asche enthaltenden, lockeren Boden, aus dem die Pflanzen nach 7 bis 9 Monaten an den definitiven Standort gebracht werden. In Java sah ich die Früchte zum Keimen am First der Häuser oder an Bäumen aufgehängt, um sie gegen Bodenungeziefer zu schützen.[S. 704] Ich traf die Cocospalme in Ceylon und Java in Kampong- und Plantagenkultur, sog. Klappertuins (I, Taf. IV, vgl. auch I, S. 49), und die gleichen Formen der Behandlung finden wir in allen übrigen tropischen Gegenden der Erde. Oft trifft man Baumwolle, Yams, Bataten, Taro, Bananen, Lemongras, Ricinus, Maranta, Erdnuß, Sesam, Mais, Sisalagave, Ananas als Zwischenpflanzen (SEMLER). Obwohl der Baum das ganze Jahr trägt, erntet man doch nur 4–6mal im Jahr. Wie schon GARCIA DA ORTA (I, S. 735) berichtet, besteigen die Eingeborenen den Baum entweder mit Steigriemen (I, Fig. 189) oder indem sie Stufen in den Baum einhauen und auf diesen emporklettern (Fig. 220). In Java binden sich die Eingeborenen auch die Füße an den Gelenken zusammen und erzielen so eine greifende Gabel. Auf den Sundainseln läßt man bisweilen die Früchte von abgerichteten Affen pflücken oder liest die reif abfallenden «todtreifen» Früchte vom Boden auf. Vor der Verarbeitung trocknet man die Früchte einen Monat. Ein Arbeiter kann täglich 800 bis 1000 Früchte aufbrechen und schälen. Das Brechen der Steinschale erfolgt mit der Axt, mit Steinen oder Holzschlägeln, die Copra (coprah, copperah) wird mit einem gebogenen Messer herausgeholt (Taf. XX) und an der Sonne in Einrichtungen, ähnlich denen zur Trocknung der Chinarinde (I, Fig. 107) oder in Trockenhäusern (Taf. XXI) getrocknet. 1000 Nüsse geben c. 250 kg Copra. Die Coprahdarren dürfen nur mit Cocosschalen geheizt werden, die ein rauchloses Feuer geben, sonst erzielt man keine weiße Copra. In Cochin wird nur in der Sonne, in Ceylon nur auf Darren getrocknet. Man schneidet hier mit einem schweren Messer die Steinschale genau in zwei Hälften und trocknet in diesen. Man unterscheidet weiße, gelbe und schwarze Copra. Nur vollreife Früchte liefern weiße Copra.

Beklettern der Cocospalme auf eingeschnittenen Stufen zum Herabholen der Früchte.
[Koloniaal-Museum, Haarlem.]
Auf den Südseeinseln erfolgt die Gewinnung des Cocosöls für den Gebrauch der Eingeborenen in sehr primitiver Weise. Man wirft die Kerne auf Haufen und sammelt das ausfließende Öl in in die Erde gesetzten Gefäßen oder verwendet einen hohlen Baumstumpf als «Ölpresse», indem man die Kerne mit Steinen beschwert. Auf Diego Garcia werden primitive, von Tieren an langer Deichsel getriebene Mühlen benutzt (vgl. I, Taf. XVII). Ähnliche Mühlen sind da und dort auch in Ceylon noch in Gebrauch (I, Taf. XVI). Im Handel ist nur aus der Copra, dem getrockneten Endosperm, gepreßtes Öl. Es wird dies sowohl in Indien (Ceylon: Colombo, in Bombay und an der Malabarküste: Cochin) wie in Europa (Marseille, Mannheim, Bremen, Harburg, Magdeburg, Groß Gerau und in England) fabrikmäßig dargestellt. In Indien wird das Öl entweder in der Weise gewonnen, daß man die in der Sonne getrocknete Copra zu einem Brei zerstampft, diesen mit Wasser auskocht und das Öl abschöpft oder indem man die gemahlene Copra in meist hydraulischen Plattenpressen auspreßt. Cocosöl wird jetzt sogar in den Tropen (Ceylon, Java) in vielen zum Teil ganz modern eingerichteten Fabriken gepreßt, die auch zugleich Coir verarbeiten und aus dem Öl Seife fabrizieren. Zu[S. 705] einer modernen Cocos-Ölmühle gehören: Eine Schneidemaschine zum Zerkleinern der Kerne, eine Mühle, um die Schnitzel zu Brei zu verreiben, eine Dampfpfanne, um den Brei auf 50 bis 80° zu erwärmen, eine hydraulische Presse zum Auspressen des Öls, eiserne Klärbottiche und eine Filtrieranlage. Ferner Luftdruck-Akkumulatoren, Saattransportvorrichtungen, Desintegratoren und Saatwärmer.

[Aus Preuß, Plantagenkultur auf Samoa.]
«Die Cocosölgewinnung sah ich in den großen Hultsdorf Mills in Colombo. Die von den Natives gesammelte Copra wird in Kähnen auf Kanälen, die bis zur Mill führen, oder Ochsenkarren in die Mill gebracht. Nach dem Ausschütten werden die Coprahaufen in die Coirsäcke der Mill gefüllt, und, wenn feucht, auf den großen Zement-Barbacues nachgetrocknet, dann wandert die Copra in die Ölmühle. Hier wird sie in der Grobmühle, die aus einem in einem Zylinder laufenden Rade mit ⅜ Zoll großen Zähnen besteht, zunächst grob zerkleinert und durch geeignet angebrachte Öffnungen gleichzeitig gesiebt. Das grobe Pulver wandert nun in die erste Presse. Diese ist wie alle anderen eine hydraulische. Man bringt c. 15 Lagen des groben Pulvers abwechselnd mit Stahlplatten und Korbgeflecht in die großen zylindrischen, an der Außenwand durchlöcherten Preßgefäße und läßt die Presse von unten nach oben gehen. Sobald die Platten anziehen strömt ein finger- bis armdicker Strahl in die darunter verlaufenden Rinnen und von dort in die Sammelgefäße (Tanks) in der tieferen Etage. Das ausfließende Öl dieser ersten Pressung ist das beste. Nun werden die Preßkuchen in Schneidemaschinen zerkleinert, im Vorwärmer durch Dampf vorgewärmt und in Cylindersieben gesiebt; das feinste Pulver geht nun in die zweite Presse, das noch nicht genügend zerkleinerte wird weiter zerkleinert und zwar je nach der Größe entweder durch platte, aufeinander ruhende Hartwalzen — die feineren Partien — oder zwischen großen Walzen, welche die gröberen, etwa erbsengroßen Stücke flach pressen, letztere werden alsdann in Kollergängen unter großen, runden Graniträdern vollends zertrümmert. Das so gewonnene grobe Pulver wird nun vorgewärmt, das gröbste geht in die erste, das feinere in die zweite Presse (Finishpresse). Die fertigen Preßkuchen werden schließlich in den Shaping-presses mit leichtem Druck in Formen gepreßt und gehen alsdann in die Schlußpressen, wo sie unter stärkstem Drucke ihre definitive Form erhalten. Diese außerordentlich stickstoffreichen «Cocosnußpreßkuchen» werden sowohl als Futtermittel als auch namentlich zum Düngen viel verwendet. Das Cocosöl, besonders das der zweiten und späteren Pressungen wird durch Beutel aus dichtem Baumwollengewebe filtriert. Das beste ist nahezu farblos und besitzt, wenn die Copra möglichst frisch zur Presse kam, auch kaum einen Geruch. Die späteren, besonders die warmen Pressungen sind gelblich und besitzen einen mehr oder weniger starken, unangenehm süßlichen Geruch» (TSCHIRCH, Ind. Heil- u. Nutzpfl.).
Cocosfett wird bisweilen in Europa durch Pressen in Olein oder Cocosöl (zur Seifenfabrikation) und Cocosstearin zur Kerzenfabrikation getrennt. Der Handel unterscheidet drei Sorten: Cochinöl, die beste, von der Malabarküste, von sorgfältig kultivierten Pflanzen, enthält weniger freie Fettsäuren als das Ceylonöl. Das geringste Öl ist das an freien Fettsäuren reiche Copraöl, das aus der in der Sonne oder in Öfen getrockneten Copra gepreßt wird, die in großen Mengen von Ceylon, Java, den Karolinen, Marianen, den Palau- und Marschallinseln, Samoa u. and. exportiert wird. Da «Cochinöl» Qualitätsbezeichnung ist, so kennt der Handel auch australisches Cochinöl und Mauritius-Cochinöl. Das aus dem frischen Endosperm kalt gepreßte Öl (Klapperöl) ist nicht Handelsprodukt. Es wird in Indien als Speisefett verbraucht. Von den Cocospreßkuchen unterscheidet der Handel drei Sorten: weiß, halbweiß und ordinär, sowie graues Cocosmehl, das den Rückstand der Extraktion mit Schwefelkohlenstoff darstellt.
Bei der Darstellung der Desiccated coprah schält der Arbeiter erst die Faserschicht ab, sprengt mit einem geschickten Schlage die Steinschale von dem Endosperm ab und schält mit einem eigenartigen Hobel (abgebildet im Tropenpflanzer 1909, 459) die braune Samenhaut ab. Der schneeweiße Hohlkern wird dann in Maschinen geraspelt und in Trockenöfen getrocknet.
Die Coirfaser (in Java mumbang, rambok oder sabut) wird ähnlich wie Flachs behandelt. Man bringt die Faserschicht der Frucht (Husk) einige Monate in stehendes Wasser (Röste), wäscht und klopft («bricht») die getrockneten Fasern mit hölzernen Hämmern. Dadurch wird das Grundgewebe und oft auch der Siebteil der Bündel zertrümmert, so daß die Coirfaser des Handels, die 20–30 cm lang ist und vorwiegend aus den braungefärbten Bastbelegen besteht, hohl ist (Abbild. bei WIESNER vgl. auch S. 256) und daher auf Wasser schwimmt. Einzelne Bastbündel führen keine Gefäßbündelelemente. Neuerdings erfolgt die Herstellung der Coirfaser in Fabriken in Röstgruben, mit Rollmühlen und Hechelmaschinen. Diese Faser wird auch mit SO2 gebleicht.[S. 706] In Ceylon unterscheidet man Rope, Yarn und Fibre. 13–15 Nüsse liefern 1 kg Coir. Coir wird in Brit. Indien, Ceylon, Südamerika, Sansibar und neuerdings auch, in Dar-es-Salam produziert, jetzt aber auch in europäischen und amerikanischen Fabriken aus dem Mesocarp (Roya) der importierten Früchte dargestellt.
Die vorwiegend aus Sklereïden bestehende Steinschale wird, nachdem die Copra und die Faserschicht entfernt wurde, für Gefäße und Drechslerarbeiten benutzt. Ich habe aus Java aus Cocosschalen gefertigte Löffel, Schalen und Becher mitgebracht.
Aus den Blütenständen wird durch Anzapfen ein zuckerreicher Saft (jagra, jaggery) und Zucker gewonnen, der gegoren Palmwein (toddy, in Indien çura) liefert (Beschreibung I, S. 1018). Durch Destillation gewinnt man aus letzterem Arrac (100 l Toddy liefern 25 l Arrac), durch Sauerwerden Essig.
Die Benutzung der jungen Blattknospen als Palmkohl sah ich nirgends. Da der Baum durch Ausschneiden der Gipfelknospe zugrunde geht, ist seine Gewinnung auch zu widerraten.
Lit. Siehe oben S. 703 und TSCHIRCH a. a. O. Ferner FERGUSON, All about the coconut-palm. Colombo. — Tropenpflanzer 1898, 1899, 1900, 1909. — MASSIGNON, Fabricat. du beurre de Coco comestible aux colonies. Bull. Jard. col. Paris 1901 (1) 266. — PREUSS, Kulturpfl. auf Samoa. Tropenpfl. Beiheft 3, 1907. — VAN EEDEN, Plantaardige Vezelstoffen. Kol. Mus. Haarlem. — Cocosölindustrie, Lahore Trib. Oil, Paint and Drug Rep. (Chem. Rev. 1906, 114).
Handel. Die Copra wird entweder in Säcken versandt oder ohne Verpackung einfach in den Schiffsraum geschüttet. Ceylon kann jährlich c. 800 Mill. bis 1 Milliarde Cocosnüsse erzeugen und exportiert bis 17 Mill. Ceylon exportierte 1894: 8747000 Stück frische und 42700 cwt. trockene Nüsse, ferner Coir 176600, Copra 45800, Cocosöl 449600, Cocosnußkuchen (Poonac) 190000 cwt, sowie 98000 Gall. Arrac. Ceylon exportierte 1910: 616377 cwt Coconutoil, 766906 cwt Copra und 16114088 Stück Cocoanut, 27201074 lbs Desiccated coconut (Raspelcopra). 309589 cwt Poonac, 108775 cwt Coir yarn und 174410 cwt Coir fibre. Brit. Indien exportierte 1908/09: 595725 Cocoanut, 395126 cwt Cocoanut kernel or copra und 2845404 gals. Cocoanutoil.
Java exportierte 1905: 108360755, 1906: 54337508 kg Copra, 1905: 63600, 1906: 5864 l Klapperolie. Niederl. Indien exportierte Copra 1908: 229491 t. Haupthandelsplätze sind London, Marseille, Rotterdam und Amsterdam. Copra ist wie Pfeffer Spekulationsartikel. Man unterscheidet die Sorten: Fair merchantable sundried (fins), Mixed, Telquel. Die Südseeinseln pressen kein Öl, sondern verschiffen die Copra. Für die Südseeinseln sind die Cocosprodukte der wichtigste Exportartikel. Die Copraausfuhr betrug 1908 in kg Bismarck-Archipel: 5586672, Kaiser Wilhelmsland: 698507, Samoa: 10240000, Westkarolienen, Palauas, Marianen: 714789, Ostkarolienen: 431739, Marschallinseln: 3560899. Deutsch-Ostafrika (1909): 3026795. — 1910 exportierte Java: 100564, Makassar: 30880, Menado, Sangir usw.: 27298, Padang: 10479, Straits settlements: 103006, Manila: 118200 t. Die Gesamtausfuhr von Copra aus allen Ländern beträgt jetzt mehr als 500000 t, von Cocosöl c. 70000 t. Das meiste verbraucht Frankreich.
Der Mittelpunkt des südamerikanischen Cocoshandels ist Para. Es exportiert jährlich 7–8 Mill. Nüsse.
Deutschland deckt ⅓ seines Bedarfes an Copra aus seinen Kolonien. Deutschland importierte 1909: 1121593 dz Copra vorwiegend aus Niederl. und Brit. Indien, sowie aus Ceylon, weniger aus Brit. Malacca, Samoa, den Philippinen und Australien und 90490 dz Cocosöl besonders aus Ceylon und Brit. Indien. Hamburg importierte 1908 seewärts 942110 dz Copra, davon 444323 aus Nied. Ostindien, 228337 aus Brit. Ostindien, 65787 aus Australien, 42986 von den Philippinen, 39135 aus Samoa, 25279 aus Singapore, 22525 aus dem Bismarckarchipel, 17395 von Neu Guinea, 16357 von den Marschallinseln, 14316 von den Fidschi- und Freundschaftsinseln, mehr wie 1000 dz von den Carolienen, Trinidat, Deutsch-Ostafrika, den Gesellschaftsinseln, Kuba, den Verein. Staaten, weniger als 1000 von Westafrika, Togo, St. Domingo, den Palauinseln, Venezuela, China usw. Ferner 91656 dz Cocosnußöl, davon 46744 aus Brit. Ostindien. Die Einfuhr von Cocoanut oil nach London betrug 1906: 1056, 1907: 1909, 1908: 3007, 1909: 1270 t. Frankreich importierte 1908 Copra (und Amandes de Coco) 1693579 Quint., davon besonders viel von den Philippinen, Holländ. und Engl. Indien, sowie von Indochina und Engl. Ostafrika, weniger von den Ozeanischen Inseln u. and. tropischen Gegenden. Die Vereinigten Staaten importierten (vorwiegend aus dem mittelamerikanischen Drogenreich) 1909: 52302999 pounds Cocoanutoil.
Chemie. Das frische Endosperm (Cocosfleisch) enthält in Prozenten: Wasser 46,64,[S. 707] eiweißartige Stoffe 5,49, Fett 35,93, stickstofffreie Extraktstoffe 8,06, Faser 2,91, Asche 0,97. Die getrocknete Copra enthält meist 64–68 bis 67,85% (NALLINO), ja 71,5% (BIZIO) Fett, gewonnen werden daraus 54–61%. Daneben 9–10% Stickstoffsubstanz, 14–26% stickstofffreie Extraktstoffe, 1,5–2,7% Asche (BACHOFEN). In der Copra sind nachgewiesen: 46% Wasser, Zucker (Saccharose 4–5% BOURQUELOT), Amide, Cholin, Lecithin, das Globulin Edestin (OSBORNE und CAMPBELL), Conglutin (RITTHAUSEN), Albumin, Albumosen und ein Nucleoproteid zusammen 4,63% Eiweiß, 3,39% Faser. Alkaloide und Glukoside fehlen (VAN ITALLIE). Die Zellwände enthalten ein Galakto-Mannan bzw. Galakto-Araban. Die Copra enthält 66,25 (Manila) bis 70% (Cochinchina) Öl, Ceylon und Sansibarcopra stehen in der Mitte (68–69% LAHACHE). Im Großen werden 50–60% gewonnen. Luftgetrocknete Nüsse liefern c. 50%, in Trockenapparaten getrocknete c. 60% Fett.
Oleum Cocos (nicht Cocois), Cososfett (Cocosbutter, Cocosnußöl, Coprafett, huile de coco, beurre de coco, Cocoanut oil, burro di cocco, cocosvet, κοκέλαιον) ist im gemäßigten Klima fest, in Indien flüssig, was schon daraus hervorgeht, daß es z. B. in Java als Lampenöl benutzt wird. Es hat frisch einen angenehmen Geruch und Geschmack, wird aber leicht schon in der Copra ranzig, riecht dann widerlich und schmeckt kratzend. Ein solches Öl enthält dann bis 25% freie Fettsäuren (LEWKOWITSCH). Die Regel bildet 2–10% freie Säuren, CROSSLEY und LE SUEUR fanden 5–17,7% (auf Ölsäure berechnet), SALKOWSKY 2,96%, PASTOROVICH und REIJST 4,75%. Das gereinigte Cocosfett enthält keine freien Fettsäuren und steht bezüglich seiner Haltbarkeit anderen Pflanzenfetten nicht nach (HERBERT und WALKER). Die Abspaltung der freien Säuren und die Erscheinungen der Ranzidität treten schon in der Copra vor dem Pressen infolge der Einwirkung von Pilzen (Aspergillus) und Enzymen ein und ein so in der Copra schon zersetztes Öl unterliegt stärkerem Ranzigwerden, als ursprünglich unzersetztes, frisch und rasch gepreßtes.
Cocosfett zeigt eine von den anderen Fetten stark abweichende Zusammensetzung (nur Palmkernöl hat eine ähnliche Zusammensetzung). Es enthält Trimyristin (beträchtliche Mengen, ULZER), Trilaurin (relativ viel), Tripalmitin und Tristearin (1%) und Trioleïn, sowie die Glyceride der flüchtigen Fettsäuren: Capronsäure, Caprylsäure und Caprinsäure, aber keine Buttersäure (REIJST) und kaum hydroxylierte Säuren. Die Alkoholyse (HALLER und YOUSSOUFIAN) ergab als Hauptbestandteile Laurin (früher Pichuritalgsäure genannt) und Myristin, dann Palmitin, Stearin, Olein, Capron-, Capryl- und Caprinsäure. PAULMAYER gibt 1907 40% Laurinsäure, 24% Myristinsäure, 10,6% Palmitinsäure, 5,4% Ölsäure, 19,5% Caprinsäure, 0,5% Capron- und Caprylsäure an (keine Stearinsäure!). Die Palmitinsäure wird von ULZER bestritten. Die Cocinsäure (BRANDES, BROMEIS) ist ein Gemenge von Laurin- und Palmitinsäure, auch die Cocosstearinsäure ist zu streichen. Die von FLÜCKIGER (1894) bestrittene Ölsäure wurde bestimmt von ULZER und REIJST nachgewiesen. Im gereinigten Cocosöl (Palmin) fand ULZER 2,32% Glyceride flüchtiger Fettsäuren (Capron- und Caprylsäure) und c. 10,45% Trioleïn, der Rest der Hauptmasse bestand aus Trilaurin und Trimyristin- und etwas Caprinsäureglycerid. Die Menge der flüchtigen Fettsäuren beträgt c. 2% (ULZER, FARNSTEINER).
Cocosfett ist bei 60° schon in 2 Teilen Alkohol von 90% löslich, besitzt also eine verhältnismäßig große Löslichkeit in Alkohol. Das spez. Gew. ist ungewöhnlich hoch, es beträgt bei 15,5°: 0,9259, bei 18°: 0,9250, bei 35°: 0,9124, bei 100°: 0,870 (0,863, bei Bengalöl: 0,9040), der Erstarrungspunkt liegt bei 14–25,5° (meist 16–20,5°), der Schmelzpunkt bei 20–28° (meist 23–25°), die Verseifungszahl ist ungewöhnlich hoch: 250–268 (gewaschen: 246,2), die Jodzahl ist[S. 708] sehr niedrig: 7,68–10 (meist 8–9), Hehnerzahl: 82,4–92,2, Reichertzahl: 3,5 bis 3,7, Reichert-Meißlzahl: 6,5–8,5. Acetylzahl: 9,5, Brechungsexponent bei 40°: 1,4497, bei 60°: 1,441. Die freien Fettsäuren zeigen bei 98° ein spez. Gew. 0,8354, Erstarrungspunkt 15,7–20°, Schmelzpunkt 24–27°, Neutralisationszahl 258 mg KOH, mittleres Molekulargewicht 196–211, Jodzahl 8,39 bis 9,3, Jodzahl der flüssigen Fettsäuren 31,9–36,3. Das Cocosnußolein zeigt bei 60° ein spez. Gew. 0,9293, die Verseifungszahl 265,35 (253,63), Jodzahl 14,8 (4), Reichert-Meißlzahl 7,95 (4,45). Die Zahlen in Klammern beziehen sich auf Cocosnußstearin.
Das Verfahren von POLENSKE zur Bestimmung des Cocosfettes in der Butter beruht auf der Bestimmung der Reichert-Meißl-Zahl, auf der Bestimmung der «Neuen Butterzahl» (nBZ, Polenskezahl), d. h. derjenigen Menge ungelöster flüchtiger Fettsäuren, die bei der Reichert-Meißl-Zahl-Bestimmung in das Destillat mit übergehen und sich im Kühlrohr und in der Vorlage vorfinden sowie auf Feststellung des Aggregatzustandes desjenigen Anteils der ungelösten flüssigen Fettsäuren bei 15°, die sich während der Destillation auf der Oberfläche des Destillates ansammeln.
Das Unverseifbare (c. 1,5%) enthält zwei Phytosterine (das eine = C33H56O2 F. 135–140° MATTHES und ACKERMANN). Ein fettspaltendes Enzym fehlt dem Öl (WALKER). Dagegen findet sich im keimenden Samen eine Lipase, im Saugorgan des Keimlings neben Lipase ein proteolytisches Enzym, Amylase, Katalase und eine Peroxydase (DE KRUYFF). Das Fett enthält auch einen Farbstoff, der durch Knochenkohle oder Walkererde entfernt werden kann und ein Alkaloid (von VAN ITALLIE bestritten), das den bitteren Geschmack bedingen soll. Der unangenehme Geruch der rohen Cocosbutter rührt nach HALLER und LASSIEUR von Methylnonylketon, Methylheptylketon und Spuren eines optisch aktiven Ketons her, die auch im Rautenöl vorkommen. Doch ist auch der Capron-, Caprin- und Caprylsäure kein angenehmer Geruch eigen. Unter dem Mikroskop zeigt Cocosfett ein Haufwerk langer Nadeln. Cocosfett läßt sich mit verdünnten Laugen nur schwer verseifen, leicht, schon in der Kälte, mit starken. Die Seifen sind nur mit großem Kochsalzüberschuß auszusalzen. Sie sind fest und hart.
Die Coprapreßkuchen enthalten in Prozenten: Wasser 6,72–13,84 (20), Stickstoffsubstanz 16,25–20,94 (30), Fett 7,52–22,6, stickstofffreie Substanz 28,9–46,7, Faser 9,73 bis 15,39, Asche 5,39–6,7 (9) (GEBEK und in COLLIN-PERROT, Res. ind.).
Die Cocosmilch ist niemals milchig, sondern nur trübe. Besser ist daher die Bezeichnung Klapperwasser (mal. ajer kalapa). Das Gewicht der Milch der unreifen Frucht variiert zwischen 230 und 383 g. Die der reifen wiegt nicht viel über 100 g (VAN SLYKE). Die Cocosmilch enthält in der unreifen Frucht bis 4,58% Glukose, in der reifen 4–5, bisweilen sogar 9–13% Saccharose (VAN SLYKE) und Cocosit (H. MÜLLER) — keine Lävulose (VAN ITALLIE) — etwas Eiweiß (0,1–0,8%), Fett (bis 0,14%), ein Zucker bildendes Enzym, Oxydase und Katalase (DE KRUYFF) und Salze 0,6%, das Extrakt beträgt 5,7–7,7% (BEHRE). Das spez. Gew. der Cocosmilch beträgt 1,0442 (1,022 VAN ITALLIE).
Die Steinschale enthält in Prozenten: Wasser 7,36, Asche 0,54, Alkoholextrakt 1,12, Kohlehydrate (auf Stärke berechnet) 20,88, Rohfaser 56,19, Stickstoff 0,18, Gerbstoff 1,82 (WILSON). In der Steinschale findet sich Xylan (TROMP DE HAAS u. TOLLENS). Ihre Asche enthält 45% K2O.
Die Blüten enthalten einen Inosit (Cocosit H. MÜLLER). Im Cocosgummi finden sich 70–90% Bassorin. Der Saft des Stammes enthält 3–6% Rohrzucker (BOURQUELOT).
Lit. Ältere Analysen von PELOUZE ET BOUDET, BRANDES (1838), BROMEIS, ST. EVRE, GÖRGEY. — VAN ITALLIE, Over Kokosnoten, Ned. Tijdschr. 1890. — H. MÜLLER, Proc. Chem. Soc. 1907, 219. — BOURQUELOT, Journ. pharm. 1904, 193. Compt. rend. 133, 690. — BACHOFEN (Aschenanalysen aller Teile der Frucht). Chem. Zeit. 1900, 16. — VAN SLYKE, Amer. Chem. Journ. 1891, 130. — BEHRE, Pharm. Centralh. 1906, 1045. — DE KRUYFF, Bull. Dep. Agr. Ind.[S. 709] neerl. 1907. — OSBORNE und CAMPBELL, Journ. amer. chem. Soc. 1896, 609. — RITTHAUSEN, Pflüg. Arch. 1880, 81. — GEBEK (Preßkuchen), Landw. Versuchsstat. 1894, 427. — WILSON, Connectic. Agric. exper. stat. in Am. journ. sc. 1901.
Öl: LEWKOWITSCH a. a. O. — RIVALS, Les corps gras ind. 1908, 258.— BENEDIKT-ULZER a. a. O. (dort weitere Lit.). — PAULMAYER, Savonnerie marseillaise 1907. — CROSSLEY und LE SUEUR, Journ. Soc. chem. Ind. 1898, 991. — ULZER, Chem. Rev. 1899, 11 und 203. — FARNSTEINER, Ebenda 1898, 196. — FLÜCKIGER, Zeitschr. anal. Chem. 1894, 571. — REIJST, Pharm. Weekbl. 1906, 117 (Rec. trav. chim. Pays Bas 1906, 271). — GÖREYS, Lieb. Ann. 66 (1848) 315. — LAHACHE, Rev. chim. pur. et appl. 1905, 309. — HALLER und YOUSSOUFIAN, Compt. rend. 143 (1906) 803. — HERBERT und WALKER, Philipp. journ. of sc. 1906, 117. — WALKER, Philippine Journ. sc. 1908. — FENDLER (Cocosspeisefette). Chem. Rev. 1906, 272. — BLUMENFELD und SEIDEL, Mitt. Technol. Gew. Mus. 1900, 60. — BIZIO, Journ. pharm. 1833, 455. — NALLINO, Ber. d. chem. Ges. 1872, 731. — MATTHES u. ACKERMANN, Ber. chem. Ges. 1908, 2000. — HALLER und LASSIEUR, Compt. rend. 1910, I, 1013. — WHITE AND BRAITHWAITE, Brit. and. Col. Dr. 1897. — POLENSKE, Best. v. Cocosfett in d. Butter. Zeitschr. f. Nahrmunters. 1904, 273 (auch Arbeit. d. k. Gesundhamt. 20 [1904], 545). — Weitere Lit. bei WEHMER.
Prüfung. Zum Nachweis fremder Beimengungen benutzt PAULMAYER die verschiedene Löslichkeit der Fettsäuren in Essigsäure von 81,18%. Bei sämtlichen übrigen Fettsäuren, mit Ausnahme des Ricinusöls liegt die «kritische Löslichkeitstemperatur» höher als 33°. MILLIAU benutzt die Phloroglucin-Resorcin-Salpetersäurereaktion, bei der sich Cocosöl ebensowenig wie Butter und Palmkernöl färbt. Wegen der Ähnlichkeit der Zusammensetzung ist Palmkernfett im Cocosfett nicht sicher nachzuweisen, auch kaum nötig, da beide den gleichen Preis besitzen.
Lit. PAULMAYER, Seifen-Zeit. 1906, 286 (auch in BENEDIKT-ULZER). — MILLIAU, Compt. rend. 140 (1905) 1702.
Da die der braunen Samenhaut anhaftenden Sklereïden bei Cocos dünnwandig sind und die Wände der Endospermzellen dünne glatte Wände besitzen, so ist eine Verfälschung des Coprapreßkuchen mit Palmkernpreßkuchen (s. d.) leicht zu erkennen.
Anwendung. Was die Olive für das Mittelmeergebiet bedeutet (vgl. S. 623), das bedeutet die Cocospalme für die Tropen Asiens. Vernichtung der Cocos bedeutet Vernichtung der Existenz. «Wenn die Natur dem Bewohner der Tropen nur die Cocospalme geschenkt hätte, sie hätte ihm alles gegeben, was er braucht: Holz, seine Hütte zu bauen, Blätter, sie regendicht zu decken, Fasern für ein Gewebe, sich zu bedecken und für Stricke zum Binden, Gefäße, um Wasser zu schöpfen, Zucker, Fett und Eiweiß für die Nahrung, Palmenkohl als Zuspeise, Essig zur Würze, in den Blattstielen Brennmaterial, die Nahrung zu kochen, Palmwein als Getränk und Öl zum Brennen, ja selbst in der Cocosmilch einen kühlen Trunk für die Zeit des Fiebers» (TSCHIRCH, Ind. Heil- und Nutzpfl.). Die Cocosnuß enthält alle notwendigen Nährstoffe. Zwei schiffbrüchige Matrosen haben 7 Jahre auf den Quairsinseln nur von ihnen gelebt. Sogar die Spatha sah ich in Java einmal und zwar als Wiege benutzt und die Wurzel wird in Indien mit Betel gekaut. Cocos ist die nützlichste aller Pflanzen. M. C. PEREIRA stellte 83 aus dem Baume hergestellter Artikel zusammen (abgedr. in WATT, Diction.) und der Inder sagt, sie ist «zu 99 Zwecken gut und den 100. wirst du auch noch finden». Frische weiße, sorgfältig geschälte Kerne werden an Ort und Stelle zu Schnitzel geschnitten und getrocknet (dessicated copra). Sie gehen als Mandelersatz nach Europa und bestehen nur aus dem Endosperm. Narikela kandha ist in Indien ein Copra enthaltendes beliebtes Arzneimittel. Der Saft der unreifen Frucht soll ähnlich wie Ricinusöl (WOOD), das geraspelte Endosperm anthelmintisch wirken. Cocosöl, besonders das «Cocoolein», ist auch als Lebertranersatz empfohlen worden, ist aber nicht so leicht verdaulich. Cocosöl eignet sich nicht für Linimente, aber gut zur Seifenfabrikation. Cocosseife gibt auch mit Meerwasser Schaum. Cocosöl wird in den Tropen als Speise- und Lampenöl, sowie zum Salben des Körpers benutzt. Die ersten Versuche, das stark riechende Cocosfett, das sich zu Genußzwecken nicht zu eignen schien, als Speisefett bei der Margarinefabrikation nutzbar zu machen, wurden 1880 von JESERICH und MEINERT unternommen. Um dies zu ermöglichen, muß das Fett mit Ätznatron entsäuert und dann durch Destillation mit Dampf desodoriert werden. Diese gereinigten Cocosöle sind im Handel unter den Namen Palmin, Lactine, Vegetalin, Laureol, Kunerol, Gloriol, Leda-Speisefett, Nuscin, Selecta, Nucifera, Parveol, Priol, Hodor, Fruchtin, Crêmin, Sanin, Daphnin, Estol, Jennil, Palmarol, Nutreïn, Pflanzenbutter usw. Cocosfett, bes.[S. 710] das Cocosstearin (s. oben) und ein Cacaoline oder Schokoladenfett genanntes Produkt werden zur Verfälschung der Cacaobutter benutzt.
Die Preßkuchen (poonac) sind eins der wertvollsten Futtermittel (COLLIN-PERROT). Gemahlene Preßkuchen sind in Europa, gemahlene Steinschalen in Amerika als Gewürzfälschung beobachtet (MOELLER-WINTON).
Die Cocosmilch, besonders die junger Früchte, schmeckt frisch ganz gut, süßlich-säuerlich und erfrischend, nimmt aber, wenn sie längere Zeit in der reifen Frucht verweilt, bald den ekelhaften Geruch nach ranzigem Cocosfett an. Die Eingeborenen schlagen die Frucht mit dem Messer auf und trinken den Inhalt. Cocosmilch gilt als Bandwurmmittel. Nach DUTT wird in Indien die Cocosmilch bei Nierenleiden, die Copra, der frische Saft und die Wurzel als Diuretikum, die Knospe als Erfrischungsmittel, das Öl als Haarwuchsmittel benutzt. Der gegorene Saft liefert destilliert Alkohol. Die Asche der Schalen dient zur Seifenfabrikation; ihre Kohle wird zu Tusche benutzt und dient, wie schon GARCIA erwähnt, den Goldschmieden. Coirfaser wird zu Schnüren, Schiffstauen, Bürsten und Türvorlegern verarbeitet. Taue und Stricke aus Coir sah schon CLUSIUS in Lissabon im XVI. Jahrh. Das Holz alter Bäume (Stachelschweinholz) ist ein wertvolles Bauholz. Ein wohlriechendes Sekret des Stammes ist in Tahiti als pia pia bekannt.
Weitere Anwendungen bei STOLZ, Trop. Nutz- u. Handelspfl. Geogr. Nachr. 1894, 81. Vgl. auch SCHRÖTER, Die Palmen und ihre Bedeutung für die Tropenbewohner. Neujahrsbl. d. Züricher Naturf. Ges. 1901.
Geschichte. Es spricht vieles dafür, daß Cocos nucifera im tropischen Asien, wo sie viele alte Namen hat, in zahlreichen Varietäten bekannt ist und seit Urzeiten zu unzähligen Zwecken benutzt wird, ursprünglich heimisch war — vornehmlich wohl auf den Inseln — frühzeitig aber wohl (vor 3–4000 Jahren) nach China, Ceylon und dem indischen Festland und durch Meeresströmungen an die Westküste Mittelamerikas, später dann auch nach Ost-Afrika gelangte (DE CANDOLLE). Von diesen Zentren aus hat sich die Palme dann über alle tropischen Länder verbreitet. Die neueren Forscher (SEEMANN, COOK, SCHUMANN) suchen aber ihre Heimat auf den Antillen, in Columbien und in Zentralamerika, wo sie bereits OVIEDO im XVI. Jahrh. wild fand. Jedenfalls sind alle übrigen Vertreter der Gattung Cocos in Amerika heimisch. DRUDE betrachtet sowohl das tropische Amerika wie Südasien als ursprüngliche Heimat der Pflanze. Wenn aber Polynesien der Überrest eines untergegangenen Erdteils (Oceanien) ist, dann dürften wir wohl in ihm die Heimat der Pflanze zu suchen haben, also dort, wo sie auch jetzt noch die größte Verbreitung hat. Die Cocospalme wurde in Indien seit 3–4000 Jahren benutzt und ist unter dem Sanskritnamen Narikela (weitere bei DE CANDOLLE) bekannt. Nach Ceylon scheint sie erst später gekommen zu sein. Die Ägypter kannten sie nicht, die Griechen nur als indische Kuriosität. Das κουκιοφόρον δένδρον des THEOPHRAST und die cuci des PLINIUS waren wohl nicht Cocos, sondern Hyphaene coriacea GÄRTN. (SPRENGEL).
Die Cocosnuß spielt in Südindien bei vielen Zeremonien eine Rolle. Eine Nuß wird z. B. der See geopfert. Das Brechen einer Cocosnuß ist in Vorderindien Zeichen der Feindschaft. Auch bei den Hochzeitsgebräuchen und ähnlichem wird die Cocosnuß (tali) dort benutzt. Sie ist Symbol der Fruchtbarkeit. Bei der Hochzeit wirft man in Piemont mit Cocosnüssen. Coir wird in Indien seit undenklichen Zeiten als Bindematerial benutzt (WIESNER). In zahlreichen Sprichwörtern und Redensarten der Bewohner der südasiatischen Inseln spielt die Cocospalme eine Rolle (zitiert bei DE CLERQ). In Ceylon wird das Vermögen der Eingeborenen oft in Cocospalmen oder Teilen derselben ausgedrückt, in Vorderindien darf eine Cocospalme bis zu 2 Shilling, in Java bis 1½ Gulden hypothekarisch belastet werden. Ursprünglich wurden die Cocospalmen in Ceylon nur bei den Tempeln angepflanzt. 1841 begannen die Europäer dort mit der Kultur.
Cocosöl war im XVIII. Jahrh. bekannt und in deutschen Apotheken zu finden, ist aber in Europa erst seit Mitte des XIX. Jahrb. mehr beachtet worden. KOSMAS ALEXANDRINUS (I, S. 720) beschreibt bereits im VI. Jahrh. Cocos, — die erste sichere Erwähnung in der europäischen Literatur. Im X. Jahrh. wurden Cocosnüsse in Kalah auf Malacca gehandelt. Bei ALHERVI (I, S. 601) findet sich Nârdschîl, bei IBN BAITHAR nārǧīl, bei SIMON JANUENSIS neregil und auch IBN SINA (I, S. 603) benutzt Cocos. MASUDI (I, S. 616) erwähnt die Cocosnüsse Mitte des X. Jahrh. bei den Malediven, KURDADBAH (I, S. 617) bei Java, MARCO POLO bei den Nicobaren, bei Malabar und Sumatra. IBN BATUTA (I, S. 618) kennt ihre mannigfache Benutzung und auch JACOBUS DE VITRIACO (I, S. 722) gedenkt ihrer im XIII. Jahrh. MARCO[S. 711] POLO erwähnt die Cocosmilch und MAUDEVILLE (I, S. 721) die große indische Nuß. Vom XV. bis XVII. Jahrh. wurde die Cocusnuß in Europa, wohin sie seit dem Mittelalter kam, viel medizinisch benutzt. (Vgl. oben.) Sie findet sich in Taxen und Registern. Das «Garn aus der Schale indischer Nüsse» bei MARCO POLO (I, S. 725) ist wohl Coir. Die alten Inder benutzten nālikera (I, S. 507), das Öl bei Bereitung der Speisen. Copra wird schon von GARCIA DA ORTA als Ausfuhrartikel von Ormuz und Balaguate erwähnt. In Brasilien erwähnt die Cocospalme schon PISO und MARCGRAF (I, S. 893), in Porto-Rico JOSEPH ACOSTA (I, S. 762), in Mittelamerika OVIEDO (I, S. 755). HERNANDEZ (I, S. 757) bemerkt, daß die Mexikaner die Palme coyolli nennen.
Lit. DE CANDOLLE, L’origin. d. pl. cult. — COOK, U. S. Dep. Agric. 1901. Div. bot. VII. — NEGER, Ursprung, Geschichte und Verbreitung der Cocosnußpalme. Globus 1902. — STOLL, Entdeckungsgesch. d. Cocospalme. Globus 1902.
Zu dieser Gruppe gehören oder sind damit verwandt:
- Palmkernöl (s. S. 720),
- Cohuneöl von Attalea Cohune MART.,
- Maripafett von Attalea Maripa AUBL.,
- Muritifett von Mauritia vimfera MART. (Coyol),
- Mocayaöl von Acrocomia sclerocarpa MART.,
- Bactrisfett von Bactris Plumeriana MART.,
- Gewürzbuschöl von Lindera Benzoïn,
- Dikafett von Mangifera gabonensis AUBR. LE COMTE und Irvingia Barteri HOOK.,
- Cay-Cay- oder Cochinchina-Wachs von Irvingia Harmadiana und Oliveri,
- Taririfett von Picramma SOW oder Tariri AUBL.,
- Tangkallafett von Lepidadenia Wightiana NEES. bzw. Cylindrodaphne sebifera.
3. Japansäure-Gruppe.
Die Japansäure ist die erste, von GEIBEL und VON DER WANT (1900) in einem natürlichen Fett aufgefundene, zweibasische Fettsäure. Sie findet sich im Japantalg.
Cera japonica.
Japantalg, Japanwachs, Sumachwachs, — Cire du Japon, — Japan wax, japan tallow, — Cera giapponesa, — in Japan: Ro.
Dies fälschlich Wachs genannte Fett wird in Japan und China aus den Früchten einiger daselbst und in Nordindien kultivierter, zu den Anacardiaceen gehörender Sumacharten, besonders von Rhus succedanea L. (Wachssumach, Wachsbaum, Fasi noki) — wächst besonders in Shikoku und Kiushiu als Einfriedung der Felder — dann auch von Rhus vernicifera DC. (Firnißsumach, urushi) und in beschränktem Maße von Rh. acuminata DC. und Rh. silvestris SIEB. et ZUCC. (Waldsumach, Yama urushi) durch Auspressen, Auskochen oder Extrahieren gewonnen (für China wird die zweifelhafte Art Rhus chinensis MILL. angegeben). Ein Baum kann bis 60 lbs. Früchte tragen.
Das Fett ist sowohl im Mesocarp (40–65%, — resp. 21% bezogen auf die ganze Frucht) wie in den Cotyledonen (36%, — resp. 26,5% bezogen auf die ganze Frucht) enthalten (A. MEYER). Das Mesocarp ist also besonders reich an Fett. Das Mesocarp- und Cotyledonenfett verhalten sich im Allgemeinen gleich. Die ganze Frucht enthält bei Rh. succedanea 27%, bei Rh. vernicifera 24,2% Fett (REIN).
Es wird in Japan besonders auf den Inseln Hiogo, Hizen, Simabara, Chutugo, Chekusin und der Provinz Kinas erzeugt. Nach dem ältesten Verfahren werden die Früchte gestoßen, gekocht und gepreßt. Neuer ist die Methode, die geschälten Früchte zwischen Mühlsteinen zu zerkleinern, die Masse mit Wasser auszukochen, das Fett abzuschöpfen, durch Umschmelzen zu reinigen und in Tafeln auszugießen. Die drei größten Wachsraffinerien (KITAGUMI, CHIKUSAN und SHIMIZI) befinden sich teils in Osaka, teils in Kobe. Auch die Methode, die unter Stroh nachgereiften Früchte in hölzernen, trichterförmigen Trögen mit der Hand zu zerdrücken, von den Hülsen durch Absieben zu befreien und die Masse in Hanfsäcken mittels Keilpressen auszupressen, ist in Gebrauch. Bisweilen werden die von den Zweigen abgedroschenen Früchte auch zuvor getrocknet und schwach geröstet und gemahlen, in Säcken auf einem Roste über kochendem Wasser gedämpft und dann erst gepreßt (SIMON). Die Früchte erscheinen im 5. Jahr. Das Maximum des Ertrages wird im 15. Jahr erreicht. ARTHUR MEYER faßt die verschiedenen Berichte wie folgt zusammen:
[S. 712]
«Zur Herstellung des Japantalgs werden die vorher gut getrockneten Früchte (gut getrocknet wohl deshalb, weil erst durch das Trocknen an der Luft der Milchsaft des Mesocarps unlöslich in Wasser usw. wird) zerkleinert durch Mühlsteine, Mörserkeule oder Bambusflegel, durch Absieben oder Ausschwingen von Kernen und Epidermis befreit oder auch (bei Rhus succedanea und silvestris) ganz gelassen. Diese Massen werden dann über Wasserdämpfen erhitzt, um das Wachs in den Zellen zu schmelzen, und dieses wird dann durch die verschiedensten Preßvorrichtungen ausgepreßt. Beim zweiten Pressen der Masse setzt man wohl hier und da etwas fettes Öl zu, um das Erstarren des Talges zu verzögern. Der so erhaltene Rohtalg wird mit dünner Lauge gekocht (Kochen mit Lauge deshalb, weil der Talg dadurch krümelig und zum Bleichen geeignet wird, nicht zur direkten Entfernung des Farbstoffes), an der Sonne gebleicht und durch mehrmaliges Umschmelzen in reinem Wasser und dazwischen wieder erfolgtes Bleichen möglichst rein und weiß hergestellt. Um dem Lichte mehr Fläche zu bieten, zerrührt man entweder das flüssige Wachs während des Erkaltens oder schneidet es nach dem Erkalten in Scheiben.» Um die Preßrückstände auszunutzen, wird ihnen bisweilen Se-nu-abura (Ye Goma), d. h. das Öl von Perilla ocimoides L. zugesetzt, die in Ihren Früchten bis 40% Fett enthält. Diese späteren Pressungen zeigen also abweichende Eigenschaften, sind weicher und klebriger. Dieser Ölzusatz wird in der europäischen Literatur schon 1877 erwähnt, ist aber jedenfalls eine alte Sitte und nicht erst seit 1895 (LEWKOWITSCH) bekannt. Neuerdings wird das Fett auch mit Äther oder Schwefelkohlenstoff extrahiert (SCHÄDLER).
«Der Rohtalg wird vor dem Export einem einfachen Verfahren unterworfen, indem er mit Wasser gekocht und dann in flüssigem Zustande abgeschöpft wird. Nach dieser Prozedur wird der Talg im Sommer 3–5, im Winter 7–8 Wochen zur Bleichung der Sonne ausgesetzt.» (PAUL MARTELL 1911). Oft wird das Rohwachs auch in dünnen Scheiben an der Sonne gebleicht. Man begießt die in flachen Körben liegenden Scheiben dabei mit Wasser. Die Ausbeute beträgt 15–25%.
Cera japonica ist in bisweilen zentnerschweren Blöcken und in runden oder viereckigen Kuchen oder gestempelten Scheiben im Handel, das prima ☐ in Kisten von c. 90 kg. Es ist ein bedeutender Handelsartikel Japans und kommt auch von Formosa und aus China über Singapore nach London — das japanische direkt von Kobe, Nagasaki, Yokohama und Osaka, das chinesische über Shanghai und Hongkong. Kobe ist Hauptmarkt. Von dort kommen 90%. Die Durchschnittsernte beträgt 4 Mill. kin (= 2,4 Mill. kg, 1 kin = 0,601 kg). Japan exportierte 1906: 3913626, 1907: 3810520, 1908: 3817374, 1909: 5701963 kin. China exportiert bedeutend weniger. Die Einfuhr von Japanwachs nach London betrug 1907: 615, 1908: 415, 1909: 1756 cases usw. Die Marke Kitagumi gilt im allgemeinen als gut, doch kommt neuerdings (1909) unter dem Namen auch minderwertiger Abfall in den Handel.
Das Rohwachs ist oft blaugrünlich, das gebleichte und durch Einlaufenlassen in Wasser raffinierte (prima, secunda) weiß oder blaßgelblich. Beim Liegen wird es tief gelb und überzieht es sich allmählich mit einem weißen Anfluge. Die Masse bricht eben und großmuschelig und läßt sich in der Hand wie Wachs kneten. Die Bruchfläche ist glanzlos, die Schnittfläche wachsartig glänzend. Der Geruch erinnert an Talg und Bienenwachs. Mikroskopisch betrachtet zeigt die innere Masse kleinere und größere Körnchen und Blättchen sowie nadelförmige Kristalle. Der weiße Beschlag enthält viel gebogene Stäbchen und breite Prismen, die zum Teil korrodiert sind.
Japantalg ist ein gemischtes Fett. Es besteht aus dem des Mesocarps und dem der Cotyledonen. Japanwachs ist unlöslich in kaltem Alkohol, wenig löslich in Äther, löslich in Petroläther, Chloroform, Benzin und setzt aus der heißen alkoholischen Lösung Kristalle ab. Bei Erkalten der heißen alkoholischen Lösung scheidet sich aber nicht alles ab (A. MEYER). Japantalg verseift sich leicht mit Alkalihydraten, teilweise auch durch Borax und Sodalösung (FLÜCKIGER).
Von den echten Wachsen ist Japanwachs durch seine Verseifungszahl und dadurch unterschieden, daß es als echtes Fett Glycerin liefert. Japantalg enthält vornehmlich Palmitin und Palmitinsäure. (Aus Japantalg läßt sich bequem Palmitinsäure darstellen, C. MAYER, Dissert. Bern 1888.) Dann die zweibasische Japansäure C21H40O4 (Nonadecamethylcarbonsäure SCHAAL) und ihre zwei niederen Homologen C20H38O4 und C19H36O4 (SCHAAL) sowie sehr geringe Mengen flüchtiger Säuren (darunter wohl Isobuttersäure ENGELHARDT), dann Pelargonsäure, eine Säure C15H30O2, Spuren Stearin- und Ölsäure, aber keine Arachinsäure (TASSILY, GEITEL und VAN DER[S. 713] Want). Die Japansäure (früher C22H42O4 [GEITEL und VAN DER WANT] oder C20H38O4 [EBERHARD] formuliert) findet sich wahrscheinlich als ein gemischtes Glycerid mit Palmitinsäure:
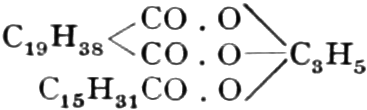
im Fett vor (GEITEL und VAN DER WANT). Letzteres enthält 10,3–11,2% (BENEDIKT und ZSIGMONDY) bzw. 11,59–14,71 (ALLEN) Glycerin. Im Unverseifbaren (0,54%) findet sich Melissylalkohol und Cerylalkohol, ein Alkohol C19H40O und ein Phytosterin (MATTHES und HEINTZ).
Spez. Gew. bei 17,5° 0,998 (KLEINSTÜCK), bei 98–99° 0,8755 (ALLEN), bei 16–18° ist die Dichte der des Wassers gleich, bei 18° leichter, bei 16° schwerer als Wasser (KLEINSTÜCK). Gebleichter Japantalg hat ein niedrigeres spez. Gew., Erstarrungspunkt 48,5–53, Schmelzpunkt 50,4–56 (ALLEN, nach OPPERMANN 48–50°), meist um 53°. Frischgeschmolzener Japantalg hat einen anderen Schmelzpunkt (42° ROUCHER, H. MÜLLER). Das Fett des Mesocarps hat einen anderen Schmelzpunkt wie das der Cotyledonen. Verseifungszahl 214–237,5 (GEITEL und VAN DER WANT), bei selbstextrahiertem 206–212 (AHRENS). (DIETERICH fand 1900: Schmelzpunkt 47,5 bis 53,5° [meist um 53], Säurezahl 15,06–18,38 [1902: 13,44–17,36], Esterzahl 198–207,9 [1904: 187,5 bis 205,8], Verseifungszahl heiß 216,64–225,08 [1902: 212,8–223], V. kalt 211,95–225, Wasser 1,38–3,45), Jodzahl 4,2–8,5 (10,6–15,1 BERNHEIMER und SCHIFF, AHRENS und HETT), Hehnerzahl 89,8–90,66. Erstarrungspunkt der Fettsäuren 53–57° (ALLEN, ULZER), Schmelzpunkt 56 bis 62°, Unverseifbares 1,1–1,63%, freie Fettsäuren 3,87–16,4%, also sehr schwankend, Asche 0,02–0,08%.
Japantalg ist bisweilen mit Wasser, mit dem es sich leicht emulgiert, beschwert (15 bis 30% WIMMEL, STOHMANN) und mit Stärke verfälscht (20–25% LA WALL) — bleibt beim Auflösen in Äther zurück — sowie mit Rinder- und Hammeltalg. Hohe Jodzahl deutet auf beigemengtes Perillaöl, das auch das spez. Gew. und andere Konstanten beeinflußt (die obigen Zahlen beziehen sich auf reinen Japantalg). Verfälschung mit Rinds- und Hammeltalg sind am niedrigen Schmelzpunkt und hoher Jodzahl zu erkennen.
Japantalg dient in Japan und Formosa als Surrogat des Talgs und Bienenwachses zur Kerzenfabrikation, in Europa wird es viel zu den sog. Wachszündhölzern allein oder mit Bienenwachs benutzt (die Mischung läßt sich leicht gießen), sowie zu Glanzwichsen (Bodenwichsen), zur Lederzurichtung und zu Ricinusölpomade. Japantalg erscheint erst 1854, d. h. seit Abschluß des ersten Handelsvertrags zwischen Japan und England im Londoner Handel (FLÜCKIGER). In China scheint das Fett der Rhusarten seit dem XIII. Jahrh. in Gebrauch zu sein. KÄMPFER lernte Rhus succedanea und vernicifera 1690 in Japan kennen. (Abbild. in den Amoenitates.) THUNBERG beschrieb die Pflanze in Flor. japon. 1784.
Lit. VOGL, Über Pflanzenwachs, Lotos 1872. — HANBURY, Science papers, p. 60. — ARTHUR MEYER, Über den Japantalg. Arch. Pharm. 215 (1879), 97 (dort weitere Literatur). — MÖBIUS, Ber. d. bot. Ges. 1897, 435. — E. BURI, Ebenda 214 (1879) 403. — FLÜCKIGER, Pharmac. Chemie. — SCHÄDLER, Fette. — WITTSTEINS Vierteljahrsschrift 14, 299. — SEMLER, Trop. Agrikultur. — MIKOSCH in WIESNER Rohstoffe. II. Aufl. — P. MARTELL, D. chem. Industr. Japans, Chem. Industr. 1909, 438. — STHAMER, Lieb. Ann. 43 (1842), 335. — LEWKOWITSCH a. a. O. — BENEDIKT-ULZER a. a. O. — OPPERMANN, Ann. chim. phys. 49, 242 (erste Unters.). — KLEINSTÜCK (spez. Gew.), Chem. Zeit. 1890, 1303. — ROUBER (Schmelzp.), Journ. pharm. 16 (1872) 20. — WIMMEL, Zeitschr. Österr. Apoth. Ver. 1867, 350. —LA WALL (Stärkefälsch.), Journ. Soc. chem. ind. 1897, 247 (u. Am. journ. pharm. 1897). — AHRENS und HETT, Zeitschr. ang. Chem. 1901, 684. — LEMARIÉ (Perillaöl), Chem. Rev. d. Fett- usw. Industr. 1904, 127. — TASSILLY, La cire du Japon. Bull. sc. pharmacol. 1911, 329. Bull. Soc. chim. (4) 9, 608. — BENEDIKT und ZSIGMONDY, Jahrb. d. chem. Techn. 1885, 1103. — EBERHARDT, Diss. Straßb. 1888. — BERNHEIMER und SCHIFF, Chem. Zeit. 25 (1901) 1008. — GEITEL und VAN DER WANT, Journ. f. prakt. Chem. 61 (1900) 151. — SCHAAL, Ber. d. d. chem. Ges. 1907, 4784. — MATTHES und HEINTZ, Arch. Pharm. 1909, 650.
4. Ölsäuregruppe.
Die Fette dieser Gruppe schließen sich am nächsten den nichttrocknenden Ölen an, enthalten also alle Ölsäure als charakteristischen Bestandteil, aber weniger wie jene, sind daher in unserem Klima fest.
[S. 714]
Fructus Elaeïdis und Oleum Palmae.
Syn. Ölpalme, Palmier à l’huile, Palmier Avoira, Elaeis de Guinée, Oil palm, Coco dente. In Kamerun: banga, malende, in Dahomey: dé, in Togo: déti, bei den Yorubas: Ope-Ifa, an der Goldküste: abobo-be.
Stammpflanze und Systemat. Stellung. Elaeïs guineensis JACQ. Palmae. Ceroxylinae — Cocoineae — Elaeïdeae.
Man unterscheidet einige Varietäten bzw. Sorten der Ölpalme: Lisombe oder Isombe (mit dünner Steinschale), groß- und kleinfrüchtige (wohl identisch mit dégbakoum), Kissede (in Dahomey), De (die häufigste in Togo), De-de bakui (mit dünner Steinschale), Se-de (liefert wenig Öl), Afa-de (Fetischpalme), Digumbe (Angola), Banga (Kamerun), Dé-Votchi (Dahomey), weitere bei SOSKIN. Sie variieren z. B. in der Größe der Frucht. Doch wird nur klude (in Togo = fadé) in Dahomey als gute Varietät betrachtet (SOSKIN).
Beschreibung der Stammpflanze und der Frucht. Die Ölpalme ist eine der schönsten Palmen, die ich kenne. Ihr schlanker, gerader, bis mannsstarker, kaum sich nach oben verjüngender, bis 20, ja 34 (PREUSS) m hoher Stamm trägt eine prachtvolle Blattkrone von 20–30, meist 3–5, aber auch bis 7 m langen tiefgrünen Blättern. Er ist anfangs nicht glatt wie bei der Cocospalme, sondern mit den, durch abortierende Fiedern bedornten, Blattbasen bedeckt, in deren Achseln sich zahlreiche Epiphyten anzusiedeln pflegen (Taf. XXII), wenn sie nicht, was oft geschieht, abgeschnitten werden. Im Alter von 20 Jahren verlieren sich die Blattbasen und der Stamm wird mehr oder weniger glatt. In Westafrika bildet sie in der Nähe der Weiler «Haine von paradiesischem Zauber. Sie stattet die Landschaft mit einer Pracht aus, welche die feierliche Majestät ägyptischer Palmenwälder fast armselig erscheinen läßt» (SCHWEINFURTH). «Überall herrscht sie: im Urwalde, in der Savane, im Buschwalde, an den Ufern des Stromes, überall zieht sie den Blick des Reisenden als der hervorragendste, schönste Ausdruck alles afrikanischen Pflanzenlebens auf sich» (SOYAUX). «In der Jugend streben die zu einem mächtigen Busche vereinigten gewaltigen Blätter in steiler Linie empor, an der Spitze leicht sich überneigend, gleich als wären sie in einer Vase vereinigt; man ist unschlüssig, was man mehr bewundern soll, die strotzende Kraft tropischen Wachstums oder das ästhetisch Schöne in der Anordnung der Glieder» (TSCHIRCH). Die Tragfähigkeit beginnt meist mit dem 7.-8. und dauert bis zum 60. Jahre. Mit 10–12 Jahren erreicht der Baum die Vollkraft und behält sie Jahrzehnte. Jährlich erscheinen 3–10 Fruchtstände. In Kultur kann eine Palme 50 kg Früchte liefern, in Lagos liefert sie aber nur c. 10 kg.
Die männlichen Blütenstände der diklin-monözischen Pflanze entspringen oben am Stamm, die weiblichen (bis 10) weiter unten. Die Form des aufrechten, konischen, kurzgestielten weiblichen Zapfens, der 20–30 (ja 50) kg schwer wird, erinnert an eine riesige Erdbeere, an der bisweilen zwei Mann zu tragen haben (LIVINGSTONE) (Fig. 221). In ihm sind hunderte (oft 6 bis 800, ja über 2000 PREUSS) von etwa pflaumengroßen, eiförmigen, glänzenden, gelben bis rötlich-braunen, violetten oder gar schwarzen Früchten dicht gedrängt vereinigt. Meist sind die Früchte an der Basis orange, oben braunrot. Viermal im Jahre kann die Palme Früchte tragen. Reifezeit 4–6 Monate. In Guinea reifen die meisten Früchte in den ersten vier Monaten des Jahres. Die mächtigen dornartigen Zacken, in die die Deckblätter der weiblichen Blüten auslaufen, bilden einen wirksamen Schutz, namentlich der jungen Früchte, gegen Tiere, besonders Affen.
DRUDE ist aus theoretischen Erwägungen der Ansicht, daß die Ölpalme ursprünglich im tropischen Amerika heimisch war, vor tausenden von Jahren aber nach Afrika verschlagen und dort zu einer scheinbar einheimischen Art wurde. Jedenfalls findet sich aber die echte Ölpalme in Südamerika jetzt nur in kultivierten Exemplaren (MARTIUS), die ihre Eltern offenbar in Afrika haben. Vielleicht hat sich die afrikanische Art aus einer amerikanischen (der sehr ähnlichen E. melanococca?) umgebildet. Jedenfalls macht jetzt die Ölpalme ganz den Eindruck einer in Westafrika heimischen Art. Sie meidet höhergelegene Distrikte und liebt feuchten Boden. In Kamerun, Dahomey, Lagos, Süd-Nigeria reicht sie bis zur Küste, in Togo bis 10 km von derselben. Jetzt ist sie besonders in den Ländern am Busen von Guinea häufig. Die Grenzen ihrer Verbreitung sind durch eine Linie bezeichnet, die sich mitten zwischen Cap Branco und Cap verde beginnend bis Benguela an der ganzen Westküste von Afrika hinzieht und die Guineainseln[S. 715] einschließt. Von Benguela läuft die Grenzlinie nach dem Nyassasee, von da zum Tanganjika und dem oberen Uëlle, von dort zum Tsadsee und zur Küste zurück (ASCHERSON). Am üppigsten wächst sie im unteren Niger- und Benuëgebiet, auf den Inseln des Busens von Guinea (z. B. Fernando Po), der Küste von Ober-Guinea bis Cap Palmas zwischen Cap Blanco und St. Paul de Loanda, sowie am Kuánsu und im unteren Congo. Sie fehlt im ostafrikanischen Steppengebiet, in Bornu, Wadai, Darfur. Geschlossene Bestände finden sich nirgends (PREUSS). Sie ist die Charakterpflanze des Buschlandes und der offenen Parklandschaft und meidet den Urwald. Von einer eigentlichen Kultur der Ölpalme war in Westafrika bisher nirgends die Rede (BUSSE), abgesehen von spontan und subspontan in der Nähe von Ansiedelungen entstandenen Hainen, doch versuchen die Europäer neuerdings auch die Anpflanzung mit Erfolg. Die Samen säen sich selbst aus und Tiere, die das Fruchtfleisch fressen, verbreiten sie. Die Kultur wird warm empfohlen (SOSKIN), da sie doppelt so hohe Erträge liefert als die Cocospalme. Die Kultur ist bei SOSKIN (a. a. O.) beschrieben. Als Feind der Ölpalme kommt fast nur der Palmbohrer, Rhynchophorus phoenicis in Betracht (weitere bei SOSKIN).

[Tschirch, phot.]

Eine 5–6jähr. Ölpalme mit 10 Fruchtständen.
[Aus Soskin, Die Ölpalme.]
Sie wird kultiviert in Brit. Südafrika, Ostafrika (Pemba hat einen großen Ölpalmenhain), Südamerika (Provinz Amazonas in Brasilien) — in Südamerika (von Bahia bis Guiana) auch verwildert — Westindien, Java (seit 1859), Sumatra, Rioux-Lingga, Nordborneo, Ceylon, Vorderindien,[S. 716] hat sich aber in Südasien, wo Cocos dominiert, nirgends durchgesetzt (TSCHIRCH) und auch sonst nur wenig.
Die kleinere, mit roten Früchten versehene Elaeis melanococca GÄRTN. (Corozo colorado in Venezuela, Caiaue in Brasilien), in Amerika, von Costa Rica bis zum Amazonas und Madeira heimisch, liefert auch etwas Palmfett, aber zunächst nur für den Bedarf der Eingeborenen.
Die Frucht ist eine Drupa. Das ölreiche gelbe, veilchenartig riechende Fruchtfleisch ist sehr faserig, etwa 0,5 cm dick, — nach der Varietät wechselnd 4–5 mm (SADEBECK) — der harte, grobgestreifte, dreikantige Steinkern ist 0,5 cm dick, zeigt an der Spitze 3 Keimlöcher und umschließt den 1–1,5 cm langen, schlanken, endospermreichen Samen, seltener 2 oder 3 (Ovula sind 3 vorhanden, entsprechend den 3 Carpellen, aber 2 pflegen fehlzuschlagen). Die Dicke der Steinschale wechselt sehr nach der Varietät. Bei der gewöhnlichen (Dé) kann der Steinkern nur mit einem Hammer aufgeschlagen werden, bei anderen (Lisombe, Degbakoum) bricht er wie bei Krachmandeln, bei noch anderen (Dé Votchi, Digumbe) ist die Steinschale in ein Fasergewebe aufgelöst. Feuchter fruchtbarer Boden soll die Ausbildung dünnschaliger Varietäten begünstigen. Das Gewicht der Früchte schwankt von 6–10 g.
Die Epidermis der Fruchtschale bildet mit der darunterliegenden, Bastfaserbündel führenden, Schicht das Exokarp, das breite Mesokarp wird von einem fetthaltigen Parenchym gebildet, in dem Oxalatzellen liegen und das von zahlreichen, bastfaserreichen, von Kristallkammerfasern begleiteten (HANAUSEK) Gefäßbündeln durchzogen wird. Das Endokarp besteht aus einer breiten Schicht Sklereïden, die braungefärbt, außerordentlich stark verdickt und reich getüpfelt sind. Da das Raphegewebe den Carpiden tief und breit eingewachsen ist, geht das Endokarp allmählich unter Verringerung der Verdickung der Zellen in das Gewebe der Samenschale über, das aus einer breiten Schicht von Zellen mit braunem Inhalt besteht (A. MEYER), deren innere sich mit Kali citronengelb färben (HANAUSEK). Das große Endosperm besteht aus radial gestreckten, nicht sehr stark verdickten, aber grobgetüpfelten Zellen, die reichlich zum Teil kristallinisches Fett und große Aleuronkörner mit ein oder mehreren, vortrefflich ausgebildeten Kristalloiden (TSCHIRCH) einschließen. Die aus der Steinschale herausgelösten, bis 1,5 cm langen Samen bilden die Palmkerne des Handels. Das als Verfälschung von Gewürzen (z. B. Pfeffer) beobachtete Palmkernmehl (daher: Poivrette, Pepperette, Mischpfeffer) besteht aus den gemahlenen Preßrückständen derselben, die noch 5–16% Öl enthalten und immer auch Sklereïden des anhängenden Endocarps erkennen lassen, neben den sehr charakteristischen reichgetüpfelten Endospermzellen mit sog. knotig gegliederter Wand und den Zellen der Samenschale.
Lit. ARTHUR MEYER, Über d. Ölpalme. Arch. Pharm. 1884, 713. — ASCHERSON, Die Ölpalme. Globus 35, 209. — DRUDE, Geogr. Verbr. d. Palmen. Peterm. geogr. Mitt. 1878. — MAYCOCK, Flora Barbadens. 1830. — SEMLER, Trop. Agrikultur. — VAN GORKOM, Oostind. Cultures. — SCHWEINFURTH, Im Herzen Afrikas 1874. — SOYAUX, Aus Westafrika 1879. — SADEBECK, D. wichtigeren Nutzpflanzen usw. aus d. deutsch. Kolon. 1897. — WARBURG in ENGLER, Pflanzenwelt Ostafr. (Verbreitung). — PREUSS, D. wirtschaftl. Bedeut. d. Ölpalme. Tropenpfl. 1902. — SOSKIN, Die Ölpalme. Ein Beitrag zu ihrer Kultur. Kolon. wirtsch. Kom. 1909. — JEAN ADAM, Le Palmier à l’huile. Paris 1910. — CHEVALIER, Documents sur le Palmier à huile. Paris 1910. (Végétaux utiles de l’Afrique trop. franç.) — ESTÈVE, Le Palmier à huile. Journ. Agr. trop. Paris 1903, 357, 238. — MOLONEY, Sketch of the forestry of West Afrika. — J. ET EUG. POISSON, Note sur le Palmier à l’huile etc. Bull. Museum d’hist. nat. 1903. — SAVARIAU, Rech. sur les variétés du palmier à l’huile au Dahomey. Suppl. Journ. Offic. Afr. occident. franc. 1909. — DANIEL, Le Palm. à l’huile au Dahomey. Rev. colon. 1902. — Varieties of the Oil palm. Bull. Misc. Inf. Bot. Gard. Kew. 1909. — DRABBLE, Comparison of palm fruits etc. Quat. journ. Univers. Liverpool 1907 u. 1908. — STRUNK, Ölpalmenkultur. Tropenpflanzer 1906, 637. — ZELLER, Die Düngungsfrage f. d. Kult. d. Ölpalme. Tropenpfl. 1911. — ZIMMERMANN, Die Ölpalme am Tanganjikasee. Tropenpfl. 1911, 549.
Abbild. TSCHIRCH, Ind. Heil- und Nutzpflanzen, t. 95 u. 96. — ARTH. MEYER a. a. O. (mit vielen Figuren). — SADEBECK, Kulturgewächs. d. deutsch. Kolonien 1899. — Bulletin miscellan. informat. Royal botanic. Garden Kew 1909. — MARTIUS u. MOHL, Hist. nat. palm. t. 54–56. — DRUDE in Mart. flor. brasil. t. 105. — SOYAUX a. a. O. t. 105. — KÖHLER-VOGTHERR, Medizinalpfl. Ergänzungsb. t. 77. — WILDEMANN, Plant. trop. I, Fig. 12. — SOSKIN a. a. O.
Anatomie besonders bei ARTH. MEYER a. a. O. — T. F. HANAUSEK, D. Frucht d.[S. 717] Ölpalme. Zeitschr. Österr. Apoth. Ver. 1882, 325 und in WIESNER, Rohstoffe 2. Aufl. — Aleuron: TSCHIRCH, Angew. Anatomie. — MOELLER, Afrik. Ölsamen. Dingl. Polyt. Journ. 1880 und MOELLER-WINTON, Mikroskopie (dort weitere Lit.). — HARZ, Landw. Samenkunde. — VOGL, Nahrungsm.
Preßkuchen: COLLIN-PERROT, Resid. industr. — HANAUSEK, Mischpfeffer in Realenzyklop. d. Pharm. — VOGL, Nahrungsm. Fig. 265. — KOBUS, Landw. Jahrb. 1884.

Bereitung von Palmöl im Ntumgebiet.
[Nach Photographie von Tessmann, Pangweesexpedition.]
Gewinnung des Palmöls. Die Gewinnung des Palmöls ist noch heute, z. B. in Kamerun und Dahomey, fast ganz in den Händen der Neger und sehr primitiv. Die Neger ersteigen den Baum mit dem Klettergurt, schneiden die Fruchtbündel los und lösen nach einigen Tagen die Früchte ab. Die Früchte werden zunächst auf Haufen oder in eine Grube geworfen, wo sie 6–10 Tage zur Fermentierung bleiben, damit sich die faserige Fruchtschale leichter vom Steinkern ablöst. Je rascher sie aber verarbeitet werden, um so besser ist das Öl. Die Früchte werden daher jetzt meist sofort c. 2 Stunden mit Wasser gekocht. Nun läßt sich der Steinkern leicht herauslösen und dies geschieht entweder durch Kneten der Früchte mit den Händen oder durch Schlagen und Stampfen mit Stangen oder Keulen in mörserartigen Gefäßen (Fig. 222) bzw. in mit Steinen ausgekleideten oder mit Lehm ausgestrichenen Gruben oder durch Bearbeiten mit den Füßen oder Händen in Holztrögen oder alten Kanoos (Taf. XXIII). Man überläßt nun die Masse c. 12 Stunden sich selbst, gießt dann kaltes oder heißes Wasser darauf, drückt die Masse mit der Hand aus und wirft die Kerne und die Fasermasse beiseite. In Dahomey läßt man letztere noch gären, was weiteres Öl freimacht. Das im Troge nun obenauf schwimmende Öl wird abgeschöpft, durch Korbsiebe filtriert und durch Erwärmen vom Wasser befreit. Filtrieren und Erwärmen wird wiederholt (SEMLER). Die europäischen Händler reinigen in ihren Faktoreien bisweilen das Öl nochmals. Es kommt in Fässern in den Handel. In Viktoria werden die Früchte zuerst in Kesseln 1–2 Stunden gekocht, dann in hölzernen oder metallenen Behältern mit hölzernen Keulen zerstampft, die Kerne abgesondert und das Öl mit der Hand ausgepreßt. Das Ausgepreßte wird in Wasser geworfen und nochmals mit der Hand ausgedrückt (die Preßrückstände enthalten immer noch 12% des Trockengewichtes Öl). Die Mischung von Wasser und Öl wird dann durchgequirlt, der Ölschaum abgehoben und in einem Tropf durch Erhitzen geschieden (PREUSS). Bei dieser Methode[S. 718] gehen ⅔ des Öls verloren. Das Öl aus Früchten, die vorher fermentiert wurden (s. oben), ist weniger gut. Die oben beschriebene Bereitung, bei der nur 10–12% der Frucht an Öl gewonnen werden und 50% des Öls in den Rückständen bleibt, ist schon alt. Das, was MARTIUS nach den Autoren von 1715 und 1723, wie das, was THONNING 1828, ROHLFS 1866 und SOYAUX 1875, berichten, stimmt im allgemeinen mit der noch heute zumeist geübten Methode überein. Bei den Niam-Niam wird das Öl der Fruchtwand einfach ausgepreßt, das Öl der Kerne durch Inbrandstecken eines über einen in der Erde versenkten Krug geschütteten Haufens derselben gewonnen (SCHWEINFURTH). Die Bewohner von Jocuba kochen die zerkleinerte Fruchtmasse aus (ROHLFS). In Loango werden die Früchte auf Raphiablattrippen über dem Feuer erwärmt, das zu einem Teige zerstampfte, von den Steinkernen getrennte Fruchtfleisch in aufgehängte Beutel gebracht und durch Drehen mit einem Hebel ausgepreßt, der Preßrückstand erwärmt und mit heißen Steinen zusammen nochmals gepreßt (PECHUËL-LÖSCHE). PREUSS bezeichnet einen Ertrag von c. 7¼ kg Öl und c. 15 kg Kerne pro Baum als das Normale. Doch wechselt dies natürlich. Den Eingeborenen liefert jeder Fruchtstand nur etwa 750 g Öl und 1500 g Kerne (PREUSS). Das Durchschnittsgewicht der Früchte eines Fruchtstandes beträgt 10 kg. Die Javanen bereiten das Öl, indem sie die Früchte in Dampf hängen, sie dann zerkleinern und in einer sehr primitiven Presse — zwischen zwei mit Steinen beschwerten Brettern auspressen (VAN GORKOM). In Kamerun und Togo sind seit 1906 deutsche Palmölwerke in Betrieb, in denen durch Schälmaschinen das Fleisch der vorgekochten Früchte vom Steinkern getrennt und dann ausgepreßt wird. Die französische Palmölfabrik in Dahomey preßt trocken direkt. Ein Verfahren, die ganze Frucht inklusive der Kerne zu pressen, ist HALLET patentiert (Franz. Pat. 321918).
Gebleichtes Palmöl wird durch Ozon oder Durchblasen von ozonisierter Luft durch auf 150° erhitztes Öl (Engl. Pat. 28682) oder durch Behandeln mit Bichromat und Salzsäure erhalten. Schmutzig rote Öle lassen sich nicht bleichen.
Die aus der Steinschale durch Aufschlagen mit Steinen herausgelösten Palmkerne werden in Hanf- oder Hyphaeneblatt-Säcken versandt. Die Palmnüsse oder Palmkerne werden meist erst in Europa (Marseille, Nantes, Harburg, Cöln, Liverpool, London usw.) und Amerika auf Palmkernöl verarbeitet — durch kalte und heiße Pressung und Extraktion — aber auch die Neger stellen es da und dort dar.
Handel. Das Palmfett ist das von allen fetten Fetten am meisten industriell verwendete und seit der Mitte des XIX. Jahrh. einer der wichtigsten Handelsartikel. Im Welthandel sind jährlich c. 7–800000 dz Palmöl und 1,2–1,3 Mill. dz. Palmkerne (SEMLER). Der Wert der Ausfuhr von Palmöl aus ganz Westafrika betrug 1907: 36,1 Mill. M. (100000 t), der der Palmkerne 53,6 Mill. M. (c. 220000 t). Es gibt zahlreiche Palmöl-Handelssorten, wie z. B. Liberia, Saltpond, Addah, Appam, Winnebah, Fernaodo Po, Braß, Neu- und Alt-Calabar, Niger, Accra, Benin, Bonny, Grand Bassa, Togo, Kamerun, Oap Labon, Cap Palmas, Lagos, Loanda, Gold Coast, Insel Sherboro, Gaboon, Half Jack, Opobo, Whidah, Dixcove, Rio Pongo, Appolonia, Grand und Little Popo, Quittah, Lahoo, Appam, Danve, Monrovia, Benin, Congo u. and. Der größte Teil der Erzeugnisse der Ölpalme geht über Lagos und das Niger Coast Protectorat, das eigentliche Gebiet der Ölflüsse. Lagos exportiert durchschnittlich im Jahre 2–4 Mill. Gall., z. B. 1895: 3826000 Gall. Palmöl und 46500 t. Palmkerne, das Nigerschutzgebiet (Alt- und Neu-Kalabar, Opobo, Bonny) durchschnittlich 10–12 Mill. Gall. Palmöl. Hauptmarkt der Kalabarhändler ist N’Dobe, Mittelpunkt des Rio del Rey-Gebietes. Kamerun erzeugt jetzt viel Palmöl. Hauptplatz ist Mandame am Mungo. 1897 exportierte Kamerun für 2300000, Togo für 500000 M. Ölpalmenprodukte, 10 Jahr später schon für 4,2 bzw. 1,4 Mill. M. 1900 exportierte Kamerun 2807229 kg Palmöl und 7945169 kg Palmkerne,[S. 719] Togo 1900: 1987382 kg Palmöl und 6330108 kg Palmkerne. 1909 exportierte Kamerun für 2,6 Mill. M. Palmkerne und für c. 1 Mill. M. Palmöl; die Goldküste jährlich c. 3–4,5 Mill. Gall. Öl. Der Kongostaat exportierte 1906: c. 2,5 Mill. kg Öl und c. 6 Mill. kg Kerne (I, S. 183). Sierra Leone exportierte 1909: 851999 Gallons Palmöl. Der Konsum in Afrika ist etwa doppelt so hoch wie der Export. Früher lieferte ausschließlich die Westküste Afrikas Palmöl, jetzt auch die Philippinen, Indien, Südafrika. Deutschland importierte 1909: 2304476 dz Palmkerne, besonders aus Brit. Westafrika, dann aus franz. Westafrika, Togo, Kamerun, Liberia und Port. Westafrika. Deutschland importierte 1909 152356 dz Palmöl, davon 132879 aus Brit. Westafrika, 11981 aus Liberia. Deutschland exportierte 1909: 425971 dz Palmkernöl. Hamburg importierte 1908 Palmöl und Palmkernöl seewärts: 151284 dz. Davon stammten aus Westafrika 112543, Kamerun: 10454, Deutsch Togo: 8084, geringe Mengen auch aus Brit. Südafrika, Brit. Ostindien. Frankreich importierte 1908: 213026 Quint. Palmöl, besonders aus Franz. Westafrika und Engl. Ostafrika und importierte 1908: 38286 Quint. Palmkerne (Amandes de palmiste), besonders vom Senegal und anderen französischen Besitzungen Westafrikas. Die Vereinigt. Staaten importierten 1908: 32615073, 1909: 58971777 pounds Palmoil.

[Aus Soskin, Die Ölpalme.]
Chemie. Das Palmöl wird also (wie das der Olive) aus dem Fruchtfleisch dargestellt, das Palmkernöl aus den geschälten Samen. Das Fruchtfleisch beträgt je nach der Varietät 27–70% der Frucht, die Kerne 9–25%. Das Fruchtfleisch enthält 22,6–70, meist 46–66,5% (FENDLER) Fett, das meiste enthält die Dévarietät. Die frischen Samenkerne enthalten 43–54 (meist 43–50)% Fett (NÖRDLINGER, FENDLER). Das frische Palmöl schmeckt süßlich, ist gelb und riecht veilchenartig. Mit der Zeit wird es an Licht und Luft (durch gebildetes Wasserstoffsuperoxyd (SCHÖNBEIN) oder Ozon(?) farblos und verliert den Geruch, aber erst sobald sich das Fett zersetzt (SADEBECK). Beim Verseifen bleibt Geruch und Farbe erhalten (LEWKOWITSCH). Die Farbe des Handelsöls schwankt zwischen orangegelb (Lagos) und schmutzig rot (Congo), die Konsistenz zwischen Butter (Lagos) und Talg (Congo). Palmöl ist in kaltem Alkohol wenig, leichter in heißem löslich. Es ist leicht verseifbar. In frischem Palmöl sieht man unter dem Mikroskop, eingebettet in eine ölige Grundmasse, Nadeln und Nadelaggregate. Ranziges Öl besteht fast nur aus Fettsäurekristallen. Die Zusammensetzung schwankt je nach Ursprung des Öls (Varietät, Bereitungsart usw.).
Die Hauptbestandteile des Palmöls (Palmbutter, Palmfett, huile de palme, palmoil, palmolie) sind Palmitin und Olein. Die festen Fettsäuren bestehen (nach NÖRDLINGER) aus 98% Palmitinsäure, 1% Stearinsäure und 1% Heptadecylsäure (C17H34O2, wohl = Daturinsäure S. 546). In den flüssigen ist Ölsäure und Linolsäure (HAZURA und GRÜSSNER) nachgewiesen.
Das spez. Gew. ist 0,9209–0,9245 (TATE), 0,945–0,947 (SCHÄDLER, MARPMANN); bei 98° 0,858–0,860. Erstarrungspunkt: 31–39 (FENDLER). Schmelzpunkt: 27–42,5 (je nach Alter und Ursprung des Öls), 35–43° (FENDLER). Verseifungszahl: 196,3–205,52 (MOORE, VALENTA, FENDLER). Jodzahl: 51–57,4, meist 53 bis 56 (TOLMAN, LEWKOWITSCH), selten 34–42. Reichert-Meisslzahl: 0,74–1,87 (FENDLER). Hehnerzahl: 94,2–97 (TATE). Brechungsexponent (bei 60°): 1,4510. Das spez. Gew. der Fettsäuren beträgt (bei 98°) 0,8369 (ALLEN), ihr Erstarrungspunkt liegt bei 35,8–46,2°, meist bei 44,5–45 (DE SCHEPPER und GEITEL), ihr Schmelzpunkt bei 47,75–50°, die Jodzahl 53,2 (THÖRNER), die der flüssigen Fettsäuren 94,6–99.
Da das Fruchtfleisch eine sehr energisch wirkende Lipase enthält, spalten sich die Glyceride des Fettes sehr leicht und schon frisches Palmöl enthält 10–12, etwas älteres oft 20–60% freie Fettsäuren, altes ist bisweilen gänzlich aufgespalten (LEWKOWITSCH). Die Säurezahl steigt mit dem Gehalt an Wasser und Verunreinigungen.[S. 720] Die Verunreinigungen betragen meist 1–8%. Der Riechstoff hat einen an Rhiz. iridis und Blauholz erinnernden Geruch. Der gelbe Farbstoff (wohl ein Lipochrom) läßt sich nicht durch Wasser entziehen. Er wird durch rauchende Salpetersäure blau, durch Schwefelsäure blaugrün, durch Chlorzink grün (BENEDIKT) und durch Erhitzen auf 240° zerstört (OUDEMANS). Die Lipase (PELOUZE und BOUDET) zerlegt das Fett rasch.
Die Samen enthalten 43,7–52,5% Öl, das meist durch hydraulische Pressen ausgepreßt wird und angenehm riecht und schmeckt. Das Palmkernöl (huile de palmiste ou de pepin de palme, palm seed oil, palm kernel oil, palm nut oil, palm pit olie) ist ganz vom Palmöl verschieden und in seiner Zusammensetzung dem Cocosöl sehr ähnlich. Es besteht hauptsächlich aus Laurinsäureglycerid, enthält 12–20% Olein, ferner Palmitinsäure und Myristicinsäure und relativ viel flüchtige Fettsäuren, wie Caprylsäure, Caprinsäure (VALENTA) und etwas Phytosterin (STELLWAAG). Seine Jodzahl ist sehr niedrig: 10,3–16,8, die Verseifungszahl sehr hoch: 242–254,8. Seine Seife läßt sich schwer aussalzen.
Der Preßkuchen (tourteau de palmiste) enthält c. 2,4% Stickstoff (13–20% stickstoffhaltige Substanzen), 4,45–16% Fett, c. 24,92% Rohfaser und 3,60–4,48% Asche (CORNEVIN, DIETERICH, MAYER, WAGNER, SCHULZE). Palmkernkuchen enthalten ein Mannogalaktan (SCHULZE) und liefern daher bei der Hydrolyse mit verdünnten Säuren Galaktose und Mannose. Er gilt als mittelmäßiges Futtermittel und wird meist nur gemischt gegeben (COLLIN-PERROT). Die Steinschale enthält 68–75% Rohfaser, 3–3,6% Rohprotein und 1,5–2,1% Rohfett (WEHNERT, VÖLCKER und EMMERLING).
Lit. FRÉMY, Journ. pr. Ch. 22, 120. — STENHOUSE, Lieb. Ann. 36, 50. — SCHWARZ, Ebenda 60, 58. — PELOUZE und BOUDET, Lieb. Ann. 29, 42. — Palmkernöl: OUDEMANS, Journ. pr. Chem. 110, 393 und VALENTA, Zeitschr. ang. Chem. 1889, 335. — BENEDIKT-ULZER, a. a. O. (dort weil. Lit.). — LEWKOWITSCH a. a. O. — BENEDIKT und HAZURA, Monatsh. f. Chem. 1889, 353. — NÖRDLINGER, Zeitschr. angew. Chem. 1892, 110 u. 1895, 19. — FENDLER, Z. Kenntn. d. Früchte von Elaeis guin. u. d. daraus gewonn. Öle. Ber. d. pharm. Ges. 1903 u. Arbeit d. pharm. Inst. Berlin I, 1903. — SCHEPPER und GEITEL (zahlr. Sorten), Dingl. polyt. Journ. 245 (1882) 295.
Verfälschung. Palmöl ist mit keinem anderen Öl zu verwechseln und wird wohl auch kaum mit anderen verfälscht (Cottonöl und Mineralöle sind beobachtet), doch mischen ihm die Neger Sand bei (Wasser und Sand dürfen 2% nicht überschreiten). Früher, als Palmöl noch teuer war, wurden mit Curcuma gefärbte, mit Iris parfümierte, aus Talg hergestellte Fälschungen beobachtet. Jetzt ist der Talg teurer.
Anwendung. «Sämtlichen Nutzpflanzen des äquatorialen Westafrikas, einheimischen wie eingeführten, an dauerndem Wert und wirtschaftlicher Bedeutung weit überlegen ist die Ölpalme. Ihre Produkte allein vermögen schon die Rentabilität von Dampferlinien und Eisenbahnen zu garantieren» (BUSSE). Obenan steht das Palmöl und die Palmkerne. Aber auch die Blätter werden als Flechtmaterial, die Fasern der Blattstiele zu Körben usw., das harte Endokarp zu Schmuckgegenständen, der nach Anschneiden der jungen männlichen Blütenstandsanlage oder Anschneiden des gefällten Stammes ausfließende Zuckersaft zur Palmweinbereitung (vgl. I, S. 1018) benutzt. Das Öl ist das Fett der Westafrikaner und dient dort wie Butter besonders zur Palmoil-chop. Vgl. auch FICKENDEY, Über die Verwendungsfähigkeit des Palmöls als Speisefett (Tropenpfl. 1910, 566). Palmkernmehl ist Futtermittel. Die Neger benutzen das Öl zu Einreibungen. Palmöl wird in Europa besonders in der Glycerin-, Seifen- und Kerzenindustrie verwendet.
Geschichte. Das Palmfett kam zuerst im XVI. Jahrh. nach Europa und ist seit dem XVIII. Jahrh. auch seiner Herkunft nach bekannt (BÖHMER), wurde aber erst im XIX. Jahrh. in größeren Mengen exportiert. Die Einfuhr begann 1807 (FLÜCKIGER). Es wurde zuerst in England technisch verwertet. Was das Ol. palmae der Taxe von Bremen 1665 und der Berluliste (I, S. 951) war, läßt sich nicht mehr feststellen (Cocosöl?). Während früher die Palmkerne[S. 721] weggeworfen wurden, brachten sie deutsche Kaufleute 1858 in den Handel und es entstand zuerst in Harburg eine Palmkernölfabrik. Jetzt ist das Palmkernöl wertvoller geworden als das Palmöl, da es besser ist.
Oleum Cacao.
Butyrum Cacao, Ol. Theobromae (Theobromatis), Cacaofett, Cacaoöl, Cacaotalg, Cacaobutter; beurre de Cacao, graisse de Cacao; Cacaobutter, oil of Theobroma; borro di Cacao. Die Bezeichnung «Butter» ist, da die Nahrungsmittelchemiker diesen Begriff scharf umschrieben haben, hier wie bei Ol. myristicae besser zu vermeiden.
Das Cacaofett ist das Fett der Samen von Theobroma Cacao L. Die Pflanze und die Samen werden bei den Purindrogen beschrieben.
Das Cacaofett wird — wohl stets als Nebenprodukt der Cacao- und Schokoladenfabrikation — in der Weise dargestellt, daß die schwach (bei 130–140°) gerösteten, geschälten und gemahlenen Samen in hydraulischen Pressen (bei bis 150 Atmosphären Druck) heiß (bei 60–70°) gepreßt werden. Die Ausbeute beträgt c. 30 bis 35%. Bisweilen wird vor dem Pressen ein Alkalikarbonat zugesetzt. Dann enthält das Fett Seife und gibt relativ viel Asche. Das Rohöl wird meist im Heißwassertrichter filtriert.
Hauptverkaufsplätze für Cacaobutter sind London und Amsterdam. Die Produktion betrug 1907 bei van Houten 820, bei Cadbury 495, Mignon Hall 474 t. GROSSMANN führt (1911) Cacaobutter in Blöcken à c. 10/16 kg und «Marke Stern» in Tafeln à 500, 250, 125, 100 und 50 g. Deutschland importierte 1907: 24, 1908: 11 t und exportierte 1907: 2080, 1908: 1849 t Cacaobutter.
Die Preßrückstände bilden den «entölten Cacao», der aber immer noch Fett (wenigstens 12%, meist mehr) enthält. Daß man durch Auskochen der zu Brei zerstoßenen Samen mit Wasser mehr Öl erhält wie durch Auspressen, wußte schon HOMBERG (s. Geschichte). Die Menge des Fettes in den Samen schwankt zwischen 36,8 und 56,5% (Extraktion mit niedrig siedendem Petroläther gibt die richtigsten Zahlen DAVIES und M’LELLAN), meist beträgt sie 51,5–56%-52% der geschälten und bei 25–30° getrockneten Samen (HEIDUSCHKA) — Durchschnitt: 55% (WELMANS). Nach anderen schwankt der Fettgehalt von 42–54 bzw. 37,1 und 51,4 (L’HÔTE) und beträgt meist 50–53,6% (ZIPPERER). Cacaofett ist spröde und hellgelblich-weiß und wird beim Aufbewahren ganz weiß. Es besitzt einen sehr angenehmen, schokoladenartigen Geruch und einen angenehm milden Geschmack. Cacaofett ist leicht in Petroläther, im halben Gewicht Benzol und im fünffachen Gewicht heißem absolutem Alkohol löslich. Die Lösung in 2 Teilen Äther bleibt bei 12° während 24 Stunden klar, während die mit 20 Teilen siedendem absolutem Alkohol hergestellte Lösung beim Erkalten alles, bis auf 1% (Olein), wieder fallen läßt (FLÜCKIGER). In 90% Alkohol ist es nur zum geringen Teile löslich (Unterschied von Cocosfett). Beim Einlegen in die Kali-Ammoniakmischung von HARTWICH und UHLMANN entstehen im Inneren des Tropfens Bündel ganz kurzer Kristallnadeln, an der Peripherie lange Nadeln.
Das Cacaofett enthält 59,7% (FARNSTEINER) feste Fettsäuren und zwar Stearinsäure (39–40% LEWKOWITSCH, HEHNER und MITCHELL), Palmitinsäure und Arachinsäure (SPECHT und GÖSSMANN). Palmitinsäure und Stearinsäure sind zum Teil als Triglyceride vorhanden (KLIMONT). Das Vorkommen von Laurinsäure (KINGZETT,[S. 722] TRAUB, GRAF) wird neuerdings bezweifelt (LEWKOWITSCH), die Theobromasäure (C64H128O2 KINGZETT) ist wohl Arachinsäure (TRAUB, GRAF). Unter den flüssigen Fettsäuren dominiert die Ölsäure (TRAUB) mit 31,2% (FARNSTEINER), daneben finden sich noch 6,3% andere flüssige Fettsäuren, darunter Linolsäure (BENEDIKT und HAZURA). Von gemischten Estern sind nachgewiesen Oleopalmitostearin (KLIMONT) C3H5(OC18.H33O)(OC16H31O)(OC18.H35O) F = 42°, Oleodipalmitin C3H5(OC16H31O)2(OC18H33O) (KLIMONT), Myristicopalmitoolein C3H5.(O.C14H27O) (O.C16H31O)(OC18H33O) F = 25–27° und Oleodistearin C3H5(C18H35O2)2C18H33O2 F = 44–44,5° (6% FRITZWEILER), wahrscheinlich aber noch andere vorhanden. Ölsäuretriglycerid fehlt (KLIMONT). Ameisensäure, Essigsäure und Buttersäure, die Graf angibt, scheinen bisweilen zu fehlen (LEWKOWITSCH), ebenso fehlt Caprylsäure (HEIDUSCHKA).
Das Fett enthält ferner eine Lipase und in dem Unverseifbaren Phytosterine (CLAYTON) wohl Stigmasterin (F = 162–163°) und Sitosterin (F = 139° MATTHES und ROHDICH), vielleicht auch etwas Cholesterin (PROCHNOW, MAURENBRECHER und TOLLENS), sowie neben einem festen Kohlenwasserstoff C30H48 (F = 133–134° wohl Amyrilen) ein hyazinthenartig riechendes Öl (MATTHES und ROHDICH). Der Träger des Geruches, den das Fett aus den Samen aufnimmt, soll das «Cacaorot in Verbindung mit einem Glykosid» (? F. MÜLLER) sein. Das bedarf der Bestätigung.
Spez. Gew. bei 15°: 0,964–0,976 (DIETERICH), bei 98°: 0,8577 (ALLEN), Pharm. helv.: 0,857–0,858. Frisch geschmolzenes Cacaofett zeigt ein niedrigeres spez. Gew., das erst nach Tagen oder Wochen wieder normal wird (WELMANS). Erstarrungspunkt: 21,5–27,3°, Schmelzpunkt: 26,5–36° (meist c. 33,5), Pharm. helv.: 29–32°, D. A. V. 30–34, Ph. austr. VIII: 30–35°; frisch geschmolzenes Fett schmilzt bedeutend niedriger (man lege über Nacht auf Eis!), mit Äther oder Petroläther extrahiertes bei 32–34°. Säurezahl: 1–2,3 (DIETERICH), 1,2–2,2 (Pharm. austr. VIII), 2,41 (WELMANS), 1,1–1,95 (LEWKOWITSCH), bei ganz altem Fett 4,6. Durch das Entwässern und Filtrieren im Dampftrichter erhöht sich der Säuregehalt zuweilen bis auf das Doppelte. Deshalb sollte längeres Erhitzen vermieden werden (E. DIETERICH). (Das Fett der Samenschalen hat eine hohe Säurezahl, bis 56 FILSINGER.) Verseifungszahl: 191,8–203,7 (meist unter 200, oft 193–196), Pharm. austr. VIII: 190–196, Jodzahl: 32,8–41,7 (STROHL), 27,9–37,5 (DIETERICH), D. A. V: 34–38, Pharm. helv.: 33–38. (Das Fett der Samenschalen hat eine höhere Jodzahl, 39–40 FILSINGER.) Bromzahl: 23,69 (TELLE), Reichert-Meißlzahl: 0,2–0,83, Polenskezahl: 0,33–0,38 (HEIDUSCHKA), Hehnerzahl: 94,59–94,9, Brechungsexponent bei 40°: 1,4565–1,4578 (STROHL) (Pharm. hel. IV: 1,4565–1,4586), Butterrefraktometer bei 40°: 46–47,8. Die freien Fettsäuren zeigen den Erstarrungspunkt 46–51°, den Schmelzpunkt 48–52°, die Jodzahl 32,6–39,1.
DIETERICH fand bei Untersuchung zahlreicher Proben: Schmelzpunkt 25,5–35° (meist 32–34), Säurezahl 3,2–25,36, Jodzahl (H-W) 33,89–38,5 (meist über 35), V. Z. h 188,72 bis 203,72 (meist 195–198), V. Z. k 187,6–196,69 (meist 194–195). STRUBE fand, daß bei langsamem Erstarren größerer Blöcke der Cacaobutter Marke «Samana» sich ein flüssiger Anteil abscheidet, der sich abweichend verhält, dessen Schmelzpunkt c. 12°, spez. Gew. bei 17,5°: 0,906, Jodzahl 53,06–58,8 ist.
Daß Cacaofett nicht ranzig wird, ist nicht richtig (LEWKOWITSCH, DIETERICH), aber es wird schwierig ranzig, vielleicht weil es reich an gemischten Glyceriden ist und der Ölsäurerest zwischen den anderen Fettsäureresten steht, also «geschützt» ist (KLIMONT).[S. 723] Mit den auf den Samen bisweilen auftretenden Schimmelpilzen und den stets vorhandenen Saccharomyceten steht das Ranzigwerden in keiner Beziehung, da nur geröstete Samen gepreßt werden.
Zur Prüfung bestimmt man in erster Linie die Jodzahl, dann Verseifungs- und Säurezahl sowie den Schmelzpunkt. Von den Verfälschungen ist Rinder- und Hammeltalg am häufigsten und am schwierigsten nachzuweisen. Bei der BJÖRKLANDschen Ätherprobe scheiden sich, wenn wenigstens 5% Talg zugegen sind, beim Abkühlen Flocken, nicht Kristallbüschel ab (LEWKOWITSCH). «Eine Lösung von 1 Teil Ol. Cacao in 2 Teilen Äther darf sich innerhalb 24 Stunden bei Zimmertemperatur nicht trüben» (D. A. V). Zuverlässiger noch ist die Phytosterinacetatprobe, unbrauchbar (nach LEWKOWITSCH) HAGERS Anilinprobe (Dingl. Pol. Journ. 175, 324). Cacaofett wird auch häufig mit Cocosfett oder Palmkernstearin, die unter dem irreführenden Namen «Schokoladenfett», «Schokoladenbutter» im Handel sind (FILSINGER), verfälscht, die an den hohen Verseifungs- und Reichert-Meißlzahlen und der niedrigen Jodzahl erkannt werden können. Ein Gemisch von Cocosfett und Japantalg fand POSETTO 1901 unter dem Namen «Cacaobutter S». Die Ersatzmittel Cacaoline und Cocoline bestehen aus Cocosfett und Palmkernstearin, denen bisweilen Japantalg zugesetzt wird (FENDLER), die «Pflanzenbutter», «Gemüsebutter» aus Cocosfett (FILSINGER). Verfälschungen mit Mandel-, Arachis-, Sesamöl (FILSINGER) und Haselnußöl verraten sich durch hohe Jodzahl und Erniedrigung des Schmelz- und Erstarrungspunktes, sowie durch die bei den Ölen oben (S. 576 u. 592) angegebenen Reaktionen, Wachs und Paraffin (neuerdings nicht mehr beobachtet) durch Erniedrigung der Verseifungszahl und Erhöhung des Unverseifbaren. Neuerdings sind auch Verfälschungen mit Ol. margarini, Stearinsäure und Dikafett (S. 711) beobachtet (letzteres ist aber selten und ebenso teuer), sowie mit dem Fette der Samenschalen, das zu 4–5% darin enthalten ist (FILSINGER, s. oben S. 722). Auf unzulässig hohe Mengen freier Säuren (infolge Ranzidität) läßt Pharm. helv. wie folgt prüfen. «Eine Lösung von 2 g Cacaofett in 10 ccm Chloroform und 20 ccm absolutem Alkohol soll nach Zusatz von 3 gtts Phenolphthaleïn und 1 ccm weingeistigem n/10 Kali bleibende Rotfärbung zeigen.»
Man bewahrt das Cacaofett am besten in Stanniol eingeschlagen auf. Cacaofett wird zu Suppositorien, Urethralstäbchen, Vaginalkugeln, Ceraten, Pillen, Lippenpomaden, Augensalben usw. benutzt, wozu es sich gut eignet, da es bei Körpertemperatur schmilzt.
Schon HOMBERG (I, S. 884) schied 1695 das Cacaofett ab, das QUELUS (cit. in Hallers Bibl. bot. II [1772] 158) für Salben und als Genußmittel empfahl. Zur Gewinnung des Öls benutzte GEOFFROY (I, S. 883) außer der Presse bereits 1741 den Äther (FLÜCKIGER). Er empfiehlt es als Salbengrundlage, für Lippenpomade und bei Hämorrhoiden. Besonders die Tübinger Dissertation von B. D. MAUCHART über Butyrum Cacao 1735 (I, S. 928) lenkte die Aufmerksamkeit auf das Fett als ein «novum atque commendatissimum medicamentum» (FLÜCKIGER-HANBURY). In die Apotheken ist es in der zweiten Hälfte des XVIII. Jahrh. gekommen. In der Pharmacopoea Wirtenbergica von 1771 steht eine Vorschrift zu seiner Bereitung in der Apotheke. Vgl. auch BUCHOLZ, Einige Vers. als Beytr. z. Bestimm. d. best. Method. die Butter aus den Cacaobohnen abzuscheiden. Trommsd. Journ. d. Pharm. 20, 1, 62. — Das Wort Cacao ist den Fremdwörterbüchern bis in die erste Hälfte des XVIII. Jahrh. noch unbekannt (KLUGE), es ist umgebildet aus mex. cacauatl, cacaotl, cacaua (so bei HERNANDEZ, bei FERNANDEZ: cacaguata [I, S. 756]). — coco (caca, cacau) = Schaum, atl = Wasser (V. LIPPMANN, Gesch. d. Zuckers). — Doch finde ich bereits im Catalogus der Dresdener Hofapotheke 1683: Grana Cacao (Cacahuatl), in der Gothaer Verordnung 1694 (1, S. 828): Fructus caccau und im Catalogus Brunsvicensis 1706: nuclei cacao.
Lit. LEWKOWITSCH a. a. O. — SPECHT und GÖSSMANN, Lieb. Ann. 90 (1854) 126. —[S. 724] TRAUB, Zusammensetzung d. Cacaoöls. Arch. Pharm. 1883, 19. — KINGZETT, Ber. d. chem. Ges. 1877, 2243; Journ. chem. soc. 1878, 38. — GRAF, D. Bestandt. d. Cacaofettes, Arch. Pharm. 1888, 830. — HEHNER und MITCHELL, Analyst. 1896, 328. — BENEDIKT und HAZURA, Monatsh. f. Chem. 1889, 353. — FRITZWEILER, Arb. d. kais. Gesundheitsamt 1902, 371. — DAVIES und M’LELLAN (Fettgehalt der Samen), Journ. Soc. Chem. Ind. 1904, 480 (Chem. Rev. 1904, 151). — WELMANS, Pharm. Zeit. 1900, 859, Seifenfabrikant 1901, 4; Zeitschr. öffentl. Chem. 1903, 206. — FILSINGER, Chem. Zeit. 1890, 507 u. 716; Zeitschr. anal. Chem. 1880, 247 u. 1896, 519; Zeitschr. öffentl. Chem. 3 (1897) 34. — DIETERICH, Helfenb. Ann. 1889, 1897, 1900, 1902, 1903, 1904. — WHITE, Oil of Theobroma, spez. grav. under cert. condit. Pharm. Journ. 1898, 69. — MAURENBRECHER und TOLLENS, Ber. d. chem. Ges. 39 (1906), 3581. — KLIMONT, Ber. d. chem. Ges. 1901, 2636; Monatsh. f. Chem. 1902, 23. — HEIDUSCHKA und HERB, Pharm. Centralh. 1908, 375. — CLAYTON, Chem. News 86 (1902), 51. — MATTHES und ROHDICH, Cacaofett, bes. die unverseifbar. Bestandt. Ber. d. chem. Ges. 1908, 19 u. 1591 und ROHDICH, Dissert. Jena 1908. — PROCHNOW, Arch. Pharm. 1910, 81. — F. MÜLLER, Pharm. Zeit. 1908, 57. — STRUBE, Zeitschr. öffentl. Chem. 1905. — POSETTO, Giorn. Farm. Chim. 1901, 337. — BJÖRKLUND, Zeitschr. anal. Chem. 1864, 233. — KREMEL, Pharm. Post 1899, 5. — VAN DER WIELEN, Invloed van andere vetten op de eigensch. van Cacaobutter, Pharm. Weekbl. 1902. — MAURENBRECHER und TOLLENS, Ber. d. chem. Ges. 1906, 3581. — LANGBEIN, Zeitschr. ang. Chem. 1908, 241.
Zu den festen vegetabilischen Fetten der Ölsäuregruppe gehören auch:
- Chinesischer oder Stillingiatalg von Stillingia sebifera JUSS.
- Pongamöl aus den Früchten von Pongamia glabra VENT.
- Chaulmugra- oder Gynocardiaöl von Gynocardia Prainii.
- Carapafett, Andirobaöl von Carapa guianensis, moluccensis u. and. Margosaöl, Veepaöl, Veppamfett, Neemöl von Melia azadirachta.
- Kadamsamenfett von Hodgsonia (Trichosanthes) Kadam MIQ.
- Mahwahbutter, Illipeöl von Bassia latifolia.
- Mowrahbutter, Bassiaöl von Bassia longifolia.
- Champacafett von Melia Champaca.
- Schi- oder Sheabutter, Galambutter von Bassia (Butyrospermum) Parkii, dem Ölbaume des nördlichen tropischen Afrika (Haussa, Sudan, Nigergebiet) und hier so wichtig wie die Ölpalme in Westafrika.
- Akeeöl von Blighia sapida.
- Makassaröl von Schleichera trijuga.
- Sawaributter von Caryocaria tomentosa.
- Mafuratalg von Mafureira oleifera.
- Phulwarabutter, Fulwa- oder indische Butter von Bassia butyracea.
- Mkányifett von Stearodendron Stuhlmanni.
- Rambutantalg von Nephelium lappaceum.
- Malabar- oder Pineytalg, Vateriafett, Pflanzentalg von Vateria indica.
- Kokumbutter von Garcinia indica.
- Borneotalg, Tangkawangfett von Shorea stenoptera und aptera, Hopea aspera, Isoptera borneensis.
- Myrtenwachs oder Myricawachs von Myrica cerifera.
IV. Feste animalische Fette.
Das Fettgewebe der Tiere wird meist als ein modifiziertes Bindegewebe angesehen und entsteht dadurch, daß in den Bindegewebszellen Fetttröpfchen auftreten, die, sich allmählich vergrößernd, schließlich Cytoplasma und Zellkern beiseite schieben. Andere betrachten die Fettzellen als Zellen des Schleimgewebes. Die fettbildenden Stoffe werden von der Zelle aufgenommen und in ihr zu Fett verarbeitet, die daneben entstehenden Stoffe durch Lymph- und Blutserum entfernt. Als Fettbildner dürften in erster Linie die Kohlehydrate, dann aber auch die Eiweißsubstanzen in Betracht kommen. Bei der Arbeit im Organismus können Fette und Kohlehydrate einander bis zu gewissem Grade im Verhältnis ihrer Verbrennungswärmen vertreten (ZUNTZ). Auch im intermuskulären Bindegewebe und dem Sarkoplasma treten Fette auf (hier neben Lecithin und Cholesterin), ferner im Knorpelgewebe, in den Knochen, in der Nervensubstanz (hier neben Myelinsubstanzen: Lecithine, Cholesterine, Protagone), in der Blutflüssigkeit (Serum),[S. 725] in der Lymphe und dem Chylus, in der Haut und ihren Anhängen und endlich auch in Körpersekreten, wie z. B. der Milch.
Die Natur der tierischen Fette erkannte bereits CHEVREUL, doch ist bis heute die Untersuchung noch nicht abgeschlossen und jede neue Arbeit bringt neue Überraschungen. Die Ansicht, daß in tierischen Fetten auch gemischte Glyceride (s. S. 547) vorkommen, wurde zuerst von J. BELL in «Analyse und Verfälschung der Nahrungsmittel 1885» für die Butter ausgesprochen, in der BELL das Oleobutyropalmitin annimmt. Dies Glycerid haben dann BLYTH und ROBERTSON (Chem. Soc. London, Jan. 1889) abgeschieden und C3H5(C18H33O2)(C4H7O2)(C16H31O2) formuliert. Genau beschrieben wurde aber zuerst von HEISE (Arb. d. k. Gesundheitsamt. 1896) ein gemischtes Glycerid (das Oleodistearin aus Mkányifett, S. 724), welchen Befund HENRIQUES und KÜNNE bestätigten. Zahlreiche neue gemischte Glyceride isolierte dann HANSEN (Arch. f. Hygiene 1902) aus Hammel- und Rindstalg (s. d.). Im Menschenfett fanden PARTHEIL und FERIÉ (Arch. Pharm. 1903) Stearodiolein. KREIS und HAFNER halten aber die Glyceride HANSENS für Gemische. Sie isolierten 1904 aus Rinds- und Hammelfett: Palmitodistearin, aus Schweinefett ein gemischtes Glycerid der Formel C3H5(C17H33O2)(C18H35O2)(C18H35O2), kontrollierten diese Glyceride durch die Analyse und Untersuchung der abgeschiedenen Fettsäuren und bestätigten den Befund durch die Synthese.
Alle tierischen Fette enthalten Cholesterin (s. S. 748). Phytosterin tritt aus pflanzlichen Futtermitteln (z. B. Baumwollsamenpreßkuchen) nicht in das Fett der Tiere über (C. VIRCHOW), so daß der Nachweis von Phytosterin wohl immer eine Beimischung von pflanzlichem Fett zu tierischem erweist.
Lit. ULZER und KLIMONT, Allgem. u. physiolog. Chem. d. Fette. Berlin 1906. — Über die Bildung des Fettes im Tier, den Übergang von Nahrungsfett in das Fettgewebe und die Organe des Tieres, die Beziehungen der Fettbildung zur Nahrung, das Verhalten der Fette im Darmkanal und den Abbau der Fette im Organismus vgl. F. RÖHMANN, Biochemie 1908, LEHMANN und VOIT, Fettbildung aus Kohlehydraten. Zeitschr. f. Biologie 42 und ROUSSELET, Chimisme intestinal d. graisses alimentaires et leur dosage en Coprologie. Thèse Paris 1909. — Über gemischte Glyceride und den zuerst von HEINTZ (1849) und DUFFY (1852) beobachteten «doppelten Schmelzpunkt» vgl. A. HAFNER, Über natürl. vorkomm. u. synthet. dargest. gemischte Fettsäureglyceride. Diss. Basel 1904 (mit KREIS, siehe bei Adeps), ADOLF GRÜN, Über d. Constit. d. Fette. Habilitationsschrift Zürich 1907 und FERIÉ, Z. Kenntn. d. Fette. Diss. Bern 1903 u. oben S. 547. — Über Kristalle aus tier. Fetten: ZUNE, Traité génér. d’analyse des beurres 1892/93 und bei HAFNER. — Über die flüchtigen Fettsäuren vgl. MOUGNAUD, Dosage d. acid. volat. dans l’analyse des corps gras. Thèse Paris 1902. — Über das Ranzigwerden d. Fette vgl. E. RITSERT, Diss. Bern 1890 (dort eine histor. Übersicht) und WINCKEL, Apoth. Zeit. 1905. — CHEVREUL untersuchte (1823) die Fettsäuren des Menschen-, Schweine-, Jaguar- und Gänsefettes, HEINTZ (Lieb. Ann. 84, 297) das Menschenfett.
1. Körperfette.
Von den Körperfetten werden jetzt in der Medizin nur noch Schweine-, Hammel- und Rindsfett benutzt.
Die alte Medizin, schon die der Assyrer (vgl. S. 551) benutzte sehr viel mehr. In zahlreichen Rezepten des Papyrus EBERS findet sich Fett. DIOSKURIDES erwähnt das Fett der Schweine, Bären, Böcke, Schafe, Hirsche, Rinder, Panther, Löwen, Hühner, Gänse, sowie das Knochenmark; GALEN das Fett der Schweine, Ziegen, Hammel, Kälber, Böcke, Bären, Löwen, Hähne, Hennen und Schlangen. PLINIUS bemerkt (XI, 85): «Gehörnte Tiere, die nur in einer Kinnlade eine vollständige Zahnreihe und an den Füßen Knöchel haben, liefern, wenn sie fett sind, Talg (sevum), die Zweihufer oder die, deren Füße in Zehen gespalten sind und die keine Hörner tragen, Schmalz (adeps).» IBN SINA (I, S. 602) benutzte Gänse-, Hühner-, Tiger- und Löwenfett. Auch noch in den Pharmacopoeen des XVI. bis XVIII. Jahrh. finden sich viele tierische Fette neben Ol. lumbricorum und Viperorum, Adeps Leonis, Canis usw. auch Menschenfett. (Vgl. TSCHIRCH, die Pharmacopoee, ein Spiegel ihrer Zeit 1904). Die Chemie der selteneren Fette bei BENEDIKT-ULZER und LEWKOWITSCH a. a. O.
[S. 726]
Der Hindu darf keine Seife aus Tierfett benutzen, daher spielt die aus dem Fett der Bassiasamen (der sog. Mowrahbutter s. oben S. 724) bereitete Seife in Vorderindien eine große Rolle.
Adeps suillus.
Axungia porci; Schweinefett, Schweineschmalz; graisse de porc, axonge de porc, adipe, saindoux; lard, hogslard; strutto. Unter «Adeps» schlechthin wird jetzt immer Adeps suillus verstanden.
Etym. Fett, von LUTHER aus dem ndd. für Feißt in die Schriftsprache eingeführte Nebenform; nnd. Fett aus asächs. fêtid, ahd. feizzit = feißt. — Schmalz von aldn. smjor, ahd. smëro, mhd. smalz. — Der alte Ausdruck für Fett: «Schmutz» ist in der Schweiz im Dialekt noch jetzt üblich. Im ganzen alamanischen Sprachgebiet: smuz = Schmiere, Fett (von smut = schmieren). — Adeps schon bei PLINIUS. — Bei DIOSKURIDES: στέαρ ὔειον — (daraus ist Stearin gebildet). Bei IBN BAITHAR heißt Fett schahm.
Gewinnung. Schweinefett wird aus dem Zellgewebe, besonders des Netzes und der Nierenhülle des Schweines, Sus Scrofa var. domesticus L., ausgeschmolzen. Das Schmerfett ist oft in dicken Schichten in der Bauchhöhle, in der Nähe der Rippen und Nieren abgelagert. Das im Speck, d. h. in den äußeren Partien unter der Haut an Bauch und Rücken abgelagerte Fett ist reicher an flüssigen Fettsäuren, daher weicher. Der Speck eignet sich daher weniger zur Schmalzfabrikation und wird als solcher verwendet. Man unterscheidet: Eingeweidefett (Gekrösefett), Netzfett (Liesen, Flohmen, Schmer, Filz) und Nierenfett. Pharm. helvet. IV verlangt, daß nur das aus zerriebenem und gewaschenem, frischem, ungesalzenem Zellgewebe des Netzes und der Nierenhülle des gesunden Schweines im Dampfbade gewonnene Fett benutzt wird, schließt also den Speck des Unterhautbindegewebes aus. D. A. V verlangt außerdem, daß das Fett vom Wasser befreit werde und Ph. austr. VIII schreibt vor, daß dies mittelst wasserfreiem Natriumsulfat geschehen und das Fett durch Baumwolle filtriert werden solle. Alle drei Pharmacopoeen denken wohl an eine Darstellung in der Apotheke, verwerfen jedenfalls alles Fett, dessen genaue Provenienz unbekannt ist. Die Schmalzfabrikation wird im größten Stil in Nordamerika betrieben, so daß der größte Teil des Handelsfettes daher stammt, in Deutschland wird es nur vereinzelt im Großbetriebe gewonnen, viel im Kleinen. Größere Mengen liefert Ungarn und Rumänien, kleinere Serbien, Dänemark und Holland. Das Ausschmelzen der zuvor wiederholt gewaschenen und zerkleinerten Körperteile geschieht entweder über direktem Feuer oder im Dampfbade oder mit gespanntem resp. überhitztem Dampf von 110–115°. Die von dem ausgeschmolzenen Fett getrennten «Grieben» werden dann zwischen erwärmten Platten gepreßt und liefern ein zweites Fett, das mit dem ersten nicht vermischt wird. Der Rückstand geht in die Blutlaugensalzfabrikation. Das abgeschiedene Fett wird bei schlechteren Sorten bisweilen mittelst Schwefelsäure «geläutert».
Schon DIOSKURIDES beschreibt (II, 87) die Darstellung des Schweinefettes durch Auskochen der gewaschenen Fettteile mit Wasser über freiem Feuer, Durchseihen, wiederholtes Umschmelzen nach Entfernung des sich am Boden Absetzenden.
In Nordamerika (Missouri, Ohio, Cincinnati) wird Schweinefett aus allen fetten Teilen des Schweines in den großen Packing houses dargestellt. Man unterscheidet von dem im Handel dominierenden amerikanischen Fett:
[S. 727]
1. Neutral Lard I, Netz- und Gekrösefett (Leafs) durch Ausschmelzen frisch geschlachteter Tiere im Wasserbade bei 40–50°, weiß, beste Marke.
2. Neutral Lard II, Rückenfett, wie 1 dargestellt.
3. Neutral Lard Imitation aus Speck von 1 gewonnen, öliger wie dieses.
4. Leaf Lard, durch Ausschmelzen der Rückstände von 1 mit direktem Dampf unter Druck im Autoklaven.
5. Choice Lard (Choice kettle rendered lard) aus den Liesen von 1 und 2 durch Ausschmelzen in offenen, mit Dampfmantel versehenen Kesseln.
6. Prime steam Lard (western steam lard) aus den Rückständen der Neutral-Lardfabrikation und aus nicht sonst verwerteten selten Teilen durch direkte Einwirkung von Dampf von 2½–2¾ Atmosphären oder durch direkten Dampf in offenen Gefäßen ausgeschmolzen. Gelblich oder grau, Röstgeschmack. Wird bisweilen in Amerika und Deutschland raffiniert, z. B. durch Kochen mit Wasser.
7. Pure Lard, mit Fullererde gebleichtes und gekühltes prime steam lard, weiß, fest, speckartig.
Durch Pressen des Fettes in hydraulischen Pressen kann Schweinefett in Schmalzöl (Specköl, lard oil, huile de graisse, Ol. Adipis) und Solarstearin (Lard stearine) geschieden werden (Demargarinierungsprozeß).
Handel. Die Vereinigten Staaten exportierten 1908: 603413770, 1909: 328722933 pounds Lard und 1908: 75183210, 1909: 75183196 pounds Lard Compounds and Substitutes for (Cottolene, Lardine usw.). Die Einfuhren von Schweinefett von Amerika nach Deutschland haben abgenommen. Sie betrugen 1907: 101,3, 1908: 104,6, 1909: 89 Mill. kg (GEHE & CO.).
Chemie. SCHEELE entdeckte 1783 im Schweinefett das Glycerin («Ölsüß») und CHEVREUL zerlegte es in zwei durch ihren Schmelzpunkt unterschiedene Substanzen, die beide verseifbar waren und aus denen er einerseits die acide margarique, die von HEINTZ und BERTHELOT als Palmitin-Stearinsäure erkannt wurde, andererseits die acide oleique abschied.
Das Schweinefett enthält Palmitinsäure, Stearinsäure und Ölsäure, wahrscheinlich in Form gemischter Glyceride, amerikanisches Schweinefett auch Triolein. Daneben findet sich Linolsäure (FAHRION, WALLENSTEIN und FINCK, FARNSTEINER, BÖMER) und vielleicht auch Linolensäure. TWITSCHELL gibt an: 10,06% Linolsäure, 49,39% Ölsäure und 40,55% feste Fettsäuren. PARTHEIL und FERIÉ fanden große Mengen Myristinsäure und Laurinsäure und geben folgende, aber bei den Fetten verschiedener Provenienz (Rasse, Körperstelle, Fütterung, Klima usw.) jedenfalls wechselnde Mengen (im Mittel in %) an: Stearinsäure 8,4, Palmitinsäure 4,48, Myristinsäure 14,35, Laurinsäure 11,68, ungesättigte Säuren 54,05, davon stärker ungesättigt 10,03. KREIS und HAFNER erhielten das gemischte Glycerid Heptadecyldistearin (Daturadistearin?) C3H5(O.C17H33O)(O.C18H35O)2 F = 66,2°.
Zwischen amerikanischen und europäischen Schweinefetten bestehen weitgehende Unterschiede, ebenso zwischen dem Fett des Kopfes, Rückens, Fußes, Schinkens, sowie des Herzens, der Niere, des Flomen und Netzes. So schwankt z. B. das spez. Gew. bei 100° zwischen 0,8588 und 0,8700, der Schmelzpunkt zwischen 26 und 45°, die Jodzahl zwischen 52,6 und 68,8. Kopffett hat eine besonders hohe Jodzahl (bis 85,03). Die Jodzahl (d. h. der Gehalt an Ölsäure und Linolsäure) ist auch von der Fütterungsart abhängig. Kranke und sehr fette, d. h. gemästete Schweine, produzieren ein an flüssigen Fettsäuren reicheres Fett. Das härteste Fett wird im Januar und Februar erhalten. Das Unverseifbare beträgt im Mittel 0,35% (LEWKOWITSCH). Der Wassergehalt ist gering, meist unter 1%. Stickstoffsubstanzen 0,26% (KÖNIG). Frisch ausgeschmolzenes Fett ist fast neutral. Es enthält nur 0,09–1% freie Fettsäuren. Reines Fett erstarrt feinkristallinisch. Die Kristalle, die man aus Äther erhält, sind[S. 728] einzelne oder büschelförmig vereinigte oblonge Platten mit abgeschrägten Enden, die für gewöhnlich keine Krümmungen zeigen (BELFIELD) — Unterschied von Rindstalg (s. d.).
Spez. Gew. bei 15°: 0,931–0,940, bei 98°: 0,860–0,862 (Pharm. helv. IV); Schmelzpunkt: 26–31° (KÖNIG) bis 37,5° (THÖRNER), 36–45° (DIETERICH); 36 bis 40° (Ph. helv. IV); Erstarrungspunkt: 26–32°; Brechungsindex bei 60°: 1,4539; Hehnerzahl: 95,1–96,15; Reichert-Meißlzahl: 0,3–0,6; Verseifungszahl: 193–200 (Pharm. austr. VIII: 194–197); Jodzahl: 46–64 (selten sogar 70 oder gar 85); Pharm. helv.: 56–62, D. A. V: 46–66; Pharm. austr. VIII: 48–60; Brechungsexponent bei 40°: 1,4606, bei 60°: 1,4539 (Pharm. helv. IV bei 40°: 1,4586 bis 1,4606). Die Fettsäuren zeigen den Erstarrungspunkt 34–40°, Schmelzpunkt 35–47°, Jodzahl 64,2 (Jodzahl der flüssigen Fettsäuren: 92–106). Schweinefett löst sich geschmolzen in Petroläther, Chloroform, Äther, Benzol, Amylalkohol.
DIETERICH fand (Methode in Helfenb. Ann. 1897) bei selbstausgelassenem Schweinefett Schmelzp.: 37–47°; S. Z.: 0,240–1,120; J. Z. n. H-W: 46,48–55,49; V. Z. k.: 195,32 bis 198,83; V. Z. h.: 192,54–199,16.
Die Verbrennungswärme von Schweinefett ist bei konst. Vol. 9469 g-cal. Es ist also ein vorzügliches Nahrungsmittel.
Verfälschungen und Prüfung. Über die Verfälschungen und ihren Nachweis ist besonders die Literatur der Nahrungsmittelchemie sowie die Werke von BENEDIKT-ULZER, LEWKOWITSCH und HEFTER zu vergleichen; für Deutschland auch die Ausführungsbestimmungen zu dem Gesetze betreffend die Schlachtvieh- und Fleischbeschau vom 3. Juni 1900. Als Verfälschungen kommen besonders in Betracht: Baumwollsamenöl und Baumwollstearin, Arachisöl, Sesamöl, Cocosfett, Palmkernöl, Rindstalg, Preßtalg, Rindsstearin, seltener Mineralöle und Paraffin. Die Arzneibücher verlangen ein gleichmäßiges, streichbar weiches, nicht ranziges, zu einer klaren, noch in 1 cm dicker Schicht farblosen, Flüssigkeit schmelzendes Fett, das möglichst wenig sauer ist (D. A. V: Säuregrad nicht über 2, Pharm. austr.: soll 0,2-norm. Kali, Pharm. helv.: 1 ccm n/10 weingeistiges Kali nicht neutralisieren), keine Mineralsäuren enthält (Pharm. austr.: Wasser damit geschüttelt färbt Lakmuspapier nicht rot) und auch kein Kochsalz. Auch soll es die Silbernitratprobe aushalten (Ph. austr.).
Eine Mischung von 2 g Fett, 3 g Natronlauge und 2 g Weingeist soll im Wasserbade gekocht auf Zusatz von 50 g Wasser und 10 g Weingeist klar bleiben (Mineralfette).
Die Pharm. helv. IV verlangt ferner: Überschichtet man farblose Salpetersäure (spec. Gew. 1,4) mit einem gleichen Volumen geschmolzenem Schweinefett und dieses mit derselben Menge Resorcin-Benzol, so soll beim Umschütteln keine vorübergehende rot- bis blauviolette Färbung auftreten (Samenöle). Erhitzt man 1 Vol. geschmolzenes Schweinefett mit 2 Vol. Halphens Reagens 10 Minuten lang im Kochsalzbade über 100°, so soll keine Rotfärbung auftreten (Baumwollsamenöl).
Werden je 5 ccm geschmolzenes Schweinefett und Salzsäure (spez. Gew. 1,19) 1 Minute lang geschüttelt, dann 5 ccm Phloroglucin hinzugefügt und weiter geschüttelt, so soll keine intensive Rotfärbung eintreten (gebleichtes und verdorbenes Fett).
Einen Aufschluß über die Reinheit eines Schweinefettes gibt (nach MUTER und KONINGH, ASBOTH, WALLENSTEIN und FINCK u. and.) auch die Jodzahl des flüssigen Anteils («innere Jodzahl»). Sie beträgt bei mitteleuropäischem Schmalz 93–96 (93,5–103,7), bei amerikanischem 103–105 (95,2–104,9) — (bei Baumwollsamenöl 136).
Da Luft und Licht das Fett verändern (wasserhaltiges Fett wird leichter ranzig), ist es in gut verschlossenen Gefäßen, vor Licht geschützt, aufzubewahren. Benzoiniertes Fett (Adeps benzoinatus) unterliegt dem Ranzigwerden weniger. Den Prozeß des Ranzigwerdens hat hier SPÄTH studiert; die Jodzahl nimmt ab, die Säurezahl zu, ebenso die Refraktometeranzeige und der Schmelzpunkt. Adeps ist die wichtigste Salbengrundlage und dient auch bei der Seifen- und Pflasterbereitung.
[S. 729]
Lit. SCHEELE, Briefe u. Aufzeichn. Herausgegeb. von NORDENSKIÖLD 1892. — CHEVREUL, Rech. chim. sur les corps gras d’origine animale. Paris 1823 (vgl. auch S. 552). — Auch BRACONNOT untersuchte das Fett, BÉRARD lieferte eine Elementaranalyse und A. VOGEL (Trommsd. Journ. d. Pharm. 16, 1, 173) studierte sein Verhalten z. B. zu Licht und Luft. — Zahlreiche Tabellen bei LEWKOWITSCH a. a. O., BENEDIKT-ULZER a. a. O. und KÖNIG a. a. O. — DIETERICH, Helfenb. Ann. 1897. — Die Trennung der Fettsäuren bei PARTHEIL und FERIÉ, Arch. Pharm. 1903. 545. — SPÄTH, Zeitschr. anal. Chem. 1896, 471. — KREIS und HAFNER, Über natürlich vorkommende und synthetisch dargestellte gemischte Fettsäureglyceride (mit Mikrophot.). Zeitschr. Unters. Nahr. u. Genußm. 1904, 641. — A. HAFNER (Gemischte Glyc.). Dissert. Basel 1904. — E. POLENSKE, Beitr. z. Unters. von Schweineschmalz. Arbeit. kais. Gesundheitsamt 22 (1905), 557 u. 576.
Über die Körperfette anderer Tiere: Gans, Reiher, Ente, Hund, Katze, Hase, Dachs, Bär usw. vgl. BENEDIKT-ULZER a. a. O., LEWKOWITSCH a. a. O. und HAGER-FISCHER-HARTWICH, Pharm. Praxis.
Sevum ovile.
Sebum oder Sevum ovillum; s. vervecinum, Hammeltalg, Hammelfett, Schöpsentalg; Unschlitt, im Volksmunde: Hirschtalg; — suif de mouton; inselt, mutton tallow, mutton suet; sego di montone. — Bei PLINIUS: sevum.
Talg (nd.), talk (ndl.), tealg (angs.), tallow (engl.), tolgr (anord.). Ein Zusammenhang mit got. tulgus (= fest, also festgewordenes) erscheint KLUGE nicht, mir wohl möglich, da das Festsein gerade das wichtigste und charakteristischste am Talge ist gegenüber anderen Fetten. — Das eigentlich hd. oberd. Wort ist aber Unschlitt (KLUGE). — Ägyptisch heißt Talg: ’d die hieroglyphischen Zeichen I, S. 467).
Hammeltalg wird durch Ausschmelzen des zerkleinerten, gewaschenen Fettgewebes, besonders des Bauchfettes gesunder Schafe, Ovis aries L., gewonnen. Pharm. austr. läßt nur das Bauchfett zu. Pharm. helv. IV verlangt ausdrücklich Ausschmelzen im Dampfbade. Im Handel ist als Hammeltalg der Talg von Schafen, Hammeln und Ziegen, auch viel australischer, Dalmatiner und türkischer Talg. Für die Pharmazie liefern den Hammeltalg einige große pharmazeutische Laboratorien. Schon DIOSKURIDES beschreibt die Darstellung von Sevum (der Böcke, Hirsche und Schafe) durch Erhitzen des gewaschenen Fettes mit Wasser über freiem Feuer.
Chemie. Der Hammeltalg, den bereits CHEVREUL untersuchte, und von dem dieser und BÉRARD bereits Elementaranalysen machten, — er und BRACONNOT gaben 80% fester und 20% flüssiger Glyceride darin an — ist besonders reich an gemischten Glyceriden. HANSEN (Arch. f. Hygiene 42 [1902], 1) isolierte daraus die gemischten Glyceride Oleopalmitostearin C3H5(O.C18H33O)(OC16H31O)(OC18H35O); F = 42°, Oleodipalmitin C3H5(O.C18H33O)(O.C16H31O)2; F = 48°, Dipalmitostearin C3H5(OC16H31O)2(OC18H35O) F = 55° und Distearopalmitin C3H5(O.C18H35O)2(OC16H31O) F = 62,5. HAFNER fand dagegen (Diss. Basel 1904) nur das Palmitodistearin: C3H5(OC16H31O)(OC18H35O)2 F = 63,2, das er durch die Spaltung, Untersuchung der Spaltungsprodukte und die Synthese bestätigte. Er hält die Glyceride HANSENS für Gemische. Den flüchtigen riechenden Stoff des Bockstalg nannte CHEVREUL Hircin.
Hammeltalg ist oft mit Rindstalg gemischt im Handel (mixed tallow). Er ist härter als dieser, hat einen höheren Schmelz- und Erstarrungspunkt und wird leichter ranzig. Seine Viskosität ist um 11,2% größer als die des Rindertalgs (LIDOW).
[S. 730]
Spez. Gew. bei 15°: 0,937–0,961, bei 100°: 0,858–0,860. Schmelzpunkt: 44–55° (49,5–55° MOSER) D. A. V 45–50°, Pharm. helv. 44–50°; Erstarrungspunkt: 32–41°; Verseifungszahl: 192–196,5 (meist 194–195 MOSER), nach Pharm. austr. 193–195; Jodzahl: 32,7–44 (THÖRNER) bis 46,2 (WILSON); bei Dalmatiner bisweilen nur 30,96 (EISENSTEIN), D. A. V und Pharm. helv.: 33–42; Hehnerzahl: 93,91–95,54; Bromthermalprobe: 7,55–8,9 (ARCHBUTT); Brechungsexponent bei 60°: 1,4501; freie Fettsäuren: 0,72–1,8% (ULZER); bei älterem Talg 6,1–9,3 (FISCHER). Aus der Fabrikation (Säuretalg s. unten S. 731) stammt bisweilen ein Gehalt an Schwefelsäure. 2 g für pharmazeutische Zwecke verwendbarer Talg sollen weniger als 1 ccm n/10 Kali neutralisieren (Pharm. helv. IV). Säuregrad nicht über 5 (D. A. V). Die Fettsäuren besitzen einen Schmelzpunkt 45–56,5°, Erstarrungspunkt 39–51,9°, Jodzahl 31–34,8 (die flüssigen: 92,7).
DIETERICH fand (1900): Schmelzp.: 45–52° (meist 47–49); S. Z.: 0,210–6,53; J. Z.: 33,02–42,83, V. Z. h.: 194,34–205,33; V. Z. k.: 194,82–200.
Die Verbrennungswärme von Hammelfett ist bei konst. Vol. 9492 g-cal.
Der Talg verschiedener Teile des Tieres differiert stark; so beträgt (nach HEHNER und MITCHELL):
|
Bei Nieren-
|
Rücken-
|
Kamm-
|
Herz-
|
Lenden-Fett
|
||
|
Jodzahl
|
48,16
|
63,3
|
48,6
|
58,2
|
50,6
|
|
|
Schmelzp. d. Fettsäuren
|
45,6
|
41,4
|
42,2
|
33,8
|
40,8
|
|
|
Stearinsäure
|
26,2–27,9
|
24,8
|
16,4
|
c. 1
|
 |
keine Abscheid.
nach 2 Tagen. |
Weitere Angaben über diese Differenz bei Moser (Ber. Landw. chem. Vers. Anst. Wien 1882 und 1883).
Die Kristalle, die man aus Äther erhält, sind Bündel sehr dünner Nadeln, die pferdeschweifartig gekrümmt sind, etwa wie ein S (BELFIELD) — Unterschied gegenüber Schweinefett (s. d.).
Prüfung. Auf Palmfett läßt Pharm. helv. durch Verrühren mit konz. Chlorzinklösung prüfen: es darf keine Grünfärbung eintreten. — 1 Teil Hammeltalg mit 5 Teilen Weingeist (90%) erwärmt und durchgeschüttelt soll nach dem Abkühlen eine klare, Lackmus nicht rötende Flüssigkeit geben, die durch die gleiche Menge Wasser nicht getrübt wird. D. A. V und Pharm. austr. VIII schreiben ausdrücklich Hammeltalg vor, Pharm. helv. läßt auch Rindstalg (s. d.) zu.
Sevum bovinum.
Sebum taurinum, Rindstalg, Rindsfett, Unschlitt, suif de boeuf ou de veau; suet of beef, beef tallow, ox tallow; sevo, sego di bove. — Bei PLINIUS: sevum.
Der Rohtalg, das wichtigste Rohmaterial, das die Fettindustrie verwertet, wird vorwiegend aus dem Bindegewebe der Niere der Ochsen, Kühe und Kälber, Bos Taurus L. ausgeschmolzen. Den besten Talg liefern die größeren zusammenhängenden Fettmassen (Rohkerntalg), geringeren der Rohausschnitt oder Brocken. Die dritte Sorte ist der Ausschnittalg. Das Ausschmelzen (Talgschmelze) erfolgt entweder im trockenen Schmelzverfahren mittelst direkten Feuers, indirekter Dampfheizung, Heißwasser- oder Heißluftheizung oder im nassen Schmelzverfahren durch Ausschmelzen auf Wasser entweder mittelst direkter Feuerung oder durch Dampfzufuhr. Bei diesem[S. 731] Verfahren wird dem Wasser bisweilen Schwefelsäure oder Natronlauge zugesetzt. Neuerdings wird Talg auch in Autoklaven (Dampftalg) im Vakuum (LIDOFF) und in verbleiten Holzbottichen durch Kochen mit sehr verdünnter Schwefelsäure und Entsäuern (Säuretalg) oder unter Zusatz von sehr verdünnter Natronlauge (s. oben) erzeugt. Der Vakuumtalg und der Natrontalg sind fast geruchlos und rein weiß. Die überseeischen Talge sind gefärbt, gelblich (australischer) dunkelgelb (nord- und südamerikan.) oder noch stärker gefärbt (austral. und nordamerikanische «No-colour» Talge).
Der Handelsunschlitt wird in den zwei Sorten Kerntalg und Ausschnittalg in Fässern oder Scheiben in den Handel gebracht. Er wird außer in Europa (Irland, Holland, Budapest, Graz, Wien, Florenz, Triest, Paris) in Australien, Nord- und Südamerika (New York, Buenos Aires), Rußland (Odessa, Orenburg, Petersburg) fabriziert und exportiert. Durch Pressen wird der Talg in festen Preßtalg und flüssiges Talgöl zerlegt. Rindstalg ist haltbarer als Hammeltalg.
Die Vereinigten Staaten exportierten 1908: 91397507, 1909: 53332767 pounds tallow.
Chemie. Die Zusammensetzung des Rindstalgs wechselt nach der Körperstelle, das Eingeweidefett ist das härteste, das Taschenfett das weichste (Tabelle von MAYER bei BENEDIKT-ULZER). Der Rindstalg, den bereits CHEVREUL untersuchte, ist reich an gemischten Glyceriden. HANSEN (Arch. f. Hyg. 1902) fand darin: Distearopalmitin F = 62,5°, Verseifungszahl 195,65, Dipalmitostearin F = 55°, V. Z. 200,2, Dipalmitoolein F = 48°, V. Z. 202,7, Jodzahl 30,18 und Stearopalmitoolein F. = 42°, V. Z. 195, J. Z. 29,13 (s. oben S. 729). HAFNER fand jedoch (1904) nur ein Palmitodistearin, wie im Hammeltalg (s. oben S. 729). Das Verhältnis von Stearin zu Palmitin ist etwa 1 : 1 (LEWKOWITSCH). Im Talgstearin fand WALLENSTEIN: Olein 21,4, Stearin 65,4, Palmitin 13,2. Auch Linolensäure scheint darin vorzukommen (FARNSTEINER), bisweilen auch oxydierte Fettsäuren (FAHRION); vielleicht auch Myristinsäure. Der Gehalt an freien Fettsäuren schwankt. Frisch ausgeschmolzener Rindstalg hat davon kaum 0,5%, beim Handelstalg erreichen sie 25% und mehr.
Spez. Gew. bei 15°: 0,943–0,952, bei 98°: 0,8626, bei 100°: 0,860. Schmelzpunkt: 42–49° (meist 42–44, nie unter 40), Erstarrungspunkt: 27–38°, Verseifungszahl: 190,6–200, Säurezahl: meist 2–7 (ULZER), Jodzahl: 35,4–45,2, Hehnerzahl: 94,7–96,1, Reichert-Meißlzahl: 0,5, Brechungsquotient bei 40°: 1,4551, bei 60°: 1,4510. Die Fettsäuren zeigen ein spez. Gew. bei 100°: 0,8698, Erstarrungspunkt: 39,3–46,6° (meist 43–45), Schmelzpunkt: 43–47°. Die Verbrennungswärme von Rindsfett ist bei konst. Vol. 9485 g-cal.
DIETERICH fand (1900. Methode: Helfenb. Ann. 1897): Schmelzp. 42,8–48,75°, S. Z.: 0,560–5,889, J. Z. nach H.-W.: 33,54–43,48, V. Z. h.: 195,28–205,01, V. Z. k.: 197,27 bis 201,52. Bei Preßtalg, Schmelzp.: 52,5–54,4°, S. Z.: 0,694–1,600, J. Z.: 17,75–23,64.
Prüfung. Über die Untersuchung des Talgs vgl. BENEDIKT-ULZER und LEWKOWITSCH a. a. O. Die Verfälschungsmittel sind zahlreich: Knochenfett, Baumwollöl, besonders Baumwollstearin, Palmkernfett, Cocosfett, Wollfett, Stearin grease, Harz, Harzöl, Paraffin. Auch der billigere Hammeltalg ist als Verfälschungsmittel beobachtet. Vgl. auch die für das Deutsche Reich erlassene Verordnung betr. die zolltechnische Unterscheidung des Talges der schmalzartigen Fette usw. vom 6. Febr. 1896.
Geschichte. Schon DIOSKURIDES gibt ausführliche Vorschriften zur Darstellung des Fettes der Rinder, Kühe und Stiere (στέαρ βόειον und ταύρειον). Er beschreibt auch das Würzen (ἀρωματιστέον) der Fette, besonders des Kalb-, Stier-, Hirsch-, Gänse-, Hühnerfettes, deren Geruch den Alten offenbar ebenso wie auch uns nicht angenehm war, mit Wein, Schoinos,[S. 732] Casia, Calamus, Narde, Balsamholz und vielem anderen, sowie das σαμψογχίζεται (das Aromatisieren mit Majoran).
In der Pharmazie wird noch bisweilen auch Sevum hircinum (Ziegenbockstalg) und S. cervinum (Hirschtalg) benutzt.
2. Milchfette.
Von den Milchfetten wurden früher einige medizinisch benutzt, wie z. B. die Frauenmilchbutter, jetzt nur noch die Kuhbutter und auch diese nur in beschränktem Maße (zu Augensalben usw.).
DIOSKURIDES und PLINIUS beschreiben die Bereitung von Butter aus der Milch der Schafe, Ziegen und Kühe, HIPPOKRATES aus der der Stuten durch «Schütteln». DIOSKURIDES kennt auch einen Rus aus Butter. Die Frauen-, Kuh- und Ziegenmilch benutzten die alten Ägypter als Arzneimittel.
Butyrum.
Butter, Milchfett; beurre de vache, butter fat, burro di vacca. — Butter mdh. buter, spätahd. u. afries. butera, (ahd. anko), ndl. boter, angls. butere aus βούτυρον (skyth.? kaum von βοῦς, wie PLINIUS will) — so schon bei HIPPOKRATES — über bûtyrum (lat. bei PLINIUS, COLUMELLA); daraus auch burro (ital.) und beurre (franz.); — mateca (span.), manteiga (port.), mantica (rum.), vielleicht aus mantica (= Mantelsack, weil in sackartigen Schläuchen zubereitet?). — Griechen und Römer kannten die Butter nur bei Barbaren (Skythen, Phrygiern, Thrakiern, Lusitaniern, Germanen). Da die germanischen Völker aber den roman. Namen aufnahmen, «müssen demnach romanische Völker den Deutschen in der Butterbereitung oder -benutzung vorbildlich gewesen sein» (SCHRADER). — Anke steht zu anctan (altpr.), unguentum, und añjana (sansc. = Salbe) in Beziehung — bedeutete also ursprünglich «Salbe zum Einreiben» (SCHRADER). — Auch im vedischen Indien war Butter (ghṛtá) aus Milch als Genußmittel bekannt (SCHRADER). Indien exportierte sogar davon, wie aus dem Periplus ersichtlich. GALEN kennt die Butter nur als Arzneimittel. HERODOT beschreibt die Bereitung aus Stutenmilch bei den Skythen (IV, 2). PLINIUS berichtet über die Herstellung der Butter bei den Nordländern (XXVIII, 133).
Gewinnung. Die Butter ist in der Milch der Kuh, des weiblichen Bos Taurus L. in Form sehr kleiner Kügelchen durch die Eiweißkörper emulgiert enthalten und scheidet sich beim Stehen, Zentrifugieren, Schlagen, Schütteln oder Schaukeln («Buttern») daraus ab, indem sich die Fettkügelchen zusammenballen. «Durch das Schlagen wird die physikalische Beschaffenheit der Milch geändert. Die Oberflächenspannung wird geringer, die Milch zähflüssiger. Infolgedessen können die zu Häufchen vereinigten Fettröpfchen dem Schlage schwer ausweichen und vereinigen sich leichter zu größeren Tropfen, die fest werden, sobald sie eine bestimmte Größe erreicht haben. Die fest gewordenen Tropfen rufen infolge ihrer besonderen Anziehungskraft auf die übrigen Milchbestandteile eine Veränderung der Flüssigkeit hervor» (SIEDEL 1902). Die Milch enthält im Mittel zahlreicher Analysen (vgl. bei KÖNIG) in %: Wasser 87,27, Casein 2,88, Albumin 0,51, Fett 3,68 (3–6, meist 3–4), Milchzucker 4,94, Asche 0,72; spez. Gew. im Mittel 1,0313.
Chemie. Die Zusammensetzung der Butter schwankt. Sie enthält (nach KÖNIG) in %: 69,96–90,92 Fett, 0,19–4,78 Casein, 0,05–1,63 Milchzucker, 0,02–15,08 Asche und 4,15 bis 35,12 Wasser. Meist enthält sie 83,41–86,85% Fett, 0,59–1,6% Casein, 11,54–13,75% Wasser und 0,09–2,03% Salze (VIETH); Mittel (nach KÖNIG) in %: 83,7 Fett, 0,76 Casein, 0,5 Milchzucker, 1,59 Salze, 13,45 Wasser. Gesalzene Butter enthält 3% und mehr Kochsalz.
Von Fettsäuren sind nachgewiesen als Hauptbestandteile: Palmitin-, Stearin-, Ölsäure, sowie Myristin- und Laurinsäure; dann Essigsäure, Buttersäure, Capronsäure, Caprylsäure, Caprinsäure und Arachinsäure. Das Vorkommen von Oxyfettsäuren (BONDZYNSKI und RUFI, WACHTEL, BROWNE) bestreitet LEWKOWITSCH, der die Acetylzahlen durch das Vorkommen von Mono- und Diglyceriden erklärt. Die Aldepalmitinsäure [n(C16H30O2)[S. 733] WANKLYN] bedarf der Bestätigung, ebenso die Linolensäure. Die Mengenverhältnisse der einzelnen Bestandteile werden sehr verschieden angegeben. PARTHEIL und FERIÉ geben an in %: Buttersäure 6,13, Capron-, Capryl- und Caprinsäure 2,09, Palmitin-, Stearin-, Myristinsäure 49,46, Ölsäure 36,10, Glycerin 12,54. Nach LEWKOWITSCH bildet Stearinsäure aber nur 0,49% der unlöslichen Fettsäuren. Nach SIEGFELD ist keine oder nur sehr wenig Stearinsäure vorhanden. FARNSTEINER fand 5,4–5,5%, HENRIQUES 5–6% flüchtige Fettsäuren. DUCLAUX gibt für Capronsäure 2–2,6, für Buttersäure 3,38–3,65% an, VIOLETTE in guter Butter 5,33 bis 6,07% Buttersäure, 3,23–3,66% Capronsäure, 2,8–3% feste flüchtige Säuren und 82,28–82,87% nichtflüchtige Säuren. Andere geben an: Butyrin 5–7,7%, Caproin, Caprylin und Caprin c. 3,5 bis 4% (nach BELL, BLYTH und SPALLANZANI: 0,1–2,28), Glyceride fester flüchtiger Säuren c. 3%, Glyceride nicht flüchtiger Fettsäuren c. 86,5–93,5% und zwar Olein c. 37,7–42,2 (nach PARTHEIL und FERIÉ ungesättigte Säuren: 30,67%). Palmitin, Stearin usw. c. 50–53% und zwar (nach PARTHEIL und FERIÉ) 6,65% Stearinsäure, 18,23% Palmitinsäure, 11% Myristinsäure, 16,39% Laurinsäure. SIEGFELD gibt dagegen 22,94–30,7% Myristinsäure an. Diese zum Teil stark differierenden Angaben zeigen, wie unsicher zurzeit noch die feinere Analyse der Fette ist. Vorwiegend scheinen Triglyceride vorzuliegen. Aber sicher sind auch gemischte Glyceride im Butterfett vorhanden. BLYTH und ROBERTSON fanden 1889 in der Butter das erste gemischte Glycerid, das Butyrooleopalmitin: C3H5(O.C4H7O)(O.C18H35O)(O.C16H31O).
Außerdem enthält das Butterfett Cholesterin (möglicherweise auch etwas Phytosterin?) — das Unverseifbare beträgt 0,35–0,51% — und Farbstoffe (Lactochrome). Sommerbutter ist stärker gefärbt. Ob Lecithin, das zu 0,017–0,38% angegeben wird, wirklich normal darin vorkommt, scheint noch zweifelhaft. JÄCKLE fand in fetter älterer Kochbutter 0,0035–0,0135%. Unter dem Mikroskop zeigt normale Butter keine Kristalle. Beim Liegen tritt zunächst der Geruch nach Buttersäureäthern, dann der nach Capron-, Caprin- und Caprylsäureäther und ein Talggeruch hervor.
Die Untersuchung der Butter gehört in das Gebiet der Nahrungsmittelchemie. Butter bzw. Butterfett wird in der Pharmacie gern zu Brandsalben benutzt, seltener zur Sapo butyrinus. Butterfett ist geschmolzene, durch Absetzen vom Molken getrennte und heiß filtrierte Butter.
Lit. BENEDIKT-ULZER a. a. O. (dort d. Literat.). — LEWKOWITSCH a. a. O. (dort d. Literat.). — HAGER-FISCHER-HARTWICH, Pharm. Praxis. — KÖNIG, Chem. Zusammens. d. menschl. Nahrungs- u. Genußm. 4. Aufl. 1903, — BLYTH und ROBERTSON, Proc. Chem. Soc. 1889, 5. — BELL (und LEWIN), Chemistry of foods II, 44. — PARTHEIL u. VON VELSEN, Grundl. d. refraktometr. Butterunters. Arch. Ph. 1900. — SCHAFFER, Über d. chem. Zusammens. d. sog. Butteröls. Landw. Jahrb. d. Schweiz. 1898. — ORLA JENSEN, Stud. über d. Ranzigwerd. d. Butter (Mikroorganismen). Landw. Jahrb. d. Schweiz. 1901. — A. BODE, Bezieh. zwischen d. Fett. d. Milch und d. Kolostrums z. d. Fetten d. Nahrung d. mütterlich. u. kindl. Körpers. Diss. Bern 1909. — KLUGE, Etymol. Wörterbuch. — SCHRADER, Reallex. d. indogerman. Altertumskunde.
V. Wachse.
Die echten Wachse unterscheiden sich von den Fetten dadurch, daß bei ihnen die Fettsäuren nicht mit dem dreiatomigen Alkohol, dem Glycerin, sondern mit ein- oder zweiatomigen höheren Alkoholen (z. B. Cetyl-, Ceryl-, Myricyl-, Coccocerylalkohol, Cholesterin, vgl. S. 548) verestert sind. Sie entwickeln daher beim Erhitzen keinen Acroleingeruch und werden, da die Wachsester schwer verseifbar sind, nicht ranzig. Oft werden diese Wachsester von Kohlenwasserstoffen begleitet. Die Wachse binden reichlich Wasser und werden dadurch salbenartig.
1. Pflanzenwachse.
Viele Pflanzen bilden auf der Oberfläche ihrer Vegetations- (und bisweilen auch Reproduktions-)Organe offenbar als Ausscheidungsprodukt der stets Wachs enthaltenden Cuticula einen Wachsüberzug, der diesen Organen die Eigenschaft verleiht, nicht[S. 734] oder schwer mit Wasser benetzbar zu sein und der wohl auch bisweilen als Schutz gegen zu starke Verdunstung wirkt. Diese Wachsüberzüge sind bei den Pflanzen unserer Klimata nur feinkörnige Überzüge, die als Reif erscheinen, bei einigen tropischen Gewächsen, besonders Palmen, erreichen dieselben aber bedeutende Mächtigkeit und können mechanisch abgelöst werden. Sie bilden hier entweder eine Schicht feiner, radial gestellter Stäbchen oder bis 5 mm dicke Krusten von kristallinischem Gefüge. Schon CHEVREUL fand, daß das Wachs der Kohlblätter sich gleich verhielt wie der nicht verseifbare Anteil des Bienenwachses. Die im Inneren von Zellen oder als Membraninkrustationen vorkommenden «Wachse» stellen eine besondere, noch näher zu studierende Form dar, die uns hier nicht näher interessiert. Das Japanwachs ist wie mehrere andere «Wachs» genannte Pflanzenprodukte ein Fett (s. S. 711), ebenso das Myrica- oder Myrtlewachs, Bay berry tallow von Myrica Cerifera L. Das Godangwachs von Ficus ceriflua bildet den Übergang von Wachs zum Kautschuk (GRESHOFF und SACK).
Lit. DE BARY, Bot. Zeit. 1871, 129 und Anatomie. — WIESNER, Technische Mikroskopie, Sitzungsber. d. Wien. Akad. u. Bot. Zeit. 1871 u. 1876. — TSCHIRCH, Angew. Anatomie Fig. 185 u. 186. — MIKOSCH in Wiesner Rohstoffe, 2. Aufl. — GRESHOFF und SACK, Zur Kenntn. d. Wachse. Rec. trav. chim. d. Pays-Bas 1901, 65. — Über das Vorkommen und die Zusammensetzung von Pflanzenwachsen vgl. die Zusammenstellung in CZAPEK, Biochemie.
Carnaubawachs.
Canauba oder Carnahubawachs, Cearawachs, Cire de Carnauba, Carnauba wax, Cera di carnauba. — Carnauba ist der Name der Palme bei den Eingeborenen von Ceará. Andere brasilianische Namen sind: Carnahyba, Caranda, Carnanahyba, Caranaūve (PECKOLT).
Das Carnaubawachs wird von der Carnaubapalme Copernicia cerifera MART. (Corypha cerifera VIREY, Arrudaria cerifera MACEDO), einer sehr nützlichen, zu den Coryphinae-Sabaleae gehörenden, 10–15 m hohen Palme Südamerikas, gewonnen, die besonders in den Staaten Ceará, Pernambuco, Rio grande do Norte, Piauhi, Parahyba, Maranhao, Matto grosso und Bahia, sowie in Venezuela wächst und von der sowohl das Holz, wie die zu Flechtwerk, besonders Hüten, geeigneten Blätter, deren Fasern (tucum) die Eingeborenen seit Menschengedenken anwenden, die eßbaren Blütenkolben und Früchte, sowie endlich das Stärkemehl des Stammes (farinha de carnauba), der Zucker und Palmwein, sowie die Samen und die an NaCl reiche Asche der Wurzeln benutzt werden (DIAS, PECKOLT). Es gilt von ihr fast das Gleiche wie von der Cocospalme (S. 709). Das Wachs überzieht beide Seiten der bis 1,5 m langen Blätter, besonders aber die Oberseite, in einer bis 5 mm dicken, aus prismatischen, radialgestellten, dicht miteinander verbundenen Stäbchen bestehenden Schicht, die abgelöst die Abdrücke der Epidermis erkennen läßt (WIESNER). Es bildet hier offenbar eine Anpassung an trockenen Standort und das relativ trockene Klima von Ceará. Denn die Palme bleibt frisch, auch wenn alles ringsum vertrocknet ist (MACEDO). Die Gewinnung des Carnaubawachses erfolgt in der Weise, daß die zur Zeit der Trockenperiode (September-März) mit einer an einer Stange befestigten Sichel abgeschnittenen, in langen Reihen mit der Unterseite nach unten auf dem Boden getrockneten Blätter (von jedem Baum werden c. 6–8 abgelöst) nach 4–5 Tagen auf Tüchern ausgebreitet, zuerst abgebürstet und dann mit kleinen Stöcken geklopft werden, bis der[S. 735] Wachsüberzug sich abgelöst hat. Um das Wachs besser abzulösen, werden die Blätter mit einem Messer aufgeschlitzt. Das grauweiße Pulver wird entweder über freiem Feuer geschmolzen oder mit der Hälfte des Gewichtes Wasser in einem eisernen Topfe gekocht. Hierbei steigt das Wachs als teigige Masse an die Oberfläche. Neuerdings (1894) werden auch die Blätter direkt in heißes Wasser gebracht und das sich auf der Oberfläche abscheidende Wachs abgenommen. Es wird dann geschmolzen und in tönerne Formen gegossen und kommt jetzt meist gereinigt, d. h. umgeschmolzen und heiß filtriert in sehr verschiedener Güte in den Handel.
Etwa 2000–5000 Blätter sollen 15 kg Wachs liefern, nach SEMLER aber schon 850, nach LIMA und PECKOLT 500–1200 Blätter 16 kg, was mir wahrscheinlicher erscheint, denn sicher liefert doch ein so großes Blatt, dessen Wachsschicht 5 mm Dicke erreicht, mehr als 3–15 g. Es bildet einen beträchtlichen Handelsartikel Brasiliens, das davon jährlich über 4 Mill. kg produziert. Viel wird im Lande zur Kerzenfabrikation verbraucht. 1900 wurden c. 1000 t, besonders aus der Umgegend von Aracaty, ausgeführt, 1902 betrug die Produktion 1547, 1903: 1920 t. Die Ausfuhr aus Brasilien betrug 1907: 2779000, 1908: 2592000, 1909: 3042000 kg. Hamburg empfing 1897: 350000, 1907: 1760000, 1908: 1260000, 1909: 2069000, 1910: 1800000 kg. Das meiste geht nach Nordamerika. Die Vereinigten Staaten importierten 1908: 3701156, 1909: 4088100 pounds Vegetable Wax (wohl vornehmlich Carnauba). Carnaubawachs ist im Großhandel (in Säcken à 75/80 kg) in zahlreichen Sorten zu finden: hellgelb extrafein, primagelb, mittelgelb, graufett, unberaubt, grau-courant, dann raffiniert weiß Schmelzpunkt 74, 73, 71° und endlich Rückstände A, 00, B (GROSSMANN). Carnaubawachs ist Objekt der Spekulation. In Brasilien hat sich ein Monopol gebildet.
Neuerdings (1909) sind Versuche mit dem Anbau der Palme in den deutschen Schutzgebieten gemacht worden.
Copernicia cerifera MART.
Ausgewachsene und junge Palme. Der obere Teil des Stammes hat die Blattnarben abgeworfen. A ein Stammstück mit diesen Narben. B Fruchtzweig.
[Aus Engler-Prantl, Pflanzenfamilien.]
[S. 736]
Das rohe Carnaubawachs ist schmutzig gelblich-grün, von Luftbläschen durchsetzt, das gereinigte ist gelblich, das gebleichte fast weiß. Es ist oft von einem kristallinischen Anfluge bedeckt. Carnaubawachs ist hart, spröde, fast geschmacklos, frisch etwas nach Cumarin riechend.
Chemie. Das Carnaubawachs, in dem LEWY 80,32% C, 13,07% H und 6,61% O fand, besteht hauptsächlich aus dem Cerotinsäure-Myricylester, C25H51.CO—O.C31H63 (MASKELYNE), daneben finden sich auch die beiden Spaltungsprodukte desselben: Cerotinsäure (BERARD, NAFZGER, C25H50O2 MARIE, C26H52O2 HENRIQUES, — das Vorkommen der Cerotinsäure im Carnaubawachs bedarf der Bestätigung, STÜRCKE nimmt eine isomere Säure an), und Myricylalkohol (C30H62O oder C31H64O (GASCARD) = Melissylalkohol PIEVERLING, STORY und MASKELYNE), die durch kalten Alkohol dem Wachse entzogen werden können. Der Myricylalkohol aus Carnaubawachs (STORY-MASKELYNE, PIEVERLING) ist identisch mit dem aus Bienenwachs (MARIE). Ferner enthält das Wachs (nach STÜRCKE) einen Kohlenwasserstoff (F = 59), einen Alkohol C27H36O (F = 76), Cerylalkohol (C26H54O HENRIQUES, C27H56O GASCARD), einen zweiwertigen Alkohol, C25H52O2 (F = 103,5), Carnaubasäure (C24H48O2, F = 72,5, isomer mit Lignocerinsäure) als Ester und eine γ-Oxysäure (C21H42O2) oder deren Lakton, vielleicht auch einen Alkohol, C23H56CH2OH (?), F = 76. Die früheren Angaben, daß das Wachs Palmitin-, Stearin- und Laurinsäure enthalte, beruhen wohl auf einem Irrtum. Die Asche beträgt 0,14–0,83% (STORY). Sie enthält Fe. Das Wachs läßt sich auch mit alkoholischer Kalilauge sehr schwer verseifen, 55 (STÜRCKE) bzw. 54,87% (ALLEN und THOMSON) sind unverseifbar. Man kann die Verseifung dadurch erleichtern, daß man zur Erhöhung des Siedepunktes höher siedende Kohlenwasserstoffe (z. B. Xylol) zusetzt (REGNAR BERG).
Spez. Gew. bei 100°: 0,797–0,798 (EVERS), Schmelzpunkt: 83–86, meist c. 84° (bei gebleichtem 61), Säurezahl: 4–8 (bei gebleicht. 0,56), Verseifungszahl: 79–95, meist c. 88 (bei gebleicht. 33–34), Jodzahl: 13,17, kritische Lösungstemperatur: 154–154,5°, Butterrefraktometeranzeige bei 40°: 66. DIETERICH fand bei Carnaubawachs naturale: S. Z. d. 2,8–4,2, E. Z. 73,9–77, V. Z. h. 76,72–81,2. Bei sog. Carnaubawachsrückständen: Schmelzp. 73–79°, S. Z. d. 6,4–18,3, E. Z. 7,3–10,2, V. Z. h. 15,6–26,3.
Carnaubawachs ist das wichtigste Ersatzmittel des Bienenwachses, aber diesem nicht gleichwertig. Es wird ihm aber oft beigemischt. Es dient jetzt unter anderem viel bei Herstellung der Phonographenwalzen.
Als Ersatz des Bienenwachses wurde es zuerst von WILLIAM THOMAS BRAND in den Abhandl. der Royal Society 1811 empfohlen, als Graf GALVÊAS an Lord GRANDVILLE eine Probe gesandt hatte. BRAND beschreibt schon eingehend seine Eigenschaften. Handelsartikel ist Carnaubawachs etwa seit 1846, nach dem ungewöhnlich trockenen Jahre 1845. (Noch 1836 konnte MACEDO kaum ½ kg zusammenbringen.) Die Ausfuhr aus Ceará stieg dann von 26208 kg im Jahre 1846 auf 68096 kg im Jahre 1860. 1862 kamen aus ganz Brasilien, besonders aus Ceará und Aracati schon c. 720000 kg, von da an steigt die Ausfuhr beständig.
Lit. Die erste Beschreibung der Palme gab der brasilianische Botaniker ARRUDA (1810). — M. A. DE MACEDO, Notice sur le Palmier Carnauba. Paris 1867. (Dort ausführlichere Angaben über die Palme.) — THIEBAUT DE BERNEAUD, Mém. sur le Cirier ou Arbre à Cire etc. Paris 1810. — TH. PECKOLT, Nutzpfl. Brasiliens. Pharmac. Rundsch. 1888, 263. — H. THEEN, Wachs, Prometheus 1894. — DRUDE in ENGLER-PRANTL, Pflanzenfamilien (dort auch eine Abbild.). — Verwert. d. Carnaubap. in Brasilien. Tropenpflanzer 1901, 173, 1902, 256. — ZIMMERMANN, Die Wachspalme in Pflanzer 1907, 191 (dort Übersicht über d. Benutzung der Wachspalme). — SEEMANN, D. Palmen. — MIKOSCH in WIESNER, Rohstoffe, 2. Aufl. — SEMLER, Trop. Agrikult. — BRANDE, Gilb. Ann. 44 (1813), 287. — LEWY, Ann. chim. phys. 13, 449 (Elementaranalyse), —[S. 737] BERARD, Bull. soc. chim. 1868, 41. — VIREY, Journ. pharm. 1834, 112. — GERHARDT, Traité de chim. org. 1854. — GIRARDIN, Lec. élém. d. chim. appl. 1861. — STORY und MASKELYNE, Journ. chem. soc. 7, 87. — MASKELYNE, Ber. d. chem. Ges. 1869,. 44. — BENEDIKT-ULZER a. a. O. — STÜRCKE, Lieb. Ann. 223 (1884), 283. — PIEVERLING, Ebenda 183 (1876), 344. — Chem. Rev. über d. Fett- u. Harzind. 1905, 56. — K. HAEGELE, Beitr. z. Kenntn. d. im Carnaubaw. enth. Myricylalkohols. Diss. Bern 1890. — HENRIQUES, Ber. d. chem. Ges. 30 (1897) 1415. — — GASCARD, Journ. pharm. chim. 1893, 49. — LIONEL GUY RADCLIFFE, Journ. Soc. Chem. Ind. 1906, 158. — REGNAR BERG, Chem. Zeit. 1909, 886. — VALENTA, Einfluß d. Carnaubawachses auf Schmelzp., Glanz und Härte von Fettkörpern, Wachs, Paraffin, Ceresin usw. Zeitschr. Landw. Gew. 1883. — DIETERICH, Helfenb. Ann.

Gruppe von Wachspalmen (Ceroxylon andicola) mit Wachssammlern in den Anden.
[Aus dem Prometheus 1903.]
Zu den Pflanzenwachsen gehören ferner:
Das Palmenwachs von Ceroxylon andicola H. B. (Fig. 224) und Klopstockia cerifera (vgl. E. KR., Die Wachspalme der Anden [Ceroxylon andicola], Prometheus 1903, 324, mit Abbild.);
[S. 738]
Raphiawachs von Raphia Ruffia MART.;
Pisangwachs von Musaarten, Pisang Karet — enthält Pisangcerylsäure (C24H48O2 F = 71) und Pisangcerylalkohol (C18H28O F = 78 GRESHOFF und SACK);
Flachswachs von Linum usitatissimum L.;
Gondang- (javanisches Pflanzen-)Wachs, Sumatraw. (Getah lahu) von Ficus ceriflua JUNGH., enthält Ficocerylsäure (C13H26O2 F = 57) und Ficocerylalkohol (C17H28O F = 198 GRESHOFF und SACK);
Curcaswachs von Jatropha Curcas, die aber eine besondere Gruppe bilden.
Dem Carnaubawachs ähnlich scheint das Ocotillawachs von Fouquiera splendens zu sein (SCHÄR, Arch. Ph. 1898), sowie das Zuckerrohrwachs (WYNBERG, Dissert. Amsterdam 1909).
Von auf Blättern vorkommenden Wachsen sind (ich folge CZAPEKS Biochemie) analysiert: Das Wachs der Gramineenblätter (Myricylalkohol, Melissinsäure, Kohlenwasserstoff, Ceroten, KÖNIG und KIESOW), der Musablätter (Myricyl-Fettsäureester, GRESHOFF und SACK), der Eucalyptusblätter (Cerylalkohol, HARTNER), der Buxusblätter (Palmitinsäure-Myricylester, BARBAGLIA), der Vaccinium Vitis Idaea-Blätter (Cerotinsäure-, Melissinsäure-, Palmitinsäure- und Myristinsäureester des Myristyl- und Cerylalkohols, OELZE), der Tabakblätter (Myristyl-Melissinsäureester), der Drimys granatensis-Blätter (Wachsalkohol Drimol HESSE).
2. Animalische Wachse.
Von den tierischen Wachsen kennen wir sowohl solche von Säugetieren, als auch Insektenwachse und von ersteren können wir wieder die Gruppe des Walrat und die des Wollfettes unterscheiden.
a) Säugetierwachse.
α) Walratgruppe.
Cetaceum.
Sperma ceti, Album ceti, Ambra alba, Flos maris, Halosanthos, Spuma maris, Walrat, Wallrath, Walrot, weißer Amber, Spermacet — Blanc de balaine, Cétine, Ambre blanc, — Spermaceti, Cetin — Spermaceto. — In der älteren englischen Literatur (SIBBALD): wale shot, scale amber.
Etym. Sperma ceti (in Lappland hvalauki) — weil für den Samen des Wal gehalten (s. Geschichte), ist eine zu Anfang des XVI. Jahrh., vermutlich auch noch früher, übliche Bezeichnung für Walrat (FLÜCKIGER). — FLÜCKIGER schreibt Walrath und Walrat, ältere Autoren meist Wallrath. Ich schreibe der Walrat (nicht das W.), denn rat ist = Vorrath (z. B. an Nahrungsmitteln), also Walrat = der Vorrath des Wals. Man dachte wohl, daß das Öl als Reservestoff diene, was aber nicht der Fall zu sein scheint, aber immerhin als «Nebenfunktion» möglich ist. Vielleicht ist aber das Wort Walrat aus dem älteren Walrâm umgebildet und umgedeutet. — Cetaceum, aus Cete = Wal gebildet, so z. B. in der Pharm. borussica 1779 (SCHELENZ). — Physeter («aussi bien que physalus», sagt CUVIER), bedeutet souffleur = Bläser, wegen des Wasserausblasens, das diese Tiere auszeichnet. — Cachalot ist ein baskischer Name (cachau = Zahn). — Der «Physeter des gallischen Oceans» bei PLINIUS (IX, 3) war vielleicht Physeter macrocephalus (kaum die Orca, die als Feinde der Wale beschrieben werden). Die φαλαῖνα des ARISTOTELES und AELIUS war wohl eine große, mit Zähnen versehene Cetacee (CUVIER). PLINIUS kannte von den wahren Balaenaarten nur den zahnlosen Mysticetus des Mittelmeeres, während JUVENAL in dem Verse «Quanto delphinis balaena britannica major» wohl Balaena Mysticetus meint.
Stammtier und systemat. Stellung. Catodon macrocephalus LACEPÈDE (Physeter macrocephalus SHAW., Ph. trumpo, Balaena macrocephala). Gemeiner Cachalot, Cachelot, Pottfisch, Pottwal, Zahnwal, Spermwhale, in Grönland: kegutilik, in Irland: tweldhval.
[S. 739]
Mammalia, Cetodontes, Physeterides.
Pharm. helv. läßt auch das Cetaceum anderer Pottwale, Pharm. austr. das anderer Catodon- und Physeterarten zu. Es sind neuerdings Bedenken aufgetaucht, ob der Walrat des heutigen Handels überhaupt von Catodon macrocephalus und nicht vielmehr von anderen Cetaceen gesammelt wird. Besonders der Entenwal Heperoodon rostratus wird genannt. Es ist dies möglich, da alle Glieder der Abteilung Fetthöhlen im Schädel besitzen (vgl. Fig. 228). FLÜCKIGER nennt auch Physeter Tursio, Ph. microps (und Delphinus edentulus?). Die Systematik der Abteilung läßt aus begreiflichen Gründen zu wünschen übrig (s. weiter unten). Sie bietet unüberwindliche Schwierigkeiten (PÖPPIG).
Beschreibung des Tieres. Der nur von tierischer Nahrung (bes. Cephalopoden) lebende Pottwal oder Cachalot ist ein riesiges, fast schwarzes, glattes, glänzendes, unterseits weißliches, plumpes, das Meer bewohnendes Tier, das eine Länge von 25 m und darüber bei einem Körperumfang von 9–12 m erreicht, «das ungeschlachteste und abenteuerlichste Mitglied der ganzen Ordnung» (Taf. XXIV). Der große viereckige Kopf, der fast ⅓ der Körperlänge einnimmt, ist vorn an der Stirn fast senkrecht absteigend, und trägt dort etwas linksseitig ein Spritzloch (Fig. 225). Echte Zähne finden sich nur im Unterkiefer, die des beträchtlich größeren Oberkiefers verkümmern (Fig. 226). Augen und Ohröffnung sind klein. Der Kopf ist vom Körper durch eine Querfurche geschieden, hinter welcher die Brustfinnen liegen. Von dort bis zum After ist der Körper fast walzenförmig, im letzten Drittel erhebt sich eine unbewegliche Fettflosse. Die sehr fettreiche Schwanzfinne ist eingeschnitten-zweilappig. Das weibliche Tier trägt zwei Zitzen, das männliche einen riesigen Penis. An Größe steht der Pottwal nur einigen der größten Bartenwale nach, gehört also zu den größten Tieren der Erde. Das Weibchen bleibt aber in der Größe beträchtlich hinter dem Männchen zurück und erreicht oft nur die halbe Länge.

Weiblicher Pottwal.
[Aus Martiny, Zool. med.]
Der Cachalot, der sich nur von Cephalopoden nährt, scheint vom Äquator bis zu den Polen vorzukommen, im Atlantischen Ozean jetzt aber selten zu sein. Ob die in der Südsee und im Stillen Ozean vorkommenden Arten spezifisch verschieden sind von denen der nördlichen Meere erscheint zweifelhaft. GRAY unterscheidet zwei Arten von Pottwalen, deren jeder er den Rang einer Unterfamilie zuspricht. Es fragt sich aber sehr, ob die hervorgehobenen Unterschiede nicht zufällige sind. Erfahrene Walfischfänger nehmen nur eine einzige Art Pottwale an, behaupten aber, daß Aufenthaltsort, Nahrung usw. auf Größe, Farbe usw. der Pottwale Einfluß haben. Auch BEAUREGARD nimmt nur eine Art an. Als eigentliche Heimat bezeichnet PECHUEL-LÖSCHE die zwischen 40° nördlicher und 40° südlicher Breite liegenden Meere, doch[S. 740] gelangt der Pottwal, warmen Strömungen folgend, bis 50, ja 60° n. und s. B. Er kommt auch an die europäischen Küsten. Die eigentliche Heimat dürfte die südliche Erdhälfte sein. Er durchzieht die Meere in oft enggeschlossenen «Schulen» oder Scharen von verschiedener Stärke (20–30), die tiefsten Stellen und die Nähe von Steilküsten bevorzugend, oft von einem männlichen «Schulmeister» geführt, in Reihen hintereinander. Nur die riesigen Männchen (Bullen) trifft man auch einzeln, oft das Wasser wie ein Dampfer durchpflügend oder senkrecht gestellt. Er kann fast eine Stunde unter Wasser verweilen, ohne an die Oberfläche zum Atemholen zu kommen. Er bläst so eigenartig, daß der Walfischfänger allein an diesem Geräusch schon den echten Pottwal erkennt.
Skelett eines männlichen Pottwal im Muséum d’histoire naturelle in Paris.
[Nach Beauregard, Mat. med. zool.]

[Aus Brehms Thierleben.]
Jetzt ist nächst dem Stillen Ozean (San Francisco) die Südsee hauptsächlichster Jagdgrund. Der Fang ist gefährlich, wie zahlreiche in BREHMS Tierleben erzählte Schiffergeschichten lehren. Der Fang erfolgt mit Harpunen und Lanzen wie beim Walfischfang und wird außer im Stillen Ozean und der Südsee auch bei den Azoren und im indischen Ozean (Mozambique, Sansibar, Ceylon), sowie in den nördlichen Meeren (z. B. bei Schottland), hauptsächlich von Nordamerikanern und Engländern betrieben. Die erlegten Cachalote werden an das Schiff bugsiert, der Kopf abgelöst und an Bord der Walratbehälter geöffnet. Aus dem Speck wird Tran gesotten. Der Wal trägt nämlich in seinem Schädel Ölbehälter von riesigen Dimensionen, die offenbar den Zweck haben, den großen mit starken Knochen versehenen Körper im Wasser schwebend zu erhalten und ihn gegen den langen Körper zu equilibrieren. Diese Walratbehälter liegen in einer muldenförmigen Aushöhlung der Schnauze (Fig. 226) und der oberen Fläche des Schädels vor dem eigentlichen Cranium, welches das Gehirn enthält, und völlig von diesem getrennt (Fig. 227). Es sind deren zwei, denn die Höhle ist durch eine wagerechte durchlöcherte Wand in zwei Kammern geteilt, die jedoch zusammenhängen. Unter der dicken Specklage des Kopfes sich ausbreitende Sehnenlagen («white horse») dienen ihnen als Decke. Die Fettbildung scheint hier wie bei den übrigen Säugetieren im Bindehautzellgewebe normal zu erfolgen, aber ins Riesige gesteigert zu sein. Der reinste Walrat ist in den kleinsten und am wenigsten ligamentösen Zellen enthalten (HUNTER). Entfernt man die äußere Kopfhaut und die darunter liegende Specklage, so stößt man auf zwei Höhlen. Auf der rechten Seite der Nase und der Oberfläche des Kopfes liegt eine dreieckige Höhle, bei den Cachelotfängern Case (= Behälter), auch erste Kammer oder Klappmütze genannt. Unter der Case im vorderen Teil der Schnauze, über dem Oberkiefer, findet sich eine zweite Höhle, bei den Cachelotfängern Junk (Junke) genannt. Beide Höhlen sind 4–6′ hoch und enthalten 3000 bis 5000 (bei großen Exemplaren nach SCORESBY bis 10000) Pfund Öl. Außer diesen beiden großen Walrathöhlen findet sich noch ein subkutaner Rückenkanal, eine ölführende Röhre, die mit der unteren Kammer in Verbindung steht, vom am Rückgrat fort vom Kopfe bis zum Schwanze verläuft, vorn schenkel-, hinten fingerdick ist. Nach KÖHNE sollen noch außerdem viele hundert kleine Seitengänge zum Speck und Fleisch des ganzen Leibes führen und auch im Fleische zerstreut dünnhäutige, mit Walrat gefüllte Höhlungen sich finden. (BEAUREGARD bestreitet [1901], daß die Walrathöhle mit anderen in Verbindung steht.) Doch stammt der Walrat vorwiegend aus den Kopfhöhlen, nach BEAUREGARD sogar nur aus der einen Höhle (A Fig. 227) «dans la région supérieure de la face, immédiatement au-dessus de la narine droite, depuis la muraille osseuse verticale formée par l’extrémité postérieure des maxillaires et le frontal, jusqu’à l’extrémité antérieure du museau». Jedenfalls wird der Kopfwalrat (head matter) gesondert gesammelt und zunächst nicht mit dem anderen gemischt. Die Ausbeute an Rohöl vom Pottwal schwankt zwischen 1150 und 33350 lbs und beträgt im Durchschnitt 5750–6900 lbs beim Weibchen und bis 17250, ja 20700 lbs beim Männchen (LEWKOWITSCH); nach BEAUREGARD beim Weibchen 15, beim Männchen 45–130 barils (1 Bar. = 114½ l).
Transversalschnitt durch den Kopf des Pottwal. A Raum, in dem sich das Cetaceum findet (organe du blanc). B faserige Wand der Kammer (caisse). C Fetthülle, in welche das rechte Nasenloch (D) getaucht ist. G linkes Nasenloch. H Scheidewandknorpel. L Speck. M linkes Nasenmuskelbündel. N rechte und linke Nasenmuskeln. O Fettpolster, die Höhlung des Maxillar- (R) und Intermaxillarknochens (P) teilend.
[Aus Beauregard, Mat. méd. zool.]
Gewinnung. Auf der rechten Seite der Nase und der oberen Kopffläche befindet sich eine dreiseitige Höhle, die von den Walfischfängern die «Kappe» oder «white horse» genannt wird. In diese wird eine Öffnung gemacht und das Öl in Eimern herausgeschöpft. Die dichte Masse von Zellgewebe zwischen jener Stelle und[S. 742] den Nasenlöchern enthält ebenfalls Öl. Das aus den Walrathöhlen frisch geschöpfte Öl ist (infolge der Körperwärme des Tieres) flüssig, scheidet sich aber in kalter Luft bald in zwei Teile, in den auskristallisierenden Walrat und das flüssig bleibende Walratöl (Spermacetöl). Die erstarrte, von Walratöl durchsetzte Masse wird in Leinwandfilter gebracht (boegged sperm) und in Haarsäcken in der hydraulischen Presse ausgepreßt (pressed sperm), die feste Masse zur Abscheidung der Unreinlichkeiten und tierischen Fasern mit Wasser gekocht, umgeschmolzen und zur Entfernung des Öls mit schwacher Potasche oder Kalilauge behandelt, gewaschen, durch Dampf geschmolzen und in Formen gegossen, neuerdings auch vielfach dann noch aus Alkohol umkristallisiert. Auf den Schiffen wird zunächst das «Kopföl» von dem weniger wertvollen «Körperöl» gesondert gehalten, doch mischt man in den Ölraffinnerien oft vor der Abscheidung des Walrat beide im Verhältnis ⅓ : ⅔ (LEWKOWITSCH).
Schädel des Grindwals (Globiocephalus melas) von der linken Seite, mit der großen der Schnauze aufliegenden Fettmasse. f weiche Fettmasse. b feste bindegewebige Schicht unterhalb der durch eine dicke, schwarze Linie angedeuteten Oberhaut. n Nasenloch. l Luftsäckchen vom Nasengang ausgehend.
[Nach Murie, Aus Boas Lehrbuch d. Zoologie]
In den Ölraffinerien wird das Rohöl in Kühlkammern 10–14 Tage bei 0° stehen gelassen und die erstarrte Masse dann in hydraulischen Pressen in der Kälte gepreßt. Das abfließende (winter sperm oil) beträgt c. 75% und erstarrt unter 38° F («Cold test 38») = 3,3° C. Der braune Preßrückstand wird dann bei 10–15° zum zweitenmal gepreßt, wobei c. 9% spring sperm oil abfließen. Die Preßkuchen schwitzen bei 26,7° nach einigen Tagen Öl aus. Die Ränder werden daher mit rotierenden Messern abgeschnitten und die Mitte bei gewöhnlicher Temperatur einem sehr hohen Preßdruck ausgesetzt. Das abfließende (taut pressed oil) beträgt 5%. Der Preßrückstand (11% des Rohöls) ist roher brauner Walrat vom Schmelzp. 43,3–46,1, der wie oben gereinigt wird. Auch das Walratöl ist ein wertvolles Produkt. Der Handel unterscheidet vom Walrat: französische Form, kubische Stücke à 15–20 kg, englische Form konisch, amerikanische Form, runde Brote.
Daß Cetaceum auch im Meere schwimmend gefunden wurde berichtet WORMIUS, BARTHOLINI, POUCHET u. and. Es scheint dies wahrscheinlich, da es beim Absterben der Tiere erstarrt und der Fäulnis widersteht. Das Altertum kannte nur dieses.
Im Darm (Rectum) des Pottwal (POUCHET et BEAUREGARD) bildet sich das Ambra genannte Sekret, das neben einem Riechstoff einen cholesterinartigen Körper (Adipocire BOUILLON-LAGRANGE, Ambrain JOHN) zu enthalten scheint. In einer dunklen orangefarbigen öligen Flüssigkeit schwimmen oft ½ kg, bisweilen sogar bis 6, ja 10 kg schwere Klumpen, die man wohl den Harn-, Gallen- oder Darmsteinen anderer Tiere vergleichen kann, die aber hier mit einem an Benzoë und Moschus erinnernden, sehr dauerhaften Riechstoff durchtränkt sind. (Über den Amber existiert eine große Menge von Fabeln.) Ob der Riechstoff der Ambra zu der vom Tier verspeisten Eledone moschata, deren Reste man bisweilen darin neben denen von Weichtieren, Sepien usw. findet, Beziehungen hat, ist noch nicht klar, aber wahrscheinlich. POUCHET fand, daß das Tier selbst nach Ambra riecht. Aber dies kann eben auch eine Folge der Eledonenahrung sein. Bisweilen tritt Ambra als Auswürfling des Meeres an den Küsten Afrikas, Südamerikas, Ost- und Westindiens auf oder wird schwimmend angetroffen. «Daß man wirklich Stücke von 90 kg, 1,5 m Länge und 0,5 m Dicke aufgefischt hat, unterliegt keinem Zweifel» (PECHUEL LÖSCHE 1891). Heute[S. 743] kommt Ambra besonders aus Amerika, Japan, Madagaskar, Surinam und Java. Boston ist Hauptplatz dafür. Sie bildet brüchige, graubraune, undurchsichtige Stücke mit schwarzen (Melanin) und gelben Adern, die in der Hand erweichen, in heißem Alkohol und Äther und in der Wärme auch in wässerigen Alkalien sich lösen und bei der Destillation 13% Öl geben. Sie sollen angeblich Benzoësäure und Bernsteinsäure enthalten. Flüssige Ambra ist Styrax. Gefälschte besteht oft aus Benzoë, Olibanum, Mehl und Moschus.
Lit. G. CUVIER, Règne animal. Mammifères pl. 100. — RAPP, D. Cetaceen zoolog.-anatom. dargest. Stuttgart 1837. — MARTINY, Naturgesch. d. f. d. Heilk. wichtig. Tiere. Gießen 1854 (dort auch die älteren Angaben über Ambra). — BEALE, Nat. hist. of the Sperm Whale 1839. — BENNET, Narr. of the Whaling Voyage 1833 to 1836. London 1840. — HUNTER, Phil. Transact. 77 (1787), 390. — BEAUREGARD, Mat. med. zoolog. Paris 1901. — POUCHET et BEAUREGARD, Rech. s. l. Cachalot. Nouv. Arch. d. Museum (3) 1 und Note sur l’ambre gris C. r. Soc. Biol. 1892. — POUCHET et CHAVES, Form. exter. du Cachal. Journ. d’Anat. phys. 1890. — POUCHET, Le Cachalot Rev. d. Deux Mondes 1888 und Contrib. à l’hist. du spermaceti. Bergens Mus. Aarbog 1895. — BREHMS Tierleben. — BOAS, Lehrb. d. Zoologie.
Abbild.: MARTINY, Mediz. Zool. t. 7. — SCHREBER, Naturgesch. d. Säuget. t. 337. — BRANDT und RATZEBURG, Mediz. Zoolog. t. 12. — LACEPÈDE, Hist. nat. des Cétacées t. 10. — BEAUREGARD a. a. O.
Handel. Spermaceti ist in Kisten à 25 kg, raff. prima in Blöcken, aber auch raff. in Tafeln à ½ und 1 kg, jede Tafel in Papier gewickelt, im Handel (GROSSMANN). Der meiste Walrat stammt aus Amerika (Kalifornien). 1909 war japanischer (WEIGEL), 1911 schottischer Walrat im Handel. Er war billiger, aber schlechter als amerikanischer. Die Vereinigten Staaten exportierten 1907: 173985, 1908: 115136, 1909: 57605 pounds Spermaceti and Spermaceti Wax. Deutschland führte 1909: 212 dz Walrat ein, vorwiegend aus den Ver. Staaten. Genaue Angaben aus neuerer Zeit über den Umfang der «Produktion» fehlen. Von 1820–1830 betrug der Ertrag jährlich c. 4600 t, 1831: 7605 t. Jetzt ist der Ertrag zurückgegangen. Ein guter Pottwal ist 9000–20000 M wert.
Chemie. Walrat besteht aus schneeweißen, bröckeligen, deutlich blätterig-kristallinischen, perlmutterglänzenden Stücken, die sich fettig anfühlen und sich fast wie Wachs kauen. Der Geruch ist schwach, eigenartig und erinnert etwas an Wachs. Er wird nicht leicht ranzig. Ranziger riecht tranig. Er brennt wie Wachs. In Wasser und kaltem Alkohol ist Walrat unlöslich, wenig löslich in Benzin, leicht in Äther, Chloroform und Schwefelkohlenstoff. Heißer Alkohol löst ihn vollständig. Beim Erkalten scheiden sich die Ester kristallinisch wieder ab, das Filtrat soll nicht sauer oder alkalisch reagieren und mit Wasser keinen flockigen Niederschlag geben (Prüfung auf Stearinsäure und Alkalien). Wässrige Lauge verseift kaum, alkoholische leicht.
Spez. Gewicht bei 15°: 0,930–0,960 [0,905 (?) KEBLER], D. A. V: 0,940 bis 0,945, bei 98°: 0,808; Schmelzpunkt: 42–49 (44,5–47,4 EVANS), bisweilen bis 50, ja 68°, Pharm. helv. IV: 41–50°, D. A. V: 45–54°, Pharm. austr. 45 bis 50°; Erstarrungspunkt: 49–43,4; kritische Mischtemperatur nach CRISMER: 120,5°; Säurezahl: 1–2 (0–5); Verseifungszahl: 108–135, meist 128,7–134 (122–124 EVANS); Jodzahl: 3,8–9,3; Gehalt an Unverseifbarem: 48,87. FENDLER fand spez. Gew. 0,942, Schmelzp. 42° (siebenmaliges Umkristallisieren aus Alkohol erhöht den Schmelzpunkt auf 48,5, nach anderen auf 50–55°), V.-Z. 134, J.-Z. 93, Gehalt an unverseifbarer Substanz (Alkohole) 51,07, Schmelzpunkt der Alkohole 45°. Jodzahl, Schmelzpunkt, spez. Gewicht usw. sind natürlich davon abhängig, ob das Walratöl ganz oder nur zum größten Teile aus dem Walrat entfernt ist. Je reiner das Produkt, um so höher ist der Schmelzpunkt und um so niedriger die Jodzahl. Die Verbrennungswärme des Walrat ist größer als die aller anderen Fette; bei konstantem Volumen 9946 g-cal.
BUNSEN fand den Schmelzpunkt, = 47,7° bei gewöhnl. Druck, = 48,3° bei 29 Atm., = 50,9 bei 156 Atm.
[S. 744]
Die spez. Wärme ist zwischen +3° und −21° = 0,385 (PERSON).
Das durch Alkohol vom Öl vollständig befreite Cetaceum analysierte CHEVREUL. Er nannte es Cetin (F = 49°), stellte es dem Cerin, Myricin, Elain, Stearin und Cholesterin gegenüber und fand in ihm 81,66% C, 12,86% H und 5,4% O. Den durch Verseifen erhaltenen Alkohol (Cetylalkohol) nannte er Äthal. DUMAS und PELIGOT geben Margarinsäure, Elainsäure und Ceten als Ester darin an. Auch BÉRARD analysierte den Walrat. HEINTZ nahm die Alkohole Stethal (C18H38O), Äthal (C16H34O), Methal (C14H30O) und Lethal (C12H26O) (die bei der Oxydation Stearinsäure, Palmitinsäure, Myristinsäure und Laurinsäure lieferten) und einen indifferenten Körper, C12H24O, darin an. Er betrachtete zuletzt den Walrat als aus Verbindungen des Cetyl- und Stethyloxyds mit Stearinsäure, Palmitinsäure, Myristinsäure und Cocinsäure bestehend. Cetinsäure und Cocinsäure sind zu streichen.
Der Hauptbestandteil des Walrates ist Palmitinsäure-Cetylester: C15H31CO–O.C16H33 (früher: cetinsaures Cetyloxyd, äthalsaures Äthal HEINTZ), der daraus durch Umkristallisieren aus Alkohol gewonnen werden kann. Daneben finden sich geringe Mengen ähnlicher Ester (außer Cetylalkohol (Hexadecylalkohol) ist auch Octadecylalkohol, C18H37OH, gefunden), etwas freie Alkohole (LEWKOWITSCH) und vielleicht auch (wenn das Spermacetolöl nicht ganz entfernt war?) kleine Mengen anderer Ester (nach HEINTZ [1854] der Laurin-, Myristin- und Stearinsäure, was aber der Bestätigung bedarf), sowie palmitinsaures Kalium und die Salze anderer mit Palmitinsäure homologer Fettsäuren. Die Alkohole betragen 51,4%, die Fettsäuren 53,45% (LEWKOWITSCH). Glycerin ist anscheinend nicht darin. Der Palmitinsäurecetylester (Cetin), durch Umkristallisieren des Walrats aus Alkohol erhalten, zeigt den Schmelzpunkt 45° (48,9–55°), Erstarrungspunkt 52–44,5°, kritische Mischtemperatur nach CRISMER 120°, spez. Gewicht bei 99°: 0,806, V.-Z. 129,1–130,1 (theoret. 116,9) (BRANDERHORST). Der reine Ester gibt natürlich keine Jodzahl und so ist die Jodzahl selbst und ihre Höhe ein Maßstab für dem Walrat beigemengtes Walratöl. Schon für sich erhitzt liefert Walrat Palmitinsäure und Ceten (Hexadecylen, Palmiten, C16H32). Im Vakuum destilliert er zum Teil unzersetzt bei 360°.
Das beim Umkristallisieren des Walrat aus Alkohol in diesem bleibende Öl nannte BERZELIUS Cetinelaïn. Es gab ihm beim Verseifen die von der Ölsäure verschiedene Cetinelaïnsäure. Das vom auskristallisierten Walrat abgetrennte (s. oben), dünnflüssige, fast geruchlose Spermacetöl (Walratöl, Pottwaltran, Ol. cetacei, huile de cachelot ou de Spermaceti, Sperm oil) besteht aus Estern einatomiger Fettalkohole mit einer Säure der Ölsäurereihe (Physetölsäure [?] HOFSTÄDTER, von FENDLER bestritten); enthält ferner eine feste Fettsäure, Baldriansäure (?) und Glycerin (HOFSTÄDTER, FENDLER, ALLEN fand nur Spuren, LEWKOWITSCH bestreitet das Vorkommen von Glycerin). Es sind darin 35% (ALLEN, 39% FENDLER) Alkohole und zwar 25% primäre Alkohole (LEWKOWITSCH) sowie 60–65% Fettsäuren enthalten. Die Fettsäuren bestehen aus 85,78% flüssigen und 14,22% festen (FENDLER). Die Alkohole sind ungesättigt (LEWKOWITSCH) und scheinen zur Äthylenreihe zu gehören, deren höhere Glieder zurzeit noch unbekannt sind. Freie Fettsäuren enthält das Öl nur wenig (0,11–0,42 DEERING).
Walrat findet sich auch unter den festen Bestandteilen einiger Trane (z. B. im Delphin- und Hai-Öl).
Lit. Ältere Analysen von CHEVREUL (cit. in GMELINS Handb. II, 440). DUMAS und PELIGOT, Ann. chim. phys. 72, 5. — PEREIRA, Elements. — FOURCROY, Syst. d. connoissances chim. IX. — BOSTOCK, Nichols. journ. IV, 130 (N. Allg. Journ. d. Chem. V). — PFAFF, Syst. d. Mat. medic. 1808. — SMITH, Lieb. Ann. 42, 241. — RADCLIFF, Ebenda 43, 349. — HOFSTÄDTER, Lieb. Ann. 91 (1854), 177. — HEINTZ, Lieb. Ann. 92 (1854), 299; Pogg. Ann. 87, 267 u. 93, 519; Journ. pr. Chem. 57, 30. — LEWKOWITSCH, Chem. Zeit. 1893, 1453. — KEBLER, Journ. soc. chem. ind. 1896, 206. — LYMANN und KEBLER, Amer. journ. pharm 1896, 7. — FENDLER, Chem. Zeit. 29 (1905), 555. — RÖDER (Prüf. auf Stearins.), Röders Jahresber. 1904. — BRANDERHORST, Pharm. Weekbl. 1909, 1043. — LEWKOWITSCH a. a. O. — BENEDIKT-ULZER a. a. O.
[S. 745]
Cetaceum wird außer in der Pharmazie auch in der Kerzenfabrikation benutzt.
Verfälschungen. Verfälschungen des Walrat kommen selten vor, da jeder Zusatz das eigenartige Aussehen des Walrat verändert. Beimischung von Stearinsäure, die vorkommt, erhöht die Säurezahl. 1 g Walrat, 1 g Na2CO3 und 50 ccm Weingeist gekocht geben ein Filtrat, das mit Essigsäure angesäuert sich höchstens trüben darf (Stearinsäure). Seltener sind Talg, Solar spermaceti (Margarinsäure), Paraffin und Wachs beobachtet. Gelber ranziger Walrat ist zu verwerfen.
Geschichte. Den Alten war Sperma ceti möglicherweise bekannt. Die Beschreibung der Salzblüte (Flos salis) bei PLINIUS (XXXI, 42): riecht unangenehm, ähnlich wie Fischbrühe, hat weder mit dem Salze noch dem Salzschaume Ähnlichkeit, zeigt beim Drücken eine Art Öl, denn im Salze steckt eine gewisse Fettigkeit, deutet auf Rohwalrat und das, was DIOSKURIDES (V, 128) über ἁλός ἄνθος sagt: übler Geruch, fettiger Geschmack, löslich in Öl — spricht nicht dagegen, jedenfalls nicht für eine Salzart oder für Ambra, womit es MATHIOLI identifizieren wollte, die aber doch wohlriechend ist. Was soll es denn sonst sein? Halosanthos wurde im Altertum medizinisch benutzt (PLINIUS, DIOSKURIDES). Doch meint FLÜCKIGER, «der Walrat scheint erst im Mittelalter in medizinischen Gebrauch genommen worden zu sein» (Grundriß 1894) und auch POUCHET hält den Halosanthos nicht für Walrat. Die Bemerkung bei MEGENBERG nach ISIDORUS VON SEVILLA «des visches sâm wirt gevangen oben auf dem Wazzer, wan sô er geunkäuscht hât, so swimt der sâm oben, den er gelâzen hât, den vaeht man denn und tuot in in klein Fläschel und den walrâm trinkt man nüchtern», deutet bestimmt auf Walrat. Es erscheint möglich, daß auch der Halosanthos der Salernitaner Walrat war. (POUCHET bestreitet dies.) In der Alphita steht: Alosanthos i. e. flos maris (FLÜCKIGER). Über den Walfang in Europa und Asien (indischer Ozean) liegen jedenfalls schon Nachrichten aus dem VII. bis IX. Jahrh. vor. Er war schon damals wohlbekannt (LIPPMANN). Eine Abbildung der Zerlegung des Wals findet sich schon bei LONICERUS (1582), wohl nach älterer Quelle (auch POMET hat eine solche). ALBERTUS MAGNUS (XIII. Jahrh.) kannte in Holland gestrandete Pottwale (FLÜCKIGER). Auch CLUSIUS erwähnt sie. Mit besonderem Eifer wurde aber der Pottwal, auf den seit alten Zeiten Jagd gemacht wird, seit Ende des XVII. Jahrh. verfolgt. Sicher genannt finde ich Cetaceum zuerst im Nördlinger Register von 1480 als spermaceti und im Braunschweiger Register (1521) steht Spermacety brabant. Es wurde also bereits in den Apotheken des XV. und XVI. Jahrh. gehalten. Im Dispensatorium des CORDUS von 1546 bildete Spermacet neben Butter einen Bestandteil des Unguentum potabile (FLÜCKIGER), das ich aber in keinem älteren Dispensatorium finde. Walrat muß damals gut bekannt gewesen sein, denn die Scholien zum Texte des Dispensatoriums, z. B. in der Ausgabe 1627, die alle zweifelhaften Drogen erläutern, geben hierzu keine Anmerkung. CORDUS schrieb eine eigene Dissertatio de halosantho seci Spermate Ceti vulgo dicto. Zürich 1565. Möglicherweise ist die Ambragialla (die zweite Art) im Ricettario fiorentino auch Cetaceum. Auch in England war Walrat im XVI. Jahrh. gut bekannt. In SHAKESPEARES 1598 erschienenen HEINRICH IV. steht (I Act. 3 Sc.): «And telling me the sovereign’st thing on earth was parmaceti for an inward bruise». Er wurde im Beginn des XVI. Jahrh. in den Mittelmeerländern schon viel gebraucht, kann also, entgegen KIRKBY, LEONARDO DA VINCI († 1519) sehr wohl bekannt gewesen sein. Der Streit über die Florabüste hat diese Frage aktuell gemacht. (PINKUS fand in der Florabüste Walrat, nachgewiesen durch Cetylalkohol.) Walrat wird auch bei GESNER (Hist. animal. Zürich 1558. Nach POUCHET bezieht sich die Stelle nicht auf Walrat), bei CLUSIUS (Exotic. l. X 1605), bei SIBBALD (Phaenologia nova 1692) erwähnt. Die Stelle lautet bei CLUSIUS (Exoticorum in Lib. VI): «Reperisse autem dicebantur mercatores in beluae capite plus quam quartam partem dolii in quo adservantur saliti haleces, plenam ejus liquoris quem vulgo Sperma ceti, Hollandi Wadschot appellant.» CLUSIUS bildet das Tier ab. Auch NIC. LEMÉRY bemerkt (Traité univers. d. dr. 1714), daß er nicht der Same von Walen sei (also kein «Sperma»), sondern aus dem Kopfe der Wale stamme, was zuerst der Abbé BOURDELOT (c. 1670) festgestellt habe, was aber, wie erwähnt, schon CLUSIUS wußte und später ELSNER (Miscell. Acad. nat. I 1652), BARTHOLINI, WORM (Museum 1615), SALMON (Seplasium 1693), QUINCY (Dispens. 1719) bestätigten. ETTMÜLLER hat diese Anschauung dann in einer eigenen Disputatio De Spermate Ceti verteidigt. CORDUS hielt ihn für den Samen, GESNER für die Milch des Walfisches. Aber eigentlich finden wir schon bei der HILDEGARD eine beinahe richtige Deutung, die davon spricht, daß das Gehirn der Wale mit Wasser gekocht und mit Öl vermischt eine Salbe gebe. Der[S. 746] Renaissancezeit war der Walfischfang, der Walfischtran und der Walrat also gut bekannt. POMET, der die Bereitung selbst sah, bemerkt, daß man 1688 aus einem Kopfe 24 Barels (vingt quatre bariques) Walrat gewonnen habe. POMET sagt (Hist. gener. d. drog. 1694 I, p. 74): «Le blanc de Baleine, que tout les anciens et modernes ont appellé et qu’on appelle encore aujoud’huy très mal-à-propos, sperme ou nature de Baleine est la Cervelle d’une espece de Baleine, que les Basques appellent Byaris et ceux de S. Jean du Luz Cachalot. Cet Animal, suivant quelques uns, est appelé Baleine mâle et des Latins Orca.» Er sagt ferner: «Le Blanc de Baleine se prepare ordinairement à Bayonne et à Saint Jean du Luz et cette fabrique est si rare en France qu’il n’y a pour le present que deux personnes à S. Jean de Luz qui sçavent bien preparer entre autre le Sieur Jean de Haraneder Monsequir». POMET schildert das Ausschmelzen und wiederholte Umschmelzen behufs Reinigung und erwähnt bereits die Verfälschung mit weißem Wachs. Ende des XVII. Jahrh. unterschied J. G. ELSNER das aus dem Kopfe stammende Sperma ceti von dem Sperma balaene der Einwohner Nord-Europas. Um 1700 war die Droge jedenfalls gut bekannt, auch ihrer Provenienz nach. Sie findet sich z. B. auch bei BERLU als Sperma Coeti von Irland und den Bermuden (I, S. 590), der sie aber als den Samen des Wals betrachtet, trotzdem er wußte, daß sie im Kopfe sich findet. Die abenteuerlichste Vorstellung bildete sich SCHRÖDER (1669) über dies «Bitumen» und «fettige Exkrement», das er als aus Schwefel, Seesalz und Fett gemischt annimmt. Erst CAMPER und HUNTER zeigten Ende des XVIII. Jahrh., daß die Walrathöhlen nichts mit dem Gehirn zu tun haben.
In VALENTINIS Museum Museorum (1704) wird bemerkt, daß der Walrath, Wolram oder Welset von der Grönländischen Compagnie vom Walfischfang mitgebracht werde. Der Reinigung des rohen Walrat durch Abseihen des flüssig bleibenden Öls in Lübeck und Amsterdam gedenkt N. SCHURTZ in seiner Materialkammer 1673 und die Reinigung des Rohwalrat mittelst Kalk und Aschenlauge in Holland und Lübeck beschreibt schon ETTMÜLLER (wiedergegeben bei VALENTINI). Das Behandeln des Fettes mit Potasche war im XVIII. Jahrh. gut bekannt (vgl. z. B. BROOKES, Introd. to phys. and surg. 1754). Einer chemischen Untersuchung unterwarf ihn zuerst NEUMANN (I, S. 961), dann FOURCROY; LORENZ CRELL stellte 1779 seine Fettnatur fest. Sein Vorkommen in den Dispensatorien hat SCHELENZ verfolgt. Walrat findet sich als Pinguedo Cerebri Ceti in der Pharm. Edinburgensis 1761 und in der Wirtembergica 1771 u. and. Pharm. borussica 1779 erwähnt die Reinigung mit Kalilauge. Das Ceratum Cetacei, die Lippenpomade, scheint zuerst im Dispensator. Lippiacum 1792 aufzutreten, Cold cream schon bei SPIELMANN (I, S. 965) und früher (als Ungt. infrigidans), wurde aber unter dem Namen erst durch HUDSON Anfang des XIX. Jahrh. eingeführt und der Name kam dann auch in die Pharmacopoee von Montpellier 1845 (SCHELENZ). Im XVIII. Jahrh. wurden Walratkerzen ziemlich viel gebraucht. Sie dienen noch heute zur Herstellung der Normalkerzen bei photometrischen Versuchen.
Die (oder das?) Ambra (arab. anbar, ambar) war im Altertum unbekannt (die Ambra der Alten war der Balsam eines Liquidambar). Ihr eigenartiger, sehr intensiver Geruch wäre gewiß von den Autoren erwähnt worden. Durch die Medizin und besonders die Parfümerie der Araber und des frühen Mittelalters gelangte sie zu hohem Ansehn und wurde viel zur Herstellung des Pomum Ambrae, des Bisamapfels (eines Riechbüchschens) benutzt (FLÜCKIGER). Ihre Herkunft wurde erst 1724 bekannt. Ricettario fiorentino (I, S. 793) unterscheidet Ambra odorifera, Ambra nera (von Grenoble) und Ambra gialla, und von letzterer wieder: succinum, dann un grasso o bitume, welchen das Meer auswirft (wie ich glaube Cetaceum) und un liquore che destilla da certi arbori (wohl Terpentin).
Lit. FLÜCKIGER, Pharm. Chemie und Grundriß; Pharm. Journ. 1910, 1, 385, 442. — KIRKBY, Spermacet, Pharm. Journ. 1910, 1, 511. — SCHELENZ, Walrath. Chem. Ind. 1910, Nr. 13. — PINKUS, D. Wachs d. Florabüste. Chem. Zeit. 1910, 277. — RATHGEN, Unters. d. Wachs. der Florabüste. Ebenda 1910, 305. — BEAUREGARD a. a. O. — POUCHET (Ambra), Vol. commém. du centennaire du Museum 1893.
β) Cholesterinwachse.
Eine besondere Gruppe der Körperfette bilden die Cholesterine enthaltenden Wollfette, die in der Rohwolle vorkommen und aus den Wollwaschwässern jetzt im[S. 747] Großen abgeschieden werden, ursprünglich besonders deshalb, weil die Polizei das Einfließenlassen der Abwässer der Wollwäschereien in die durch sie verpesteten Flußläufe verbot und eine Selbstreinigung der Abwässer unmöglich ist.
LIEBREICH behauptete (1885), daß Cholesterinfette (Lanolin) in dem keratinhaltigen Gewebe, wie der menschlichen Haut, den Haaren, des Vernix caseosa usw. sowie in dem Fett der Niere, der Leber und des Blutes vorkommen. Dies wurde aber von BUZZI und SANTI (1889) bestritten. SANTI zeigte, daß Cholesterin und Lanolin nicht die gleichen Reaktionen geben und meint, daß in den genannten Organen nur Cholesterin, nicht Cholesterinester, vorhanden sind. Das Blutplasma enthält Cholesterinester (HÜRTHLE) neben Cholesterin, die Blutkörperchen Cholesterin (HEPNER). In der Schafwolle kommen jedenfalls auch Cholesterinester vor. BURCHARD betrachtet (Dissert. Rostock 1889) die Sterine als im Plasma jeder entwicklungsfähigen Zelle der Tiere vorkommend. — Cholestearin, Cholsterin (so schreibt z. B. LIEBIG) oder Cholesterin wurde zuerst von CONRADI (Dissert. Jena 1775) und GREN (Diss. Halle 1788) in den Gallensteinen aufgefunden. Es findet sich dort frei und verestert. Es wurde zuerst von CHEVREUL, COUERBE und MARCHAND analysiert und von CHEVREUL benannt. Das rechtsdrehende Isocholesterin wurde 1872 von E. SCHULZE im Wollfett der Schafe aufgefunden.
Das Cholesterin besitzt die merkwürdige Fähigkeit die roten Blutkörperchen vor der Einwirkung der Hämolysine (Saponine, Solanin, Schlangengift) zu schützen, daher wird ihm eine entgiftende Rolle zugeschrieben, resp. die Fähigkeit den Organismus gegen ihm von außen zugeführte hämolytische Substanzen zu schützen. Jedenfalls wirkt Cholesterin entgiftend auf Saponine (RANSOM) und gibt mit Digitonin unlösliche Additionsprodukte. Im tierischen Organismus ist vorwiegend nur das eigentliche Cholesterin (C27H43OH.H2O MAUTHNER und SUIDA, VAN OORDT, C27H46O DIELS und ABDERHALDEN), F = 147°, αD = −31,12°, gefunden worden und zwar bei Vertebraten (Säugetieren, Vögeln, Reptilien, Fischen), Tunikaten, Mollusken, Arthropoden, Würmern, Echinodermen. Es war überall das gleiche (DORÉE). Bei den Insekten dagegen scheinen mehrere verschiedene Sterine vorzukommen, wie z. B. das Bombicesterin und ein anderes bei Blatta, doch ist auch normales Cholesterin in dem an Unverseifbaren sehr reichen Öle der Insekten nachgewiesen (z. B. in den Canthariden, in Melolontha, Octopus WELSCH). Auch in den Schwämmen sind besondere Zoosterine [Spongosterin (C27H38O), Clionasterin DORÉE] gefunden worden. Neben dem Cholesterin findet sich dann noch in den Tieren oft Isocholesterin (C26H43OH SCHULZE) und in den Faeces Coprosterin (C27H47OH BONDZYNSKI) und Hippocoprosterin, die DORÉE in einer besonderen Klasse vereinigt. Oxycholesterin (C26H42(OH)2) ist außer im Wollschweiß auch im Blut und den Knochen gefunden worden (LIFSCHÜTZ).
Eine verwandte Gruppe von Körpern findet sich bei den Pflanzen. Ein Vertreter derselben wurde zuerst von HESSE (1878) von dem tierischen Cholesterin unterschieden und Phytosterin genannt. HESSE und THOMS fassen alle pflanzlichen Sterine unter dem Namen Phytosterin zusammen. Von ABDERHALDEN (Lehrb. d. phys. Chem. 1909) wurde dann der Name Sterine für alle Cholesterine und Phytosterine vorgeschlagen. DORÉE wünscht den Namen Cholesterin nur für die in der Natur vorkommenden, ungesättigten Alkohole der Formel C27H46O zu reservieren. Cholesterin und Phytosterin lösen sich in Chloralalkoholat leicht, schwerer und zwar verschieden schwer in Chloralhydratlösung (SCHERER). Auf der Wiener Naturforscherversammlung 1894 habe ich darauf hingewiesen, daß wir in den Phytosterinen eine ganze Klasse von nahe verwandten Substanzen nicht nur ein Individuum vor uns haben und daß diese Körper zu den regelmäßigen Bestandteilen des Plasmas der Vegetationsorgane der höheren Pflanzen gehören. Bei den Schleimpilzen hatten sie schon REINKE und RODEWALD im Plasma gefunden und in Reservestoffbehältern, besonders Samen, waren sie schon 1862 von BENEKE als weitverbreitet erkannt worden (analysiert hat BENEKE nur das Phytosterin der Erbse, gefunden aber[S. 748] auch eins im Olivenöl). Auch POWER und seine Mitarbeiter stießen fast bei jeder ihrer Drogenuntersuchungen der letzten 10 Jahre auf Phytosterine. Sie finden sich bei den Samen im Ölplasma (TSCHIRCH), bei den Sklerotien von Claviceps purpurea wohl in den Oleoplasten. Aber welche Rolle sie spielen ist noch ganz unklar. Reservestoffe sind sie keinesfalls, denn ihre Menge vermehrt sich beim Keimen (SCHULZE). BENEKE meint, indem er auf das Vorkommen im Eidotter und den Samen hinweist, daß sie «sich gerade überall da finden, wo der Lebensprozeß und die Entwicklung der organischen Formen ihre reichste Entfaltung erfahren». In die Fette des Handels gelangen sie dadurch, daß sie sich, da sie am gleichen Orte wie diese vorkommen, beim Auspressen oder Ausschmelzen des Ausgangsmaterials in dem Fett lösen — also rein zufällig.
Bei der Pflanze findet sich nicht ein, sondern mehrere Sterine. Die Mannigfaltigkeit ist also bei ihr, die ja überhaupt ein viel besserer Chemiker ist wie das Tier, viel größer. Am weitesten verbreitet ist hier das Phytosterin, das HESSE in Calabarbohnen und ich in zahlreichen anderen Pflanzen beim Ausschütteln alkalischer Blattauszüge mit Äther fand (C26H44O).H2O F = 138,5°) und das wohl mit Sitosterin (C27H45OH.H2O BURIAN, RITTER) identisch ist. Wahrscheinlich sind alle in Pflanzen gefundenen, zwischen 132 und 138° schmelzenden Phytosterine mehr oder weniger reines Sitosterin, z. B. das Ampelosterin, Sojasterol u. a. m. Dann sind zu nennen das höher schmelzende Stigmasterin (C30H50O oder C30H48O. H2O) aus Calabarbohnen, das, wie es scheint, besonders in Kautschukharzen und Samen weit verbreitete Lupeol (LIKIERNIK C30H50O, identisch mit Anthesterin KLOBB). Lactucerol (C36H58(OH)22) im Milchsafte von Lactuca virosa; Arnidiol (C28H46O2 KLOBB) in Arnica und Onocol (C26H44O2 THOMS) in Ononis; Ergosterin (C27H52O. H2O TANRET) und Fungisterin (C25H40O. H2O?), beide im Mutterkorn. Auch andere Pilze (Penicillium, Aethalium, Saccharomyces, Mucor, Lobaria, Amanita, Trametes, Polyporus) enthalten ergosterinartige Phytosterine; in Aethalium septic. fanden REINKE und RODEWALD Paracholesterin C26H44O. Dann gehören hierher Caulosterin (SCHULZE und BARBIERI), Brassicasterin (C28H46O. H2O WELSCH), Cynanchol (HESSE) und Quebrachol (HESSE). Cupreol (C20H34O. H2O), Cinchol (isomer mit Cupreol), Alkohol C30H50O in Coca (HESSE), Urson (GINTL) in Fol. uvi ursi, Homosterin im Insektenpulver, Rhamnol (JOWETT) in Cascara Sagrada und viele andere Körper, die HAUTH (Diss. Freiburg 1907), WELSCH (Diss. Freiburg 1909) und COHEN (Over Lupeol Dissert. Utrecht 1906) in Tabellen zusammengestellt haben. Daß Isocholesterin in der Pflanze vorkommt, hat COHEN nachgewiesen. Er fand es im Africa-Rubber. Zu den Phytosterinen im weiteren Sinne gehören wahrscheinlich auch die Körper, die ich Resinole genannt habe: α- und β-Amyrin (C30H50O), Euphorbon (C30H48O TSCHIRCH und PAUL), Benzoresinol (C16H26O2 TSCHIRCH und LÜDY) in Benzoë, Storesinol (C16H26O2) und Styresinol (C16H26O2 TSCHIRCH und VAN ITALLIE) in dem Styrax, Chironol (C28H48O TSCHIRCH und BAUR) im Opopanax, Gurjuresinol (C15H25OH TSCHIRCH und KETO) u. and. Vielleicht gehört auch die Abietinsäure in die Nähe der Phytosterine. Ich habe die in den letzten Jahren in meinem Institute isolierten Harzsubstanzen stets mit den Phytosterinreagentien prüfen lassen und oft Phytosterinreaktionen erhalten.
Bemerkenswert ist endlich das Vorkommen von Sterinen in einigen Arten Petroleum (RAKUSIN 1906), was auf den organischen Ursprung dieser Produkte deutet und ihre Drehung erklärt. Bekanntlich leitet ja ENGLER das Petroleum wesentlich von den Fetten einer untergegangenen Fauna und Flora ab.
Die in den tierischen Fetten vorkommenden Cholesterine unterscheiden sich in verschiedenen Punkten von den in den Pflanzenfetten auftretenden Phytosterinen, beide Sterine sind aber offenbar nahe miteinander verwandt. Sie unterscheiden sich durch die Kristallform (Fig. 229) und den Schmelzpunkt der Acetate (BÖMER). Derselbe liegt beim Cholesterinacetat bei 114,3–114,8, bei den Phytosterinacetaten (aus Pflanzenfetten) zwischen 125,6–137°. Wenn der Schmelzpunkt auch nach fünfmaligem Umkristallisieren unter 116° bleibt, so darf auf Cholesterin und Abwesenheit von Phytosterin geschlossen werden. Auch mit Hilfe der Dibromadditionsprodukte gelingt die Trennung (WINDAUS). Eine wichtige Rolle spielen die Sterine bekanntlich bei der Analyse der Fette. Sie bilden meist allein den «unverseifbaren Anteil» (s. oben)[S. 749] und wie für die tierischen Fette das Cholesterin, so sind für die pflanzlichen Fette Phytosterine, besonders das Sitosterin charakteristisch. Noch ist Cholesterin niemals mit Sicherheit in pflanzlichen, Phytosterin niemals sicher in tierischen Fetten nachgewiesen worden.
a–d Cholesterinkristalle. a–h Phytosterinkristalle.
[Aus Lewkowitsch, Öle. Braunschweig, Vieweg 1905.]
Als Reaktionen zum Nachweis der Sterine dienen die von LIEBERMANN-BURCHARD (Chloroform-Essigsäureanhydrid-Schwefelsäure) SALKOWSKI-HESSE (Chloroform-Schwefelsäure), MACH (Salzsäure-Eisenchlorid), HIRSCHSOHN (Trichloressigsäure-Salzsäure) und TSCHUGAEFF, sowie die Jodschwefelsäure-Reaktion. (Vgl. in TSCHIRCH, Harze II. Aufl.) Zum mikrohistochemischen Nachweise der Phytosterine eignen sich die bisher bekannt gewordenen makrochemischen Reaktionen nicht (SCHERER).
WINDAUS teilt mir (1912) folgendes über das Cholesterin mit: «Dem Cholesterin kommt die Formel C27H46O zu; es ist ein sekundärer Alkohol, dessen CHOH-Gruppe sich in einem Ringe zwischen zwei Methylenresten befindet. Das Cholesterin besitzt eine Doppelbindung, und zwar in einer endständigen Vinylgruppe CH:CH2. Endlich ist ein Isoamylrest, (CH3)2CHCH2CH2, im Molekül des Cholesterins nachgewiesen. Das Cholesterin enthält vier vollständig hydrierte Ringe, dagegen kein aromatisches Ringsystem. Die Formel des Cholesterins läßt sich also bisher auflösen in:
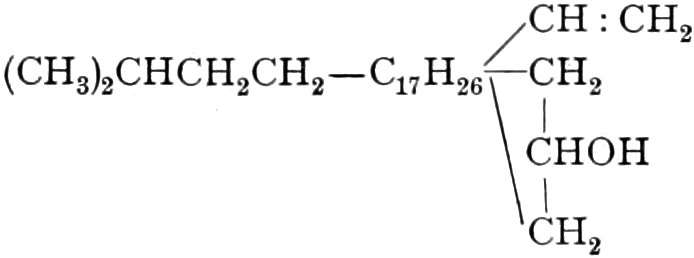
PICKARD und YATES glauben, daß das Cholesterin aus einem sehr beständigen komplexen Kern besteht, der mit einer normalen Kette von etwa 19 Kohlenstoffatomen verbunden ist. Bei der Oxydation entsteht Arachinsäure (C20H40O2).
Die Sterine werden durch Licht verändert (SCHULZE und WINTERSTEIN).
Lit. Cholesterin: MAUTHNER und SUIDA, Monatsh. f. Chem. 1894, 85 u. 362. — VAN OORDT, Jahresb. d. Tierchem. 31 (1902), Diss. Freiburg 1901. — WELSCH, Vorkommen u. Verbreit. d. Sterine im Tier- u. Pflanzenreich. Diss. Freiburg 1909. — DORÉE, Biochem. Journ. 4, 72. — WINDAUS, Arch. Pharm. 246 (1908), 117 und Habilitationsschr. Freiburg 1903; Ber. d. chem. Ges. 36, 3699 u. 3752; 37, 2027 u. 4753; 39, 518, 2008 und 2249; 40, 257 u. 2637; 41, 611; 42, 241. — G. STEIN, Über Cholesterin. Diss. Freiburg 1905. — PICKARD und YATES, Proc. chem. Soc. 19, 147. — DIELS und ABDERHALDEN, Ber. d. chem. Ges. 37 (1904), 3092; 39 (1906) 884. — E. SCHULZE, Ber. d. chem. Ges. 5, 1075; 6, 252. — LIEBERMANN, Ber. d. chem. Ges. 18, 1803. — BURCHARD, Beitr. z. Kenntn. d. Cholesterine. Dissert. Rostock 1889. — BONDZYNSKI-HUMNICKI, Zeitschr. phys. Chem. 22 (1896), 396; Ber. d. chem. Ges. 29, 476. — HUMNICKI, Über d. Schicksal d. Cholesterins im tier. Organism. Diss. Freiburg 1898. — BÖMER, Zeitschr. Unters. v. Nahrungs- u. Genußm. 1898, 544. — BÖMER und WINTER, Über einige Ester der Cholester. u. Phytoster. Zeitschr. Unters. Nahr. u. Genußm. 1901, 1091. — BLÜMNER, Über Cholesterinäther. Dissert. Zürich 1911. — E. RITTER, Beitr. z. Kenntn. d. Cholesterine u. d. Method., die zu ihrer Abscheid. aus d. Fetten u. z. ihrer quantit. Best. verwendbar sind. Diss.[S. 750] Zürich 1902. — JUCKENACK-HILGER, Gewinn. d. Cholest. u. Phytost. aus Tier- u. Pflanzenfetten. Arch. Pharm. 1898, 367. — RAUMER, Zeitschr. angew. Chem. 1898. — Weitere Nachweise über Cholesterin in RÖHMANN, Biochemie.
Phytosterine: BENEKE, Cholesterin im Pflanzenreiche aufgefunden. Lieb. Ann. 122 (1862), 249. — HESSE, Phytosterin und Cholesterin. Ebenda 192 (1870), 175. — LINDENMEYER, Journ. pr. Chem. 90, 321. — REINKE und RODEWALD, Über Paracholesterin aus Aethal. sept. Lieb. Ann. 207 (1881), 229. — TSCHIRCH, Verh. d. Naturforschervers. Wien 1894 und Chem. u. Biolog. d. pflanzl. Sekrete. — THOMS, Arch. Pharm. 235, 39. — SCHULZE, Lupeol, Zeitschr. phys. Chem. 41 (1904). — SCHULZE und WINTERSTEIN, Verh. d. Cholest. gegen d. Licht. Zeitschr. phys. Chem. 43, 316 und 48, 546. — HAUTH, Z. Kenntn. d. Phytosterine. Diss. Freiburg 1907. — H. SCHERER, Über Phytosterine usw. Diss. Straßburg 1909. — COHEN, Over Lupeol. Proefschr. Utrecht 1906, Arch. Pharm. 1908, 510, 515, 520 und 592. Phytosterine aus Balata. Ebenda 1908, 510. — SACK und TOLLENS, Ber. d. chem. Ges. 1904 (aus SACK, Diss. Göttingen 1901). Weitere Nachweise über Phytosterine in CZAPEK, Biochemie.
Reaktionen: SALKOWSKI, Pflüg. Arch. 6 (1872), 207. — HESSE, Lieb. Ann. 211 (1882), 284. — LIEBERMANN, Ber. d. chem. Ges. 18 (1885), 1803. — BURCHARD, Beitr. z. Kenntn. d. Cholester. Diss. Rostock 1889. — HIRSCHSOHN, Pharm. Centralh. 1902, 357.
Wollfettgruppe.
Adeps Lanae.
Wollfett, Wollschweißfett, Suint, Wool fat, Wool grease, Recovered grease, grasso di lana, in Amerika: Dégras, — das wasserhaltige: Lanolin, Lanichol, Laniol, Lanesin, Agnin, Alapurin, Anaspalin, Vellolin usw. — das wasserfreie: Lanolinum anhydricum, nach HUSEMANNS, HEBBELERS und WULFSBERGS Ausführungen besser: oesypum (nicht oesipus wie INCE und LIEBREICH schreiben), das masc. kommt bei keinem römischen Autor vor.
Etym. οἴσυπος aus ὀίς = ovis Schaf; οἰὸς ῥύπος = Schmutz der Schafe; οἰὸς λίπος = Fett der Schafe; griech. ὀίσυπος (Neutr.) oder οἰσύπη (Fem.), bei DIOSKURIDES οἴσυπος (Masc.); bei GALEN auch ὀίσπη αἰγός; bei ORIBASIUS ὀίσσυπος, bei AËTIUS, PAULUS AEGINETES, NICOL. MYREPSUS auch ὕσσωπος. Daraus wurde dann im I. Jahrh. n. Chr. Hyssopus und Hyssopum; — gleichlautend mit der Pflanze — so bei SCRIBONIUS LARGUS und CELSUS, bei PLINIUS steht sowohl Oesypum wie Hyssopus. — In der Alphita: Ysopum vel ysopus humida cerotum est succus lanae per decoctionem extractus. Bei MATHAEUS SILVATICUS: cenferatab (aus zûfâ ratab jabis corrumpiert, zûf, zûfâ, Name des Ysop). Das lat. ysopum humidum auch bei IBN BAITHAR als zûfâ rathaba (raṭab) = feuchtes Ysop (die Ysoppflanze hieß trockener Ysop = zûfâ jabis; schon PAULUS AEGINETES unterscheidet das Wollfett: ὕσσωπος ὑγρός τὸ φάρμακον vom Ysop: ὕσσωπος ἡ βοτάνη). — Bei SERAPION: sinferatab, im Liber Servitoris: zuscherak. — Arab. heißt Wollschweiß auch wadsah —. Oesypum war aber im Altertum auch Kollektivbegriff für allen möglichen «Schmutz», wie Ziegenkoth und das aus Ziegenbärten ausgekämmte Ladanum (Oesypum caprarum bei PLINIUS). Der Name Hyssopus humidus wurde durch die arabischen Autoren im ganzen Mittelalter allgemein gebräuchlich (MESUË, LIBER SERVITORIS, NICOLAI). Im XVI. Jahrh. kam aber dann wieder durch die Humanisten und das Bestreben, die Medizin vom Arabismus zu reinigen, οἴσυπος und οἴσυπον (so z. B. bei BRUNFELS) in Aufnahme. Doch schleppt sich der Ausdruck Hyssopus humida als Nebenbezeichnung noch durch die Arzneibücher des XVII. Jahrh. (SCHRÖDERS Pharm. med. chym., Pharmac. augustana 1634–1734), ja ist sogar ganz als hisopo umido oder hesipo humedo in die spanische Sprache übergegangen. Im Thesaurus aromat.: ysopus humide. In des Cordus Dispensat.: oesypi i. e. hyssopi humida. Im Ricett. fiorent. nur oesypus.
Gewinnung. Die Wolle der Schafe enthält wechselnde Mengen (20–70%) der unter dem Namen Wollschweiß zusammengefaßten Ausscheidungsprodukte der Haare und Schweißdrüsen der Haut, vermischt mit mancherlei Verunreinigungen (Staub, Fasern, Kletten, Kot usw.). Dieser Wollschweiß, von dem die Wolle vor ihrer[S. 751] Verarbeitung befreit werden muß (Wollwäsche, Entschweißen), besteht einerseits aus in Wasser, zum Teil auch in Alkohol löslichen Bestandteilen: Kalisalzen organischer Säuren (s. unten S. 753), andererseits aus aus Cholesterinen und deren Fettsäureestern bestehendem Fett. Die Wolle enthält 20–28% dieses «Wollfettes». Die Fabrikwäsche der Wolle (die Rückenwäsche am Tiere selbst wird nur selten noch geübt) geschieht entweder mittelst flüchtiger Lösungsmittel (Benzin, Äther, Schwefelkohlenstoff, Amylalkohol, Naphta) oder — meist — mittelst alkalischer Laugen (früher gefaulter Harn, jetzt Soda, Potasche, Seife, Ammoncarbonat, auch Wasserglas wurde empfohlen). Meist wird die Schweißwolle zunächst der Vorwäsche unterworfen, d. h. mit Wasser von gewöhnlicher Temperatur behandelt. Die gelösten Kalisalze werden durch Calcinieren des Rückstandes der eingedampften Lösung auf Potasche verarbeitet («Potasche aus Wollschweiß», s. unten S. 752). Die Hauptwäsche erfolgt gewöhnlich in den großen Wollwaschmaschinen (Leviathan) mittelst Seifenlösungen von 40–45° C. oder Seifen- und Sodalösungen, wodurch die Fette emulgiert werden. Das Waschwasser wird zunächst durch Klärkufen geschickt, in denen sich der Schmutz und andere Verunreinigungen absetzen, dann verschieden weiter verarbeitet. In dem einen Verfahren (Lanolinprozeß) setzt man zu der Emulsion verdünnte Schwefelsäure. Die Seife wird dadurch zerlegt und mit den freien Fettsäuren scheidet sich auch das Wollfett ab. Dies wird abgetrennt, abermals mit Kalilauge oder Potasche emulgiert und die aus Kaliseife und Lanolin bestehende Emulsion zentrifugiert, wobei sich das Lanolin als Rahm abscheidet. Dies wird dann mit Wasser gewaschen, die Seifen durch Chlorcalcium in Kalkseifen übergeführt und aus dem Gemisch das Wollfett mit Aceton extrahiert. Oder aber es wird das rohe Wollfett zunächst durch Ätzalkalien oder Carbonate in eine Emulsion verwandelt und diese dann der Zentrifugierung unterworfen. Dabei trennt sich diese in eine untere, die Fettsäuren und Fette als Seife enthaltende Lösung, und eine obere, die Cholesterinäther enthaltende, als Rahm abfließende Schicht. Das so gewonnene Rohlanolin wird dann wiederholt mit Wasser umgeschmolzen und gewaschen, hierauf Chlorcalciumlösung zugesetzt und die Kalkseife mit siedendem Aceton extrahiert. Das nach Abdestillieren des Acetons zurückbleibende Lanolin wird mit Kaliumpermanganat oder anderen Oxydationsmitteln von den Riechstoffen befreit. Durch Einkneten von 25% Wasser wird das Wollfett in Lanolin übergeführt. Neuerdings wird geruchloses Wollfett dadurch erhalten, daß der Wollfettschlamm statt mit Schwefelsäure mit schwefliger Säure gefällt wird. Ein anderes Verfahren (Adeps lanae-Prozeß) geht in der Weise vor, daß die geklärte Rohemulsion (s. oben) direkt mit Chlorcalcium versetzt und der ausfallende Schlamm (Suinter), ein Gemisch aus fettsaurem Kalk und Cholesterinestern, mit Wasser oder mit Salzlösungen (von 1,02–1,04 spez. Gew.) geschlämmt wird. Dabei bleiben die schweren Kalksalze zurück und der Wollfettschaum wird mit dem Waschwasser fortgeschlämmt und den Waschwässern durch einen Gegenstrom von Benzin oder einem anderen Lösungsmittel entzogen. Bisweilen werden auch die Rohemulsionen direkt zentrifugiert und das Fett durch Waschen, Umschmelzen usw. gereinigt. Wird die Rohwolle direkt mit Benzin oder Äther extrahiert, so müssen die Wollschweißsalze durch nachträgliches Waschen mit Wasser entfernt werden. Das Wollschweißfett, das durch Extraktion der Wolle mit flüchtigen Lösungsmitteln erhalten wird, enthält die natürlichen Bestandteile, soweit diese löslich sind: Fettsäuren, neutrale Ester und freie Alkohole, sowie Kalisalze der Fettsäuren. Die Darstellung von hellem Wollfett ist möglich, wenn die Lösung in Benzin mit Gerbsäure,[S. 752] Phosphorsäure, Essigsäure oder Bleiacetat unter Zusatz von Alkohol behandelt wird (KLEEMANN). Gewöhnlich wird zum Bleichen Kaliumbichromat und Schwefelsäure benutzt (HERBIG). Die Darstellung gereinigter Wollfette ist durch vielerlei Patente geschützt. Ausführliche Darstellung der Methoden bei DONATH und MARGOSCHES a. a. O. Viel rohes Wollfett kommt aus der Levante (CAESAR-LORETZ).
Handelssorten. Die Norddeutsche Wollkämmerei in Delmenhorst bringt 1912 in den Handel: Alapurin, reines, neutrales, wasserfreies Wollfett, die beste Sorte, dann Adeps Lanae N. W. K. (Lanolinum puriss. anhydr.) und Adeps Lanae ad usum veterinarium. Ferner für technische Zwecke Adeps Lanae technicus, Neutral-Wollfett I und II (säurefrei), Wollfett-Fettsäure und rohes Wollfett. Über die Darstellung dieser Präparate teilt mir die Firma folgendes mit: «Das nach D. R. P. 69598 hergestellte, leicht schmelzbare Wollfett kommt jetzt bekanntlich unter dem Namen «Alapurin», als feinstes Produkt für medizinische Salben usw. in den Handel. Seines hohen Preises wegen tritt die Verwendung zurück gegenüber dem Adeps Lanae N. W. K., welches überall eingeführt und sich dauernd bewährt hat. Dieses Adeps Lanae N. W. K. hat als Grundlage das Neutral-Wollfett, welches direkt aus dem mittels Kalk und Erdalkalisalzen gewonnenem Suinter extrahiert wird. Zwei Drittel des gesamten Wollwaschwassers werden nach diesem Neutralverfahren mit Kalk und Erdalkalisalzen geklärt. Bei der Extraktion des Suinters entsteht zunächst ein gelbbraunes Fett mit ziemlich starkem Geruche, das Neutral-Wollfett II. Dies wird mit Sauerstoff (Ozon) gebleicht und desodorisiert, dadurch verwandelt es sich in Stern-Lanolin. Ein letzter Raffinationsprozeß verwandelt das Stern-Lanolin in Adeps Lanae N. W. K. Wird dies mit Wasser verknetet, so entsteht das Adeps Lanae cum aqua. Die im Suinter verbleibenden Alkaliseifen werden durch besondere Extraktion mit anderem Lösungsmittel gewonnen und liefern nach Zersetzung mit Salzsäure die Wollfett-Fettsäure. Ein Teil des Wollwaschwassers wird nach dem altbekannten sauren Verfahren mit Schwefelsäure geklärt. Der hierbei sich absetzende Schlamm (saurer Suinter) wird in Dampfpressen gepreßt. Dabei läuft das Roh-Wollfett ab. Die Rückstände werden als Dünger verkauft.»
Chemie. Die Wolle enthält in %: 12,28–23,48 Wasser, 7,17–34,19 Wollfett, 9,76 bis 21,83 Wollschweiß (in Wasser löslich), 0,35–0,89 in Alkohol löslich, 1,39–5,64 in verd. Salzsäure löslich, 0,29–0,57 in Ätheralkohol löslich, 20,83–43,2 reine Wollfaser; 2,93–23,64 unlösliche Verunreinigungen (MÄRCKER, SCHULZE, BARBIERI). Der Wollschweiß besteht aus Kaliumsalzen der Ölsäure und Stearinsäure, — also Kaliseifen — wahrscheinlich auch anderer nicht flüchtiger und einiger flüchtiger Fettsäuren (Essigsäure, Propionsäure, Buttersäure, Capronsäure, Baldriansäure, Önanthsäure, Cerotinsäure), sowie Kaliumchlorid, Phosphaten und Sulfaten, Ammonsalzen usw., Kaliumphenylsulfat, Sarkolaktinsäure, Benzoësäure, Oxalsäure, Milchsäure, Bernsteinsäure, Harnsäure, Glycocoll, Leucin, Tyrosin, Mono- und Trimethylamin u. a. m. (ULBRICH, REICH, HARTMANN, BUISINE). Die Wollschweißasche (Potasche) enthält 58,9–63,4% Kali. Beim Glühen der Kohle des Wollschweißwaschwassers entstehen brauchbare Gase. Die Wollschweißpotasche ist oft fast frei von Natronsalzen. Je edler die Rasse und je besser genährt die Tiere sind, um so höher ist der Kaligehalt. In Deutschland wird sie in Döhren bei Hannover, Chemnitz und in Bremen dargestellt. Die Ausbeute beträgt 5% des Gewichtes der Wolle.
Das wasserfreie Wollfett bildet eine fast geruchlose, klebrige, stark viskose salbenartige Masse, die meist bei 40–42° schmilzt (die Norddeutsche Wollkämmerei liefert ein Wollfett von dem sehr niedrigen Schmelzpunkt 30–36°). Es nimmt mehr als das doppelte Gewicht Wasser auf, ohne seine salbenartige Beschaffenheit zu verlieren. Die Farbe des Wollfettes ist verschieden: hellgelb, gelb, grünlichgelb, goldgelb, dunkelgrün, dunkelbraun bis schwarzbraun. In Wasser ist es unlöslich, in Alkohol schwer löslich, leicht löslich in Aceton, Äther, Benzol, Petroläther und Schwefelkohlenstoff.
Spez. Gewicht: 0,970–0,973, Schmelzpunkt: 36–42,5°, V.-Z.: 82–130, J.-Z.: 10–28 (J.-Z. der Fettsäuren: 17), Hehnerzahl: 60, Schmelzpunkt der Fettsäuren: 41,8°, Erstarrungspunkt der Fettsäuren: 40°, Schmelzpunkt der Alkohole: 33,5°, Erstarrungspunkt der Alkohole: 28°. DIETERICH fand (Methode: Helfenb. Ann. 1897)[S. 753] für wasserfreies Wollfett (1900): Verlust bei 100°: 0,1–2,2%, S.-Z.: 0,196–2,419, Wasseraufnahmefähigkeit: 56,26–246,86, Asche: Spuren –0,3%. Adeps lanae enthält meist nur Spuren Chlor.
Eine Analyse von rohem Wollfett (recovered grease) ergab LEWKOWITSCH in %: flüchtige Fettsäuren 1,26, unlösliche freie Fettsäuren 20,22, Unverseifbares (unverbund. Alkohole) 6,21, Total des Unverseifbaren 36,71, Wachs 72,31, darin: gebundene Alkohole 30,5 und gebundene Fettsäuren 41,81. Für mit überhitztem Wasserdampf destilliertes Wollfett (flüssiger Anteil): Freie Fettsäuren 54,91, unzersetztes Wachs 11,39, darin: gebundene Fettsäuren 7,09 und gebundene Alkohole 4,30, Unverseifbares (Kohlenwasserstoffe) 34,50.
Wollfett läßt sich in einen harten (Wollwachs) und einen weichen Teil scheiden. Die Abscheidung des Wollwachses erfolgt durch Abkühlung der Lösung in Fuselöl unter den Schmelzpunkt des Wollfettes.
CHEVREULS Analyse des Wollschweißes (1856) ergab neben oxalsaurem Kalk, kieselsaurem Alkali und Chlorkalium die Kalisalze zweier organischer Säuren und wenigstens 5 «besondere» Fette, vorwiegend Stearerin (unverseifbar) und Elaierin (verseifbar). ULBRICHT und REICH fanden 1867 Stearinsäure und Ölsäure. Die Cholesterine wurden von HARTMANN (1868) und E. SCHULZE (1870) im Wollfett entdeckt. HARTMANN wies nach, daß im Wollfett kein Glycerin enthalten ist, E. SCHULZE, der alle wichtigen Punkte aufklärte, daß darin Isocholesterin und ein Benzoësäureester (?) vorkommen. V. SANCTIS fand im Lanolin von JAFFÉ und DARMSTÄTTER: Cerotinsäure, Palmitinsäure, geringe Mengen Capron- und Ölsäure, sehr geringe Mengen Stearin-, Isovalerian- und Buttersäure, sämtlich als Äther des Cholesterins und Isocholesterins, vielleicht auch anderer höherer Alkohole. Glycerin fehlte. Ob aber Ölsäure darin vorkommt, die auch SCHULZE (1874) angibt, ist zweifelhaft. Ebenso bedarf die Hyaenasäure der Bestätigung. Buisine fand Cerotinsäureceryläther.
Die charakteristischen Bestandteile des Wollfettes sind Fettsäureester des linksdrehenden Cholesterins (F = 145°), des rechtsdrehenden Isocholesterins (F = 138,5°) und der Oxycholesterine, sowie die Fettsäureester kohlenstoffreicherer, cholesterinartiger Verbindungen. Die Zusammensetzung des Wollfettes ist aber eine sehr schwankende und variiert stark nach der Provenienz. SCHULZE erhielt mehrfach bis 15% Cholesterin- und Isocholesterinester, etwa zu gleichen Teilen (im Wollwachs 85–90%), DARMSTÄDTER sehr viel weniger. In einigen Fällen fehlte Cholesterin fast ganz, in anderen Isocholesterin. Die höher schmelzenden wachsartigen Bestandteile, das Wollwachs, können (s. oben) durch Lösen des Wollfettes in Fuselöl und Abkühlen der Lösung entfernt werden (JAFFÉ-DARMSTÄDTER 1894). MARCHETTI isolierte den keine Cholesterinreaktion gebenden Lanolinalkohol (C12H24O), DARMSTÄDTER und LIFSCHÜTZ aus Wollfettwachs Carnaubasäure (C24H48O2, identisch mit der Carnaubasäure STÜRCKES) und Myristinsäure (C14H28O2) — australisches Wollfett enthielt 10–12% dieser Säuren —, sowie Lanocerinsäure (C30H60O4, F = 104°), die eine Dioxysäure sein soll und deren Lakton C30H58O3 von ihnen früher als ein Lanestol, d. h. als ein Wollalkohol betrachtet und beschrieben wurde (sie macht den Hauptbestandteil der in kaltem Alkohol unlöslichen, bei der Verseifung erhaltenen Substanzen aus) und in der alkohollöslichen Seifengruppe: 34% Lanopalminsäure (C16H32O3, F = 88°), die im geschmolzenen Zustande sich mit Wasser emulgiert und, neben einer flüchtigen, 15% einer öligen Säure (Ölsäure?). Von Alkoholen erhielten sie Cerylalkohol und einen vielleicht damit isomeren Alkohol, sowie Carnaubylalkohol (C24H50O), der bei der Oxydation Carnaubasäure liefert und Cholesterin (im harten Bestandteil kein Isocholesterin). Das bei 55–60° schmelzende Wollfettwachs lieferte 33% Rohalkohole, 41,6% in Alkohol unlösliche Seife (rohes[S. 754] lanocerinsaures Kali) und 36,2% alkohollösliche Seife. Der Säurebestandteil betrug über 65% (darunter nur wenige Prozente flüssige Säuren). In dem «Weichfett» beträgt er nur 40–45%. In ihm fehlt Lanocerin- und Lanopalminsäure. Dagegen sind auch hier Myristin- und Carnaubasäure, vielleicht auch Cerotinsäure und in beträchtlicher Menge (40%) die ölige Säure vorhanden, als Alkohole ein Isocholesterin (C26H44O, F = 137–138, nicht mit SCHULZES Isocholesterin identisch) neben anderen nicht näher charakterisierten Sterinen. Von Alkoholen wurden im Weichfett Cerylalkohol und Carnaubylalkohol nachgewiesen.
Endlich wurden auch die Oxydationsstufen des Cholesterins: Oxycholesterin [C26H42OH)2], Oxycholesterinäther (C26H43O)2O), Cholansäure (C26H40O4) u. and. im Wollfett gefunden (LIFSCHÜTZ). Ob Stearinsäure, Palmitinsäure, Capronsäure, Isovaleriansäure und Normal-Buttersäure (in Esterbindung) zu den normalen Bestandteilen aller Wollfette gehören ist zweifelhaft. Sie finden sich wohl nur im Rohfett und werden bei der Reinigung zum Teil entfernt (s. oben unter Wollwäsche). Ein bedeutender Teil des Wollfettes besteht jedenfalls nicht aus Cholesterin-, Oleïn- und Cerotinsäureestern. Nach DARMSTÄDTER und LIFSCHÜTZ treten weniger die Cholesterin- und Isocholesterinester der Cerotinsäure, als vielmehr die der Carnaubasäure und Lanocerinsäure in den Vordergrund.
Dagegen wird nach UNNA das Wollfett nicht durch Vorhandensein von Cholesterin und Cholesterinestern charakterisiert, sondern durch Isocholesterin (SCHULZE) und Oxycholesterin (Lifschütz), Lanocerinsäure und Lanopalminsäure (LIFSCHÜTZ und DARMSTÄDTER).
Im Fett der Epidermis, der Cutis und der Subcutis der menschlichen Fußsohle, im Ohrenschmalz und in den Nägeln, die Cholesterin enthalten, fehlen Isocholesterin und Oxycholesterin. Die menschliche Haut enthält also kein Wollfett. Die Hydrophilie, die Fähigkeit mit Wasser zu lanolisieren, geht den Hautfetten ab und eignet dem Wollfett wegen seines Gehaltes an Oxycholesterinen. Die Fettsäureester der Cholesterine lassen sich nur mit alkoholischer Kalilauge oder den Alkoholaten der Alkalien (KOSSEL und KRÜGER) verseifen. Sie sind gegen Mikroorganismen widerstandsfähiger als Fette und daher sehr geeignet zu Hautschutzmitteln.
Lit. DONATH und MARGOSCHES, D. Wollfett, seine Gewinn., Zusammensetz., Untersuch., Eigensch. u. Verwert. in Samml. chem. u. chem. techn. Vortr. VI, 1901 (dort die Lit.). — MÖHLAU, Wollwäsche in LUEGERS Lexikon der Ges. Technik 1911. — KNECHT, RAWSON und LÖWENTHAL, Handb. d. Färberei. Berlin 1900. — HERBIG, Die Verwert. d. Abfallprod. d. Wollwäschereien. Zeitschr. f. d. Ges. Textilindustrie 1897/98. — BORCHERS, Verwert. d. Wollschweißes. Zeitschr. Angew. Chem. 1890, 96.
CHEVREUL, Compt. rend. 43, 13 (Journ. pr. Chem. 70, 256). — BERTHELOT, Ann. ch. phys. (3) 56, 51 (Lieb. Ann. 112, 356). — HARTMANN, Über den Fettschweiß der Schafwolle 1868. — E. SCHULZE (Cholesterine). Ber. d. chem. Ges. 1872, 1075 und 1873, 1279. Zeitschr. f. Chem. 1870, 453. — SCHULZE und UHRICH, Ber. d. chem. Ges. 1874, 570. — ULBRICHT u. REICH, Preuß. Ann. d. Landw. Monatsbl. 49, 122. — HERBIG und VON COCHENHAUSEN, Dingl. Polyt. Journ. 292 u. 297.
LIEBREICH, Über d. Lanolin, eine neue Salbengrundlage. Berl. klin. Wochenschr. 1885, 761, in Real-Encycl. d. ges. Medizin XI, 1887. Vorkommen von Lanolin in der Haut: Verh. d. phys. Ges. Berlin 1890. Therapeut. Monatsh. 1890. Virchows Archiv 121 (1890) 383. Du Bois Reymonds Archiv 1890, 363. — SCHULZE, Journ. pr. Chem. (2) 25, 459 u. 7 (1873), 163 u. 178, 9, 321. Ber. d. chem. Ges. 6 (1872), 251. Einig. Best. d. Wollfettes. Ber. d. chem. Ges. 31 (1898), 1200. Zeitschr. phys. Chemie 14 (1890), 522. — SPENZER u. CLEVELAND, On gallstones Clevel. Med. Gaz. 1895. — BUISINE, Bull. soc. chim. 42, 201. — V. SANCTIS, l’Orosi 1894 (Apoth. Zeit. 1894, 371). — HARTMANN, Über den Fettschweiß der[S. 755] Schafwolle. Diss. Göttingen 1868. — MARCHETTI (Lanolinalkohol). Gazz. chim. ital. 25 (1895). — DARMSTAEDTER und LIFSCHÜTZ, Beitr. z. Kenntn. d. Zusammens. d. Wollfettes. Ber. d. chem. Ges. 1895, 3133; 1896, 618, 1474 u. 2890; 1898, 97 u. 1122. — BURCHARD, Beitr. z. Kenntn. d. Cholesterine. Rostock 1889. — UNNA, Monatsh. f. prakt. Dermatologie 1907, 443. — SANTI, Über Lanolin. Monatsh. f. prakt. Dermatol. 1889 u. 1892. — LIFSCHÜTZ (Oxycholester.). Zeitschr. phys. Chem. 50, 436, 53, 140 (1907). — LEWKOWITSCH, Chem. Technol. d. Fette I, 444 und Journ. Soc. Chem. Ind. 1892 u. 1896. — Identitätsreaktionen für Wollfett: HILGER, Jahresb. d. Pharm. 1893, 383 und ASTOLFI, Bull. chim. farm. 1894, 4; vgl. auch bei DONATH a. a. O. — Wertbestimmung: V. COCHENHAUSEN, Chem. Zeit. 1894, 143. — Controverse über den Chlorgehalt: Pharm. Jahresber. 1894.
Zur Wertbestimmung gehört: Bestimmung des Wassers und der fremden Stoffe, Säurezahl, Verseifungszahl, Bestimmung der freien Fettsäuren, ihrer Säurezahl und ihres Molekulargewichts, Bestimmung der flüchtigen Fettsäuren und bei der Verseifung frei gewordenen Alkohole sowie der schwer verseifbaren Stoffe, Bestimmung der Säurezahl des aufgeschlossenen Wollfettes und der Gesamtfettsäuren (V. COCHENHAUSEN). Pharm. helv. IV. verlangt bei Adeps lanae außer den Identitätsreaktionen von SALKOWSKY-HESSE und LIEBERMANN-BURCHARD (s. oben S. 749) Prüfung auf Seife, Glycerin, mineralische Stoffe und Ammoniaksalze, Säure und Alkalinität. Schmelzpunkt 35–40°. J. Z. 20–26.
Präparate. Lanolin: Adeps lana 75, Wasser 25 (D. A. V läßt flüssiges Paraffin zusetzen). Lanogen ist eine Mischung der wasserbindenden Substanz des Wollfettes mit Vaselin (es bindet 300% Wasser). Dermozon ist sterilisiertes wasserstoffperoxydhaltiges Wollfett, Lanoform ein Formaldehydwollfettpräparat, Thilanin geschwefeltes Wollfett, Bryolin Borsäure-Glycerin-Olivenöl-Wollfett. (Weitere Präparate in GEHES Codex.)
Geschichte. Das wasserhaltige Wollfett ist durch LIEBREICH 1885 unter dem Namen Lanolin als Salbengrundlage in den Arzneischatz eingeführt worden, aber bekannt ist Wollfett seit c. 2000 Jahren als Cosmeticum und Arzneimittel. Seine Geschichte wurde gelegentlich der Lanolin-Patentprozesse besonders durch TH. HUSEMANN aufgeklärt. Vorschriften zur Darstellung des Oesypum gab bereits DIOSKURIDES (II c. 84) und PLINIUS (XXIX, c. 2). Im wesentlichen wurde es durch Auskochen der Wolle mit Wasser, Sammeln, Reinigen und Bleichen des abgeschiedenen Fettes dargestellt. Das Produkt hatte einen üblen Geruch (ut sordium virus oleat). Die Vorschrift von DIOSKURIDES, der auch schon einer Verfälschung mit Cerat und Talg gedenkt, reproduzierte mit wenigen Modifikationen AËTIUS, NICOL. MYREPSUS und SERAPION, der schon ein weniger übelriechendes Produkt erhielt. Ein neues Verfahren führte MÉSUE, der die Bereitung des Wollfettes aus der Hand der Hirten in die der Apotheker legen wollte, im Grabbadin (I, S. 599) ein, das dann das herrschende wurde, z. B. auch in das Dispensatorium NICOLAI (I, S. 790) und in das Luminare majus (I, S. 793) überging. JACOBUS SYLVIUS verlangt 1542, daß es nicht von räudigen Schafen dargestellt werde, was die Pharmac. coloniensis 1565 wiederholt. Auch HEINRICH VON MONDEVILLE reproduziert in seinem Antidotarius die Vorschrift des MÉSUE. Er bemerkt, daß Isopus humida ein Mittelding zwischen Salbe und Pflaster sei. In der Zeit der Renaissance, als der Arabismus bekämpft und die Alten «wiederhergestellt» wurden, grub CORDUS die Vorschrift des DIOSKURIDES wieder aus und ihm folgt der Ricettario fiorentino (I, S. 793), die Kölnische Pharmacopoee (1565) und die Pharmac. augustana (1640) in ihren verschiedenen Ausgaben (I, S. 793). Als legitimes Quid pro quo tritt hier Knochenmark, medulla vitulina und cervina auf, die später ganz allgemein als Succedanea dafür angegeben wurden, denn keine der späteren amtlichen Pharmacopoeen führte mehr eine Bereitungsvorschrift für Oesypum auf. Wohl aber hat die SCHRÖDERsche Pharmacopoee (I, S. 890) bis in ihre spätesten Auflagen (1748) noch die Vorschrift des DIOSKURIDES mit wenigen Abweichungen. Die Vorschrift, daß man die Schafe vorher abhetzen solle, wohl um die Ausbeute zu vermehren, steht schon im Antidotarium romanum aus dem XVI. Jahrh. und ging in die Pharmac. augustana und londinensis über. Aber im XVII. und XVIII. Jahrh. verschwinden allmählich diese schmierigen Präparate aus den Pharmacopoeen und Arzneibüchern, da sich das Präparat immer mehr verschlechterte und die Bereitung in der Apotheke zu viel Mühe machte, und erst die Pharmacop. hispanica III 1803 kennt wieder eine Oesypi purificatio und die von 1817 benutzt einen Oesypus praeparatus.
Als Handelsware scheint Oesypum schon im Altertum zur Zeit des DIOSKURIDES einen großen Verbreitungsbezirk gehabt zu haben (HUSEMANN). Es diente nach PLINIUS unzähligen[S. 756] Zwecken und war ein auch von CELSUS, GALEN und später auch im Mittelalter (AËTIUS, PAULUS VON AEGINA) viel benutztes Medikament (besonders für Pflaster, Salben und Pessi) und Cosmeticum trotz seines abscheulichen Geruches. Das beste Wollfett lieferte Attica. Als Verfälschungen wird neben Wachssalbe und Talg auch Teig genannt. Es gab aber sogar Ersatzmittel aus Colophonium, Wachs und Fichtenharz. Im Mittelalter wurde es jedenfalls nicht in den Apotheken gemacht, sondern von den «herbatici» bezogen. Ende des XVII. und Anfang des XVIII. Jahrh. wurde Wollfett in Frankreich in größerem Stil produziert und exportiert (VALENTINI, Hist. simpl., POMET, Hist. d. drog.). Für das Verschwinden des Wollfettes aus den Arzneivorschriften ist wohl der Protest ZWELFES in der Pharmac. august. reform. 1652 gegen dies stinkende Präparat maßgebend gewesen (HUSEMANN). Erst nach der Mitte des XIX. Jahrh. wurde, nachdem die Aufmerksamkeit durch CHEVREUL (1856) und BERTHELOT (1858), später auch durch E. SCHULZE auf die Cholesterine des Wollfettes gelenkt war, die technische Gewinnung desselben durch die Arbeiten von VOHL, Abscheidung und Benutzung der Fette aus den Seifenwässern der Tuch- und Wollwarenfabriken. Dingl. Polyt. Journ. 185 [1867], 465 und HARTMANN, Über den Fettschweiß der Schafwolle. Diss. Göttingen 1868 eingeleitet.
Die Tatsache, daß Wollfett beim Verreiben mit Wasser weiß wird, war schon den Alten bekannt, wurde aber nur als Identitätsreaktion benutzt (TH. HUSEMANN). Das Verdienst LIEBREICHS ist es, 1885 gezeigt zu haben, daß das durch Wasseraufnahme in Lanolin verwandelte, entsprechend gereinigte, völlig neutrale, seifenfreie Wollfett eine vorzügliche Salbengrundlage ist. Dargestellt wurde aber wasserhaltiges Wollfett (Lanolin) zuerst 1882 durch BRAUN. Der «Wollfettkrieg» tobte 1894 und 1895 (vgl. d. Jahresberichte). Jetzt ist das Lanolinpatent erloschen und auch das Wort Freizeichen. Nach dem Verfahren von DIOSKURIDES und MESUË wird niemals ein gutes reines Wollfett, sondern stets ein übelriechendes Produkt von geringem Werte erhalten. Die besonders durch B. JAFFÉ und DARMSTÄDTER in Martinikenfelde und die Norddeutsche Wollkämmerei in Delmenhorst-Bremen ausgearbeiteten verbesserten neuen Fabrikationsverfahren bedeuten einen großen Fortschritt; ohne sie wäre das Wollfett niemals aus seiner Vergessenheit gezogen worden. BECKURTS bezeichnete aber die Patentierung der Vermischung von Wollfett mit Wasser als einen Eingriff in pharmazeutische Rechte.
Die Gewinnung von Potasche aus Wollschweiß erfanden MAUMENÉ und ROGELET (1859) und H. FISCHER (vgl. F. FISCHER, Dingl. polyt. Journ. 218, 484). Die erste Anregung dazu gaben KURRER und WESTRUMB 1831.
Lit. LIEBREICH, Brit. Med. Journ. 1896. — WULFSBERG, Geschichtl. Not. über Oesypum. Therapeut. Monatsh. 1887. — VULPIUS, Zur Gesch. d. Lanolins. Arch. Pharm. 1888. — TH. HUSEMANN, Zur Vorgeschichte des Lanolins. Janus 1897 (ausführliche Darstellung).
b) Insektenwachse.
Eine große Zahl niederer Tiere, besonders Insekten, besitzen die Fähigkeit, wachsartige Substanzen auszuscheiden (häufig neben Zucker). Bisweilen sind die Ausscheidungen so beträchtlich, daß sie in größerer Menge gewonnen werden können. So entstammt das im Schellack (s. d.) enthaltene Wachs zweifellos dem Tier und auch das chinesische Wachs ist ein Insektenwachs. Besonders sind wachsausscheidend die zu den Hymenopteren gehörenden Apiden (Immen), zu denen die Bienen (Apinae), Hummeln (Bombinae), die Trigonae und Meliponae gehören. Ferner sind wachsausscheidend von den Hemipteren die Cicaden (z. B. Cicada laternina) und die Wachsschildläuse (z. B. Coccus ceriferus), die Blutlaus u. and. Die Hauptbestandteile dieser Wachse sind schwer verseifbare Ester der höheren Fettsäuren (Wachssäuren) mit einwertigen Alkoholen mit hohem Kohlenstoffgehalt (Wachsalkoholen, s. oben S. 548). Oft treten homologe Glieder der Reihe nebeneinander auf und daneben Kohlenwasserstoffe.
Lit. betr. Insektenwachs zusammengestellt bei FÜRTH, Vergleichend. Chem. Phys. d. nied. Tiere 1903 und PILLIER, Hist. nat. et chim. des cires d’insectes. Thèse Paris.
[S. 757]
Cera Flava.
Cera citrina, Bienenwachs, gelbes Wachs, cire d’abeilles, cire jaune, beeswax, yellowwax.
Etym. Wachs (mhd.) — ahd. wahs, anord. vax, angels. weahs, engl. wax, ndl. vaas. Der Zusammenhang mit wabe ist unsicher (KLUGE). SCHRADER stellt die Gleichung auf: gr. κηρός, lat. cêra, lit. koris, ahd. wahs (altsl. voskû, lit. waszkas). — Wachs heißt ägyptisch: mnḥ (die hieroglyphischen Zeichen I, S. 470). — Propolis = Vorstadt, hier wohl = Vorbau, da man früher von der (irrigen) Ansicht ausging, daß die Bienen zuerst die Propolis auf die Wand streichen und daran die Waben befestigen (KÜSTENMACHER).
Stammtier. Das gewöhnliche Bienenwachs stammt von der Hymenoptere Apis mellifica L. (A. mellifera, cerifera, domestica, gregaria) und deren Rassen und Varietäten.
Von A. mellifica unterscheidet man gewöhnlich 6 Rassen: 1. die einfarbig dunkle deutsche Biene (A. mellifica im engeren Sinne) im nördlichen Europa bis 61° n. B., in Mitteleuropa und einigen Gegenden Südeuropas und Nordafrikas. Hierher gehört auch die griechische oder Hymettusbiene (A. Cecropia). 2. Die bunte südeuropäische mit gelbem ersten Hinterleibssegment in Südfrankreich und Westasien. Hierher gehört die norditalienische Biene (A. ligustica), die 1853 in Deutschland eingeführt wurde. 3. Die gebänderte ägyptische Biene (A. fasciata) in Ägypten, Arabien, Syrien, Himalaya, China, 1864 in Deutschland eingeführt. 4. Die afrikanische Biene (A. Adansonii) mit graugelber Behaarung, in Afrika bis zum Kap, nicht in Nordafrika. 5. Die schwarze madagassische Biene (A. unicolor) in Madagaskar und Mauritius. 6. Die amerikanische (A. pallida). Die Rassen können sich untereinander paaren. Sie zerfallen wieder in Varietäten. Von der deutschen unterscheidet man z. B. die Lüneburger Heidebiene, die krainische, die niederösterreichische. Das britisch-indische beeswax stammt von Apis dorsata FABR., A. indica FABR., A. florea FABR. und Melipona- (Trigona)arten (HOOPER). A. dorsata und florea sind beide wildlebend und nicht domestizierbar. Auch von anderen Bienen, besonders wilden, wird da und dort (z. B. in Niederl. Indien, in Guadeloupe u. and.) Wachs gewonnen.
Die Arbeitsbienen sind geschlechtlich funktionslos gewordene Weibchen. Die Drohnen (von Dröhnen, Summen) sind männlich, die Königin (Weisel, wohl eigentlich Weiser) weiblich — ausschließlich «Eierlegmaschine». Ein mittelstarkes Bienenvolk hat etwa 30000 (kleinere 12–24000, starke 70–100000) Arbeiterinnen, 2000 (kleinere 600–1000) Drohnen und eine Königin. Die Arbeiterinnen bauen die Waben, pflegen die Eier, füttern die Brut, die Drohnen sowie die Königin, deckeln die vor der Verpuppung stehenden Larven und helfen den ausschlüpfenden jungen Bienen beim Verlassen der Zellen. Sie allein fliegen auf «Tracht», d. h. sammeln Nektar, Pollen, Wasser und Propolis und speichern Honig, Pollen und Propolis im Wachsbau auf. Letztere werden im Körbchen eingebracht. Das «Körbchen» ist eine Mulde auf der Außenseite der Hinterschienen, von langen Wimperhaaren umstellt, in das die Arbeitsbiene bei ihren Blütenbesuchen den Pollen, beim Sammeln an harzenden Pflanzen das Kittwachs zu einem Klümpchen, dem «Höschen» zusammenstreicht. Es fehlt der Königin und Drohne, die auch keine «Zange» zum Abnehmen der Wachsblättchen besitzen. Die Pollenhöschen, die oft aus verschiedenen Pollenarten bestehen, werden von der Arbeiterin von den Hinterbeinen in eine Arbeiterzelle abgestreift, bis diese gefüllt ist. Die Masse wird mit dem Kopf festgestampft und bisweilen mit Honig übergossen. «Der Bedarf an Blütenstaub erreicht nicht den Verbrauch an Honig. Immerhin scheint der Instinkt, ihn über Bedarf zu sammeln wie den Honig auch den Bienen volksgesunder Stöcke nicht zu fehlen» (STADLER). Jüngere Trachtbienen sammeln in der ersten Zeit ihrer Ausflüge vorwiegend Pollen. Auch sonst bringt die Arbeiterin bald entweder Pollen oder Nektar heim. Den Pollen führt die Biene mit den Oberkiefern der Mundöffnung zu. Die Arbeiterinnen säubern auch den Stock von Kranken und Toten, verteidigen den Bau mit ihren Kiefern gegen Eindringlinge und ventilieren den Bau mit ihren Flügeln. Sie arbeiten sich so ab, daß sie nicht länger als 6 Wochen leben. Nur die im Herbst ausschlüpfenden, überwinternden gehen erst während der Frühjahrsarbeit ein.
[S. 758]
Die etwa 3 Monate alt werdenden Drohnen beteiligen sich nicht an den Arbeiten des Stockes. Eine Drohne befruchtet im «Hochzeitsflug» die Königin. Nachdem die Haupttracht vorüber, werden die Drohnen von den Arbeitern aus dem Bau entfernt (Drohnenschlacht).
Eine Königin kann zur Zeit der Haupttracht in 24 Stunden 2000–3500 Eier ablegen, in 4–5 Jahren (so alt kann sie werden) viele hunderttausende. Doch legt sie stets nur je ein Ei in je eine Zelle. In Arbeiter- und Weiselzellen legt sie befruchtete, in Drohnenzellen unbefruchtete Eier, die sich aber parthenogenetisch entwickeln.
Lit. SCHMIEDEKNECHT, Apidae europaeae 1882–86. 2 B. — COWAN, Die Honigbiene (aus dem Engl.) 1891. — HESS, Die Feinde der Biene 1887. — V. BERLEPSCH, Die Biene und ihre Zucht 1873, und Die Biene nach ihrem jetzigen ration. Standp. (3. Aufl. von Vogel 1891). — DATHE, Lehrb. d. Bienenzucht. 5. Aufl. 1892. — WITZGALL, Das Buch von der Biene 1906. — BESSLER, Illustr. Lehrb. d. Bienenzucht. Stuttgart 1896. — BEAUREGARD, Mat. med. zool. 1901. — KRAMER-THEILER, Der schweizerische Bienenvater. 7. Aufl. 1910 (darin auch die Feinde d. B.). — BUTTEL-REEPEN, Die stammesgeschichtl. Entstehung d. Bienenstaates und: Sind die Bienen Reflexmaschinen? — FOREL, D. Sinnesleben der Insekten. 1910. — HANS STADLER, Die Biologie d. Biene. 1911. — H. VOGT, Geometrie u. Ökonomie d. Bienenzelle. 1911. — Gute Übersicht über die Morphologie der Biene in: ZANDER, Der Bau der Biene. Stuttgart 1911. — Viele und gute anatomische und morphologische Details der Biene in SNODGRASS, The anatomy of the honey bee. U. S. Dep. Agric. Bur. Entomol. 1910. Bull. No. 18. — Vgl. auch den Artikel Honig S. 8.
Entstehung. Aus welchen Stoffen das Wachs in den Bienen gebildet wird wissen wir nicht bestimmt. Die einen (LIEBIG, G. BUCHNER) nehmen an, daß es aus Kohlehydraten, namentlich Zucker, umgebildet werde — HANRIOT hat für die Überführung von Hexosen in Wachs Formeln erdacht —, die anderen (VOIT, BERLEPSCH), daß Eiweißkörper die Muttersubstanzen sind, noch andere (SWAMERDAMM, MARALDI, RÉAUMUR, HOPPE-SEYLER) sind der Ansicht, daß es von den Bienen fertig gebildet aus den Pflanzen aufgenommen und nur in reiner Form abgeschieden werde. Gegen letztere Ansicht spricht, daß Bienen angeblich auch bei wachsfreier (gibt es diese?) Nahrung wenigstens einige Zeit Wachs zu produzieren vermögen (SCHNEIDER), was freilich schwer zu kontrollieren ist. Immerhin ist zu berücksichtigen, daß das Pollenin (s. S. 472) der Pollenkörner, das dem Korke offenbar sehr nahe steht, jedenfalls wie dieses auch wachsartige Substanzen enthält, die von der Biene verarbeitet und vielleicht einige Zeit gespeichert werden können (TSCHIRCH) — daß Pollenkörner Wachs enthalten wußte schon PROUST. Auch sonst kommen die Bienen ja vielfach mit den Wachsüberzügen der Pflanzen in Berührung. Auch gibt zu denken, daß das Bienenwachs und das Pflanzenwachs chemisch sehr nahe verwandt sind (s. Carnaubawachs). Meist wird jetzt das Wachs als ein Produkt der Überernährung der Biene mit Honig und Pollen betrachtet und als aus dem Honig umgebildet (HUBER 1793, HUNTER). Man hat sogar berechnet, daß für 1 kg Wachswabe 10 kg Honig konsumiert werden müssen und daraus gefolgert, daß der Honigertrag durch den Wachsbau empfindlich geschmälert würde, daher eben künstliche Waben eingesetzt, die aber in erster Linie den Zweck haben, der Biene die volle Ausnutzung der Einsammeltage zur Honigproduktion zu ermöglichen. Zu denken gibt die mir von Imkern hervorgehobene Tatsache, daß die Biene jederzeit zum Wachsbau angeregt werden kann, und daß der Wabenbau außerordentlich rasch erfolgt. Das sieht fast darnach aus, daß sie das Wachs produziert. Aber freilich, an Pollen ist ja immer Vorrat vorhanden. Die Biene hat bekanntlich einen eigenen Pollenmagen und speichert auch im Bau Pollen und anderes Wachsmaterial auf.
HUBER meint freilich, daß Bienen ausschließlich mit Pollen ernährt, niemals Wachs geben, und daß mit Honig ernährte es reichlich produzierten (DUMAS und MILNE-EDWARDS stimmen[S. 759] dem bei). Aber BEAUREGARD bemerkt, daß dies doch nicht so viel heißen solle, daß die Wachsmaterialien der Pflanze gar keinen Einfluß auf die Wachsbildung haben und niemals dazu benutzt werden. Er nimmt also einen vermittelnden Standpunkt ein. Ich nehme an (Schweiz. Wochenschr. 1911 Dez.), daß die Hauptquelle des Bienenwachses die von den Pflanzen stammenden Wachssubstanzen sind, aber zu seiner Bildung die Anwesenheit von Honig nötig ist. Wegleitend ist für mich die Tatsache, daß das Bienenwachs ebenso wie das Pflanzenwachs eigenartige Kohlenwasserstoffe enthält, und daß der Biene stets reichliche pflanzliche Wachsquellen (s. oben) zur Verfügung stehen, aus denen sie mit viel geringerem Energieaufwand wie aus Honig allein Wachs bilden kann.
Die von HORNBORSTEL ausgesprochene Ansicht, daß den Bienen zur Wachsbereitung Honig in genügender Menge zur Verfügung stehen müsse, war schon, wie es schien, durch HUBERS Versuche bestätigt worden. GUNDELACH (1842), V. BERLEPSCH (1854) und DÖNHOFF (1861) suchten dann durch zahlreiche Fütterungsversuche den Nachweis zu erbringen, in welchen Gewichtsverhältnissen die gegebenen Honigmengen und die produzierten Wachsmassen stehen. Die Resultate sind aber so verschieden und weichen von denen späterer Beobachter so stark ab, daß sich ein sicheres Urteil nicht abgeben läßt. Der Punkt ist also auch heute noch strittig (vgl. bei DREYLING a. a. O.).
Wenn ich oben als möglich bezeichnet habe, daß das Wachs, welches die Biene ausscheidet, vorwiegend den von ihr gesammelten Wachsmaterialien der Pflanze entstammt, so ist das doch selbstverständlich nicht so zu verstehen, daß dies Material einfach so wie es ist wieder ausgeschieden wird. Es passiert den Tierkörper, erleidet hier (mit Ausnahme der Kohlenwasserstoffe) eine Umbildung und wird dann in veränderter Form von den Wachsdrüsen abgeschieden. Ich stütze mich hierbei unter anderem auch auf die Tatsache, daß wir Cerotinsäure und Melissylalkohol sowie Kohlenwasserstoffe sowohl in Pflanzenwachsen wie im Bienenwachs finden und daß z. B. der in Pflanzenwachsen gefundene Myricylalkohol völlig identisch ist mit dem aus Bienenwachs isolierten.
18–24 Stunden nach der Aufnahme der Nahrung, die in dem zuckerhaltigen Nektar und dem Pollen der besuchten Blüten besteht, erfolgt bei den Arbeitsbienen an den vier letzten Bauchringen, den sog. «Spiegeln», die den Drohnen fehlen, und zwar in der sog. Wachsmembran, einer Schicht epithelialer Zellen, welche zwischen der Cuticula und der inneren membranösen Auskleidung der Bauchsegmente liegen (CARLET), die Ausscheidung des Wachses in Form kleiner länglich-runder Lamellen, von denen acht etwa 0,0015 wiegen (DUMAS). Aus diesen bauen die Arbeitsbienen die sechseckigen Zellen in die sie dann den aus dem Nektar gebildeten Honig (s. S. 9) entleeren, «erbrechen».
DREYLING faßt seine Untersuchungen über die wachsbereitenden Organe der gesellig lebenden Bienen (1905), wie folgt, zusammen: «Die Arbeiterinnen der Honigbiene scheiden das Wachs durch besonders ausgebildete Drüsen («Hautdrüsen») an den vier letzten Ventralplatten des Abdomens aus. Die Anlagen der Wachsdrüsen sind bereits im Puppenstadium sichtbar, erreichen bei der ausgebildeten Biene einen gewissen Höhepunkt und degenerieren mit zunehmendem Alter allmählich. Die Sekretionsfähigkeit der Wachsdrüsen hängt mit dem Bau derselben innig zusammen. Das Wachs gelangt durch die Poren auf die Außenseite des Spiegels, wo es sich in Form kleiner Plättchen ablagert.» Die Wachsdrüsen (Fig. 230) zeigen eine auffallende Ähnlichkeit mit den Drüsenflecken der Pflanzen, z. B. bei Capsicum (TSCHIRCH). Die Wachsdrüsen bringen also nur eine gewisse Zeit das Wachs hervor. Sie sind bei den jüngsten Bienen noch nicht ausgebildet, bei Trachtbienen schon wieder zurückgebildet. «Das «Wachsschwitzen» liegt also einer bestimmten Altersklasse der weiblichen Bienen ob, einer Altersklasse, die noch nicht auf Tracht ausfliegt, sondern noch zu den Stockbienen gehört.»
«Beim Bau der Waben ziehen die Bienen mit den Hinterfüßen sich selbst oder (meist) anderen Bienen die Wachsblättchen aus den Bauchringen hervor, zerkauen[S. 760] und bespeicheln sie und bringen sie dort an, wo sie eine Wabe beginnen oder weiterführen wollen.» Um die für die Wachsbildung nötige Temperatur (c. 35°) zu erzielen, legen sich die Bienen in einem Haufen übereinander. Der Wabenbau erfolgt besonders im Frühling (Mai, Juni). Die neugebauten Waben sind schneeweiß, sie werden aber bald gelblich. Der Honig wird in verlängerte Arbeiter- und Drohnenzellen entleert. «Bei einem Schwarm mit noch unbefruchteter Königin bauen die Bienen zarte weiße Waben in der Farbe, wie sie das Wachs an den Bauchdrüsen ausschwitzen, das sog. Jungfernwachs, und erst, wenn die Befruchtung der Königin gelungen und Brut eingeschlagen wird, fangen die Waben an sich zu färben» (KÜSTENMACHER).
Wachsbildung bei der Honigbiene.
1 Sagittalschnitt durch das Abdomen bei den vier hinteren Ringen (R) mit den Wachsdrüsen (wdr). 2 Wachsdrüse stärker vergrößert. 3 Teil einer Wachsdrüse stark vergrößert. Die subcuticulare Wachsbildung (w) ist deutlich.
[Nach Dreyling.]
Zwei Waben mit einer Wabengasse dazwischen, die unten im Brutraum (b) zwei, oben im Honigbogen (h) einer Biene Raum gibt.
[Nach Stadler.]
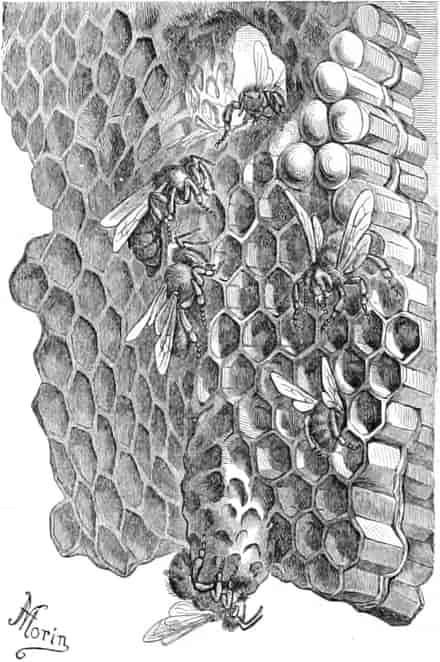
Die Biene bei der Arbeit; rechts oben gedeckelte Zellen, unten eine Königinzelle.

Oben: Honigbogen (Halbkreis). Mitte: Geschlossene Arbeiterbrut (oben offen, die Hauptmasse gedeckelt). Unten: Drohnenbrut, zumeist offen.
[Aus Stadler, Biologie der Biene.]
Der Bau der Wachswaben beginnt an der Decke. Zunächst wird eine Vertikalwand gezogen. Bei den in dichten Guirlanden von der Decke hängenden Arbeiterinnen nimmt die vorderste von ihren Bauchschuppen ein Wachsplättchen ums andere in die Wachszangen ihrer Hinterbeine und von hier in die Klauen der Vorderbeine, erfaßt sie mit den Oberkiefern, knetet sie und klebt sie an die Decke. Die ihr zunächst hängende reicht ihr dann mit den Kiefern ihre Wachsschüppchen zu und die erste baut damit weiter. «So wandern durch die ganze Bienenkette die von den einzelnen Tieren geschwitzten Wachslamellen vor zu der vordersten. Da mehrere Ketten gleichzeitig arbeiten, so sind es gewöhnlich auch mehrere Wabenanfänge (3–4), die zu gleicher Zeit aufgeführt werden. Sobald die Fundamente gebaut sind, lösen sich die Ketten auf und es arbeiten von nun ab zahlreiche Bienen zugleich an der Vergrößerung und dem Ausbau der Waben. Dabei ziehen sich die bauenden Arbeiterinnen nun auch gegenseitig mit den Kiefern die Wachsplättchen zwischen den Bauchringen hervor». Die auf die vertikale «Mittelwand» von beiden Seiten her in großer Zahl aufgesetzten «Zellen» sind hohle sechsseitige, mit einer Kante nach unten gerichtete Säulen, die nicht genau horizontal, sondern etwas gegen die Mittelwand geneigt, angelegt werden (Fig. 231), deren Wand etwa 0,1 mm dick ist (gegen die Mittelwand dicker) und die durch einen Deckel verschlossen werden (Fig. 232 u. 233). Der Zellverband ist die Wabe. Zuerst werden immer nur Arbeiterzellen gebaut (Arbeiterwaben, Arbeiterbau) als Brutstätten für die Eier, aus denen Arbeiterinnen hervorgehen, sowie zur Aufnahme[S. 761] von Pollen und Honig. Der größte Teil eines Stockes besteht aus Arbeiterwaben. Die Arbeiterbrutzelle ist etwa 12,5 mm, die als Honigzelle benutzte Arbeiterzelle 5,7–39,5 (meist 16–17) mm tief (lang) und mißt von Wand zu Wand c. 5,16 mm. Sobald das Volk «an Vermehrung denkt», werden auch Drohnenzellen gebaut, die beträchtlich größer sind (6,87 : 18,75 mm) und durch Übergangs-, Flick- oder Schaltzellen angeschlossen werden, sowie schließlich die in beschränkter Zahl (höchstens 30 pro Volk) angelegten, bis 24 mm großen, unregelmäßig eichelförmigen Weiselzellen (Weiselwiege) für die Königin (Fig. 232), in denen die weiblichen Larven erbrütet werden. Ihre Öffnung liegt nach unten. Während die Weiselzelle nur einmal benutzt und ihr Wachs weiter verwendet wird, verleben in den Arbeiter- und Drohnenzellen Dutzende von Generationen ihre Larvenzeit. Die einzelnen Zellenbaue (Waben) stehen in parallelen, durch Wabengassen getrennten Reihen nebeneinander (Fig. 231) — die Mittelwände fast genau 3,5 cm voneinander entfernt. Sie sind an der Decke und an den Seiten, bisweilen, aber nicht immer, auch unten durch besonders starke, aber fünfeckige «Heftzellen» befestigt. Im modernen Rähmchenbau (Mobilbau) werden die Mittelwände künstlich gezogen (Kunstwabe) und dadurch der Bau regelmäßiger. Die Waben enthalten die Brut, den Honig und den Pollen. Der mittlere Teil des Stockes besteht meist aus Brutwaben, über denen die nur Honig enthaltenden Zellen des «Honigbogens» (Fig. 233) liegen, die Drohnenzellen liegen zu unterst. Sind die Waben hoch genug, so füllt die Biene bisweilen auch in die gleiche Zelle unten Brut und oben Honig. Reine Pollenwaben gibt es für gewöhnlich nicht. Die Honigzellen sind meist «vertiefte», d. h. verlängerte (und bisweilen sehr stark verlängerte) Arbeiterzellen. Alle Honigzellen werden gedeckelt, aber auch die Brut-, Drohnen- und Weiselzellen erhalten meist Deckel. Junger Wabenbau ist sehr zerbrechlich. Er wird erst durch die sich den Wachszellen anschmiegenden Cocons («Nymphenhäutchen») der Larven derber, besonders wenn zahlreiche Larven nacheinander die gleiche Zelle benutzten. Die anfangs weißen Waben sollen sich «infolge der Stockausdünstung» gelb färben. Alte Waben sind fast schwarz. Die Arbeitsbienen entleeren[S. 762] ihren Koth nie im Bau, das tun nur die Drohnen und die Königin. Er wird aber von den Arbeiterinnen entfernt, die überhaupt den ganzen Bau rein halten. Um den Fortpflanzungstrieb der Biene zu beschränken und den Sammeltrieb zu begünstigen, wird jetzt oft der Stock in zwei Abschnitte getrennt, einen Brutraum, in welchem die Königin die Eier ablegt, die dann durch die Arbeiterinnen bebrütet werden und einen Honigraum, in dem die Arbeiterinnen den Honig ablegen. Beide werden durch ein Absperrgitter getrennt, das so enge Maschen hat, daß nur die Arbeiterinnen, nicht Drohnen und Königin es passieren können. Die im modernen Mobilbau, der den alten Stabilbau (die Bienenkörbe usw.) immer mehr verdrängt, in auswechselbaren Rähmchen sich befindenden Honigwaben werden jetzt meist, nachdem sie entdeckelt wurden, in der Honigschleuder zentrifugiert und die entleerten Waben wieder in den Bau gehängt. Dies erspart den Bienen den Bau neuer Wachszellen, konzentriert ihre Arbeit auf die Honigernte, drückt aber natürlich die Wachsproduktion herab.
Drei Erfindungen haben die Imkerei unserer Zeit mächtig gefördert: der Mobilbau, die Kunstwabe und die Honigschleuder.
Lit. Wachsbildung: CLAUS, Über d. wachsbereitenden Hautdrüsen der Insekten. Ges. z. Bef. d. ges. Naturw. Marburg 1867. — CARLET, Le cire et ses organes sécréteurs. La Naturaliste 1890. — L. DREYLING, Die wachsbereitenden Organe bei den gesellig lebenden Bienen. Diss. Marburg 1905 (dort auch die ältere Lit.).
Der Blütenstaub wird verzehrt oder durchgearbeitet und aufbewahrt und bildet das sog. Bienenbrot oder wird auf Propolis verarbeitet. Außer den genannten Substanzen sammeln die Bienen angeblich besonders von harzausscheidenden Blattknospen der Erlen, Akazien, Pappeln, Roßkastanien, Birken, Eschen, Bisampappel, Mandel, Brombeere, Distel, Männertreu, Lein, Balsamine usw., das Gummiharz der Kolleteren und das Sekret anderer Drüsenhaare und verarbeiten dies zu dem sog. Kleb-, Stopf- oder Vorwachs, der Propolis, welches sie zum Verkleben der Löcher, besonders als Schutz gegen Zugluft, wogegen die Bienen sehr empfindlich sind, und zum Einhüllen von in den Stock eingedrungenen Fremdkörpern benutzen. Auch wurde schon oft bemerkt, daß die Bienen an dem Gummifluß der Prunoideen, am Harze des Sägemehls, ja am Peche der Bierfässer nagen (DIETERICH), das sie dann ebenfalls zu Propolis verarbeiten. Nach der Ansicht KÜSTENMACHERS, der richtig bemerkt, daß die Kolleteren der Winterknospen nicht in Betracht kommen können, da sie im Sommer abgeworfen sind, «besteht Propolis aber aus dem Öl resp. Balsam von der Oberfläche der Pollenkörner, dem von den Bienen noch Wachs und als Füllstoff alter Pollen und allerlei Gemüll aus dem Bienenstock in variabler Menge zugesetzt wird». Die Wahrheit liegt vielleicht in der Mitte und die Biene verwendet alles ihr erreichbare harzartige Material. Dafür spricht die außerordentlich unregelmäßige Zusammensetzung der Propolis (KÜSTENMACHER fand z. B. Zimtalkohol und Zimtsäure darin, DIETERICH nicht).
Gelegentlich der Entleerung des Honigs aus den Waben, der durch einfaches Auslaufenlassen, oder durch Abpressen, Ausschleudern oder Zentrifugieren geschieht, gewinnt man nun auch als Nebenprodukt das Wachs (Wachsernte). Die entleerten Waben werden in heißem Wasser zusammengeschmolzen und die Masse dann in Formen oder Erdlöcher gegossen. Dieses Rohwachs, das mancherlei Verunreinigungen (tote Bienen und deren Teile, Nymphenhäutchen, Pollenkörner, Sand, Staub, Erde, Pflanzenteile usw.) enthält — besonders die überseeischen Wachse enthalten oft viel Erde — und in Blöcken (Vergl. I. Fig. 258), Kuchen, Broten oder Stangen im Handel ist, wird in Säcken, Kisten oder Körben versandt. Die Wachsproduktion geht durch Aufgabe des Stabilbetriebs zurück.
Das Rohwachs wird durch Umschmelzen mit Wasser über direkter Feuerung oder mit Dampf gereinigt (gereinigtes, geklärtes, geläutertes, raffiniertes Wachs). Das Erhitzen erfolgt meist in Holzfässern mit direktem Dampf, die Masse wird dabei durch Rührwerke gut durchgemischt und dem Wasser meist etwas Schwefelsäure, Salzsäure oder Oxalsäure zugesetzt. Das Ganze wird zum Absetzen der Verunreinigungen lange geschmolzen gehalten. Dann zieht man das obere klare Wachs mittelst Hähnen[S. 763] in Formen ab. Die unteren Partien liefern das Schmutz- oder Kotwachs (Wachskot). Es wird nochmals umgeschmolzen, das Klare abgezogen, die Rückstände mit Stroh geschichtet in Topfpressen ausgepreßt (Preßwachs), die Preßrückstände mit Benzin oder anderen Lösungsmitteln extrahiert (Extraktionswachs). Für pharmazeutische Zwecke ist nur das beste Wachs verwendbar.
Über die Gewinnung des Bienenwachses berichtet mir Herr Apotheker WARTMANN-Biel (Schweiz), der eine große Bienenzucht (c. 100 Völker) besitzt. «Das wachshaltige Material, das sich bei der Pflege der Bienen und der Gewinnung des Honigs ergibt, kann in zwei Gruppen geteilt werden:
1. die vor dem Ausschleudern der Honigwaben mit scharfem Schnitt abgetrennten Wachsdeckel der Zellen, meist mit etwas Honig vermischt; dann etwaige unregelmäßig ausgeführte unbebrütete, noch weiße Wabenstücke, sowie Wachsteile, die von den Bienen oft zwischen und außer den Rahmen abgelagert sind;
2. die seit kürzerer oder längerer Zeit im Brutnest benutzten Waben, durch die in den Zellen zurückgelassenen Kokonhäutchen dunkel gefärbt. Wenn auch regelmäßig gebaute Waben trotz einer mehrmaligen Bebrütung innert eines Sommers für zehn und mehr Jahre benutzt werden können, so ist eine schrittweise Erneuerung der Brutwaben doch angezeigt, — wozu dann noch etwaige Bruchstücke kommen.
Da das erstgenannte Material zum größten Teil aus Wachs besteht, ist dessen Verarbeitung eine einfachere und wird mit Vorteil unter Mithilfe der Sonnenwärme in dem sog. Sonnwachsschmelzer, einem nach oben mit einem gegen die Sonne geneigtem Fenster geschlossenem Holzkasten vorgenommen. Auf ein geneigtes Blech gibt man die Wachsabfälle und infolge der unter dem Fenster entstehenden Wärme (bis zu 70 Grad) fließt das reine Wachs unter Zurücklassung der nichtschmelzbaren Bestandteile in ein untergestelltes Gefäß. Um das Produkt von etwa eingeschlossenem Honig, der mit abgeflossen, zu befreien und das Ganze zu einer gleichmäßig gefärbten Masse zu vereinigen, schmilzt man es am besten in einer Email- oder Messingpfanne unter Zusatz von etwas Wasser auf ganz gelindem Feuer und läßt möglichst langsam erkalten. Etwaige Unreinigkeiten sammeln sich an der unteren Fläche des Kuchens und können davon abgekratzt werden. — In Ermangelung eines Sonnwachsschmelzers oder der Sonnenstrahlen werden die gleichen Abfälle mit dem mehrfachen Wasser unter Umrühren geschmolzen und durch ein ziemlich dichtes Gewebe geseiht. Auch hier kann nach dem möglichst langsamen Erkalten der Kuchen auf der Unterseite vollends geputzt werden. — Auf beiden Wegen wird nur verhältnismäßig wenig Rückstand verbleiben.
Umständlicher gestaltet sich die Verarbeitung der zweiten Gruppe, da in diesen alten Waben höchstens 20–40 % reines Wachs enthalten ist und zudem in den durch die sich trennenden Kokonbecher zurückgehalten würde, wenn nicht noch in warmem Zustand eine Pressung darauf ausgeübt würde. Dies wird auf nachfolgende Weisen erreicht:
Die Wabenstücke werden zerkleinert in einen lockeren Sack eingeschlossen und dieser in einem großen Kessel Wasser unter Beschwerung mit Steinen und Kneten mit einem Stück Holz oder desgleichen erhitzt. Das sich im Laufe der Behandlung auf dem Wasser ansammelnde Wachs kann dann entweder gleich oder erst nach dem Erkalten abgeschöpft werden.
Hölzerne Wachspresse.
[Aus Kramer-Theiler, Bienenvater.]
Auch wird die Masse offen mit viel Wasser zu einem dünnen Brei erhitzt und möglichst heiß und rasch durch einen Sack gegossen und dieser auf verschiedene Art ausgepreßt. Entweder wird die Holzpresse (Fig. 234) erst mit heißem Wasser vorgewärmt oder man verwendet[S. 764] die sog. Dampfwachspresse (Fig. 235), bei der der Preßraum in einem doppelwandigen Kessel durch Wasserdampf erhitzt wird, während durch die Spindel das Wachs aus der Masse gedrückt wird. — In allen diesen Fällen ist ein Umschmelzen des ersten Produktes und Trennung von mitgerissenem Bodensatz, wie schon oben erklärt, nötig. Da bei steter Gegenwart von Wasser ein Überhitzen fast unmöglich ist, so lässt das Produkt nichts zu wünschen übrig, sofern jede Benutzung von eisernen Gefäßen vermieden worden ist. — Einen großen Teil des eigenen Wachses verwendet der Imker wieder für Mittelwände (Kunstwaben), auf welche die Bienen dann nur die Zellen errichten, aber in gewollter Richtung und Größe.»

Andermatts neue Dampfwachspresse.
[Aus Kramer-Theiler, Bienenvater.]
Die sogenannte Wachsläuterung wird übrigens auf verschiedene Weise betrieben. In Pommern z. B. kocht man die gesammelten Wachsstoffe im Wasser unter stetem Umrühren auf, läßt die Masse aber nicht überkochen, schüttet sie in einen Spitzbeutel von starker Leinwand und preßt diesen auf einer Flachsbrake, die über einem Gefäß mit Wasser steht. Das flüssige Wachs rinnt da hinein und schwimmt auf dem Wasser. Nachdem es erkaltet ist, erhitzt man es nochmals im Wasser, doch nicht bis zum Kochen, und läßt es in dem Gefäße, das oben weiter als unten sein muß, erkalten, hebt die ganze Platte heraus und schneidet die schmutzigen Teile an der unteren Fläche mit einem Messer ab. Statt der Flachsbrake benutzt man auch zwei entsprechend lange, runde Stäbe von etwa 2½ cm Dicke, hängt den Spitzbeutel, nachdem die aufgekochte Wachsmasse hineingeschüttet ist, mit seinem offenen Ende an einen starken Haken, stellt ein Gefäß mit Wasser darunter, nimmt den Beutel zwischen die beiden Stäbe und preßt die Masse aus, indem man die Stäbe fest zusammendrückt und nach unten zieht. Hat man ein größeres Quantum Wachs zu verarbeiten, so bedient man sich einer «Wachspresse», die in verschiedenen Konstruktionen im Handel sind (THEEN).
Das Bleichen geschieht auf eine im Grunde sehr einfache, aber doch umständliche Weise, welche bisher wenig Veränderungen hat zweckmäßig erscheinen lassen. Das in einem Kessel mit etwas kochendem Wasser geschmolzene geläuterte Wachs wird in Form feiner Blättchen gebracht, entweder indem man es in geschmolzenem Zustande auf eine sich langsam drehende und halb in kaltem Wasser gehende Holzwalze laufen läßt, wobei die dadurch entstehenden dünnen Bänder (gebändertes Wachs) sich im Wasser ablösen, oder indem man von der wieder erstarrten Masse mittelst scharfer Messer ganz feine Späne abschneidet. Ehe man das Wachs schneidet, pflegt man es bisweilen einige Male in Wasser umzuschmelzen, um ihm einen gewissen Wassergehalt einzuverleiben. Schließlich kommen die in Siebkörben herausgeschöpften feinen Blätter auf den Bleichplan und unterliegen hier auf mit Tuch überspannten Drahtnetzen der Einwirkung von Sonne und Luft, je nach der Witterung und der Wachsart[S. 765] kürzere oder längere Zeit, jedenfalls so lange, bis der Farbstoff in ihnen zerstört und das Wachs weiß geworden ist. Ein Zusatz von etwas verdünnter englischer Schwefelsäure zu dem schmelzenden Wachse ist für die Bleichung von günstigem Einfluß. Neuerdings wendet man zum Bleichen des Wachses vornehmlich Kalibichromatschwefelsäure unter Zusatz von Oxalsäure und Einleiten von Dampf, seltener Kaliumpermanganat, Chlorkalk, Terpentinöl und Wasserstoffperoxyd an. Das gebleichte Wachs wird meistens in runden Scheiben von 5 mm Dicke ausgegossen (THEEN). Das Bleichen kann auch mit Walkerde erfolgen, die die färbenden Substanzen aufnimmt (A. MÜLLER-JAKOBI). Bei der Rasenbleiche wird das geschmolzene Wachs in Wasser gegossen, die dünne Scheibe abgehoben und unter Begießen an der Sonne gebleicht. In Laibach (Krain) beschäftigen sich mehrere Firmen mit dem Bleichen ägyptischen Wachses (G. und R. FRITZ).
Hauptproduktionsländer sind:
In Europa: Deutschland (Bayern, Hessen, Hannover, Norddeutsche Heide, Holstein, Pommern), Krain, Schweden, Türkei (Konstantinopel) und Rumelien, Bosnien, Slavonien, Moldau, Walachei, Rußland (Ukraine, Podolien), Polen (Galizien), Italien (Venetien: Belluno, Mailand, Livorno), Frankreich (Marseille, Languedoc, Somme, Bourgogne, Gatinois, Nord, Alpes, Landes, Bretagne, Normandie, Corsica), Portugal, Spanien, Schweiz.
In Asien: Smyrna, Syrien (Beirut, Aleppo, Alexandrette), Palästina, Persien, Singapore, Ceylon, Tonkin, Rangoon, Vorderindien (Bengalen, Panjab, Zentralprov., Bombay, Berar, Madras), Assam, Kashmir, Burma, Tahiti.
In Afrika: Tunis, Algier, Marocco (Mogador, Mazagan), Sierra Leone, Gambia, Kamerun, Senegal (Conakry), Angola, Benguela, Mossamedes, Senegambien (Bissao), Deutsch-Ostafrika, Mozambique, Mombassa, Sansibar, Madagascar, Ägypten (Alexandrien, Cairo), Abyssinien.
In Amerika: Carolina, Californien, Mexiko, Cuba (Habana), St. Domingo, Haiti, Brasilien, Argentinien, Chile (Valparaiso).
In Australien: Melbourne, Sidney.
Haupthandelsplätze sind Algier, Triest, Wien, Genua, Marseille, Havre, London, Liverpool, Lissabon, Hamburg, Bremen.
Auf dem deutschen Markt ist afrikanisches, indisches, madagassisches, ostasiatisches und mittel- und südamerikanisches Wachs. Das Deutsch-Ostafrikanische erfreut sich steigender Beliebtheit. Von einer Gesamteinfuhr von 1421500 kg Wachs nach Hamburg im Jahre 1904 stammten 151000 kg dorther. Britisch-Indien exportierte 1906/07: 8162, 1907/08: 5120, 1908/09: 4671 cwts Beeswax. Von indischen Wachs unterscheidet man Gheddawachs, Tonkin (Cochinchina), Rangoon, Anam. Deutschland importierte 1905: 1737000 kg Bienenwachse, 1904: 18248 dz Bienenwachs (incl. and. Insektenwachs), besonders aus Abyssinien und Madagaskar, dann aus Portugal, Deutsch-Ostafrika, Port. Westafrika, Brasilien, Marocco, Brit. Indien, Cuba, Spanien, Port. Ostafrika. Die Vereinigten Staaten importierten 1908: 672437, 1909: 764895 pounds und exportierten 1908: 90506, 1909: 77547 pounds beeswax. Die Einfuhr von Bienenwachs nach London betrug 1908: 2793, 1909: 1361 bls and srns. und 1908: 3148, 1909: 3583 cks and css. Die guten Wachssorten werden jetzt meist «mit Attest» angeboten.
Cera flava ist in Kisten von c. 50 kg, das gebleichte meist in runden Scheiben im Handel.
Eigenschaften. Die Farbe des Rohwachses differiert ziemlich stark. Sie ist hellgelb bei dem Wachse aus der Türkei, von Smyrna, Jaffa und der Levante, aber auch die chilenischen und Belladi- (ägyptischen) Wachse, die von Benguela, Sassi und die schwedischen und einige deutsche sind relativ hell; dunkelgelb ist im allgemeinen das deutsche, belgische, italienische, marokkanische und kubanische Bienenwachs, grünlichgelb das amerikanische und ostindische, rotgelb einige Sorten des französischen und italienischen. Nur die Wachse von Madagascar und St. Domingo sind dunkelbraun fast schwarz. Die Farbe des Wachses hängt nicht mit der Farbe der Blüten zusammen, sondern wohl mit der der Pollenkörner, besonders der eigenartigen, oft stark gefärbten Massen, die oft den Pollenkörnern anhängen und die z. B. bei Verbascum tief orangerot[S. 766] gefärbt sind (TSCHIRCH, vgl. oben S. 21). Auch KÜSTENMACHER sagt: «Die ausgeschiedene Propolis, der Balsam des Pollens, gibt dem Wachsbau des Biens die Farbe.»
Der Geruch ist verschieden. Die europäischen Sorten riechen angenehm honigartig, einige italienische und indische haben einen schwer definierbaren «Blumengeruch», die amerikanischen und afrikanischen riechen oft muffig. Von einem eigenen Geschmack kann man meist nicht sprechen. Beim Kauen klebt es nicht an den Zähnen (Kauprobe, Unterschied von verfälschtem Wachs).
Bienenwachs bildet durchscheinende, auf dem Bruche feinkörnige, in der Kälte spröde und brüchige Massen, die in der warmen Hand knetbar werden. Aber die einzelnen Wachssorten sind sehr verschieden hart, manche sogar fast schmierig (Marocco). Sehr hart sind Mozambique-, Haiti-, plastisch (strong) das Gheddawachs. Wachs hat einen hohen Ausdehnungskoeffizienten und brennt, da ihm das Glycerin fehlt, ohne Geruch zu verbreiten, oder beim Auslöschen zu stinken, wie dies bekanntlich die Unschlittkerze tat. Es löst sich in der Wärme in Äther, Benzol, Chloroform, Benzin, Schwefelkohlenstoff und ätherischen Ölen, besonders gut in Tetrachlorkohlenstoff. Bei gewöhnlicher Temperatur löst Äther c. 50%, Chloroform c. 25% (BUCHNER, ROBINEAUD, A. VOGEL). In Wasser und kaltem Alkohol ist es nahezu unlöslich. Bienenwachs verändert sich mit der Zeit kaum. Ein aus dem Jahre 1610 stammendes Stück (aus einer Pariser Büste) stimmte mit unserem heutigen Bienenwachs überein (PINKUS).
Die reine Propolis (Pissoceros des PLINIUS) ist sehr weich und besitzt große Klebkraft, sie ist stark aromatisch und schmeckt bitter. Die ältere mit Wachs und Gemüll zusammengeknetete Propolis (die Propolis des PLINIUS) ist dunkler, nicht mehr so stark klebend und unter 15° brüchig. Die ältesten, mehrere Jahre alten äußeren Propolisschichten (Gummigrund, commosis des PLINIUS) sind sehr fest und spröde, fast schwarz, erst beim Erwärmen riechend (KÜSTENMACHER).
Chemie. JOHN unterschied das Cerin vom Myricin und BUCHOLZ und BRACONNOT fanden im gelben Wachs 90% Cerin, 8% Myricin und 2% balsamisch-fettigen Stoff.
Das Bienenwachs zeigt, gleichviel aus welchem Lande es stammt, ziemlich übereinstimmende Zusammensetzung auch in dem relativen Verhältnis der Bestandteile (nur ostindisches Wachs weicht stärker ab, es enthält mehr Wachsester und bei dem ostafrikanischen ist eine Verschiebung zwischen den verseifbaren und unverseifbaren Anteilen zu beobachten, BUCHNER). Es besteht vornehmlich aus Palmitinsäure-, Myricyl-(Melissyl-)ester (Myricin BRODIE 1848), C15H31.CO—O.C31H63, und sog. roher Cerotinsäure (Cerin), d. h. Cerotinsäure (C26H52O2, BRODIE formulierte die Cerotinsäure: C27H54O2, SCHALFEJEW: C34H68O2, NAFZGER: C30H60O2 oder C31H62O2, MARIE: C25H50O2), die 30–40% der Cerotinsäure homologe Säuren enthält (T. MARIE), sowie Kohlenwasserstoffen, von denen das Heptacosan (C27H56, F = 60,5) und das Hentriacontan (C31H64) isoliert wurden (SCHWALB). Daneben finden sich in geringerer Menge Melissinsäure (C30H60O2, nach SCHWALB: C31H62O2), Myricyl-(Mellisyl-)alkohol (C30H62O, nach SCHWALB: C31H64O), Cerylalkohol (C26H54O) und ein weiterer Alkohol, sowie ungesättigte Fettsäuren, ferner wahrscheinlich auch zusammengesetzte Äther der Palmitinsäure, vielleicht auch der Stearinsäure und einer der Oxalsäurereihe angehörenden, bei 44° schmelzenden Säure mit Melissylalkohol, Cerylalkohol und vielleicht auch Cetylalkohol, C16H34O (BRODIE, SCHWALB, NAFZGER, EICHEL); endlich auch ungesättigte Säuren, Farb-, Gerb- und Riechstoffe und eine klebrige, aromatisch riechende Substanz (Ceroleïn), sowie wahrscheinlich auch Cholesterinester und Spuren von Glyceriden.
[S. 767]
Das Verhältnis der freien Säuren (bes. Cerotinsäure) zum Myricin ist 14 : 86 (HEHNER), der Gehalt an Kohlenwasserstoffen 12,7–13% (BUISINE, MANGOLD, 12,5–14,5 KEBLER, 12,8–17,35 HETT und AHRENS, 5–6% SCHWALB), der Gehalt an Fettsäuren 46–47%, der Gehalt an unverseifbaren Stoffen (Kohlenwasserstoffen, Alkoholen) 52–55%. HEHNER fand 12,17–15,71% Cerotinsäure und 85,12–92,08% Myricin. Der aromatische Geruch des Wachses rührt von einem unbekannten «Balsam» her. Er kommt Stoffen zu, die teils in Petroläther unlöslich, teils darin löslich sind. Letztere scheinen Ester zu sein, die Essigsäure, Buttersäure und Valeriansäure, sowie eine ungesättigte flüssige Säure, zum Teil gebunden an cholesterinartige Substanzen (Cholesterinester 0,6% R. BERG) enthalten. Das Wachs von Bienen, die viel in Nadelholzwaldungen schwärmen, enthält Harz, riecht eigenartig, läßt sich nicht leicht bleichen und hängt beim Schmelzen an den Kesselwänden. Den Farbstoff hält KÜSTENMACHER für einen Gerbstoff (?), der sich durch Oxydation immer dunkler färbt, so daß die Wabe braun bis schwarz werden kann (aber doch nicht immer wird). Die Farbe variiert oft stark, wie ja auch der an den Pollenkörnern anhaftende Balsam (s. oben S. 766) bald gelb oder gelbgrün, bald orange oder fast rot ist.
Hummelwachs (von Bombus terrestris) enthält Psyllaalkohol (C33H68O F = 69–69,5), aber keinen Melissylalkohol, keine Cerotin- und Palmitinsäure.
Spez. Gewicht: 0,958–0,970, bei deutschem: 0,960–0,966 (AHRENS und HETT); Schmelzpunkt: 62–66,5° (bei deutschem: 63,5–64,5°); Säurezahl: 16,71 bis 22 (bei deutschem: 18,29–20,44), nach HÜBL: 19–21, meist 20; Verseifungszahl: 82–103,69 (bei deutschem: 82–97, meist 90–93); Differenzahl (von S.-Z. und V.-Z.) = Ätherzahl: 66,16–81,99 (bei deutschem: 72–77), nach HÜBL: 73 bis 76, meist 75; Verhältniszahl (der Säure zu den Estern): 3,02–4,3 (bei deutschem: 3,5–3,9), nach HÜBL: 3,6–3,8 — diese Zahl ist sehr konstant! — Jodzahl: 6,1–13,01 (bei deutschem: 7,5–8); Buchnerzahl (die in 80proz. Alkohol löslichen Säuren brauchen ccm n/10 KOH): 2–6,1 (bei deutschem: 2,6–3,3 BERG); Kohlenwasserstoffe in %: 12,28–17,3. DIETERICH fand (Helf. Ann. 1904): Spez. Gew. bei 15°: 0,962–0,966, Schmelzp.: 64–65°, S.-Z. d.: 19,6–20,53, E.-Z.: 70,99–77,7, V.-Z. h.: 91,21–98. Die Zahlen schwanken also bei den Bienenwachsen der ganzen Erde nur in relativ engen Grenzen. Das spez. Gew. kann durch die auch von der Pharm. helvet. IV aufgenommene sog. HAGERsche Schwimmprobe (Wachstropfen schwimmen in Alkohol bestimmter Konzentration) oder mit der MOHRschen Wage (BOHRISCH und RICHTER) bestimmt werden. KRAMER-Zürich teilte mir mit, daß sowohl die Wabe wie der Honig radioaktiv sind.
Indisches Gheddawachs zeigte abweichende Zahlen S. Z.: 6,01–6,1, Ä. Z.: 76,11–77,2, V. Z.: 82,12–83,3, Verhältniszahl: 12,1–12,6, Jodzahl: 10 (G. BUCHNER). Das Annam-Bienenwachs ist dem indischen ähnlich (BELLIER). Es hat eine höhere Jodzahl und enthält weniger freie und mehr gebundene Fettsäuren als europäisches Wachs. Es hat eine hohe Verhältniszahl. Das Ind. Gheddawachs stammt von Apis dorsata, florea und indica (s. oben S. 757).
Bienenwachs ist nach BUCHNER in absol. Alkohol gelöst und mit absolutalkoholischer Kalilauge gekocht in einer Stunde vollständig verseift, nach anderen (BERG, BOHRISCH) muß man länger, bis 3 Stunden, kochen. Die in 80% Alkohol löslichen freien Wachssäuren bestehen nur zum geringsten Teile aus Cerotinsäure (R. BERG). Heißer Alkohol löst alle Cerotinsäure neben geringen Mengen Melissinsäure (Cerin, rohe Cerotinsäure), Farbstoffe, einer klebrigen aromatischen Substanz (Ceroleïn) und[S. 768] Spuren Myricin, die beim Erkalten sich nahezu vollständig wieder abscheiden, so daß bei Zusatz von Wasser zum Filtrat nur leichte Opalescenz eintritt (Unterschied von Stearinsäure). Mit 300 Teilen Alkohol (90%) am Rückflußkühler gekocht löst sich das Wachs bis auf die Verunreinigungen (0,6–1,5%) auf. In kalten Äther geht viel Cerotinsäure, die Farbstoffe, die Kohlenwasserstoffe, ein wenig Wachsester und das Cerolëin, als weißer Rückstand bleibt die Hauptmenge der Wachsester und etwas Cerotinsäure (G. BUCHNER). Man muß das Wachs in Porzellan oder Email schmelzen, da die Gerbstoffe, die in ihm enthalten sind, mit Eisen mißfarbige Verbindungen geben. Das Bleichen, das entweder in sog. Luftbleiche (Rasenbleiche) oder in chemischer Bleiche (s. oben S. 764), oder mit Tierkohle erfolgt, verändert das Wachs mehr oder weniger stark (am wenigsten die Behandlung mit Kohle), die Jodzahl sinkt, Säurezahl und Verseifungszahl steigen meist, ohne daß sich jedoch eine Gesetzmäßigkeit erkennen läßt und daß die Differenzen immer groß sind. Beim Bleichen werden die Farbstoffe und die aromatischen Substanzen zerstört bzw. in Petroläther lösliche Stoffe umgewandelt.
Lit. SENEBIER, Physiol. végét. 2, 424 (1800). Dort die älteste Lit. — Ältere: JOHN (Analys. d. Wachs. d. Beeren von Myrica cordifolia nebst Betracht. über d. Wachs überhaupt). Chem. Schrift. IV, 38. — SAUSSURE, Ann. chim. phys. (2) 13, 339 (1820). — BOUDET u. BOISSENOT, Dingl. Pol. Journ. 1827, 23, 524. — OPPERMANN, Ebenda (2) 49, 240 (1832). — HESS, Pogg. Ann. 43 (1838), 382; Journ. pr. Chem. 13, 411. — MULDER, Journ. pr. Chem. 32, 172 (1844). — COLLINS BRODIE, Lieb. Ann. 67 (1848), 180; 71 (1849), 144 (Hauptarbeit). — LEWY, Dingl. Pol. Journ. 1845, 36. — GERHARDS, Ebenda 1845, 36, 82. — THOMSON, in Syst. d. Chem. IV. — J. BOSTOCK, Vgl. Vers. u. Beobacht. über d. Wachs aus d. Früchten d. Wachsbaums (Myrica cerif.), das Bienenwachs, den Walrat, das Fettwachs u. d. krist. Substanz aus d. Gallensteinen. Nicholsons Journ. nat. Philos. IV u. N. allg. Journ. d. Chem. VI, 645.
Neuere: GEORG BUCHNER in BENEDIKT-ULZER a. a. O. — V. FÜRTH, Vgl. chem. Physiol. d. nieder. Tiere 1903. — CHATEAU, Fette u. Wachsarten. Leipzig 1864. — SCHALFEJEFF, Journ. d. russ. chem. Ges. 2, 113; Ber. d. chem. Ges. 1876, 278. — NAFZGER, Lieb. Ann. 224, 225. — SCHWALB, Ebenda 235, 106. — T. MARIE, Extrait. d. acid. libr. d. l. cire d’abeilles; Compt. rend. 119, 428, Journ. Pharm. Chim. [3] 30, 199; Journ. Soc. Chem. Ind. 1894, 1895, 1896; Ann. chim. phys. 1896, 145; Bull. soc. chim. 11, 908 u. 15, 565. — HENRIQUES, Ber. d. chem. Ges. 1897, 1415. — JIRMANN, Hochmolekulare Kohlenw. aus Bienenwachs. Diss. Heidelberg 1899. — BOHRISCH und RICHTER, Pharm. Centralh. 1906, 11 u. 208. — BOHRISCH, Chem. Zeit. 1907, 191 u. 351. — G. BUCHNER, Chem. Zeit. 1907, 45, 126, 271, 570 u. 631; Zeitschr. öffentl. Chem. 3, 570 (1897) und 1910, 128. — BERG, Chem. Zeit. 1907, 537, 1908, 777. — BUISINE, Trav. et Mém. d. facult. Lille 1891. Bull. soc. chim. 5, 654. — MANGOLD, Chem. Zeit. 1891, 799.
SUNDWIK (Hummelw.), Journ. phys. Chem. 1907, 365. — MEDERER (Maroccan. W.), Zeitschr. öffentl. Chem. 1898. — BERTAINCHAUD u. MARCILLE, Monit. scient. 12, 533 (Pharm. Zeit. 1898, 864). — BLITS (Schwarz. Wachs aus Holl. Ind.) Nederl. Tijdschr. 1898. — Über indische Wachse: HOOPER, Sources, prepar., trade and composit. of beeswax of Brit. India. Agric. Ledger 1904. Entom. ser. No. 11.
Chronolog. geordnete Bibliographie. Journ. soc. chem. ind. 1892, 756 und BUCHNER in BENEDIKT-ULZER a. a. O. — Über die Fortschritte der Wachsindustrie berichtet die Seifensiederzeitung, die Chem. Revue der Fett- und Harzindustr. und die Bienenzeitung.
Propolis (s. S. 762). VAUQUELIN fand in Propolis 57% Harz, 14% Wachs und 15% einer Säure, die nach CADET Gallussäure mit etwas Benzoesäure (?) sein soll. LAUGIER erwähnt ein ätherisches Öl. GRESHOFF und SACK bezeichnen die Propolis als ein Gemisch von Harz (84%), Wachs (12%) und Unreinheiten, unlöslich in Alkohol (4%). Im Wachs fanden sie Cerotinsäure, dem Propolisharz geben sie die Formel C26H26O3 (F = 66°). Propolis ergab bei jeder Analyse andere Resultate. Sie zeigt stark abweichende Zusammensetzung.
BOHRISCH fand in %: Harz, unlöslich in heißem Petroläther, löslich in 96% Alkohol:[S. 769] 43,6, Propolisbalsam, in heißem Petroläther und 70% Alkohol löslich: 8,7, Bienenwachs: 27,9, Verunreinigungen: 12,9, flüchtige Bestandteile (incl. Wasser): 6,9. KÜSTENMACHER fand in von den Ammen erbrochener Propolis (Pissoceros) in %: Pollen, Spuren Wachs, 95 roten Balsam, darin 10% Zimtalkohol; in selbst gesammelter Propolis: 5–18 feste Körper, 22–35 Wachs, 60 Balsam, darin 9–10,7%, Zimtalkohol; in selbst gesammelter commosis: 20 Wachs, 73 Balsam, darin 9,5% Zimtalkohol; in Propolissorten aus Thüringen und Posen: 14,7–15,2 feste Körper, 6,6–9,6 Wachs A, 1–3,64 Wachs B, 4,8–21,3 Wachs C, 4,4–5,6 Ceresin D, 3,1–7,3 Zimtalkohol, 2–2,2 Gerbstoffe, 46,8–51,4 Harze. Auch Zimtsäure wurde von KÜSTENMACHER in der Propolis gefunden, doch fehlen Analysen der isolierten Substanzen. DIETERICH fand in selbst gesammelter Propolis 65% Harz (in Handelsware bis 44%), c. 3% Balsam, 45% Wachs (in Handelsware über 60%), bis 2% Asche und 5–6% wässriges Extrakt, und bei einer eingehenderen Untersuchung in %: Wachs bis 60, unlösliche Anteile bis 22, bei 100° flüchtige Anteile bis 6, Propolisbalsam (nach BOHRISCH) bis 11, Vanillin und andere Aldehyde ganz geringe Mengen (im Balsam), Gummi wenig, Propolisrohharz (F = 90–106°) bis 65. Das Propolisharz bestand aus Gerbstoffen c. 20, Proporesen 1,5, α-Proporesin (F = 182–187°) c. 1, β-Proporesin (F = 124–125°) c. 4, freie Harzsäure Spuren, Reinharz c. 70 (wahrscheinlich der Resinotannolester der Propolisharzsäure), Oxydationsprodukte der Gerbstoffe c. 3,5%.
Propolis wird noch jetzt zu Räucherungs- und Aromatisierungszwecken benutzt. Es ist aber kaum im Handel anzutreffen.
Lit. (Propolis) GALE, Agric. Gaz. N. S. W. 1901, 840. — ROOT, A B C of Bee culture 1901. — VAN TRICHT, Scheikund. Woordenb. 1865. — GRESHOFF u. SACK, Contribut à la connaissance du propolis (matière précieuse). Rev. tr. chim. P. B. 22 und Pharm. Weekbl. 1902, 933. — K. DIETERICH, Anal. d. Bienenw. in s. verschied. Entwicklungsstad. u. über d. Bienenharz. Chem. Zeit. 1907, 987 (Apoth. Zeit. 1907, 824) und Beitr. z. Kenntn. d. Bienenharzes. Apoth. Zeit. 1910, 762 u. Weit. Beitr. z. Kenntn. d. Bienenharzes. Pharm. Centralh. 1911, Nr. 39. — BOHRISCH, Propolis, Pharm. Centralh. 1907, 929. — KÜSTENMACHER, Propolis. Ber. d. pharm. Ges. 1911, 65.
Verfälschungen und Prüfung. Als Verfälschungen des Bienenwachses sind neben Wasser und mineralischen Substanzen, Mehl und Stärke, Talg, Japanwachs, Stearinsäure, Paraffin, Ceresin, Colophonium, Carnaubawachs und Insektenwachs beobachtet. In Indien wird das Wachs bisweilen mit Curcuma gefärbt (HOOPER). Die häufigste Beimengung ist jetzt Ceresin, das dadurch hineingelangt, daß man in neuerer Zeit bisweilen künstliche, aus Ceresin oder Ceresin und Wachs hergestellte Waben verwendet. Die Schweizer Imker halten aber darauf, daß nur künstliche Waben aus Bienenwachs verwendet werden (KRAMER). Übrigens nimmt die Biene reine Ceresinwaben nicht an, sondern baut daneben. Die Methode von BUISINE (mit Kalikalk) erlaubt die dem Wachs zugesetzten Kohlenwasserstoffe direkt zu bestimmen. HÜBL bemerkt: Wenn die Verseifungszahl unter 92 liegt, während die Verhältniszahl (s. oben) mit der eines reinen Bienenwachses übereinstimmt, dann muß Paraffin oder Ceresin vorhanden sein. Wenn die Verhältniszahl größer ist als 3,2, dann muß ein Zusatz von Japantalg, Carnaubawachs oder Talg vermutet werden. Wenn die Säurezahl weit unter 20 liegt, dann fehlt Japantalg, wenn jedoch die Verhältniszahl unter 3,8 liegt, dann ist Stearinsäure oder Kolophonium anwesend. Zusatz von Carnaubawachs drückt die Säurezahl herab und erhöht Spez. Gew. und Schmelzpunkt.
Lit. Über Wachsfälschung und Wachsuntersuchung existiert eine ganze Literatur, vgl. in BENEDIKT-ULZER a. a. O., LEWKOWITSCH a. a. O. und DIETERICH, Helf. Ann. — Ferner: NIEDERSTADT, Pharm. Zeit. 1897, 654. — HENRIQUES, Zeitschr. öffentl. Chem. 1897. — SCHWEISSINGER, Pharm. Centralh. 1897. — LEMAIRE, Rep. d. pharm. 1904. — EICHHORN, Zeitschr. anal. Chem. 1900. — BUCHNER, Chem. Zeit. 19 (1895), 1422, 25, 21, 31, 126 u. 570. — RAGNAR-BERG, Chem. Zeit. 1907, 537 u. 1908, 777. — BUISINE, Monit. scient. 1890, 1127. — BELLIER (Annam-W.). Ann. Chim. anal. 1906, 366. — GEIGER (Jodzahl). Zeitschr. angew. Chem. 1898. — HIRSCHEL (Extraktionsw.). Chem. Zeit. 1904. — AHRENS und HETT (Kohlenwasserst). Pharm. Zeit. 1899, 242. — LE SUEUR und CROSSLEY (Schmelzp.). Zeitschr. angew. Chem. 1899. — RAKUSIN (spez. Gew.). Chem. Zeit. 1905. — HEHNER, Analyst 1883, 16. — HÜBL, Dingl. polyt. Journ. 219 (1883), 338. — Bestimmung der Säure- und Verseifungszahl aus neuerer Zeit: RAGNAR BERG, Apoth. Zeit. 1910, 784. — C. JACOBSEN, Ebenda 1910, 113. Vgl. auch die Chem. Revue der Fett- und Harzindustrie und die Seifensiederzeitung.
[S. 770]
Die Zweige des Wax tree (Fraxinus chinensis) mit Wachs bedeckt, unten das Wachsinsekt (Coccus ceriferus).
[Nach Hanbury, Science papers.]
Geschichte. «Eigentliche Bienenzucht ist erst nach Trennung des indogermanischen Urvolkes aufgekommen, im Norden Europas die wilde Waldbienenzucht an Zeidelbäumen, im Süden die zahme Bienenzucht in Bienenstöcken, die dann allmählich auch nach Norden vorgedrungen ist» (SCHRADER). HOMER hat noch keine Spur davon, erst bei HESIOD werden Bienenkörbe erwähnt. Im Norden ist die Waldbienenzucht sehr alt. (Über Biene und Honig vergl. oben S. 8 u. 757 und SCHRADER, Reallex. d. indogerm. Altertumsk.) In Amerika wurde in der präkolumbischen Zeit Wachs und Honig nur von den verwandten Gattungen Trigona und Melipona gesammelt. Nach Mexiko kam die europäische Biene bald nach der Eroberung, nach Nordamerika von England aus, 1764 kam sie nach Cuba, 1793 nach New York, 1797 nach den Gegenden westlich vom Mississippi, aber erst 1845 nach Brasilien. Jetzt hat sich die deutsche Biene über ganz Süd- und Nordamerika verbreitet und auch die italienische und ägyptische Biene (s. oben) ist von Deutschland aus hinüber gebracht worden. Nach Australien kam die Biene 1862 von England aus. DIOSKURIDES (II, c. 105) bezeichnet als das beste Wachs (κηρός) das von Creta und dem Pontus. Er beschreibt das Bleichen durch Auskochen des Wachses mit Meerwasser und Natron, Umschmelzen, Erstarrenlassen zu dünnen Scheiben und Bleichen dieser unter fortwährendem Anfeuchten an der Sonne. Er kennt die medizinische Anwendung auch der πρόπολις, von der aber nur die gelbe, styraxartig riechende, wie Mastix knetbare benutzt werden soll. PLINIUS (XI, 5), der für die Waben den Ausdruck cellula braucht (jetzt übertragen auf die «Zelle»), erwähnt außer cera die commosis (Gummigrund), Harzwachs (pissoceros) und Stopfwachs (propolis), dessen Bedeutung er richtig schildert — sowie das Bienenbrot (erithace, sandarace, cerinthus) und nennt als Quelle des melligo den klebrigen, gummigen und harzigen Saft der Weiden, Ulmen und Rohre, als Quelle der Propolis das Harz der Pappel und des Weinstocks unter Zusatz von Blütenstaub (flos). Er bemerkt: «ceras ex omnium arborum satorumque floribus confingunt, excepta rumice et echinopode». Außerdem nennt er cera maxime fulva, cretisches und corsicanisches und erwähnt das Färben mit Alcanna («Anchusa»). Auch OVID erwähnt Cera flava (FLÜCKIGER). GALEN kennt die Verwendung des Wachses zu kühlenden Pflastern. Auch die Araber erwähnen es (bei IBN BAITHAR: schama und mum) als Pflasterbestandteil. — In dem Bericht der Bischöfe RICHARD und THOMAS (1303 bzw. 1310) wird auch Cere nebst dem Preise erwähnt (HANBURY, The spices, groceries and wax of a mediaeval household. Science pap. 478) und JOHN DE GARLANDE (XIII. Jahrh.) erwähnt die schon damals häufigste Verfälschung mit «cereis esclesiasticis», d. h. einer Talg-Wachsmischung. Im Ricettario fiorentino ist Wachs von Toscana erwähnt. Die Unguenta der alten Dispensatorien enthielten meist ein Adeps und Öl, oft auch Wachs. CORDUS hat z. B. Cera citrina und fulva.[S. 771] POMET nennt 1694 neben Frankreich (bes. der Champagne, Bretagne) Polen und «La Barbarie» als wachsliefernd und bezeichnet besonders das Wachs von Danzig als gut. In der Taxe von Prag 1659 steht Cera alba Veneta — die Wachsbleicherei wurde im XVII. Jahrh. (und wohl auch schon im XVI.) besonders in Venedig betrieben.
PLINIUS und CELSUS (De medic. V, 3, 4) erwähnen Propolis, ebenso VARRO (De re rustica III, 16, 23), VEGETUS u. and. VIRGIL nennt den Namen nicht, erwähnt es aber auch. Propoli steht bei CORDUS in den Annotationes ad Dioscoridem und in der Frankfurter Liste (1450): propoleos uel on. Von ihm sagt POMET, daß es ehedem viel gebraucht wurde, man aber jetzt (1694) kaum mehr wisse was es eigentlich sei. Als Arzneimittel ist es längst außer Gebrauch.
Chinesisches Insektenwachs.
Pelawachs, Pihla, Pe-la-or, Latschu, Chung-pih-la (= weißes Insektenwachs, das rohe Wachs heißt lă-tscha = Wachs-Sediment), vegetabilisches Spermacet, chines. Baumwachs, Cire d’insectes, Insect wax, White wax of insects, Chinese wax, Chinese vegetable wax, Cera d’insetti.
Das chines. Wachs ist das Produkt einer Schildlaus, Coccus ceriferus FABR. (C. pela WESTW., pe-lah chines. = weißes Wachs, C. cereus WALK., Ericerus ceriferus GUER. MÉN., E. pe-la KÜNCK.), die auf verschiedenen Bäumen Chinas, besonders auf Ligustrum lucidum, im Tale Tschien-Tschang lebt. Man überträgt aber das Tier in Schantung, Honan, Tschekiang, Szetschwan, Anhwei auf am Rande der Felder kultivierte, etwa dreijährige Eschen (Fraxinus chinensis ROXB.), löst, sobald die Wachsproduktion ihren Höhepunkt erreicht hat, die Rinde von den Bäumen, erwärmt sie in eisernen Töpfen mit Wasser und schöpft das Wachs ab, das dann umgeschmolzen wird. Hauptproduktionsgegend ist Chiating in der Provinz Szetschwan. Die jährliche Produktion beträgt c. 200000 kg Wachs, früher beträchtlich mehr. Aber die Produktion und der Preis sind seit Einführung des Petroleums stark zurückgegangen. Nur in der Provinz Anhwei und im Distrikt Pochou und der Provinz Tschekiang hat Produktion und Handel mit diesem Wachs nicht merklich abgenommen (1900). Nach der Stadt Kiu-hua wurden 1887 gegen 300 t gebracht (SEMLER). Hauptdistrikte sind die Provinzen Szetschwan, Anhwei und Tschekiang, aber auch in Hainan, Kwangtung, Hunan, Schantung und selbst im Amurgebiet wird Wachs gewonnen.

Der Wachsbaum und sein Insekt nach einer Darstellung im Pen Tsʿao Kang Mu (I, S. 518). Die Schriftzeichen links oben bedeuten Chung-la (= Insektenwachs), die darunter stehenden Lă-chŭng (= Wachssame, die Cocons des Insektes auch la-tsze = Wachssohn), die in der Ecke rechts unten Tung-tsing-shoo (= Wintergrünbaum), die großen am Rande rechts Chŭng-pih-lă (= weißes Insektenwachs).
[Aus Hanbury, Science papers.]
Das Wachs ist dem Walrat ähnlich, kristallinisch, fast geruch- und geschmacklos oder mit schwachem Talggeruch, weiß bis gelblich. Es kommt in großen runden Broten in den Handel. Das Wachs wird in China zur Kerzenfabrikation und zum Haarsteifen, aber auch zum Einhüllen von Pillen und Boli (ich traf 1889 damit überzogene Boli in chinesischen Apotheken), sowie für Pflaster und zum Wachsen von Papier und Baumwolle benutzt. In England wird es bisweilen dem Walrat beigemischt. Es löst sich in siedendem Chloroform und Tetrachlorkohlenstoff[S. 772] leicht und kristallisiert beim Erkalten wieder aus. In Alkohol ist es auch beim Kochen sehr wenig löslich; desgleichen in Äther und Petroläther. Es ist sehr schwer verseifbar. Spez. Gew. bei 15°: 0,970, Schmelzpunkt: 81–83°, Erstarrungspunkt: 80,5–81, V. Z.: 63–93. «Chines. Wachs» zeigte (G. BUCHNER): S. Z. 6,28–9,74, Ätherzahl 83,82–111,45, V. Z. 90,2–120,17, Verhältniszahl 11,06–17,9. Es besteht nach BRODIE aus fast reinem Cerotinsäurecerylester (C52H104O2), d. h. dem Ester der Cerotinsäure (C26H52O2 HENRIQUES) und dem Cerylalkohol (C26H53OH HENRIQUES). Nach HERBIG ist das Vorhandensein einer zweiten hochmolekularen Säure, einer niedrigen Säure und eines zweiten Alkohols wahrscheinlich.
Ein Teil des chinesischen Wachses stammt von einer Minicicade, Flata limbata, die lange, dünne, weiße Wachsfäden in so großer Masse ausschwitzt, daß der ganze Hinterleib davon bedeckt ist. In Japan sammelt man das von einer Schildlaus auf Ligustrum Ibota ausgeschiedene Wachs.
Lit. HANBURY, On the Insect-White Wax of China. Science pap. 60 u. Note of a spec. of insect wax from China. Ebenda 272 (dort die weitere Literatur). — BEAUREGARD, Mat. med. zool. 1901. — HOSIE, Seifensiederzeit. 1910, 1253 (nach Three Years in Western Chine). — SEMLER, Trop. Agrikultur. — Chem. Rev. 1897, 290. — BRODIE, Lieb. Ann. 67 (1848), 199. — HENRIQUES, Ber. d. chem. Ges. 30, 1415. — BENEDIKT-ULZER a. a. O. (dort weit. Lit.).
[S. 773]
Zusätze und Berichtigungen
zu Band II. Erste Abteilung.
S. 7. Zeile 1: CH2OH nicht CH2CH. — Bei d-Fructose: αD = −91° statt αD = c - 91°.
S. 12. Honig enthält neben Katalase und Diastase auch ein eiweißlösendes Enzym (LENZ 1910).
S. 19. Verbascum wird auch in Schweighausen bei Hagenau cultiviert (ROSENTHALER).
S. 26. Die Fig. 7, von TIEDEMANN als «kleinasiatischer Feigenbaum» bezeichnet, ist nicht Ficus Carica. Dementsprechend ist die Bemerkung auf S. 24, Zeile 8 v. u., daß bei Ficus Carica Cauliflorie vorkommt, zu streichen. Über die neue Abstammungslehre der Feigen und besonders die Urfeige (Ficus Carica [L] Erinosyce TSCH. et RAV.) vgl. TSCHIRCH, die Feigenbäume Italiens, Ber. d. d. Bot. Ges. 1911, sowie die gleichlautende Dissertation von RAVASINI, Bern, M. DRECHSEL 1912 (mit zahlr. Abbildungen).
S. 27. Parthenogenesis kommt bei der Feige nicht vor. Über die Caprification vgl. bei RAVASINI a. a. O.
S. 39. Die Fig. 13 ist in den Grandes cultures als «Rosinenmarkt» bezeichnet. Es beruht dies auf einer Verwechslung von Rosin (= Colophonium) und Rosine. Die Figur gehört also nicht hierher, sondern zum Artikel Colophonium.
S. 56. Zeile 27 v. o. statt Amygdalin: Sambunigrin (ROSENTHALER).
S. 89. Zeile 3 v. u. glycyrrhizinreicher.
S. 132. Dem Artikel Tabaschir habe ich, trotz der Gegenbemerkungen von HOSSEUS nichts hinzuzufügen. Rohrzuckerfabrikation ist erst seit dem III. bez. VII. Jahrh. n. Ch. beglaubigt (LIPPMANN).
S. 137, Zeile 5 v. o. Es ist möglich, daß κερωνία nichts mit κέρας (= Horn) zu tun hat, sondern den «keronischen Feigenbaum» bezeichnen sollte.
S. 154. Die Amylose scheint ein Übergangsprodukt von den kristallisierenden Sacchariden zu den komplexen Polysacchariden zu sein (BOTAZZI und VICTOROW 1910).
S. 155. Auch Narcein wird durch Jod blau.
S. 165. WITTMACK betrachtet (1909) Solanum tuberosum L. als gute Art und als Stammpflanze unserer Kartoffel.
S. 170. Amylum Marantae wurde in Deutschland besonders durch OLAW SWARTZ (Observat. botanicae Erlang. 1791) bekannt, doch bedient man sich seiner in Deutschland erst seit 1819 (DIERBACH).
S. 193. Als Verfälschung des Reis ist 1910 Talcum und Asbestpulver (?) beobachtet (LOWE und TAYLOR. Lancet 1910, 1687).
S. 209. Taraxacum wird in Jenalöbnitz auch angebaut. Die Ernte geht nach Nordamerika (1910).
S. 219. Die jetzt in Nordamerika von Maine bis Maryland, Minnesota und Missouri vorkommende Quecke ist wahrscheinlich von Europa eingeführt (ALICE HENKEL).
S. 241. Der Literatur ist einzufügen: CROSS, BEVAN, KING und JOYNSON, Rep. on Indian Fibres and fibrous substances. London 1887 und
S. 242. CROSS und BEVAN, Journ. chem. soc., Ber. d. d. chem. Ges. und Cellulose an outline of the chemistry of the structural elements of plants 1895–1906.
S. 243. Erste Erwähnung der Baumwolle im VIII. Jahrh. n. Chr. auf einem Tonprisma Sanheribs (DELITZSCH, 1910).
[S. 774]
S. 250. Zeile 10 v. u. 20–30% Nicht-Cellulose statt 50–60%.
S. 270. Die schlechteste Sorte Lichen islandicus besteht in Ungarn aus dem ganzen, vom Boden abgehobenen Rasen und enthält nur 25–40% der Flechte, sonst viel Moose, Coniferennadeln, Vaccinium u. and. (AUGUSTIN).
S. 283. Literatur. Grundlegend ist die Arbeit von SCHMIDT, Lieb. Ann. 51, 29 (Jahresb. d. Pharm. 1844, 14).
S. 291. Chondrus crispus enthält Arsen — in 100 g: 0,07 mg (TASSILY und LEROIDE).
S. 300. Zeile 1 v. o. die Formel des Methylfurfurols ist:
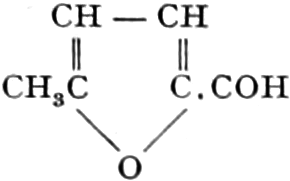
S. 302. Jod wies in Laminarien bereits PRICE 1851 (Journ. pr. Chem. 55, 232) mikrochemisch nach — mittelst HCl und KNO2 und Stärkekleister.
S. 313. Zeile 19 v. u. chirurgisch statt chirurchisch.
S. 322. Das Linamarin formuliert JONCK: C30H50N3O7.
S. 325. Zeile 1 v. o. Cruciferen statt Coniferen.
S. 347. Zeile 3 v. u. Höfles statt Horles; Zeile 2 v. u. Gründlach statt Grundlach.
S. 356. Auf den Marktplätzen in Budapest verkaufen die Marktweiber der umliegenden deutschen Ortschaften als «Eibisch» das Kraut von Lavathera thuringiaca, dessen sich auch die ungarischen Kurpfuscher bedienen (AUGUSTIN).
S. 357. Zeile 18 v. o. Althaeablüten statt Althaeablätter.
S. 363. Bei den Fol. Althaeae und Malvae ist auch der Arbeit von NETOLITZKY, Bestimmungsschlüssel der Dikotyledonenblätter zu gedenken.
S. 458. nhd. Kork wurde nach dem XV. Jahrh. durch niederländische Handelsbeziehungen aus span. corcho entlehnt.
S. 479. Die bisweilen in russischem und galizischem Lycopodium beobachtete Weizenstärke rührt wohl von den Getreidesäcken her, in die die Droge gefüllt wurde (AUGUSTIN).
S. 487. Zeile 12 v. o. WICHERS und TOLLENS.
S. 489. Überall Ebstorf statt Ebsdorf.
S. 494. Hinzufügen: ROSENTHALER und TÜRK, Über die absorbierenden Eigenschaften verschiedener Kohlensorten. Arch. Pharm. 1906, 517. — Zeile 2 v. u. ist «und Histidin» zu streichen.
S. 495. Die Formeln lauten:
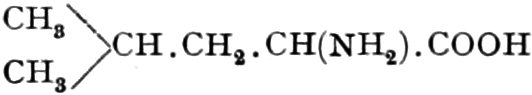
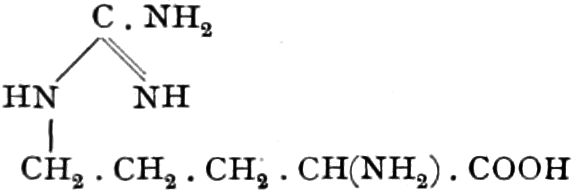
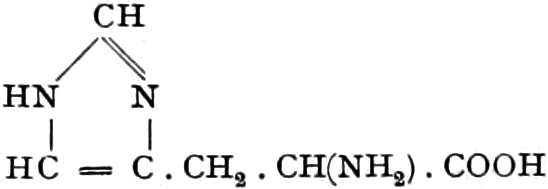
S. 546. Zeile 26 v. o. Myristinsäure statt Myristicinsäure.
S. 553. Zeile 19 v. o.: 1 Phase > C = C < + O2 statt > C = < + O2.
S. 563. Zeile 32 v. o. lit. statt lat.
S. 569. Mohnsamen wurden 1911 verfälscht gefunden mit Samen von Hyoscyamus niger und Zucker (Journ. pharm. 1911, 72). Der russische enthielt (1910) meist die Samen der einjährigen Varietät von Hyoscyamus agrestis (DÉGEN).
S. 576. bei der Baudouinschen Reaktion wirkt w-Oxymethylfurfurol (ROSENTHALER).
S. 589. Fettes Senföl wird in riesigen Mengen in Indien als Speiseöl dargestellt (Tropenpfl. 1909, 413).
S. 606. Zeile 17 v. u. Die Analyse von ROSENTHALER und SCHAEFFER bezieht sich auf süße Aprikosenkerne von Südfrankreich (Pharm. Centralh. 1911, Nr. 19).
S. 612. Der Ertrag an Oliven betrug in Spanien 1909: 13982939, 1910: 6246189 dz an Öl 1909: 2397720, 1910: 1085088 dz; die mit Ölbäumen bepflanzte Fläche 1910: 1416122 ha.
[S. 775]
S. 620. HOLDE fand im Olivenöl: C3H5(C17H33O2)2C18H35O2.
S. 646 und 651 sowie Taf. XVII statt Browne überall Bowne.
S. 682. Bei Myristicin und Myristicinsäure sind die 2 doppelten Bindungen einzutragen.
S. 684. Zeile 3 v. o. ist hinzuzufügen: THOMS, Constitut. d. Myristicins Arb. d. pharm. Inst. Berlin I, 18.
**
*
Bei der Bearbeitung bin ich in liebenswürdigster und verdankenswertester Weise von zahlreichen Kollegen und früheren Schülern unterstützt worden, mein treuster Mitarbeiter war aber meine Frau.
Die pflanzlichen Schädlinge hat Prof. ED. FISCHER (Bern), die tierischen Apotheker ISRAËL (Gera), die Taxen und 4 Karten (im I. Bande) Dr. TUNMANN (Bern) bearbeitet.
Alle Bogen hat Prof. VON LIPPMANN (Halle), viele Prof. TOLLENS (Göttingen) in der Korrektur durchgelesen, einige Kapitel auch Direktor BULL (Bergen), Prof. T. F. HANAUSEK (Krems), Prof. HARTWICH (Zürich) und Prof. WINTERSTEIN (Zürich), denen allen ich wertvolle Winke verdanke.
Auskünfte verdanke ich ferner Prof. VON WISSELINGH (Groningen), Prof. WINDAUS (Freiburg i. B.), Dr. RAVASINI (Rom), Dr. EMMANUEL (Athen), Dr. PECKOLT (Rio de Janeiro), Prof. GREENISH (London), Prof. VAN DER WIELEN (Amsterdam), Dr. GRESHOFF (Haarlem), Dr. SENFT (Prag), Medizinalrat DÖLL (Karlsruhe), Dr. TISZA (New York), Prof. SCHRÖTER (Zürich), Dr. ROSENBERG (Liestal), WOLDEMAR FERREIN (Moskau), Prof. RIKLI (Zürich), Dr. KELLER (Zürich), Prof. OTTO MÜLLER (Berlin), SCHWARZ (Nürnberg), KRAFT (Würzburg), Prof. MORPURGO (Triest), J. NOVák (Prag), Dr. NETOLITZKY (Czernowitz), Prof. MITLACHER (Wien), Prof. ROSENTHALER (Straßburg), Prof. A. FOREL (Yvorne), Dr. AUGUSTIN (Budapest), WARTMANN (Biel), Prof. VAN ITALLIE (Leiden), Prof. OESTERLE (Bern), F. KUNDRát (Pilsen), E. KRARUP (Odense, Dänemark), Prof. ROSENDAHL (Stockholm), HAUSDING (Cölleda), R. SCHMID (Naumburg), A. WEBER (Zehlendorf) und den Drogenhäusern und Fabriken von CAESAR-LORETZ (Halle), FRITZ (Wien), GEHE & CO. (Dresden), GROSSMANN (Hamburg), SIEGFRIED (Zofingen), SCHIMMEL & Co. (Miltitz), Norddeutsche Wollkämmerei (Delmenhorst), sowie zahlreichen deutschen Konsulaten des Auslandes.
Philologisch-historischen Rat empfing ich von Prof. SEYBOLD (Tübingen), Prof. MARTI (Bern), Dr. OEFELE (Neuenahr), Prof. MÜLLER-Hess (Bern), Dr. DORVEAUX (Paris), Prof. LOTMAR (Bern).
Abbildungen verdanke ich in erster Linie dem Koloniaal Museum Haarlem (Dr. GRESHOFF und Dr. DEKKER), STAFFORD ALLEN AND SONS (Long Melford), Dr. TUNMANN (Bern), WELLCOME brothrs. (London-Khartum), ROURE-BERTRAND (Grasse), Prof. VAN DER WIELEN (Amsterdam) und Prof. PERROT von der Ecole supér. de pharmacie in Paris; dann Prof. HARTWICH (Zürich), Dr. MARLOTH (Kapstadt), Dr. HOOPER (Kalkutta), Dr. RAVASINI (Rom), Dr. WEIGEL (Hamburg), BULL (Bergen), Dr. SVENDSEN (Kristiania), Prof. BENEDICENTI (Genua), MACEWAN Editor of the Chemist and Druggist (London), Prof. MOELLER (Wien), Dr. HÄLLSTRÖM (Helsingfors), Dr. BUSINGER (Zürich), Dr. KRAMER (Zürich), SCOTT und BOWNE (Frankfurt a/M.), sowie zahlreichen Zeitschriften, Hand- und Lehrbüchern. Das Kew-Museum hat mir die photographische Aufnahme zahlreicher Objekte gestattet und Prof. GREENISH hatte die Güte, viele derselben aufzunehmen. Zahlreiche photographische Aufnahmen hat in meinem Institute auch Prof. OESTERLE gemacht.
Druck von Poeschel & Trepte in Leipzig
Hellenica World Literatur, Deutsch

