\require{mhchem}
Το τριοξείδιο του ξένου ή ξενοτριοξείδιο είναι είναι μια ασταθής χημική ένωση του ξένου, ενός ευγενούς αερίου με χημικό τύπο XeO3. Είναι ένα πανίσχυρο οξειδωτικό αντιδραστήριο που, αν έρθει σε επαφή με το νερό, απελευθερώνει, με αργό ρυθμό που επιταχύνεται από το ηλιακό φως, οξυγόνο και ξένο. Είναι επικίνδυνα εκρηκτικό αν έρθει σε επαφή με οργανικές ενώσεις.
| Τριοξείδιο του ξένου | |||
|---|---|---|---|
 |
|||
 |
|||
 |
|||
 |
|||
 |
|||
| Γενικά | |||
| Όνομα IUPAC | Τριοξείδιο του ξένου | ||
| Άλλες ονομασίες | Ξενοτριοξείδιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | XeO3 | ||
| Μοριακή μάζα | 179,288 amu | ||
| Αριθμός CAS | 13776-58-4 | ||
| SMILES | O=Xe(=O)=O | ||
| Δομή | |||
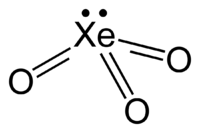
| Μοριακή γεωμετρία | τριγωνική πυραμιδική | ||
| Φυσικές ιδιότητες | |||
| Πυκνότητα | 4.550 kg/m3 | ||
| Διαλυτότητα στο νερό |
Διαλυτό με αντίδραση | ||
| Χημικές ιδιότητες | |||
| Αυτοδιάσπαση | 25 °C | ||
| Επικινδυνότητα | |||
| Κίνδυνοι κατά NFPA 704 |
0
1
4
|
||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Παραγωγή
Το τριοξείδιο του ξένου παράγεται με υδρόλυση του τετραφθοριούχου ξένου (XeF4). Από το διάλυμα που προκύπτει κρυσταλλώνονται άχρωμοι κρύσταλλοι XeO3 με εξάτμιση[1]:
{\displaystyle \mathrm {2XeF_{4}+4H_{2}O{\xrightarrow {}}Xe+{\frac {1}{2}}O_{2}+8HF+XeO_{3}} }
Οι κρύσταλλοι του τριοξειδίου του ξένου είναι σταθεροί για μέρες σε ξηρό αέρα, αλλά γρήγορα αποροφούν υγρασία από υγρό αέρα και σχηματίζουν ένα πυκνό διάλυμα.
Δομή
Η κρυσταλλική δομή είναι ορθορομβική με α = 616,3, β = 811,5 και 523,4 pm και τέσσερα (4) μόρια ανά κρυσταλλική μονάδα[2].
Χημική συμπεριφορά και εφαρμογές
Το τριοξείδιο του ξένου είναι ένα ισχυρό οξειδωτικό αντιδραστήριο και μπορεί να οξειδώσει τις περισσότερες από τις ουσίες με τις οποίες έρχεται σε επαφή. Ωστόσο είναι (σχετικά) αργό στη δράση και αυτό μειώνει τη χρησιμότητά του[3].
Όταν διαλύεται στο νερό σχηματίζεται ένα όξινο διάλυμα ξενικού οξέος (H2XeO4):
{\displaystyle \mathrm {XeO_{3}+4H_{2}O{\xrightarrow {}}H_{2}XeO_{4}\rightleftarrows [HXeO_{4}]^{-}+H^{+}} }
Αυτό το διάλυμα είναι σταθερό σε θερμοκρασία δωματίου και δεν έχει τις εκκρηκτικές ιδιότητες του τριοξειδίου του ξένου. Οξειδώνει ποσοτικά καρβονικά οξέα προς διοξείδιο του άνθρακα (CO2) και νερό[4].
{\displaystyle \mathrm {(3v+5)H_{2}XeO_{4}+3C_{v}H_{2v+1}COOH{\xrightarrow {}}(3v+5)Xe+(3v+3)CO_{2}+(6v+8)H_{2}O} }
Εναλλακτικά, διαλύεται σε βασικά διαλύματα και παράγει ξενικά άλατα. Το ανιόν [HXeO4]- είναι το δομικό χημικό είδιος στα ξενικά διαλύματα[5]. Αυτά δεν είναι σταθερά κι αρχίζουν να μετατρέπονται σε υπερξενικά ([XeO6]4-), ξένο (Xe) και οξυγόνο (O2)[6]:
{\displaystyle \mathrm {2XeO_{3}+4OH^{-}{\xrightarrow {}}Xe\uparrow +[XeO_{6}]^{4-}+O_{2}\uparrow +2H_{2}O} }
Στερεά άλατα των δυο οξέων δεν έχουν απομονωθεί. Ωστόσο, το τριοξείδιο του ξένου αντιδρά με φθορίδια όπως το φθοριούχο κάλιο (KF), φθοριούχο ρουβήδιο (RbF) ή φθοριούχο καίσιο (CsF) σχηματίζοντας σταθερές ενώσεις του γενικού τύπου MXeO3F[7]:
{\displaystyle \mathrm {XeO_{3}+MF{\xrightarrow {}}MXeO_{3}F} }
Ασφάλεια
Το τριοξείδιο του ξένου πρέπει να μεταχειρίζεται με μεγάλη προσοχή. Δείγματα έχουν εκραγεί όταν εκτίθενται σε θερμοκρασίες δωματίου. Ξηροί κρύσταλλοι αντιδρούν εκρηκτικά με την κυτταρίνη[2][8]
Αναφορές και παρατηρήσεις
John H. Holloway; Eric G. Hope (1998). A. G. Sykes. ed. Recent Advances in Noble-gas Chemistry. Advances in Inorganic Chemistry, Volume 46. Academic Press. p. 65. ISBN 012023646X.
Templeton, D. H.; Zalkin, A.; Forrester, J. D.; Williamson, S. M. (1963). Journal of the American Chemical Society 85 (6): 817. doi:10.1021/ja00889a037. edit
Greenwood, N.; Earnshaw, A. (1997). Chemistry of the Elements. Oxford: Butterworth-Heinemann.
Jaselskis B.; Krueger R. H. (July 1966). "Titrimetric determination of some organic acids by xenon trioxide oxidation". Talanta 13 (7): 945–949. PMID 18959958.
Jeffrey L. Peterson; Howard H. Claassen; Evan H. Appelman (March 1970). "Vibrational spectra and structures of xenate(VI) and perxenate(VIII) ions in aqueous solution". Inorganic Chemistry 9 (3): 619–621. doi:10.1021/ic50085a037. edit
W. Henderson (2000). Main group chemistry. Great Britain: Royal Society of Chemistry. pp. 152–153. ISBN 0854046178.
Egon Wiberg; Nils Wiberg; Arnold Frederick Holleman (2001). Inorganic chemistry. Academic Press. p. 399. ISBN 0123526515.
Bartlett, N.; Rao, P. R. (1963). "Xenon Hydroxide: an Experimental Hazard". Science 139 (3554): 506.
Hellenica World - Scientific Library
Από τη ελληνική Βικιπαίδεια http://el.wikipedia.org . Όλα τα κείμενα είναι διαθέσιμα υπό την GNU Free Documentation License


