Η πρότυπη ενθαλπία σχηματισμού (standard enthalpy of formation) ή πρότυπη θερμότητα σχηματισμού (standard heat of formation) μιας ένωσης είναι η μεταβολή της ενθαλπίας κατά τη διάρκεια σχηματισμού 1 mol της ένωσης από τα συστατικά της στοιχεία, με όλες τις ουσίες στις πρότυπες καταστάσεις τους|ατμόσφαιρα]] (1 atm ή 101.3 kPa). Το σύμβολό της είναι ΔHfO ή ΔfHO. Ο εκθέτης θήτα (μηδέν) σε αυτό το σύμβολο δείχνει ότι η διεργασία συνέβη κάτω από πρότυπες συνθήκες στη συγκεκριμένη θερμοκρασία (συνήθως 25 βαθμοί Κελσίου ή 298.15 K). Οι πρότυπες συνθήκες έχουν ως εξής:
- Για ένα αέριο: η πρότυπη κατάσταση είναι πίεση 1 atm ακριβώς.
- Για μια διαλυμένη ουσία που είναι παρούσα σε ένα ιδανικό διάλυμα: συγκέντρωση 1 mol/L (M) ακριβώς σε πίεση 1 atm
- Για μια καθαρή ουσία ή έναν διαλύτη σε μια συμπυκνωμένη κατάσταση (ένα υγρό ή ένα στερεό): η πρότυπη κατάσταση είναι το καθαρό υγρό ή στερεό σε πίεση 1 atm
- Για ένα στοιχείο: η μορφή στην οποία το στοιχείο είναι πιο σταθερό κάτω από πίεση 1 atm. Μια εξαίρεση αποτελεί ο φώσφορος, για τον οποίον η πιο σταθερή μορφή σε 1 atm είναι ο μαύρος φώσφορος, αλλά ο λευκός φώσφορος έχει επιλεγεί ως η πρότυπη κατάσταση αναφοράς για μηδενική ενθαλπία σχηματισμού.[1]
Παραδείγματος χάρη, η πρότυπη ενθαλπία σχηματισμού του διοξειδίου του άνθρακα θα ήταν η ενθαλπία της παρακάτω αντίδρασης στις παραπάνω συνθήκες:
- C(s,graphite) + O2(g) → CO2(g)
Όλα τα στοιχεία γράφονται στις πρότυπές τους καταστάσεις και για σχηματισμό ενός mol προϊόντος. Αυτό ισχύει για όλες τις ενθαλπίες σχηματισμού.
Η πρότυπη ενθαλπία σχηματισμού μετράται σε μονάδες ενέργειας ανά ποσότητα ουσίας, που συνήθως δηλώνεται ως kilojoule ανά mol (kJ mol−1), αλλά επίσης και σε θερμίδες ανά mol, joule ανά mol ή kcal ανά g (οποιοσδήποτε συνδυασμός αυτών των μονάδων που είναι συμβατός με την οδηγία ενέργεια ανά μάζα ή ποσότητα). Στη φυσική η ενέργεια ανά σωματίδιο εκφράζεται συνήθως σε ηλεκτρονιοβόλτ που αντιστοιχεί σε περίπου 100 kJ mol−1.
Όλα τα στοιχεία στις πρότυπές τους καταστάσεις (αέριο οξυγόνο, στερεός άνθρακας με τη μορφή γραφίτη, κλπ.) έχουν μια πρότυπη ενθαλπία σχηματισμού ίση με μηδέν, επειδή δεν υπεισέρχεται καμία μεταβολή στον σχηματισμό τους.
Η αντίδραση σχηματισμού είναι μια διεργασία κάτω από σταθερή πίεση και θερμοκρασία. Επειδή η πίεση της πρότυπης αντίδρασης σχηματισμού είναι καθορισμένη στη 1 atm, η πρότυπη ενθαλπία σχηματισμού ή θερμότητα αντίδρασης είναι μια συνάρτηση της θερμοκρασίας. Για σκοπούς ταξινόμησης, οι πρότυπες ενθαλπίες σχηματισμού δίνονται σε μία μόνο θερμοκρασία: 298 K, που παριστάνεται με το σύμβολο ΔHf298O .
.
Υπολογισμός
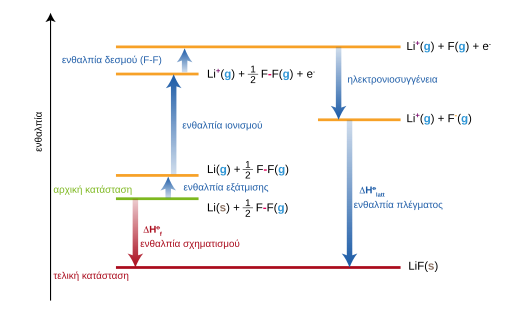
Η πρότυπη ενθαλπία σχηματισμού είναι ισοδύναμη με το άθροισμα των πολλών διακριτών διεργασιών που περιλαμβάνονται στον κύκλο Μπορν-Χάμπερ (Born-Haber cycle) των αντιδράσεων σύνθεσης. Παραδείγματος χάρη, για τον υπολογισμό της πρότυπης ενθαλπίας σχηματισμού του χλωριούχου νατρίου, χρησιμοποιούμε την παρακάτω αντίδραση:
- Na(s) + (1/2)Cl2(g) → NaCl(s)
Αυτή η διεργασία αποτελείται από πολλές ξεχωριστές υποδιεργασίες, με καθεμιά της να έχει τη δικιά της ενθαλπία. Συνεπώς, πρέπει να λάβουμε υπόψη:
Πρότυπη ενθαλπία σχηματισμού του διαγράμματος Μπορν-Χάμπερ για το φθοριούχο λίθιο.
Την πρότυπη ενθαλπία ατομοποίησης (standard enthalpy of atomization) του στερεού νατρίου
Την πρώτη ενέργεια ιονισμού (first ionization energy) του αέριου νατρίου
Την πρότυπη ενθαλπία ατομοποίησης του αέριου χλωρίου
Την ηλεκτρονιακή συγγένεια των ατόμων του χλωρίου
Την ενθαλπία πλέγματος του χλωριούχου νατρίου
Το άθροισμα όλων αυτών των τιμών θα δώσει την πρότυπη ενθαλπία σχηματισμού του χλωριούχου νατρίου.
Επιπλέον, η εφαρμογή του νόμου του Χες (Hess's Law) δείχνει ότι το άθροισμα των επιμέρους αντιδράσεων που αντιστοιχούν στην ενθαλπία σχηματισμού για κάθε ουσία στην αντίδραση ισούται με την ενθαλπία της συνολικής αντίδρασης, ανεξάρτητα από τον αριθμό των βημάτων ή των επιμέρους ενδιάμεσων αντιδράσεων. Αυτό συμβαίνει, επειδή η ενθαλπία είναι μια καταστατική συνάρτηση (ή ιδιότητα) (state function). Στο παραπάνω παράδειγμα η πρότυπη ενθαλία σχηματισμού για το χλωριούχο νάτριο ισούται με το άθροισμα των πρότυπων ενθαλπιών σχηματισμού (standard enthalpy change of formation) για καθένα από τα επιμέρους βήματα στη διεργασία. Αυτό είναι ιδιαίτερα χρήσιμο για πολύ μεγάλες αντιδράσεις με πολλά ενδιάμεσα στάδια και ενώσεις.
Οι χημικοί μπορούν να χρησιμοποιήσουν τις πρότυπες ενθαλπίες σχηματισμού για μια αντίδραση που είναι υποθετική. Παραδείγματος χάρη, ο άνθρακας και το υδρογόνο δεν θα αντιδράσουν άμεσα για το σχηματισμό μεθανίου, αλλά η πρότυπη ενθαλπία σχηματισμού για το μεθάνιο έχει προσδιοριστεί −74.8 kJ mol−1 από τη χρήση άλλων γνωστών πρότυπων ενθαλπιών αντίδρασης με τον νόμο του Χες. Το ότι η αντίδραση αυτή είναι αρνητική δείχνει, ότι η αντίδραση είναι εξώθερμη· δηλαδή ότι ενθαλπικά είναι πιο σταθερή από το αέριο υδρογόνο και τον άνθρακα.
Είναι δυνατή η πρόβλεψη των θερμοτήτων σχηματισμού για απλές οργανικές ενώσεις με τη μέθοδο της θερμότητας σχηματισμού με προσθήκη ομάδων (Heat of formation group additivity).
Πρότυπη ενθαλπία αντίδρασης
Οι πρότυπες ενθαλπίες σχηματισμού χρησιμοποιούνται στη θερμοχημεία για την εύρεση της πρότυπης ενθαλπίας των αντιδράσεων (Standard enthalpy of reaction)]. Αυτό γίνεται αφαιρώντας το άθροισμα των πρότυπων ενθαλπιών σχηματισμού αντιδρώντων (που το καθένα τους πολλαπλασιάζεται με τον αντίστοιχο στοιχειομετρικό συντελεστή, ν) από το άθροισμα των πρότυπων ενθαλπιών σχηματισμού των προϊόντων (που το καθένα τους πολλαπλασιάζεται επίσης με τον αντίστοιχο στοιχειομετρικό συντελεστή), όπως φαίνεται στην παρακάτω ισότητα:
- ΔH° = Σ(ν × ΔHf°) (προϊόντα) - Σ(ν × ΔHf°) (αντιδρώντα)
Αυτός ο υπολογισμός έχει μια υπονοούμενη υπόθεση ότι τα διαλύματα μεταξύ αντιδρώντων και προϊόντων είναι ιδανικά όπου η ενθαλπία ανάμειξης (enthalpy of mixing) είναι μηδέν.
Παραδείγματος χάρη, για την αντίδραση CH4 + 2 O2 → CO2 + 2 H2O:
- ΔHr° = [(1 × ΔHf°(CO2)) + (2 × ΔHf°(H2O))] (προϊόντα) - [(1 × ΔHf°(CH4)) + (2 × ΔHf°(O2))] (αντιδρώντα)
Αν η πρότυπη ενθαλπία των προϊόντων είναι μικρότερη από την πρότυπη ενθαλπία των αντιδρώντων, η πρότυπη ενθαλπία της αντίδρασης θα είναι αρνητική. Αυτό σημαίνει ότι η αντίδραση είναι εξώθερμη. Το αντίστροφο ισχύει επίσης· η πρότυπη ενθαλπία της αντίδρασης θα είναι θετική για μια ενδόθερμη αντίδραση.
Βασικές έννοιες για τον υπολογισμό της ενθαλπίας
Όταν η αντίδραση αντιστρέφεται, το μέγεθος του ΔH παραμένει το ίδιο, αλλά το πρόσημο αλλάζει.
Όταν η εξισορροπημένη αντίδραση για μια αντίδραση πολλαπλασιάζεται με έναν ακέραιο, η αντίστοιχη τιμή του ΔH πρέπει να πολλαπλασιαστεί με αυτόν τον ακέραιο, επίσης.
Η μεταβολή της ενθαλπίας για μια αντίδραση μπορεί να υπολογιστεί από τις ενθαλπίες σχηματισμού των αντιδρώντων και των προϊόντων
Τα στοιχεία στις πρότυπες καταστάσεις τους δεν συνεισφέρουν στους υπολογισμούς της ενθαλπίας της αντίδρασης αφού η ενθαλπία ενός στοιχείου στην πρότυπη κατάστασή του είναι μηδέν. Οι άλλες αλλοτροπικές μορφές ενός στοιχείου πέρα από την πρότυπη κατάσταση έχουν γενικά μη μηδενικές πρότυπες ενθαλπίες σχηματισμού.
Υποπκατηγορίες
Η πρότυπη ενθαλπία εξουδετέρωσης (Standard enthalpy of neutralization) είναι η μεταβολή της ενθαλπίας που συμβαίνει όταν οξύ και βάση of sublimation), ή θερμότητα εξάχνωσης, ορίζεται ως η απαιτούμενη ενθαλπία για την εξάχνωση ενός mol της ουσίας κάτω από πρότυπες συνθήκες, όπως ορίστηκε προηγουμένως.
Η πρότυπη ενθαλπία διαλύματος (Standard enthalpy of solution) (ή μεταβολή της ενθαλπίας διάλυσης (enthalpy change of dissolution) ή θερμότητα διαλύματος (heat of solution)) είναι η μεταβολή της ενθαλπίας που σχετίζεται με τη διάλυση μιας ουσίας σε έναν διαλύτη σε σταθερή πίεση κάτω από πρότυπες συνθήκες, όπως ορίστηκε προηγουμένως.
Η πρότυπη ενθαλπία υδρογόνωσης (Standard enthalpy of hydrogenation) ορίζεται ως η μεταβολή της ενθαλπίας που παρατηρείται όταν ένα mol μιας ακόρεστης ένωσης αντιδρά με περίσσεια υδρογόνου για να κορεστεί πλήρως κάτω από πρότυπες συνθήκες, όπως ορίστηκε προηγουμένως.
Παραδείγματα: Πρότυπες ενθαλπίες σχηματισμού (στους 25°C, 298 K)
Χ
| Χημική ένωση | Φάση | Χημικός τύπος | Δ Hf0 σε kJ/mol |
|---|---|---|---|
| Προπανόνη | l | C3H6O | −248,4 |
| Αιθίνιο | g | C2H2 | +227,4 |
| Αμμωνία (Υδροξείδιο του αμμωνίου) | aq | NH3 (NH4OH) | −80,8 |
| Αμμωνία | g | NH3 | −46,1 |
| Νιτρικό αμμώνιο | s | NH4NO3 | −365,6 |
| Βενζόλιο | l | C6H6 | +49,1 |
| Βρώμιο | l | Br2 | 0 |
| Βρώμιο | g | Br2 | +31 |
| Βρώμιο | g | Br | +111,9 |
| Υδροβρώμιο | g | HBr | −36,3 |
| Ασβέστιο | s | Ca | 0 |
| Οξείδιο του ασβεστίου | s | CaO | −634,9 |
| Ανθρακικό ασβέστιο | s | CaCO3 | −1207,6 |
| Άνθρακας | s | C (graphite) | 0 |
| Άνθρακας | s | C (diamond) | +1,88 |
| Μονοξείδιο του άνθρακα | g | CO | −110,5 |
| Διοξείδιο του άνθρακα | g | CO2 | −393,5 |
| Χλώριο | g | Cl2 | 0 |
| Χλώριο | g | Cl | +121,3 |
| Υδροχλώριο | g | HCl | −92,3 |
| Θειικός χαλκός | aq | CuSO4 | −769,98 |
| Αιθάνιο | g | C2H6 | −84,68 |
| Αιθανόλη | l | C2H5OH | −277,6 |
| Αιθένιο | g | C2H4 | +52,4 |
| Φθόριο | g | F2 | 0 |
| Φθόριο | g | F | +79,38 |
| Υδροφθορικό οξύ | g | HF | −273,3 |
| Γλυκόζη | s | C6H12O6 | −1273,3 |
| Υδρογόνο | g | H2 | 0 |
| Ιώδιο | s | I2 | 0 |
| Ιώδιο | g | I2 | +62 |
| 2-προπανόλη | g | C3H7OH | −318,1 |
| Μεθάνιο | g | CH4 | −74,87 |
| Μεθανόλη | l | CH3OH | −238,6 |
| Άζωτο | g | N2 | 0 |
| Διοξείδιο του αζώτου | g | NO2 | +33,2 |
| Μονοξείδιο του αζώτου | g | NO | +91,3 |
| Οξυγόνο | g | O2 | 0 |
| Όζον | g | O3 | +142,7 |
| Προπάνιο | g | C3H8 | −103,85 |
| Νάτριο | s | Na | 0 |
| Νάτριο | g | Na | +107,5 |
| Όξινο ανθρακικό νάτριο | s | NaHCO3 | −950,8 |
| Ανθρακικό νάτριο | s | Na2CO3 | −1131 |
| Χλωριούχο νάτριο (επιτραπέζιο αλάτι) | aq | NaCl | −407 |
| Χλωριούχο νάτριο (επιτραπέζιο αλάτι) | s | NaCl | −411,12 |
| Χλωριούχο νάτριο (επιτραπέζιο αλάτι) | l | NaCl | −385,92 |
| Χλωριούχο νάτριο (επιτραπέζιο αλάτι) | g | NaCl | −181,42 |
| Υδροξείδιο του νατρίου | aq | NaOH | −470,1 |
| Υδροξείδιο του νατρίου | s | NaOH | −426,7 |
| Νιτρικό νάτριο | aq | NaNO3 | −446,2 |
| Νιτρικό νάτριο | s | NaNO3 | −424,8 |
| Ζάχαρη | s | C12H22O11 | −2226,1 |
| Θείο (μονοκλινές) | s | S8 | 0,3 |
| Sulfur (ρομβικό) | s | S8 | 0 |
| Διοξείδιο του θείου | g | SO2 | −296,8 |
| τριοξείδιο του θείου | g | SO3 | −395,7 |
| Θειικό οξύ | l | H2SO4 | −814 |
| Διοξείδιο του πυριτίου | s | SiO2 | −911 |
| Άργυρος | s | Ag | 0 |
| Χλωριούχος άργυρος | s | AgCl | −127,0 |
| Νερό | l | H2O | −285,8 |
| Υδρατμός | g | H2O | −241,82 |
| Θειικός ψευδάργυρος | s | ZnSO4 | −980,14 |
(Κατάσταση: g = αέρια· l = υγρή· s = στερεή· aq = υδατική)
Δείτε επίσης
Θερμοχημεία
Ενθαλπία
Θερμιδομετρία
Εξωτερικοί σύνδεσμοι
NIST Chemistry WebBook
Παραπομπές
[2]
Principles of Modern Chemistry 547p
Zumdahl, Steven (2009). Chemical Principles, Ed. 6 p. 384-387. Houghton Mifflin, Boston. New York. ISBN 978-0-547-19626-8.
Hellenica World - Scientific Library
Από τη ελληνική Βικιπαίδεια http://el.wikipedia.org . Όλα τα κείμενα είναι διαθέσιμα υπό την GNU Free Documentation License