Ο όρος οξειδοαναγωγή περιγράφει όλες τις χημικές αντιδράσεις κατά τις οποίες τα άτομα των στοιχείων που συμμετέχουν αλλάζουν αριθμό οξείδωσης. Η διαδικασία της οξειδοαναγωγής μπορεί να γίνεται σχετικά απλά και γρήγορα, όπως η οξείδωση του άνθρακα από το οξυγόνο προς διοξείδιο του άνθρακα, ή μπορεί να είναι μια πολύπλοκη διαδικασία, όπως η οξείδωση της γλυκόζης στους οργανισμούς, η οποία επιτυγχάνεται μέσω πολύπλοκων διεργασιών μεταφοράς ηλεκτρονίων.
Ιστορία της οξειδοαναγωγής
Οι απόψεις το 17ο αιώνα
Η εξερεύνηση της φύσης του φαινομένου της οξείδωσης ξεκίνησε γύρω στο 1718, όταν ο Γερμανός χημικός Σταλ (Georg Ernst Stahl) διατύπωσε την άποψη ότι ο σχηματισμός των μετάλλων από τα οξείδιά τους, κατά τη θέρμανσή τους με άνθρακα, οφείλεται στην απορρόφηση μιας ουσίας την οποία ονόμασε "φλογιστόν". Αντίθετα, η θέρμανση των μετάλλων στον αέρα που οδηγεί στο σχηματισμό οξειδίων συνοδεύεται από ελευθέρωση του φλογιστού. Το φλογιστόν, ανάλογα με το χημικό φαινόμενο, μπορούσε να έχει ή να μην έχει βάρος ή ακόμα να έχει "αρνητικό βάρος". Η θεωρία του φλογιστού απέκτησε πολλούς και φανατικούς οπαδούς. Το 1772, ο θεμελιωτής της σύγχρονης χημείας Λαβουαζιέ (Antoine Lavoisier) υποστήριξε ότι η αύξηση του βάρους των μετάλλων κατά τη θέρμανσή τους, οφείλεται στην πρόσληψη οξυγόνου από την ατμόσφαιρα και όχι φλογιστού. Ο σχηματισμός των μετάλλων από τα οξείδιά τους αντιστοιχεί σε απώλεια οξυγόνου. Οι απόψεις του Lavoisier δεν έγιναν δεκτές αρχικά από τους περισσότερους Γάλλους επιστήμονες της εποχής γιατί αυτοί ήταν φανατικοί υποστηρικτές της θεωρίας του φλογιστού.
Οι απόψεις το 19ο αιώνα
Σε όλη τη διάρκεια του 19ου αιώνα, ως οξείδωση θεωρούνταν η πρόσληψη οξυγόνου από μια ουσία. Έτσι, η ένωση ενός στοιχείου με το οξυγόνο χαρακτηρίζονταν ως οξείδωση π.χ. Mg + 1/2O2 → MgO ή C + O2 → CO2. Στις αντιδράσεις αυτές το οξυγόνο χαρακτηρίστηκε ως οξειδωτικό μέσο επειδή ενώνονταν με το μαγνήσιο (Mg) και τον άνθρακα (C).
Αναγωγή ήταν η αφαίρεση οξυγόνου. Έτσι στην αντίδραση Fe2O3 + 3H2 → 2Fe + 3H2O, αφαιρείται οξυγόνο από το οξείδιο του σιδήρου (ΙΙΙ) (Fe2O3). Το υδρογόνο (Η2) των αντιδρώντων χαρακτηρίστηκε ως αναγωγικό μέσο.
Δηλαδή, παλιότερα η οξείδωση και η αναγωγή ήταν αντιδράσεις που συνδέονταν με την εκ των υστέρων ή εκ των προτέρων εμφάνιση οξυγόνου στο μόριο μιας χημικής ένωσης. Λίγο αργότερα, ο όρος οξείδωση χρησιμοποιήθηκε και για την αφαίρεση υδρογόνου (αφυδρογόνωση) από μία ένωση π.χ. CH3OH → HCHO + H2. Αντίστοιχα η πρόσληψη υδρογόνου (υδρογόνωση) από μία ουσία χαρακτηρίστηκε ως αναγωγή π.χ. H2 + Cl2 → 2HCl.
Αρχές του 20ου αιώνα
Μετά την ανακάλυψη της ηλεκτρονικής δομής των ατόμων, διαπιστώθηκε ότι γενικά οι αντιδράσεις των μετάλλων με τα αμέταλλα γίνονται με τον ίδιο μηχανισμό που πραγματοποιούνται οι αντιδράσεις του οξυγόνου με τα μέταλλα.
Έτσι, και στις δύο αντιδράσεις Ca + 1/2O2 ⟶ CaO (1) και Ca + Cl2 ⟶ CaCl2 (2) το άτομο Ca αποβάλλει 2 ηλεκτρόνια από την εξωτερική του στιβάδα μετατρεπόμενο έτσι σε κατιόν Ca2+ : Ca ⟶ Ca2+ + 2e.
Τα δύο ηλεκτρόνια που αποβάλλονται στη μεν αντίδραση (1) προσλαμβάνονται από το άτομο Ο το οποίο μετατρέπεται σε ανιόν : 1/2O2 + 2e ⟶ O2- στη δε αντίδραση (2) τα ηλεκτρόνια προσλαμβάνονται από δύο άτομα Cl που μετατρέπονται έτσι σε ανιόντα Cl2 + 2e ⟶ 2Cl-
Και στις δύο αντιδράσεις έχουμε μεταφορά ηλεκτρονίων και σχηματισμό ετεροπολικού δεσμού. Συνεπώς σύμφωνα με την παλαιότερη ηλεκτρονική θεωρία :
Οξείδωση ενός στοιχείου είναι η αποβολή ηλεκτρονίων από αυτό.
Αναγωγή ενός στοιχείου είναι η πρόσληψη ηλεκτρονίων από αυτό.
Φυσικά οξείδωση και αναγωγή γίνονται πάντα ταυτόχρονα οπότε μπορούμε να πούμε ότι :
Οξειδοαναγωγή είναι η μετακίνηση ηλεκτρονίων μεταξύ ατόμων.
Όπως φαίνεται, οι παραπάνω ορισμοί παρουσιάζουν τα εξής πλεονεκτήματα :
- Η οξειδοαναγωγή επεκτείνεται σε όλες τις αντιδράσεις μεταφοράς ηλεκτρονίων χωρίς να είναι απαραίτητη η παρουσία Ο2 ή Η2.
- Εμφανίζονται δύο ημιαντιδράσεις που γίνονται βέβαια ταυτόχρονα π.χ. :
Ca ⟶ Ca2+ + 2e (ημιαντίδραση οξείδωσης)
Cl2 + 2e ⟶ 2Cl- (ημιαντίδραση αναγωγής)
- Με πρόσθεση κατά μέλη παίρνουμε :
Ca + Cl2 ⟶ CaCl2 (αντίδραση οξειδοαναγωγής)
Παρόλο που οι ορισμοί αυτοί πλεονεκτούν σαφώς έναντι εκείνων του 19ου αιώνα, έχουν και τα εξής πολύ σοβαρά μειονεκτήματα:
Η2 + F2 ⟶ 2HF
- Καλύπτουν μόνο τις περιπτώσεις σχηματισμού ετεροπολικών ενώσεων στις οποίες υπάρχει μεταφορά (αποβολή+πρόσληψη) ηλεκτρονίων.
- Αποδεικνύονται ανεπαρκείς για το σχηματισμό ομοιοπολικών ενώσεων (π.χ. C + O2 ⟶ CO2) στις οποίες δεν παρατηρείται μετακίνηση αλλά αμοιβαία συνεισφορά ηλεκτρονίων. Αν όμως η ομοιοπολική ένωση έχει έντονο ετεροπολικό χαρακτήρα, τότε οι παραπάνω ορισμοί είναι ικανοποιητικοί. Παράδειγμα αποτελεί το πολικό μόριο HF (διπλανή εικόνα) που έχει 43 % ετεροπολικό χαρακτήρα και 57 % ομοιοπολικό λόγω μεγάλης διπολικής ροπής (1,91 D).
Η οξειδοαναγωγή σήμερα
Για να συμπεριληφθούν όλα τα παρόμοια φαινόμενα (και στις ετεροπολικές και στις ομοιοπολικές ενώσεις), δημιουργήθηκε η ανάγκη να οριστούν τα φαινόμενα οξείδωσης κι αναγωγής πάνω σε νέα βάση.
Σύγχρονες απόψεις και ορισμοί
Παρατηρήθηκε ότι σε διάφορες οξειδοαναγωγικές αντιδράσεις που καλύπτονταν από τους υπάχοντες ορισμούς αλλά και σε αντιδράσεις που δεν καλύπτονταν, μεταβάλλονταν οι αριθμοί οξείδωσης (α.ο) κάποιων ατόμων που συμμετείχαν στα φαινόμενα :
- Στην αντίδραση μεταξύ ομοιοπολικών ενώσεων : H2 + Cl2 ⟶ 2HCl είναι α.ο. Η (στο Η2) = 0 ενώ α.ο. Η (στο HCl) = +1. Ανάλογα είναι α.ο. Cl (στο Cl2) = 0 και α.ο. Cl (στο HCl) = -1.
- Στην αντίδραση μεταξύ ετεροπολικών ενώσεων : Mg + 1/2O2 ⟶ MgO είναι α.ο. Mg = 0 και α.ο. Mg (στο MgΟ) = +2, ενώ α.ο. Ο (στο Ο2) = 0 και α.ο. Ο (στο MgO) = -2.
Από αυτές και άλλες παρόμοιες αντιδράσεις συνάγονται οι ορισμοί που ισχύουν σήμερα για τα φαινόμενα οξείδωσης και αναγωγής :
Οξείδωση ονομάζεται το φαινόμενο της αλγεβρικής αύξησης του αριθμού οξείδωσης ενός ατόμου ή ιόντος και αναγωγή το φαινόμενο της αλγεβρικής ελάττωσης του αριθμού οξείδωσης ενός ατόμου ή ιόντος.
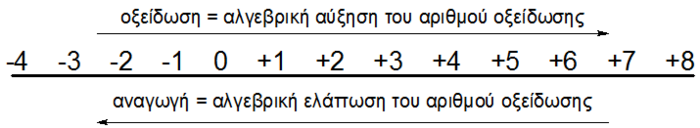
Δεν έχει σημασία αν οι μεταβολές αυτές του α.ο. προκαλούνται από τη μεταβίβαση ή την αμοιβαία συνεισφορά ηλεκτρονίων.
Οξείδωση και αναγωγή γίνονται πάντα ταυτόχρονα οπότε το συνολικό φαινόμενο λέγεται οξειδοαναγωγή.
Οξειδωτικά και αναγωγικά σώματα
Κύριο λήμμα: Οξειδοαναγωγικά σώματα
Στις οξειδοαναγωγικές αντιδράσεις διακρίνουμε το οξειδωτικό μέσο και το αναγωγικό μέσο.
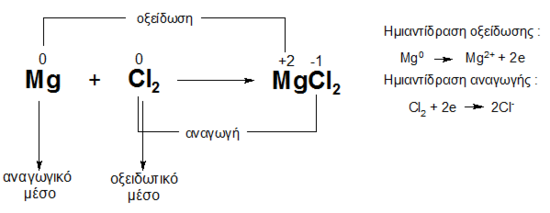
Οξειδοαναγωγικές αντιδράσεις
Oι αντιδράσεις στις οποίες παρατηρείται το φαινόμενο της οξειδοαναγωγής ονομάζονται οξειδοαναγωγικές αντιδράσεις και ταξινομούνται σε διάφορες κατηγορίες όπως αντιδράσεις σύνθεσης, αντιδράσεις αποσύνθεσης, αντιδράσεις απλής αντικατάστασης κ.λ.π. Για το σημαντικό ρόλο των οξειδοαναγωγικών αντιδράσεων στη ζωή μας αρκεί να αναφέρουμε ότι οι βασικές βιολογικές αντιδράσεις καθώς και οι αντιδράσεις καύσης που αποτελούν την κύρια πηγή ενέργειας, είναι αντιδράσεις οξειδοαναγωγής. Αλλά εκτός απ' αυτές, πολυάριθμες αντιδράσεις οξειδοαναγωγής έχουν μεγάλη σημασία στην τεχνολογία για την παραγωγή χρήσιμων προϊόντων, ενώ άλλες έχουν ιδιαίτερη περιβαλλοντική σημασία.
Ταξινόμηση αντιδράσεων οξειδοαναγωγής
Το σύνολο των οξειδοαναγωγικών αντιδράσεων μπορούμε να το ταξινομήσουμε στις παρακάτω κατηγορίες αντιδράσεων :
Αντιδράσεις σύνθεσης
Αντιδράσεις αποσύνθεσης ή διάσπασης
Αντιδράσεις απλής αντικατάστασης
Πολύπλοκες οξειδοαναγωγικές αντιδράσεις
Αντιδράσεις αυτοξειδοαναγωγής
Η σημασία της οξειδοαναγωγής στη ζωή και στην τεχνολογία
Ο ρόλος των οξειδοαναγωγικών φαινομένων στη ζωή είναι θεμελιώδης. Όλες οι βασικές βιολογικές αντιδράσεις (συμπεριλαμβανομένων των καύσεων) που γίνονται μέσα στους ζωντανούς οργανισμούς είναι οξειδοαναγωγικές. Τα οξειδοαναγωγικά φαινόμενα εμφανίζονται πολύ συχνά και στη βιομηχανία. Οι μεταλλουργικές κατεργασίες αποτελούν εφαρμογές αυτών των φαινομένων. Αλλά και στην αναλυτική χημεία έχουν μεγάλη εφαρμογή όπως σε διαλυτοποίηση, διαχωρισμό, καταβύθιση, καθώς και σε ογκομετρικούς προσδιορισμούς. Παρακάτω αναφέρονται ορισμένοι μόνο τομείς στους οποίους είναι φανερή η χρησιμότητα των οξειδοαναγωγικών αντιδράσεων:
Ο μεταβολισμός στους ζωικούς οργανισμούς
Ο μεταβολισμός είναι μία σύνθετη λειτουργία κάθε ζωντανού οργανισμού με την οποία αυτός ανταλλάσσει ύλη και ενέργεια με το περιβάλλον του. Περιλαμβάνει αντιδράσεις "καταβολικές" κατά τις οποίες γίνεται διάσπαση ουσιών και ελευθέρωση ενέργειας και αντιδράσεις "αναβολικές" κατά τις οποίες γίνεται σύνθεση ενώσεων από άλλες με κατανάλωση ενέργειας. Η απαραίτητη ενέργεια προέρχεται από την αναπνοή των κυττάρων και στη συνέχεια με την καύση, παρουσία βιολογικών καταλυτών (ένζυμα), ουσιών όπως η γλυκόζη (C6H12O6): C6H12O6 + 6O2 → 6CO2 + 6H2O + Ενέργεια. Σ'αυτή την αντίδραση, η γλυκόζη οξειδώνεται προς CO2 και το Ο2 ανάγεται προς νερό.
Φωτοσύνθεση
Κύριο λήμμα: Φωτοσύνθεση
Όλη η ενέργεια που χρειάζονται οι φυτικοί οργανισμοί για να βιοσυνθέσουν τα κυτταρικά τους συστατικά, προέρχεται άμεσα ή έμμεσα από την ηλιακή ακτινοβολία η οποία δεσμεύεται από την χλωροφύλλη με το μηχανισμό της φωτοσύνθεσης που είναι κατά κάποιο τρόπο η αντίστροφη διαδικασία της κυτταρικής αναπνοής. Η φωτοσύνθεση περιλαμβάνει δύο στάδια βιοχημικών αντιδράσεων. Η συνολική αντίδραση μπορεί να παρασταθεί με την παρακάτω χημική εξίσωση, από την οποία φαίνεται ότι το CO2 ανάγεται προς σάκχαρα (γλυκόζη) και το νερό οξειδώνεται προς Ο2 : 6CO2 + 6H2O → C6H12O6 + 6O2 - Q.
Βιολογικές διεργασίες και οξειδοαναγωγικοί κύκλοι
Ο κύκλος του Krebs είναι ένας από τους σημαντικότερους οξειδοαναγωγικούς βιολογικούς κύκλους
Η σημαντικότερη, ενεργειακά, αντίδραση για τους ζωντανούς οργανισμούς είναι η αναγωγή του οξυγόνου. Έτσι, πολύπλοκα μόρια διασπώνται σε κομμάτια αποτελούμενα από ομάδες με μόνο 2 άτομα άνθρακα (οξικές ομάδες). Σε επόμενο στάδιο οι ομάδες διασπώνται και δημιουργούνται μόρια CO2 και άτομα Η. Το τελικό προϊόν, το νερό, δημιουργείται από τα συνένζυμα της αναπνοή|αναπνευστικής αλυσίδας που έχουν αναχθεί, με ταυτόχρονη αποθήκευση μέρους της ενέργειας που παράγεται στους χημικούς δεσμούς του αδενοσινοτριφωσφορικού οξέος (ATP). Όλοι αυτοί οι μετασχηματισμοί γίνονται με βιοχημικούς κύκλους που είναι μεταβολικές διαδικασίες που αποτελούμενες από οξειδοαναγωγικές αντιδράσεις η σπουδαιότητα των οποίων είναι πάρα πολύ μεγάλη για τα φαινόμενα της ζωής. Ενδεικτικά αναφέρονται :
Η αναπνευστική αλυσίδα.
Η οξειδωτική φωσφορυλίωση.
Ο κύκλος Calvin-Benson.
Ο κύκλος του Krebs (κύκλος κιτρικού οξέος).
Ο κύκλος του γλυοξυλικού οξέος.
Οι μεταβολισμοί των υδατανθράκων, λιποειδών, αμινοξέων, νουκλεϊνικών οξέων, πρωτεϊνών κ.λ.π.
Μεταλλουργία
Κύριο λήμμα: Μεταλλουργία
Τα μέταλλα συνήθως περιέχονται στα μεταλλεύματά τους. Το σύνολο των φυσικοχημικών διεργασίων που πρέπει να γίνουν για να παρασκευαστεί ένα μέταλλο από το μετάλλευμά του, λέγεται μεταλλουργία. Οι περισσότερες χημικές αντιδράσεις που χρησιμοποιούνται στη μεταλλουργία είναι οξειδοναγωγικές. Επειδή τα μεταλλεύματα περιέχουν τα περισσότερα μέταλλα με μορφή ενώσεων (αλάτων, οξειδίων κ.λ.π.), οι μέθοδοι εξαγωγής βασίζονται στην αναγωγή των ενώσεων αυτών, οπότε το μέταλλο από θετικό αριθμό οξείδωσης που έχει αποκτά αριθμό οξείδωσης 0. Η αναγωγή γίνεται με διάφορα αναγωγικά όπως ο C, το Al κ.ά. Παραδείγματα :
- Η παραλαβή του Cr από το Cr2O3 (αργιλιοθερμική μέθοδος) : Cr2O3 + 2Al → Al2O3 + 2Cr.
- Παραλαβή μετάλλων με αναγωγή των οξειδίων τους με μεταλλουργικό κωκ : M2Ox + xC → 2M + xCO όπου Μ = Pb, Sn, Bi, Cu, Zn, Co, Mg και x = α.ο. του Μ.
Αλλά και άλλες μεταλλουργικές διεργασίες στηρίζονται σε οξειδοαναγωγικές αντιδράσεις :
- Κυανίωση : 2Na[M(CN)2] + Zn → Na2[Zn(CN)4] + 2M όπου Μ = Ag, Au.
- Ηλεκτρολυτική αναγωγή τήγματος ή διαλύματος.
- Θερμική διάσπαση συμπλόκου : Ni(CO)4 → Ni + 4CO.
- Κυπέλλωση για την παρασκευή Ag από ορυκτά μολύβδου.
- Αμαλγάμωση για την παραλαβή Hg κ.λ.π.
Εκρηκτικές ύλες
Κόκκοι μαύρης πυρίτιδας
Οι εκρηκτικές ύλες είναι μίγματα που περιέχουν ισχυρά οξειδωτικές και αναγωγικές ενώσεις οι οποίες υπό κατάλληλες συνθήκες αντιδρούν μεταξύ τους βίαια και ταχύτατα προκαλώντας έκρηξη. Οι χημικές αντιδράσεις που πραγματοποιούνται κατά τη διάρκεια μιας έκρηξης είναι οξειδοαναγωγικές. Ενδεικτικά αναφέρονται :
- Η μαύρη πυρίτιδα που είναι μίγμα αποτελούμενο από KNO3, S και ξυλάνθρακα (C). Οι οξειδοαναωγικές αντιδράσεις που γίνονται είναι πολλές και διάφορες όπως π.χ. 2KNO3 + C + 2S → K2SO4 + CO2 + N2 κ.ά.
- Η τρινιτροτολουόλη η έκρηξη της οποίας βασίζεται στην παραγωγή μεγάλου όγκου αερίων σύμφωνα με την αντίδραση : 2C7H5N3O6 → 3N2 + 5H2O + 7CO + 7C.
- Η νιτρογλυκερίνη με τύπο C3H5N3O9 κ.ά.
Διάβρωση των μετάλλων
Διάβρωση μετάλλου
Πολλά μέταλλα οξειδώνονται από το Ο2 της ατμόσφαιρας και γι' αυτό τα υποβάλλουμε σε κατεργασίες με σκοπό να καλυφθούν εξωτερικά με προστατευτικά μεταλλικά ή οργανικά επιστρώματα. Για παράδειγμα ο άργυρος όταν παραμείνει για πολύ στον αέρα καλύπτεται από στρώμα μελανού Ag2S που σχηματίζεται από την επίδραση του υδρόθειου της ατμόσφαιρας σύμφωνα με την οξειδοαναγωγική αντίδραση : 2Ag + 1/2 O2 + H2S → Ag2S + H2O.
Τα μέταλλα των αλκαλίων και των αλκαλικών γαιών οξειδώνονται γρήγορα όταν εκτεθούν στην ατμόσφαιρα : Ca + 1/2O2 → CaO.
Η γνωστότερη περίπτωση διάβρωσης είναι αυτή του σιδήρου (καστανέρυθρη σκουριά) η οποία είναι εντονότερη όταν ο αέρας έχει υγρασία. Η σκουριά έχει μεταβλητή σύσταση και αποδίδεται με τύπο της μορφής Fe2O3.xH2O. Η σχετική οξειδοναγωγική αντίδραση αποδίδεται ως : 4Fe + 3O2 + xH2O → 2Fe2O3.xH2O.
Καύση των καυσίμων
Κύριο λήμμα: Καύση
Η κυριότερη πηγή ενέργειας στην ανθρώπινη τεχνολογία είναι η καύση διαφόρων καυσίμων, όπως το πετρέλαιο (μίγμα υδρογοναθράκων κυρίως αλκανίων, ο άνθρακας (με τις διάφορες μορφές γαιανθράκων) και το φυσικό αέριο (που περιέχει 90% μεθάνιο). Όλες οι καύσεις είναι οξειδοαναγωγικά φαινόμενα. Έτσι, π.χ. για το οκτάνιο που είναι συστατικό της βενζίνης θα έχουμε την ακόλουθη οξειδοαναγωγική αντίδραση καύσης : C8H18 + 25/2O2 → 8CO2 + 9H2O. Η καύση μπορεί να πραγματοποιηθεί και χωρίς την παρουσία Ο2. Το οξείδιο του χαλκού (ΙΙ) μπορεί να πραγματοποιήσει καύσεις. Π.χ. για το οινόπνευμα (C2H6O) θα έχουμε : C2H6O + 6CuO → 2CO2 + 3H2O + 6Cu. Λεύκανση των υφασμάτων
Τα λευκαντικά είναι χημικές ενώσεις που χρησιμοποιούνται στην κλωστοϋφαντουργία για τον αποχρωματισμό ρούχων. Παλιότερα η λεύκανση επιτυγχάνονταν με έκθεση στον ήλιο και τον αέρα. Σήμερα όμως οι περισσότεροι λευκαντικοί παράγοντες του εμπορίου είναι ουσίες, όπως το υποχλωριώδες νάτριο (NaOCl) ή το υπεροξείδιο του υδρογόνου, οι οποίες επιτυγχάνουν αποχρωματισμό μέσω οξειδοαναγωγικών αντιδράσεων.
Λευκαντικά.png
Το υποχλωριώδες ανιόν που υπάρχει σε πολλά εμπορικά προϊόντα, ανάγεται προς ιόντα χλωρίου αποσπώντας ηλεκτρόνια από το έγχρωμο υλικό ενώ ταυτόχρονα τα ιόντα υδροξυλίου δημιουργούν βασικό διάλυμα, αποχρωματίζοντας έτσι το ρούχο : OCl- + 2e + H2O → Cl- + 2OH-.
Επεξεργασία αποβλήτων
Κομποστοποίηση
Τα οξειδοαναγωγικά φαινόμενα χρησιµοποιούνται ευρέως για την επεξεργασία τοξικών ή µη τοξικών υγρών αποβλήτων, πόσιµου νερού και αστικών λυµάτων. Ρύποι που υφίστανται επεξεργασία µε επιτυχία είναι :
Οργανικές ενώσεις όπως φαινόλες, ινδόλες, ζιζανιοκτόνα, χλωριωµένοι διαλύτες, πολυκυκλικοί αρωµατικοί υδρογονάνθρακες (PAHs), βενζόλιο και τολουόλιο.
Ανόργανες ενώσεις όπως θειούχα ιόντα, αµµωνία, κυανιούχα, βαρέα µέταλλα.
Οξειδωτικά µέσα που χρησιµοποιούνται µε επιτυχία είναι:
Αέριο χλώριο και υποχλωριώδη άλατα,
Υπεροξείδιο του υδρογόνου,
Υπερµαγγανικό κάλιο,
Οξυγόνο,
Όζον,
Αντιδραστήριο Fenton[1] κ.ά.
Οι οξειδοαναγωγικές δράσεις που πραγματοποιούνται είναι :
Οξείδωση στην αέρια φάση µε καθαρό οξυγόνο ή ατµοσφαιρικό αέρα.
Υγρή οξείδωση που τελείται είτε σε συνθήκες περιβάλλοντος – συνήθως µε χρήση καταλύτη – είτε σε υψηλές θερµοκρασίες και πιέσεις – σε κλασικά αυτόκλειστα δοχεία.
Καύση – αποτέφρωση.
Κομποστοποίηση[2].
Οζονόλυση.
Ηλεκτροχημεία
Κύριο λήμμα: Ηλεκτροχημεία
Οι μπαταρίες Ni-Cd αποτελούν εμπορική εφαρμογή της οξειδοαναγωγής
Η ηλεκτροχημεία είναι κλάδος της χημείας που μελετά τη μετατροπή της χημικής ενέργειας σε ηλεκτρική και το αντίστροφο. Οι μετατροπές αυτές στηρίζονται σε οξειδοαναγωγικά φαινόμενα :
- Αν η αυθόρμητη μεταφορά ηλεκτρονίων από το αναγωγικό στο οξειδωτικό γίνει σε κατάλληλη διάταξη, μπορούμε να έχουμε παραγωγή ηλεκτρικού ρεύματος και τη διάταξη τη λέμε ηλεκτροχημικό ή γαλβανικό στοιχείο. Οι συσσωρευτές μολύβδου, τα ξηρά στοιχεία Leclancè, οι αλκαλικές μπαταρίες αποτελούν μερικές εφαρμογές οξειδοαναγωγικών φαινομένω για εμπορική χρήση.
- Από την άλλη μεριά, με τη χρήση του ρεύματος τα ηλεκτρόνια μεταφέρονται κατά τη μη αυθόρμητη φορά, δηλαδή από το οξειδωτικό στο αναγωγικό. Τέτοια διαδικασία λέγεται ηλεκτρόλυση και η αντίστοιχη διάταξη λέγεται ηλεκτρολυτικό στοιχείο. Οι εφαρμογές της ηλεκτρόλυσης είναι πάρα πολλές : Ηλεκτροαπόκτηση, καθοδική προστασία, επιμετάλλωση, γαλβανοπλαστική κ.ά.
- Ενδεικτικά αναφέρονται μερικές οξειδοαναγωγικές δράσεις που γίνονται κατά την ηλεκτρόλυση :
- Κατά την ηλεκτρόλυση τήγματος NaCl, η συνολική οξειδοαναγωγική αντίδραση είναι : 2NaCl ⟶ 2Na + Cl2.
- Κατά την ηλεκτρόλυση τήγματος NaOH, η συνολική οξειδοαναγωγική αντίδραση είναι : 4NaOH ⟶ 4Na + 2H2O + O2.
- Κατά την ηλεκτρόλυση διαλύματος NaCl η συνολική αντίδραση είναι : 2H2O + 2NaCl ⟶ H2 + 2NaOH + Cl2.
- Πολλές οργανικές συνθέσεις είναι δυνατόν να παραχθούν οικονομικά με τη χρήσιμοποίηση ηλεκτροχημικών μεθόδων όπως π.χ. η παραγωγή αδιπονιτριλίου που είναι η πρώτη ύλη για την παρασκευή του nylon.
Δείτε επίσης
Αριθμός οξείδωσης
Οξειδοαναγωγικά σώματα
Οξειδοαναγωγικές αντιδράσεις
Αυτοξειδοαναγωγή
Κανονικό δυναμικό οξειδοαναγωγής
Σημειώσεις
Είναι συνδυασµός Η2Ο2 µε ιόντα Fe2+. Η δραστικότητά του παρατηρήθηκε για πρώτη φορά το 1894, αλλά η χρησιµότητά του αναγνωρίστηκε το 1930 όταν προσδιορίστηκε ο µηχανισµός του.
Είναι μια οξειδοαναγωγική διαδικασία κατά την οποία τα οργανικά απόβλητα (φρούτα, λαχανικά, φύλλα, κλαδέματα κ.α.) μετατρέπονται σε ένα πλούσιο οργανικό μίγμα που λειτουργεί ως εδαφοβελτιωτικό και λίπασμα.
Πηγές
Γεωργάτσος Ι. Ε. "Βιοχημεία, Τόμος Α', Δομή μακρομορίων-Ένζυμα-Βιολογικές Οξειδώσεις", Θεσσαλονίκη 1985.
Γιαννακουδάκης Δ. Α. "Φυσική Χημεία Ιονικών και Ηλεκτροδιακών Δράσεων", Θεσσαλονίκη 1986.
Μανουσάκης Γ.Ε. "Γενική και Ανόργανη Χημεία", Τόμοι 1ος και 2ος, Θεσσαλονίκη 1981.
Μανωλκίδης Κ., Μπέζας Κ. "Στοιχεία Ανόργανης Χημείας", Έκδοση 14η, Αθήνα 1984.
Μανωλκίδης Κ., Μπέζας Κ. "Χημικές Αντιδράσεις", Αθήνα 1976.
Γιαννακουδάκης Δ. Α. "Φυσική Χημεία Ομογενών και Ετερογενών Συστημάτων", Θεσσαλονίκη 1986.
Morrison R. T., Boyd R. N. "Οργανική Χημεία" Τόμοι 1ος,2ος,3ος, Μετάφραση:Σακαρέλλος-Πηλίδης-Γεροθανάσης, Ιωάννινα 1991.
Δημητριάδης Θ. Γ. "Test Οξειδοαναγωγής", Αθήνα 1989.
Γεωργάτσος Ι. Ε. "Βιοχημεία, Τόμος Β', Ενδιάμεση Ανταλλαγή της Ύλης-Μοριακή Πληροφορική", Θεσσαλονίκη 1985.
Βασιλικιώτης Γ. Σ. "Χημεία Περιβάλλοντος", Θεσσαλονίκη 1986.
Μάτης Κ. Α., Γιαννακουδάκης Δ. Α. "Φυσικές Διεργασίες στη Χημική Τεχνολογία", Θεσσαλονίκη 1987.
Μπαζάκης Ι. Α. "Γενική Χημεία", Αθήνα.
"Oξειδοαναγωγή" από τη Wikipedia
"Ηλεκτροχημεία" από τη Wikipedia
Hellenica World - Scientific Library
Από τη ελληνική Βικιπαίδεια http://el.wikipedia.org . Όλα τα κείμενα είναι διαθέσιμα υπό την GNU Free Documentation License

