\require{mhchem}
To νιτρώδες οξύ (αγγλικά: nitrous acid) είναι ανόργανη χημική ένωση, που περιέχει υδρογόνο, άζωτο και οξυγόνο, με μοριακό τύπο HNO2. Είναι ασθενές μονοβασικό οξύ, που είναι γνωστό μόνο σε μορφή διαλύματος και στη μορφή των νιτρωδών αλάτων. Χρησιμοποιείται στην παραγωγή διαζιδίων από αμίνες. Αυτό συμβαίνει με πυρηνόφιλη προσβολή των αμινών στα νιτρώδη ιόντα, επαναπρωτονίωση του περιβάλλοντος διαλύτη, και διπλή εξουδετέρωση του νερού. Στη συνέχεια, τα διαζίδια μπορούν να απελευθερωθούν, με τη μορφή διαζώτου, δίνοντας παράλληλα καρβένιο ή καρβενοειδές.
| Νιτρώδες οξύ | |||
|---|---|---|---|
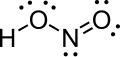 |
|||
 |
|||
 |
|||
 |
|||
| Γενικά | |||
| Όνομα IUPAC | Νιτρώδες οξύ | ||
| Άλλες ονομασίες | Οξειδοϋδροξυάζωτο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | ΝO2 | ||
| Μοριακή μάζα | 47,013 amu | ||
| Αριθμός CAS | 7782-77-6 | ||
| SMILES | O=NO | ||
| InChI | 1S/HNO2/c2-1-3/h(H,2,3) | ||
| Αριθμός EINECS | 231-963-7 | ||
| PubChem CID | 24529 | ||
| ChemSpider ID | 22936 | ||
| Δομή | |||
| Μοριακή γεωμετρία | επίπεδη | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 1 Διοξαζιριδίνη |
||
| Γεωμετρικά ισομερή | 2 | ||
| Φυσικές ιδιότητες | |||
| Χημικές ιδιότητες | |||
| pKa | 3,398 | ||
| Επικινδυνότητα | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Φυσική παρουσία
Το νιτρώδες οξύ εμπλέκεται με την παρουσία όζοντος στην τροπόσφαιρα. Η ετερογενής αντίδραση μονοξειδίου του αζώτου (NO) και νερού παράγει νιτρώδες οξύ. Όταν η αντίδραση αυτή συμβαίνει στην επιφάνεια ατμοσφαιρικών αερολημάτων, το προϊόν της αντίδρασης (νιτρώδες οξύ), φωτολύεται γρήγορα, σχηματίζοντας ελεύθερες ρίζες υδροξυλίου (ΟΗ•) και μονοξειδίου του αζώτου (NO•).
Δομή
Στην αέρια φάση, το επίπεδο μόριο του νιτρώδους οξέος μπορεί να υιοθετήσει cis- ή trans- μορφή. Η trans- μορφή επικρατεί στη θερμοκρασία δωματίου (20°C) και οι μετρήσεις υπερύθρου δείχνουν ότι είναι πιο σταθερή κατά περίπου 2,3 KJ/mole.[1]
Παραγωγή
Όταν ψυχρά και αραιά διαλύματα νιτρωδών ιόντων (NO2-) οξυνίζονται προσεκτικά, σχηματίζεται ανοικτογάλανο διάλυμα νιτρώδους οξέος.
Το ελεύθερο νιτρώδες οξύ είναι ασταθές και διασπάται τάχιστα. Μπορεί να παραχθεί με διάλυση τριοξειδίου του διαζώτου (N2O3) σε νερό, σύμφωνα με την ακόλουθη στοιχειομετρική εξίσωση:
{\displaystyle \mathrm {N_{2}O_{3}+H_{2}O{\xrightarrow {}}2HNO_{2}} }
Ακόμη, το διοξείδιο του αζώτου σε όξινο διάλυμα δυσαναλογοποιείται σε μείγμα νιτρικού οξέος και νιτρώδους οξέος:[2]
{\displaystyle \mathrm {2NO_{2}+H_{2}O{\xrightarrow {}}HNO_{3}+HNO_{2}} }
Χημική συμπεριφορά
Αντιδράσεις διάσπασης
Σε οποιαδήποτε άλλη περίπτωση πλην των πολύ αραιών και ψυχρών διαλυμάτων του, το νιτρώδες οξύ διασπάται γρήγορα σε διοξείδιο του αζώτου (NO2), μονοξείδιο του αζώτου (NO) και νερό:
{\displaystyle \mathrm {2HNO_{2}{\xrightarrow {}}NO_{2}+NO+H_{2}O} }
Σε θερμά ή πυκνά διαλύματα νιτρώδους οξέος, η συνολική αντίδραση δίνει νιτρικό οξύ, μονοξείδιο του αζώτου και νερό:
{\displaystyle \mathrm {3HNO_{2}{\xrightarrow {}}HNO_{3}+2NO+H_{2}O} }
Αντιδράσεις οξείδωσης ανόργανων ενώσεων
Η αναγωγή του οξέος (ή των αλάτων του) δίνει διαφορετικά προϊόντα, ανάλογα με το αναγωγικό μέσο.[3]
Αν χρησιμοποιηθούν ιόντα I- ή Fe2+, τότε παράγεται μονοξείδιο του αζώτου:
{\displaystyle \mathrm {2KNO_{2}+2KI+2H_{2}SO_{4}{\xrightarrow {}}I_{2}+2NO+2H_{2}O+2K_{2}SO_{4}} }
{\displaystyle \mathrm {2KNO_{2}+2FeSO_{4}+2H_{2}SO_{4}{\xrightarrow {}}Fe_{2}(SO_{4})_{3}+2NO+2H_{2}O+K_{2}SO_{4}} }
Αν χρησιμοποιηθούν ιόντα Sn2+, τότε παράγεται υποξείδιο του αζώτου (N2O):
{\displaystyle \mathrm {2KNO_{2}+6HCl+2SnCl_{2}{\xrightarrow {}}2SnCl_{4}+N_{2}O+3H_{2}O+2KCl} }
Αν χρησιμοποιηθεί διοξείδιο του θείου (SO2), τότε παράγεται υδροξυλαμίνη (NH2OH):
{\displaystyle \mathrm {2KNO_{2}+6H_{2}O+4SO_{2}{\xrightarrow {}}3H_{2}SO_{4}+2K_{2}SO_{4}+2NH_{2}OH} }
Αν χρησιμοποιηθεί μεταλλικός ψευδάργυρος σε αλκαλικό διάλυμα, τότε παράγεται αμμωνία (NH3):
{\displaystyle \mathrm {KNO_{2}+5H_{2}O+3Zn{\xrightarrow {OH^{-}}}NH_{3}+KOH+3Zn(OH)_{2}} }
Αν χρησιμοποιηθεί υδραζώνιο (N2H5+), τότε αρχικά παράγεται υδραζωτικό οξύ (HN3) και τελικά υποξείδιο του αζώτυου και διάζωτο (N2):
{\displaystyle \mathrm {HNO_{2}+N_{2}H_{5}^{+}{\xrightarrow {}}HN_{3}+H_{2}O+H_{3}O^{+}} }
{\displaystyle \mathrm {HNO_{2}+HN_{3}{\xrightarrow {}}N_{2}O+N_{2}+H_{2}O} }
Η οξείδωση από νιτρώδες οξύ έχει κινητικό έλεγχο έναντι θερμοδυναμικού ελέγχου, όπως καλύτερα επισημαίνεται στο ότι το αραιό διάλυμα νιτρώδους οξέος μπορεί να οξειδώσει I- σε I2, ενώ αραιό διάλυμα νιτρικού οξέος δεν μπορεί:
{\displaystyle \mathrm {I_{2}+2e^{-}\rightleftarrows 2I^{-}\;(E^{0}=0,54\;V)} }
{\displaystyle \mathrm {NO_{3}^{-}+3H^{+}+2e^{-}\rightleftarrows HNO_{2}+H_{2}O\;(E^{0}=0,93\;V)} }
{\displaystyle \mathrm {HNO_{2}+H^{+}+e^{-}\rightleftarrows NO+H_{2}O\;(E^{0}=0,98\;V)} }
Από τα παραπάνω, γίνεται φανερό ότι οι τιμές E0 για αυτές είναι παρόμοιες, αλλά το νιτρικό οξύ είναι ισχυρότερο οξειδωτικό μέσο. Με βάση, λοιπόν, το γεγονός ότι το αραιό διάλυμα νιτρώδους οξέος μπορεί να οξειδώσει τα ανιόντα ιωδίδιου (I-) σε στοιχειακό ιώδιο (I2), ενώ το αραιό διάλυμα νιτρικού οξέος όχι δείχνει ότι το νιτρώδες οξύ δρα ταχύτερα από το νιτρικό οξύ, παρ' όλο που το τελευταίο είναι ισχυρότερο οξειδωτικό μέσο.[3]
Εφαρμογές στις οργανικές συνθέσεις
Το νιτρώδες οξύ χρησιμοποιείται στην παραγωγή διαζωνιακών αλάτων:
{\displaystyle \mathrm {HNO_{2}+A_{r}NH_{2}+H^{+}{\xrightarrow {}}ArN_{2}^{+}+H_{2}O} }
Όπου το Ar παριστάνει μια ρίζα αρυλίου.
έτοια άλατα χρησιμοποιούνται ευρύτατα σε οργανικές συνθέσεις, για παράδειγμα στην αντίδραση Σαντμέγιερ (Sandmeyer reaction) και στην παραγωγή αζωχρωμάτων, που είναι έντοντα έγχρωμες ενώσεις, οι οποίες αποτελούν τη βάση ποιοτικού ελέγχου για παρουσία ανιλινών.[4] Το νιτρώδες οξύ χρηισμοποιείται για την καταστροφή του τοξικού και δυνάμει εκρηκτικού αζιδίου του νατρίου (NaN3). Για τις περισσότερες περιπτώσεις το νιτρώδες οξύ συνήθως παράγεται in situ με επίδραση μεταπυριτικού οξέος σε νιτρώδες νάτριο (NaNO2).[5]
Με αντίδραση με δυο α- άτομα υδρογόνου σε κετόνες, το νιτρώδες οξύ παράγει οξίμες, που μπορούν να οξειδωθούν παραπέρα σε καρβοξυλικά οξέα, ή να αναχθούν σε αμίνες. Η διεργασία αυτή έχει εμπορική εφαρμογή στην παραγωγή του αδιπικού οξέος.
Το νιτρώδες οξύ αντιδρά γρήγορα με αλειφατικές αλκοόλες παράγοντας τους αντίστοιχους εστέρες του νιτρώδους οξέος, που είναι ισχυρά αγγειοδιασταλτικά:
{\displaystyle \mathrm {ROH+HNO_{2}\rightleftarrows RONO+H_{2}O} }
Αναφορές και σημειώσεις
Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd έκδοση). Butterworth–Heinemann. ISBN 0080379419. p. 462
Kameoka, Yohji; Pigford, Robert (February 1977). «Absorption of Nitrogen Dioxide into Water, Sulfuric Acid, Sodium Hydroxide, and Alkaline Sodium Sulfite Aqueous». Ind. Eng. Chem. Fundamen. 16 (1): 163–169. doi:10.1021/i160061a031.
Catherine E. Housecroft; Alan G. Sharpe (2008). «Chapter 15: The group 15 elements». Inorganic Chemistry, 3rd Edition. Pearson. σελ. 449. ISBN 978-0-13-175553-6.
Clarke, H. T.; Kirner, W. R. "Methyl Red" Organic Syntheses, Collected Volume 1, p.374 (1941). http://www.orgsyn.org/orgsyn/pdfs/CV1P0374.pdf Αρχειοθετήθηκε 2007-09-30 στο Wayback Machine.
Prudent practices in the laboratory: handling and disposal of chemicals. Washington, D.C.: National Academy Press. 1995. ISBN 0-309-05229-7.
Hellenica World - Scientific Library
Από τη ελληνική Βικιπαίδεια http://el.wikipedia.org . Όλα τα κείμενα είναι διαθέσιμα υπό την GNU Free Documentation License

