\require{mhchem}
Το μεθυλένιο (συστηματικά ονομάζεται λ²-μεθάνιο, μεθυλιδένιο ή διυδριδάνθρακας) ή καρβένιο είναι οργανική ένωση με χημικό τύπο CH2 (γράφεται επίσης [CH2] ή [:CH2]). Είναι ένα άχρωμο αέριο που φθορίζει στο μέσο υπέρυθρο εύρος, και εξακολουθεί να υπάρχει μόνο σε διάλυμα ή ως ένα σύμπλοκο εγκλεισμού.
Το μεθυλένιο είναι το απλούστερο από τα καρβένια[2][3]. Συνήθως ανιχνεύεται μόνο υπό πολύ χαμηλές πιέσεις, σε πολύ χαμηλές θερμοκρασίες, ή και ως ένα βραχύβιο ενδιάμεσο σε χημικές αντιδράσεις[4].
| Μεθυλένιο | |||
|---|---|---|---|
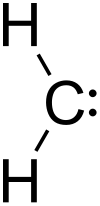 |
|||
 |
|||
 |
|||
| Γενικά | |||
| Όνομα IUPAC | Διυδριδάνθρακας(2•)[1] | ||
| Άλλες ονομασίες | Μεθυλένιο Καρβένιο[1] |
||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | CH22• | ||
| Μοριακή μάζα | 14,0266 amu | ||
| Αριθμός CAS | 2465-56-7 | ||
| SMILES | [CH2] | ||
| InChI | 1S/CH2/h1H2 | ||
| PubChem CID | 123164 | ||
| ChemSpider ID | 109779 | ||
| Δομή | |||
| Φυσικές ιδιότητες | |||
| Διαλυτότητα στο νερό |
Αντιδρά | ||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Ονοματολογία
Το εμπειρικό όνομα καρβένιο είναι το προτεινόμενο όνομα της IUPAC. Τα συστηματικά ονόματα λ²-μεθάνιο ή διυδριδάνθρακας, έγκυρα ονόματα κατά IUPAC, συντάσσονται ανάλογα με την ονοματολογία υποκαταστάτων και την ονοματολογία προσθέτων, αντίστοιχα.
Το μεθυλένιο μπορεί να θεωρηθεί ως μεθάνιο, από το οποίο αφαιρέθηκαν δύο (2) άτομα υδρογόνου, οπότε ως τέτοιο θα μπορούσε, θεωρητικά, να χρησιμοποιηθεί η ονομασία μεθυλιδένιο ως ειδικό συστηματικό όνομα, σύμφωνα με την ονοματολογία υποκατάστασης. Εξ' ορισμού, όμως, αυτή ονομασία δεν αναφέρει καθόλου τη συμπεριφορά δίριζας του μορίου του μεθυλενίου. Ομοίως, παρόλο που με παρόμοια συλλογιστική θα μπορούσε να ονομαστεί και ως μεθανοδιύλιο, αυτή δε λαμβάνει υπόψη τη μη ριζική απλή του κατάσταση, αλλά αναφέρεται μόνο στη βασική διριζική του κατάσταση.
Η ονομασία μεθυλένιο επίσης χρησιμοποιείται, παρόλο που είναι μη συστηματική, για να αποφευχθεί η σύγχυση με τις ομάδες - υποκαταστάτες μεθανοδιύλιο (>CH2) και μεθυλιδένιο (=CH2).
Ανακάλυψη
Η ένωση ανακαλύφθηκε για πρώτη φορά και μελετήθηκε γύρω στο 1960, με φασματοσκοπία υπερύθρου σε πειράματα απομόνωσης μήτρας παγωμένου αερίου[5][6].
Παραγωγή
Στις παρακάτω αντιδράσεις, εκτός από φωτοχημική διάσπαση, μπορεί να χρησιμοποιηθεί επίσης θερμική διάσπαση, ή η χρήση φωτοηλεκτροχημικώς ευαίσθητων αντιδραστηρίων, όπως η βενζοφαινόνη, ως καταλύτες[4][7].
Με απόσπαση υδραλογόνου
Το μεθυλένιο μπορεί να παραχθεί με απόσπαση υδραλογόνου από (μον)αλομεθάνιο, συνήθως χλωρομεθάνιο. Η αντίδραση μπορεί να πραγματοποιηθεί με επίδραση υδροξειδίου του καλίου ή και φωτοχημικά[8]:
{\displaystyle \mathrm {CH_{3}Cl+KOH{\xrightarrow {}}[CH_{2}]+KCl+H_{2}O} }
ή
{\displaystyle \mathrm {CH_{3}Cl{\xrightarrow {hv}}[CH_{2}]+HCl} }
Με απόσπαση ιωδίου
Το μεθυλένιο μπορεί να παραχθεί με απόσπαση ιωδίου από διιωδομεθάνιο, παρουσία χαλκού, ως καταλύτη[9]:
{\displaystyle \mathrm {CH_{2}I_{2}+Zn{\xrightarrow {Cu}}[CH_{2}]+ZnI_{2}} }
Όταν παράγεται με αυτήν τη μέθοδο ευνοεί σχεδόν εκλεκτικά, στη συνέχεια, την παραγωγή κυκλικών ενώσεων, όταν μετέχει σε αντιδράσεις προσθήκης σε πολλαπλούς δεσμούς.
Με απόσπαση αζώτου
Το μεθυλένιο μπορεί να παραχθεί με φωτοχημική απόσπαση αζώτου από το διαζωμεθάνιο[10] ή τη διαζιρίνη:
{\displaystyle \mathrm {CH_{2}N_{2}{\xrightarrow {hv}}[CH_{2}]+N_{2}} }
Diazirin - Diazirine.svg {\displaystyle \mathrm {{\xrightarrow {hv}}[CH_{2}]+N_{2}} }
Με απόσπαση μονοξειδίου του άνθρακα
Το μεθυλένιο μπορεί να παραχθεί με φωτοχημική απόσπαση μονοξειδίου του άνθρακα (CO) από την αιθενόνη[11] (CH2=CO):
{\displaystyle \mathrm {CH_{2}=CO{\xrightarrow {hv}}[CH_{2}]+CO} }
Δομή και χημική συμπεριφορά
Το αδιάλυτο μεθυλένιο αυθόρμητα αυτοπολυμερίζεται, σχηματίζοντας διάφορα ολιγομερή, αιθένιου. Τα διεγερμένα ολιγομερή, διασπούνται περισσότερο, παρά επιστρέφουν σε μια βασική τους κατάσταση. Για παράδειγμα, η διεγερμένη μορφή του αιθένιου διασπάται σε αιθίνιο και ατομικό υδρογόνο[7]:
{\displaystyle \mathrm {2[CH_{2}]{\xrightarrow {}}CH_{2}=CH_{2}^{*}{\xrightarrow {}}HC\equiv CH+2H^{\bullet }} }
Υπολογισμοί απέδειξαν ότι η βασική κατάσταση του μεθυλενίου είναι μια δίριζη τριπλή κατάσταση[7]. Σε αυτήν την κατάσταση, το μεθυλένιο έχει ενέργεια ιονισμού 10,396 eV. Έχει μια λυγισμένη διαμόρφωση, με γωνία HCH ίση με 133,84°[7], και έτσι είναι παραμαγνητική. Η σωστή πρόβλεψη της γωνίας αυτής ήταν μια πρώιμη επιτυχία της Ab initio κβαντοχημικής μεθόδου[7]. Ωστόσο, η μετατροπή σε μια γραμμική διαμόρφωση απαιτεί μόλις 5,5 kcal/mol[7].
Το μόριο υπάρχει επίσης και σε μια μονή κατάσταση, όπου τα δυο ελεύθερα ηλεκτρόνια μοιράζονται το ίδιο τροχιακό, με αντίθετα σπιν. Αυτή η κατάσταση βρίσκεται σε ελαφρά υψηλότερη ενεργειακή στάθμη, κατά περίπου 9 kcal/mol, σε σύγκριση με την τριπλή κατάσταση δίριζας[7]. Η γωνία H-C-H στη μονή κατάσταση είναι μικρότερη, περίπου 102°. Σε διαλυμένα μίγματα, μέσα σε ένα ευγενές αέριο, οι δυο καταστάσεις αλληλομετατρέπονται η μία στην άλλη, μέχρι να φθάσουν σε μια χημική ισορροπία[7].
Η μονή κατάσταση είναι σημαντικά πιο δραστική από την τριπλή κατάσταση, και συμπεριφέρεται πολύ διαφορετικά σε χημικές αντιδράσεις. Για παράδειγμα, όταν το μεθυλένιο αντιδρά με αλκάνια, το μεθυλένιο μονής κατάστασης εισέρχεται μετά από ένα ακραίο μεθύλιο, ενώ το μεθυλένιο τριπλής κατάστασης αποσπά ένα άτομο υδρογόνου, αφήνοντας μια ελεύθερη ρίζα[7]:
{\displaystyle \mathrm {[:CH_{2}]+H_{3}C-R{\xrightarrow {}}H-CH_{2}-CH_{2}-R} }
{\displaystyle \mathrm {[CH_{2}^{2\bullet }]+H-R{\xrightarrow {}}CH_{3}^{\bullet }+R^{\bullet }} }
Επίσης, η μονή κατάσταση είναι πιο στερεοειδική από ότι η τριπλή[7].
Χημικές αντιδράσεις
Οργανική χημεία
Ουδέτερα σύμπλοκα μεθυλενίου
Τα ουδέτερα σύμπλοκα μεθυλενίου διεξάγουν διαφορετικές χημικές αντιδράσεις, που εξαρτώνται από τον π χαρακτήρα του δεσμού συναρμογής στο ανθρακικό κέντρο. μια μικρή συνεισφορά του π χαρακτήρα, όπως στο διαζωμεθάνιο, δίνει κυρίως αντιδράσεις υποκατάστασης, ενώ μια ισχυρή συνεισφορά, όπως στην αιθενόνη, δίνει κυρίως αντιδράσεις προσθήκης. Μετά από επίδραση με μια ισχυρή βάση, τα συμπλοκα με ασθενή συνεισφορά του π χαρακτήρα μετατρέπονται σε μεθοξείδιο του μετάλλου. Με ισχυρά οξέα, όπως για παράδειγμα το φθοροθειικό οξύ, μπορούν να πρωτονιωθούν και να δώσουν CH3L+. Η οξείδωση αυτών συμπλόκων δίνει μεθανάλη, ενώ η η αναγωγή τους δίνει μεθάνιο.
Ελεύθερο μεθυλένιο
Το ελεύθερο μεθυλένιο διεξάγει τις τυπικές αντιδράσεις ενός καρβενίου. Οι αντιδράσεις προσθήκης είναι πολύ γρήγορες και εξώθερμες[12].
Όταν το μόριο του μεθυλενίου βρίσκεται στη βασική του, ενεργειακά χαμηλότερη, κατάσταση, τα δύο μονήρη ηλεκτρόνια σθένους του κατέχουν ξεχωριστά ατομικά τροχιακά με ανεξάρτητα σπιν, μια διαμόρφωση που είναι γνωστή ως «τριπλή κατάσταση».
Ανιόν μεθανιδυλίου
Το μεθυλένιο μπορεί να κερδίσει ένα ηλεκτρόνιο, σχηματίζοντας ένα μονοσθενές ανιόν, το μεθανιδύλιο (CH2·-), που μπορεί να ληφθεί ως άλας τετραμεθυλαμμώνιου [(CH3)4N+], με αντίδραση του φαινυλονάτριου (PhNa) με βρωμιούχο τετραμεθυλαμμώνιο [4]. Το ιόν αυτό έχει επίσης λυγισμένη δομή, με γωνία H-C-H περίπου 103°[7].
Ανόργανη χημεία
Το μεθυλένιο είναι επίσης ένας συνηθισμένος συναρμοτής για ενώσεις συναρμογής, όπως ο μεθυλενοχαλκός (CuCH2)[13].
Άλλες έννοιες του όρου μεθυλένιο
Το μεθυλένιο μπορεί να συνδεθεί ως ένας τερματικός συναρμοτής, οπότε ονομάζεται «μεθυλιδένιο», ή ως συναρμοτής - γέφυρα, οπότε ονομάζεται «μεθανοδιύλιο».
Πηγές
Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
Aναφορές και σημειώσεις
"methanediyl (CHEBI:29357)". Chemical Entities of Biological Interest. UK: European Bioinformatics Institute. 14 January 2009. IUPAC Names. Retrieved 2 January 2012.
Roald Hoffman (2005), Molecular Orbitals of Transition Metal Complexes. Oxford. ISBN 0-19-853093-5
IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "carbenes".
W. B. DeMore and S. W. Benson (1964), Preparation, properties, and reactivity of methylene. In Advances in Photochemistry, John Wiley & Sons, 453 pages. ISBN 0470133597
William B. DeMore, H. O. Pritchard, and Norman Davidson (1959), Photochemical experiments in rigid media at low temperatures. II. The reactions of methylene, cyclopentadienylene and diphenylmethylene. Journal of the American Chemical Society, volume 81, issue 22, pages 5874–5879. doi:10.1021/ja01531a008
Marilyn E. Jacox and Dolphus E. Milligan (1963), 'Infrared study of the reactions of CH2 and NH with C2H2 and C2H4 in solid argon.Journal of the American Chemical Society, volume 85, issue 3, pages 278–282. doi:10.1021/ja00886a006
Isaiah Shavitt (1985), Geometry and singlet-triplet energy gap in methylene: A critical review of experimental and theoretical determinations. Tetrahedron, volume 41, issue 8, page 1531 doi:10.1016/S0040-4020(01)96393-8
Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.7., σελ. 187, §7.3.7β., §7.3.8., προσαρμογή στο μεθυλένιο.
SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, σελ. 138, §9.2Β5β.
Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 223, §9.8Γ3.
Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 248, §10.7.5.
Milan Lazár (1989), Free radicals in chemistry and biology. CRC Press. ISBN 0-8493-5387-4
Sou-Chan Chang, Zakya H. Kafafi, Robert H. Hauge, W. Edward Billups, and John L. Margrave (1987), Isolation and characterization of copper methylene (CuCH2) via FTIR matrix isolation spectroscopy. Journal of the American Chemical Society, volume 109 pages 4508-4513. doi:10.1021/ja00249a013.
Hellenica World - Scientific Library
Από τη ελληνική Βικιπαίδεια http://el.wikipedia.org . Όλα τα κείμενα είναι διαθέσιμα υπό την GNU Free Documentation License

