\require{mhchem}
Το χλωριούχο αμμώνιο είναι ανόργανη χημική ένωση, που περιέχει άζωτο, υδρογόνο και χλώριο, με μοριακό τύπο NH_{4}Cl
| Χλωριούχο αμμώνιο | |||
|---|---|---|---|
| Γενικά | |||
| Όνομα IUPAC | Χλωριούχο αμμώνιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | NH4Cl | ||
| Μοριακή μάζα | 53,49 amu | ||
| Αριθμός CAS | 12125-02-9 | ||
| SMILES | [Cl-].[NH4+] | ||
| InChI | 1S/ClH.H3N/h1H;1H3 | ||
| Αριθμός EINECS | 235-186-4 | ||
| Αριθμός RTECS | BP4550000 | ||
| Αριθμός UN | 01Q9PC255D | ||
| ChemSpider ID | 23807 | ||
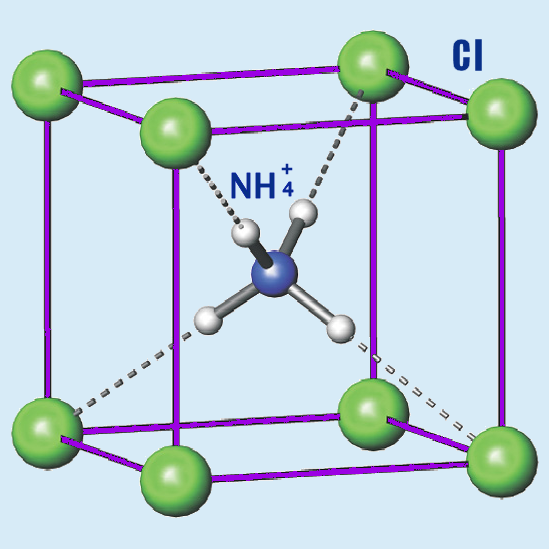
| Δομή | |||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | 338°C | ||
| Σημείο βρασμού | 520°C | ||
| Πυκνότητα | 1.527,4 kg/m³ | ||
| Διαλυτότητα στο νερό |
244 kg/m³ (-15°C) 294 kg/m³ (0°C) 383 kg/m³ (25°C) 454,4 kg/m³ (40°C) 740,8 kg/m³ (100°C) |
||
| Διαλυτότητα σε άλλους διαλύτες |
Διαλυτό σε Yγρή αμμωνία Υδραζίνη Αιθανόλη (6 kg/m³ 19°C) Μεθανόλη (3,54% w/w 25°C) Γλυκερίνη (9,7% w/w) Ελαφρά διαλυτό σε Προπανόνη Διαιθυλαιθέρα Αιθανικό αιθυλεστέρα |
||
| Δείκτης διάθλασης , nD |
1,642 (20°C) | ||
| Τάση ατμών | 133.3 Pa (160,4°C) 6,5 kPa (250 °C) 33,5 kPa (300°C) |
||
| Εμφάνιση | Λευκό υγροσκοπικό στερεό | ||
| Χημικές ιδιότητες | |||
| pKa | 9,24 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
Μη αναφλέξιμο | ||
| Επικινδυνότητα | |||
 |
|||
| Φράσεις κινδύνου | 22, 36 | ||
| Φράσεις ασφαλείας | (2), 22 | ||
| LD50 | 1.650 mg/kg | ||
| Κίνδυνοι κατά NFPA 704 |
0
2
0
|
||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Είναι το άλας που προκύπτει από την αντίδραση εξουδετέρωσης του υδροχλωρικού οξέος (HCl) από αμμωνία (NH3):
{\displaystyle \mathrm {HCl+NH_{3}{\xrightarrow {}}NH_{4}Cl} }
Στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, το χημικά καθαρό χλωριούχο αμμώνιο είναι λευκό κρυσταλλικό άλας, πολύ ευδιάλυτο στο νερό. Τα (υδατικά) διαλύματα χλωριούχου αμμωνίου είναι ελαφρώς όξινα. Αμμωνιακό άλας (sal ammoniac) ονομάζεται το ορυκτό χλωριούχο αμμώνιο. Είναι ορυκτό που συνήθως σχηματίστηκε από την καύση εκβολάδων γαιανθράκων, (που σχηματίστηκαν με τη σειρά τους) από τη συμπύκνωση ανθρακούχων αερίων. Έχει, επίσης, βρεθεί γύρω από κάποιους τύπους ηφαιστειακών πόρων. Οι κύριες εφαρμογές του είναι ως λίπασμα και ως αρωματικό πρόσθετο σε κάποιους τύπους γλυκόριζας.
Παραγωγή
Είναι έτερο προϊόν της διεργασίας Σολβέ (Solvay process), της οποίας το κύριο προϊόν είναι το ανθρακικό νάτριο (Na2CO3):[1]
{\displaystyle \mathrm {CO_{2}+2NH_{3}+2NaCl+H_{2}O{\xrightarrow {}}2NH_{4}Cl+Na_{2}CO_{3}} }
Εκτός από το γεγονός ότι έτσι κι αλλιώς η μέθοδος αυτή αποτελεί την κύρια μέθοδο παραγωγής χλωριούχου αμμωνίου, αποτελεί επιπλέον μέθοδο ελαχιστοποίησης της έκλυσης αμμωνίας στο περιβάλλον, κατά τη διάρκεια διαφόρων βιομηχανικών διεργασιών, που παράγουν αμμωνία ως παραπροϊόν. Εναλλακτικά, το χλωριούχο αμμώνιο παράγεται βιομηχανικά και με την αντίδραση αμμωνίας και υδροχλωρίου, τόσο στην αέρια κατάσταση, όσο και σε διαλύματα:[1]
{\displaystyle \mathrm {HCl+NH_{3}{\xrightarrow {}}NH_{4}Cl} }
Ακόμη, το χλωριούχο αμμώνιο υπάρχει σε φυσική ορυκτή μορφή σε ορισμένες ηφαιστειογενείς περιοχές, σχηματίζοντας ηφαιστειογενή πετρώματα γύρω από πόρους διαφυγής καπνού. Οι κρύσταλλοι χλωριούχου αμμωνίου σχηματίζονται άμεσα από την αέρια κατάσταση, αλλά τείνουν να είναι βραχύβιοι, γιατί είναι πολύ ευδιάλυτοι στο νερό.[2]
Χημικές ιδιότητες
Το χλωριούχο αμμώνιο μοιάζει να εξαχνώνεται με όταν θερμαίνεται, αλλά στην πραγματικότητα διασπάται σε ατμούς αμμωνίας και αέριο υδροχλώριο:[1]
{\displaystyle \mathrm {NH_{4}Cl{\xrightarrow {\triangle }}HCl+NH_{3}} }
Το χλωριούχο αμμώνιο έχει συμπεριφορά ασθενούς οξέος και γι' αυτό αντιδρά με ισχυρές βάσεις, όπως το υδροξείδιο του νατρίου (NaOH), εκλύοντας ατμούς αμμωνίας:
{\displaystyle \mathrm {NH_{4}Cl+NaOH{\xrightarrow {}}NH_{3}+NaCl+H_{2}O} }
Ομοίως, αντιδρά και με άλατα που έχουν βασική συμπεριφορά, όπως τα ανθρακικά αλκαλιμέταλλα (M2CO3), σε αυξημένες θερμοκρασίες, δίνοντας αμμωνία και τα αντίστοιχα χλωρίδια των συγκεκριμένων μετάλλων (MCl). Για παράδειγμα:
{\displaystyle \mathrm {2NH_{4}Cl+Na_{2}CO_{3}{\xrightarrow {}}2NH_{3}+2NaCl+H_{2}O+CO_{2}} }
Ένα διάλυμα 5% κατά βάρος χλωριούχου αμμωνίου σε νερό έχει pH που κυμαίνεται από 4,6 ως 6,0.[3]
Κάποιες αντιδράσεις χλωριούχου αμμωνίου με άλλα χημικά είναι ενδοθερμικές, όπως αντίδρασή του με το υδροξείδιο του βαρίου [Ba(OH)2] , όπως και η διάλυση του ίδιου του χλωριούχου αμμωνίου στο νερό.
Αναφορές
Wiberg, Egon; Wiberg, Nils (2001). Inorganic Chemistry (illustrated έκδοση). Academic Press. σελ. 614. ISBN 0-12-352651-5.
Rowley, Steven P. (2011). General Chemistry I Laboratory Manual (Second έκδοση). Kendall Hunt. ISBN 978-0-7575-8942-3.
Dr. K. G. Bothara (7 Οκτωβρίου 2008). Inorganic Pharmaceutical Chemistry. Pragati Books Pvt. Ltd. σελίδες 13–. ISBN 978-81-85790-05-3. Ανακτήθηκε στις 12 Οκτωβρίου 2011.
Hellenica World - Scientific Library
Από τη ελληνική Βικιπαίδεια http://el.wikipedia.org . Όλα τα κείμενα είναι διαθέσιμα υπό την GNU Free Documentation License