\require{mhchem}
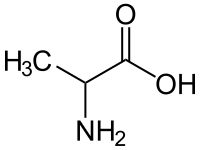
Η αλανίνη (διεθνείς συντομογραφίες: Ala και A[2], από την αγγλική λέξη alanine). Είναι οργανική χημική ένωση, που περιέχει άνθρακα, υδρογόνο, άζωτο και οξυγόνο, με μοριακό τύπο C3H7NO2 και ημισυντακτικό τύπο CH3CH(NH2)COOH. Ανήκει στα αμινοξέα. Η L-αλανίνη (S διαμόρφωση ως προς τον α-άνθρακα) είναι το δεύτερο απλούστερο πρωτεϊνικό αμινοξύ, μετά τη γλυκίνη.
| Αλανίνη | |
|---|---|
 |
|
 |
|
 |
|
| Γενικά | |
| Όνομα IUPAC | 2-αμινοπροπανικό οξύ |
| Άλλες ονομασίες | Αλανίνη |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C3H7NO2 |
| Μοριακή μάζα | 89,09 amu |
| Σύντομος συντακτικός τύπος |
CH3CH(NH2)COOH |
| Συντομογραφίες | ala, A |
| Αριθμός CAS | 302-72-7 (DL) 56-41-7 (L) 338-69-2 (D) |
| SMILES | O=C(O)C(N)C |
| InChI | 1/C3H7NO2/c1-2(4)3(5)6/h2H,4H2,1H3,(H,5,6) |
| Αριθμός EINECS | 206-126-4 |
| Αριθμός RTECS | SJ3325000 |
| PubChem CID | 5950 |
| ChemSpider ID | 971 |
| Aντίστοιχα κωδικόνια | GCU GCC GCA GCG |
| Ισομέρεια | |
| Ισομερή θέσης | >119 |
| Οπτικά ισομερή | 2 |
| Φυσικές ιδιότητες | |
| Σημείο τήξης | 258 °C |
| Πυκνότητα | 1.424 kg/m3 |
| Διαλυτότητα στο νερό |
166,5 g/m3 |
| Εμφάνιση | λευκό κρυσταλλικό στερεό |
| Χημικές ιδιότητες | |
| pKa | 2,35 (COOH) 9,87 (NH2) |
| pI | 6,11[1] |
| Ελάχιστη θερμοκρασία ανάφλεξης |
79 °C |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Η χημικά καθαρή αλανίνη, στις κανονικές συνθήκες περιβάλλοντος, είναι λευκό κρυσταλλικό στερεό, αρκετά ευδιάλυτο στο νερό (167,2 kg/m³). Κανονικά, η πλήρως συστηματική ονομασία κατά IUPAC θα ήταν: 2-αμινοπροπανικό οξύ, αλλά και το «αλανίνη» αποτελεί επίσης αποδεκτή ονομασία από την IUPAC.
Γενετικά, κωδικοποιείται με τα κωδώνια GCU, GCC, GCA και GCG). Το L-στερεοϊσομερές της είναι ένα από τα χρησιμοποιείται στη βιοσύνθεση των πρωτεϊνών. Το μόριό της περιέχει μια α-αμινομάδα[3] (-NH2), που πρωτονιώνεται (οπότε γίνεται -NH3+), υπό τις κανονικές βιολογικές συνθήκες[4], μια α-καρβοξυλομάδα (-COOH), που αποπρωτονιώνεται (οπότε γίνεται -COO-), υπό τις κανονικές βιολογικές συνθήκες[5], καθώς και μια α-μεθυλομάδα (CH3-). Ως αμινοξύ ταξινομείται στα «μη πολικά» ή «υδρόφοβα» αμινοξέα, ως προς τη διαλυτότητα της «πλευρικής αλυσίδας» της, καθώς και στα «μη απαραίτητα» για τους ανθρώπους, γιατί ο ανθρώπινος οργανισμός μπορεί ο ίδιος να τη συνθέσει, οπότε δεν είναι απαραίτητο να ληφθεί αυτούσια από την τροφή του. Η L-αλανίνη είναι ένα από τα 20 αμινοξέα που είναι κωδικοποιημένα για χρήση στις πρωτεΐνες από τον ανθρώπινο γενετικό κώδικα. Ακόμη, η L-αλανίνη είναι το δεύτερο αμινοξύ, μετά από μόνο τη L-λευκίνη, σε συχνότητα χρήσης της σε πρωτεΐνες, αφού αποτελεί (κατά μέσο όρο) το 7,8% της πρωτοταγούς δομής, σε δείγμα 1.150 πρωτεϊνών.
Η D-αλανίνη, γνωστή ως β-αλανίνη, υπάρχει σε βακτηριακά κυτταρικά τοιχώματα, καθώς και σε σε κάποια πεπτίδια αντιβιοτικών.
Η β-αλανίνη (το 3-αμινοπροπανικό οξύ, H2NCH2CH2COOH) δεν βρίσκεται στις πρωτεΐνες αλλά εμφανίζεται σε δύο φυσικά πολυπεπτίδια: καρνοσίνη και ανσερίνη, που βρίσκονται στο μαστοφόρο μυ. Είναι, ακόμη, ένα σημαντικό συστατικό του παντοθενικού οξέος (βιταμίνη B5).
Ισομέρεια
Με βάση το χημικό τύπο της, C3H7NO2, έχει τουλάχιστον 119 ισομερή θέσης, τα σημαντικότερα από τα οποία είναι τα ακόλουθα:
- β-αλανίνη, με ημισυντακτικό τύπο: H2NCH2CH2COOH.
- Σαρκοζίνη, με ημισυντακτικό τύπο: CH3NHCH2COOH.
- Αιθυλοκαρβαμίδιο, με ημισυντακτικό τύπο: CH3CH2OCONH2.
- Νιτρώδης προπυλεστέρας, με ημισυντακτικό τύπο: CH3CH2CH2ONO.
- Νιτρώδης ισοπροπυλεστέρας, με ημισυντακτικό τύπο: (CH3)2CHONO.
- Λακταμίδιο, με ημισυντακτικό τύπο: CH3CH(OH)CONH2, σε δύο (2) οπτικά ισομερή.
- 1-νιτροπροπάνιο, με ημισυντακτικό τύπο: CH3CH2CH2NO2.
- 2-νιτροπροπάνιο, με ημισυντακτικό τύπο: CH3CH(NO2)CH3.
Δομή
Είναι το απλούστερο πρωτεϊνικό αμινοξύ, μετά τη γλυκίνη. Το α-άτομο άνθρακα συνδέεται με μια μεθυλομάδα (-CH3). Με βάση το χαρακτηριστικό αυτό ταξινομείται στα «μη πολικά» ή «υδρόφοβα» αμινοξέα[6] και «αλειφατικό» (δεν περιέχει κανένα δακτύλιο). Επίσης η μεθυλομάδα είναι (σχετικά) χημικά αδρανής, γεγονός που σημαίνει ότι η αλανίνη σχεδόν ποτέ δε μετέχει στη λειτουργικότητα των πρωτεϊνών στις οποίες συμμετέχει, δηλαδή αποτελεί (συνήθως) δομικό τμήμα τους χωρίς να αποτελεί μέρος του «ενεργού κέντρου»[7] τους.
| Δεσμοί[8] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C#3-C#2 | σ | 2sp3-2sp3 | 154 pm | |
| C#2-C#1 | σ | 2sp3-2sp2 | 151 pm | |
| C-N | σ | 2sp3-2sp3 | 152 pm | 6% C+ Ν- |
| Ν-H | σ | 2sp3-1s | 101,7 pm | 17% N- H+ |
| C=O | σ | 2sp2-2sp2 | 132 pm | 19% C+ O- |
| π | 2p-2p | |||
| C-O | σ | 2sp2-2sp3 | 147 pm | 19% C+ O- |
| O-H | σ | 2sp3-1s | 96 pm | 32% O- H+ |
| Κατανομή φορτίων σε ουδέτερο μόριο |
||||
| -O | -0,51 | |||
| -N | -0,40 | |||
| =O | -0,38 | |||
| C#3 | -0,09 | |||
| C#2 | +0,03 | |||
| H(CH) | +0,03 | |||
| H(NH2) | +0,17 | |||
| H(OH) | +0,32 | |||
| C#1 | +0,57 | |||
Παραγωγή αλανίνης
Απαιτείται ρύθμιση του pH στο pI = 6,11 για να επιτευχθεί η κρυστάλλωσή της σε καθαρή μορφή.
Από α-αλοπροπανικό οξύ
1.. Με επίδραση αμμωνίας[9]:
\( {\displaystyle \mathrm {CH_{3}CHXCOOH+2NH_{3}{\xrightarrow {}}CH_{3}CH(NH_{2})COOH+NH_{4}X} } \(
2. Μέσω οργανομαγνησιακών ενώσεων και αλαμίνης με εστεροποίηση για «προστασία»[10] της καρβοξυλομάδας[11]:
\( {\displaystyle \mathrm {CH_{3}CHXCOOH+ROH{\stackrel {-H_{2}O}{\overrightarrow {\longleftarrow }}}CH_{3}CHXCOOR{\xrightarrow[{|Et_{2}O|}]{+Mg}}CH_{3}CH(MgX)COOR{\xrightarrow[{-MgX_{2}}]{+NH_{2}X}}CH_{3}CH(NH_{2})COOR{\stackrel {+H_{2}O}{\overrightarrow {\longleftarrow }}}CH_{3}CH(NH_{2})COOH+ROH} }
3. Με φθαλιμιδικό κάλιο (σύνθεση Gabriel)[12]:
 {\displaystyle \mathrm {+CH_{3}CHXCOOH{\xrightarrow {-KX}}} }
{\displaystyle \mathrm {+CH_{3}CHXCOOH{\xrightarrow {-KX}}} }  {\displaystyle \mathrm {{\xrightarrow {+2H_{2}O}}CH_{3}CH(NH_{2})COOH+} }
{\displaystyle \mathrm {{\xrightarrow {+2H_{2}O}}CH_{3}CH(NH_{2})COOH+} }
Αντίδραση Strecker
Με επίδραση υδροκυανίου (HCN) και αμμωνίας (NH3) σε αιθανάλη (CH3CHO). Ενδιάμεσα σχηματίζεται 2-αμινοπροπανονιτρίλιο, το οποίο στη συνέχεια υδρολύεται σε αλανίνη[13]:
{\displaystyle \mathrm {CH_{3}CHO+HCN+NH_{3}{\xrightarrow {-H_{2}O}}CH_{3}CH(NH_{2})CN{\xrightarrow {+2H_{2}O}}CH_{3}CH(NH_{2})COOH+NH_{3}} }
Με αναγωγική αμμωνίωση πυροσταφυλικού οξέος
Με αναγωγική αμμωνίωση πυροσταφυλικού οξέος[14]::
{\displaystyle \mathrm {CH_{3}COCOOH+2NH_{3}{\xrightarrow {-H_{2}O}}CH_{3}C(=NH)COONH_{4}{\xrightarrow[{Ni}]{+H_{2}}}CH_{3}CH(NH_{2})COONH_{4}{\xrightarrow {+HCl}}CH_{3}CH(NH_{2})COOH+NH_{4}Cl} }
Επειδή οι αντιδράσεις τρανσαμίνωσης είναι εύκολα αντιστρέψιμες και το πυροσταφυλικό οξύ πρωτογενές, η αλανίνη μπορεί εύκολα να σχηματιστεί έτσι και βιοχημικά, από τις μεταβολικές οδούς της γλυκόλυσης γλυκονεογένεσης και του κύκλου του κιτρικού οξέος.
Με αναγωγή α-νιτροπροπανικού οξέος
Από α-νιτροπροπανικό οξύ με αναγωγή[15]:
{\displaystyle \mathrm {CH_{3}CH(NO_{2})COOH+2Fe+6HCl{\xrightarrow {}}CH_{3}CH(NH_{2})COOH+2FeCl_{3}+2H_{2}O} }
Το α-νιτροαιθανικό οξύ παράγεται από α-αλοπροπανικό οξύ:
{\displaystyle \mathrm {CH_{3}CHXCOOH+AgNO_{2}{\xrightarrow {}}CH_{3}CH(NO_{2})COOH+AgX\downarrow } }
Από μεθυλομηλονικό οξύ
Από μεθυλομηλονικό οξύ με μετροπή σε μονοαμίδιο και αποικοδόμηση-μετάθεση Hofmann[16]:
{\displaystyle \mathrm {HOOCCH(CH_{3})COOH+ROH{\xrightarrow {}}HOOCCH(CH_{3})COOR+H_{2}O} }
{\displaystyle \mathrm {HOOCCH(CH_{3})COOR+SOCl_{2}{\xrightarrow {}}ClOCCH(CH_{3})COOR+SO_{2}+HCl} }
{\displaystyle \mathrm {ClOCCH(CH_{3})COOR+NH_{3}{\xrightarrow {}}H_{2}NOCCH(CH_{3})COOR+HCl} }
{\displaystyle \mathrm {H_{2}NOCCH(CH_{3})COOR+KBrO{\xrightarrow {}}CH_{3}CH(NH_{2})COOR+KBr+CO_{2}} }
{\displaystyle \mathrm {CH_{3}CH(NH_{2})COOR+H_{2}O{\xrightarrow {}}CH_{3}CH(NH_{2})COOH+ROH} }
Από α-αμινοπροπανονιτρίλιο
Από α-αμινοπροπανονιτρίλιο με υδρόλυση:
{\displaystyle \mathrm {CH_{3}CH(NH_{2})CN+2H_{2}O{\xrightarrow {}}CH_{3}CH(NH_{2})COOH+NH_{3}} }
To α-αμινοπροπανονιτρίλιο παράγεται από αιθανάλη με επίδραση χλωριούχου αμμωνίου και κυανιούχου νατρίου[17]
{\displaystyle \mathrm {CH_{3}CHO+NH_{4}Cl+NaCN{\xrightarrow {}}CH_{3}CH(NH_{2})CN+H_{2}O+NaCl} }
Χημικές ιδιότητες και παράγωγα
Αμφολυτική αυμπεριφορά
1. Η πιο χαρακτηριστική είναι η αμφολυτική διάστασή της:
{\displaystyle \mathrm {CH_{3}CH(NH_{2})COO^{-}{\begin{matrix}+H^{+}\\{\overrightarrow {\longleftarrow }}\\\;\end{matrix}}{\begin{Bmatrix}CH_{3}CH(NH_{2})COOH\\\uparrow \downarrow \\CH_{3}CH(NH_{3}^{+})COO^{-}\end{Bmatrix}}{\begin{matrix}+H^{+}\\{\overrightarrow {\longleftarrow }}\\\;\end{matrix}}CH_{3}CH(NH_{3}^{+})COOH} }
Η κεντρική πάνω κατάσταση ισχύει για αδιάλυτη (ή διαλυτή σε απρωτικούς διαλύτες) αλανίνη.
Σε υδατικά διαλύματα:
Για pH<pK1 ιονίζεται μόνο η αμινομάδα (δεξιά).
Για pH=pI ιονίζονται και η αμινομάδα και η καρβοξυλομάδα (κένρο κάτω).
Για pH>pK2 ιονίζεται μόνο η καρβοξυλομάδα (αριστερά).
2. Παραγωγή αλάτων με οξέα και βάσεις. Π.χ.:
{\displaystyle \mathrm {CH_{3}CH(NH_{2})COOH+HCl{\xrightarrow {}}CH_{3}CH(NH_{3}Cl)COOH} }
και
{\displaystyle \mathrm {CH_{3}CH(NH_{2})COOH+NaOH{\xrightarrow {}}CH_{3}CH(NH_{2})COONa+H_{2}O} }
Εστεροποίηση
Αντιδρά με αλκοόλες σχηματίζοντας αμινεστέρες. Αποτελεί και μέθοδο «προστασίας»[18] της καρβοξυλομάδας.
{\displaystyle \mathrm {CH_{3}CH(NH_{2})COOH+ROH{\overrightarrow {\longleftarrow }}CH_{3}CH(NH_{2})COOR+H_{2}O} }
Αλκυλίωση
Με επίδραση αλκυλοαλογονιδίων σχηματίζονται δευτεροταγή αμινοξέα:
{\displaystyle \mathrm {CH_{3}CH(NH_{2})COOH+RX{\xrightarrow {}}RNHCH(CH_{3})COOH+HX} }
Ακυλίωαη
Με επίδραση ακυλοαλογονιδίων σχηματίζονται δευτεροταγή αμιδοξέα. Αποτελεί και μέθοδο «προστασίας»[18] της αμινομάδας, αφού τα αμίδια υδρολύονται.
{\displaystyle \mathrm {CH_{3}CH(NH_{2})COOH+RCOX{\xrightarrow {}}RCONHCH(CH_{3})COOH+HX} }
Απαζώτωση
Με επίδραση νιτρώδους οξέος πρακτικά αντικαθίστανται η αμινομάδα με υδροξυλομάδα. Παράγεται γαλακτικό οξύ:
{\displaystyle \mathrm {CH_{3}CH(NH_{2})COOH+HNO_{2}{\xrightarrow {}}CH_{3}CH(OH)COOH+H_{2}O+N_{2}} }
Επίδραση καρβενίων
Με επίδραση καρβενίων παράγεται ένα μίγμα προϊόντων. Π.χ. με μεθυλένιο έχουμε περίπου την παρακάτω στοιχειομετρική εξίσωση:
{\displaystyle \mathrm {CH_{3}CH(NH_{2})COOH+CH_{2}N_{2}{\xrightarrow {hv}}{\frac {3}{8}}CH_{3}CH_{2}CH(NH_{2})COOH+{\frac {2}{8}}CH_{3}CH(NHCH_{3})COOH+{\frac {1}{8}}(CH_{3})_{2}C(NH_{2})COOH+N_{2}+{\frac {1}{8}}} } 
- Η παραπάνω στοιχειομετρική εξίσωση είναι άθροισμα κατά μέλη των ακόλουθων δράσεων:
- Παρεμβολή στους τρεις (3) δεσμούς C#3-H. Παράγεται 2-αμινοβουτανικό οξύ, ένα μη πρωτεϊνικό πρωτοταγές α-αμινοξύ.
- Παρεμβολή στους δύο (2) δεσμούς N-H. Παράγεται 2-(μεθυλαμινο)προπανικό οξύ, ένα μη πρωτεϊνικό δευτεροταγές α-αμινοξύ.
- Παρεμβολή στον ένα (1) δεσμό C#2-H. Παράγεται 2-αμινο-2-μεθυλοπροπανικό οξύ, ένα μη πρωτεϊνικό πρωτοταγές α-αμινοξύ.
- Παρεμβολή στον ένα (1) δεσμό O-H. Παράγεται 2-αμινοπροπανικός μεθυλεστέρας, ο μεθυλεστέρας της αλανίνης.
- Προσθήκη στον ένα (1) δεσμό C=O. Παράγεται 1-(1'-αμινοαιθυλο)-1-υδροξυοξιράνιο, μια ετεροκυκλική αμιναλκοόλη.
- Συνολικά δηλαδή οκτώ (8) παράγωγα προϊόντα, που είναι πρακτικά ισοδύναμα (σ' αυτήν την περίπτωση) σε παραγωγή, εξαιτίας της μεγάλης δραστικότητας του μεθυλενίου, που ως δίριζα κάνει σχεδόν απόλυτα κινητικές (δηλαδή όχι εκλεκτικές) τις αντιδράσεις του.
Η αλανίνη ως βιολογικό μόριο
Η L-αλανίνη είναι δεύτερη σε συχνότητα εμφάνισης στις πρωτεΐνες (μετά από μόνο τη λευκίνη) και αποτελεί το 7,8% της πρωτοταγούς δομής σε ένα δείγμα 1.150 πρωτεϊνών[19]. Οι κωδικόνια της είναι: GCU, GCC, GCA και GCG.
Μια ιδιαίτερα πλούσια πηγή α-αλανίνης είναι η ινοΐνη (πρωτεΐνη) μεταξιού, από την οποία απομονώθηκε αρχικά η αλανίνη το 1879. Είναι ένα από τα μη απαραίτητα αμινοξέα καθώς μπορούν να τη συνθέσουν τα πουλιά και τα θηλαστικά από το μεταβολισμό σακχάρων και δεν απαιτείται η άμεση διατροφική λήψη της. Ωστόσο καλή πηγή αλανίνης αποτελούν οι ακόλουθες τροφές: κρέας, θαλασσινά, γαλακτοκομικά, αυγά, ζελατίνη, φασόλια, καρύδια, σπόροι, ρύζι, καλαμπόκι, σιτάρι, κ.ά.
Η αλανίνη μπορεί να βιοσυντεθεί από πυροσταφυλικό οξύ και διακλαδισμένα αμινοξέα όπως η βαλίνη, η λευκίνη και η ισολευκίνη. Επίσης, κατά την αποικοδόμηση της θρυπτοφάνης τρία μόρια άνθρακα αυτής αποβάλλονται ως αλανίνη.
Καταβολισμός της αλανίνης
Η L-αλανίνη χαρακτηρίζεται ως αμιγώς γλυκογενετικό αμινοξύ καθώς κατά τον καταβολισμό της αποδίδει πυροσταφυλικό το οποίο μπορεί να εισέλθει στην γλυκονεογενετική πορεία και να αποδώσει γλυκόζη. Η μετατροπή της αλανίνης σε πυροσταφυλικό επιτελείται από το ένζυμο αμινομεταφοράση της αλανίνης. Κατά την αντίδραση αυτή η αμινομάδα της αλανίνης μεταφέρεται στο α-κετογλουταρικό οξύ με αποτέλεσμα το σχηματισμό γλουταμινικού. Ο εναπομένων ανθρακικός σκελετός της απαμινωμένης αλανίνης αποτελεί το πυροσταφυλικό οξύ. Κατά το πρώτα βήματα της γλυκονεογένεσης το πυροσταφυλικό που προκύπτει από την αλανίνη καρβοξυλιώνεται σε οξαλοξικό οξύ με την ανάλωση ενός μορίου τριφωσφορικής αδενοσίνης (ATP) και το οξαλοξικό με τη σειρά του αποκαρβοξυλιώνεται και φωσφορυλιώνεται για να αποδώσει φωσφοενολοπυροσταφυλικό (PEP) με ανάλωση ενός μορίου τριφωσφορικής γουανοσίνης (GTP).
Κύκλος της αλανίνης
Η L-αλανίνη χρησιμοποιείται από τους μύες για τη μεταφορά του αζώτου, που προκύπτει από τον καταβολισμό των αμινοξέων ως καυσίμων, κατά τη διάρκεια παρατεταμένης άσκησης ή ασιτίας, προς το ήπαρ. Αρχικά το άζωτο εναποτίθεται στο α-κετογλουταρικό προς σχηματισμό γλουταμινικού αλλά οι μύες στερούνται των ενζύμων του κύκλου της ουρίας που θα μπορούσαν να οδηγήσουν στην απέκκριση του αζώτου. Επομένως θα πρέπει με κάποιον τρόπο το προκύπτον άζωτο να μεταφερθεί από τους μύες στο ήπαρ. Ο τρόπος είναι μέσω της μεταφοράς της αμινομάδας από το γλουταμινικό στο πυροσταφυλικό με αποτέλεσμα το σχηματισμό α-κετογλουταρικού και αλανίνης η οποία φέρει το «υπό διωγμόν» άζωτο. Η αλανίνη τότε μεταφέρεται μέσω του αίματος προς το ήπαρ όπου εκεί τρανσαμινώνεται σχηματίζοντας πυροσταφυλικό και γλουταμινικό. Το γλουταμινικό που φέρει το «υπό διωγμόν» άζωτο μετέχει του κύκλου της ουρίας με τελικό αποτέλεσμα την απέκκριση του αζώτου μέσω των ούρων.
Αναφορές και σημειώσεις
Προκύπτει ως μέσος όρος των pKa (βλέπε οξύτητα).
Nomenclature and symbolism for amino acids and peptides (IUPAC-IUB Recommendations 1983)", Pure Appl. Chem. 56 (5): 595–624, 1984, doi:10.1351/pac198456050595.
Σημείωση: Το α- δηλώνει ότι η αμινομάδα συνδέεται στο #2 άτομο άνθρακα, δηλαδή σε αυτό που βρίσκεται αμέσως μετά το καρβοξύλιο.
Σημείωση: Για την ακρίβεια πρωτονιώνεται για pH<6,11. To 6,11 αποτελεί το ισοηλεκτρικό σημείο (pH) της αλανίνης, όπου και οι δυο χαρακτηριστικές της ομάδες ιονίζονται.
Σημείωση: Για την ακρίβεια αποπρωτονιώνεται για pH>6,11. To 6,11 αποτελεί το ισοηλεκτρικό σημείο (pH) της αλανίνης, όπου και οι δυο χαρακτηριστικές της ομάδες ιονίζονται.
Ο χαρακτηρισμός αναφέρεται μόνο στο τμήμα του μορίου μετά το α-άτομο άνθρακα. Το υπόλοιπο μόριο, με δυο ιονιζόμενες ομάδες είναι υδρόφιλο.
Είναι το τμήμα της πρωτεΐνης που εκτελεί τη βιολογική της λειτουργία, όταν βέβαια η πρωτεΐνη δεν είναι απλά «δομική».
Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
«Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 243, §10.2Α.
Προσωρινή κάλυψη χαρακτηριστικής ομάδας για την αποφυγή παραγωγής ανεπιθύμητων παραπροϊόντων.
«Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 298, §13.3Α1, σελ. 243, §10.2B4 και σελ. 301. §13.4.αII.
«Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 329, §14.2.1.
«Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 329, §14.2.2.
«Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 329, §14.2.3.
«Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 243, §10.2B2α.
«Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982, σελ. 298, §13.3Α1, σελ. 296, §13.2Αα, §13.2Γ1, σελ. 243, §10.2B3 και σελ. 301. §13.4.αII.
Σύνθεση Streckel
Προστασία ονομάζεται η προσωρινή δέσμευση μιας χαρακτηριστικής ενεργής ομάδας, ώστε αυτή να μη δώσει ανεπιθύμητες αντιδράσεις και παράγωγα με την επίδραση αντιδραστηρίων που σκοπεύουμε να χρησιμοποιήσουμε πάνω στην ένωση με σκοπό να αξιοποιήσουμε μια άλλη ομάδα και να πάρουμε τα επιθυμητά αποτελέσματα-παράγωγα. Μετά απελευθερώνουμε ή αποπροστατεύουμε την αρχική ομάδα, δηλαδή φροντίζουμε να απομακρυνθεί η ομάδα που την προστάτεψε προσωρινά.
Doolittle, R. F. (1989), "Redundancies in protein sequences", in Fasman, G. D., Prediction of Protein Structures and the Principles of Protein Conformation, New York: Plenum, pp. 599–623, ISBN 0-306-43131-9.
Πηγές πληροφόρησης
Britanica 2004 Ultimate Reference DVD Suite.
SCHAUM'S OUTLINE SERIES, «ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ», Μτφ. Α. Βάρβογλη, 1999
«Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982
Αναστάσιου Βάρβογλη, «Χημεία Οργανικών Ενώσεων», Παρατηρητής, Θεσσαλονίκη 1991
Καραγκιοζίδη Σ. Πολυχρόνη, «Ονοματολογία Οργανικών Ενώσεων στα Ελληνικά & Αγγλικά» Β΄ ΈκδοσηΘεσσαλονίκη 1991
Νικολάου Ε. Αλεξάνδρου, «Γενική Οργανική Χημεία», Εκδόσεις Ζήτη, Θεσσαλονίκη 1985
Δημητρίου Ν. Νικολαΐδη, «Ειδικά Μαθήματα Οργανικής Χημείας», ΑΠΘ, θεσσαλονίκη 1983
Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Φαίδωνα Χατζημηχαλάκη, «Εργαστηριακός Οδηγός», Εκδόσεις Ζήτη, Θεσσαλονίκη 1986
Διαδικτυακοί τόποι που αναφέρονται στις «Αναφορές και παρατηρήσεις».
Πρωτεϊνικά αμινοξέα
Μη πολικά πρωτεϊνικά αμινοξέα
Γλυκίνη (Gly) · Αλανίνη (Ala) · Βαλίνη (Val) · Λευκίνη (Leu) · Ισολευκίνη (Ile) · Φαινυλαλανίνη (Phe) · Μεθειονίνη (Met) · Τρυπτοφάνη (Trp)
Ουδέτερα πολικά πρωτεϊνικά αμινοξέα
Σερίνη (Ser) · Θρεονίνη (Thr) · Ασπαραγίνη (Asn) · Γλουταμίνη (Gln)
Όξινα πρωτεϊνικά αμινοξέα
Κυστεΐνη (Cys) · Ασπαραγινικό οξύ (Asp) · Γλουταμινικό οξύ (Glu) · Τυροσίνη (Tyr)
Βασικά πρωτεϊνικά αμινοξέα
Προλίνη (Pro) · Λυσίνη (Lys) · Ιστιδίνη (His) · Αργινίνη (Arg)
Ειδικά πρωτεϊνικά αμινοξέα
Αλλυσίνη (Aly) · Υδροξυπρολίνη (Hpr) · Σεληνοκυστεΐνη (Sec) Πυρρολυσίνη (Pyl)
Hellenica World - Scientific Library
Από τη ελληνική Βικιπαίδεια http://el.wikipedia.org . Όλα τα κείμενα είναι διαθέσιμα υπό την GNU Free Documentation License