\require{mhchem}
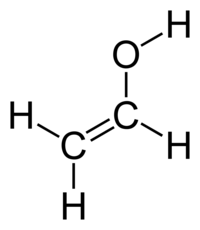
Η αιθενόλη ή βινυλική αλκοόλη ή υδροξυαιθένιο ή υδροξυαιθυλένιο είναι η απλούστερη, αν και ασταθής, αλκενόλη, δηλαδή ακόρεστη άκυκλη αλκοόλη με ένα διπλό δεσμό και ένα υδροξύλιο. Συνήθως αντιπροσωπεύεται από τους τύπους CH2=CHOH και ViOH. Με βάση το χημικό της τύπο, C2H4O έχει τα ακόλουθα δύο (2) ισομερή:
Αιθανάλη ή ακεταλδεΰδη (κύριο ταυτομερές) με σύντομο συντακτικό τύπο CH3CHO.
Οξιράνιο ή αιθυλενοξείδιο με σύντομο συντακτικό τύπο Οξιράνιο.
| Αιθενόλη | |
|---|---|
 |
|
 |
|
| Γενικά | |
| Όνομα IUPAC | Αιθενόλη |
| Άλλες ονομασίες | Βινυλική αλκοόλη Υδροξυαιθένιο Υδροξυαιθυλένιο |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C2H4O |
| Μοριακή μάζα | 44,053 amu |
| Σύντομος συντακτικός τύπος |
CH2=CHOH |
| Συντομογραφίες | ViOH |
| Αριθμός CAS | 557-75-5 |
| SMILES | C=CO |
| PubChem CID | 11199 |
| ChemSpider ID | 10726 |
| Δομή | |
| Μοριακή γεωμετρία | επίπεδη |
| Ισομέρεια | |
| Ισομερή θέσης | 2 Αιθανάλη (ταυτομερές) Οξιράνιο |
| Φυσικές ιδιότητες | |
| Χημικές ιδιότητες | |
| Αυτοϊσομερίωση | ναι προς αιθανάλη |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Δομή
| Δεσμοί[1] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp2-1s | 107 pm | 3% C- H+ |
| O-H | σ | 2sp3-1s | 96 pm | 32% O- H+ |
| C-O | σ | 2sp2-2sp3 | 147 pm pm | 19% C+ O- |
| C=C | σ | 2sp2-2sp2 | 134 pm | |
| π | 2p-2p | |||
| Στατιστικό ηλεκτρικό φορτίο[2] | ||||
| O | -0,51 | |||
| C#2 | -0,06 | |||
| H (H-C) | +0,03 | |||
| C#1 | +0,16 | |||
| H (H-O) | +0,32 | |||
Χημικές ιδιότητες και παράγωγα
Ταυτομέρεια
Βασική ιδιότητά της είναι η ταυτομέρεια με την αιθανάλη, με την οποία βρίσκεται πάντα σε χημική ισορροπία, έντονα μετατοπισμένη σε όφελος της αλδεδης, η οποία όμως δεν είναι δυνατό να απομονωθεί χωρίς την παρουσία ανιχνεύσιμων ιχνών αιθενόλης. Μπορεί να καταλυθεί προς την επιθυμητή κατεύθυνση με παρουσία οξέων, βάσεων ή ουσιών που απομακρύνουν ποσότητες από τη μια από τις δύο ενώσεις[3]:
Ταυτομέρεια αιθανάλης-αιθενόλης
Η σταθερά ισορροπίας της αντίδρασης αιθανάλης προς αιθενόλη σε ουδέτρο περιβάλλον είναι μόλις 6·10-5 στους 20 °C
Αλογόνωση
Με επίδραση αλογόνου (X2) έχουμε προσθήκη στην αιθενόλη, οπότε παράγεται αρχικά η ασταθής 1,2-διαλοαιθανόλη, που αφυδραλογονώνεται σχηματίζοντας τελικά αλαιθανάλη[4]:
{\displaystyle \mathrm {CH_{2}=CHOH+X_{2}{\xrightarrow {}}XCH_{2}CH(X)OH{\xrightarrow {}}XCH_{2}CHO+HX} }
Πολυμερισμός
Εξαιτίας της αστάθειας (λόγω ταυτομέρειας με την αιθανάλη της ίδιας της αιθενάλης, το θερμοπλαστικό πολυβινυλική αλκοόλη (PVA ή PVOH) παράγεται βιομηχανικά με πολυμερισμό του αιθανικού βινυλεστέρα, οπότε ενδιάμεσα παράγεται πολυαιθανικός βινυλεστέρας, που στη συνέχεια υδρολύεται σχηματίζοντας πολυβινυλική αλκοόλη και αιθανικό οξύ:
{\displaystyle \mathrm {(CH_{3}COOCHCH_{2}-)_{v}+vH_{2}O{\xrightarrow {}}(-CH_{2}CHOH-)_{v}+vCH_{3}COOH} } {\displaystyle \mathrm {(CH_{3}COOCHCH_{2}-)_{v}+vH_{2}O{\xrightarrow {}}(-CH_{2}CHOH-)_{v}+vCH_{3}COOH} }
Όπου v, ο βαθμός πολυμερισμού του πολυμερούς.
Ενώσεις συναρμογής
Αρκετά μεταλλικά σύμπλοκα περιέχουν αιθενόλη ως συναρμωτή. Π.χ. το σύμπλοκο αιθενολοοξαλικοχλωρολευκόχρυσος [Pt(acac)(η2-CH2=CHOH)Cl][5][6]
Ανίχνευση αιθενόλης στο διαστρικό υλικό
Η αιθενόλη ανακαλύφθηκε στο μοριακό νεφέλωμα του Τοξότη Β΄ χρησμοποιώντας ένα ραδιοτηλεσκόπιο 12 μέτρων στο Kitt Peak National Observatory[7]. Το γεγονός ότι βρέθηκε αιθενόλη (χωρίς το ταυτομερές της) στο αραιό διαστρικό ενδιάμεσο δείχνει ότι η αντίδραση ταυτομερισμού της δεν είναι μονομοριακή, όπως πιστεύοταν.
Aναφορές και σημειώσεις
Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.218, §9.5.1.
Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.220, §9.5.13.
F. A. Cotton, J. N. Francis, B. A. Frenz, M. Tsutsui "Structure of a dihapto(vinyl alcohol) complex of platinum(II)" Journal of the American Chemical Society, 1973, volume 95, p. 2483-6. doi:10.1021/ja00789a011
Όπου acac: οξαλικό οξύ
«Scientists Toast the Discovery of Vinyl Alcohol in Interstellar Space». National Radio Astronomy Observatory. 2001-10-01. Ανακτήθηκε στις 2006-12-20.
Πηγές
Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
Δημήτριου Ν. Νικολαΐδη: Ειδικά μαθήματα Οργανικής Χημείας, Θεσσαλονίκη 1983.
Hellenica World - Scientific Library
Από τη ελληνική Βικιπαίδεια http://el.wikipedia.org . Όλα τα κείμενα είναι διαθέσιμα υπό την GNU Free Documentation License


