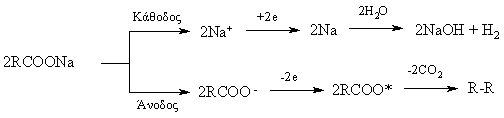\require{mhchem}
Τα αλκάνια[1], στην οργανική χημεία, είναι κορεσμένοι αλειφατικοί (δηλαδή μη κυκλικοί) υδρογονάνθρακες, και ταυτόχρονα οι πιο απλές οργανικές ενώσεις. Ο γενικός χημικός τύπος των ενώσεων της ομόλογης σειράς των κορεσμένων υδρογονανθράκων, ανάλογα με τον αριθμό των ατόμων άνθρακα (n) που περιέχουν, είναι: CnH2n+2. Τα αλκάνια αποτελούν μια από τις ομόλογες σειρές των οργανικών ενώσεων. Κάθε επόμενο μέλος της σειράς, με επιπλέον αλυσοποίηση, διαφέρει από το προηγούμενο κατά μοριακή μάζα 14,03 amu, δηλαδή τη μάζα μιας μεθυλενικής ομάδας (-CH2-), δηλαδή το άθροισμα των ατομικών μαζών ενός (1) ατόμου άνθρακα και δύο (2) ατόμων υδρογόνου. Υπάρχουν δυο κύριες εμπορικά συμφέρουσες πηγές αλκανίων: Το πετρέλαιο και το φυσικό αέριο.
Στα αλκάνια, κάθε άτομο άνθρακα έχει τέσσερεις (4) ομοιοπολικούς δεσμούς, είτε C-H, είτε C-C, και κάθε άτομο υδρογόνου έχει έναν (1) ομοιοπολικό δεσμό πάντα με ένα (1) άτομο άνθρακα. Μια σειρά από συνδεμένα με δεσμούς άτομα άνθρακα είναι γνωστή ως ανθρακική αλυσίδα ή «ανθρακικός σκελετός». Ο αριθμός των ατόμων του άνθρακα που χρησιμοποιήθηκε για την παραγωγή ενός μορίου αλκανίου ονομάζεται «μέγεθος» του αλκανίου.
Ένα αλκύλιο, που γενικά παριστάνεται διεθνώς σύμβολο με το R[2] και είναι μια λειτουργική ομάδα ή «διακλάδωση», που όπως τα αλκάνια, αποτελούνται μόνο από άτομα άνθρακα, συνδεμένα μεταξύ τους μόνο με απλούς δεσμούς, και άτομα υδρογόνου, αλλά διαφέρουν από τα αντίστοιχα αλκάνια, έχοντας ένα άτομο υδρογόνου λιγότερο, και άρα έχοντας ελεύθερο ένα δεσμικό ηλεκτρόνιο άνθρακα, που μπορεί να σχηματίσει άμεσα χημικό δεσμό. Παραδείγματα αλκυλίων αποτελούν το μεθύλιο και το αιθύλιο.
Το απλούστερο αλκάνιο είναι το μεθάνιο (CH4) και αποκαλείται μερικές φορές «μητρική ένωση των αλκανίων». δεν υπάρχει κανένα όριο στον αριθμό ατόμων άνθρακα που μπορούν να συνδεθούν μαζί σε ένα μόριο. Ορισμένα έλαια και κηροί (όσες από τις ενώσεις αυτές είναι αλκάνια) αποτελούν παραδείγματα μεγαλύτερων (και βαρύτερων) αλκανίων, όπου το μέγεθος ανθρακικής αλυσίδας πάνω από 10.
Όλα τα αλκάνια είναι άχρωμα και άοσμα. Τα αλκάνια δεν είναι και πολύ δραστικά από χημικής άποψης κα έχουν μικρή βιολογική δραστηριότητα. Αλλά, τα αλκάνια μπορεί να τα δει κανείς ως ένα είδους μοριακού δέντρου, από τα οποία μπορούν να «κρεμαστούν», μετά την αφαίρεση ατόμων υδρογόνου, διάφορες χημικά ή και βιολογικά δραστικές λειτουργικές ομάδες, σχηματίζοντας νέα μόρια.
Οι κορεσμένοι υδρογονάνθρακες στους οποίους τα άτομα άνθρακα σχηματίζουν δακτύλιο ονομάζονται κυκλοαλκάνια και έχουν γενικό τύπο CnH2n. Πρόκειται για άλλη ομόλογη σειρά με βαθμό ακορεστότητας 1, που έχουν ως ισομερή θέσης τα αλκένια.
Δομική ταξινόμιση
Τα αλκάνια μπορεί να είναι:
«Γραμμικά» ή «κανονικά»: Τα άτομα άνθρακα είναι ενωμένα στη σειρά, σε μια δομή που θυμίζει φίδι.
«Διακλαδισμένα»: Με βάση το γενικό τύπο των αλκανίων, CnH2n+2, υπάρχουν για n > 3. Σε αυτά η «κύρια», δηλαδή η πολυπλοκότερη ή μεγαλύτερη ανθρακική αλυσίδα διακλαδίζεται τουλάχιστον μία φορά.
Αναπαράσταση αλκανίων
Όταν αποδίδουμε τη δομή ενός αλκανίου, μπορείτε να δείτε διαφορετικά επίπεδα σχεδίασης, που εξαρτώνται από τις επιθυμητές λεπτομέρειες και το διαθέσιμο χώρο και χρόνο. Για παράδειγμα, το πεντάνιο, με χημικό τύπο C5H12, μπορεί να αναπαρασταθεί με τους ακόλουθους τρόπους:
Pentane
ή
CH3–CH2–CH2–CH2–CH3,
ή
CH3(CH2)3CH3,
ή απλοποιημένα
Pentane-2D-Skeletal
Ισομέρεια αλκανίων
Τα αλκάνια που έχουν περισσότερα από τρία (3) άτομα άνθρακα μπορούν πλέον να συνδεθούν με διαφορετικούς και μη ισοδύναμους τρόπους, σχηματίζοντας έτσι ισομερή θέσης. Τα απλούστερα ισομερή είναι πάντοτε τα γραμμικά ή κανονικά αλκάνια, που δεν έχουν καμμία διακλάδωση. Μερικές φορές το γεγονός ότι πρόκειται για το κανονικό ισομερές επισημαίνεται με το πρόθεμα n- (διεθνώς, από την αγγλική λέξη normal) ή κ- (σε ελληνικά συγγράμματα, από την ελληνική λέξη κανονικός). Ωστόσο η ανθρακική αλυσίδα μπορεί να διακλαδιστεί σε ένα ή περισσότερα σημεία. Ο αριθμός των πιθανών ισομερών αυξάνει γρήγορα με την αύξηση των ατόμων άνθρακα της ανθρακικής αλυσίδας των αλκανίων. Για παράδειγμα:
Α
| Αριθμός ατόμων C | Αριθμός ισομερών | Ονομασίες ισομερών |
| 1 | 1 | Μεθάνιο |
| 2 | 1 | Αιθάνιο |
| 3 | 1 | Προπάνιο |
| 4 | 2 | Βουτάνιο και μεθυλοπροπάνιο |
| 5 | 3 | Πεντάνιο, μεθυλοβουτάνιο και διμεθυλοπροπάνιο |
| 6 | 5 | Εξάνιο, 2-μεθυλοπεντάνιο, 3-μεθυλοπεντάνιο, 2,2-διμεθυλοβουτάνιο και 2,3-διμεθυλοβουτάνιο |
| 7 | 9 | |
| 8 | 17 | |
| ... | ... | |
| 12 | 355 | |
| ... | ... | |
| 32 | 27.711.253.769 | |
| ... | ... | |
| 60 | 22.158.734.535.770.411.074.184[3] | |
| ... | ... |
Επίσης, τα διακλαδισμένα αλκάνια, μπορεί να είναι χειρόμορφα. Για παράδειγμα, το 3-μεθυλεξάνιο είναι χειρόμορφο, γιατί το άτομο άνθρακα #3 της ένωσης είναι ασυμμετρικό. Το γεγονός αυτό προσθέτει σε μερικά από τα ισομερή θέσης και στεροϊσομερή.
Επειδή τα ισομερή αυτά έχουν διαφορετικές δομές, έχουν και διαφορετικές ιδιότητες όπως φαίνεται για παράδειγμα στον παρακάτω πίνακα με τα ισομερή του πεντανίου:
| Συντακτικός τύπος Δομή |
Όνομα IUPAC (ελληνική μορφή) Όνομα |
Μοριακό βάρος |
Σημείο ζέσεως (°C, 1 atm) |
Κρίσιμη πίεση (atm) |
Κρίσιμη θερμοκρασία (°C) |
 |
κ-πεντάνιο πεντάνιο |
72,149 | 36,06 | 33,25 | 196,50 |
  |
2-μεθυλοβουτάνιο ισοπεντάνιο |
72,149 | 27,84 | 33,37 | 187,24 |
  |
2,2-διμεθυλοπροπάνιο νεοπεντάνιο |
72,149 | 9,50 | 31,57 | 160,60 |
Ονοματολογία
Κύριο λήμμα: Ονοματολογία οργανικών ενώσεων
Η κατά IUPAC ονοματολογία για τα αλκάνια βασίζεται στην ταυτοποίηση της υδρανθρακικής τους αλυσίδας. Για τα μη διακλαδισμένα αλκάνια, οι υδρανθρακικές αλυσίδες ονομάζονται γενικά συστηματικά με τη χρήση ενός ελληνικού αριθμητικού πολλαπλασιαστικού προθέματος, που αναφέρεται στον αριθμό των ατόμων άνθρακα της αλυσίδας, και μιας σταθερής κατάληξης «-άνιο»[4]. Κατ' εξαίρεση, όμως, τα πρώτα τέσσερα μέλη της σειράς των αλκανίων ονομάζονται, αντίστοιχα μεθάνιο, αιθάνιο, προπάνιο και βουτάνιο. Τα προθέματα αυτά πρήλθαν από αντίστοιχα από τις ονομασίες των ενώσεων μεθανόλη, αιθέρας, προπιονικό οξύ και βουτυρικό οξύ. Τα αλκάνια με πάνω από 5 άτομα άνθρακα ονοματίζονται κανονικά με τα ελληνικά αριθμητικά πολλαπλασιαστικά προθέματα («πεντ-», «εξ-», «επτ-», «οκτ-», κ.τ.λ.)[5] και τη σταθερή κατάληξη «-άνιο». Στην αγγλόφωνη ονοματολογία χρησιμοποιείται το ίδιο σύστημα ονοματολογίας και αριθμητικών προθεμάτων, αλλά με κατάληξη «-ane». Επίσης ειδικά για το εννεάνιο, αντί του ελληνικού αριθμητικού πολλαπλασιαστικού «εννέα»-, χρησιμοποιούν το αντίστοιχο λατινικό «non-». Οπότε έχουμε «εννεάνιο» στα ελληνικά και «nonane», στα αγγλικά. Δείτε μερικά παραδείγματα (ελληνικής ονοματολογίας μόνο) αμέσως παρακάτω:
| n | n | n | |||
| 1 | μεθάνιο | 4 | βουτάνιο | 19 | δεκαεννεάνιο |
| 2 | αιθάνιο | 5 | πεντάνιο | 30 | τριακοντάνιο |
| 3 | προπάνιο | 10 | δεκάνιο | 70 | εβδομηκοντάνιο |
Οι μονοσθενείς ρίζες, που προκύπτουν από τα αλκάνια με αφαίρεση ενός ατόμου υδρογόνου από ακραίο άτομο άνθρακα, ονομάζονται όπως τα αντίστοιχα αλκάνια με αντικατάσταση της καταλήξεως «-άνιο» από την κατάληξη «-υλο-». Η αρίθμηση της ανθρακικής αλυσίδας αρχίζει από τον άνθρακα με το ελεύθερο σθένος. Π.χ. μεθύλιο: CH3- , αιθύλιο: CH3CH2-, πεντύλιο: CH3CH2CH2CH2CH2-, κ.τ.λ..
Οι δισθενείς ρίζες, που προκύπτουν από τα αλκάνια με αφαίρεση ατόμων υδρογόνου από δύο ακραία άτομα άνθρακα, ονομάζονται «-υλενο-», προπυλενο-, βουτυλενο-, κ.ο.κ., ανάλογα με τον αριθμό ατόμων άνθρακα. Π.χ. αιθυλενο-: -CH2CH2- , προπυλενο-: -CH2CH2CH2-, κ.τ.λ..
Οι επόμενοι κανόνες κατά IUPAC εφαρμόζονται για την απόδοση ονομάτων σε αλκάνια με διακλαδισμένες αλυσίδες:
- Προσδιορίζεται η μακρύτερη συνεχόμενη (όχι υποχρεωτικά ευθεία) αλυσίδα ατόμων άνθρακα στο μόριο. Το κύριο όνομα του αλκανίου διακλαδισμένης αλυσίδας είναι το όνομα του αλκανίου ευθύγραμμης αλυσίδας, το οποίο αντιστοιχεί στον αριθμό ατόμων άνθρακα αυτής της μακρύτερης αλυσίδας. Το πλήρες όνομα του αλκανίου περιλαμβάνει και το όνομα κάθε διακλαδισμένης αλυσίδας. Τα ονόματα αυτά τοποθετούνται μπροστά από το κύριο όνομα, όπως περιγράφουν οι επόμενοι κανόνες.
- Κάθε αλυσίδα που εμφανίζεται ως διακλάδωση της μακρύτερης αλυσίδας παίρνει το όνομα μια αλκυλομάδας, δηλαδή της μονοσθενούς ρίζας του αντίστοιχου αλκανίου η οποία ονοματίζεται όπως περιγράφεται παραπάνω.
- Το πλήρες όνομα της διακλάδωσης απαιτεί έναν αριθμό θέσης, ο οποίος εντοπίζει τη διακλάδωση πάνω στη μακρύτερη αλυσίδα. Για το σκοπό αυτό, αριθμείται κάθε άτομο άνθρακα της μακρύτερης αλυσίδας προς την κατεύθυνση που δίνει τους μικρότερους αριθμούς εντοπισμού (το μικρότερο άθροισμα αριθμών όταν είναι περισσότερες από μία) όλων των διακλαδώσεων.[6].
- Όταν υπάρχουν περισσότερες από μία διακλαδώσεις αλκυλίων του ίδιο είδους, ο αριθμός τους υποδηλώνεται από ένα πρόθεμα, όπως δι-, τρι- ή τετρα-, το οποίο συνοδεύει το όνομα της διακλάδωσης. Η θέση κάθε ομάδας πάνω στη μακρύτερη αλυσίδα δίνεται από αριθμούς. Οι αριθμοί που υποδηλώνουν τη θέση διαχωρίζονται με κόμμα και ακολουθούνται από μία παύλα. Όταν υπάρχουν δύο ή περισσότερες διαφορετικές διακλαδώσεις αλκυλίων, το όνομα κάθε διακλάδωσης, μαζί με τον αριθμό θέσης προηγείται του βασικού ονόματος. Τα ονόματα των αλυσίδων τοποθετούνται είτε με αλφαβητική σειρά είτε με βάση την απλότητα των πλευρικών αλυσίδων.
- Οι παραπάνω κανόνες παραβιάζονται μερικές φορές για λόγους απλοποίησης του τελικού ονόματος. Η πιο συνηθισμένη παραβίαση είναι του 1ου κανόνα, δηλαδή η επιλογή όχι της μακρύτερης αλυσίδας, αλλά της πιο πολύπλοκης (δηλ. αυτή με τους περισσότερες ή πολυπλοκότερες διακλαδώσεις), για να αποφευχθεί η ανάγκη αναγραφής μεγάλου αριθμού διακλαδώσεων.
Π.χ.:
 g 4-αιθυλο-8-δευτ. βουτυλο-2,3,5,9-τετραμεθυλοδωδεκάνιο
g 4-αιθυλο-8-δευτ. βουτυλο-2,3,5,9-τετραμεθυλοδωδεκάνιο
Αλκάνια που διατηρούν και εμπειρικές ονομασίες
Ισοβουτάνιο ή μεθυλοπροπάνιο.
Ισοπεντάνιο ή μεθυλοβουτάνιο.
Νεοπεντάνιο ή διμεθυλοπροπάνιο.
Ισοεξάνιο ή 2-μεθυλοπεντάνιο.
Νεοεξάνιο ή 2,2-διμεθυλοβουτάνιο.
Ισοοκτάνιο ή 2,2,4-τριμεθυλοπεντάνιο.
sec-βούτυλο (sec-bu)
tetr-βουτυλο(tetr-bu)
Μοριακή γεωμετρία
Η τετραεδρική δομή του μεθανίου
Το άτομο του άνθρακα στη θεμελιώδη του κατάσταση εμφανίζει μία ηλεκτρονική διαμόρφωση με τρία 2p τροχιακά και ένα 2s τροχιακό. Με βάση την ηλεκτρονική θεωρία του σθένους, κατά την οποία το αριθμητικό σθένος εξισώνεται με τον αριθμό των μονήρων ηλεκτρονίων σθένους, το άτομο του άνθρακα θα έπρεπε να εμφανίζεται ως δισθενές και όχι τετρασθενές. Για να εξηγήσει λοιπόν την τετρασθένειά του και την ισοτιμία των τεσσάρων σθενών, ο Αμερικανός χημικός Linus Pauling διατύπωσε τη θεωρία του υβριδισμού των ατομικών τροχιακών.
Σύμφωνα με τη θεωρία αυτή, η εξίσωση του αριθμητικού σθένους με τον αριθμό των μονήρων ηλεκτρονίων εξηγείται με την παραδοχή ότι ένα ηλεκτρόνιο από την 2s τροχιά ανυψώνεται στην κενή 2pz τροχιά. Τα τέσσερα τροχιακά που δημιουργούνται με αυτόν τον τρόπο υβριδοποιούνται, οπότε δημιουργούνται τέσσερα ισότιμα υβριδοποιημένα τροχιακά που συμβολίζονται ως sp3. Οι δεσμοί που δημιουργούνται είναι ισότιμοι, ονομάζονται σ δεσμοί και έχουν τετραεδρική διάταξη με γωνία μεταξύ των δεσμών 109° 28'.
Προέλευση
Τα αλκάνια απαντώνται τόσο στη Γη όσο και στο ηλιακό μας σύστημα, αλλά συνήθως μόνο τα περίπου εκατό πρώτα μέλη της ομόλογης σειράς και κυρίως σε ίχνη. Οι ελαφροί υδρογονάνθρακες, και κυρίως το μεθάνιο και το αιθάνιο, έχουν εντοπιστεί σε ουρές κομητών αλλά και σε μετεωρίτες. Επίσης, αποτελούν ένα σημαντικό ποσοστό της ατμόσφαιρας των αέριων πλανητών Δία, Κρόνου, Ουρανού και Ποσειδώνα. Στον Τιτάνα, δορυφόρο του Κρόνου, πιστεύεται ότι κάποτε υπήρχαν μεγάλοι ωκεανοί μικρών ή και μακρύτερων αλκανίων ενώ τώρα πιστεύεται ότι υπάρχουν μικρότερες θάλασσες υγρού αιθανίου.
Στη Γη οι κύριες πηγές των υδρογονανθράκων είναι τα ορυκτά καύσιμα (φυσικό αέριο, πετρέλαιο και γαιάνθρακες. Το φυσικό αέριο είναι κατά βάση μεθάνιο με μικρότερες ποσότητες άλλων αέριων αλκανίων (αιθάνιο, προπάνιο, βουτάνιο), καθώς και ποσότητες διυδρογόνου και ηλίου. Το πετρέλαιο είναι μείγμα αλκανίων και κυκλοαλκανίων με μικρότερες ποσότητες αρωματικών υδρογονανθράκων, αλλά και άλλων (κυρίως θειούχων) οργανικών ενώσεων (δηλαδή και άλλων κατηγοριών υδρογονανθράκων και μη υδρογονανθράκων). Η δημιουργία των ορυκτών αυτών σχετίζεται με την δημιουργία ιζηματογενών πετρωμάτων και αποτελεί προϊόν αποδόμησης των ζωικών και φυτικών ιστών οι οποίοι παγιδεύτηκαν μέσα στα πετρώματα στη διάρκεια της δημιουργίας τους. Η διεργασία αυτή έλαβε χώρα στη διάρκεια εκατομμυρίων ετών. Αρχικά μία ποσότητα του οργανικού υλικού υπό την επίδραση αερόβιων μικροοργανισμών μετατράπηκε σε αέριο το οποίο και απελευθερώθηκε, ενώ απομακρύνθηκε το υδατοδιαλυτό μέρος του υλικού. Το υπόλειμμα δεν αποδομήθηκε λόγω έλλειψης οξυγόνου. Υπό την επίδραση αναερόβιων μικροοργανισμών τα μεγάλα οργανικά μόρια διασπάστηκαν δίδοντας συστατικά πλούσια σε άνθρακα και υδρογόνο. Η αυξημένη πίεση από το βάρος των υπερκειμένων στρωμάτων του πετρώματος και η υψηλή θερμοκρασία ολοκληρώνουν την μετατροπή της οργανικής ύλης σε πετρέλαιο. Τα αρχαιότερα κοιτάσματα χρονολογούνται στα 600 εκατομμύρια χρόνια και τα νεότερα σε 1 εκατομμύριο χρόνια.
Παραγωγή
Βιομηχανικό ενδιαφέρον συνθετικής παρασκευής αλκανίων δεν υπάρχει ακόμη, διότι όλες οι ανάγκες καλύπτονται άμεσα ή έμμεσα από φυσικές πηγές. Η γνώση όμως των μεθόδων συνθετικής παρασκευής αλκανίων παρουσιάζει ενδιαφέρον για την Συνθετική Οργανική Χημεία, εφόσον ουσιαστικά πρόκειται για μεθόδους παραγωγής δεσμών C-C ή C-H, τα μόνα είδη δεσμών που περιέχουν τα αλκάνια. Έτσι, οι σπουδαιότεροι τρόποι παραγωγής αλκανίων είναι οι ακόλουθοι[7]:
Ανοικοδόμηση: σύνθεση μεγαλύτερης αλυσίδας από μικρότερες
1. Μέθοδος Würtz: Κατά την επίδραση νατρίου (Na) σε αλκυλαλογονίδια (RX) σχηματίζονται «συμμετρικά» αλκάνια[8]:
{\displaystyle 2RX+Na{\xrightarrow {}}RR+NaX}
Αν το αλκύλιο είναι τριτοταγές η παραπάνω αντίδραση δεν πραγματοποιείται, λόγω στερεοχημικής παρεμπόδισης.
Αν και στην κλασσική αντίδραση που χρησιμοποίησε ο Würtz χρησιμοποίησε νάτριο, αργότερα αποδείχθηκε ότι μπορούν να χρησιμοποιηθούν για ανάλογη αντίδραση επίσης τα ακόλουθα μέταλλα: Κάλιο (K), μαγνήσιο (Mg) και ψευδάργυρος (Zn).
Αν χρησιμοποιηθούν δυο διαφορετικά αλκυλαλογονίδια παράγονται μίγματα των δυο συμμετρικών και ενός μη συμμετρικού:
{\displaystyle 3RX+3R{\acute {}}X+6Na{\xrightarrow {}}RR+RR{\acute {}}+R{\acute {}}R{\acute {}}+6NaX}
Η αντίδραση χρησιμοποιείται όταν τα διαφορετικά αλκάνια που παράγονται έχουν σημεία ζέσης με (σχετικά) μεγάλη διαφορά, γιατί τότε είναι σχετικά εύκολος ο διαχωρισμός τους με κλασματική απόσταξη.
2. Με οργανομεταλλικές ενώσεις:
α. Με Li (σύνθεση κατά Corey-House)[9]:
{\displaystyle RX+2Li{\xrightarrow[{-LiX}]{|Et_{2}O|}}RLi{\xrightarrow[{CuX}]{+R{\acute {}}X}}RR{\acute {}}+LiX}
β. Με Mg[10]:
{\displaystyle RX+Mg{\xrightarrow {|Et_{2}O|}}RMgX{\xrightarrow {+R{\acute {}}X}}RR{\acute {}}+MgX_{2}}
3. Ηλεκτρολυτική μέθοδος Kolbé: Κατά την ηλεκτρόλυση διαλυμάτων αλάτων καρβονικών οξέων με αλκάλια σχηματίζονται στην άνοδο «συμμετρικά» αλκάνια. Για την αντίδραση Kolbé έχουν προταθεί διάφοροι μηχανισμοί, με επικρατέστερο των μηχανισμό ελεύθερων ριζών[11]:.
Το μειονέκτημα και αυτής της μεθόδου είναι ο σχηματισμός παραπροϊόντων, ακόμη και αν χρησιμοποιηθεί άλας ενός καρβονικού οξέος, γιατί συμπαράγονται παραπροϊόντα μεταθέσεων.
4. Παρεμβολή καρβένίου σε αλκάνια. Π.χ.[12]:
{\displaystyle RH+[:CH_{2}]{\xrightarrow {}}RCH_{3}}
Το μειονέκτημα αυτής της μεθόδου είναι ο σχηματισμός όλων των πιθανών ισομερών, γιατί όλοι οι δεσμοί C-H έχουν πρακτικά ίσες πιθανότητες παρεμβολής από το εξαιρετικά ασταθές και δραστικό καρβένιο (που λειτουργεί πρακτικά σαν ελεύθερη δίριζα) που παράγεται ενδιάμεσα.
Χωρίς μεταβολή της ανθρακικής αλυσίδας
1. Αναγωγή αλκυλαλογονιδίων (RX): Σ' αυτή τη μέθοδο χρησιμοποιούνται διάφορα αναγωγικά μέσα, η εκλογή του οποίου εξαρτάται κυρίως από τη φύση του αλκυλαλογονιδίου (πρωτοταγές, δευτεροταγές, τριτοταγές, καθώς και του αλογόνου του).
1. Αναγωγή με «υδρογόνο εν τω γεννάσθαι» (μέταλλο + οξύ). Π.χ.[13]:
{\displaystyle RX+Zn+HX{\xrightarrow {}}RH+ZnX_{2}}
2. Αναγωγή με LiAlH4 ή NaBH4. Π.χ.[13]:
{\displaystyle 4RX+LiAlH_{4}{\xrightarrow {}}4RH+LiX+AlX_{3}}
ή ομοίως: {\displaystyle 4RX+NaBH_{4}{\xrightarrow {}}4RH+NaX+BX_{3}}
3. Αναγωγή αλκυλιωδιδίων με HI. Π.χ.[14]:
{\displaystyle RI+HI{\xrightarrow {}}RH+I_{2}}
4. Αναγωγή μέσω οργανομαγνησιακών ενώσεων[13]:
{\displaystyle RX+Mg{\xrightarrow {|Et_{2}O}}RMgX{\xrightarrow {+H_{2}O}}RH+Mg(OH)X\downarrow }
5. Με αναγωγή αλκυλαλογονιδίου από σιλάνιο, παρουσία τριφθοριούχου βορίου παράγεται αλκάνιo[15]:
{\displaystyle RX+SiH_{4}{\xrightarrow {BF_{3}}}RH+SiH_{3}X}
6. Αναγωγή από ένα αλκανοκασσιτεράνιο. Π.χ.[13]:
{\displaystyle RX+R{\acute {}}\ SnH{\xrightarrow {}}RH+R{\acute {}}\ SnX}
2. Καταλυτική υδρογόνωση ακόρεστων αλειφατικών υδρογονανθράκων, κυκλοπροπανίων ή και κυκλοβουτανίων: Η υδρογόνωση ακόρεστων υδρογονανθράκων οδηγεί σε αλκάνια, των οποίων οι αποδόσεις προσεγγίζουν το 100%, συνήθως παρουσία καταλυτών όπως Pt, Pd και Ni. Π.χ.:
{\displaystyle RCH=CH_{2}+H_{2}{\xrightarrow {Ni,Pd,Pt}}RCH_{2}CH_{3}}
{\displaystyle RC\equiv CH+2H_{2}{\xrightarrow {Ni,Pd,Pt}}RCH_{2}CH_{3}}
Alkylcyclopropane.png {\displaystyle +H_{2}{\xrightarrow {Pt}}{\frac {2}{3}}RCH_{2}CH_{2}CH_{3}+{\frac {1}{3}}CH_{3}CH(R)CH_{3}}
3. Με αναγωγή αλδεΰδης - Αντίδραση Wolf-Kishner[13]:
{\displaystyle RCHO+NH_{2}NH_{2}{\xrightarrow {KOH}}RCH_{3}+N_{2}+H_{2}O}
4. Με αναγωγή κετόνης - Αντίδραση Clemmensen[13]:
{\displaystyle RCOR{\acute {}}+2Zn+2HCl{\xrightarrow {}}RCH_{2}R{\acute {}}+ZnCl_{2}+ZnO}
5. Με αναγωγή των κατάλληλων θειολών μπορεί να παραχθεί αλκάνιο (μέθοδος Raney)[16]:
\( {\displaystyle RSH+H_{2}{\xrightarrow {Ni}}RH+H_{2}S} \_
6. Με αναγωγή των κατάλληλων θειεστέρων μπορεί να παραχθεί αλκάνιο (μέθοδος Raney).[16]:
{\displaystyle RSR+2H_{2}{\xrightarrow {Ni}}2RH+H_{2}S}
Αποικοδόμηση: αποσύνθεση μεγαλύτερης αλυσίδας σε μικρότερη
Αποκαρβοξυλίωση αλάτων καρβονικών οξέων: Κατά τη θέρμανση αλάτων καρβονικών οξέων με καυστικά αλκάλια σχηματίζονται αλκάνια. Π.χ.:
{\displaystyle RCOOH+NaOH{\xrightarrow {}}RCOONa+H_{2}O{\xrightarrow {\triangle }}RH+NaHCO_{3}{\xrightarrow {}}RH+NaOH+CO_{2}}
Φυσικές ιδιότητες
Τα σημεία τήξης (μπλε) και σημεία ζέσεως (ροζ) των κανονικών αλκανίων μέχρι τα 14 άτομα άνθρακα σε °C
Τα μέλη της ομόλογης σειράς των αλκανίων έχουν φυσικές ιδιότητες οι οποίες μεταβάλλονται κατά μήκος της σειράς με κανονικό τρόπο. Έτσι υπό κανονικές συνθήκες, τα πρώτα μέλη της σειράς από 1 έως 4 άτομα άνθρακα είναι αέρια, τα μέσα μέλη άνω του βουτανίου είναι υγρά και τα ανώτερα αλκάνια, άνω του δεκαπεντανίου, είναι στερεά. Σε γενικές γραμμές για κάθε μεθυλενική ομάδα που προστίθεται το σημείο ζέσεως αυξάνεται από 20 έως 30 °C, όπως φαίνεται και στο διπλανό διάγραμμα. Από την άλλη, το σημείο τήξης των κανονικών αλκανίων, παρόλο που αυξάνεται επίσης με την αύξηση των ατόμων άνθρακα (με την εξαίρεση του προπανίου), αυξάνεται εμφανώς πιο αργά ιδιαίτερα στα ανώτερα αλκάνια. Επίσης, το σημείο τήξης των αλκανίων με περιττό αριθμό ατόμων άνθρακα αυξάνεται γρηγορότερα από το σημείο τήξης των αλκανίων με ζυγό αριθμό ατόμων άνθρακα.
Γενικά, τα γραμμικά αλκάνια έχουν υψηλότερο σημείο ζέσεως από τα αντίστοιχα διακλαδισμένα. Αυτό αποδίδεται στις δυνάμεις van der Waals που ασκούνται εντονότερα μεταξύ των μορίων γραμμικών αλκανίων από ότι μεταξύ των μορίων διακλαδισμένων αλκανίων. Στα διακλαδισμένα αλκάνια, τα οποία έχουν περισσότερο σφαιρικό σχήμα από τα γραμμικά και άρα μικρότερη εξωτερική επιφάνεια, η επαφή μεταξύ των μορίων είναι μικρότερη και επομένως μεταξύ των μορίων ασκούνται ασθενέστερες δυνάμεις van der Waals.
Τα αλκάνια θεωρούνται άπολες ενώσεις και γι' αυτό δεν σχηματίζουν δεσμούς υδρογόνου και δεν διαλύονται σε πολικούς διαλύτες όπως το νερό και οι αλκοόλες. Αντίθετα, διαλύονται εύκολα σε άπολους διαλύτες όπως το βενζόλιο και ο τετραχλωράνθρακας. Τέλος, διάφορα αλκάνια μπορούν αναμιχθούν μεταξύ τους σε διάφορες αναλογίες.
Η πυκνότητα των αλκανίων αυξάνεται με την αύξηση του αριθμού των ατόμων άνθρακα αλλά παραμένει μικρότερη από αυτή του νερού. Έτσι, σε ένα μείγμα νερού-αλκανίων τα αλκάνια διατηρούνται πάντα στα ανώτερα στρώματα του μίγματος.
Φασματοσκοπικές ιδιότητες
Ουσιαστικά όλες οι οργανικές ενώσεις περιέχουν δεσμούς άνθρακα-άνθρακα και άνθρακα-υδρογόνου, και έτσι παρουσιάζουν κάποια από τα χαρακτηριστικά των αλκανίων στο φάσμα τους. Αντίθετα, τα αλκάνια χαρακτηρίζονται από την απουσία άλλων χαρακτηριστικών ομάδων εκτός από τις παραπάνω με αποτέλεσμα την απουσία στο φάσμα των αντίστοιχων χαρακτηριστικών απορροφήσεων. Γι' αυτό τον λόγο τα αλκάνια είναι πολύ καλοί διαλύτες άλλων ουσιών ιδιαίτερα για την μελέτη των τελευταίων με φασματοσκοπία υπεριώδους-ορατού.
Στη φασματοσκοπία υπερύθρου (IR) η δόνηση τάσεως του δεσμού άνθρακα-υδρογόνου εμφανίζεται ισχυρή μεταξύ 2850 και 2950 cm−1, ενώ η αντίστοιχη του δεσμού άνθρακα-άνθρακα εμφανίζεται μεταξύ 700 και 1300 cm−1. Η δόνηση κάμψεως του δεσμού άνθρακα-υδρογόνου εξαρτάται από το είδος της ομάδας. Έτσι, στις μεθυλο-ομάδες εμφανίζεται στα 1430 – 1470 cm−1 και στα 1370 – 1380 cm−1, ενώ στις μεθυλενο-ομάδες στα 1445 – 1485 cm−1. Τέλος, αλκάνια με περισσότερα από τέσσερα άτομα άνθρακα παρουσιάζουν μία ασθενή απορρόφηση στα 720 – 750 cm−1.
Στη φασματοσκοπία πρωτονιακού πυρηνικού μαγνητικού συντονισμού (H-NMR) των αλκανίων είναι πολύ χαρακτηριστικά. Τα πρωτόνια των μέθυλο-ομάδων συντονίζονται περίπου στα 0,9 ppm, ενώ των μεθυλενο-ομάδων στα 1,25 ppm περίπου. Διάκριση μεταξύ γραμμικού και διακλαδισμένου αλκανίου μπορεί να γίνει με συγκριτική μελέτη της εμβαδομετρήσεως των κορυφών των μεθυλο- και μεθυλενο- ομάδων.
Η φασματοσκοπία μαζών αποτελεί μια πρώτης τάξεως μέθοδο για τη μελέτη της δομής είτε καθαρών είτε μιγμάτων αλκανίων. Αλκάνια με ευθεία αλυσίδα δίνουν φάσματα μαζών, χαρακτηριστικό των οποίων είναι η ύπαρξη ομάδων κορυφών που απέχουν κατά 14 μονάδες μάζας (-CH2-). Κάθε ομάδα αποτελείται από τρεις επιμέρους κορυφές που αντιστοιχούν στα CnH2n+1 (περισσότερο έντονη), CnH2n και CnH2n-1. Χαρακτηριστικό των διακλαδισμένων αλκανίων είναι το θραύσμα που αντιστοιχεί στο σημείο της διακλαδώσεως και εμφανίζεται με μεγαλύτερη ένταση.
Χημικές ιδιότητες
Τα αλκάνια έχουν γενικά μικρή δραστικότητα, διότι οι δεσμοί άνθρακα – άνθρακα και άνθρακα – υδρογόνου είναι σχετικά σταθεροί και τα μόρια των αλκανίων δεν διαθέτουν άλλες χαρακτηριστικές ομάδες.
Παρόλα αυτά, σήμερα ορισμένες αντιδράσεις των αλκανίων έχουν εξαιρετική σπουδαιότητα τόσο στη διύλιση του πετρελαίου όσο και γενικότερα στην οργανική χημική βιομηχανία και χρησιμοποιούνται περισσότερο από κάθε άλλη αντίδραση, κυρίως εξαιτίας της σχετικά μεγάλης και εύκολης διαθεσιμότητας που έχουν ως πρώτες ύλες, άμεσα ή έμμεσα, λόγω της παγκόσμιας μαζικής χρήσης των ορυκτών κοιτασμάτων υδρογονανθράκων του πλανήτη. Άλλωστε η σχετικά μεγάλη απλότητά τους κάνει εφικτή και σχετικά οικονομική και την τεχνητή σύνθεσή τους.
Οξείδωση
1. Όλα τα αλκάνια πάνω από μια ορισμένη θερμοκρασία, με περίσσεια οξυγόνου οξειδώνονται τόσο γρήγορα προς διοξείδιο του άνθρακα και νερό, ώστε να λέμε ότι καίγονται. Η γενική εξίσωση της πλήρους καύσης των αλκανίων έχει την παρακάτω μορφή[17]:
{\displaystyle C_{v}H_{2v+2}+{\frac {3v+1}{2}}O_{2}{\xrightarrow {\triangle }}vCO_{2}+(v+1)H_{2}O+(157v+55)\;kcal}
2. Επίσης, τα αλκάνια σε σύγκριση με πολλές άλλες τάξεις οργανικών ενώσεων, είναι αρκετά ανθεκτικά στην επίδραση συνηθισμένων οξειδωτικών μέσων. Έτσι, στη συνηθισμένη θερμοκρασία, το υπερμαγγανικό ή το διχρωμικό κάλιο προσβάλουν αρκετά αργά τα αλκάνια. Παρόλα αυτά, αλκάνια με τριτοταγές άτομο άνθρακα (παράδειγμα ισοβουτάνιο) στη συνηθισμένη θερμοκρασία οξειδώνονται σχετικά εύκολα με υπερμαγγανικό κάλιο. Π.χ.:
{\displaystyle 3(CH_{3})_{3}CH+2KMnO_{4}+H_{2}SO_{4}{\xrightarrow {}}3(CH_{3})_{3}COH+2MnO_{2}+K_{2}SO_{4}+H_{2}O}
3. Επίσης πολλά δίνουν αντιδράσεις καταλυτικής μερικής οξείδωσης. Π.χ.:
{\displaystyle CH_{4}+O_{2}{\xrightarrow[{\triangle }]{Cu}}HCHO+H_{2}O}
Αλογόνωση
Η δραστικότητα των αλογόνων ακολουθεί την εξής σειρά: φθόριο >> χλώριο > βρώμιο >> ιώδιο. Έτσι, η απευθείας φθορίωση των αλκανίων γίνεται συνήθως βίαια και συχνά με έκρηξη. Γι' αυτό τον λόγο συνήθως εφαρμόζονται ειδικές μέθοδοι για την παρασκευή φθοροπαραγώγων. Η αντίδραση με χλώριο είναι σχετικά γρήγορη, με βρώμιο πιο αργή, απαιτεί σημαντική ποσότητα υπεριώδους ακτινοβολίας και είναι πιο εκλεκτική, ενώ με ιώδιο είναι εξαιρετικά βραδεία και ενεργοβόρα, οπότε και για τα ιωδοπαράγωγα συνήθως εφαρμόζονται ειδικές μέθοδοι για την παρασκευή τους.
Τα άτομα υδρογόνου των αλκανίων μπορούν να αντικατασταθούν από χλώριο ή βρώμιο δια μέσου μια αλυσωτής αντιδράσεως ελευθέρων ριζών, ο μηχανισμός της οποίας μπορεί να συνοψισθεί ως εξής:
1. Έναρξη: Ένα μόριο αλογόνου διασπάται σε δύο ελεύθερες ρίζες με τη βοήθεια υπεριώδους ακτινοβολίας ή θέρμανσης:
{\displaystyle X_{2}{\xrightarrow[{\triangle }]{UV}}X^{\bullet }}
2. Διάδοση: Η ελεύθερη ρίζα του αλογόνου αποσπά ένα άτομο υδρογόνου από το αλκάνιο (RH) και στη συνέχεια η ρίζα αντιδρά με αλογόνο δίνοντας το προϊόν της αλογόνωσης:
{\displaystyle RH+X^{\bullet }{\xrightarrow {}}R^{\bullet }+HX}
{\displaystyle RH+R^{\bullet }{\xrightarrow {}}RX+X^{\bullet }}
3. Τερματισμός: Η αντίδραση ολοκληρώνεται με τους παρακάτω τρεις τρόπους:
{\displaystyle 2X^{\bullet }{\xrightarrow {}}X_{2}}
{\displaystyle 2R^{\bullet }{\xrightarrow {}}RR}
{\displaystyle R^{\bullet }+X^{\bullet }{\xrightarrow {}}RX}
Παρεμβολή καρβενίων στους δεσμούς C-H
Τα καρβένια ([:CH2]) είναι ασταθείς και γι' αυτό εξαιρετικά δραστικές ενώσεις του CII και μπορούν παρεμβληθούν στους δεσμούς C-H. Π.χ. έχουμε[18]:
{\displaystyle RH+CH_{3}Cl+KOH{\xrightarrow {}}RCH_{3}+KCl+H_{2}O}
Νίτρωση
Κατά την κατεργασία αλκανίων με νιτρικό οξύ μπορούν να αντικατασταθούν ένα ή περισσότερα άτομα υδρογόνου από την νιτρο-ομάδα (-ΝΟ2). Η όλη αντίδραση είναι γνωστή ως νίτρωση. Η νίτρωση γίνεται είτε σε αέρια φάση (καταλληλότερη για αλκάνια μικρού μοριακού βάρους), είτε σε υγρή φάση, κατά την οποία αλκάνια μεγάλου μοριακού βάρους θερμαίνονται σε θερμοκρασία 140 °C με πυκνό νιτρικό οξύ υπό πίεση[19]:
{\displaystyle RH+HNO_{3}{\xrightarrow[{{\acute {\eta }}\;140^{o}C,\;\pi {\acute {\iota }}\epsilon \sigma \eta }]{\alpha {\acute {\epsilon }}\rho \iota \alpha \;\phi {\acute {\alpha }}\sigma \eta }}RNO_{2}+H_{2}O}
Κατά την νίτρωση αλκανίων παράγονται μίγματα νιτροπαραφινών, ο σχηματισμός των οποίων οφείλεται όχι μόνο σε αντικατάσταση ατόμων υδρογόνου από νιτρο-ομάδες, αλλά και σε αντίδραση της νιτρο-ομάδας με οποιαδήποτε αλκυλο-ομάδα που θα μπορούσε να δημιουργηθεί από τη σχάση της αλυσίδας του υδρογονάνθρακα.
Η νίτρωση σε αέρια φάση ακολουθεί τον μηχανισμό ελεύθερων ριζών. Σε αυτή την περίπτωση η ευκολία υποκαταστάσεως υδρογόνου από νιτρο-ομάδα ακολουθεί την παρακάτω σειρά εξαιτίας του ενδιάμεσου σχηματισμού σταθερότερων ριζών: {\displaystyle R_{3}C^{\bullet }>R_{2}CH^{\bullet }>RCH_{2}^{\bullet }>CH_{3}^{\bullet }}.
Χρήσεις – Εφαρμογές των αλκανίων
Μεθάνιο: αέριο κύριο συστατικό του φυσικού αερίου (καύσιμο) Αιθάνιο: συστατικό του φυσικού αερίου (καύσιμο) Προπάνιο: συστατικό του υγραερίου (LPG), υγραερίου (καύσιμο) Βουτάνιο: συστατικό του υγραερίου (LPG), αναπτήρες (καύσιμο) Πεντάνιο: συστατικό της βενζίνης (καύσιμο) Εξάνιο: συστατικό της βενζίνης (καύσιμο) Επτάνιο: συστατικό της βενζίνης. Οκτάνιο: σημαντικό συστατικό της βενζίνης (καύσιμο). Εννεάνιο: συστατικό της βενζίνης (καύσιμο). Δεκάνιο: συστατικό της βενζίνης (καύσιμο). Δεκαεξάνιο: συστατικό του καυσίμου ντίζελ και του πετρελαίου θέρμανσης.
Τα αλκάνια χρησιμοποιούνται επίσης: -Στην παραγωγή πολυμερών - Χρησιμεύουν ως ενδιάμεσα στη σύνθεση των φαρμάκων, εντομοκτόνων και άλλων πολύτιμων χημικών ουσιών (π.χ. αιθανόλη, οξικό οξύ, αιθυλενογλυκόλη, χλωριούχο βινύλιο). -Παραφίνη (κατασκευή κεριών). -Βαζελίνη -Άσφαλτο, σε όλα τα πλαστικά, ακρυλικά και πλαστικά χρώματα, στα καλλυντικά, στα απορρυπαντικά, στα γκαζάκια, κινητήρες ως καύσιμο αλλά και σε στα μέρη των μηχανών (π.χ. καρμπιρατέρ). -Ως διαλύτης με το όνομα πετρελαϊκός αιθέρας. -Ως λιπαντικά έλαια και με τη μορφή των αλάτων σουλφοξέων με νάτριο στη βιομηχανία των απορρυπαντικών.
Κίνδυνοι για την υγεία
Το μεθάνιο καθώς και άλλα αλκάνια χαμηλού μοριακού βάρους μπορούν να δημιουργήσουν εκρηκτικά μίγματα με τον αέρα (1-8% CH4) ενώ το μεθάνιο θεωρείται δεύτερο σημαντικότερο αέριο του θερμοκηπίου (μετά το CO2). Τα ελαφρά υγρά αλκάνια είναι εξαιρετικά εύφλεκτα αλλά αυτός ο κίνδυνος μειώνεται με την αύξηση του μήκους της ανθρακικής αλυσίδας. Τα πεντάνιο, εξάνιο, επτάνιο και οκτάνιο έχουν επισημανθεί από την Ευρωπαϊκή Ένωση ως επικίνδυνα για το περιβάλλον και επιβλαβή.
Πηγές πληροφόρησης
Παπαγεωργίου Β.Π., Εφαρμοσμένη Οργανική Χημεία: Άκυκλες ενώσεις, Εκδόσεις Παρατηρητής, Θεσσαλονίκη 1986.
SCHAUM'S OUTLINE SERIES, «ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ», Μτφ. Α. Βάρβογλη, 1999
«Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982
Αναστάσιου Βάρβογλη, «Χημεία Οργανικών Ενώσεων», Παρατηρητής, Θεσσαλονίκη 1991
Καραγκιοζίδη Σ. Πολυχρόνη, «Ονοματολογία Οργανικών Ενώσεων στα Ελληνικά & Αγγλικά» Β΄ ΈκδοσηΘεσσαλονίκη 1991
Νικολάου Ε. Αλεξάνδρου, «Γενική Οργανική Χημεία», Εκδόσεις Ζήτη, Θεσσαλονίκη 1985
Δημητρίου Ν. Νικολαΐδη, «Ειδικά Μαθήματα Οργανικής Χημείας», ΑΠΘ, θεσσαλονίκη 1983
Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Φαίδωνα Χατζημηχαλάκη, «Εργαστηριακός Οδηγός», Εκδόσεις Ζήτη, Θεσσαλονίκη 1986
Η σελίδα της Ε.Ε. για την ταξινόμηση και την επισήμανση των επικίνδυνων ουσιών.
Coates J., Interpretation of Infrared Spectra, A Practical Approach, Encyclopedia of Analytical Chemistry, R.A. Meyers (Ed.), pp. 10815–10837, John Wiley & Sons Ltd, Chichester (2000).
Διαδικτυακοί τόποι που αναφέρονται στις «Παρατηρήσεις, υποσημειώσεις και αναφορές».
Παρατηρήσεις, υποσημειώσεις και αναφορές
Παλαιότερα, πριν την επιβολή της ονοματολογίας της Γενεύης, τα αλκάνια και οι άλλοι κορεσμένοι υδρογονάνθρακες ονομάστηκαν παραφίνες εκ των λατινικών λέξεων "parun" (= ολίγον) και "affinas" (= συγγένεια) και αυτό λόγω της χαρακτηριστικής τους χημικής σταθερότητας και αδράνειας που παρουσιάζουν έναντι των περισσοτέρων αντιδραστηρίων. Συνεχίζεται όμως να υφίσταται σύγχιση σε πολλά χημικά εγχειρίδια, αλλά οι παραφίνες αποτελούν γνήσιο υπερσύνολο των αλκανίων. Οι παραφίνες, αποτελούν παλαιότερη κατηγορία, που χρησιμοποιεί κυρίως η Χημική Βιομηχανία, που είναι όμως ευρύτερη, αφού περιλαμβάνει όλους τους κορεσμένους υδρογονάνθρακες. Δηλαδή περιλαμβάνει όχι μόνο τα αλκάνια, αλλά και τα κυκλοαλκάνια, τα δικυκλοαλκάνια και κάθε άλλη ομόλογη σειρά υδρογονανθράκων που δεν περιέχει κανέναν πολλαπλό (διπλό ή τριπλό) δεσμό. Ο γενικός τύπος των αλκανίων δεν ισχύει για όσες παραφίνες έχουν βαθμό ακορεστότητας > 0, δηλαδή για όσες παραφίνες περιέχουν δακτυλίους, καθένας από τους οποίους προσθέτει +1 στο βαθμό ακορεστότητες κάθε ένωσης.
Αν και πολλές φορές συμβαίνει το σύμβολο αυτό χρησιμοποιείται και ευρύτερα για υδροκαρβύλια ή και ακόμη ευρύτερα για μονοσθενείς οργανικές ή και μη οργανικές ομάδες.
Πολλά από αυτά δεν είναι σταθερά.
IUPAC, Commission on Nomenclature of Organic Chemistry (1993). "R-2.2.1: Hydrocarbons". A Guide to IUPAC Nomenclature of Organic Compounds (Recommendations 1993). Blackwell Scientific. ISBN 0-632-03488-2. Retrieved 12 February 2007.
William Reusch. "Nomenclature - Alkanes". Virtual Textbook of Organic Chemistry.
Δεν χρησιμοποιείται ο κανόνας όταν εννοούνται οι αριθμοί θεσης, δηλαδή όταν υπάρχει μια μοναδική κατανομή των διακλαδώσεων στη συγκεκριμένη κύρια ανθρακική αλυσίδα.
όπου με Χ συμβολίζεται ένα αλογόνο και με R ένα αλκύλιο.
Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ. 152, §6.2.2
SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ.42, §4.3.
Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ. 152, §6.2.4α
Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ. 152, §6.2.3β
Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ. 155, §6.7.3
SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ. 42, §4.3.
Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», Παρατηρητής, Θεσσαλονίκη 1991, Σελ. 14, §1.1.
Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ. 291-293, §19.1.
Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.269, §11.6B7.
Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.1.
Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 244 , §10.3.2
Hellenica World - Scientific Library
Από τη ελληνική Βικιπαίδεια http://el.wikipedia.org . Όλα τα κείμενα είναι διαθέσιμα υπό την GNU Free Documentation License